WO2025075396A1 - Lipid nanoparticles carrying material for detecting target nucleic acids, and membrane fusion-based method for detecting target nucleic acids by using same - Google Patents
Lipid nanoparticles carrying material for detecting target nucleic acids, and membrane fusion-based method for detecting target nucleic acids by using sameDownload PDFInfo
- Publication number
- WO2025075396A1 WO2025075396A1PCT/KR2024/014992KR2024014992WWO2025075396A1WO 2025075396 A1WO2025075396 A1WO 2025075396A1KR 2024014992 WKR2024014992 WKR 2024014992WWO 2025075396 A1WO2025075396 A1WO 2025075396A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- lipid
- nucleic acid
- target nucleic
- detection
- lipid nanoparticle
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6806—Preparing nucleic acids for analysis, e.g. for polymerase chain reaction [PCR] assay
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
Definitions
- Antigen testsare currently the most widely used for point-of-care diagnosis because they are fast and easy to use. However, compared to molecular diagnostic technologies that target nucleic acids, they have low sensitivity and false-negative results occur more frequently.
- antigen testshave the problem of reduced sensitivity when detecting RNA viruses that mutate frequently, such as coronaviruses, due to changes in the protein (antigen) structure resulting from mutations.
- the inventors of the present inventioncontinued research to solve the above problems, developed lipid nanoparticles that do not require preprocessing and sample amplification processes, and reached the present invention.
- Another object of the present inventionis to provide a method for manufacturing lipid nanoparticles loaded with a detection substance for detecting target nucleic acids.
- the present inventionprovides a lipid nanoparticle loaded with a detection substance for detecting a target nucleic acid.
- lipid nanoparticlesare prepared as follows:
- helper lipid0-40 mol% helper lipid
- the lipid nanoparticlemay further comprise 1 mol % or less of a lipid for bioconjugation of a receptor that binds to a substance containing the target nucleic acid on the surface of the lipid nanoparticle.
- the above bioconjugationmeans conjugating a receptor that binds to the surface of a material including the target nucleic acid to the surface of the lipid nanoparticle.
- the above receptormay be, but is not limited to, ACE2 (angiotensin converting enzyme 2), and any that is used in this technical field are included.
- the lipid for the bioconjugationmay be, but is not limited to, maleimide-PEG-PE, and any that is used in this technical field are included.
- the detection material for detecting the above target nucleic acidmay be a) a nucleic acid probe linked to a fluorescent material; or b) a guide RNA, a CRISPR-associated endonuclease and a reporter nucleic acid; or c) a lipid nanoparticle which is a LAMP (Loop-mediated Isothermal Amplification) reactant.
- LAMPLoop-mediated Isothermal Amplification
- the above detection substancesmay be included in an amount of 0.00001-4 wt% or less, respectively, with respect to the total weight of the lipid nanoparticles.
- the above phosphocholinecan be DPhyPC (1,2-Diphytanoyl-sn-glycero-3-phosphocholine), DOPC (1,2-dioleoyl-sn-glycero-3-phosphocholine) or (DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine).
- the above ionic lipidmay be a cationic lipid or an anionic lipid.
- the cationic lipidmay be DDAB (dimethyldioctadecylammonium bromide); DOTAP (1,2-dioleoyloxy-3-(trimethyl ammonium)propane); DODAC (dimethyldioleylammonium chloride); N-[1-(2,3-Dioloyloxy)propyl]-N,N,N-trimethylammonium methylsulfate; DOTMA (N-[1-[2,3-bis(oleoyloxy)]propyl]-N,N,N-trimethylammonium chloride); DOGS (di-octadecyl-amido-glycyl-spermine); DC-cholesterol (3 ⁇ -[N ⁇ (N′,N′'-dimethyl amino ethane)carbamoyl] cholesterol); DOSPA (2,3-di
- the anionic lipidis DMPA (dimyristyl glycerophosphate); DPPA (dipalmitoyl glycerophosphate); DMPG (dimyristyl glycerophosphate); disteroyl glycerophosphate (DSPA); DSPG (distearoyl-sn-glycero-3-phosphoglycerol); DPPG (dipalmitoyl glycerophosphoraglycerol); MPS (dimyristylyl glycerophosphoseline); DPPS (dipalmitoyl glycerophosphoseline);
- the above helper lipidmay be selected from the group consisting of DOPE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DPPE (1,2-bis(diphenylphosphino)ethane), DMPE (1,2-bis(dimethylphosphino)ethane), and mixtures thereof, but is not necessarily limited thereto, and any helper lipid having a phosphoethanolamine head usable in this technical field or a lipid molecule packing parameter of 1 or more may be used.
- the above cholesterolis used to ensure lipid membrane stability.
- the lipid bound to the water-soluble polymermay be DOPE-PEG2000.
- the above target nucleic acidmay be DNA or RNA.
- the present inventionprovides a method for producing lipid nanoparticles loaded with a detection substance for detecting the following target nucleic acids:
- ii0-40 mol% of ionic lipids
- the present inventionprovides a diagnostic kit comprising the composition for detecting the target nucleic acid.
- the target nucleic acid detection material within the lipid nanoparticlereacts with the target nucleic acid to generate a detection signal.
- the above methoddoes not require pretreatment or nucleic acid amplification process for the target nucleic acid and can be performed at room temperature or isothermal.
- the above methodcan be performed regardless of whether the target nucleic acid is of wild type or mutant origin.
- a sample containing a substance in which a target nucleic acid exists inside the lipid bilayercan be obtained from a mask worn by the subject and/or the surface of an object on which the subject stays or uses, without a separate sample collection process.
- target nucleic acidscan be detected by mixing the lipid nanoparticles or the detection composition on the surface of the mask or object to cause membrane fusion.
- the above detection signaloccurs within 30 minutes, enabling rapid diagnosis.
- Membrane fusion-based target nucleic acid detectionis possible by using lipid nanoparticles loaded with a detection substance for detecting target nucleic acids according to the present invention.
- the membrane fusion-based target nucleic acid detection method according to the present inventiondoes not require preprocessing or nucleic acid amplification processes for the target nucleic acid, is performed at room temperature, and allows rapid confirmation of test results.
- the membrane fusion-based target nucleic acid detection method using lipid nanoparticles of the present inventionprovides rapid diagnosis of infectious diseases.
- lipid vesiclesexosomes, extracellular vesicles, etc.
- Figure 1(b)is a schematic diagram showing a bioconjugation method according to one embodiment of the present invention.
- FIG. 2is a schematic diagram showing a membrane fusion-based target nucleic acid detection process according to one embodiment of the present invention.
- Figure 3shows a target nucleic acid detection process of CRISPR Cas13a according to one embodiment of a detection agent loaded on a liposome.
- Figure 5shows the capture rates of reporter RNA and Cas13a protein-guide RNA complexes within liposomes.
- Figure 6is a graph showing changes in liposome size and surface zeta potential according to loading and bioconjugation of a detection substance for detecting target nucleic acids.
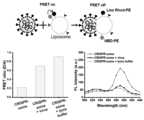
- Figure 7shows FRET-based fluorescence results showing membrane fusion of liposomes and SARS-CoV-2 virus according to one embodiment of the present invention.
- Figure 8is a cryo-transmission electron micrograph showing membrane fusion of liposomes and the SARS-CoV-2 virus.
- Figure 10(b)shows the results of the analysis specificity of liposomes for SARS-CoV-2 virus according to one embodiment of the present invention.
- Figure 11shows that membrane fusion with the SARS-CoV-2 virus occurs only by electrical attraction by cationic lipids even when ACE2 is not present on the liposome surface according to one embodiment of the present invention, and that bioconjugation of ACE2 to the liposome surface further increases the detection signal.
- Figure 12shows the detection of SARS-CoV-2 virus mutation-independent liposomes according to one embodiment of the present invention.
- Figure 13shows that liposomes according to one embodiment of the present invention exhibit a visually distinguishable color change through membrane fusion with the SARS-CoV-2 virus.
- Figure 14(a)shows that detection of the SARS-CoV-2 virus by liposomes according to an embodiment of the present invention is possible even on the surface of a mask.
- Figure 14(b)shows that liposome mask-based SARS-CoV-2 virus detection according to an embodiment of the present invention can detect up to 3 aM with a detection time of only 10 minutes.
- FIG. 16(a)shows that CRISPR Cas13a according to one embodiment of a detection agent loaded onto liposomes can also detect influenza A (H1N1) RNA.
- Figure 16(b)shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is also possible for influenza A (H1N1) virus.
- Figure 16(c)shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is a target nucleic acid-specific reaction.
- Figure 17shows that when liposomes according to an embodiment of the present invention were stored in a 4 o C refrigerator while blocking light, the particle size continued to increase for up to 6 months of storage, and there was slight agglomeration between particles, but the SARS-CoV-2 virus detection performance was maintained.
- ii0-40 mol% of ionic lipids
- helper lipid0-40 mol% helper lipid
- the present inventionprovides a one-step method for producing lipid nanoparticles, which enables the formation of lipid nanoparticles and the loading of a target nucleic acid detection substance at the same time (pre-encapsulation) by optimizing the composition of a lipid mixture included in the ethanol feeding solution.
- lipid nanoparticlesis a term commonly used in this technical field, and refers to nanoparticles composed of a lipid bilayer including a liposome.
- microfluidic deviceis a widely known technology in this technical field, a detailed description will be omitted.
- the present inventioncan utilize a microfluidic device having two or more inlets; a material mixing section in which the inlets are combined into one; and a single outlet connected to the material mixing section (see Fig. 1(a)).
- the above material mixing unitmay include a SHM (staggered herringbone mixer), which is known in the art (Belliveau, NM et. al ., Microfluidic Synthesis of Highly Potent Limit-Size Lipid Nanoparticles for in vivo Delivery of siRNA. Mol. Ther. Nucleic Acids 2012, 1, 1-9.).
- SHMstaggered herringbone mixer
- the above-mentioned multiple injection portscan be, for example, two injection ports.
- An ethanol feeding solution containing a lipid mixture and a water feeding solution containing a detection substancecan be independently injected into each of the two injection ports.
- the injected ethanol feeding solution containing a lipid mixture and the water feeding solutionmeet each other, and the lipids are monodispersely mixed in the material mixing port.
- the lipid mixture solutionundergoes a self-assembly process to form lipid crystal nanoparticles, and this self-assembly process can be performed in a rotary evaporator.
- the self-assembly conditions in the above rotary evaporatorcan be performed under conditions known in the art.
- the above lipid nanoparticlesmay further comprise 1 mol % or less of lipid for bioconjugation of a receptor that binds to a substance containing the target nucleic acid on the surface of the nanoparticles.
- bioconjugationrefers to linking a receptor capable of binding to a substance (e.g., a surface protein) present on the surface of a substance (e.g., a virus) containing a target nucleic acid to a binding functional group of the lipid nanoparticle (see Figure 1(b)).
- a substancee.g., a surface protein
- a substancee.g., a virus
- lipid for bioconjugationis used in excess of 1 mol%, problems such as unfavorable membrane fusion or reduced loading efficiency may occur.
- the CRISPR systemis an adaptive immune mechanism found in bacteria and other organisms, and is currently known as a genome editing technology that uses CRISPR-associated endonuclease.
- CRISPR-associated endonucleasesare Cas1, Cas1B, Cas2, Cas3, Cas4, Cas5, Cas6, Cas7, Cas8, Cas9, Cas10, Cas12a, Cas12b, Cas12c, Cas12d, Cas12e, Cas12g, Cas12h, Cas12i, Cas13a, Cas13b, Cas13c, Cas13d, Cas14, Csy1, Csy2, Csy3, Cse1, Cse2, Csc1, Csc2, Csa5, Csn2, CsMT2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, It may be selected from the group consisting of, but is not necessarily limited to, Csx14, Csx10, Csx16, CsaX, Csx3, Csx1,
- the above CRISPR-associated endonucleaseis an enzyme protein that plays a role in delivering target nucleic acids or cleaving foreign nucleic acids.
- the reporter nucleic acidmay be RNA or DNA, and is labeled with a fluorophore and a quencher at each end, respectively, and is cleaved when the CRISPR-associated endonuclease is activated, thereby emitting a fluorescent signal (see Fig. 3).
- the above detection substancesmay be included in an amount of 0.00001-4 wt% or less, respectively, relative to the total weight of the lipid nanoparticles. If the amount is outside the above range, the lipid nanoparticle structure may not be well maintained and the loading efficiency may be reduced.
- the above phosphocholinecan be DPhyPC (1,2-Diphytanoyl-sn-glycero-3-phosphocholine), DOPC (1,2-dioleoyl-sn-glycero-3-phosphocholine (1,2-dioleoyl-sn-glycero-3-phosphocholine)) or (DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine).
- the above ionic lipidmay be a cationic lipid or an anionic lipid.
- cationic lipidor "anionic lipid” are used herein to encompass all lipids of the invention which are either cationic or anionic.
- a lipidwill be determined to be cationic when it has a positive charge (at physiological pH) as measured by the instrument utilized for the measurement.
- the cationic lipidis DDAB (dimethyldioctadecylammonium bromide); DOGS (N,N-di octadecyl amido glycyl spermine); DOTAP (1,2-dioleoyloxy-3-(trimethyl ammonium)propane); DODAC (dimethyldioleylammonium chloride); N-[1-(2,3-Dioloyloxy)propyl]-N,N,N-trimethylammonium methylsulfate; DOTMA(N-[1-[2,3-bis(oleoyloxy)]propyl]-N,N,N-trimethylammonium chloride); DOGS (di-octadecyl-amido-glycyl-spermine); DC-cholesterol (3 ⁇ -[N—(N′,N′'-dimethyl amino ethane)carbamoyl] cholesterol); DOSPA
- the anionic lipidis DMPA (dimyristyl glycerophosphate); DPPA (dipalmitoyl glycerophosphate); DMPG (dimyristyl glycerophosphate); disteroyl glycerophosphate (DSPA); DSPG (distearoyl-sn-glycero-3-phosphoglycerol); DPPG (dipalmitoyl glycerophosphoraglycerol); MPS (dimyristylyl glycerophosphoseline); DPPS (dipalmitoyl glycerophosphoseline);
- anionic lipid usable in this technical fieldmay be used, but is not necessarily limited to, the group consisting of DSPS (disteroyl glycerophosphoseline) and mixtures thereof.
- the above helper lipidmay be selected from the group consisting of DOPE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DPPE (1,2-bis(diphenylphosphino)ethane), DMPE (1,2-bis(dimethylphosphino)ethane), and mixtures thereof, but is not necessarily limited thereto, and any helper lipid having a Phosphoethanolamine head usable in this technical field or a lipid molecule packing parameter of 1 or more may be used.
- the above cholesterolis used to secure lipid membrane stability.
- the lipid bound to the above water-soluble polymeris used as a stabilizer for lipid crystal nanoparticles.
- the water-soluble polymermay be selected from the group consisting of polyethylene glycol, polyacrylic acid, polyvinyl alcohol, polyvinylpyrrolidone, polyacrylamide, polyethylene oxide, polysaccharides, and mixtures thereof, but is not necessarily limited thereto, and any water-soluble polymer usable in this technical field may be used.
- the lipidmay be a phospholipid.
- the lipid bound to the water-soluble polymermay be DOPE-PEG2000.
- the polymer and lipidare dissolved in the same solvent, ethanol, they are always mixed uniformly when mixed within the microfluidic device, and thus homogeneous particles can be formed.
- the lipid nanoparticle according to the present inventionmay be in a form in which a substance containing a target nucleic acid, for example, a receptor capable of binding to a virus, is conjugated to its surface. This is to effectively facilitate membrane fusion with the virus, as mentioned above.
- a substance containing a target nucleic acidfor example, a receptor capable of binding to a virus
- the above target nucleic acidmay be DNA or RNA, and may include ssDNA, dsDNA, ssRNA, and microRNA.
- the above lipid mixtureis composed as follows: a method for manufacturing lipid nanoparticles loaded with a detection substance for detecting target nucleic acids:
- ii0-40 mol% of ionic lipids
- helper lipid0-40 mol% helper lipid
- lipidswere dissolved in chloroform solvent at 25 mg/mL and used as a stock solution. After mixing in the desired ratio, the solvent was evaporated with nitrogen gas. After that, ethanol was added to make the concentration 10 mM and used as an ethanol feeding solution. The solvent and lipids used here were used without further purification.
- lipid nanoparticleswere loaded onto lacey carbon-coated copper grids (Structure Probe Incorporation, PA, USA) using a Vitrobot (Vitrobot Mark IV, FEI). Briefly, 5 ⁇ L of synthesized lipid nanoparticles were dropped onto the carbon grid at 24 °C with 100% RH. The carbon grid was then rapidly quenched in liquid ethane after two blotting sessions (1 s blotting time) to form an amorphous ice film with a thickness of less than 500 nm.
- cryo-EMThe samples were then transferred to cryo-EM using a cryo-transfer holder (Gatan, CA, USA). To prevent ice recrystallization, the sample temperature was maintained below -170°C until successful transfer to the cryo-EM. Images were acquired underfocus at ⁇ 4000 nm. Higher magnification images were obtained using a smaller aperture to minimize electron beam damage and sample drift.
- the size and zeta potential of individual lipid nanoparticleswere characterized by Zetasizer Ultra (Malvern Panalytical Ltd., Malvern, UK).
- a staggered herringbone mixerSHM
- SHMherringbone mixer
- a syringe pumpNE-400, New Era Pump Systems, NY, USA
- the flow conditions and flow rate ratiowere fixed at 0.05 ml/min and 3, respectively.
- the emulsion obtained by mixingwas collected in a 50 mL round-bottomed glass flask.
- a 0.15 M 100 ⁇ l final solutionwas obtained by evaporating the solvent, and the solution showed a color change from transparent to white opaque but no macroscopic precipitate.
- the generated lipid nanoparticle solutionwas filtered using a centrifugal filter (Nanosep 100K MWCO, Sigma Aldrich, MO, USA) as needed to remove unreacted substances.
- FIG. 1(b)A schematic diagram of the bioconjugation according to the present invention is shown in Fig. 1(b).
- 1 mol% of DOPCis replaced with 1 mol% of Maleimide-PEG-PE, and the same method is used to prepare the final product (0.15 M 100 ul) having a protruding Maleimide functional group.
- the receptoris immersed in a 10 mM Tris(2-corboxyethyl)phosphine hydrochloride solution to separate the dithiol bond.
- lipid nanoparticle solutionis mixed with the receptor solution from which the dithiol bond has been separated, and the resultant product is reacted at room temperature for 1 hour to prepare a lipid nanoparticle solution in which the receptor is bioconjugated. After that, the unreacted products are diluted with a Float-a-lyzer product and separated.
- Example 2-1In the liposome manufacturing process of Example 2-1, 0.025 wt% and 0.055 wt% of Leptotrichia buccalis (Lbu) Cas13a protein-guide RNA complex and reporter RNA, respectively, were further added to the water feeding solution to manufacture liposomes loaded with a detection substance.
- Leptotrichia buccalis (Lbu) Cas13a protein-guide RNA complex and reporter RNAwere further added to the water feeding solution to manufacture liposomes loaded with a detection substance.
- Figure 13shows that liposomes according to Example 2-3 exhibit a visually distinguishable color change through membrane fusion with the SARS-CoV-2 virus.
- a PCR tubewas loaded with a mixture of 10 uL of liposome solution and 10 uL of SARS-CoV-2 virus-negative sample or a mixture of 10 uL of liposome solution and 10 uL of 150 fM SARS-CoV-2 virus-positive sample, and the reaction was performed at 65 degrees for 30 minutes.
- Fig. 14(a)shows that the detection of the SARS-CoV-2 virus by liposomes according to Example 2-2 is possible even on the surface of a mask.
- the liposome solution according to the present inventionis sprayed onto a mask contaminated with the SARS-CoV-2 virus, the liposome solution is membrane fused with the SARS-CoV-2 virus present on the mask, and green fluorescence is obtained using an LED that excites it at 465 nm.
- Fig. 14(b)shows that even a virus of 3 aM can be detected with only a detection time of 10 minutes. Therefore, by using the membrane fusion-based detection method according to the present invention, target nucleic acids can be detected without a separate sample collection process.
- Figure 15shows that the detection of SARS-CoV-2 virus by liposomes according to Example 2-2 is possible on various surfaces where the virus exists.
- various surfaceswere prepared, including a wooden desk surface, a stainless steel surface, and a ceramic glass surface.
- the liposome solutionwas sprayed, it fused with the SARS-CoV-2 virus present on the desk, and green fluorescence was obtained using an LED that excites it at 465 nm.
- up to 3 aM virusescould be detected with only a detection time of 10 minutes on all surfaces.
- Figure 16(a)shows that when the crRNA of Table 2 is used instead of the crRNA of Table 1 when preparing the Lbu Cas13a-crRNA complex among the detection substances loaded on the liposome of Example 2-2, the detection substance can also detect influenza A (H1N1) RNA.
- Figure 16(b)shows that when crRNA4 and crRNA5 of Table 2 are used instead of crRNA of Table 1 in the liposome manufacturing according to Example 2-2, liposomes can detect influenza A (H1N1) virus. With a detection time of only 2 minutes, 7.9 It can be seen that viruses at levels of 10 2 TCID 50 /mL can be detected.
- influenza AH1N1
- Figure 16(c)shows that when the crRNA of Table 1 is used in the liposome manufacturing according to Example 2-2, the liposome cannot be detected for the influenza A (H1N1) virus, demonstrating that this detection reaction is a target nucleic acid specific reaction.
- Figure 17shows that when liposomes manufactured according to Example 2-2 were stored in a 4 o C refrigerator while blocking light, the particle size continued to increase for up to 6 months of storage, with some particle agglomeration occurring; however, the same detection results were observed for the 750 fM SARS-CoV-2 virus, demonstrating that the detection performance was maintained.
- Figure 18shows that liposomes manufactured according to Example 2-2 exhibit high RNase stability by showing no fluorescence change in the presence of 100 ⁇ g/mL of RNase A. In contrast, reporter RNA is degraded by RNase A, resulting in fluorescence.
- Figure 19shows that the same detection is achieved by simply adding the liposome solution to the SARS-CoV-2 virus sample without physically mixing the liposome solution according to Example 2-2 with the 2 aM SARS-CoV-2 virus sample.
- the pipetting methodwas used for physical mixing.
- Figure 20shows that the liposome solution according to Example 2-2 can detect SARS-CoV-2 virus present in nasopharyngeal swab and saliva. It can be seen that SARS-CoV-2 virus in saliva can be detected up to 2 aM with a detection time of only 2 minutes.
- Figure 21(a)shows that when the crRNA of Table 3 is used instead of the crRNA of Table 1 when preparing the Lbu Cas13a-crRNA complex among the detection substances loaded on the liposome of Example 2-2, the detection substance can also detect RSV (Respiratory Syncytial Virus) RNA.
- RSVRespiratory Syncytial Virus
- Figure 21(b)shows that liposomes can detect RSV virus when crRNA of Table 3 is used instead of crRNA of Table 1 in liposome preparation according to Example 2-2. With a detection time of only 2 minutes, 1.25 It can be seen that viruses at levels of 10 4 TCID 50 /mL can be detected.
- Figure 22(a)shows that when preparing a complex of Lbu Cas13a-crRNA among the detection substances loaded on liposomes in Example 2-2, when using crRNA of Table 4 instead of crRNA of Table 1, the detection substance can also detect miRNA-21.
- Figure 22(b)shows that detection of exosomes is possible when crRNA of Table 4 is used instead of crRNA of Table 1 when manufacturing liposomes according to Example 2-2. It can be seen that liposomes can detect 1.3 pM exosomes with a detection time of only 2 minutes.
- FIG. 23(a)shows that when the crRNA of Table 5 is used in the preparation of the Lb Cas12a-crRNA complex among the detection substances loaded on the liposome of Example 2-4, the detection substance can also detect HSV (Herpes Simplex virus) DNA.
- HSVHerpes Simplex virus
- Figure 23(b)shows that when the crRNA of Table 4 is used in the liposome preparation according to Example 2-4, the liposome can detect the HSV virus. It can be seen that even a virus at the level of 7900 TCID 50 /mL can be detected with a detection time of only 10 minutes.
- Figure 24(a)shows that the fluorescence-linked nucleic acid probe loaded on the liposome of Example 2-5 can detect SARS-CoV-2 RNA.
- the fluorescence-linked nucleic acid probe 1 and the fluorescence-linked nucleic acid probe 2were diluted to 1 ⁇ M in 1X PBS buffer, heated at 95 o C for 5 minutes, and cooled to 4 o C to form a secondary structure in a hairpin shape.
- the fluorescence-linked nucleic acid probe 1 and the fluorescence-linked nucleic acid probe 2were diluted to 500 nM in 1X PBS buffer containing 1.55 nM of isolated SARS-CoV-2 RNA.
- the lipid nanoparticle loaded with the target nucleic acid detection substance according to the present inventioncan undergo membrane fusion with a lipid bilayer, and thus can be used to detect internal nucleic acids of cells, exosomes, viruses, etc., which are composed of lipid bilayers.
- the lipid nanoparticle loaded with the target nucleic acid detection substance according to the present inventioncan be used as a field diagnostic kit since it can detect wild type or mutant without distinction and does not require a separate preprocessing or amplification process.
- itcan detect viruses existing on the surfaces of masks and/or various objects without a separate sample collection process.
- the lipid nanoparticle according to the present inventioncan be used for membrane fusion-based target nucleic acid detection.
- the membrane fusion-based target nucleic acid detection method according to the present inventiondoes not require pretreatment or nucleic acid amplification processes for the target nucleic acid, is performed at room temperature, and allows rapid confirmation of test results.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Analytical Chemistry (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
Description
Translated fromKorean본 발명은 타겟 핵산 검출물질이 담지된 지질 나노입자 및 이를 이용한 막융합 기반의 타겟 핵산 검출 방법에 대한 것이다.The present invention relates to a lipid nanoparticle loaded with a target nucleic acid detection material and a membrane fusion-based target nucleic acid detection method using the same.
신속하고 사용자 친화적인 현장 진단 검사는 질병의 조기 발견을 위한 빈번한 테스트를 가능하게 하고, 이를 통해 감염자를 격리하거나 신속한 치료를 제공하는 등 적절한 조치를 허용하여 질병의 확산 방지, 치료 효과 상승에 기여한다.Rapid, user-friendly point-of-care diagnostic tests enable frequent testing for early detection of disease, allowing appropriate measures such as isolating infected individuals or providing rapid treatment, thereby contributing to preventing the spread of disease and increasing the effectiveness of treatment.
항원 검사는 빠르고 사용하기 쉽기 때문에 현재 현장 진단에 가장 많이 사용된다. 그러나 핵산 (nucleic acid)을 표적으로 하는 분자 진단 기술과 비교하여 민감도가 낮아 위음성 (false-negative) 결과가 더 자주 발생한다는 문제가 있다.Antigen tests are currently the most widely used for point-of-care diagnosis because they are fast and easy to use. However, compared to molecular diagnostic technologies that target nucleic acids, they have low sensitivity and false-negative results occur more frequently.
또한 항원 검사는 코로나 바이러스와 같이 변이가 잦은 RNA 바이러스를 검출할 시, 변이에 따른 단백질 (항원) 구조 변화로 인해 민감도가 저하되는 문제점이 있다.Additionally, antigen tests have the problem of reduced sensitivity when detecting RNA viruses that mutate frequently, such as coronaviruses, due to changes in the protein (antigen) structure resulting from mutations.
따라서, 효과적인 감염자 선별과 방역책 구축을 위해 항원 검사보다 더 민감한 분자 진단 기술에 기반하되, 신속하고 사용자 친화적인 현장 진단 기술을 개발할 필요가 있다.Therefore, to effectively screen infected individuals and establish quarantine measures, it is necessary to develop a rapid and user-friendly field diagnostic technology based on molecular diagnostic technology that is more sensitive than antigen testing.
그러나 기존 분자 진단 기술은 진단 반응이 복잡하거나 (예시: 정량적 역전사 중합효소 연쇄 반응, quantitative reverse transcription polymerase chain reaction), 반응 자체가 상대적으로 간단하더라도 (예시: 등온-고속 증폭법 혹은 증폭 불필요 검출법) 핵산의 추출 및 분리를 포함한 시료 전처리가 필요하여 현장 진단으로의 사용이 어렵다.However, existing molecular diagnostic technologies are difficult to use for on-site diagnosis because they require sample preprocessing, including extraction and separation of nucleic acids, even if the diagnostic reaction is complex (e.g., quantitative reverse transcription polymerase chain reaction) or the reaction itself is relatively simple (e.g., isothermal-fast amplification method or amplification-free detection method).
최근 시료 전처리 단계를 최소화하거나 보조 기기를 사용하여 시료 전처리를 자동화한 현장형 분자 진단 기술이 개발되었으나, 여전히 시료 전처리에 따른 추가적인 검사 시간이 필요하고 보조 기기에 따른 추가적인 비용이 발생하여 현장 진단에 사용하기에는 제약이 크다.Recently, field-based molecular diagnostic technologies have been developed that minimize sample preparation steps or automate sample preparation using auxiliary devices. However, additional testing time is still required due to sample preparation, and additional costs are incurred due to auxiliary devices, which limits their use in field diagnosis.
이에 본 발명자들은 상기와 같은 문제점을 해결하기 위해 연구를 계속하여, 전처리와 샘플 증폭과정이 필요없는 지질 나노입자를 개발하고 본 발명에 이르렀다.Accordingly, the inventors of the present invention continued research to solve the above problems, developed lipid nanoparticles that do not require preprocessing and sample amplification processes, and reached the present invention.
[비특허문헌][Non-patent literature]
Xihui Gaoet al. Rapid Detection of Exosomal microRNAs Using Virus-Mimicking Fusogenic Vesicles,Angewandte Chemie International Edition 2019Xihui Gaoet al . Rapid Detection of Exosomal microRNAs Using Virus-Mimicking Fusogenic Vesicles,Angewandte Chemie International Edition 2019
본 발명의 목적은 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 제공하기 위한 것이다.The purpose of the present invention is to provide a lipid nanoparticle loaded with a detection substance for detecting a target nucleic acid.
본 발명의 다른 목적은 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 제조하는 방법을 제공하기 위한 것이다.Another object of the present invention is to provide a method for manufacturing lipid nanoparticles loaded with a detection substance for detecting target nucleic acids.
본 발명의 또 다른 목적은 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 포함하는 막융합 기반 타겟 핵산 검출용 조성물 및 검출 키트를 제공하기 위한 것이다.Another object of the present invention is to provide a membrane fusion-based target nucleic acid detection composition and detection kit including a lipid nanoparticle loaded with a detection substance for detecting a target nucleic acid.
본 발명의 또 다른 목적은 막융합 기반 타겟 핵산 검출 방법을 제공하기 위한 것이다.Another object of the present invention is to provide a membrane fusion-based target nucleic acid detection method.
그러나 본 발명이 이루고자 하는 기술적 과제는 이상에서 언급한 목적에 제한되지 않으며, 언급되지 않은 또 다른 과제들은 아래의 기재로부터 이 기술분야의 통상의 기술자에게 명확하게 이해될 수 있을 것이다.However, the technical problems to be achieved by the present invention are not limited to the purposes mentioned above, and other problems not mentioned will be clearly understood by those skilled in the art from the description below.
상기 과제를 해결하기 위하여, 본 발명은 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 제공한다.To solve the above problem, the present invention provides a lipid nanoparticle loaded with a detection substance for detecting a target nucleic acid.
구체적으로, 상기 지질 나노입자는 다음과 같이 제조된다:Specifically, the lipid nanoparticles are prepared as follows:
지질 혼합물이 포함된 에탄올 피딩 용액; 및 상기 검출물질이 포함된 물 피딩 용액을, 각각 독립적으로, 미세유체소자에 통과시켜서 혼합하고 자가조립 과정을 거쳐서 제조된 지질 나노입자로,An ethanol feeding solution containing a lipid mixture; and a water feeding solution containing the detection substance are each independently passed through a microfluidic device to be mixed and manufactured through a self-assembly process to produce lipid nanoparticles.
상기 지질 혼합물은,The above lipid mixture is,
i) 포스포콜린 0-40mol%;i) phosphocholine 0-40 mol%;
ii) 이온성 지질 0-40mol%;ii) 0-40 mol% of ionic lipids;
iii) 헬퍼(helper) 지질 0-40mol%;iii) 0-40 mol% helper lipid;
iv) 콜레스테롤 0-40mol%; 및iv) cholesterol 0-40 mol%; and
v) 수용성 고분자가 결합된 지질 0-5mol%로 구성됨.v) Composed of 0-5 mol% of lipids bound to water-soluble polymers.
상기 지질 나노입자는 상기 지질 나노입자 표면에 상기 타겟 핵산이 포함된 물질과 결합하는 수용체의 바이오컨쥬게이션을 위한 지질을 1 mol % 이하로 더 포함할 수 있다.The lipid nanoparticle may further comprise 1 mol % or less of a lipid for bioconjugation of a receptor that binds to a substance containing the target nucleic acid on the surface of the lipid nanoparticle.
상기 바이오컨쥬게이션은, 상기 타겟 핵산을 포함하는 물질 표면과 결합하는 수용체를 상기 지질 나노입자 표면에 컨쥬게이션하는 것을 의미한다.The above bioconjugation means conjugating a receptor that binds to the surface of a material including the target nucleic acid to the surface of the lipid nanoparticle.
상기 수용체는 ACE2 (angiotensin converting enzyme 2)일 수 있으나, 이로 제한되는 것은 아니고 이 기술분야에 사용되는 것이라면 모두 포함된다. 상기 바이오컨쥬게이션을 위한 지질은 maleimide-PEG-PE일 수 있으나, 이로 제한되는 것은 아니고 이 기술분야에 사용되는 것이라면 모두 포함된다.The above receptor may be, but is not limited to, ACE2 (angiotensin converting enzyme 2), and any that is used in this technical field are included. The lipid for the bioconjugation may be, but is not limited to, maleimide-PEG-PE, and any that is used in this technical field are included.
상기 타겟 핵산을 검출하기 위한 검출물질은 a) 형광물질이 연결된 핵산 프로브; 또는 b) 가이드 RNA, CRISPR 연관 엔도뉴클라아제 및 리포터 핵산; c) LAMP(Loop-mediated Isothermal Amplification) 반응물인 지질 나노입자일 수 있다.The detection material for detecting the above target nucleic acid may be a) a nucleic acid probe linked to a fluorescent material; or b) a guide RNA, a CRISPR-associated endonuclease and a reporter nucleic acid; or c) a lipid nanoparticle which is a LAMP (Loop-mediated Isothermal Amplification) reactant.
상기 검출물질은, 상기 지질 나노입자의 전체 중량에 대하여, 각각 0.00001-4 중량% 이하로 포함될 수 있다.The above detection substances may be included in an amount of 0.00001-4 wt% or less, respectively, with respect to the total weight of the lipid nanoparticles.
상기 포스포콜린은 DPhyPC(1,2-Diphytanoyl-sn-glycero-3-phosphocholine), DOPC(1,2-dioleoyl-sn-glycero-3-phosphocholine (1,2-dioleoyl-sn-glycero-3-phosphocholine) 또는 (DPPC(1,2-dipalmitoyl-sn-glycero-3-phosphocholine)일 수 있다.The above phosphocholine can be DPhyPC (1,2-Diphytanoyl-sn-glycero-3-phosphocholine), DOPC (1,2-dioleoyl-sn-glycero-3-phosphocholine) or (DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine).
상기 이온성 지질은 양이온성 지질 또는 음이온성 지질일 수 있다. 구체적으로, 상기 양이온성 지질은, DDAB(dimethyldioctadecylammonium bromide); DOTAP(1,2-dioleoyloxy-3-(trimethyl ammonium)propane); DODAC(dimethyldioleylammonium chloride); N-[1-(2,3-Dioloyloxy)propyl]-N,N,N-trimethylammonium methylsulfate; DOTMA(N-[1-[2,3-bis(oleoyloxy)]propyl]-N,N,N-trimethylammonium chloride); DOGS(di-octadecyl-amido-glycyl-spermine); DC-cholesterol(3β-[N―(N′,N′'-dimethyl amino ethane)carbamoyl] cholesterol); DOSPA(2,3-dioleoyloxy-N-(2(spermine carboxamido)-ethyl)-N,N-dimethyl-1-propanaminium trifluoroacetate); 1,2-diacyl-sn-glycero-3-ethyl phosphocholines; DODMA(1,2-dioleyloxy-3-dimethylaminopropane); MVL5(N1-[2-((1S)-1-[(3-aminopropyl)amino]-4-[di(3-amino-propyl)amino]butylcarboxamido)ethyl]-3,4-di[oleyloxy]-benzamide); β-alanyl cholesterol; CTAB(cetyltrimethylammonium bromide); DOSPER(1,3-dioleoyloxy-2-(6-carboxy-spermyl)-propylamide); N,N,N′,N′'-tetramethyl-N,N′'-bis(2-hydroxylethyl)-2,3-dioleoyloxy-1,4-butane diammonium iodide; 및 이들의 혼합물로 이루어진 군으로부터 선택될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 양이온성 지질은 모두 사용할 수 있다.The above ionic lipid may be a cationic lipid or an anionic lipid. Specifically, the cationic lipid may be DDAB (dimethyldioctadecylammonium bromide); DOTAP (1,2-dioleoyloxy-3-(trimethyl ammonium)propane); DODAC (dimethyldioleylammonium chloride); N-[1-(2,3-Dioloyloxy)propyl]-N,N,N-trimethylammonium methylsulfate; DOTMA (N-[1-[2,3-bis(oleoyloxy)]propyl]-N,N,N-trimethylammonium chloride); DOGS (di-octadecyl-amido-glycyl-spermine); DC-cholesterol (3β-[N―(N′,N′'-dimethyl amino ethane)carbamoyl] cholesterol); DOSPA (2,3-dioleoyloxy-N-(2(spermine carboxamido)-ethyl)-N,N-dimethyl-1-propanaminium trifluoroacetate); 1,2-diacyl-sn-glycero-3-ethyl phosphocholines; DODMA (1,2-dioleyloxy-3-dimethylaminopropane); MVL5(N1-[2-((1S)-1-[(3-aminopropyl)amino]-4-[di(3-amino-propyl)amino]butylcarboxamido)ethyl]-3,4-di[oleyloxy]-benzamide); β-alanyl cholesterol; CTAB (cetyltrimethylammonium bromide); DOSPER (1,3-dioleoyloxy-2-(6-carboxy-spermyl)-propylamide); N,N,N′,N′'-tetramethyl-N,N′'-bis(2-hydroxylethyl)-2,3-dioleoyloxy-1,4-butane diammonium iodide; and mixtures thereof, but are not necessarily limited thereto, and any cationic lipid usable in this art can be used.
구체적으로, 상기 음이온성 지질은, DMPA(dimyristyl glycerophosphate); DPPA(dipalmitoyl glycerophosphate); DMPG(dimyristyl glycerophosphate); DSPA(disteroyl glycerophosphate); DSPG(distearoyl-sn-glycero-3-phosphoglycerol); DPPG(dipalmitoyl glycerophosphoraglycerol); MPS(dimyristylyl glycerophosphoseline); DPPS(dipalmitoyl glycerophosphoseline);Specifically, the anionic lipid is DMPA (dimyristyl glycerophosphate); DPPA (dipalmitoyl glycerophosphate); DMPG (dimyristyl glycerophosphate); disteroyl glycerophosphate (DSPA); DSPG (distearoyl-sn-glycero-3-phosphoglycerol); DPPG (dipalmitoyl glycerophosphoraglycerol); MPS (dimyristylyl glycerophosphoseline); DPPS (dipalmitoyl glycerophosphoseline);
DSPS(disteroyl glycerophosphoseline) 및 이들의 혼합물로 이루어진 군으로부터 선택될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 음이온성 지질은 모두 사용할 수 있다.Any anionic lipid usable in this technical field may be used, but is not necessarily limited to, the group consisting of DSPS (disteroyl glycerophosphoseline) and mixtures thereof.
상기 헬퍼 지질은 DOPE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), DSPE(1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DSPE(1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DPPE(1,2-bis(diphenylphosphino)ethane), DMPE(1,2-bis(dimethylphosphino)ethane) 및 이들의 혼합물로 이루어진 군으로부터 선택될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 phosphoethanolamine 머리를 갖는 지질 혹은 지질 분자 패킹 파라미터(packing parameter)가 1 이상인 헬퍼 지질은 모두 사용할 수 있다.The above helper lipid may be selected from the group consisting of DOPE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DPPE (1,2-bis(diphenylphosphino)ethane), DMPE (1,2-bis(dimethylphosphino)ethane), and mixtures thereof, but is not necessarily limited thereto, and any helper lipid having a phosphoethanolamine head usable in this technical field or a lipid molecule packing parameter of 1 or more may be used.
상기 콜레스테롤은 지질막 안정성 확보 용도로 사용한다.The above cholesterol is used to ensure lipid membrane stability.
상기 수용성 고분자는 폴리에틸렌글리콜(polyethylene glycol), 폴리아크릴산(polyacrylic acid), 폴리비닐알코올(polyvinyl alcohol), 폴리비닐피롤리돈(polyvinylpyrrolidone), 폴리아크릴아미드(polyacrylamide), 폴리에틸렌옥사이드(polyethylene oxide) 폴리사카라이드(polysaccharide) 및 이들의 혼합물로 이루어진 군으로부터 선택될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 수용성 고분자라면 모두 사용할 수 있다.The water-soluble polymer may be selected from the group consisting of polyethylene glycol, polyacrylic acid, polyvinyl alcohol, polyvinylpyrrolidone, polyacrylamide, polyethylene oxide, polysaccharides, and mixtures thereof, but is not necessarily limited thereto, and any water-soluble polymer usable in this technical field may be used.
상기 수용성 고분자가 결합된 지질에서, 상기 수용성 고분자의 분자량은 2000~5000 Da일 수 있고, 그리고 상기 지질은 인지질일 수 있다.In the lipid to which the water-soluble polymer is bound, the molecular weight of the water-soluble polymer may be 2000 to 5000 Da, and the lipid may be a phospholipid.
수용성 고분자가 결합된 지질은 DOPE-PEG2000일 수 있다.The lipid bound to the water-soluble polymer may be DOPE-PEG2000.
상기 지질 나노입자는 그 표면에 타겟 핵산이 포함된 물질과 결합할 수 있는 수용체를 컨쥬게이션한 것일 수 있다. 다만 상기 컨쥬게이션은 선택적인 것으로 반드시 필요한 것은 아니다.The above lipid nanoparticle may be conjugated to a receptor capable of binding to a substance containing a target nucleic acid on its surface. However, the conjugation is optional and not necessarily required.
상기 타겟 핵산은 DNA 또는 RNA일 수 있다.The above target nucleic acid may be DNA or RNA.
다른 측면에서 본 발명은 다음과 같은 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자 제조방법을 제공한다:In another aspect, the present invention provides a method for producing lipid nanoparticles loaded with a detection substance for detecting the following target nucleic acids:
지질 혼합물이 포함된 에탄올 피딩 용액; 및 타겟 핵산 검출물질이 포함된 물 피딩 용액을 각각 준비하고;An ethanol feeding solution containing a lipid mixture and a water feeding solution containing a target nucleic acid detection substance are each prepared;
상기 준비된 지질 혼합물이 포함된 에탄올 피딩 용액과 검출물질이 포함된 물 피딩 용액을, 각각 독립적으로, 미세유체소자에 통과시켜서 지질 혼합물이 포함된 에탄올 피딩 용액과 타겟 핵산 검출물질이 포함된 물 피딩 용액을 혼합시키고; 그리고The ethanol feeding solution containing the prepared lipid mixture and the water feeding solution containing the detection substance are each independently passed through the microfluidic device to mix the ethanol feeding solution containing the lipid mixture and the water feeding solution containing the target nucleic acid detection substance; and
상기 혼합된 용액의 자기조립 과정을 거쳐서, 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 제조하는 방법으로,A method for manufacturing lipid nanoparticles loaded with a detection substance for detecting target nucleic acids through a self-assembly process of the above mixed solution,
상기 지질 혼합물은 다음과 같이 구성됨:The above lipid mixture is composed as follows:
i) 포스포콜린 0-40mol%;i) phosphocholine 0-40 mol%;
ii) 이온성 지질 0-40mol%;ii) 0-40 mol% of ionic lipids;
iii) 헬퍼(helper) 지질 0-40mol%;iii) 0-40 mol% helper lipid;
iv) 콜레스테롤 0-40mol%; 및iv) cholesterol 0-40 mol%; and
v) 수용성 고분자가 결합된 지질 0-5mol%.v) 0-5 mol% of lipids bound to water-soluble polymers.
상기 지질 나노입자는, 상기 지질 나노입자 표면에, 상기 타겟 핵산이 포함된 물질과 결합하는 수용체의 바이오컨쥬게이션을 위한 지질을 1 mol % 이하로 포함할 수 있다.The lipid nanoparticle may contain 1 mol % or less of a lipid for bioconjugation of a receptor that binds to a substance containing the target nucleic acid on the surface of the lipid nanoparticle.
다른 측면에서 본 발명은 상기 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 포함하는 타겟 핵산 검출용 조성물을 제공한다.In another aspect, the present invention provides a composition for detecting target nucleic acids, comprising lipid nanoparticles loaded with a detection substance for detecting the target nucleic acids.
또 다른 측면에서 본 발명은 상기 타겟 핵산 검출용 조성물을 포함하는 진단 키트를 제공한다.In another aspect, the present invention provides a diagnostic kit comprising the composition for detecting the target nucleic acid.
또 다른 측면에서 본 발명은, 다음과 같은 막융합 기반 타겟 핵산 검출 방법을 제공한다:In another aspect, the present invention provides a membrane fusion-based target nucleic acid detection method as follows:
지질 이중층 내부에 타겟 핵산이 존재하는 물질이 포함된 샘플과 상기 언급한 지질 나노입자 또는 타겟 핵산 검출용 조성물을 혼합함으로써, 상기 타겟 핵산을 포함하는 물질과 상기 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자의 막융합을 발생시키고; 그리고By mixing a sample containing a substance in which a target nucleic acid exists inside a lipid bilayer and the lipid nanoparticle or the composition for detecting a target nucleic acid mentioned above, membrane fusion of the substance containing the target nucleic acid and the lipid nanoparticle carrying a detection substance for detecting the target nucleic acid is caused; and
상기 지질 나노입자 내의 타겟 핵산 검출 물질이 상기 타겟 핵산과 반응하여 검출 신호를 발생시킴.The target nucleic acid detection material within the lipid nanoparticle reacts with the target nucleic acid to generate a detection signal.
상기 샘플은 대상체로부터 얻어진 DNA 바이러스 또는 RNA 바이러스 또는 세포 또는 지질 소포체(세포외 소포체, 엑소좀 등) 이고, 상기 타겟 핵산을 포함하는 물질과 상기 지질 나노입자의 막융합은 바이러스 지질층 막 또는 세포막 또는 지질 기반 소포체의 지질층 막과 상기 지질 나노입자 막 사이의 융합이 될 수 있다.The above sample is a DNA virus or RNA virus or a cell or lipid vesicle (exosome, etc.) obtained from a subject, and the membrane fusion of the substance containing the target nucleic acid and the lipid nanoparticle can be fusion between a viral lipid layer membrane or a cell membrane or a lipid layer membrane of a lipid-based vesicle and the lipid nanoparticle membrane.
상기 타겟 핵산 검출물질은 a) 형광물질이 연결된 핵산 프로브; 또는 b) 가이드 RNA, CRISPR 연관 엔도뉴클라아제 및 리포터 핵산; c) LAMP(Loop-Mediated Isothermal Amplification) 반응물이고, 상기 검출물질이 타겟 핵산과 반응하면 검출 신호로 형광 또는 색변화를 발생시킬 수 있다.The above target nucleic acid detection material is a) a nucleic acid probe linked to a fluorescent material; or b) a guide RNA, a CRISPR-linked endonuclease, and a reporter nucleic acid; or c) a LAMP (Loop-Mediated Isothermal Amplification) reactant, and when the detection material reacts with the target nucleic acid, fluorescence or a color change can be generated as a detection signal.
상기 방법은 타겟 핵산에 대한 전처리 및 핵산 증폭 과정이 필요 없고 상온 또는등온에서 이루어질 수 있다.The above method does not require pretreatment or nucleic acid amplification process for the target nucleic acid and can be performed at room temperature or isothermal.
또한 상기 방법은 타겟 핵산이 야생형 또는 돌연변이 유래이든 상관없이 이루어질 수 있다.Additionally, the above method can be performed regardless of whether the target nucleic acid is of wild type or mutant origin.
또한, 상기 지질 이중층 내부에 타겟 핵산이 존재하는 물질이 포함된 샘플은, 별도의 샘플 채취 과정 없이, 대상체가 착용한 마스크 및/또는 대상체가 머물거나 이용한 물체 표면으로부터 얻어질 수 있다.Additionally, a sample containing a substance in which a target nucleic acid exists inside the lipid bilayer can be obtained from a mask worn by the subject and/or the surface of an object on which the subject stays or uses, without a separate sample collection process.
또한 상기 마스크 또는 물체 표면에서 상기 지질 나노입자 또는 상기 검출용 조성물을 혼합하여 막융합을 발생시킴으로써 타겟 핵산을 검출할 수 있다.In addition, target nucleic acids can be detected by mixing the lipid nanoparticles or the detection composition on the surface of the mask or object to cause membrane fusion.
또한 상기 검출 신호는 30분 이내에 발생하여 신속한 진단이 가능하다.In addition, the above detection signal occurs within 30 minutes, enabling rapid diagnosis.
본 발명에 따른 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 이용하면 막융합 기반의 타겟 핵산 검출이 가능하다.Membrane fusion-based target nucleic acid detection is possible by using lipid nanoparticles loaded with a detection substance for detecting target nucleic acids according to the present invention.
본 발명에 따른 막융합 기반 타겟 핵산 검출 방법은 타겟 핵산에 대한 전처리 및 핵산 증폭 과정이 필요 없고 상온에서 이루어지고, 신속하게 검사 결과를 확인할 수 있다.The membrane fusion-based target nucleic acid detection method according to the present invention does not require preprocessing or nucleic acid amplification processes for the target nucleic acid, is performed at room temperature, and allows rapid confirmation of test results.
본 발명의 지질 나노입자를 이용한 막융합 기반 타겟 핵산 검출 방법은 감염병에 대한 신속한 진단을 제공한다.The membrane fusion-based target nucleic acid detection method using lipid nanoparticles of the present invention provides rapid diagnosis of infectious diseases.
또한 본 발명에 따른 막융합 기반 타겟 핵산 검출 방법을 이용하면 지질 소포체 (엑소좀, 세포외 소포체 등) 검출도 가능하다.In addition, using the membrane fusion-based target nucleic acid detection method according to the present invention, detection of lipid vesicles (exosomes, extracellular vesicles, etc.) is also possible.
또한 본 발명의 지질 나노입자는 장기간 냉장 보관이 가능하다.In addition, the lipid nanoparticles of the present invention can be stored under refrigeration for a long period of time.
도 1(a)는 본 발명의 일 실시예에 따른 리포좀 제조 방법을 나타내는 모식도이다.Figure 1(a) is a schematic diagram showing a method for preparing liposomes according to one embodiment of the present invention.
도 1(b)는 본 발명의 일 실시예에 따른 바이오컨쥬게이션 방법을 나타내는 모식도이다.Figure 1(b) is a schematic diagram showing a bioconjugation method according to one embodiment of the present invention.
도 2는 본 발명의 일 실시예에 따른 막융합 기반 타겟 핵산 검출 과정을 나타내는 모식도이다.FIG. 2 is a schematic diagram showing a membrane fusion-based target nucleic acid detection process according to one embodiment of the present invention.
도 3은 리포좀에 담지된 검출물질의 일 실시예에 따른 CRISPR Cas13a의 타겟 핵산 검출 과정을 나타낸다.Figure 3 shows a target nucleic acid detection process of CRISPR Cas13a according to one embodiment of a detection agent loaded on a liposome.
도 4는 SAXS 및 cryo-TEM 결과로부터 리포좀의 지질 이중층 형성을 확인한 결과이다.Figure 4 shows the results of SAXS and cryo-TEM that confirm the formation of a lipid bilayer of liposomes.
도 5는 리포좀 내의 리포터 RNA 및 Cas13a 단백질-가이드 RNA 복합체 포집율을 나타낸 것이다.Figure 5 shows the capture rates of reporter RNA and Cas13a protein-guide RNA complexes within liposomes.
도 6은 타겟 핵산을 검출하기 위한 검출물질의 담지 및 바이오컨쥬게이션에 따른 리포좀 크기 변화 및 표면 제타 전위 변화를 나타낸 그래프이다.Figure 6 is a graph showing changes in liposome size and surface zeta potential according to loading and bioconjugation of a detection substance for detecting target nucleic acids.
도 7은 본 발명의 일 실시예에 따른 리포좀과 SARS-CoV-2 바이러스의 막 융합을 보여주는 FRET 기반 형광 결과를 나타낸 것이다.Figure 7 shows FRET-based fluorescence results showing membrane fusion of liposomes and SARS-CoV-2 virus according to one embodiment of the present invention.
도 8은 리포좀과 SARS-CoV-2 바이러스의 막 융합을 보여주는 극저온 투과 전자현미경 사진이다.Figure 8 is a cryo-transmission electron micrograph showing membrane fusion of liposomes and the SARS-CoV-2 virus.
도 9(a)는 리포좀에 담지된 검출물질의 일 실시예에 따른 CRISPR Cas13a의 SARS-CoV-2 RNA 분석 민감도 결과이다.Figure 9(a) shows the sensitivity results of SARS-CoV-2 RNA analysis of CRISPR Cas13a according to one example of a detection substance loaded on liposomes.
도 9(b)는 리포좀에 담지된 검출물질의 일 실시예에 따른 CRISPR Cas13a의 SARS-CoV-2 RNA 분석 특이도 결과이다.Figure 9(b) shows the results of SARS-CoV-2 RNA analysis specificity of CRISPR Cas13a according to one example of a detection agent loaded on liposomes.
도 10(a)는 본 발명의 일 실시예에 따른 리포좀의 SARS-CoV-2 바이러스에 대한 분석 민감도 결과이다.Figure 10(a) shows the results of the analysis sensitivity of liposomes to SARS-CoV-2 virus according to one embodiment of the present invention.
도 10(b)는 본 발명의 일 실시예에 따른 리포좀의 SARS-CoV-2 바이러스에 대한 분석 특이도 결과이다.Figure 10(b) shows the results of the analysis specificity of liposomes for SARS-CoV-2 virus according to one embodiment of the present invention.
도 11은 본 발명의 일 실시예에 따른 리포좀 표면에 ACE2가 존재하지 않을 때에도, 양이온성 지질에 의한 전기적 인력만으로도 SARS-CoV-2 바이러스와 막융합이 일어남을 보여주고, ACE2를 리포좀 표면에 바이오컨쥬게이션하면 검출 신호가 더 증가함을 보여준다.Figure 11 shows that membrane fusion with the SARS-CoV-2 virus occurs only by electrical attraction by cationic lipids even when ACE2 is not present on the liposome surface according to one embodiment of the present invention, and that bioconjugation of ACE2 to the liposome surface further increases the detection signal.
도 12는 본 발명의 일 실시예에 따른 리포좀의 SARS-CoV-2 바이러스 변이에 상관 없는 검출을 보여준다.Figure 12 shows the detection of SARS-CoV-2 virus mutation-independent liposomes according to one embodiment of the present invention.
도 13은 본 발명의 일 실시예에 따른 리포좀이 SARS-CoV-2 바이러스와 막융합을 통해 육안으로 구분 가능한 색변화가 나타남을 보여준다.Figure 13 shows that liposomes according to one embodiment of the present invention exhibit a visually distinguishable color change through membrane fusion with the SARS-CoV-2 virus.
도 14(a)는 본 발명의 실시예에 따른 리포좀의 SARS-CoV-2 바이러스 검출이 마스크 표면 위에서도 가능함을 보여준다.Figure 14(a) shows that detection of the SARS-CoV-2 virus by liposomes according to an embodiment of the present invention is possible even on the surface of a mask.
도 14(b)는 본 발명의 실시예에 따른 리포좀의 마스크 기반 SARS-CoV-2 바이러스 검출이 10분만의 검출 시간만으로도 3 aM까지도 검출할 수 있음을 보여준다.Figure 14(b) shows that liposome mask-based SARS-CoV-2 virus detection according to an embodiment of the present invention can detect up to 3 aM with a detection time of only 10 minutes.
도 15는 본 발명의 실시예에 따른 리포좀의 SARS-CoV-2 바이러스 검출이 다양한 표면 위에서도 가능하며, 10분만의 검출 시간만으로도 3 aM 까지도 검출할 수 있음을 보여준다.Figure 15 shows that detection of SARS-CoV-2 virus by liposomes according to an embodiment of the present invention is possible on various surfaces, and that detection of up to 3 aM is possible with a detection time of only 10 minutes.
도 16(a)는 리포좀에 담지된 검출물질의 일 실시예에 따른 CRISPR Cas13a가 influenza A (H1N1) RNA에 대해서도 검출이 가능함을 보여준다.Figure 16(a) shows that CRISPR Cas13a according to one embodiment of a detection agent loaded onto liposomes can also detect influenza A (H1N1) RNA.
도 16(b)는 본 발명의 실시예에 따른 리포좀의 막융합 기반 검출법이 influenza A (H1N1) 바이러스에 대해서도 가능함을 보여준다.Figure 16(b) shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is also possible for influenza A (H1N1) virus.
도 16(c)는 본 발명의 실시예에 따른 리포좀의 막융합 기반 검출법이 표적 핵산 특이적 반응임을 보여준다.Figure 16(c) shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is a target nucleic acid-specific reaction.
도 17은 본 발명의 실시예에 따른 리포좀을 빛을 차단한채로 4oC 냉장고에 보관했을 때 보관기간 6개월까지 입자 크기가 계속 증가하여 약간의 입자간 뭉침현상이 있었음을 보여주나, SARS-CoV-2 바이러스 검출 성능은 유지됨을 보여준다.Figure 17 shows that when liposomes according to an embodiment of the present invention were stored in a 4o C refrigerator while blocking light, the particle size continued to increase for up to 6 months of storage, and there was slight agglomeration between particles, but the SARS-CoV-2 virus detection performance was maintained.
도 18은 본 발명의 일 실시예에 따른 리포좀의 RNase에 대한 안정성을 보여준다.Figure 18 shows the stability of liposomes against RNase according to one embodiment of the present invention.
도 19는 본 발명의 일 실시예에 따른 리포좀 용액과 SARS-CoV-2 바이러스 시료를 물리적 혼합하지 않고 SARS-CoV-2 바이러스 시료에 리포좀 용액을 첨가만 해도 동일하게 검출이 되는 것을 보여준다.Figure 19 shows that the same detection is achieved by simply adding the liposome solution to the SARS-CoV-2 virus sample without physically mixing the liposome solution and the SARS-CoV-2 virus sample according to one embodiment of the present invention.
도 20은 본 발명의 일 실시예에 따른 리포좀 기반 검출법이 적용 가능한 샘플로 타액 및 비인두 모두 검출이 되는 것을 보여준다.Figure 20 shows that both saliva and nasopharynx are detectable samples using the liposome-based detection method according to one embodiment of the present invention.
도 21(a)는 리포좀에 담지된 검출물질의 일 실시예에 따른 CRISPR Cas13a가 Respiratory Syncytial Virus (RSV) RNA에 대해서도 검출이 가능함을 보여준다.Figure 21(a) shows that CRISPR Cas13a according to one embodiment of a detection agent loaded onto liposomes can also detect Respiratory Syncytial Virus (RSV) RNA.
도 21(b)는 본 발명의 실시예에 따른 리포좀의 막융합 기반 검출법이 Respiratory Syncytial Virus (RSV) 바이러스에 대해서도 가능함을 보여준다.Figure 21(b) shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is also possible for the Respiratory Syncytial Virus (RSV) virus.
도 22(a)는 리포좀에 담지된 검출물질의 일 실시예에 따른 CRISPR Cas13a가 miRNA-21에 대해서 검출이 가능함을 보여준다.Figure 22(a) shows that CRISPR Cas13a according to one embodiment of a detection agent loaded onto liposomes can detect miRNA-21.
도 22(b)는 본 발명의 실시예에 따른 리포좀의 막융합 기반 검출법이 세포외 소포체(엑소좀)에 대해서도 가능함을 보여준다.Figure 22(b) shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is also possible for extracellular vesicles (exosomes).
도 23(a)는 리포좀에 담지된 검출물질의 일 실시예에 따른 CRISPR Cas12a가 HSV(Herpes Simplex virus) DNA에 대해서도 검출이 가능함을 보여준다.Figure 23(a) shows that CRISPR Cas12a according to one embodiment of a detection agent loaded onto liposomes can also detect HSV (Herpes Simplex virus) DNA.
도 23(b)는 본 발명의 실시예에 따른 리포좀의 막융합 기반 검출법이 HSV(Herpes Simplex virus) 바이러스에 대해서도 가능함을 보여준다.Figure 23(b) shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is also possible for the Herpes Simplex virus (HSV).
도 24(a)는 리포좀에 담지된 검출물질의 일 실시예에 따른 형광물질이 연결된 핵산 프로브가 SARS-CoV-2 RNA에 대해서 검출이 가능함을 보여준다.Figure 24(a) shows that a nucleic acid probe linked to a fluorescent substance according to one embodiment of a detection substance loaded on a liposome is capable of detecting SARS-CoV-2 RNA.
도 24(b)는 본 발명의 실시예에 따른 리포좀의 막융합 기반 검출법이 SARS-CoV-2 바이러스에 대해서도 가능함을 보여준다.Figure 24(b) shows that the membrane fusion-based detection method of liposomes according to an embodiment of the present invention is also possible for the SARS-CoV-2 virus.
본 발명은 다음 방법으로 제조된 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 제공한다:The present invention provides a lipid nanoparticle loaded with a detection substance for detecting a target nucleic acid, which is manufactured by the following method:
지질 혼합물이 포함된 에탄올 피딩 용액; 및 상기 검출물질이 포함된 물 피딩 용액을, 각각 독립적으로, 미세유체소자에 통과시켜서 혼합하고 자가조립 과정을 거쳐서 제조된 지질 나노입자로,An ethanol feeding solution containing a lipid mixture; and a water feeding solution containing the detection substance are each independently passed through a microfluidic device to be mixed and manufactured through a self-assembly process to produce lipid nanoparticles.
상기 지질 혼합물은,The above lipid mixture is,
i) 포스포콜린 0-40mol%;i) phosphocholine 0-40 mol%;
ii) 이온성 지질 0-40mol%;ii) 0-40 mol% of ionic lipids;
iii) 헬퍼(helper) 지질 0-40mol%;iii) 0-40 mol% helper lipid;
iv) 콜레스테롤 0-40mol%; 및iv) cholesterol 0-40 mol%; and
v) 수용성 고분자가 결합된 지질 0-5mol%로 구성됨.v) Composed of 0-5 mol% of lipids bound to water-soluble polymers.
본 발명은 상기 에탄올 피딩 용액에 포함되는 지질 혼합물의 조성을 최적화함으로써, 지질 나노입자를 형성하면서 동시에 타겟 핵산 검출용 물질의 담지가 가능한(pre-encapsulation) 원스텝의 지질 나노입자 제조방법을 제공한다.The present invention provides a one-step method for producing lipid nanoparticles, which enables the formation of lipid nanoparticles and the loading of a target nucleic acid detection substance at the same time (pre-encapsulation) by optimizing the composition of a lipid mixture included in the ethanol feeding solution.
상기 "지질 나노입자(lipid nanoparticles)"란, 이 기술분야에서 통상적으로 사용되는 용어로, 리포좀(liposome)을 포함하는 지질 이중층으로 구성되는 나노입자를 말한다.The above "lipid nanoparticles" is a term commonly used in this technical field, and refers to nanoparticles composed of a lipid bilayer including a liposome.
상기 "미세유체소자(microfluidic device)"는 이 기술분야에 널리 알려진 기술이므로 구체적인 설명은 생략한다.Since the above “microfluidic device” is a widely known technology in this technical field, a detailed description will be omitted.
본 발명에서는 두 개 이상의 복수 개의 주입구; 상기 주입구가 하나로 합쳐지는 물질 혼합부; 및 상기 물질 혼합부에 연결되는 단일한 배출구;를 가진 미세유체소자를 이용할 수 있다(도 1(a) 참고).The present invention can utilize a microfluidic device having two or more inlets; a material mixing section in which the inlets are combined into one; and a single outlet connected to the material mixing section (see Fig. 1(a)).
상기 물질혼합부는, 이 기술분야에 알려진, SHM(staggered herringbone mixer)를 포함할 수 있다(Belliveau, N. M. et. al., Microfluidic Synthesis of Highly Potent Limit-Size Lipid Nanoparticles for in vivo Delivery of siRNA. Mol. Ther. Nucleic Acids 2012, 1, 1-9.).The above material mixing unit may include a SHM (staggered herringbone mixer), which is known in the art (Belliveau, NMet. al ., Microfluidic Synthesis of Highly Potent Limit-Size Lipid Nanoparticles for in vivo Delivery of siRNA.Mol. Ther.
상기 복수 개의 주입부는, 예를 들면, 2개의 주입부일 수 있다. 이 두 개의 주입부 각각에, 지질 혼합물이 포함된 에탄올 피딩 용액과 검출물질이 포함된 물 피딩 용액이 독립적으로 주입될 수 있다. 주입된 지질 혼합물 포함 에탄올 피딩 용액과 물 피딩 용액은 서로 만나고, 물질혼합부에서 지질이 단분산적으로 혼합된다. 그 후 지질 혼합 용액은 자가조립 과정을 거쳐서 지질결정 나노입자를 형성하게 되는데, 이 자가조립 과정은 회전 증발기에서 이루어질 수 있다.The above-mentioned multiple injection ports can be, for example, two injection ports. An ethanol feeding solution containing a lipid mixture and a water feeding solution containing a detection substance can be independently injected into each of the two injection ports. The injected ethanol feeding solution containing a lipid mixture and the water feeding solution meet each other, and the lipids are monodispersely mixed in the material mixing port. Thereafter, the lipid mixture solution undergoes a self-assembly process to form lipid crystal nanoparticles, and this self-assembly process can be performed in a rotary evaporator.
상기 회전 증발기에서의 자가조립 조건은 이 기술분야에 알려진 조건으로 수행될 수 있다.The self-assembly conditions in the above rotary evaporator can be performed under conditions known in the art.
상기 지질 나노입자는 상기 나노입자 표면에 상기 타겟 핵산이 포함된 물질과 결합하는 수용체의 바이오컨쥬게이션을 위한 지질을 1 mol % 이하로 더 포함할 수 있다.The above lipid nanoparticles may further comprise 1 mol % or less of lipid for bioconjugation of a receptor that binds to a substance containing the target nucleic acid on the surface of the nanoparticles.
본 발명에서 상기 용어 "바이오컨쥬게이션(bioconjugation)"이란, 타겟 핵산이 포함된 물질(예를 들면, 바이러스)의 표면에 존재하는 물질(예를 들면, 표면 단백질)과 결합할 수 있는 수용체를 상기 지질나노입자의 결합 작용기와 서로 연결하여 결합시키는 것을 말한다 (도 1(b) 참고).In the present invention, the term "bioconjugation" refers to linking a receptor capable of binding to a substance (e.g., a surface protein) present on the surface of a substance (e.g., a virus) containing a target nucleic acid to a binding functional group of the lipid nanoparticle (see Figure 1(b)).
상기 바이오컨쥬게이션용 지질은 maleimide-PEG-PE일 수 있으나 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 바이오컨쥬게이션용 지질로 사용되는 것이라면 제한없이 모두 포함될 수 있다.The lipid for bioconjugation may be, but is not necessarily limited to, maleimide-PEG-PE, and any lipid used in this technical field for bioconjugation may be included without limitation.
상기 바이오컨쥬게이션을 통해 타겟 핵산이 포함된 물질과 지질나노입자를 결합시키게 되면 막 융합이 촉진될 수 있다. 예를 들면, 타겟 핵산이 포함된 물질이 SARS-CoV-2인 경우, 이 바이러스는 숙주세포의 ACE2(angiotensin Converting Enzyme-2)에 결합하므로, ACE2를 본 발명의 지질 나노입자 표면에 바이오컨쥬게이션하여 SARS-CoV-2와의 막융합을 촉진시킬 수 있다(도 2 및 도 11 참고). 이러한 경우에 사용하는 지질을 1 mol % 이하로 더 포함하여 지질 나노입자를 제조할 수 있는 것이다.By combining a substance containing a target nucleic acid with a lipid nanoparticle through the above bioconjugation, membrane fusion can be promoted. For example, if the substance containing a target nucleic acid is SARS-CoV-2, this virus binds to ACE2 (angiotensin converting enzyme-2) of the host cell, and therefore, by bioconjugating ACE2 to the surface of the lipid nanoparticle of the present invention, membrane fusion with SARS-CoV-2 can be promoted (see FIGS. 2 and 11). In this case, the lipid used can be further included in an amount of 1 mol % or less to manufacture the lipid nanoparticle.
상기 바이오컨쥬게이션용 지질을 1 mol% 범위를 초과하여 사용하는 경우에는 막융합에 불리하거나 담지 효율 저하 등의 문제가 발생할 수도 있다.If the lipid for bioconjugation is used in excess of 1 mol%, problems such as unfavorable membrane fusion or reduced loading efficiency may occur.
상기 타겟 핵산을 검출하기 위한 검출물질은 a) 형광물질이 연결된 핵산 프로브; 또는 b) 가이드 RNA, CRISPR 연관 엔도뉴클라아제 및 리포터 핵산; 또는 c) LAMP (Loop-Mediated Isothermal Amplification) 반응물일 수 있다.The detection material for detecting the above target nucleic acid may be a) a nucleic acid probe linked to a fluorescent material; or b) a guide RNA, a CRISPR-associated endonuclease and a reporter nucleic acid; or c) a LAMP (Loop-Mediated Isothermal Amplification) reactant.
상기 a) 형광물질이 연결된 핵산 프로브는, 양 말단에 각각 형광체와 소광체가 표지되어 있고, 상기 형광 물질 및 소광체가 핵산에 결합되어 있는 링커 영역; 타겟 핵산과 혼성화될 수 있는 영역을 포함할 수 있다.The above a) nucleic acid probe linked to a fluorescent substance may include a linker region in which a fluorescent substance and a quencher are labeled at each end, respectively, and the fluorescent substance and the quencher are bound to a nucleic acid; and a region capable of hybridizing with a target nucleic acid.
형광 물질 및 링커의 종류는 이 기술분야에 널리 알려져 있으므로 자세한 설명은 생략한다.The types of fluorescent substances and linkers are widely known in this technical field, so a detailed description is omitted.
상기 b) 가이드 RNA, CRISPR 연관 엔도뉴클라아제 및 리포터 핵산으로 이루어진 검출물질은 CRIPSR(Clusters of Regularly Interspaced Palindromic Repeats) 기반 검출물질이다.The above b) detection material consisting of guide RNA, CRISPR-associated endonuclease, and reporter nucleic acid is a detection material based on CRIPSR (Clusters of Regularly Interspaced Palindromic Repeats).
CRISPR(크리스퍼) 시스템은 세균 등에서 발견되는 적응 면역 기작으로, 현재는 이를 응용한 유전체 편집 기술로 알려져 있고, CRISPR 연관 엔도뉴클라아제를 이용한다.The CRISPR system is an adaptive immune mechanism found in bacteria and other organisms, and is currently known as a genome editing technology that uses CRISPR-associated endonuclease.
상기 CRISPR 연관 엔도뉴클라아제는 Cas1, Cas1B, Cas2, Cas3, Cas4, Cas5, Cas6, Cas7, Cas8, Cas9, Cas10, Cas12a, Cas12b, Cas12c, Cas12d, Cas12e, Cas12g, Cas12h, Cas12i, Cas13a, Cas13b, Cas13c, Cas13d, Cas14, Csy1, Csy2, Csy3, Cse1, Cse2, Csc1, Csc2, Csa5, Csn2, CsMT2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, Csx14, Csx10, Csx16, CsaX, Csx3, Csx1, Csx15, Csf1, Csf2, Csf3 및 Csf4로 이루어진 군에서 선택될 수 있으나 반드시 이로 제한되는 것은 아니다. The above CRISPR-associated endonucleases are Cas1, Cas1B, Cas2, Cas3, Cas4, Cas5, Cas6, Cas7, Cas8, Cas9, Cas10, Cas12a, Cas12b, Cas12c, Cas12d, Cas12e, Cas12g, Cas12h, Cas12i, Cas13a, Cas13b, Cas13c, Cas13d, Cas14, Csy1, Csy2, Csy3, Cse1, Cse2, Csc1, Csc2, Csa5, Csn2, CsMT2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, It may be selected from the group consisting of, but is not necessarily limited to, Csx14, Csx10, Csx16, CsaX, Csx3, Csx1, Csx15, Csf1, Csf2, Csf3, and Csf4.
상기 가이드 RNA는 타겟 핵산을 인식하는 역할을 하며 crRNA; 또는 crRNA가 포함된 sgRNA일 수 있다.The above guide RNA serves to recognize the target nucleic acid and may be a crRNA; or an sgRNA containing a crRNA.
상기 CRISPR 연관 엔도뉴클라아제는 타겟 핵산을 전달 혹은 외부의 핵산을 절단하는 역할을 하는 효소 단백질이다.The above CRISPR-associated endonuclease is an enzyme protein that plays a role in delivering target nucleic acids or cleaving foreign nucleic acids.
상기 리포터 핵산은 RNA 또는 DNA 일 수 있으며, 양 말단에 각각 형광체와 소광체가 표지되어 있고, CRISPR 연관 엔도뉴클라아제가 활성화되면 절단되면서 형광 신호를 방출한다(도 3 참고).The reporter nucleic acid may be RNA or DNA, and is labeled with a fluorophore and a quencher at each end, respectively, and is cleaved when the CRISPR-associated endonuclease is activated, thereby emitting a fluorescent signal (see Fig. 3).
상기 LAMP(Loop-Mediated Isothermal Amplification)는 등온 온도 조건에서 4개 또는 6개의 프라이머 세트 및 DNA 중합 효소를 사용하여 수행되는 DNA 증폭 방법 중 하나이다. 상기 LAMP 검출물은 타겟 핵산을 인식하면 LAMP 증폭 반응을 통해 육안으로 확인할 수 있는 빨강에서 노랑으로의 색변화를 발생시킨다(도 13 참고) .The above LAMP (Loop-Mediated Isothermal Amplification) is one of the DNA amplification methods performed using four or six primer sets and DNA polymerase under isothermal temperature conditions. The LAMP detector causes a color change from red to yellow that can be confirmed with the naked eye through the LAMP amplification reaction when it recognizes the target nucleic acid (see Figure 13).
상기 검출물질은, 상기 지질 나노입자의 전체 중량에 대하여, 각각 0.00001-4 중량% 이하로 포함될 수 있다. 상기 범위를 벗어나는 경우, 지질 나노입자 구조가 잘 유지되지 않고 담지 효율이 낮아질 수 있다.The above detection substances may be included in an amount of 0.00001-4 wt% or less, respectively, relative to the total weight of the lipid nanoparticles. If the amount is outside the above range, the lipid nanoparticle structure may not be well maintained and the loading efficiency may be reduced.
상기 포스포콜린은 DPhyPC(1,2-Diphytanoyl-sn-glycero-3-phosphocholine ), DOPC(1,2-dioleoyl-sn-glycero-3-phosphocholine (1,2-dioleoyl-sn-glycero-3-phosphocholine) 또는 (DPPC(1,2-dipalmitoyl-sn-glycero-3-phosphocholine)일 수 있다.The above phosphocholine can be DPhyPC (1,2-Diphytanoyl-sn-glycero-3-phosphocholine), DOPC (1,2-dioleoyl-sn-glycero-3-phosphocholine (1,2-dioleoyl-sn-glycero-3-phosphocholine)) or (DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine).
상기 이온성 지질은 양이온성 지질 또는 음이온성 지질일 수 있다.The above ionic lipid may be a cationic lipid or an anionic lipid.
상기 "양이온성 지질" 또는 "음이온성 지질"이란 용어는, 양이온 또는 음이온인 본 발명의 모든 지질을 포함하기 위하여 본 명세서에서 사용된다. 지질이 측정시에 이용한 기계에 의하여 측정되어 양전하(생리학적 pH에서)를 가질 때, 이 지질은 양이온성이라고 결정될 것이다.The terms "cationic lipid" or "anionic lipid" are used herein to encompass all lipids of the invention which are either cationic or anionic. A lipid will be determined to be cationic when it has a positive charge (at physiological pH) as measured by the instrument utilized for the measurement.
구체적으로, 상기 양이온성 지질은, DDAB(dimethyldioctadecylammonium bromide); DOGS(N,N-di octadecyl amido glycyl spermine); DOTAP(1,2-dioleoyloxy-3-(trimethyl ammonium)propane); DODAC(dimethyldioleylammonium chloride); N-[1-(2,3-Dioloyloxy)propyl]-N,N,N-trimethylammonium methylsulfate; DOTMA(N-[1-[2,3-bis(oleoyloxy)]propyl]-N,N,N-trimethylammonium chloride); DOGS(di-octadecyl-amido-glycyl-spermine); DC-cholesterol(3β-[N―(N′,N′'-dimethyl amino ethane)carbamoyl] cholesterol); DOSPA(2,3-dioleoyloxy-N-(2(spermine carboxamido)-ethyl)-N,N-dimethyl-1-propanaminium trifluoroacetate); 1,2-diacyl-sn-glycero-3-ethyl phosphocholines; β-alanyl cholesterol; CTAB(cetyl trimethylammonium bromide); DODMA(1,2-dioleyloxy-3-dimethylaminopropane); MVL5(N1-[2-((1S)-1-[(3-aminopropyl)amino]-4-[di(3-amino-propyl)amino]butylcarboxamido)ethyl]-3,4-di[oleyloxy]-benzamide); DOSPER(1,3-dioleoyloxy-2-(6-carboxy-spermyl)-propylamide); N,N,N′,N′'-tetramethyl-N,N′'-bis(2-hydroxylethyl)-2,3-dioleoyloxy-1,4-butane diammonium iodide; 및 이들의 혼합물로 이루어진 군으로부터 선택될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 양이온성 지질은 모두 사용할 수 있다.Specifically, the cationic lipid is DDAB (dimethyldioctadecylammonium bromide); DOGS (N,N-di octadecyl amido glycyl spermine); DOTAP (1,2-dioleoyloxy-3-(trimethyl ammonium)propane); DODAC (dimethyldioleylammonium chloride); N-[1-(2,3-Dioloyloxy)propyl]-N,N,N-trimethylammonium methylsulfate; DOTMA(N-[1-[2,3-bis(oleoyloxy)]propyl]-N,N,N-trimethylammonium chloride); DOGS (di-octadecyl-amido-glycyl-spermine); DC-cholesterol (3β-[N—(N′,N′'-dimethyl amino ethane)carbamoyl] cholesterol); DOSPA (2,3-dioleoyloxy-N-(2(spermine carboxamido)-ethyl)-N,N-dimethyl-1-propanaminium trifluoroacetate); 1,2-diacyl-sn-glycero-3-ethyl phosphocholines; β-alanyl cholesterol; CTAB (cetyl trimethylammonium bromide); DODMA (1,2-dioleyloxy-3-dimethylaminopropane); MVL5(N1-[2-((1S)-1-[(3-aminopropyl)amino]-4-[di(3-amino-propyl)amino]butylcarboxamido)ethyl]-3,4-di[oleyloxy]-benzamide); DOSPER (1,3-dioleoyloxy-2-(6-carboxy-spermyl)-propylamide); N,N,N′,N′'-tetramethyl-N,N′'-bis(2-hydroxylethyl)-2,3-dioleoyloxy-1,4-butane diammonium iodide; and mixtures thereof, but are not necessarily limited thereto, and any cationic lipid usable in this art can be used.
구체적으로, 상기 음이온성 지질은, DMPA(dimyristyl glycerophosphate); DPPA(dipalmitoyl glycerophosphate); DMPG(dimyristyl glycerophosphate); DSPA(disteroyl glycerophosphate); DSPG(distearoyl-sn-glycero-3-phosphoglycerol); DPPG(dipalmitoyl glycerophosphoraglycerol); MPS(dimyristylyl glycerophosphoseline); DPPS(dipalmitoyl glycerophosphoseline);Specifically, the anionic lipid is DMPA (dimyristyl glycerophosphate); DPPA (dipalmitoyl glycerophosphate); DMPG (dimyristyl glycerophosphate); disteroyl glycerophosphate (DSPA); DSPG (distearoyl-sn-glycero-3-phosphoglycerol); DPPG (dipalmitoyl glycerophosphoraglycerol); MPS (dimyristylyl glycerophosphoseline); DPPS (dipalmitoyl glycerophosphoseline);
DSPS(disteroyl glycerophosphoseline) 및 이들의 혼합물로 이루어진 군으로부터 선택 될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 음이온성 지질은 모두 사용할 수 있다.Any anionic lipid usable in this technical field may be used, but is not necessarily limited to, the group consisting of DSPS (disteroyl glycerophosphoseline) and mixtures thereof.
상기 헬퍼 지질은 DOPE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), DSPE(1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DSPE(1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DPPE(1,2-bis(diphenylphosphino)ethane), DMPE(1,2-bis(dimethylphosphino)ethane) 및 이들의 혼합물로 이루어진 군으로부터 선택될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 Phosphoethanolamine 머리를 갖는 지질 혹은 지질 분자 패킹 파라미터(packing parameter)가 1 이상인 헬퍼 지질은 모두 사용할 수 있다.The above helper lipid may be selected from the group consisting of DOPE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DSPE (1,2-distearoyl-sn-glycero-3-phosphoethanolamine), DPPE (1,2-bis(diphenylphosphino)ethane), DMPE (1,2-bis(dimethylphosphino)ethane), and mixtures thereof, but is not necessarily limited thereto, and any helper lipid having a Phosphoethanolamine head usable in this technical field or a lipid molecule packing parameter of 1 or more may be used.
상기 콜레스테롤은 지질막 안정성 확보 용도이다.The above cholesterol is used to secure lipid membrane stability.
상기 수용성 고분자가 결합된 지질은 지질결정 나노입자의 안정화제 용도이다.The lipid bound to the above water-soluble polymer is used as a stabilizer for lipid crystal nanoparticles.
상기 수용성 고분자는 폴리에틸렌글리콜(polyethylene glycol), 폴리아크릴산(polyacrylic acid), 폴리비닐알코올(polyvinyl alcohol), 폴리비닐피롤리돈(polyvinylpyrrolidone), 폴리아크릴아미드(polyacrylamide), 폴리에틸렌옥사이드(polyethylene oxide) 폴리사카라이드(polysaccharide) 및 이들의 혼합물로 이루어진 군으로부터 선택될 수 있으나, 반드시 이로 제한되는 것은 아니고, 이 기술분야에서 사용가능한 수용성 고분자라면 모두 사용할 수 있다.The water-soluble polymer may be selected from the group consisting of polyethylene glycol, polyacrylic acid, polyvinyl alcohol, polyvinylpyrrolidone, polyacrylamide, polyethylene oxide, polysaccharides, and mixtures thereof, but is not necessarily limited thereto, and any water-soluble polymer usable in this technical field may be used.
상기 수용성 고분자가 결합된 지질에서, 상기 지질은 인지질일 수 있다.In the lipid to which the water-soluble polymer is bound, the lipid may be a phospholipid.
수용성 고분자가 결합된 지질은 DOPE-PEG2000일 수 있다.The lipid bound to the water-soluble polymer may be DOPE-PEG2000.
본 발명에서는 수용성 고분자의 길이를 짧게 (2000~5000 Da) 하고, 이를 지질의 머리 부분에 공유결합시킨 지질을 사용할 수 있다.In the present invention, a lipid can be used in which the length of a water-soluble polymer is shortened (2000 to 5000 Da) and this is covalently bonded to the head portion of a lipid.
이와 같이 길이가 짧은 수용성 고분자를 사용함으로써 고분자 자체의 마이셀(micelle) 형성을 방지하고, 미세유체소자를 사용해 균일한 입자를 형성할 수 있다. 그리고 지질 나노입자들이 융합 및 자기조립하는 과정을 혼입 과정과 분리하여 균일한 크기 및 구조의 지질 나노입자를 형성할 수 있다.By using a short-length water-soluble polymer like this, micelle formation of the polymer itself can be prevented, and uniform particles can be formed using a microfluidic device. In addition, the process of lipid nanoparticles fusing and self-assembling can be separated from the mixing process, so that lipid nanoparticles of uniform size and structure can be formed.
즉, 고분자와 지질을 동일한 용매인 에탄올에 녹여 사용하므로 미세유체소자 내에서 섞일 때 항상 균일하게 섞이게 되고, 따라서 균질한 입자가 형성될 수 있다.That is, since the polymer and lipid are dissolved in the same solvent, ethanol, they are always mixed uniformly when mixed within the microfluidic device, and thus homogeneous particles can be formed.
본 발명에서는 기름과 유화제를 전혀 사용하지 않지만, 필요한 경우 기름과 유화제도 혼입도 가능하다.The present invention does not use any oil or emulsifier, but oil and emulsifier may also be mixed in if necessary.
본 발명에 따른 상기 지질 나노입자는 그 표면에 타겟 핵산이 포함된 물질, 예를 들면 바이러스와 결합할 수 있는 수용체를 컨쥬게이션한 형태일 수 있다. 이는 앞서 언급한 것과 같이 바이러스와 막 융합을 효과적으로 하기 위한 것이다.The lipid nanoparticle according to the present invention may be in a form in which a substance containing a target nucleic acid, for example, a receptor capable of binding to a virus, is conjugated to its surface. This is to effectively facilitate membrane fusion with the virus, as mentioned above.
상기 타겟 핵산은 DNA 또는 RNA일 수 있으며, ssDNA, dsDNA, ssRNA 및 microRNA를 모두 포함할 수 있다.The above target nucleic acid may be DNA or RNA, and may include ssDNA, dsDNA, ssRNA, and microRNA.
검출 가능한 타겟 핵산이 포함된 물질은 RNA 바이러스, DNA 바이러스, 세포, 세포 등 대상체에서 분비되는 핵산을 담지한 지질 기반 소포체 (세포외 소포체, 엑소좀) 이나, 반드시 이로 제한되는 것은 아니다.The substance containing the detectable target nucleic acid includes, but is not necessarily limited to, an RNA virus, a DNA virus, a cell, a lipid-based vesicle (exosomes) containing nucleic acid secreted from a target organism such as a cell, etc.
다른 측면에서 본 발명은 다음을 포함하는 지질결정 나노입자 제조방법을 제공한다:In another aspect, the present invention provides a method for preparing lipid crystal nanoparticles, comprising:
상기 준비된 지질 혼합물이 포함된 에탄올 피딩 용액과 검출물질이 포함된 물 피딩 용액을, 각각 독립적으로, 미세유체소자에 통과시켜서 지질 혼합물이 포함된 에탄올 피딩 용액과 타겟 핵산 검출물질이 포함된 물 피딩 용액을 혼합시키고; 그리고The ethanol feeding solution containing the prepared lipid mixture and the water feeding solution containing the detection substance are each independently passed through the microfluidic device to mix the ethanol feeding solution containing the lipid mixture and the water feeding solution containing the target nucleic acid detection substance; and
상기 혼합된 용액의 자기조립 과정을 거쳐서, 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 제조하는 방법으로,A method for manufacturing lipid nanoparticles loaded with a detection substance for detecting target nucleic acids through a self-assembly process of the above mixed solution,
상기 지질 혼합물은 다음과 같이 구성되는, 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자 제조방법:The above lipid mixture is composed as follows: a method for manufacturing lipid nanoparticles loaded with a detection substance for detecting target nucleic acids:
i) 포스포콜린 0-40mol%;i) phosphocholine 0-40 mol%;
ii) 이온성 지질 0-40mol%;ii) 0-40 mol% of ionic lipids;
iii) 헬퍼(helper) 지질 0-40mol%;iii) 0-40 mol% helper lipid;
iv) 콜레스테롤 0-40mol%; 및iv) cholesterol 0-40 mol%; and
v) 수용성 고분자가 결합된 지질 0-5mol%.v) 0-5 mol% of lipids bound to water-soluble polymers.
상기 지질 나노입자는 상기 지질 나노입자 표면에 상기 타겟 핵산이 포함된 물질과 결합하는 수용체의 바이오컨쥬게이션을 위한 지질을 1 mol % 이하로 더 포함할 수 있다.The lipid nanoparticle may further comprise 1 mol % or less of a lipid for bioconjugation of a receptor that binds to a substance containing the target nucleic acid on the surface of the lipid nanoparticle.
상기 바이오컨쥬게이션의 정의는 앞서 설명한 바와 같다.The definition of the above bioconjugation is as described above.
각각의 물질에 대한 내용은 앞서 언급한 내용과 동일하다.The contents for each material are the same as those mentioned above.
다른 측면에서 본 발명은 상기 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자를 포함하는 타겟 핵산 검출용 조성물을 제공한다.In another aspect, the present invention provides a composition for detecting target nucleic acids, comprising lipid nanoparticles loaded with a detection substance for detecting the target nucleic acids.
상기 조성물에는 지질 나노입자의 구조를 안정하게 유지하는 증류수 또는 완충액을 더 포함할 수 있다.The above composition may further include distilled water or a buffer solution that maintains the structure of the lipid nanoparticles stable.
또 다른 측면에서 본 발명은 상기 타겟 핵산 검출용 조성물을 포함하는 진단 키트를 제공한다.In another aspect, the present invention provides a diagnostic kit comprising the composition for detecting the target nucleic acid.
본 발명의 상기 키트는 검출 방법에 적합한 한 종류 또는 그 이상의 다른 구성 성분 조성물, 용액 또는 장치를 더 포함할 수 있다. 예를 들면, 상기 키트는 테스트 튜브 또는 다른 적절한 용기, 반응 완충액(pH 및 마그네슘 농도는 다양), 멸균수 등을 포함할 수 있다.The kit of the present invention may further comprise one or more other component compositions, solutions or devices suitable for the detection method. For example, the kit may comprise a test tube or other suitable container, a reaction buffer (having various pH and magnesium concentrations), sterile water, and the like.
또 다른 측면에서 본 발명은, 다음과 같은 막융합 기반 타겟 핵산 검출 방법을 제공한다:In another aspect, the present invention provides a membrane fusion-based target nucleic acid detection method as follows:
지질 이중층 내부에 타겟 핵산이 존재하는 물질이 포함된 샘플과 상기 언급한 지질 나노입자 또는 타겟 핵산 검출용 조성물을 혼합함으로써, 상기 타겟 핵산을 포함하는 물질과 상기 타겟 핵산을 검출하기 위한 검출물질이 담지된 지질 나노입자의 막융합을 발생시키고; 그리고By mixing a sample containing a substance in which a target nucleic acid exists inside a lipid bilayer and the lipid nanoparticle or the composition for detecting a target nucleic acid mentioned above, membrane fusion of the substance containing the target nucleic acid and the lipid nanoparticle carrying a detection substance for detecting the target nucleic acid is caused; and
상기 지질 나노입자 내의 타겟 핵산 검출 물질이 상기 타겟 핵산과 반응하여 검출 신호를 발생시킴.The target nucleic acid detection material within the lipid nanoparticle reacts with the target nucleic acid to generate a detection signal.
상기 샘플은 대상체(subject)로부터 얻어진 DNA 바이러스 또는 RNA 바이러스, 세포 또는 지질 기반 소포체(엑소좀, 세포외 소포체 등)이고, 상기 타겟 핵산을 포함하는 물질과 상기 지질 나노입자의 막융합은 바이러스 지질층 막 또는 세포막 또는 지질 기반 소포체 지질층 막과 상기 지질 나노입자 막이 융합되는 것일 수 있다.The above sample is a DNA virus or RNA virus, a cell or a lipid-based vesicle (exosome, extracellular vesicle, etc.) obtained from a subject, and the membrane fusion of the substance containing the target nucleic acid and the lipid nanoparticle may be a fusion of a viral lipid layer membrane or a cell membrane or a lipid-based vesicle lipid layer membrane with the lipid nanoparticle membrane.
도 2에 나타낸 것과 같이, 타겟 핵산을 포함하는 바이러스 물질과 본 발명의 지질 나노입자가 막융합을 통해 결합하여 지질 나노입자의 타겟 핵산 검출물질에 의해 타겟 핵산이 검출되면서 형광 신호를 발생시킨다.As shown in Fig. 2, a viral material containing a target nucleic acid and a lipid nanoparticle of the present invention are combined through membrane fusion, and the target nucleic acid is detected by the target nucleic acid detection material of the lipid nanoparticle, thereby generating a fluorescent signal.
상기 용어 "대상체"는 포유동물, 예컨대 영장류 또는 인간을 포함할 수 있다. 또한, 사육 동물 (예를 들어, 고양이, 개, 등), 가축 (예를 들어, 소, 말, 돼지, 양, 염소, 등), 실험실 동물 (예를 들어, 마우스, 토끼, 랫트, 기니아 피그, 등), 및 조류를 포함할 수 있다.The term "subject" above may include mammals, such as primates or humans. It may also include farmed animals (e.g., cats, dogs, etc.), livestock (e.g., cows, horses, pigs, sheep, goats, etc.), laboratory animals (e.g., mice, rabbits, rats, guinea pigs, etc.), and birds.
상기 용어 " 샘플"은 대상체부터 수득된 샘플을 지칭한다. 예를 들어, 비인두, 타액, 가래, 혈액, 조직, 혈청, 대변, 소변, 및 세포 용해물로부터의 상청액으로부터 수득될 수 있다.The above term "sample" refers to a sample obtained from a subject. For example, it can be obtained from a supernatant from the nasopharynx, saliva, sputum, blood, tissue, serum, feces, urine, and cell lysates.
상기 타겟 핵산 검출물질은 a) 형광물질이 연결된 핵산 프로브; 또는 b) 가이드 RNA, CRISPR 연관 엔도뉴클라아제 및 리포터 핵산; c) LAMP (Loop-Mediated Isothermal Amplification) 반응물이고, 상기 검출물질이 타겟 핵산과 반응하면 검출 신호로 형광 또는 색변화를 발생시킬 수 있다.The above target nucleic acid detection material is a) a nucleic acid probe linked to a fluorescent material; or b) a guide RNA, a CRISPR-linked endonuclease, and a reporter nucleic acid; or c) a LAMP (Loop-Mediated Isothermal Amplification) reactant, and when the detection material reacts with the target nucleic acid, fluorescence or a color change can be generated as a detection signal.
본 발명에 따른 막 융합 기반 타겟 핵산 검출 방법은 타겟 핵산에 대한 전처리 및 핵산 증폭 과정이 필요 없고 상온에서 이루어질 수 있다.The membrane fusion-based target nucleic acid detection method according to the present invention does not require pretreatment or nucleic acid amplification processes for the target nucleic acid and can be performed at room temperature.
또한 검출 시간은 30분 이내로 매우 빠르게 이루어진다. 바람직하게는 15분 이내, 더 바람직하게는 10분 이내, 더욱 바람직하게는 5분 이내, 더더욱 바람직하게는 2분 이내로 매우 빠르게 이루어진다.In addition, the detection time is very fast, within 30 minutes. Preferably within 15 minutes, more preferably within 10 minutes, even more preferably within 5 minutes, and even more preferably within 2 minutes.
또한 상기 방법은 타겟 핵산이 야생형 또는 돌연변이 유래이든 상관없이 이루어질 수 있다.Additionally, the above method can be performed regardless of whether the target nucleic acid is of wild type or mutant origin.
또한, 상기 지질 이중층 내부에 타겟 핵산이 존재하는 물질이 포함된 샘플은, 별도의 샘플 채취 과정 없이, 대상체가 착용한 마스크 및/또는 대상체가 머물거나 이용한 물체 표면으로부터 얻어질 수 있다.Additionally, a sample containing a substance in which a target nucleic acid exists inside the lipid bilayer can be obtained from a mask worn by the subject and/or the surface of an object on which the subject stays or uses, without a separate sample collection process.
상기 대상체가 머물거나 이용한 물체에서, 상기 대상체는 인간으로 한정되지 않으며, 검출 대상인 타겟 핵산이 포함된 물질, 예를 들면, 바이러스를 가진 것으로 의심되는 대상체라면 인간 이외의 동물도 모두 포함된다.In the object where the subject stays or uses, the subject is not limited to a human, and if it is a subject suspected of having a virus, for example, a substance containing the target nucleic acid to be detected, all animals other than humans are also included.
또한 상기 마스크 또는 물체 표면에서 상기 지질 나노입자 또는 상기 검출용 조성물을 혼합하여 막융합을 발생시킴으로써 타겟 핵산을 검출할 수 있다.In addition, target nucleic acids can be detected by mixing the lipid nanoparticles or the detection composition on the surface of the mask or object to cause membrane fusion.
상기 물체는 주거 공간과 사무 공간 뿐 아니라 공공시설 등 공용으로 사용하는 공간에 있는 물체는 모두 포함되며, 예를 들면, 책상, 가구, 계단 난간, 에스컬레이터 손잡이, 엘리베이터 버튼, 공용 화장실의 변기와 세면대 등이다,The above objects include all objects in public spaces such as residential and office spaces as well as public facilities, for example, desks, furniture, stair railings, escalator handrails, elevator buttons, toilets and sinks in public restrooms, etc.
또한 본 발명의 지질 나노입자는 4℃에서 장기간 냉장 보관이 가능하다.In addition, the lipid nanoparticles of the present invention can be stored for long periods of time under refrigeration at 4°C.
본 발명은 다양한 변환을 가할 수 있고 여러 가지 실시예를 가질 수 있는 바, 이하 특정 실시예들을 도면에 예시하고 상세한 설명에 상세하게 설명하고자 한다. 그러나, 이는 본 발명을 특정한 실시 형태에 대해 한정하려는 것이 아니며, 본 발명의 사상 및 기술 범위에 포함되는 모든 변환, 균등물 내지 대체물을 포함하는 것으로 이해되어야 한다. 본 발명을 설명함에 있어서 관련된 공지 기술에 대한 구체적인 설명이 본 발명의 요지를 흐릴 수 있다고 판단되는 경우 그 상세한 설명을 생략한다.The present invention can be modified in various ways and has various embodiments, and thus specific embodiments are illustrated in the drawings and described in detail in the detailed description below. However, this is not intended to limit the present invention to specific embodiments, and it should be understood that all modifications, equivalents, and substitutes included in the spirit and technical scope of the present invention are included. In describing the present invention, if it is determined that a specific description of a related known technology may obscure the gist of the present invention, the detailed description thereof will be omitted.
[실시예][Example]
이하, 본 발명을 실시예에 의해 상세히 설명한다.Hereinafter, the present invention will be described in detail by examples.
단, 하기 실시예는 본 발명을 예시하는 것일 뿐, 본 발명의 내용이 하기 실시예에 의해 한정되는 것은 아니다.However, the following examples are only intended to illustrate the present invention, and the content of the present invention is not limited by the following examples.
<실시예 1><Example 1>
1-1: 재료1-1: Materials
DOPC(1,2-dioleoyl-sn-glycero-3-phosphocholine), DOPE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), Cholesterol, DOTAP(Cholesterol, 1,2-dioleoyl-3-trimethylammonium-propane), DOPE-PEG2k, DSPE-PEG2k-maleimide, 18:1 NBD PE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl), 및 Liss Rhod PE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl)은 Avanti Polar Lipids(Alabaster, AL, USA)에서 구입하여 정제하지 않고 사용했다. ACE2(Human angiotensin converting enzyme-2)는 Sino Biological에서 구입했다(Beijing, China). α2,6-연결된 시알산(Neu5Acα(2-6)Galβ(1-4)GlcNAc-β-ethylamine)은 TCI Chemicals(Tokyo Chemical Industry Co., Ltd., Tokyo, Japan)에서 구입했다. Murine RNase Inhibitor는 New England Biolabs(Ipswich, MA, USA)에서 구입하였고, HEPES 용액, 염화칼륨 용액, 염화마그네슘 용액, 글리세롤, 에탄올, 클로로포름, DTT(1,4-Dithiothreitol)는 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하였다. UltrapureTM diethylpyrocarbonate(DEPC) 처리수는 Thermo-Fisher(Waltham, MA, USA)에서 구입하였다. 단일 기증 인간 타액(single donor human saliva)는 Innovative Research, Inc.(Novi, MI, USA)에서 구입하였다. 엑소좀은 ExoQuick-TC (System Bioscience, Palo Alto, CA, USA)를 통해 시험관 내 세포(HeLa) 배양 배지에서 추출하였다.DOPC(1,2-dioleoyl-sn-glycero-3-phosphocholine), DOPE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), Cholesterol, DOTAP(Cholesterol, 1,2-dioleoyl-3-trimethylammonium-propane), DOPE-PEG2k, DSPE-PEG2k-maleimide, 18:1 NBD PE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl), and Liss Rhod PE(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) were purchased from Avanti Polar Lipids (Alabaster, AL, USA) and were purified without purification. ACE2 (Human angiotensin converting) was used. enzyme-2) was purchased from Sino Biological (Beijing, China). α2,6-linked sialic acid (Neu5Acα(2-6)Galβ(1-4)GlcNAc-β-ethylamine) was purchased from TCI Chemicals (Tokyo Chemical Industry Co., Ltd., Tokyo, Japan). Murine RNase Inhibitor was purchased from New England Biolabs (Ipswich, MA, USA). HEPES solution, potassium chloride solution, magnesium chloride solution, glycerol, ethanol, chloroform, and DTT (1,4-Dithiothreitol) were purchased from Sigma-Aldrich (St. Louis, MO, USA). UltrapureTM diethylpyrocarbonate (DEPC)-treated water was purchased from Thermo-Fisher (Waltham, MA, USA). Single donor human saliva was purchased from Innovative Research, Inc. (Novi, MI, USA). Exosomes were extracted from in vitro cell (HeLa) culture medium using ExoQuick-TC (System Bioscience, Palo Alto, CA, USA).
Leptotrichia buccalis(Lbu) Cas13a은 SignalChem Biotech Inc. (Richmond, BC, Canada)에서 구입했다. NEBufferTM r2.1, SARS-CoV-2 Rapid Colorimetric LAMP Assay Kit는 New England Biolabs (Ipswich, MA, USA)에서 구입했다.Lachnospiraceae bacterium Cas12a, crRNA, 리포터 핵산은 모두 Integrated DNA Technologies (Coralville, IA, USA)에서 구입했으며 염기서열은 표1에 기재된 것과 같다.Leptotrichia buccalis (Lbu) Cas13a was purchased from SignalChem Biotech Inc. (Richmond, BC, Canada). NEBufferTM r2.1, SARS-CoV-2 Rapid Colorimetric LAMP Assay Kit was purchased from New England Biolabs (Ipswich, MA, USA).Lachnospiraceae bacterium Cas12a, crRNA, and reporter nucleic acids were all purchased from Integrated DNA Technologies (Coralville, IA, USA), and the base sequences are listed in Table 1.
지질은 모두 25 mg/ml 클로로포름 용매에 녹여 스톡(stock) 용액으로 사용하였고, 원하는 비율로 섞은 후 용매를 질소가스로 휘발시켰다. 그 후 에탄올을 넣어 10 mM 농도로 만든 후 에탄올 피딩 용액으로 사용되었다. 여기서 사용한 용매 및 리피드는 추가 정제 없이 사용되었다.All lipids were dissolved in chloroform solvent at 25 mg/mL and used as a stock solution. After mixing in the desired ratio, the solvent was evaporated with nitrogen gas. After that, ethanol was added to make the
1-2: 소각 X-선 산란(Small-Angle X-ray Scattering.)1-2: Small-Angle X-ray Scattering.
포항 가속기 연구소(Pohang Accelerator Laboratory, PAL, 대한민국)의 빔라인 4C(PLS-II)에서 싱크로트론 소각 X선 산란 (Synchrotron small-angle X-ray ) 스캔을 수행하였다. 싱크로트론 X선 소스는 평균 빔 크기가 100μm Х 300μm(V Х H)인 16.9keV의 평균 광자 에너지를 가졌다. 샘플-검출기 거리는 약 1m 였으며 실버 베헤네이트(silver behenate)를 사용하여 샘플-검출기 거리가 보정되었다.Synchrotron small-angle X-ray scans were performed at beamline 4C (PLS-II) of the Pohang Accelerator Laboratory (PAL, Republic of Korea). The synchrotron X-ray source had an average photon energy of 16.9 keV with an average beam size of 100 μm Х 300 μm (V Х H). The sample-to-detector distance was about 1 m, and the sample-to-detector distance was compensated using silver behenate.
산란된 광자는 Rayonix 2D SX 165 CCD 검출기(Rayonix, USA)를 사용하여 기록되었고 빔라인(beamline 4C)에서 제공하는 맞춤형 소프트웨어를 사용하여 방사형으로 적분되었다. 그리고 인지질 이중층 두께 등의 정보는 Sasfit 프로그램을 이용하여 분석되었다.Scattered photons were recorded using a Rayonix 2D SX 165 CCD detector (Rayonix, USA) and radially integrated using custom software provided at the beamline (beamline 4C). Information such as phospholipid bilayer thickness was analyzed using the Sasfit program.
1-3: 극저온 투과 전자 현미경1-3: Cryogenic transmission electron microscopy
개별 지질 나노입자, 바이러스, 그리고 둘 사이의 막융합 중간체의 상세한 형태 및 구조는 Cryo-TEM(200kV에서 FEI Tecnai F20 G2)에 의해 특성화되었다. 지질 나노입자는 Vitrobot(Vitrobot Mark IV, FEI)을 사용하여 레이시 탄소 코팅 구리 그리드(lacey carbon-coated copper grid)(Structure Probe Incorporation, PA, USA)에 로딩되었다. 간략하게, 합성된 지질 나노입자 5uL를 상대습도 100%, 24℃에서 탄소 격자 위에 떨어뜨렸다. 그 후 탄소 그리드는 두 번의 블로팅 세션(1초 블로팅 시간) 후에 액체 에탄에서 빠르게 퀜칭되어(quenched) 두께가 500 nm 미만인 비결정질 얼음 필름으로 제조되었다. 그 다음 샘플을 cryo-transfer holder (Gatan, CA, USA)를 사용하여 Cryo-EM으로 옮겼다. 얼음의 재결정화를 방지하기 위해 Cryo-EM으로 성공적으로 옮길 때까지 샘플 온도를 -170°C 미만으로 유지하였다. ~4000 nm의 언더포커스에서 이미지를 얻었다. 전자 빔 손상 및 샘플 드리프트(drift)를 최소화하기 위해 더 작은 조리개를 사용하여 고배율 이미지를 얻었다.The detailed morphology and structure of individual lipid nanoparticles, viruses, and membrane fusion intermediates between them were characterized by cryo-TEM (FEI Tecnai F20 G2 at 200 kV). Lipid nanoparticles were loaded onto lacey carbon-coated copper grids (Structure Probe Incorporation, PA, USA) using a Vitrobot (Vitrobot Mark IV, FEI). Briefly, 5 μL of synthesized lipid nanoparticles were dropped onto the carbon grid at 24 °C with 100% RH. The carbon grid was then rapidly quenched in liquid ethane after two blotting sessions (1 s blotting time) to form an amorphous ice film with a thickness of less than 500 nm. The samples were then transferred to cryo-EM using a cryo-transfer holder (Gatan, CA, USA). To prevent ice recrystallization, the sample temperature was maintained below -170°C until successful transfer to the cryo-EM. Images were acquired underfocus at ~4000 nm. Higher magnification images were obtained using a smaller aperture to minimize electron beam damage and sample drift.
1-4: 입자 크기 및 제타 전위 분석1-4: Particle size and zeta potential analysis
개별 지질 나노입자의 크기 및 제타 전위 분석은 Zetasizer Ultra (Malvern Panalytical Ltd., Malvern, UK)에 의해 특성화되었다.The size and zeta potential of individual lipid nanoparticles were characterized by Zetasizer Ultra (Malvern Panalytical Ltd., Malvern, UK).
1-5: 리포좀 내 리포터 RNA 및 Cas13a 단백질-가이드 RNA 복합체 포집율 분석1-5: Analysis of the entrapment rate of reporter RNA and Cas13a protein-guide RNA complexes in liposomes
리포좀 내 리포터 RNA 및 Cas13a 단백질-가이드 RNA 복합체의 포집율을 평가하기 위해 먼저 포집되지 않은 리포터 RNA 및 Cas13a 단백질-가이드 RNA 복합체의 농도를 특성화하고, 이를 리포좀 제조 시 넣어준 리포터 RNA 및 Cas13a 단백질-가이드 RNA의 초기 양에서 제외한 모든 리포터 RNA 및 Cas13a 단백질-가이드 RNA 복합체가 포집되었다고 가정하여 포집 효율을 계산했다.To evaluate the entrapment efficiency of reporter RNA and Cas13a protein-guide RNA complexes in liposomes, we first characterized the concentration of unentrapped reporter RNA and Cas13a protein-guide RNA complexes, and calculated the entrapment efficiency by assuming that all reporter RNA and Cas13a protein-guide RNA complexes were entrapped, minus the initial amount of reporter RNA and Cas13a protein-guide RNA added during liposome preparation.
이 때 포집되지 않은 Cas13a-crRNA 복합체의 정량화를 위해, 395 nM의 짧은 표적1 (표 1 참고)과 1975 nM의 리포터 RNA의 존재 하에 2배씩 희석된 Cas13a-crRNA 복합체에 대해 1시간 동안 수행한 절단 반응의 형광 값으로 검량선을 얻었다. 그 다음, 다음과 같이 볼츠만 함수를 사용하여 비선형 회귀를 얻고 포집되지 않은 Cas13a-crRNA 복합체의 양을 정량화하였다.To quantify the uncaptured Cas13a-crRNA complexes at this time, a calibration curve was obtained from the fluorescence values of the cleavage reaction performed for 1 h for two-fold diluted Cas13a-crRNA complexes in the presence of 395 nM short target 1 (see Table 1) and 1975 nM reporter RNA. Nonlinear regression was then obtained using the Boltzmann function as follows, and the amount of uncaptured Cas13a-crRNA complexes was quantified.
[수학식 1][Mathematical Formula 1]
포집되지 않은 리포터 RNA의 양을 계산하기 위해 RNA 정량화는 Quant-iT쪠 RiboGreen쪠 RNA 키트를 사용하여 달성했다. 그 다음 선형 회귀는 다음과 같이 교정 곡선에서 얻었다. 이를 바탕으로 포집되지 않은 리포터 RNA의 양을 정량화하였다.To calculate the amount of uncaptured reporter RNA, RNA quantification was achieved using the Quant-iT® RiboGreen® RNA kit. Then, linear regression was obtained from the calibration curve as follows. Based on this, the amount of uncaptured reporter RNA was quantified.
[수학식 2][Mathematical formula 2]
1-6: 리포좀의 장기간 보관 안정성 분석1-6: Long-term storage stability analysis of liposomes
Cas13a 단백질-crRNA 복합체와 리포터 RNA가 담지된 리포좀 용액을 분주하여 빛으로부터 보호하고 4°C에서 보관한 다음 안정성 분석 테스트에 즉시 사용했다. 보관 후 3개월과 6개월에 DLS 기기를 사용하여 리포좀의 크기를 측정했고, 마이크로플레이트 리더를 사용하여 본 발명의 막 융합 기반 분석 성능을 특성화했다. 상기 분석 시 384-웰 플레이트에 리포좀 용액 10 uL와 SARS-CoV-2 바이러스 음성 시료 10 uL 혼합액 혹은 리포좀 용액 10 uL와 1.5 pM의 SARS-CoV-2 바이러스 양성 시료 10 uL 혼합액을 로딩하고 485 nm에서 여기하는 마이크로 플레이트 리더기 (SpectraMax M2, Molecular Devices, CA, USA)를 사용하여 520 nm에서의 형광 세기 값을 30초 간격으로 얻었다.The liposome solution loaded with Cas13a protein-crRNA complex and reporter RNA was dispensed, stored at 4°C under protection from light, and then used immediately for stability analysis tests. The size of the liposomes was measured using a DLS instrument after 3 and 6 months of storage, and the membrane fusion-based assay performance of the present invention was characterized using a microplate reader. In the assay, a 384-well plate was loaded with a mixture of 10 uL of the liposome solution and 10 uL of a SARS-CoV-2 virus-negative sample or a mixture of 10 uL of the liposome solution and 10 uL of a 1.5 pM SARS-CoV-2 virus-positive sample, and the fluorescence intensity values at 520 nm were obtained at 30-second intervals using a microplate reader (SpectraMax M2, Molecular Devices, CA, USA) that excites at 485 nm.
<실시예 2> 리포좀 합성<Example 2> Liposome synthesis
2-1: 리포좀 제조2-1: Liposome preparation
본 발명에 따른 리포좀 제조방법에 대한 모식도를 도 1(a)에 나타내었다. SHM(staggered herringbone mixer)를 가지는 미세유체 소자는 알려진 방법으로 제작하였다(Belliveau, N. M.et. al., Microfluidic Synthesis of Highly Potent Limit-Size Lipid Nanoparticles for in vivo Delivery of siRNA.Mol. Ther. Nucleic Acids 2012, 1, 1-9.). 지질 혼합물(DOPC 40 mol%, DOPE 40 mol%, DOTAP 20 mol%)을 준비하였다. 클로로포름에 용해된 지질혼합물(DOPC 40 mol%, DOPE 40 mol%, DOTAP 20 mol%)을 바이알에서 건조시킨 다음 다시 에탄올 피딩 용액 1mL(15 mM 총 지질 농도)에 용해시켰다.A schematic diagram of a method for preparing liposomes according to the present invention is shown in Fig. 1(a). A microfluidic device having a staggered herringbone mixer (SHM) was fabricated by a known method (Belliveau, NMet. al ., Microfluidic Synthesis of Highly Potent Limit-Size Lipid Nanoparticles for in vivo Delivery of siRNA.Mol. Ther.
그 다음, 물 피딩 용액 3 mL와 에탄올 피딩 용액 1 mL를 SHM(staggered herringbone mixer)을 가진 미세유체의 주입구에 주입하여 지질을 단분산적으로 혼합하였다. 구체적으로, 주사기 펌프(NE-400, New Era Pump Systems, NY, USA)를 사용하여 에탄올 및 물 피딩 용액의 흐름 조건을 조절했다. 흐름 조건과 유속 비율은 각각 0.05 ml/min과 3로 고정하였다. 혼합하여 얻어진 에멀젼을 둥근 바닥 50 ml 유리 플라스크에 수집하였다. 수집된 에멀젼 용액(총 지질 농도: 3.75 mM)을 약 15분 동안 P= 75 mbar 및 T = 57 ℃에서 작동하는 회전식 증발기(RV 10, IKA, NC, USA)로 옮겼다. 용매를 휘발시킴으로써 0.15 M 100 ul 최종 용액이 얻어졌으며, 용액은 투명에서 백색 불투명으로 색상 변화를 나타내었지만 거시적 침전물은 없었다. 생성된 지질 나노입자 용액을 필요에 따라 원심분리 필터(Nanosep 100K MWCO, Sigma Aldrich, MO, USA)로 여과하여 미반응 물질을 제거하였다.Next, 3 mL of water feeding solution and 1 mL of ethanol feeding solution were injected into the inlet of the microfluidic device with a staggered herringbone mixer (SHM) to monodispersely mix the lipids. Specifically, a syringe pump (NE-400, New Era Pump Systems, NY, USA) was used to control the flow conditions of the ethanol and water feeding solutions. The flow conditions and flow rate ratio were fixed at 0.05 ml/min and 3, respectively. The emulsion obtained by mixing was collected in a 50 mL round-bottomed glass flask. The collected emulsion solution (total lipid concentration: 3.75 mM) was transferred to a rotary evaporator (
도 4의 SAXS 및cryo-TEM 결과로부터 지질 이중층 형성을 확인함으로써 리포좀이 잘 제조되었음을 확인할 수 있었다.From the SAXS and cryo-TEM results in Fig. 4, it was confirmed that the liposomes were well prepared by confirming the formation of a lipid bilayer.
본 발명에 따른 바이오 컨쥬게이션에 대한 모식도를 도 1(b)에 나타내었다. 수용체를 바이오컨쥬게이션하는 경우, DOPC 1 mol%를 Maleimide-PEG-PE 1 mol%로 치환하여 같은 방법으로 제조하여 Maleimide 작용기가 돌출된 최종 산물 (0.15M 100 ul)을 제조한다. 그와 동시에 수용체를 10mM Tris(2-corboxyethyl)phosphine hydrochloride 용액에 담지시켜 다이티올(dithiol) 결합을 분리시킨다. 그리고 다이티올 결합이 분리된 수용체 용액에 지질 나노입자용액을 섞어 상온에서 1시간 반응시킴으로써 수용체가 바이오컨쥬게이션된 지질 나노입자 용액을 제조한 후, 반응하지 않은 산물들을 Float-a-lyzer 제품으로 희석하여 분리해 낸다.A schematic diagram of the bioconjugation according to the present invention is shown in Fig. 1(b). In the case of bioconjugating the receptor, 1 mol% of DOPC is replaced with 1 mol% of Maleimide-PEG-PE, and the same method is used to prepare the final product (0.15 M 100 ul) having a protruding Maleimide functional group. At the same time, the receptor is immersed in a 10 mM Tris(2-corboxyethyl)phosphine hydrochloride solution to separate the dithiol bond. Then, a lipid nanoparticle solution is mixed with the receptor solution from which the dithiol bond has been separated, and the resultant product is reacted at room temperature for 1 hour to prepare a lipid nanoparticle solution in which the receptor is bioconjugated. After that, the unreacted products are diluted with a Float-a-lyzer product and separated.
2-2: Cas13a 단백질과 리포터 RNA가 담지된 리포좀 제조2-2: Preparation of liposomes loaded with Cas13a protein and reporter RNA
실시예 2-1의 리포좀 제조 과정에서, 물 피딩 용액에Leptotrichia buccalis(Lbu) Cas13a 단백질-가이드 RNA 복합체와 리포터 RNA를 각각 0.025 중량% 및 0.055중량%를 더 추가하여, 검출물질이 담지된 리포좀을 제조하였다.In the liposome manufacturing process of Example 2-1, 0.025 wt% and 0.055 wt% ofLeptotrichia buccalis (Lbu) Cas13a protein-guide RNA complex and reporter RNA, respectively, were further added to the water feeding solution to manufacture liposomes loaded with a detection substance.
도 5를 통해, RNA의경우 88~94 %의 포집 효율을 보이고, Cas13a 단백질-가이드RNA 복합체의 경우~75 %의 포집 효율 보임을 알 수 있다.Through Figure 5, it can be seen that the capture efficiency is 88-94% for RNA and ~75% for Cas13a protein-guide RNA complex.
2-3: LAMP 검출물이 담지된 리포좀 제조2-3: Preparation of liposomes loaded with LAMP detection agent
실시예 2-1의 리포좀 제조 과정에서, 물 피딩 용액에 SARS-CoV-2 Rapid Colorimetric LAMP Assay Kit 용액중 WarmStart Colorimetric LAMP 2X Master Mix with UDG 50 uL, SARS-CoV-2 LAMP Primer Mix (N/E) 10 uL, Guanidine Hydrochloride 10 uL를 더 추가하여, 검출물질이 담지된 리포좀을 제조하였다.In the liposome manufacturing process of Example 2-1, 50 uL of WarmStart Colorimetric LAMP 2X Master Mix with UDG, 10 uL of SARS-CoV-2 Rapid Colorimetric LAMP Assay Kit solution, 10 uL of SARS-CoV-2 LAMP Primer Mix (N/E), and 10 uL of Guanidine Hydrochloride were further added to the water feeding solution to manufacture liposomes loaded with a detection substance.
2-4: Cas12a 단백질과 리포터 DNA가 담지된 리포좀 제조2-4: Preparation of liposomes loaded with Cas12a protein and reporter DNA
실시예 2-1의 리포좀 제조 과정에서, 물 피딩 용액에Lachnospiraceae bacterium Cas12a 단백질-가이드 RNA 복합체와 리포터 DNA를 각각 0.026 중량% 및 0.05중량% 더 추가하여, 검출 물질이 담지된 리포좀을 제조하였다.In the liposome manufacturing process of Example 2-1, 0.026 wt% and 0.05 wt% ofLachnospiraceae bacterium Cas12a protein-guide RNA complex and reporter DNA, respectively, were further added to the water feeding solution to manufacture liposomes loaded with a detection substance.
2-5: 형광물질이 연결된 핵산 프로브가 담지된 리포좀 제조2-5: Preparation of liposomes loaded with fluorescently linked nucleic acid probes
실시예 2-1의 리포좀 제조 과정에서, 물 피딩 용액에 형광물질이 연결된 핵산 프로브1 및 형광물질이 연결된 핵산 프로브2를 각각 0.28 중량% 및 0.296 중량% 더 추가하여, 검출 물질이 담지된 리포좀을 제조하였다.In the liposome manufacturing process of Example 2-1, 0.28 wt% and 0.296 wt% of fluorescent substance-linked
<실시예 3> 리포좀 특성 확인<Example 3> Confirmation of liposome characteristics
도 6은 타겟 핵산 검출용 검출물질의 담지 및 표면 개질에 따른 리포좀 크기 변화 및 표면 제타 전위 변화를 나타낸 그래프이다. 검출물질 담지 및 표면 개질에 따른 리포좀 입자 크기 증가를 볼 수 있고 양이온성 지질 분자를 사용하여 ACE2 도입 후에도 높은 제타 전위값을 보임을 알 수 있다.Figure 6 is a graph showing changes in liposome size and surface zeta potential according to loading of a detection substance for target nucleic acid detection and surface modification. It can be seen that the liposome particle size increases according to loading of a detection substance and surface modification, and that a high zeta potential value is shown even after introduction of ACE2 using cationic lipid molecules.
<실시예 4> 리포좀과 코로나 바이러스의 막 융합 특성 확인<Example 4> Confirmation of membrane fusion characteristics of liposomes and coronavirus
도 7은 실시예 2-1의 지질 혼합물에, DOPC 40 mol% 기준, NBD-PE를 DOPC의 0.625 mol%, Liss Rhod-PE를 DOPC의 0.625 mol% 첨가하여 리포좀을 준비하였다. 리포좀만 있을 때는 리포좀 표면에 형광체 쌍 (형광 주개 NBD 및 형광 받개 Liss Rhod)의 거리가 가까이 존재해서 FRET이 일어나 형광 주개/형광 받개의 형광 세기 비율이 0.2 수준으로 낮았다. 그 다음 준비한 리포좀과 30.73 pM의 SARS-CoV-2 바이러스의 막 융합 관찰 결과, 막 융합 시 형광체 쌍의 거리가 멀어지면서 형광 주개/형광 받개의 형광 세기 비율이 증가하는 것을 관찰함으로써 막 융합이 일어난 것을 확인한 결과이다. 또한, 리포좀을 lysis buffer (50 mM Tris(hydroxymethyl)-aminomethane (TRIS), 0.05% sodium azide)에 섞어서 리포좀을 완전히 분해해서도 형광 주개/형광 받개의 형광 세기 비율을 확인했으며, 이와 막융합 결과를 비교해서 막융합이 효율적으로 일어났음을 보여주었다. 상기 분석은 리포좀 및 바이러스 혼합액을 384-웰 플레이트에 로딩하고 460 nm에서 여기(excitation)하는 형광 마이크로 플레이트 리더기 (SpectraMax M2, Molecular Devices, CA, USA)를 사용하여 형광 변화를 측정하였다.Figure 7 shows that liposomes were prepared by adding NBD-PE in an amount of 0.625 mol% of DOPC and Liss Rhod-PE in an amount of 0.625 mol% of DOPC to the lipid mixture of Example 2-1 (40 mol% of DOPC). When there is only liposome, the distance between the fluorophore pair (fluorescent donor NBD and fluorescence acceptor Liss Rhod) on the liposome surface is close, so FRET occurs and the fluorescence intensity ratio of the fluorescence donor/fluorescence acceptor is low at the level of 0.2. Next, as a result of observing the membrane fusion of the prepared liposome and the 30.73 pM SARS-CoV-2 virus, it was confirmed that membrane fusion occurred by observing that as the distance between the fluorophore pair increased during membrane fusion, the fluorescence intensity ratio of the fluorescence donor/fluorescence acceptor increased. In addition, the fluorescence intensity ratio of the fluorescent donor/fluorescent acceptor was confirmed by completely disintegrating the liposomes by mixing them in lysis buffer (50 mM Tris(hydroxymethyl)-aminomethane (TRIS), 0.05% sodium azide), and comparing it with the membrane fusion results, it was shown that the membrane fusion occurred efficiently. For the analysis, the liposome and virus mixture was loaded into a 384-well plate, and the fluorescence change was measured using a fluorescence microplate reader (SpectraMax M2, Molecular Devices, CA, USA) that excites at 460 nm.
도 8은 투과 전자현미경으로 실시예 2-2에 따른 리포좀과 SARS-CoV-2 바이러스의 막 융합 관찰 결과, 막 융합에 앞서 SARS-CoV-2 바이러스와 리포좀이 부착되는 것부터 융합 후 입자 크기가 증가하는 것을 관찰함으로써 막 융합이 일어난 것을 확인한 결과이다.Figure 8 shows the results of observing membrane fusion between liposomes and SARS-CoV-2 virus according to Example 2-2 using a transmission electron microscope, confirming that membrane fusion occurred by observing that the SARS-CoV-2 virus and liposomes were attached before membrane fusion and that the particle size increased after fusion.
<실시예 5> 리포좀의 검출 특성 확인<Example 5> Confirmation of detection characteristics of liposomes
도 9(a)는 실시예 2-2의 리포좀에 담지된 검출물질 중 CRISPR Cas13a의 분석 민감도 결과이다. 먼저, 2 M Lbu Cas13a와 2 M crRNA를 섞고 상온에서 30분동안 반응시킴으로써 Lbu Cas13a-crRNA 복합체를 준비했다. 그 다음 다양한 농도의 SARS-CoV-2 RNA와 400 nM의 리포터 RNA가 포함된 분해 버퍼(cleavage buffer) (20mM HEPES, 50mM KCl, 5mM MgCl2, 5% glycerol, and 1 U/mL Murine RNase Inhibitor)에서 Lbu Cas13a-crRNA를 100 nM로 희석하였다. 해당 용액은 384-웰 플레이트에 20 uL 로딩하고 485 nm에서 여기하는 마이크로 플레이트 리더기 (SpectraMax M2, Molecular Devices, CA, USA)를 사용하여 520 nm에서의 형광 세기 값을 얻었다. 결과적으로 SARS-CoV-2 RNA에 대해 변이에 상관없이10 fM 수준의 민감도를 보임을 알 수 있다.Figure 9(a) shows the analysis sensitivity results of CRISPR Cas13a among the detection substances loaded on the liposomes of Example 2-2. First, 2 M Lbu Cas13a and 2 M crRNA were mixed and reacted at room temperature for 30 minutes to prepare the Lbu Cas13a-crRNA complex. Then, Lbu Cas13a-crRNA was diluted to 100 nM in cleavage buffer (20 mM HEPES, 50 mM KCl, 5 mM MgCl2, 5% glycerol, and 1 U/mL Murine RNase Inhibitor) containing various concentrations of SARS-CoV-2 RNA and 400 nM reporter RNA. The solution was loaded at 20 μL in a 384-well plate and the fluorescence intensity value at 520 nm was obtained using a microplate reader (SpectraMax M2, Molecular Devices, CA, USA) excited at 485 nm. As a result, regardless of mutation, it was confirmed that SARS-CoV-2 RNA It can be seen that it exhibits a sensitivity of 10 fM level.
도 9(b)는 실시예 2-2의 리포좀에 담지된 검출물질 중 CRISPR Cas13a의 분석 특이도 결과이다. 도 9(a)와 동일한 실험 조건으로 수행하되, 다양한 농도의 SARS-CoV-2 RNA 대신 100 fM의 SARS-CoV-2 RNA 혹은 100 fM의 miR-21 혹은 100 fM의 H1N1 RNA를 포함하여 분석하였다. 결과적으로 SARS-CoV-2 RNA에 대해서만 검출 신호를 보였다.Fig. 9(b) is the result of the analysis specificity of CRISPR Cas13a among the detection materials loaded on the liposomes of Example 2-2. The same experimental conditions as Fig. 9(a) were performed, but instead of various concentrations of SARS-CoV-2 RNA, 100 fM of SARS-CoV-2 RNA, 100 fM of miR-21, or 100 fM of H1N1 RNA were included for analysis. As a result, a detection signal was observed only for SARS-CoV-2 RNA.
도 10(a)는 실시예 2-2에 따른 리포좀의 SARS-CoV-2 바이러스에 대한 분석적 민감도를 나타낸 결과로, 2분만의 검출 시간만으로도 2 aM의 바이러스까지도 검출할 수 있음을 알 수 있고, 도 10(b)는 실시예 2-2에 따른 리포좀의 분석적 특이도를 보여준다. 1.3 pM의 엑소좀과 1107 TCID50/mL (~16.61 pM)의 H1N1과 비교하여 3.8 pM의 SARS-CoV-2 바이러스만 검출 신호를 보였다. 상기 분석 시 384-웰 플레이트에 리포좀 용액 10 uL와 SARS-CoV-2 바이러스 음성 시료 10 uL 혼합액 혹은 리포좀 용액 10 uL와 SARS-CoV-2 바이러스 양성 시료 10 uL 혼합액을 로딩하고 485 nm에서 여기하는 마이크로 플레이트 리더기 (SpectraMax M2, Molecular Devices, CA, USA)를 사용하여 520 nm에서의 형광 세기 값을 30초 간격으로 얻었다.Figure 10(a) shows the analytical sensitivity of liposomes according to Example 2-2 to the SARS-CoV-2 virus, showing that even a virus of 2 aM can be detected with a detection time of only 2 minutes, and Figure 10(b) shows the analytical specificity of liposomes according to Example 2-2. 1.3 pM exosomes and 1 Compared to H1N1 at 107 TCID50 /mL (~16.61 pM), only 3.8 pM SARS-CoV-2 virus showed a detectable signal. In the above assay, a mixture of 10 uL liposome solution and 10 uL SARS-CoV-2 virus-negative sample or a mixture of 10 uL liposome solution and 10 uL SARS-CoV-2 virus-positive sample was loaded into a 384-well plate, and the fluorescence intensity values at 520 nm were obtained at 30-second intervals using a microplate reader (SpectraMax M2, Molecular Devices, CA, USA) exciting at 485 nm.
도 11은 실시예 2-2에 따른 리포좀 표면에 ACE2가 존재하지 않을 때에도, 양이온성 지질에 의한 전기적 인력만으로도 SARS-CoV-2 바이러스와 막융합이 일어남을 보여주고, ACE2를 리포좀 표면에 도입시 검출 신호가 더 증가함을 보여준다. 상기 분석 시 384-웰플레이트에 리포좀 용액 10 uL와 30.4 pM의 불활화 SARS-CoV-2 바이러스 10 uL 혼합액을 로딩하고 485 nm에서 여기하는 마이크로 플레이트 리더기 (SpectraMax M2, Molecular Devices, CA, USA)를 사용하여 520 nm에서의 형광 세기 값을 얻었다.Figure 11 shows that even when ACE2 is not present on the liposome surface according to Example 2-2, membrane fusion with the SARS-CoV-2 virus occurs only by the electrical attraction due to cationic lipids, and that the detection signal further increases when ACE2 is introduced to the liposome surface. In the above analysis, a mixture of 10 uL of liposome solution and 10 uL of 30.4 pM inactivated SARS-CoV-2 virus was loaded into a 384-well plate, and the fluorescence intensity value at 520 nm was obtained using a microplate reader (SpectraMax M2, Molecular Devices, CA, USA) excited at 485 nm.
도 12는 실시예 2-2에 따른 리포좀이 야생형 SARS-CoV-2 바이러스와 XBB.1.5 변이 SARS-CoV-2 바이러스에 대해 비슷한 검출 신호를 보여줌으로써 변이에 상관 없이 검출이 가능함을 보여준다.Figure 12 shows that liposomes according to Example 2-2 exhibit similar detection signals for wild-type SARS-CoV-2 virus and XBB.1.5 mutant SARS-CoV-2 virus, demonstrating that detection is possible regardless of mutation.
도 13는 실시예 2-3에 따른 리포좀이 SARS-CoV-2 바이러스와 막융합을 통해 육안으로 구분 가능한 색변화가 나타남을 보여준다. 상기 분석 시 PCR 튜브에 리포좀 용액 10 uL와 SARS-CoV-2 바이러스 음성 시료 10 uL 혼합액 혹은 리포좀 용액 10 uL와 150 fM의 SARS-CoV-2 바이러스 양성 시료 10 uL 혼합액을 로딩하고 65도에서 30분간 반응시켰다.Figure 13 shows that liposomes according to Example 2-3 exhibit a visually distinguishable color change through membrane fusion with the SARS-CoV-2 virus. In the above analysis, a PCR tube was loaded with a mixture of 10 uL of liposome solution and 10 uL of SARS-CoV-2 virus-negative sample or a mixture of 10 uL of liposome solution and 10 uL of 150 fM SARS-CoV-2 virus-positive sample, and the reaction was performed at 65 degrees for 30 minutes.
도 14(a)는 실시예 2-2에 따른 리포좀의 SARS-CoV-2 바이러스 검출이 마스크 표면 위에서도 가능함을 보여준다. SARS-CoV-2 바이러스가 묻은 마스크에 본 발명에 따른 리포좀 용액을 스프레이로 분사하면 마스크 위에 존재하는 SARS-CoV-2 바이러스와 막 융합하고, 이를 465 nm에서 여기하는 LED를 사용하여 초록색 형광을 얻었다. 도 14(b)는 10분만의 검출 시간만으로도 3 aM의 바이러스까지도 검출할 수 있음을 알 수 있다. 따라서 본 발명에 따른 막융합 기반 검출 방법을 이용하면, 별도의 샘플 채취 과정 없이 타겟 핵산을 검출할 수 있다.Fig. 14(a) shows that the detection of the SARS-CoV-2 virus by liposomes according to Example 2-2 is possible even on the surface of a mask. When the liposome solution according to the present invention is sprayed onto a mask contaminated with the SARS-CoV-2 virus, the liposome solution is membrane fused with the SARS-CoV-2 virus present on the mask, and green fluorescence is obtained using an LED that excites it at 465 nm. Fig. 14(b) shows that even a virus of 3 aM can be detected with only a detection time of 10 minutes. Therefore, by using the membrane fusion-based detection method according to the present invention, target nucleic acids can be detected without a separate sample collection process.
도 15는 실시예 2-2에 따른 리포좀의 SARS-CoV-2 바이러스 검출이 바이러스가 존재하는 다양한 표면 위에서도 가능함을 보여준다. 여기서 다양한 표면으로는 목재 책상 표면, 스테인리스 스틸 표면, 세라믹 유리 표면을 준비하였다. 리포좀 용액을 스프레이로 분사하면 책상 위에 존재하는 SARS-CoV-2 바이러스와 막 융합하고, 이를 465 nm에서 여기하는 LED를 사용하여 초록색 형광을 얻었다. 결과적으로 모든 표면에서 10분만의 검출 시간만으로도 3 aM의 바이러스까지도 검출할 수 있음을 알 수 있다.Figure 15 shows that the detection of SARS-CoV-2 virus by liposomes according to Example 2-2 is possible on various surfaces where the virus exists. Here, various surfaces were prepared, including a wooden desk surface, a stainless steel surface, and a ceramic glass surface. When the liposome solution was sprayed, it fused with the SARS-CoV-2 virus present on the desk, and green fluorescence was obtained using an LED that excites it at 465 nm. As a result, it was found that up to 3 aM viruses could be detected with only a detection time of 10 minutes on all surfaces.
도 16(a)는 실시예 2-2의 리포좀에 담지하는 검출물질 중 Lbu Cas13a-crRNA 복합체 제조 시 표 1의 crRNA 대신 표 2의 crRNA를 사용하면 검출물질이 influenza A (H1N1) RNA에 대해서도 검출이 가능함을 보여준다.Figure 16(a) shows that when the crRNA of Table 2 is used instead of the crRNA of Table 1 when preparing the Lbu Cas13a-crRNA complex among the detection substances loaded on the liposome of Example 2-2, the detection substance can also detect influenza A (H1N1) RNA.
도 16(b)는 실시예 2-2에 따른 리포좀 제조 시 표 1의 crRNA 대신 표 2의 crRNA4, crRNA5를 사용 시 리포좀이 influenza A (H1N1) 바이러스에 대해서도 검출이 가능함을 보여준다. 2분만의 검출 시간만으로도 7.9102 TCID50/mL 수준의 바이러스까지도 검출할 수 있음을 알 수 있다.Figure 16(b) shows that when crRNA4 and crRNA5 of Table 2 are used instead of crRNA of Table 1 in the liposome manufacturing according to Example 2-2, liposomes can detect influenza A (H1N1) virus. With a detection time of only 2 minutes, 7.9 It can be seen that viruses at levels of 102 TCID50 /mL can be detected.
도 16(c)는 실시예 2-2에 따른 리포좀 제조 시 표 1의 crRNA를 사용 시 리포좀이 influenza A (H1N1) 바이러스에 대해서 검출이 불가능함을 보여주며, 본 검출 반응이 표적 핵산 특이적 반응임을 보여준다.Figure 16(c) shows that when the crRNA of Table 1 is used in the liposome manufacturing according to Example 2-2, the liposome cannot be detected for the influenza A (H1N1) virus, demonstrating that this detection reaction is a target nucleic acid specific reaction.
도 17는 실시예 2-2에 따라 제조한 리포좀을 빛을 차단한채로 4oC 냉장고에 보관했을 때 보관기간 6개월까지 입자 크기가 계속 증가하여 약간의 입자간 뭉침 현상이 있었음을 보여주나, 750 fM의 SARS-CoV-2 바이러스에 대해서 동일한 검출 결과를 보여 검출 성능은 유지됨을 보여준다.Figure 17 shows that when liposomes manufactured according to Example 2-2 were stored in a 4o C refrigerator while blocking light, the particle size continued to increase for up to 6 months of storage, with some particle agglomeration occurring; however, the same detection results were observed for the 750 fM SARS-CoV-2 virus, demonstrating that the detection performance was maintained.
도 18는 실시예 2-2에 따라 제조한 리포좀이 100 νg/mL의 RNase A 존재 하에서 형광 변화가 없음을 보여 높은 RNase 안정성을 보여준다. 반면, 리포터 RNA는 RNase A에 의해 분해되서 형광이 나타난다.Figure 18 shows that liposomes manufactured according to Example 2-2 exhibit high RNase stability by showing no fluorescence change in the presence of 100 νg/mL of RNase A. In contrast, reporter RNA is degraded by RNase A, resulting in fluorescence.
도 19은 실시예 2-2에 따른 리포좀 용액과 2 aM의 SARS-CoV-2 바이러스 시료를 물리적 혼합하지 않고 SARS-CoV-2 바이러스 시료에 리포좀 용액을 첨가만 해도 동일하게 검출이 되는 것을 보여준다. 여기서 물리적 혼합으로는 파이펫팅(pipetting) 방법을 사용했다.Figure 19 shows that the same detection is achieved by simply adding the liposome solution to the SARS-CoV-2 virus sample without physically mixing the liposome solution according to Example 2-2 with the 2 aM SARS-CoV-2 virus sample. Here, the pipetting method was used for physical mixing.
도 20은 실시예 2-2에 따른 리포좀 용액이 비인두 도말과 타액에 존재하는 SARS-CoV-2 바이러스에 대해서도 검출이 되는 것을 보여준다. 2 분만의 검출 시간만으로도 타액 내 SARS-CoV-2 바이러스를 2 aM까지 검출할 수 있음을 알 수 있다.Figure 20 shows that the liposome solution according to Example 2-2 can detect SARS-CoV-2 virus present in nasopharyngeal swab and saliva. It can be seen that SARS-CoV-2 virus in saliva can be detected up to 2 aM with a detection time of only 2 minutes.
도 21(a)는 실시예 2-2의 리포좀에 담지하는 검출물질 중 Lbu Cas13a-crRNA 복합체 제조 시 표 1의 crRNA 대신 표 3의 crRNA를 사용하면 검출물질이 RSV(Respiratory Syncytial Virus) RNA에 대해서도 검출이 가능함을 보여준다.Figure 21(a) shows that when the crRNA of Table 3 is used instead of the crRNA of Table 1 when preparing the Lbu Cas13a-crRNA complex among the detection substances loaded on the liposome of Example 2-2, the detection substance can also detect RSV (Respiratory Syncytial Virus) RNA.
도 21(b)는 실시예 2-2에 따른 리포좀 제조 시 표 1의 crRNA 대신 표 3의 crRNA를 사용 시 리포좀이 RSV 바이러스에 대해서도 검출이 가능함을 보여준다. 2분만의 검출 시간만으로도 1.25104 TCID50/mL 수준의 바이러스까지도 검출할 수 있음을 알 수 있다.Figure 21(b) shows that liposomes can detect RSV virus when crRNA of Table 3 is used instead of crRNA of Table 1 in liposome preparation according to Example 2-2. With a detection time of only 2 minutes, 1.25 It can be seen that viruses at levels of 104 TCID50 /mL can be detected.
도 22(a)는 실시예 2-2의 리포좀에 담지하는 검출물질 중 Lbu Cas13a-crRNA의 복합체 제조 시 표 1의 crRNA 대신 표 4의 crRNA를 사용하면 검출물질이 miRNA-21에 대해서도 검출이 가능함을 보여준다.Figure 22(a) shows that when preparing a complex of Lbu Cas13a-crRNA among the detection substances loaded on liposomes in Example 2-2, when using crRNA of Table 4 instead of crRNA of Table 1, the detection substance can also detect miRNA-21.
도 22(b)는 실시예 2-2에 따른 리포좀 제조 시 표 1의 crRNA 대신 표 4의 crRNA를 사용 시 엑소좀에 대해서도 검출이 가능함을 보여준다. 2분만의 검출 시간만으로도 리포좀이 1.3 pM의 엑소좀을 검출할 수 있음을 알 수 있다.Figure 22(b) shows that detection of exosomes is possible when crRNA of Table 4 is used instead of crRNA of Table 1 when manufacturing liposomes according to Example 2-2. It can be seen that liposomes can detect 1.3 pM exosomes with a detection time of only 2 minutes.
도 23(a)는 실시예 2-4의 리포좀에 담지하는 검출물질 중 Lb Cas12a-crRNA 복합체 제조 시 표 5의 crRNA를 사용하면 검출물질이 HSV(Herpes Simplex virus) DNA에 대해서도 검출이 가능함을 보여준다. 먼저, 200 nM Lb Cas12a와 250 nM의 crRNA7을 섞고 상온에서 30분동안 반응시킴으로써 Lb Cas12a-crRNA 복합체를 준비했다. 그 다음 12 pM의 분리된 HSV DNA와 750 nM의 리포터 DNA가 포함된 1X NEB 버퍼에서 Lb Cas12a-crRNA를 100 nM로 희석하였다. 해당 용액은 384-웰 플레이트에 20 uL 로딩하고 485 nm에서 여기하는 마이크로 플레이트 리더기 (SpectraMax M2, Molecular Devices, CA, USA)를 사용하여 520 nm에서의 형광 세기 값을 얻었다. 이 때 마이크로 플레이트 리더기 내부 온도는 37oC로 유지하였다.FIG. 23(a) shows that when the crRNA of Table 5 is used in the preparation of the Lb Cas12a-crRNA complex among the detection substances loaded on the liposome of Example 2-4, the detection substance can also detect HSV (Herpes Simplex virus) DNA. First, 200 nM Lb Cas12a and 250 nM crRNA7 were mixed and reacted at room temperature for 30 minutes to prepare the Lb Cas12a-crRNA complex. Then, Lb Cas12a-crRNA was diluted to 100 nM in 1X NEB buffer containing 12 pM of isolated HSV DNA and 750 nM of reporter DNA. 20 uL of the solution was loaded into a 384-well plate, and the fluorescence intensity value at 520 nm was obtained using a microplate reader (SpectraMax M2, Molecular Devices, CA, USA) that excites at 485 nm. At this time, the internal temperature of the microplate reader was maintained at 37o C.
도 23(b)는 실시예 2-4에 따른 리포좀 제조 시 표 4의 crRNA를 사용하면 리포좀이 HSV 바이러스에 대해서도 검출이 가능함을 보여준다. 10분만의 검출 시간만으로도 7900 TCID50/mL 수준의 바이러스까지도 검출할 수 있음을 알 수 있다.Figure 23(b) shows that when the crRNA of Table 4 is used in the liposome preparation according to Example 2-4, the liposome can detect the HSV virus. It can be seen that even a virus at the level of 7900 TCID50 /mL can be detected with a detection time of only 10 minutes.
도 24(a)는 실시예 2-5의 리포좀에 담지하는 형광물질이 연결된 핵산 프로브가 SARS-CoV-2 RNA에 대해서 검출이 가능함을 보여준다. 먼저, 형광물질이 연결된 핵산 프로브1과 형광물질이 연결된 핵산 프로브2를 1X PBS 버퍼에서 1 νM로 희석하고 95oC에서 5분동안 가열하고 4oC로 냉각시킴으로써 헤어핀 모양으로 2차 구조를 형성시켰다. 그 다음 1.55 nM의 isolated SARS-CoV-2 RNA가 포함된 1X PBS 버퍼에서 형광물질이 연결된 핵산 프로브1과 형광물질이 연결된 핵산 프로브2를 500 nM로 희석하였다. 해당 용액은 384-웰 플레이트에 20 uL 로딩하고 485 nm에서 여기하는 마이크로 플레이트 리더기 (SpectraMax M2, Molecular Devices, CA, USA)를 사용하여 520 nm에서의 형광 세기 값을 얻었다. 이 때 마이크로 플레이트 리더기 내부 온도는 37oC로 유지하였다.Figure 24(a) shows that the fluorescence-linked nucleic acid probe loaded on the liposome of Example 2-5 can detect SARS-CoV-2 RNA. First, the fluorescence-linked
도 24(b)는 실시예 2-5에 따른 리포좀이 SARS-CoV-2 바이러스를 검출 가능함을 보여준다. 10분만의 검출 시간만으로도 1.3107 TCID50/mL 수준의 바이러스까지도 검출할 수 있음을 알 수 있다.Figure 24(b) shows that liposomes according to Example 2-5 can detect SARS-CoV-2 virus. With a detection time of only 10 minutes, 1.3 It can be seen that viruses at levels as low as 107 TCID50 /mL can be detected.
이상 살펴본 바와 같이, 본 발명에 따른 타겟 핵산 검출물질이 담지된 지질 나노입자는 지질 이중층과 막융합이 가능하므로, 지질 이중충으로 구성된 세포, 엑소좀, 바이러스 등의 내부 핵산 검출에 이용될 수 있다. 또한 본 발명에 따른 타겟 핵산 검출물질이 담지된 리피드 나노입자는, 야생형이나 돌연변이 구분없이 검출이 가능하고, 별도의 전처리나 증폭 과정이 필요 없으므로 현장형 진단 키트로 이용할 수 있다. 또한, 별도의 샘플 수집 과정 없이 마스크 및/또는 다양한 물체 표면에 존재하는 바이러스를 검출할 수 있다.As described above, the lipid nanoparticle loaded with the target nucleic acid detection substance according to the present invention can undergo membrane fusion with a lipid bilayer, and thus can be used to detect internal nucleic acids of cells, exosomes, viruses, etc., which are composed of lipid bilayers. In addition, the lipid nanoparticle loaded with the target nucleic acid detection substance according to the present invention can be used as a field diagnostic kit since it can detect wild type or mutant without distinction and does not require a separate preprocessing or amplification process. In addition, it can detect viruses existing on the surfaces of masks and/or various objects without a separate sample collection process.
이상으로 본 발명 내용의 특정한 부분을 상세히 기술하였는 바, 이 기술분야의 통상의 지식을 가진 자에게 있어서, 이러한 구체적 기술은 단지 바람직한 실시 양태일 뿐이며, 이에 의해 본 발명의 범위가 제한되는 것이 아닌 점은 명백할 것이다. 따라서 본 발명의 실질적인 범위는 첨부된 청구항들과 그것들의 등가물에 의하여 정의된다고 할 것이다.As described above, specific parts of the present invention have been described in detail. It will be obvious to those skilled in the art that such specific descriptions are merely preferred embodiments and that the scope of the present invention is not limited thereby. Accordingly, the actual scope of the present invention will be defined by the appended claims and their equivalents.
본 발명에 따른 지질 나노입자는 막융합 기반의 타겟 핵산 검출에 이용할 수 있다. 본 발명에 따른 막융합 기반 타겟 핵산 검출 방법은 타겟 핵산에 대한 전처리 및 핵산 증폭 과정이 필요 없고 상온에서 이루어지고, 신속하게 검사 결과를 확인할 수 있다.The lipid nanoparticle according to the present invention can be used for membrane fusion-based target nucleic acid detection. The membrane fusion-based target nucleic acid detection method according to the present invention does not require pretreatment or nucleic acid amplification processes for the target nucleic acid, is performed at room temperature, and allows rapid confirmation of test results.
Claims (27)
Translated fromKoreanApplications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20230133541 | 2023-10-06 | ||
| KR10-2023-0133541 | 2023-10-06 | ||
| KR10-2024-0129248 | 2024-09-24 | ||
| KR1020240129248AKR20250051570A (en) | 2023-10-06 | 2024-09-24 | A lipid nanoparticle loaded with target nucleic acid detection materials and target nucleic acid detection method based on membrane fusion using the same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2025075396A1true WO2025075396A1 (en) | 2025-04-10 |
Family
ID=95283559
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/KR2024/014992PendingWO2025075396A1 (en) | 2023-10-06 | 2024-10-02 | Lipid nanoparticles carrying material for detecting target nucleic acids, and membrane fusion-based method for detecting target nucleic acids by using same |
Country Status (1)
| Country | Link |
|---|---|
| WO (1) | WO2025075396A1 (en) |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210053898A (en)* | 2018-07-31 | 2021-05-12 | 더 브로드 인스티튜트, 인코퍼레이티드 | New CRISPR enzyme and system |
| US20220378700A1 (en)* | 2019-10-18 | 2022-12-01 | The Trustees Of The University Of Pennsylvania | Lipid Nanoparticles and Formulations Thereof for CAR mRNA Delivery |
| WO2023031394A1 (en)* | 2021-09-03 | 2023-03-09 | CureVac SE | Novel lipid nanoparticles for delivery of nucleic acids |
| WO2023056418A1 (en)* | 2021-10-01 | 2023-04-06 | The Trustees Of The University Of Pennsylvania | Lipid nanoparticle (lnp) compositions and methods of use thereof |
| US20230293429A1 (en)* | 2021-03-22 | 2023-09-21 | Recode Therapeutics, Inc. | Compositions and methods for targeted delivery to cells |
- 2024
- 2024-10-02WOPCT/KR2024/014992patent/WO2025075396A1/enactivePending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210053898A (en)* | 2018-07-31 | 2021-05-12 | 더 브로드 인스티튜트, 인코퍼레이티드 | New CRISPR enzyme and system |
| US20220378700A1 (en)* | 2019-10-18 | 2022-12-01 | The Trustees Of The University Of Pennsylvania | Lipid Nanoparticles and Formulations Thereof for CAR mRNA Delivery |
| US20230293429A1 (en)* | 2021-03-22 | 2023-09-21 | Recode Therapeutics, Inc. | Compositions and methods for targeted delivery to cells |
| WO2023031394A1 (en)* | 2021-09-03 | 2023-03-09 | CureVac SE | Novel lipid nanoparticles for delivery of nucleic acids |
| WO2023056418A1 (en)* | 2021-10-01 | 2023-04-06 | The Trustees Of The University Of Pennsylvania | Lipid nanoparticle (lnp) compositions and methods of use thereof |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2022139528A1 (en) | Lipid nanoparticles comprising mannose or uses thereof | |
| WO2021145595A1 (en) | Lipid nanoparticles for in-vivo drug delivery, and uses thereof | |
| WO2011142515A1 (en) | Asymmetric liposomes for the highly efficient encapsulation of nucleic acids and hydrophilic anionic compounds, and method for preparing same | |
| WO2011002239A9 (en) | Microvesicles derived from nucleated, mammalian cells and use thereof | |
| WO2019156365A1 (en) | Peptide nucleic acid complex having endosomal escape capacity, and use thereof | |
| Bigley et al. | Human cytomegalovirus pUL97 regulates the viral major immediate early promoter by phosphorylation-mediated disruption of histone deacetylase 1 binding | |
| SK99299A3 (en) | Peptide-lipid conjugates, liposomes and liposomal drug delivery | |
| WO2018110980A1 (en) | Pharmaceutical composition for preventing or treating hepatitis b | |
| WO2019117632A1 (en) | Recombinant adenoviruses and stem cells comprising same | |
| WO2025075396A1 (en) | Lipid nanoparticles carrying material for detecting target nucleic acids, and membrane fusion-based method for detecting target nucleic acids by using same | |
| Singh et al. | The spike protein of SARS-CoV-2 induces heme oxygenase-1: Pathophysiologic implications | |
| WO2023136689A1 (en) | Ionizable lipid containing biodegradable ester bond and lipid nanoparticles comprising same | |
| WO2023158159A1 (en) | Nanodisc comprising angiotensin converting enzyme 2 | |
| Sukhorukov et al. | Mitochondrial genome editing: Exploring the possible relationship of the atherosclerosis-associated mutation m. 15059G> A with defective mitophagy | |
| WO2015002512A1 (en) | Dengue virus-specific sirna, double helix oligo-rna structure comprising sirna, and composition for suppressing proliferation of dengue virus comprising rna structure | |
| Klug et al. | Early and late HIV-1 membrane fusion events are impaired by sphinganine lipidated peptides that target the fusion site | |
| WO2023136688A1 (en) | Ionizable lipid containing biodegradable disulfide bond and lipid nanoparticles comprising same | |
| WO2019156541A1 (en) | Composition for increasing expression of blood coagulation factor gene, comprising core-shell structured microparticles as active ingredient | |
| WO2012173319A1 (en) | Composition containing bee venom phospholipase as active ingredient for treatment of prion disease | |
| WO2024096642A1 (en) | Dna aptamer for diagnosis or treatment of colorectal cancer | |
| WO2024177424A1 (en) | Novel ionizable lipid and lipid nanoparticle containing same | |
| WO2022250503A1 (en) | Pharmaceutical composition for preventing or treating coronavirus-19, comprising cas13 protein and crrna | |
| WO2024144009A1 (en) | Lipid nanoparticle formulation comprising ionized lipids with branched structure, and use thereof | |
| WO2016111568A1 (en) | Kit for detecting virus | |
| WO2023170187A1 (en) | INHIBITION OF INTRACELLULAR PATHOGEN UPTAKE BY INHIBITORS OF THE IKK-α/NIK COMPLEX |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | Ref document number:24874952 Country of ref document:EP Kind code of ref document:A1 |