WO2017014545A1 - Pharmaceutical composition for treating parkinson's disease and inhibiting side effects of levodopa, containing melanin concentrating hormone as active ingredient - Google Patents
Pharmaceutical composition for treating parkinson's disease and inhibiting side effects of levodopa, containing melanin concentrating hormone as active ingredientDownload PDFInfo
- Publication number
- WO2017014545A1 WO2017014545A1PCT/KR2016/007884KR2016007884WWO2017014545A1WO 2017014545 A1WO2017014545 A1WO 2017014545A1KR 2016007884 WKR2016007884 WKR 2016007884WWO 2017014545 A1WO2017014545 A1WO 2017014545A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- mch
- levodopa
- disease
- parkinson
- dopamine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
Definitions
- the present inventionrelates to a pharmaceutical composition for treating Parkinson's disease and inhibiting levodopa side effects and a health functional food comprising melanin concentrating hormone as an active ingredient.
- Parkinson's diseaseis characterized by neurodegeneration of dopaminergic neurons in the substantia nigra pars compacta (SNc), which gradually leads to depletion of dopamine in the striatum. Parkinson's disease breaks down the balance of the basal ganglia and impairs the function of motor neurons, causing rigidity, tremor, and ainesia. One to five percent of people over 50 are the second most common neurodegenerative diseases.
- Parkinson's diseaseThe ultimate cause of Parkinson's disease is unknown, but several symptoms appear to be due to a deficiency of dopamine, a neurotransmitter in the brain made from nerve cells in the substantia nigra area of the normal brain. .
- Dopamine produced by neurons distributed in the black matter of the brainis linked to the basal ganglia of the brain, including the corpus striatum.
- the basal gangliaare intricately linked to the motor cortex and many other areas of the brain, making it an important part of the body's movements, allowing them to perform smooth, harmonious and accurate movements.
- Dopamine deficiencywhich is free from the end of basal ganglia dopaminergic nerves caused by such dopaminergic nerve damage, is a major cause of motility disorders in Parkinson's disease.
- Parkinson's diseasenamely, the destruction of the neural cells of the black matter, but active research is being conducted to find out.
- Infection theorysuch as viral encephalitis, immune theory that immune mechanisms are involved, genetic theory that innately inherits its substrate, theory that free radicals destroy nerve cells, poisoning theory of neurotoxic substances, and dopamine production and metabolism
- Infection theorysuch as viral encephalitis, immune theory that immune mechanisms are involved, genetic theory that innately inherits its substrate, theory that free radicals destroy nerve cells, poisoning theory of neurotoxic substances, and dopamine production and metabolism
- the neurotoxin 6-hydroxydopamine (6-OHDA) or 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (1-methyl-4- phenyl-1,2,3,6-tetrahydropyridine, MPTP)are mainly used (Nat Rev Neurosci, 2001, 2 (5), 325-334). 6-OHDA is absorbed by the dopamine transporter (DAT) and produces free radicals. MPTP reduces dopamine neurons in humans and nonhuman primates, causes astrocytes and activates microglia in cerebrospinal densities rather than specifically targeting dopaminergic neurons associated with Parkinson's disease (Nat Med, 1999, 5). (12), 1403-1409), causing typical biochemical or pathological symptoms of Parkinson's disease (Neurosci, 2000, 16 (2), 135-142).
- L-dopa preparationsAs drugs for the treatment of Parkinson's disease, L-dopa preparations, dopamine receptor agonists, anticholinergic drugs, eldefril and the like are known.
- the use of the dopamine precursor, L-dopa(levodopa), is an absolute criterion for treating Parkinson's disease, as motor neurons function dramatically in the early stages of Parkinson's disease.
- levodopacauses side effects such as hallucination, insomnia, nausea and dyskinesia.
- levodopa-induced dyskinesiaLID is the most serious side effect in patients with Parkinson's disease who are chronically using levodopa.
- Anticholinergic drugsmay show autonomic nervous system abnormalities or mental function abnormalities, and thus they are limited to continuous administration to older patients.
- surgical treatmentsuch as high frequency nerve stimulation, that is, high frequency destruction or deep brain stimulation, is also performed, but there is a problem that requires invasive surgery and consumes a lot of money.
- MCHmelanin-concentrating hormone
- One object of the present inventionto provide a pharmaceutical composition for the treatment or prevention of Parkinson's disease comprising melanin concentrating hormone (melanin concentrating hormone) as an active ingredient.
- Another object of the present inventionto provide a health functional food for improving or preventing Parkinson's disease comprising melanin aggregation hormone as an active ingredient.
- Another object of the present inventionis to provide a pharmaceutical composition for treating or preventing Parkinson's disease, including MCH and levodopa.
- Another object of the present inventionto provide a pharmaceutical composition for inhibiting levodopa side effects, including melanin aggregation hormone and levodopa.
- MCHis applied to dopamine neurons.
- the present inventionwas completed by confirming that it has a protective effect and alleviates a motor disorder caused by levodopa.
- compositioncomprising the melanin aggregation hormone of the present invention as an active ingredient restores the loss of dopamine neurons, and thus has an excellent effect on the treatment and prevention of Parkinson's disease, and improves dyskinesia caused by levodopa, a treatment for Parkinson's disease. There is.
- FIG. 1is a diagram showing the change in the number of dopamine neurons after the treatment of MCH, MCH + anti-MCH to the brain brain dopamine neurons.
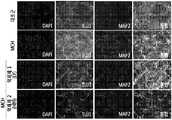
- Figure 2is a diagram showing the change in the number of dopamine neurons through the immunofluorescence staining of Tuj1 and MAP2 by treating MCH, MCH + anti-MCH to the brain brain dopamine neurons.
- Figure 3is a diagram showing the qRT-PCR results of the dopamine neuron marker genes of MAP2, DAT, TH, AADC after the treatment of MCH in the brain brain dopamine neurons.
- Figure 4shows the number of dopamine neurons different in the treatment of MCH by concentration in the midbrain dopamine neurons.
- 5is a diagram showing the expression level of the marker gene.
- Figure 6is a diagram showing the change in the number of dopamine neurons after MCH treatment to 6-hydroxy dopamine or MPP + -treated midbrain dopamine neurons.
- Figure 7shows the number of dopamine neurons through immunofluorescence staining for TH, MAP2 after MCH treatment of 6-hydroxydopamine or MPP + -treated midbrain dopamine neurons and untreated midbrain dopamine neurons.
- Figure 8is a diagram showing the expression level of the gene through qRT-PCR for TH, DAT and synapsin after MCH treatment in 6-hydroxy dopamine or MPP + -treated midbrain dopamine neurons.
- Figure 9is a diagram analyzing the overall gene expression after the treatment of MCH in the brain brain dopamine neurons.
- 10is a diagram showing the expression of pCREB, pGSK-3 ⁇ , pAkt, and pERK proteins through Western blot after treatment with MCH in mesenchymal dopamine neurons.
- 11is a diagram showing the results of measuring the phosphorylation level of pCREB, pGSK-3 ⁇ , pAkt and pERK using phosphate-specific antibodies after MCH treatment in midbrain dopamine neurons.
- FIG. 12is a diagram showing that neuroprotective effect is suppressed through immunofluorescence staining of Tuj1 and MAP2 after treatment with PI3K and PKA signaling specific inhibitors to MCH-treated midbrain dopamine neurons.
- 13is a diagram showing the results of FIG. 12 numerically.
- Figure 14after treatment with MCH in MPP + -induced midbrain dopamine neuron killing environment, after treatment with PI3K and PKA signaling inhibitors, the neuronal protective effect against neuronal cell death through immunofluorescence staining of Tuj1 and MAP2 Is a diagram showing suppression. 15 is a diagram showing the results of FIG. 14 numerically.
- FIG. 16is a diagram showing that apoptosis is inhibited by MCH treatment of 0, 50 and 100 nM MCH in 6-OHDA induced human neuroblastoma SY-SY5Y cells.
- FIG. 17is a diagram illustrating phosphorylation levels of Ikb- ⁇ and p38 through Western blot after treatment of 6-OHDA-induced human neuroblastoma SY-SY5Y cells with MCH.
- 18is a diagram showing the results of FIG. 17 numerically.
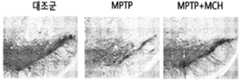
- 19is a diagram showing the change of TH-positive neurons in the black matter after MCH injection into the MPTP-treated mice.
- 20is a diagram showing the density change of TH-positive fibers in the striatum after MCH injection into the MPTP-treated mice.
- 21is a diagram showing that the motor function is improved after injecting MCH to the MPTP-treated mice.
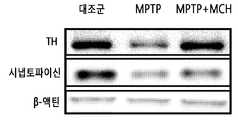
- FIG. 22is a diagram showing the expression of TH and synaptophysin proteins in black matter through Western blot after injection of MCH into mice treated with MPTP.
- FIG. 23is a diagram showing the results of FIG. 22 in TH and synaptophysin / ⁇ -actin (%).
- FIG. 24 and 25show the results of measuring the phosphorylation level of pAkt and pCREB through Western blot after injection of MCH into MPTP treated mice.
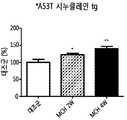
- Figure 26is a diagram showing the result of measuring the motor function through the rotarod test at 2 and 4 weeks after MCH injection into A53T alpha-synuclein transgenic mice.
- FIG. 27shows the results of measuring phosphorylation levels of pGKS-3 ⁇ and pAMPK through Western blot after MCH injection into A53T alpha-synuclein transgenic mice.
- FIG. 28is a diagram quantifying the results of FIG. 27.
- FIG. 29shows protein expression of synuclein, BDNF after MCH injection into A53T alpha-synuclein transgenic mice.
- FIG. 30is a diagram showing the results of FIG. 29 using synuclein and BDNF / ⁇ -actin.
- FIG. 31shows abnormal involuntary motility (AIM) at 1, 4 and 7 days after injection of levodopa and MCH at concentrations of 0.1 ⁇ g, 0.5 ⁇ g and 2.5 ⁇ g in 6-hydroxydopamine-induced Parkinson's disease model animals. The figure which shows the result of measuring.
- AIMabnormal involuntary motility
- the present inventionprovides a pharmaceutical composition for the treatment or prevention of Parkinson's disease comprising melanin concentrating hormone (melanin concentrating hormone) as an active ingredient.
- 'melanin aggregation hormone' used in the present inventionis a kind of neuropeptide, which is distributed in the central nervous system, and is known to be involved in dietary control and weight control of foods. It is known to have a function of softening and inhibiting melanin production. However, melanin aggregation hormone has a neuroprotective effect in the dopamine neurons, through which it has been identified for the first time through the Parkinson's disease treatment effect and dyskinesia induced effect from levodopa through the present invention.
- the amino acid sequence of the melanin aggregation hormone and the nucleotide sequence information of the gene encoding the sameare known to the NCBI (Genbank: NP_002665, NM_002674).
- the term 'Parkinson' disease used in the present inventionis caused by the progressive loss of dopamine neurons distributed in the substantia nigra of the brain, chronic progressive degenerative of the nervous system, which is characterized by stability, stiffness, locomotor movement and postural instability. Means disease.
- the term 'prevention'refers to any action of inhibiting or delaying Parkinson's disease by administration of a composition containing the melanin aggregation hormone as an active ingredient.
- treatmentrefers to any action in which the symptoms of the disease are improved or advantageously changed by administration of the composition containing the melanin aggregation hormone as an active ingredient.
- the treatment of Parkinson's diseasemay be due to neuronal cell protection, motor function or neuronal cell number increase.
- the neuronis a dopamine neuron, which may mean a neuron whose main neurotransmitter is dopamine, ventral tegmental area (VTA), substantia nigra pars compacta, hypothalamus arch of the middle brain It may be located in the nucleus (arcuate nucleus of the hypothalamus) or striatum.
- VTAventral tegmental area
- substantia nigra pars compactahypothalamus arch of the middle brain It may be located in the nucleus (arcuate nucleus of the hypothalamus) or striatum.
- the melanin aggregation hormone of the present inventionis treated to dopamine neurons, and then immunofluorescence staining is performed on neuron-related genes such as Tuj1 (class III beta-tubulin) and MAP2 (microtubule associated protein 2). It was confirmed that the number of dopamine neurons is increased, the number of dopamine neurons is effectively suppressed by the treatment of anti-melanin aggregation hormone (Fig. 1 to 2).
- Tuj1class III beta-tubulin
- MAP2microtubule associated protein 2
- melanin aggregation hormoneis MPP + or 6-OHDA It was confirmed to restore the death of neurons induced by (Figs. 6 to 8).
- composition of the present inventionmay be to suppress the side effects of levodopa which is a therapeutic agent for Parkinson's disease.
- levodopais the most widely used drug in the treatment of Parkinson's disease, and it is known that administered levodopa freely crosses the blood brain barrier to artificially promote dopamine secretion.
- side effects of levodopainclude hallucination (hallucination), insomnia, nausea and dyskinesia.
- exercise disordersinclude movement impairment, for example, slow and non-cooperative involuntary movements, shaking (the appearance of shaking, stiffness and gait disturbances. Patients treated with levodopa often have reduced Parkinson's disease symptoms, but they experience increasingly difficult to keep standing or even sitting.
- composition of the present inventionis tyrosine hydroxylase (TH), dopamine transporter (DAT), aromatic l-amino acid decarboxylase (AADC), MAP2 (microtuble associated protein 2) and increase the expression of one or more genes selected from the group consisting of synapsin, brain-derived neurotrophic factor protein, synaptophysin or tyrosine hydroxylase (tyrosine) It may be to increase the expression of hydroxylase (TH) protein or to reduce the expression of synuclin (synucelin) protein.
- the MAP2belongs to a microtubule associated protein and is involved in microtubule assembly. It is known that microtubules are primarily involved in microtubule assembly by combining with other microtubules and intermediate fibers.
- composition of the present inventionmay be to increase the activity of pCREB, pGSK, pAkt or pAMPK, to inhibit the activity of Ikb ⁇ or p38, or to increase the activity of PI3K or PKA.
- Akt signaling-related geneswas increased through analysis of global gene expression in dopamine neurons treated with melanin aggregation hormone, and pCREB, pGSK and pAkt through Western blots for pCREB, pGSK and pAkt. It was confirmed that the phosphorylation of the Akt signaling-related protein including the (Fig. 9 to Fig. 11).
- A53T alpha-synuclein transgenic mouseused in the present invention is a transformant in which the alanine, which is the 53rd amino acid, is transformed into threonine, and the mutant aggregates alpha-synuclein, a dopamine neurodegenerative protein, Causes degeneration of dopamine neurons.
- the neuronal protective effect of melanin aggregation hormonewas confirmed using A53T alpha-synuclein transgenic mice.
- the alpha-synucleinis part of a large protein family including beta- and gamma-synuclein and synoretin. Dual alpha-synuclein is known to be expressed in the normal state associated with synapses and play a role in neuroplasticity, learning and memory. Alpha-synuclein can be an important protein in Parkinson's and related diseases because it can induce neuronal death and neuroinflammatory and can be a mediator of aggregate spreading in the brain (Proc Natl Acad Sci USA , 2009; 106: 13010-5; J Biol Chem, 2010a; 285: 9262-72).
- the A53T alpha-synuclein transgenic mice injected with melanin coagulation hormonewas longer in the rod than the non-injecting group, the melanin coagulation hormone through the exercise improvement effect It can be seen that (Fig. 26).
- composition of the present inventionmay be administered in a pharmaceutically effective amount.
- the term “pharmaceutically effective amount”means an amount sufficient to treat a disease at a reasonable benefit / risk ratio applicable to medical treatment, and an effective dose level is determined by the type and severity, age, sex, disease of the individual. It can be determined according to the type, activity of the drug, sensitivity to the drug, time of administration, route of administration and rate of release, duration of treatment, factors including the drug used concurrently and other factors well known in the medical field.
- the compositions of the present inventionmay be administered as individual therapeutic agents or in combination with other therapeutic agents and may be administered sequentially or simultaneously with conventional therapeutic agents. And single or multiple administrations.
- compositions of the present inventiondepend on the condition and weight of the patient, the extent of the disease, the form of the drug, the route and duration of administration, and the suitable total daily dosage can be determined by the practitioner within the scope of good medical judgment, It may generally be in an amount of 0.001 to 1000 mg / kg.
- the compositionis not particularly limited as long as it is an individual for the purpose of preventing or treating Parkinson's disease, and any individual may be applied.
- any individualsuch as monkeys, dogs, cats, rabbits, marmots, rats, mice, cows, sheep, pigs, goats, and the like, and to humans, and the mode of administration is conventional in the art. If not included.
- transdermal administration through topical applicationmay be used, but is not limited thereto.
- compositions of the present inventionmay be administered as individual therapeutic agents or in combination with other therapeutic agents and may be administered sequentially or simultaneously with conventional therapeutic agents. And single or multiple administrations. Taking all of the above factors into consideration, it is important to administer an amount that can obtain the maximum effect in a minimum amount without side effects, and can be easily determined by those skilled in the art.
- the pharmaceutical composition for treating or preventing Parkinson's disease of the present inventionmay include a pharmaceutically acceptable carrier, excipient or diluent in addition to the active ingredient described above.
- the carriers, excipients and diluentsinclude lactose, dextrose, sucrose, sorbitol, mannitol, xylitol, erythritol, maltitol, starch, acacia gum, alginate, gelatin, calcium phosphate, calcium silicate, cellulose, methyl cellulose, microcrystalline Cellulose, polyvinyl pyrrolidone, water, methylhydroxybenzoate, propylhydroxybenzoate, talc, magnesium stearate and mineral oil.
- compositions of the present inventionmay be used in the form of oral dosage forms, external preparations, suppositories, or sterile injectable solutions, such as powders, granules, tablets, capsules, suspensions, emulsions, syrups, and aerosols, respectively, according to conventional methods.
- itmay be prepared by using diluents or excipients such as fillers, weighting agents, binders, wetting agents, disintegrating agents, and surfactants which are commonly used.
- Solid preparations for oral administrationinclude, but are not limited to, tablets, pills, powders, granules, capsules, and the like.
- Such solid preparationsmay be prepared by mixing at least one excipient such as starch, calcium carbonate, sucrose, lactose, gelatin and the like.
- excipientssuch as starch, calcium carbonate, sucrose, lactose, gelatin and the like.
- lubricantssuch as magnesium stearate, talc can also be used.
- Itmay be prepared by adding various excipients such as humectants, sweeteners, fragrances, preservatives and the like in addition to liquid oral liquids or liquid paraffin for oral use.
- Formulations for parenteral administrationinclude sterile aqueous solutions, non-aqueous solvents, suspensions, emulsions, lyophilized formulations and suppositories.
- non-aqueous solvent and suspending agentpropylene glycol, polyethylene glycol, vegetable oils such as olive oil, injectable esters such as ethyl oleate and the like can be used.
- base of the suppositoryutopsol, macrogol, tween 61, cacao butter, laurin butter, glycerogelatin and the like can be used.
- the route of administration of the pharmaceutical composition of the present inventionmay be one selected from the group consisting of oral, subcutaneous, intraperitoneal, pulmonary, intranasal, intramuscular, intravenous and arterial.
- the melanin aggregation hormone solutionwas injected into the nasal cavity of the mouse injected with MPTP or A53T alpha-synuclein transgenic mice after dissolving melanin aggregation hormone in the saline solution.
- the dosagedepends on the condition and weight of the patient, the extent of the disease, the form of the drug, the route of administration and the time of day, and may be appropriately selected by those skilled in the art.
- the present inventionprovides a health functional food for improving or preventing Parkinson's disease comprising melanin aggregation hormone as an active ingredient.
- the health functional food of the present inventionmay be to suppress the side effect of levodopa Parkinson's disease improver. Specifically, it may be to suppress the movement disorder caused by the side effects of levodopa, a Parkinson's disease improving agent.
- Parkinson's diseaseThe definition of the melanin aggregation hormone, Parkinson's disease is as described above.
- 'health functional food' used in the present inventionmeans a food manufactured and processed using raw materials or ingredients having functional properties useful for the human body according to Act No.6775 of the Health Functional Food Act. This means that it is ingested for the purpose of obtaining useful effects on health use such as nutrient control or physiological action on the structure and function of the human body.
- the health functional foodincludes various nutrients, vitamins, minerals (electrolytes), flavors such as synthetic flavors and natural flavors, coloring and neutralizing agents (such as cheese and chocolate), pectic acid and salts thereof, alginic acid and salts thereof, Organic acids, protective colloidal thickeners, pH adjusters, stabilizers, preservatives, glycerin, alcohols, carbonation agents used in carbonated drinks and the like.
- dietary supplementmay be in the form of any one of meat, sausage, bread, chocolate, candy, confectionary, pizza, ramen, gum, ice cream, soup, beverage, tea, functional water, drink, alcoholic beverage and vitamin complex. have.
- the health functional foodmay further include food additives, and the suitability as a 'food additive' is related to the relevant items according to the General Regulations of the Food Additives Code and General Test Act, etc., unless otherwise specified. Judging by the standards and standards.
- the chemical additivessuch as ketones, glycine, potassium citrate, nicotinic acid, and cinnamic acid, natural additives such as navy dye, licorice extract, crystalline cellulose, guar gum, and sodium L-glutamate Mixed preparations, such as a preparation, an alkali addition agent, a preservative preparation, and a tar pigment preparation, are mentioned.
- composition of the present inventionprovides a pharmaceutical composition for treating or preventing Parkinson's disease, including melanin aggregation hormone and levodopa.
- composition of the present inventionmay be that levodopa side effects are suppressed compared to the levodopa alone administration group. Specifically, it may be that the movement disorder caused by levodopa compared to the levodopa alone administration group is suppressed.
- the composition of the present inventionexhibits a dopamine neuron protective effect, it may be administered alone to treat Parkinson's disease, or by administering the pharmaceutical composition of the present invention and levodopa in parallel, the Parkinson's disease may be treated.
- the pharmaceutical composition of the present invention and levodopaa Parkinson's disease therapeutic agent
- the activity of the conventional Parkinson's disease therapeutic agent and the therapeutic activity represented by the pharmaceutical composition of the present inventioncan be duplicated to more effectively treat Parkinson's disease.
- the side effects of levodopawhich is a side effect of movement disorders also have an effect.
- the combination dosage agent which can be used at this timeis not specifically limited as long as it shows the therapeutic activity of Parkinson's disease as well as levodopa.
- dyskinesiasis in a group administered with levodopa and melanin aggregation hormone in combination with levodopa alone in a Parkinson's disease model animal induced with 6-hydroxydopamine (6-OHDA).was less induced (FIG. 31).
- the present inventionalso provides a pharmaceutical composition for inhibiting levodopa side effects, including melanin aggregation hormone and levodopa.
- composition of the present inventionmay be that levodopa side effects are suppressed compared to the levodopa alone administration group. Specifically, it may be that the movement disorder caused by levodopa compared to the levodopa alone administration group is suppressed.
- composition of the present inventionsuppresses the side effects of levodopa
- levodopa side effectscan be suppressed.
- the pharmaceutical composition of the present invention and levodopawhich is a Parkinson's disease therapeutic agent
- the activity of the conventional Parkinson's disease therapeutic agent and the therapeutic activity represented by the pharmaceutical composition of the present inventionmay overlap, thereby more effectively treating Parkinson's disease.
- Exercise disorders, a side effect of levodopaalso have an inhibitory effect.
- Example 1in primary dopamine neurons and human neuroblastoma cells MCH Functional Roles and Neuronal Protection Mechanisms
- midbrain containing SNC and VTAwas easily cut by treatment with papain at 37 ° C. for 30 minutes (5 U / ml; Worthington Biochemicals). The cut tissue was made into single cells through chewing using a small pipette tip. Cells were then centrifuged at 250 xg for 5 minutes and 5% fetal bovine serum, 1x B27 (Invitrogen), 1x GlutaMAX (Invitrogen), 0.4% D-glucose (Sigma-Aldrich), 10 U / ml penicillin (Invitrogen) , And 10 ⁇ g / ml streptomycin (invitrogen) were suspended in plating medium.
- the cells isolated from each midbrainwere divided equally and dispensed onto 4 poly-D-lysine (Sigma) and laminin (BD Bioscience) precoated 12-mm-round coverslips, followed by carbon dioxide It was kept at 37 ° C. in an incubator humidified with. At 24 hours after dispensing, the medium was changed to serum-free medium supplemented with 5 uM cytosine ⁇ -D-arabinofuranoside ( ⁇ -D-arabinofuranoside, Sigma Aldrich). glia) was used to inhibit the proliferation. Three days after plating, the medium was treated with MCH or other drugs.
- Human neuroblastoma SH-SY5Y cellswere purchased from American Type Culture Collection (Rockville, MD, USA). Cells were 10% fetal bovine serum (FBS, Invitrogen, Carlsbad, CA, USA), 100 unit / ml penicillin, and 100 ⁇ g / ml streptoceat at 37 ° C., 95% air, and 5% CO 2 atmosphere. DMEM (Dulbecco's modified Eagle's minimum essential medium, Invitrogen, Carlsbad, CA, USA with the addition of mycin (Gibco-BRL, Rockville, MD, USA) and additionally trypsin-EDTA (Gibco-BRL, Rockville, MD, USA) ).
- MTTThiazolyl Blue Tetrazolium Bromide
- DMSOdimethyl sulfoxide
- Cellswere fixed with PBS containing 4% paraformaldehyde and immunostaining was performed using the following primary antibodies according to standard protocols: Tuj1 (mouse monoclonal, Covance); TH (rabbit polyclonal, Pelfreez); Appropriate Molecular Probes Secondary antibodies linked with Alexa Fluor® stains were used. Nuclei were counterstained with 4,6-diamidino-2-phenylindole (4,6-diamidino-2-phenylindole, DAPI, Invitrogen). Cells were imaged with Nikon Eclipse Ti, and images were processed and analyzed with Adobe Photoshop software. Immunoblotting was performed according to standard protocols.
- RNase H-mediated second-strand cDNARNase H-treated cDNA
- the cRNA produced through in vitro transcriptionwas combined with a biotin-coupled nucleotide analog during cDNA synthesis. Samples were prepared by placing 15 ⁇ g of biotin-bound cDNA into a 1 ⁇ hybridization cocktail according to the Affymetrix Hybridization Manual.
- GeneChip arrays(GeneChip array, mouse genome 430A 2.0 arrays) were hybridized in a gene chip hybridization oven at 45 °C for 16 hours at 60 RPM. Washing was performed in GeneChip Fluidics Station 450 with buffer provided by Affymetrix GeneChip Hybridization, Wash, and Stain Kit. Analysis results were scanned with GeneChip Scanner 3000, and images were extracted and analyzed with GeneChip Operating Software v1.4. For statistical analysis, CEL files were processed using GeneSpring 7.0 and normalized using robust multi-array analysis.
- Cellswere 50 mM tris-base (pH 7.5), 150 mM sodium chloride, 2 mM EDTA, 1% glycerol, 10 mM sodium fluoride (NAF), 10 mM sodium-pyrophosphate, 1% NP- Homogenized in lysis buffer containing 40 and protease inhibitor (0.1 mM phenylmethylsulfonylfluoride, 5 ⁇ g / ml aprotinin, and 5 ⁇ g / ml leupeptin).
- protease inhibitor0.1 mM phenylmethylsulfonylfluoride, 5 ⁇ g / ml aprotinin, and 5 ⁇ g / ml leupeptin.
- qRT-PCRwas performed using the dopamine neuron medium treated with MCH.
- THtyrosine hydroxylase
- DATdopamine transporter
- AADCaromatic l-amino acid decarboxylase
- fine particleswere treated by the MCH treatment. It was confirmed that the expression of dopamine (dopamine, DA) marker gene including microtubule associated protein 2 (MAP2) increased (FIG. 3).
- MCHplays an important role in the maintenance and survival of midbrain dopamine neurons.
- MCHchanges the overall gene expression, among which the expression of Akt signaling-related genes increased after the treatment of MCH (Fig. 9).
- Akt signalingis involved in the neuronal cell protection mechanism of MCH, and CREB, Akt and GSK-3 ⁇ are involved in Akt signaling, but not ERK.
- MPP + induced dopamine neuronswere treated with MCH together with PI3K (LY294002) and PKA (H89) signaling specific inhibitors.
- PI3KLY294002
- PKAH89
- Akt and CREBare involved in the protective effect of dopamine neurons induced by MCH using PI3K and PKA signaling inhibitors.
- MCHexhibited a strong protective effect in neurons by inhibiting the activation of Ikb- ⁇ or p38.
- the 12-week-old male C57BL / 6 mouse(Central Laboratories Animal Inc, Republic of Korea), weighing 23-25 g, was kept for 12 hours in light and 12 hours in dark, and free access to water and food. Room temperature was maintained at 23 ⁇ 1 ° C. All experiments were approved by Kyung Hee University Animal Protection Committee for Animal Welfare.
- MCHwas injected by intranasal injection, a noninvasive method that bypasses the blood brain barrier to deliver drugs from the nasal cavity to the brain.
- intracerebroventricular injectionis widely used for brain specific delivery of certain drugs, it is an invasive method and needs to anesthetize the experimental animal. Therefore, intranasal injection was chosen as the next best method for delivering MCH to the brain. Intranasal infusion was performed as described in De Rosa et al., 2005. MCH (Tocris biosciences, Bristol, UK) was injected intranasally into mice 2 hours after MPTP injection. Prior to injection, MCH was dissolved in saline solution (saline, 0.5 mg / 30 ⁇ L) and stored at 4 ° C.
- saline solutionsaline, 0.5 mg / 30 ⁇ L
- miceAll mice were held in a standing position to hold their heads and necks intact, and 15 ⁇ l of MCH solution was slowly injected with a pipette for about 15 seconds into one nasal cavity. After 2 to 3 minutes, the same injection was repeated in the other nostril. Another group of mice received a salt solution (i.n.).
- Tissue sectionswere reacted with biotin-conjugated anti-rabbit IgG (Vector Laboratories Inc., Burlingame, CA, USA) for 1 hour at room temperature, and for 1 hour with ABC reagent (Vector Laboratories Inc., Burlingame, CA, USA).
- the reactionwas carried out at room temperature and for 2 minutes in 1 M Tris-buffered saline (pH 7.5) containing 0.02% diaminobenzidine and 0.003% hydrogen peroxide.
- the tissue sectionswere fixed and dried on gelatin-coated slides, water was removed and the cover was covered. Photographs of striatum and black matter were taken using a brightfield microscope (BX51; Olympus, Tokyo, Japan). Three independent observers who did not know the expected results counted TH-positive neurons in the black matter. Counted cells were checked three times for validity of the data.
- Substantia nigracontains 50 mM tris-base (pH 7.5), 150 mM sodium chloride, 2 mM EDTA, 1% glycerol, 10 mM sodium fluoride (NAF), 10 mM sodium-pyrophosphate (Na-pyrophosphate). ), 1% NP-40 and a protease inhibitor (0.1 mM phenylmethylsulfonylfluoride, 5 ⁇ g / ml aprotinin, and 5 ⁇ g / ml leupeptin) Homogenized.
- phosphorylation levels of Akt and CREBwere confirmed in black matter isolated from mice treated with MPTP.
- phosphorylation levels of Akt and CREBdecreased in the black matter of MPTP-treated mice, but recovered in the black matter of MCH-infused or acupuncture mice (FIGS. 24 and 25). ).
- Heterozygous breeder of A53T alpha-synuclein (B6; C3-Tg-Prnp / SNCA * A53T / 83Vle / J) variantwas purchased from Jackson Laboratories (Bar Harbor, ME, USA), and A53T transgenic and non-transformant Breeding was obtained to obtain litters.
- miceGenotyped mice were reared free of water and food in a temperature and humidity controlled room at 12 hour light / dark cycles.
- MCHTocris biosciences, Bristol, UK
- salt solution0.5 mg / 30 ⁇ L
- the control groupCON
- micewere pre-trained for 2 minutes in accelerated road speed mode one hour before the experiment.
- the time on the roadwas up to 480 seconds at continuous load speed. Latency time was also analyzed.
- cells and black matterwere treated with 50 mM tris-base (pH 7.5), 150 mM sodium chloride, 2 mM EDTA, 1% glycerol, 10 mM sodium fluoride (NAF), 10 mM sodium-pyrophosphate (Na dissolution including -pyrophosphate), 1% NP-40 and protease inhibitor (0.1 mM phenylmethylsulfonylfluoride, 5 ⁇ g / ml aprotinin, and 5 ⁇ g / ml leupeptin) Homogenized in solution.
- protease inhibitor0.1 mM phenylmethylsulfonylfluoride, 5 ⁇ g / ml aprotinin, and 5 ⁇ g / ml leupeptin
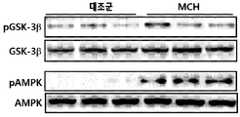
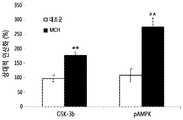
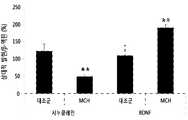
- MCHphosphorylation of GSK3 ⁇ , phosphorylation of AMPK, brain-derived neurotrophic factor (BDNF) expression, and down-ampling of AMPK as targets of Akt in the black matter Expression of synuclein was confirmed as a stream target.
- MCHincreased phosphorylation expression of GSK3- ⁇ and AMPK in black matter of A53T alpha-synuclein transgenic mice, increased expression of BDNF protein, and decreased expression of synuclein protein (FIGS. 27-30). ).
- miceNine week old male C57BL / 6 mice (Central Lab. Animal Inc., Seoul, Republic of Korea) weighing 24-26 g each were used. All experiments were approved by the Kyung Hee University Animal Protection Committee for Animal Welfare and were strictly maintained according to the guidelines of the NIH and the Korean Medical Association. Stereotaxic surgery was performed to create unilateral 6-OHDA lesions in striata of mice.
- micewere treated with tiletamine + zolazepam (30 mg / kg; Zoletil 50, Virbac, France) and xylazine (10 mg / kg; Rompun, Bayer Korea, Republic of Korea ) Was anesthetized with physiological saline and fixed in a stereotactic frame with a mouse adapter (Stoelting Co., USA). 6-OHDA-HCl mixture (3.0 mg / ml; Sigma Aldrich, USA) was dissolved in 0.02% ascorbic acid-based saline.
- micewere injected with either saline solution or 6-OHDA in the right striatum, unilaterally according to the brain atlas of the mouse: +1.0 mm of AP, -2.1 mm of ML, -3.2 mm of DV; And +0.3 mm of AP, -2.3 mm of ML, -3.2 mm of DV (BJ and GP, 2008).
- Each flow rateis 0.5 ⁇ l / min.
- LIDlevodopa induced dyskinesia
- AIMaxial AIM
- limb AIMrepetitive and regular spasm or dystonia of the forelimbs
- AIMorolingual AIM
- dyskinesiawas quantified on a 4-point scale that reflects frequency (0, none; 1, sometimes; 2, frequent; 3, interrupted by an external stimulus but continued; 4, external Continuous and serious without being interrupted by the stimulus).
- three subtypes of AIM valueswere integrated.
- AIM levelswere evaluated after L-dopa injection.
- the group administered with L-dopa (20 mg / kg)induced more dyskinesia (p ⁇ 0.05) compared with the 6-OHDA group and the control group.
- the group injected with MCH (0.5 mg / kg) with L-dopainduced less dyskinesia than the group that received only L-dopa (p ⁇ 0.05) (FIG. 31).
- Sub-analysis of AIM levelsshowed that all subcategories of AIM levels also had this tendency.
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Endocrinology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Mycology (AREA)
- Nutrition Science (AREA)
- Food Science & Technology (AREA)
- Polymers & Plastics (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
Translated fromKorean본 발명은 멜라닌 응집 호르몬(melanin concentrating hormone)을 유효성분으로 포함하는 파킨슨병 치료 및 레보도파 부작용 억제용 약학 조성물 및 건강기능식품에 관한 것이다.The present invention relates to a pharmaceutical composition for treating Parkinson's disease and inhibiting levodopa side effects and a health functional food comprising melanin concentrating hormone as an active ingredient.
파킨슨 병은 흑질 치밀부(substantia nigra pars compacta, SNc)에서 도파민작동성 뉴런의 신경퇴화가 특징으로써, 이는 선조체(striatum)에서 점차 도파민의 고갈을 일으킨다. 파킨슨병의 특징은 기저핵 순환의 균형을 망가뜨리고 운동뉴런의 제 기능을 못하게 하여, 경직(rigidity), 진전(tremor), 운동불능(akinesia)를 일으킨다. 50대 이상의 인구의 1~5 %가 두 번째로 가장 흔하게 겪는 신경퇴화 질병이다.Parkinson's disease is characterized by neurodegeneration of dopaminergic neurons in the substantia nigra pars compacta (SNc), which gradually leads to depletion of dopamine in the striatum. Parkinson's disease breaks down the balance of the basal ganglia and impairs the function of motor neurons, causing rigidity, tremor, and ainesia. One to five percent of people over 50 are the second most common neurodegenerative diseases.
파킨슨병의 궁극적인 원인은 아직 밝혀지지 않은 상황이나 정상인의 중뇌의 흑질(substantia nigra) 부위의 신경세포에서 만들어지는 뇌의 신경전달 물질인 도파민(dopamine)의 결핍으로 인해 여러 증상들이 나타나는 것으로 알려져 있다.The ultimate cause of Parkinson's disease is unknown, but several symptoms appear to be due to a deficiency of dopamine, a neurotransmitter in the brain made from nerve cells in the substantia nigra area of the normal brain. .
뇌의 흑질에 분포하는 신경세포에서 생성된 도파민은 선조체(corpus striatum)를 포함하는 뇌의 기저핵(basal ganglia)과 연결된다. 기저핵은 뇌의 운동피질 및 기타 여러 부위와 복잡하게 연결되어 있어 인체의 운동을 부드럽고 조화롭게 그리고 정확하게 수행할 수 있도록 해주는 매우 중요한 부위이다. 이러한 도파민성 신경의 손상에 의하여 결과적으로 기저핵 도파민성 신경 말단에서 유리되는 도파민의 결핍이 파킨슨병에서 나타나는 운동성 장애의 주요 원인이다.Dopamine produced by neurons distributed in the black matter of the brain is linked to the basal ganglia of the brain, including the corpus striatum. The basal ganglia are intricately linked to the motor cortex and many other areas of the brain, making it an important part of the body's movements, allowing them to perform smooth, harmonious and accurate movements. Dopamine deficiency, which is free from the end of basal ganglia dopaminergic nerves caused by such dopaminergic nerve damage, is a major cause of motility disorders in Parkinson's disease.
파킨슨병의 원인, 즉, 무엇 때문에 흑질의 신경세포가 파괴되는가에 대하여 아직 정확한 해답이 없으나, 이를 규명하기 위하여 활발한 연구가 진행되고 있다. 바이러스성 뇌염 등 감염설, 면역기전이 관계된다는 면역설, 선천적으로 그 기질을 타고난다는 유전설, 유리기가 생성되어 신경세포를 파괴한다는 설, 신경독성 물질의 중독설, 그리고 도파민의 생성 및 대사과정에 문제가 있다는 설 등이 있으나 아직 파킨슨병 전체를 설명하기에는 부족한 점이 많다.There is no exact answer yet about the cause of Parkinson's disease, namely, the destruction of the neural cells of the black matter, but active research is being conducted to find out. Infection theory such as viral encephalitis, immune theory that immune mechanisms are involved, genetic theory that innately inherits its substrate, theory that free radicals destroy nerve cells, poisoning theory of neurotoxic substances, and dopamine production and metabolism There is a theory that there is a problem, but there is still not enough to explain Parkinson's disease.
파킨슨병의 모델로서, 신경독소인 6-히드록시도파민(6-hydroxydopamine, 6-OHDA) 또는 1-메틸-4-페닐-1,2,3,6-테트라히드로피리딘(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)이 주로 이용된다(Nat Rev Neurosci, 2001, 2(5), 325-334). 6-OHDA는 도파민 수송체(DAT)에 의해 흡수되고, 자유 라디칼(free radical)을 만들어낸다. MPTP는 파킨슨병에 관련된 도파민성 뉴런을 특정 표적으로 하기보다는 인간과 비인간영장류에서 도파민성 뉴런을 감소시키고, 성상교세포증을 일으키며, 뇌흑질 치밀부에서 소교세포를 활성화시켜(Nat Med, 1999, 5(12), 1403-1409), 파킨슨병의 전형적인 생화학적 또는 병리학적 증상을 야기한다(Neurosci, 2000, 16(2), 135-142).As a model of Parkinson's disease, the neurotoxin 6-hydroxydopamine (6-OHDA) or 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (1-methyl-4- phenyl-1,2,3,6-tetrahydropyridine, MPTP) are mainly used (Nat Rev Neurosci, 2001, 2 (5), 325-334). 6-OHDA is absorbed by the dopamine transporter (DAT) and produces free radicals. MPTP reduces dopamine neurons in humans and nonhuman primates, causes astrocytes and activates microglia in cerebrospinal densities rather than specifically targeting dopaminergic neurons associated with Parkinson's disease (Nat Med, 1999, 5). (12), 1403-1409), causing typical biochemical or pathological symptoms of Parkinson's disease (Neurosci, 2000, 16 (2), 135-142).
파킨슨병의 치료를 위한 약물로서, 엘-도파(L-dopa) 제제, 도파민수용체 작용제, 항콜린 약제, 엘데프릴 등이 알려져 있다. 파킨슨병 초기에 운동 뉴런의 기능이 극적인 개선효과가 나타나기 때문에 도파민 전구물질인 L-dopa(레보도파)를 사용하는 것이 파킨슨병 치료에 있어 절대적 기준이다. 그러나 레보도파는 환각(hallucination), 불면증(insomnia), 메스꺼움(nausea) 및 운동장애(dyskinesia)와 같은 부작용을 일으킨다. 이러한 부작용 중에서 레보도파로 유발되는 운동장애(LID)는 레보도파를 만성적으로 사용하고 있는 파킨슨 병 환자에서 일어나는 가장 심각한 부작용이다. 만성적으로 레보도파를 사용하고 있는 파킨슨병 환자의 50 % 이상이 5년 안에 이러한 부작용을 겪었다. 항콜린 약제들은 자율 신경계 이상이나 정신기능의 이상 등이 나타날 수 있어 고령의 환자들에게 지속적으로 투여하는 것에 한계가 있다. 기타, 고주파를 이용한 신경자극술 즉, 고주파 파괴술 또는 심부 뇌자극술 등의 수술 치료도 행해지고 있으나, 침습적인 수술을 필요로 하고 또한 많은 비용이 소모되는 문제가 있다.As drugs for the treatment of Parkinson's disease, L-dopa preparations, dopamine receptor agonists, anticholinergic drugs, eldefril and the like are known. The use of the dopamine precursor, L-dopa (levodopa), is an absolute criterion for treating Parkinson's disease, as motor neurons function dramatically in the early stages of Parkinson's disease. However, levodopa causes side effects such as hallucination, insomnia, nausea and dyskinesia. Among these side effects, levodopa-induced dyskinesia (LID) is the most serious side effect in patients with Parkinson's disease who are chronically using levodopa. More than 50% of Parkinson's patients chronically using levodopa had these side effects within five years. Anticholinergic drugs may show autonomic nervous system abnormalities or mental function abnormalities, and thus they are limited to continuous administration to older patients. In addition, surgical treatment such as high frequency nerve stimulation, that is, high frequency destruction or deep brain stimulation, is also performed, but there is a problem that requires invasive surgery and consumes a lot of money.
한편, 멜라닌 응집 호르몬(Melanin-concentrating hormone, MCH)은 뇌하수체로부터 첫 번째로 분리된 고리모양의 19개의 아미노산으로 구성된 시상하부의 펩타이드이다. 뇌에서 MCH에 대한 우성 발현은 외측 시상하부에서 발견되었고 뇌 도처에 돌출되어 있다. MCH는 에너지를 소모하고 섭식행동을 자극함으로써, 에너지 항상성을 조절하는 것으로 알려져 있으나, 도파민작동성 신경세포에 대해 MCH의 손실과 관련된 기능은 아직 발견되지 않았다.On the other hand, melanin-concentrating hormone (MCH) is a hypothalamic peptide consisting of 19 ring-shaped amino acids first isolated from the pituitary gland. Dominant expression of MCH in the brain was found in the lateral hypothalamus and protrudes throughout the brain. MCH is known to modulate energy homeostasis by consuming energy and stimulating feeding behavior, but the function associated with loss of MCH has not yet been found for dopaminergic neurons.
본 발명의 하나의 목적은 멜라닌 응집 호르몬(melanin concentrating hormone)을 유효성분으로 포함하는 파킨슨병 치료 또는 예방용 약학 조성물을 제공하는 것이다.One object of the present invention to provide a pharmaceutical composition for the treatment or prevention of Parkinson's disease comprising melanin concentrating hormone (melanin concentrating hormone) as an active ingredient.
또한, 본 발명의 다른 목적은 멜라닌 응집 호르몬을 유효성분으로 포함하는 파킨슨병 개선 또는 예방용 건강기능식품을 제공하는 것이다.In addition, another object of the present invention to provide a health functional food for improving or preventing Parkinson's disease comprising melanin aggregation hormone as an active ingredient.
또한, 본 발명의 다른 목적은 MCH 및 레보도파를 포함하는 파킨슨병 치료 또는 예방용 약학 조성물을 제공하는 것이다.Another object of the present invention is to provide a pharmaceutical composition for treating or preventing Parkinson's disease, including MCH and levodopa.
또한, 본 발명의 다른 목적은 멜라닌 응집 호르몬 및 레보도파를 포함하는 레보도파 부작용 억제용 약학 조성물을 제공하는 것이다.In addition, another object of the present invention to provide a pharmaceutical composition for inhibiting levodopa side effects, including melanin aggregation hormone and levodopa.
따라서, 본 발명자들은 MCH를 이용하여 파킨슨병을 치료하고, 레보도파로 유발되는 부작용을 억제할 수 있는 조성물을 개발하기 위해 예의 노력한 결과, 일차 도파민 신경세포 및 파킨슨병 마우스 모델에서 MCH가 도파민 신경세포에 대하여 보호효과를 가지고 레보도파로부터 유발되는 운동장애를 경감시킴을 확인하여 본 발명을 완성하였다.Therefore, the present inventors have made intensive efforts to treat Parkinson's disease using MCH and to develop a composition capable of suppressing levodopa-induced side effects. In the primary dopamine neurons and Parkinson's disease mouse models, MCH is applied to dopamine neurons. The present invention was completed by confirming that it has a protective effect and alleviates a motor disorder caused by levodopa.
본 발명의 멜라닌 응집 호르몬을 유효성분으로 포함하는 조성물은 도파민 신경세포의 손실을 회복시키므로 파킨슨병의 치료 및 예방에 우수한 효과가 있으며, 파킨슨병 치료제인 레보도파에 의해 유발되는 이상운동증을 개선시키는 효과가 있다.The composition comprising the melanin aggregation hormone of the present invention as an active ingredient restores the loss of dopamine neurons, and thus has an excellent effect on the treatment and prevention of Parkinson's disease, and improves dyskinesia caused by levodopa, a treatment for Parkinson's disease. There is.
도 1은 중뇌 도파민 신경세포에 MCH, MCH + 항 MCH를 처리한 후 도파민 신경세포 수의 변화를 나타낸 도이다. 도 2는 중뇌 도파민 신경세포에 MCH, MCH + 항 MCH를 처리하여 Tuj1 및 MAP2의 면역형광염색을 통해 도파민 신경세포 수의 변화를 나타낸 도이다.1 is a diagram showing the change in the number of dopamine neurons after the treatment of MCH, MCH + anti-MCH to the brain brain dopamine neurons. Figure 2 is a diagram showing the change in the number of dopamine neurons through the immunofluorescence staining of Tuj1 and MAP2 by treating MCH, MCH + anti-MCH to the brain brain dopamine neurons.
도 3은 중뇌 도파민 신경세포에 MCH를 처리한 후 MAP2, DAT, TH, AADC의 도파민 신경세포 마커 유전자의 qRT-PCR 결과를 나타낸 도이다. 도 4는 중뇌 도파민 신경세포에서 농도별 MCH의 처리에 다른 도파민 신경세포 수를 나타낸 것이다. 도 5는 상기 마커 유전자의 발현량을 나타낸 도이다.Figure 3 is a diagram showing the qRT-PCR results of the dopamine neuron marker genes of MAP2, DAT, TH, AADC after the treatment of MCH in the brain brain dopamine neurons. Figure 4 shows the number of dopamine neurons different in the treatment of MCH by concentration in the midbrain dopamine neurons. 5 is a diagram showing the expression level of the marker gene.
도 6은 6-히드록시도파민 또는 MPP+를 처리한 중뇌 도파민 신경세포에 MCH를 처리한 후 도파민 신경세포 수의 변화를 나타낸 도이다. 도 7은 6-히드록시도파민 또는 MPP+를 처리한 중뇌도파민 신경세포 및 상기 약물을 처리하지 않은 중뇌 도파민 신경세포에 MCH를 처리한 후 TH, MAP2에 대한 면역형광염색을 통해 도파민 신경세포 수의 변화를 나타낸 도이다. 도 8은 6-히드록시도파민 또는 MPP+를 처리한 중뇌 도파민 신경세포에 MCH를 처리한 후 TH, DAT 및 synapsin에 대한 qRT-PCR를 통해 상기 유전자의 발현량을 나타낸 도이다.Figure 6 is a diagram showing the change in the number of dopamine neurons after MCH treatment to 6-hydroxy dopamine or MPP+ -treated midbrain dopamine neurons. Figure 7 shows the number of dopamine neurons through immunofluorescence staining for TH, MAP2 after MCH treatment of 6-hydroxydopamine or MPP+ -treated midbrain dopamine neurons and untreated midbrain dopamine neurons. Figure shows the change. 8 is a diagram showing the expression level of the gene through qRT-PCR for TH, DAT and synapsin after MCH treatment in 6-hydroxy dopamine or MPP+ -treated midbrain dopamine neurons.
도 9는 중뇌 도파민 신경세포에 MCH를 처리한 후 전체적 유전자 발현을 분석한 도이다. 도 10은 중뇌 도파민 신경세포에 MCH를 처리한 후 웨스턴 블랏을 통해 pCREB, pGSK-3β, pAkt 및 pERK의 단백질의 발현을 나타낸 도이다. 도 11은 중뇌 도파민 신경세포에 MCH를 처리한 후 인산 특이적 항체를 이용하여 pCREB, pGSK-3β, pAkt 및 pERK의 인산화 수준을 측정한 결과를 나타낸 도이다.Figure 9 is a diagram analyzing the overall gene expression after the treatment of MCH in the brain brain dopamine neurons. 10 is a diagram showing the expression of pCREB, pGSK-3β, pAkt, and pERK proteins through Western blot after treatment with MCH in mesenchymal dopamine neurons. 11 is a diagram showing the results of measuring the phosphorylation level of pCREB, pGSK-3β, pAkt and pERK using phosphate-specific antibodies after MCH treatment in midbrain dopamine neurons.
도 12는 MCH를 처리한 중뇌 도파민 신경세포에 PI3K 및 PKA 시그널링 특이적인 억제제를 처리한 후, Tuj1 및 MAP2의 면역형광염색을 통해 신경세포 보호효과가 억제됨을 나타낸 도이다. 도 13은 도 12의 결과를 수치로 나타낸 도이다.12 is a diagram showing that neuroprotective effect is suppressed through immunofluorescence staining of Tuj1 and MAP2 after treatment with PI3K and PKA signaling specific inhibitors to MCH-treated midbrain dopamine neurons. 13 is a diagram showing the results of FIG. 12 numerically.
도 14는 MPP+로 유도된 중뇌 도파민 신경세포 사멸환경에 MCH를 처리한 후, PI3K 및 PKA 시그널링 억제제를 처리한 후, Tuj1 및 MAP2의 면역형광염색을 통해 신경세포 사멸에 대한 신경세포 보호효과가 억제됨을 나타낸 도이다. 도 15는 도 14의 결과를 수치로 나타낸 도이다.Figure 14 after treatment with MCH in MPP+ -induced midbrain dopamine neuron killing environment, after treatment with PI3K and PKA signaling inhibitors, the neuronal protective effect against neuronal cell death through immunofluorescence staining of Tuj1 and MAP2 Is a diagram showing suppression. 15 is a diagram showing the results of FIG. 14 numerically.
도 16은 6-OHDA로 유도된 인간 신경모세포종 SY-SY5Y 세포에 MCH를 0, 50 및 100 nM의 MCH 처리에 의해 세포사멸이 억제됨을 나타낸 도이다. 도 17은 6-OHDA로 유도된 인간 신경모세포종 SY-SY5Y 세포에 MCH를 처리한 후 웨스턴 블랏을 통해 Ikb-α 및 p38의 인산화 수준을 측정한 도이다. 도 18은 도 17의 결과를 수치로 나타낸 도이다.16 is a diagram showing that apoptosis is inhibited by MCH treatment of 0, 50 and 100 nM MCH in 6-OHDA induced human neuroblastoma SY-SY5Y cells. FIG. 17 is a diagram illustrating phosphorylation levels of Ikb-α and p38 through Western blot after treatment of 6-OHDA-induced human neuroblastoma SY-SY5Y cells with MCH. 18 is a diagram showing the results of FIG. 17 numerically.
도 19는 MPTP를 처리한 마우스에 MCH를 주입한 후 흑질에서 TH-양성 신경세포의 변화를 나타낸 도이다. 도 20은 MPTP를 처리한 마우스에 MCH를 주입한 후 선조체에서 TH-양성 섬유의 밀도 변화를 나타낸 도이다. 도 21은 MPTP를 처리한 마우스에 MCH를 주입한 후 운동기능이 개선됨을 나타낸 도이다.19 is a diagram showing the change of TH-positive neurons in the black matter after MCH injection into the MPTP-treated mice. 20 is a diagram showing the density change of TH-positive fibers in the striatum after MCH injection into the MPTP-treated mice. 21 is a diagram showing that the motor function is improved after injecting MCH to the MPTP-treated mice.
도 22는 MPTP를 처리한 마우스에 MCH를 주입한 후 웨스턴 블랏을 통해 흑질에서 TH 및 시냅토파이신(synaptophysin) 단백질의 발현을 나타낸 도이다. 도 23은 도 22의 결과를 TH, 시냅토파이신/β-actin(%)으로 나타낸 도이다. 도 24 및 도 25는 MPTP를 처리한 마우스에 MCH를 주입한 후 웨스턴 블랏을 통해 pAkt 및 pCREB의 인산화 수준을 측정한 결과를 나타낸 도이다.FIG. 22 is a diagram showing the expression of TH and synaptophysin proteins in black matter through Western blot after injection of MCH into mice treated with MPTP. FIG. 23 is a diagram showing the results of FIG. 22 in TH and synaptophysin / β-actin (%). FIG. 24 and 25 show the results of measuring the phosphorylation level of pAkt and pCREB through Western blot after injection of MCH into MPTP treated mice.
도 26은 A53T 알파-시누클레인 형질전환 마우스에 MCH를 주입한 후 2주 및 4주 째 로타로드 테스트를 통해 운동기능을 측정한 결과를 나타낸 도이다.Figure 26 is a diagram showing the result of measuring the motor function through the rotarod test at 2 and 4 weeks after MCH injection into A53T alpha-synuclein transgenic mice.
도 27은 A53T 알파-시누클레인 형질전환 마우스에 MCH를 주입한 후 웨스턴 블랏을 통해 pGKS-3β 및 pAMPK의 인산화 수준을 측정한 결과를 나타낸 도이다. 도 28은 도 27의 결과를 수치화한 도이다. 도 29는 A53T 알파-시누클레인 형질전환 마우스에 MCH를 주입한 후 시누클레인, BDNF의 단백질 발현을 나타낸 도이다. 도 30은 도 29의 결과를 시누클레인, BDNF/β-actin으로 나타낸 도이다.FIG. 27 shows the results of measuring phosphorylation levels of pGKS-3β and pAMPK through Western blot after MCH injection into A53T alpha-synuclein transgenic mice. FIG. 28 is a diagram quantifying the results of FIG. 27. FIG. 29 shows protein expression of synuclein, BDNF after MCH injection into A53T alpha-synuclein transgenic mice. FIG. FIG. 30 is a diagram showing the results of FIG. 29 using synuclein and BDNF / β-actin.
도 31은 6-히드록시도파민으로 유도된 파킨슨병 모델 동물에 레보도파와 MCH를 0.1 ㎍, 0.5 ㎍ 및 2.5 ㎍의 농도로 주입한 후 1일, 4일 및 7일 째 비정상 불수의 운동 수치(AIM)을 측정한 결과를 나타낸 도이다.FIG. 31 shows abnormal involuntary motility (AIM) at 1, 4 and 7 days after injection of levodopa and MCH at concentrations of 0.1 μg, 0.5 μg and 2.5 μg in 6-hydroxydopamine-induced Parkinson's disease model animals. The figure which shows the result of measuring.
상기 과제를 해결하기 위하여, 본 발명은 멜라닌 응집 호르몬(melanin concentrating hormone)을 유효성분으로 포함하는 파킨슨병 치료 또는 예방용 약학 조성물을 제공한다.In order to solve the above problems, the present invention provides a pharmaceutical composition for the treatment or prevention of Parkinson's disease comprising melanin concentrating hormone (melanin concentrating hormone) as an active ingredient.
본 발명에서 사용된 용어 '멜라닌 응집 호르몬'은 신경펩티드의 일종으로, 중앙 신경계에 분포되어 있고, 음식물의 식이조절 및 체중 조절에 관여하는 것으로 알려져 있으며, 레트 또는 인체에서 색소 미립자를 응집시켜 색을 연하게 하며, 멜라닌 생성을 억제하는 기능을 갖는 것으로 알려져 있다. 그러나, 멜라닌 응집 호르몬이 도파민 신경세포에서 신경세포 보호효과를 가지며, 이를 통해 파킨슨병 치료효과 및 레보도파로부터 유발되는 운동이상증 개선효과를 가지는 것은 본 발명을 통해 처음으로 규명하였다. 상기 멜라닌 응집 호르몬의 아미노산 서열 및 이를 코딩하는 유전자의 염기서열 정보는 NCBI에 공지되어 있다(Genbank:NP_002665, NM_002674).The term 'melanin aggregation hormone' used in the present invention is a kind of neuropeptide, which is distributed in the central nervous system, and is known to be involved in dietary control and weight control of foods. It is known to have a function of softening and inhibiting melanin production. However, melanin aggregation hormone has a neuroprotective effect in the dopamine neurons, through which it has been identified for the first time through the Parkinson's disease treatment effect and dyskinesia induced effect from levodopa through the present invention. The amino acid sequence of the melanin aggregation hormone and the nucleotide sequence information of the gene encoding the same are known to the NCBI (Genbank: NP_002665, NM_002674).
본 발명에서 사용된 용어 '파킨슨병'은 뇌의 흑질(substantia nigra)에 분포하는 도파민의 신경세포가 점차 소실되어 발생하며 안정떨림, 경직, 운동완만 및 자세 불안정성이 특징적으로 나타나는 신경계의 만성 진행성 퇴행성 질환을 의미한다.The term 'Parkinson' disease used in the present invention is caused by the progressive loss of dopamine neurons distributed in the substantia nigra of the brain, chronic progressive degenerative of the nervous system, which is characterized by stability, stiffness, locomotor movement and postural instability. Means disease.
본 발명에서 사용되는 용어 '예방'은 상기 멜라닌 응집 호르몬을 유효성분으로 포함하는 조성물의 투여로 파킨슨 질환을 억제 또는 지연시키는 모든 행위를 의미한다.As used herein, the term 'prevention' refers to any action of inhibiting or delaying Parkinson's disease by administration of a composition containing the melanin aggregation hormone as an active ingredient.
본 발명에서 사용되는 용어 '치료'는, 상기 멜라닌 응집 호르몬을 유효성분으로 포함하는 조성물의 투여로 질환의 증세가 호전되거나 이롭게 변경되는 모든 행위를 의미한다.As used herein, the term 'treatment' refers to any action in which the symptoms of the disease are improved or advantageously changed by administration of the composition containing the melanin aggregation hormone as an active ingredient.
본 발명에서 파킨슨병의 치료는 신경세포 보호, 운동기능 개선 또는 신경세포의 수 증가에 의한 것일 수 있다.In the present invention, the treatment of Parkinson's disease may be due to neuronal cell protection, motor function or neuronal cell number increase.
상기 신경세포는 도파민 신경세포로서, 주요 신경전달물질이 도파민인 신경세포를 의미할 수 있고, 중뇌의 복측피개영역(ventral tegmental area, VTA), 흑질 치밀부(substantia nigra pars compacta), 시상하부 궁상핵(arcuate nucleus of the hypothalamus) 또는 선조체(striatum)에 위치할 수 있다.The neuron is a dopamine neuron, which may mean a neuron whose main neurotransmitter is dopamine, ventral tegmental area (VTA), substantia nigra pars compacta, hypothalamus arch of the middle brain It may be located in the nucleus (arcuate nucleus of the hypothalamus) or striatum.
구체적인 일 실시예에서, 본 발명의 멜라닌 응집 호르몬을 도파민 신경세포에 처리한 후, Tuj1(class III beta-tubulin) 및 MAP2(microtubule associated protein 2)와 같은 신경세포 관련 유전자에 대해 면역형광염색을 수행하여 도파민 신경세포의 수가 증가하는 것을 확인하였고, 항 멜라닌 응집 호르몬을 처리하여 도파민 신경세포의 수가 효과적으로 억제되는 것을 확인하였다(도 1 내지 도 2).In a specific embodiment, the melanin aggregation hormone of the present invention is treated to dopamine neurons, and then immunofluorescence staining is performed on neuron-related genes such as Tuj1 (class III beta-tubulin) and MAP2 (microtubule associated protein 2). It was confirmed that the number of dopamine neurons is increased, the number of dopamine neurons is effectively suppressed by the treatment of anti-melanin aggregation hormone (Fig. 1 to 2).
또한, 구체적인 일 실시예에서, MPP+ 또는 6-OHDA를 처리한 도파민 신경세포에 멜라닌 응집 호르몬을 처리한 후, TH 및 MAP2에 대한 면역형광염색을 통해, 멜라닌 응집 호르몬이 MPP+ 또는 6-OHDA로 유도된 신경세포의 사멸을 회복시킴을 확인하였다(도 6 내지 도 8).In addition, in one specific embodiment, after treatment with melanin aggregation hormone to the dopamine neurons treated with MPP+ or 6-OHDA, and through immunofluorescence staining for TH and MAP2, melanin aggregation hormone is MPP+ or 6-OHDA It was confirmed to restore the death of neurons induced by (Figs. 6 to 8).
본 발명의 조성물은 파킨슨병 치료제인 레보도파 부작용을 억제하는 것 일 수 있다.The composition of the present invention may be to suppress the side effects of levodopa which is a therapeutic agent for Parkinson's disease.
본 발명에서 사용되는 용어 "레보도파"는 파킨슨병을 치료하는데 있어, 현재 가장 널리 쓰이고 있는 약물로서, 투여된 레보도파는 혈액뇌장벽을 자유롭게 통과하여 인위적으로 도파민 분비를 촉진시키는 것으로 알려져 있다. 그러나 상기 레보도파는 파킨슨병 치료를 위해 가장 광범위하게 사용되고 있으나, 부작용이 있는 것으로 알려져 있다. 상기 레보도파의 부작용으로는 환각(hallucination), 불면증(insomnia), 메스꺼움(nausea) 및 운동장애(dyskinesia)가 있는데, 상기 부작용 중에서 운동장애에는 운동손상, 예를 들어 느리고 비협동적인 불수의운동, 진탕(shaking), 경직(stiffness) 및 보행 장애의 출현이 포함된다. 레보도파로 치료받은 환자는 종종 감소된 파킨슨병 증상을 가지나, 이들은 서있거나 심지어 앉아있는 것을 유지하기가 점점 더 곤란해지는 것을 경험한다.As used herein, the term "levodopa" is the most widely used drug in the treatment of Parkinson's disease, and it is known that administered levodopa freely crosses the blood brain barrier to artificially promote dopamine secretion. However, although levodopa is most widely used for the treatment of Parkinson's disease, it is known to have side effects. Side effects of levodopa include hallucination (hallucination), insomnia, nausea and dyskinesia. Among these side effects, exercise disorders include movement impairment, for example, slow and non-cooperative involuntary movements, shaking ( the appearance of shaking, stiffness and gait disturbances. Patients treated with levodopa often have reduced Parkinson's disease symptoms, but they experience increasingly difficult to keep standing or even sitting.
본 발명의 조성물은 티로신수산화효소(tyrosine hydroxylase, TH), 도파민 트랜스포터(dopamine transporter, DAT), 방향족 l-아미노산 탈탄산카르복실화효소(aromatic l-amino acid decarboxylase, AADC), MAP2(microtuble associated protein 2) 및 시냅신(synapsin)으로 구성된 군으로부터 선택되는 하나 이상의 유전자의 발현을 증가시키거나, 뇌유래신경영양인자(brain-derived neurotrophic factor) 단백질, 시냅토파이신(synaptophysin) 또는 티로신수산화효소(tyrosine hydroxylase, TH) 단백질의 발현을 증가시키거나, 또는 시누클레인(synucelin) 단백질의 발현을 감소시키는 것일 수 있다.The composition of the present invention is tyrosine hydroxylase (TH), dopamine transporter (DAT), aromatic l-amino acid decarboxylase (AADC), MAP2 (microtuble associated protein 2) and increase the expression of one or more genes selected from the group consisting of synapsin, brain-derived neurotrophic factor protein, synaptophysin or tyrosine hydroxylase (tyrosine) It may be to increase the expression of hydroxylase (TH) protein or to reduce the expression of synuclin (synucelin) protein.
상기 MAP2는 미세소관 관련 단백질(microtubule associated protein)에 속하는 것으로, 미세소관 조립에 관여한다. 주로 미세소관이 다른 미세소관 및 중간섬유와 결합하여 미세소관 조립에 관여한다고 알려져 있다.The MAP2 belongs to a microtubule associated protein and is involved in microtubule assembly. It is known that microtubules are primarily involved in microtubule assembly by combining with other microtubules and intermediate fibers.
구체적인 일 실시예에서, 본 발명의 멜라닌 응집 호르몬을 도파민 신경세포에 처리한 후, qRT-PCR 분석을 통해 티로신 수산화효소(tyrosine hydroxylase, TH), 도파민 트랜스포터(dopamine transporter, DAT), 방향족 l-아미노산 탈탄산카르복실화효소(aromatic l-amino acid decarboxylase, AADC) 및 MAP2(microtuble associated protein 2)를 포함하는 도파민 신경세포 관련 유전자들의 발현이 증가하는 것을 확인하였다(도 1 내지 도 3).In a specific embodiment, after treating the melanin aggregation hormone of the present invention to the dopamine neurons, and by qRT-PCR analysis tyrosine hydroxylase (TH), dopamine transporter (DAT), aromatic l- It was confirmed that the expression of dopamine neuron-related genes including the amino acid decarboxylase (AADC) and MAP2 (microtuble associated protein 2) was increased (FIGS. 1 to 3).
또한, 구체적인 일 실시예에서, MPP+ 또는 6-OHDA를 처리한 도파민 신경세포에 멜라닌 응집 호르몬을 처리한 후, qRT-PCR을 수행한 결과, 멜라닌 응집 호르몬에 의해 TH, DAT, synapsin 유전자의 발현이 증가됨을 확인하였다(도 6 내지 도 8).In addition, in one specific embodiment, after treatment with melanin aggregation hormone to the dopamine neurons treated with MPP+ or 6-OHDA, qRT-PCR, the expression of the TH, DAT, synapsin gene by melanin aggregation hormone It was confirmed that this increased (Figs. 6 to 8).
구체적인 다른 일 실시예에서, 본 발명의 멜라닌 응집 호르몬을 MPTP를 주입한 마우스에 비강 내로 주입한 후, 면역화학염색법을 통해 흑질에서 TH-양성 신경세포가 증가함을 확인하였고, 선조체에서 TH-양성인 섬유가 높은 밀도로 존재함을 확인하였다(도 19). 또한, 상기와 같이 MPTP를 처리한 마우스의 흑질에 멜라닌 응집 호르몬을 처리하였을 경우, TH 단백질 및 시냅토파이신 단백질의 발현이 회복되는 것을 확인하였다(도 22).In another specific embodiment, after injecting the melanin aggregation hormone of the present invention into the mouse injected with MPTP intranasally, it was confirmed that the TH-positive neurons increase in the black matter through immunochemical staining, TH-positive in the striatum It was confirmed that the fibers were present at high density (FIG. 19). In addition, when the melanin aggregation hormone was treated to the black matter of the MPTP-treated mice, it was confirmed that the expression of TH protein and synaptopycin protein was restored (FIG. 22).
구체적인 또 다른 일 실시예에서, 웨스턴 블랏을 통해 멜라닌 응집 호르몬이 A53T 알파-시누클레인 형질전환 마우스의 흑질에서 뇌유래신경영양인자 단백질의 발현을 증가시키고, 시누클레인 단백질의 발현을 감소시킴을 확인하였다(도 29 및 도 30).In another specific example, Western blot confirmed that melanin aggregation hormone increased the expression of brain-derived quantum protein and reduced the expression of synuclein protein in the black matter of A53T alpha-synuclein transgenic mice ( 29 and 30).
본 발명의 조성물은 pCREB, pGSK, pAkt 또는 pAMPK의 활성을 증가시키거나, Ikbα 또는 p38의 활성을 억제시키거나, PI3K 또는 PKA의 활성을 증가시키는 것일 수 있다.The composition of the present invention may be to increase the activity of pCREB, pGSK, pAkt or pAMPK, to inhibit the activity of Ikbα or p38, or to increase the activity of PI3K or PKA.
구체적인 일 실시예에서, 멜라닌 응집 호르몬을 처리한 도파민 신경세포에서 전체적 유전자 발현 분석을 통해 Akt 시그널링 관련 유전자의 발현이 증가함을 확인하였고 pCREB, pGSK 및 pAkt에 대한 웨스턴 블랏을 통해 pCREB, pGSK 및 pAkt을 포함하는 Akt 시그널링 관련 단백질의 인산화가 증가함을 확인하였다(도 9 내지 도 11).In a specific embodiment, it was confirmed that the expression of Akt signaling-related genes was increased through analysis of global gene expression in dopamine neurons treated with melanin aggregation hormone, and pCREB, pGSK and pAkt through Western blots for pCREB, pGSK and pAkt. It was confirmed that the phosphorylation of the Akt signaling-related protein including the (Fig. 9 to Fig. 11).
또한, MPTP를 처리한 마우스의 흑질에 멜라닌 응집 호르몬을 처리하였을 경우, Akt 및 CREB의 인산화 수준이 회복되는 것을 확인하였다(도 24 및 도 25).In addition, it was confirmed that when melanin aggregation hormone was treated in the black matter of mice treated with MPTP, phosphorylation levels of Akt and CREB were recovered (FIGS. 24 and 25).
또한, PI3K 및 PKA 시그널링에 대한 억제제를 이용한 실험에서, PI3K, PKA가 멜라닌 응집 호르몬에 의한 신경세포 보호효과에 관여함을 확인하였다(도 14 및 도 15).In addition, in experiments using inhibitors for PI3K and PKA signaling, it was confirmed that PI3K and PKA are involved in the neuronal protective effect by melanin aggregation hormone (FIGS. 14 and 15).
구체적인 다른 일 실시예에서, 6-OHDA로 유도된 인간 신경모세포종 SH-SY5Y 세포에서 멜라닌 응집 호르몬 처리에 의해 세포사멸이 억제되는 것을 확인하였고, 6-OHDA로 유도된 인간 신경모세포종 SH-SY5Y 세포에서 멜라닌 응집 호르몬 처리에 의해 Ikbα 또는 p38의 활성이 억제되는 것을 확인하였다(도 16 내지 도 18)).In another specific embodiment, it was confirmed that apoptosis was inhibited by melanin aggregation hormone treatment in 6-OHDA-induced human neuroblastoma SH-SY5Y cells, and in 6-OHDA-induced human neuroblastoma SH-SY5Y cells It was confirmed that the activity of Ikbα or p38 was inhibited by melanin aggregation hormone treatment (FIGS. 16 to 18)).
또한, 웨스턴 블랏을 통해 멜라닌 응집 호르몬이 A53T 알파-시누클레인 형질전환 마우스의 흑질에서 BDNF 단백질의 발현을 증가시키고, 시누클레인 단백질의 발현을 감소시킴을 확인하였다(도 27 내지 도 30).In addition, Western blot confirmed that melanin aggregation hormone increased the expression of BDNF protein in the black matter of A53T alpha-synuclein transgenic mice, and reduced the expression of synuclein protein (FIGS. 27-30).
본 발명에 사용되는 용어 "A53T 알파-시누클레인 형질전환 마우스"는 53번째 아미노산인 알라닌이 트레오닌으로 변이가 일어난 형질전환체로서, 상기 돌연변이체는 도파민 신경 퇴화유도 단백질인 알파-시누클레인이 응집되고 도파민 신경세포의 퇴화를 일으킨다. 본 발명에서는 A53T 알파-시누클레인 형질전환 마우스를 이용하여 멜라닌 응집 호르몬의 신경세포 보호효과를 확인하였다.The term "A53T alpha-synuclein transgenic mouse" used in the present invention is a transformant in which the alanine, which is the 53rd amino acid, is transformed into threonine, and the mutant aggregates alpha-synuclein, a dopamine neurodegenerative protein, Causes degeneration of dopamine neurons. In the present invention, the neuronal protective effect of melanin aggregation hormone was confirmed using A53T alpha-synuclein transgenic mice.
상기 알파-시누클레인(synuclein)은 베타- 및 감마-시누클레인 및 시노레틴(synoretin)을 비롯한 큰 단백질 패밀리의 일부이다. 이중 알파-시누클레인은 시냅스와 관련된 정상 상태에서 발현되고 신경 가소성, 학습 및 기억에 있어서 일정한 역할을 수행하는 것으로 알려져 있다. 알파-시누클레인은 신경세포사 및 신경염증을 유발할 수 있고, 뇌에서 응집체 퍼짐(aggregate spreading)의 매개체가 될 수 있기 때문에, 파킨슨병 및 관련질병에 있어 중요한 단백질이 될 수 있다(Proc Natl Acad Sci U S A, 2009; 106: 13010-5; J Biol Chem, 2010a; 285: 9262-72).The alpha-synuclein is part of a large protein family including beta- and gamma-synuclein and synoretin. Dual alpha-synuclein is known to be expressed in the normal state associated with synapses and play a role in neuroplasticity, learning and memory. Alpha-synuclein can be an important protein in Parkinson's and related diseases because it can induce neuronal death and neuroinflammatory and can be a mediator of aggregate spreading in the brain (Proc Natl Acad Sci USA , 2009; 106: 13010-5; J Biol Chem, 2010a; 285: 9262-72).
본 발명의 일 실시예에서, A53T 알파-시누클레인 형질전환 마우스에 멜라닌 응집 호르몬을 주입한 그룹이 주입하지 않은 그룹보다 로드 위에 있던 시간이 더 길었음을 확인하였고 이를 통해 멜라닌 응집 호르몬이 운동개선 효과를 가짐을 알 수 있었다(도 26).In one embodiment of the present invention, the A53T alpha-synuclein transgenic mice injected with melanin coagulation hormone was longer in the rod than the non-injecting group, the melanin coagulation hormone through the exercise improvement effect It can be seen that (Fig. 26).
본 발명의 조성물은 약학적으로 유효한 양으로 투여할 수 있다.The composition of the present invention may be administered in a pharmaceutically effective amount.
본 발명에서 용어, "약학적으로 유효한 양"은 의학적 치료에 적용 가능한 합리적인 수혜/위험 비율로 질환을 치료하기에 충분한 양을 의미하며, 유효 용량 수준은 개체 종류 및 중증도, 연령, 성별, 질병의 종류, 약물의 활성, 약물에 대한 민감도, 투여 시간, 투여 경로 및 배출 비율, 치료 기간, 동시 사용되는 약물을 포함한 요소 및 기타 의학 분야에 잘 알려진 요소에 따라 결정될 수 있다. 본 발명의 조성물은 개별 치료제로 투여하거나 다른 치료제와 병용하여 투여될 수 있고 종래의 치료제와 순차적 또는 동시에 투여될 수 있다. 그리고 단일 또는 다중 투여될 수 있다. 상기 요소를 모두 고려하여 부작용 없이 최소한의 양으로 최대 효과를 얻을 수 있는 양을 투여하는 것이 중요하며, 당업자에 의해 용이하게 결정될 수 있다. 본 발명의 조성물의 바람직한 투여량은 환자의 상태 및 체중, 질병의 정도, 약물 형태, 투여 경로 및 기간에 따라 다르며, 적합한 총 1일 사용량은 올바른 의학적 판단범위 내에서 처치의에 의해 결정될 수 있으나, 일반적으로 0.001 내지 1000 mg/kg의 양일 수 있다.As used herein, the term “pharmaceutically effective amount” means an amount sufficient to treat a disease at a reasonable benefit / risk ratio applicable to medical treatment, and an effective dose level is determined by the type and severity, age, sex, disease of the individual. It can be determined according to the type, activity of the drug, sensitivity to the drug, time of administration, route of administration and rate of release, duration of treatment, factors including the drug used concurrently and other factors well known in the medical field. The compositions of the present invention may be administered as individual therapeutic agents or in combination with other therapeutic agents and may be administered sequentially or simultaneously with conventional therapeutic agents. And single or multiple administrations. Taking all of the above factors into consideration, it is important to administer an amount that can obtain the maximum effect in a minimum amount without side effects, and can be easily determined by those skilled in the art. Preferred dosages of the compositions of the present invention depend on the condition and weight of the patient, the extent of the disease, the form of the drug, the route and duration of administration, and the suitable total daily dosage can be determined by the practitioner within the scope of good medical judgment, It may generally be in an amount of 0.001 to 1000 mg / kg.
상기 조성물은 파킨슨병의 예방 또는 치료를 목적으로 하는 개체이면 특별히 한정되지 않고, 어떠한 개체이든 적용가능하다. 예를 들면, 원숭이, 개, 고양이, 토끼, 모르모트, 랫트, 마우스, 소, 양, 돼지, 염소 등과 같은 비인간동물 및 인간 등 어느 개체에나 적용할 수 있으며, 투여의 방식은 당업계의 통상적인 방법이라면 제한 없이 포함한다. 예를 들어, 국소도포 등을 통한 경피투여 방식을 사용할 수 있으나, 이에 제한되는 것은 아니다. 또한, 특별한 제한이 있는 것은 아니지만 상기 조성물을 비강으로 주입하는 것도 가능하다.The composition is not particularly limited as long as it is an individual for the purpose of preventing or treating Parkinson's disease, and any individual may be applied. For example, it can be applied to any individual, such as monkeys, dogs, cats, rabbits, marmots, rats, mice, cows, sheep, pigs, goats, and the like, and to humans, and the mode of administration is conventional in the art. If not included. For example, transdermal administration through topical application may be used, but is not limited thereto. In addition, there is no particular limitation, but it is also possible to inject the composition into the nasal cavity.
본 발명의 조성물은 개별 치료제로 투여하거나 다른 치료제와 병용하여 투여될 수 있고 종래의 치료제와는 순차적 또는 동시에 투여될 수 있다. 그리고 단일 또는 다중 투여될 수 있다. 상기 요소를 모두 고려하여 부작용 없이 최소한의 양으로 최대 효과를 얻을 수 있는 양을 투여하는 것이 중요하며, 당업자에 의해 용이하게 결정될 수 있다.The compositions of the present invention may be administered as individual therapeutic agents or in combination with other therapeutic agents and may be administered sequentially or simultaneously with conventional therapeutic agents. And single or multiple administrations. Taking all of the above factors into consideration, it is important to administer an amount that can obtain the maximum effect in a minimum amount without side effects, and can be easily determined by those skilled in the art.
본 발명의 파킨슨병의 치료 또는 예방용 약학적 조성물은 상기 기재한 유효성분 이외에 약학적으로 허용 가능한 담체, 부형제 또는 희석제를 포함할 수 있다.The pharmaceutical composition for treating or preventing Parkinson's disease of the present invention may include a pharmaceutically acceptable carrier, excipient or diluent in addition to the active ingredient described above.
상기 담체, 부형제 및 희석제로는 락토즈, 덱스트로즈, 수크로스, 솔비톨, 만니톨, 자일리톨, 에리스리톨, 말티톨, 전분, 아카시아 고무, 알지네이트, 젤라틴, 칼슘 포스페이트, 칼슘 실리케이트, 셀룰로즈, 메틸 셀룰로즈, 미정질 셀룰로스, 폴리비닐 피롤리돈, 물, 메틸히드록시벤조에이트, 프로필히드록시벤조에이트, 탈크, 마그네슘 스테아레이트 및 광물유를 들 수 있다.The carriers, excipients and diluents include lactose, dextrose, sucrose, sorbitol, mannitol, xylitol, erythritol, maltitol, starch, acacia gum, alginate, gelatin, calcium phosphate, calcium silicate, cellulose, methyl cellulose, microcrystalline Cellulose, polyvinyl pyrrolidone, water, methylhydroxybenzoate, propylhydroxybenzoate, talc, magnesium stearate and mineral oil.
본 발명의 상기 약학적 조성물은 각각 통상의 방법에 따라 산제, 과립제, 정제, 캡슐제, 현탁액, 에멀젼, 시럽, 에어로졸 등의 경구형 제형, 외용제, 좌제 또는 멸균 주사용액의 형태로 제형화하여 사용할 수 있다. 상세하게는, 제형화할 경우 통상 사용하는 충진제, 중량제, 결합제, 습윤제, 붕해제, 계면활성제 등의 희석제 또는 부형제를 사용하여 조제될 수 있다. 경구투여를 위한 고형제제로는 정제, 환제, 산제, 과립제, 캡슐제 등을 포함하나, 이에 한정되는 것은 아니다. 이러한 고형제제는 적어도 하나 이상의 부형제, 예를 들면, 전분, 칼슘 카보네이트, 수크로오스, 락토오스, 젤라틴 등을 섞어 조제될 수 있다. 또한, 단순한 부형제 이외에 마그네슘 스테아레이트, 탈크 같은 윤활제들도 사용될 수 있다. 경구를 위한 액상물, 리퀴드 파라핀 이외에 여러 가지 부형제, 예를 들면 습윤제, 감미제, 방향제, 보존제 등을 첨가하여 조제될 수 있다. 비경구 투여를 위한 제제는 멸균된 수용액, 비수성 용제, 현탁제, 유제, 동결건조 제제 및 좌제를 포함한다. 비수성 용제 및 현탁제로는 프로필렌 글리콜, 폴리에틸렌 글리콜, 올리브 오일과 같은 식물성 오일, 에틸올레이트와 같은 주사가능한 에스테르 등이 사용될 수 있다. 좌제의 기제로는 위텝솔, 마크로골, 트윈 61, 카카오지, 라우린지, 글리세로젤라틴 등이 사용될 수 있다.The pharmaceutical compositions of the present invention may be used in the form of oral dosage forms, external preparations, suppositories, or sterile injectable solutions, such as powders, granules, tablets, capsules, suspensions, emulsions, syrups, and aerosols, respectively, according to conventional methods. Can be. Specifically, when formulated, it may be prepared by using diluents or excipients such as fillers, weighting agents, binders, wetting agents, disintegrating agents, and surfactants which are commonly used. Solid preparations for oral administration include, but are not limited to, tablets, pills, powders, granules, capsules, and the like. Such solid preparations may be prepared by mixing at least one excipient such as starch, calcium carbonate, sucrose, lactose, gelatin and the like. In addition to simple excipients, lubricants such as magnesium stearate, talc can also be used. It may be prepared by adding various excipients such as humectants, sweeteners, fragrances, preservatives and the like in addition to liquid oral liquids or liquid paraffin for oral use. Formulations for parenteral administration include sterile aqueous solutions, non-aqueous solvents, suspensions, emulsions, lyophilized formulations and suppositories. As the non-aqueous solvent and suspending agent, propylene glycol, polyethylene glycol, vegetable oils such as olive oil, injectable esters such as ethyl oleate and the like can be used. As the base of the suppository, utopsol, macrogol, tween 61, cacao butter, laurin butter, glycerogelatin and the like can be used.
본 발명의 상기 약학적 조성물의 투여 경로는 경구, 피하, 복강 내, 폐 내, 비강 내, 근육 내, 정맥 내 및 동맥 내로 이루어진 군으로부터 선택된 하나인 것일 수 있다. 본 발명에서는 멜라닌 응집 호르몬을 뇌로 전달하기 위해, 멜라닌 응집 호르몬을 염류용액에 용해 시킨 후 MPTP를 주입 한 마우스 또는 A53T 알파-시누클레인 형질전환 마우스의 비강 내로 멜라닌 응집 호르몬 용액을 주입하였다.The route of administration of the pharmaceutical composition of the present invention may be one selected from the group consisting of oral, subcutaneous, intraperitoneal, pulmonary, intranasal, intramuscular, intravenous and arterial. In the present invention, in order to transfer the melanin aggregation hormone to the brain, the melanin aggregation hormone solution was injected into the nasal cavity of the mouse injected with MPTP or A53T alpha-synuclein transgenic mice after dissolving melanin aggregation hormone in the saline solution.
투여량은 환자의 상태 및 체중, 질병의 정도, 약물형태, 투여경로 및 시간에 따라 다르지만, 당업자에 의해 적절하게 선택될 수 있다.The dosage depends on the condition and weight of the patient, the extent of the disease, the form of the drug, the route of administration and the time of day, and may be appropriately selected by those skilled in the art.
또한, 본 발명은 멜라닌 응집 호르몬을 유효성분으로 포함하는 파킨슨병 개선 또는 예방용 건강기능식품을 제공한다.In addition, the present invention provides a health functional food for improving or preventing Parkinson's disease comprising melanin aggregation hormone as an active ingredient.
상기 본 발명의 건강기능식품은 파킨슨병 개선제인 레보도파 부작용을 억제하는 것일 수 있다. 구체적으로, 파킨슨병 개선제인 레보도파의 부작용으로부터 유발되는 운동장애를 억제하는 것일 수 있다.The health functional food of the present invention may be to suppress the side effect of levodopa Parkinson's disease improver. Specifically, it may be to suppress the movement disorder caused by the side effects of levodopa, a Parkinson's disease improving agent.
상기 멜라닌 응집 호르몬, 파킨슨병의 정의는 상기에서 설명한 바와 같다.The definition of the melanin aggregation hormone, Parkinson's disease is as described above.
본 발명에서 사용된 용어, '건강기능식품'이라 함은 건강기능식품에 관한 법률 제6727호에 따른 인체에 유용한 기능성을 가진 원료나 성분을 사용하여 제조 및 가공한 식품을 의미하며, '기능성'이라 함은 인체의 구조 및 기능에 대하여 영양소를 조절하거나 생리학적 작용 등과 같은 보건 용도에 유용한 효과를 얻을 목적으로 섭취하는 것을 의미한다.The term 'health functional food' used in the present invention means a food manufactured and processed using raw materials or ingredients having functional properties useful for the human body according to Act No.6775 of the Health Functional Food Act. This means that it is ingested for the purpose of obtaining useful effects on health use such as nutrient control or physiological action on the structure and function of the human body.
상기 건강기능식품은 여러 가지 영양제, 비타민, 광물(전해질), 합성 풍미제 및 천연 풍미제 등의 풍미제, 착색제 및 중진제(치즈, 초콜릿 등), 펙트산 및 그의 염, 알긴산 및 그의 염, 유기산, 보호성 콜로이드 증점제, pH 조절제, 안정화제, 방부제, 글리세린, 알코올, 탄산음료에 사용되는 탄산화제 등을 함유할 수 있다.The health functional food includes various nutrients, vitamins, minerals (electrolytes), flavors such as synthetic flavors and natural flavors, coloring and neutralizing agents (such as cheese and chocolate), pectic acid and salts thereof, alginic acid and salts thereof, Organic acids, protective colloidal thickeners, pH adjusters, stabilizers, preservatives, glycerin, alcohols, carbonation agents used in carbonated drinks and the like.
그 밖에 천연 과일쥬스 및 과일쥬스 음료 및 야채 음료의 제조를 위한 과육을 함유할 수 있다. 이러한 성분은 독립적으로 또는 조합하여 사용할 수 있다. 또한, 건강기능식품은 육류, 소세지, 빵, 쵸코렛, 캔디류, 과자류, 피자, 라면, 껌류, 아이스크림류, 스프, 음료수, 차, 기능수, 드링크제, 알콜 음료 및 비타민 복합제 중 어느 하나의 형태일 수 있다.Others may contain pulp for the production of natural fruit juices and fruit juice drinks and vegetable drinks. These components can be used independently or in combination. In addition, the dietary supplement may be in the form of any one of meat, sausage, bread, chocolate, candy, confectionary, pizza, ramen, gum, ice cream, soup, beverage, tea, functional water, drink, alcoholic beverage and vitamin complex. have.
또한 상기 건강기능식품은 식품첨가물을 추가로 포함할 수 있으며, '식품첨가물'로서의 적합여부는 다른 규정이 없는 한 식품의약품안정청에 승인된 식품첨가물공전의 총칙 및 일반시험법 등에 따라 해당 품목에 관한 규격 및 기준에 의하여 판정한다.In addition, the health functional food may further include food additives, and the suitability as a 'food additive' is related to the relevant items according to the General Regulations of the Food Additives Code and General Test Act, etc., unless otherwise specified. Judging by the standards and standards.
상기 '식품첨가물공전'에 수재된 품목으로 예를 들어, 케톤류, 글리신, 구연산칼륨, 니코틴산, 계피산 등의 화학적 합성품, 감색소, 감초추출물, 결정셀룰로오스, 구아검 등의 천연첨가물, L-글루타민산나트륨제제, 면류첨가알칼리제, 보존료 제제, 타르색소제제 등의 혼합 제제류들을 들 수 있다.For example, the chemical additives such as ketones, glycine, potassium citrate, nicotinic acid, and cinnamic acid, natural additives such as navy dye, licorice extract, crystalline cellulose, guar gum, and sodium L-glutamate Mixed preparations, such as a preparation, an alkali addition agent, a preservative preparation, and a tar pigment preparation, are mentioned.
또한, 본 발명의 조성물은 멜라닌 응집 호르몬 및 레보도파를 포함하는 파킨슨병 치료 또는 예방용 약학 조성물을 제공한다.In addition, the composition of the present invention provides a pharmaceutical composition for treating or preventing Parkinson's disease, including melanin aggregation hormone and levodopa.
상기 본 발명의 조성물은 레보도파 단독 투여군에 비해 레보도파 부작용이 억제되는 것일 수 있다. 구체적으로, 레보도파 단독 투여군에 비해 레보도파로부터 유발되는 운동장애가 억제되는 것 일 수 있다.The composition of the present invention may be that levodopa side effects are suppressed compared to the levodopa alone administration group. Specifically, it may be that the movement disorder caused by levodopa compared to the levodopa alone administration group is suppressed.
상기 본 발명의 조성물은 도파민 신경세포 보호 효과를 나타내므로, 단독으로 투여하여 파킨슨병을 치료할 수도 있고, 본 발명의 약학조성물과 레보도파를 병행하여 투여함으로써, 파킨슨병을 치료할 수 있다. 특히, 상기 본 발명의 약학조성물과 파킨슨병 치료제인 레보도파를 병용 투여할 경우에는, 종래의 파킨슨병 치료제가 나타내는 활성과 본 발명의 약학 조성물이 나타내는 치료활성이 중복되어 보다 효과적으로 파킨슨병을 치료할 수 있으며, 레보도파가 가지는 부작용인 운동장애 역시 억제하는 효과를 가진다. 또한, 이때, 사용될 수 있는 병용 투여제로는 레보도파 뿐만 아니라, 파킨슨 병의 치료활성을 나타내는 한 특별히 이에 제한되지 않는다.Since the composition of the present invention exhibits a dopamine neuron protective effect, it may be administered alone to treat Parkinson's disease, or by administering the pharmaceutical composition of the present invention and levodopa in parallel, the Parkinson's disease may be treated. In particular, when the pharmaceutical composition of the present invention and levodopa, a Parkinson's disease therapeutic agent, are used in combination, the activity of the conventional Parkinson's disease therapeutic agent and the therapeutic activity represented by the pharmaceutical composition of the present invention can be duplicated to more effectively treat Parkinson's disease. In addition, the side effects of levodopa, which is a side effect of movement disorders also have an effect. In addition, the combination dosage agent which can be used at this time is not specifically limited as long as it shows the therapeutic activity of Parkinson's disease as well as levodopa.
구체적인 일 실시예에서, 6-히드록시도파민(6-hydroxydopamine, 6-OHDA)으로 유도된 파킨슨병 모델 동물에서 레보도파만을 단독으로 투여한 그룹보다 레보도파와 멜라닌 응집 호르몬을 병용 투여한 그룹에서 이상운동증이 더 적게 유발되었다(도 31).In one specific embodiment, dyskinesiasis in a group administered with levodopa and melanin aggregation hormone in combination with levodopa alone in a Parkinson's disease model animal induced with 6-hydroxydopamine (6-OHDA). Was less induced (FIG. 31).
또한, 본 발명은 멜라닌 응집 호르몬 및 레보도파를 포함하는 레보도파 부작용 억제용 약학 조성물을 제공한다.The present invention also provides a pharmaceutical composition for inhibiting levodopa side effects, including melanin aggregation hormone and levodopa.
상기 본 발명의 조성물은 레보도파 단독 투여군에 비해 레보도파 부작용이 억제되는 것일 수 있다. 구체적으로, 레보도파 단독 투여군에 비해 레보도파로부터 유발되는 운동장애가 억제되는 것 일 수 있다.The composition of the present invention may be that levodopa side effects are suppressed compared to the levodopa alone administration group. Specifically, it may be that the movement disorder caused by levodopa compared to the levodopa alone administration group is suppressed.
상기 본 발명의 조성물은 레보도파의 부작용을 억제하므로 본 발명의 약학조성물과 레보도파를 병행하여 투여함으로써, 레보도파 부작용을 억제할 수 있다. 특히, 상기 본 발명의 약학조성물과 파킨슨병 치료제인 레보도파를 병용 투여할 경우에는 종래의 파킨슨병 치료제가 나타내는 활성과 본 발명의 약학 조성물이 나타내는 치료활성이 중복되어 보다 효과적으로 파킨슨병을 치료할 수 있으며, 레보도파가 가지는 부작용인 운동장애 역시 억제하는 효과를 가진다.Since the composition of the present invention suppresses the side effects of levodopa, by administering the pharmaceutical composition of the present invention and levodopa in parallel, levodopa side effects can be suppressed. In particular, when the pharmaceutical composition of the present invention and levodopa, which is a Parkinson's disease therapeutic agent, are used in combination, the activity of the conventional Parkinson's disease therapeutic agent and the therapeutic activity represented by the pharmaceutical composition of the present invention may overlap, thereby more effectively treating Parkinson's disease. Exercise disorders, a side effect of levodopa, also have an inhibitory effect.
이하, 실시예를 통하여 본 발명의 구성 및 효과를 더욱 자세히 설명하고자 한다. 이들 실시예는 오로지 본 발명을 예시하기 위한 것일 뿐, 본 발명의 범위가 이들 실시예에 의해 한정되는 것은 아니다.Hereinafter, the configuration and effects of the present invention through the embodiments will be described in more detail. These examples are only for illustrating the present invention, but the scope of the present invention is not limited by these examples.
실시예Example 1: 일차 도파민 신경세포 및 인간 신경모세포종 세포에 있어 1: in primary dopamine neurons and human neuroblastoma cellsMCH의MCH 기능적인 역할 및 신경세포 보호 메카니즘 Functional Roles and Neuronal Protection Mechanisms
1-1: 일차 도파민 신경세포 배양1-1: Primary Dopamine Neuron Culture
출생한 마우스의 중뇌로부터 분리된 일차 세포를 배양하였다. 간단하게, SNC 및 VTA를 포함하는 중뇌는 37 ℃에서 30분 동안 파파인을 처리하여 쉽게 잘랐다(5 U/ml; Worthington Biochemicals). 잘라진 조직은 작은 피펫 팁을 사용하여 저작을 통해 단세포로 만들었다. 그리고 나서 세포들은 250 x g로 5분 동안 원심분리하고 5 % 소태아혈청, 1x B27(Invitrogen), 1x GlutaMAX(Invitrogen), 0.4 % D-글루코스(Sigma-Aldrich), 10 U/ml 페니실린(Invitrogen), 및 10 μg/ml 스트렙토마이신(invitrogen)을 첨가한 플레이팅 배지에 현탁하였다. 각 중뇌로부터 분리된 세포는 동일하게 나누어, 4개의 폴리-D-리신(poly-D-lysine, Sigma) 및 라미닌(BD Bioscience)이 미리 코팅된 12-mm-원형 커버슬립 위에 분주한 후, 이산화탄소로 가습화된 인큐베이터에서 37 ℃로 유지하였다. 분주 후 24시간 째, 배지는 5 uM 사이토신 β-D-아라비노푸라노시드(β-D-arabinofuranoside, Sigma Aldrich)를 첨가한 혈청이 없는 배지(serum-free medium)로 바꿔주었고 이는 교세포(glia)의 증식을 억제하기 위해 사용하였다. 플레이팅 후 3일 째 배지에 MCH 또는 다른 약물을 처리하였다.Primary cells isolated from the midbrain of born mice were cultured. Briefly, midbrain containing SNC and VTA was easily cut by treatment with papain at 37 ° C. for 30 minutes (5 U / ml; Worthington Biochemicals). The cut tissue was made into single cells through chewing using a small pipette tip. Cells were then centrifuged at 250 xg for 5 minutes and 5% fetal bovine serum, 1x B27 (Invitrogen), 1x GlutaMAX (Invitrogen), 0.4% D-glucose (Sigma-Aldrich), 10 U / ml penicillin (Invitrogen) , And 10 μg / ml streptomycin (invitrogen) were suspended in plating medium. The cells isolated from each midbrain were divided equally and dispensed onto 4 poly-D-lysine (Sigma) and laminin (BD Bioscience) precoated 12-mm-round coverslips, followed by carbon dioxide It was kept at 37 ° C. in an incubator humidified with. At 24 hours after dispensing, the medium was changed to serum-free medium supplemented with 5 uM cytosine β-D-arabinofuranoside (β-D-arabinofuranoside, Sigma Aldrich). glia) was used to inhibit the proliferation. Three days after plating, the medium was treated with MCH or other drugs.
1-2. 인간 신경모세포종 SH-SY5Y 세포 배양1-2. Human Neuroblastoma SH-SY5Y Cell Culture
인간 신경모세포종 SH-SY5Y 세포는 American Type Culture Collection (Rockville, MD, USA)로부터 구입하였다. 세포는 37 ℃의 온도, 95 %의 공기 및 5 %의 CO2로 구성된 대기에서 10 % 소 태아 혈청(FBS, Invitrogen, Carlsbad, CA, USA), 100 unit/ml 페니실린, 및 100 μg/ml 스트렙토마이신(Gibco-BRL, Rockville, MD, USA)을 첨가하고 추가로 트립신-EDTA(Gibco-BRL, Rockville, MD, USA)를 첨가한 DMEM(Dulbecco’s modified Eagle’s minimum essential medium, Invitrogen, Carlsbad, CA, USA)에서 유지하였다.Human neuroblastoma SH-SY5Y cells were purchased from American Type Culture Collection (Rockville, MD, USA). Cells were 10% fetal bovine serum (FBS, Invitrogen, Carlsbad, CA, USA), 100 unit / ml penicillin, and 100 μg / ml streptoceat at 37 ° C., 95% air, and 5% CO2 atmosphere. DMEM (Dulbecco's modified Eagle's minimum essential medium, Invitrogen, Carlsbad, CA, USA with the addition of mycin (Gibco-BRL, Rockville, MD, USA) and additionally trypsin-EDTA (Gibco-BRL, Rockville, MD, USA) ).
세포 생존률은 티아졸릴 블루 테트라졸리움 브로마이드(Thiazolyl Blue Tetrazolium Bromide, MTT)를 이용하여 확인하였다. 간단하게, 세포는 5 X 103 세포/웰의 밀도로 12-웰 플레이트(Corning Incorporated, USA)에 분주하였고, 37 ℃에서 16시간 동안 안정화시킨 후 24시간 동안 10 uM의 레티노산으로 분화시켰다. 분화된 세포들은 24시간 동안 100 uM의 6-OHDA(Sigma-Aldrich, St. Louis, MO, USA)를 처리한 것 또는 처리하지 않은 것으로 나누고 상기 그룹에 각각 표시된 농도로 MCH(Tocris biosciences, Bristol, UK)를 처리하였다. 세포는 2 mg/mL의 MTT 용액과 함께 배양하였다. 5 % CO2, 37 ℃에서 4시간 동안 배양 후, 상등액은 제거하고, 디메틸 설폭사이드(dimethyl sulfoxide, DMSO, Sigma, USA)를 추가하였다. 반응물의 광학밀도(optical density, OD)는 마이크로플레이트 리더기(iMARK, Bio-Rad, USA)를 사용하여 580 nm에서 측정하였다. 광학밀도는 다음 식을 사용하여 퍼센트로 바꾸었다: 세포 생존율 (%) = (OD 샘플/OD 음성 대조군) X 100. 음성 대조군 세포는 완벽히 DMEM만을 처리하였다.Cell viability was confirmed using Thiazolyl Blue Tetrazolium Bromide (MTT). Briefly, cells were dispensed into 12-well plates (Corning Incorporated, USA) at a density of 5 × 103 cells / well, stabilized at 37 ° C. for 16 hours and then differentiated with 10 uM of retinoic acid for 24 hours. Differentiated cells were divided into treated or untreated with 100 uM of 6-OHDA (Sigma-Aldrich, St. Louis, Mo., USA) for 24 hours and at the concentrations indicated in the groups, respectively, to MCH (Tocris biosciences, Bristol, UK). Cells were incubated with 2 mg / mL MTT solution. After 4 hours of incubation at 37 ° C. for 5% CO2 , the supernatant was removed and dimethyl sulfoxide (DMSO, Sigma, USA) was added. Optical density (OD) of the reactants was measured at 580 nm using a microplate reader (iMARK, Bio-Rad, USA). Optical density was changed in percent using the following formula: Cell viability (%) = (OD Sample / OD Negative Control)
1-3: 면역세포화학법(Immunocytochemistry)1-3: Immunocytochemistry
4 % 파라포름알데하이드가 포함된 PBS로 세포를 고정시키고 표준 프로토콜에 따라 다음의 일차 항체들을 이용하여 면역염색을 수행하였다: Tuj1 (마우스 단일클론, Covance); TH (토끼 다클론, Pelfreez); 적절한 분자적 프로브(Molecular Probes) Alexa Fluor® 염색제가 연결된 이차항체를 사용하였다. 핵은 4, 6- 디아미디노-2-페닐린돌(4,6-diamidino-2-phenylindole, DAPI, Invitrogen)로 대비염색하였다(counterstained). 세포들은 Nikon Eclipse Ti로 이미지화하였고, 이미지들은 Adobe Photoshop 소프트웨어로 처리 및 분석하였다. 면역블랏팅은 표준 프로토콜에 따라 수행하였다.Cells were fixed with PBS containing 4% paraformaldehyde and immunostaining was performed using the following primary antibodies according to standard protocols: Tuj1 (mouse monoclonal, Covance); TH (rabbit polyclonal, Pelfreez); Appropriate Molecular Probes Secondary antibodies linked with Alexa Fluor® stains were used. Nuclei were counterstained with 4,6-diamidino-2-phenylindole (4,6-diamidino-2-phenylindole, DAPI, Invitrogen). Cells were imaged with Nikon Eclipse Ti, and images were processed and analyzed with Adobe Photoshop software. Immunoblotting was performed according to standard protocols.
1-4: 전체 게놈 발현 분석1-4: Whole Genome Expression Analysis
RNeasy Mini Kit(QIAGEN)를 사용하여 배양한 신경세포로부터 전체 RNA(total RNA)를 분리하였다. 전체 RNA(total RNA)의 2 μg은 바이오틴 결합 cDNA를 제조하기 위해 사용하였다(Affymetrix One Cycle cDNA Synthesis Kit). 간단히 말해서, 이 방법은 첫 가닥(first strand) cDNA를 만들기 위해서 T7-Oligo(dT) 프로모터 프라이머를 사용하는 SuperScript Ⅱ-유도 역전사(directed reverse transcription)를 이용하였다. RNase H를 처리한 두번째 가닥 cDNA(RNase H-mediated second-strand cDNA)는 T7 RNA 합성효소에 의해 시험관 내 전사(T7 RNA Polymerase-directed in vitro transcription)를 통해 합성되었다. 시험관내 전사를 통해 만들어진 cRNA는 cDNA를 합성하는 과정에서 바이오틴이 결합된 뉴클레오티드 아날로그와 결합시켰다. 샘플은 Affymetrix 혼성화 매뉴얼에 따라 1X 혼성화 칵테일에 15 μg의 바이오틴이 결합된 cDNA를 넣어 제조하였다.Total RNA was isolated from neurons cultured using RNeasy Mini Kit (QIAGEN). 2 μg of total RNA was used to prepare biotin binding cDNA (Affymetrix One Cycle cDNA Synthesis Kit). In short, the method used SuperScript II-directed reverse transcription using a T7-Oligo (dT) promoter primer to make the first strand cDNA. RNase H-mediated second-strand cDNA (RNase H-treated cDNA) was synthesized by T7 RNA polymerase via T7 RNA Polymerase-directed in vitro transcription. The cRNA produced through in vitro transcription was combined with a biotin-coupled nucleotide analog during cDNA synthesis. Samples were prepared by placing 15 μg of biotin-bound cDNA into a 1 × hybridization cocktail according to the Affymetrix Hybridization Manual.
유전자칩 어레이(GeneChip array, mouse genome 430A 2.0 arrays)은 60 RPM으로 16시간 동안 45 ℃에서 유전자칩 혼성화 오븐에서 혼성화하였다. 세척은 Affymetrix GeneChip Hybridization, Wash, 및 Stain Kit에서 제공되는 완충용액으로 GeneChip Fluidics Station 450에서 수행하였다. 분석 결과는 GeneChip Scanner 3000로 스캔하였고, 이미지는 GeneChip Operating Software v1.4로 추출하고 분석하였다. 통계적 분석을 위해, CEL 파일을 GeneSpring 7.0을 사용하여 처리하였고 로부스트 멀티-어레이 분석(robust multi-array analysis)을 사용하여 정규화하였다(normalized).GeneChip arrays (GeneChip array, mouse genome 430A 2.0 arrays) were hybridized in a gene chip hybridization oven at 45 ℃ for 16 hours at 60 RPM. Washing was performed in GeneChip Fluidics Station 450 with buffer provided by Affymetrix GeneChip Hybridization, Wash, and Stain Kit. Analysis results were scanned with GeneChip Scanner 3000, and images were extracted and analyzed with GeneChip Operating Software v1.4. For statistical analysis, CEL files were processed using GeneSpring 7.0 and normalized using robust multi-array analysis.
1-5. 웨스턴 블랏1-5. Western Blot
세포는 50 mM 트리스-베이스 (pH 7.5), 150 mM 염화나트륨, 2 mM EDTA, 1% 글리세롤, 10 mM 플루오린화나트륨(NAF), 10 mM 나트륨-파이로포스페이트(Na-pyrophosphate), 1% NP-40 및 프로테아제 억제제 (0.1 mM 페닐메틸설포닐플루오라이드(phenylmethylsulfonylfluoride), 5 μg/ml 아프로티닌(aprotinin), 및 5 μg/ml 루펩틴(leupeptin))를 포함하는 용해 완충용액에서 균질화하였다. 30 μg의 용해물(lysate)은 10% SDS-폴리아크릴아마이드 젤에서 전기영동하였고 니트로셀룰로오스 멤브레인으로 이동시킨 후, 16시간 동안 4 ℃에서 항-포스포-CREB(pCREB), 항-CREB, 항-포스포-GSK-3β(pGSK-3β), 항-GSK-3β, 항-포스포-Akt(pAkt), 항-Akt, 항-포스포-ERK, 항-ERK(Cell signaling technology, Beverly, MA, USA), 항-포스포-p38, 항-p38, 항-포스포-Ikbα 및 항-Ikbα(Cell signaling technology, Beverly, MA, USA) 항체와 함께 반응시켰다. 다음으로, TBS-T (0.05%)로 세척한 후, 블랏을 홀스라디쉬 퍼옥시데이즈(horseradish peroxidase)-연결된 항-토끼 항체와 함께 반응시켰고, 그 밴드는 ECL system(Thermo Fisher Scienctific, USA)를 사용하여 관찰하였다. 밴드 이미지는 Molecular Imager ChemiDoc XRS+(Bio-Rad, Hercules, CA, USA)를 사용하여 얻었고 밴드의 강도는 Image LabTM 소프트웨어 버전 2.0.1(Bio-Rad)를 이용하여 분석하였다.Cells were 50 mM tris-base (pH 7.5), 150 mM sodium chloride, 2 mM EDTA, 1% glycerol, 10 mM sodium fluoride (NAF), 10 mM sodium-pyrophosphate, 1% NP- Homogenized in lysis buffer containing 40 and protease inhibitor (0.1 mM phenylmethylsulfonylfluoride, 5 μg / ml aprotinin, and 5 μg / ml leupeptin). 30 μg of lysate was electrophoresed on a 10% SDS-polyacrylamide gel and transferred to nitrocellulose membrane, followed by anti-phospho-CREB (pCREB), anti-CREB, anti -Phospho-GSK-3β (pGSK-3β), anti-GSK-3β, anti-phospho-Akt (pAkt), anti-Akt, anti-phospho-ERK, anti-ERK (Cell signaling technology, Beverly, MA, USA), anti-phospho-p38, anti-p38, anti-phospho-Ikbα and anti-Ikbα (Cell signaling technology, Beverly, MA, USA) antibodies. Next, after washing with TBS-T (0.05%), the blot was reacted with horseradish peroxidase-linked anti-rabbit antibody, and the band was subjected to the ECL system (Thermo Fisher Scienctific, USA). Was observed using. Band images were obtained using Molecular Imager ChemiDoc XRS + (Bio-Rad, Hercules, CA, USA) and band intensities were analyzed using Image Lab™ software version 2.0.1 (Bio-Rad).
1-6. 중뇌 도파민 신경세포의 생존에 있어 MCH의 기능1-6. Function of MCH in Survival of Midbrain Dopamine Neurons
중뇌 도파민 신경세포의 유지 및 생존에 있어 MCH의 기능을 알아보기 위하여, 하기와 같은 실험을 수행하였다.In order to investigate the function of MCH in the maintenance and survival of midbrain dopamine neurons, the following experiment was performed.
출생후, 1일된 마우스 중뇌로부터 일차 도파민 신경세포를 분리하였으며, 이를 배지에 분주한 후 5일 째 MCH를 처리하고 24시간 동안 배양시켰다. 상기 배양시킨 MCH를 처리한 도파민 신경세포를 포함한 배지에서 도파민 신경세포를 관찰하고 Tuj1 및 MAP2와 같은 신경세포 관련 유전자에 대해 면역형광염색을 수행하여 도파민 신경세포의 수를 확인하였다. 그 결과, MCH 처리에 의해 도파민 신경세포의 수가 증가하는 것을 확인하였다. 또한, 상기 MCH를 처리한 신경세포 배지에 항 MCH를 처리한 경우에는 도파민 신경세포의 수가 효과적으로 억제되는 것을 확인하였다(도 1 및 도 2).After birth, primary dopamine neurons were isolated from 1 day old mouse midbrain, which were dispensed into medium and treated with MCH on day 5 and incubated for 24 hours. Dopamine neurons were observed in a medium containing the cultured MCH treated dopamine neurons, and immunofluorescence staining was performed on neuron-related genes such as Tuj1 and MAP2 to confirm the number of dopamine neurons. As a result, it was confirmed that the number of dopamine neurons increased by MCH treatment. In addition, when anti-MCH was treated to the MCH-treated neuronal cell medium, it was confirmed that the number of dopamine neurons was effectively suppressed (FIGS. 1 and 2).
다음으로, MCH를 처리한 도파민 신경세포 배지를 이용하여 qRT-PCR를 수행하였다. 그 결과, 상기 MCH 처리에 의해 티로신수산화효소(tyrosine hydroxylase, TH), 도파민 트랜스포터(dopamine transporter, DAT), 방향족 l-아미노산 탈탄산카르복실화효소(aromatic l-amino acid decarboxylase, AADC) 및 미세소관 연관 단백질 2(microtubule associated protein 2, MAP2)를 포함하는 도파민(dopamine, DA) 마커 유전자의 발현이 증가함을 확인하였다(도 3).Next, qRT-PCR was performed using the dopamine neuron medium treated with MCH. As a result, tyrosine hydroxylase (TH), dopamine transporter (DAT), aromatic l-amino acid decarboxylase (AADC) and fine particles were treated by the MCH treatment. It was confirmed that the expression of dopamine (dopamine, DA) marker gene including microtubule associated protein 2 (MAP2) increased (FIG. 3).
또한, 도파민 신경세포 배지에 다양한 농도의 MCH를 처리한 후, TH, DAT, AADC 및 MAP2와 같은 도파민 신경세포 마커에 대한 qRT-PCR을 수행하였고 이를 분석하였다. 그 결과, MCH의 농도가 2 uM일 경우, 도파민 신경세포 수와 상기 마커의 발현이 가장 큰 증가율을 보여주었다(도 4 및 도 5).In addition, after treatment with various concentrations of MCH in the dopamine neuron medium, qRT-PCR for dopamine neuron markers such as TH, DAT, AADC and MAP2 was performed and analyzed. As a result, when the concentration of MCH is 2 uM, the dopamine neuron number and the expression of the marker showed the largest increase rate (Figs. 4 and 5).
1-7. 6-히드록시 도파민 또는 MPP+ 처리 후 중뇌 도파민 신경세포에서1-7. In midbrain dopamine neurons after 6-hydroxy dopamine or MPP + treatmentMCH의MCH 기능 function
다음으로, 중뇌 도파민 신경세포에서 파킨슨병 모델을 유발하는 약물을 처리한 후 MCH의 신경세포 보호효과를 알아보기 위해, 플레이팅 후 5일 째, MPP+ 또는 6-OHDA를 노출시킨 도파민 신경세포에 MCH를 처리하였다.Next, in order to investigate the neuroprotective effects of MCH after treatment with a drug that induces Parkinson's disease in mesenchymal dopamine neurons, 5 days after plating, the dopamine neurons exposed to MPP+ or 6-OHDA were exposed. MCH was treated.
도파민 신경세포의 수를 관찰하고 TH 및 MAP2에 대한 면역염색을 수행한 결과, MCH가 도파민 신경세포에서 MPP+ 또는 6-OHDA로부터 유도된 신경세포의 사멸을 회복시킴을 알 수 있었다(도 6 및 도 7). 또한, TH, DAT 및 synapsin에 대하여 qRT-PCR을 수행한 결과, 역시 MCH가 TH, DAT 및 synapsin 유전자의 발현을 증가시킴을 확인하였으며, 이에 의해 신경세포 보호효과를 가짐을 확인하였다(도 8).Observation of the number of dopamine neurons and immunostaining for TH and MAP2 showed that MCH restored the death of neurons derived from MPP+ or 6-OHDA in dopamine neurons (FIG. 6 and 7). In addition, as a result of performing qRT-PCR on TH, DAT and synapsin, it was confirmed that MCH also increased the expression of TH, DAT and synapsin genes, thereby having a neuronal protective effect (FIG. 8). .
따라서, 상기의 결과를 통해 MCH가 중뇌 도파민 신경세포의 유지 및 생존에 있어 중요한 역할을 수행하고 있음을 알 수 있었다.Therefore, it can be seen from the above results that MCH plays an important role in the maintenance and survival of midbrain dopamine neurons.
1-8. 도파민 신경세포에서 MCH의 신경보호 메커니즘1-8. Neuroprotective Mechanism of MCH in Dopamine Neurons
도파민 신경세포에서 보여주는 MCH의 신경세포 보호효과 메커니즘을 알아보기 위하여, MCH를 처리한 도파민 신경세포에서의 전체적 유전자 발현(global gene expression)을 분석하였다. 도파민 신경세포에 MCH를 처리하고 24시간 후, 이 도파민 신경세포의 전사체(transcriptome)를 분석하였고, 대조군과 전사 프로필(transcriptional profile)을 비교하였다. 그 결과, MCH가 전체적인 유전자 발현을 변화시킴을 확인하였고 그 중에 Akt 시그널링 관련 유전자의 발현이 MCH를 처리한 후 증가하는 것을 확인하였다(도 9).To investigate the neuroprotective effect of MCH on dopamine neurons, global gene expression in MCH-treated dopamine neurons was analyzed. 24 hours after MCH treatment of dopamine neurons, the transcriptome of the dopamine neurons was analyzed and the transcriptional profile was compared with the control group. As a result, it was confirmed that MCH changes the overall gene expression, among which the expression of Akt signaling-related genes increased after the treatment of MCH (Fig. 9).
또한, Akt 시그널링 단백질인 pCREB, pGSK-3β, pAkt 및 pERK에 대하여 웨스턴 블랏을 수행하였다. 그 결과, 상기 결과와 동일하게, 대조군(untreated culture)과 비교하여 MCH를 처리한 일차 도파민 신경세포에서 pCREB, pGSK-3β 및 pAkt를 포함하는 Akt 시그널링 단백질의 발현이 현저히 증가함을 확인하였다(도 10).In addition, Western blot was performed for the Akt signaling proteins pCREB, pGSK-3β, pAkt and pERK. As a result, it was confirmed that the expression of Akt signaling protein including pCREB, pGSK-3β and pAkt was significantly increased in primary dopamine neurons treated with MCH as compared with the control (untreated culture) (Fig. 10).
다음으로, 도파민 신경세포에서 MCH의 시그널링 경로를 알아보기 위해, MCH를 처리한 일차 도파민 신경세포에서 인산 특이적 항체(phospho-specific antibody)를 처리하여 CREB, Akt, GSK-3β 또는 ERK 활성을 확인하였다. 2mM의 MCH를 처리한 후 3시간이 되었을 때, 세포들을 수득하였고 각각의 항체를 이용하여 면역블롯을 수행하였다. 그 결과, 도 11에서 보듯이, CREB, GSK-3β 및 Akt의 인산화 수준은 MCH 처리에 의해 증가하였지만, ERK의 인산화 수준은 증가하지 않았다(도 11).Next, to determine the signaling pathway of MCH in dopamine neurons, the treatment of phospho-specific antibodies in primary dopamine neurons treated with MCH confirmed CREB, Akt, GSK-3β or ERK activity. It was. Three hours after treatment with 2 mM MCH, cells were obtained and immunoblot was performed with each antibody. As a result, as shown in Fig. 11, phosphorylation levels of CREB, GSK-3β and Akt were increased by MCH treatment, but the phosphorylation level of ERK was not increased (Fig. 11).
따라서, 상기의 결과를 통하여, MCH의 신경세포 보호 메커니즘에는 Akt 시그널링이 관여하고 Akt 시그널링에 있어서도 CREB, Akt, GSK-3β이 관여하고 ERK는 관여하지 않음을 알 수 있었다.Therefore, it can be seen from the above results that Akt signaling is involved in the neuronal cell protection mechanism of MCH, and CREB, Akt and GSK-3β are involved in Akt signaling, but not ERK.
1-9.1-9.MCH의MCH 신경세포 보호효과에 있어 In neuroprotective effect포스파티딜이노시톨Phosphatidyl Inositol 3-키나아제(phosphatidylinositol 3- 3-kinase (phosphatidylinositol 3-kinasekinase) 및) And프로테인Protein 키나아제(protein Kinaseskinasekinase A)의 관여 A) involvement
PI3K/Akt, 및 PKA/CREB가 도파민 신경세포에서 MCH의 신경세포 보호효과에 관여하는지 알아보기 위해, MCH를 처리한 일차 도파민 신경세포에 PI3K(LY294002) 및 PKA(H89) 시그널링 특이적인 억제제를 처리하여 Tuj1 및 MAP2에 대한 면역형광염색을 수행하였다. 그 결과, PI3K/Akt 및 PKA/CREB 시그널링 특이적인 억제제 LY294002 및 H89가 MCH에 의해 나타나는 신경세포 보호효과를 억제하였다(도 12 및 도 13).To investigate whether PI3K / Akt, and PKA / CREB are involved in the neuroprotective effects of MCH in dopamine neurons, we treated PI3K (LY294002) and PKA (H89) signaling specific inhibitors in MCH-treated primary dopamine neurons. Immunofluorescence staining for Tuj1 and MAP2 was performed. As a result, PI3K / Akt and PKA / CREB signaling specific inhibitors LY294002 and H89 inhibited the neuronal protective effect exhibited by MCH (FIGS. 12 and 13).
또한, MPP+로 유도된 도파민 신경세포에서도 MCH와 함께 PI3K(LY294002) 및 PKA(H89) 시그널링 특이적인 억제제를 처리하였다. 그 결과, MPP+로 유도된 도파민 신경세포 사멸(neuronal death)에 대한 MCH의 신경세포 보호효과가 PI3K/Akt 및 PKA/CREB의 억제제에 의해 억제되는 것을 확인하였다(도 14 및 도 15).In addition, MPP+ induced dopamine neurons were treated with MCH together with PI3K (LY294002) and PKA (H89) signaling specific inhibitors. As a result, it was confirmed that the neuronal protective effect of MCH against MPP+ induced dopamine neuronal death was inhibited by inhibitors of PI3K / Akt and PKA / CREB (FIGS. 14 and 15).
따라서, PI3K, PKA 시그널링 억제제를 이용하여 MCH에 의해 유도되는 도파민 신경세포 보호효과에 있어 Akt 및 CREB이 관여함을 알 수 있었다.Therefore, it was found that Akt and CREB are involved in the protective effect of dopamine neurons induced by MCH using PI3K and PKA signaling inhibitors.
1-10. 6-1-10. 6-OHDA로By OHDA 유도된 인간 신경모세포종 Induced human neuroblastomaSHSH--SY5YSY5Y 세포에서 In the cellMCH의MCH 신경세포 보호효과 Nerve cell protective effect
6-OHDA로 유도된 인간 신경모세포종 SH-SY5Y 세포에서 MCH의 신경세포 보호효과를 알아보기 위해, 24시간 동안 10 uM의 레티노산으로 세포를 분화시킨 후, 상기 세포에 100 uM의 6-OHDA를 50 또는 100 nM의 MCH와 함께 처리하거나 또는 MCH 없이 처리하였다. 그 결과, SH-SY5Y 세포에서 6-OHDA로 유도된 세포사멸은 100 nM의 MCH 처리에 의해서 상당히 억제됨을 확인하였다(도 16).To investigate the neuroprotective effects of MCH in 6-OHDA-induced human neuroblastoma SH-SY5Y cells, cells were differentiated with 10 uM of retinoic acid for 24 hours, and then 100 uM of 6-OHDA was applied to the cells. Treatments were performed with or without 50 or 100 nM MCH. As a result, it was confirmed that 6-OHDA-induced apoptosis in SH-SY5Y cells was significantly suppressed by 100 nM MCH treatment (FIG. 16).
다음으로, MCH의 신경세포 보호효과에 관여하는 시그널링 경로를 알아보기 위해, SH-SY5Y 세포에서 6-OHDA를 처리한 후, 웨스턴 블랏을 통해 Ikb-α 또는 p38의 인산화 수준을 확인하였다. 그 결과, MCH가 6-OHDA에 의해 유도되는 Ikb-α 또는 p38의 인산화를 억제함을 확인하였다(도 17 및 도 18).Next, in order to determine the signaling pathways involved in the neuronal protective effect of MCH, after treating 6-OHDA in SH-SY5Y cells, the phosphorylation level of Ikb-α or p38 was confirmed by Western blot. As a result, it was confirmed that MCH inhibits phosphorylation of Ikb-α or p38 induced by 6-OHDA (FIGS. 17 and 18).
따라서, 상기 결과를 통해 MCH가 Ikb-α 또는 p38의 활성화를 억제함으로써 신경세포에서 강한 보호효과를 나타냄을 알 수 있었다.Therefore, the results showed that MCH exhibited a strong protective effect in neurons by inhibiting the activation of Ikb-α or p38.
실시예 2: MPTP로 유도된 파킨슨병 모델 동물에서 MCH의 효과Example 2 Effect of MCH in MPTP-Induced Parkinson's Disease Model Animals
2-1. MPTP로 유도된 파킨슨병 모델 동물 준비2-1. MPTP-induced Parkinson's Disease Model Animal Preparation
몸무게가 23~25 g이고 12주된 수컷 C57BL/6 마우스(Central Laboratories Animal Inc, Republic of Korea)를 12시간은 빛, 12시간은 어둠을 주기로 하여 유지하였고 물과 음식에 대해 자유롭게 접근을 가능하게 하였으며 방 온도는 23±1°C로 유지하였다. 모든 실험은 동물 복지를 위한 경희대학교 동물 보호 위원회의 승인을 받았다.The 12-week-old male C57BL / 6 mouse (Central Laboratories Animal Inc, Republic of Korea), weighing 23-25 g, was kept for 12 hours in light and 12 hours in dark, and free access to water and food. Room temperature was maintained at 23 ± 1 ° C. All experiments were approved by Kyung Hee University Animal Protection Committee for Animal Welfare.
먼저, 마우스를 무작위로 6개의 그룹으로 나누었다: CON (대조군, n=5), MPTP (MPTP만 처리, n= 5), AP (MPTP + 경혈에 침술 치료, n=5), CP (MPTP + 대조군 지점에 침술 치료, n= 5), MCH (MPTP+MCH, i.n., n=5), 및 aMR1 (MPTP+AP+ MCH-R1 길항제, i.p.). 모든 그룹들은 5일 동안 MPTP(30mg/kg, 염류용액에 용해; Sigma-Aldrich, MO, USA) 또는 염류용액(saline)을 복강 내 주입하였다. First, mice were randomly divided into six groups: CON (control, n = 5), MPTP (MPTP only treatment, n = 5), AP (MPTP + acupuncture treatment on menstrual blood, n = 5), CP (MPTP + Acupuncture treatment at control points, n = 5), MCH (MPTP + MCH, in, n = 5), and aMR1 (MPTP + AP + MCH-R1 antagonist, ip). All groups were intraperitoneally injected with MPTP (30 mg / kg, dissolved in saline solution; Sigma-Aldrich, MO, USA) or saline for 5 days.
2-2. MCH 주입2-2. MCH Injection
비강에서 뇌로 약물을 전달하기 위해 혈액뇌관문을 우회하는 비침입성 방법인 비강 내 주입방법으로 MCH를 주입하였다. 비록 대뇌심실내부의(intracerebroventricular) 주입이 특정약물의 뇌 특이적인 전달에 있어 광범위하게 사용되고 있으나, 이는 침입적인 방법이고 실험동물을 마취시킬 필요가 있다. 그러므로 뇌로 MCH를 전달하기 위해 차선의 방법으로 비강 내 주입을 선택하였다. 비강 내 주입은 De Rosa et al., 2005에서 기술한 대로 수행하였다. MCH(Tocris biosciences, Bristol, UK)는 MPTP 주입 후 2시간이 지나 마우스에 비강 내로 주입하였다. 주입 전, MCH는 염류용액(saline, 0.5mg/30μL)에 용해시켜 4 ℃에 보관하였다. 모든 마우스는 바로 선 자세로 머리와 목을 잡고 움직이지 않도록 하였으며, 15 ㎕의 MCH 용액을 하나의 비강 안으로 약 15초 동안 피펫으로 천천히 주입하였다. 2분 내지 3분 후에, 다른 콧구멍에서 같은 주입을 반복하였다. 다른 그룹의 마우스들은 염류용액(i.n.)을 주입하였다.MCH was injected by intranasal injection, a noninvasive method that bypasses the blood brain barrier to deliver drugs from the nasal cavity to the brain. Although intracerebroventricular injection is widely used for brain specific delivery of certain drugs, it is an invasive method and needs to anesthetize the experimental animal. Therefore, intranasal injection was chosen as the next best method for delivering MCH to the brain. Intranasal infusion was performed as described in De Rosa et al., 2005. MCH (Tocris biosciences, Bristol, UK) was injected intranasally into
2-3. 면역화학염색2-3. Immunochemical staining
동물들은 첫 MPTP 또는 염류용액을 주입 후 12일째에 희생시켰고 4 % 파라포름알데하이드를 포함하는 0.2 M 인산 완충용액을 이용하여 경심관류로 관류하였다(perfused). 뇌는 제거하였고 이후 고정하였으며(postfixed), 동결보존하였다(cryoprotected). 면역화학염색은 Hirsch & Faucheux, 1998; Hirsch et al., 1998에서 기술한대로 흑질(substantia nigra) 및 선조체(마우스 뇌의 아틀라스를 따라 중뇌의 브레그마로부터 AP -3.08 ~ -3.28 mm 사이 수준 및 선조체의 브레그마로부터 AP +0.38 ~ +0.98의 사이 수준)를 포함하는 프리-플로팅 동결조직절편기-컷 섹션(free-floating cryomicrotome-cut sections)에서 수행하였다(Keith & Franklin, 2008).Animals were sacrificed 12 days after the first MPTP or saline solution and perfused perfused with 0.2 M phosphate buffer containing 4% paraformaldehyde. The brain was removed and then postfixed and cryoprotected. Immunohistochemical staining is described in Hirsch & Faucheux, 1998; As described in Hirsch et al., 1998, substantia nigra and striatum (levels between AP -3.08 to -3.28 mm from Brema of midbrain along atlas of mouse brain and AP +0.38 to +0.98 from stragna of striatum) And free-floating cryomicrotome-cut sections (Keith & Franklin, 2008).
다음으로, 흑질을 염색하기 위해, Hirsch & Faucheux, 1998; Hirsch et al., 1998에서 기술한 대로 면역화학염색법을 수행하였다. 3 % H2O2를 포함하는 0.05 M 인산-완충 식염수(phosphate-buffered saline)에서 반응시킨 후 섹션은 1 % BSA 및 일반적인 염소 혈청으로 블로킹했다. 그리고 나서, 조직 섹션은 1차 항체로 실온에서 밤새도록 반응시켰다. 토끼의 TH (1:1,000; Santa Cruz Biotechnology, Santa Cruz, CA, USA)는 1차 항체로서 사용하였다. 조직 섹션은 바이오틴이 결합된 항토끼 IgG(Vector Laboratories Inc., Burlingame, CA, USA)로 1시간 동안 실온에서 반응시켰으며, ABC 시약(Vector Laboratories Inc., Burlingame, CA, USA)으로 1시간 동안 실온에서 반응시켰고, 0.02 % 디아미노벤지딘 및 0.003 % 과산화 수소를 포함한 1 M 트리스-완충 식염수(pH 7.5)에서 2분 동안 반응시켰다. 반응 후, 조직섹션은 젤라틴으로 코팅된 슬라이드에 고정시키고 말렸으며, 물을 제거하고 커버를 덮었다. 브라이트필드(brightfield) 현미경(BX51; Olympus, Tokyo, Japan)을 사용하여, 선조체 및 흑질의 사진을 찍었다. 예상되는 결과를 모르는 3명의 독립적 관찰자가 흑질에서 TH-양성인 신경세포를 카운팅했다. 카운팅된 세포는 데이터의 유효성을 위해 3번 확인하였다.Next, to dye black matter, Hirsch & Faucheux, 1998; Immunohistochemical staining was performed as described in Hirsch et al., 1998. After reaction in 0.05 M phosphate-buffered saline containing 3% H2 O2 , sections were blocked with 1% BSA and normal goat serum. Tissue sections were then reacted overnight at room temperature with the primary antibody. Rabbit TH (1: 1,000; Santa Cruz Biotechnology, Santa Cruz, CA, USA) was used as the primary antibody. Tissue sections were reacted with biotin-conjugated anti-rabbit IgG (Vector Laboratories Inc., Burlingame, CA, USA) for 1 hour at room temperature, and for 1 hour with ABC reagent (Vector Laboratories Inc., Burlingame, CA, USA). The reaction was carried out at room temperature and for 2 minutes in 1 M Tris-buffered saline (pH 7.5) containing 0.02% diaminobenzidine and 0.003% hydrogen peroxide. After the reaction, the tissue sections were fixed and dried on gelatin-coated slides, water was removed and the cover was covered. Photographs of striatum and black matter were taken using a brightfield microscope (BX51; Olympus, Tokyo, Japan). Three independent observers who did not know the expected results counted TH-positive neurons in the black matter. Counted cells were checked three times for validity of the data.
2-4. 웨스턴 블랏2-4. Western Blot
흑질(substantia nigra, SN)은 50 mM 트리스-베이스 (pH 7.5), 150 mM 염화나트륨, 2 mM EDTA, 1% 글리세롤, 10 mM 플루오린화나트륨(NAF), 10 mM 나트륨-파이로포스페이트(Na-pyrophosphate), 1% NP-40 및 프로테아제 억제제 (0.1 mM 페닐메틸설포닐플루오라이드(phenylmethylsulfonylfluoride), 5 μg/ml 아프로티닌(aprotinin), 및 5 μg/ml 루펩틴(leupeptin))를 포함하는 용해액에서 균질화하였다. 30 μg의 용해물(lysate)을 10% SDS-폴리아크릴아마이드 젤에서 전기영동하였고 니트로셀룰로오스 멤브레인으로 이동시킨 후, 16시간 동안 4 ℃에서 항-시냅토피신 및 항-β-액틴(Cell signaling technology, Beverly, MA, USA) 및 항-TH(Santa Cruz Biotechnology, CA, USA) 항체와 함께 반응시켰다. TBS-T (0.05%)로 세척한 후, 블랏을 홀스라디쉬 퍼옥시데이즈(horseradish peroxidase)-연결된 항-토끼 항체와 함께 반응시켰고, 그 밴드는 ECL system (Thermo Fisher Scienctific, USA)를 사용하여 관찰하였다. 밴드 이미지는 Molecular Imager ChemiDoc XRS+ (Bio-Rad, Hercules, CA, USA)를 사용하여 얻었고 밴드의 강도는 Image LabTM 소프트웨어 버전 2.0.1 (Bio-Rad)를 이용하여 분석하였다.Substantia nigra (SN) contains 50 mM tris-base (pH 7.5), 150 mM sodium chloride, 2 mM EDTA, 1% glycerol, 10 mM sodium fluoride (NAF), 10 mM sodium-pyrophosphate (Na-pyrophosphate). ), 1% NP-40 and a protease inhibitor (0.1 mM phenylmethylsulfonylfluoride, 5 μg / ml aprotinin, and 5 μg / ml leupeptin) Homogenized. 30 μg of lysate was electrophoresed on 10% SDS-polyacrylamide gels and transferred to nitrocellulose membrane, followed by anti-synaptopycin and anti-β-actin (Cell signaling technology at 4 ° C. for 16 hours). , Beverly, MA, USA) and anti-TH (Santa Cruz Biotechnology, CA, USA) antibodies. After washing with TBS-T (0.05%), the blots were reacted with horseradish peroxidase-linked anti-rabbit antibodies and the bands were subjected to the ECL system (Thermo Fisher Scienctific, USA). Observed. Band images were obtained using Molecular Imager ChemiDoc XRS + (Bio-Rad, Hercules, Calif., USA) and band intensities were analyzed using Image Lab™ software version 2.0.1 (Bio-Rad).
2-5. MPTP로 유도된 파킨슨병 모델 동물에서 MCH의 효과2-5. Effects of MCH in MPTP-induced Parkinson's Disease Model Animals
MPTP를 처리한 마우스에서 MCH가 도파민 신경세포 보호효과에 있어 중요한 역할을 하는지 알아보기 위해, MPTP로 유도된 파킨슨병 모델에서 MCH의 효과를 하기의 실험을 통해 확인하였다.To determine whether MCH plays an important role in the dopamine neuron protective effect in MPTP-treated mice, the effects of MCH in MPTP-induced Parkinson's disease model were confirmed by the following experiment.
그 결과, MPTP를 처리한 마우스에 MCH를 비강 내로 주입한 것은 확실히 효과적이었다. MCH를 주입한 그룹은 MPTP만을 처리한 그룹보다 마우스의 흑질에서 TH-양성 신경세포가 상당히 많았고(P<0.001)(도 19), 또한, 선조체에서 TH-양성 섬유의 밀도가 높았다(도 20). 상기의 실험결과와 유사하게, 로타로드 시험(rotarod test)를 수행한 결과에서도 MCH가 운동기능을 개선시킴을 확인하였다(도 21).As a result, it was certainly effective to inject MCH intranasally into mice treated with MPTP. The group injected with MCH had significantly more TH-positive neurons in the black matter of the mouse than the group treated with MPTP only (P <0.001) (FIG. 19), and the density of TH-positive fibers in the striatum was higher (FIG. 20). . Similar to the above experimental results, it was confirmed that MCH improves the motor function even in the results of the rotarod test (FIG. 21).
2-6.2-6.MPTP를MPTP 처리한 마우스에서 티로신수산화효소(tyrosine Tyrosine Hydroxylase in Treated Micehydroxylasehydroxylase), 시냅토파이신(synaptophysin), pAkt 및 pCREB에 대한 MCH의 효과), The effect of MCH on synaptophysin, pAkt and pCREB
MCH의 신경세포 보호효과를 확인하기 위해, 흑질에서 TH 및 시냅토파이신의 발현을 확인하였다. 그 결과, MPTP로 유도된 흑질에서 TH 및 시냅토파이신의 발현은 감소되었지만, MCH를 주입한 마우스의 흑질에서 TH 및 시냅토파이신 단백질의 발현은 상당히 회복되었다(도 22 및 도 23).In order to confirm the neuronal protective effect of MCH, the expression of TH and synaptopycin in black matter was confirmed. As a result, the expression of TH and synaptopycin in MPTP-induced black matter was reduced, but the expression of TH and synaptopycin protein was significantly restored in black matter in mice injected with MCH (FIGS. 22 and 23).
다음으로, 뇌에서 MCH 주입 또는 침술에 따른 시그널링 경로를 확인하기 위해, MPTP를 처리한 마우스로부터 분리한 흑질에서 Akt 및 CREB의 인산화 수준을 확인하였다. 그 결과, 도 24 및 도 25에서 볼 수 있듯이, Akt 및 CREB의 인산화 수준은 MPTP를 처리한 마우스의 흑질에서 감소하였지만, MCH를 주입 또는 침술을 한 마우스의 흑질에서는 회복되었다(도 24 및 도 25).Next, in order to confirm signaling pathways following MCH injection or acupuncture in the brain, phosphorylation levels of Akt and CREB were confirmed in black matter isolated from mice treated with MPTP. As a result, as shown in FIGS. 24 and 25, phosphorylation levels of Akt and CREB decreased in the black matter of MPTP-treated mice, but recovered in the black matter of MCH-infused or acupuncture mice (FIGS. 24 and 25). ).
실시예 3. A53T 알파-시누클레인 형질전환 마우스에서 MCH의 효과Example 3 Effect of MCH in A53T Alpha-Synuclein Transgenic Mice
3-1. 형질전환 마우스3-1. Transgenic mouse
A53T 알파-시누클레인(B6; C3-Tg-Prnp/SNCA*A53T/83Vle/J) 이형의 브리더(heterozygous breeder)는 잭슨 실험실(Bar Harbor, ME, USA)에서 구입하였고, A53T 형질전환 및 비형질전환 한배 새끼를 얻기 위해 사육하였다. 형질전환 마우스를 동정하기 위해, 센스(5`- TGT AGG CTC CAA AAC CAA GG -3`, 서열번호 1)와 안티센스(5`- TGT CAG GAT CCA CAG GCA TA -3`, 서열번호 2) 프라이머를 사용하여 표준 PCR을 수행하였고 1.5 % 아가로스 젤에서 전기영동을 통해 분석하였다. 유전형이 분석된 마우스는 12시간 명/암 주기로 온도와 습도가 조절되는 방에서 물과 음식을 자유롭게 먹을 수 있도록 사육되었다. MCH(Tocris biosciences, Bristol, UK)는 염류용액(0.5mg/30μL)에서 용해하였고 4 ℃에 보관하였다. 그리고 나서, 마우스의 목을 고정시켜 15 uL의 MCH 약물을 천천히 피펫으로 주입하였다. 상기 과정을 5분 후에 반복하였다. 대조군(CON) 그룹은 염류용액으로 처리하였다. 10개월에서 12개월 된 수컷 형질전환 마우스는 무작위로 두 그룹으로 나누었다: 대조군 그룹(n=5) 및 MCH를 주입한 그룹(n=5), 각 그룹은 4주 동안 염류용액 또는 MCH를 매일 비강 내로 주입하였다. 영양상태를 검사하기 위해 체중증가량을 매주 측정하였고 4주 동안 같은 시간에 매 주마다 음식 섭취량을 기록하였다.Heterozygous breeder of A53T alpha-synuclein (B6; C3-Tg-Prnp / SNCA* A53T / 83Vle / J) variant was purchased from Jackson Laboratories (Bar Harbor, ME, USA), and A53T transgenic and non-transformant Breeding was obtained to obtain litters. To identify transgenic mice, the sense (5′- TGT AGG CTC CAA AAC CAA GG-3 ′, SEQ ID NO: 1) and antisense (5′- TGT CAG GAT CCA CAG GCA TA-3 ′, SEQ ID NO: 2) primers Standard PCR was performed using and analyzed by electrophoresis on 1.5% agarose gel. Genotyped mice were reared free of water and food in a temperature and humidity controlled room at 12 hour light / dark cycles. MCH (Tocris biosciences, Bristol, UK) was dissolved in salt solution (0.5 mg / 30 μL) and stored at 4 ° C. Then, the neck of the mouse was fixed and 15 uL of MCH drug was slowly pipetted. The process was repeated after 5 minutes. The control group (CON) was treated with saline solution. Male
3-2. 행동실험3-2. Behavioral experiment
4주째, 로타로드 실험을 수행하여 마우스의 행동방식을 측정하였다. 마우스는 실험 한 시간 전에 가속중인 로드 스피드 모드에서 2분 동안 미리 연습하였다.At 4 weeks, a rotarod experiment was performed to measure the behavior of the mice. Mice were pre-trained for 2 minutes in accelerated road speed mode one hour before the experiment.
로드 위에 있었던 시간은 연속적인 로드 스피드에서 최고 480초를 기록하였다. 떨어지는 시간(latency time)도 분석하였다.The time on the road was up to 480 seconds at continuous load speed. Latency time was also analyzed.
3-3. 웨스턴 블랏3-3. Western Blot
웨스턴블랏팅을 위해서, 세포 및 흑질은 50 mM 트리스-베이스 (pH 7.5), 150 mM 염화나트륨, 2 mM EDTA, 1% 글리세롤, 10 mM 플루오린화나트륨(NAF), 10 mM 나트륨-파이로포스페이트(Na-pyrophosphate), 1% NP-40 및 프로테아제 억제제 (0.1 mM 페닐메틸설포닐플루오라이드(phenylmethylsulfonylfluoride), 5 μg/ml 아프로티닌(aprotinin), 및 5 μg/ml 루펩틴(leupeptin))를 포함하는 용해액에서 균질화하였다. 30 μg의 용해물(lysate)을 10% SDS-폴리아크릴아마이드 젤에서 전기영동하였고 니트로셀룰로오스 멤브레인으로 이동시킨 후, 16시간 동안 4 ℃에서 항-포스포 Thr172AMPKa, 항-AMPKa, 항-BDNF 항체, 항-시누클레인, 및 항-β-액틴(Cell signaling technology, Beverly, MA, USA), 항-TH(Santa Cruz Biotechnology, CA, USA) 항체와 반응시켰다. TBS-T (0.05%)로 세척한 후, 블랏을 홀스라디쉬 퍼옥시데이즈(horseradish peroxidase)-연결된 항-토끼 항체와 함께 반응시켰고, 그 밴드는 ECL system (Thermo Fisher Scienctific, USA)를 사용하여 관찰하였다. 밴드 이미지는 Molecular Imager ChemiDoc XRS+ (Bio-Rad, Hercules, CA, USA)를 사용하여 얻었고 밴드의 강도는 Image LabTM software version 2.0.1 (Bio-Rad)를 이용하여 분석하였다.For western blotting, cells and black matter were treated with 50 mM tris-base (pH 7.5), 150 mM sodium chloride, 2 mM EDTA, 1% glycerol, 10 mM sodium fluoride (NAF), 10 mM sodium-pyrophosphate (Na dissolution including -pyrophosphate), 1% NP-40 and protease inhibitor (0.1 mM phenylmethylsulfonylfluoride, 5 μg / ml aprotinin, and 5 μg / ml leupeptin) Homogenized in solution. 30 μg of lysate was electrophoresed on a 10% SDS-polyacrylamide gel and transferred to nitrocellulose membrane, followed by anti-phospho Thr172 AMPKa, anti-AMPKa, anti-BDNF at 4 ° C. for 16 hours. React with antibodies, anti-synuclein, and anti-β-actin (Cell signaling technology, Beverly, MA, USA), anti-TH (Santa Cruz Biotechnology, CA, USA) antibodies. After washing with TBS-T (0.05%), the blots were reacted with horseradish peroxidase-linked anti-rabbit antibodies and the bands were subjected to the ECL system (Thermo Fisher Scienctific, USA). Observed. Band images were obtained using Molecular Imager ChemiDoc XRS + (Bio-Rad, Hercules, CA, USA) and band intensities were analyzed using Image Lab™ software version 2.0.1 (Bio-Rad).
3-4.3-4.A53TA53T 알파- Alpha-시누클레인Synuclein 형질전환 마우스에서 운동기능, Motor function in transgenic mice,pGSKpGSK--3β3β, pAMPK, 시누클레인 및 뇌유래신경영양인자 단백질 발현에 있어서 MCH의 효과of MCH on the expression of protein, pAMPK, synuclein, and brain-derived leucine management factors
A53T 알파-시누클레인 형질전환 마우스에서 MCH의 효과를 확인하기 위하여, MCH를 주입한 그룹과 주입하지 않은 그룹, 두 그룹으로 나누어 실험을 진행하였다.In order to confirm the effect of MCH in A53T alpha-synuclein transgenic mice, the experiment was divided into two groups, the group injected with MCH and the group not injected.
MCH를 주입하기 전, 두 그룹의 로드 위에 있던 시간(latency time)은 차이가 없었다. 4주 째, MCH를 주입한 그룹은 MCH를 주입하지 않은 그룹보다 로타로드 테스트에서 로드 위에 훨씬 오래 있었다(p<0.01)(도 26). 또한, 두 그룹 간의 체중 및 섭취량에서도 차이가 없었다.Prior to injecting MCH, the latency time on the loads of the two groups was not different. At 4 weeks, the group injected with MCH was much longer on the rod in the rotarod test than the group not injected with MCH (p <0.01) (FIG. 26). There was also no difference in body weight and intake between the two groups.
A53T 알파-시누클레인 형질전환 마우스에서 MCH의 작용 메커니즘을 조사하기 위하여, 흑질에서 Akt의 타겟으로서 GSK3β의 인산화, AMPK의 인산화, 뇌유래신경영양인자(Brain-derived neurotrophic factor, BDNF) 발현, AMPK의 다운스트림 타겟으로써 시누클레인(synuclein)의 발현을 확인하였다. 그 결과, MCH가 A53T 알파-시누클레인 형질전환 마우스의 흑질에서 GSK3-β 및 AMPK의 인산화 발현을 증가시켰고 BDNF 단백질의 발현 역시 증가시켰으며, 시누클레인 단백질의 발현은 감소시켰다(도 27 내지 도 30).To investigate the mechanism of action of MCH in A53T alpha-synuclein transgenic mice, phosphorylation of GSK3β, phosphorylation of AMPK, brain-derived neurotrophic factor (BDNF) expression, and down-ampling of AMPK as targets of Akt in the black matter Expression of synuclein was confirmed as a stream target. As a result, MCH increased phosphorylation expression of GSK3-β and AMPK in black matter of A53T alpha-synuclein transgenic mice, increased expression of BDNF protein, and decreased expression of synuclein protein (FIGS. 27-30). ).
4. 6-4. 6-히드록시도파민으로With hydroxydopamine 유도되는 파킨슨병 모델에서 In induced Parkinson's disease model레보도파로Levodoparo 유발되는 부작용에 있어 MCH의 효과 Effect of MCH on the Evoked Side Effects
4-1. 동물 모델 준비4-1. Animal model preparation
각각 24-26 g의 무게를 가지는 9주된 수컷 C57BL/6 마우스(Central Lab. Animal Inc., Seoul, Republic of Korea)를 사용하였다. 모든 실험은 동물 복지를 위한 경희대학교 동물 보호 위원회의 승인을 받았고, NIH 및 대한의학회의 가이드라인에 따라 엄격하게 유지하였다. 입체 정위 시술(stereotaxic surgery)은 마우스의 스트리아타(striata)에서 편측 6-OHDA 병변(unilateral 6-OHDA lesions)을 만들어 수행하였다.Nine week old male C57BL / 6 mice (Central Lab. Animal Inc., Seoul, Republic of Korea) weighing 24-26 g each were used. All experiments were approved by the Kyung Hee University Animal Protection Committee for Animal Welfare and were strictly maintained according to the guidelines of the NIH and the Korean Medical Association. Stereotaxic surgery was performed to create unilateral 6-OHDA lesions in striata of mice.
4-2. 편측 병변에 대한 입체 정위 시술4-2. Stereotactic Stereotactic Procedures for Unilateral Lesions
입체 정위 시술을 위해서, 마우스를 틸레타마인 + 졸라제팜(tiletamine + zolazepam, 30 mg/kg; Zoletil 50, Virbac, France) 및 자일라진(xylazine, 10 mg/kg; Rompun, Bayer Korea, Republic of Korea)을 포함하는 생리식염수로 마취시켰고 마우스 어답터(mouse adaptor, Stoelting Co., USA)로 정위적 틀(stereotactic frame)에서 고정시켰다. 6-OHDA-HCl 혼합액(3.0 mg/ml; Sigma Aldrich, USA)은 0.02 % 아스코르브산-기반 생리식염수에 용해시켰다. 마우스에는 마우스의 뇌 아틀라스(atlas)에 따라 편측으로 우측 선조체에 염류용액 또는 6-OHDA를 주입하였다: +1.0 mm of AP, -2.1 mm of ML, -3.2 mm of DV; 및 +0.3 mm of AP, -2.3 mm of ML, -3.2 mm of DV(BJ and GP, 2008). 각각의 주입률(flow rate)은 0.5 ㎕/min이다.For stereopositional procedures, mice were treated with tiletamine + zolazepam (30 mg / kg;
4-3. 비정상불수의 운동(AIM) 수치4-3. Abnormal Involuntary Movement (AIM) Levels
레보도파로 유발되는 운동장애(levodopa induced dyskinesia, LID)를 정량화하기 위해, 관찰자(blinded observer)가 비정상 행동을 평가할 수 있도록 분리된 케이지에 각각의 마우스를 두었다. 레보도파 또는 운반체(vehicle, Cenci et al., 1998)를 주입한 후 20분부터 140분까지 20분마다 각각 관찰하였다. 그들이 보여주는 행동이 다음 조건들을 만족시킨다면 LID에 의한 움직임이라고 간주하였다: (1) 레보도파 주입 후 개선된 움직임 (2) 병변의 반대편으로 향하는 움직임 (3) 반복적이고 목적이 없고 명확히 자연스럽지 않은 움직임.To quantify levodopa induced dyskinesia (LID), each mouse was placed in a separate cage to allow blind observers to assess abnormal behavior. After injection of levodopa or vehicle (vehicle, Cenci et al., 1998), 20 minutes to 140 minutes were observed every 20 minutes. The behavior they showed was considered to be a movement by the LID if they met the following conditions: (1) improved movement after levodopa injection (2) movement towards the opposite side of the lesion (3) repetitive, purposeless and clearly unnatural movement.
그리고 나서, AIM 수치를 하위유형을 분리하였다: (1) 축의 AIM(axial AIM), 반대편을 향해 몸과 목을 비틀은 자세; (2) 사지 AIM, 반복적이고 규칙적인 경련 또는 앞다리의 근긴장이상 자세; 및 (3) 입 및 혀의 AIM(orolingual AIM), 비정상 저작 움직임 및 때때로 혀의 과장된 움직임. 이러한 하위유형을 수치화하기 위해, 이상운동증은 빈도수를 반영하는 4점 규모로 수치화하였다(0, 없음; 1, 때때로; 2, 자주; 3, 외부의 자극에 의해 중단되지만 계속적인; 4, 외부의 자극에 의해 중단되지 않고 계속적이고 심각한). 수치화 후, 각 그룹의 비교를 위해, AIM 수치의 3가지 하위유형(축, 사지, 오로링구어 AIM)을 통합하였다.Then, the AIM values were subtyped: (1) AIM (axial AIM), twisting body and neck toward the opposite side; (2) limb AIM, repetitive and regular spasm or dystonia of the forelimbs; And (3) orolingual AIM (AIM) of the mouth and tongue, abnormal chewing movements and sometimes tongue exaggerated movements. To quantify this subtype, dyskinesia was quantified on a 4-point scale that reflects frequency (0, none; 1, sometimes; 2, frequent; 3, interrupted by an external stimulus but continued; 4, external Continuous and serious without being interrupted by the stimulus). After quantification, for comparison of each group, three subtypes of AIM values (axis, limb, ororingur AIM) were integrated.
4-4.4-4.레보도파에Levodopa 의해 유발된 비정상 불수의 운동에 있어 In the abnormal involuntary movement caused byMCH의MCH 효과 effect
레보도파에 의해 유발된 부작용에 있어 MCH의 효과를 알아보기 위해, L-도파 주입 후 AIM 수치를 평가하였다.To determine the effect of MCH on the side effects caused by levodopa, AIM levels were evaluated after L-dopa injection.
그 결과, L-도파(20 mg/kg)를 투여한 그룹은 6-OHDA 그룹 및 대조군과 비교하여 이상운동증(p<0.05)이 더 많이 유발되었다. 또한, L-도파와 함께 MCH(0.5 mg/kg)를 주입한 그룹은 L-도파만을 투여한 그룹들보다(p<0.05) 이상운동증이 더 적게 유발되었다(도 31). AIM 수치의 하위 분석(sub-analysis)은 AIM 수치의 모든 하위 카테고리(subcategories)도 이런 경향을 가지고 있음을 보여주었다.As a result, the group administered with L-dopa (20 mg / kg) induced more dyskinesia (p <0.05) compared with the 6-OHDA group and the control group. In addition, the group injected with MCH (0.5 mg / kg) with L-dopa induced less dyskinesia than the group that received only L-dopa (p <0.05) (FIG. 31). Sub-analysis of AIM levels showed that all subcategories of AIM levels also had this tendency.
Claims (10)
Translated fromKoreanApplications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2015-0102459 | 2015-07-20 | ||
| KR1020150102459AKR101749675B1 (en) | 2015-07-20 | 2015-07-20 | Pharmaceutical composition for inhibition of levodopa induced side effect and treatment of Parkinson's disease comprising melanin concentrating hormone |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2017014545A1true WO2017014545A1 (en) | 2017-01-26 |
Family
ID=57834905
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/KR2016/007884CeasedWO2017014545A1 (en) | 2015-07-20 | 2016-07-20 | Pharmaceutical composition for treating parkinson's disease and inhibiting side effects of levodopa, containing melanin concentrating hormone as active ingredient |
Country Status (2)
| Country | Link |
|---|---|
| KR (1) | KR101749675B1 (en) |
| WO (1) | WO2017014545A1 (en) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102001338B1 (en) | 2018-02-08 | 2019-07-17 | 동국대학교 경주캠퍼스 산학협력단 | Pharmaceutical Composition comprising the Extracts of Mixed Crude Drugs for the Prevention or Treatment of the Parkinson's Disease |
| WO2025080080A1 (en)* | 2023-10-10 | 2025-04-17 | 한양대학교 산학협력단 | Pharmaceutical composition for preventing or treating parkinson's disease, containing pdk inhibitor as active ingredient |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5210076A (en)* | 1988-09-13 | 1993-05-11 | Berliner David L | Methods of treating Parkinson's disease using melanin |
| US20030031707A1 (en)* | 1997-04-08 | 2003-02-13 | Alan A. Rubin | Treatment of parkinson's disease and related disorders by novel formulations of the combination carbidopa-levodopa |
| KR20100088136A (en)* | 2007-10-12 | 2010-08-06 | 노파르티스 아게 | Metabotropic glutamate receptor modulators for the treatment of parkinson's disease |
| KR20150017763A (en)* | 2012-06-11 | 2015-02-17 | 싸이코제닉스 아이엔씨. | Treatment of motor and movement disorder side effects asscoated with parkinson's disease treatments |
- 2015
- 2015-07-20KRKR1020150102459Apatent/KR101749675B1/enactiveActive
- 2016
- 2016-07-20WOPCT/KR2016/007884patent/WO2017014545A1/ennot_activeCeased
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5210076A (en)* | 1988-09-13 | 1993-05-11 | Berliner David L | Methods of treating Parkinson's disease using melanin |
| US20030031707A1 (en)* | 1997-04-08 | 2003-02-13 | Alan A. Rubin | Treatment of parkinson's disease and related disorders by novel formulations of the combination carbidopa-levodopa |
| KR20100088136A (en)* | 2007-10-12 | 2010-08-06 | 노파르티스 아게 | Metabotropic glutamate receptor modulators for the treatment of parkinson's disease |
| KR20150017763A (en)* | 2012-06-11 | 2015-02-17 | 싸이코제닉스 아이엔씨. | Treatment of motor and movement disorder side effects asscoated with parkinson's disease treatments |
Non-Patent Citations (2)
| Title |
|---|
| LEE: "A Novel Target for L-dopa Induced Dyskinesia in Parkinson's Disease: the Role of Melanin Concentrating Hormone", MASTER'S THESIS OF KYUNGHEE UNIVERSITY, February 2016 (2016-02-01)* |
| THANVI ET AL.: "Levodopa-induced Dyskinesia in Parkinson's Disease: Clinical Features, Pathogenesis, Prevention and Treatment", POSTGRADUATE MEDICAL JOURNAL, vol. 83, 2007, pages 384 - 388, XP055348991* |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20170010947A (en) | 2017-02-02 |
| KR101749675B1 (en) | 2017-06-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2017078499A2 (en) | Composition for prevention or treatment of neuroinflammatory disease, containing protein tyrosine phosphatase inhibitor | |
| WO2022131791A1 (en) | Composition for preventing or treating neurological diseases related to copper metabolism, comprising multi-copper oxidase peptide | |
| WO2018097628A2 (en) | Composition for promoting differentiation of and protecting neural stem cells and method for inducing neural regeneration using same | |
| WO2017048072A1 (en) | Myocyte differentiation-promoting composition containing amino acids | |
| WO2021015437A1 (en) | Composition for preventing, treating, or ameliorating viral infection disease, containing active oxygen production inhibitor and active oxygen scavenger complex as active ingredients | |
| WO2009093864A2 (en) | Composition for preventing or treating brain diseases | |
| WO2020106048A1 (en) | Pharmaceutical composition for prevention or treatment of neurodegenerative disease | |
| WO2017043935A1 (en) | Composition for preventing or treating muscle weakness related diseases comprising sobrerol | |
| WO2017014545A1 (en) | Pharmaceutical composition for treating parkinson's disease and inhibiting side effects of levodopa, containing melanin concentrating hormone as active ingredient | |
| WO2023177128A1 (en) | Composition comprising alox5 inhibitor for preventing or treating sarcopenia | |
| WO2013022139A1 (en) | Method for treatment of diseases caused by accumulation of beta-amyloids in brain parenchyma with low concentration thiazolidinedione derivatives | |
| WO2020040382A1 (en) | Novel magnesium-serinate compound and use thereof | |
| WO2019078381A1 (en) | Pharmaceutical composition, food composition and food additive for preventing, alleviating or treating muscle loss, weakness and atrophy, containing, as active ingredient, enterococcus faecalis, culture liquid thereof or dead cells thereof | |
| WO2023140505A1 (en) | Composition for preventing or treating neurodegenerative or motor neuron diseases containing halofuginone as active ingredient | |
| JP2023135605A (en) | Prepro-orexin as bioactive peptide, fragments thereof, and variants thereof | |
| WO2022231309A1 (en) | Food composition and pharmaceutical composition for preventing or alleviating sarcopenia, containing low-molecular-weight collagen as active ingredient | |
| WO2023008981A1 (en) | Anti-viral composition and use thereof | |
| WO2015108372A1 (en) | Composition for preventing or treating neurological disorders caused by excitotoxicity or synaptic dysfunction, containing osmotin, and method for preventing or treating neurological disorders by using same | |
| WO2022163971A1 (en) | Composite pharmaceutical composition for treatment of brain disease, comprising cholinesterase inhibitor and antioxidant | |
| WO2021002664A1 (en) | Composition for preventing, relieving or treating cancer | |
| WO2021033995A1 (en) | Composition comprising amomum tsaoko extract for prevention, alleviation, or treatment of sarcopenia-related disease | |
| WO2014051398A1 (en) | Pharmaceutical composition comprising acecainide or derivative thereof for preventing or treating diseases associated with muscular weakness | |
| WO2018135738A1 (en) | COMPOSITION FOR INHIBITING MYOSTATIN ACTIVITY, CONTAINING MATRIX gla PROTEIN AS ACTIVE INGREDIENT | |
| WO2025127437A1 (en) | Use of cyclo(his-pro) (chp) for enhancing exercise performance, improving muscle function, or preventing, alleviating, or treating muscle diseases | |
| WO2022186658A1 (en) | Composition for preventing, alleviating or treating sarcopenia, containing d-ribo-2-hexulose as active ingredient |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | Ref document number:16828049 Country of ref document:EP Kind code of ref document:A1 | |
| NENP | Non-entry into the national phase | Ref country code:DE | |
| 122 | Ep: pct application non-entry in european phase | Ref document number:16828049 Country of ref document:EP Kind code of ref document:A1 |