RU2170589C2 - Composition for inhibition of angiogenesis, monoclonal antibody, polypeptide, method of inhibition of tumor growth (variants) - Google Patents
Composition for inhibition of angiogenesis, monoclonal antibody, polypeptide, method of inhibition of tumor growth (variants)Download PDFInfo
- Publication number
- RU2170589C2 RU2170589C2RU95109930ARU95109930ARU2170589C2RU 2170589 C2RU2170589 C2RU 2170589C2RU 95109930 ARU95109930 ARU 95109930ARU 95109930 ARU95109930 ARU 95109930ARU 2170589 C2RU2170589 C2RU 2170589C2
- Authority
- RU
- Russia
- Prior art keywords
- monoclonal antibody
- receptor
- antibody according
- cells
- amino acid
- Prior art date
Links
- 238000000034methodMethods0.000titleclaimsabstractdescription40
- 239000000203mixtureSubstances0.000titleclaimsabstractdescription21
- 230000004614tumor growthEffects0.000titleclaimsabstractdescription9
- 108090000765processed proteins & peptidesProteins0.000titleclaimsdescription29
- 102000004196processed proteins & peptidesHuman genes0.000titleclaimsdescription27
- 229920001184polypeptidePolymers0.000titleclaimsdescription26
- 230000005764inhibitory processEffects0.000titleabstractdescription7
- 230000014399negative regulation of angiogenesisEffects0.000title1
- 239000005557antagonistSubstances0.000claimsabstractdescription59
- 230000002297mitogenic effectEffects0.000claimsabstractdescription13
- 230000002401inhibitory effectEffects0.000claimsabstractdescription9
- 210000004027cellAnatomy0.000claimsdescription86
- 102000005962receptorsHuman genes0.000claimsdescription82
- 108020003175receptorsProteins0.000claimsdescription82
- 230000027455bindingEffects0.000claimsdescription56
- 125000003275alpha amino acid groupChemical group0.000claimsdescription21
- 108060003951ImmunoglobulinProteins0.000claimsdescription19
- 239000000427antigenSubstances0.000claimsdescription19
- 102000036639antigensHuman genes0.000claimsdescription19
- 108091007433antigensProteins0.000claimsdescription19
- 102000018358immunoglobulinHuman genes0.000claimsdescription19
- 230000012010growthEffects0.000claimsdescription17
- 241000283690Bos taurusSpecies0.000claimsdescription12
- 230000033115angiogenesisEffects0.000claimsdescription12
- 230000001472cytotoxic effectEffects0.000claimsdescription11
- 231100000433cytotoxicToxicity0.000claimsdescription10
- 230000001225therapeutic effectEffects0.000claimsdescription10
- 241000124008MammaliaSpecies0.000claimsdescription8
- 108020001507fusion proteinsProteins0.000claimsdescription8
- 108090000386Fibroblast Growth Factor 1Proteins0.000claimsdescription7
- 102000037865fusion proteinsHuman genes0.000claimsdescription7
- 229920000642polymerPolymers0.000claimsdescription7
- 102100031706Fibroblast growth factor 1Human genes0.000claimsdescription6
- 210000003556vascular endothelial cellAnatomy0.000claimsdescription6
- 210000004404adrenal cortexAnatomy0.000claimsdescription5
- 210000003989endothelium vascularAnatomy0.000claimsdescription4
- 230000000295complement effectEffects0.000claimsdescription3
- 239000003053toxinSubstances0.000claimsdescription2
- 231100000765toxinToxicity0.000claimsdescription2
- 102000004127CytokinesHuman genes0.000claims2
- 108090000695CytokinesProteins0.000claims2
- 102000009484Vascular Endothelial Growth Factor ReceptorsHuman genes0.000claims1
- 108010034265Vascular Endothelial Growth Factor ReceptorsProteins0.000claims1
- 239000012636effectorSubstances0.000claims1
- 230000003993interactionEffects0.000claims1
- 239000000644isotonic solutionSubstances0.000claims1
- 230000000694effectsEffects0.000abstractdescription32
- 210000002889endothelial cellAnatomy0.000abstractdescription25
- 239000000126substanceSubstances0.000abstractdescription17
- 210000004204blood vesselAnatomy0.000abstractdescription16
- 230000002491angiogenic effectEffects0.000abstractdescription7
- 239000003102growth factorSubstances0.000abstractdescription7
- 230000035755proliferationEffects0.000abstractdescription7
- 206010029113NeovascularisationDiseases0.000abstractdescription5
- 238000002360preparation methodMethods0.000abstractdescription5
- 230000008569processEffects0.000abstractdescription4
- 239000003814drugSubstances0.000abstractdescription3
- 210000004408hybridomaAnatomy0.000description50
- 206010028980NeoplasmDiseases0.000description35
- 229940024606amino acidDrugs0.000description35
- 235000001014amino acidNutrition0.000description34
- 150000001413amino acidsChemical class0.000description34
- 108090000623proteins and genesProteins0.000description28
- 235000018102proteinsNutrition0.000description25
- 102000004169proteins and genesHuman genes0.000description25
- 239000012634fragmentSubstances0.000description19
- 241000699670Mus sp.Species0.000description18
- 230000004071biological effectEffects0.000description15
- 108020004414DNAProteins0.000description14
- 239000002609mediumSubstances0.000description14
- 241001529936MurinaeSpecies0.000description13
- 238000004458analytical methodMethods0.000description13
- 208000037265diseases, disorders, signs and symptomsDiseases0.000description13
- 239000000523sampleSubstances0.000description11
- 231100000599cytotoxic agentToxicity0.000description10
- 239000002619cytotoxinSubstances0.000description10
- 201000010099diseaseDiseases0.000description10
- 210000001179synovial fluidAnatomy0.000description10
- 238000002965ELISAMethods0.000description9
- 239000002202Polyethylene glycolSubstances0.000description9
- 125000000539amino acid groupChemical group0.000description9
- 239000001963growth mediumSubstances0.000description9
- 229920001223polyethylene glycolPolymers0.000description9
- 101710112752CytotoxinProteins0.000description8
- 206010035226Plasma cell myelomaDiseases0.000description8
- 108060008682Tumor Necrosis FactorProteins0.000description8
- 201000000050myeloid neoplasmDiseases0.000description8
- 206010039073rheumatoid arthritisDiseases0.000description8
- 102000003390tumor necrosis factorHuman genes0.000description8
- 230000015572biosynthetic processEffects0.000description7
- 238000004113cell cultureMethods0.000description7
- 230000001413cellular effectEffects0.000description7
- 239000002299complementary DNASubstances0.000description7
- 230000014509gene expressionEffects0.000description7
- 238000011282treatmentMethods0.000description7
- 206010027476MetastasesDiseases0.000description6
- 238000012217deletionMethods0.000description6
- 230000037430deletionEffects0.000description6
- 238000000338in vitroMethods0.000description6
- 210000004881tumor cellAnatomy0.000description6
- 201000009030CarcinomaDiseases0.000description5
- 108700020796OncogeneProteins0.000description5
- 230000004913activationEffects0.000description5
- 230000035605chemotaxisEffects0.000description5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-Idipotassium trisodium dihydrogen phosphate hydrogen phosphate dichlorideChemical compoundP(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+]LOKCTEFSRHRXRJ-UHFFFAOYSA-I0.000description5
- 239000002502liposomeSubstances0.000description5
- 239000002953phosphate buffered salineSubstances0.000description5
- 230000004083survival effectEffects0.000description5
- 210000001519tissueAnatomy0.000description5
- 206010003445AscitesDiseases0.000description4
- 241000283707CapraSpecies0.000description4
- 102000018233Fibroblast Growth FactorHuman genes0.000description4
- 108050007372Fibroblast Growth FactorProteins0.000description4
- DHMQDGOQFOQNFH-UHFFFAOYSA-NGlycineChemical compoundNCC(O)=ODHMQDGOQFOQNFH-UHFFFAOYSA-N0.000description4
- 241001465754MetazoaSpecies0.000description4
- FAPWRFPIFSIZLT-UHFFFAOYSA-MSodium chlorideChemical compound[Na+].[Cl-]FAPWRFPIFSIZLT-UHFFFAOYSA-M0.000description4
- DBMJMQXJHONAFJ-UHFFFAOYSA-MSodium laurylsulphateChemical compound[Na+].CCCCCCCCCCCCOS([O-])(=O)=ODBMJMQXJHONAFJ-UHFFFAOYSA-M0.000description4
- 230000002776aggregationEffects0.000description4
- 238000004220aggregationMethods0.000description4
- 230000003042antagnostic effectEffects0.000description4
- 238000003556assayMethods0.000description4
- 201000011510cancerDiseases0.000description4
- 239000003795chemical substances by applicationSubstances0.000description4
- 238000004132cross linkingMethods0.000description4
- 230000003053immunizationEffects0.000description4
- 229940072221immunoglobulinsDrugs0.000description4
- 238000011081inoculationMethods0.000description4
- 238000003780insertionMethods0.000description4
- 230000037431insertionEffects0.000description4
- 230000003834intracellular effectEffects0.000description4
- 210000004698lymphocyteAnatomy0.000description4
- 230000007246mechanismEffects0.000description4
- 230000035772mutationEffects0.000description4
- 230000001613neoplastic effectEffects0.000description4
- 230000003472neutralizing effectEffects0.000description4
- 239000013612plasmidSubstances0.000description4
- 238000011160researchMethods0.000description4
- 201000009410rhabdomyosarcomaDiseases0.000description4
- 238000010561standard procedureMethods0.000description4
- 238000006467substitution reactionMethods0.000description4
- 102000002260Alkaline PhosphataseHuman genes0.000description3
- 108020004774Alkaline PhosphataseProteins0.000description3
- 201000001320AtherosclerosisDiseases0.000description3
- 208000010412GlaucomaDiseases0.000description3
- AEMRFAOFKBGASW-UHFFFAOYSA-NGlycolic acidChemical classOCC(O)=OAEMRFAOFKBGASW-UHFFFAOYSA-N0.000description3
- 102100021866Hepatocyte growth factorHuman genes0.000description3
- WHUUTDBJXJRKMK-VKHMYHEASA-NL-glutamic acidChemical compoundOC(=O)[C@@H](N)CCC(O)=OWHUUTDBJXJRKMK-VKHMYHEASA-N0.000description3
- 201000004681PsoriasisDiseases0.000description3
- 206010038933Retinopathy of prematurityDiseases0.000description3
- HEMHJVSKTPXQMS-UHFFFAOYSA-MSodium hydroxideChemical compound[OH-].[Na+]HEMHJVSKTPXQMS-UHFFFAOYSA-M0.000description3
- 108010053099Vascular Endothelial Growth Factor Receptor-2Proteins0.000description3
- 239000003242anti bacterial agentSubstances0.000description3
- 229940088710antibiotic agentDrugs0.000description3
- 244000309466calfSpecies0.000description3
- 238000004587chromatography analysisMethods0.000description3
- 208000037976chronic inflammationDiseases0.000description3
- 230000006020chronic inflammationEffects0.000description3
- 238000004891communicationMethods0.000description3
- 150000001875compoundsChemical class0.000description3
- 229920001577copolymerPolymers0.000description3
- 208000037765diseases and disordersDiseases0.000description3
- 208000035475disorderDiseases0.000description3
- 239000013604expression vectorSubstances0.000description3
- 208000005719familial benign fleck retinaDiseases0.000description3
- 230000001605fetal effectEffects0.000description3
- 239000012530fluidSubstances0.000description3
- 239000000499gelSubstances0.000description3
- 208000005017glioblastomaDiseases0.000description3
- ZDXPYRJPNDTMRX-UHFFFAOYSA-NglutamineNatural productsOC(=O)C(N)CCC(N)=OZDXPYRJPNDTMRX-UHFFFAOYSA-N0.000description3
- 201000011066hemangiomaDiseases0.000description3
- 238000002649immunizationMethods0.000description3
- 238000001114immunoprecipitationMethods0.000description3
- 238000001727in vivoMethods0.000description3
- 238000007912intraperitoneal administrationMethods0.000description3
- 239000003446ligandSubstances0.000description3
- 210000004962mammalian cellAnatomy0.000description3
- 238000004519manufacturing processMethods0.000description3
- 239000011159matrix materialSubstances0.000description3
- 230000009401metastasisEffects0.000description3
- 201000003142neovascular glaucomaDiseases0.000description3
- 201000008482osteoarthritisDiseases0.000description3
- 230000035699permeabilityEffects0.000description3
- 239000000047productSubstances0.000description3
- 238000012552reviewMethods0.000description3
- 238000012216screeningMethods0.000description3
- 235000002639sodium chlorideNutrition0.000description3
- 239000007787solidSubstances0.000description3
- 238000013268sustained releaseMethods0.000description3
- 239000012730sustained-release formSubstances0.000description3
- 238000003786synthesis reactionMethods0.000description3
- 238000012360testing methodMethods0.000description3
- 239000013598vectorSubstances0.000description3
- 102000004506Blood ProteinsHuman genes0.000description2
- 108010017384Blood ProteinsProteins0.000description2
- 208000003174Brain NeoplasmsDiseases0.000description2
- 206010006187Breast cancerDiseases0.000description2
- 208000026310Breast neoplasmDiseases0.000description2
- 108091026890Coding regionProteins0.000description2
- 206010009944Colon cancerDiseases0.000description2
- 238000012286ELISA AssayMethods0.000description2
- 102000004190EnzymesHuman genes0.000description2
- 108090000790EnzymesProteins0.000description2
- 239000004471GlycineSubstances0.000description2
- 206010018498GoitreDiseases0.000description2
- 208000003807Graves DiseaseDiseases0.000description2
- 208000015023Graves' diseaseDiseases0.000description2
- 108090000100Hepatocyte Growth FactorProteins0.000description2
- MHAJPDPJQMAIIY-UHFFFAOYSA-NHydrogen peroxideChemical compoundOOMHAJPDPJQMAIIY-UHFFFAOYSA-N0.000description2
- 102000006496Immunoglobulin Heavy ChainsHuman genes0.000description2
- 108010019476Immunoglobulin Heavy ChainsProteins0.000description2
- 102000000589Interleukin-1Human genes0.000description2
- 108010002352Interleukin-1Proteins0.000description2
- 102000000588Interleukin-2Human genes0.000description2
- 108010002350Interleukin-2Proteins0.000description2
- FFEARJCKVFRZRR-BYPYZUCNSA-NL-methionineChemical compoundCSCC[C@H](N)C(O)=OFFEARJCKVFRZRR-BYPYZUCNSA-N0.000description2
- 208000006395Meigs SyndromeDiseases0.000description2
- 241000699666Mus <mouse, genus>Species0.000description2
- 206010029164Nephrotic syndromeDiseases0.000description2
- 206010030113OedemaDiseases0.000description2
- 208000005228Pericardial EffusionDiseases0.000description2
- 208000002151Pleural effusionDiseases0.000description2
- 101800004937Protein CProteins0.000description2
- 102000017975Protein CHuman genes0.000description2
- 102000001708Protein IsoformsHuman genes0.000description2
- 108010029485Protein IsoformsProteins0.000description2
- 108090000412Protein-Tyrosine KinasesProteins0.000description2
- 102000004022Protein-Tyrosine KinasesHuman genes0.000description2
- 108020004511Recombinant DNAProteins0.000description2
- 206010038923RetinopathyDiseases0.000description2
- 101800001700Saposin-DProteins0.000description2
- 229920002684SepharosePolymers0.000description2
- 108010000499ThromboplastinProteins0.000description2
- 102000002262ThromboplastinHuman genes0.000description2
- IQFYYKKMVGJFEH-XLPZGREQSA-NThymidineChemical compoundO=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1IQFYYKKMVGJFEH-XLPZGREQSA-N0.000description2
- 102000009618Transforming Growth FactorsHuman genes0.000description2
- 108010009583Transforming Growth FactorsProteins0.000description2
- 102000016549Vascular Endothelial Growth Factor Receptor-2Human genes0.000description2
- 230000002378acidificating effectEffects0.000description2
- 230000009471actionEffects0.000description2
- 230000010056antibody-dependent cellular cytotoxicityEffects0.000description2
- 239000012148binding bufferSubstances0.000description2
- 229920001222biopolymerPolymers0.000description2
- 201000008275breast carcinomaDiseases0.000description2
- DQXBYHZEEUGOBF-UHFFFAOYSA-Nbut-3-enoic acid;etheneChemical compoundC=C.OC(=O)CC=CDQXBYHZEEUGOBF-UHFFFAOYSA-N0.000description2
- 239000000969carrierSubstances0.000description2
- 230000010261cell growthEffects0.000description2
- 238000006243chemical reactionMethods0.000description2
- HVYWMOMLDIMFJA-DPAQBDIFSA-NcholesterolChemical compoundC1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2HVYWMOMLDIMFJA-DPAQBDIFSA-N0.000description2
- 238000012875competitive assayMethods0.000description2
- 230000009137competitive bindingEffects0.000description2
- 238000004590computer programMethods0.000description2
- 230000001143conditioned effectEffects0.000description2
- 238000007796conventional methodMethods0.000description2
- 210000004087corneaAnatomy0.000description2
- 230000001086cytosolic effectEffects0.000description2
- 238000001514detection methodMethods0.000description2
- 206010012601diabetes mellitusDiseases0.000description2
- 230000010595endothelial cell migrationEffects0.000description2
- 229940088598enzymeDrugs0.000description2
- 239000005038ethylene vinyl acetateSubstances0.000description2
- 229940126864fibroblast growth factorDrugs0.000description2
- 238000009472formulationMethods0.000description2
- 210000005260human cellAnatomy0.000description2
- 238000009396hybridizationMethods0.000description2
- 239000000017hydrogelSubstances0.000description2
- FDGQSTZJBFJUBT-UHFFFAOYSA-NhypoxanthineChemical compoundO=C1NC=NC2=C1NC=N2FDGQSTZJBFJUBT-UHFFFAOYSA-N0.000description2
- 230000002163immunogenEffects0.000description2
- 239000012133immunoprecipitateSubstances0.000description2
- 238000011534incubationMethods0.000description2
- 238000001802infusionMethods0.000description2
- 239000007928intraperitoneal injectionSubstances0.000description2
- 238000002955isolationMethods0.000description2
- RGLRXNKKBLIBQS-XNHQSDQCSA-Nleuprolide acetateChemical compoundCC(O)=O.CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1RGLRXNKKBLIBQS-XNHQSDQCSA-N0.000description2
- 230000000670limiting effectEffects0.000description2
- 230000001394metastastic effectEffects0.000description2
- 206010061289metastatic neoplasmDiseases0.000description2
- 229960004452methionineDrugs0.000description2
- 239000003094microcapsuleSubstances0.000description2
- 238000002703mutagenesisMethods0.000description2
- 231100000350mutagenesisToxicity0.000description2
- 108020004707nucleic acidsProteins0.000description2
- 102000039446nucleic acidsHuman genes0.000description2
- 150000007523nucleic acidsChemical class0.000description2
- 239000002773nucleotideSubstances0.000description2
- 125000003729nucleotide groupChemical group0.000description2
- 210000001672ovaryAnatomy0.000description2
- 208000008494pericarditisDiseases0.000description2
- 102000013415peroxidase activity proteinsHuman genes0.000description2
- 108040007629peroxidase activity proteinsProteins0.000description2
- 229920001200poly(ethylene-vinyl acetate)Polymers0.000description2
- 239000001267polyvinylpyrrolidoneSubstances0.000description2
- 229920000036polyvinylpyrrolidonePolymers0.000description2
- 235000013855polyvinylpyrrolidoneNutrition0.000description2
- 125000002924primary amino groupChemical group[H]N([H])*0.000description2
- -1protamine sulfateChemical class0.000description2
- 229960000856protein cDrugs0.000description2
- 238000000746purificationMethods0.000description2
- 230000005855radiationEffects0.000description2
- 230000002285radioactive effectEffects0.000description2
- 238000003127radioimmunoassayMethods0.000description2
- 229920006395saturated elastomerPolymers0.000description2
- 238000013391scatchard analysisMethods0.000description2
- 238000002741site-directed mutagenesisMethods0.000description2
- 239000011780sodium chlorideSubstances0.000description2
- 238000010532solid phase synthesis reactionMethods0.000description2
- 238000007920subcutaneous administrationMethods0.000description2
- 238000002560therapeutic procedureMethods0.000description2
- 208000013077thyroid gland carcinomaDiseases0.000description2
- 230000008728vascular permeabilityEffects0.000description2
- XMQUEQJCYRFIQS-YFKPBYRVSA-N(2s)-2-amino-5-ethoxy-5-oxopentanoic acidChemical compoundCCOC(=O)CC[C@H](N)C(O)=OXMQUEQJCYRFIQS-YFKPBYRVSA-N0.000description1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholineChemical compoundCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCCIIZPXYDJLKNOIY-JXPKJXOSSA-N0.000description1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)-Chemical compound[K+].CC=CC=CC([O-])=OCHHHXKFHOYLYRE-UHFFFAOYSA-M0.000description1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acidChemical compoundOCC[NH+]1CCN(CCS([O-])(=O)=O)CC1JKMHFZQWWAIEOD-UHFFFAOYSA-N0.000description1
- XZKIHKMTEMTJQX-UHFFFAOYSA-N4-Nitrophenyl PhosphateChemical compoundOP(O)(=O)OC1=CC=C([N+]([O-])=O)C=C1XZKIHKMTEMTJQX-UHFFFAOYSA-N0.000description1
- TVZGACDUOSZQKY-LBPRGKRZSA-N4-aminofolic acidChemical compoundC1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1TVZGACDUOSZQKY-LBPRGKRZSA-N0.000description1
- 206010003571AstrocytomaDiseases0.000description1
- 108090001008AvidinProteins0.000description1
- DWRXFEITVBNRMK-UHFFFAOYSA-NBeta-D-1-ArabinofuranosylthymineNatural productsO=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1DWRXFEITVBNRMK-UHFFFAOYSA-N0.000description1
- 101710117545C proteinProteins0.000description1
- 208000017897Carcinoma of esophagusDiseases0.000description1
- 208000003163Cavernous HemangiomaDiseases0.000description1
- 108010001857Cell Surface ReceptorsProteins0.000description1
- 102000000844Cell Surface ReceptorsHuman genes0.000description1
- 241000282693CercopithecidaeSpecies0.000description1
- 206010008342Cervix carcinomaDiseases0.000description1
- 108020004705CodonProteins0.000description1
- 208000001333Colorectal NeoplasmsDiseases0.000description1
- 102000006912Complement C4b-Binding ProteinHuman genes0.000description1
- 108010047548Complement C4b-Binding ProteinProteins0.000description1
- 108020004635Complementary DNAProteins0.000description1
- 102100031673CorneodesmosinHuman genes0.000description1
- 101710139375CorneodesmosinProteins0.000description1
- 241000699802Cricetulus griseusSpecies0.000description1
- 102000001189Cyclic PeptidesHuman genes0.000description1
- 108010069514Cyclic PeptidesProteins0.000description1
- IGXWBGJHJZYPQS-SSDOTTSWSA-ND-LuciferinChemical compoundOC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1IGXWBGJHJZYPQS-SSDOTTSWSA-N0.000description1
- CYCGRDQQIOGCKX-UHFFFAOYSA-NDehydro-luciferinNatural productsOC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1CYCGRDQQIOGCKX-UHFFFAOYSA-N0.000description1
- 206010012689Diabetic retinopathyDiseases0.000description1
- 239000006144Dulbecco’s modified Eagle's mediumSubstances0.000description1
- 201000009273EndometriosisDiseases0.000description1
- 241000588724Escherichia coliSpecies0.000description1
- 102000003971Fibroblast Growth Factor 1Human genes0.000description1
- 102000003974Fibroblast growth factor 2Human genes0.000description1
- 108090000379Fibroblast growth factor 2Proteins0.000description1
- BJGNCJDXODQBOB-UHFFFAOYSA-NFivefly LuciferinNatural productsOC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1BJGNCJDXODQBOB-UHFFFAOYSA-N0.000description1
- GHASVSINZRGABV-UHFFFAOYSA-NFluorouracilChemical compoundFC1=CNC(=O)NC1=OGHASVSINZRGABV-UHFFFAOYSA-N0.000description1
- 108010010803GelatinProteins0.000description1
- 208000032612Glial tumorDiseases0.000description1
- 206010018338GliomaDiseases0.000description1
- WHUUTDBJXJRKMK-UHFFFAOYSA-NGlutamic acidNatural productsOC(=O)C(N)CCC(O)=OWHUUTDBJXJRKMK-UHFFFAOYSA-N0.000description1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-NGlutaraldehydeChemical compoundO=CCCCC=OSXRSQZLOMIGNAQ-UHFFFAOYSA-N0.000description1
- 239000007995HEPES bufferSubstances0.000description1
- 101001012157Homo sapiens Receptor tyrosine-protein kinase erbB-2Proteins0.000description1
- 108010001336Horseradish PeroxidaseProteins0.000description1
- 102000018251Hypoxanthine PhosphoribosyltransferaseHuman genes0.000description1
- 108010091358Hypoxanthine PhosphoribosyltransferaseProteins0.000description1
- UGQMRVRMYYASKQ-UHFFFAOYSA-NHypoxanthine nucleosideNatural productsOC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1UGQMRVRMYYASKQ-UHFFFAOYSA-N0.000description1
- 102000001706Immunoglobulin Fab FragmentsHuman genes0.000description1
- 108010054477Immunoglobulin Fab FragmentsProteins0.000description1
- 102000008394Immunoglobulin FragmentsHuman genes0.000description1
- 108010021625Immunoglobulin FragmentsProteins0.000description1
- 102000012745Immunoglobulin SubunitsHuman genes0.000description1
- 108010079585Immunoglobulin SubunitsProteins0.000description1
- 102000006992Interferon-alphaHuman genes0.000description1
- 108010047761Interferon-alphaProteins0.000description1
- 102000003996Interferon-betaHuman genes0.000description1
- 108090000467Interferon-betaProteins0.000description1
- 102000008070Interferon-gammaHuman genes0.000description1
- 108010074328Interferon-gammaProteins0.000description1
- 102000014150InterferonsHuman genes0.000description1
- 108010050904InterferonsProteins0.000description1
- 102000015696InterleukinsHuman genes0.000description1
- 108010063738InterleukinsProteins0.000description1
- 208000007766Kaposi sarcomaDiseases0.000description1
- XUJNEKJLAYXESH-REOHCLBHSA-NL-CysteineChemical compoundSC[C@H](N)C(O)=OXUJNEKJLAYXESH-REOHCLBHSA-N0.000description1
- QNAYBMKLOCPYGJ-REOHCLBHSA-NL-alanineChemical compoundC[C@H](N)C(O)=OQNAYBMKLOCPYGJ-REOHCLBHSA-N0.000description1
- 208000018142LeiomyosarcomaDiseases0.000description1
- 102100032352Leukemia inhibitory factorHuman genes0.000description1
- 108090000581Leukemia inhibitory factorProteins0.000description1
- 108010000817LeuprolideProteins0.000description1
- DDWFXDSYGUXRAY-UHFFFAOYSA-NLuciferinNatural productsCCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3CDDWFXDSYGUXRAY-UHFFFAOYSA-N0.000description1
- 208000035771Malignant Sertoli-Leydig cell tumor of the ovaryDiseases0.000description1
- 208000000172MedulloblastomaDiseases0.000description1
- 102000007474Multiprotein ComplexesHuman genes0.000description1
- 108010085220Multiprotein ComplexesProteins0.000description1
- 101100059658Mus musculus Cetn4 geneProteins0.000description1
- 238000005481NMR spectroscopyMethods0.000description1
- 208000002454Nasopharyngeal CarcinomaDiseases0.000description1
- 206010061306Nasopharyngeal cancerDiseases0.000description1
- 102400000058Neuregulin-1Human genes0.000description1
- 108090000556Neuregulin-1Proteins0.000description1
- 206010029260NeuroblastomaDiseases0.000description1
- 108091028043Nucleic acid sequenceProteins0.000description1
- 201000010133OligodendrogliomaDiseases0.000description1
- 108020005187Oligonucleotide ProbesProteins0.000description1
- 241000283973Oryctolagus cuniculusSpecies0.000description1
- 206010033128Ovarian cancerDiseases0.000description1
- 206010061535Ovarian neoplasmDiseases0.000description1
- 229910019142PO4Inorganic materials0.000description1
- 241001111421PannusSpecies0.000description1
- 108091000080PhosphotransferaseProteins0.000description1
- 102000010780Platelet-Derived Growth FactorHuman genes0.000description1
- 108010038512Platelet-Derived Growth FactorProteins0.000description1
- 206010035664PneumoniaDiseases0.000description1
- 241000276498Pollachius virensSpecies0.000description1
- 102000003946ProlactinHuman genes0.000description1
- 108010057464ProlactinProteins0.000description1
- 102000007327ProtaminesHuman genes0.000description1
- 108010007568ProtaminesProteins0.000description1
- 229940096437Protein SDrugs0.000description1
- 108010066124Protein SProteins0.000description1
- 102000029301Protein SHuman genes0.000description1
- 241000589516PseudomonasSpecies0.000description1
- 239000012980RPMI-1640 mediumSubstances0.000description1
- 102100030086Receptor tyrosine-protein kinase erbB-2Human genes0.000description1
- 208000017442Retinal diseaseDiseases0.000description1
- 201000000582RetinoblastomaDiseases0.000description1
- 108010039491RicinProteins0.000description1
- 240000004808Saccharomyces cerevisiaeSpecies0.000description1
- 229920005654SephadexPolymers0.000description1
- 239000012507Sephadex™Substances0.000description1
- 208000000097Sertoli-Leydig cell tumorDiseases0.000description1
- 108010071390Serum AlbuminProteins0.000description1
- 102000007562Serum AlbuminHuman genes0.000description1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-NSilicium dioxideChemical compoundO=[Si]=OVYPSYNLAJGMNEJ-UHFFFAOYSA-N0.000description1
- PMZURENOXWZQFD-UHFFFAOYSA-LSodium SulfateChemical compound[Na+].[Na+].[O-]S([O-])(=O)=OPMZURENOXWZQFD-UHFFFAOYSA-L0.000description1
- 241000269319Squalius cephalusSpecies0.000description1
- 208000007536ThrombosisDiseases0.000description1
- 208000033781Thyroid carcinomaDiseases0.000description1
- 208000024770Thyroid neoplasmDiseases0.000description1
- 239000007983Tris bufferSubstances0.000description1
- 101100029436Trypanosoma brucei brucei PFRB geneProteins0.000description1
- 102000004142TrypsinHuman genes0.000description1
- 108090000631TrypsinProteins0.000description1
- 206010054094Tumour necrosisDiseases0.000description1
- 102000016548Vascular Endothelial Growth Factor Receptor-1Human genes0.000description1
- 108010053096Vascular Endothelial Growth Factor Receptor-1Proteins0.000description1
- 241000700605VirusesSpecies0.000description1
- DPXJVFZANSGRMM-UHFFFAOYSA-Nacetic acid;2,3,4,5,6-pentahydroxyhexanal;sodiumChemical compound[Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=ODPXJVFZANSGRMM-UHFFFAOYSA-N0.000description1
- 239000003929acidic solutionSubstances0.000description1
- 239000000654additiveSubstances0.000description1
- 239000000443aerosolSubstances0.000description1
- 238000001042affinity chromatographyMethods0.000description1
- 238000001261affinity purificationMethods0.000description1
- 239000000556agonistSubstances0.000description1
- 235000004279alanineNutrition0.000description1
- 150000001298alcoholsChemical class0.000description1
- 230000002152alkylating effectEffects0.000description1
- 229940037003alumDrugs0.000description1
- 229910052782aluminiumInorganic materials0.000description1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-Kaluminium tristearateChemical compound[Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=OCEGOLXSVJUTHNZ-UHFFFAOYSA-K0.000description1
- 229940063655aluminum stearateDrugs0.000description1
- 150000001412aminesChemical class0.000description1
- 229960003896aminopterinDrugs0.000description1
- 230000001772anti-angiogenic effectEffects0.000description1
- 230000000340anti-metaboliteEffects0.000description1
- 230000000259anti-tumor effectEffects0.000description1
- 210000000628antibody-producing cellAnatomy0.000description1
- 229940100197antimetaboliteDrugs0.000description1
- 239000002256antimetaboliteSubstances0.000description1
- 238000000376autoradiographyMethods0.000description1
- 230000001580bacterial effectEffects0.000description1
- 230000004888barrier functionEffects0.000description1
- RIIWUGSYXOBDMC-UHFFFAOYSA-Nbenzene-1,2-diamine;hydron;dichlorideChemical compoundCl.Cl.NC1=CC=CC=C1NRIIWUGSYXOBDMC-UHFFFAOYSA-N0.000description1
- 102000005936beta-GalactosidaseHuman genes0.000description1
- 108010005774beta-GalactosidaseProteins0.000description1
- IQFYYKKMVGJFEH-UHFFFAOYSA-Nbeta-L-thymidineNatural productsO=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1IQFYYKKMVGJFEH-UHFFFAOYSA-N0.000description1
- 238000012742biochemical analysisMethods0.000description1
- 210000004369bloodAnatomy0.000description1
- 239000008280bloodSubstances0.000description1
- 230000023555blood coagulationEffects0.000description1
- 210000004556brainAnatomy0.000description1
- 239000000872bufferSubstances0.000description1
- 239000006172buffering agentSubstances0.000description1
- 244000309464bullSpecies0.000description1
- 210000004899c-terminal regionAnatomy0.000description1
- 210000001043capillary endothelial cellAnatomy0.000description1
- 150000001720carbohydratesChemical class0.000description1
- 235000014633carbohydratesNutrition0.000description1
- 125000003178carboxy groupChemical group[H]OC(*)=O0.000description1
- 239000001768carboxy methyl celluloseSubstances0.000description1
- 210000000845cartilageAnatomy0.000description1
- 230000007910cell fusionEffects0.000description1
- 239000013592cell lysateSubstances0.000description1
- 210000000170cell membraneAnatomy0.000description1
- 230000004663cell proliferationEffects0.000description1
- 239000001913celluloseSubstances0.000description1
- 229920002678cellulosePolymers0.000description1
- 235000010980celluloseNutrition0.000description1
- 238000005119centrifugationMethods0.000description1
- 208000019065cervical carcinomaDiseases0.000description1
- 238000012512characterization methodMethods0.000description1
- 230000000973chemotherapeutic effectEffects0.000description1
- 210000000038chestAnatomy0.000description1
- 235000012000cholesterolNutrition0.000description1
- 239000003593chromogenic compoundSubstances0.000description1
- 238000003776cleavage reactionMethods0.000description1
- 230000007012clinical effectEffects0.000description1
- 238000010367cloningMethods0.000description1
- 239000000701coagulantSubstances0.000description1
- 230000015271coagulationEffects0.000description1
- 238000005345coagulationMethods0.000description1
- 201000010989colorectal carcinomaDiseases0.000description1
- 238000002648combination therapyMethods0.000description1
- 230000000536complexating effectEffects0.000description1
- 239000003636conditioned culture mediumSubstances0.000description1
- 239000003246corticosteroidSubstances0.000description1
- 229960001334corticosteroidsDrugs0.000description1
- 230000037029cross reactionEffects0.000description1
- 239000012228culture supernatantSubstances0.000description1
- XUJNEKJLAYXESH-UHFFFAOYSA-NcysteineNatural productsSCC(N)C(O)=OXUJNEKJLAYXESH-UHFFFAOYSA-N0.000description1
- 235000018417cysteineNutrition0.000description1
- 125000000151cysteine groupChemical groupN[C@@H](CS)C(=O)*0.000description1
- 102000003675cytokine receptorsHuman genes0.000description1
- 108010057085cytokine receptorsProteins0.000description1
- 239000003145cytotoxic factorSubstances0.000description1
- 230000006378damageEffects0.000description1
- 229940009976deoxycholateDrugs0.000description1
- KXGVEGMKQFWNSR-LLQZFEROSA-Ndeoxycholic acidChemical compoundC([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1KXGVEGMKQFWNSR-LLQZFEROSA-N0.000description1
- 238000003745diagnosisMethods0.000description1
- 238000000502dialysisMethods0.000description1
- 235000014113dietary fatty acidsNutrition0.000description1
- 238000010790dilutionMethods0.000description1
- 239000012895dilutionSubstances0.000description1
- GXGAKHNRMVGRPK-UHFFFAOYSA-Ndimagnesium;dioxido-bis[[oxido(oxo)silyl]oxy]silaneChemical compound[Mg+2].[Mg+2].[O-][Si](=O)O[Si]([O-])([O-])O[Si]([O-])=OGXGAKHNRMVGRPK-UHFFFAOYSA-N0.000description1
- 239000000539dimerSubstances0.000description1
- 206010013023diphtheriaDiseases0.000description1
- ZPWVASYFFYYZEW-UHFFFAOYSA-Ldipotassium hydrogen phosphateChemical compound[K+].[K+].OP([O-])([O-])=OZPWVASYFFYYZEW-UHFFFAOYSA-L0.000description1
- 229910000396dipotassium phosphateInorganic materials0.000description1
- 235000019797dipotassium phosphateNutrition0.000description1
- 229910000397disodium phosphateInorganic materials0.000description1
- 235000019800disodium phosphateNutrition0.000description1
- 238000004090dissolutionMethods0.000description1
- 238000009826distributionMethods0.000description1
- 125000002228disulfide groupChemical group0.000description1
- 239000002552dosage formSubstances0.000description1
- 229940079593drugDrugs0.000description1
- 239000003937drug carrierSubstances0.000description1
- 239000003792electrolyteSubstances0.000description1
- 238000004520electroporationMethods0.000description1
- 201000003914endometrial carcinomaDiseases0.000description1
- 201000006828endometrial hyperplasiaDiseases0.000description1
- 230000026721endothelial cell chemotaxisEffects0.000description1
- 210000003038endotheliumAnatomy0.000description1
- 238000005516engineering processMethods0.000description1
- 230000002255enzymatic effectEffects0.000description1
- BEFDCLMNVWHSGT-UHFFFAOYSA-NethenylcyclopentaneChemical compoundC=CC1CCCC1BEFDCLMNVWHSGT-UHFFFAOYSA-N0.000description1
- 208000021045exocrine pancreatic carcinomaDiseases0.000description1
- 238000002474experimental methodMethods0.000description1
- 239000000194fatty acidSubstances0.000description1
- 229930195729fatty acidNatural products0.000description1
- 150000004665fatty acidsChemical class0.000description1
- MHMNJMPURVTYEJ-UHFFFAOYSA-Nfluorescein-5-isothiocyanateChemical compoundO1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21MHMNJMPURVTYEJ-UHFFFAOYSA-N0.000description1
- 229960002949fluorouracilDrugs0.000description1
- 239000004052folic acid antagonistSubstances0.000description1
- 230000003325follicularEffects0.000description1
- 238000004108freeze dryingMethods0.000description1
- 125000000524functional groupChemical group0.000description1
- 230000004927fusionEffects0.000description1
- 230000005251gamma rayEffects0.000description1
- 229940044627gamma-interferonDrugs0.000description1
- 208000010749gastric carcinomaDiseases0.000description1
- 238000001502gel electrophoresisMethods0.000description1
- 239000008273gelatinSubstances0.000description1
- 229920000159gelatinPolymers0.000description1
- 235000019322gelatineNutrition0.000description1
- 235000011852gelatine dessertsNutrition0.000description1
- 210000004907glandAnatomy0.000description1
- 229960002989glutamic acidDrugs0.000description1
- 150000004676glycansChemical class0.000description1
- 125000005456glyceride groupChemical group0.000description1
- 229960002449glycineDrugs0.000description1
- 210000003714granulocyteAnatomy0.000description1
- 239000000122growth hormoneSubstances0.000description1
- 201000010536head and neck cancerDiseases0.000description1
- 208000014829head and neck neoplasmDiseases0.000description1
- 201000002222hemangioblastomaDiseases0.000description1
- 108060003552hemocyaninProteins0.000description1
- 208000006359hepatoblastomaDiseases0.000description1
- 235000012907honeyNutrition0.000description1
- 229920001600hydrophobic polymerPolymers0.000description1
- 238000012872hydroxylapatite chromatographyMethods0.000description1
- 206010020718hyperplasiaDiseases0.000description1
- 238000003384imaging methodMethods0.000description1
- 230000005847immunogenicityEffects0.000description1
- 230000016784immunoglobulin productionEffects0.000description1
- 239000003547immunosorbentSubstances0.000description1
- 230000006872improvementEffects0.000description1
- 238000010348incorporationMethods0.000description1
- 238000002743insertional mutagenesisMethods0.000description1
- 229940047124interferonsDrugs0.000description1
- 229940047122interleukinsDrugs0.000description1
- 102000027411intracellular receptorsHuman genes0.000description1
- 108091008582intracellular receptorsProteins0.000description1
- 238000007917intracranial administrationMethods0.000description1
- 238000007918intramuscular administrationMethods0.000description1
- 239000007927intramuscular injectionSubstances0.000description1
- 238000010255intramuscular injectionMethods0.000description1
- 230000002601intratumoral effectEffects0.000description1
- 230000009545invasionEffects0.000description1
- XMBWDFGMSWQBCA-YPZZEJLDSA-NiodaneChemical compound[125IH]XMBWDFGMSWQBCA-YPZZEJLDSA-N0.000description1
- 238000005342ion exchangeMethods0.000description1
- 238000002372labellingMethods0.000description1
- 201000005264laryngeal carcinomaDiseases0.000description1
- 235000010445lecithinNutrition0.000description1
- 229940067606lecithinDrugs0.000description1
- 239000000787lecithinSubstances0.000description1
- 229960004338leuprorelinDrugs0.000description1
- 150000002632lipidsChemical class0.000description1
- 210000004185liverAnatomy0.000description1
- 230000004807localizationEffects0.000description1
- 210000004072lungAnatomy0.000description1
- 201000005296lung carcinomaDiseases0.000description1
- 239000006166lysateSubstances0.000description1
- 239000012139lysis bufferSubstances0.000description1
- 210000002540macrophageAnatomy0.000description1
- 239000000391magnesium silicateSubstances0.000description1
- 229940099273magnesium trisilicateDrugs0.000description1
- 229910000386magnesium trisilicateInorganic materials0.000description1
- 235000019793magnesium trisilicateNutrition0.000description1
- 238000013507mappingMethods0.000description1
- 239000000463materialSubstances0.000description1
- 230000001404mediated effectEffects0.000description1
- 201000001441melanomaDiseases0.000description1
- 230000004060metabolic processEffects0.000description1
- MYWUZJCMWCOHBA-VIFPVBQESA-NmethamphetamineChemical compoundCN[C@@H](C)CC1=CC=CC=C1MYWUZJCMWCOHBA-VIFPVBQESA-N0.000description1
- 229930182817methionineNatural products0.000description1
- 229920000609methyl cellulosePolymers0.000description1
- 125000002496methyl groupChemical group[H]C([H])([H])*0.000description1
- 239000001923methylcelluloseSubstances0.000description1
- 235000010981methylcelluloseNutrition0.000description1
- 239000004005microsphereSubstances0.000description1
- 210000004088microvesselAnatomy0.000description1
- 230000005012migrationEffects0.000description1
- 238000013508migrationMethods0.000description1
- 210000001616monocyteAnatomy0.000description1
- 239000002088nanocapsuleSubstances0.000description1
- 201000011216nasopharynx carcinomaDiseases0.000description1
- 230000010807negative regulation of bindingEffects0.000description1
- 230000009826neoplastic cell growthEffects0.000description1
- 210000002569neuronAnatomy0.000description1
- 239000002777nucleosideSubstances0.000description1
- 235000016709nutritionNutrition0.000description1
- 230000035764nutritionEffects0.000description1
- 239000002751oligonucleotide probeSubstances0.000description1
- 230000003287optical effectEffects0.000description1
- 238000011369optimal treatmentMethods0.000description1
- 210000000056organAnatomy0.000description1
- 230000003349osteoarthritic effectEffects0.000description1
- 201000008968osteosarcomaDiseases0.000description1
- 208000012221ovarian Sertoli-Leydig cell tumorDiseases0.000description1
- 230000002018overexpressionEffects0.000description1
- 208000008443pancreatic carcinomaDiseases0.000description1
- 230000036961partial effectEffects0.000description1
- 244000052769pathogenSpecies0.000description1
- 230000008506pathogenesisEffects0.000description1
- 230000001717pathogenic effectEffects0.000description1
- 230000001575pathological effectEffects0.000description1
- 230000037361pathwayEffects0.000description1
- 239000008194pharmaceutical compositionSubstances0.000description1
- 235000021317phosphateNutrition0.000description1
- 150000003013phosphoric acid derivativesChemical class0.000description1
- 102000020233phosphotransferaseHuman genes0.000description1
- 230000001817pituitary effectEffects0.000description1
- 229920000747poly(lactic acid)Polymers0.000description1
- 229920002401polyacrylamidePolymers0.000description1
- 229920000058polyacrylatePolymers0.000description1
- 229920000728polyesterPolymers0.000description1
- 229920002338polyhydroxyethylmethacrylatePolymers0.000description1
- 229920002503polyoxyethylene-polyoxypropylenePolymers0.000description1
- 229920001282polysaccharidePolymers0.000description1
- 239000005017polysaccharideSubstances0.000description1
- 229920002451polyvinyl alcoholPolymers0.000description1
- 239000011148porous materialSubstances0.000description1
- 235000010241potassium sorbateNutrition0.000description1
- 239000004302potassium sorbateSubstances0.000description1
- 229940069338potassium sorbateDrugs0.000description1
- 201000011461pre-eclampsiaDiseases0.000description1
- 239000002244precipitateSubstances0.000description1
- 238000004321preservationMethods0.000description1
- 230000002265preventionEffects0.000description1
- 230000002947procoagulating effectEffects0.000description1
- 229940097325prolactinDrugs0.000description1
- 230000000069prophylactic effectEffects0.000description1
- 229950008679protamine sulfateDrugs0.000description1
- 238000000159protein binding assayMethods0.000description1
- 230000017854proteolysisEffects0.000description1
- 239000002212purine nucleosideSubstances0.000description1
- 150000003230pyrimidinesChemical class0.000description1
- 239000000941radioactive substanceSubstances0.000description1
- 238000002601radiographyMethods0.000description1
- 238000003259recombinant expressionMethods0.000description1
- 238000010188recombinant methodMethods0.000description1
- 238000005215recombinationMethods0.000description1
- 230000006798recombinationEffects0.000description1
- 210000000664rectumAnatomy0.000description1
- 230000009467reductionEffects0.000description1
- 230000002829reductive effectEffects0.000description1
- 229920005989resinPolymers0.000description1
- 239000011347resinSubstances0.000description1
- 230000004044responseEffects0.000description1
- PYWVYCXTNDRMGF-UHFFFAOYSA-Nrhodamine BChemical compound[Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=OPYWVYCXTNDRMGF-UHFFFAOYSA-N0.000description1
- 150000003839saltsChemical class0.000description1
- 230000007017scissionEffects0.000description1
- 238000007423screening assayMethods0.000description1
- 230000008054signal transmissionEffects0.000description1
- 229910052814silicon oxideInorganic materials0.000description1
- 239000002356single layerSubstances0.000description1
- 201000000849skin cancerDiseases0.000description1
- 201000008261skin carcinomaDiseases0.000description1
- 150000003384small moleculesChemical class0.000description1
- 210000000329smooth muscle myocyteAnatomy0.000description1
- 235000019812sodium carboxymethyl celluloseNutrition0.000description1
- 229920001027sodium carboxymethylcellulosePolymers0.000description1
- 239000007790solid phaseSubstances0.000description1
- 239000000243solutionSubstances0.000description1
- 239000002904solventSubstances0.000description1
- 235000010199sorbic acidNutrition0.000description1
- 229940075582sorbic acidDrugs0.000description1
- 239000004334sorbic acidSubstances0.000description1
- 230000009870specific bindingEffects0.000description1
- 210000004989spleen cellAnatomy0.000description1
- 230000006641stabilisationEffects0.000description1
- 238000011105stabilizationMethods0.000description1
- 230000000638stimulationEffects0.000description1
- 238000003756stirringMethods0.000description1
- 210000002784stomachAnatomy0.000description1
- 239000006190sub-lingual tabletSubstances0.000description1
- 239000007929subcutaneous injectionSubstances0.000description1
- 239000006228supernatantSubstances0.000description1
- 230000001629suppressionEffects0.000description1
- 230000008961swellingEffects0.000description1
- 208000024891symptomDiseases0.000description1
- 210000001258synovial membraneAnatomy0.000description1
- 230000009885systemic effectEffects0.000description1
- 230000008685targetingEffects0.000description1
- 229940124597therapeutic agentDrugs0.000description1
- 125000003396thiol groupChemical group[H]S*0.000description1
- 230000002537thrombolytic effectEffects0.000description1
- 229940104230thymidineDrugs0.000description1
- 201000002510thyroid cancerDiseases0.000description1
- 231100000331toxicToxicity0.000description1
- 230000002588toxic effectEffects0.000description1
- 238000001890transfectionMethods0.000description1
- 230000007704transitionEffects0.000description1
- 108091008578transmembrane receptorsProteins0.000description1
- 102000027257transmembrane receptorsHuman genes0.000description1
- 238000002054transplantationMethods0.000description1
- LENZDBCJOHFCAS-UHFFFAOYSA-NtrisChemical compoundOCC(N)(CO)COLENZDBCJOHFCAS-UHFFFAOYSA-N0.000description1
- 239000012588trypsinSubstances0.000description1
- 230000004565tumor cell growthEffects0.000description1
- 210000003954umbilical cordAnatomy0.000description1
- 210000001635urinary tractAnatomy0.000description1
- VBEQCZHXXJYVRD-GACYYNSASA-NuroantheloneChemical compoundC([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1VBEQCZHXXJYVRD-GACYYNSASA-N0.000description1
- 235000013311vegetablesNutrition0.000description1
- 238000012800visualizationMethods0.000description1
- XLYOFNOQVPJJNP-UHFFFAOYSA-NwaterSubstancesOXLYOFNOQVPJJNP-UHFFFAOYSA-N0.000description1
- 238000005303weighingMethods0.000description1
- 230000029663wound healingEffects0.000description1
- 210000005253yeast cellAnatomy0.000description1
- 150000003751zincChemical class0.000description1
Images
Landscapes
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
Abstract
Description
Translated fromRussianИзобретение относится к антагонистам фактора роста клеток сосудистого эндотелия (ФРЭККС), к терапевтическому составу этих антагонистов, а также к методам использования антагонистов в диагностических и терапевтических целях. The invention relates to antagonists of vascular endothelial cell growth factor (FREKS), to the therapeutic composition of these antagonists, as well as to methods for using antagonists for diagnostic and therapeutic purposes.
Предпосылки изобретения
Двумя основными клеточными компонентами кровеносных сосудов являются эндотелиальные клетки и гладкие мышечные клетки. Эндотелиальные клетки образуют выстилку внутренней поверхности всех кровеносных сосудов и представляют собой барьер между кровью и тканями, препятствующий образованию тромбов. Помимо того, эндотелиальные клетки являются важным компонентом в формировании новых капилляров и кровеносных сосудов. Таким образом, эндотелиальные клетки пролиферируют во время ангиогенеза, или неоваскуляризации, связанного с ростом и метастазированием опухолей и с другими заболеваниями или нарушениями, иными чем неопластические.BACKGROUND OF THE INVENTION
The two main cellular components of blood vessels are endothelial cells and smooth muscle cells. Endothelial cells form the lining of the inner surface of all blood vessels and represent a barrier between blood and tissues, preventing the formation of blood clots. In addition, endothelial cells are an important component in the formation of new capillaries and blood vessels. Thus, endothelial cells proliferate during angiogenesis, or neovascularization, associated with the growth and metastasis of tumors and with other diseases or disorders other than neoplastic.
По имеющимся данным пролиферация эндотелиальных клеток может вызываться различными полипептидами, которые естественным образом встречаются в природе. К числу таких полипептидов относятся основные и кислотные факторы роста фибробластов (ФРФ) (Берджесс и Масиаг, "Ежег. биохим.обозрение" (Animal Rev. Biochem. ) 58, 575 (1989)), фактор роста эндотелиальных клеток, образующийся из тромбоцитов (ФРЭКТ) (Исикава и др., "Природа" (Nature), 338, 557 (1989)), и фактор роста эндотелиальных клеток кровеносных сосудов (ФРЭККС) (Леунг и др. "Наука" (Science) 246, 1306 (1989), Феррара и Ген-цель, "Научн.сообщ.по биохим. и биофиз." (Biochem. Biophys. Res. Commun), 161, 851 (1989), Тишер и др. , "Научн. сообщ. по биохим. и биофиз." (Biochem. Biophys. Res. Commun), 165, 1198 (1989), Феррара и др. PCT Pat. Publ. N WO 90/13649 (опубликовано 15 ноября 1990 г.); Феррара и др. Заявка на патент США (U. S. Pat. App.) N 07/360229). According to reports, endothelial cell proliferation can be caused by various polypeptides that naturally occur in nature. Among these polypeptides are basic and acidic fibroblast growth factors (FGFs) (Burgess and Masiag, Animal Biochemical Review (Animal Rev. Biochem.) 58, 575 (1989)), endothelial cell growth factor derived from platelets ( TRACT) (Ishikawa et al., Nature, 338, 557 (1989)), and the growth factor of blood vessel endothelial cells (FRECKS) (Leung et al. Science 246, 1306 (1989) , Ferrara and the Purpose Gene, "Scientific Communications on Biochemistry and Biophysics" (Biochem. Biophys. Res. Commun), 161, 851 (1989), Tischer et al., "Scientific Communications on Biochem. And Biophys. "(Biochem. Biophys. Res. Commun), 165, 1198 (1989), Ferrara et al. PCT Pat. Publ. N WO 90/13649 (published November 15, 1990); Ferrara et al. U.S. Patent Application (U. S. Pat. App.) N 07/360229).
ФРЭККС был впервые определен в среде, кондиционированной фолликулярными или фолликулостеллярными клетками бычьего гипофиза. Биохимический анализ показывает, что бычий ФРЭККС представляет собой димерный белок с примерным молекулярным весом около 45000 дальтон и с вероятной митогенной специфичностью для эндотелиальных клеток кровеносных сосудов. ДНК, кодирующая бычий ФРЭККС, была выделена посредством скрининга библиотеки кДНК, приготовленной из таких клеток с использованием в качестве пробы гибридизации олегонуклеотидов, основанных на последовательности аминокислот аминного конца молекулы белка. PRECKS was first determined in a medium conditioned by bovine pituitary follicular or folliculostellar cells. Biochemical analysis shows that bovine TRACKS is a dimeric protein with an approximate molecular weight of about 45,000 daltons and with likely mitogenic specificity for endothelial cells of blood vessels. The DNA encoding bovine TRACKS was isolated by screening a cDNA library prepared from such cells using oleconucleotides based on the amino acid sequence of the amino terminus of the protein molecule as a hybridization probe.
ФРЭККС человека был приготовлен сначала посредством скрининга библиотеки кДНК, приготовленной из таких клеток человека, с использованием кДНК бычьего ФРЭККС в качестве пробы для гибридизации. Одна из кДНК, выделенных таким способом, кодирует белок, состоящий из 165 аминокислот и имеющий более чем 95% гомологию с бычьим ФРЭККС. Данный белок получил название человеческого ФРЭККС (ФРЭККС). Митогенная активность человеческого ФРЭККС была подтверждена путем экспрессии кДНК человеческого ФРЭККС в клетках млекопитающих. Среда, кондиционированная клетками, которые были трансфецированы кДНК человеческого ФРЭККС, поддерживала пролиферацию капиллярных эндотелиальных клеток, в то время как контрольные клетки не проявляли такой активности [Леунг и др., "Наука" (Science), 246: 1306 (1989)]. Human HREFKS was first prepared by screening a cDNA library prepared from such human cells using bovine HMFRS cDNA as a hybridization probe. One of the cDNA isolated in this way encodes a protein consisting of 165 amino acids and having more than 95% homology with bovine TRACKS. This protein is called human TRACKS (FRECKS). Mitogenic activity of human HREFKS was confirmed by expression of human hREFKS cDNA in mammalian cells. Medium-conditioned cells that were transfected with human TRACKS cDNA supported the proliferation of capillary endothelial cells, while control cells did not show such activity [Leung et al., Science, 246: 1306 (1989)].
Помимо ФРЭККС в библиотеках кДНК человека были определены еще несколько дополнительных кДНК, которые кодируют изоформы ФРЭККС, состоящие из 121, 189, и 206 аминокислот (совместно называемые белками, близкими к ФРЭККС). Белок, состоящий из 121 аминокислоты, отличается от ФРЭККС наличием делеции 44 аминокислот между позициями аминокислотных остатков 116 и 159 в последовательности ФРЭККС. Белок, состоящий из 189 аминокислот, отличается от ФРЭККС наличием вставки добавочных 24 аминокислот после позиции аминокислотного остатка 116, и, по всей видимости, этот белок идентичен человеческому фактору проницаемости кровеносных сосудов (чФПКС). Белок, состоящий из 206 аминокислот, отличается от ФРЭККС наличием вставки добавочной 41 аминокислоты после позиции аминокислотного остатка 116 [Хоук и др. "Молекулярная эндокринология" (Mol. Endocrinol.), 5: 1806 (1991); Феррара и др. "Журнал клеточной биохимии" (J. Cell Biochem.), 47: 211 (1991); Феррара и др. "Эндокринол. обозрение" (Endrocrine Reviews), 13: 18 (1992); Кек и др. "Наука" (Science), 246: 1309 (1989); Коннолли и др. "Журнал биологической химии" (J. Biol. Chem. ), 264: 20017 (1989); Кек и др. ЕРО. Pat. Publ. N 0370989 (опубликовано 30 мая 1990 г.). In addition to FREKS, several additional cDNAs have been identified in human cDNA libraries that encode isoforms of FREKS, consisting of 121, 189, and 206 amino acids (collectively called proteins close to FREKS). A protein consisting of 121 amino acids differs from FREKS in the presence of a deletion of 44 amino acids between the positions of amino acid residues 116 and 159 in the sequence of FREKS. A protein consisting of 189 amino acids differs from FREX in the presence of an insertion of an additional 24 amino acids after the position of amino acid residue 116, and, apparently, this protein is identical to the human blood vessel permeability factor (hFPCS). A protein consisting of 206 amino acids differs from FREX in the presence of an insertion of an additional 41 amino acids after the position of amino acid residue 116 [Hawke et al. "Molecular endocrinology" (Mol. Endocrinol.), 5: 1806 (1991); Ferrara et al. Journal of Cell Biochemistry (J. Cell Biochem.), 47: 211 (1991); Ferrara et al. Endrocrine Reviews (Endrocrine Reviews), 13: 18 (1992); Keck et al. Science, 246: 1309 (1989); Connolly et al. Journal of Biological Chemistry (J. Biol. Chem.), 264: 20017 (1989); Kek et al. EPO. Pat. Publ. N 0370989 (published May 30, 1990).
ФРЭККС не только стимулирует пролиферацию эндотелиальных клеток кровеносных сосудов, но также индуцирует проницаемость кровеносных сосудов и ангиогенез. Ангиогенез, который включает образование новых кровеносных сосудов из уже существующего эндотелия, является важным компонентом многих заболеваний и нарушений, в том числе таких, как рост и метастазирование опухолей, ревматический артрит, псориаз, атеросклероз, диабетическая ретинопатия, ретролентальная фиброплазия, неоваскулярная глаукома, гемангиомы, иммунное отторжение трансплантированной роговицы и других тканей, а также хронические воспаления. TRACKS not only stimulates the proliferation of endothelial cells of blood vessels, but also induces permeability of blood vessels and angiogenesis. Angiogenesis, which includes the formation of new blood vessels from an existing endothelium, is an important component of many diseases and disorders, including such as tumor growth and metastasis, rheumatoid arthritis, psoriasis, atherosclerosis, diabetic retinopathy, retrolental fibroplasia, neovascular glaucoma, hemangiomas, immune rejection of the transplanted cornea and other tissues, as well as chronic inflammation.
В случае роста опухолей ангиогенез имеет особенно важное значение при переходе от гиперплазии к неоплазии, а также для обеспечения питания растущей твердой опухоли [Фолкман и др. "Природа" (Nature), 339: 58 (1989)]. Ангиогенез также позволяет опухолям находиться в контакте с кровеносной системой хозяина, в результате чего могут быть определены направления метастазирования для клеток опухоли. Данные, подтверждающие роль ангиогенеза в метастазировании клеток опухоли, были получены, в частности, в результате исследований, показавших корреляцию между количеством и плотностью микрососудов на гистологических срезах инвазивной карциномы груди человека и фактическим наличием метастазов, распространившихся на значительное расстояние [Вейднер и др."Медицинск, журнал Новой Англии" (New Eng. J. Med.), 324: 1 (1991)]. In the case of tumor growth, angiogenesis is especially important in the transition from hyperplasia to neoplasia, as well as to ensure the nutrition of a growing solid tumor [Folkman et al. Nature, 339: 58 (1989)]. Angiogenesis also allows tumors to be in contact with the host circulatory system, as a result of which metastatic directions for tumor cells can be determined. Data confirming the role of angiogenesis in tumor cell metastasis was obtained, in particular, as a result of studies showing a correlation between the number and density of microvessels on histological sections of invasive human breast carcinoma and the actual presence of metastases spread over a considerable distance [Weidner et al. "Medical New England Journal "(New Eng. J. Med.), 324: 1 (1991)].
В свете значения роста эндотелиальных клеток кровеносных сосудов и ангиогенеза, а также роли этих процессов в различных заболеваниях и нарушениях желательно было бы иметь средства для уменьшения или остановки одного или нескольких из биологических эффектов, оказываемых ФРЭККС. In light of the importance of the growth of endothelial cells of blood vessels and angiogenesis, as well as the role of these processes in various diseases and disorders, it would be desirable to have means to reduce or stop one or more of the biological effects exerted by HREFKS.
Желательно также иметь средства для обнаружения присутствия ФРЭККС в нормальных и патологических условиях, и особенно в случае наличия рака. It is also desirable to have means for detecting the presence of TRACKS in normal and pathological conditions, and especially in the case of cancer.
Краткое описание изобретения
В настоящем изобретении представлены вещества-антагонисты ФРЭКСС, включая (а) антитела и их варианты, способные к специфическому связыванию ФРЭККС, рецептора ФРЭККС или же комплекса ФРЭККС и рецептора ФРЭККС; (б) рецептор ФРЭККС и его варианты и (в) варианты ФРЭККС. Подобные антагонисты ингибируют митогенную, ангиогенную и прочую биологическую активность ФРЭККС и, следовательно, могут быть применены для лечения заболеваний или нарушений, характеризующихся избыточной неоваскуляризацией, в том числе, например, опухолей (в особенности твердых злокачественных опухолей), ревматоидного артрита, псориаза, атеросклероза, диабетической и другой ретинопатии, ретролентальной фиброплазии, неоваскулярной глаукомы, гемангиомы, гиперплазии щитовидной железы (включая болезнь Грейва), иммунного отторжения трансплантировенной роговицы и других тканей, а также хронических воспалений. Антагонисты могут быть применены также для лечения заболеваний или нарушений, характеризующихся нежелательной избыточной проницаемостью кровеносных сосудов, таких как отеки, связанные с опухолью мозга, асциты, связанные со злокачественными опухолями, синдром Мейгса, воспаление легких, нефротический синдром, перикардиальный выпот (например, связанный с перикардитом) и плевральный выпот.SUMMARY OF THE INVENTION
The present invention provides antagonists of the HREFCC antagonist, including (a) antibodies and variants thereof capable of specific binding of the HREFX, the HREAX receptor, or the HREAX complex and the HREA receptor; (b) the receptor of the FREX and its variants; and (c) the variants of the FREX. Such antagonists inhibit mitogenic, angiogenic and other biological activity of PRECKS and, therefore, can be used to treat diseases or disorders characterized by excessive neovascularization, including, for example, tumors (especially solid malignant tumors), rheumatoid arthritis, psoriasis, atherosclerosis, diabetic and other retinopathy, retrolental fibroplasia, neovascular glaucoma, hemangiomas, thyroid hyperplasia (including Grave's disease), immune trans rejection spliced cornea and other tissues, as well as chronic inflammation. Antagonists can also be used to treat diseases or disorders characterized by undesirable excess vascular permeability, such as swelling associated with a brain tumor, ascites associated with malignant tumors, Meigs syndrome, pneumonia, nephrotic syndrome, pericardial effusion (for example, associated with pericarditis) and pleural effusion.
Помимо того, антагонисты ФРЭККС являются полиспецифическими моноклональными антителами, которые способны связываться: (а) с иными эпитопами, чем эпитоп ФРЭККС, например эпитопами белка, участвующего в процессах тромбогенеза или тромболиза, или антигеном поверхности опухолевой клетки и (б) с ФРЭККС, рецептором ФРЭККС или же с комплексом ФРЭККС и рецептора ФРЭККС. In addition, PRECKS antagonists are polyspecific monoclonal antibodies that can bind: (a) to other epitopes than the PRECKS epitope, for example, the epitopes of a protein involved in thrombogenesis or thrombolysis, or the antigen of the surface of a tumor cell, and (b) the PRECKS receptor or with a complex of PREFX and a receptor PFREX.
Помимо того, антагонисты ФРЭККС могут быть присоединены к цитотоксическому остатку. In addition, TRACKS antagonists may be attached to the cytotoxic residue.
Кроме того, данное изобретение относится к выделению нуклеиновых кислот, кодирующих моноклональные антитела согласно вышеописанному, а также к линиям клеток гибридомы, продуцирующим подобные моноклональные антитела. In addition, this invention relates to the isolation of nucleic acids encoding monoclonal antibodies as described above, as well as to hybridoma cell lines producing similar monoclonal antibodies.
Помимо того, данное изобретение относится к фармацевтическим составам, включающим антагонист ФРЭККС в количестве, достаточном для снижения или остановки митогенной или ангиогенной активности ФРЭККС млекопитающих. In addition, this invention relates to pharmaceutical compositions comprising an antagonist of the HREA in an amount sufficient to reduce or stop the mitogenic or angiogenic activity of the HREA of mammals.
В другом плане данное изобретение относится к методам лечения, состоящим в применении к млекопитающему, желательно к пациенту-человеку, нуждающемуся в подобном лечении, физиологически эффективного количества антагониста ФРЭККС. При желании, совместно с антагонистом ФРЭККС могут быть применены (одновременно или последовательно) другие антагонисты ФРЭККС или антиопухолевые или антиангиогенные вещества (одно или более). In another aspect, this invention relates to methods of treatment consisting in applying to a mammal, preferably to a human patient, in need of such treatment, a physiologically effective amount of an antagonist of TRACKS. If desired, in conjunction with an antagonist of PRECKS, other antagonists of PRECKS or antitumor or antiangiogenic substances (one or more) can be used (simultaneously or sequentially).
Кроме того, данное изобретение относится к методу обнаружения ФРЭККС в пробах посредством приведения пробы в контакт с антителом, способным специфически связываться с ФРЭККС, и определения степени такого связывания. In addition, this invention relates to a method for detecting TRACKS in samples by contacting a sample with an antibody capable of specifically binding to TRACKS and determining the extent of such binding.
Краткое описание иллюстраций
Фиг. 1 показывает эффект моноклональных антител к ФРЭККС (A4.6.1 или В2.6.2), а также постороннего антитела к фактору роста гепатоцитов (анти-ФРГ) на связывание моноклональных антител к ФРЭККС с ФРЭККС.Brief Description of the Illustrations
FIG. 1 shows the effect of monoclonal antibodies to HREFKS (A4.6.1 or B2.6.2), as well as an extraneous antibody to hepatocyte growth factor (anti-HGF), on the binding of monoclonal antibodies to HREFKS with HREFKS.
Фиг. 2 показывает эффект моноклональных антител к ФРЭККС (A4.6.1 или B2.6.2), а также постороннего анти-ФРГ на биологическую активность ФРЭККС в культурах бычьих клеток капиллярного эндотелия коры надпочечников (КЭКН). FIG. 2 shows the effect of monoclonal antibodies to HREFKS (A4.6.1 or B2.6.2), as well as extraneous anti-HGF on the biological activity of HREFKS in bovine cell cultures of capillary endothelium of the adrenal cortex (ECCN).
Фиг. 3 показывает эффект моноклональных антител к ФРЭККС (A4.6.1, B2.6.2 или A2.6.1) на связывание ФРЭККС с бычьими клетками КЭКН. FIG. Figure 3 shows the effect of monoclonal antibodies to TRACKS (A4.6.1, B2.6.2 or A2.6.1) on the binding of TRACKS to bovine ECEC cells.
Фиг. 4 показывает эффект применения моноклонального антитела к ФРЭККС (A4.6.1) на скорость роста мышиных опухолей NEG55. FIG. Figure 4 shows the effect of the application of the monoclonal anti-HREFX antibody (A4.6.1) on the growth rate of murine NEG55 tumors.
Фиг. 5 показывает эффект применения моноклонального антитела к ФРЭККС (A4.6.1) на величину мышиных опухолей NEG55 после применения в течение пяти недель. FIG. Figure 5 shows the effect of the application of the monoclonal antibody to PRECKS (A4.6.1) on the size of murine NEG55 tumors after administration for five weeks.
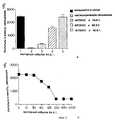
Фиг. 6 показывает эффект применения моноклонального антитела к ФРЭККС A4.6.1 (Ат ФРЭККС) на рост мышиных опухолей SK-LMS-1. FIG. Figure 6 shows the effect of the application of the monoclonal antibody to PRECKS A4.6.1 (AT PRECKS) on the growth of murine tumors SK-LMS-1.
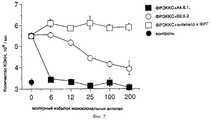
Фиг. 7 показывает эффект применения различных по величине доз моноклонального антитела к ФРЭККС A4.6.1 (Ат ФРЭККС) на рост мышиных опухолей A673. FIG. 7 shows the effect of the use of different-sized doses of the monoclonal anti-HREFX A4.6.1 monoclonal antibody (AT HREFX) on the growth of murine A673 tumors.
Фиг. 8 показывает эффект моноклонального антитела к ФРЭККС A4.6.1 на рост и выживаемость культуры клеток глиобластомы NEG55 (G55). FIG. Figure 8 shows the effect of the monoclonal anti-HREFRS A4.6.1 antibody on the growth and survival of a NEG55 glioblastoma cell culture (G55).
Фиг. 9 показывает эффект моноклонального антитела к ФРЭККС A4.6.1 на рост и выживаемость культуры клеток рабдомиосаркомы A673. FIG. 9 shows the effect of the monoclonal anti-HREFRS A4.6.1 antibody on the growth and survival of the A673 rhabdomyosarcoma cell culture.
Фиг. 10 показывает эффект моноклонального антитела к ФРЭККС A4.6.1 на хемотаксис человеческих эндотелиальных клеток, вызванный человеческой синовиальной жидкостью. FIG. 10 shows the effect of a monoclonal antibody to HREFX A4.6.1 on chemotaxis of human endothelial cells caused by human synovial fluid.
Подробное описание изобретения
Термин "ФРЭККС" используется здесь и далее по отношению к человеческому фактору роста эндотелиальных клеток кровеносных сосудов, состоящему из 165 аминокислот, а также по отношению к близким человеческим факторам роста эндотелиальных клеток кровеносных сосудов, состоящим из 121, 189 и 206 аминокислот, согласно описанию Леунг и др. "Наука" (Science), 246: 1306 (1989) и Хоук и др., "Молекулярная эндокринология" (Mol. Endocrin.), 5: 1806 (1991), а также по отношению к встречающимся в природе аллельным или модифицированным формам таких факторов роста.DETAILED DESCRIPTION OF THE INVENTION
The term "FREX" is used hereinafter in relation to the human growth factor of blood vessel endothelial cells, consisting of 165 amino acids, as well as in relation to close human growth factors of blood vessel endothelial cells, consisting of 121, 189 and 206 amino acids, as described by Leung et al. “Science” (Science), 246: 1306 (1989) and Hawke et al., “Molecular Endocrinology” (Mol. Endocrin.), 5: 1806 (1991), as well as in relation to naturally occurring allelic or modified forms of such growth factors.
Настоящее изобретение включает вещества-антагонисты ФРЭККС, которые способны ингибировать одну или более из биологических активностей ФРЭККС, например его митогенную или ангиогенную активность. Действие антагонистов ФРЭККС заключается в препятствовании связыванию ФРЭККС с клеточным рецептором, в остановке жизнедеятельности или уничтожении клеток, которые были активированы ФРЭККС, или в препятствовании активации эндотелиальных клеток кровеносных сосудов после того, как ФРЭККС связывается с клеточным рецептором. Для целей данного изобретения все подобные моменты воздействия антагонистов ФРЭККС будут считаться эквивалентными. Таким образом, в состав данного изобретения включаются антитела, предпочтительно моноклональные, или же фрагменты таковых, которые связываются с ФРЭККС, рецептором ФРЭККС или же с комплексом ФРЭККС и рецептора ФРЭККС. Помимо того, в состав данного изобретения включаются фрагменты ФРЭККС и варианты аминокислотной последовательности ФРЭККС, которые связываются с рецептором ФРЭККС, но не проявляют биологической активности нативного ФРЭККС. Помимо того, в состав данного изобретения включаются рецептор ФРЭККС, а также его фрагменты и варианты его аминокислотной последовательности, которые способны связывать ФРЭККС. The present invention includes antagonists of TRACKS, which are capable of inhibiting one or more of the biological activities of TRACKS, for example, its mitogenic or angiogenic activity. The action of TRACKS antagonists is to inhibit the binding of TRACKS to the cell receptor, to halt the activity or destruction of cells that have been activated by TRACKS, or to inhibit the activation of endothelial cells of blood vessels after the TRACKS binds to the cell receptor. For the purposes of this invention, all such moments of exposure to TRACKS antagonists will be considered equivalent. Thus, the composition of the present invention includes antibodies, preferably monoclonal, or fragments thereof, which bind to the HREFKS, the HREFKS receptor, or the complex HREFKS and the HREFKS receptor. In addition, the composition of the present invention includes fragments of PRECKS and variants of the amino acid sequence of PRECKS, which bind to the receptor of PRECKS, but do not exhibit the biological activity of the native PRECKS. In addition, the composition of the present invention includes the receptor of PRECKS, as well as its fragments and variants of its amino acid sequence, which are able to bind PRECKS.
Термин "рецептор ФРЭККС" (рФРЭККС) используется здесь и далее по отношению к клеточному, как правило, поверхностному рецептору, находящемуся на эндотелиальных клетках кровеносных сосудов человека, а также к его вариантам, которые сохраняют способность связывать ФРЭККС. Как правило, те рецепторы ФРЭККС и их варианты, которые являются антагонистами ФРЭККС, будут фигурировать в изолированной форме, в отличие от ситуации в естественных условиях, где они могут быть интегрированы в состав клеточной мембраны или прикреплены к поверхности клетки. Одним из примеров рецептора ФРЭККС является fms-подобная тирозинкиназа (flt), трансмембранный рецептор из группы тирозинкиназ [ДеФриз и др. "Наука" (Science), 255: 989 (1992); Шибуя и др. "Онкоген" (Oncogene), 5: 519 (1990)]. Рецептор flt состоит из внеклеточного домена, трансмембранного домена и внутриклеточного домена, имеющего тирозинкиназную активность. Внеклеточный домен участвует в связывании ФРЭККС, в то время как внутриклеточный домен участвует в передаче сигнала. The term “FRECX receptor” (rFREX) is used hereinafter in relation to the cellular, usually surface, receptor located on the endothelial cells of human blood vessels, as well as its variants that retain the ability to bind FREX. As a rule, those receptors of PRECKS and their variants that are antagonists of PRECKS will appear in an isolated form, in contrast to the situation in vivo, where they can be integrated into the composition of the cell membrane or attached to the surface of the cell. One example of a PRECKS receptor is fms-like tyrosine kinase (flt), a transmembrane receptor from the tyrosine kinase group [DeFreeze et al. Science, 255: 989 (1992); Shibuya et al. Oncogene (Oncogene), 5: 519 (1990)]. The flt receptor consists of an extracellular domain, a transmembrane domain, and an intracellular domain having tyrosine kinase activity. The extracellular domain is involved in the binding of HECREF, while the intracellular domain is involved in signal transmission.
Другим примером рецептора ФРЭККС является рецептор flk-1 (называемый также KDR) [Мэтьюс и др. "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci. ), 88: 9026 (1991); Терман и др. "Онкоген" (Oncogene), 6: 1677 (1991); Терман и др. "Научн. сообщ. по биохим. и биофиз". (Biochem. Biophys. Res. Commun.), 187: 1579 (1992)]. Another example of a receptor for TRACKS is the flk-1 receptor (also called KDR) [Matthews et al. Proceedings of the National Acad. Sciences (Proc. Nat. Acad. Sci.), 88: 9026 (1991); Terman et al. Oncogene (Oncogene), 6: 1677 (1991); Terman et al. "Scientific communication on biochemistry and biophysis." (Biochem. Biophys. Res. Commun.), 187: 1579 (1992)].
Связывание ФРЭККС с рецептором flt приводит к образованию по меньшей мере двух комплексов с высоким молекулярным весом от 205000 до 300000 дальтон. Комплекс с весом 300000 дальтон, по-видимому, является димером, включающим две молекулы рецептора, связанные с одной молекулой ФРЭККС. The binding of PRECKS to the flt receptor leads to the formation of at least two complexes with a high molecular weight of from 205,000 to 300,000 daltons. The complex, weighing 300,000 daltons, appears to be a dimer comprising two receptor molecules linked to a single FRECX molecule.
В состав данного изобретения включены также варианты рФРЭККС. Примеры таких вариантов включают усеченные формы рецепторов, где отсутствуют трансмембранный и цитоплазматический домены, а также слитые белки, в которых полимеры или полипептиды, отличные от рФРЭККС, присоединены к рФРЭККС или же, предпочтительно, к его усеченным формам. Примером такого полипептида, отличного от рФРЭККС, является иммуноглобулин. В этом случае, например, внеклеточный домен рФРЭККС замещен Fv-доменом легкой или (предпочтительно) тяжелой цепи иммуноглобулина, причем C-конец внеклеточного домена рецептора ковалентно соединен с аминоконцом фрагмента тяжелой цепи (CH-1, сочленения, CH-2, или другого фрагмента). Подобные варианты построены таким же образом, как известные иммуноадгезоны, см., например: Гаскойн и др. "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci.), 84: 2936 (1987); Капон и др. "Природа" (Nature), 337: 525 (1989); Аруффо и др. "Клетка" (Cell), 61: 1303 (1990); Ашкенази и др. "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci.), 88: 10535 (1991); Беннетт и др. "Журн. биол. химии" (J. Biol. Chem.), 266: 23060 (1991). В других случаях рФРЭККС может быть присоединен к небелковому полимеру, такому как полиэтиленгликоль (ПЭГ) [см. Дэвис и др. Патент США (U. S. Patent) N 4179337; Гудсон и др. "Биотехнология" (Biotechnology), 8: 343-346 (1990); Абуховски и др. "Журн. биол. химии" (J. Biol. Chem.), 252: 3578 (1977); Абуховски и др. "Журн. биол. химии" (J. Biol. Chem.), 252: 3582 (1977)] или углеводы [см., например: Маршалл и др. "Архив биохимии и биофизики" (Arch. Biochem. Biophys. ), 167: 77 (1975)]. Посредством этого достигается увеличение срока биологического полураспада рФРЭККС и уменьшается вероятность того, что рецептор окажет иммуногенное влияние на млекопитающее, к которому этот рецептор будет применен. Использование рФРЭККС аналогично использованию антител к ФРЭККС, если принять во внимание сродство антагониста и число мест его связывания с ФРЭККС. Also included in the composition of the present invention are variants of rFREX. Examples of such options include truncated forms of receptors where there is no transmembrane and cytoplasmic domains, as well as fusion proteins in which polymers or polypeptides other than rFREX are attached to rFREX or, preferably, to its truncated forms. An example of such a polypeptide other than rFREX is immunoglobulin. In this case, for example, the extracellular domain of rFREX is replaced by the Fv domain of the light or (preferably) immunoglobulin heavy chain, the C-terminus of the extracellular domain of the receptor being covalently linked to the amino terminus of the heavy chain fragment (CH-1, junction, CH-2, or another fragment ) Similar variants are constructed in the same way as the well-known immunoadhesion agents, see, for example: Gascoigne et al. Izvestia National Akad. Nauk (Proc. Nat. Acad. Sci.), 84: 2936 (1987); Kapon et al. Nature, 337: 525 (1989); Aruffo et al. Cell, 61: 1303 (1990); Ashkenazi et al. "Proceedings of the National Acad. Sciences" (Proc. Nat. Acad. Sci.), 88: 10535 (1991); Bennett et al., J. Biol. Chemistry (J. Biol. Chem.), 266: 23060 (1991). In other cases, rFREX may be attached to a non-protein polymer, such as polyethylene glycol (PEG) [see Davis et al. U.S. Patent No. 4,179,337; Goodson et al. Biotechnology, 8: 343-346 (1990); Abukhovsky et al., J. Biol. Chemistry (J. Biol. Chem.), 252: 3578 (1977); Abukhovsky et al., J. Biol. Chemistry (J. Biol. Chem.), 252: 3582 (1977)] or carbohydrates [see, for example, Marshall et al., Archive of Biochemistry and Biophysics (Arch. Biochem. Biophys.), 167: 77 (1975)]. Through this, an increase in the biological half-life of rFREXX is achieved and the likelihood that the receptor will have an immunogenic effect on the mammal to which this receptor is applied is reduced. The use of rFREX is similar to the use of antibodies to FREKS, given the affinity of the antagonist and the number of sites of its binding to FREKS.
Внеклеточный домен рецептора ФРЭККС сам по себе или же слитый с иммуноглобулинным полипептидом или другим полипептидом-носителем в особенности полезен для использования в качестве антагониста ФРЭККС ввиду того, что внеклеточный домен может связывать ФРЭККС клетки-хозяина, не связанный с рФРЭККС на поверхности клетки. The extracellular domain of the TRACKS receptor alone or fused to an immunoglobulin polypeptide or other carrier polypeptide is particularly useful for use as a TRACKS antagonist because the extracellular domain can bind the TRACKS of a host cell unrelated to rFREKS on the cell surface.
Кроме того, рФРЭККС и его варианты могут использоваться в скрининговых анализах для выявления агонистов и антагонистов ФРЭККС. Например, клетки хозяина, трансфецированные ДНК, кодирующей рФРЭККС (например, ДНК flt или flk-1), проявляют избыточную экспрессию рецепторного полипептида на поверхности клетки, в результате чего такие рекомбинантные клетки хозяина могут идеально служить для анализа того, как тестируемое вещество (например, небольшая молекула, линейный или циклический пептид или полипептид) связывается с рФРЭККС. Подобным же образом могут быть использованы белки, в которых рФРЭККС слит с другим белком, например слитый белок рФРЭККС-ИгГ. К примеру, слитый белок может быть присоединен к иммобилизованному основанию, после чего определяется способность тестируемого вещества удалять ФРЭККС, помеченный радиоактивным изотопом, из домена слитого белка, включающего рФРЭККС. In addition, rFREX and its variants can be used in screening assays for the detection of agonists and antagonists of FREX. For example, host cells transfected with DNA encoding rFREX (e.g., flt or flk-1 DNA) exhibit over-expression of the receptor polypeptide on the cell surface, whereby such recombinant host cells can ideally serve to analyze how the test substance (e.g. a small molecule, a linear or cyclic peptide or polypeptide) binds to rFREX. Similarly, proteins may be used in which rFREXX is fused to another protein, for example, the rFREX-IgG fusion protein. For example, a fusion protein can be attached to an immobilized base, after which the ability of a test substance to remove the HECF, labeled with a radioactive isotope, from the domain of the fusion protein, including rFREX, is determined.
Термин "рекомбинантный", применяемый в отношении к ФРЭККС, рецептору ФРЭККС, моноклональным антителам или прочим белкам, обозначает белки, которые производятся путем экспрессии рекомбинантной ДНК в клетках хозяина. Клетка-хозяин может быть прокариотической (например, бактериальная клетка, такая как Е. coli) или эукариотической (например, клетка дрожжей или млекопитающих). The term "recombinant", as used in relation to FREKS, receptor FREKS, monoclonal antibodies or other proteins, refers to proteins that are produced by expression of recombinant DNA in the host cells. The host cell may be prokaryotic (for example, a bacterial cell such as E. coli) or eukaryotic (for example, a yeast or mammalian cell).
Моноклональные антитела-антагонисты
Термин "моноклональное антитело" используется здесь и далее для обозначения антитела, полученного из популяции достаточно однородных антител, т. е. индивидуальные антитела, составляющие популяцию, идентичны в своей специфичности и сродству, за исключением возможных, естественно встречающихся мутаций, которые могут присутствовать в незначительных количествах. Необходимо обратить внимание на то, что в результате подобных, естественно встречающихся, мутаций состав моноклональных антител в данном изобретении, которое в большинстве своем содержит антитела, способные специфически связывать ФРЭККС, рецептор ФРЭККС или же комплекс ФРЭККС и рецептора ФРЭККС, может также включать незначительные количества прочих антител.Monoclonal Antagonist Antibodies
The term "monoclonal antibody" is used hereinafter to mean an antibody obtained from a population of sufficiently homogeneous antibodies, that is, the individual antibodies that make up the population are identical in their specificity and affinity, with the exception of possible naturally occurring mutations that may be present in minor quantities. It is necessary to pay attention to the fact that, as a result of naturally occurring mutations, the composition of monoclonal antibodies in this invention, which for the most part contains antibodies that can specifically bind FRECC, the TRACC receptor, or the complex of TRACC and the FRECC receptor, may also include insignificant amounts of others antibodies.
Таким образом, термин "моноклональное" указывает на характер антитела, происходящего из достаточно однородной популяции антител, но здесь не имеется в виду, что антитела должны производиться каким-либо определенным путем. Например, моноклональные антитела, описанные в данном изобретении, могут быть получены гибридомным методом [Колер и Милстейн."Природа" (Nature), 256: 495 (1975)] или с применением методов, использующих рекомбинантную ДНК [Кабилли и др. Патент США (U. S. Patent) N 4816567]. Thus, the term "monoclonal" indicates the nature of the antibody originating from a fairly homogeneous population of antibodies, but this does not mean that antibodies must be produced in any particular way. For example, the monoclonal antibodies described in this invention can be obtained by hybridoma method [Kohler and Milstein. "Nature", 256: 495 (1975)] or using methods using recombinant DNA [Cabilly et al. US Patent ( US Patent) N 4816567].
При получении моноклональных антител гибридомным методом мышь или другое подходящее животное-хозяин иммунизируется антигеном посредством подкожной, внутриперитонеальной или внутримышечной инъекции с целью выявить лимфоциты, которые производят или же способны производить антитела, специфически связывающиеся с белком(ами), использованным(и) для иммунизации. В качестве альтернативы, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с клетками миеломы с использованием соответствующего агента, например такого, как полиэтиленгликоль, чтобы создать гибридомную клетку [Годинг, "Моноклональные антитела: Принципы и практика" (Monoclonal Antibodies: Principles and Practice, с. 59-103 (Academic Press, 1986)]. When monoclonal antibodies are produced by the hybridoma method, a mouse or other suitable host animal is immunized with an antigen by subcutaneous, intraperitoneal, or intramuscular injection to detect lymphocytes that produce or are capable of producing antibodies that specifically bind to the protein (s) used for immunization. Alternatively, lymphocytes can be immunized in vitro. The lymphocytes are then fused to myeloma cells using an appropriate agent, such as polyethylene glycol, to create a hybridoma cell [Goding, “Monoclonal Antibodies: Principles and Practice” (Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986 )].
Таким антигеном могут являться ФРЭККС, рФРЭККС или же комплекс ФР ЭККС и рФРЭККС. Антиген может представлять собой фрагмент или часть ФРЭККС или рФРЭККС, обладающие одним или несколькими аминокислотными остатками, которые участвуют в связывании ФРЭККС с одним из его рецепторов. Например, иммунизация внеклеточным доменом рФРЭККС (т.е. усеченным полипептидом рФРЭККС, в котором отсутствуют трансмембранный и внутриклеточный домены) будет особенно пригодна для получения антител, являющихся антагонистами ФРЭККС, поскольку именно внеклеточный домен участвует в связывании ФРЭККС. Such an antigen can be FREX, rFREX or a complex of HF EX and rFREX. An antigen may be a fragment or part of an HFREX or rFREX having one or more amino acid residues that are involved in the binding of HREFKS to one of its receptors. For example, immunization with the rFREXX extracellular domain (i.e., the truncated rFREXC polypeptide in which there are no transmembrane and intracellular domains) will be particularly suitable for the production of antibodies that are antagonists of the HREFKS, since it is the extracellular domain that is involved in the binding of HREFKS.
Также могут быть использованы моноклональные антитела, способные к связыванию комплекса ФРЭККС и рФРЭККС, в особенности если они при этом не связываются с неассоциированными (не находящимся в составе комплекса) ФРЭККС и рФРЭККС. Подобные антитела, таким образом, связываются только с клетками, которые находятся в данный момент в состоянии активации, вызванном ФРЭККС, и, соответственно, не изолированы свободными ФРЭККС и рФРЭККС, что является обычной ситуацией в клетках млекопитающих. Такие антитела обычно связывают эпитоп, который занимает одно или несколько мест контакта между рецептором и ФРЭККС. Такие антитела были получены и для других лигандных рецепторных комплексов и могут быть аналогичным образом получены и в данном случае. Подобные антитела, независимо от наличия или отсутствия способности связываться с неассоциированными ФРЭККС и рФРЭККС, не обязательно должны нейтрализовать или ингибировать биологическую активность неассоциированных ФРЭККС и рФРЭККС. Monoclonal antibodies capable of binding the complex of HECF and rFREX can also be used, especially if they do not bind to unassociated (not part of the complex) HMFRS and rFREX. Such antibodies, therefore, bind only to cells that are currently in the activation state caused by HREFX, and, accordingly, are not isolated by free HREFX and rFREX, which is a common situation in mammalian cells. Such antibodies typically bind an epitope that occupies one or more sites of contact between the receptor and TRACKS. Such antibodies were obtained for other ligand receptor complexes and can be similarly obtained in this case. Such antibodies, irrespective of the presence or absence of the ability to bind to unassociated TRACKS and rFREKS, do not have to neutralize or inhibit the biological activity of unassociated TRACKS and rFREKS.
Приготовленные таким образом гибридомные клетки высеваются и выращиваются в подходящей культуральной среде, которая предпочтительно должна содержать одно или несколько веществ, которые ингибируют рост или выживание неслитых, родительских клеток миеломы. Например, в случае, если в родительских клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (ГГФРТ или ГФРТ), культуральная среда для гибридом обычно будет содержать гипоксантин, аминоптерин и тимидин (среда HAT), каковые вещества препятствуют росту клеток, не обладающих ГГФРТ. Thus prepared hybridoma cells are seeded and grown in a suitable culture medium, which preferably should contain one or more substances that inhibit the growth or survival of the unfused, parental myeloma cells. For example, if the parent myeloma cells lack the enzyme hypoxanthine guanine phosphoribosyltransferase (GGFRT or GGFRT), the hybrid culture medium will usually contain hypoxanthine, aminopterin and thymidine (HAT medium), which substances inhibit the growth of cells that do not have GGFRT.
Предпочтительно выбирать такие клетки миеломы, которые эффективно сливаются, поддерживают стабильный высокий уровень экспрессии антител в отобранных клетках, производящих антитела, и являются чувствительными к средам, таким, например, как среда HAT. Среди таких клеток предпочтительными клеточными линиями являются: мышиные линии миеломы, такие как линии, происходящие от мышиных опухолей МОРС-21 и МРС-11, которые можно получить из Центра распределения клеток Института им. Солка в Сан-Диего (Калифорния, США); клетки SP-2, которые можно получить из Американской коллекции типовых культур в Роквилле (Мэриленд, США); и клетки P3X63Ag8U.1, описанные Йелтоном и др. ("Текущие вопросы в микробиологии и иммунологии" (Curr. Top. Microbiol. Immunol.), 81: 1 (1978). Кроме того, были описаны клеточные линии человеческой миеломы и человеческо-мышиной гетеромиеломы, способные производить человеческие моноклональные антитела (Козбор, "Журн. иммунологии" (J.Immunol.), 133: 3001 (1984); Бродер и пр. "Получение моноклональных антител: методы и их применение" (Monoclonal Antibody Production Techniques and Applications), c. 51-63 (Marcel Dekker Inc., New York, 1987). It is preferable to select those myeloma cells that fuse efficiently, maintain a stable high level of antibody expression in selected antibody producing cells, and are sensitive to media, such as, for example, HAT medium. Among these cells, preferred cell lines are: murine myeloma lines, such as lines derived from murine tumors MORS-21 and MPC-11, which can be obtained from the Center for cell distribution of the Institute. Salk in San Diego (California, USA); SP-2 cells, which can be obtained from the American Type Culture Collection in Rockville (Maryland, USA); and P3X63Ag8U.1 cells described by Yelton et al. ("Current Issues in Microbiology and Immunology" (Curr. Top. Microbiol. Immunol.), 81: 1 (1978). In addition, cell lines of human myeloma and human murine heteromyelomas capable of producing human monoclonal antibodies (Cozbor, J. Immunol., J.Immunol., 133: 3001 (1984); Broder et al., “Preparation of monoclonal antibodies: methods and their use” (Monoclonal Antibody Production Techniques and Applications), pp. 51-63 (Marcel Dekker Inc., New York, 1987).
Культурная среда, в которой выращиваются клетки гибридомы, подвергается анализу для производства моноклональных антител, направленных против соответствующего антигена. Предпочтительно, чтобы специфичность связывания моноклональных антител, производимых клетками гибридомы, определялась путем иммунопреципитации или анализа связывания in vitro, например радиоиммуноанализом (RIA) или твердофазным иммуноферментным анализом (ELISA). Данное изобретение относится к тем моноклональным антителам, которые предпочтительно образуют иммунопреципитат с ФРЭККС, рФРЭККС или комплекс ФРЭККС и рФРЭККС, или же предпочтительно связывают по меньшей мере один из этих антигенов при анализе связывания и способны ингибировать биологическую активность ФРЭККС. The culture medium in which the hybridoma cells are grown is analyzed to produce monoclonal antibodies directed against the corresponding antigen. Preferably, the binding specificity of the monoclonal antibodies produced by the hybridoma cells is determined by immunoprecipitation or in vitro binding analysis, for example, radioimmunoassay (RIA) or enzyme-linked immunosorbent assay (ELISA). This invention relates to those monoclonal antibodies that preferably form an immunoprecipitate with PREFX, rFREX or a complex of PREFX and rFREX, or preferably bind at least one of these antigens in a binding assay and are capable of inhibiting the biological activity of PREFX.
После определения клеток гибридомы, которые производят антагонистические антитела желаемой специфичности, сродства и активности, клоны могут быть субклонированы методом ограниченных разбавлений и выращены стандартными методами [Годинг, "Моноклональные антитела: Принципы и практика" (Monoclonal Antibodies: Principles and Practice, с. 59-104 (Academic Press, 1986)]. К подходящим культуральным средам относятся, например, среда Игла, модифицированная Дулбекко (СИМД), или среда RPMI-1640. Кроме того, клетки гибридомы могут выращиваться in vivo в животных как асцитные опухоли. After identifying hybridoma cells that produce antagonistic antibodies of the desired specificity, affinity and activity, the clones can be subcloned by the method of limited dilutions and grown by standard methods [Goding, "Monoclonal Antibodies: Principles and Practice" (Monoclonal Antibodies: Principles and Practice, p. 59- 104 (Academic Press, 1986)]. Suitable culture media include, for example, Dulbecco's Modified Eagle Medium (SIMD) or RPMI-1640 Medium. In addition, hybridoma cells can be grown in vivo in animals as ascites tumors.
Моноклональные антитела, продуцированные субклонами, отделяются от культуральной среды, асцитной жидкости или плазмы путем использования обычных методов иммуноглобулинной очистки, таких как, например, белок A-Сефароза, гидроксилапатитная хроматография, электрофорез в гелях, диализ или аффинная хроматография. Monoclonal antibodies produced by subclones are separated from the culture medium, ascites fluid or plasma by conventional immunoglobulin purification methods, such as, for example, A-Sepharose protein, hydroxylapatite chromatography, gel electrophoresis, dialysis or affinity chromatography.
ДНК, кодирующая моноклональные антитела, описанные в данном изобретении, может быть с легкостью выделена и секвенирована обычными методами (например, с использованием олигонуклеотидных проб, способных связываться специфически с генами, кодирующими тяжелую и легкую цепу мышиных антител). В качестве предпочтительного источника ДНК служат клетки гибридомы, описанные в данном изобретении. После выделения ДНК может быть помещена в векторы экспрессии, которые затем трансфецируются в клетки хозяина, такие как обезьяньи клетки линии COS, клетки яичника китайского хомячка (СНО) или клетки миеломы, которые в иной ситуации не продуцируют иммуноглобулинный белок, для того чтобы достигнуть синтеза моноклональных антител в рекомбинантных клетках хозяина. DNA encoding the monoclonal antibodies described in this invention can be easily isolated and sequenced by conventional methods (for example, using oligonucleotide probes capable of binding specifically to genes encoding the heavy and light chains of murine antibodies). As a preferred source of DNA, hybridoma cells described in this invention are used. After isolation, DNA can be placed in expression vectors, which are then transfected into host cells, such as COS monkey monkey cells, Chinese hamster ovary (CHO) cells, or myeloma cells, which otherwise do not produce immunoglobulin protein in order to achieve monoclonal synthesis antibodies in recombinant host cells.
ДНК может быть модифицирована по выбору для того, чтобы изменить характер иммуноглобулина, продуцируемого экспрессией этой ДНК. Так, например, гуманизированные формы мышиных антител могут быть получены путем замещения комплементарной определяющей области (CDR) вариабельного домена мышиного антитела на соответствующую область человеческого антитела. В некоторых вариантах отдельные аминокислоты из базовой области (FR) мышиного антитела также замещаются на соответствующие аминокислотные остатки человеческого антитела [Картер и др. "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci.), 89: 4285 (1992); Картер и др. "Биотехнология" (Biotechnology), 10: 163 (1992)]. Химерные формы мышиных антител могут быть получены также путем замещения гомологичных мышиных последовательностей ДНК на последовательность, кодирующую отдельные области человеческих постоянных цепей иммуноглобулина (тяжелой и легкой) [Кабилли и др., Патент США (U. S. Patent) N 4816567; Моррисон и пр. "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci.), 81: 6851 (1984)]. DNA may be optionally modified in order to alter the nature of the immunoglobulin produced by expression of that DNA. For example, humanized forms of murine antibodies can be obtained by substituting the complementary determining region (CDR) of the variable domain of a murine antibody with the corresponding region of a human antibody. In some embodiments, individual amino acids from the base region (FR) of the murine antibody are also substituted with the corresponding amino acid residues of the human antibody [Carter et al. Proc. Nat. Acad. Sci., 89: 4285 (1992 ); Carter et al. "Biotechnology" (Biotechnology), 10: 163 (1992)]. Chimeric forms of murine antibodies can also be obtained by replacing homologous murine DNA sequences with a sequence encoding individual regions of the human immunoglobulin constant chains (heavy and light) [Cabilli et al., US Patent (U. S. Patent) N 4816567; Morrison et al. "Proceedings of the National Acad. Sciences" (Proc. Nat. Acad. Sci.), 81: 6851 (1984)].
Антитела, описанные в данном изобретении, включают варианты антител, такие как химерные (в том числе "гуманизированные") антитела и гибридные антитела, представляющие собой иммуноглобулинные цепи, способные связывать ФРЭККС, рецептор ФРЭККС, комплекс ФРЭККС и рецептора ФРЭККС, или же эпитоп, не принадлежащий к ФРЭККС. Antibodies described in this invention include antibody variants such as chimeric (including "humanized") antibodies and fusion antibodies that are immunoglobulin chains capable of binding to the HREFKS receptor, HREFKS receptor complex, HREFKS complex and HREFKS receptor, or an epitope, not belonging to FRECKS.
В состав таких антител включаются все виды, классы (например, IgA, IgD, lgE, IgG и IgM) и подклассы иммуноглобулинов, а также и фрагменты антител (например, Fab, F(ab')2 и Fv), пока они обладают способностью связывать ФРЭККС, рецептор ФРЭККС или комплекс ФРЭККС и рецептора ФРЭККС и пока они проявляют антагонизм по отношению к биологической активности ФРЭККС.The composition of such antibodies includes all types, classes (e.g., IgA, IgD, IgE, IgG and IgM) and subclasses of immunoglobulins, as well as antibody fragments (e.g., Fab, F (ab ')2 and Fv), while they have the ability to bind FREKS, the FREKS receptor or the complex of FREKS and the FREKS receptor and so far they are antagonistic to the biological activity of FREKS.
В случае предпочитаемого варианта данного изобретения моноклональные антитела будут проявлять сродство к иммунизирующему антигену в размере по меньшей мере 109 литров/моль, как определяется, например, анализом Скатчарда [Мансон и Поллард, "Аналит. биохимия" (Anal. Biochem), 107: 220 (1980)]. Кроме того, моноклональные антитела обычно будут ингибировать митогенную или ангиогенную активность ФРЭККС по крайней мере на 50%; предпочтительно на 80% и наиболее предпочтительно на 90%, как определяется, например, анализом выживания или пролиферации клеток in vitro, подобно описанному в Примере 2.In the case of a preferred embodiment of the present invention, monoclonal antibodies will show an affinity for the immunizing antigen of at least 109 liters / mol, as determined, for example, by Scatchard analysis [Manson and Pollard, Anal. Biochem), 107: 220 (1980)]. In addition, monoclonal antibodies will usually inhibit mitogenic or angiogenic activity of PRECKS by at least 50%; preferably 80% and most preferably 90%, as determined, for example, by analysis of the survival or proliferation of cells in vitro, as described in Example 2.
Для некоторых терапевтических и диагностических применений желательно, чтобы моноклональные антитела реагировали не со всеми различными молекулярными формами ФРЭККС. Например, может быть желательно получить моноклональное антитело, которое способно специфически связываться только с полипептидом ФРЭККС, имеющим последовательность из 165 аминокислот, но не с полипептидами ФРЭККС, имеющими последовательности из 121 или 189 аминокислот. Такие антитела легко определяются путем сравнения анализов ELISA или путем сравнения иммуноприпитации различных полипептидов ФРЭККС. For some therapeutic and diagnostic applications, it is desirable that monoclonal antibodies do not react with all of the various molecular forms of the HREFKS. For example, it may be desirable to obtain a monoclonal antibody that is able to specifically bind only to the HREA polypeptide having a sequence of 165 amino acids, but not to the HREA polypeptides having a sequence of 121 or 189 amino acids. Such antibodies are readily determined by comparing ELISA assays or by comparing the immunoprecipitation of various TRACKS polypeptides.
Конъюгаты с цитотоксическими остатками
В некоторых вариантах желательно иметь цитотоксический остаток в виде конъюгата с моноклональным антителом, специфическим для ФРЭККС, или же в виде конъюгата с рФРЭККС. В подобных вариантах цитотоксин служит для приостановки жизнедеятельности или для уничтожения клеток, которые проявляют экспрессию ФРЭККС или рецептора ФРЭККС или же связывают эти белки. Конъюгат нацеливается на клетку-мишень через посредство домена, который способен связываться с ФРЭККС, рФРЭККС или комплексом ФРЭККС и рФРЭККС.Conjugates with cytotoxic residues
In some embodiments, it is desirable to have a cytotoxic residue in the form of a conjugate with a monoclonal antibody specific for TRACKS, or in the form of a conjugate with rFREKS. In such embodiments, the cytotoxin is used to suspend vital activity or to kill cells that exhibit expression of the HECF or the HECF receptor or bind these proteins. The conjugate targets the target cell via a domain that is able to bind to FREX, rFREX or a complex of FREX and rFREX.
Таким образом, моноклональные антитела, способные связываться с ФРЭККС, рФРЭККС или комплексом ФРЭККС и рФРЭККС, конъюгируются с цитотоксинами. Подобным же образом конъюгируется с цитотоксином ФРЭККС. В то время, как в оптимальном случае моноклональные антитела способны нейтрализовать активность ФРЭККС и без участия цитотоксина, в случае данного варианта не является необходимым, чтобы моноклональное антитело или рецептор были способны к какой-либо другой активности, кроме связывания с ФРЭККС, рФРЭККС или комплексом ФРЭККС и рФРЭККС. Thus, monoclonal antibodies that are able to bind to FREKS, rFREKS or a complex of FREKS and rFREKS conjugate with cytotoxins. Similarly conjugated with the cytotoxin FRECKS. While in the best case, monoclonal antibodies are able to neutralize the activity of PRECKS without the participation of cytotoxin, in the case of this option it is not necessary that the monoclonal antibody or receptor is capable of any other activity, except for binding to PRECKS, rFREX or the complex PRECKS and rFREKKS.
В обычном случае в качестве цитотоксина выступает белковый цитотоксин, например токсин возбудителя дифтерии, рицин или токсин Pseudomonas, хотя в ряде случаев с некоторыми классами иммуноглобулинов домен Fc самого моноклонального антитела может служить в качестве цитотоксина [например, в случае антител IgG2, которые способны фиксировать комплемент и участвовать в антителозависимой клеточной цитотоксичности (АТКЦ)]. Однако цитотоксин не обязательно должен иметь белковую природу и может включать химиотерапевтические вещества, до настоящего времени употреблявшиеся, например, для лечения опухолей. In the usual case, a protein cytotoxin acts as a cytotoxin, for example, diphtheria pathogen toxin, ricin or Pseudomonas toxin, although in some cases with some classes of immunoglobulins the Fc domain of the monoclonal antibody itself can serve as a cytotoxin [for example, in the case of IgG2 antibodies that can fix complement and participate in antibody-dependent cellular cytotoxicity (ATCC)]. However, cytotoxin does not have to be protein in nature and may include chemotherapeutic substances that have so far been used, for example, to treat tumors.
Обычно цитотоксин присоединяется к моноклональному антителу или же фрагменту такого антитела через амидную связь в составе основной цепи молекулы антитела в ее домене Fc (или же замещая этот домен или его часть). В случае, когда рФРЭККС обеспечивает функцию нацеливания на клетку, цитотоксический остаток присоединяется к любому домену рецептора, который не участвует в связывании ФРЭККС. Предпочтительно, чтобы остаток замещал трансмембранный или цитоплазматический домены рецептора или присоединялся к ним. Оптимальный участок замещения должен быть определен путем стандартных экспериментов, не требующих дополнительных навыков. Typically, a cytotoxin binds to a monoclonal antibody or a fragment of such an antibody through an amide bond in the main chain of an antibody molecule in its Fc domain (or replacing this domain or part thereof). In the case where rFREXX provides the function of targeting the cell, the cytotoxic residue joins any domain of the receptor that is not involved in the binding of HREFKS. Preferably, the residue replaces or joins the transmembrane or cytoplasmic domains of the receptor. The optimal replacement site should be determined by standard experiments that do not require additional skills.
Конъюгаты, являющиеся слитыми белками, легко производятся в рекомбинантной культуре клеток путем экспрессии гена, который кодирует данный конъюгат. В альтернативном случае конъюгаты производятся путем ковалентного перекрестного сшивания цитотоксического остатка с боковой цепью или с C-терминальным карбоксилом антитела рецептора с использованием методик, которые известны сами по себе как дисульфидный обмен или сшивание посредством тиоэфирной связи, например, с использованием иминотиолата и метил-4-меркаптобутиримадата. Conjugates that are fusion proteins are readily produced in recombinant cell culture by expression of a gene that encodes the conjugate. Alternatively, conjugates are produced by covalently crosslinking a cytotoxic residue with a side chain or with a C-terminal carboxyl of a receptor antibody using techniques that are themselves known as disulfide exchange or crosslinking via a thioether bond, for example, using iminothiolate and methyl 4- mercaptobutyrimadate.
Конъюгаты с другими остатками
Моноклональные антитела и рФРЭККС, являющиеся антагонистами ФРЭККС, также могут конъюгироваться с веществами, которые сами по себе не могут быть непосредственно отнесены к цитотоксинам, но которые повышают активность описанных составов. Например, моноклональные антитела, способные связываться с ФРЭККС, рФРЭККС или комплексом ФРЭККС и рФРЭККС, сливают с гетерологичными полипептидами, такими как последовательности вирусов, клеточные рецепторы, цитокины (такие как ТНФ), интерфероны или интерлейкины, с полипептидами, имеющими прокоагулянтную активность, и с прочими биологически или иммунологически активными полипептидами. Подобные слитые конструкции легко изготовляются с помощью рекомбинантных методов. Обычно такие неиммуноглобулинные полипептиды замещаются на постоянный домен (или домены) антитела к ФРЭККС или к комплексу ФРЭККС и рФРЭККС или на трансмембранный и/или внутриклеточный домены рФРЭККС. В альтернативном случае они замещаются на вариабельный домен одного антигенсвязывающего участка описанного антитела к ФРЭККС.Conjugates with other residues
Monoclonal antibodies and rFREX, which are antagonists of FREX, can also be conjugated with substances that alone cannot be directly attributed to cytotoxins, but which increase the activity of the described compounds. For example, monoclonal antibodies that can bind to FREXC, rFREX or a complex of FREX and rFREX are fused to heterologous polypeptides such as virus sequences, cell receptors, cytokines (such as TNF), interferons or interleukins, with polypeptides having procoagulant activity, other biologically or immunologically active polypeptides. Such fused structures are easily fabricated using recombinant techniques. Typically, such non-immunoglobulin polypeptides are substituted for the constant domain (or domains) of the anti-HECF antibody, or the HMAC complex and rFREX or the transmembrane and / or intracellular rFREX domain. Alternatively, they are replaced by the variable domain of one antigen-binding region of the described anti-HECF antibody.
Предпочтительными являются те варианты, в которых такие неиммуноглобулинные полипептиды соединены с или заменяют постоянные домены описанного антитела [Беннетт и др. "Журнал биологической химии" (J. Biol. Chem.), 266: 23060 (1991)]. В альтернативном случае они замещаются на Fv описанного антитела для создания химерного поливалентного антитела, включающего по крайней мере один остающийся антигенсвязывающий участок, специфичный для ФРЭККС, рФРЭККС или комплекса ФРЭККС и рФРЭККС, и суррогатный антигенсвязывающий участок, имеющий иную специфичность, чем исходное антитело. Preferred are those in which such non-immunoglobulin polypeptides are fused to or replace the constant domains of the described antibody [Bennett et al. Journal of Biological Chemistry ”(J. Biol. Chem.), 266: 23060 (1991)]. Alternatively, they are replaced by the Fv of the described antibody to create a chimeric polyvalent antibody comprising at least one remaining antigen binding site specific for PREFX, rFREX or a complex of PREFX and rFREX, and a surrogate antigen binding site having a different specificity than the parent antibody.
Гетероспецифические антитела
Моноклональные антитела, способные связываться с ФРЭККС, рФРЭККС или комплексом ФРЭККС и рФРЭККС, должны содержать только один связывающий участок для данных эпитопов, обычно одиночный комплекс тяжелой и легкой цепей или фрагмент такого комплекса. Однако подобные антитела могут также иметь антигенсвязывающие домены, способные связывать иные эпитопы, нежели эпитопы ФРЭККС, рФРЭККС или комплекса ФРЭККС и рФРЭККС. Например, в результате замещения соответствующей аминокислотной последовательности или аминокислотных остатков нативных антител к ФРЭККС, рФРЭККС или к комплексу ФРЭККС и рФРЭККС на остатки, определяющие комплементарность, и, в случае необходимости, остовные остатки антитела, специфического по отношению к антигену, иному чем ФРЭККС, рФРЭККС или комплекс ФРЭККС и рФРЭККС, может быть создано полиспецифическое антитело, включающее один антигенсвязывающий участок, специфический для ФРЭККС, рФРЭККС или комплекса ФРЭККС и рФРЭККС, и другой антигенсвязывающий участок, специфический для антигена, иного чем ФРЭККС, рФРЭККС или комплекс ФРЭККС и рФРЭККС. Такие антитела являются по меньшей мере бивалентными, но могут быть и поливалентными, в зависимости от числа антигенсвязывающих участков, которым обладают антитела выбранного класса. Например, антитела класса IgM будут поливалентными.Heterospecific Antibodies
Monoclonal antibodies that can bind to FREX, rFREX or the complex FREX and rFREX must contain only one binding site for these epitopes, usually a single complex of heavy and light chains or a fragment of such a complex. However, such antibodies may also have antigen-binding domains capable of binding other epitopes than the epitopes of PREFKS, rFREX or a complex of PREFKS and rFREX. For example, as a result of the substitution of the corresponding amino acid sequence or amino acid residues of native antibodies to FREX, rFREX or to the complex FREX and rFREX on residues that determine complementarity and, if necessary, core residues of an antibody specific for an antigen other than FREX, rFREX or a complex of FREKS and rFREKS, a multispecific antibody can be created that includes one antigen binding site specific for FREKS, rFREKS or a complex of FREKS and rFREKS, and another an antigen binding site specific for an antigen other than FREX, rFREX or a complex of FREX and rFREX. Such antibodies are at least bivalent, but can also be multivalent, depending on the number of antigen-binding sites that antibodies of the selected class possess. For example, IgM antibodies will be multivalent.
Предпочтительными являются те варианты, в которых такие антитела способны связывать эпитопы ФРЭККС или рФРЭККС, а также (а) полипептид, активный при коагиляции крови, такой как белок C или тканевый фактор, или (б) цитотоксический белок, такой как фактор некроза опухолей (ФНО), или (в) рецептор клеточной поверхности, отличный от рФРЭККС, такой как рецепторы CD4 или HER-2 [Мэддон и др., "Клетка" (Cell), 42: 93 (1985); Куссенс и др., "Наука" (Science), 230: 1137 (1985)]. Гетероспецифические, мультивалентные антитела могут быть получены путем котрансформации клетки-хозяина ДНК, кодирующей тяжелую и легкую цепи обоих антител, с последующим сохранением, путем имунноаффинной хроматографии или подобным методом, той части экспрессированных антител, которые обладают желаемыми антигенсвязывающими свойствами. В альтернативном случае подобные антитела получаются путем рекомбинации моноспецифических антител in vitro. Preferred are those in which such antibodies are able to bind the epitopes of PREFX or rFREX, as well as (a) a polypeptide that is active in blood coagulation, such as protein C or tissue factor, or (b) a cytotoxic protein, such as tumor necrosis factor (TNF) ), or (c) a cell surface receptor other than rFREX, such as the CD4 or HER-2 receptors [Maddon et al., Cell, 42: 93 (1985); Kussens et al., Science, 230: 1137 (1985)]. Heterospecific, multivalent antibodies can be obtained by cotransformation of the host cell DNA encoding the heavy and light chains of both antibodies, followed by preservation, by immunoaffinity chromatography or the like, of that part of the expressed antibodies that possess the desired antigen binding properties. Alternatively, such antibodies are obtained by recombination of monospecific antibodies in vitro.
Моновалентные антитела
Моновалентные антитела, способные связываться с ФРЭККС или комплексом ФРЭККС и рФРЭККС, особенно полезны в качестве антагонистов ФРЭККС. Данное изобретение не ограничено описанием какого-либо отдельного механизма биологической активности; предполагается, что активация клеточных рецепторов ФРЭККС следует механизму, в котором связывание ФРЭККС и клеточных рецепторов ФРЭККС индуцирует агрегацию рецепторов, что в свою очередь активирует киназную активность внутриклеточного рецептора. Поскольку моновалентные антитела к рецептору ФРЭККС не способны индуцировать подобную агрегацию и вследствие этого активировать ФРЭККС описанным способом, они являются идеальными антагонистами ФРЭККС.Monovalent antibodies
Monovalent antibodies that are able to bind to FREX or a complex of FREX and rFREX are especially useful as antagonists of FREX. The invention is not limited to the description of any particular mechanism of biological activity; It is believed that activation of the cellular receptors of the HREFX follows a mechanism in which the binding of HFREX and the cellular HFREX receptors induces receptor aggregation, which in turn activates the kinase activity of the intracellular receptor. Since monovalent antibodies to the TRACKS receptor are not able to induce such aggregation and therefore activate the TRACKS in the manner described, they are ideal antagonists of the TRACKS.
Необходимо, однако, заметить, что такие антитела должны быть направлены на ФРЭККС-связывающий участок рецептора или же должны быть иным образом способны интерферировать со связыванием ФРЭККС и рецептора ФРЭККС, скажем, пространственным образом преграждать доступ ФРЭККС к рецептору. Однако, как описано в данном изобретении, те антитела к ФРЭККС, которые не способны интерферировать со связыванием ФРЭККС, могут быть использованы в виде конъюгата с неиммуноглобулинными остатками, например с цитотоксинами. It should be noted, however, that such antibodies must be directed to the HREFX-binding portion of the receptor or otherwise be able to interfere with the binding of HREFX and the HREFX receptor, say, to spatially block the access of HREFX to the receptor. However, as described in this invention, those anti-HECRE antibodies that are unable to interfere with the binding of HECAC can be used as a conjugate with non-immunoglobulin residues, such as cytotoxins.
Методы приготовления моновалентных антител относятся к числу широко известных в данной области. Например, один из методов состоит в рекомбинантной экспрессии легкой цепи и модифицированной тяжелой цепи иммуноглобулина. Тяжелая цепь усекается, в принципе, в любом месте участка Fc так, чтобы предотвратить сшивку тяжелой цепи. В альтернативном случае подходящие остатки цистеина замещаются другим аминокислотным остатком или вырезаются так, чтобы предотвратить сшивку. Для приготовления моновалентных антител используются также методы in vitro. Например, фрагменты Fab получаются путем ферменативного расщепления интактных антител. Methods for preparing monovalent antibodies are well known in the art. For example, one method consists in recombinant expression of a light chain and a modified immunoglobulin heavy chain. The heavy chain is truncated, in principle, anywhere in the Fc region so as to prevent crosslinking of the heavy chain. Alternatively, suitable cysteine residues are replaced with another amino acid residue or excised so as to prevent crosslinking. In vitro methods are also used to prepare monovalent antibodies. For example, Fab fragments are obtained by enzymatic cleavage of intact antibodies.
Использование в диагностике
Для использования в диагностике антитела к ФРЭККС, описанные в данном изобретении, обычно должны быть помечены остатком, который легко обнаружить. Это может быть любой остаток, который, прямо или косвенно, может продуцировать обнаруживаемый сигнал. Например, это могут быть радиоизотопы, такие как3H,14C,32P,35S,125I; флюоресцентное или хемилюминесцентное соединение, такое как изотиоцианат флюоресцеина, родамин или люциферин; метки, помеченные радиоизотопами, такими как, например,125I,32P,14C или3H, или ферменты, такие как щелочная фосфатаза, бетагалактозидаза или пероксидаза хрена.Diagnostic Use
For use in the diagnosis of antibodies to PRECKS described in this invention should usually be labeled with a residue that is easy to detect. This can be any residue that, directly or indirectly, can produce a detectable signal. For example, it can be radioisotopes, such as3 H,14 C,32 P,35 S,125 I; a fluorescent or chemiluminescent compound such as fluorescein isothiocyanate, rhodamine or luciferin; labels labeled with radioisotopes, such as, for example,125 I,32 P,14 C or3 H, or enzymes, such as alkaline phosphatase, betagalactosidase or horseradish peroxidase.
Здесь может применяться любой известный в данной области метод для конъюгирования отдельных антител к обнаруживаемым остаткам, включая описанные методы [Хантер и др. "Природа" (Nature), 144: 945 (1962); Дэвид и др. "Биохимия" (Biochemistry), 13: 1014 (1974); Пейн и др. "Методы иммунол." (J. Immunol. Meth.), 40: 219 (1981), и Нигрен, "Журн. гистохим. и цитохим." (J. Histochem. and Cytochem.), 30: 407 (1982)]. Any method known in the art can be used to conjugate individual antibodies to detectable residues, including the methods described [Hunter et al. Nature, 144: 945 (1962); David et al. Biochemistry, 13: 1014 (1974); Payne et al. "Immunol methods." (J. Immunol. Meth.), 40: 219 (1981), and Nigren, "J. Histochem. And Cytochem." (J. Histochem. And Cytochem.), 30: 407 (1982)].
Антитела и рецепторы данного изобретения могут быть использованы в любом известном методе анализа, например в анализе конкурентного связывания, анализе методом прямых и косвенных иммуносэндвичей и анализе методом иммунопреципитации (Зола, "Моноклональные антитела: практическое пособие" (Monoclonal Antibodies: A Manual of Techniques), с. 147-158 (CRC Press Inc. 1987). The antibodies and receptors of the present invention can be used in any known assay, for example, competitive binding assays, direct and indirect immuno-sandwiches and immunoprecipitation assays (Zola, Monoclonal Antibodies: A Manual of Techniques), pp. 147-158 (CRC Press Inc. 1987).
Анализ конкурентного связывания основан на способности помеченного стандарта (это может быть ФРЭККС или же его иммунологически активная часть) конкурировать за ограниченное количество антитела с образцом ФРЭККС. Количество ФРЭККС в образце обратно пропорционально количеству стандарта, который связывается с антителами или рецепторами. Чтобы способствовать определению количества стандарта, которое переходит в связанное состояние, антитела или рецепты обычно переводятся в нерастворимую форму перед анализом или после него таким образом, что стандарт и образец, связанные с антителами или рецепторами, могут быть легко отделены от стандарта и образца, которые находятся в свободном состоянии. Competitive binding assays are based on the ability of a labeled standard (it may be a HECF or its immunologically active part) to compete for a limited amount of antibody with a HMFRS sample. The amount of PRECKS in the sample is inversely proportional to the amount of standard that binds to antibodies or receptors. To help quantify the amount of standard that becomes bound, antibodies or recipes are usually converted to insoluble form before or after analysis so that the standard and sample associated with antibodies or receptors can be easily separated from the standard and sample that are in a free state.
Анализ методом иммуносэндвичей включает использование двух антител или рецепторов, каждый из которых способен связываться с различной иммуногенной областью или эпитопом белка, подлежащего обнаружению. При анализе методом иммуносэндвичей тестируемый образец связывается с первым антителом или рецептором, иммобилизованным на твердой основе, а затем второе антитело или рецептор связывается с образцом, образуя таким образом нерастворимый тройной комплекс [Дэвид и Грин, Патент США N 4376110]. Второе антитело или рецептор может быть помечено обнаруживаемым остатком (прямой метод иммуносэндвичей) или же может быть определено с использованием антитела к иммуноглобулину, помеченного обнаруживаемым остатком (косвенный метод иммуносэндвичей). Например, один из типов сэндвичей - это твердофазный иммуноферментный анализ (ELISA), и в этом случае обнаруживаемым остатком является фермент. An immunosandwich analysis involves the use of two antibodies or receptors, each of which is capable of binding to a different immunogenic region or epitope of the protein to be detected. In an immunosandwich assay, the test sample binds to the first antibody or receptor immobilized on a solid basis, and then the second antibody or receptor binds to the sample, thus forming an insoluble triple complex [David and Green, US Patent No. 4376110]. The second antibody or receptor can be labeled with a detectable residue (direct immunosandwich method) or can be determined using an antibody to immunoglobulin labeled with a detectable residue (indirect immunosandwich method). For example, one type of sandwich is an enzyme-linked immunosorbent assay (ELISA), in which case the enzyme is the detectable residue.
Антитела рецептора также используются для выявления in vivo. когда антитело или рФРЭККС, помеченные обнаруживаемым остатком, вводится пациенту, предпочтительно в кровеносную систему, и анализируется присутствие и местонахождение меченого антитела или рецептора в организме пациента. Такая визуализация может использоваться, например, при определении стадии заболевания и при лечении неоплазм. Антитело или рФРЭККС метятся любым остатком, обнаружимым в организме млекопитающих, известными в этой области методами, например ядерным магнитным резонансом, радиологическим методом и т.д. Receptor antibodies are also used for in vivo detection. when an antibody or rFREX labeled with a detectable residue is administered to a patient, preferably into the circulatory system, and the presence and location of the labeled antibody or receptor in the patient is analyzed. Such visualization can be used, for example, in determining the stage of the disease and in the treatment of neoplasms. An antibody or rFREX is labeled with any residue found in a mammalian organism by methods known in the art, such as nuclear magnetic resonance, radiological, etc.
Антагонисты-варианты ФРЭККС
В дополнение к описанным антителам могут быть использованы другие применяемые антагонисты ФРЭККС, а именно фрагменты и аминокислотные варианты нативного ФРЭККС, которые связываются с рецептором ФРЭККС, но не проявляют биологической активности, свойственной нативному ФРЭККС. Например, к таким антагонистам относятся фрагменты и аминокислотные варианты, которые составляют домен нативного ФРЭККС, связывающийся с рецептором, но не включают в себя домен, который проявляет биологическую активность, или имеют иные недостатки, так что они не могут активировать клеточный рецептор ФРЭККС, как, например, в случае с аминокислотным фрагментом, лишенным способности индуцировать агрегацию или активацию клеточных рецепторов ФРЭККС. Термин "домен, связывающийся с рецептором", относится к аминокислотным последовательностям ФРЭККС, которые участвуют в связывании с рецептором ФРЭККС. Термин "биологически активный домен" или "домен, обладающий биологической активностью", относится к аминокислотным последовательностям ФРЭККС, которые отвечают за определенную биологическую активность фактора, например его митогенную или ангиогенную активность.Antagonists options FRECKS
In addition to the antibodies described, other applicable TRACKS antagonists can be used, namely fragments and amino acid variants of the native TRACKS that bind to the TRACKS receptor but do not exhibit the biological activity characteristic of the native TRACKS. For example, such antagonists include fragments and amino acid variants that make up the native FRACX domain that binds to the receptor, but do not include a domain that exhibits biological activity, or have other disadvantages, so that they cannot activate the cellular receptor of TRACKS, such as for example, in the case of an amino acid fragment lacking the ability to induce aggregation or activation of cellular receptors of HECF. The term “receptor-binding domain” refers to the amino acid sequences of the HREAX that are involved in binding to the HREA receptor. The term "biologically active domain" or "domain with biological activity" refers to the amino acid sequences of the HREFKS that are responsible for a particular biological activity of a factor, for example, its mitogenic or angiogenic activity.
ФРЭККС, по-видимому, способен образовывать комплекс с двумя или более молекулами рФРЭККС на поверхности клетки; это предполагает наличие у ФРЭККС по меньшей мере двух отдельных участков для связывания рФРЭККС; представляется также, что ФРЭККС связывается с такими клеточными рецепторами последовательным образом, сначала с одним участком и потом с другим, прежде чем происходит активация, как это делают гормоны роста - пролактин и подобные ему [см. Каннингем и др. "Наука" (Science), 254: 821 (1991); деВос и др. "Наука" (Science), 255: 306 (1992); Фу и др. "Наука" (Science), 256: 1677 (1992)] . Соответственно выбираются антагонисты-варианты ФРЭККС, в которых один участок ФРЭККС для связывания рецептора (обычно участок, который участвует в первоначальном связывании ФРЭККС и рФРЭККС) остается без изменения (или, в случае модификации, варьируется для того, чтобы усилить связывание), в то время как второй участок ФРЭККС, связывающий рецептор, обычно модифицируется путем субституции(й) или делеции(й) неконсервативных аминокислотных остатков с целью лишить этот участок его связывающих свойств. FREKS is apparently capable of complexing with two or more rFREKS molecules on the cell surface; this implies the presence of at least two separate regions for the binding of rFREX to the FREKS; it also seems that PRECKS binds to such cellular receptors in a sequential manner, first with one site and then with another, before activation occurs, as growth hormones do - prolactin and the like [see Cunningham et al. Science, 254: 821 (1991); deVos et al. "Science" (Science), 255: 306 (1992); Fu et al. "Science" (Science), 256: 1677 (1992)]. Correspondingly, the antagonists of the HREFCC variant are selected, in which one site of HFREX for binding to the receptor (usually the site that is involved in the initial binding of HREFX and rFREX) remains unchanged (or, if modified, varies in order to enhance binding), while as the second receptor binding fragment of the HREFKS, it is usually modified by substitution (s) or deletion (s) of non-conservative amino acid residues in order to deprive this site of its binding properties.
Домены ФРЭККС, связывающие рецептор, и домены рФРЭККС, связывающие ФРЭККС, определяются любыми известными в этой области методами, в том числе рентгенографией, анализом мутаций или анализом связывания антител. Анализ мутаций включает в себя методы неспецифического насыщающего мутагенеза в совокупности с отбором утекающих мутантов и инсерционным мутагенезом. Другая стратегия, пригодная для определения доменов, которые связываются с рецептором, в составе лигандов известна как аланин (Ала)-сканирующий мутагенез [Каннингем и др. "Наука" (Science), 244: 1081-1985 (1989)]. Этот метод включает в себя определение областей, содержащих заряженные боковые цепи аминокислот. Заряженные остатки определяются на (например, Арг, Асп, Гис, Лиз и Глю) и замещаются на Ала (на одной области на каждую мутантную молекулу), и тестируется связывание полученных лигандов с рецептором, чтобы оценить значение отдельных областей в связывании с рецептором. Еще более мощным методом для локализации доменов, которые связываются с рецептором, является использование нейтрализующих антител к ФРЭККС [Ким и др. "Факторы роста" (Growth Factors), 7: 53 (1992)]. Обычно для локализации доменов, которые связываются с рецептором, используется комбинация таких методов и подобных им. The receptor binding FREXCs and the hREFCC binding rFREXC domains are determined by any methods known in the art, including radiography, mutation analysis, or antibody binding analysis. Analysis of mutations includes methods of nonspecific satiating mutagenesis in conjunction with the selection of leaking mutants and insertional mutagenesis. Another strategy suitable for determining the domains that bind to the receptor in ligands is known as alanine (Ala) -scanning mutagenesis [Cunningham et al. Science, 244: 1081-1985 (1989)]. This method involves determining regions containing charged amino acid side chains. The charged residues are determined on (e.g., Arg, Asp, His, Lys and Glu) and replaced by Al (on one region for each mutant molecule), and the binding of the resulting ligands to the receptor is tested to evaluate the significance of individual regions in binding to the receptor. An even more powerful method for the localization of domains that bind to the receptor is the use of neutralizing antibodies to PRECKS [Kim et al. “Growth Factors”, 7: 53 (1992)]. Usually, a combination of such methods and the like are used to localize domains that bind to the receptor.
Термин "аминокислотный вариант", используемый по отношению к ФРЭККС, относится к полипептидам, аминокислотные последовательности которых до некоторой степени отличаются от аминокислотных последовательностей нативных форм ФРЭККС. Как правило, антагонистические варианты аминокислотных последовательностей будут обладать не менее чем 70% гомологией c по меньшей мере одним доменом нативного ФРЭККС, который связывается с рецептором; предпочтительно, чтобы гомология была около 80%; еще более предпочтительно, чтобы гомология с доменом нативного ФРЭККС, который связывается с рецептором, была около 90%. Варианты аминокислотных последовательностей обладают субституциями, делециями и/или инсерциями в определенных позициях последовательности нативного ФРЭККС таким образом, что варианты сохраняют способность связываться с рецептором ФРЭККС (и таким образом конкурировать с нативным ФРЭККС за связывание с рецептором ФРЭККС), но лишены способности индуцировать один или более биологических эффектов ФРЭККС, таких как пролиферация эндотелиальных клеток, ангиогенез или проницаемость сосудов. The term "amino acid variant", used in relation to FREKS, refers to polypeptides, the amino acid sequences of which are to some extent different from the amino acid sequences of native forms of FREKS. Typically, antagonistic variants of amino acid sequences will have at least 70% homology with at least one domain of native TRACKS that binds to the receptor; preferably, the homology is about 80%; even more preferably, the homology with the domain of the native FRECX that binds to the receptor is about 90%. Variants of amino acid sequences possess substitutions, deletions, and / or insertions at specific positions of the native TRACKS sequence so that the variants retain the ability to bind to the TRACKS receptor (and thus compete with the native TRACKS for binding to the TRACKS receptor), but lack the ability to induce one or more biological effects of TRACKS, such as proliferation of endothelial cells, angiogenesis or vascular permeability.
"Гомология" определяется как процент остатков в аминокислотной последовательности, которые идентичны остаткам аминокислотной последовательности домена нативного ФРЭККС, который связывается с рецептором после того, как эти последовательности были сопоставлены и учтены пропуски в них, если это необходимо для достижения максимальной процентной гомологии. Для такого сопоставления в данной области исследований существуют соответствующие методы и компьютерные программы. Одна из таких компьютерных программ, "Align 2", была создана компанией "Генентек, Инк." (Genentech, Inc.), и документация к ней была занесена в архивы Управления по Авторским Правам США (United States Copyright Office, Washington, DC 20559) 10 декабря 1991 года. Субституционными вариантами являются варианты, в которых из нативной последовательности удален хотя бы один аминокислотный остаток и в той же позиции на его место вставлена другая аминокислота. Субституции могут быть одиночными или множественными, когда в одной и той же молекуле замещены две или более аминокислоты. "Homology" is defined as the percentage of residues in the amino acid sequence that are identical to the residues of the amino acid sequence of the native domain of HREFKS, which binds to the receptor after these sequences have been compared and gaps in them have been taken into account, if necessary to achieve maximum percentage homology. For such a comparison in this field of research, there are appropriate methods and computer programs. One such computer program,
Инсерционными вариантами являются варианты, в которых одна или более аминокислот вставлены непосредственно по соседству с аминокислотой в определенной позиции нативной последовательности. "Непосредственно по соседству с аминокислотой" означает, что аминокислоты присоединяются либо к α-карбоксильной функциональной группе, либо к α-аминогруппе. Insertion variants are variants in which one or more amino acids are inserted directly adjacent to the amino acid at a specific position in the native sequence. “Directly adjacent to an amino acid” means that the amino acids are attached either to the α-carboxyl functional group or to the α-amino group.
Делеционными вариантами являются варианты, в которых одна или более аминокислот удалены из нативной последовательности. Обычно делеционные варианты обладают делецией одной или более аминокислот в определенном участке молекулы. Фрагменты и аминокислотные варианты ФРЭККС легко могут быть получены известными в данной области методами, в том числе сайт-направленным мутагенезом ДНК, кодирующей нативный фактор. Мутировавшая ДНК вставляется в cоответствующий вектор экспрессии, и клетки-хозяева затем трансфецируются рекомбинантным вектором. Рекомбинантные клетки-хозяева выращиваются в соответствующей культуральной среде, и желаемый фрагмент или аминокислотный вариант ФРЭККС, выраженный в клетках-хозяевах, выделяется затем из культуры рекомбинантных клеток хроматографией или другими методами очистки. Deletion variants are variants in which one or more amino acids are deleted from the native sequence. Typically, deletion variants have a deletion of one or more amino acids in a particular region of the molecule. FRECKS fragments and amino acid variants can easily be obtained by methods known in the art, including site-directed mutagenesis of DNA encoding the native factor. The mutated DNA is inserted into an appropriate expression vector, and the host cells are then transfected with a recombinant vector. Recombinant host cells are grown in an appropriate culture medium, and the desired fragment or amino acid variant of HECRE expressed in host cells is then isolated from the recombinant cell culture by chromatography or other purification methods.
В альтернативном случае фрагменты и аминокислотные варианты ФРЭККС приготовляются in vitro, например, путем протеолиза нативного ФРЭККС или синтезом с использованием стандартных методов твердофазного синтеза пептидов, соответственно описанию Меррифилда ["Журн. Амер. хим. об-ва" (J. Am. Chem. Soc.), 85: 2149 (1963)], хотя могут быть использованы и другие эквивалентные химические синтезы, известные в данной области. Твердофазный синтез инициируется с C-конца пептида путем присоединения защищенной аминокислоты к соответствующей смоле. Аминокислоты присоединяются к пептидной цепи с использованием стандартных методов для создания пептидных связей. Alternatively, fragments and amino acid variants of TRACKS are prepared in vitro, for example, by proteolysis of native TRACKS or synthesis using standard methods of solid-phase synthesis of peptides, according to the description of Merrifield [J. Mag. Chem. Ob-va (J. Am. Chem. Soc.), 85: 2149 (1963)], although other equivalent chemical syntheses known in the art may be used. Solid phase synthesis is initiated from the C-terminus of the peptide by attaching a protected amino acid to the corresponding resin. Amino acids are attached to the peptide chain using standard methods to create peptide bonds.
Терапевтическое использование
Для использования в терапевтической практике антагонисты, описанные в данном изобретении, вводятся млекопитающему, предпочтительно человеку, в фармацевтически приемлемой форме, включая введение внутривенно в виде шарика или постоянного вливания в течение некоторого периода времени, а также следующими путями: внутримышечной, интраперитонеальным, интрацереброспинальным, подкожным, внутрисуставным, внуртисиновиальным, внутриоболочечным, оральным, локальным или ингаляционным. Антагонисты также могут вводиться внутриопухолевым, околоопухолевым, внутриочаговым и околоочаговым путями для обеспечения локального действия наряду с системным терапевтическим действием. Ожидается, что особенно пригодным должно быть интраперитонеальное введение, например, для лечения опухолей яичников.Therapeutic use
For use in therapeutic practice, the antagonists described in this invention are administered to a mammal, preferably a human, in a pharmaceutically acceptable form, including intravenously in the form of a ball or continuous infusion over a period of time, as well as in the following ways: intramuscular, intraperitoneal, intracerebrospinal, subcutaneous , intraarticular, inturtisinovial, intracranial, oral, local or inhaled. Antagonists can also be administered by intratumoral, peritumoral, intrafocal and focal pathways to provide local action along with a systemic therapeutic effect. Intraperitoneal administration, for example, for treating ovarian tumors, is expected to be particularly suitable.
Подобные формы введения включают фармацевтически приемлемые носители, которые по своей природе не обладают ни токсическим, ни терапевтическим действием. Примерами таких носителей являются ионообменные вещества, квасцы, стеарат алюминия, лецитин, белки плазмы (такие, как белок плазмы человека), буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, частичные глицеридные смеси насыщенных овощных жирных кислот, вода, соли или электролиты, такие как сульфат протамина, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидная окись кремния, трисиликат магния, поливинилпирролидон, вещества с целлюлозной основой и полиэтиленгликоль. Such administration forms include pharmaceutically acceptable carriers which, by their nature, have neither toxic nor therapeutic effects. Examples of such carriers are ion exchange agents, alum, aluminum stearate, lecithin, plasma proteins (such as human plasma protein), buffering agents such as phosphates, glycine, sorbic acid, potassium sorbate, partial glyceride mixtures of saturated vegetable fatty acids, water, salts or electrolytes such as protamine sulfate, sodium hydrogen phosphate, potassium hydrogen phosphate, sodium chloride, zinc salts, colloidal silicon oxide, magnesium trisilicate, polyvinylpyrrolidone, cellulose-based substances and polyethylene glycol.
Носители для локальной или основанной на геле форм антагонистов включают полисахариды, такие как натриевая соль карбоксиметилцеллюлозы или метилцеллюлозы, поливинилпирролидон, полиакрилаты, полимеры полиоксиэтилен-полиоксипропиленового блока, полиэтиленгликоль и спирты. Для введения во всех случаях используются обычные лекарственные формы, получаемые со складов. К таким формам относятся, например, микрокапсулы, нанокапсулы, липосомы, пластыри, ингаляционные препараты, аэрозоли, подъязычные таблетки и препараты с постоянным высвобождением вещества. Антагонист в таких препаратах будет обычно содержаться в концентрации примерно от 0,1 мг/мл до 100 мг/мл. Carriers for local or gel-based antagonist forms include polysaccharides, such as sodium carboxymethyl cellulose or methyl cellulose, polyvinylpyrrolidone, polyacrylates, polyoxyethylene-polyoxypropylene block polymers, polyethylene glycol and alcohols. For administration in all cases, conventional dosage forms obtained from warehouses are used. Such forms include, for example, microcapsules, nanocapsules, liposomes, plasters, inhalants, aerosols, sublingual tablets, and sustained release drugs. The antagonist in such preparations will usually be contained in a concentration of from about 0.1 mg / ml to 100 mg / ml.
Подходящие примеры препаратов с постоянным высвобождением вещества включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антагонист; подобные матрицы имеют определенную форму, например это могут быть пленки или микрокапсулы. К примерам матриц с постоянным высвобождением относятся полиэфиры, гидрогели [например, поли(2-гидроксиэтил-метакрилат)] , описанные Лангером и др., "Ж. иссл. биомед. материалов" (J. Biomed. Mater. Res.), 15: 167 (1981) и Лангером, "Химич. технол." (Chem. Tech.), 12: 98-105 (1982), или поли(винилалкоголь), полилактиды (Патент США N 3773919), сополимеры L-глутаминовой кислоты и гаммаэтил-L-глутамата (Сидман и др. "Биополимеры" (Biopolymers), 22: 547 (1983), недеградируемый этиленвинилацетат (Лангер и др. см. выше), деградируемые сополимеры молочной и гликолевой кислот, такие как Lupron DepotТМ (инъецируемые микросферы, состоящие из полимеров молочной и гликолевой кислот и ацетата лейпролида), и поли-D-(-)- 3-гидроксибутировой кислоты. В то время, как такие полимеры, как этиленвинилацетат и cополимер молочной и гликолевой кислот, способны к постоянному высвобождению молекул в течение более 100 дней, определенные гидрогели высвобождают белки за более короткие периоды времени. Когда инкапсулированные полипептидные антагонисты остаются в организме на долгое время, они могут денатурировать или агрегироваться в результате воздействия влаги при температуре 37oC, что ведет к потере биологической активности и возможным изменениям в иммуногенности. С целью стабилизации могут быть разработаны разумные стратегии, в зависимости от действующего механизма. Например, если обнаружен механизм агрегации, выражающийся в формировании межмолекулярной S-S-связи посредством тиодисульфидного обмена, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации с целью удаления кислых растворов, контролирования влажности, использования соответствующих добавок и разработки специфических полимерных матричных составов.Suitable examples of sustained release formulations include semipermeable matrices of solid hydrophobic polymers containing an antagonist; such matrices have a certain shape, for example, it can be films or microcapsules. Examples of sustained release matrices include polyesters, hydrogels [eg, poly (2-hydroxyethyl-methacrylate)] described by Langer et al., J. Biomedical Research Materials (J. Biomed. Mater. Res.), 15 : 167 (1981) and Langer, "Chemical Technology." (Chem. Tech.), 12: 98-105 (1982), or poly (vinyl alcohol), polylactides (US Pat. No. 3,773,919), copolymers of L-glutamic acid and gammaethyl-L-glutamate (Sidman et al. "Biopolymers" ( Biopolymers), 22: 547 (1983), non-degradable ethylene vinyl acetate (Langer et al. See above), degradable copolymers of lactic and glycolic acids such as Lupron Depot™ (injectable microspheres consisting of polymers of lactic and glycolic acids and leuprolide acetate), and poly-D - (-) - 3-hydroxybutyric acid, while polymers such as ethylene vinyl acetate and a copolymer of lactic and glycolic acids, with individuality for constant release of molecules for over 100 days, certain hydrogels release proteins for shorter time periods. When encapsulated polypeptide antagonists remain in the body for a long time, they may denature or aggregate as a result of exposure to moisture at 37o C, which leads to loss of biological activity and possible changes in immunogenicity. In order to stabilize, reasonable strategies may be developed, depending on the mechanism in place. For example, if an aggregation mechanism is revealed, which manifests itself in the formation of an intermolecular SS bond through thiodisulfide exchange, stabilization can be achieved by modifying sulfhydryl residues, lyophilization to remove acidic solutions, controlling humidity, using appropriate additives and developing specific polymer matrix compositions.
Антагонистические составы с постоянным высвобождением ФРЭККС включают также антагонистические антитела и рФРЭККС, заключенные в липосомах. Липосомы, содержащие антагонисты, могут быть получены известными в данной области методами, например, описанными Эпстейном и др., "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci.), 82: 3688 (1985); Хуанг и др. "Известия национальн. Акад. Наук" (Proсс. Nat. Acad. Sci.), 77: 4030 (1980); Патент США N 4485045 и Патент США N 4544545. Липосомы, как правило, имеют небольшую величину (величиной около 200-800 ангстрем) и принадлежат к однослойному типу, в котором содержание липидов выше, чем 30 мол.% холестерина; выбранное соотношение может изменяться для подбора оптимальных условий терапии. Липосомы с продолжительным сроком циркуляции покрываются Патентом США N 5013556. Constant release antagonist formulations of HREFX also include antagonistic antibodies and rhFREX contained in liposomes. Liposomes containing antagonists can be obtained by methods known in the art, such as those described by Epstein et al., Proceedings of the National Acad. Sciences (Proc. Nat. Acad. Sci.), 82: 3688 (1985); Huang et al. "Proceedings of the National Acad. Sciences" (Pross. Nat. Acad. Sci.), 77: 4030 (1980); US patent N 4485045 and US Patent N 4544545. Liposomes, as a rule, are small (about 200-800 angstroms) and belong to the single-layer type in which the lipid content is higher than 30 mol.% Cholesterol; the selected ratio may vary to select the optimal treatment conditions. Long circulating liposomes are covered by US Pat. No. 5,013,556.
Еще одним путем использования данного изобретения является инкорпорирование антагониста ФРЭККС внутрь изделий, имеющих определенную форму. Такие изделия могут быть использованы для модулирования роста клеток эндотелия и ангиогенеза. Кроме того, такие изделия могут быть использованы для модулирования инвазии опухолей и метастазов. Another way of using this invention is the incorporation of an antagonist of the HREXX into products having a specific shape. Such products can be used to modulate endothelial cell growth and angiogenesis. In addition, such products can be used to modulate the invasion of tumors and metastases.
При профилактике или лечении заболевания необходимая доза антагониста будет зависеть от типа заболевания, от его степени серьезности и протекания, от того, вводятся ли антитела с профилактической или терапевтической целью, от предыдущей терапии, от истории болезни пациента и его реакции на антагонист и от указаний лечащего врача. Антагонист может вводиться пациенту различными способами, единовременно или в качестве серии назначений. When preventing or treating a disease, the required dose of the antagonist will depend on the type of disease, on its severity and course, on whether antibodies are administered for prophylactic or therapeutic purposes, on previous therapy, on the patient’s medical history and its response to the antagonist, and on the instructions of the patient a doctor. The antagonist can be administered to the patient in various ways, at a time or as a series of appointments.
Антагонисты ФРЭККС могут быть использованы для лечения различных неопластических и ненеопластических заболеваний и нарушений. Неоплазмы и близкие состояния, которые поддаются такому лечению, включают карциному груди, карциному легких, карциному желудка, карциному пищевода, колоректальную карциному, карциному печени, карциному яичников, текому, арренобластому, карциному шейки матки, карциному эндометрия, гиперплазию эндометрия, эндометриоз, фибросаркомы, хориосаркомы, рак головы и шеи, носоглоточную карциному, карциному гортани, гепатобластому, саркому Капоши, меланому, карциномы кожи, гемангиому, кавернозную гемангиому, гемангиобластому, карциному поджелудочной железы, ретинобластомы, астроцитому, глиобластому, шванному, олигодендроглиому, медуллобластому, нейробластому, рабдомиосаркому, остеогенную саркому, лейомиосаркому, карциномы мочеполового тракта, карциномы щитовидной железы, опухоль Вильмса, карциному клеток почки, карциному предстательной железы, аномальную пролиферацию сосудов, связанную с факоматозами, отеки (такие как отеки, связанные с опухолями мозга) и синдром Мейгса. TRACKS antagonists can be used to treat various neoplastic and non-neoplastic diseases and disorders. Neoplasms and related conditions that can be treated with this include breast carcinoma, carcinoma of the lung, carcinoma of the stomach, carcinoma of the esophagus, colorectal carcinoma, carcinoma of the liver, carcinoma of the ovaries, flow, arrhenoblastoma, carcinoma of the cervix uteri, carcinoma of the endometrium, endometrial hyperplasia, endometriosis, choriosarcomas, head and neck cancer, nasopharyngeal carcinoma, laryngeal carcinoma, hepatoblastoma, Kaposi’s sarcoma, melanoma, skin carcinoma, hemangioma, cavernous hemangioma, hemangioblastoma, pancreatic carcinoma gland, retinoblastoma, astrocytoma, glioblastoma, schwanno, oligodendroglioma, medulloblastoma, neuroblastoma, rhabdomyosarcoma, osteogenic sarcoma, leiomyosarcoma, urinary tract carcinoma, thyroid carcinoma, carcinoma of the thyroid gland, carcinoma of the cell carcinoma, carcinoma of the cell edema (such as edema associated with brain tumors) and Meigs syndrome.
Ненеопластические заболевания, которые поддаются лечению, включают такие, как ревматоидный артрит, псориаз, атеросклероз, диабетические и другие ретинопатии, ретролентальная фиброплазия, неоваскулярнуя глаукома, тироидные гиперплазии (в том числе болезнь Граве), трансплантация роговицы и других тканей, хронические воспаления, воспаление легких, нефротический синдром, асцит, преэклампсия, перикардиальный выпот (например, связанный с перикардитом) и плевральный выпот. Treatable non-neoplastic diseases include rheumatoid arthritis, psoriasis, atherosclerosis, diabetic and other retinopathies, retrolental fibroplasia, neovascular glaucoma, thyroid hyperplasias (including Grave’s disease), corneal and other tissue transplantation, chronic inflammation, nephrotic syndrome, ascites, preeclampsia, pericardial effusion (eg, associated with pericarditis) and pleural effusion.
В зависимости от типа заболевания и от степени его серьезности первоначальная доза для введения пациенту будет составлять от 1 мкг/кг до 15 мг/кг и может вводиться путем одного или многих отдельных введений или путем постоянного вливания. Обычная дневная доза может варьировать примерно от 1 мкг/кг до 100 мг/кг и более, в зависимости от вышеупомянутых факторов. Для повторного введения в течение нескольких дней и более, в зависимости от условий, лечение повторяется, пока не достигается желаемое подавление симптомов болезни. Однако могут использоваться и другие режимы дозировки. Успех лечения легко определяется обычными методами и анализами, например радиографической визуализацией опухолей. Depending on the type of disease and its severity, the initial dose for administration to a patient will be from 1 μg / kg to 15 mg / kg and may be administered by one or many separate administrations or by continuous infusion. A typical daily dose may vary from about 1 μg / kg to 100 mg / kg or more, depending on the above factors. For repeated administration for several days or more, depending on the conditions, the treatment is repeated until the desired suppression of the symptoms of the disease is achieved. However, other dosage regimens may also be used. The success of treatment is easily determined by conventional methods and analyzes, such as radiographic imaging of tumors.
В соответствии с другим применением изобретения эффективность антагониста в предотвращении или лечении болезней может быть улучшена путем введения антагониста серийно или же в комбинации с другим веществом, эффективным для данной цели, таким как фактор некроза опухоли (ФНО); антитело, способное ингибировать или нейтрализовать ангиогенную активность кислого или основного фактора роста фибробластов (ФРФ) или фактора роста гепатоцитов (ФРГ); антитело, способное ингибировать или нейтрализовать коагулянтную активность тканевого фактора, белка C или белка S (см. Эсмон и др. РСТ Патентная публикация N WO 91/01753, опубл. 21 февраля 1991 г.); или одно или более обычных терапевтических веществ, таких как, например, алкилирующие соединения, антагонисты фолиевой кислоты, антиметаболиты метаболизма нуклеиновых кислот, антибиотики, аналоги пиримидинов, 5-флюороурацил, пуриновые нуклеозиды, амины, аминокислоты, триазольные нуклеозиды или кортикостероиды. Подобные вещества могут присутствовать во вводимом составе или могут вводиться отдельно. Кроме того, антагонист может вводиться серийно или же в комбинации с радиологическим лечением, которое может включать как иррадиацию, так и введение радиоактивных веществ. In accordance with another application of the invention, the effectiveness of an antagonist in the prevention or treatment of diseases can be improved by administering the antagonist serially or in combination with another substance effective for this purpose, such as tumor necrosis factor (TNF); an antibody capable of inhibiting or neutralizing the angiogenic activity of acidic or basic fibroblast growth factor (FRF) or hepatocyte growth factor (FRG); an antibody capable of inhibiting or neutralizing the coagulant activity of tissue factor, protein C, or protein S (see Esmon et al. PCT Patent Publication No. WO 91/01753, publ. February 21, 1991); or one or more conventional therapeutic substances, such as, for example, alkylating compounds, folic acid antagonists, nucleic acid metabolism antimetabolites, antibiotics, pyrimidine analogs, 5-fluorouracil, purine nucleosides, amines, amino acids, triazole nucleosides or corticosteroids. Such substances may be present in the composition to be administered or may be administered separately. In addition, the antagonist may be administered serially or in combination with radiological treatment, which may include both radiation and the introduction of radioactive substances.
В соответствии с одним из применений изобретения при комбинированной терапии подвергается атаке васкуляризация опухоли. Один или более антагонист ФРЭККС вводятся пациенту с опухолью в терапевтически эффективных дозах, определенных, например, при наблюдении некроза опухоли или ее метастазных фокусов, если они имеются. Такая терапия продолжается до тех пор, пока перестает наблюдаться дальнейшее улучшение или клиническое обследование показывает, что опухоль или ее метастазы исчезли. Затем вводится ФНО, отдельно или в комбинации с дополнительным веществом, таким как альфа-, бета- или гамма-интерферон, антитело к HER2, херегулин, антитело к херегулину, D-фактор, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), фактор стимуляции колонии гранулоцитов-макрофагов (ФСК-ГМ) или вещества, которые способствуют микрососудистой когуляции в опухолях, таких как антитела к белкам C или S или связывающий белок C4b (см. Эсмон и др. PCT Патентная публикация N WO 91/01753, опубл. 21 февраля 1991 г.), или тепло и радиация. In accordance with one application of the invention, in combination therapy, tumor vascularization is attacked. One or more TRACKS antagonists are administered to a patient with a tumor in therapeutically effective doses determined, for example, by observing tumor necrosis or its metastatic foci, if any. Such therapy continues until further improvement ceases to be observed or clinical examination indicates that the tumor or its metastases have disappeared. Then TNF is administered, alone or in combination with an additional substance, such as alpha, beta or gamma interferon, anti-HER2 antibody, heregulin, anti-heregulin antibody, D-factor, interleukin-1 (IL-1), interleukin-2 (IL-2), macrophage granulocyte colony stimulation factor (FSK-GM) or substances that promote microvascular coagulation in tumors, such as antibodies to C or S proteins or C4b binding protein (see Esmon et al. PCT Patent Publication N WO 91/01753, published February 21, 1991), or heat and radiation.
Поскольку эффективность дополнительных веществ будет варьировать, желательно сравнить их влияние на опухоль путем стандартного матричного скрининга. Производится повторное введение антагониста ФРЭККС и ФНО, пока не будет достигнут желаемый клинический эффект. В альтернативном случае антагонист(ы) ФРЭККС и ФНО вводятся совместно и, при желании, вместе с дополнительными веществами. В случае, когда обнаруживаются твердые опухоли в суставах или других местах, более изолированных от общей циркуляции, описанные здесь терапевтические агенты вводятся в изолированную опухоль или орган. В других случаях совместно с антагонистом ФРЭККС пациенту вводятся антагонист ФРФ или тромбоцитный фактор роста (ТФР), такой как нейтрализующее антитело к ФРФ или ТФР. Применение антагонистов ФРЭККС при оптимальных обстоятельствах может быть приостановлено во время залечивания раны или желательной неоваскуляризации. Since the effectiveness of additional substances will vary, it is advisable to compare their effect on the tumor by standard matrix screening. Repeated administration of the antagonist of TRACKS and TNF is performed until the desired clinical effect is achieved. Alternatively, the antagonist (s) of TRACKS and TNF are administered together and, if desired, together with additional substances. When solid tumors are found in joints or other places more isolated from the general circulation, the therapeutic agents described herein are introduced into an isolated tumor or organ. In other instances, an FGF antagonist or platelet-derived growth factor (TGF), such as a neutralizing anti-FGF or TGF antibody, is administered to a patient in conjunction with a TRACKS antagonist. The use of PRECKS antagonists under optimal circumstances may be suspended during wound healing or desired neovascularization.
Прочие применения
Антитела к ФРЭККС, описываемые в данном изобретении, могут служить в качестве агентов для аффинной очистки. В этом процессе антитела к ФРЭККС иммобилизуются на подходящем носителе, таком как Сефадекс или фильтровальная бумага, с использованием известных методов. Иммобилизованное антитело затем приводится в контакт с образцом, содержащим ФРЭККС, который необходимо очистить; далее база промывается соответствующим растворителем, таким как глициновый буфер, pH 5,0, который освобождает ФРЭККС от антитела.Other applications
Antibodies to PRECKS described in this invention can serve as agents for affinity purification. In this process, antibodies to PRECKS are immobilized on a suitable carrier, such as Sephadex or filter paper, using known methods. The immobilized antibody is then brought into contact with a sample containing FREKS, which must be cleaned; the base is then washed with an appropriate solvent, such as glycine buffer, pH 5.0, which frees FRECX from the antibody.
Нижеследующие примеры предлагаются только в качестве иллюстрации и не должны восприниматься как в чем-либо ограничивающие изобретение. The following examples are offered by way of illustration only and should not be construed as limiting the invention in any way.
ПРИМЕР 1
Приготовление моноклональных антител к ФРЭККС
Для получения ФРЭККС, конъюгированного с гемоцианином морского блюдечка (ГМБ) для иммунизации, рекомбинантный ФРЭККС [165 аминокислот; Леунг и др. "Наука" (Science), 246: 1306 (1989)] смешивали с ГМБ в отношении 4:1 в присутствии 0,05% глютаральдегида и смесь инкубировали при комнатной температуре в течение 3 часов, слегка помешивая. Смесь была затем диализована против фосфатного буферного физиологического раствора (ФБРФ) при температуре 4oC в течение ночи.EXAMPLE 1
Preparation of Monoclonal Antibodies to PRECKS
To obtain FREKS, conjugated with a saucer hemocyanin (GMB) for immunization, recombinant FREKS [165 amino acids; Leung et al. Science, 246: 1306 (1989)] were mixed with HMB in a 4: 1 ratio in the presence of 0.05% glutaraldehyde and the mixture was incubated at room temperature for 3 hours, stirring slightly. The mixture was then dialyzed against phosphate buffered saline (PBS) at 4° C. overnight.
Мыши линии Balb/c были иммунизованы четыре раза в течение каждых двух недель путем интраперитонеальных инъекций пятью мкг ФРЭККС, конъюгированными с 20 мкг ГМБ, и реиммунизированы той же дозой ФРЭККС, конъюгированного с ГМБ, за четыре дня до слияния клеток. Balb / c mice were immunized four times every two weeks by intraperitoneal injection with five μg of HECF conjugated to 20 μg of HMB, and reimmunized with the same dose of HMEG-conjugated HECF four days before cell fusion.
Клетки селезенки от иммунизованной мыши были слиты с клетками миеломы линии P3X63Ag8U.1. (Йелтон и др. "Текущие вопросы в микробиологии и иммунологии" (Curr. Top. Microbiol. Immunol.), 81: 1 (1978) с использованием 35% полиэтиленгликоля (ПЭГ). (Ярмуш и др. "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci.), 77: 2899 (1980). Гибридомы отбирались в среде HAT. Spleen cells from an immunized mouse were fused to P3X63Ag8U.1 myeloma cells. (Yelton et al. Current Issues in Microbiology and Immunology (Curr. Top. Microbiol. Immunol.), 81: 1 (1978) using 35% polyethylene glycol (PEG). (Yarmush et al. Izvestia National Akad. Science "(Proc. Nat. Acad. Sci.), 77: 2899 (1980). Hybridomas were selected in HAT medium.
Супернатанты культур гибридомных клеток подвергались скринингу на продукцию антитела к ФРЭККС; применялся твердофазный иммуносорбентный анализ ELISA с микротитровочными пластинками, покрытыми ФРЭККС. Антитело, которое привязывалось к ФРЭККС в каждой из лунок, определялось при помощи козьего антимышиного иммуноглобулина IgG, конъюгированного со щелочной фосфатазой, и хромогенного субстрата п-нитрофенилфосфата [Харлоу и Лейн, "Антитела: Лабораторное руководство" (Antibodies: A Laboratory Manual), с. 597 (Cold Spring Harbor Laboratory, 1988)]. Клетки гибридомы, которые, как было установлено этим методом, производят антитела к ФРЭККС, были субклонированы путем лимитирующего растворения, и два из этих клонов, названные A4.6.1 и B2.6.2, были выбраны для дальнейших исследований. Hybridoma cell culture supernatants were screened for production of anti-HECRE antibodies; ELISA solid phase immunosorbent assay was used with microtiter plates coated with FREX. The antibody that binds to HECFEC in each of the wells was determined using goat anti-mouse immunoglobulin IgG conjugated with alkaline phosphatase and a chromogenic substrate of p-nitrophenyl phosphate [Harlow and Lane, “Antibodies: Laboratory Manual, Antibodies: A Laboratory Manual), c . 597 (Cold Spring Harbor Laboratory, 1988)]. Hybridoma cells that were established by this method to produce antibodies to PRECKS were subcloned by limiting dissolution, and two of these clones, named A4.6.1 and B2.6.2, were selected for further studies.
ПРИМЕР 2
Характеризация моноклональных антител к ФРЭККС
А. Специфичность по отношению к антигену.EXAMPLE 2
Characterization of Monoclonal Antibodies to PRECKS
A. Specificity for antigen.
Связывающие специфичности моноклональных антител к ФРЭККС, произведенных гибридомами A4.6.1 и B2.6.2, были определены методом ELISA. Моноклональные антитела были добавлены в лунки микротитровочных пластинок, которые до этого были покрыты ФРЭККС, ФРФ, ФРГ или эпидермальным фактором роста (ЭФР). Связанное антитело было обнаружено при помощи козьих антимышиных иммуноглобулинов IgG, конъюгированных с пероксидазой. Результаты данного анализа подтверждают, что моноклональные антитела, продуцированные гибридомами A4.6.1 и B2.6.2, связываются с ФРЭККС, но связывания их с прочими белковыми факторами роста не наблюдается. The binding specificities of monoclonal antibodies to PRECKS produced by A4.6.1 and B2.6.2 hybridomas were determined by ELISA. Monoclonal antibodies were added to the wells of microtiter plates, which had previously been coated with FREKS, FGF, HGF or epidermal growth factor (EGF). The bound antibody was detected using goat anti-mouse IgG immunoglobulins conjugated to peroxidase. The results of this analysis confirm that the monoclonal antibodies produced by the A4.6.1 and B2.6.2 hybridomas bind to FREX, but they are not associated with other protein growth factors.
Б. Картирование эпитопа. B. Epitope mapping.
Анализ конкурентного связывания ELISA использовался для того, чтобы определить, связываются ли моноклональные антитела, продуцированные гибридомами A4.6.1 и B2.6.2, к тем же или к различным эпитопам (участкам) в пределах ФРЭККС [Ким и др. "Инфекц. иммунол. " (Infect. Immunol), 57: 944 (1989)]. Индивидуальные немеченые моноклональные антитела к ФРЭККС (A4.6.1 и B2.6.2) или постороннее антитело к ФРГ (изотип IgG1) были добавлены в лунки микротитровочных пластинок, до этого покрытых только ФРЭККС. Затем были добавлены биотинилированные моноклональные антитела (ВIO-A4.6.1 и BIO-В2.6.2). Отношение биотинилированных моноклональных антител к немеченым моноклональным антителам было около 1:1000. Связывание биотинилированных моноклональных антител визуализировалось добавлением авидинконъюгированной пероксидазы, а затем о-фенилен-диаминдигидрохлорида и перекиси водорода. Цветная реакция, которая показывает, какое количество биотинилированных моноклональных антител связалось с эпитопом, требует измерения оптической плотности (O.D) на длине волны 495 нанометров. Competitive binding analysis ELISA was used to determine whether monoclonal antibodies produced by A4.6.1 and B2.6.2 hybridomas bind to the same or different epitopes (sites) within FRECC [Kim et al. "Infect. Immunol." (Infect. Immunol), 57: 944 (1989)]. Individual unlabeled monoclonal anti-HECF antibodies (A4.6.1 and B2.6.2) or an extraneous anti-HGF antibody (IgG1 isotype) were added to the wells of microtiter plates, previously coated with HMFRS only. Then biotinylated monoclonal antibodies (BIO-A4.6.1 and BIO-B2.6.2) were added. The ratio of biotinylated monoclonal antibodies to unlabeled monoclonal antibodies was about 1: 1000. Binding of biotinylated monoclonal antibodies was visualized by the addition of avidin-conjugated peroxidase, and then o-phenylene diamine dihydrochloride and hydrogen peroxide. The color reaction, which shows how many biotinylated monoclonal antibodies bind to the epitope, requires measuring the optical density (O.D) at a wavelength of 495 nanometers.
Как показано на фиг. 1, в каждом случае связывание биотинилированного антитела к ФРЭККС было ингибировано соответствующим немеченым антителом к ФРЭККС или антителом к ФРГ. Эти результаты показывают, что моноклональные антитела, продуцированные гибридомами A4.6.1 и B2.6.2, связываются с различными эпитопами в пределах ФРЭККС
В. Изотипы.As shown in FIG. 1, in each case, the binding of a biotinylated anti-HECF antibody was inhibited by the corresponding unlabeled anti-HECF antibody or anti-HGF antibody. These results show that monoclonal antibodies produced by A4.6.1 and B2.6.2 hybridomas bind to different epitopes within the HREFKS
B. Isotypes.
Анализ ELISA использовался для того, чтобы определить моноклональные антитела, продуцированные гибридомами A4.6.1 и B2.6.2. Образцы культуральной среды (супернатанта), в которой росла каждая из гибридом, добавлялись в лунки микротитровочных пластинок, до этого покрытых ФРЭККС. Добытые моноклональные антитела к ФРЭККС инкубировались с различными изотипспецифичными козьими антимышиными иммуноглобулинами IgG, конъюгированного со щелочной фосфатазой, а связывание конъюгированных моноклональных антител к ФРЭККС было определено путем добавления n-нитрофенилфосфата. Цветная реакция измерялась при длине волны 405 нанометров с помощью счетчика на пластинке для анализа ELISA. An ELISA assay was used to determine monoclonal antibodies produced by A4.6.1 and B2.6.2 hybridomas. Samples of the culture medium (supernatant) in which each of the hybridomas grew was added to the wells of microtiter plates previously coated with HFREX. The obtained monoclonal antibodies to TRACKS were incubated with various isotype-specific goat anti-mouse immunoglobulins IgG conjugated with alkaline phosphatase, and the binding of conjugated monoclonal antibodies to TRACKS was determined by adding n-nitrophenyl phosphate. The color reaction was measured at a wavelength of 405 nanometers using a counter on a plate for ELISA analysis.
В результате применения этого метода был определен изотип (IgG1) моноклональных антител, продуцированных гибридомами A4.6.1 и B2.6.2. As a result of the application of this method, the isotype (IgG1) of monoclonal antibodies produced by A4.6.1 and B2.6.2 hybridomas was determined.
Г. Связывающее сродство. G. Binding affinity.
Сродство для моноклональных антител к ФРЭККС, продуцированных гибридомами A4.6.1 и В2.6.2, было определено путем анализа конкурентного связывания. Заранее известная субоптимальная концентрация моноклонального антитела была добавлена к образцам, содержащим 20000 - 40000 импульсов в минуту помеченного радиоактивным иодом125I-ФРЭККС (1-2 нанограмма) и различные, известные количества немеченого ФРЭККС (1 - 1000 нг). После инкубации в течение часа при комнатной температуре было добавлено 100 мкл козьей антимышиной антисыворотки Ig (Пел-Фриз, Роджерс, Аризона, США), и смеси инкубировались в течение еще одного часа при комнатной температуре. Комплексы антитела и связанного белка (иммунные комплексы) были осаждены добавлением 500 мкл 6% полиэтиленгликоля (ПЭГ, мол. вес 8000) при 4oC, а затем центрифугированы при 2000 х G 20 мин 4oC. Количество связанного с моноклональным антителом125I-ФРЭККС в каждом образце определялось подсчетом осадка на счетчике гамма-излучения.The affinity for monoclonal antibodies to PRECKS produced by hybridomas A4.6.1 and B2.6.2 was determined by analysis of competitive binding. A well-known suboptimal concentration of monoclonal antibody was added to samples containing 20,000 - 40,000 pulses per minute labeled with radioactive iodine125 I-PREFX (1-2 nanograms) and various, known amounts of unlabeled PREF-X (1 - 1000 ng). After incubation for one hour at room temperature, 100 μl of goat anti-mouse Ig antiserum was added (Pel-Frieze, Rogers, Arizona, USA), and the mixtures were incubated for another hour at room temperature. Antibody and bound protein complexes (immune complexes) were precipitated by the addition of 500 μl of 6% polyethylene glycol (PEG, mol. Weight 8000) at 4° C and then centrifuged at 2000 x G 20
Из этих данных были определены константы сродства путем Скатчард-анализа. Сродство моноклонального антитела к ФРЭККС, продуцированного гибридомой A4.6.1, было определено как 1,2 х 109 л/моль. Сродство моноклонального антитела к ФРЭККС, продуцированного гибридомой B2.6.2, было определено как 2,5 х 109 л/моль.From these data, affinity constants were determined by Scatchard analysis. The affinity of the monoclonal anti-PRECX antibody produced by A4.6.1 hybridoma was determined to be 1.2 x 109 L / mol. The affinity of the monoclonal antibody to PRECKS produced by B2.6.2 hybridoma was determined to be 2.5 x 109 L / mol.
Д. Ингибирование митогенной активности ФРЭККС. D. Inhibition of mitogenic activity of TRACKS.
Бычьи клетки капиллярного эндотелия коры надпочечников (КЭКН) [Феррара и др. , "Известия национальн. Акад. Наук" (Proc. Nat. Acad. Sci.), 84: 5773 (1987)] были высеяны с плотностью 104 клеток/мл в 12-луночных пластинках. В каждую лунку было добавлено 2,5 нг/мл ФРЭККС в присутствии или в отсутствие различных концентраций моноклональных антител к ФРЭККС, продуцированных гибридомами A4.6.1 и В2.6.2, а также постороннего моноклонального антитела к ФРГ. После роста культуры в течение 5 дней клетки в каждой лунке были подсчитаны с помощью счетчика Коултера. В качестве контроля КЭКН выращивались в отсутствие ФРЭККС.Bull cells of the capillary endothelium of the adrenal cortex (ECCN) [Ferrara et al., Proc. Nat. Acad. Sci.), 84: 5773 (1987)] were seeded with a density of 104 cells / ml in 12-well plates. 2.5 ng / ml of PRECKS was added to each well in the presence or absence of different concentrations of monoclonal antibodies to PRECKS produced by hybridomas A4.6.1 and B2.6.2, as well as an extraneous monoclonal antibody to FRG. After culture growth for 5 days, cells in each well were counted using a Coulter counter. As a control, ECECs were grown in the absence of FRECX.
Как показано на фиг. 2, оба моноклональных антитела к ФРЭККС ингибировали способность добавленного ФРЭККС поддерживать рост и выживание бычьих КЭКН. Моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1, полностью ингибировало митогенную активность ФРЭККС (на более чем 90%), тогда как моноклональное антитело, продуцированное гибридомой В2.6.2, лишь частично ингибировало митогенную активность ФРЭККС. As shown in FIG. 2, both monoclonal antibodies to TRACKS inhibited the ability of the added TRACKS to support the growth and survival of bovine ECEC. The monoclonal antibody to HREA produced by hybridoma A4.6.1 completely inhibited the mitogenic activity of HREA (by more than 90%), while the monoclonal antibody produced by hybridoma B2.6.2 only partially inhibited the mitogenic activity of HREA.
Е. Ингибирование связывания ФРЭККС. E. Inhibition of binding of HECRE.
Бычьи клетки капиллярного эндотелия коры надпочечников (КЭКН) были высеяны с плотностью 2,5 • 104 клеток/0,5 мл/лунку в 24-луночных микротитровочных пластинках в СИМД (среда Игла, модифицированная Дулбекко), содержащей 10% плазмы теленка, 2 мМ глютамина и 1 нг/мл основного фактора роста фибробластов. После роста культуры в течение ночи клетки были один раз промыты связывающим буфером (равные объемы CИМД и среды F12 плюс 25 мМ HEPES и 1% альбумина бычьей плазмы) при 4oC.Bovine cells of the capillary endothelium of the adrenal cortex (ECCN) were seeded with a density of 2.5 • 104 cells / 0.5 ml / well in 24-well microtiter plates in SIMD (Dulbecco's modified Igla medium) containing 10% calf plasma, 2 mM glutamine and 1 ng / ml major fibroblast growth factor. After culture growth overnight, the cells were washed once with binding buffer (equal volumes of CIMD and F12 medium plus 25 mM HEPES and 1% bovine plasma albumin) at 4o C.
12000 импульсов в минуту (ивм)125I-ФРЭККС (около 5 • 104 ивм/нг/мл) были преинкубированы в течение 30 мин с 5 мкг моноклональных антител к ФРЭККС, продуцированных гибридомами A4.6.1, В2.6.2 или A2.6.1 (общий объем 250 мкл), после чего смеси были добавлены к КЭКН на микротитровочных пластинках. После инкубации клеток 3 часа при 4oC клетки были промыты 3 раза связывающим буфером при 4oC, переведены в раствор добавлением 0,5 мл 0,2 н. NaOH, и сигнал был подсчитан с помощью гамма-счетчика. Как показано на фиг. 3 (вверху), моноклональное антитело, продуцированное гибридомой
A2.6.1 и B2.6.2, прекращало прикрепление ФРЭККС к КЭКН. В противоположном случае моноклональные антитела к ФРЭККС, продуцированные гибридомами A4.6.1, не влияют на прикрепление ФРЭККС к КЭКН. Это согласуется с результатами, полученными путем анализа проницаемости клеток, описанной выше. Моноклональные антитела, продуцированные гибридомами A4.6.1, сильнее препятствовали прикреплению ФРЭККС, чем моноклональные антитела, продуцированные гибридомами B2.6.2.12000 pulses per minute (ivm)125 I-PREFKS (about 5 • 104 ivm / ng / ml) were preincubated for 30 min with 5 μg of monoclonal anti-PREFX antibodies produced by A4.6.1, B2.6.2 or A2.6.1 hybridomas (total volume 250 μl), after which the mixtures were added to ECEC on microtiter plates. After the cells were incubated for 3 hours at 4° C, the cells were washed 3 times with binding buffer at 4° C, transferred to the solution by adding 0.5 ml of 0.2 N NaOH, and the signal was counted using a gamma counter. As shown in FIG. 3 (above), a monoclonal antibody produced by hybridoma
A2.6.1 and B2.6.2, terminated the attachment of FRECX to ECNS. In the opposite case, monoclonal antibodies to PRECKS produced by A4.6.1 hybridomas do not affect the attachment of PRECKS to ECEC. This is consistent with the results obtained by analyzing the cell permeability described above. Monoclonal antibodies produced by A4.6.1 hybridomas were more likely to inhibit the attachment of HECRE than monoclonal antibodies produced by B2.6.2 hybridomas.
Как показано на фиг. 3 (внизу), моноклональное антитело, продуцированное гибридомой A4.6.1, полностью ингибировало связывание ФРЭККС с КЭКН при соотношении ФРЭККС к антителу 1:250. As shown in FIG. 3 (bottom), the monoclonal antibody produced by A4.6.1 hybridoma completely inhibited the binding of PRECKS to ECCN at a ratio of PRECKS to antibody of 1: 250.
Ж. Перекрестняя реакция с другими изоформами ФРЭККС. G. Cross-reaction with other isoforms of FREX.
Для определения того, реагирует ли моноклональное антитело, продуцированное гибридомой A4.6.1, с 121- и 189-аминокислотными формами ФРЭККС, это антитело было проанализировано на предмет способности иммунопреципитировать подобные полипептиды. To determine whether the monoclonal antibody produced by A4.6.1 hybridoma reacts with 121- and 189-amino acid forms of HECF, this antibody was analyzed for its ability to immunoprecipitate such polypeptides.
Человеческие клетки 293 были трансфецированы векторами, включающими нуклеотидные кодрующие последовательности 121-й 189-аминокислотных полипептидов ФРЭККС, описанных Леунг и др., "Наука" (Science), 246: 1306 (1989). Спустя два дня после трансфекции, клетки были переведены в среду, лишенную цистеина и метионина. Клетки инкубировались в этой среде 30 минут, а затем были добавлены35S-метионин и35S-цистеин, 100 мкКюри/мл каждого. После мечения клетки перевели в среду, лишенную плазмы, и инкубировали три часа. Культуральная среда была собрана, и клетки были лизированы инкубацией 30 мин в лизирующем буфере (150 мМ NaCl, 1% NP40, 0,5% дезоксихолат, 0,1% додецилсульфат натрия (SDS), 50 мМ Трис, pH 8,0). Клеточные остатки были удалены из лизатов путем центрифугирования при 200 G в течение 30 мин.293 human cells were transfected with vectors including the nucleotide coding sequences of the 121st 189-amino acid polypeptides FRECKS described by Leung et al., Science, 246: 1306 (1989). Two days after transfection, the cells were transferred to a medium lacking cysteine and methionine. Cells were incubated in this medium for 30 minutes, and then35 S-methionine and35 S-cysteine, 100 μCi / ml each, were added. After labeling, the cells were transferred to a plasma-free medium and incubated for three hours. The culture medium was harvested and the cells were lysed by incubation for 30 min in lysis buffer (150 mM NaCl, 1% NP40, 0.5% deoxycholate, 0.1% sodium dodecyl sulfate (SDS), 50 mM Tris, pH 8.0). Cell residues were removed from the lysates by centrifugation at 200 G for 30 minutes.
Аликвоты 500 мкл культуральной среды и клеточных лизатов инкубировали вместе с 2 мкл моноклонального антитела, продуцированного гибридомой A4.6.1 (2,4 мг/мл) в течение 1 часа при 4oC, а затем инкубировали с 5 мкл антимышиного иммуноглобулина IgG кролика 1 час при 4oC. Иммунные комплексы меченого35S ФРЭККС и моноклонального антитела к ФРЭККС были преципитированы на Сефарозе с белком А (Фармация), затем подверглись электрофорезу в 12% полиакриламидном геле с SDS в восстанавливающих условиях. Гель был экспонирован на рентгенограмму для анализа иммунопреципитированных белков, меченых радиоизотопами, путем авторадиографии.Aliquots of 500 μl of culture medium and cell lysates were incubated with 2 μl of monoclonal antibody produced by A4.6.1 hybridoma (2.4 mg / ml) for 1 hour at 4° C, and then incubated with 5 μl of rabbit anti-mouse immunoglobulin IgG for 1 hour at 4° C. Immune complexes of35 S-labeled FREX and a monoclonal antibody to H-FREX were precipitated on Sepharose with Protein A (Pharmacia), then electrophoresed on a 12% SDS SDS polyacrylamide gel under reducing conditions. The gel was exposed to an x-ray to analyze immunoprecipitated proteins labeled with radioisotopes by autoradiography.
Результаты этого анализа показали, что моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1, перекрестно реагировало с 121- и 189-аминокислотными формами ФРЭККС. The results of this analysis showed that the monoclonal anti-HREFX antibody produced by A4.6.1 hybridoma cross-reacted with 121- and 189-amino acid forms of HREFKS.
ПРИМЕР 3
Приготовление слитого белка "рецептор ФРЭККС-IgG".EXAMPLE 3
Preparation of the FREKS-IgG Receptor Fusion Protein
Нуклеотидные и аминокислотные кодирующие последовательности рецептора ФРЭККС, flt, описаны Шибуя и др., "Онкоген" (Oncogene), 5: 519-524 (1990). Кодирующая последовательность внеклеточного домена рецептора ФРЭККС, flt, была слита с кодирующей последовательностью тяжелой цепи человеческого IgG1 в два приема. The nucleotide and amino acid coding sequences of the TRACKS receptor, flt, are described by Shibuya et al., Oncogene, 5: 519-524 (1990). The coding sequence of the extracellular domain of the TRACKS receptor, flt, was fused to the human IgG1 heavy chain coding sequence in two steps.
Сайт-направленный мутагенез применялся для того, чтобы включить рестрикционный сайт BstBI в ДНК, кодирующую flt, в 5'-сайте к кодону для аминокислоты 759 flt и перевести единственный BstEII рестрикционный сайт в плазмиде pBSSKFC в сайт BstBI [Беннетт и др. "Журн. биол. химии" (J. Biol. Chem. ), 266: 23060-23067 (1991)]. Модифицированная плазмида была обработана EcoRI и BstBI, и получившийся большой фрагмент плазмидной ДНК был соединен с EcoRI-BstBI фрагментом ДНК flt, кодирующей внеклеточный домен (аминокикслоты 1-758) рецептора ФРЭККС, flt. Site-directed mutagenesis was used to incorporate the BstBI restriction site into flt-encoding DNA at the 5 ′ site of the 759 flt amino acid codon and to translate the only BstEII restriction site in the pBSSKFC plasmid to the BstBI site [Bennett et al. Biol. Chemistry "(J. Biol. Chem.), 266: 23060-23067 (1991)]. The modified plasmid was digested with EcoRI and BstBI, and the resulting large plasmid DNA fragment was coupled to the EcoRI-BstBI flt DNA fragment encoding the extracellular domain (amino acids 1-758) of the FREX receptor, flt.
Полученная конструкция была обработана ClaI и NotI; был получен фрагмент длиной примерно 3,3 kb, который был путем лигирования вставлен в множественный клонирующий сайт вектора экспрессии млекопитающих pHЕВO2 [Леунг и др. "Нейрон" (Neuron), 8: 1045 (1992)]. Концы фрагмента длиной 3,3 kb могут быть модифицированы, например, посредством добавления линкеров, чтобы вставка фрагмента в вектор могла быть ориентирована в правильном направлении для экспрессии. The resulting construct was processed by ClaI and NotI; a fragment of approximately 3.3 kb was obtained, which was inserted by ligation into the multiple cloning site of the mammalian expression vector pHEBO2 [Leung et al. Neuron, 8: 1045 (1992)]. The ends of a 3.3 kb fragment can be modified, for example, by adding linkers so that the insert of the fragment into the vector can be oriented in the right direction for expression.
Клетки-хозяева млекопитающих, например клетки CEN4 (Леунг и др. см. выше), трансфецировались плазмидой pHЕВO2, содержащей вставку flt, путем электропорации. Трансфецированные клетки выращивались в среде, содержащей около 10% эмбриональной бычьей плазмы, 2 мМ глютамина и антибиотики; около 75% клеток были перенесены в среду, свободную от плазмы. Среда кондиционировалась 3-4 дня до того, как собирались клетки, и слитый белок "flt-IgG" был выделен из кондиционированной среды хроматографией на аффинной матрице с белком А, в целом согласно описанию Беннетта и др. "Журнал биологической химии" (J. Biol. Chem.), 266: 23060-23067 (1991). Mammalian host cells, for example, CEN4 cells (Leung et al., Supra), were transfected with the pHEBO2 plasmid containing the flt insert by electroporation. Transfected cells were grown in medium containing about 10% fetal bovine plasma, 2 mM glutamine and antibiotics; about 75% of the cells were transferred to plasma free medium. The medium was conditioned 3-4 days before the cells were collected, and the flt-IgG fusion protein was isolated from the conditioned medium by protein A affinity matrix chromatography, generally as described by Bennett et al. Journal of Biological Chemistry (J. Biol. Chem.), 266: 23060-23067 (1991).
ПРИМЕР 4
Ингибирование роста опухоли антагонистами ФРЭККС.EXAMPLE 4
Inhibition of tumor growth by TRACKS antagonists.
Различные человеческие линии опухолевых клеток анализировались методом ELISA на продукцию ФРЭККС. Было обнаружено, что ФРЭККС производится в клетках опухолей яичников, легких, прямой кишки, желудка, груди и мозга. Три линии опухолевых клеток продуцировали ФРЭККС: NEG55 (G55) (линия клеток глиомы человека получена от Д-ра М. Вестфал, Отделение нейрохирургии, Университ, Госпиталь Эппендор, Гамбург, Германия), А-673 (линия клеток рабдомиосаркомы человека получена из Американской коллекции типовых культур (АКТК), Роквилл, Мэриленд, США 20852, номер линии CRL 1598) и SK-LMS-1 (линия клеток лиомиосаркомы человека получена из АКТК, номер линии НТВ 88); эти линии были использованы для дальнейших исследований. Various human tumor cell lines were analyzed by ELISA for the production of FRECKS. It was found that PRECKS is produced in the cells of tumors of the ovaries, lungs, rectum, stomach, chest and brain. Three tumor cell lines produced FRECKS: NEG55 (G55) (human glioma cell line obtained from Dr. M. Westfal, Department of Neurosurgery, University, Eppendor Hospital, Hamburg, Germany), A-673 (human rhabdomyosarcoma cell line was obtained from the American collection type cultures (ACCT), Rockville, Maryland, USA 20852, line number CRL 1598) and SK-LMS-1 (human lyomyosarcoma cell line obtained from ACCT, line number NTV 88); these lines were used for further research.
Самкам мышей (Beige/nude) возрастом от 6 до 10 недель (полученные из лаборатории Чарльз Ривер, Уилмингтон, Массачусеттс, США) были подкожно введены 1-5 • 106 опухолевых клеток в 100-200 мкл физиологического раствора с фосфатным буфером (ФРФБ). В различное время после того, как установился рост опухоли, мышам вводили, интраперитонеально, один или два раза в неделю различные дозы моноклонального антитела к ФРЭККС, продуцированного гибридомой A4.6.1, постороннего моноклонального антитела к gp120 (5В6) или ПБС. Величина опухоли измерялась каждую неделю, и по завершении исследования опухоли были вырезаны и взвешены.Female mice (Beige / nude) aged 6 to 10 weeks (obtained from the Charles River Laboratory, Wilmington, Mass., USA) were injected subcutaneously with 1-5 • 106 tumor cells in 100-200 μl of phosphate buffered saline (PBS) . At different times after the growth of the tumor was established, the mice were injected, intraperitoneally, once or twice a week with different doses of a monoclonal antibody to HREFKS produced by hybridoma A4.6.1, an extraneous monoclonal antibody to gp120 (5B6) or PBS. Tumor size was measured every week, and at the end of the study, the tumors were excised and weighed.
Эффект различных доз моноклонального антитела к ФРЭККС, продуцированного гибридомой A4.6.1, на рост опухолей NEG55 показан у мышей на фиг. 4 и 5. Фиг. 4 показывает, что у тех мышей, которым было введено от 25 до 100 мкг моноклонального антитела к ФРЭККС, продуцированного гибридомой A4.6.1, начиная с одной недели после инокуляции клетками NEG55, скорость роста опухолей была значительно более медленной, чем у мышей, которым вводили постороннее моноклональное антитело или ФРФБ. Фиг.5 показывает, что к тому моменту, когда прошло пять недель после инокуляции клетками NEG55, величина опухоли у мышей, которым было введено моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1, была на 50% (в случае, когда мыши получали 25 мкг антитела) или на 85% (в случае, когда мыши получали 100 мкг антитела) меньше, нежели у мышей, которым вводили постороннее моноклональное антитело или ФРФБ. The effect of different doses of the monoclonal anti-HREFX antibody produced by A4.6.1 hybridoma on the growth of NEG55 tumors is shown in mice in FIG. 4 and 5. FIG. 4 shows that in those mice that were injected with 25 to 100 μg of the monoclonal anti-PREFX monoclonal antibody produced by A4.6.1 hybridoma, starting one week after inoculation with NEG55 cells, the tumor growth rate was significantly slower than in mice that were injected extraneous monoclonal antibody or FRFB. Figure 5 shows that by the time five weeks after inoculation with NEG55 cells, the tumor size in mice that were injected with a monoclonal anti-PRECX antibody produced by A4.6.1 hybridoma was 50% (in the case when the mice received 25 μg of antibody) or 85% (in the case when mice received 100 μg of antibody) less than in mice that were injected with an extraneous monoclonal antibody or PFRB.
Эффект моноклонального антитела к ФРЭККС, продуцированного гибридомой A4.6.1, на рост опухолей SK-LMS-1 у мышей показан на фиг. 6. К тому моменту, когда прошло пять недель после инокуляции клетками SK-LMS-1, средняя величина опухоли у мышей, которым было введено моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1, была на 75% меньше, нежели у мышей, которым вводили постороннее моноклональное антитело или ФРФБ. The effect of the monoclonal anti-HREFX antibody produced by hybridoma A4.6.1 on the growth of SK-LMS-1 tumors in mice is shown in FIG. 6. By the time five weeks after inoculation with SK-LMS-1 cells, the average tumor size in mice that were injected with a monoclonal anti-PREFX antibody produced by A4.6.1 hybridoma was 75% less than in mice that a foreign monoclonal antibody or FRFB was administered.
Эффект моноклонального антитела к ФРЭККС, продуцированного гибридомой A4.6.1, на рост опухолей A673 у мышей показан на фиг.7. К тому моменту, когда прошло четыре недели после инокуляции клетками A673, средняя величина опухоли у мышей, которым было введено моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1, была на 60% (в случае, когда мыши получали 10 мкг антитела) до более чем на 90% (в случае, когда мыши получали 50 - 400 мкг антитела) меньше, нежели у мышей, которым вводили постороннее моноклональное антитело или ФРФБ. The effect of the monoclonal anti-HREFX antibody produced by hybridoma A4.6.1 on the growth of A673 tumors in mice is shown in Fig. 7. By the time four weeks after inoculation with A673 cells, the average tumor size in mice that were injected with a monoclonal anti-HREFX antibody produced by hybridoma A4.6.1 was 60% (in the case when the mice received 10 μg of antibody) to more than 90% (in the case when the mice received 50 - 400 μg of antibody) less than in mice that were injected with an extraneous monoclonal antibody or PFRS.
ПРИМЕР 5
Анализ непосредственного эффекта антитела к ФРЭККС на рост клеток опухоли в культуре.EXAMPLE 5
Analysis of the direct effect of the anti-HECREF antibody on tumor cell growth in culture.
Клетки глиобластомы человека NEG55 или клетки рабдомиосаркомы человека А-673 были высеяны с плотностью 7 • 103 клеток/лунку в многолуночных пластинках (12 лунок на пластинку) в среде F12/СИМД, содержащей 10% эмбриональной плазмы теленка, 2 мМ глютамина и антибиотики. К культурам клеток было добавлено моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1; его конечная концентрация была от 0 до 20,0 мкг/мл. По истечении 5 дней клетки, растущие в лунках, были диссоциированы с помощью трипсина и подсчитаны с помощью счетчика Коултера.Human NEG55 glioblastoma cells or human A-673 rhabdomyosarcoma cells were seeded at a density of 7 x 103 cells / well in multi-well plates (12 wells per plate) in F12 / SIMD medium containing 10% fetal calf plasma, 2 mM glutamine and antibiotics. A monoclonal anti-HREFX antibody produced by hybridoma A4.6.1 was added to cell cultures; its final concentration was from 0 to 20.0 μg / ml. After 5 days, the cells growing in the wells were dissociated with trypsin and counted using a Coulter counter.
Результаты этого анализа показаны на фиг. 8 и 9. Очевидно, что моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1, не имело сколько-нибудь значительного эффекта на рост клеток NEG55 или A-673 в культуре. Эти результаты свидетельствуют, что моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1, не имеет цитотоксических свойств, и с уверенностью подтверждают, что наблюдаемый эффект антитела на рост опухолей совершается за счет ингибирования неоваскуляризации, опосредованной ФРЭККС. The results of this analysis are shown in FIG. 8 and 9. Obviously, the monoclonal anti-PREFX antibody produced by A4.6.1 hybridoma did not have any significant effect on the growth of NEG55 or A-673 cells in culture. These results indicate that the monoclonal anti-HREFX antibody produced by A4.6.1 hybridoma does not have cytotoxic properties and confirms with confidence that the observed effect of the antibody on tumor growth is accomplished by inhibiting neovascularization mediated by HREFKS.
ПРИМЕР 6
Эффект антитела к ФРЭККС на хемотаксис эндотелиальных клеток.EXAMPLE 6
The effect of antibodies to PRECKS on chemotaxis of endothelial cells.
Хемотаксис эндотелиальных клеток, а также иных клеток, включая моноциты и лимфоциты, играет важную роль в патогенезе ревматоидного артрита. Миграция эндотелиальных клеток и их пролиферация сопровождают ангиогенез, происходящий в ревматоидной синовиальной оболочке. Ткань, насыщенная кровеносными сосудами (паннус), вторгается в хрящ сустава и разрушает его. Chemotaxis of endothelial cells, as well as other cells, including monocytes and lymphocytes, plays an important role in the pathogenesis of rheumatoid arthritis. Migration of endothelial cells and their proliferation accompany angiogenesis that occurs in the rheumatoid synovial membrane. A tissue saturated with blood vessels (pannus) invades the cartilage of the joint and destroys it.
Чтобы определить, интерферируют ли антагонисты ФРЭККС с этим процессом, проанализировали эффект антитела к ФРЭККС, продуцированного гибридомой A4.6.1, на хемотаксис эндотелиальных клеток, стимулированный синовиальной жидкостью, взятой у пациентов с ревматоидным артритом. В качестве контроля проанализировали эффект антитела к ФРЭККС, продуцированного гибридомой А4.6.1, на хемотаксис эндотелиальных клеток, стимулированный синовиальной жидкостью, взятой у пациентов с остеоартритом (ангиогенез, происходящий при ревматоидном артрите, не имеет места при остеоартрите). In order to determine whether the antagonists of PRECKS interfere with this process, we analyzed the effect of the anti-PRACEX antibody produced by hybridoma A4.6.1 on chemotaxis of endothelial cells stimulated by synovial fluid taken from patients with rheumatoid arthritis. As a control, we analyzed the effect of the anti-FRECX antibody produced by A4.6.1 hybridoma on endothelial cell chemotaxis stimulated by synovial fluid taken from patients with osteoarthritis (angiogenesis that occurs with rheumatoid arthritis does not occur with osteoarthritis).
Хемотаксис эндотелиальных клеток анализировался в модифицированных камерах Бойдена согласно стандартным методам [Томпсон и др."Раковые исследования" (Cancer Res.), 51: 2670 (1991); Филлипс и др. "Изв. эскпер. биол. и мед. "(Proc. Exper. Biol. Med.), 197: 458 (1991)]. Около 104 эндотелиальных клеток пуповины человека были нанесены на фильтры, покрытые желатином (размер пор 0,8 микрон) в многолуночных (48 лунок) микрокамерах в среде, содержащей 0,1% эмбриональной плазмы теленка. По истечении двух часов камеры были перевернуты, и были добавлены образцы (синовиальная жидкость при ревматоидном артрите, синовиальная жидкость при остеоартрите, основной ФРФ (оФРФ) (до конечной концентрации 1 мкг/мл) или ФРФБ и моноклональное антитело к ФРЭККС, продуцированное гибридомой A4.6.1 (до конечной концентрации 10 мкг/мл). По истечении еще двух-трех часов все мигрировавшие клетки были окрашены и подсчитаны.Chemotaxis of endothelial cells was analyzed in modified Boyden chambers according to standard methods [Thompson et al. Cancer Research (Cancer Res.), 51: 2670 (1991); Phillips et al. "Izv. Esk. Biol. And honey." (Proc. Exper. Biol. Med.), 197: 458 (1991)]. About 104 human umbilical cord endothelial cells were deposited on gelatin coated filters (pore size 0.8 microns) in multi-well (48 holes) microchambers in a medium containing 0.1% calf fetal plasma. After two hours, the chambers were turned upside down and samples were added (synovial fluid for rheumatoid arthritis, synovial fluid for osteoarthritis, basic RFF (oFRF) (to a final concentration of 1 μg / ml) or RFFB and a monoclonal anti-FRECX antibody produced by A4 hybridoma. 6.1 (to a final concentration of 10 μg / ml) After another two to three hours, all migrated cells were stained and counted.
Результаты этого исследования показаны на фиг. 10. Значения, показанные в столбце, обозначенном "син. жидк.", а также данные внизу страницы показывают среднее количество эндотелиальных клеток, которые мигрировали в присутствии синовиальной жидкости, оФРФ или только ФРФБ. Значения, показанные в столбце, обозначенном "син. жидк. + а-т ФРЭККС", показывают среднее количество эндотелиальных клеток, которые мигрировали в присутствии синовиальной жидкости и добавленного антитела к ФРЭККС, продуцированного гибридомой A4.6.1. Значения, показанные в столбце, обозначенном "% подавления", отражают процентное сокращение миграции эндотелиальных клеток, вызванной присутствием синовиальной жидкости, при добавлении антитела к ФРЭККС. Как видно из этих данных, антитело к ФРЭККС существенно ингибировало свойства синовиальной жидкости при ревматоидном артрите (средний процент ингибирования 53.40), но не остеоартритной синовиальной жидкости (средний процент ингибирования 13.64) вызывать миграции эндотелиальных клеток. The results of this study are shown in FIG. 10. The values shown in the column labeled “syn. Fluid.”, As well as the data at the bottom of the page, show the average number of endothelial cells that migrated in the presence of synovial fluid, OFF, or only FRFB. The values shown in the column labeled “syn. Fluid + a-TREKX” show the average number of endothelial cells that migrated in the presence of synovial fluid and the added anti-TREKX antibody produced by hybridoma A4.6.1. The values shown in the column labeled “% inhibition” reflect the percentage reduction in endothelial cell migration caused by the presence of synovial fluid when antibody is added to PRECKS. As can be seen from these data, the anti-FRECX antibody significantly inhibited the properties of synovial fluid in rheumatoid arthritis (average percent inhibition 53.40), but not osteoarthritic synovial fluid (average percent inhibition 13.64) to cause endothelial cell migration.
Claims (21)
Translated fromRussianPriority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU95109930ARU2170589C2 (en) | 1992-10-28 | 1992-10-28 | Composition for inhibition of angiogenesis, monoclonal antibody, polypeptide, method of inhibition of tumor growth (variants) |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU95109930ARU2170589C2 (en) | 1992-10-28 | 1992-10-28 | Composition for inhibition of angiogenesis, monoclonal antibody, polypeptide, method of inhibition of tumor growth (variants) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU95109930A RU95109930A (en) | 1998-02-10 |
| RU2170589C2true RU2170589C2 (en) | 2001-07-20 |
Family
ID=20168881
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU95109930ARU2170589C2 (en) | 1992-10-28 | 1992-10-28 | Composition for inhibition of angiogenesis, monoclonal antibody, polypeptide, method of inhibition of tumor growth (variants) |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2170589C2 (en) |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2295329C2 (en)* | 2001-09-12 | 2007-03-20 | ВиРекс Медикал Корпорейшн | Circulation-overlapping solid-phase preparation with covering being out of immobilized binding preparation |
| RU2317097C2 (en)* | 2002-08-26 | 2008-02-20 | Сосьете Де Консей Де Решерш Э Д`Аппликасьон Сьентифик (С.К.Р.А.С.) | Plant-originated heterocarpine protein having anti-cancer properties |
| RU2387667C2 (en)* | 2003-07-15 | 2010-04-27 | Кембридж Антибоди Текнолоджи Лимитед | Human il-13 antibody molecules |
| RU2389509C2 (en)* | 2004-04-07 | 2010-05-20 | Ринат Ньюросайенс Корп. | Methods for bone cancer related pain management by administration of nerve growth factor antagonist |
| RU2392966C2 (en)* | 2004-07-20 | 2010-06-27 | Дженентек, Инк. | Angiopoietic angiopoietin-like protein 4 inhibitors, in combinations and application |
| RU2404806C2 (en)* | 2005-02-23 | 2010-11-27 | Дженентек, Инк. | Extension of time to progression of disease or lifetime of oncologic patients with application of her dimerisation inhibitors |
| RU2421464C2 (en)* | 2005-10-21 | 2011-06-20 | Новартис Аг | Human il-13 antibodies and their therapeutic application |
| RU2477530C2 (en)* | 2011-04-28 | 2013-03-10 | Общество С Ограниченной Ответственностью "Научно-Производственная Фирма "Материа Медика Холдинг" | Method for endothelial dysfunction correction by solution of homoeopathic dilutions of interleukin-6 antibodies |
| US11208497B2 (en) | 2013-12-23 | 2021-12-28 | Zymeworks Inc. | Antibodies comprising C-terminal light chain polypeptide extensions and conjugates and methods of use thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU1698287A1 (en)* | 1989-10-31 | 1991-12-15 | Всесоюзный онкологический научный центр АМН СССР | The strain of hybrid cultivated animal cells mus musculus as monoclonal antibody producer to the woman milk fat globule membrane antigen |
- 1992
- 1992-10-28RURU95109930Apatent/RU2170589C2/enactive
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU1698287A1 (en)* | 1989-10-31 | 1991-12-15 | Всесоюзный онкологический научный центр АМН СССР | The strain of hybrid cultivated animal cells mus musculus as monoclonal antibody producer to the woman milk fat globule membrane antigen |
Non-Patent Citations (1)
| Title |
|---|
| МАРТИН D.S. et al., Role of Murine tumor model in cancer treatment research, Cancer Research, 1986, v.46, pp.2189 - 2192. McKenzie S.J. Generation and characterization of monoclonal antibodyes specific for the human new oncogene product, Oncogene. 1989, v.4, pp.543 - 548.* |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2295329C2 (en)* | 2001-09-12 | 2007-03-20 | ВиРекс Медикал Корпорейшн | Circulation-overlapping solid-phase preparation with covering being out of immobilized binding preparation |
| RU2317097C2 (en)* | 2002-08-26 | 2008-02-20 | Сосьете Де Консей Де Решерш Э Д`Аппликасьон Сьентифик (С.К.Р.А.С.) | Plant-originated heterocarpine protein having anti-cancer properties |
| RU2387667C2 (en)* | 2003-07-15 | 2010-04-27 | Кембридж Антибоди Текнолоджи Лимитед | Human il-13 antibody molecules |
| RU2389509C2 (en)* | 2004-04-07 | 2010-05-20 | Ринат Ньюросайенс Корп. | Methods for bone cancer related pain management by administration of nerve growth factor antagonist |
| RU2392966C2 (en)* | 2004-07-20 | 2010-06-27 | Дженентек, Инк. | Angiopoietic angiopoietin-like protein 4 inhibitors, in combinations and application |
| RU2404806C2 (en)* | 2005-02-23 | 2010-11-27 | Дженентек, Инк. | Extension of time to progression of disease or lifetime of oncologic patients with application of her dimerisation inhibitors |
| RU2421464C2 (en)* | 2005-10-21 | 2011-06-20 | Новартис Аг | Human il-13 antibodies and their therapeutic application |
| RU2477530C2 (en)* | 2011-04-28 | 2013-03-10 | Общество С Ограниченной Ответственностью "Научно-Производственная Фирма "Материа Медика Холдинг" | Method for endothelial dysfunction correction by solution of homoeopathic dilutions of interleukin-6 antibodies |
| US11208497B2 (en) | 2013-12-23 | 2021-12-28 | Zymeworks Inc. | Antibodies comprising C-terminal light chain polypeptide extensions and conjugates and methods of use thereof |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3398382B2 (en) | Vascular endothelial cell growth factor antagonist | |
| CA2213833C (en) | Vascular endothelial cell growth factor antagonists | |
| US20030206899A1 (en) | Vascular endothelial cell growth factor antagonists | |
| US20020032313A1 (en) | Vascular endothelial cell growth factor antagonists | |
| US20010021382A1 (en) | Vascular endothelial cell growth factor antagonists | |
| US20030023046A1 (en) | Vascular endothelial cell growth factor antagonists | |
| RU2170589C2 (en) | Composition for inhibition of angiogenesis, monoclonal antibody, polypeptide, method of inhibition of tumor growth (variants) | |
| US20060193862A1 (en) | Vascular endothelial cell growth factor antagonists | |
| KR100315613B1 (en) | Vascular Endothelial Cell Growth Factor Antagonists | |
| HK1117549A1 (en) | Use of vascular endothelial cell growth factor antagonists | |
| HK1117549B (en) | Use of vascular endothelial cell growth factor antagonists | |
| HK1089658A (en) | Vascular endothelial cell growth factor antagonists |