KR20240118881A - Circular polyribonucleotide encoding an antifusogenic polypeptide - Google Patents
Circular polyribonucleotide encoding an antifusogenic polypeptideDownload PDFInfo
- Publication number
- KR20240118881A KR20240118881AKR1020247024156AKR20247024156AKR20240118881AKR 20240118881 AKR20240118881 AKR 20240118881AKR 1020247024156 AKR1020247024156 AKR 1020247024156AKR 20247024156 AKR20247024156 AKR 20247024156AKR 20240118881 AKR20240118881 AKR 20240118881A
- Authority
- KR
- South Korea
- Prior art keywords
- polyribonucleotide
- circular
- days
- polypeptide
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/64—General methods for preparing the vector, for introducing it into the cell or for selecting the vector-containing host
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16041—Use of virus, viral particle or viral elements as a vector
- C12N2740/16043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16041—Use of virus, viral particle or viral elements as a vector
- C12N2740/16045—Special targeting system for viral vectors
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/20011—Coronaviridae
- C12N2770/20022—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/50—Vector systems having a special element relevant for transcription regulating RNA stability, not being an intron, e.g. poly A signal
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2840/00—Vectors comprising a special translation-regulating system
- C12N2840/20—Vectors comprising a special translation-regulating system translation of more than one cistron
- C12N2840/203—Vectors comprising a special translation-regulating system translation of more than one cistron having an IRES
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Zoology (AREA)
- Epidemiology (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Virology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Toxicology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean폴리뉴클레오티드 및 단백질의 전달은 다양한 치료 분야에서 중요하다. 그러나 현재의 전달 방식은 종종 효과가 없다. 예를 들어, 항푸소제닉(antifusogenic) 폴리펩티드를 인코딩하는 폴리펩티드와 같은 짧은 폴리펩티드의 전달은 종종 짧은 반감기 및 폴리펩티드의 신속한 제거를 초래한다. 따라서, 예를 들어, 바이러스 감염을 치료하거나 예방하기 위해 항푸소제닉 폴리펩티드를 전달하기 위한 개선된 조성물 및 방법에 대한 필요성이 존재한다.Delivery of polynucleotides and proteins is important in various therapeutic fields. However, current delivery methods are often ineffective. For example, delivery of short polypeptides, such as polypeptides encoding antifusogenic polypeptides, often results in a short half-life and rapid clearance of the polypeptide. Accordingly, a need exists for improved compositions and methods for delivering antifusogenic polypeptides, for example, to treat or prevent viral infections.
본 개시내용은 항푸소제닉 폴리펩티드를 인코딩하는 원형 RNA를 생산, 정제 및 사용하기 위한 조성물 및 방법을 제공한다.The present disclosure provides compositions and methods for producing, purifying, and using circular RNA encoding antifusogenic polypeptides.
한 양태에서, 본 발명은 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 카고를 포함하는 원형 폴리리보뉴클레오티드를 특징으로 한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In one aspect, the invention features a circular polyribonucleotide comprising a polyribonucleotide cargo encoding an antifusogenic polypeptide. In some embodiments, the polyribonucleotide cargo comprises an expression sequence encoding an antifusogenic polypeptide.
일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 표 1의 폴리펩티드를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 표 1의 폴리펩티드와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 1 내지 324 중 어느 하나와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In some embodiments, the polyribonucleotide cargo comprises an expression sequence encoding a polypeptide of Table 1. In some embodiments, the polyribonucleotide cargo has an expressed sequence encoding a polypeptide having at least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity to a polypeptide of Table 1. Includes. In some embodiments, the polyribonucleotide cargo has at least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity with any one of SEQ ID NO: 1 to 324. It contains an expression sequence encoding a polypeptide.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 5' 엑손 단편 및 3' 엑손 단편을 연결(join)하는 스플라이스 접합부를 포함한다.In some embodiments, the circular polyribonucleotide comprises a splice junction joining the 5' exon fragment and the 3' exon fragment.
일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열에 작동가능하게 연결된 IRES를 포함한다. 원형 폴리리보뉴클레오티드는 IRES와 3' 엑손 단편 또는 5' 엑손 단편 사이에 스페이서 영역을 추가로 포함할 수 있다. 스페이서 영역은 적어도 5개의 리보뉴클레오티드의 길이를 가질 수 있다. 예를 들어, 스페이서 영역은 적어도 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1,000개, 또는 그 초과의 리보뉴클레오티드의 길이를 가질 수 있다. 일부 실시 형태에서, 스페이서 영역은 5 내지 500개의 리보뉴클레오티드의 길이를 갖는다. 스페이서 영역은 폴리A, 폴리A-C, 폴리A-U, 또는 폴리A-G 서열을 포함할 수 있다. 스페이서 영역은 무작위 서열일 수 있다.In some embodiments, the polyribonucleotide cargo comprises an IRES operably linked to an expression sequence encoding an antifusogenic polypeptide. The circular polyribonucleotide may further comprise a spacer region between the IRES and the 3' exon fragment or the 5' exon fragment. The spacer region may be at least 5 ribonucleotides in length. For example, the spacer regions can be at least 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1,000, or more. It can have a ribonucleotide length of . In some embodiments, the spacer region is 5 to 500 ribonucleotides in length. The spacer region may include polyA, polyA-C, polyA-U, or polyA-G sequences. The spacer region may be a random sequence.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 적어도 500개의 리보뉴클레오티드의 길이를 갖는다. 예를 들어, 원형 폴리리보뉴클레오티드는 적어도 500, 600, 700, 800, 900, 1,000, 2,000, 3,000, 4,000, 5,000, 6,000, 7,000, 8,000, 9,000, 10,000, 15,000, 20,000, 25,000, 30,000, 35,000, 40,000, 45,000, 50,000개, 또는 그 초과의 폴리리보뉴클레오티드일 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 500 내지 20,000개의 리보뉴클레오티드의 길이를 갖는다.In some embodiments, the circular polyribonucleotide is at least 500 ribonucleotides in length. For example, a circular polyribonucleotide may have at least 500, 600, 700, 800, 900, 1,000, 2,000, 3,000, 4,000, 5,000, 6,000, 7,000, 8,000, 9,000, 10,000, 15,000, 00, 25,000, 30,000, 35,000, It may be 40,000, 45,000, 50,000, or more polyribonucleotides. In some embodiments, the circular polyribonucleotide has a length of 500 to 20,000 ribonucleotides.
또 다른 양태에서, 5'로부터 3'로, (A) 3' 인트론 단편; (B) 3' 스플라이스 부위; (C) 3' 엑손 단편; (D) 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 카고; (E) 5' 엑손 단편; (F) 5' 스플라이스 부위; 및 (G) 5' 인트론 단편을 포함하는 선형 폴리리보뉴클레오티드를 특징으로 한다.In another embodiment, from 5' to 3', (A) a 3' intron fragment; (B) 3' splice site; (C) 3' exon fragment; (D) a polyribonucleotide cargo encoding an antifusogenic polypeptide; (E) 5' exon fragment; (F) 5' splice site; and (G) a linear polyribonucleotide comprising a 5' intron fragment.
일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In some embodiments, the polyribonucleotide cargo comprises an expression sequence encoding an antifusogenic polypeptide.
일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 발현 서열에 작동가능하게 연결된 IRES를 포함한다. 원형 폴리리보뉴클레오티드는 IRES와 3' 엑손 단편 또는 5' 엑손 단편 사이에 스페이서 영역을 추가로 포함할 수 있다. 원형 폴리리보뉴클레오티드는 (A), (B), (C), (D), (E), (F), 및 (G) 중 하나 이상 사이에 스페이서 영역을 추가로 포함할 수 있다.In some embodiments, the polyribonucleotide cargo comprises an IRES operably linked to an expression sequence encoding an antifusogenic polypeptide (e.g., a polypeptide in Table 1). The circular polyribonucleotide may further comprise a spacer region between the IRES and the 3' exon fragment or the 5' exon fragment. The circular polyribonucleotide may further include a spacer region between one or more of (A), (B), (C), (D), (E), (F), and (G).
스페이서 영역은 적어도 5개의 리보뉴클레오티드의 길이를 가질 수 있다. 예를 들어, 스페이서 영역은 적어도 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000개, 또는 그 초과의 리보뉴클레오티드의 길이를 가질 수 있다. 일부 실시 형태에서, 스페이서 영역은 5 내지 500개의 리보뉴클레오티드의 길이를 가질 수 있다. 스페이서 영역은 폴리A, 폴리A-C, 폴리A-U, 또는 폴리A-G 서열을 포함할 수 있다. 스페이서 영역은 무작위 서열일 수 있다.The spacer region may be at least 5 ribonucleotides in length. For example, the spacer regions can be at least 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, or more. It can have a ribonucleotide length of . In some embodiments, the spacer region can be between 5 and 500 ribonucleotides in length. The spacer region may include polyA, polyA-C, polyA-U, or polyA-G sequences. The spacer region may be a random sequence.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 IRES를 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 5' 캡 및 폴리A 서열 중 하나 또는 둘 모두를 결여한다.In some embodiments, the circular polyribonucleotide lacks an IRES. In some embodiments, the circular polyribonucleotide lacks one or both of the 5' cap and polyA sequences.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 단백질 번역 개시 부위를 포함한다. 일부 실시 형태에서, 단백질 번역 개시 부위는 코작(Kozak) 서열을 포함한다.In some embodiments, the circular polyribonucleotide comprises a protein translation initiation site. In some embodiments, the protein translation initiation site comprises a Kozak sequence.
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 적어도 500개의 리보뉴클레오티드의 길이를 갖는다. 예를 들어, 선형 폴리리보뉴클레오티드는 적어도 500, 600, 700, 800, 900, 1,000, 2,000, 3,000, 4,000, 5,000, 6,000, 7,000, 8,000, 9,000, 10,000, 15,000, 20,000, 25,000, 30,000, 35,000, 40,000, 45,000, 50,000개, 또는 그 초과의 폴리리보뉴클레오티드일 수 있다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 500 내지 20,000개의 리보뉴클레오티드의 길이를 갖는다.In some embodiments, the linear polyribonucleotide is at least 500 ribonucleotides in length. For example, a linear polyribonucleotide may have at least 500, 600, 700, 800, 900, 1,000, 2,000, 3,000, 4,000, 5,000, 6,000, 7,000, 8,000, 9,000, 10,000, 15,000, 00, 25,000, 30,000, 35,000, It may be 40,000, 45,000, 50,000, or more polyribonucleotides. In some embodiments, the linear polyribonucleotide has a length of 500 to 20,000 ribonucleotides.
또 다른 양태에서, 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 선형 또는 원형 폴리리보뉴클레오티드)를 인코딩하는 DNA 벡터를 특징으로 한다.In another aspect, a DNA vector encoding a polyribonucleotide (e.g., a linear or circular polyribonucleotide) described herein is featured.
또 다른 양태에서, 세포에서 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 발현시키는 방법을 특징으로 한다. 방법은 항푸소제닉 폴리펩티드를 발현시키기에 적합한 조건 하에서 세포에 본원에 기재된 바와 같은 원형, 선형 폴리리보뉴클레오티드 또는 DNA 벡터를 제공하는 것을 포함한다.In another aspect, a method of expressing an antifusogenic polypeptide (e.g., a polypeptide of Table 1) in a cell is featured. The method includes providing a circular, linear polyribonucleotide or DNA vector as described herein to a cell under conditions suitable for expressing the antifusogenic polypeptide.
또 다른 양태에서, 본원에 기재된 선형 폴리리보뉴클레오티드로부터 원형 폴리리보뉴클레오티드를 생성하는 방법을 특징으로 한다. 방법은 원형 폴리리보뉴클레오티드를 생성하기 위해 선형 폴리리보뉴클레오티드의 자기-스플라이싱에 적합한 조건 하에서 선형 폴리리보뉴클레오티드를 제공하는 것을 포함한다.In another aspect, a method of producing circular polyribonucleotides from linear polyribonucleotides described herein is featured. The method includes providing a linear polyribonucleotide under conditions suitable for self-splicing of the linear polyribonucleotide to produce a circular polyribonucleotide.
또 다른 양태에서, 임의의 상기 실시 형태의 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드 또는 DNA 벡터, 및 희석제, 담체 또는 부형제를 포함하는 약제학적 조성물을 특징으로 한다.In another aspect, a pharmaceutical composition is featured comprising a circular polyribonucleotide, linear polyribonucleotide, or DNA vector of any of the above embodiments, and a diluent, carrier, or excipient.
또 다른 양태에서, 대상체에서 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 발현시키는 방법을 특징으로 한다. 방법은 대상체에서 적어도 500 ng/mL(예를 들어, 적어도 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, 또는 그 초과)의 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)의 혈청 농도를 생성하기에 충분한 양으로 약제학적 조성물의 제1 용량을 투여하는 것을 포함한다.In another embodiment, a method of expressing an antifusogenic polypeptide (e.g., a polypeptide of Table 1) in a subject is featured. The method involves obtaining in a subject at least 500 ng/mL (e.g., at least 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, or more) of an antifusogenic polypeptide ( For example, administering the first dose of the pharmaceutical composition in an amount sufficient to produce a serum concentration of the polypeptide in Table 1).
일부 실시 형태에서, 방법은 약제학적 조성물의 제2 용량을 투여하는 것을 추가로 포함할 수 있다. 방법은 약제학적 조성물의 제3, 제4, 제5, 제6, 제7, 제8, 제9, 제10 또는 그 초과의 용량을 투여하는 것을 추가로 포함할 수 있다.In some embodiments, the method may further include administering a second dose of the pharmaceutical composition. The method may further include administering a third, fourth, fifth, sixth, seventh, eighth, ninth, tenth or more doses of the pharmaceutical composition.
일부 실시 형태에서, 제2 용량은 약제학적 조성물의 제1 용량을 투여한지 적어도 1시간(예를 들어, 적어도 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 1일, 2일, 3일, 4일, 5일, 6일, 1주, 2주, 3주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 1년, 또는 그 초과) 후에 투여된다.In some embodiments, the second dose is administered at least 1 hour (e.g., at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours) after administering the first dose of the pharmaceutical composition. Hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hours, 22 hours, 23 hours, 1 day, 2 days, 3 days, 4 days, 5 days, 6 days, 1 week, 2 weeks, 3 weeks, 1 month, 2 months, 3 months, 4 months, 5 months, 6 months, 7 months, 8 months, 9 months, 10 months , 11 months, 1 year, or more).
일부 실시 형태에서, 제2 용량은 약제학적 조성물의 제1 용량을 투여한지 1시간 내지 1년(예를 들어, 1시간 내지 1일, 예를 들어, 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 또는 1일, 예를 들어, 1일 내지 1주, 예를 들어, 2일, 3일, 4일, 5일, 6일, 또는 1주, 예를 들어, 1주 내지 1개월, 예를 들어, 2주, 3주, 또는 1개월, 예를 들어, 1개월 내지 1년, 예를 들어, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 또는 1년) 후에 투여된다. 일부 실시 형태에서, 제2 용량은 약제학적 조성물의 제1 용량을 투여한지 1일 내지 180일(예를 들어, 1일 내지 90일, 1일 내지 45일, 1일 내지 30일, 1일 내지 14일, 1일 내지 7일, 2일 내지 45일, 2일 내지 30일, 2일 내지 14일, 2일 내지 7일, 3일 내지 90일, 3일 내지 45일, 3일 내지 30일, 3일 내지 14일, 3일 내지 7일, 4일 내지 90일, 4일 내지 45일, 4일 내지 30일, 4일 내지 14일, 4일 내지 7일, 5일 내지 90일, 5일 내지 45일, 5일 내지 30일, 5일 내지 14일, 5일 내지 7일, 6일 내지 90일, 6일 내지 45일, 6일 내지 30일, 6일 내지 14일, 6일 내지 7일, 7일 내지 90일, 7일 내지 45일, 7일 내지 30일, 7일 내지 14일, 14일 내지 90일, 14일 내지 45일, 14일 내지 30일, 21일 내지 90일, 21일 내지 60일, 21일 내지 45일, 21일 내지 30일, 30일 내지 90일, 30일 내지 60일, 30일 내지 45일, 45일 내지 180일, 45일 내지 120일, 45일 내지 100일, 45일 내지 90일, 45일 내지 60일, 60일 내지 180일, 60일 내지 120일, 60일 내지 100일, 60일 내지 90일, 90일 내지 100일, 90일 내지 120일, 또는 90일 내지 180일) 후에 투여된다.In some embodiments, the second dose is administered 1 hour to 1 year (e.g., 1 hour to 1 day, e.g., 1 hour, 2 hours, 3 hours, 4 hours) after administering the first dose of the pharmaceutical composition. , 5 hours, 6 hours, 7 hours, 8 hours, 9 hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hour, 22 hours, 23 hours, or 1 day, such as 1 day to 1 week, such as 2 days, 3 days, 4 days, 5 days, 6 days, or 1 week, such as 1 Weeks to 1 month, such as 2 weeks, 3 weeks, or 1 month, such as 1 month to 1 year, such as 1 month, 2 months, 3 months, 4 months, 5 months, 6 months. , 7 months, 8 months, 9 months, 10 months, 11 months, or 1 year). In some embodiments, the second dose is administered 1 to 180 days (e.g., 1 to 90 days, 1 to 45 days, 1 to 30 days, 1 to 180 days) after administering the first dose of the pharmaceutical composition. 14 days, 1 to 7 days, 2 to 45 days, 2 to 30 days, 2 to 14 days, 2 to 7 days, 3 to 90 days, 3 to 45 days, 3 to 30 days , 3 to 14 days, 3 to 7 days, 4 to 90 days, 4 to 45 days, 4 to 30 days, 4 to 14 days, 4 to 7 days, 5 to 90 days, 5 45 days to 45 days, 5 to 30 days, 5 to 14 days, 5 to 7 days, 6 to 90 days, 6 to 45 days, 6 to 30 days, 6 to 14 days, 6 days to 7 days, 7 to 90 days, 7 to 45 days, 7 to 30 days, 7 to 14 days, 14 to 90 days, 14 to 45 days, 14 to 30 days, 21 to 90 days , 21 to 60 days, 21 to 45 days, 21 to 30 days, 30 to 90 days, 30 to 60 days, 30 to 45 days, 45 to 180 days, 45 to 120 days, 45 100 days to 100 days, 45 days to 90 days, 45 days to 60 days, 60 days to 180 days, 60 days to 120 days, 60 days to 100 days, 60 days to 90 days, 90 days to 100 days, 90 days to administered after 120 days, or 90 to 180 days).
일부 실시 형태에서, 제3 용량은 약제학적 조성물의 제2 용량을 투여한지 적어도 1시간(예를 들어, 적어도 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 1일, 2일, 3일, 4일, 5일, 6일, 1주, 2주, 3주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 1년, 또는 그 초과) 후에 투여된다.In some embodiments, the third dose is administered at least 1 hour (e.g., at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours) after administering the second dose of the pharmaceutical composition. Hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hours, 22 hours, 23 hours, 1 day, 2 days, 3 days, 4 days, 5 days, 6 days, 1 week, 2 weeks, 3 weeks, 1 month, 2 months, 3 months, 4 months, 5 months, 6 months, 7 months, 8 months, 9 months, 10 months , 11 months, 1 year, or more).
일부 실시 형태에서, 제3 용량은 약제학적 조성물의 제2 용량을 투여한지 1시간 내지 1년(예를 들어, 1시간 내지 1일, 예를 들어, 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 또는 1일, 예를 들어, 1일 내지 1주, 예를 들어, 2일, 3일, 4일, 5일, 6일, 또는 1주, 예를 들어, 1주 내지 1개월, 예를 들어, 2주, 3주, 또는 1개월, 예를 들어, 1개월 내지 1년, 예를 들어, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 또는 1년) 후에 투여된다. 일부 실시 형태에서, 제3 용량은 약제학적 조성물의 제2 용량을 투여한지 1일 내지 180일(예를 들어, 1일 내지 90일, 1일 내지 45일, 1일 내지 30일, 1일 내지 14일, 1일 내지 7일, 2일 내지 45일, 2일 내지 30일, 2일 내지 14일, 2일 내지 7일, 3일 내지 90일, 3일 내지 45일, 3일 내지 30일, 3일 내지 14일, 3일 내지 7일, 4일 내지 90일, 4일 내지 45일, 4일 내지 30일, 4일 내지 14일, 4일 내지 7일, 5일 내지 90일, 5일 내지 45일, 5일 내지 30일, 5일 내지 14일, 5일 내지 7일, 6일 내지 90일, 6일 내지 45일, 6일 내지 30일, 6일 내지 14일, 6일 내지 7일, 7일 내지 90일, 7일 내지 45일, 7일 내지 30일, 7일 내지 14일, 14일 내지 90일, 14일 내지 45일, 14일 내지 30일, 21일 내지 90일, 21일 내지 60일, 21일 내지 45일, 21일 내지 30일, 30일 내지 90일, 30일 내지 60일, 30일 내지 45일, 45일 내지 180일, 45일 내지 120일, 45일 내지 100일, 45일 내지 90일, 45일 내지 60일, 60일 내지 180일, 60일 내지 120일, 60일 내지 100일, 60일 내지 90일, 90일 내지 100일, 90일 내지 120일, 또는 90일 내지 180일) 후에 투여된다.In some embodiments, the third dose is administered 1 hour to 1 year (e.g., 1 hour to 1 day, e.g., 1 hour, 2 hours, 3 hours, 4 hours) after administering the second dose of the pharmaceutical composition. , 5 hours, 6 hours, 7 hours, 8 hours, 9 hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hour, 22 hours, 23 hours, or 1 day, such as 1 day to 1 week, such as 2 days, 3 days, 4 days, 5 days, 6 days, or 1 week, such as 1 Weeks to 1 month, such as 2 weeks, 3 weeks, or 1 month, such as 1 month to 1 year, such as 1 month, 2 months, 3 months, 4 months, 5 months, 6 months. , 7 months, 8 months, 9 months, 10 months, 11 months, or 1 year). In some embodiments, the third dose is administered 1 to 180 days (e.g., 1 to 90 days, 1 to 45 days, 1 to 30 days, 1 to 180 days) after administering the second dose of the pharmaceutical composition. 14 days, 1 to 7 days, 2 to 45 days, 2 to 30 days, 2 to 14 days, 2 to 7 days, 3 to 90 days, 3 to 45 days, 3 to 30 days , 3 to 14 days, 3 to 7 days, 4 to 90 days, 4 to 45 days, 4 to 30 days, 4 to 14 days, 4 to 7 days, 5 to 90 days, 5 45 days to 45 days, 5 to 30 days, 5 to 14 days, 5 to 7 days, 6 to 90 days, 6 to 45 days, 6 to 30 days, 6 to 14 days, 6 days to 7 days, 7 to 90 days, 7 to 45 days, 7 to 30 days, 7 to 14 days, 14 to 90 days, 14 to 45 days, 14 to 30 days, 21 to 90 days , 21 to 60 days, 21 to 45 days, 21 to 30 days, 30 to 90 days, 30 to 60 days, 30 to 45 days, 45 to 180 days, 45 to 120 days, 45 100 days to 100 days, 45 days to 90 days, 45 days to 60 days, 60 days to 180 days, 60 days to 120 days, 60 days to 100 days, 60 days to 90 days, 90 days to 100 days, 90 days to administered after 120 days, or 90 to 180 days).
일부 실시 형태에서, 제2 용량은 항푸소제닉 폴리펩티드의 혈청 농도가 대상체의 혈청 중 약 500 ng/mL 미만이 되기 전에 투여된다.In some embodiments, the second dose is administered before the serum concentration of the antifusogenic polypeptide is less than about 500 ng/mL in the subject's serum.
일부 실시 형태에서, 방법은 대상체에서 적어도 500 ng/mL(예를 들어, 적어도 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, 또는 그 초과)의 항푸소제닉 폴리펩티드의 혈청 농도를, 예를 들어, 적어도 1시간(예를 들어, 적어도 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 1일, 2일, 3일, 4일, 5일, 6일, 1주, 2주, 3주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 1년, 또는 그 초과)동안 유지한다.In some embodiments, the method comprises administering to the subject at least 500 ng/mL (e.g., at least 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, or more) Serum concentrations of the antifusogenic polypeptide can be measured, for example, over a period of at least 1 hour (e.g., at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours, 10 hours, 11 hours). Hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hours, 22 hours, 23 hours, 1 day, 2 days, 3 days, 4 days, 5 days, 6 days, 1 week, 2 weeks, 3 weeks, 1 month, 2 months, 3 months, 4 months, 5 months, 6 months, 7 months, 8 months, 9 months, 10 months, 11 months, 1 year , or longer).
일부 실시 형태에서, 방법은 대상체에서 바이러스 감염을 치료하거나 예방한다. 예를 들어, 약제학적 조성물은 바이러스 감염을 치료하거나 예방하는 데 충분한 양으로 및 충분한 기간 동안 대상체에게 투여될 수 있다. 약제학적 조성물은 바이러스 감염의 위험을 감소시키기 위해 대상체에게 투여될 수 있다.In some embodiments, the method treats or prevents a viral infection in a subject. For example, the pharmaceutical composition can be administered to a subject in an amount sufficient and for a sufficient period of time to treat or prevent a viral infection. Pharmaceutical compositions can be administered to a subject to reduce the risk of viral infection.
일부 실시 형태에서, 방법은 인간 면역결핍 바이러스(HIV) 감염을 치료하거나 예방한다.In some embodiments, the method treats or prevents human immunodeficiency virus (HIV) infection.
일부 실시 형태에서, 방법은 코로나바이러스 감염(예를 들어, 베타코로나바이러스 감염, 예를 들어, SARS-CoV-2 감염, 예컨대 COVID-19의 증상을 유발하는 SARS-CoV-2 감염)을 치료하거나 예방한다.In some embodiments, the method treats a coronavirus infection (e.g., a betacoronavirus infection, e.g., a SARS-CoV-2 infection, e.g., a SARS-CoV-2 infection that causes symptoms of COVID-19) or prevent it
일부 실시 형태에서, 방법은 C형 간염 바이러스(HCV) 감염을 치료하거나 예방한다.In some embodiments, the method treats or prevents hepatitis C virus (HCV) infection.
일부 실시 형태에서, 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리뉴클레오티드는 바이러스 진입을 감소시키기 위해 사용된다.In some embodiments, circular polynucleotides encoding antifusogenic polypeptides (e.g., polypeptides in Table 1) are used to reduce viral entry.
또 다른 양태에서, 다중 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 카고를 포함하는 원형 폴리리보뉴클레오티드를 특징으로 한다. 폴리리보뉴클레오티드 카고는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함할 수 있다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 동일한 바이러스에 관한 것이다. 대안적으로, 항푸소제닉 폴리펩티드는 하나 초과의 바이러스에 관한 것일 수 있다.In another aspect, a circular polyribonucleotide is featured that contains a polyribonucleotide cargo encoding multiple antifusogenic polypeptides. The polyribonucleotide cargo may include an expression sequence encoding an antifusogenic polypeptide. In some embodiments, the antifusogenic polypeptides are directed to the same virus. Alternatively, the antifusogenic polypeptide may be directed to more than one virus.
정의Justice
본 개시내용의 이해를 용이하게 하기 위해, 다수의 용어가 하기에 정의된다. 본원에 정의된 용어는 본 개시내용과 관련된 분야의 당업자에 의해 통상적으로 이해되는 바와 같은 의미를 갖는다. 단수 형태 용어는 단수 실체를 지칭하는 것으로 의도될 뿐만 아니라 그의 구체적인 예가 예시를 위해 사용될 수 있는 일반적 부류를 포함한다. "또는"이라는 용어는 단지 대안을 지칭하는 것으로 명백하게 표시되거나 대안이 상호 배타적이지 않는 한, "및/또는"을 의미하기 위해 사용되지만, 본 개시내용은 단지 대안 및 "및/또는"을 지칭하는 정의를 지지한다. 본원에서의 용어는 구체적인 실시 형태를 기재하기 위해 사용되지만, 그들의 용법은 청구범위에 개요된 것을 제외하고는, 제한적인 것으로 취해지지 않아야 한다.To facilitate understanding of the present disclosure, a number of terms are defined below. Terms defined herein have the same meaning as commonly understood by a person skilled in the art to which this disclosure pertains. Singular terms are intended to refer to a singular entity as well as a general class, specific examples of which may be used for illustration. The term "or" is used to mean "and/or" unless explicitly indicated to refer to only an alternative or the alternatives are mutually exclusive; however, this disclosure only refers to an alternative and "and/or". Support justice. Although terms herein are used to describe specific embodiments, their usage should not be taken as limiting, except as outlined in the claims.
본원에 사용된 바와 같이, 값의 범위로 제공된 임의의 값은 상계 및 하계 둘 모두, 및 상계 및 하계 내에 함유된 임의의 값을 포함한다.As used herein, any value given as a range of values includes both upper and lower bounds, and any values contained within the upper and lower bounds.
본원에 사용된 바와 같이, "약"이라는 용어는 나열된 값의 ± 10% 이내인 값을 지칭한다.As used herein, the term “about” refers to a value within ±10% of the listed value.
본원에 사용된 바와 같이, "담체"라는 용어는 부분적으로 또는 완전히 캡슐화제를 통해, 원형 폴리리보뉴클레오티드의 공유 변형에 의해 세포 내로의 조성물(예를 들어, 원형 폴리리보뉴클레오티드)의 수송 또는 전달을 용이하게 하는 화합물, 조성물, 시약, 또는 분자, 또는 이들의 조합이다. 담체의 비제한적인 예는 탄수화물 담체(예를 들어, 무수물-변형된 피토글리코겐 또는 글리코겐-유형 물질), 나노입자(예를 들어, 캡슐화하거나 공유적으로 연결된 나노입자는 원형 폴리리보뉴클레오티드에 결합함), 리포좀, 푸소좀, 생체외 분화된 망상적혈구, 엑소좀, 단백질 담체(예를 들어, 원형 폴리리보뉴클레오티드에 공유적으로 연결된 단백질), 또는 양이온성 담체(예를 들어, 양이온성 지질중합체 또는 형질감염 시약)를 포함한다.As used herein, the term “carrier” refers to the transport or delivery of a composition (e.g., a circular polyribonucleotide) into a cell by covalent modification of the circular polyribonucleotide, partially or completely through an encapsulating agent. It is a compound, composition, reagent, or molecule that facilitates, or a combination thereof. Non-limiting examples of carriers include carbohydrate carriers (e.g., anhydride-modified phytoglycogen or glycogen-type materials), nanoparticles (e.g., encapsulating or covalently linked nanoparticles bound to circular polyribonucleotides). ), liposomes, fusosomes, in vitro differentiated reticulocytes, exosomes, protein carriers (e.g., proteins covalently linked to circular polyribonucleotides), or cationic carriers (e.g., cationic lipopolymers or transfection reagent).
본원에 사용된 바와 같이, "원형 폴리리보뉴클레오티드", "원형 RNA", 및 "circRNA"라는 용어는 상호교환 가능하게 사용되며, 유리 단부를 갖지 않는(즉, 유리 3' 또는 5' 단부를 갖지 않는) 구조를 갖는 폴리리보뉴클레오티드 분자, 예를 들어, 공유 또는 비-공유 결합을 통해 원형 또는 단부 없는 구조를 형성하는 폴리리보뉴클레오티드 분자를 의미한다. 원형 폴리리보뉴클레오티드는 예를 들어, 공유적으로 폐쇄된 폴리리보뉴클레오티드일 수 있다.As used herein, the terms “circular polyribonucleotide”, “circular RNA”, and “circRNA” are used interchangeably and do not have free ends (i.e., do not have free 3′ or 5′ ends). refers to a polyribonucleotide molecule having a structure (e.g., a polyribonucleotide molecule that forms a circular or endless structure through covalent or non-covalent bonds). Circular polyribonucleotides may be, for example, covalently closed polyribonucleotides.
본원에 사용된 바와 같이, "원형화 효율"이라는 용어는 그의 비-원형 출발 물질 대비 생성된 원형 폴리리보뉴클레오티드의 측정이다.As used herein, the term “circularization efficiency” is a measure of the resulting circular polyribonucleotide relative to its non-circular starting material.
용어 "희석제"는 본원에 기재된 조성물(예를 들어, 원형 폴리리보뉴클레오티드를 포함하는 조성물)이 희석되거나 용해될 수 있는 불활성 용매를 포함하는 비히클을 의미한다. 희석제는 RNA 가용화제, 완충제, 등장성제, 또는 이들의 혼합물일 수 있다. 희석제는 액체 희석제 또는 고체 희석제일 수 있다. 액체 희석제의 비제한적인 예는 물 또는 다른 용매, 가용화제 및 유화제, 예컨대 에틸 알코올, 이소프로필 알코올, 에틸 카보네이트, 에틸 아세테이트, 벤질 알코올, 벤질 벤조에이트, 프로필렌 글리콜, 1,3-부틸렌 글리콜, 디메틸포름아미드, 오일(특히, 면실, 땅콩, 옥수수, 배아, 올리브, 피마자, 및 참깨 오일), 글리세롤, 테트라히드로푸르푸릴 알코올, 폴리에틸렌 글리콜 및 소르비탄의 지방산 에스테르, 및 1,3-부탄디올을 포함한다. 고체 희석제의 비제한적인 예는 탄산칼슘, 탄산나트륨, 인산칼슘, 인산이칼슘, 황산칼슘, 인산수소칼슘, 인산나트륨 락토스, 수크로스, 셀룰로스, 미결정 셀룰로스, 카올린, 만니톨, 소르비톨, 이노시톨, 염화나트륨, 건조 전분, 옥수수 전분, 또는 분말 당을 포함한다.The term “diluent” refers to a vehicle comprising an inert solvent in which a composition described herein (e.g., a composition comprising a circular polyribonucleotide) may be diluted or dissolved. The diluent may be an RNA solubilizer, a buffer, an isotonic agent, or a mixture thereof. The diluent may be a liquid diluent or a solid diluent. Non-limiting examples of liquid diluents include water or other solvents, solubilizers and emulsifiers such as ethyl alcohol, isopropyl alcohol, ethyl carbonate, ethyl acetate, benzyl alcohol, benzyl benzoate, propylene glycol, 1,3-butylene glycol, Contains dimethylformamide, oils (especially cottonseed, peanut, corn, germ, olive, castor, and sesame oils), glycerol, tetrahydrofurfuryl alcohol, fatty acid esters of polyethylene glycol and sorbitan, and 1,3-butanediol. do. Non-limiting examples of solid diluents include calcium carbonate, sodium carbonate, calcium phosphate, dicalcium phosphate, calcium sulfate, calcium biphosphate, sodium lactose, sucrose, cellulose, microcrystalline cellulose, kaolin, mannitol, sorbitol, inositol, sodium chloride, dry Contains starch, cornstarch, or powdered sugar.
본원에 사용된 바와 같이, "질병", "장애", 및 "질환"이라는 용어는 각각 준최적 건강의 상태, 예를 들어, 전형적으로 의학 전문가에 의해 진단되거나 치료되는 또는 진단되거나 치료될 상태를 지칭한다.As used herein, the terms “disease,” “disorder,” and “condition” each refer to a state of suboptimal health, e.g., a condition that is or will be diagnosed or treated typically by a medical professional. refers to
본원에 사용된 바와 같이, "발현 서열"이라는 용어는 생성물, 예를 들어, 펩티드 또는 폴리펩티드(예를 들어, 항푸소제닉 폴리펩티드)를 인코딩하는 핵산 서열이다. 펩티드 또는 폴리펩티드에 대해 코딩하는 예시적인 발현 서열은 복수의 뉴클레오티드 삼중체를 포함할 수 있으며, 이들 각각은 아미노산을 코딩할 수 있고 "코돈"으로 지칭된다.As used herein, the term “expression sequence” is a nucleic acid sequence that encodes a product, e.g., a peptide or polypeptide (e.g., an antifusogenic polypeptide). Exemplary expression sequences encoding for peptides or polypeptides may include multiple nucleotide triplets, each of which may encode an amino acid and are referred to as “codons.”
본원에 사용된 바와 같이, 폴리펩티드 또는 핵산 서열, 예를 들어, 항푸소제닉 폴리펩티드 또는 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열에 대한 "단편"이라는 용어는 폴리펩티드 또는 핵산의 서열의 전체 부분 미만의 연속적인 것을 지칭한다. 폴리펩티드 또는 폴리펩티드를 인코딩하는 핵산 서열의 단편은, 예를 들어, 본원에 개시된 서열과 같은 서열의 전체 분획 미만(예를 들어, 전체 길이의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 또는 99%)의 연속적인 것을 지칭한다. 본 개시내용은 모두 본원에 개시된 임의의 항푸소제닉 폴리펩티드의 단편을 고려하는 것으로 이해된다.As used herein, the term "fragment" for a polypeptide or nucleic acid sequence, e.g., an antifusogenic polypeptide or a nucleic acid sequence encoding an antifusogenic polypeptide, means a continuous portion of less than the entire portion of the sequence of the polypeptide or nucleic acid. refers to something A polypeptide or a fragment of a nucleic acid sequence encoding a polypeptide may be, for example, a sequence disclosed herein, less than a total fraction of the sequence (e.g., at least 20%, 30%, 40%, 50%, 60% of the total length). , 70%, 80%, 90%, 95%, or 99%). It is understood that the present disclosure contemplates fragments of any of the antifusogenic polypeptides disclosed herein.
본원에 사용된 바와 같이, "Fc 도메인"이라는 용어는 적어도 힌지 도메인 및 제2 및 제3 항체 불변 도메인(CH2 및 CH3) 또는 이의 기능적 단편(예를 들어, Fc 수용체에 이량체화 및 결합할 수 있는 단편)을 포함하는 폴리펩티드 사슬을 지칭한다. Fc 도메인은 IgG, IgE, IgM, IgA, 또는 IgD(예를 들어, IgG)를 포함하는 임의의 면역글로불린 항체 이소타입일 수 있다. 또한, Fc 도메인은 IgG 서브타입(예를 들어, IgG1, IgG2a, IgG2b, IgG3, 또는 IgG4)(예를 들어, IgG1)일 수 있다. Fc 도메인은 항원-인식 영역으로서 작용할 수 있는 면역글로불린의 임의의 부분, 예를 들어, 가변 도메인 또는 상보성 결정 영역(CDR)을 포함하지 않는다. 본원에 기재된 바와 같은 컨쥬게이트 내의 Fc 도메인은 Fc 도메인과 Fc 수용체 사이의 상호작용을 변경하는 야생형 Fc 도메인 서열(예를 들어, 1 내지 10, 1 내지 8, 1 내지 6, 1 내지 4 아미노산 치환, 부가, 또는 결실)로부터의 하나 이상의 변화를 함유할 수 있다. 적합한 변화의 예는 당업계에 알려져 있다. 본원에 달리 명시되지 않는 한, IgG 또는 Fc 도메인 내의 아미노산 잔기의 넘버링은, 예를 들어, 문헌[Kabat et al.,Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991]에 기재된 바와 같이, Kabat EU 인덱스라고도 불리는 항체에 대한 EU 넘버링 시스템에 따른다.As used herein, the term “Fc domain” refers to at least a hinge domain and second and third antibody constant domains (
본원에서 사용되는 용어 "GC 함량"은 핵산 서열에서 구아닌(G) 및 시토신(C)의 백분율을 지칭한다. GC 함량의 계산식은 (G+C)/(A+G+C+U) x 100% (RNA의 경우) 또는 (G+C)/(A+G+C+T) x 100% (DNA의 경우)이다. 마찬가지로, 용어 "우리딘 함량"은 핵산 서열 내의 우리딘(U)의 백분율을 지칭한다. 우리딘 함량의 계산식은 U/(A+G+C+U) x 100%이다. 마찬가지로, 용어 "티미딘 함량"은 핵산 서열 내의 티미딘(T)의 백분율을 지칭한다. 티미딘 함량의 계산식은 T/(A+G+C+T) x 100%이다.As used herein, the term “GC content” refers to the percentage of guanine (G) and cytosine (C) in a nucleic acid sequence. The formula for calculating GC content is (G+C)/(A+G+C+U) x 100% (for RNA) or (G+C)/(A+G+C+T) x 100% (for DNA). case). Likewise, the term “uridine content” refers to the percentage of uridine (U) in a nucleic acid sequence. The formula for calculating uridine content is U/(A+G+C+U) x 100%. Likewise, the term “thymidine content” refers to the percentage of thymidine (T) in a nucleic acid sequence. The formula for calculating thymidine content is T/(A+G+C+T) x 100%.
"이종"은 천연 발생(천연) 맥락 이외의 맥락에서 발생하는 것을 의미한다. "이종" 폴리뉴클레오티드 서열은 폴리뉴클레오티드 서열이 그 서열의 천연 게놈에서 발견되는 것 이외의 방식으로 사용되고 있음을 나타낸다. 예를 들어, "이종 프로모터"는 그 프로모터에 의해 천연적으로 전사되는 것이 아닌 서열의 전사를 유도하는 데 사용되며; 따라서, "이종 프로모터" 서열은 종종 재조합 핵산 기법에 의해 발현 작제물에 포함된다. "이종"이라는 용어는 또한 주어진 서열이 또 다른 서열에 대해 비-천연 발생 관계에 놓인 것을 지칭하기 위해 사용되며; 예를 들어, 이종 코딩 또는 비-코딩 뉴클레오티드 서열은 통상적으로 게놈 형질전환 기법에 의해 게놈 내로 삽입되어 유전적으로 변형된 또는 재조합 게놈을 발생시킨다.“Xenogeneic” means occurring in a context other than the naturally occurring (natural) context. A “heterologous” polynucleotide sequence indicates that the polynucleotide sequence is being used in a manner other than that found in the native genome of that sequence. For example, a “heterologous promoter” is used to drive transcription of a sequence that is not naturally transcribed by that promoter; Accordingly, “heterologous promoter” sequences are often incorporated into expression constructs by recombinant nucleic acid techniques. The term “heterologous” is also used to refer to a given sequence being in a non-naturally occurring relationship to another sequence; For example, heterologous coding or non-coding nucleotide sequences are typically inserted into a genome by genomic transformation techniques to generate a genetically modified or recombinant genome.
본원에 사용된 바와 같이, "인트론 단편"이라는 용어는 인트론의 일부를 지칭하며, 여기서 제1 인트론 단편 및 제2 인트론 단편은 함께 촉매 인트론과 같은 인트론을 형성한다. 인트론 단편은 인트론의 5' 부분(예를 들어, 촉매 인트론의 5' 부분) 또는 인트론의 3' 부분(예를 들어, 촉매 인트론의 3' 부분)일 수 있고, 그에 따라 5' 인트론 단편 및 3' 인트론 단편은 함께 촉매 자기-스플라이싱이 가능한 기능성 인트론과 같은 기능성 인트론을 형성한다. 인트론 단편이라는 용어는 두 부분으로 분할된 인트론을 지칭하는 것을 의미한다. 인트론 단편이라는 용어는 두 부분 또는 절반의 길이가 동일함을 나타내거나 암시하거나 제안하는 것을 의미하지 않는다. 인트론 단편이라는 용어는 분할-인트론이라는 용어와 동의어로 사용되며 "절반-인트론"이라는 용어 대신 사용될 수 있다.As used herein, the term “intron fragment” refers to a portion of an intron, where a first intron fragment and a second intron fragment together form an intron, such as a catalytic intron. The intron fragment may be the 5' portion of an intron (e.g., the 5' portion of a catalytic intron) or the 3' portion of an intron (e.g., the 3' portion of a catalytic intron), and thus the 5' intron fragment and 3' 'The intron fragments together form a functional intron, such as a functional intron capable of catalytic self-splicing. The term intron fragment is meant to refer to an intron that is split into two parts. The term intron fragment is not meant to indicate, imply or suggest that the two parts or halves are of equal length. The term intron fragment is used synonymously with the term split-intron and may be used instead of the term "half-intron".
본원에서 사용되는 바와 같이, 용어 "선형 대응물"은 원형 폴리리보뉴클레오티드와 동일하거나 유사한 뉴클레오티드 서열(예를 들어, 100%, 95%, 90%, 85%, 80%, 75%, 또는 이들 사이의 임의의 백분율 서열 동일성)을 갖고 2개의 유리 단부(즉, 원형화된 폴리리보뉴클레오티드의 비원형화된 버전(및 그의 단편))를 갖는 폴리리보뉴클레오티드 분자(및 그의 단편)이다. 일부 실시 형태에서, 선형 대응물(예를 들어, 원형화되기 전의 버전)은 원형 폴리리보뉴클레오티드와 동일하거나 유사한 뉴클레오티드 서열(예를 들어, 100%, 95%, 90%, 85%, 80%, 75%, 또는 이들 사이의 임의의 백분율 서열 동일성) 및 동일하거나 유사한 핵산 변형을 갖고 2개의 유리 단부(즉, 원형화된 폴리리보뉴클레오티드의 비원형화된 버전(및 그의 단편))를 갖는 폴리리보뉴클레오티드 분자(및 그의 단편)이다. 일부 실시 형태에서, 선형 대응물은 동일하거나 유사한 뉴클레오티드 서열(예를 들어, 100%, 95%, 90%, 85%, 80%, 75%, 또는 이들 사이의 임의의 백분율 서열 동일성)을 갖고, 원형 폴리리보뉴클레오티드와 상이하거나 핵산 변형이 없으며, 2개의 유리 단부(즉, 원형화된 폴리리보뉴클레오티드의 비원형화된 버전(및 그의 단편))를 갖는 폴리리보뉴클레오티드 분자(및 그의 단편)이다. 일부 실시 형태에서, 선형 대응물인 폴리리보뉴클레오티드 분자의 단편은 선형 대응물인 폴리리보뉴클레오티드 분자보다 짧은 선형 대응물인 폴리리보뉴클레오티드 분자의 임의의 부분이다. 일부 실시 형태에서, 선형 대응물은 5' 캡을 추가로 포함한다. 일부 실시 형태에서, 선형 대응물은 폴리 아데노신 테일을 추가로 포함한다. 일부 실시 형태에서, 선형 대응물은 3' UTR을 추가로 포함한다. 일부 실시에서, 선형 대응물은 5' UTR을 추가로 포함한다.As used herein, the term “linear counterpart” refers to a nucleotide sequence that is identical or similar to a circular polyribonucleotide (e.g., 100%, 95%, 90%, 85%, 80%, 75%, or between these). is a polyribonucleotide molecule (and fragments thereof) that has any percentage sequence identity of . In some embodiments, the linear counterpart (e.g., a non-circularized version) has a nucleotide sequence identical or similar to the circular polyribonucleotide (e.g., 100%, 95%, 90%, 85%, 80%, 75% sequence identity, or any percentage sequence identity therebetween) and identical or similar nucleic acid modifications and having two free ends (i.e., non-circularized versions of circularized polyribonucleotides (and fragments thereof)) A nucleotide molecule (and fragments thereof). In some embodiments, the linear counterparts have identical or similar nucleotide sequences (e.g., 100%, 95%, 90%, 85%, 80%, 75%, or any percentage sequence identity therebetween); A polyribonucleotide molecule (and fragments thereof) that is different from a circular polyribonucleotide or has no nucleic acid modifications and has two free ends (i.e., a non-circularized version (and fragments thereof) of a circularized polyribonucleotide). In some embodiments, a fragment of a linear counterpart polyribonucleotide molecule is any portion of a linear counterpart polyribonucleotide molecule that is shorter than the linear counterpart polyribonucleotide molecule. In some embodiments, the linear counterpart further comprises a 5' cap. In some embodiments, the linear counterpart further comprises a polyadenosine tail. In some embodiments, the linear counterpart further includes a 3' UTR. In some implementations, the linear counterpart additionally includes a 5' UTR.
본원에 사용된 바와 같이, "선형 RNA", "선형 폴리리보뉴클레오티드" 및 "선형 폴리리보뉴클레오티드 분자"라는 용어는 상호교환적으로 사용되며, 5' 및 3' 단부를 갖는 폴리리보뉴클레오티드 분자를 의미한다. 5' 및 3' 단부 중 하나 또는 둘 모두는 유리 단부이거나 또 다른 모이어티에 연결될 수 있다. 선형 RNA는 원형화를 겪지 않은(예를 들어, 원형화되기 전인) RNA를 포함하고, 예를 들어, 스플린트 결찰 또는 화학적, 효소적, 리보자임 또는 스플라이싱 촉매화된 원형화 방법을 통해 원형화를 위한 출발 물질로서 사용될 수 있다.As used herein, the terms "linear RNA", "linear polyribonucleotide" and "linear polyribonucleotide molecule" are used interchangeably and refer to polyribonucleotide molecules having 5' and 3' ends. do. One or both of the 5' and 3' ends may be free ends or connected to another moiety. Linear RNA includes RNA that has not undergone circularization (e.g., before circularization) and has been circularized, for example, by splint ligation or a chemical, enzymatic, ribozyme, or splicing catalyzed circularization method. It can be used as a starting material for chemical conversion.
본원에 사용된 바와 같이, "변형된 리보뉴클레오티드"라는 용어는 당, 핵염기, 또는 뉴클레오시드간 연결에 대한 적어도 하나의 변형을 갖는 뉴클레오티드를 의미한다.As used herein, the term “modified ribonucleotide” refers to a nucleotide that has at least one modification to the sugar, nucleobase, or internucleoside linkage.
본원에 사용된 바와 같이, "네이키드 전달"이라는 용어는 담체의 보조 없이 및 세포로의 전달을 보조하는 모이어티에 대한 공유 변형 없이 세포에 전달하기 위한 제형이다. 네이키드 전달 제형은 임의의 형질감염 시약, 양이온성 담체, 탄수화물 담체, 나노입자 담체, 또는 단백질 담체가 없다. 예를 들어, 원형 폴리리보뉴클레오티드의 네이키드 전달 제형은 공유 변형이 없고 담체가 없는 원형 폴리리보뉴클레오티드를 포함하는 제형이다.As used herein, the term “naked delivery” is a formulation for delivery to cells without the assistance of a carrier and without covalent modifications to moieties that assist delivery to the cells. Naked delivery formulations are free of any transfection reagents, cationic carriers, carbohydrate carriers, nanoparticle carriers, or protein carriers. For example, a naked delivery formulation of a circular polyribonucleotide is a formulation comprising the circular polyribonucleotide without covalent modifications and without a carrier.
본원에 사용된 바와 같이, "닉킹된(nicked) RNA", "닉킹된 선형 폴리리보뉴클레오티드" 및 "닉킹된 선형 폴리리보뉴클레오티드 분자"라는 용어는 상호교환적으로 사용되며, 원형 RNA의 닉킹 또는 분해로부터 생성되는 5' 및 3' 단부를 갖는 폴리리보뉴클레오티드 분자를 의미한다.As used herein, the terms “nicked RNA,” “nicked linear polyribonucleotide,” and “nicked linear polyribonucleotide molecule” are used interchangeably and refer to the nicking or degradation of circular RNA. refers to a polyribonucleotide molecule having 5' and 3' ends produced from.
용어 "약제학적 조성물"은 또한 약제학적 조성물 내에 포함된 원형 또는 선형 폴리리보뉴클레오티드가 요법에 의한 인간 또는 동물의 신체의 치료에 사용될 수 있음을 개시하고자 의도된다. 따라서 이는 "요법에 사용하기 위한 폴리리보뉴클레오티드"와 동등한 것으로 여겨진다.The term “pharmaceutical composition” is also intended to disclose that the circular or linear polyribonucleotide contained in the pharmaceutical composition can be used for the treatment of the human or animal body by therapy. It is therefore considered equivalent to “polyribonucleotide for use in therapy”.
본원에 사용된 바와 같이, "폴리뉴클레오티드"라는 용어는 하나 이상의 핵산 서브유닛, 또는 뉴클레오티드를 포함하는 분자를 의미하며, "핵산" 또는 "올리고뉴클레오티드"와 상호교환 가능하게 사용될 수 있다. 폴리뉴클레오티드는 아데노신(A), 시토신(C), 구아닌(G), 티민(T) 및 우라실(U), 또는 그의 변이체로부터 선택되는 하나 이상의 뉴클레오티드를 포함할 수 있다. 뉴클레오티드는 뉴클레오시드 및 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10개, 또는 그 초과의 포스페이트(PO3) 기를 포함할 수 있다. 뉴클레오티드는 핵염기, 5탄당(리보스 또는 데옥시리보스 중 어느 하나), 및 하나 이상의 포스페이트 기를 포함할 수 있다. 리보뉴클레오티드는 당이 리보스인 뉴클레오티드이다. 폴리리보뉴클레오티드 또는 리보핵산, 또는 RNA는 포스포디에스테르 결합을 통해 중합된 다수의 리보뉴클레오티드를 포함하는 거대 분자를 지칭할 수 있다. 데옥시리보뉴클레오티드는 당이 데옥시리보스인 뉴클레오티드이다. 본원에 사용된 바와 같이, 티민(T)을 나열하는 폴리리보뉴클레오티드 서열은 우라실(U)을 나타내는 것으로 이해된다.As used herein, the term “polynucleotide” refers to a molecule comprising one or more nucleic acid subunits, or nucleotides, and can be used interchangeably with “nucleic acid” or “oligonucleotide.” The polynucleotide may include one or more nucleotides selected from adenosine (A), cytosine (C), guanine (G), thymine (T), and uracil (U), or variants thereof. A nucleotide may comprise a nucleoside and at least 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, or more phosphate (PO3 ) groups. A nucleotide may include a nucleobase, a 5-carbon sugar (either ribose or deoxyribose), and one or more phosphate groups. Ribonucleotides are nucleotides whose sugar is ribose. Polyribonucleotide or ribonucleic acid, or RNA, can refer to a macromolecule containing multiple ribonucleotides polymerized through phosphodiester bonds. Deoxyribonucleotides are nucleotides whose sugar is deoxyribose. As used herein, a polyribonucleotide sequence listing thymine (T) is understood to represent uracil (U).
본원에 사용된 바와 같이, 본원에서 "폴리리보뉴클레오티드 카고"라는 용어는 적어도 하나의 폴리리보뉴클레오티드를 포함하는 임의의 서열을 포함한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 하나 또는 다수의 발현 서열을 포함하고, 여기서 각각의 발현 서열은 폴리펩티드를 인코딩한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 하나 또는 다수의 비코딩 서열, 예컨대 조절 또는 촉매 기능을 갖는 폴리리보뉴클레오티드를 포함한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 발현 및 비코딩 서열의 조합을 포함한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 본원에 기재된 하나 이상의 폴리리보뉴클레오티드 서열, 예컨대 하나 또는 다수의 조절 요소, 내부 리보솜 진입 부위(IRES) 요소, 또는 스페이서 서열을 포함한다.As used herein, the term “polyribonucleotide cargo” includes any sequence comprising at least one polyribonucleotide. In an embodiment, the polyribonucleotide cargo comprises one or multiple expression sequences, where each expression sequence encodes a polypeptide. In an embodiment, the polyribonucleotide cargo comprises one or multiple non-coding sequences, such as polyribonucleotides with regulatory or catalytic functions. In an embodiment, the polyribonucleotide cargo comprises a combination of expression and non-coding sequences. In an embodiment, the polyribonucleotide cargo comprises one or more polyribonucleotide sequences described herein, such as one or multiple regulatory elements, internal ribosome entry site (IRES) elements, or spacer sequences.
본원에서 상호교환 가능하게 사용된 바와 같이, "폴리A" 및 "폴리A 서열"이라는 용어는 적어도 5개의 뉴클레오티드의 길이를 갖고 아데노신 잔기로 이루어진 핵산 분자의 비번역된 인접한 영역을 지칭한다. 일부 실시 형태에서, 폴리A 서열은 적어도 10개, 적어도 15개, 적어도 20개, 적어도 30개, 적어도 40개, 또는 적어도 50개의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 폴리A 서열은 오픈 리딩 프레임(예를 들어, 폴리펩티드를 인코딩하는 오픈 리딩 프레임)에 대해 3'에(예를 들어, 그의 하류에) 위치하고, 폴리A 서열은 폴리A가 번역되지 않도록 종결 요소(예를 들어, 정지 코돈)에 대해 3'이다. 일부 실시 형태에서, 폴리A 서열은 종결 요소 및 3' 비번역된 영역에 대해 3'에 위치한다.As used interchangeably herein, the terms “polyA” and “polyA sequence” refer to a contiguous untranslated region of a nucleic acid molecule that is at least 5 nucleotides in length and consists of adenosine residues. In some embodiments, the polyA sequence is at least 10, at least 15, at least 20, at least 30, at least 40, or at least 50 nucleotides in length. In some embodiments, the polyA sequence is located 3' to (e.g., downstream of) an open reading frame (e.g., an open reading frame encoding a polypeptide), and the polyA sequence is such that the polyA is not translated. 3' to a termination element (e.g., a stop codon). In some embodiments, the polyA sequence is located 3' to the terminator element and the 3' untranslated region.
본원에 사용된 바와 같이, 핵산의 요소는, 이들이 전사되어 선형 RNA를 형성할 수 있고, 이는 이어서 본원에서 제공된 방법을 사용하여 원형 RNA로 원형화될 수 있도록 벡터 상에 위치되는 경우, "작동가능하게 연결(operably connected)"되거나 "작동가능하게 연결(operably linked)"된다.As used herein, elements of a nucleic acid are "operable" when placed on a vector such that they can be transcribed to form linear RNA, which can then be circularized into circular RNA using the methods provided herein. “Operably connected” or “operably linked.”
"폴리데옥시리보뉴클레오티드", "데옥시리보핵산", 및 "DNA"는 포스포디에스테르 결합을 통해 중합된 다수의 데옥시리보뉴클레오티드를 포함하는 거대분자를 의미한다. 뉴클레오티드는 뉴클레오시드 모노포스페이트 또는 뉴클레오시드 폴리포스페이트일 수 있다. 뉴클레오티드는 검출가능한 태그, 예컨대 발광 태그 또는 마커(예를 들어, 형광단)를 포함하는, 데옥시아데노신 트리포스페이트(dATP), 데옥시시티딘 트리포스페이트(dCTP), 데옥시구아노신 트리포스페이트(dGTP), 우리딘 트리포스페이트(dUTP) 및 데옥시티미딘 트리포스페이트(dTTP) dNTP로부터 선택될 수 있는 데옥시리보뉴클레오시드 폴리포스페이트, 예컨대, 예를 들어, 데옥시리보뉴클레오시드 트리포스페이트(dNTP)를 의미한다. 뉴클레오티드는 성장하는 핵산 가닥 내로 혼입될 수 있는 임의의 서브유닛을 포함할 수 있다. 이러한 서브유닛은 A, C, G, T, 또는 U, 또는 하나 이상의 상보적 A, C, G, T 또는 U에 대해 특이적이거나, 퓨린(즉, A 또는 G, 또는 그의 변이체) 또는 피리미딘(즉, C, T 또는 U, 또는 그의 변이체)에 대해 상보적인 임의의 다른 서브유닛일 수 있다. 일부 예에서, 폴리뉴클레오티드는 데옥시리보핵산(DNA), 리보핵산(RNA), 또는 그의 유도체 또는 변이체이다. 일부 경우에, 폴리뉴클레오티드는 약간의 예를 들자면, 짧은 간섭 RNA(siRNA), 마이크로RNA(miRNA), 플라스미드 DNA(pDNA), 짧은 헤어핀 RNA(shRNA), 소핵 RNA(snRNA), 메신저 RNA(mRNA), 전구체 mRNA(프리-mRNA), 안티센스 RNA(asRNA)이고, 뉴클레오티드 서열 및 그의 임의의 구조적 실시 형태 둘 모두, 예컨대 단일-가닥, 이중-가닥, 삼중-가닥, 나선, 헤어핀 등을 포괄한다. 일부 경우에, 폴리뉴클레오티드 분자는 원형이다. 폴리뉴클레오티드는 다양한 길이를 가질 수 있다. 핵산 분자는 적어도 약 10개의 염기, 20개의 염기, 30개의 염기, 40개의 염기, 50개의 염기, 100개의 염기, 200개의 염기, 300개의 염기, 400개의 염기, 500개의 염기, 1 킬로베이스(kb), 2 kb, 3, kb, 4 kb, 5 kb, 10 kb, 50 kb, 또는 그 초과의 길이를 가질 수 있다. 폴리뉴클레오티드는 세포 또는 조직으로부터 단리될 수 있다. 폴리뉴클레오티드의 실시 형태는 단리된 및 정제된 DNA/RNA 분자, 합성 DNA/RNA 분자, 및 합성 DNA/RNA 유사체를 포함한다.“Polydeoxyribonucleotide,” “deoxyribonucleic acid,” and “DNA” refer to a macromolecule comprising multiple deoxyribonucleotides polymerized through phosphodiester bonds. Nucleotides may be nucleoside monophosphates or nucleoside polyphosphates. Nucleotides may contain detectable tags, such as luminescent tags or markers (e.g., fluorophores), such as deoxyadenosine triphosphate (dATP), deoxycytidine triphosphate (dCTP), deoxyguanosine triphosphate (dGTP), ), deoxyribonucleoside polyphosphates, which may be selected from uridine triphosphate (dUTP) and deoxythymidine triphosphate (dTTP) dNTPs, such as, for example, deoxyribonucleoside triphosphate (dNTP) ) means. Nucleotides can include any subunit that can be incorporated into a growing nucleic acid strand. These subunits may be specific for A, C, G, T, or U, or one or more complementary A, C, G, T, or U, or purine (i.e., A or G, or variants thereof) or pyrimidine (i.e., C, T or U, or variants thereof). In some examples, the polynucleotide is deoxyribonucleic acid (DNA), ribonucleic acid (RNA), or a derivative or variant thereof. In some cases, polynucleotides include short interfering RNA (siRNA), microRNA (miRNA), plasmid DNA (pDNA), short hairpin RNA (shRNA), micronuclear RNA (snRNA), and messenger RNA (mRNA), to name a few. , precursor mRNA (pre-mRNA), antisense RNA (asRNA), and encompasses both the nucleotide sequence and any structural embodiments thereof, such as single-stranded, double-stranded, triple-stranded, helix, hairpin, etc. In some cases, polynucleotide molecules are circular. Polynucleotides can have various lengths. A nucleic acid molecule has at least about 10 bases, 20 bases, 30 bases, 40 bases, 50 bases, 100 bases, 200 bases, 300 bases, 400 bases, 500 bases, 1 kilobase (kb). ), 2 kb, 3, kb, 4 kb, 5 kb, 10 kb, 50 kb, or more. Polynucleotides can be isolated from cells or tissues. Embodiments of polynucleotides include isolated and purified DNA/RNA molecules, synthetic DNA/RNA molecules, and synthetic DNA/RNA analogs.
폴리뉴클레오티드의 실시 형태, 예를 들어, 폴리리보뉴클레오티드 또는 폴리데옥시리보뉴클레오티드는 비표준 뉴클레오티드(들), 비-천연 뉴클레오티드(들), 뉴클레오티드 유사체(들) 또는 변형된 뉴클레오티드를 포함하는 하나 이상의 뉴클레오티드 변이체를 포함할 수 있다. 변형된 뉴클레오티드의 예는 디아미노퓨린, 5-플루오로우라실, 5-브로모우라실, 5-클로로우라실, 5-아이오도우라실, 히포크산틴, 크산틴, 4-아세틸시토신, 5-(카르복시히드록실메틸)우라실, 5-카르복시메틸아미노메틸-2-티오우리딘, 5-카르복시메틸아미노메틸우라실, 디히드로우라실, 베타-D-갈락토실퀘오신, 이노신, N6-이소펜테닐아데닌, 1-메틸구아닌, 1-메틸이노신, 2,2-디메틸구아닌, 2-메틸아데닌, 2-메틸구아닌, 3-메틸시토신, 5-메틸시토신, N6-아데닌, 7-메틸구아닌, 5-메틸아미노메틸우라실, 5-메톡시아미노메틸-2-티오우라실, 베타-D-만노실퀘오신, 5'-메톡시카르복시메틸우라실, 5-메톡시우라실, 2-메틸티오-D46-이소펜테닐아데닌, 우라실-5-옥시아세트산, 와이부톡소신, 슈도우라실, 퀘오신, 2-티오시토신, 5-메틸-2-티오우라실, 2-티오우라실, 4-티오우라실, 5-메틸우라실, 우라실-5-옥시아세트산 메틸에스테르, 우라실-5-옥시아세트산(v), 5-메틸-2-티오우라실, 3-(3-아미노-3-N-2-카르복시프로필) 우라실, (acp3)w, 2,6-디아미노퓨린 등을 포함하지만, 이에 한정되는 것은 아니다. 일부 경우에, 뉴클레오티드는 트리포스페이트 모이어티에 대한 변형을 포함하는 그들의 포스페이트 모이어티의 변형을 포함할 수 있다. 이러한 변형의 비제한적인 예는 더 큰 길이의 포스페이트 쇄(예를 들어, 4, 5, 6, 7, 8, 9, 10개 또는 그 초과의 포스페이트 모이어티를 갖는 포스페이트 쇄) 및 티올 모이어티를 갖는 변형(예를 들어, 알파-티오트리포스페이트 및 베타-티오트리포스페이트)을 포함한다. 실시 형태에서, 핵산 분자는 염기 모이어티(예를 들어, 전형적으로 상보적 뉴클레오티드와 수소 결합을 형성하는 데 이용가능한 하나 이상의 원자에서 또는 전형적으로 상보적 뉴클레오티드와 수소 결합을 형성할 수 없는 하나 이상의 원자에서), 당 모이어티 또는 포스페이트 백본에서 변형된다. 실시 형태에서, 핵산 분자는 아민-변형된 기, 예컨대 아민 반응성 모이어티, 예컨대 N-히드록시숙신이미드 에스테르(NHS)의 공유 부착을 허용하는 아미노 알릴 1-dUTP(aa-dUTP) 및 아미노헥실아크릴아미드-dCTP(aha-dCTP)를 함유한다. 본 개시내용의 올리고뉴클레오티드에서 표준 DNA 염기 쌍 또는 RNA 염기 쌍에 대한 대안은 mm3당 비트 단위의 더 높은 밀도, 더 높은 안전성(천연 독소의 우연한 또는 목적성 합성에 대해 저항성), 광-프로그램된 폴리머라제에서의 더 용이한 식별, 또는 더 낮은 2차 구조를 제공할 수 있다. 데 노보 또는 증폭 합성을 위한 천연 및 돌연변이체 폴리머라제와 혼화성인 이러한 대안적인 염기 쌍은 문헌[Betz K, Malyshev DA, Lavergne T, Welte W, Diederichs K, Dwyer TJ, Ordoukhanian P, Romesberg FE, Marx A. Nat. Chem. Biol. 2012 Jul;8(7):612-4]에 기재되어 있으며, 이는 모든 목적을 위해 본원에 참조로 포함된다.Embodiments of polynucleotides, e.g., polyribonucleotides or polydeoxyribonucleotides, are one or more nucleotide variants comprising non-standard nucleotide(s), non-natural nucleotide(s), nucleotide analog(s), or modified nucleotides. may include. Examples of modified nucleotides include diaminopurine, 5-fluorouracil, 5-bromouracil, 5-chlorouracil, 5-iodouracil, hypoxanthine, xanthine, 4-acetylcytosine, 5-(carboxylhydroxide) roxylmethyl)uracil, 5-carboxymethylaminomethyl-2-thiouridine, 5-carboxymethylaminomethyluracil, dihydrouracil, beta-D-galactosylqueosine, inosine, N6-isopentenyladenine, 1- Methylguanine, 1-methylinosine, 2,2-dimethylguanine, 2-methyladenine, 2-methylguanine, 3-methylcytosine, 5-methylcytosine, N6-adenine, 7-methylguanine, 5-methylaminomethyluracil , 5-methoxyaminomethyl-2-thiouracil, beta-D-mannosylqueosine, 5'-methoxycarboxymethyluracil, 5-methoxyuracil, 2-methylthio-D46-isopentenyladenine, uracil -5-oxyacetic acid, wybutoxoxin, pseudouracil, queosine, 2-thiocytosine, 5-methyl-2-thiouracil, 2-thiouracil, 4-thiouracil, 5-methyluracil, uracil-5-oxy Acetic acid methyl ester, uracil-5-oxyacetic acid (v), 5-methyl-2-thiouracil, 3-(3-amino-3-N-2-carboxypropyl) uracil, (acp3)w, 2,6- It includes, but is not limited to, diaminopurine. In some cases, nucleotides may contain modifications to their phosphate moieties, including modifications to triphosphate moieties. Non-limiting examples of such modifications include phosphate chains of greater length (e.g., phosphate chains with 4, 5, 6, 7, 8, 9, 10 or more phosphate moieties) and thiol moieties. modifications with (e.g., alpha-thiotriphosphate and beta-thiotriphosphate). In an embodiment, the nucleic acid molecule has a base moiety (e.g., typically at one or more atoms available to form hydrogen bonds with complementary nucleotides or at one or more atoms typically unable to form hydrogen bonds with complementary nucleotides). ), is modified at the sugar moiety or the phosphate backbone. In an embodiment, the nucleic acid molecule is an amine-modified group, such as aminoallyl 1-dUTP (aa-dUTP) and aminohexyl groups that allow covalent attachment of amine-reactive moieties such as N-hydroxysuccinimide ester (NHS). Contains acrylamide-dCTP (aha-dCTP). Alternatives to standard DNA base pairs or RNA base pairs in the oligonucleotides of the present disclosure include higher density in bits per mm3 , higher safety (resistance to accidental or purposeful synthesis of natural toxins), light-programmed polymers. It may provide easier identification at the base, or lower secondary structure. These alternative base pairs that are compatible with native and mutant polymerases for de novo or amplification synthesis are described in Betz K, Malyshev DA, Lavergne T, Welte W, Diederichs K, Dwyer TJ, Ordoukhanian P, Romesberg FE, Marx A. Nat. Chem. Biol. 2012 Jul;8(7):612-4, which is incorporated herein by reference for all purposes.
본원에 사용된 바와 같이, "폴리펩티드"는 대부분 펩티드 결합에 의해 함께 연결된 아미노산 잔기(천연 또는 비천연)의 중합체를 의미한다. 본원에 사용된 바와 같이, 상기 용어는 임의의 크기, 구조, 또는 기능의 단백질, 폴리펩티드, 및 펩티드를 지칭한다. 폴리펩티드는 유전자 생성물, 천연 발생 폴리펩티드, 합성 폴리펩티드, 상기의 동족체, 오르토로그, 파라로그, 단편 및 다른 등가물, 변이체, 및 유사체를 포함할 수 있다. 폴리펩티드는 단일 분자 또는 다중-분자 복합체, 예컨대 이량체, 삼량체, 또는 사량체일 수 있다. 이들은 또한 단일 쇄 또는 다중쇄 폴리펩티드, 예컨대 항체 또는 인슐린을 포함할 수 있고, 회합되거나 연결될 수 있다. 가장 통상적으로 디술피드 연결은 다중쇄 폴리펩티드에서 발견된다. 폴리펩티드라는 용어는 또한 하나 이상의 아미노산 잔기가 상응하는 천연 발생 아미노산의 인공 화학적 유사체인 아미노산 중합체에도 적용될 수 있다.As used herein, “polypeptide” refers to a polymer of amino acid residues (natural or non-natural) linked together, most often by peptide bonds. As used herein, the term refers to proteins, polypeptides, and peptides of any size, structure, or function. Polypeptides may include gene products, naturally occurring polypeptides, synthetic polypeptides, homologues, orthologs, paralogs, fragments and other equivalents, variants, and analogs thereof. A polypeptide may be a single molecule or a multi-molecular complex, such as a dimer, trimer, or tetramer. They may also include single-chain or multi-chain polypeptides, such as antibodies or insulin, and may be associated or linked. Most commonly disulfide linkages are found in multi-chain polypeptides. The term polypeptide can also be applied to amino acid polymers in which one or more amino acid residues are artificial chemical analogs of the corresponding naturally occurring amino acids.
본원에 사용된 바와 같이, "예방하다"라는 용어는 질병, 장애 또는 질환(예를 들어, 바이러스 감염, 예를 들어, HIV, SARS-CoV-2, HCV, 인플루엔자 또는 RSV)의 발생 가능성을 감소시키거나, 대안적으로, 후속적으로 발생된 질병 또는 장애에서 증상의 중증도 또는 빈도를 감소시키는 것을 의미한다. 치료제는 질병 또는 질환의 발병을 예방하거나 중증도를 감소시키기 위해 일반 집단의 구성원에 비해 바이러스 감염이 발병될 위험이 증가된 대상체에게 투여될 수 있다. 치료제는, 예를 들어, 바이러스 감염의 임의의 증상 또는 징후가 발생하기 전에 예방제로서 투여될 수 있다.As used herein, the term “prevent” means reducing the likelihood of developing a disease, disorder, or condition (e.g., a viral infection, e.g., HIV, SARS-CoV-2, HCV, influenza, or RSV). It means reducing the severity or frequency of symptoms in a subsequently developing disease or disorder. The therapeutic agent may be administered to subjects at increased risk of developing a viral infection compared to members of the general population to prevent the onset or reduce the severity of the disease or condition. The therapeutic agent may be administered as a prophylactic agent, for example, before any symptoms or signs of viral infection occur.
본원에 사용된 바와 같이, "조절 요소"라는 용어는 원형 또는 선형 폴리리보뉴클레오티드 내의 발현 서열의 발현을 변형시키는 모이어티, 예컨대 핵산 서열이다.As used herein, the term “regulatory element” is a moiety, such as a nucleic acid sequence, that modifies the expression of an expression sequence within a circular or linear polyribonucleotide.
본원에 사용된 바와 같이, "스페이서"는 2개의 인접한 폴리뉴클레오티드 영역 사이의 거리 또는 유연성을 제공하는 (예를 들어, 하나 이상의 뉴클레오티드의) 임의의 인접한 뉴클레오티드 서열을 지칭한다.As used herein, “spacer” refers to any contiguous nucleotide sequence (e.g., of one or more nucleotides) that provides distance or flexibility between two adjacent polynucleotide regions.
"신호 서열"은 폴리펩티드 서열을 분비 경로로 표적화하는 초기 단백질의 폴리펩티드 서열의 N-말단에 존재하는, 예를 들어, 10개 내지 45개 아미노산 길이의 폴리펩티드 서열을 지칭한다.“Signal sequence” refers to a polypeptide sequence, e.g., 10 to 45 amino acids in length, present at the N-terminus of the polypeptide sequence of a nascent protein that targets the polypeptide sequence to the secretory pathway.
본원에 사용된 바와 같이, "서열 동일성"이라는 용어는 전역 또는 국부 정렬 알고리즘을 사용하여 2개의 펩티드 또는 2개의 뉴클레오티드 서열의 정렬에 의해 결정된다. 서열은 이들이 최적으로 정렬된 경우(예를 들어, 디폴트 파라미터를 사용하는 GAP 또는 BESTFIT와 같은 프로그램에 의해 정렬되는 경우) 서열 동일성의 적어도 특정 최소 백분율을 공유하는 경우, "실질적으로 동일한" 또는 "본질적으로 유사한" 것으로 지칭된다. GAP는 2개의 서열을 그들의 전체 길이에 걸쳐 정렬하여, 매치의 수를 최대화하고, 갭의 수를 최소화하는 Needleman 및 Wunsch 전역 정렬 알고리즘을 사용한다. 일반적으로, GAP 디폴트 파라미터가 사용되며, 갭 생성 페널티 = 50(뉴클레오티드) / 8(단백질) 및 갭 연장 페널티 = 3(뉴클레오티드) / 2(단백질)이다. 뉴클레오티드에 대해, 사용되는 디폴트 점수화 매트릭스는 nwsgapdna이고, 단백질에 대해, 디폴트 점수화 매트릭스는 Blosum62이다(Henikoff & Henikoff, 1992, PNAS 89, 915-919). 서열 정렬 및 백분율 서열 동일성에 대한 점수는 예를 들어, 컴퓨터 프로그램, 예컨대 미국 92121-3752 캘리포니아주 샌 디에고 스크랜톤 로드 9685에 소재하는 악셀리스 인크.(Accelrys Inc.)로부터 이용가능한 GCG Wisconsin Package, 버전 10.3, 또는 EmbossWin 버전 2.10.0(프로그램 "needle"을 사용하여)을 사용하여 결정된다. 대안적으로, 또는 추가적으로, 퍼센트 동일성은 예를 들어, FASTA, BLAST 등과 같은 알고리즘을 사용하여, 데이터베이스에 대해 검색함으로써 결정된다. 서열 동일성은 서열의 전체 길이에 걸친 서열 동일성을 지칭한다.As used herein, the term “sequence identity” is determined by alignment of two peptide or two nucleotide sequences using a global or local alignment algorithm. Sequences are said to be “substantially identical” or “essentially identical” if they are optimally aligned (e.g., by a program such as GAP or BESTFIT using default parameters) and share at least a certain minimum percentage of sequence identity. It is referred to as “similar.” GAP uses the Needleman and Wunsch global alignment algorithm, which aligns two sequences over their entire length, maximizing the number of matches and minimizing the number of gaps. Typically, GAP default parameters are used, gap creation penalty = 50 (nucleotides) / 8 (protein) and gap extension penalty = 3 (nucleotides) / 2 (protein). For nucleotides, the default scoring matrix used is nwsgapdna, and for proteins, the default scoring matrix is Blosum62 (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Sequence alignment and scoring for percent sequence identity can be performed using, for example, a computer program such as the GCG Wisconsin Package, version 10.3, available from Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752, USA. , or determined using EmbossWin version 2.10.0 (using the program "needle"). Alternatively, or additionally, percent identity is determined by searching against a database, for example, using an algorithm such as FASTA, BLAST, etc. Sequence identity refers to sequence identity over the entire length of the sequence.
본원에 사용된 바와 같이, "대상체"라는 용어는 유기체, 예컨대 동물, 식물, 또는 미생물을 지칭한다. 실시 형태에서, 대상체는 척추 동물(예를 들어, 포유류, 조류, 어류, 파충류, 또는 양서류)이다. 실시 형태에서, 대상체는 인간이다. 실시 형태에서, 대상체는 비-인간 포유류다. 실시 형태에서, 대상체는 비-인간 포유류, 예컨대 비-인간 영장류(예를 들어, 원숭이, 유인원), 유제류(예를 들어, 소, 버팔로, 비손, 양, 염소, 돼지, 낙타, 라마, 알파카, 사슴, 말, 당나귀), 육식동물(예를 들어, 개, 고양이), 설치류(예를 들어, 래트, 마우스), 또는 토끼목(예를 들어, 토끼)이다. 실시 형태에서, 대상체는 조류, 예컨대 조류 분류군 순계목(예를 들어, 닭, 칠면조, 꿩, 메추라기), 기러기목(예를 들어, 오리, 거위), 고관목(예를 들어, 타조, 에뮤), 비둘기목(예를 들어, 피존, 도브), 또는 앵무새목(예를 들어, 앵무새)의 구성원이다. 실시 형태에서, 대상체는 무척추동물, 예컨대 절지동물(예를 들어, 곤충류, 거미류, 갑각류), 선충, 환형동물, 연충, 또는 연체동물이다. 실시 형태에서, 대상체는 무척추동물 농업적 해충 또는 무척추동물 또는 척추동물 숙주 상에 기생하는 무척추동물이다. 실시 형태에서, 대상체는 식물, 예컨대 피자 식물(쌍자엽 또는 단자엽일 수 있음) 또는 나자 식물(예를 들어, 침엽수, 소철류, 마황문, 은행나무), 양치식물, 쇠뜨기, 석송, 또는 선태식물이다. 실시 형태에서, 대상체는 진핵 조류(단세포 또는 다세포)이다. 실시 형태에서, 대상체는 농업적으로 또는 원예적으로 중요한 식물, 예컨대 줄뿌림 작물 식물, 과실-생산 식물 및 나무, 채소, 나무, 및 관상용 꽃, 관목, 나무, 지표식물, 및 잔디풀을 포함하는 관상용 식물이다.As used herein, the term “subject” refers to an organism, such as an animal, plant, or microorganism. In an embodiment, the subject is a vertebrate (e.g., a mammal, bird, fish, reptile, or amphibian). In an embodiment, the subject is a human. In an embodiment, the subject is a non-human mammal. In an embodiment, the subject is a non-human mammal, such as a non-human primate (e.g., monkey, ape), ungulate (e.g., cow, buffalo, bison, sheep, goat, pig, camel, llama, alpaca, deer, horse, donkey), carnivore (e.g., dog, cat), rodent (e.g., rat, mouse), or lagomorph (e.g., rabbit). In an embodiment, the subject is a bird, such as from the avian taxa Order Order (e.g., chickens, turkeys, pheasants, quail), Orchids (e.g., ducks, geese), Archaea (e.g., ostriches, emus). , a member of the order Columbine (e.g., pigeon, dove), or the order Parrot (e.g., parrot). In an embodiment, the subject is an invertebrate, such as an arthropod (e.g., insect, arachnid, crustacean), nematode, annelid, helminth, or mollusk. In an embodiment, the subject is an invertebrate agricultural pest or an invertebrate that lives on an invertebrate or vertebrate host. In an embodiment, the subject is a plant, such as an angiosperm (which may be dicotyledonous or monocot) or a germinal plant (e.g., conifer, cycad, ephedra, ginkgo), fern, horsetail, lycophyte, or bryophyte. In an embodiment, the subject is a eukaryotic algae (unicellular or multicellular). In embodiments, the subject is agriculturally or horticulturally important plants, such as row crop plants, fruit-producing plants and trees, vegetables, trees, and ornamental plants, including ornamental flowers, shrubs, trees, groundcover plants, and turfgrasses. It is a plant.
본원에 사용된 바와 같이, "항푸소제닉 폴리펩티드"라는 용어는 바이러스 진입 또는 바이러스 융합과 같은 바이러스 융합 관련 이벤트를 억제하는 10 내지 200개 아미노산의 폴리펩티드와 같은 폴리펩티드를 지칭한다. 항푸소제닉 폴리펩티드는, 예를 들어, 표 1의 폴리펩티드를 포함한다. 항푸소제닉 폴리펩티드는 폴리펩티드뿐만 아니라 이의 임의의 생물학적 활성 단편(예를 들어, 적어도 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 또는 500개 아미노산의 단편)을 포함한다. 항푸소제닉 폴리펩티드는, 예를 들어, HIV, SARS-CoV-2, HCV 또는 RSV를 표적으로 하는 폴리펩티드를 포함한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 SEQ ID NO: 1 내지 324 중 어느 하나와 적어도 70%, 예를 들어, 적어도 80%, 예를 들어, 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 포함한다. 항푸소제닉 폴리펩티드는 또한 폴리뉴클레오티드(예를 들어, 폴리리보뉴클레오티드, 예를 들어, 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리리보뉴클레오티드 또는 이의 생물학적 활성 단편을 지칭한다.As used herein, the term “antifusogenic polypeptide” refers to a polypeptide, such as a polypeptide of 10 to 200 amino acids, that inhibits viral fusion related events such as viral entry or viral fusion. Antifusogenic polypeptides include, for example, the polypeptides in Table 1. Antifusogenic polypeptides include polypeptides as well as any biologically active fragments thereof (e.g., at least 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, fragments of 400, 450, or 500 amino acids). Antifusogenic polypeptides include, for example, polypeptides that target HIV, SARS-CoV-2, HCV or RSV. In some embodiments, the antifusogenic polypeptide is at least 70%, such as at least 80%, such as at least 85% (e.g., at least 90%, 95%) any one of SEQ ID NO: 1-324 %, 97%, 99%, or 100%) sequence identity. Antifusogenic polypeptide also refers to a polynucleotide (e.g., a polyribonucleotide, e.g., a circular polyribonucleotide encoding an antifusogenic polypeptide (e.g., a polypeptide in Table 1) or a biologically active fragment thereof .
본원에 사용된 바와 같이, "치료하다" 및 "치료하는"이라는 용어는 대상체에서의 바이러스 감염, 예를 들어, HIV, SARS-CoV-2, HCV, 인플루엔자 또는 RSV의 예방적 또는 치료적 치료를 지칭한다. 치료의 효과는 치료적 치료의 부재 하에서의 바이러스 감염의 양상 또는 상태와 비교하여, 바이러스 감염을 반전시키는 것, 경감시키는 것, 그의 중증도를 감소시키는 것, 치유하는 것, 그의 진행을 억제하는 것, 질병 또는 하나 이상의 증상 또는 증후의 재발의 가능성을 감소시키는 것, 바이러스 감염의 상태를 안정화시키는 것(즉, 악화시키지 않는 것), 또는 바이러스 감염의 확산을 예방하는 것을 포함할 수 있다.As used herein, the terms “treat” and “treating” refer to the prophylactic or therapeutic treatment of a viral infection, e.g., HIV, SARS-CoV-2, HCV, influenza, or RSV, in a subject. refers to The effect of treatment is to reverse, alleviate, reduce the severity of, cure, inhibit the progression of, or disease of a viral infection compared to the pattern or condition of the viral infection in the absence of therapeutic treatment. or reducing the likelihood of recurrence of one or more symptoms or symptoms, stabilizing (i.e., not worsening) the condition of the viral infection, or preventing the spread of the viral infection.
본원에 사용된 바와 같이, "종결 요소"라는 용어는 원형 또는 선형 폴리리보뉴클레오티드에서 발현 서열의 번역을 종결시키는 모이어티, 예컨대 핵산 서열이다.As used herein, the term “termination element” is a moiety, such as a nucleic acid sequence, that terminates translation of an expressed sequence in a circular or linear polyribonucleotide.
본원에 사용된 바와 같이, "번역 효율"이라는 용어는 리보뉴클레오티드 전사체로부터의 단백질 또는 펩티드 생성의 속도 또는 양이다. 일부 실시 형태에서, 번역 효율은 예를 들어, 주어진 기간에, 예를 들어, 주어진 번역 시스템, 예를 들어, 토끼 망상적혈구 용해물과 같은 무세포 번역 시스템에서, 단백질 또는 펩티드를 코딩하는 전사체의 주어진 양당 생성된 단백질 또는 펩티드의 양으로서 표현될 수 있다.As used herein, the term “translation efficiency” is the rate or amount of protein or peptide production from a ribonucleotide transcript. In some embodiments, the translation efficiency is the ratio of transcripts encoding a protein or peptide, e.g., in a given translation system, e.g., a cell-free translation system such as rabbit reticulocyte lysate, in a given period of time. It can be expressed as the amount of protein or peptide produced per given amount.
본원에 사용된 바와 같이, "번역 개시 서열"이라는 용어는 원형 또는 선형 폴리리보뉴클레오티드에서 발현 서열의 번역을 개시시키는 핵산 서열이다.As used herein, the term “translation initiation sequence” is a nucleic acid sequence that initiates translation of an expression sequence in a circular or linear polyribonucleotide.
본원에 사용된 바와 같이, "벡터"는 외래 DNA 단편이 클로닝 또는 발현 목적을 위해 삽입될 수 있거나 삽입된 합성된(예를 들어, PCR을 사용하여), 또는 바이러스, 플라스미드, 또는 고등 유기체의 세포로부터 취해진 DNA의 조각을 의미한다. 일부 실시 형태에서, 벡터는 유기체에서 안정하게 유지될 수 있다. 벡터는 예를 들어, 복제 기점, 선택가능한 마커 또는 리포터 유전자, 예컨대 항생제 저항성 또는 GFP, 또는 다중 클로닝 부위(MCS)를 포함할 수 있다. 상기 용어는 선형 DNA 단편(예를 들어, PCR 생성물, 선형화된 플라스미드 단편), 플라스미드 벡터, 바이러스 벡터, 코스미드, 박테리아 인공 염색체(BAC), 효모 인공 염색체(YAC) 등을 포함한다. 한 실시 형태에서, 본원에서 제공된 벡터는 다중 클로닝 부위(MCS)를 포함한다. 또 다른 실시 형태에서, 본원에서 제공된 벡터는 MCS를 포함하지 않는다.As used herein, “vector” means a foreign DNA fragment into which a foreign DNA fragment can be inserted or has been inserted (e.g., using PCR), or a virus, plasmid, or cell of a higher organism. refers to a piece of DNA taken from In some embodiments, the vector can be stably maintained in the organism. The vector may contain, for example, an origin of replication, a selectable marker or reporter gene such as antibiotic resistance or GFP, or a multiple cloning site (MCS). The term includes linear DNA fragments (e.g., PCR products, linearized plasmid fragments), plasmid vectors, viral vectors, cosmids, bacterial artificial chromosomes (BAC), yeast artificial chromosomes (YAC), and the like. In one embodiment, the vectors provided herein include multiple cloning sites (MCS). In another embodiment, the vectors provided herein do not include MCS.
도 1은 다양한 코로나바이러스 S 단백질의 단백질 도메인 또는 영역 및 HR1 및 HR2 영역의 서열을 보여주는 개략도이다.
도 2는 SARS CoV-2의 HR2 영역으로부터 유래된 다양한 항푸소제닉 폴리펩티드 및 서열을 보여주는 개략도이다.
도 3은 다중 ORF 항푸소제닉 폴리펩티드 작제물의 예시적인 실시 형태를 보여주는 개략도이다.
도 4a 및도 4b는 오미크론(Omicron) 및 델타 유사 바이러스를 사용하는 융합에 대한 억제 효능을 보여주는 그래프이다.도 4a는 HR2 전장 또는 HiBiT 태그를 갖는 HR2 전장 중 어느 하나를 사용하는 델타 및 오미크론의 억제%를 보여준다.도 4b는 모의 대조군과 비교하여 항푸소제닉 폴리펩티드의 상대적 발현을 보여준다.
도 5는 6시간 및 24시간째에 HiBiT 태그가 있거나 없는 HR2 전장 항푸소제닉 폴리펩티드의 생체내 발현을 보여주는 그래프이다.
도 6a 및도 6b는 HR2A 폴리펩티드를 사용하는 SARS CoV-2의 우한(Wuhan) 및 오미크론 균주의 슈도바이러스의 시험관내 중화를 보여주는 그래프이다.도 6a는 HR2A를 사용하는 SARS CoV-2의 우한 균주의 중화를 보여준다.도 6b는 HR2A를 사용하는 SARS CoV-2의 오미크론 균주의 중화를 보여준다.
도 7a 및도 7b는 SARS CoV-2 슈도바이러스 오미크론 BA4 및 BA.5(도 7a) 또는 SARS CoV-1 슈도바이러스(도 7b) 균주의 억제율(%)을 보여주는 그래프이다.
도 8a 내지 도 8d는 전장 HR2(HR2컴플리트)를 이용한 SARS CoV-2 슈도바이러스의 억제율(%)을 보여주는 그래프이다.도 8a는 우한 균주의 억제를 보여준다.도 8b는 오미크론 BA.4 및 BA.5 균주의 억제를 보여준다.도 8c는 오미크론 BA.1 균주의 억제를 보여준다.도 8d는 SARS CoV-1 슈도바이러스의 억제를 보여준다.
도 9는 다양한 HIV 항푸소제닉 폴리펩티드에 대한 작제물 설계 및 서열을 보여주는 개략도이다.
도 10a 및도 10b는 원형 RNA로부터의 다양한 HIV 항푸소제닉 폴리펩티드의 발현을 보여주는 그래프(도 10a) 및 표(도 10b)이다.
도 11a 및도 11b는 원형 RNA(도 11a) 또는 플라스미드 DNA(도 11b)로부터의 다양한 HIV 항푸소제닉 폴리펩티드의 발현을 보여주는 그래프이다
도 12는 원형 RNA로부터의 다양한 HIV 항푸소제닉 폴리펩티드의 발현을 보여주는 표이다.Figure 1 is a schematic diagram showing the sequences of protein domains or regions and HR1 and HR2 regions of various coronavirus S proteins.
Figure 2 is a schematic diagram showing various antifusogenic polypeptides and sequences derived from the HR2 region of SARS CoV-2.
Figure 3 is a schematic diagram showing an exemplary embodiment of a multiple ORF antifusogenic polypeptide construct.
Figures 4A and4B are graphs showing the inhibitory efficacy against fusion using Omicron and delta-like viruses.Figure 4A shows the % inhibition of delta and omicron using either HR2 full length or HR2 full length with HiBiT tag.Figure 4B shows the relative expression of antifusogenic polypeptides compared to mock controls.
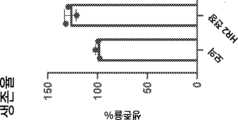
Figure 5 is a graph showing in vivo expression of HR2 full-length antifusogenic polypeptide with and without HiBiT tag at 6 and 24 hours.
Figures 6A and6B are graphs showing in vitro neutralization of pseudoviruses of the Wuhan and Omicron strains of SARS CoV-2 using HR2A polypeptide.Figure 6A shows neutralization of the Wuhan strain of SARS CoV-2 using HR2A.Figure 6B shows neutralization of omicron strains of SARS CoV-2 using HR2A.
Figures 7a and7b are graphs showing the inhibition rate (%) of SARS CoV-2 pseudovirus Omicron BA4 and BA.5 (Figure 7a ) or SARS CoV-1 pseudovirus (Figure 7b ) strains.
Figures 8a to 8d are graphs showing the inhibition rate (%) of SARS CoV-2 pseudovirus using full-length HR2 (HR2 complete).Figure 8A shows suppression of the Wuhan strain.Figure 8B shows inhibition of Omicron BA.4 and BA.5 strains.Figure 8C shows inhibition of Omicron BA.1 strain.Figure 8D shows inhibition of SARS CoV-1 pseudovirus.
Figure 9 is a schematic showing construct design and sequences for various HIV antifusogenic polypeptides.
Figures 10A and10B are graphs (Figure 10A ) and tables (Figure 10B ) showing expression of various HIV antifusogenic polypeptides from circular RNA.
Figures 11A and11B are graphs showing the expression of various HIV antifusogenic polypeptides from circular RNA (Figure 11A ) or plasmid DNA (Figure 11B ).
Figure 12 is a table showing expression of various HIV antifusogenic polypeptides from circular RNA.
본 발명은 항푸소제닉 폴리펩티드를 인코딩하는 원형 폴리리보뉴클레오티드(원형 RNA)를 함유하는 조성물 및 이의 사용 방법을 특징으로 한다. 본원에 기재된 원형 폴리리보뉴클레오티드는 항푸소제닉 폴리펩티드를 인코딩하는 폴리뉴클레오티드 카고를 표적 세포에 전달하는 데 특히 유용하다.The present invention features compositions containing circular polyribonucleotides (circular RNAs) encoding antifusogenic polypeptides and methods of using the same. The circular polyribonucleotides described herein are particularly useful for delivering polynucleotide cargo encoding antifusogenic polypeptides to target cells.
원형 폴리리보뉴클레오티드는 표 1의 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 카고를 포함할 수 있다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 표 1의 폴리펩티드와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 1 내지 324 중 어느 하나와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다.The circular polyribonucleotide may comprise a polyribonucleotide cargo encoding a polypeptide of Table 1. In some embodiments, the polyribonucleotide cargo has an expressed sequence encoding a polypeptide having at least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity to a polypeptide of Table 1. Includes. In some embodiments, the polyribonucleotide cargo has at least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity with any one of SEQ ID NO: 1 to 324. It contains an expression sequence encoding a polypeptide.
원형 폴리리보뉴클레오티드는 선형 데옥시리보뉴클레오티드, 원형 데옥시리보뉴클레오티드, 또는 원형 폴리리보뉴클레오티드와 같은 전구체로부터 생성될 수 있다.Circular polyribonucleotides can be generated from precursors such as linear deoxyribonucleotides, circular deoxyribonucleotides, or circular polyribonucleotides.
원형 폴리리보뉴클레오티드는 예를 들어, 5' 엑손 단편 및 3' 엑손 단편을 연결하는 스플라이스 접합부를 포함할 수 있다.A circular polyribonucleotide may include, for example, a splice junction connecting a 5' exon fragment and a 3' exon fragment.
본원에 기재된 선형 RNA 분자는 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드이다. 일부 실시 형태에서, 선형 RNA 분자는 5'로부터 3'로, (A) 3' 촉매 인트론 단편; (B) 3' 스플라이스 부위; (C) 3' 엑손 단편; (D) 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 카고(예를 들어, 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열에 작동가능하게 연결된 IRES를 인코딩하는 폴리리보뉴클레오티드 카고); (E) 5' 엑손 단편; (F) 5' 스플라이스 부위; 및 (G) 5' 촉매 인트론 단편을 포함한다. 그런 다음 촉매 인트론 단편 및 스플라이스 부위는 선형 폴리리보뉴클레오티드가 자기-스플라이싱되도록 하고, 따라서 항푸소제닉 폴리펩티드를 인코딩하는 원형 폴리리보뉴클레오티드를 형성할 수 있다.The linear RNA molecules described herein are polyribonucleotides that encode antifusogenic polypeptides. In some embodiments, the linear RNA molecule comprises, from 5' to 3': (A) a 3' catalytic intron fragment; (B) 3' splice site; (C) 3' exon fragment; (D) a polyribonucleotide cargo encoding an antifusogenic polypeptide (e.g., a polyribonucleotide cargo encoding an IRES operably linked to an expression sequence encoding an antifusogenic polypeptide); (E) 5' exon fragment; (F) 5' splice site; and (G) a 5' catalytic intron fragment. The catalytic intron fragment and splice site can then cause the linear polyribonucleotide to self-splice, thus forming a circular polyribonucleotide encoding the antifusogenic polypeptide.
또한, 본원에 기재된 바와 같은 원형 폴리리보뉴클레오티드를 사용하는 방법을 특징으로 한다. 예를 들어, 원형 폴리리보뉴클레오티드는 대상체, 예를 들어, 인간 대상체에 투여하기 위한 조성물(예를 들어, 약제학적 조성물)로서 제형화될 수 있다. 약제학적 조성물은 조성물의 하나 이상의 용량으로 투여될 수 있다. 조성물은 바이러스 감염(예를 들어, HIV, SARS-CoV-2, HCV, 인플루엔자, 또는 RSV)을 치료하거나 예방하기 위해 대상체에게 투여될 수 있다.Also featured are methods using circular polyribonucleotides as described herein. For example, a circular polyribonucleotide can be formulated as a composition (e.g., a pharmaceutical composition) for administration to a subject, e.g., a human subject. Pharmaceutical compositions may be administered in one or more doses of the composition. The composition can be administered to a subject to treat or prevent a viral infection (e.g., HIV, SARS-CoV-2, HCV, influenza, or RSV).
폴리뉴클레오티드polynucleotide
본 개시내용은 항푸소제닉 폴리펩티드를 인코딩하는 원형 폴리리보뉴클레오티드 조성물, 이의 용도, 및 항푸소제닉 폴리펩티드를 인코딩하는 원형 폴리리보뉴클레오티드를 제조하는 방법을 특징으로 한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드로부터 (예를 들어, 선형 폴리리보뉴클레오티드의 혼화성 단부를 자기-스플라이싱함으로써) 생성된다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 데옥시리보뉴클레오티드 주형(예를 들어, 벡터, 선형화 벡터, 또는 cDNA)으로부터 전사된다. 따라서, 본 개시내용은 항푸소제닉 폴리펩티드를 인코딩하는 원형 폴리리보뉴클레오티드의 생성에 유용한 데옥시리보뉴클레오티드, 선형 폴리리보뉴클레오티드, 및 원형 폴리리보뉴클레오티드 및 그의 조성물을 특징으로 한다.The present disclosure features circular polyribonucleotide compositions encoding antifusogenic polypeptides, uses thereof, and methods of making circular polyribonucleotides encoding antifusogenic polypeptides. In some embodiments, circular polyribonucleotides are generated from linear polyribonucleotides (e.g., by self-splicing the compatible ends of the linear polyribonucleotides). In some embodiments, linear polyribonucleotides are transcribed from a deoxyribonucleotide template (e.g., a vector, linearized vector, or cDNA). Accordingly, the present disclosure features deoxyribonucleotides, linear polyribonucleotides, and circular polyribonucleotides and compositions thereof useful for the production of circular polyribonucleotides encoding antifusogenic polypeptides.
주형 데옥시리보뉴클레오티드Template deoxyribonucleotide
본 발명은 본원에 기재된 바와 같은 원형 RNA를 제조하기 위한 주형 데옥시리보뉴클레오티드를 특징으로 한다. 실시 형태에서, 데옥시리보뉴클레오티드는 5'로부터 3' 배향으로 작동가능하게 연결된 하기의 것을 포함한다: (A) 3' 촉매 인트론 단편; (B) 3' 스플라이스 부위; (C) 3' 엑손 단편; (D) 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 카고; (E) 5' 엑손 단편; (F) 5' 스플라이스 부위; 및 (G) 5' 촉매 인트론 단편. 실시 형태에서, 데옥시리보뉴클레오티드는 예를 들어, 요소 (A), (B), (C), (D), (E), (F), 또는 (G) 중 임의의 것의 외부에 또는 그 사이에 추가의 요소를 포함한다. 실시 형태에서, 요소 (A), (B), (C), (D), (E), (F), 또는 (G) 중 임의의 것은 본원에 기재된 바와 같이 스페이서 서열에 의해 서로로부터 분리된다.The invention features template deoxyribonucleotides for making circular RNA as described herein. In an embodiment, the deoxyribonucleotide comprises the following operably linked in a 5' to 3' orientation: (A) a 3' catalytic intron fragment; (B) 3' splice site; (C) 3' exon fragment; (D) a polyribonucleotide cargo encoding an antifusogenic polypeptide; (E) 5' exon fragment; (F) 5' splice site; and (G) 5' catalytic intron fragment. In an embodiment, the deoxyribonucleotide is, for example, outside of or within any of elements (A), (B), (C), (D), (E), (F), or (G). Includes additional elements in between. In an embodiment, any of elements (A), (B), (C), (D), (E), (F), or (G) are separated from each other by a spacer sequence as described herein .
실시 형태에서, 데옥시리보뉴클레오티드는 예를 들어, 원형 DNA 벡터, 선형화 DNA 벡터, 또는 선형 DNA(예를 들어, DNA 벡터로부터 생성된, 예를 들어, cDNA)이다.In an embodiment, the deoxyribonucleotide is, for example, a circular DNA vector, a linearized DNA vector, or linear DNA (e.g., produced from a DNA vector, e.g., cDNA).
일부 실시 형태에서, 데옥시리보뉴클레오티드는 본원에 기재된 선형 RNA를 인코딩하는 서열에 작동가능하게 연결된 RNA 폴리머라제 프로모터를 추가로 포함한다. 실시 형태에서, RNA 폴리머라제 프로모터는 선형 RNA를 인코딩하는 서열에 대해 이종이다. 일부 실시 형태에서, RNA 폴리머라제 프로모터는 T7 프로모터, T6 프로모터, T4 프로모터, T3 프로모터, SP6 바이러스 프로모터, 또는 SP3 프로모터이다.In some embodiments, the deoxyribonucleotide further comprises an RNA polymerase promoter operably linked to a sequence encoding a linear RNA described herein. In an embodiment, the RNA polymerase promoter is heterologous to the sequence encoding linear RNA. In some embodiments, the RNA polymerase promoter is a T7 promoter, T6 promoter, T4 promoter, T3 promoter, SP6 viral promoter, or SP3 promoter.
일부 실시 형태에서, 데옥시리보뉴클레오티드는 다중-클로닝 부위(MCS)를 포함한다.In some embodiments, the deoxyribonucleotide includes a multi-cloning site (MCS).
일부 실시 형태에서, 데옥시리보뉴클레오티드는 약 100개 내지 약 20,000개의 뉴클레오티드의 크기 범위를 갖는 원형 RNA를 생성하는 데 사용된다. 일부 실시 형태에서, 원형 RNA는 적어도 100, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1,000, 1,100, 1,200, 1,300, 1,400, 1,500, 1,600 1,700, 1,800, 1,900, 2,000, 2,500, 3,000, 3,500, 4,000, 4,500 또는 5,000개의 뉴클레오티드의 크기이다. 일부 실시 형태에서, 원형 RNA는 20,000, 15,000 10,000, 9,000, 8,000, 7,000, 6,000, 5,000 또는 4,000개 이하의 뉴클레오티드의 크기이다.In some embodiments, deoxyribonucleotides are used to produce circular RNA ranging in size from about 100 to about 20,000 nucleotides. In some embodiments, the circular RNA has at least 100, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1,000, 1,100, 1,200, 1,300, 1,400, 1,500, 1,600, 1,700, 00, 1,900, It is 2,000, 2,500, 3,000, 3,500, 4,000, 4,500 or 5,000 nucleotides in size. In some embodiments, the circular RNA is no more than 20,000, 15,000, 10,000, 9,000, 8,000, 7,000, 6,000, 5,000, or 4,000 nucleotides in size.
선형 폴리리보뉴클레오티드linear polyribonucleotide
본 발명은 또한 항푸소제닉 폴리펩티드를 인코딩하는 선형 폴리리보뉴클레오티드를 특징으로 한다. 선형 폴리리보뉴클레오티드는 예를 들어, 선형 폴리리보뉴클레오티드를 결찰 또는 스플라이싱(예를 들어, 자기-스플라이싱)하여 원형 폴리리보뉴클레오티드를 생성함으로써 원형 폴리리보뉴클레오티드를 생성하는 데 사용될 수 있다. 실시 형태에서, 선형 폴리리보뉴클레오티드는 5'로부터 3' 배향으로 작동가능하게 연결된 하기의 것을 포함한다: (A) 3' 촉매 인트론 단편; (B) 3' 스플라이스 부위; (C) 3' 엑손 단편; (D) 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 카고; (E) 5' 엑손 단편; (F) 5' 스플라이스 부위; 및 (G) 5' 촉매 인트론 단편. 실시 형태에서, 선형 폴리리보뉴클레오티드는 예를 들어, 요소 (A), (B), (C), (D), (E), (F), 또는 (G) 중 임의의 것의 외부에 또는 그 사이에 추가의 요소를 포함한다. 예를 들어, 요소 (A), (B), (C), (D), (E), (F), 또는 (G) 중 임의의 것은 본원에 기재된 바와 같이 스페이서 서열에 의해 분리될 수 있다.The invention also features linear polyribonucleotides encoding antifusogenic polypeptides. Linear polyribonucleotides can be used to generate circular polyribonucleotides, for example, by ligating or splicing (e.g., self-splicing) linear polyribonucleotides to generate circular polyribonucleotides. In an embodiment, the linear polyribonucleotide comprises the following operably linked in a 5' to 3' orientation: (A) a 3' catalytic intron fragment; (B) 3' splice site; (C) 3' exon fragment; (D) a polyribonucleotide cargo encoding an antifusogenic polypeptide; (E) 5' exon fragment; (F) 5' splice site; and (G) 5' catalytic intron fragment. In an embodiment, the linear polyribonucleotide is, for example, outside of or within any of elements (A), (B), (C), (D), (E), (F), or (G). Includes additional elements in between. For example, any of elements (A), (B), (C), (D), (E), (F), or (G) can be separated by a spacer sequence as described herein. .
특정 실시 형태에서, 본원에서 제공된 항푸소제닉 폴리펩티드를 인코딩하는 데옥시리보뉴클레오티드(예를 들어, 벡터, 선형화 벡터, 또는 cDNA)를 주형(예를 들어, 선형 RNA를 코딩하는 영역의 상류에 위치한 RNA 폴리머라제 프로모터를 갖는 본원에서 제공된 벡터, 선형화 벡터, 또는 cDNA)으로서 사용하여 무세포 시스템에서의 전사(예를 들어, 시험관내 전사)를 수행함으로써 항푸소제닉 폴리펩티드를 인코딩하는 선형 RNA를 생성하는 방법이 본원에서 제공된다.In certain embodiments, a deoxyribonucleotide (e.g., a vector, linearized vector, or cDNA) encoding an antifusogenic polypeptide provided herein is used as a template (e.g., an RNA located upstream of the region encoding the linear RNA). A method of producing a linear RNA encoding an antifusogenic polypeptide by performing transcription in a cell-free system (e.g., in vitro transcription) using a vector provided herein having a polymerase promoter, a linearized vector, or a cDNA). It is provided herein.
실시 형태에서, 데옥시리보뉴클레오티드 주형은 전사되어 본원에 기재된 구성성분을 함유하는 선형 RNA를 생성한다. 발현시, 선형 폴리리보뉴클레오티드는 원형 폴리리보뉴클레오티드를 생성하기 위해 자기-스플라이싱될 수 있는 스플라이싱-혼화성 폴리리보뉴클레오티드를 생성한다.In an embodiment, the deoxyribonucleotide template is transcribed to produce linear RNA containing the components described herein. Upon expression, linear polyribonucleotides generate splicing-miscible polyribonucleotides that can self-splice to produce circular polyribonucleotides.
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 50 내지 20,000개, 100 내지 20,000개, 200 내지 20,000개, 300 내지 20,000개(예를 들어, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,100, 1,200, 1,300, 1,400, 1,500, 1,600, 1,700, 1,800, 1,900, 2,000, 2,500, 3,000, 3,500, 4,000, 5,000, 6,000, 7,000, 8,000, 9,000, 10,000, 11,000, 12,000, 13,000, 14,000, 15,000, 16,000, 17,000, 18,000, 19,000, 또는 20,000개)의 리보뉴클레오티드의 길이를 갖는다. 실시 형태에서, 선형 폴리리보뉴클레오티드는 예를 들어, 적어도 500개, 적어도 1,000개, 적어도 2,000개, 적어도 3,000개, 적어도 4,000개, 또는 적어도 5,000개의 리보뉴클레오티드의 길이를 갖는다.In some embodiments, the linear polyribonucleotides are 50 to 20,000, 100 to 20,000, 200 to 20,000, 300 to 20,000 (e.g., 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,100, 1,200, 1,300, 1,400, 1,500, 1,600, 1,700, 1,800, 1,900, 2,000, 2,500, 3,000, 3,500, 4,000, 5,000, 6,000, 7,000, 8,000, 9,000, 10,000, 11,000, 12,000, 13,000, 14,000, 15,000, 16,000, 17,000, 18,000, 19,000, or 20,000 ribonucleotides in length. In an embodiment, the linear polyribonucleotide has a length of, for example, at least 500, at least 1,000, at least 2,000, at least 3,000, at least 4,000, or at least 5,000 ribonucleotides.
원형 폴리리보뉴클레오티드circular polyribonucleotide
일부 실시 형태에서, 본 발명은 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함하는 원형 폴리리보뉴클레오티드를 특징으로 한다. 실시 형태에서, 폴리리보뉴클레오티드는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열에 작동가능하게 연결된 IRES를 포함한다. 원형 폴리리보뉴클레오티드는 예를 들어, 5' 엑손 단편 및 3' 엑손 단편을 연결하는 스플라이스 접합부를 포함할 수 있다. 원형 폴리리보뉴클레오티드는 본원에 기재된 요소 중 임의의 하나 이상을 포함할 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호에 개시된 바와 같은 임의의 특징 또는 특징의 임의의 조합을 포함한다.In some embodiments, the invention features circular polyribonucleotides comprising an expression sequence encoding an antifusogenic polypeptide. In an embodiment, the polyribonucleotide comprises an IRES operably linked to an expression sequence encoding an antifusogenic polypeptide. A circular polyribonucleotide may include, for example, a splice junction connecting a 5' exon fragment and a 3' exon fragment. Circular polyribonucleotides may include any one or more of the elements described herein. In some embodiments, the circular polyribonucleotide comprises any feature or any combination of features as disclosed in International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
실시 형태에서, 원형 폴리뉴클레오티드는 폴리리보뉴클레오티드 카고를 추가로 포함한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 발현(또는 코딩) 서열, 비-코딩 서열, 또는 발현(코딩) 서열 및 비-코딩 서열의 조합을 포함한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 폴리펩티드를 인코딩하는 발현(코딩) 서열을 포함한다. 실시 형태에서, 폴리리보뉴클레오티드는 폴리펩티드를 인코딩하는 발현 서열에 작동가능하게 연결된 IRES를 포함한다. 일부 실시 형태에서, IRES는 발현 서열의 상류에 위치한다. 일부 실시 형태에서, IRES는 발현 서열의 하류에 위치한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 IRES와 3' 엑손 단편 또는 5' 엑손 단편 사이에 스페이서 영역을 추가로 포함한다. 스페이서 영역은 예를 들어, 적어도 5개(예를 들어, 적어도 10개, 적어도 15개, 적어도 20개)의 리보뉴클레오티드의 길이를 리보뉴클레오티드의 길이를 가질 수 있다. 스페이서 영역은 예를 들어, 5 내지 500개(예를 들어, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 또는 500개)의 리보뉴클레오티드일 수 있다. 일부 실시 형태에서, 스페이서 영역은 폴리A 서열을 포함한다. 일부 실시 형태에서, 스페이서 영역은 폴리A-C 서열을 포함한다. 일부 실시 형태에서, 스페이서 영역은 폴리A-G 서열을 포함한다. 일부 실시 형태에서, 스페이서 영역은 폴리A-T 서열을 포함한다. 일부 실시 형태에서, 스페이서 영역은 무작위 서열을 포함한다. 일부 실시 형태에서, 제1 어닐링 영역 및 제2 어닐링 영역은 연결되고, 그에 의해 원형 폴리리보뉴클레오티드를 형성한다.In an embodiment, the circular polynucleotide further comprises a polyribonucleotide cargo. In an embodiment, the polyribonucleotide cargo comprises expression (or coding) sequences, non-coding sequences, or a combination of expression (coding) sequences and non-coding sequences. In an embodiment, the polyribonucleotide cargo comprises an expression (coding) sequence encoding a polypeptide. In an embodiment, the polyribonucleotide comprises an IRES operably linked to an expression sequence encoding the polypeptide. In some embodiments, the IRES is located upstream of the expression sequence. In some embodiments, the IRES is located downstream of the expression sequence. In some embodiments, the circular polyribonucleotide further comprises a spacer region between the IRES and the 3' exon fragment or the 5' exon fragment. The spacer region may have a length of, for example, at least 5 (e.g., at least 10, at least 15, or at least 20) ribonucleotides. The spacer regions may be, for example, 5 to 500 (e.g., 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, or 500) ribonucleotides. In some embodiments, the spacer region comprises a polyA sequence. In some embodiments, the spacer region comprises a polyA-C sequence. In some embodiments, the spacer region comprises a polyA-G sequence. In some embodiments, the spacer region comprises a polyA-T sequence. In some embodiments, the spacer region comprises a random sequence. In some embodiments, the first anneal region and the second anneal region are joined, thereby forming a circular polyribonucleotide.
일부 실시 형태에서, 원형 RNA는 본원에 기재된 데옥시리보뉴클레오티드 주형 또는 선형 RNA에 의해 생성된다. 일부 실시 형태에서, 원형 RNA는 본원에 기재된 방법 중 임의의 것에 의해 생성된다.In some embodiments, circular RNA is produced by a deoxyribonucleotide template or linear RNA described herein. In some embodiments, circular RNA is produced by any of the methods described herein.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 적어도 약 20개의 뉴클레오티드, 적어도 약 30개의 뉴클레오티드, 적어도 약 40개의 뉴클레오티드, 적어도 약 50개의 뉴클레오티드, 적어도 약 75개의 뉴클레오티드, 적어도 약 100개의 뉴클레오티드, 적어도 약 200개의 뉴클레오티드, 적어도 약 300개의 뉴클레오티드, 적어도 약 400개의 뉴클레오티드, 적어도 약 500개의 뉴클레오티드, 적어도 약 1,000개의 뉴클레오티드, 적어도 약 2,000개의 뉴클레오티드, 적어도 약 5,000개의 뉴클레오티드, 적어도 약 6,000개의 뉴클레오티드, 적어도 약 7,000개의 뉴클레오티드, 적어도 약 8,000개의 뉴클레오티드, 적어도 약 9,000개의 뉴클레오티드, 적어도 약 10,000개의 뉴클레오티드, 적어도 약 12,000개의 뉴클레오티드, 적어도 약 14,000개의 뉴클레오티드, 적어도 약 15,000개의 뉴클레오티드, 적어도 약 16,000개의 뉴클레오티드, 적어도 약 17,000개의 뉴클레오티드, 적어도 약 18,000개의 뉴클레오티드, 적어도 약 19,000개의 뉴클레오티드, 또는 적어도 약 20,000개의 뉴클레오티드이다.In some embodiments, the circular polyribonucleotide is at least about 20 nucleotides, at least about 30 nucleotides, at least about 40 nucleotides, at least about 50 nucleotides, at least about 75 nucleotides, at least about 100 nucleotides, at least about 200 nucleotides. nucleotides, at least about 300 nucleotides, at least about 400 nucleotides, at least about 500 nucleotides, at least about 1,000 nucleotides, at least about 2,000 nucleotides, at least about 5,000 nucleotides, at least about 6,000 nucleotides, at least about 7,000 nucleotides, at least about 8,000 nucleotides, at least about 9,000 nucleotides, at least about 10,000 nucleotides, at least about 12,000 nucleotides, at least about 14,000 nucleotides, at least about 15,000 nucleotides, at least about 16,000 nucleotides, at least about 17,000 nucleotides, at least about 18,000 nucleotides, at least about 19,000 nucleotides, or at least about 20,000 nucleotides.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 500개의 뉴클레오티드 내지 20,000개의 뉴클레오티드, 1,000개 내지 20,000개의 뉴클레오티드, 2,000개 내지 20,000개의 뉴클레오티드, 또는 5,000개 내지 20,000개의 뉴클레오티드이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 500개의 뉴클레오티드 내지 10,000개의 뉴클레오티드, 1,000개 내지 10,000개의 뉴클레오티드, 2,000개 내지 10,000개의 뉴클레오티드, 또는 5,000개 내지 10,000개의 뉴클레오티드이다.In some embodiments, the circular polyribonucleotide is 500 nucleotides to 20,000 nucleotides, 1,000 to 20,000 nucleotides, 2,000 to 20,000 nucleotides, or 5,000 to 20,000 nucleotides. In some embodiments, the circular polyribonucleotide is 500 nucleotides to 10,000 nucleotides, 1,000 to 10,000 nucleotides, 2,000 to 10,000 nucleotides, or 5,000 to 10,000 nucleotides.
원형 폴리리보뉴클레오티드는 원형화의 결과로서, 선형 RNA와 구별되는 특정 특징을 포함할 수 있다. 예를 들어, 원형 폴리리보뉴클레오티드는 선형 RNA와 비교하여 엑소뉴클레아제에 의한 분해에 덜 감수성이다. 따라서, 원형 폴리리보뉴클레오티드는, 특히 엑소뉴클레아제의 존재 하에서 인큐베이션되는 경우, 선형 RNA보다 더 안정하다. 선형 RNA와 비교하여 원형 폴리리보뉴클레오티드의 증가된 안정성은 원형 폴리리보뉴클레오티드를 폴리펩티드를 생성하기 위한 세포 형질전환 시약으로서 더 유용하게 만들고, 선형 RNA보다 더 용이하게 및 더 오랫동안 저장될 수 있다. 엑소뉴클레아제로 처리된 원형 폴리리보뉴클레오티드의 안정성은 RNA 분해가 발생하였는지 여부를 결정하는 당업계의 표준 방법을 사용하여(예를 들어, 겔 전기영동에 의해) 테스트될 수 있다. 더욱이, 선형 RNA와는 달리, 원형 폴리리보뉴클레오티드는, 원형 폴리리보뉴클레오티드가 포스파타제, 예컨대 송아지 장 포스파타제와 인큐베이션되는 경우, 탈인산화에 덜 감수성이다.Circular polyribonucleotides, as a result of circularization, may contain certain characteristics that distinguish them from linear RNA. For example, circular polyribonucleotides are less susceptible to degradation by exonucleases compared to linear RNA. Therefore, circular polyribonucleotides are more stable than linear RNA, especially when incubated in the presence of exonucleases. The increased stability of circular polyribonucleotides compared to linear RNA makes circular polyribonucleotides more useful as cell transformation reagents for producing polypeptides and can be stored more easily and for longer periods than linear RNA. The stability of exonuclease-treated circular polyribonucleotides can be tested using standard methods in the art to determine whether RNA degradation has occurred (e.g., by gel electrophoresis). Moreover, unlike linear RNA, circular polyribonucleotides are less susceptible to dephosphorylation when circular polyribonucleotides are incubated with phosphatases, such as calf intestinal phosphatase.
본원에 기재된 원형 폴리리보뉴클레오티드 및 이의 조성물 또는 약제학적 조성물은 복수의 세포에 적어도 2회 용량의 원형 폴리리보뉴클레오티드를 제공한 후에, 복수의 세포 내 원형 폴리리보뉴클레오티드 수준, 표적에 대한 결합 수준, 또는 단백질 수준을 생성하기 위한 치료적 및 수의학적 투여 방법에 사용될 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 포유류, 예를 들어, 인간에서 비면역원성이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 양식 동물(어류, 게, 새우, 굴 등)로부터의 세포, 포유동물 세포, 예를 들어, 애완 동물 또는 동물원 동물(고양이, 개, 도마뱀, 조류, 사자, 호랑이 및 곰 등)로부터의 세포, 농장 또는 작업 동물(말, 소, 돼지, 닭 등)로부터의 세포, 인간 세포, 배양 세포, 1차 세포 또는 세포주, 줄기 세포, 전구 세포, 분화 세포, 생식 세포, 암 세포(예를 들어, 종양형성, 전이성), 비-종양형성 세포(정상 세포), 태아 세포, 배아 세포, 성체 세포, 유사분열 세포, 비-유사분열 세포, 또는 이들의 임의의 조합으로부터 복제될 수 있거나 복제된다. 일부 실시 형태에서, 본 발명은 본원에 기재된 원형 폴리리보뉴클레오티드를 포함하는 세포를 포함하며, 여기서 세포는 양식 동물(어류, 게, 새우, 굴 등)로부터의 세포, 포유동물 세포, 예를 들어, 애완 동물 또는 동물원 동물(고양이, 개, 도마뱀, 조류, 사자, 호랑이 및 곰 등)로부터의 세포, 농장 또는 작업 동물(말, 소, 돼지, 닭 등)로부터의 세포, 인간 세포, 배양 세포, 1차 세포 또는 세포주, 줄기 세포, 전구 세포, 분화 세포, 생식 세포, 암 세포(예를 들어, 종양형성, 전이성), 비-종양형성 세포(정상 세포), 태아 세포, 배아 세포, 성체 세포, 유사분열 세포, 비-유사분열 세포, 또는 이들의 임의의 조합이다. 일부 실시 형태에서, 세포는 원형 폴리리보뉴클레오티드를 포함하도록 변형된다.The circular polyribonucleotides and compositions or pharmaceutical compositions described herein may, after providing at least two doses of the circular polyribonucleotide to a plurality of cells, determine the level of the circular polyribonucleotide in the plurality of cells, the level of binding to the target, or It can be used in therapeutic and veterinary administration methods to produce protein levels. In some embodiments, the circular polyribonucleotide is non-immunogenic in mammals, such as humans. In some embodiments, the circular polyribonucleotide is used in cells from farmed animals (fish, crab, shrimp, oysters, etc.), mammalian cells, such as pets or zoo animals (cats, dogs, lizards, birds, lions, etc.) cells from farm or working animals (horses, cows, pigs, chickens, etc.), human cells, cultured cells, primary cells or cell lines, stem cells, progenitor cells, differentiated cells, germ cells , cancer cells (e.g., tumorigenic, metastatic), non-tumorigenic cells (normal cells), fetal cells, embryonic cells, adult cells, mitotic cells, non-mitotic cells, or any combination thereof. Can be or is copied. In some embodiments, the invention includes cells comprising circular polyribonucleotides described herein, wherein the cells are cells from farmed animals (fish, crab, shrimp, oysters, etc.), mammalian cells, e.g. Cells from pet or zoo animals (such as cats, dogs, lizards, birds, lions, tigers and bears), cells from farm or working animals (such as horses, cows, pigs, chickens), human cells, cultured cells, 1 Primary cells or cell lines, stem cells, progenitor cells, differentiated cells, germ cells, cancer cells (e.g. tumorigenic, metastatic), non-tumorigenic cells (normal cells), fetal cells, embryonic cells, adult cells, similar dividing cells, non-mitotic cells, or any combination thereof. In some embodiments, the cells are modified to contain circular polyribonucleotides.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 발현 생성물에 대한 서열을 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 표적에 결합하기 위한 결합 부위를 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 본원에 기재된 임의의 투여 양생법을 통해 복수의 세포에 제공된다. 일부 실시 형태에서, 본원에 기재된 원형 폴리리보뉴클레오티드는 대상체에서의 반응 또는 반응 수준을 유도한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드에 포함된 서열에 의해 인코딩된 발현 생성물은 복수의 세포 중 하나 이상의 세포에서 발현된다.In some embodiments, the circular polyribonucleotide comprises a sequence for the expression product. In some embodiments, the circular polyribonucleotide includes a binding site for binding to a target. In some embodiments, circular polyribonucleotides are provided to a plurality of cells via any of the administration regimens described herein. In some embodiments, circular polyribonucleotides described herein induce a response or level of response in a subject. In some embodiments, the expression product encoded by a sequence comprised in a circular polyribonucleotide is expressed in one or more cells of a plurality of cells.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 적어도 선형 대응물, 예를 들어, 선형 발현 서열 또는 선형 폴리리보뉴클레오티드의 반감기를 갖는다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 선형 대응물의 반감기보다 증가된 반감기를 갖는다. 일부 실시 형태에서, 반감기는 약 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 또는 그 초과만큼 증가된다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 세포에서 적어도 약 1시간, 예를 들어, 적어도 2시간, 3시간, 4시간, 5시간 6시간, 12시간, 24시간, 1일, 2일, 3일, 4일, 5일, 6일, 7일, 2주, 3주, 4주, 2개월, 3개월, 6개월, 또는 그 초과 동안의 반감기 또는 지속성을 갖는다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 세포에서 약 1시간 내지 약 60일, 예를 들어, 약 1시간, 2시간, 6시간, 12시간, 18시간, 24시간, 2일, 3일, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일, 14일, 15일, 16일, 17일, 18일, 19일, 20일, 21일, 22일, 23일, 24일, 25일, 26일, 27일, 28일, 29일, 30일, 35일, 40일, 45일, 50일, 55일, 또는 60일 동안의 반감기 또는 지속성을 갖는다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 세포가 분열하는 동안 세포에서 반감기 또는 지속성을 갖는다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 분열 후 세포에서 반감기 또는 지속성을 갖는다. 특정 실시 형태에서, 원형 폴리리보뉴클레오티드는 분열 세포에서 적어도 약 10분, 예를 들어, 적어도 약 1시간, 예를 들어 적어도 2시간, 3시간, 4시간, 5시간 6시간, 12시간, 24시간, 1일, 2일, 3일, 4일, 5일, 6일, 7일, 2주, 3주, 4주, 2개월, 3개월, 6개월, 또는 그 초과 동안의 반감기 또는 지속성을 갖는다. 특정 실시 형태에서, 원형 폴리리보뉴클레오티드는 분열 세포에서 약 10분 내지 약 60일, 예를 들어, 약 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 24시간, 2일, 3일, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일, 14일, 15일, 16일, 17일, 18일, 19일, 20일, 21일, 22일, 23일, 24일, 25일, 26일, 27일, 28일, 29일, 30일, 또는 60일의 반감기 또는 지속성을 갖는다.In some embodiments, the circular polyribonucleotide has at least the half-life of its linear counterpart, e.g., a linear expression sequence or a linear polyribonucleotide. In some embodiments, circular polyribonucleotides have an increased half-life over that of their linear counterparts. In some embodiments, the half-life is increased by about 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, or more. In some embodiments, the circular polyribonucleotide is in the cell for at least about 1 hour, e.g., at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 12 hours, 24 hours, 1 day, 2 days, 3 days. , has a half-life or persistence of 4 days, 5 days, 6 days, 7 days, 2 weeks, 3 weeks, 4 weeks, 2 months, 3 months, 6 months, or more. In some embodiments, the circular polyribonucleotide remains in the cell for about 1 hour to about 60 days, e.g., about 1 hour, 2 hours, 6 hours, 12 hours, 18 hours, 24 hours, 2 days, 3 days, 4 days. 1st, 5th, 6th, 7th, 8th, 9th, 10th, 11th, 12th, 13th, 14th, 15th, 16th, 17th, 18th, 19th, 20th, for 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, or 60 days. It has a half-life or persistence. In some embodiments, the circular polyribonucleotide has a half-life or persistence in the cell while the cell divides. In some embodiments, the circular polyribonucleotide has a half-life or persistence in the cell after division. In certain embodiments, the circular polyribonucleotide is incubated in dividing cells for at least about 10 minutes, such as at least about 1 hour, such as at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 12 hours, 24 hours. , has a half-life or persistence of 1 day, 2 days, 3 days, 4 days, 5 days, 6 days, 7 days, 2 weeks, 3 weeks, 4 weeks, 2 months, 3 months, 6 months, or more. . In certain embodiments, circular polyribonucleotides are cultured in dividing cells for about 10 minutes to about 60 days, e.g., about 1 hour, 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 24 hours, 2 days, 3 days, 4 days, 5 days, 6 days, 7 days , 8th, 9th, 10th, 11th, 12th, 13th, 14th, 15th, 16th, 17th, 18th, 19th, 20th, 21st, 22nd, 23rd, 24th It has a half-life or duration of 1, 25, 26, 27, 28, 29, 30, or 60 days.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 세포 기능을, 예를 들어, 일시적으로 또는 장기간 조절한다. 특정 실시 형태에서, 세포 기능은 적어도 약 10분, 예를 들어, 적어도 약 1시간, 예를 들어, 적어도 2시간, 3시간, 4시간, 5시간 6시간, 12시간, 24시간, 1일, 2일, 3일, 4일, 5일, 6일, 7일, 2주, 3주, 4주, 2개월, 3개월, 6개월, 또는 그 초과 동안 지속되는 조절과 같이 안정적으로 변경된다. 특정 실시 형태에서, 세포 기능은 약 1시간 내지 약 60일, 예를 들어, 약 1시간 내지 약 30일 동안, 예를 들어, 적어도 약 2시간, 6시간, 12시간, 18시간, 24시간, 2일, 3일, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일, 14일, 15일, 16일, 17일, 18일, 19일, 20일, 21일, 22일, 23일, 24일, 25일, 26일, 27일, 28일, 29일, 30일, 또는 60일 동안 지속되는 조절과 같이 안정적으로 변경된다.In some embodiments, the circular polyribonucleotide modulates cellular function, e.g., temporarily or long-term. In certain embodiments, the cellular function is maintained for at least about 10 minutes, such as at least about 1 hour, such as at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 12 hours, 24 hours, 1 day, The change is stable, such that the adjustment lasts for 2 days, 3 days, 4 days, 5 days, 6 days, 7 days, 2 weeks, 3 weeks, 4 weeks, 2 months, 3 months, 6 months, or more. In certain embodiments, the cellular function is maintained for from about 1 hour to about 60 days, e.g., for about 1 hour to about 30 days, e.g., at least about 2 hours, 6 hours, 12 hours, 18 hours, 24 hours, 2nd, 3rd, 4th, 5th, 6th, 7th, 8th, 9th, 10th, 11th, 12th, 13th, 14th, 15th, 16th, 17th, 18th , changes reliably, with adjustments lasting 19 days, 20 days, 21 days, 22 days, 23 days, 24 days, 25 days, 26 days, 27 days, 28 days, 29 days, 30 days, or 60 days. .
폴리뉴클레오티드의 요소elements of polynucleotides
본원에 기재된 폴리뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드)는 본원에 기재된 요소 중 임의의 하나 이상 및 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함할 수 있다.A polynucleotide (e.g., a circular polyribonucleotide) described herein may comprise any one or more of the elements described herein and an expression sequence encoding an antifusogenic polypeptide.
항푸소제닉 폴리펩티드Antifusogenic polypeptide
본 개시내용은 항푸소제닉 폴리펩티드를 인코딩하는 적어도 하나의 발현 서열을 인코딩하는 원형 폴리리보뉴클레오티드를 제공한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 바이러스 진입을 억제한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 바이러스 융합을 억제한다.The present disclosure provides circular polyribonucleotides encoding at least one expression sequence encoding an antifusogenic polypeptide. In some embodiments, the antifusogenic polypeptide inhibits viral entry. In some embodiments, the antifusogenic polypeptide inhibits viral fusion.
일부 실시 형태에서, 항푸소제닉 폴리펩티드는 표 1의 서열로부터 선택된 아미노산 서열을 포함하는 폴리펩티드 또는 이의 변이체이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 표 1의 서열의 적어도 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 또는 100개의 아미노산이 인접해 있는 구간을 포함하는 폴리펩티드이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 표 1의 서열의 적어도 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 또는 95%의 아미노산이 인접해 있는 구간을 포함하는 폴리펩티드이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 표 1의 서열과 적어도 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99%의 서열 동일성을 갖는 서열을 포함하는 폴리펩티드이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개 이하의 돌연변이(예를 들어, 치환, 결실 또는 삽입)를 포함하는 표 1의 서열의 변이체이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 초과의 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 하나 초과의 융합 단백질을 인코딩하는 원형 폴리리보뉴클레오티드는 바이러스 탈출의 기회를 감소시킨다.In some embodiments, the antifusogenic polypeptide is a polypeptide comprising an amino acid sequence selected from the sequences in Table 1, or a variant thereof. In some embodiments, the antifusogenic polypeptide is at least 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, of the sequence in Table 1. Or, it is a polypeptide containing a section of 100 adjacent amino acids. In some embodiments, the antifusogenic polypeptide is at least 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85 of the sequence in Table 1. It is a polypeptide containing a segment where %, 90%, or 95% of the amino acids are contiguous. In some embodiments, the antifusogenic polypeptide is at least 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, or 99% of the sequence in Table 1. It is a polypeptide containing a sequence with sequence identity. In some embodiments, the antifusogenic polypeptide is as defined in Table 1 comprising no more than 1, 2, 3, 4, 5, 6, 7, 8, 9, or 10 mutations (e.g., substitutions, deletions, or insertions). It is a variant of the sequence of . In some embodiments, the circular polyribonucleotide comprises an expression sequence encoding more than one antifusogenic polypeptide. In some embodiments, circular polyribonucleotides encoding more than one fusion protein reduce the chance of viral escape.
일부 실시 형태에서, 항푸소제닉 폴리펩티드는 하나 이상(예를 들어, 2개, 3개, 4개, 또는 5개)의 바이러스를 표적으로 한다. 항푸소제닉 폴리펩티드에 의해 표적화될 수 있는 바이러스는 표 1에 나열된 바이러스의 모든 균주를 포함하지만, 이에 한정되는 것은 아니다. 일부 실시 형태에서, 바이러스는 인간을 감염시키지 않는다. 일부 실시 형태에서, 바이러스는 인간을 감염시킨다.In some embodiments, the antifusogenic polypeptide targets one or more (e.g., 2, 3, 4, or 5) viruses. Viruses that can be targeted by antifusogenic polypeptides include, but are not limited to, all strains of viruses listed in Table 1. In some embodiments, the virus does not infect humans. In some embodiments, the virus infects humans.
표 1. 예시적인 항푸소제닉 폴리펩티드Table 1. Exemplary antifusogenic polypeptides
일부 실시 형태에서, 바이러스는 인간 면역결핍 바이러스(HIV)이다(예를 들어, 항푸소제닉 폴리펩티드는 HIV의 바이러스 진입을 억제한다). 일부 실시 형태에서, HIV는 HIV-1이다. 일부 실시 형태에서, HIV는 HIV-1의 균주(예를 들어, HIV-1HE, HIV-1IIIB, HIV-1MN, HIV-1NDK,HIV-1NL4-3,HIV-1RF, 또는 HIV-1SF2)이다. 일부 실시 형태에서, HIV는 HIV-2이다. 일부 실시 형태에서, HIV는 HIV-2의 균주(예를 들어, HIV-2EHO 또는 HIV-2ROD)이다. 일부 실시 형태에서, HIV는 HIV 슈도비리온이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 HIV 당단백질 120(gp120)에 특이적으로 결합함으로써 HIV 바이러스 융합을 예방한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 gp120이 분화 4 클러스터(CD4) 공동 수용체에 결합하는 것을 예방한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 공동 수용체(예를 들어, C-C 케모카인 수용체 유형 5(CCR5) 및 C-X-C 케모카인 수용체 유형 4(CXCR4))에 대한 gp120의 친화도를 감소시킨다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 gp120이 공동 수용체(예를 들어, CCR5 및 CXCR4)에 결합하는 것을 예방한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 HIV 당단백질 41(gp41)에 특이적으로 결합함으로써 HIV 바이러스 융합을 예방한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 HIV 바이러스 코어가 세포로 진입하는 것을 억제한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 1, 5, 11, 13 내지 18, 22 내지 38, 40 내지 46, 49 내지 56, 58, 59, 61, 66 내지 78, 80 내지 85, 87 내지 91, 95 내지 100, 112, 113, 153, 163, 64, 168, 169, 171 내지 184, 211 내지 215, 242, 243, 247, 255, 256, 258, 261, 261, 265, 267, 271, 272, 274, 276, 286, 287, 또는 312 내지 324 중 어느 하나의 폴리펩티드(예를 들어, HIV의 바이러스 진입을 억제하는 폴리펩티드)를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 1, 5, 11, 13 내지 18, 22 내지 38, 40 내지 46, 49 내지 56, 58, 59, 61, 66 내지 78, 80 내지 85, 87 내지 91, 95 내지 100, 112, 113, 153, 163, 64, 168, 169, 171 내지 184, 211 내지 215, 242, 243, 247, 255, 256, 258, 261, 261, 265, 267, 271, 272, 274, 276, 286, 287, 또는 312 내지 324 중 어느 하나의 폴리펩티드와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In some embodiments, the virus is human immunodeficiency virus (HIV) (e.g., the antifusogenic polypeptide inhibits viral entry of HIV). In some embodiments, the HIV is HIV-1. In some embodiments, the HIV is a strain of HIV-1 (e.g., HIV-1HE , HIV-1IIIB, HIV-1MN , HIV-1NDK, HIV-1NL4-3, HIV-1RF , or HIV-1SF2 ). In some embodiments, the HIV is HIV-2. In some embodiments, the HIV is a strain of HIV-2 (e.g., HIV-2EHO or HIV-2ROD ). In some embodiments, the HIV is an HIV pseudovirion. In some embodiments, the antifusogenic polypeptide prevents HIV virus fusion by specifically binding to HIV glycoprotein 120 (gp120). In some embodiments, the antifusogenic polypeptide prevents gp120 from binding to the cluster of differentiation 4 (CD4) coreceptor. In some embodiments, the antifusogenic polypeptide reduces the affinity of gp120 for coreceptors (e.g., CC chemokine receptor type 5 (CCR5) and CXC chemokine receptor type 4 (CXCR4)). In some embodiments, the antifusogenic polypeptide prevents gp120 from binding to coreceptors (e.g., CCR5 and CXCR4). In some embodiments, the antifusogenic polypeptide prevents HIV virus fusion by specifically binding to HIV glycoprotein 41 (gp41). In some embodiments, the antifusogenic polypeptide inhibits entry of the HIV viral core into cells. In some embodiments, the polyribonucleotide cargo is SEQ ID NO: 1, 5, 11, 13-18, 22-38, 40-46, 49-56, 58, 59, 61, 66-78, 80-85, 87 to 91, 95 to 100, 112, 113, 153, 163, 64, 168, 169, 171 to 184, 211 to 215, 242, 243, 247, 255, 256, 258, 261, 261, 265, 267, and an expression sequence encoding any one of polypeptides 271, 272, 274, 276, 286, 287, or 312 to 324 (e.g., a polypeptide that inhibits viral entry of HIV). In some embodiments, the polyribonucleotide cargo is SEQ ID NO: 1, 5, 11, 13-18, 22-38, 40-46, 49-56, 58, 59, 61, 66-78, 80-85, 87 to 91, 95 to 100, 112, 113, 153, 163, 64, 168, 169, 171 to 184, 211 to 215, 242, 243, 247, 255, 256, 258, 261, 261, 265, 267, At least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity to any of the polypeptides of 271, 272, 274, 276, 286, 287, or 312 to 324. and an expression sequence encoding a polypeptide having.
일부 실시 형태에서, 바이러스는 간염 바이러스이다(예를 들어, 항푸소제닉 폴리펩티드는 간염 바이러스의 바이러스 진입을 억제한다). 일부 실시 형태에서, 간염 바이러스는 A형 간염 바이러스(HAV)이다. 일부 실시 형태에서, 간염 바이러스는 B형 간염 바이러스(HBV)이다. 일부 실시 형태에서, 간염 바이러스는 C형 간염 바이러스(HCV)이다. 일부 실시 형태에서, 간염 바이러스는 D형 간염 바이러스(HDV)이다. 일부 실시 형태에서, 간염 바이러스는 E형 간염 바이러스(HEV)이다. 일부 실시 형태에서, 간염 바이러스는 오리 간염 바이러스(DHV)이다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 104, 109, 112, 113, 141 내지 145, 158 내지 160, 또는 284 중 어느 하나의 폴리펩티드(예를 들어, HCV와 같은 간염 바이러스의 바이러스 진입을 억제하는 폴리펩티드)를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 104, 109, 112, 113, 141 내지 145, 158 내지 160, 또는 284 중 어느 하나의 폴리펩티드와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In some embodiments, the virus is a hepatitis virus (e.g., the antifusogenic polypeptide inhibits viral entry of a hepatitis virus). In some embodiments, the hepatitis virus is hepatitis A virus (HAV). In some embodiments, the hepatitis virus is hepatitis B virus (HBV). In some embodiments, the hepatitis virus is hepatitis C virus (HCV). In some embodiments, the hepatitis virus is hepatitis D virus (HDV). In some embodiments, the hepatitis virus is hepatitis E virus (HEV). In some embodiments, the hepatitis virus is duck hepatitis virus (DHV). In some embodiments, the polyribonucleotide cargo is a polypeptide of any one of SEQ ID NO: 104, 109, 112, 113, 141-145, 158-160, or 284 (e.g., viral entry of a hepatitis virus such as HCV) It contains an expression sequence encoding a polypeptide that inhibits. In some embodiments, the polyribonucleotide cargo is at least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity.
일부 실시 형태에서, 바이러스는 코로나바이러스, 예컨대 베타코로나바이러스이다(예를 들어, 항푸소제닉 폴리펩티드는 코로나바이러스의 바이러스 진입을 억제한다). 일부 실시 형태에서, 베타코로나바이러스는 SARS-CoV 1형(SARS-CoV-1)이다. 일부 실시 형태에서, 베타코로나바이러스는 SARS-CoV 2형(SARS-CoV-2)이다. 일부 실시 형태에서, 베타코로나바이러스는 SARS-CoV-2 스파이크 단백질을 발현시키는 슈도타입화된 바이러스이다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 6 내지 9, 119 내지 123, 165 내지 167, 또는 288 내지 311 중 어느 하나의 폴리펩티드(예를 들어, SARS-CoV-1 또는 SARS-CoV-2와 같은 베타코로나바이러스의 바이러스 진입을 억제하는 폴리펩티드)를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 6 내지 9, 119 내지 123, 165 내지 167, 또는 288 내지 311 중 어느 하나의 폴리펩티드와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In some embodiments, the virus is a coronavirus, such as a betacoronavirus (e.g., the antifusogenic polypeptide inhibits viral entry of a coronavirus). In some embodiments, the betacoronavirus is SARS-CoV type 1 (SARS-CoV-1). In some embodiments, the betacoronavirus is SARS-CoV type 2 (SARS-CoV-2). In some embodiments, the betacoronavirus is a pseudotyped virus that expresses the SARS-CoV-2 spike protein. In some embodiments, the polyribonucleotide cargo is a polypeptide of any one of SEQ ID NO: 6 to 9, 119 to 123, 165 to 167, or 288 to 311 (e.g., SARS-CoV-1 or SARS-CoV- It contains an expression sequence encoding a polypeptide that inhibits viral entry of betacoronaviruses, such as 2. In some embodiments, the polyribonucleotide cargo is at least 85% (e.g., at least 90%, 95%) identical to the polypeptide of any one of SEQ ID NOs: 6 to 9, 119 to 123, 165 to 167, or 288 to 311. , 97%, 99%, or 100%) sequence identity.
일부 실시 형태에서, 바이러스는 호흡기 세포융합 바이러스(RSV)이다(예를 들어, 항푸소제닉 폴리펩티드는 RSV의 바이러스 진입을 억제한다). 일부 실시 형태에서, RSV는 RSV 서브타입 A(RSVA)이다. 일부 실시 형태에서, RSV는 RSV 서브타입 B(RSVB)이다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 11, 13, 39, 112, 113, 153, 185 내지 188, 216 내지 219, 244, 246, 247 내지 249, 251, 252, 257, 259, 264, 266, 268, 270, 273, 282, 또는 285 중 어느 하나의 폴리펩티드(예를 들어, RSV의 바이러스 진입을 억제하는 폴리펩티드)를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 11, 13, 39, 112, 113, 153, 185 내지 188, 216 내지 219, 244, 246, 247 내지 249, 251, 252, 257, 259, 264, 266, 268, 270, 273, 282, 또는 285 중 어느 하나의 폴리펩티드와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In some embodiments, the virus is respiratory syncytial virus (RSV) (e.g., the antifusogenic polypeptide inhibits viral entry of RSV). In some embodiments, the RSV is RSV subtype A (RSVA). In some embodiments, RSV is RSV subtype B (RSVB). In some embodiments, the polyribonucleotide cargo is SEQ ID NO: 11, 13, 39, 112, 113, 153, 185 to 188, 216 to 219, 244, 246, 247 to 249, 251, 252, 257, 259, and an expression sequence encoding any one of 264, 266, 268, 270, 273, 282, or 285 (e.g., a polypeptide that inhibits viral entry of RSV). In some embodiments, the polyribonucleotide cargo is SEQ ID NO: 11, 13, 39, 112, 113, 153, 185 to 188, 216 to 219, 244, 246, 247 to 249, 251, 252, 257, 259, A polypeptide having at least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity with any of the polypeptides of 264, 266, 268, 270, 273, 282, or 285. It contains an expression sequence encoding.
일부 실시 형태에서, 바이러스는 인플루엔자(예를 들어, 계절성 인플루엔자, 유행성 인플루엔자, 인플루엔자 A, 인플루엔자 H1N1 서브타입, 인플루엔자 B, 인플루엔자 C, 인플루엔자 D)이다. 일부 실시 형태에서, 인플루엔자는 인플루엔자 A이다. 일부 실시 형태에서, 인플루엔자는 인플루엔자 B이다. 일부 실시 형태에서, 인플루엔자는 인플루엔자 C이다. 일부 실시 형태에서, 인플루엔자는 인플루엔자 D이다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 1, 4, 11, 245, 247, 253, 262, 269, 275, 277, 278, 279, 280, 281, 또는 283 중 어느 하나의 폴리펩티드(예를 들어, 인플루엔자의 바이러스 진입을 억제하는 폴리펩티드)를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 SEQ ID NO: 1, 4, 11, 245, 247, 253, 262, 269, 275, 277, 278, 279, 280, 281, 또는 283 중 어느 하나의 폴리펩티드와 적어도 85%(예를 들어, 적어도 90%, 95%, 97%, 99%, 또는 100%) 서열 동일성을 갖는 폴리펩티드를 인코딩하는 발현 서열을 포함한다.In some embodiments, the virus is influenza (e.g., seasonal influenza, pandemic influenza, influenza A, influenza H1N1 subtype, influenza B, influenza C, influenza D). In some embodiments, the influenza is influenza A. In some embodiments, the influenza is influenza B. In some embodiments, the influenza is influenza C. In some embodiments, the influenza is influenza D. In some embodiments, the polyribonucleotide cargo is a polypeptide of any one of SEQ ID NO: 1, 4, 11, 245, 247, 253, 262, 269, 275, 277, 278, 279, 280, 281, or 283 ( For example, a polypeptide that inhibits viral entry of influenza). In some embodiments, the polyribonucleotide cargo comprises the polypeptide of any one of SEQ ID NO: 1, 4, 11, 245, 247, 253, 262, 269, 275, 277, 278, 279, 280, 281, or 283. and an expression sequence encoding a polypeptide having at least 85% (e.g., at least 90%, 95%, 97%, 99%, or 100%) sequence identity.
일부 실시 형태에서, 바이러스는 인플루엔자 바이러스이다(예를 들어, 항푸소제닉 폴리펩티드는 인플루엔자의 바이러스 진입을 억제한다). 일부 실시 형태에서, 인플루엔자 바이러스는 A형 인플루엔자 바이러스(IAV)이다. 일부 실시 형태에서, 인플루엔자 바이러스는 B형 인플루엔자 바이러스(IBV)이다. 일부 실시 형태에서, 인플루엔자 바이러스는 헤마글루티닌(HA)을 발현시키는 인플루엔자 바이러스이다.In some embodiments, the virus is an influenza virus (e.g., the antifusogenic polypeptide inhibits viral entry of influenza). In some embodiments, the influenza virus is an influenza A virus (IAV). In some embodiments, the influenza virus is influenza B virus (IBV). In some embodiments, the influenza virus is an influenza virus that expresses hemagglutinin (HA).
일부 실시 형태에서, 바이러스는 단순 포진 바이러스(HSV)이다(예를 들어, 항푸소제닉 폴리펩티드는 HSV의 바이러스 진입을 억제한다). 일부 실시 형태에서, HSV는 HSV-1이다. 일부 실시 형태에서, HSV는 HSV-2이다.In some embodiments, the virus is herpes simplex virus (HSV) (e.g., the antifusogenic polypeptide inhibits viral entry of HSV). In some embodiments, the HSV is HSV-1. In some embodiments, the HSV is HSV-2.
일부 실시 형태에서, 바이러스는 인간 유두종 바이러스(HPV)이다(예를 들어, 항푸소제닉 폴리펩티드는 HPV의 바이러스 진입을 억제한다). 일부 실시 형태에서, HPV는 고위험 HPV 균주(예를 들어, HPV 16, HPV 18, HPV 31, HPV 33, HPV 45, HPV 52 또는 HPV 58)이다. 일부 실시 형태에서, HPV는 저위험 HPV 균주(예를 들어, HPV 6, HPV 11, HPV 42, HPV 43, HPV 또는 44)이다.In some embodiments, the virus is human papillomavirus (HPV) (e.g., the antifusogenic polypeptide inhibits viral entry of HPV). In some embodiments, the HPV is a high-risk HPV strain (e.g., HPV 16,
일부 실시 형태에서, 바이러스는 표 1에 나열된 임의의 바이러스이다.In some embodiments, the virus is any virus listed in Table 1.
일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 GC 함량은 적어도 51%(예를 들어, 적어도 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 또는 60%)이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 GC 함량은 최대 52%, 53%, 54%, 55%, 56%, 57%, 58% 또는 59%, 또는 60%이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 GC 함량은 51% 내지 60%, 52% 내지 60%, 53% 내지 60%, 54% 내지 60%, 55% 내지 60%, 52% 내지 58%, 53% 내지 58%이다.In some embodiments, the GC content of the nucleic acid sequence encoding the antifusogenic polypeptide is at least 51% (e.g., at least 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%) , or 60%). In some embodiments, the GC content of the nucleic acid sequence encoding the antifusogenic polypeptide is at most 52%, 53%, 54%, 55%, 56%, 57%, 58% or 59%, or 60%. In some embodiments, the GC content of the nucleic acid sequence encoding the antifusogenic polypeptide is 51% to 60%, 52% to 60%, 53% to 60%, 54% to 60%, 55% to 60%, 52%. to 58%, 53% to 58%.
일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 우리딘 함량(RNA의 경우) 또는 티미딘 함량(DNA의 경우)은 10% 초과(예를 들어, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 또는 25% 초과)이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 우리딘 함량(RNA의 경우) 또는 티미딘 함량(DNA의 경우)은 최대 30%(예를 들어, 최대 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21%, 또는 20%)이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 우리딘 함량(RNA의 경우) 또는 티미딘 함량(DNA의 경우)은 20% 내지 28%, 21% 내지 26%, 10% 내지 24%, 15% 내지 24%, 20% 내지 24%, 21% 내지 24%, 22% 내지 24%, 23% 내지 24%, 10% 내지 23%, 15% 내지 23%, 20% 내지 23%, 21% 내지 23%, 또는 22% 내지 23%이다.In some embodiments, the uridine content (for RNA) or thymidine content (for DNA) of the nucleic acid sequence encoding the antifusogenic polypeptide is greater than 10% (e.g., 11%, 12%, 13%, greater than 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, or 25%). In some embodiments, the uridine content (for RNA) or thymidine content (for DNA) of the nucleic acid sequence encoding the antifusogenic polypeptide is up to 30% (e.g., up to 29%, 28%, 27%). , 26%, 25%, 24%, 23%, 22%, 21%, or 20%). In some embodiments, the uridine content (for RNA) or thymidine content (for DNA) of the nucleic acid sequence encoding the antifusogenic polypeptide is 20% to 28%, 21% to 26%, 10% to 24%. , 15% to 24%, 20% to 24%, 21% to 24%, 22% to 24%, 23% to 24%, 10% to 23%, 15% to 23%, 20% to 23%, 21 % to 23%, or 22% to 23%.
항푸소제닉 폴리펩티드를 인코딩하는 발현 서열의 GC 함량은 항푸소제닉 폴리펩티드 이외의 폴리펩티드를 인코딩하는 다른 코딩 영역 없이 항푸소제닉 폴리펩티드만을 인코딩하는 발현 서열의 GC 함량을 지칭한다. 마찬가지로, 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열의 우리딘 함량 또는 티미딘은 항푸소제닉 폴리펩티드 이외의 폴리펩티드를 인코딩하는 다른 코딩 영역 없이 항푸소제닉 폴리펩티드만을 인코딩하는 발현 서열의 우리딘 함량을 지칭한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열의 GC 함량 또는 우리딘(또는 티미딘) 함량의 계산은 항푸소제닉 폴리펩티드를 인코딩하는 오픈 리딩 프레임의 시작 코돈의 첫 번째 뉴클레오시드로부터 동일한 오픈 리딩 프레임의 정지 코돈의 마지막 뉴클레오시드까지 5'로부터 3' 방향으로 시작하는 연속적인 핵산 서열만을 고려한다. 다른 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열의 GC 함량 또는 우리딘(또는 티미딘) 함량의 계산은 항푸소제닉 폴리펩티드의 N-말단 단부 아미노산 잔기를 인코딩하는 코돈의 첫 번째 뉴클레오시드로부터 항푸소제닉 폴리펩티드의 C-말단 단부 아미노산 잔기를 인코딩하는 코돈의 마지막 뉴클레오시드까지 5'로부터 3' 방향으로 시작하는 연속적인 핵산 서열만을 고려한다.The GC content of an expression sequence encoding an antifusogenic polypeptide refers to the GC content of an expression sequence encoding only an antifusogenic polypeptide without other coding regions encoding polypeptides other than the antifusogenic polypeptide. Likewise, uridine content or thymidine of an expression sequence encoding an antifusogenic polypeptide refers to the uridine content of an expression sequence encoding only an antifusogenic polypeptide without any other coding regions encoding polypeptides other than the antifusogenic polypeptide. In some embodiments, calculation of the GC content or uridine (or thymidine) content of an expressed sequence encoding an antifusogenic polypeptide is determined by calculating the Only contiguous nucleic acid sequences starting in the 5' to 3' direction up to the last nucleoside of the stop codon of the open reading frame are considered. In another embodiment, calculation of the GC content or uridine (or thymidine) content of an expression sequence encoding an antifusogenic polypeptide is based on the first nucleoside of the codon encoding the N-terminal terminal amino acid residue of the antifusogenic polypeptide. Only the contiguous nucleic acid sequence starting in the 5' to 3' direction from to the last nucleoside of the codon encoding the C-terminal terminal amino acid residue of the antifusogenic polypeptide is considered.
일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열은 20% 초과의 우리딘 함량을 갖는다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 우리딘 함량은 10% 초과(예를 들어, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 또는 25% 초과)이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 우리딘 함량은 최대 30%(예를 들어, 최대 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21%, 또는 20%)이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열의 우리딘 함량은 20% 내지 28%, 21% 내지 26%, 10% 내지 24%, 15% 내지 24%, 20% 내지 24%, 21% 내지 24%, 22% 내지 24%, 23% 내지 24%, 10% 내지 23%, 15% 내지 23%, 20% 내지 23%, 21% 내지 23%, 또는 22% 내지 23%이다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드를 인코딩하는 핵산 서열은 20% 내지 28%의 우리딘 함량을 갖는다.In some embodiments, the nucleic acid sequence encoding the antifusogenic polypeptide has a uridine content greater than 20%. In some embodiments, the uridine content of the nucleic acid sequence encoding the antifusogenic polypeptide is greater than 10% (e.g., 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%) , 19%, 20%, 21%, 22%, 23%, 24%, or greater than 25%). In some embodiments, the uridine content of the nucleic acid sequence encoding the antifusogenic polypeptide is up to 30% (e.g., up to 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22 %, 21%, or 20%). In some embodiments, the uridine content of the nucleic acid sequence encoding the antifusogenic polypeptide is 20% to 28%, 21% to 26%, 10% to 24%, 15% to 24%, 20% to 24%, 21 % to 24%, 22% to 24%, 23% to 24%, 10% to 23%, 15% to 23%, 20% to 23%, 21% to 23%, or 22% to 23%. In some embodiments, the nucleic acid sequence encoding the antifusogenic polypeptide has a uridine content of 20% to 28%.
다중 항푸소제닉 폴리펩티드Multiple antifusogenic polypeptides
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 각각이 항푸소제닉 폴리펩티드를 인코딩하는 다중 발현 서열(예를 들어, 2개 이상, 예컨대 2 내지 100개, 2 내지 50개, 2 내지 20개, 2 내지 10개, 5 내지 100개, 5 내지 50개, 5 내지 20개, 또는 5 내지 10개의 발현 서열)을 인코딩한다.In some embodiments, the circular polyribonucleotides comprise multiple expressed sequences (e.g., 2 or more, such as 2 to 100, 2 to 50, 2 to 20, 2 to 10, etc.) each encoding an antifusogenic polypeptide. 5 to 100, 5 to 50, 5 to 20, or 5 to 10 expressed sequences).
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 동일한 항푸소제닉 폴리펩티드의 2개 이상(예를 들어, 2 내지 100개, 2 내지 50개, 2 내지 20개, 2 내지 10개, 5 내지 100개, 5 내지 50개, 5 내지 20개, 또는 5 내지 10개)의 카피를 인코딩한다.In some embodiments, the circular polyribonucleotide is two or more (e.g., 2 to 100, 2 to 50, 2 to 20, 2 to 10, 5 to 100, 5) of the same antifusogenic polypeptide. to 50, 5 to 20, or 5 to 10) copies.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 2개 이상(예를 들어, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개)의 상이한(예를 들어, 100% 미만의 서열 동일성을 공유하는) 항푸소제닉 폴리펩티드를 인코딩한다. 일부 실시 형태에서, 2개 이상의 상이한 항푸소제닉 폴리펩티드는 각각 표 1의 항푸소제닉 폴리펩티드로부터 선택된다. 일부 실시 형태에서, 2개 이상의 상이한 항푸소제닉 폴리펩티드는 각각 상이한 바이러스를 억제한다. 예를 들어, 원형 폴리리보뉴클레오티드는 인플루엔자를 억제하는 제1 항푸소제닉 폴리펩티드 및 RSV를 억제하는 제2 항푸소제닉 폴리펩티드를 인코딩할 수 있다. 원형 폴리리보뉴클레오티드는 인플루엔자를 억제하는 제1 항푸소제닉 폴리펩티드 및 SARS-CoV-2를 억제하는 제2 항푸소제닉 폴리펩티드를 포함할 수 있다. 원형 폴리리보뉴클레오티드는 HIV를 억제하는 제1 항푸소제닉 폴리펩티드 및 SARS-CoV-2를 억제하는 제2 항푸소제닉 폴리펩티드를 포함할 수 있다. 원형 폴리리보뉴클레오티드는 HIV를 억제하는 제1 항푸소제닉 폴리펩티드 및 HCV를 억제하는 제2 항푸소제닉 폴리펩티드를 포함할 수 있다. 제1 또는 제2 항푸소제닉 폴리펩티드 중 어느 하나가 복수의 바이러스를 억제하는 경우, 제1 및 제2 항푸소제닉 폴리펩티드는 상이한 바이러스 특이성을 가질 수 있다.In some embodiments, the circular polyribonucleotide has two or more (e.g., 2, 3, 4, 5, 6, 7, 8, 9, or 10) different (e.g., less than 100% sequence (sharing identity) encodes an antifusogenic polypeptide. In some embodiments, the two or more different antifusogenic polypeptides are each selected from the antifusogenic polypeptides in Table 1. In some embodiments, two or more different antifusogenic polypeptides each inhibit a different virus. For example, a circular polyribonucleotide may encode a first antifusogenic polypeptide that inhibits influenza and a second antifusogenic polypeptide that inhibits RSV. The circular polyribonucleotide may include a first antifusogenic polypeptide that inhibits influenza and a second antifusogenic polypeptide that inhibits SARS-CoV-2. The circular polyribonucleotide may include a first antifusogenic polypeptide that inhibits HIV and a second antifusogenic polypeptide that inhibits SARS-CoV-2. The circular polyribonucleotide may comprise a first antifusogenic polypeptide that inhibits HIV and a second antifusogenic polypeptide that inhibits HCV. When either the first or second antifusogenic polypeptide inhibits multiple viruses, the first and second antifusogenic polypeptides may have different virus specificities.
원형 폴리리보뉴클레오티드가 2개 이상의 항푸소제닉 폴리펩티드를 인코딩하는 경우, 항푸소제닉 폴리펩티드는 단일 오픈 리딩 프레임 또는 다중 오픈 리딩 프레임으로 인코딩될 수 있다.When a circular polyribonucleotide encodes two or more antifusogenic polypeptides, the antifusogenic polypeptides may be encoded with a single open reading frame or multiple open reading frames.
일부 실시 형태에서, 본 개시내용은 2개 이상의 발현 서열을 포함하는 오픈 리딩 프레임(예를 들어, IRES에 작동가능하게 연결된 오픈 리딩 프레임)을 포함하는 원형 폴리리보뉴클레오티드를 제공하며, 여기서 각각의 발현 서열은 항푸소제닉 폴리펩티드를 인코딩한다. 일부 실시 형태에서, 오픈 리딩 프레임의 번역은 2개 이상의 항푸소제닉 폴리펩티드를 포함하는 폴리펩티드 융합을 생성한다. 항푸소제닉 폴리펩티드는, 예를 들어, 본원에 기재된 링커(예를 들어, 펩티드-Fc 융합과 관련하여 하기에 기재된 글리신-세린 링커와 같은 오픈 리딩 프레임에 의해 인코딩된 펩티드 링커)에 의해 연결될 수 있다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 예를 들어, 본원에 기재된 바와 같이 절단 도메인(예를 들어, 스태거 서열)에 의해 분리될 수 있다.In some embodiments, the present disclosure provides circular polyribonucleotides comprising an open reading frame (e.g., an open reading frame operably linked to an IRES) comprising two or more expression sequences, wherein each expression The sequence encodes an antifusogenic polypeptide. In some embodiments, translation of the open reading frame creates a polypeptide fusion comprising two or more antifusogenic polypeptides. Antifusogenic polypeptides can be linked, for example, by linkers described herein (e.g., peptide linkers encoded by an open reading frame, such as the glycine-serine linker described below in relation to peptide-Fc fusions). . In some embodiments, antifusogenic polypeptides may be separated by cleavage domains (e.g., stagger sequences), e.g., as described herein.
일부 실시 형태에서, 본 개시내용은 제1 항푸소제닉 폴리펩티드(예를 들어, 제1 IRES에 작동가능하게 연결됨)를 인코딩하는 제1 오픈 리딩 프레임 및 제2 항푸소제닉 폴리펩티드(예를 들어, 제2 IRES에 작동가능하게 연결됨)를 인코딩하는 제2 오픈 리딩 프레임을 포함하는 원형 폴리리보뉴클레오티드를 제공한다.In some embodiments, the present disclosure provides a first open reading frame encoding a first antifusogenic polypeptide (e.g., operably linked to a first IRES) and a second antifusogenic polypeptide (e.g., 2 operably linked to an IRES).
항푸소제닉 폴리펩티드-Fc 융합체Antifusogenic polypeptide-Fc fusion
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 항푸소제닉 폴리펩티드를 포함하는 융합 단백질을 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 융합 단백질은 면역글로불린의 Fc 도메인(예를 들어, Fc 도메인의 단일 사슬)에 융합된 항푸소제닉 폴리펩티드를 포함한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드는 표 1로부터 선택된다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 항푸소제닉 폴리펩티드를 포함하는 하나 초과의 융합 단백질을 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 초과의 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 하나 초과의 융합 단백질을 인코딩하는 원형 폴리리보뉴클레오티드는 바이러스 탈출의 기회를 감소시킨다.In some embodiments, the circular polyribonucleotide comprises an expression sequence encoding a fusion protein comprising an antifusogenic polypeptide. In some embodiments, the fusion protein comprises an antifusogenic polypeptide fused to the Fc domain of an immunoglobulin (e.g., a single chain of Fc domains). In some embodiments, the antifusogenic polypeptide is selected from Table 1. In some embodiments, the circular polyribonucleotide comprises an expression sequence encoding more than one fusion protein comprising an antifusogenic polypeptide. In some embodiments, the circular polyribonucleotide comprises an expression sequence encoding more than one antifusogenic polypeptide. In some embodiments, circular polyribonucleotides encoding more than one fusion protein reduce the chance of viral escape.
일부 실시 형태에서, Fc 도메인은 IgG4 Fc 도메인 또는 이의 단편이다. 일부 실시 형태에서, Fc 도메인은 IgG1 Fc 도메인 또는 이의 단편이다. 일부 실시 형태에서, Fc 도메인은 IgG2 Fc 도메인 또는 이의 단편이다. 일부 실시 형태에서, Fc 도메인은 IgG2a Fc 도메인 또는 이의 단편이다. 일부 실시 형태에서, Fc 도메인은 IgG2b Fc 도메인 또는 이의 단편이다. 일부 실시 형태에서, Fc 도메인은 IgG3 Fc 도메인 또는 이의 단편이다.In some embodiments, the Fc domain is an IgG4 Fc domain or fragment thereof. In some embodiments, the Fc domain is an IgG1 Fc domain or fragment thereof. In some embodiments, the Fc domain is an IgG2 Fc domain or fragment thereof. In some embodiments, the Fc domain is an IgG2a Fc domain or fragment thereof. In some embodiments, the Fc domain is an IgG2b Fc domain or fragment thereof. In some embodiments, the Fc domain is an IgG3 Fc domain or fragment thereof.
일부 실시 형태에서, 항푸소제닉 폴리펩티드의 C-말단 아미노산 잔기는 선택적으로 펩티드 링커를 통해 Fc 도메인의 N-말단 아미노산 잔기에 융합된다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드의 N-말단 아미노산 잔기는 선택적으로 펩티드 링커를 통해 Fc 도메인의 C-말단 아미노산 잔기에 융합된다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드와 Fc 도메인 사이의 펩티드 링커는 적어도 2개의 아미노산 잔기(예를 들어, 적어도 3개, 적어도 4개, 적어도 5개, 적어도 6개, 적어도 7개, 적어도 8개, 적어도 9개, 적어도 10개, 적어도 15개, 또는 적어도 20개의 아미노산 잔기)를 포함한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드와 Fc 도메인 사이의 펩티드 링커는 2 내지 200개의 아미노산 잔기(예를 들어, 2 내지 200개, 2 내지 180개, 2 내지 160개, 2 내지 140개, 2 내지 120개, 2 내지 100개, 2 내지 90개, 2 내지 80개, 2 내지 70개, 2 내지 60개, 2 내지 50개, 2 내지 45개, 2 내지 40개, 2 내지 35개, 2 내지 30개, 2 내지 25개, 2 내지 20개, 2 내지 15개, 2 내지 10개, 2 내지 9개, 2 내지 8개, 2 내지 7개, 2 내지 6개, 2 내지 5개, 2 내지 4개, 4 내지 200개, 5 내지 200개, 6 내지 200개, 7 내지 200개, 8 내지 200개, 9 내지 200개, 10 내지 200개, 15 내지 200개, 20 내지 200개, 25 내지 200개, 30 내지 200개, 35 내지 200개, 40 내지 200개, 45 내지 200개, 50 내지 200개, 60 내지 200개, 70 내지 200개, 80 내지 200개, 90 내지 200개, 100 내지 200개, 120 내지 200개, 140 내지 200개, 160 내지 200개, 또는 180 내지 200개의 아미노산 잔기)를 포함한다. 일부 실시 형태에서, 펩티드 링커는 글리신(Gly) 및 세린(Ser) 잔기로 구성된다. 일부 실시 형태에서, 펩티드 링커는 (GS)x, (GGS)x, (GGGGS)x, (GGSG)x, 또는 (SGGG)x 중 어느 하나의 아미노산 서열을 포함하며, 여기서 x는 1 내지 50의 정수(예를 들어, 1 내지 40, 1 내지 30, 1 내지 20, 1 내지 10, 또는 1 내지 5)이다. 일부 실시 형태에서, 펩티드 링커는 (GS)x, (GGS)x, (GGGGS)x, (GGSG)x, 또는 (SGGG)x 중 어느 하나의 아미노산 서열을 포함하며, 여기서 x는 1 내지 10(예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10)의 정수이다. 일부 실시 형태에서, 펩티드 링커는 6 내지 36개의 아미노산을 포함한다. 일부 실시 형태에서, 펩티드 링커는 21 내지 31개의 아미노산을 포함한다.In some embodiments, the C-terminal amino acid residue of the antifusogenic polypeptide is fused to the N-terminal amino acid residue of the Fc domain, optionally via a peptide linker. In some embodiments, the N-terminal amino acid residue of the antifusogenic polypeptide is fused to the C-terminal amino acid residue of the Fc domain, optionally via a peptide linker. In some embodiments, the peptide linker between the antifusogenic polypeptide and the Fc domain comprises at least 2 amino acid residues (e.g., at least 3, at least 4, at least 5, at least 6, at least 7, at least 8) , at least 9, at least 10, at least 15, or at least 20 amino acid residues). In some embodiments, the peptide linker between the antifusogenic polypeptide and the Fc domain is 2 to 200 amino acid residues (e.g., 2 to 200, 2 to 180, 2 to 160, 2 to 140, 2 to 200 amino acid residues). 120, 2 to 100, 2 to 90, 2 to 80, 2 to 70, 2 to 60, 2 to 50, 2 to 45, 2 to 40, 2 to 35, 2 to 30, 2 to 25, 2 to 20, 2 to 15, 2 to 10, 2 to 9, 2 to 8, 2 to 7, 2 to 6, 2 to 5, 2 to 4, 4 to 200, 5 to 200, 6 to 200, 7 to 200, 8 to 200, 9 to 200, 10 to 200, 15 to 200, 20 to 200, 25 to 200, 30 to 200, 35 to 200, 40 to 200, 45 to 200, 50 to 200, 60 to 200, 70 to 200, 80 to 200, 90 to 200, 100 to 100 200, 120 to 200, 140 to 200, 160 to 200, or 180 to 200 amino acid residues). In some embodiments, the peptide linker consists of glycine (Gly) and serine (Ser) residues. In some embodiments, the peptide linker comprises the amino acid sequence of any of (GS)x , (GGS)x , (GGGGS)x , (GGSG)x , or (SGGG)x , where x is from 1 to 50 It is an integer (e.g., 1 to 40, 1 to 30, 1 to 20, 1 to 10, or 1 to 5). In some embodiments, the peptide linker comprises the amino acid sequence of any of (GS)x , (GGS)x , (GGGGS)x , (GGSG)x , or (SGGG)x , where For example, it is an integer of 1, 2, 3, 4, 5, 6, 7, 8, 9, or 10). In some embodiments, the peptide linker contains 6 to 36 amino acids. In some embodiments, the peptide linker contains 21 to 31 amino acids.
폴리리보뉴클레오티드 카고Polyribonucleotide Cargo
본원에 기재된 폴리리보뉴클레오티드 카고는 적어도 하나의 폴리리보뉴클레오티드를 포함하는 임의의 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 발현 서열, 비-코딩 서열, 또는 발현 서열 및 비-코딩 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열에 작동가능하게 연결된 IRES를 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 대상체에 대한 생물학적 효과를 갖는 항푸소제닉 폴리펩티드를 인코딩하는 발현 서열을 포함한다.Polyribonucleotide cargo described herein includes any sequence comprising at least one polyribonucleotide. In some embodiments, the polyribonucleotide cargo includes an expression sequence, a non-coding sequence, or an expression sequence and a non-coding sequence. In some embodiments, the polyribonucleotide cargo comprises an expression sequence encoding an antifusogenic polypeptide. In some embodiments, the polyribonucleotide cargo comprises an IRES operably linked to an expression sequence encoding an antifusogenic polypeptide. In some embodiments, the polyribonucleotide cargo comprises an expression sequence encoding an antifusogenic polypeptide that has a biological effect on the subject.
폴리리보뉴클레오티드 카고는 예를 들어, 적어도 약 40개의 뉴클레오티드, 적어도 약 50개의 뉴클레오티드, 적어도 약 75개의 뉴클레오티드, 적어도 약 100개의 뉴클레오티드, 적어도 약 200개의 뉴클레오티드, 적어도 약 300개의 뉴클레오티드, 적어도 약 400개의 뉴클레오티드, 적어도 약 500개의 뉴클레오티드, 적어도 약 1,000개의 뉴클레오티드, 적어도 약 2,000개의 뉴클레오티드, 적어도 약 5,000개의 뉴클레오티드, 적어도 약 6,000개의 뉴클레오티드, 적어도 약 7,000개의 뉴클레오티드, 적어도 약 8,000개의 뉴클레오티드, 적어도 약 9,000개의 뉴클레오티드, 적어도 약 10,000개의 뉴클레오티드, 적어도 약 12,000개의 뉴클레오티드, 적어도 약 14,000개의 뉴클레오티드, 적어도 약 15,000개의 뉴클레오티드, 적어도 약 16,000개의 뉴클레오티드, 적어도 약 17,000개의 뉴클레오티드, 적어도 약 18,000개의 뉴클레오티드, 적어도 약 19,000개의 뉴클레오티드, 또는 적어도 약 20,000개의 뉴클레오티드를 포함할 수 있다. 일부 실시 형태에서, 폴리리보뉴클레오티드 카고는 1 내지 20,000개의 뉴클레오티드, 1 내지 10,000개의 뉴클레오티드, 1 내지 5,000개의 뉴클레오티드, 100 내지 20,000 뉴클레오티드, 100 내지 10,000개의 뉴클레오티드, 100 내지 5,000개의 뉴클레오티드, 500 내지 20,000개의 뉴클레오티드, 500 내지 10,000개의 뉴클레오티드, 500 내지 5,000개의 뉴클레오티드, 1,000 내지 20,000개의 뉴클레오티드, 1,000 내지 10,000개의 뉴클레오티드, 또는 1,000 내지 5,000개의 뉴클레오티드를 포함한다.The polyribonucleotide cargo may be, for example, at least about 40 nucleotides, at least about 50 nucleotides, at least about 75 nucleotides, at least about 100 nucleotides, at least about 200 nucleotides, at least about 300 nucleotides, at least about 400 nucleotides. , at least about 500 nucleotides, at least about 1,000 nucleotides, at least about 2,000 nucleotides, at least about 5,000 nucleotides, at least about 6,000 nucleotides, at least about 7,000 nucleotides, at least about 8,000 nucleotides, at least about 9,000 nucleotides, at least About 10,000 nucleotides, at least about 12,000 nucleotides, at least about 14,000 nucleotides, at least about 15,000 nucleotides, at least about 16,000 nucleotides, at least about 17,000 nucleotides, at least about 18,000 nucleotides, at least about 19,000 nucleotides, or at least about It can contain 20,000 nucleotides. In some embodiments, the polyribonucleotide cargo is 1 to 20,000 nucleotides, 1 to 10,000 nucleotides, 1 to 5,000 nucleotides, 100 to 20,000 nucleotides, 100 to 10,000 nucleotides, 100 to 5,000 nucleotides, 500 to 20, 000 nucleotides , 500 to 10,000 nucleotides, 500 to 5,000 nucleotides, 1,000 to 20,000 nucleotides, 1,000 to 10,000 nucleotides, or 1,000 to 5,000 nucleotides.
실시 형태에서, 폴리리보뉴클레오티드 카고는 하나 또는 다수의 발현(또는 코딩) 서열을 포함하고, 여기서 각각의 발현(또는 코딩) 서열은 폴리펩티드(예를 들어, 항푸소제닉 폴리펩티드)를 인코딩한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 하나 또는 다수의 비코딩 서열을 포함한다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 전적으로 비-코딩 서열(들)로 이루어진다. 실시 형태에서, 폴리리보뉴클레오티드 카고는 발현(또는 코딩) 및 비코딩 서열의 조합을 포함한다.In an embodiment, the polyribonucleotide cargo comprises one or multiple expression (or coding) sequences, where each expression (or coding) sequence encodes a polypeptide (e.g., an antifusogenic polypeptide). In an embodiment, the polyribonucleotide cargo comprises one or multiple non-coding sequences. In an embodiment, the polyribonucleotide cargo consists entirely of non-coding sequence(s). In an embodiment, the polyribonucleotide cargo comprises a combination of expressing (or coding) and non-coding sequences.
일부 실시 형태에서, 폴리리보뉴클레오티드는 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호에 개시된 바와 같은 임의의 특징, 또는 특징의 임의의 조합을 포함한다.In some embodiments, the polyribonucleotide includes any feature, or any combination of features, as disclosed in International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
폴리펩티드 발현 서열polypeptide expression sequence
일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드의 폴리리보뉴클레오티드 카고)는 하나 이상의 발현(또는 코딩) 서열을 포함하고, 여기서 각각의 발현 서열은 항푸소제닉 폴리펩티드를 인코딩한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 2, 3, 4, 5, 6, 7, 8, 9, 10개 또는 그 초과의 발현(또는 코딩) 서열을 포함한다.In some embodiments, the polyribonucleotides described herein (e.g., a polyribonucleotide cargo of a circular polyribonucleotide) comprise one or more expression (or coding) sequences, wherein each expression sequence represents an antifusogenic polypeptide. Encode. In some embodiments, the circular polyribonucleotide comprises 2, 3, 4, 5, 6, 7, 8, 9, 10 or more expression (or coding) sequences.
각각의 인코딩된 폴리펩티드는 선형 또는 분지형일 수 있다. 다양한 실시 형태에서, 폴리펩티드는 약 5개 내지 약 40,000개의 아미노산, 약 15개 내지 약 35,000개의 아미노산, 약 20개 내지 약 30,000개의 아미노산, 약 25개 내지 약 25,000개의 아미노산, 약 50개 내지 약 20,000개의 아미노산, 약 100개 내지 약 15,000개의 아미노산, 약 200개 내지 약 10,000개의 아미노산, 약 500개 내지 약 5,000개의 아미노산, 약 1,000개 내지 약 2,500개의 아미노산, 또는 그들 사이의 임의의 범위의 길이를 갖는다. 일부 실시 형태에서, 폴리펩티드는 약 40,000개 미만의 아미노산, 약 35,000개 미만의 아미노산, 약 30,000개 미만의 아미노산, 약 25,000개 미만의 아미노산, 약 20,000개 미만의 아미노산, 약 15,000개 미만의 아미노산, 약 10,000개 미만의 아미노산, 약 9,000개 미만의 아미노산, 약 8,000개 미만의 아미노산, 약 7,000개 미만의 아미노산, 약 6,000개 미만의 아미노산, 약 5,000개 미만의 아미노산, 약 4,000개 미만의 아미노산, 약 3,000개 미만의 아미노산, 약 2,500개 미만의 아미노산, 약 2,000개 미만의 아미노산, 약 1,500개 미만의 아미노산, 약 1,000개 미만의 아미노산, 약 900개 미만의 아미노산, 약 800개 미만의 아미노산, 약 700개 미만의 아미노산, 약 600개 미만의 아미노산, 약 500개 미만의 아미노산, 약 400개 미만의 아미노산, 약 300개 미만의 아미노산의 길이를 갖거나, 그 미만이 유용할 수 있다.Each encoded polypeptide may be linear or branched. In various embodiments, the polypeptide has about 5 to about 40,000 amino acids, about 15 to about 35,000 amino acids, about 20 to about 30,000 amino acids, about 25 to about 25,000 amino acids, about 50 to about 20,000 amino acids. Amino acids, from about 100 to about 15,000 amino acids, from about 200 to about 10,000 amino acids, from about 500 to about 5,000 amino acids, from about 1,000 to about 2,500 amino acids, or any range in between. In some embodiments, the polypeptide has less than about 40,000 amino acids, less than about 35,000 amino acids, less than about 30,000 amino acids, less than about 25,000 amino acids, less than about 20,000 amino acids, less than about 15,000 amino acids, about Less than 10,000 amino acids, Less than about 9,000 amino acids, Less than about 8,000 amino acids, Less than about 7,000 amino acids, Less than about 6,000 amino acids, Less than about 5,000 amino acids, Less than about 4,000 amino acids, About 3,000 less than about 2,500 amino acids, less than about 2,000 amino acids, less than about 1,500 amino acids, less than about 1,000 amino acids, less than about 900 amino acids, less than about 800 amino acids, about 700 amino acids Lengths of less than about 600 amino acids, less than about 500 amino acids, less than about 400 amino acids, less than about 300 amino acids, or less may be useful.
본원에 포함된 폴리펩티드는 천연 발생 폴리펩티드 또는 비-천연 발생 폴리펩티드를 포함할 수 있다. 일부 실시 형태에서, 폴리펩티드는 기준 폴리펩티드의 기능적 단편 또는 변이체(예를 들어, 항푸소제닉 폴리펩티드의 생물학적으로 활성인 단편 또는 변이체)이거나 이를 포함한다. 예를 들어, 폴리펩티드는 본원에 기재된 폴리펩티드 또는 천연 발생 폴리펩티드의 서열과, 예를 들어, 특정된 영역에 걸쳐 또는 전체 서열에 걸쳐, 적어도 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 본원에 기재된 폴리펩티드 중 임의의 것의 기능적으로 활성인 변이체일 수 있다. 일부 경우에, 폴리펩티드는 관심 단백질과 적어도 50%(예를 들어, 적어도 50%, 60%, 70%, 80%, 90%, 95%, 97%, 99%, 또는 그 초과) 동일성을 가질 수 있다.Polypeptides encompassed herein may include naturally occurring polypeptides or non-naturally occurring polypeptides. In some embodiments, the polypeptide is or comprises a functional fragment or variant of a reference polypeptide (e.g., a biologically active fragment or variant of an antifusogenic polypeptide). For example, a polypeptide may be at least 70%, 71%, 72%, 73%, 74%, 75% closer to the sequence of a polypeptide described herein or a naturally occurring polypeptide, e.g., over a specified region or across the entire sequence. %, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, It may be a functionally active variant of any of the polypeptides described herein having 92%, 93%, 94%, 95%, 96%, 97%, 98%, or 99% identity. In some cases, the polypeptide may have at least 50% (e.g., at least 50%, 60%, 70%, 80%, 90%, 95%, 97%, 99%, or more) identity with the protein of interest. there is.
실시 형태에서, 폴리펩티드는 다수의 폴리펩티드, 예를 들어, 하나의 폴리펩티드 서열의 다수의 카피, 또는 다수의 상이한 폴리펩티드 서열을 포함한다. 실시 형태에서, 다수의 폴리펩티드는 링커 아미노산 또는 스페이서 아미노산에 의해 연결된다.In an embodiment, a polypeptide comprises multiple polypeptides, e.g., multiple copies of one polypeptide sequence, or multiple different polypeptide sequences. In an embodiment, multiple polypeptides are linked by linker amino acids or spacer amino acids.
실시 형태에서, 폴리뉴클레오티드 카고는 신호 펩티드를 인코딩하는 서열을 포함한다. 많은 신호 펩티드 서열이 기재되었으며, 예를 들어, Tat(트윈-아르기닌 전위) 신호 서열은 전형적으로 지질 이중층에 걸쳐 이러한 Tat 신호 펩티드를 함유하는 폴딩된 단백질을 전위시키는 역할을 하는 컨센서스 SRRxFLK "트윈-아르기닌" 모티프를 함유하는 N-말단 펩티드 서열이다. 또한, 예를 들어, www[dot]signalpeptide[dot]de에서 공개적으로 이용가능한 신호 펩티드 데이터베이스를 참조한다. 신호 펩티드는 또한 단백질을 특이적 소기관에 지정하는 데 유용하며; 예를 들어, proline.bic.nus.edu.sg/spdb에서 공개적으로 이용가능한 Spdb 신호 펩티드 데이터베이스에 개시된 실험적으로 결정되고 컴퓨터로 예측되는 신호 펩티드를 참조한다.In an embodiment, the polynucleotide cargo comprises a sequence encoding a signal peptide. Many signal peptide sequences have been described, for example, the Tat (twin-arginine translocation) signal sequence, the consensus SRRxFLK "twin-arginine" signal sequence, which is typically responsible for translocating folded proteins containing this Tat signal peptide across lipid bilayers. " is the N-terminal peptide sequence containing the motif. See also the publicly available signal peptide database, for example at www[dot]signalpeptide[dot]de. Signal peptides are also useful in specifying proteins to specific organelles; See, for example, experimentally determined and computationally predicted signal peptides disclosed in the Spdb signal peptide database, publicly available at proline.bic.nus.edu.sg/spdb.
일부 실시 형태에서, 발현(또는 코딩) 서열은 폴리-A 서열을 포함한다(예를 들어, 발현 서열의 3' 단부에). 일부 실시 형태에서, 폴리-A 서열의 길이는 10개 초과의 뉴클레오티드의 길이를 갖는다. 한 실시 형태에서, 폴리-A 서열은 15개 초과의 뉴클레오티드의 길이(예를 들어, 적어도 약 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900, 1,000, 1,100, 1,200, 1,300, 1,400, 1,500, 1,600, 1,700, 1,800, 1,900, 2,000, 2,500, 및 3,000개의 뉴클레오티드 또는 그 초과)를 갖는다. 일부 실시 형태에서, 폴리-A 서열은 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919A1호의 [0202] 내지 [0204]에서의 폴리-A 서열의 설명에 따라 설계된다. 일부 실시 형태에서, 발현 서열은 폴리-A 서열을 결여한다(예를 들어, 발현 서열의 3' 단부에).In some embodiments, the expression (or coding) sequence includes a poly-A sequence (e.g., at the 3' end of the expression sequence). In some embodiments, the poly-A sequence is greater than 10 nucleotides in length. In one embodiment, the poly-A sequence is greater than 15 nucleotides in length (e.g., at least about 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900, 1,000, 1,100, 1,200, 1,300, 1,400, 00, 1,600, 1,700, 1,800, 1,900, 2,000, 2,500, and 3,000 nucleotides or more). In some embodiments, the poly-A sequence is designed according to the description of the poly-A sequence in [0202] to [0204] of International Patent Publication No. WO2019/118919A1, which is incorporated herein by reference in its entirety. In some embodiments, the expression sequence lacks a poly-A sequence (e.g., at the 3' end of the expression sequence).
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 폴리A를 포함하거나, 폴리A를 결여하거나, 원형 폴리리보뉴클레오티드의 하나 이상의 특징을 조정하도록 변형된 폴리A를 갖는다. 일부 실시 형태에서, 폴리A를 결여하거나 변형된 폴리A를 갖는 원형 폴리리보뉴클레오티드는 하나 이상의 기능적 특징, 예를 들어, 면역원성(예를 들어, 면역 또는 염증 반응의 하나 이상의 마커의 수준), 반감기, 및/또는 발현 효율을 개선시킨다.In some embodiments, the circular polyribonucleotide comprises polyA, lacks polyA, or has polyA modified to modulate one or more characteristics of the circular polyribonucleotide. In some embodiments, circular polyribonucleotides lacking polyA or having modified polyA exhibit one or more functional characteristics, such as immunogenicity (e.g., level of one or more markers of an immune or inflammatory response), half-life, etc. , and/or improve expression efficiency.
내부 리보솜 진입 부위Internal ribosome entry site
일부 실시 형태에서, 본원에 기재된 원형 폴리리보뉴클레오티드는 하나 이상의 내부 리보솜 진입 부위(IRES) 요소를 포함한다. 일부 실시 형태에서, IRES는 하나 이상의 발현 서열에 작동가능하게 연결된다(예를 들어, 각각의 IRES는 하나 이상의 발현 서열에 작동가능하게 연결된다). 실시 형태에서, IRES는 이종 프로모터와 코딩 서열의 5' 단부 사이에 위치한다.In some embodiments, circular polyribonucleotides described herein include one or more internal ribosome entry site (IRES) elements. In some embodiments, the IRES is operably linked to one or more expression sequences (e.g., each IRES is operably linked to one or more expression sequences). In an embodiment, the IRES is located between the heterologous promoter and the 5' end of the coding sequence.
폴리리보뉴클레오티드에 포함시키는 데 적합한 IRES 요소는 진핵 리보솜을 결착할 수 있는 RNA 서열을 포함한다. 일부 실시 형태에서, IRES 요소는 적어도 약 5 nt, 적어도 약 8 nt, 적어도 약 9 nt, 적어도 약 10 nt, 적어도 약 15 nt, 적어도 약 20 nt, 적어도 약 25 nt, 적어도 약 30 nt, 적어도 약 40 nt, 적어도 약 50 nt, 적어도 약 100 nt, 적어도 약 200 nt, 적어도 약 250 nt, 적어도 약 350 nt, 또는 적어도 약 500 nt이다.IRES elements suitable for inclusion in polyribonucleotides include RNA sequences capable of binding eukaryotic ribosomes. In some embodiments, the IRES element is at least about 5 nt, at least about 8 nt, at least about 9 nt, at least about 10 nt, at least about 15 nt, at least about 20 nt, at least about 25 nt, at least about 30 nt, at least about 40 nt, at least about 50 nt, at least about 100 nt, at least about 200 nt, at least about 250 nt, at least about 350 nt, or at least about 500 nt.
일부 실시 형태에서, IRES 요소는 바이러스, 포유류, 및 드로소필라(Drosophila)를 포함하지만, 이에 한정되는 것은 아닌 유기체의 DNA로부터 유래된다. 이러한 바이러스 DNA는 뇌심근염 바이러스(EMCV) cDNA 및 폴리오바이러스 cDNA와의 피코르나바이러스 상보적 DNA(cDNA)로부터 유래될 수 있지만, 이에 한정되는 것은 아니다. 한 실시 형태에서, IRES 요소가 유래되는 드로소필라 DNA는 드로소필라 멜라노가스터(Drosophila melanogaster)로부터의 안테나페디아(Antennapedia) 유전자를 포함하지만, 이에 한정되는 것은 아니다.In some embodiments, the IRES element is derived from the DNA of an organism, including, but not limited to, viruses, mammals, and Drosophila. Such viral DNA may be derived from, but is not limited to, encephalomyocarditis virus (EMCV) cDNA and picornavirus complementary DNA (cDNA) with poliovirus cDNA. In one embodiment, the Drosophila DNA from which the IRES element is derived includes, but is not limited to, the Antennapedia gene from Drosophila melanogaster.
일부 실시 형태에서, IRES 서열은 타우라 증후군 바이러스, 트리아토마(Triatoma) 바이러스, 타일러 뇌척수염 바이러스, 원숭이 바이러스 40, 솔레놉시스 인빅타(Solenopsis invicta) 바이러스 1, 로팔로시품 파디(Rhopalosiphum padi) 바이러스, 망상내피증 바이러스, 인간 폴리오바이러스 1, 플라우티아 스톨(Plautia stall) 장 바이러스, 카슈미르 벌 바이러스, 인간 리노바이러스 2(HRV-2), 호말로디스카 코아굴라타(Homalodisca coagulata) 바이러스- 1, 인간 면역결핍 바이러스 유형 1, 호말로디스카 코아굴라타 바이러스- 1, 히메토비(Himetobi) P 바이러스, C형 간염 바이러스, A형 간염 바이러스, GB형 간염 바이러스, 구제역 바이러스, 인간 엔테로바이러스 71, 말 비염 바이러스, 엑트로피스 오블리쿠아(Ectropis obliqua) 피코르나-유사 바이러스, 뇌심근염 바이러스(EMCV), 드로소필라 C 바이러스, 크루시퍼 토바모(Crucifer tobamo) 바이러스, 귀뚜라미 마비 바이러스, 소 바이러스성 설사 바이러스 1, 블랙 퀸 세포(Black Queen Cell) 바이러스, 진딧물 치사성 마비 바이러스, 조류 뇌척수염 바이러스(AEV), 급성 벌 마비 바이러스, 히비스쿠스 황백화 윤문병 바이러스, 고전적 돼지열 바이러스, 인간 FGF2, 인간 SFTPA1, 인간 AML1/RUNX1, 드로소필라 안테나페디아, 인간 AQP4, 인간 AT1R, 인간 BAG-l, 인간 BCL2, 인간 BiP, 인간 c-IAPl, 인간 c-myc, 인간 eIF4G, 마우스 NDST4L, 인간 LEF1, 마우스 HIF1 알파, 인간 n.myc, 마우스 Gtx, 인간 p27kipl, 인간 PDGF2/c-sis, 인간 p53, 인간 Pim-l, 마우스 Rbm3, 드로소필라 레아퍼(Drosophila reaper), 카나인 스캠퍼(Canine Scamper), 드로소필라 Ubx, 인간 UNR, 마우스 UtrA, 인간 VEGF-A, 인간 XIAP, 살리바이러스, 코사바이러스, 파레코바이러스, 드로소필라 헤어리스, 에스. 세레비지아에(S. cerevisiae) TFIID, 에스. 세레비지아에 YAP1, 인간 c-src, 인간 FGF-l, 원숭이 피코마바이러스, 순무 주름 바이러스, 에이치바이러스(Aichivirus), 크로히바이러스(Crohivirus), 에코바이러스 11, eIF4G에 대한 압타머, 콕사키바이러스 B3(CVB3) 또는 콕사키바이러스 A(CVB1/2)의 IRES 서열이다. 추가의 또 다른 실시 형태에서, IRES는 콕사키바이러스 B3(CVB3)의 IRES 서열이다. 추가 실시 형태에서, IRES는 뇌심근염 바이러스의 IRES 서열이다. 추가 실시 형태에서, IRES는 타일러 뇌척수염 바이러스의 IRES 서열이다.In some embodiments, the IRES sequence is Taura syndrome virus, Triatoma virus, Tyler encephalomyelitis virus,
IRES 서열은 야생형 IRES 서열과 비교하여 변형된 서열을 가질 수 있다. 일부 실시 형태에서, 야생형 IRES의 마지막 뉴클레오티드가 시토신 핵산 잔기가 아닌 경우, 야생형 IRES 서열의 마지막 뉴클레오티드는 시토신 잔기가 되도록 변형될 수 있다. 예를 들어, IRES 서열은 말단 아데노신 잔기가 시토신 잔기로 변형된 CVB3 IRES 서열일 수 있다. 일부 실시 형태에서, 변형된 CVB3 IRES는 다음의 핵산 서열을 가질 수 있다:The IRES sequence may have a modified sequence compared to the wild-type IRES sequence. In some embodiments, if the last nucleotide of a wild-type IRES is not a cytosine nucleic acid residue, the last nucleotide of the wild-type IRES sequence may be modified to become a cytosine residue. For example, the IRES sequence may be the CVB3 IRES sequence with the terminal adenosine residue modified to a cytosine residue. In some embodiments, the modified CVB3 IRES may have the following nucleic acid sequence:
일부 실시 형태에서, IRES 서열은 엔테로바이러스 71(EV17) IRES이다. 일부 실시 형태에서, EV17 IRES 서열의 말단 구아노신 잔기는 시토신 잔기로 변형된다. 일부 실시 형태에서, 변형된 EV71 IRES는 다음의 핵산 서열을 가질 수 있다:In some embodiments, the IRES sequence is Enterovirus 71 (EV17) IRES. In some embodiments, the terminal guanosine residues of the EV17 IRES sequence are modified to cytosine residues. In some embodiments, the modified EV71 IRES may have the following nucleic acid sequence:
일부 실시 형태에서, 폴리리보뉴클레오티드는 적어도 하나(예를 들어, 2, 3, 4, 5개 또는 그 초과)의 발현 서열에 플랭킹된 적어도 하나의 IRES를 포함한다. 일부 실시 형태에서, IRES는 적어도 하나(예를 들어, 2, 3, 4, 5개 또는 그 초과)의 발현 서열의 양측에 플랭킹된다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 각각의 발현 서열의 한 측 또는 양측 상에 하나 이상의 IRES 서열을 포함하여, 생성된 펩티드(들) 및 또는 폴리펩티드(들)의 분리를 초래한다. 예를 들어, 본원에 기재된 폴리리보뉴클레오티드는 제1 발현 서열에 작동가능하게 연결된 제1 IRES 및 제2 발현 서열에 작동가능하게 연결된 제2 IRES를 포함할 수 있다.In some embodiments, the polyribonucleotide comprises at least one IRES flanking at least one (e.g., 2, 3, 4, 5 or more) expression sequences. In some embodiments, the IRES is flanked on either side of at least one (e.g., 2, 3, 4, 5 or more) expression sequences. In some embodiments, the polyribonucleotide comprises one or more IRES sequences on one or both sides of each expression sequence, resulting in separation of the resulting peptide(s) and/or polypeptide(s). For example, a polyribonucleotide described herein can include a first IRES operably linked to a first expression sequence and a second IRES operably linked to a second expression sequence.
일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드는 IRES(예를 들어, 코딩 영역에 작동가능하게 연결된 IRES)를 포함한다. 예를 들어, 폴리리보뉴클레오티드는 각각 그 전체가 본원에 참조로 포함되는 문헌[Chen et al. MOL. CELL 81(20):4300-18, 2021]; [Jopling et al. ONCOGENE 20:2664-70, 2001]; [Baranick et al. PNAS 105(12):4733-38, 2008]; [Lang et al. MOLECULAR BIOLOGY OF THE CELL 13(5):1792-1801, 2002]; [Dorokhov et al. PNAS 99(8):5301-06, 2002]; [Wang et al. NUCLEIC ACIDS RESEARCH 33(7):2248-58, 2005]; [Petz et al. NUCLEIC ACIDS RESEARCH 35(8):2473-82, 2007]; [Chen et al. SCIENCE 268:415-417, 1995]; [Fan et al. NATURE COMMUNICATION 13(1):3751-3765, 2022], 및 국제 공개 제WO2021/263124호에 기재된 바와 같은 임의의 IRES를 포함한다.In some embodiments, the polyribonucleotides described herein comprise an IRES (e.g., an IRES operably linked to a coding region). For example, polyribonucleotides are described in Chen et al., each of which is incorporated herein by reference in its entirety. MOL. CELL 81(20):4300-18, 2021]; [Jopling et al. ONCOGENE 20:2664-70, 2001]; [Baranick et al. PNAS 105(12):4733-38, 2008]; [Lang et al. MOLECULAR BIOLOGY OF THE CELL 13(5):1792-1801, 2002]; [Dorokhov et al. PNAS 99(8):5301-06, 2002]; [Wang et al. NUCLEIC ACIDS RESEARCH 33(7):2248-58, 2005]; [Petz et al. NUCLEIC ACIDS RESEARCH 35(8):2473-82, 2007]; [Chen et al. SCIENCE 268:415-417, 1995]; [Fan et al. NATURE COMMUNICATION 13(1):3751-3765, 2022], and any IRES as described in International Publication No. WO2021/263124.
신호 서열signal sequence
일부 실시 형태에서, 본원에 개시된 원형 폴리리보뉴클레오티드로부터 발현된 항푸소제닉 폴리펩티드는 분비된 단백질, 예를 들어, 자연적으로 신호 서열을 포함하는 단백질, 또는 일반적으로 신호 서열을 인코딩하지 않지만 신호 서열을 함유하도록 변형된 단백질을 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드에 의해 인코딩된 항푸소제닉 폴리펩티드는 분비 신호를 포함한다. 예를 들어, 분비 신호는 분비 단백질에 대한 자연적으로 인코딩된 분비 신호일 수 있다. 또 다른 예에서, 분비 신호는 분비된 단백질에 대한 변형된 분비 신호일 수 있다. 다른 실시 형태에서, 원형 폴리리보뉴클레오티드에 의해 인코딩된 항푸소제닉 폴리펩티드는 분비 신호를 포함하지 않는다.In some embodiments, antifusogenic polypeptides expressed from the circular polyribonucleotides disclosed herein are secreted proteins, e.g., proteins that naturally contain a signal sequence, or do not typically encode a signal sequence but contain a signal sequence. Contains proteins that have been modified to do so. In some embodiments, the antifusogenic polypeptide encoded by a circular polyribonucleotide comprises a secretion signal. For example, the secretion signal may be a naturally encoded secretion signal for a secreted protein. In another example, the secretion signal may be a modified secretion signal for a secreted protein. In another embodiment, the antifusogenic polypeptide encoded by the circular polyribonucleotide does not include a secretion signal.
일부 실시 형태에서, 신호 서열은In some embodiments, the signal sequence is
로부터 선택된다.is selected from
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 동일한 항푸소제닉 폴리펩티드의 다수의 카피(예를 들어, 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개 또는 그 초과)를 인코딩한다. 일부 실시 형태에서, 항푸소제닉 폴리펩티드의 적어도 하나의 카피는 신호 서열을 포함하고 항푸소제닉 폴리펩티드의 적어도 하나의 카피는 신호 서열을 포함하지 않는다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 복수의 항푸소제닉 폴리펩티드(예를 들어, 복수의 상이한 항푸소제닉 폴리펩티드 또는 100% 미만의 서열 동일성을 갖는 복수의 항푸소제닉 폴리펩티드)를 인코딩하고, 여기서 복수의 항푸소제닉 폴리펩티드 중 적어도 하나는 신호 서열을 포함하고 복수의 항푸소제닉 폴리펩티드의 적어도 하나의 카피는 신호 서열을 포함하지 않는다.In some embodiments, the circular polyribonucleotide is comprised of multiple copies (e.g., 1, 2, 3, 4, 5, 6, 7, 8, 9) of the same antifusogenic polypeptide. , 10 or more). In some embodiments, at least one copy of the antifusogenic polypeptide comprises a signal sequence and at least one copy of the antifusogenic polypeptide does not comprise a signal sequence. In some embodiments, the circular polyribonucleotide encodes a plurality of antifusogenic polypeptides (e.g., a plurality of different antifusogenic polypeptides or a plurality of antifusogenic polypeptides with less than 100% sequence identity), wherein a plurality of antifusogenic polypeptides At least one of the antifusogenic polypeptides comprises a signal sequence and at least one copy of the plurality of antifusogenic polypeptides does not comprise a signal sequence.
일부 실시 형태에서, 신호 서열은, 예를 들어, 내인성으로 발현되는 경우 상응하는 야생형 항푸소제닉 폴리펩티드의 N-말단에 존재하는 야생형 신호 서열이다. 일부 실시 형태에서, 신호 서열은 항푸소제닉 폴리펩티드에 대해 이종이며, 예를 들어, 야생형 항푸소제닉 폴리펩티드가 내인성으로 발현되는 경우에는 존재하지 않는다. 항푸소제닉 폴리펩티드를 인코딩하는 폴리리보뉴클레오티드 서열은 변형되어 야생형 신호 서열을 인코딩하는 뉴클레오티드 서열을 제거하고/하거나 이종 신호 서열을 인코딩하는 서열을 추가할 수 있다.In some embodiments, the signal sequence is, for example, a wild-type signal sequence present at the N-terminus of the corresponding wild-type antifusogenic polypeptide when expressed endogenously. In some embodiments, the signal sequence is heterologous to the antifusogenic polypeptide, e.g., is not present when the wild-type antifusogenic polypeptide is endogenously expressed. The polyribonucleotide sequence encoding the antifusogenic polypeptide can be modified to remove the nucleotide sequence encoding the wild-type signal sequence and/or add the sequence encoding the heterologous signal sequence.
폴리리보뉴클레오티드에 의해 인코딩된 폴리펩티드(예를 들어, 항포소제닉 폴리펩티드)는 항푸소제닉 폴리펩티드를 분비 경로로 지시하는 신호 서열을 포함할 수 있다. 일부 실시 형태에서, 신호 서열은 항푸소제닉 폴리펩티드가 특정 소기관(예를 들어, 소포체, 골지체 또는 엔도솜)에 존재하도록 지시할 수 있다. 일부 실시 형태에서, 신호 서열은 항푸소제닉 폴리펩티드가 세포로부터 분비되도록 지시한다. 분비된 단백질의 경우, 신호 서열은 분비 후 절단되어 성숙한 단백질을 초래할 수 있다. 다른 실시 형태에서, 신호 서열은 세포 또는 특정 소기관의 막에 매립되어, 단백질을 세포의 막, 소포체 또는 골지체에 고정하는 막횡단 세그먼트를 생성할 수 있다. 특정 실시 형태에서, 막횡단 단백질의 신호 서열은 폴리펩티드의 N-말단에서의 짧은 서열이다. 다른 실시 형태에서, 제1 막횡단 도메인은 단백질을 막에 표적화하는 제1 신호 서열로서 작용한다.A polypeptide encoded by a polyribonucleotide (e.g., an antifusogenic polypeptide) may include a signal sequence that directs the antifusogenic polypeptide to the secretory pathway. In some embodiments, the signal sequence may direct the antifusogenic polypeptide to be present in a specific organelle (e.g., the endoplasmic reticulum, Golgi apparatus, or endosome). In some embodiments, the signal sequence directs the antifusogenic polypeptide to be secreted from the cell. For secreted proteins, the signal sequence can be cleaved after secretion, resulting in the mature protein. In other embodiments, the signal sequence may be embedded in the membrane of a cell or specific organelle, creating a transmembrane segment that anchors the protein to the cell's membrane, endoplasmic reticulum, or Golgi apparatus. In certain embodiments, the signal sequence of the transmembrane protein is a short sequence at the N-terminus of the polypeptide. In other embodiments, the first transmembrane domain acts as a first signal sequence that targets the protein to the membrane.
일부 실시 형태에서, 분비 신호는 인간 인터루킨-2(IL-2) 분비 신호이다. 일부 실시 형태에서, IL-2 분비 신호는와 적어도 90% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, IL-2 분비 신호는 SEQ ID NO: 332와 적어도 95% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, IL-2 분비 신호는 SEQ ID NO: 332와 적어도 99% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, IL-2 분비 신호는 SEQ ID NO: 332와 100% 서열 동일성의 아미노산 서열을 갖는다.In some embodiments, the secretion signal is a human interleukin-2 (IL-2) secretion signal. In some embodiments, the IL-2 secretion signal is It has an amino acid sequence of at least 90% sequence identity. In some embodiments, the IL-2 secretion signal has an amino acid sequence with at least 95% sequence identity to SEQ ID NO:332. In some embodiments, the IL-2 secretion signal has an amino acid sequence with at least 99% sequence identity to SEQ ID NO:332. In some embodiments, the IL-2 secretion signal has an amino acid sequence with 100% sequence identity to SEQ ID NO:332.
일부 실시 형태에서, 분비 신호는 가우시아 루시페라제 분비 신호이다. 일부 실시 형태에서, 가우시아 루시페라제 분비 신호는에 대해 적어도 90% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, 가우시아 루시페라제 분비 신호는 SEQ ID NO: 329에 대해 적어도 95% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, 가우시아 루시페라제 분비 신호는 SEQ ID NO: 329에 대해 적어도 99% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, 가우시아 루시페라제 분비 신호는 SEQ ID NO: 329에 대해 100% 서열 동일성의 아미노산 서열을 갖는다.In some embodiments, the secretion signal is a Gaussia luciferase secretion signal. In some embodiments, the Gaussia luciferase secretion signal is Has an amino acid sequence of at least 90% sequence identity to. In some embodiments, the Gaussia luciferase secretion signal has an amino acid sequence with at least 95% sequence identity to SEQ ID NO:329. In some embodiments, the Gaussia luciferase secretion signal has an amino acid sequence with at least 99% sequence identity to SEQ ID NO:329. In some embodiments, the Gaussia luciferase secretion signal has an amino acid sequence with 100% sequence identity to SEQ ID NO:329.
일부 실시 형태에서, 분비 신호는 EPO(예를 들어, 인간 EPO) 분비 신호이다. 일부 실시 형태에서, EPO 분비 신호는에 대해 적어도 90% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, EPO 분비 신호는 SEQ ID NO: 333에 대해 적어도 95% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, EPO 분비 신호는 SEQ ID NO: 333에 대해 적어도 99% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, EPO 분비 신호는 SEQ ID NO: 333에 대해 100% 서열 동일성의 아미노산 서열을 갖는다.In some embodiments, the secretion signal is an EPO (eg, human EPO) secretion signal. In some embodiments, the EPO secretion signal is Has an amino acid sequence of at least 90% sequence identity to. In some embodiments, the EPO secretion signal has an amino acid sequence with at least 95% sequence identity to SEQ ID NO:333. In some embodiments, the EPO secretion signal has an amino acid sequence with at least 99% sequence identity to SEQ ID NO:333. In some embodiments, the EPO secretion signal has an amino acid sequence with 100% sequence identity to SEQ ID NO:333.
일부 실시 형태에서, 분비 신호는 야생형 SARS-CoV-2 분비 신호이다. 일부 실시 형태에서, 야생형 SARS-CoV-2 분비 신호는에 대해 적어도 90% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, 야생형 SARS-CoV-2 분비 신호는 SEQ ID NO: 334에 대해 적어도 95% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, 야생형 SARS-CoV-2 분비 신호는 SEQ ID NO: 334에 대해 적어도 99% 서열 동일성의 아미노산 서열을 갖는다. 일부 실시 형태에서, 야생형 SARS-CoV-2 분비 신호는 SEQ ID NO: 334에 대해 100% 서열 동일성의 아미노산 서열을 갖는다.In some embodiments, the secretion signal is a wild-type SARS-CoV-2 secretion signal. In some embodiments, the wild-type SARS-CoV-2 secretion signal is Has an amino acid sequence of at least 90% sequence identity to. In some embodiments, the wild-type SARS-CoV-2 secretion signal has an amino acid sequence with at least 95% sequence identity to SEQ ID NO:334. In some embodiments, the wild-type SARS-CoV-2 secretion signal has an amino acid sequence with at least 99% sequence identity to SEQ ID NO:334. In some embodiments, the wild-type SARS-CoV-2 secretion signal has an amino acid sequence with 100% sequence identity to SEQ ID NO:334.
일부 실시 형태에서, 폴리리보뉴클레오티드에 의해 인코딩되는 항푸소제닉 폴리펩티드는 분비 신호 서열, 막횡단 삽입 신호 서열을 포함하거나 신호 서열을 포함하지 않는다.In some embodiments, the antifusogenic polypeptide encoded by the polyribonucleotide comprises a secretion signal sequence, a transmembrane insertion signal sequence, or no signal sequence.
조절 요소regulating element
일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 폴리리보뉴클레오티드의 폴리리보뉴클레오티드 카고)는 하나 이상의 조절 요소를 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 조절 요소, 예를 들어, 폴리리보뉴클레오티드 내의 발현 서열의 발현을 변형시키는 서열을 포함한다.In some embodiments, a polyribonucleotide described herein (e.g., a polyribonucleotide cargo of a polyribonucleotide) includes one or more regulatory elements. In some embodiments, the polyribonucleotide includes regulatory elements, such as sequences that modify the expression of expression sequences within the polyribonucleotide.
조절 요소는 발현 생성물을 인코딩하는 발현 서열에 인접하여 위치한 서열을 포함할 수 있다. 조절 요소는 인접한 서열에 작동가능하게 연결될 수 있다. 조절 요소는 조절 요소가 존재하지 않는 경우 발현된 생성물의 양과 비교하여 발현된 생성물의 양을 증가시킬 수 있다. 또한, 하나의 조절 요소는 탠덤으로 부착된 다수의 발현 서열에 대해 발현된 생성물의 양을 증가시킬 수 있다. 따라서, 하나의 조절 요소는 하나 이상의 발현 서열의 발현을 증진시킬 수 있다. 다수의 조절 요소는 당업자에게 널리 알려져 있다.Regulatory elements may include sequences located adjacent to the expression sequence encoding the expression product. Regulatory elements can be operably linked to adjacent sequences. A regulatory element can increase the amount of product expressed compared to the amount of product expressed if the regulatory element is not present. Additionally, one regulatory element can increase the amount of expressed product for multiple expression sequences attached in tandem. Accordingly, one regulatory element can enhance the expression of more than one expression sequence. Many regulatory elements are well known to those skilled in the art.
일부 실시 형태에서, 조절 요소는 번역 조정제이다. 번역 조정제는 폴리리보뉴클레오티드에서 발현 서열의 번역을 조정할 수 있다. 번역 조정제는 번역 증진제 또는 억제제일 수 있다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 적어도 하나의 발현 서열에 인접한 적어도 하나의 번역 조정제를 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 각각의 발현 서열에 인접한 번역 조정제를 포함한다. 일부 실시 형태에서, 번역 조정제는 각각의 발현 서열의 한 측 또는 양측에 존재하여, 발현 생성물, 예를 들어, 펩티드(들) 및 또는 폴리펩티드(들)의 분리를 초래한다.In some embodiments, the regulatory element is a translation modulator. A translation modulator can regulate the translation of an expression sequence in a polyribonucleotide. Translation modulators may be translation enhancers or inhibitors. In some embodiments, the polyribonucleotide includes at least one translation modulator adjacent to at least one expression sequence. In some embodiments, the polyribonucleotide includes a translation modulator adjacent to each expression sequence. In some embodiments, translation regulators are present on one or both sides of each expression sequence, resulting in isolation of the expression products, e.g., peptide(s) and/or polypeptide(s).
일부 실시 형태에서, 조절 요소는 마이크로RNA(miRNA) 또는 miRNA 결합 부위이다.In some embodiments, the regulatory element is a microRNA (miRNA) or miRNA binding site.
조절 요소의 추가의 예는 예를 들어, 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0154] 내지 [0161]에 기재되어 있다.Further examples of regulatory elements are described, for example, in paragraphs [0154] to [0161] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
절단 도메인cutting domain
본 개시내용의 원형 폴리리보뉴클레오티드는 절단 도메인(예를 들어, 스태거 요소 또는 절단 서열)을 포함할 수 있다.Circular polyribonucleotides of the present disclosure may include cleavage domains (e.g., stagger elements or cleavage sequences).
용어 "스태거 요소"는 번역 동안 리보솜 휴지를 유도하는 뉴클레오티드 서열과 같은 모이어티를 지칭한다. 일부 실시 형태에서, 스태거 요소는 강한 알파-나선 경향을 갖는 아미노산의 비-보존된 서열, 이어서 컨센서스 서열 -D(V/I)ExNPGP이고, 여기서 x= 임의의 아미노산(SEQ ID NO: 335)이다. 일부 실시 형태에서, 스태거 요소는 글리세롤, 비-핵산 연결 모이어티, 화학적 변형, 변형된 핵산, 또는 이들의 임의의 조합과 같은 화학적 모이어티를 포함할 수 있다.The term “stagger element” refers to a moiety, such as a nucleotide sequence, that induces ribosome pausing during translation. In some embodiments, the stagger element is a non-conserved sequence of amino acids with a strong alpha-helix tendency, followed by the consensus sequence -D(V/I)ExNPGP, where x = any amino acid (SEQ ID NO: 335) am. In some embodiments, the staggered element may include a chemical moiety such as glycerol, a non-nucleic acid linking moiety, a chemical modification, a modified nucleic acid, or any combination thereof.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 발현 서열에 인접한 적어도 하나의 스태거 요소를 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 각각의 발현 서열에 인접한 스태거 요소를 포함한다. 일부 실시 형태에서, 스태거 요소는 각각의 발현 서열의 한 측 또는 양측에 존재하여, 발현 생성물, 예를 들어, 펩티드(들) 및 또는 폴리펩티드(들)의 분리를 초래한다. 일부 실시 형태에서, 스태거 요소는 하나 이상의 발현 서열의 부분이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 이상의 발현 서열을 포함하고, 하나 이상의 발현 서열 각각은 원형 폴리리보뉴클레오티드 상의 스태거 요소에 의해 뒤이은 발현 서열로부터 분리된다. 일부 실시 형태에서, 스태거 요소는 (a) 단일 발현 서열의 번역의 2개 라운드로부터의 또는 (b) 2개 이상의 발현 서열의 번역의 하나 이상의 라운드로부터의 단일 폴리펩티드의 생성을 예방한다. 일부 실시 형태에서, 스태거 요소는 하나 이상의 발현 서열로부터 별개의 서열이다. 일부 실시 형태에서, 스태거 요소는 하나 이상의 발현 서열의 발현 서열의 부분을 포함한다.In some embodiments, the circular polyribonucleotide includes at least one stagger element adjacent to the expression sequence. In some embodiments, circular polyribonucleotides include stagger elements adjacent to each expression sequence. In some embodiments, stagger elements are present on one or both sides of each expression sequence, resulting in separation of the expression products, e.g., peptide(s) and/or polypeptide(s). In some embodiments, a stagger element is part of one or more expression sequences. In some embodiments, the circular polyribonucleotide comprises one or more expression sequences, each of the one or more expression sequences being separated from the subsequent expression sequence by a stagger element on the circular polyribonucleotide. In some embodiments, the stagger element prevents production of a single polypeptide (a) from two rounds of translation of a single expressed sequence or (b) from one or more rounds of translation of two or more expressed sequences. In some embodiments, the stagger element is a separate sequence from one or more expression sequences. In some embodiments, a staggered element comprises a portion of an expression sequence of one or more expression sequences.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 스태거 요소를 포함한다. 롤링 서클 번역을 유지하면서 연속 발현 생성물, 예를 들어 펩티드 또는 폴리펩티드의 생성을 회피하기 위해, 스태거 요소는 번역 동안 리보솜 휴지를 유도하기 위해 포함될 수 있다. 일부 실시 형태에서, 스태거 요소는 하나 이상의 발현 서열 중 적어도 하나의 3' 단부에 있다. 스태거 요소는 원형 폴리리보뉴클레오티드의 롤링 서클 번역 동안 리보솜을 멈추게 하도록 구성될 수 있다. 스태거 요소는 2A-유사, 또는 CHYSEL(SEQ ID NO: 336)(시스-작용 히드롤라제 요소) 서열을 포함할 수 있지만, 이에 한정되는 것은 아니다. 일부 실시 형태에서, 스태거 요소는 X1X2X3EX5NPGP(SEQ ID NO: 337)인 C-말단 컨센서스 서열을 갖는 서열을 인코딩하고, 여기서 X1은 부재하거나 G 또는 H이고, X2는 부재하거나 D 또는 G이고, X3은 D 또는 V 또는 I 또는 S 또는 M이고, X5는 임의의 아미노산이다. 일부 실시 형태에서, 이 서열은 강한 알파-나선 경향을 갖는 아미노산의 비-보존된 서열, 이어서 컨센서스 서열 -D(V/I)EXNPGP(SEQ ID NO: 338)를 포함하고, 여기서 x= 임의의 아미노산이다. 스태거 요소의 일부 비제한적인 예는In some embodiments, the circular polyribonucleotide includes a staggered element. To avoid the production of continuous expression products, such as peptides or polypeptides, while maintaining rolling circle translation, stagger elements can be included to induce ribosome pauses during translation. In some embodiments, the stagger element is at the 3' end of at least one of the one or more expression sequences. Stagger elements can be configured to stall ribosomes during rolling circle translation of circular polyribonucleotides. Stagger elements may include, but are not limited to, 2A-like, or CHYSEL (SEQ ID NO: 336) (cis-acting hydrolase element) sequences. In some embodiments, the stagger element encodes a sequence havingaC -terminalconsensus sequencethat is X12 is absent or is D or G, X3 is D or V or I or S or M, and X5 is any amino acid. In some embodiments, this sequence comprises a non-conserved sequence of amino acids with a strong alpha-helix tendency followed by the consensus sequence -D(V/I)EXNPGP (SEQ ID NO: 338), where x=any It is an amino acid. Some non-limiting examples of stagger elements are:
를 포함한다.Includes.
일부 실시 형태에서, 본원에 기재된 스태거 요소는 예컨대 본원에 기재된 컨센서스 서열의 G와 P 사이에서 발현 생성물을 절단한다. 한 비제한적인 예로서, 원형 폴리리보뉴클레오티드는 발현 생성물을 절단하기 위해 적어도 하나의 스태거 요소를 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 적어도 하나의 발현 서열에 인접한 스태거 요소를 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 각각의 발현 서열 뒤에 스태거 요소를 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 각각의 발현 서열의 한 측 또는 양측에 존재하는 스태거 요소를 포함하여, 각각의 발현 서열로부터의 개별적인 펩티드(들) 및/또는 폴리펩티드(들)의 번역을 초래한다.In some embodiments, a stagger element described herein cleaves the expression product, such as between G and P of a consensus sequence described herein. As a non-limiting example, the circular polyribonucleotide includes at least one stagger element to cleave the expression product. In some embodiments, the circular polyribonucleotide includes a stagger element adjacent to at least one expression sequence. In some embodiments, circular polyribonucleotides include a stagger element after each expression sequence. In some embodiments, the circular polyribonucleotide comprises stagger elements present on one or both sides of each expression sequence to allow translation of the individual peptide(s) and/or polypeptide(s) from each expression sequence. bring about
일부 실시 형태에서, 스태거 요소는 번역 동안 리보솜 휴지를 유도하는 하나 이상의 변형된 뉴클레오티드 또는 비천연 뉴클레오티드를 포함한다. 비천연 뉴클레오티드는 펩티드 핵산(PNA), 모르폴리노 및 잠금 핵산(LNA), 뿐만 아니라 글리콜 핵산(GNA) 및 트레오스 핵산(TNA)을 포함할 수 있다. 이들과 같은 예는 분자의 백본에 대한 변화에 의해 천연 발생 DNA 또는 RNA로부터 구별된다. 예시적인 변형은 번역 동안 리보솜 휴지를 유도할 수 있는 당, 핵염기, (예를 들어, 연결 포스페이트에 대한/포스포디에스테르 연결에 대한/포스포디에스테르 백본에 대한) 뉴클레오시드간 연결, 및 이들의 임의의 조합에 대한 임의의 변형을 포함할 수 있다. 본원에서 제공된 예시적인 변형의 일부는 본원의 다른 곳에 기재되어 있다.In some embodiments, the stagger element comprises one or more modified nucleotides or unnatural nucleotides that induce ribosome pausing during translation. Non-natural nucleotides may include peptide nucleic acids (PNAs), morpholino and locked nucleic acids (LNA), as well as glycol nucleic acids (GNA) and throse nucleic acids (TNA). Examples such as these are distinguished from naturally occurring DNA or RNA by changes to the backbone of the molecule. Exemplary modifications include sugars, nucleobases, internucleoside linkages (e.g., to a linking phosphate/to a phosphodiester linkage/to a phosphodiester backbone), and these that can induce ribosome pausing during translation. It may include any modification to any combination of. Some of the exemplary variations provided herein are described elsewhere herein.
일부 실시 형태에서, 스태거 요소는 다른 형태로 원형 폴리리보뉴클레오티드에 존재한다. 예를 들어, 일부 예시적인 원형 폴리리보뉴클레오티드에서, 스태거 요소는 원형 폴리리보뉴클레오티드 내의 제1 발현 서열의 종결 요소, 및 제1 발현 서열에 뒤이은 발현의 제1 번역 개시 서열로부터 종결 요소를 분리하는 뉴클레오티드 스페이서 서열을 포함한다. 일부 예에서, 제1 발현 서열의 제1 스태거 요소는 원형 폴리리보뉴클레오티드 내의 제1 발현 서열에 뒤이은 발현의 제1 번역 개시 서열의 상류(그에 대해 5')에 있다. 일부 경우에, 제1 발현 서열 및 제1 발현 서열에 뒤이은 발현 서열은 원형 폴리리보뉴클레오티드 내의 2개의 별개의 발현 서열이다. 제1 스태거 요소와 제1 번역 개시 서열 사이의 거리는 제1 발현 서열 및 그의 뒤이은 발현 서열의 연속적 번역을 가능하게 할 수 있다.In some embodiments, stagger elements are present in circular polyribonucleotides in different forms. For example, in some exemplary circular polyribonucleotides, the stagger element separates the termination element from the termination element of the first expression sequence within the circular polyribonucleotide and from the first translation initiation sequence of expression following the first expression sequence. It contains a nucleotide spacer sequence. In some examples, the first stagger element of the first expression sequence is upstream (5' relative to) the first translation initiation sequence of expression following the first expression sequence in the circular polyribonucleotide. In some cases, the first expression sequence and the expression sequence following the first expression sequence are two separate expression sequences within a circular polyribonucleotide. The distance between the first stagger element and the first translation initiation sequence can enable sequential translation of the first expression sequence and its subsequent expression sequence.
일부 실시 형태에서, 제1 스태거 요소는 종결 요소를 포함하고, 제1 발현 서열의 발현 생성물을 그의 뒤이은 발현 서열의 발현 생성물로부터 분리하고, 그에 의해 별개의 발현 생성물을 생성한다. 일부 경우에, 원형 폴리리보뉴클레오티드 내의 뒤이은 서열의 제1 번역 개시 서열의 상류에 제1 스태거 요소를 포함하는 원형 폴리리보뉴클레오티드는 연속적으로 번역되는 반면, 제2 발현 서열에 뒤이은 발현 서열의 제2 번역 개시 서열의 상류에 있는 제2 발현 서열의 스태거 요소를 포함하는 상응하는 원형 폴리리보뉴클레오티드는 연속적으로 번역되지 않는다. 일부 경우에, 원형 폴리리보뉴클레오티드에 단지 하나의 발현 서열이 존재하며, 제1 발현 서열 및 그의 뒤이은 발현 서열은 동일한 발현 서열이다. 일부 예시적인 원형 폴리리보뉴클레오티드에서, 스태거 요소는 원형 폴리리보뉴클레오티드 내의 제1 발현 서열의 제1 종결 요소, 및 종결 요소를 하류 번역 개시 서열로부터 분리하는 뉴클레오티드 스페이서 서열을 포함한다. 일부 이러한 예에서, 제1 스태거 요소는 원형 폴리리보뉴클레오티드 내의 제1 발현 서열의 제1 번역 개시 서열의 상류에(그에 대해 5'에) 있다. 일부 경우에, 제1 스태거 요소와 제1 번역 개시 서열 사이의 거리는 제1 발현 서열 및 임의의 뒤이은 발현 서열의 연속적 번역을 가능하게 한다.In some embodiments, the first stagger element comprises a termination element and separates the expression product of the first expression sequence from the expression product of its subsequent expression sequence, thereby producing a distinct expression product. In some cases, a circular polyribonucleotide comprising a first stagger element upstream of the first translation initiation sequence of the subsequent sequence in the circular polyribonucleotide is translated sequentially, while the expression sequence of the subsequent sequence in the circular polyribonucleotide is translated sequentially. The corresponding circular polyribonucleotide containing the stagger element of the second expression sequence upstream of the second translation initiation sequence is not translated continuously. In some cases, there is only one expression sequence in a circular polyribonucleotide, and the first expression sequence and the expression sequence following it are the same expression sequence. In some exemplary circular polyribonucleotides, the stagger element comprises a first termination element of the first expression sequence within the circular polyribonucleotide, and a nucleotide spacer sequence that separates the termination element from the downstream translation initiation sequence. In some such examples, the first stagger element is upstream (5' relative to) the first translation initiation sequence of the first expression sequence in the circular polyribonucleotide. In some cases, the distance between the first stagger element and the first translation initiation sequence allows sequential translation of the first expression sequence and any subsequent expression sequences.
일부 실시 형태에서, 제1 스태거 요소는 제1 발현 서열의 하나의 라운드 발현 생성물을 제1 발현 서열의 다음 라운드 발현 생성물로부터 분리하고, 그에 의해 별개의 발현 생성물을 생성한다. 일부 경우에, 원형 폴리리보뉴클레오티드 내의 제1 발현 서열의 제1 번역 개시 서열의 상류에 제1 스태거 요소를 포함하는 원형 폴리리보뉴클레오티드는 연속적으로 번역되는 반면, 상응하는 원형 폴리리보뉴클레오티드 내의 제2 발현 서열의 제2 번역 개시 서열의 상류에 스태거 요소를 포함하는 상응하는 원형 폴리리보뉴클레오티드는 연속적으로 번역되지 않는다. 일부 경우에, 제2 스태거 요소와 제2 번역 개시 서열 사이의 거리는 원형 폴리리보뉴클레오티드 내의 제1 스태거 요소와 제1 번역 개시 사이의 거리보다 상응하는 원형 폴리리보뉴클레오티드에서 적어도 2x, 3x, 4x, 5x, 6x, 7x, 8x, 9x, 또는 10x 더 크다. 일부 경우에, 제1 스태거 요소와 제1 번역 개시 사이의 거리는 적어도 2 nt, 3 nt, 4 nt, 5 nt, 6 nt, 7 nt, 8 nt, 9 nt, 10 nt, 11 nt, 12 nt, 13 nt, 14 nt, 15 nt, 16 nt, 17 nt, 18 nt, 19 nt, 20 nt, 25 nt, 30 nt, 35 nt, 40 nt, 45 nt, 50 nt, 55 nt, 60 nt, 65 nt, 70 nt, 75 nt, 또는 그 초과이다. 일부 실시 형태에서, 제2 스태거 요소와 제2 번역 개시 사이의 거리는 제1 스태거 요소와 제1 번역 개시 사이의 거리보다 적어도 2 nt, 3 nt, 4 nt, 5 nt, 6 nt, 7 nt, 8 nt, 9 nt, 10 nt, 11 nt, 12 nt, 13 nt, 14 nt, 15 nt, 16 nt, 17 nt, 18 nt, 19 nt, 20 nt, 25 nt, 30 nt, 35 nt, 40 nt, 45 nt, 50 nt, 55 nt, 60 nt, 65 nt, 70 nt, 75 nt, 또는 그 초과로 더 크다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 초과의 발현 서열을 포함한다.In some embodiments, the first stagger element separates one round of expression products of the first expression sequence from the next round of expression products of the first expression sequence, thereby producing distinct expression products. In some cases, a circular polyribonucleotide comprising a first stagger element upstream of the first translation initiation sequence of the first expression sequence within the circular polyribonucleotide is translated sequentially, while the second stagger element within the corresponding circular polyribonucleotide The corresponding circular polyribonucleotide containing a stagger element upstream of the second translation initiation sequence of the expression sequence is not translated continuously. In some cases, the distance between the second stagger element and the second translation initiation sequence is at least 2x, 3x, 4x in the corresponding circular polyribonucleotide than the distance between the first translation initiation and the first stagger element in the circular polyribonucleotide. , 5x, 6x, 7x, 8x, 9x, or 10x larger. In some cases, the distance between the first stagger element and the first translation initiation is at least 2 nt, 3 nt, 4 nt, 5 nt, 6 nt, 7 nt, 8 nt, 9 nt, 10 nt, 11 nt, 12 nt. , 13 nt, 14 nt, 15 nt, 16 nt, 17 nt, 18 nt, 19 nt, 20 nt, 25 nt, 30 nt, 35 nt, 40 nt, 45 nt, 50 nt, 55 nt, 60 nt, 65 nt, 70 nt, 75 nt, or more. In some embodiments, the distance between the second staggered element and the second translation start is at least 2 nt, 3 nt, 4 nt, 5 nt, 6 nt, 7 nt less than the distance between the first staggered element and the first translation start. , 8 nt, 9 nt, 10 nt, 11 nt, 12 nt, 13 nt, 14 nt, 15 nt, 16 nt, 17 nt, 18 nt, 19 nt, 20 nt, 25 nt, 30 nt, 35 nt, 40 nt, 45 nt, 50 nt, 55 nt, 60 nt, 65 nt, 70 nt, 75 nt, or greater. In some embodiments, the circular polyribonucleotide includes more than one expression sequence.
스태거 요소의 예는 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0172] 내지 [0175]에 기재되어 있다.Examples of staggered elements are described in paragraphs [0172] to [0175] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
일부 실시 형태에서, 원형 리보뉴클레오티드에 의해 인코딩된 복수의 항푸소제닉 폴리펩티드는 각각의 항푸소제닉 폴리펩티드 사이의 IRES에 의해 분리될 수 있다(예를 들어, 각각의 항푸소제닉 폴리펩티드는 별개의 IRES에 작동가능하게 연결된다). 예를 들어, 원형 폴리리보뉴클레오티드는 제1 발현 서열에 작동가능하게 연결된 제1 IRES 및 제2 발현 서열에 작동가능하게 연결된 제2 IRES를 포함할 수 있다. IRES는 모든 항푸소제닉 폴리펩티드 사이에서 동일한 IRES일 수 있다. IRES는 상이한 항푸소제닉 폴리펩티드 사이에서 상이할 수 있다.In some embodiments, a plurality of antifusogenic polypeptides encoded by circular ribonucleotides may be separated by an IRES between each antifusogenic polypeptide (e.g., each antifusogenic polypeptide may have a separate IRES). operably connected). For example, a circular polyribonucleotide can include a first IRES operably linked to a first expression sequence and a second IRES operably linked to a second expression sequence. The IRES may be the same IRES among all antifusogenic polypeptides. IRES may differ between different antifusogenic polypeptides.
일부 실시 형태에서, 복수의 항푸소제닉 폴리펩티드는 2A 자가-절단 펩티드에 의해 분리될 수 있다. 예를 들어, 원형 폴리리보뉴클레오티드는 제1 항푸소제닉 폴리펩티드, 2A 및 제2 항푸소제닉 폴리펩티드를 인코딩하는 오픈 리딩 프레임에 작동가능하게 연결된 IRES를 인코딩할 수 있다.In some embodiments, multiple antifusogenic polypeptides can be separated by a 2A self-cleaving peptide. For example, a circular polyribonucleotide can encode an IRES operably linked to an open reading frame encoding a first antifusogenic polypeptide, 2A, and a second antifusogenic polypeptide.
일부 실시 형태에서, 복수의 항푸소제닉 폴리펩티드는 프로테아제 절단 부위(예를 들어, 푸린 절단 부위)에 의해 분리될 수 있다. 예를 들어, 원형 폴리리보뉴클레오티드는 제1 항푸소제닉 폴리펩티드, 프로테아제 절단 부위(예를 들어, 푸린 절단 부위) 및 제2 항푸소제닉 폴리펩티드를 인코딩하는 오픈 리딩 프레임에 작동가능하게 연결된 IRES를 인코딩할 수 있다.In some embodiments, a plurality of antifusogenic polypeptides may be separated by a protease cleavage site (e.g., a furin cleavage site). For example, the circular polyribonucleotide may encode an IRES operably linked to an open reading frame encoding a first antifusogenic polypeptide, a protease cleavage site (e.g., a furin cleavage site), and a second antifusogenic polypeptide. You can.
일부 실시 형태에서, 복수의 항푸소제닉 폴리펩티드는 2A 자가-절단 펩티드 및 프로테아제 절단 부위(예를 들어, 푸린 절단 부위)에 의해 분리될 수 있다. 예를 들어, 원형 폴리리보뉴클레오티드는 제1 항푸소제닉 폴리펩티드, 2A, 프로테아제 절단 부위(예를 들어, 푸린 절단 부위), 및 제2 항푸소제닉 폴리펩티드를 인코딩하는 오픈 리딩 프레임에 작동가능하게 연결된 IRES를 인코딩할 수 있다. 원형 폴리리보뉴클레오티드는 또한 제1 항푸소제닉 폴리펩티드, 프로테아제 절단 부위(예를 들어, 푸린 절단 부위), 2A, 및 제2 항푸소제닉 폴리펩티드를 인코딩하는 오픈 리딩 프레임에 작동가능하게 연결된 IRES를 인코딩할 수 있다. 탠덤 2A 및 푸린 절단 부위는 푸린-2A(어느 배향으로든 배열된 푸린-2A 또는 2A-푸린을 포함함)로 지칭될 수 있다.In some embodiments, a plurality of antifusogenic polypeptides may be separated by a 2A self-cleaving peptide and a protease cleavage site (e.g., a furin cleavage site). For example, the circular polyribonucleotide may comprise an IRES operably linked to an open reading frame encoding a first antifusogenic polypeptide, 2A, a protease cleavage site (e.g., a furin cleavage site), and a second antifusogenic polypeptide. can be encoded. The circular polyribonucleotide may also encode a first antifusogenic polypeptide, a protease cleavage site (e.g., a furin cleavage site), 2A, and an IRES operably linked to an open reading frame encoding a second antifusogenic polypeptide. You can. The tandem 2A and furin cleavage site may be referred to as furin-2A (including furin-2A or 2A-furin arranged in either orientation).
또한, 원형 리보뉴클레오티드에 의해 인코딩된 복수의 항푸소제닉 폴리펩티드는 IRES 및 2A 서열 둘 모두에 의해 분리될 수 있다. 예를 들어, IRES는 하나의 항푸소제닉 폴리펩티드와 제2 항푸소제닉 폴리펩티드 사이에 있을 수 있는 반면, 2A 펩티드는 제2 항푸소제닉 폴리펩티드와 제3 항푸소제닉 폴리펩티드 사이에 있을 수 있다. 특정 IRES 또는 2A 자가-절단 펩티드의 선택은 IRES 또는 2A 서열의 제어 하에 항푸소제닉 폴리펩티드의 발현 수준을 제어하는 데 사용될 수 있다. 예를 들어, 선택된 IRES 및 또는 2A 펩티드에 따라, 폴리펩티드에서의 발현은 더 많거나 더 적을 수 있다.Additionally, multiple antifusogenic polypeptides encoded by circular ribonucleotides can be separated by both IRES and 2A sequences. For example, an IRES may be between one antifusogenic polypeptide and a second antifusogenic polypeptide, while a 2A peptide may be between a second antifusogenic polypeptide and a third antifusogenic polypeptide. Selection of a specific IRES or 2A self-cleaving peptide can be used to control the expression level of the antifusogenic polypeptide under the control of the IRES or 2A sequence. For example, depending on the IRES and or 2A peptide selected, there may be more or less expression in the polypeptide.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 적어도 하나의 절단 서열을 포함한다. 일부 실시 형태에서, 절단 서열은 발현 서열에 인접한다. 일부 실시 형태에서, 절단 서열은 2개의 발현 서열 사이에 존재한다. 일부 실시 형태에서, 절단 서열은 발현 서열 내에 포함된다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 2 내지 10개의 절단 서열을 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 2 내지 5개의 절단 서열을 포함한다. 일부 실시 형태에서, 다수의 절단 서열은 다수의 발현 서열 사이에 존재하고; 예를 들어, 원형 폴리리보뉴클레오티드는 각각의 발현 서열 사이에 절단 서열이 존재하도록 3개의 발현 서열, 2개의 절단 서열을 포함할 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 절단 서열, 예컨대 이몰레이팅(immolating) circRNA 또는 절단 가능한 circRNA 또는 자가-절단 circRNA를 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 2개 이상의 절단 서열을 포함하여, 원형 폴리리보뉴클레오티드를 다수의 생성물, 예를 들어 miRNA, 선형 RNA, 더 작은 원형 폴리리보뉴클레오티드 등으로의 분리를 초래한다.In some embodiments, the circular polyribonucleotide includes at least one cleavage sequence. In some embodiments, the cleavage sequence is adjacent to the expression sequence. In some embodiments, the cleavage sequence is between two expression sequences. In some embodiments, the cleavage sequence is included within the expression sequence. In some embodiments, the circular polyribonucleotide comprises 2 to 10 cleavage sequences. In some embodiments, the circular polyribonucleotide includes 2 to 5 cleavage sequences. In some embodiments, multiple cleavage sequences are between multiple expression sequences; For example, a circular polyribonucleotide may include three expression sequences, two cleavage sequences, such that there is a cleavage sequence between each expression sequence. In some embodiments, the circular polyribonucleotide comprises a cleavage sequence, such as an immolating circRNA or a cleavable circRNA or a self-cleaving circRNA. In some embodiments, the circular polyribonucleotide comprises two or more cleavage sequences, resulting in separation of the circular polyribonucleotide into multiple products, such as miRNA, linear RNA, smaller circular polyribonucleotides, etc.
일부 실시 형태에서, 절단 서열은 리보자임 RNA 서열을 포함한다. 리보자임(리보핵산 효소로부터 유래하며, 또한 RNA 효소 또는 촉매 RNA라고도 함)은 화학 반응을 촉매하는 RNA 분자이다. 많은 천연 리보자임은 그들 자신의 포스포디에스테르 결합 중 하나의 가수분해 또는 다른 RNA에서의 결합의 가수분해 중 어느 하나를 촉매하지만 이들은 또한 리보솜의 아미노트랜스퍼라제 활성도 촉매하는 것으로 확인되었다. 촉매 RNA는 시험관내 방법에 의해 "진화"될 수 있다. 위에서 논의한 리보스위치 활성과 유사하게, 리보자임 및 그 반응 생성물은 유전자 발현을 조절할 수 있다. 일부 실시 형태에서, 촉매 RNA 또는 리보자임은 리보자임이 벌크 부피로부터 분자의 화학적 형질전환을 목적으로 세포 내의 많은 카피로 존재하도록 더 큰 비-코딩 RNA 내에 배치될 수 있다. 일부 실시 형태에서, 압타머 및 리보자임 둘 모두는 동일한 비-코딩 RNA에서 인코딩될 수 있다.In some embodiments, the cleavage sequence comprises a ribozyme RNA sequence. Ribozymes (derived from ribonucleic acid enzymes, also called RNA enzymes or catalytic RNAs) are RNA molecules that catalyze chemical reactions. Many natural ribozymes catalyze either the hydrolysis of one of their own phosphodiester bonds or the hydrolysis of a bond in another RNA, but they have also been shown to catalyze the aminotransferase activity of ribosomes. Catalytic RNA can be “evolved” by in vitro methods. Similar to the riboswitch activities discussed above, ribozymes and their reaction products can regulate gene expression. In some embodiments, the catalytic RNA or ribozyme may be placed within a larger non-coding RNA such that the ribozyme is present in many copies within the cell for the purpose of chemical transformation of the molecule from the bulk volume. In some embodiments, both aptamer and ribozyme can be encoded in the same non-coding RNA.
일부 실시 형태에서, 절단 서열은 절단가능한 폴리펩티드 링커를 인코딩한다. 예를 들어, 폴리리보뉴클레오티드는 2개 이상의 항푸소제닉 폴리펩티드를 인코딩할 수 있으며, 예를 들어, 2개 이상의 항푸소제닉 폴리펩티드는 단일 오픈 리딩 프레임(ORF)에 의해 인코딩된다. 예를 들어, 2개 이상의 항푸소제닉 폴리펩티드는 IRES에 의해 그의 발현이 조절되는 단일 오픈 리딩 프레임에 의해 인코딩될 수 있다. 일부 실시 형태에서, ORF는 폴리펩티드 링커를 추가로 인코딩하여, 예를 들어, ORF의 발현 생성물이 폴리펩티드 링커(예를 들어, 5 내지 200개, 5 내지 100개, 5 내지 50개, 5 내지 20개, 50 내지 100개, 또는 50 내지 200개 아미노산의 링커)를 인코딩하는 서열에 의해 각각 분리된 2개 이상의 항푸소제닉 폴리펩티드를 인코딩하도록 한다. 폴리펩티드 링커는 절단 부위, 예를 들어, 프로테아제(예를 들어, 폴리리보뉴클레오티드를 대상체에게 투여한 후의 그 대상체 내의 내인성 프로테아제)에 의해 인식되고 절단되는 절단 부위를 포함할 수 있다. 이러한 실시 형태에서, 2개 이상의 항푸소제닉 폴리펩티드의 아미노산 서열을 포함하는 단일 발현 생성물은 발현 시 절단되고, 그에 따라 2개 이상의 항푸소제닉 폴리펩티드가 발현 후 분리된다. 예시적인 프로테아제 절단 부위는 당업자에게 알려져 있으며, 예를 들어, 메탈로프로테이나제(예를 들어, 매트릭스 메탈로프로테이나제(MMP), 예컨대 MMP 1 내지 28 중 임의의 하나 이상), 디스인테그린 및 메탈로프로테이나제(ADAM, 예컨대 ADAM 2, 7 내지 12, 15, 17 내지 23, 28 내지 30 및 33 중 임의의 하나 이상), 세린 프로테아제(예를 들어, 푸린), 우로키나제-유형 플라스미노겐 활성화제, 마트립타제, 시스테인 프로테아제, 아스파르트산 프로테아제, 또는 카텝신 프로테아제에 의해 인식되는 프로테아제 절단 부위로서 작용하는 아미노산 서열이다. 일부 실시 형태에서, 프로테아제는 MMP9 또는 MMP2이다. 일부 실시 형태에서, 프로테아제는 마트립타제이다.In some embodiments, the cleavage sequence encodes a cleavable polypeptide linker. For example, a polyribonucleotide may encode two or more antifusogenic polypeptides, e.g., two or more antifusogenic polypeptides are encoded by a single open reading frame (ORF). For example, two or more antifusogenic polypeptides can be encoded by a single open reading frame whose expression is regulated by an IRES. In some embodiments, the ORF further encodes a polypeptide linker, e.g., such that the expression product of the ORF has a polypeptide linker (e.g., 5-200, 5-100, 5-50, 5-20). , a linker of 50 to 100 amino acids, or a linker of 50 to 200 amino acids), each separated by a sequence encoding two or more antifusogenic polypeptides. A polypeptide linker may comprise a cleavage site, e.g., a cleavage site that is recognized and cleaved by a protease (e.g., an endogenous protease in a subject after administration of a polyribonucleotide to the subject). In this embodiment, a single expression product comprising the amino acid sequences of two or more antifusogenic polypeptides is cleaved upon expression, such that the two or more antifusogenic polypeptides are separated after expression. Exemplary protease cleavage sites are known to those skilled in the art and include, for example, metalloproteinases (e.g., any one or more of matrix metalloproteinases (MMPs), such as
일부 실시 형태에서, 본원에 기재된 원형 폴리리보뉴클레오티드는 이몰레이팅 원형 폴리리보뉴클레오티드, 절단가능한 원형 폴리리보뉴클레오티드, 또는 자가-절단 원형 폴리리보뉴클레오티드이다. 원형 폴리리보뉴클레오티드는 예를 들어, RNA, lncRNA, lincRNA, miRNA, tRNA, rRNA, snoRNA, ncRNA, siRNA, 또는 shRNA를 포함하는 세포 구성성분을 전달할 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 (i) 자가-절단가능한 요소; (ii) 절단 모집 부위; (iii) 분해가능한 링커; (iv) 화학적 링커; 및/또는 (v) 스페이서 서열에 의해 분리된 miRNA를 포함한다. 일부 실시 형태에서, circRNA는 (i) 자가-절단가능한 요소; (ii) 절단 모집 부위(예를 들어, ADAR); (iii) 분해가능한 링커(예를 들어, 글리세롤); (iv) 화학적 링커; 및/또는 (v) 스페이서 서열에 의해 분리된 siRNA를 포함한다. 자가-절단가능한 요소의 비제한적인 예는 해머헤드, 스플라이싱 요소, 헤어핀, 간염 델타 바이러스(HDV), 바르쿠드 새틀라이트(VS), 및glmS 리보자임을 포함한다.In some embodiments, the circular polyribonucleotides described herein are imolarizing circular polyribonucleotides, cleavable circular polyribonucleotides, or self-cleavable circular polyribonucleotides. Circular polyribonucleotides can deliver cellular components, including, for example, RNA, lncRNA, lincRNA, miRNA, tRNA, rRNA, snoRNA, ncRNA, siRNA, or shRNA. In some embodiments, the circular polyribonucleotide comprises (i) a self-cleavable element; (ii) cleavage recruitment site; (iii) a cleavable linker; (iv) chemical linker; and/or (v) a miRNA separated by a spacer sequence. In some embodiments, the circRNA includes (i) a self-cleavable element; (ii) cleavage recruitment site (e.g., ADAR); (iii) a cleavable linker (eg, glycerol); (iv) chemical linker; and/or (v) siRNA separated by a spacer sequence. Non-limiting examples of self-cleavable elements include hammerheads, splicing elements, hairpins, hepatitis delta virus (HDV), Barkud satellite (VS), andglm S ribozymes.
번역 개시 서열translation initiation sequence
일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 폴리리보뉴클레오티드의 폴리리보뉴클레오티드 카고)는 적어도 하나의 번역 개시 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 발현 서열에 작동가능하게 연결된 번역 개시 서열을 포함한다.In some embodiments, a polyribonucleotide described herein (e.g., a polyribonucleotide cargo of a polyribonucleotide) includes at least one translation initiation sequence. In some embodiments, the polyribonucleotide comprises a translation initiation sequence operably linked to an expression sequence.
일부 실시 형태에서, 폴리리보뉴클레오티드는 폴리펩티드를 인코딩하고, 번역 개시 서열, 예를 들어, 시작 코돈을 포함할 수 있다. 일부 실시 형태에서, 번역 개시 서열은 코작(Kozak) 또는 샤인-달가노(Shine-Dalgarno) 서열을 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 발현 서열에 인접한 번역 개시 서열, 예를 들어, 코작 서열을 포함한다. 일부 실시 형태에서, 번역 개시 서열은 비-코딩 시작 코돈이다. 일부 실시 형태에서, 번역 개시 서열, 예를 들어, 코작 서열은 각각의 발현 서열의 한 측 또는 양측에 존재하여, 발현 생성물의 분리를 초래한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 발현 서열에 인접한 적어도 하나의 번역 개시 서열을 포함한다. 일부 실시 형태에서, 번역 개시 서열은 폴리리보뉴클레오티드에 대한 형태적 유연성을 제공한다. 일부 실시 형태에서, 번역 개시 서열은 폴리리보뉴클레오티드의 실질적으로 단일 가닥 영역 내에 있다. 번역 개시 서열의 추가의 예는 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0163] 내지 [0165]에 기재되어 있다.In some embodiments, the polyribonucleotide encodes a polypeptide and may include a translation initiation sequence, such as a start codon. In some embodiments, the translation initiation sequence comprises a Kozak or Shine-Dalgarno sequence. In some embodiments, the polyribonucleotide comprises a translation initiation sequence adjacent to the expression sequence, such as a Kozak sequence. In some embodiments, the translation initiation sequence is a non-coding start codon. In some embodiments, a translation initiation sequence, such as a Kozak sequence, is present on one or both sides of each expression sequence, resulting in isolation of the expression products. In some embodiments, the polyribonucleotide includes at least one translation initiation sequence adjacent to the expression sequence. In some embodiments, the translation initiation sequence provides conformational flexibility for the polyribonucleotide. In some embodiments, the translation initiation sequence is within a substantially single-stranded region of the polyribonucleotide. Additional examples of translation initiation sequences are described in paragraphs [0163] to [0165] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
폴리리보뉴클레오티드는 1개 초과의 시작 코돈, 예컨대 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 적어도 6개, 적어도 7개, 적어도 8개, 적어도 9개, 적어도 10개, 적어도 11개, 적어도 12개, 적어도 13개, 적어도 14개, 적어도 15개, 적어도 16개, 적어도 17개, 적어도 18개, 적어도 19개, 적어도 20개, 적어도 25개, 적어도 30개, 적어도 35개, 적어도 40개, 적어도 50개, 적어도 60개 또는 60개 초과의 시작 코돈(그러나 이에 한정되는 것은 아님)을 포함할 수 있다. 번역은 제1 시작 코돈 상에서 개시될 수 있거나, 제1 시작 코돈의 하류에서 개시될 수 있다.The polyribonucleotide may have more than one start codon, such as at least 2, at least 3, at least 4, at least 5, at least 6, at least 7, at least 8, at least 9, at least 10, at least 11. at least 12, at least 13, at least 14, at least 15, at least 16, at least 17, at least 18, at least 19, at least 20, at least 25, at least 30, at least 35, It may include (but is not limited to) at least 40, at least 50, at least 60 or more than 60 start codons. Translation can be initiated on the first start codon or can be initiated downstream of the first start codon.
일부 실시 형태에서, 폴리리보뉴클레오티드는 제1 시작 코돈이 아닌 코돈, 예를 들어, AUG에서 개시될 수 있다. 폴리리보뉴클레오티드의 번역은 대안적인 번역 개시 서열, 예컨대 ACG, AGG, AAG, CTG/CUG, GTG/GUG, ATA/AUA, ATT/AUU, TTG/UUG(그러나 이에 한정되는 것은 아님)에서 개시될 수 있다. 일부 실시 형태에서, 번역은 선택적 조건, 예를 들어, 스트레스 유도 조건 하에서 대안적인 번역 개시 서열에서 시작한다. 비제한적인 예로서, 폴리리보뉴클레오티드의 번역은 대안적인 번역 개시 서열, 예컨대 ACG에서 시작할 수 있다. 또 다른 비제한적인 예로서, 폴리리보뉴클레오티드 번역은 대안적인 번역 개시 서열, CTG/CUG에서 시작할 수 있다. 또 다른 비제한적인 예로서, 폴리리보뉴클레오티드 번역은 대안적인 번역 개시 서열, GTG/GUG에서 시작할 수 있다. 또 다른 비제한적인 예로서, 폴리리보뉴클레오티드는 반복부-관련 비-AUG(RAN) 서열, 예컨대 반복적 RNA의 짧은 구간을 포함하는 대안적인 번역 개시 서열, 예를 들어, CGG, GGGGCC, CAG, CTG에서 번역을 시작할 수 있다.In some embodiments, the polyribonucleotide may start at a codon other than the first start codon, such as AUG. Translation of polyribonucleotides can be initiated at alternative translation initiation sequences, such as, but not limited to, ACG, AGG, AAG, CTG/CUG, GTG/GUG, ATA/AUA, ATT/AUU, TTG/UUG. there is. In some embodiments, translation begins at an alternative translation initiation sequence under selective conditions, such as stress-inducing conditions. As a non-limiting example, translation of a polyribonucleotide can begin at an alternative translation initiation sequence, such as ACG. As another non-limiting example, polyribonucleotide translation can begin at an alternative translation initiation sequence, CTG/CUG. As another non-limiting example, polyribonucleotide translation can begin at an alternative translation initiation sequence, GTG/GUG. As another non-limiting example, a polyribonucleotide may be a repeat-related non-AUG (RAN) sequence, such as an alternative translation initiation sequence comprising a short segment of repetitive RNA, e.g., CGG, GGGGCC, CAG, CTG. You can start translation from .
종결 요소Termination Element
일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 폴리리보뉴클레오티드의 폴리리보뉴클레오티드 카고)는 최소 하나의 종결 요소를 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 발현 서열에 작동가능하게 연결된 종결 요소를 포함한다. 일부 실시 형태에서, 폴리뉴클레오티드는 종결 요소를 결여한다.In some embodiments, a polyribonucleotide described herein (e.g., a polyribonucleotide cargo of a polyribonucleotide) includes at least one termination element. In some embodiments, the polyribonucleotide includes a termination element operably linked to the expression sequence. In some embodiments, the polynucleotide lacks a termination element.
일부 실시 형태에서, 폴리리보뉴클레오티드는 하나 이상의 발현 서열을 포함하고, 각각의 발현 서열은 종결 요소를 가질 수 있거나 갖지 않을 수 있다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 하나 이상의 발현 서열을 포함하고, 발현 서열은, 폴리리보뉴클레오티드가 연속적으로 번역되도록, 종결 요소를 결여한다. 종결 요소의 배제는 발현 생성물의 롤링 서클 번역 또는 연속적 발현을 발생시킬 수 있다.In some embodiments, the polyribonucleotide comprises one or more expression sequences, each expression sequence may or may not have a termination element. In some embodiments, the polyribonucleotide comprises one or more expression sequences, and the expression sequences lack a termination element such that the polyribonucleotide is translated continuously. Exclusion of termination elements can result in rolling circle translation or continuous expression of the expression product.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 이상의 발현 서열을 포함하고, 각각의 발현 서열은 종결 요소를 가질 수 있거나 갖지 않을 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 이상의 발현 서열을 포함하고, 발현 서열은, 원형 폴리리보뉴클레오티드가 연속적으로 번역되도록, 종결 요소를 결여한다. 종결 요소의 배제는 리보솜 멈춤 또는 탈락의 결여로 인해, 발현 생성물, 예를 들어, 펩티드 또는 폴리펩티드의 롤링 서클 번역 또는 연속적 발현을 발생시킬 수 있다. 이러한 실시 형태에서, 롤링 서클 번역은 각각의 발현 서열을 통해 연속적 발현 생성물을 발현시킨다. 일부 다른 실시 형태에서, 발현 서열의 종결 요소는 스태거 요소의 일부일 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드 내의 하나 이상의 발현 서열은 종결 요소를 포함한다. 그러나, 원형 폴리리보뉴클레오티드 내의 뒤이은(예를 들어, 제2, 제3, 제4, 제5 등의) 발현 서열의 롤링 서클 번역 또는 발현이 수행된다. 이러한 경우에, 발현 생성물은 리보솜이 종결 요소, 예를 들어, 정지 코돈에 직면할 때 리보솜을 탈락시킬 수 있고, 번역을 종결시킨다. 일부 실시 형태에서, 번역은 리보솜, 예를 들어, 리보솜의 적어도 하나의 서브유닛이 원형 폴리리보뉴클레오티드와 접촉하여 남아 있는 동안 종결된다.In some embodiments, the circular polyribonucleotide comprises one or more expression sequences, each expression sequence may or may not have a termination element. In some embodiments, the circular polyribonucleotide comprises one or more expression sequences, and the expression sequences lack a termination element such that the circular polyribonucleotide is translated continuously. Exclusion of a termination element can result in rolling circle translation or continuous expression of the expression product, e.g., a peptide or polypeptide, due to lack of ribosome pausing or shedding. In this embodiment, rolling circle translation results in sequential expression products through each expression sequence. In some other embodiments, the termination element of the expression sequence may be part of a stagger element. In some embodiments, one or more expression sequences within the circular polyribonucleotide include a termination element. However, rolling circle translation or expression of subsequent (e.g., second, third, fourth, fifth, etc.) expression sequences within the circular polyribonucleotide is performed. In these cases, the expression product can dislodge the ribosome when the ribosome encounters a termination element, such as a stop codon, and terminate translation. In some embodiments, translation is terminated while the ribosome, e.g., at least one subunit of the ribosome, remains in contact with the circular polyribonucleotide.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 이상의 발현 서열의 단부에 종결 요소를 포함한다. 일부 실시 형태에서, 하나 이상의 발현 서열은 잇달아 2개 이상의 종결 요소를 포함한다. 이러한 실시 형태에서, 번역은 종결되고, 롤링 서클 번역은 종결된다. 일부 실시 형태에서, 리보솜은 원형 폴리리보뉴클레오티드와 완전히 탈착된다. 일부 이러한 실시 형태에서, 원형 폴리리보뉴클레오티드 내의 뒤이은(예를 들어, 제2, 제3, 제4, 제5 등의) 발현 서열의 생성은 번역의 개시 전에 리보솜이 원형 폴리리보뉴클레오티드와 재결착하는 것을 요구할 수 있다. 일반적으로, 종결 요소는 번역의 종결을 신호화하는 프레임내 뉴클레오티드 삼중자, 예를 들어, UAA, UGA, UAG를 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드 내의 하나 이상의 종결 요소는 프레임-이동된 종결 요소, 예컨대 번역을 종결시킬 수 있는 오프-프레임 또는 -1 및 + 1 이동된 리딩 프레임(예를 들어, 히든 스톱)(그러나 이에 한정되는 것은 아님)이다. 프레임-이동된 종결 요소는 발현 서열의 제2 및 제3 리딩 프레임에서 보이는 뉴클레오티드 삼중자, TAA, TAG, 및 TGA를 포함한다. 프레임-이동된 종결 요소는 종종 세포에 유해한 mRNA의 오해독을 방지하는 데 있어서 중요할 수 있다. 일부 실시 형태에서, 종결 요소는 정지 코돈이다.In some embodiments, the circular polyribonucleotide includes termination elements at the ends of one or more expression sequences. In some embodiments, one or more expression sequences include two or more termination elements in a row. In this embodiment, the translation is terminated and the rolling circle translation is terminated. In some embodiments, the ribosome is completely detached from the circular polyribonucleotide. In some such embodiments, generation of subsequent (e.g., second, third, fourth, fifth, etc.) expression sequences within the circular polyribonucleotide occurs when the ribosome re-associates with the circular polyribonucleotide prior to initiation of translation. You can request that. Typically, termination elements include in-frame nucleotide triplets that signal termination of translation, such as UAA, UGA, UAG. In some embodiments, one or more termination elements within the circular polyribonucleotide are frame-shifted termination elements, such as off-frame or -1 and + 1 shifted reading frames that can terminate translation (e.g., hidden stops). (but is not limited to this). Frame-shifted termination elements include nucleotide triplets, TAA, TAG, and TGA, seen in the second and third reading frames of the expression sequence. Frame-shifted termination elements can be important in preventing misreading of mRNA, which is often detrimental to the cell. In some embodiments, the termination element is a stop codon.
종결 요소의 추가의 예는 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0169] 내지 [0170]에 기재되어 있다.Additional examples of termination elements are described in paragraphs [0169] to [0170] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
비번역된 영역untranslated area
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 비번역된 영역(UTR)을 포함한다. 유전자를 포함하는 게놈 영역의 UTR은 전사되지만 번역되지 않을 수 있다. 일부 실시 형태에서, UTR은 본원에 기재된 발현 서열의 번역 개시 서열의 상류에 포함될 수 있다. 일부 실시 형태에서, UTR은 본원에 기재된 발현 서열의 하류에 포함될 수 있다. 일부 경우에, 제1 발현 서열에 대한 하나의 UTR은 제2 발현 서열에 대한 또 다른 UTR과 동일하거나, 그와 연속적이거나 그와 중첩한다. 일부 실시 형태에서, 인트론은 인간 인트론이다. 일부 실시 형태에서, 인트론은 전장 인간 인트론, 예를 들어, ZKSCAN1이다.In some embodiments, the circular polyribonucleotide includes an untranslated region (UTR). The UTR of a genomic region containing a gene may be transcribed but not translated. In some embodiments, the UTR may be included upstream of the translation initiation sequence of the expression sequence described herein. In some embodiments, UTRs may be included downstream of the expression sequences described herein. In some cases, one UTR for the first expression sequence is identical to, contiguous with, or overlaps another UTR for the second expression sequence. In some embodiments, the intron is a human intron. In some embodiments, the intron is a full-length human intron, e.g., ZKSCAN1.
예시적인 비번역된 영역은 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0197] 내지 [201]에 기재되어 있다.Exemplary untranslated regions are described in paragraphs [0197] to [201] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 폴리A 서열을 포함한다. 예시적인 폴리A 서열은 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0202] 내지 [0205]에 기재되어 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 폴리A 서열을 결여한다.In some embodiments, the circular polyribonucleotide comprises a polyA sequence. Exemplary polyA sequences are described in paragraphs [0202] to [0205] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety. In some embodiments, the circular polyribonucleotide lacks a polyA sequence.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 아데노신과 우리딘이 그 안에 내포되어 있는 하나 이상의 구간을 갖는 UTR을 포함한다. 이들 AU 풍부 특징은 발현 생성물의 턴오버 속도를 증가시킬 수 있다.In some embodiments, the circular polyribonucleotide comprises a UTR having one or more segments within which adenosine and uridine are nested. These AU enrichment features can increase the turnover rate of the expression product.
UTR AU 풍부 요소(ARE)의 도입, 제거, 또는 변형은 원형 폴리리보뉴클레오티드의 안정성, 또는 면역원성(예를 들어, 면역 또는 염증 반응의 하나 이상의 마커의 수준)을 조정하는 데 유용할 수 있다. 특정 원형 폴리리보뉴클레오티드를 조작하는 경우, ARE의 하나 이상의 카피는 원형 폴리리보뉴클레오티드에 도입될 수 있고, ARE의 카피는 발현 생성물의 번역 및/또는 생성을 조정할 수 있다. 마찬가지로, ARE는 확인되고 제거되거나 원형 폴리리보뉴클레오티드 내로 조작되어 세포내 안정성을 조정하고, 따라서 생성된 단백질의 번역 및 생성에 영향을 미칠 수 있다.Introducing, removing, or modifying a UTR AU rich element (ARE) may be useful to adjust the stability, or immunogenicity (e.g., the level of one or more markers of an immune or inflammatory response) of a circular polyribonucleotide. When engineering a particular circular polyribonucleotide, one or more copies of an ARE can be introduced into the circular polyribonucleotide, and the copies of the ARE can modulate the translation and/or production of the expression product. Likewise, AREs can be identified and removed or engineered into circular polyribonucleotides to modulate intracellular stability and thus influence translation and production of the resulting protein.
임의의 유전자로부터의 임의의 UTR은 원형 폴리리보뉴클레오티드의 각각의 플랭킹 영역 내로 혼입될 수 있음을 이해해야 한다.It should be understood that any UTR from any gene may be incorporated into each flanking region of the circular polyribonucleotide.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 5'-UTR을 결여하고, 그의 하나 이상의 발현 서열로부터의 단백질 발현을 위해 적격이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 3'-UTR을 결여하고, 그의 하나 이상의 발현 서열로부터의 단백질 발현을 위해 적격이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 폴리A 서열을 결여하고, 그의 하나 이상의 발현 서열로부터의 단백질 발현을 위해 적격이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 종결 요소를 결여하고, 그의 하나 이상의 발현 서열로부터의 단백질 발현을 위해 적격이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 내부 리보솜 진입 부위를 결여하고, 그의 하나 이상의 발현 서열로부터의 단백질 발현을 위해 적격이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 캡을 결여하고, 그의 하나 이상의 발현 서열로부터의 단백질 발현을 위해 적격이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 5'-UTR, 3'-UTR, 및 IRES를 결여하고, 그의 하나 이상의 발현 서열로부터의 단백질 발현을 위해 적격이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하기 서열 중 하나 이상을 포함한다: 하나 이상의 miRNA를 인코딩하는 서열, 하나 이상의 복제 단백질을 인코딩하는 서열, 외인성 유전자를 인코딩하는 서열, 치료제를 인코딩하는 서열, 조절 요소(예를 들어, 번역 조정제, 예를 들어, 번역 증진제 또는 억제제), 번역 개시 서열, 내인성 유전자를 표적화하는 하나 이상의 조절 핵산(예를 들어, siRNA, lncRNA, shRNA), 및 치료 mRNA 또는 단백질을 인코딩하는 서열.In some embodiments, the circular polyribonucleotide lacks a 5'-UTR and is competent for protein expression from one or more expression sequences thereof. In some embodiments, the circular polyribonucleotide lacks a 3'-UTR and is competent for protein expression from one or more expression sequences thereof. In some embodiments, the circular polyribonucleotide lacks a polyA sequence and is competent for protein expression from one or more expression sequences thereof. In some embodiments, the circular polyribonucleotide lacks a termination element and is competent for protein expression from one or more expression sequences thereof. In some embodiments, the circular polyribonucleotide lacks an internal ribosome entry site and is competent for protein expression from one or more expression sequences thereof. In some embodiments, the circular polyribonucleotide lacks a cap and is competent for protein expression from one or more expression sequences thereof. In some embodiments, the circular polyribonucleotide lacks a 5'-UTR, 3'-UTR, and IRES and is competent for protein expression from one or more expression sequences thereof. In some embodiments, the circular polyribonucleotide comprises one or more of the following sequences: a sequence encoding one or more miRNAs, a sequence encoding one or more replication proteins, a sequence encoding an exogenous gene, a sequence encoding a therapeutic agent, a regulatory an element (e.g., a translation modulator, e.g., a translation enhancer or repressor), a translation initiation sequence, one or more regulatory nucleic acids (e.g., siRNA, lncRNA, shRNA) targeting an endogenous gene, and a therapeutic mRNA or protein. Encoding sequence.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 5'-UTR을 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 3'-UTR을 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 폴리A 서열을 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 종결 요소를 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 내부 리보솜 진입 부위를 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 엑소뉴클레아제에 의한 분해 감수성을 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드가 분해 감수성을 결여한다는 사실은 원형 폴리리보뉴클레오티드가 엑소뉴클레아제에 의해 분해되지 않거나, 엑소뉴클레아제의 존재 하에서 단지 제한된 정도로, 예를 들어, 엑소뉴클레아제의 부재 하에서와 대등하거나 유사한 정도로 분해됨을 의미할 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 엑소뉴클레아제에 의해 분해되지 않는다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 엑소뉴클레아제에 노출되는 경우 감소된 분해를 갖는다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 캡-결합 단백질에의 결합을 결여한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 5' 캡을 결여한다.In some embodiments, the circular polyribonucleotide lacks a 5'-UTR. In some embodiments, the circular polyribonucleotide lacks a 3'-UTR. In some embodiments, the circular polyribonucleotide lacks a polyA sequence. In some embodiments, the circular polyribonucleotide lacks a termination element. In some embodiments, the circular polyribonucleotide lacks an internal ribosome entry site. In some embodiments, circular polyribonucleotides lack susceptibility to degradation by exonucleases. In some embodiments, the fact that the circular polyribonucleotide lacks degradation susceptibility means that the circular polyribonucleotide is not degraded by an exonuclease or is degraded to only a limited extent in the presence of an exonuclease, e.g. It can mean decomposition to an equal or similar degree as in the absence of ritual. In some embodiments, circular polyribonucleotides are not degraded by exonucleases. In some embodiments, circular polyribonucleotides have reduced degradation when exposed to exonucleases. In some embodiments, the circular polyribonucleotide lacks binding to a cap-binding protein. In some embodiments, the circular polyribonucleotide lacks a 5' cap.
단백질-결합 서열protein-binding sequence
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 단백질, 예를 들어, 리보솜이 RNA 서열 내의 내부 부위에 결합하는 것을 가능하게 하는 하나 이상의 단백질 결합 부위를 포함한다. 단백질 결합 부위, 예를 들어, 리보솜 결합 부위를 원형 폴리리보뉴클레오티드 내로 조작함으로써, 원형 폴리리보뉴클레오티드는 숙주의 면역계에 의한 검출을 회피하거나 감소된 검출을 가질 수 있고, 원형 폴리리보뉴클레오티드를 숙주의 면역계의 구성성분으로부터 마스킹함으로써, 조정된 분해, 또는 조정된 번역을 가질 수 있다.In some embodiments, the circular polyribonucleotide includes one or more protein binding sites that allow proteins, such as ribosomes, to bind to internal sites within the RNA sequence. By engineering a protein binding site, e.g., a ribosome binding site, into a circular polyribonucleotide, the circular polyribonucleotide can evade detection by the host's immune system or have reduced detection, and the circular polyribonucleotide can be linked to the host's immune system. By masking from the components of , one can have coordinated decomposition, or coordinated translation.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 예를 들어, 면역 반응, 예를 들어, CTL(세포독성 T 림프구) 반응을 회피하기 위해, 적어도 하나의 면역단백질 결합 부위를 포함한다. 일부 실시 형태에서, 면역단백질 결합 부위는 면역단백질에 결합하고 원형 폴리리보뉴클레오티드를 외인성으로서 마스킹하는 것을 보조하는 뉴클레오티드 서열이다. 일부 실시 형태에서, 면역단백질 결합 부위는 면역단백질에 결합하고 원형 폴리리보뉴클레오티드를 외인성 또는 외래로서 은폐시키는 것을 보조하는 뉴클레오티드 서열이다.In some embodiments, the circular polyribonucleotide comprises at least one immunoprotein binding site, e.g., to avoid an immune response, e.g., a CTL (cytotoxic T lymphocyte) response. In some embodiments, the immunoprotein binding site is a nucleotide sequence that binds the immunoprotein and assists in masking the circular polyribonucleotide as exogenous. In some embodiments, an immunoprotein binding site is a nucleotide sequence that binds an immunoprotein and assists in masking the circular polyribonucleotide as exogenous or foreign.
선형 RNA에 대한 리보솜 결착의 전통적인 메카니즘은 RNA의 캡핑된 5' 단부에 대한 리보솜 결합을 수반한다. 5' 단부로부터, 리보솜은 개시 코돈으로 이동하고, 그 때 제1 펩티드 결합이 형성된다. 본 개시내용에 따르면, 원형 폴리리보뉴클레오티드의 번역의 내부 개시(즉, 캡-독립적)는 유리 단부 또는 캡핑된 단부를 요구하지 않는다. 오히려, 리보솜은 비-캡핑된 내부 부위에 결합하고, 그에 의해 리보솜은 개시 코돈에서 폴리펩티드 신장을 시작한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 리보솜 결합 부위, 예를 들어, 개시 코돈을 포함하는 하나 이상의 RNA 서열을 포함한다.The traditional mechanism of ribosome binding to linear RNA involves ribosome binding to a capped 5' end of the RNA. From the 5' end, the ribosome moves to the initiation codon, whereupon the first peptide bond is formed. According to the present disclosure, internal initiation (i.e., cap-independent) of translation of a circular polyribonucleotide does not require a free end or a capped end. Rather, the ribosome binds to an uncapped internal site, whereby the ribosome initiates polypeptide elongation at the initiation codon. In some embodiments, the circular polyribonucleotide comprises one or more RNA sequences that include a ribosome binding site, e.g., an initiation codon.
천연 5' UTR은 번역 개시에서 역할을 하는 특징을 보유한다. 이들은 리보솜이 많은 유전자의 번역을 개시시키는 과정에 관여하는 것으로 통상적으로 알려져 있는 코작 서열과 같은 특징을 갖는다. 코작 서열은 컨센서스 CCR(A/G)CCAUGG(SEQ ID NO: 358)를 갖고, 여기서 R은 시작 코돈(AUG)의 3개의 염기 상류에 있는 퓨린(아데닌 또는 구아닌)이고, 여기에 또 다른 'G'가 이어진다. 5' UTR은 또한 신장 인자 결합에 관여하는 2차 구조를 형성하는 것으로 알려졌다.The native 5' UTR possesses features that play a role in translation initiation. These have the same characteristics as Kozak sequences, which are commonly known to be involved in the process by which ribosomes initiate translation of many genes. The Kozak sequence has the consensus CCR(A/G)CCAUGG (SEQ ID NO: 358), where R is a purine (adenine or guanine) three bases upstream of the start codon (AUG), followed by another 'G ' continues. The 5' UTR is also known to form secondary structures involved in elongation factor binding.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 단백질에 결합하는 단백질 결합 서열을 인코딩한다. 일부 실시 형태에서, 단백질 결합 서열은 원형 폴리리보뉴클레오티드를 특이적 표적에 표적화하거나 국재화한다. 일부 실시 형태에서, 단백질 결합 서열은 단백질의 아르기닌-풍부 영역에 특이적으로 결합한다.In some embodiments, the circular polyribonucleotide encodes a protein binding sequence that binds to the protein. In some embodiments, the protein binding sequence targets or localizes the circular polyribonucleotide to a specific target. In some embodiments, the protein binding sequence specifically binds to an arginine-rich region of the protein.
일부 실시 형태에서, 단백질 결합 부위는 단백질, 예컨대 ACIN1, AGO, APOBEC3F, APOBEC3G, ATXN2, AUH, BCCIP, CAPRIN1, CELF2, CPSF1, CPSF2, CPSF6, CPSF7, CSTF2, CSTF2T, CTCF, DDX21, DDX3, DDX3X, DDX42, DGCR8, EIF3A, EIF4A3, EIF4G2, ELAVL1, ELAVL3, FAM120A, FBL, FIP1L1, FKBP4, FMR1, FUS, FXR1, FXR2, GNL3, GTF2F1, HNRNPA1, HNRNPA2B1, HNRNPC, HNRNPK, HNRNPL, HNRNPM, HNRNPU, HNRNPUL1, IGF2BP1, IGF2BP2, IGF2BP3, ILF3, KHDRBS1, LARP7, LIN28A, LIN28B, m6A, MBNL2, METTL3, MOV10, MSI1, MSI2, NONO, NONO-, NOP58, NPM1, NUDT21, PCBP2, POLR2A, PRPF8, PTBP1, RBFOX2, RBM10, RBM22, RBM27, RBM47, RNPS1, SAFB2, SBDS, SF3A3, SF3B4, SIRT7, SLBP, SLTM, SMNDC1, SND1, SRRM4, SRSF1, SRSF3, SRSF7, SRSF9, TAF15, TARDBP, TIA1, TNRC6A, TOP3B, TRA2A, TRA2B, U2AF1, U2AF2, UNK, UPF1, WDR33, XRN2, YBX1, YTHDC1, YTHDF1, YTHDF2, YWHAG, ZC3H7B, PDK1, AKT1, 및 RNA에 결합하는 임의의 다른 단백질에 대한 결합 부위를 포함하지만, 이에 한정되는 것은 아니다.In some embodiments, the protein binding site is a protein, such as ACIN1, AGO, APOBEC3F, APOBEC3G, ATXN2, AUH, BCCIP, CAPRIN1, CELF2, CPSF1, CPSF2, CPSF6, CPSF7, CSTF2, CSTF2T, CTCF, DDX21, DDX3, DDX3X, DDX42, DGCR8, EIF3A, EIF4A3, EIF4G2, ELAVL1, ELAVL3, FAM120A, FBL, FIP1L1, FKBP4, FMR1, FUS, FXR1, FXR2, GNL3, GTF2F1, HNRNPA1, HNRNPA2B1, HNRNPC, HNRNPK, HNRNPL, HNRNPM, U, HNRNPUL1, IGF2BP1, IGF2BP2, IGF2BP3, ILF3, KHDRBS1, LARP7, LIN28A, LIN28B, m6A, MBNL2, METTL3, MOV10, MSI1, MSI2, NONO, NONO-, NOP58, NPM1, NUDT21, PCBP2, POLR2A, PRPF8, PTBP1, RBFOX2, RBM10 , RBM22, RBM27, RBM47, RNPS1, SAFB2, SBDS, SF3A3, SF3B4, SIRT7, SLBP, SLTM, SMNDC1, SND1, SRRM4, SRSF1, SRSF3, SRSF7, SRSF9, TAF15, TARDBP, TIA1, TNRC6A, TOP3B, TRA2A, TRA2B , U2AF1, U2AF2, UNK, UPF1, WDR33, no.
스페이서 서열spacer sequence
일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드는 하나 이상의 스페이서 서열을 포함한다. 스페이서는 2개의 인접한 폴리뉴클레오티드 영역 사이에 거리 또는 유연성을 제공하는 (예를 들어, 하나 이상의 뉴클레오티드의) 임의의 인접한 뉴클레오티드 서열을 지칭한다. 스페이서는 본원에 기재된 핵산 요소 중 임의의 것 사이에 존재할 수 있다. 스페이서는 또한 본원에 기재된 핵산 요소 내에 존재할 수 있다.In some embodiments, the polyribonucleotides described herein include one or more spacer sequences. A spacer refers to any contiguous nucleotide sequence (e.g., of one or more nucleotides) that provides distance or flexibility between two adjacent polynucleotide regions. Spacers may be present between any of the nucleic acid elements described herein. Spacers may also be present within the nucleic acid elements described herein.
예를 들어, 여기서 핵산은 하기 요소 중 임의의 2개 이상을 포함한다: (A) 3' 촉매 인트론 단편; (B) 3' 스플라이스 부위; (C) 3' 엑손 단편; (D) 폴리리보뉴클레오티드 카고; (E) 5' 엑손 단편; (F) 5' 스플라이스 부위; 및 (G) 5' 촉매 인트론 단편; 스페이서 영역은 요소 중 임의의 하나 이상 사이에 존재할 수 있다. 요소 (A), (B), (C), (D), (E), (F), 또는 (G) 중 임의의 것은 본원에 기재된 바와 같이 스페이서 서열에 의해 분리될 수 있다. 예를 들어, (A)와 (B) 사이, (B)와 (C) 사이, (C)와 (D) 사이, (D)와 (E) 사이, (E)와 (F) 사이, 또는 (F)와 (G) 사이에 스페이서가 존재할 수 있다.For example, wherein the nucleic acid comprises any two or more of the following elements: (A) a 3' catalytic intron fragment; (B) 3' splice site; (C) 3' exon fragment; (D) polyribonucleotide cargo; (E) 5' exon fragment; (F) 5' splice site; and (G) 5' catalytic intron fragment; Spacer regions may exist between any one or more of the elements. Any of elements (A), (B), (C), (D), (E), (F), or (G) may be separated by a spacer sequence as described herein. For example, between (A) and (B), between (B) and (C), between (C) and (D), between (D) and (E), between (E) and (F), or A spacer may exist between (F) and (G).
일부 실시 형태에서, 폴리리보뉴클레오티드는 (C)의 5' 엑손 단편과 (D)의 폴리리보뉴클레오티드 카고 사이에 제1 스페이서 영역을 추가로 포함한다. 스페이서는 예를 들어, 적어도 5개(예를 들어, 적어도 10개, 적어도 15개, 적어도 20개)의 리보뉴클레오티드의 길이를 가질 수 있다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 (D)의 폴리리보뉴클레오티드 카고와 (E)의 5' 엑손 단편 사이에 제2 스페이서 영역을 추가로 포함한다.In some embodiments, the polyribonucleotide further comprises a first spacer region between the 5' exon fragment of (C) and the polyribonucleotide cargo of (D). The spacer may be, for example, at least 5 (e.g., at least 10, at least 15, at least 20) ribonucleotides in length. In some embodiments, the polyribonucleotide further comprises a second spacer region between the polyribonucleotide cargo of (D) and the 5' exon fragment of (E).
스페이서 서열은 IRES를 인접한 구조적 요소로부터 분리하여 IRES 또는 인접한 요소의 구조 및 기능을 유지하는 데 사용될 수 있다. 스페이서는 IRES에 따라 특이적으로 조작될 수 있다. 일부 실시 형태에서, RNA 폴딩 컴퓨터 소프트웨어, 예컨대 RNAFold는 스페이서를 포함하는 벡터의 다양한 요소의 설계를 가이드하는 데 이용될 수 있다.Spacer sequences can be used to separate the IRES from adjacent structural elements, thereby maintaining the structure and function of the IRES or adjacent elements. Spacers can be specifically engineered according to the IRES. In some embodiments, RNA folding computer software, such as RNAFold, can be used to guide the design of various elements of the vector, including spacers.
스페이서는 예를 들어, 적어도 5개(예를 들어, 적어도 10개, 적어도 15개, 적어도 20개)의 리보뉴클레오티드의 길이를 가질 수 있다. 일부 실시 형태에서, 각각의 스페이서 영역은 적어도 5개(예를 들어, 적어도 10개, 적어도 15개, 적어도 20개)의 리보뉴클레오티드의 길이를 갖는다. 각각의 스페이서 영역은 예를 들어, 5 내지 500개(예를 들어, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 또는 500개)의 리보뉴클레오티드의 길이를 가질 수 있다. 제1 스페이서 영역, 제2 스페이서 영역, 또는 제1 스페이서 영역 및 제2 스페이서 영역은 폴리A 서열을 포함할 수 있다. 제1 스페이서 영역, 제2 스페이서 영역, 또는 제1 스페이서 영역 및 제2 스페이서 영역은 폴리A-C 서열을 포함할 수 있다. 일부 실시 형태에서, 제1 스페이서 영역, 제2 스페이서 영역, 또는 제1 스페이서 영역 및 제2 스페이서 영역은 폴리A-G 서열을 포함한다. 일부 실시 형태에서, 제1 스페이서 영역, 제2 스페이서 영역, 또는 제1 스페이서 영역 및 제2 스페이서 영역은 폴리A-T 서열을 포함한다. 일부 실시 형태에서, 제1 스페이서 영역, 제2 스페이서 영역, 또는 제1 스페이서 영역 및 제2 스페이서 영역은 무작위 서열을 포함한다.The spacer may be, for example, at least 5 (e.g., at least 10, at least 15, at least 20) ribonucleotides in length. In some embodiments, each spacer region is at least 5 (e.g., at least 10, at least 15, at least 20) ribonucleotides in length. Each spacer region may have, for example, 5 to 500 (e.g., 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, It may have a length of 450 or 500 ribonucleotides. The first spacer region, the second spacer region, or the first spacer region and the second spacer region may comprise a polyA sequence. The first spacer region, the second spacer region, or the first spacer region and the second spacer region may comprise a polyA-C sequence. In some embodiments, the first spacer region, the second spacer region, or the first spacer region and the second spacer region comprise a polyA-G sequence. In some embodiments, the first spacer region, the second spacer region, or the first spacer region and the second spacer region comprise a polyA-T sequence. In some embodiments, the first spacer region, the second spacer region, or the first spacer region and the second spacer region comprise a random sequence.
스페이서는 또한 본원에 기재된 핵산 영역 내에 존재할 수 있다. 예를 들어, 폴리뉴클레오티드 카고 영역은 하나 또는 다수의 스페이서를 포함할 수 있다. 스페이서는 폴리뉴클레오티드 카고 내에서 영역을 분리할 수 있다.Spacers may also be present within nucleic acid regions described herein. For example, a polynucleotide cargo region may include one or multiple spacers. Spacers can separate regions within a polynucleotide cargo.
일부 실시 형태에서, 스페이서 서열은 예를 들어, 적어도 10개의 뉴클레오티드의 길이, 적어도 15개의 뉴클레오티드의 길이, 또는 적어도 30개의 뉴클레오티드의 길이를 가질 수 있다. 일부 실시 형태에서, 스페이서 서열은 적어도 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25 또는 30개의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 스페이서 서열은 100, 90, 80, 70, 60, 50, 45, 40, 35 또는 30개 이하의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 스페이서 서열은 20 내지 50개의 뉴클레오티드의 길이를 갖는다. 특정 실시 형태에서, 스페이서 서열은 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50개의 뉴클레오티드의 길이를 갖는다.In some embodiments, the spacer sequence can be, for example, at least 10 nucleotides in length, at least 15 nucleotides in length, or at least 30 nucleotides in length. In some embodiments, the spacer sequence is at least 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, or 30 nucleotides in length. In some embodiments, the spacer sequence is no more than 100, 90, 80, 70, 60, 50, 45, 40, 35, or 30 nucleotides in length. In some embodiments, the spacer sequence is 20 to 50 nucleotides in length. In certain embodiments, the spacer sequence is 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, has a length of 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, or 50 nucleotides.
스페이서 서열은 폴리A 서열, 폴리A-C 서열, 폴리C 서열, 또는 폴리-U 서열일 수 있다.The spacer sequence may be a polyA sequence, a polyA-C sequence, a polyC sequence, or a poly-U sequence.
일부 실시 형태에서, 스페이서 서열은 폴리A-T, 폴리A-C, 폴리A-G, 또는 무작위 서열일 수 있다.In some embodiments, the spacer sequence may be polyA-T, polyA-C, polyA-G, or a random sequence.
예시적인 스페이서 서열은 그 전문이 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0293] 내지 [0302]에 기재되어 있다.Exemplary spacer sequences are described in paragraphs [0293] to [0302] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
일부 실시 형태에서, 폴리리보뉴클레오티드는 5' 스페이서 서열(예를 들어, 5' 어닐링 영역과 폴리리보뉴클레오티드 카고 사이에)을 포함한다. 일부 실시 형태에서, 5' 스페이서 서열은 적어도 10개의 뉴클레오티드의 길이를 갖는다. 또 다른 실시 형태에서, 5' 스페이서 서열은 적어도 15개의 뉴클레오티드의 길이를 갖는다. 추가의 실시 형태에서, 5' 스페이서 서열은 적어도 30개의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 5' 스페이서 서열은 적어도 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25 또는 30개의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 5' 스페이서 서열은 100, 90, 80, 70, 60, 50, 45, 40, 35 또는 30개 이하의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 5' 스페이서 서열은 20 내지 50개의 뉴클레오티드의 길이를 갖는다. 특정 실시 형태에서, 5' 스페이서 서열은 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50개의 뉴클레오티드의 길이를 갖는다. 한 실시 형태에서, 5' 스페이서 서열은 폴리A 서열이다. 또 다른 실시 형태에서, 5' 스페이서 서열은 폴리A-C 서열이다. 일부 실시 형태에서, 5' 스페이서 서열은 폴리A-G 서열을 포함한다. 일부 실시 형태에서, 5' 스페이서 서열은 폴리A-T 서열을 포함한다. 일부 실시 형태에서, 5' 스페이서 서열은 무작위 서열을 포함한다.In some embodiments, the polyribonucleotide includes a 5' spacer sequence (e.g., between the 5' annealing region and the polyribonucleotide cargo). In some embodiments, the 5' spacer sequence is at least 10 nucleotides in length. In another embodiment, the 5' spacer sequence is at least 15 nucleotides in length. In a further embodiment, the 5' spacer sequence is at least 30 nucleotides in length. In some embodiments, the 5' spacer sequence is at least 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, or 30 nucleotides in length. In some embodiments, the 5' spacer sequence is no more than 100, 90, 80, 70, 60, 50, 45, 40, 35, or 30 nucleotides in length. In some embodiments, the 5' spacer sequence is 20 to 50 nucleotides in length. In certain embodiments, the 5' spacer sequence is 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, has a length of 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 or 50 nucleotides. In one embodiment, the 5' spacer sequence is a polyA sequence. In another embodiment, the 5' spacer sequence is a polyA-C sequence. In some embodiments, the 5' spacer sequence comprises a polyA-G sequence. In some embodiments, the 5' spacer sequence comprises a polyA-T sequence. In some embodiments, the 5' spacer sequence comprises a random sequence.
일부 실시 형태에서, 폴리리보뉴클레오티드는 3' 스페이서 서열(예를 들어, 3' 어닐링 영역과 폴리리보뉴클레오티드 카고 사이에)을 포함한다. 일부 실시 형태에서, 3' 스페이서 서열은 적어도 10개의 뉴클레오티드의 길이를 갖는다. 또 다른 실시 형태에서, 3' 스페이서 서열은 적어도 15개의 뉴클레오티드의 길이를 갖는다. 추가의 실시 형태에서, 3' 스페이서 서열은 적어도 30개의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 3' 스페이서 서열은 적어도 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25 또는 30개의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 3' 스페이서 서열은 100, 90, 80, 70, 60, 50, 45, 40, 35 또는 30개 이하의 뉴클레오티드의 길이를 갖는다. 일부 실시 형태에서, 3' 스페이서 서열은 20 내지 50개의 뉴클레오티드의 길이를 갖는다. 특정 실시 형태에서, 3' 스페이서 서열은 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50개의 뉴클레오티드의 길이를 갖는다. 한 실시 형태에서, 3' 스페이서 서열은 폴리A 서열이다. 또 다른 실시 형태에서, 5' 스페이서 서열은 폴리A-C 서열이다. 일부 실시 형태에서, 5' 스페이서 서열은 폴리A-G 서열을 포함한다. 일부 실시 형태에서, 5' 스페이서 서열은 폴리A-T 서열을 포함한다. 일부 실시 형태에서, 5' 스페이서 서열은 무작위 서열을 포함한다.In some embodiments, the polyribonucleotide includes a 3' spacer sequence (e.g., between the 3' annealing region and the polyribonucleotide cargo). In some embodiments, the 3' spacer sequence is at least 10 nucleotides in length. In another embodiment, the 3' spacer sequence is at least 15 nucleotides in length. In a further embodiment, the 3' spacer sequence is at least 30 nucleotides in length. In some embodiments, the 3' spacer sequence is at least 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, or 30 nucleotides in length. In some embodiments, the 3' spacer sequence is no more than 100, 90, 80, 70, 60, 50, 45, 40, 35, or 30 nucleotides in length. In some embodiments, the 3' spacer sequence is 20 to 50 nucleotides in length. In certain embodiments, the 3' spacer sequence is 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, has a length of 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 or 50 nucleotides. In one embodiment, the 3' spacer sequence is a polyA sequence. In another embodiment, the 5' spacer sequence is a polyA-C sequence. In some embodiments, the 5' spacer sequence comprises a polyA-G sequence. In some embodiments, the 5' spacer sequence comprises a polyA-T sequence. In some embodiments, the 5' spacer sequence comprises a random sequence.
한 실시 형태에서, 폴리리보뉴클레오티드는 5' 스페이서 서열을 포함하지만, 3' 스페이서 서열은 포함하지 않는다. 또 다른 실시 형태에서, 폴리리보뉴클레오티드는 3' 스페이서 서열을 포함하지만, 5' 스페이서 서열은 포함하지 않는다. 또 다른 실시 형태에서, 폴리리보뉴클레오티드는 5' 스페이서 서열도 3' 스페이서 서열도 포함하지 않는다. 또 다른 실시 형태에서, 폴리리보뉴클레오티드는 IRES 서열을 포함하지 않는다. 추가의 실시 형태에서, 폴리리보뉴클레오티드는 IRES 서열, 5' 스페이서 서열 또는 3' 스페이서 서열을 포함하지 않는다.In one embodiment, the polyribonucleotide includes a 5' spacer sequence, but does not include a 3' spacer sequence. In another embodiment, the polyribonucleotide includes a 3' spacer sequence, but does not include a 5' spacer sequence. In another embodiment, the polyribonucleotide includes neither a 5' spacer sequence nor a 3' spacer sequence. In another embodiment, the polyribonucleotide does not include an IRES sequence. In a further embodiment, the polyribonucleotide does not include an IRES sequence, a 5' spacer sequence, or a 3' spacer sequence.
일부 실시 형태에서, 스페이서 서열은 적어도 3개의 리보뉴클레오티드, 적어도 4개의 리보뉴클레오티드, 적어도 5개의 리보뉴클레오티드, 적어도 약 8개의 리보뉴클레오티드, 적어도 약 10개의 리보뉴클레오티드, 적어도 약 12개의 리보뉴클레오티드, 적어도 약 15개의 리보뉴클레오티드, 적어도 약 20개의 리보뉴클레오티드, 적어도 약 25개의 리보뉴클레오티드, 적어도 약 30개의 리보뉴클레오티드, 적어도 약 40개의 리보뉴클레오티드, 적어도 약 50개의 리보뉴클레오티드, 적어도 약 60개의 리보뉴클레오티드, 적어도 약 70개의 리보뉴클레오티드, 적어도 약 80개의 리보뉴클레오티드, 적어도 약 90개의 리보뉴클레오티드, 적어도 약 100개의 리보뉴클레오티드, 적어도 약 120개의 리보뉴클레오티드, 적어도 약 150개의 리보뉴클레오티드, 적어도 약 200개의 리보뉴클레오티드, 적어도 약 250개의 리보뉴클레오티드, 적어도 약 300개의 리보뉴클레오티드, 적어도 약 400개의 리보뉴클레오티드, 적어도 약 500개의 리보뉴클레오티드, 적어도 약 600개의 리보뉴클레오티드, 적어도 약 700개의 리보뉴클레오티드, 적어도 약 800개의 리보뉴클레오티드, 적어도 약 900개의 리보뉴클레오티드, 또는 적어도 약 100개의 리보뉴클레오티드를 포함한다.In some embodiments, the spacer sequence is at least 3 ribonucleotides, at least 4 ribonucleotides, at least 5 ribonucleotides, at least about 8 ribonucleotides, at least about 10 ribonucleotides, at least about 12 ribonucleotides, at least about 15 ribonucleotides. ribonucleotides, at least about 20 ribonucleotides, at least about 25 ribonucleotides, at least about 30 ribonucleotides, at least about 40 ribonucleotides, at least about 50 ribonucleotides, at least about 60 ribonucleotides, at least about 70 ribonucleotides Ribonucleotide, at least about 80 ribonucleotides, at least about 90 ribonucleotides, at least about 100 ribonucleotides, at least about 120 ribonucleotides, at least about 150 ribonucleotides, at least about 200 ribonucleotides, at least about 250 ribonucleotides Nucleotides, at least about 300 ribonucleotides, at least about 400 ribonucleotides, at least about 500 ribonucleotides, at least about 600 ribonucleotides, at least about 700 ribonucleotides, at least about 800 ribonucleotides, at least about 900 ribonucleotides , or at least about 100 ribonucleotides.
변형transform
본원에 기재된 바와 같은 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드)는 하나 이상의 치환, 삽입 및/또는 부가, 결실, 및 참조 서열, 특히 모 폴리리보뉴클레오티드에 대한 공유 변형을 포함할 수 있으며, 이는 본 개시내용의 범위 내에 포함된다.Polyribonucleotides (e.g., circular polyribonucleotides) as described herein may contain one or more substitutions, insertions and/or additions, deletions, and covalent modifications to a reference sequence, especially a parent polyribonucleotide; This is included within the scope of this disclosure.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 이상의 전사 후 변형(예를 들어, 캡핑, 절단, 폴리아데닐화, 스플라이싱, 폴리A 서열, 메틸화, 아실화, 인산화, 리신 및 아르기닌 잔기의 메틸화, 아세틸화, 및 티올 기 및 티로신 잔기의 니트로실화 등)을 포함한다. 하나 이상의 전사 후 변형은 RNA에서 확인된 100개 초과의 상이한 뉴클레오시드 변형 중 임의의 것과 같은 임의의 전사 후 변형일 수 있다(Rozenski, J, Crain, P, and McCloskey, J. (1999).The RNA Modification Database: 1999 update. Nucl Acids Res27: 196-197). 일부 실시 형태에서, 제1 단리된 핵산은 메신저 RNA(mRNA)를 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919A1호의 [0311]에 기재된 것과 같은 군으로부터 선택된 적어도 하나의 뉴클레오시드를 포함한다.In some embodiments, the circular polyribonucleotide can be modified with one or more post-transcriptional modifications (e.g., capping, cleavage, polyadenylation, splicing, polyA sequence, methylation, acylation, phosphorylation, methylation of lysine and arginine residues, acetylation, and nitrosylation of thiol groups and tyrosine residues, etc.). The one or more post-transcriptional modifications may be any post-transcriptional modification, such as any of the over 100 different nucleoside modifications identified in RNA (Rozenski, J, Crain, P, and McCloskey, J. (1999).The RNA Modification Database: 1999 update (Nucl Acids Res 27: 196-197). In some embodiments, the first isolated nucleic acid comprises messenger RNA (mRNA). In some embodiments, the polyribonucleotide comprises at least one nucleoside selected from the group as described in [0311] of International Patent Publication No. WO2019/118919A1, which is incorporated herein by reference in its entirety.
폴리리보뉴클레오티드는 임의의 유용한 변형, 예컨대 당, 핵염기, 또는 (예를 들어, 연결 포스페이트에 대한/포스포디에스테르 연결에 대한/포스포디에스테르 백본에 대한) 뉴클레오시드간 연결을 포함할 수 있다. 피리미딘 핵염기의 하나 이상의 원자는 선택적으로 치환된 아미노, 선택적으로 치환된 티올, 선택적으로 치환된 알킬(예를 들어, 메틸 또는 에틸), 또는 할로(예를 들어, 클로로 또는 플루오로)로 대체되거나 치환될 수 있다. 특정 실시 형태에서, 변형(예를 들어, 하나 이상의 변형)은 당 및 뉴클레오시드간 연결의 각각에 존재한다. 변형은 리보핵산(RNA)의 데옥시리보핵산(DNA), 트레오스 핵산(TNA), 글리콜 핵산(GNA), 펩티드 핵산(PNA), 잠금 핵산(LNA) 또는 이들의 혼성화물)로의 변형일 수 있다. 추가의 변형들이 본원에 기재되어 있다.Polyribonucleotides may contain any useful modifications, such as sugars, nucleobases, or internucleoside linkages (e.g., to linking phosphate/to phosphodiester linkage/to phosphodiester backbone). . One or more atoms of the pyrimidine nucleobase are replaced with optionally substituted amino, optionally substituted thiol, optionally substituted alkyl (e.g., methyl or ethyl), or halo (e.g., chloro or fluoro). It can be or be replaced. In certain embodiments, modifications (e.g., one or more modifications) are present in each of the sugar and internucleoside linkages. The modification may be a transformation of ribonucleic acid (RNA) into deoxyribonucleic acid (DNA), threonose nucleic acid (TNA), glycol nucleic acid (GNA), peptide nucleic acid (PNA), locked nucleic acid (LNA), or hybrids thereof. there is. Additional variations are described herein.
일부 실시 형태에서, 폴리리보뉴클레오티드는 번역 효율을 증가시키기 위해 적어도 하나의 N(6)메틸아데노신(m6A) 변형을 포함한다. 일부 실시 형태에서, m6A 변형은 원형 폴리리보뉴클레오티드의 면역원성을 감소시킬 수 있다(예를 들어, 면역 또는 염증 반응의 하나 이상의 마커의 수준을 감소시킬 수 있다).In some embodiments, the polyribonucleotide includes at least one N(6)methyladenosine (m6A) modification to increase translation efficiency. In some embodiments, the m6A modification may reduce the immunogenicity of the circular polyribonucleotide (e.g., may reduce the level of one or more markers of an immune or inflammatory response).
일부 실시 형태에서, 변형은 화학적 또는 세포 유도 변형을 포함할 수 있다. 예를 들어, 세포내 RNA 변형의 일부 비제한적인 예는 문헌[Lewis and Pan in "RNA modifications and structures cooperate to guide RNA-protein interactions" from Nat Reviews Mol Cell Biol, 2017, 18:202-210]에 의해 기재되어 있다.In some embodiments, modifications may include chemical or cell-induced modifications. For example, some non-limiting examples of intracellular RNA modifications are described in Lewis and Pan in "RNA modifications and structures cooperate to guide RNA-protein interactions" from Nat Reviews Mol Cell Biol, 2017, 18:202-210. It is described by.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드의 리보뉴클레오티드에 대한 화학적 변형은 면역 회피를 향상시킬 수 있다. 원형 폴리리보뉴클레오티드는 당업계에 잘 확립된 방법, 예컨대 본원에 참조로 포함되는 문헌["Current protocols in nucleic acid chemistry," Beaucage, S.L. et al. (Eds.), John Wiley & Sons, Inc., New York, NY, USA]에 기재된 방법에 의해 합성 및/또는 변형될 수 있다. 변형은, 예를 들어, 단부 변형, 예를 들어, 5' 단부 변형(인산화(모노-, 디- 및 트리-), 컨쥬게이션, 역 연결 등), 3' 단부 변형(컨쥬게이션, DNA 뉴클레오티드, 역 연결 등), 염기 변형(예를 들어, 안정화 염기, 불안정화 염기, 또는 파트너의 확장된 레퍼토리로 염기 쌍을 이루는 염기로 대체), 염기(비염기성 뉴클레오티드)의 제거, 또는 컨쥬게이트된 염기를 포함한다. 변형된 리보뉴클레오티드 염기는 또한 5-메틸시티딘 및 슈도우리딘을 포함할 수 있다. 일부 실시 형태에서, 염기 변형은 원형 폴리리보뉴클레오티드의 발현, 면역 반응, 안정성, 세포내 국소화를 조절하여 몇몇 기능적 효과를 언급할 수 있다. 일부 실시 형태에서, 변형은 이중직교 뉴클레오티드, 예를 들어, 비천연 염기를 포함한다. 예를 들어, 본원에 참조로 포함되는 문헌[Kimoto et al, Chem Commun (Camb), 2017, 53:12309, DOI: 10.1039/c7cc06661a]을 참조한다.In some embodiments, chemical modifications to the ribonucleotides of circular polyribonucleotides can enhance immune evasion. Circular polyribonucleotides can be prepared using methods well established in the art, such as those described in “Current protocols in nucleic acid chemistry,” Beaucage, S.L., incorporated herein by reference. et al. (Eds.), John Wiley & Sons, Inc., New York, NY, USA. Modifications include, for example, end modifications, such as 5' end modifications (phosphorylation (mono-, di- and tri-), conjugation, back ligation, etc.), 3' end modifications (conjugation, DNA nucleotides, back-linking, etc.), base modifications (e.g., replacement of a stabilizing base, a destabilizing base, or a base that pairs with an expanded repertoire of partners), removal of a base (non-basic nucleotide), or conjugated bases. do. Modified ribonucleotide bases may also include 5-methylcytidine and pseudouridine. In some embodiments, base modifications may modulate the expression, immune response, stability, and intracellular localization of the circular polyribonucleotide, to name a few functional effects. In some embodiments, the modification includes a biorthogonal nucleotide, e.g., a non-natural base. See, for example, Kimoto et al, Chem Commun (Camb), 2017, 53:12309, DOI: 10.1039/c7cc06661a, which is incorporated herein by reference.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드의 하나 이상의 리보뉴클레오티드 당 변형(예를 들어, 2' 위치 또는 4' 위치에서) 또는 당의 교체, 뿐만 아니라 백본 변형은 포스포디에스테르 연결의 변형 또는 교체를 포함할 수 있다. 원형 폴리리보뉴클레오티드의 구체적인 예는 변형된 백본을 포함하는 원형 폴리리보뉴클레오티드 또는 포스포디에스테르 연결의 변형 또는 교체를 포함하는 뉴클레오시드간 변형과 같은 천연 뉴클레오시드간 연결을 포함하지 않는 원형 폴리리보뉴클레오티드를 포함하지만, 이에 한정되는 것은 아니다. 변형된 백본을 갖는 원형 폴리리보뉴클레오티드는, 다른 것들 중에서도, 백본에 인 원자를 갖지 않는 것들을 포함한다. 본 출원의 목적을 위해, 그리고 당업계에서 종종 언급되는 바와 같이, 이들의 뉴클레오시드간 백본에 인 원자를 갖지 않는 변형된 RNA는 또한 올리고뉴클레오시드로 간주될 수 있다. 특정 실시 형태에서, 원형 폴리리보뉴클레오티드는 그의 뉴클레오시드간 백본에 인 원자를 갖는 리보뉴클레오티드를 포함할 것이다.In some embodiments, modification of one or more ribonucleotide sugars (e.g., at the 2' position or 4' position) or replacement of sugars of the circular polyribonucleotide, as well as backbone modifications may include modification or replacement of phosphodiester linkages. You can. Specific examples of circular polyribonucleotides include circular polyribonucleotides that do not contain natural internucleoside linkages, such as circular polyribonucleotides that contain a modified backbone or internucleoside modifications that involve modifications or replacements of phosphodiester linkages. Including, but not limited to, nucleotides. Circular polyribonucleotides with modified backbones include, among others, those that do not have a phosphorus atom in the backbone. For the purposes of this application, and as often referred to in the art, modified RNAs that do not have a phosphorus atom in their internucleoside backbone may also be considered oligonucleosides. In certain embodiments, a circular polyribonucleotide will comprise a ribonucleotide having a phosphorus atom in its internucleoside backbone.
변형된 폴리리보뉴클레오티드 백본은, 예를 들어 포스포로티오에이트, 키랄 포스포로티오에이트, 포스포로디티오에이트, 포스포트리에스테르, 아미노알킬포스포트리에스테르, 메틸 및 3'-알킬렌 포스포네이트 및 키랄 포스포네이트와 같은 다른 알킬 포스포네이트, 포스피네이트, 3'-아미노 포스포르아미데이트 및 아미노알킬포스포르아미데이트와 같은 포스포르아미데이트, 티오노포스포르아미데이트, 티오노알킬포스포네이트, 티오노알킬포스포트리에스테르, 및 정상적인 3'-5' 연결을 갖는 보라노포스페이트, 이들의 2'-5' 연결된 유사체, 및 인접한 쌍의 뉴클레오시드 단위가 3'-5' 내지 5'-3' 또는 2'-5' 내지 5'-2'에 연결된 역극성을 갖는 것들을 포함할 수 있다. 다양한 염, 혼합 염 및 유리 산 형태도 또한 포함된다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 음으로 또는 양으로 하전될 수 있다.Modified polyribonucleotide backbones include, for example, phosphorothioates, chiral phosphorothioates, phosphorodithioates, phosphotriesters, aminoalkylphosphotriesters, methyl and 3'-alkylene phosphonates and chiral Other alkyl phosphonates such as phosphonates, phosphinates, phosphoramidates such as 3'-amino phosphoramidate and aminoalkylphosphoramidate, thionophosphoramidate, thionoalkylphosphonate , thionoalkylphosphotriesters, and boranophosphates with normal 3'-5' linkages, their 2'-5' linked analogues, and adjacent pairs of nucleoside units having a 3'-5' to 5'- It may include those with reverse polarity connected to 3' or 2'-5' to 5'-2'. Various salts, mixed salts and free acid forms are also included. In some embodiments, circular polyribonucleotides can be negatively or positively charged.
폴리리보뉴클레오티드에 혼입될 수 있는 변형된 뉴클레오티드는 뉴클레오시드간 연결(예를 들어, 포스페이트 백본) 상에서 변형될 수 있다. 본원에서, 폴리뉴클레오티드 백본의 맥락에서, 문구 "포스페이트" 및 "포스포디에스테르"는 상호교환적으로 사용된다. 백본 포스페이트 기는 하나 이상의 산소 원자를 상이한 치환기로 대체함으로써 변형될 수 있다. 또한, 변형된 뉴클레오시드 및 뉴클레오티드는 본원에 기재된 바와 같이 비변형된 포스페이트 모이어티를 또 다른 뉴클레오시드간 연결로 전면 대체하는 것을 포함할 수 있다. 변형된 포스페이트 기의 예는 포스포로티오에이트, 포스포로셀레네이트, 보라노포스페이트, 보라노포스페이트 에스테르, 수소 포스포네이트, 포스포르아미데이트, 포스포로디아미데이트, 알킬 또는 아릴 포스포네이트, 및 포스포트리에스테르를 포함하지만, 이에 한정되는 것은 아니다. 포스포로디티오에이트는 모두 황으로 대체된 비연결 산소를 가지고 있다. 포스페이트 링커는 또한 연결 산소를 질소(가교된 포스포르아미데이트), 황(가교된 포스포로티오에이트), 및 탄소(가교된 메틸렌포스포네이트)로 대체함으로써 변형될 수 있다.Modified nucleotides that can be incorporated into polyribonucleotides can be modified on internucleoside linkages (e.g., phosphate backbone). Herein, in the context of polynucleotide backbones, the phrases “phosphate” and “phosphodiester” are used interchangeably. The backbone phosphate group can be modified by replacing one or more oxygen atoms with a different substituent. Modified nucleosides and nucleotides may also include wholesale replacement of an unmodified phosphate moiety with another internucleoside linkage as described herein. Examples of modified phosphate groups include phosphorothioate, phosphoroselenate, boranophosphate, boranophosphate ester, hydrogen phosphonate, phosphoramidate, phosphorodiamidate, alkyl or aryl phosphonate, and Including, but not limited to, phosphotriesters. Phosphorodithioates have all unpaired oxygens replaced with sulfur. Phosphate linkers can also be modified by replacing the linking oxygen with nitrogen (cross-linked phosphoramidate), sulfur (cross-linked phosphorothioate), and carbon (cross-linked methylenephosphonate).
α-티오 치환된 포스페이트 모이어티는 비천연 포스포로티오에이트 백본 연결을 통해 RNA 및 DNA 중합체에 안정성을 부여하기 위해 제공된다. 포스포로티오에이트 DNA 및 RNA는 뉴클레아제 내성을 증가시켰고 결과적으로 세포 환경에서 반감기가 더 길어졌다. 원형 폴리리보뉴클레오티드에 연결된 포스포로티오에이트는 세포의 선천성 면역 분자의 약한 결합/활성화를 통해 선천성 면역 반응을 감소시킬 것으로 예상된다.α-thio substituted phosphate moieties are provided to impart stability to RNA and DNA polymers through non-natural phosphorothioate backbone linkages. Phosphorothioate DNA and RNA have increased nuclease resistance and consequently a longer half-life in the cellular environment. Phosphorothioates linked to circular polyribonucleotides are expected to reduce innate immune responses through weak binding/activation of cellular innate immune molecules.
특정 실시 형태에서, 변형된 뉴클레오시드는 알파-티오-뉴클레오시드(예를 들어, 5'-0-(l-티오포스페이트)-아데노신, 5'-0-(l-티오포스페이트)-시티딘(a-티오-시티딘), 5'-0-(l-티오포스페이트)-구아노신, 5'-0-(l-티오포스페이트)-우리딘, 또는 5'-0-(1-티오포스페이트)-슈도우리딘)을 포함한다.In certain embodiments, the modified nucleoside is an alpha-thio-nucleoside (e.g., 5'-0-(l-thiophosphate)-adenosine, 5'-0-(l-thiophosphate)-cytidine (a-thio-cytidine), 5'-0-(l-thiophosphate)-guanosine, 5'-0-(l-thiophosphate)-uridine, or 5'-0-(l-thiophosphate) )-pseudouridine).
인 원자를 함유하지 않는 뉴클레오시드간 연결을 포함하는, 본 개시내용에 따라 사용될 수 있는 다른 뉴클레오시드간 연결이 본원에 기재된다.Other internucleoside linkages that can be used in accordance with the present disclosure are described herein, including internucleoside linkages that do not contain a phosphorus atom.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 하나 이상의 세포독성 뉴클레오시드를 포함할 수 있다. 예를 들어, 세포독성 뉴클레오시드는 이작용성 변형과 같은 원형 폴리리보뉴클레오티드 so에 통합될 수 있다. 세포독성 뉴클레오시드는 아데노신 아라비노시드, 5-아자시티딘, 4'-티오-아라시티딘, 시클로펜테닐시토신, 클라드리빈, 클로파라빈, 시타라빈, 시토신 아라비노시드, l-(2-C-시아노-2-데옥시-베타-D-아라비노-펜토푸라노실)-시토신, 데시타빈, 5-플루오로우라실, 플루다라빈, 플록스우리딘, 젬시타빈, 테가푸르와 우라실의 조합, 테가푸르((RS)-5-플루오로-l-(테트라히드로푸란-2-일)피리미딘-2,4(lH,3H)-디온), 트록사시타빈, 테자시타빈, 2'-데옥시-2'-메틸리덴시티딘(DMDC), 및 6-메르캅토퓨린을 포함할 수 있지만, 이에 한정되는 것은 아니다. 추가의 예는 플루다라빈 포스페이트, N4-베헤노일-l-베타-D-아라비노푸라노실시토신, N4-옥타데실-1-베타-D-아라비노푸라노실시토신, N4-팔미토일-l-(2-C-시아노-2-데옥시-베타-D-아라비노-펜토푸라노실)시토신, 및 P-4055(시타라빈 5'-엘라이드산 에스테르)를 포함한다.In some embodiments, circular polyribonucleotides may include one or more cytotoxic nucleosides. For example, cytotoxic nucleosides can be incorporated into circular polyribonucleotides such as bifunctional modifications. Cytotoxic nucleosides include adenosine arabinoside, 5-azacytidine, 4'-thio-aracitidine, cyclopentenylcytosine, cladribine, clofarabine, cytarabine, cytosine arabinoside, l-(2 -C-cyano-2-deoxy-beta-D-arabino-pentofuranosyl)-cytosine, decitabine, 5-fluorouracil, fludarabine, floxuridine, gemcitabine, tegafur and uracil A combination of, tegafur ((RS)-5-fluoro-l-(tetrahydrofuran-2-yl)pyrimidine-2,4(lH,3H)-dione), troxacitabine, tezacitabine, It may include, but is not limited to, 2'-deoxy-2'-methylidencitidine (DMDC), and 6-mercaptopurine. Further examples are fludarabine phosphate, N4-behenoyl-l-beta-D-arabinofuranosylcytosine, N4-octadecyl-l-beta-D-arabinosylcytosine, N4-palmitoyl-l- (2-C-cyano-2-deoxy-beta-D-arabino-pentofuranosyl)cytosine, and P-4055 (cytarabine 5'-elaidic acid ester).
폴리리보뉴클레오티드는 분자의 전체 길이를 따라 균일하게 변형되거나 변형되지 않을 수 있다. 예를 들어, 하나 이상의 또는 모든 유형의 뉴클레오티드(예를 들어, 자연 발생 뉴클레오티드, 퓨린 또는 피리미딘, 또는 A, G, U, C, I, pU 중 임의의 하나 이상 또는 전부)는 원형 폴리리보뉴클레오티드에서, 또는 그의 주어진 미리 결정된 서열 영역에서 균일하게 변형되거나 변형되지 않을 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 슈도우리딘을 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 이노신을 포함하며, 이는 내인성 대 바이러스 RNA로서 원형 폴리리보뉴클레오티드를 특징짓는 면역계에 도움이 될 수 있다. 이노신의 통합은 또한 개선된 RNA 안정성/감소된 분해를 매개할 수 있다. 예를 들어, 그 전체가 참조로 포함되는 문헌[Yu, Z. et al. (2015) RNA editing by ADAR1 marks dsRNA as "self". Cell Res. 25, 1283-1284]을 참조한다.Polyribonucleotides may or may not be uniformly modified along the entire length of the molecule. For example, one or more or all types of nucleotides (e.g., naturally occurring nucleotides, purines, or pyrimidines, or any one or more or all of A, G, U, C, I, pU) are circular polyribonucleotides. may or may not be uniformly modified in, or in a given predetermined sequence region thereof. In some embodiments, the circular polyribonucleotide comprises pseudouridine. In some embodiments, the circular polyribonucleotide includes inosine, which may be helpful to the immune system in characterizing the circular polyribonucleotide as endogenous versus viral RNA. Incorporation of inosine may also mediate improved RNA stability/reduced degradation. See, for example, Yu, Z. et al., incorporated by reference in their entirety. (2015) RNA editing by ADAR1 marks dsRNA as "self". Cell Res. 25, 1283-1284].
일부 실시 형태에서, 폴리리보뉴클레오티드(또는 그의 주어진 서열 영역) 내의 모든 뉴클레오티드가 변형된다. 일부 실시 형태에서, 변형은 발현을 증가시킬 수 있는 m6A; 면역 반응을 약화시킬 수 있는 이노신; RNA 안정성을 증가시킬 수 있는 슈도우리딘, 또는 안정성을 증가시킬 수 있는 번역 판독(스태거 요소), m5C; 및 세포내 전위(예를 들어, 핵 국소화)를 보조하는 2,2,7-트리메틸구아노신을 포함할 수 있다.In some embodiments, all nucleotides within a polyribonucleotide (or a given sequence region thereof) are modified. In some embodiments, the modification is m6A, which can increase expression; Inosine, which may weaken the immune response; Pseudouridine, which can increase RNA stability, or a translational readthrough (stagger element), m5C, which can increase stability; and 2,2,7-trimethylguanosine, which assists in intracellular translocation (eg, nuclear localization).
상이한 당 변형, 뉴클레오티드 변형, 및/또는 뉴클레오시드간 연결(예를 들어, 백본 구조)은 원형 폴리리보뉴클레오티드에서 다양한 위치에 존재할 수 있다. 당업자는 뉴클레오티드 유사체 또는 다른 변형(들)이 원형 폴리리보뉴클레오티드의 임의의 위치(들)에 위치하고, 그에 따라 원형 폴리리보뉴클레오티드의 기능이 실질적으로 감소되지 않는다는 것을 이해할 것이다. 변형은 또한 비-코딩 영역 변형일 수 있다. 원형 폴리리보뉴클레오티드는 약 1% 내지 약 100% 변형된 뉴클레오티드(전체 뉴클레오티드 함량과 관련하여, 또는 하나 이상의 뉴클레오티드 유형, 즉 A, G, U 또는 C 중 임의의 하나 이상과 관련하여) 또는 임의의 중간 백분율(예를 들어, 1% 내지 20%>, 1% 내지 25%, 1% 내지 50%, 1% 내지 60%, 1% 내지 70%, 1% 내지 80%, 1% 내지 90%, 1% 내지 95%, 10% 내지 20%, 10% 내지 25%, 10% 내지 50%, 10% 내지 60%, 10% 내지 70%, 10% 내지 80%, 10% 내지 90%, 10% 내지 95%, 10% 내지 100%, 20% 내지 25%, 20% 내지 50%, 20% 내지 60%, 20% 내지 70%, 20% 내지 80%, 20% 내지 90%, 20% 내지 95%, 20% 내지 100%, 50% 내지 60%, 50% 내지 70%, 50% 내지 80%, 50% 내지 90%, 50% 내지 95%, 50% 내지 100%, 70% 내지 80%, 70% 내지 90%, 70% 내지 95%, 70% 내지 100%, 80% 내지 90%, 80% 내지 95%, 80% 내지 100%, 90% 내지 95%, 90% 내지 100%, 및 95% 내지 100%)을 포함할 수 있다.Different sugar modifications, nucleotide modifications, and/or internucleoside linkages (e.g., backbone structures) may be present at various positions in the circular polyribonucleotide. Those skilled in the art will understand that nucleotide analogs or other modification(s) can be placed at any position(s) of the circular polyribonucleotide without thereby substantially reducing the function of the circular polyribonucleotide. The modification may also be a non-coding region modification. Circular polyribonucleotides are nucleotides that are modified from about 1% to about 100% (with respect to the total nucleotide content, or with respect to any one or more of one or more nucleotide types, i.e., A, G, U or C) or any intermediate Percentages (e.g., 1% to 20%>, 1% to 25%, 1% to 50%, 1% to 60%, 1% to 70%, 1% to 80%, 1% to 90%, 1 % to 95%, 10% to 20%, 10% to 25%, 10% to 50%, 10% to 60%, 10% to 70%, 10% to 80%, 10% to 90%, 10% to 95%, 10% to 100%, 20% to 25%, 20% to 50%, 20% to 60%, 20% to 70%, 20% to 80%, 20% to 90%, 20% to 95% , 20% to 100%, 50% to 60%, 50% to 70%, 50% to 80%, 50% to 90%, 50% to 95%, 50% to 100%, 70% to 80%, 70 % to 90%, 70% to 95%, 70% to 100%, 80% to 90%, 80% to 95%, 80% to 100%, 90% to 95%, 90% to 100%, and 95% to 100%).
원형화 방법Circularization method
본 개시내용은 예를 들어, 재조합 기술 또는 화학적 합성을 포함하는 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리리보뉴클레오티드를 생성하는 방법을 제공한다. 예를 들어, RNA 서클을 생성하는 데 사용되는 DNA 분자는 자연적으로 발생하는 원래의 핵산 서열의 DNA 서열, 이의 변형된 버전, 또는 자연에서 일반적으로 발견되지 않는 합성 폴리펩티드(예를 들어, 키메라 분자 또는 융합 단백질)를 인코딩하는 DNA 서열을 포함할 수 있다. DNA 및 RNA 분자는 전통적인 돌연변이유발 기술 및 재조합 기술, 예컨대 부위-지정 돌연변이유발, 돌연변이를 유도하기 위한 핵산 분자의 화학적 처리, 핵산 단편의 제한 효소 절단, 핵산 단편의 결찰, 핵산 서열의 선택된 영역의 폴리머라제 연쇄 반응(PCR) 증폭 또는 돌연변이유발, 올리고뉴클레오티드 혼합물의 합성 및 핵산 분자의 혼합물을 "구축"하기 위한 혼합물 그룹의 결찰 및 이들의 조합을 포함하지만, 이에 한정되는 것은 아닌 다양한 기술을 사용하여 변형될 수 있다.The present disclosure provides methods for producing circular polyribonucleotides encoding antifusogenic polypeptides (e.g., polypeptides in Table 1) involving, for example, recombinant techniques or chemical synthesis. For example, the DNA molecules used to generate RNA circles may be DNA sequences of the original naturally occurring nucleic acid sequence, modified versions thereof, or synthetic polypeptides not commonly found in nature (e.g., chimeric molecules or It may contain a DNA sequence encoding a fusion protein). DNA and RNA molecules can be prepared using traditional mutagenesis and recombination techniques, such as site-directed mutagenesis, chemical treatment of nucleic acid molecules to induce mutations, restriction enzyme digestion of nucleic acid fragments, ligation of nucleic acid fragments, and polymerization of selected regions of the nucleic acid sequence. Modification using a variety of techniques, including, but not limited to, PCR amplification or mutagenesis, synthesis of oligonucleotide mixtures, and ligation of mixture groups to "construct" mixtures of nucleic acid molecules, and combinations thereof. It can be.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 고리화 또는 연쇄화될 수 있다. 일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 제형 및/또는 전달 전에 시험관내에서 고리화될 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드와의 혼합물일 수 있다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 원형 폴리리보뉴클레오티드와 동일한 핵산 서열을 갖는다.In some embodiments, linear polyribonucleotides for circularization may be cyclized or concatenated. In some embodiments, linear polyribonucleotides for circularization can be cyclized in vitro prior to formulation and/or delivery. In some embodiments, circular polyribonucleotides can be a mixture of linear polyribonucleotides. In some embodiments, the linear polyribonucleotide has the same nucleic acid sequence as the circular polyribonucleotide.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 고리화되거나, 또는 화학적 방법을 사용하여 연쇄화되어 원형 폴리리보뉴클레오티드를 형성한다. 일부 화학적 방법에서, 핵산의 5'-단부 및 3'-단부(예를 들어, 원형화를 위한 선형 폴리리보뉴클레오티드)는 화학적으로 반응성인 기를 포함하며, 이는 서로 가까울 때 분자의 5'-단부 및 3'-말단 사이에 새로운 공유 연결을 형성할 수 있다. 5'-단부는 NHS-에스테르 반응성 기를 함유할 수 있고 3'-단부는 3'-아미노-종결된 뉴클레오티드를 함유할 수 있고, 그에 따라 유기 용매에서 선형 RNA 분자의 3'-단부 상의 3'-아미노-종결된 뉴클레오티드는 새로운 5'-/3'-아미드 결합을 형성하는 5'-NHS-에스테르 모이어티에 대한 친핵성 공격을 받을 것이다.In some embodiments, linear polyribonucleotides for circularization are cyclized or concatenated using chemical methods to form circular polyribonucleotides. In some chemical methods, the 5'-end and 3'-end of a nucleic acid (e.g., linear polyribonucleotides for circularization) contain chemically reactive groups that, when close to each other, are attached to the 5'-end and 3'-end of the molecule. A new covalent linkage can be formed between the 3'-ends. The 5'-end may contain an NHS-ester reactive group and the 3'-end may contain a 3'-amino-terminated nucleotide, and thus the 3'-end on the 3'-end of the linear RNA molecule in an organic solvent. The amino-terminated nucleotide will undergo nucleophilic attack on the 5'-NHS-ester moiety forming a new 5'-/3'-amide bond.
일부 실시 형태에서, DNA 또는 RNA 리가제는 5'-인산화된 핵산 분자(예를 들어, 원형화를 위한 선형 폴리리보뉴클레오티드)를 새로운 포스포로디에스테르 연결을 형성하는 핵산(예를 들어, 선형 핵산)의 3'-히드록실 기에 효소적으로 연결하는 데 사용된다. 예시적인 반응에서, 원형화를 위한 선형 폴리리보뉴클레오티드를 제조사의 프로토콜에 따라 T4 RNA 리가제(뉴 잉글랜드 바이오랩스(New England Biolabs), 입스위치, 메사추세스)의 1 내지 10 단위와 함께 37℃에서 1시간 동안 인큐베이션하였다. 결찰 반응은 효소 결찰 반응을 돕기 위해 병치된 5'- 및 3'-영역 둘 모두와 염기-쌍을 형성할 수 있는 선형 핵산의 존재 하에 발생할 수 있다. 일부 실시 형태에서, 결찰은 스플린트 결찰이다. 예를 들어, SplintR® 리가제와 같은 스플린트 리가제는 스플린트 결찰, RNA 리가제 II, T4 RNA 리가제, 또는 T4 DNA 리가제에 사용될 수 있다. 스플린트 결찰의 경우, 단일 가닥 RNA와 같은 단일 가닥 폴리뉴클레오티드(스플린트)는 선형 폴리리보뉴클레오티드의 양쪽 말단과 혼성화하도록 설계될 수 있고, 그에 따라 두 말단 모두는 단일 가닥 스플린트와 혼성화시 병치될 수 있다. 따라서 스플린트 리가제는 선형 폴리리보뉴클레오티드의 병치된 두 말단의 결찰을 촉매하여 원형 폴리리보뉴클레오티드를 생성할 수 있다.In some embodiments, a DNA or RNA ligase ligates a 5'-phosphorylated nucleic acid molecule (e.g., a linear polyribonucleotide for circularization) to a nucleic acid (e.g., a linear nucleic acid) that forms new phosphorodiester linkages. ) is used to enzymatically link the 3'-hydroxyl group of. In an exemplary reaction, linear polyribonucleotides for circularization are incubated at 37°C with 1 to 10 units of T4 RNA ligase (New England Biolabs, Ipswich, MA) according to the manufacturer's protocol. It was incubated for 1 hour. The ligation reaction can occur in the presence of a linear nucleic acid capable of base-pairing with both the juxtaposed 5'- and 3'-regions to assist in the enzymatic ligation reaction. In some embodiments, the ligation is a splint ligation. For example, a splint ligase, such as SplintR® ligase, can be used for splint ligation, RNA ligase II, T4 RNA ligase, or T4 DNA ligase. For splint ligation, a single-stranded polynucleotide (splint), such as a single-stranded RNA, can be designed to hybridize with both ends of a linear polyribonucleotide, such that both ends can be juxtaposed upon hybridization with the single-stranded splint. Therefore, splint ligase can catalyze the ligation of two juxtaposed ends of a linear polyribonucleotide to generate a circular polyribonucleotide.
일부 실시 형태에서, DNA 또는 RNA 리가제는 원형 폴리뉴클레오티드의 합성에 사용된다. 일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드의 5'-단부 또는 3'-단부 중 어느 하나는 리가제 리보자임 서열을 인코딩할 수 있고, 그에 따라 시험관내 전사 동안, 원형화를 위한 생성된 선형 폴리리보뉴클레오티드가 원형화를 위한 선형 폴리리보뉴클레오티드의 5'-단부를 원형화를 위한 선형 폴리리보뉴클레오티드의 3'-단부에 결찰시킬 수 있는 활성 리보자임 서열을 포함한다. 리가제 리보자임은 그룹 I 인트론, 간염 델타 바이러스, 헤어핀 리보자임으로부터 유래될 수 있거나, SELEX(지수 농축에 의한 리간드의 체계적인 진화)에 의해 선택될 수 있다. 리보자임 리가제 반응은 0 내지 37℃의 온도에서 1 내지 24시간이 걸릴 수 있다.In some embodiments, DNA or RNA ligase is used in the synthesis of circular polynucleotides. In some embodiments, either the 5'-end or the 3'-end of the linear polyribonucleotide for circularization may encode a ligase ribozyme sequence, thereby producing a ligase ribozyme sequence for circularization during in vitro transcription. The linear polyribonucleotide comprises an active ribozyme sequence capable of ligating the 5'-end of the linear polyribonucleotide for circularization to the 3'-end of the linear polyribonucleotide for circularization. Ligase ribozymes can be derived from group I introns, hepatitis delta virus, hairpin ribozymes, or selected by SELEX (Systematic Evolution of Ligands by Exponential Enrichment). The ribozyme ligase reaction may take 1 to 24 hours at a temperature of 0 to 37°C.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 적어도 하나의 비-핵산 모이어티를 사용함으로써 고리화 또는 연쇄화된다. 한 양태에서, 적어도 하나의 비-핵산 모이어티는 원형화를 위해 선형 폴리리보뉴클레오티드를 고리화 또는 연쇄화시키기 위해 원형화를 위한 선형 폴리리보뉴클레오티드의 5' 말단 근처 및/또는 3' 말단 근처의 영역 또는 특징과 반응할 수 있다. 또 다른 양태에서, 적어도 하나의 비-핵산 모이어티는 원형화를 위해 선형 폴리리보뉴클레오티드의 5' 말단 및/또는 3' 말단 내에 위치하거나 이에 또는 그 근처에 연결될 수 있다. 고려되는 비-핵산 모이어티는 상동성 또는 이종성일 수 있다. 비제한적인 예로서, 비-핵산 모이어티는 소수성 연결, 이온성 연결, 생분해성 연결, 및/또는 절단가능한 연결과 같은 연결일 수 있다. 또 다른 비제한적인 예로서, 비-핵산 모이어티는 결찰 모이어티이다. 또 다른 비제한적인 예로서, 비-핵산 모이어티는 올리고뉴클레오티드 또는 펩티드 모이어티, 예컨대 본원에 기재된 바와 같은 압타머 또는 비-핵산 링커일 수 있다.In some embodiments, the linear polyribonucleotide for circularization is cyclized or concatenated by using at least one non-nucleic acid moiety. In one embodiment, the at least one non-nucleic acid moiety is near the 5' end and/or near the 3' end of the linear polyribonucleotide for circularization to cyclize or concatenate the linear polyribonucleotide for circularization. Can react with areas or features. In another aspect, at least one non-nucleic acid moiety may be located within or linked to or near the 5' end and/or 3' end of the linear polyribonucleotide for circularization. Non-nucleic acid moieties contemplated may be homologous or heterologous. By way of non-limiting example, the non-nucleic acid moiety may be a linkage such as a hydrophobic linkage, an ionic linkage, a biodegradable linkage, and/or a cleavable linkage. As another non-limiting example, the non-nucleic acid moiety is a ligation moiety. As another non-limiting example, the non-nucleic acid moiety may be an oligonucleotide or peptide moiety, such as an aptamer or non-nucleic acid linker as described herein.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 IVT 및 RNA 폴리머라제를 사용하여 합성되며, 여기서 IVT에 사용되는 뉴클레오티드 혼합물은 5' 모노포스페이트를 갖는 RNA를 우선적으로 생성하기 위해 구아노신 트리포스페이트에 비해 과량의 구아노신 모노포스페이트를 함유할 수 있고; 정제된 IVT 생성물은 스플린트 DNA를 사용하여 원형화될 수 있다.In some embodiments, linear polyribonucleotides for circularization are synthesized using IVT and RNA polymerase, wherein the nucleotide mixture used in IVT is guanosine triphosphate to preferentially produce RNA with a 5' monophosphate. may contain an excess amount of guanosine monophosphate compared to; Purified IVT product can be circularized using splinted DNA.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 원형화를 위한 선형 폴리리보뉴클레오티드의 5' 및 3' 단부에서, 그 근처에서 또는 그에 연결된 원자, 분자 표면 사이의 인력을 유발하는 비-핵산 모이어티로 인해 고리화 또는 연쇄화된다. 비제한적인 예로서, 원형화를 위한 하나 이상의 선형 폴리리보뉴클레오티드는 분자간 힘 또는 분자내 힘에 의해 고리화 또는 연쇄화될 수 있다. 분자간 힘의 비제한적인 예는 쌍극자-쌍극자 힘, 쌍극자-유도 쌍극자 힘, 유도 쌍극자-유도 쌍극자 힘, 반 데르 발스 힘, 및 런던 분산력을 포함한다. 분자내 힘의 비제한적인 예는 공유 결합, 금속 결합, 이온 결합, 공진 결합, 불가지성 결합, 쌍극성 결합, 컨쥬게이션, 하이퍼 컨쥬게이션 및 항결합을 포함한다.In some embodiments, the linear polyribonucleotide for circularization is a non-nucleic acid that causes attraction between the molecular surfaces, atoms at, near or connected to the 5' and 3' ends of the linear polyribonucleotide for circularization. It is cyclized or chained due to the moiety. As a non-limiting example, one or more linear polyribonucleotides for circularization may be cyclized or chained by intermolecular or intramolecular forces. Non-limiting examples of intermolecular forces include dipole-dipole forces, dipole-induced dipole forces, induced dipole-induced dipole forces, van der Waals forces, and London dispersion forces. Non-limiting examples of intramolecular forces include covalent bonding, metallic bonding, ionic bonding, resonant bonding, agnostic bonding, dipolar bonding, conjugation, hyperconjugation, and antibonding.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 5' 말단 근처 및 3' 말단 근처의 리보자임 RNA 서열을 포함할 수 있다. 리보자임 RNA 서열은 서열이 리보자임의 나머지 부분에 노출될 때 펩티드에 공유적으로 연결될 수 있다. 한 양태에서, 5' 말단 및 3' 말단 근처의 리보자임 RNA 서열에 공유적으로 연결된 펩티드는 서로 회합하여 원형화를 위한 선형 폴리리보뉴클레오티드가 고리화 또는 연쇄화되도록 할 수 있다. 또 다른 양태에서, 5' 말단 및 3' 말단 근처의 리보자임 RNA에 공유적으로 연결된 펩티드는 선형 1차 작제물 또는 선형 mRNA가 단백질 결찰과 같은, 그러나 이에 한정되지 않는 당업계에 알려져 있는 다양한 방법을 사용하여 결찰을 겪은 후 고리화 또는 연쇄화되도록 할 수 있다. 본 발명의 선형 1차 작제물 또는 선형 RNA 또는 펩티드를 통합하고/하거나 공유적으로 연결하는 방법의 비포괄적인 목록에 사용하기 위한 리보자임의 비제한적인 예는 미국 특허 출원 제US20030082768호에 기재되어 있으며, 그 내용은 그 전체가 본원에 참조로 포함된다.In some embodiments, linear polyribonucleotides for circularization may include ribozyme RNA sequences near the 5' end and near the 3' end. A ribozyme RNA sequence can be covalently linked to a peptide when the sequence is exposed to the rest of the ribozyme. In one embodiment, peptides covalently linked to ribozyme RNA sequences near the 5' and 3' ends can associate with each other to cause the linear polyribonucleotide for circularization to be cyclized or concatenated. In another embodiment, the peptides covalently linked to the ribozyme RNA near the 5' and 3' ends can be transformed into linear primary constructs or linear mRNAs by a variety of methods known in the art, such as, but not limited to, protein ligation. It can be cyclized or chained after undergoing ligation using . Non-limiting examples of ribozymes for use in the non-exhaustive list of methods of integrating and/or covalently linking linear primary constructs or linear RNA or peptides of the invention are described in U.S. Patent Application No. US20030082768. and the contents thereof are incorporated herein by reference in their entirety.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는, 예를 들어, 5' 트리포스페이트를 RNA 5' 피로포스포히드롤라제(RppH) 또는 ATP 디포스포히드롤라제(아피라제)와 접촉시킴으로써 5' 모노포스페이트로 전환된 핵산의 5' 트리포스페이트를 포함할 수 있다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드의 적어도 일부의 5' 단부는 모노포스페이트 모이어티를 포함한다. 일부 실시 형태에서, 원형 및 선형 폴리리보뉴클레오티드를 포함하는 폴리리보뉴클레오티드의 집단은 선형 폴리리보뉴클레오티드의 적어도 일부를 5' 엑소뉴클레아제 및/또는 3' 엑소뉴클레아제로 분해하기 전에 RppH와 접촉된다. 대안적으로, 원형화를 위한 선형 폴리리보뉴클레오티드의 5' 트리포스페이트를 5' 모노포스페이트로 전환하는 것은, (a) 원형화를 위한 선형 폴리리보뉴클레오티드의 5' 뉴클레오티드를 포스파타제(예를 들어, 남극 포스파타제, 새우 알칼리성 포스파타제, 또는 송아지 장 포스파타제)와 접촉시켜 3개의 포스페이트 모두를 제거하는 단계; 및 (b) 단계 (a) 이후의 5' 뉴클레오티드를 단일 포스페이트를 첨가하는 키나제(예를 들어, 폴리뉴클레오티드 키나제)와 접촉시키는 단계를 포함하는 2단계 반응에 의해 발생할 수 있다.In some embodiments, linear polyribonucleotides for circularization are prepared by, for example, contacting the 5' triphosphate with RNA 5' pyrophosphohydrolase (RppH) or ATP dephosphohydrolase (apyrase). It may include the 5' triphosphate of a nucleic acid converted to a 5' monophosphate. In some embodiments, at least a portion of the 5' end of the linear polyribonucleotide comprises a monophosphate moiety. In some embodiments, the population of polyribonucleotides, including circular and linear polyribonucleotides, is contacted with RppH prior to digesting at least a portion of the linear polyribonucleotides with a 5' exonuclease and/or 3' exonuclease. . Alternatively, converting the 5' triphosphate of a linear polyribonucleotide for circularization to a 5' monophosphate can be achieved by (a) converting the 5' nucleotide of the linear polyribonucleotide for circularization to a phosphatase (e.g., Antarctic removing all three phosphates by contacting them with phosphatase, shrimp alkaline phosphatase, or calf intestinal phosphatase; and (b) contacting the 5' nucleotide after step (a) with a kinase (e.g., polynucleotide kinase) that adds a single phosphate.
일부 실시 형태에서, 본원에서 제공된 원형화 방법의 원형화 효율은 적어도 약 10%, 적어도 약 15%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 적어도 약 95%, 또는 100%이다. 일부 실시 형태에서, 본원에서 제공된 원형화 방법의 원형화 효율은 적어도 약 40%이다. 일부 실시 형태에서, 제공된 원형화 방법은 약 10% 내지 약 100%의 원형화 효율을 가지며; 예를 들어, 원형화 효율은 약 15%, 약 20%, 약 25%, 약 30%, 약 35%, 약 40%, 약 45%, 약 50%, 약 55%, 약 60%, 약 65%, 약 70%, 약 75%, 약 80%, 약 85%, 약 90%, 약 95%, 및 약 99%일 수 있다. 일부 실시 형태에서, 원형화 효율은 약 20% 내지 약 80%이다. 일부 실시 형태에서, 원형화 효율은 약 30% 내지 약 60%이다. 일부 실시 형태에서, 원형화 효율은 약 40%이다.In some embodiments, the circularization efficiency of the circularization methods provided herein is at least about 10%, at least about 15%, at least about 20%, at least about 25%, at least about 30%, at least about 35%, at least about 40%. , at least about 45%, at least about 50%, at least about 60%, at least about 70%, at least about 80%, at least about 90%, at least about 95%, or 100%. In some embodiments, the circularization efficiency of the circularization methods provided herein is at least about 40%. In some embodiments, provided circularization methods have a circularization efficiency of about 10% to about 100%; For example, the circularization efficiency is about 15%, about 20%, about 25%, about 30%, about 35%, about 40%, about 45%, about 50%, about 55%, about 60%, about 65%. %, about 70%, about 75%, about 80%, about 85%, about 90%, about 95%, and about 99%. In some embodiments, the circularization efficiency is about 20% to about 80%. In some embodiments, the circularization efficiency is about 30% to about 60%. In some embodiments, the circularization efficiency is about 40%.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 복제될 때 스플라이싱된 단부가 함께 연결되는 내부 스플라이싱 요소를 포함한다. 일부 예는 스플라이스 부위 서열 및 짧은 역 반복부(30 내지 40 nt), 예컨대 AluSq2, AluJr 및 AluSz를 갖는 소형 인트론(100 nt 미만), 플랭킹 인트론 내의 역 서열, 플랭킹 인트론 내의Alu요소, 및 플랭킹 엑손을 갖는 후방 스플라이스 부위에 선행하는(이의 상류) 또는 후행하는(이로부터의 하류) 200 bp의 서열과 같은 후방 스플라이스 이벤트에 근접한 (추정가능한4 농축 모티프)시스-서열 요소에서 발견되는 모티프를 포함할 수 있다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 내부 스플라이싱 요소로서 본원의 다른 곳에서 기재된 적어도 하나의 반복 뉴클레오티드 서열을 포함한다. 이러한 실시 형태에서, 반복 뉴클레오티드 서열은 인트론의 Alu 패밀리로부터의 반복 서열을 포함할 수 있다. 일부 실시 형태에서, 스플라이싱-관련 리보솜 결합 단백질은 원형 폴리리보뉴클레오티드 생합성(예를 들어, 근육 블라인드 및 퀘이킹(QKI) 스플라이싱 인자)을 조절할 수 있다.In some embodiments, circular polyribonucleotides include internal splicing elements through which the spliced ends are joined together when replicated. Some examples include splice site sequences and short inverted repeats (30 to 40 nt), such as small introns (less than 100 nt) with AluSq2, AluJr and AluSz, inverted sequences within flanking introns,Alu elements within flanking introns, and Found incis -sequence elements (possible 4-enriched motifs) close to the posterior splice event, such as 200 bp of sequence preceding (upstream of) or following (downstream from) the posterior splice site with flanking exons. It may include motifs that are In some embodiments, the linear polyribonucleotide comprises at least one repeating nucleotide sequence described elsewhere herein as an internal splicing element. In this embodiment, the repeating nucleotide sequence may comprise a repeating sequence from the Alu family of introns. In some embodiments, a splicing-related ribosome binding protein can regulate circular polyribonucleotide biosynthesis (e.g., muscle blinding and quaking (QKI) splicing factor).
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 원형 폴리리보뉴클레오티드의 헤드-투-테일(head-to-tail) 접합부에 플랭킹된 표준 스플라이스 부위를 포함할 수 있다.In some embodiments, a linear polyribonucleotide may include standard splice sites flanking a head-to-tail junction of a circular polyribonucleotide.
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 2개의 3-뉴클레오티드 벌지가 플랭킹된 4-염기쌍 스템을 포함하는 벌지-나선-벌지 모티프를 포함할 수 있다. 절단은 벌지 영역의 부위에서 발생하여 말단의 5'-히드록실 기와 2',3'-환형 포스페이트를 갖는 특징적인 단편을 생성한다. 원형화는 3',5'-포스포디에스테르 다리를 형성하는 동일한 분자의 2',3'-환형 포스페이트에 대한 5'-OH 기의 친핵성 공격에 의해 진행된다.In some embodiments, the linear polyribonucleotide may comprise a bulge-helix-bulge motif comprising a 4-base pair stem flanked by two 3-nucleotide bulges. Cleavage occurs at the site of the bulge region, producing a characteristic fragment with a terminal 5'-hydroxyl group and a 2',3'-cyclic phosphate. Circularization proceeds by nucleophilic attack of the 5'-OH group on the 2',3'-cyclic phosphate of the same molecule, forming a 3',5'-phosphodiester bridge.
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 HPR 요소를 보유하는 다량체 반복 RNA 서열을 포함할 수 있다. HPR은 2',3'-시클릭 포스페이트 및 5'-OH 말단을 포함한다. HPR 요소는 선형 선형 폴리리보뉴클레오티드의 5'- 및 3'-단부를 자체 처리함으로써 단부를 결찰시킨다.In some embodiments, linear polyribonucleotides may comprise multimeric repeat RNA sequences bearing HPR elements. HPR contains a 2',3'-cyclic phosphate and a 5'-OH terminus. The HPR element ligates the ends of linear polyribonucleotides by self-processing the 5'- and 3'-ends.
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 자가-결찰을 매개하는 서열을 포함할 수 있다. 한 실시 형태에서, 선형 폴리리보뉴클레오티드는 자가-결찰에 대한 HDV 서열, 예를 들어 HDV 복제 도메인 보존 서열,In some embodiments, linear polyribonucleotides may include sequences that mediate self-ligation. In one embodiment, the linear polyribonucleotide comprises an HDV sequence for self-ligation, e.g., an HDV replication domain conserved sequence,
을 포함할 수 있다. 한 실시 형태에서, 선형 폴리리보뉴클레오티드는 자가-결찰을 위해 루프 E 서열(예를 들어, PSTVd에서)을 포함할 수 있다. 또 다른 실시 형태에서, 선형 폴리리보뉴클레오티드는 자가-원형화 인트론, 예를 들어, 5' 및 3' 슬라이스 접합, 또는 그룹 I, 그룹 II 또는 그룹 III 인트론과 같은 자가-원형화 촉매 인트론을 포함할 수 있다. 그룹 I 인트론 자기-스플라이싱 서열의 비제한적인 예는 T4 박테리오파지 유전자 td로부터 유래된 자기-스플라이싱 순열 인트론-엑손 서열, 및 테트라하이메나(Tetrahymena)의 개재 서열(IVS) rRNA를 포함할 수 있다.may include. In one embodiment, the linear polyribonucleotide may include a loop E sequence (e.g., in PSTVd) for self-ligation. In another embodiment, the linear polyribonucleotide may comprise a self-circularizing intron, e.g., a 5' and 3' slice junction, or a self-circularizing catalytic intron, such as a group I, group II, or group III intron. You can. Non-limiting examples of Group I intronic self-splicing sequences may include a self-splicing permuted intron-exon sequence derived from the T4 bacteriophage gene td, and the intervening sequence (IVS) rRNA of Tetrahymena. You can.
일부 실시 형태에서, 원형화를 위한 선형 폴리리보뉴클레오티드는 개별 인트론 내 또는 플랭킹 인트론에 걸쳐 반복 핵산 서열 또는 비반복 핵산 서열 중 어느 하나를 포함하는 상보적 서열을 포함할 수 있다. 반복 핵산 서열은 선형 폴리리보뉴클레오티드의 세그먼트 내에서 발생하는 서열이다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 반복 핵산 서열을 포함한다. 일부 실시 형태에서, 반복 뉴클레오티드 서열은 폴리 CA 또는 폴리 UG 서열을 포함한다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드의 또 다른 세그먼트 내의 상보적 반복 핵산 서열에 혼성화하는 적어도 하나의 반복 핵산 서열을 포함하고, 혼성화된 세그먼트는 내부 이중 가닥을 형성한다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드의 다른 세그먼트에서 상보적 반복 핵산 서열에 혼성화하는 1 내지 10개(예를 들어, 2, 3, 4, 5, 6, 7, 8, 9 및 10개)의 반복 핵산 서열을 포함하고, 혼성화된 세그먼트는 내부 이중 가닥을 형성한다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드의 또 다른 세그먼트에서 상보적 반복 핵산 서열에 혼성화하는 2개의 반복 핵산 서열을 포함하고, 혼성화된 세그먼트는 내부 이중 가닥을 형성한다. 일부 실시 형태에서, 2개의 별개의 선형 폴리리보뉴클레오티드로부터의 반복 핵산 서열 및 상보적 반복 핵산 서열은 혼성화되어 단일의 원형화된 폴리리보뉴클레오티드를 생성하며, 혼성화된 세그먼트는 내부 이중 가닥을 형성한다. 일부 실시 형태에서, 상보적 서열은 원형화를 위한 선형 폴리리보뉴클레오티드의 5' 및 3' 단부에서 발견된다. 일부 실시 형태에서, 상보적 서열은 약 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100개, 또는 그 초과의 쌍을 이루는 뉴클레오티드를 포함한다.In some embodiments, linear polyribonucleotides for circularization may comprise complementary sequences, including either repetitive or non-repetitive nucleic acid sequences within individual introns or across flanking introns. Repetitive nucleic acid sequences are sequences that occur within segments of linear polyribonucleotides. In some embodiments, linear polyribonucleotides comprise repetitive nucleic acid sequences. In some embodiments, the repeating nucleotide sequence comprises a poly CA or poly UG sequence. In some embodiments, the linear polyribonucleotide comprises at least one repeating nucleic acid sequence that hybridizes to a complementary repeating nucleic acid sequence within another segment of the linear polyribonucleotide, and the hybridized segment forms an internal duplex. In some embodiments, the linear polyribonucleotide has 1 to 10 nucleic acid sequences (e.g., 2, 3, 4, 5, 6, 7, 8, 9) that hybridize to complementary repeating nucleic acid sequences in other segments of the linear polyribonucleotide. and 10) repetitive nucleic acid sequences, the hybridized segments forming an internal duplex. In some embodiments, the linear polyribonucleotide comprises two repeating nucleic acid sequences that hybridize to a complementary repeating nucleic acid sequence in another segment of the linear polyribonucleotide, and the hybridized segments form an internal duplex. In some embodiments, repetitive nucleic acid sequences from two separate linear polyribonucleotides and complementary repetitive nucleic acid sequences hybridize to produce a single circularized polyribonucleotide, with the hybridized segments forming an internal duplex. In some embodiments, complementary sequences are found at the 5' and 3' ends of the linear polyribonucleotide for circularization. In some embodiments, the complementary sequence is about 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, or more pairs It contains nucleotides that make up.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드를 생성하기 위해 원형화의 화학적 방법이 사용될 수 있다. 이러한 방법은 클릭 화학(예를 들어, 알킨 및 아지드계 방법, 또는 클릭 가능한 염기), 올레핀 복분해, 포스포르아미데이트 결찰, 헤미아민-이민 가교, 염기 변형, 및 이들의 임의의 조합을 포함할 수 있지만, 이에 한정되는 것은 아니다.In some embodiments, chemical methods of circularization can be used to generate circular polyribonucleotides. These methods may include click chemistry (e.g., alkyne and azide based methods, or clickable bases), olefin metathesis, phosphoramidate ligation, hemiamine-imine cross-linking, base modification, and any combinations thereof. It may be possible, but it is not limited to this.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드를 생성하기 위해 효소적 원형화 방법이 사용될 수 있다. 일부 실시 형태에서, 결찰 효소, 예를 들어 DNA 또는 RNA 리가제를 사용하여 원형 폴리리보뉴클레오티드 또는 보체의 주형, 원형 폴리리보뉴클레오티드의 상보적 가닥, 또는 원형 폴리리보뉴클레오티드를 생성할 수 있다.In some embodiments, enzymatic circularization methods can be used to generate circular polyribonucleotides. In some embodiments, a ligation enzyme, such as a DNA or RNA ligase, can be used to generate a circular polyribonucleotide or a template of complement, a complementary strand of a circular polyribonucleotide, or a circular polyribonucleotide.
선형 폴리리보뉴클레오티드의 원형화는 당업계에 알려져 있는 방법, 예를 들어, 문헌["RNA circularization strategies in vivo and in vitro", Petkovic and Muller, Nucleic Acids Res, 2015, 43(4): 2454-2465] 및 문헌["In vitro circularization of RNA", Muller and Appel, RNA Biol, 2017, 14(8):1018-1027]에 기재된 방법에 의해 달성될 수 있다.Circularization of linear polyribonucleotides can be accomplished using methods known in the art, e.g., “RNA circularization strategies in vivo and in vitro”, Petkovic and Muller, Nucleic Acids Res, 2015, 43(4): 2454-2465. ] and the literature ["In vitro circularization of RNA", Muller and Appel, RNA Biol, 2017, 14(8):1018-1027].
원형 폴리리보뉴클레오티드는 복제에 유용한 서열 및/또는 모티프를 인코딩할 수 있다. 예시적인 복제 요소는 그 전체가 본원에 참조로 포함되는 국제 특허 공개 제WO2019/118919호의 단락 [0280] 내지 [0286]에 기재되어 있다.Circular polyribonucleotides may encode sequences and/or motifs useful for replication. Exemplary replication elements are described in paragraphs [0280] to [0286] of International Patent Publication No. WO2019/118919, which is incorporated herein by reference in its entirety.
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 개별 인트론 내 또는 플랭킹 인트론에 걸쳐 반복 핵산 서열 또는 비반복 핵산 서열 중 어느 하나를 포함하는 상보적 서열을 포함할 수 있다. 반복 핵산 서열은 원형 폴리리보뉴클레오티드의 세그먼트 내에서 발생하는 서열이다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 반복 핵산 서열을 포함한다. 일부 실시 형태에서, 반복 뉴클레오티드 서열은 폴리 CA 또는 폴리 UG 서열을 포함한다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드의 또 다른 세그먼트 내의 상보적 반복 핵산 서열에 혼성화하는 적어도 하나의 반복 핵산 서열을 포함하고, 혼성화된 세그먼트는 내부 이중 가닥을 형성한다. 일부 실시 형태에서, 2개의 별개의 선형 폴리리보뉴클레오티드로부터의 반복 핵산 서열 및 상보적 반복 핵산 서열은 혼성화되어 단일의 원형화된 폴리리보뉴클레오티드를 생성하며, 혼성화된 세그먼트는 내부 이중 가닥을 형성한다. 일부 실시 형태에서, 상보적 서열은 선형 폴리리보뉴클레오티드의 5' 및 3' 단부에서 발견된다. 일부 실시 형태에서, 상보적 서열은 약 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100개, 또는 그 초과의 쌍을 이루는 뉴클레오티드를 포함한다.In some embodiments, linear polyribonucleotides may comprise complementary sequences comprising either repetitive or non-repeating nucleic acid sequences within individual introns or across flanking introns. Repetitive nucleic acid sequences are sequences that occur within segments of circular polyribonucleotides. In some embodiments, linear polyribonucleotides comprise repetitive nucleic acid sequences. In some embodiments, the repeating nucleotide sequence comprises a poly CA or poly UG sequence. In some embodiments, the linear polyribonucleotide comprises at least one repeating nucleic acid sequence that hybridizes to a complementary repeating nucleic acid sequence within another segment of the linear polyribonucleotide, and the hybridized segment forms an internal duplex. In some embodiments, repetitive nucleic acid sequences from two separate linear polyribonucleotides and complementary repetitive nucleic acid sequences hybridize to produce a single circularized polyribonucleotide, with the hybridized segments forming an internal duplex. In some embodiments, complementary sequences are found at the 5' and 3' ends of the linear polyribonucleotide. In some embodiments, the complementary sequence is about 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, or more pairs It contains nucleotides that make up.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드를 생성하기 위해 원형화의 화학적 방법이 사용될 수 있다. 이러한 방법은 클릭 화학(예를 들어, 알킨 및 아지드계 방법, 또는 클릭 가능한 염기), 올레핀 복분해, 포스포르아미데이트 결찰, 헤미아민-이민 가교, 염기 변형, 및 이들의 임의의 조합을 포함할 수 있지만, 이에 한정되는 것은 아니다.In some embodiments, chemical methods of circularization can be used to generate circular polyribonucleotides. These methods may include click chemistry (e.g., alkyne and azide based methods, or clickable bases), olefin metathesis, phosphoramidate ligation, hemiamine-imine cross-linking, base modification, and any combinations thereof. It may be possible, but it is not limited to this.
본원에 기재된 원형 폴리리보뉴클레오티드를 제조하는 방법은 예를 들어, 문헌[Khudyakov & Fields, Artificial DNA: Methods and Applications, CRC Press (2002)]; 문헌[Zhao, Synthetic Biology: Tools and Applications, (First Edition), Academic Press (2013)]; 문헌[Muller and Appel, from RNA Biol, 2017, 14(8):1018-1027]; 및 문헌[Egli & Herdewijn, Chemistry and Biology of Artificial Nucleic Acids, (First Edition), Wiley-VCH (2012)]에 기재되어 있다. 원형 폴리리보뉴클레오티드를 제조하는 다른 방법은 예를 들어, 국제 특허 공개 제WO2022/247943호, 미국 특허 제US11000547호, 국제 특허 공개 제2018/191722호, 국제 특허 공개 제WO2019/236673호, 국제 특허 공개 제WO2020/023595호, 국제 특허 공개 제WO2022/204460호, 국제 특허 공개 제WO2022/204464호, 및 국제 특허 공개 제WO2022/204466호에 기재되어 있다.Methods for making circular polyribonucleotides described herein are described, for example, in Khudyakov & Fields, Artificial DNA: Methods and Applications, CRC Press (2002); Zhao, Synthetic Biology: Tools and Applications, (First Edition), Academic Press (2013); Muller and Appel, from RNA Biol, 2017, 14(8):1018-1027; and Egli & Herdewijn, Chemistry and Biology of Artificial Nucleic Acids, (First Edition), Wiley-VCH (2012). Other methods of preparing circular polyribonucleotides include, for example, International Patent Publication No. WO2022/247943, US Patent No. US11000547, International Patent Publication No. 2018/191722, International Patent Publication No. WO2019/236673, International Patent Publication No. It is described in WO2020/023595, International Patent Publication No. WO2022/204460, International Patent Publication No. WO2022/204464, and International Patent Publication No. WO2022/204466.
원형 폴리리보뉴클레오티드를 합성하는 다양한 방법이 또한 다른 곳에 기재되어 있다(예를 들어, 미국 특허 제US6210931호, 미국 특허 제US5773244호, 미국 특허 제US5766903호, 미국 특허 제US5712128호, 미국 특허 제US5426180호, 미국 특허 공개 제US20100137407호, 국제 특허 공개 제WO1992001813호, 국제 특허 공개 제WO2010084371호, 및 문헌[Petkovic et al., Nucleic Acids Res. 43:2454-65 (2015)]을 참조하며; 각각의 내용은 그 전체가 본원에 참조로 포함된다).Various methods for synthesizing circular polyribonucleotides are also described elsewhere (e.g., US6210931, US5773244, US5766903, US5712128, US5426180). , U.S. Patent Publication No. US20100137407, International Patent Publication No. WO1992001813, International Patent Publication No. WO2010084371, and Petkovic et al., Nucleic Acids Res 43:2454-65 (2015); is incorporated herein by reference in its entirety).
일부 실시 형태에서, 원형 폴리리보뉴클레오티드가 정제되고, 예를 들어 유리 리보핵산, 선형 또는 닉킹된 RNA, DNA, 단백질 등이 제거된다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 당업계에서 통상적으로 사용되는 임의의 알려져 있는 방법에 의해 정제될 수 있다. 비제한적인 정제 방법의 예는 컬럼 크로마토그래피, 겔 절제, 크기 배제 등을 포함한다.In some embodiments, circular polyribonucleotides are purified, e.g., free ribonucleic acids, linear or nicked RNA, DNA, proteins, etc. are removed. In some embodiments, circular polyribonucleotides can be purified by any known method commonly used in the art. Non-limiting examples of purification methods include column chromatography, gel excision, size exclusion, etc.
생성 방법How to create
무세포 시스템에서의 생성 방법Production method in cell-free system
본 개시내용은 또한 원형 RNA를 생성하는 방법을 제공한다. 예를 들어, 데옥시리보뉴클레오티드 주형은 무세포 시스템에서 (예를 들어, 시험관내 전사에 의해) 전사되어 선형 RNA를 생성할 수 있다. 선형 폴리리보뉴클레오티드는 스플라이싱-혼화성 폴리리보뉴클레오티드를 생성하며, 이는 자기-스플라이싱되어 원형 폴리리보뉴클레오티드를 생성할 수 있다.The present disclosure also provides methods for producing circular RNA. For example, a deoxyribonucleotide template can be transcribed in a cell-free system (e.g., by in vitro transcription) to produce linear RNA. Linear polyribonucleotides produce splicing-miscible polyribonucleotides, which can self-splice to produce circular polyribonucleotides.
일부 실시 형태에서, 본 개시내용은 선형 폴리리보뉴클레오티드를 제공하고; 선형 폴리리보뉴클레오티드의 3' 및 5' 스플라이스 부위의 스플라이싱에 적합한 조건 하에서 선형 폴리리보뉴클레오티드를 자기-스플라이싱하고; 그에 의해 원형 폴리리보뉴클레오티드를 생성함으로써 (예를 들어, 무세포 시스템에서) 원형 폴리리보뉴클레오티드를 생성하는 방법을 제공한다.In some embodiments, the present disclosure provides linear polyribonucleotides; self-splicing the linear polyribonucleotide under conditions suitable for splicing the 3' and 5' splice sites of the linear polyribonucleotide; Methods are provided for producing circular polyribonucleotides (e.g., in a cell-free system) thereby producing circular polyribonucleotides.
일부 실시 형태에서, 본 개시내용은 선형 폴리리보뉴클레오티드를 인코딩하는 데옥시리보뉴클레오티드를 제공하고; 데옥시리보뉴클레오티드를 무세포 시스템에서 전사하여 선형 폴리리보뉴클레오티드를 생성하고; 선택적으로 스플라이싱-혼화성 선형 폴리리보뉴클레오티드를 정제하고; 선형 폴리리보뉴클레오티드의 3' 및 5' 스플라이스 부위의 스플라이싱에 적합한 조건 하에서 선형 폴리리보뉴클레오티드를 자기-스플라이싱하고, 그에 의해 원형 폴리리보뉴클레오티드를 생성함으로써, 원형 폴리리보뉴클레오티드를 생성하는 방법을 제공한다.In some embodiments, the present disclosure provides deoxyribonucleotides encoding linear polyribonucleotides; Transcribing deoxyribonucleotides in a cell-free system to produce linear polyribonucleotides; Optionally purifying splicing-miscible linear polyribonucleotides; Self-splicing a linear polyribonucleotide under conditions suitable for splicing of the 3' and 5' splice sites of the linear polyribonucleotide, thereby producing a circular polyribonucleotide, thereby producing a circular polyribonucleotide. Provides a method.
일부 실시 형태에서, 본 개시내용은 선형 폴리리보뉴클레오티드를 인코딩하는 데옥시리보뉴클레오티드를 제공하고; 데옥시리보뉴클레오티드를 무세포 시스템에서 전사하여 선형 폴리리보뉴클레오티드를 생성하고, 여기서 전사는 선형 폴리리보뉴클레오티드의 3' 및 5' 스플라이스 부위의 스플라이싱에 적합한 조건 하에서 용액에서 일어나고, 그에 의해 원형 폴리리보뉴클레오티드를 생성함으로써 원형 폴리리보뉴클레오티드를 생성하는 방법을 제공한다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 5' 스플리트-인트론 및 3' 스플리트-인트론(예를 들어, 원형 폴리리보뉴클레오티드를 생성하기 위한 자기-스플라이싱 작제물)을 포함한다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 5' 어닐링 영역 및 3' 어닐링 영역을 포함한다.In some embodiments, the present disclosure provides deoxyribonucleotides encoding linear polyribonucleotides; Deoxyribonucleotides are transcribed in a cell-free system to produce linear polyribonucleotides, wherein transcription occurs in solution under conditions suitable for splicing of the 3' and 5' splice sites of the linear polyribonucleotide, thereby producing a circular A method for producing circular polyribonucleotides is provided by producing polyribonucleotides. In some embodiments, the linear polyribonucleotide includes a 5' split-intron and a 3' split-intron (e.g., a self-splicing construct to generate a circular polyribonucleotide). In some embodiments, the linear polyribonucleotide includes a 5' annealing region and a 3' annealing region.
시험관내 전사 및 또는 자기-스플라이싱을 위한 적합한 조건은 하나 이상의 관점에서 생리학적 조건을 모방하는 임의의 조건(예를 들어, 용액 또는 완충제, 예컨대 수성 완충제 또는 용액)을 포함할 수 있다. 일부 실시 형태에서, 적합한 조건은 0.1 내지 100 mM Mg2+ 이온 또는 그의 염(예를 들어, 1 내지 100 mM, 1 내지 50 mM, 1 내지 20 mM, 5 내지 50 mM, 5 내지 20 mM, 또는 5 내지 15 mM)을 포함한다. 일부 실시 형태에서, 적합한 조건은 1 내지 1000 mM K+ 이온 또는 그의 염, 예컨대 KCl(예를 들어, 1 내지 1000 mM, 1 내지 500 mM, 1 내지 200 mM, 50 내지 500 mM, 100 내지 500 mM, 또는 100 내지 300 mM)을 포함한다. 일부 실시 형태에서, 적합한 조건은 1 내지 1000 mM Cl- 이온 또는 그의 염, 예컨대 KCl(예를 들어, 1 내지 1000 mM, 1 내지 500 mM, 1 내지 200 mM, 50 내지 500 mM, 100 내지 500 mM, 또는 100 내지 300 mM)을 포함한다. 일부 실시 형태에서, 적합한 조건은 0.1 내지 100 mM Mn2+ 이온 또는 그의 염, 예컨대 MnCl2(예를 들어, 0.1 내지 100 mM, 0.1 내지 50 mM, 0.1 내지 20 mM, 0.1 내지 10 mM, 0.1 내지 5 mM, 0.1 내지 2 mM, 0.5 내지 50 mM, 0.5 내지 20 mM, 0.5 내지 15 mM, 0.5 내지 5 mM, 0.5 내지 2 mM, 또는 0.1 내지 10 mM)를 포함한다. 일부 실시 형태에서, 적합한 조건은 디티오트레이톨(DTT)(예를 들어, 1 내지 1000 μM, 1 내지 500 μM, 1 내지 200 μM, 50 내지 500 μM, 100 내지 500 μM, 100 내지 300 μM, 0.1 내지 100 mM, 0.1 내지 50 mM, 0.1 내지 20 mM, 0.1 내지 10 mM, 0.1 내지 5 mM, 0.1 내지 2 mM, 0.5 내지 50 mM, 0.5 내지 20 mM, 0.5 내지 15 mM, 0.5 내지 5 mM, 0.5 내지 2 mM, 또는 0.1 내지 10 mM)을 포함한다. 일부 실시 형태에서, 적합한 조건은 0.1 mM 내지 100 mM 리보뉴클레오시드 트리포스페이트(NTP)(예를 들어, 0.1 내지 100 mM, 0.1 내지 50 mM, 0.1 내지 10 mM, 1 내지 100 mM, 1 내지 50 mM, 또는 1 내지 10 mM)를 포함한다. 일부 실시 형태에서, 적합한 조건은 4 내지 10의 pH(예를 들어, 5 내지 9의 pH, 6 내지 9의 pH, 또는 6.5 내지 8.5의 pH)를 포함한다. 일부 실시 형태에서, 적합한 조건은 4℃ 내지 50℃의 온도(예를 들어, 10℃ 내지 40℃, 15℃ 내지 40℃, 20℃ 내지 40℃, 또는 30℃ 내지 40℃)를 포함한다.Suitable conditions for in vitro transcription and or self-splicing may include any conditions (e.g., solutions or buffers, such as aqueous buffers or solutions) that mimic physiological conditions in one or more respects. In some embodiments, suitable conditions include 0.1 to 100 mM Mg2+ ion or a salt thereof (e.g., 1 to 100 mM, 1 to 50 mM, 1 to 20 mM, 5 to 50 mM, 5 to 20 mM, or 5 to 15mM). In some embodiments, suitable conditions include 1 to 1000mM K+ ions or salts thereof, such as KCl (e.g., 1 to 1000mM, 1 to 500mM, 1 to 200mM, 50 to 500mM, 100 to 500mM, or 100 to 300 mM). In some embodiments, suitable conditions include 1 to 1000 mM Cl- ion or a salt thereof, such as KCl (e.g., 1 to 1000 mM, 1 to 500 mM, 1 to 200 mM, 50 to 500 mM, 100 to 500 mM , or 100 to 300 mM). In some embodiments, suitable conditions include 0.1 to 100 mM Mn2+ ions or salts thereof, such as MnCl2 (e.g., 0.1 to 100 mM, 0.1 to 50 mM, 0.1 to 20 mM, 0.1 to 10 mM, 0.1 to 5 mM, 0.1 to 2mM, 0.5 to 50mM, 0.5 to 20mM, 0.5 to 15mM, 0.5 to 5mM, 0.5 to 2mM, or 0.1 to 10mM). In some embodiments, suitable conditions include dithiothreitol (DTT) (e.g., 1 to 1000 μM, 1 to 500 μM, 1 to 200 μM, 50 to 500 μM, 100 to 500 μM, 100 to 300 μM, 0.1 to 100mM, 0.1 to 50mM, 0.1 to 20mM, 0.1 to 10mM, 0.1 to 5mM, 0.1 to 2mM, 0.5 to 50mM, 0.5 to 20mM, 0.5 to 15mM, 0.5 to 5mM, 0.5 to 2 mM, or 0.1 to 10 mM). In some embodiments, suitable conditions include 0.1 to 100 mM ribonucleoside triphosphate (NTP) (e.g., 0.1 to 100 mM, 0.1 to 50 mM, 0.1 to 10 mM, 1 to 100 mM, 1 to 50 mM, or 1 to 10 mM). In some embodiments, suitable conditions include a pH of 4 to 10 (eg, a pH of 5 to 9, a pH of 6 to 9, or a pH of 6.5 to 8.5). In some embodiments, suitable conditions include temperatures of 4°C to 50°C (e.g., 10°C to 40°C, 15°C to 40°C, 20°C to 40°C, or 30°C to 40°C).
일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 데옥시리보핵산, 예를 들어, 본원에 기재된 데옥시리보핵산, 예컨대 DNA 벡터, 선형화 DNA 벡터, 또는 cDNA로부터 생성된다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 무세포 시스템에서의 전사(예를 들어, 시험관내 전사)에 의해 데옥시리보핵산으로부터 전사된다.In some embodiments, the linear polyribonucleotide is produced from a deoxyribonucleic acid, e.g., a deoxyribonucleic acid described herein, such as a DNA vector, linearized DNA vector, or cDNA. In some embodiments, the linear polyribonucleotide is transcribed from deoxyribonucleic acid by transcription in a cell-free system (e.g., in vitro transcription).
세포에서의 생성 방법How are they produced in cells?
본 개시내용은 또한 세포, 예를 들어, 원핵 세포 또는 진핵 세포에서 원형 RNA를 생성하는 방법을 제공한다. 일부 실시 형태에서, 외인성 폴리리보뉴클레오티드는 세포에 제공된다(예를 들어, 본원에 기재된 선형 폴리리보뉴클레오티드 또는 여기에 기재된 선형 폴리리보뉴클레오티드의 전사를 인코딩하는 DNA 분자). 선형 폴리리보뉴클레오티드는 세포에서 세포에 제공된 외인성 DNA 분자로부터 전사될 수 있다. 선형 폴리리보뉴클레오티드는 세포에서 세포에 일시적으로 제공된 외인성 재조합 DNA 분자로부터 전사될 수 있다. 일부 실시 형태에서, 외인성 DNA 분자는 세포의 게놈 내로 통합되지 않는다. 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 세포에서 세포의 게놈 내로 혼입된 재조합 DNA 분자로부터 전사된다.The present disclosure also provides methods for producing circular RNA in a cell, e.g., a prokaryotic cell or a eukaryotic cell. In some embodiments, an exogenous polyribonucleotide is provided to the cell (e.g., a DNA molecule encoding a linear polyribonucleotide described herein or a transcription of a linear polyribonucleotide described herein). Linear polyribonucleotides can be transcribed in cells from exogenous DNA molecules presented to the cell. Linear polyribonucleotides can be transcribed in cells from exogenous recombinant DNA molecules transiently provided to the cell. In some embodiments, the exogenous DNA molecule is not integrated into the cell's genome. In some embodiments, the linear polyribonucleotide is transcribed in a cell from a recombinant DNA molecule incorporated into the genome of the cell.
일부 실시 형태에서, 세포는 원핵 세포이다. 일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드를 포함하는 원핵 세포는 박테리아 세포 또는 고세균 세포일 수 있다. 예를 들어, 본원에 기재된 폴리리보뉴클레오티드를 포함하는 원핵 세포는 이 콜라이(E coli), 호염성 고세균(예를 들어, 할로페락스 볼카니이(Haloferax volcaniii)), 스핑고모나스(Sphingomonas), 시아노박테리아(예를 들어, 시네코코쿠스 엘론가투스(Synechococcus elongatus), 스피룰리나(Spirulina)(아르트로스피라(Arthrospira)) 종, 및 시네코시스티스(Synechocystis) 종), 스트렙토미세스(Streptomyces), 악티노미세테스(예를 들어, 노노무라에아(Nonomuraea), 키타사토스포라(Kitasatospora), 또는 써모비피다(Thermobifida)), 바실루스(Bacillus) 종(예를 들어, 바실루스 서브틸리스(Bacillus subtilis), 바실루스 안트라시스(Bacillus anthracis), 바실루스 세레우스(Bacillus cereus)), 베타프로테오박테리아(예를 들어, 부르크홀데리아(Burkholderia)), 알파프로테오박테리아(예를 들어, 아그로박테리움(Agrobacterium)), 슈도모나스(Pseudomonas)(예를 들어, 슈도모나스 푸티다(Pseudomonas putida)), 및 엔테로박테리아일 수 있다. 원핵 세포는 배양 배지에서 성장될 수 있다. 원핵 세포는 생물반응기에 함유될 수 있다.In some embodiments, the cell is a prokaryotic cell. In some embodiments, the prokaryotic cell comprising the polyribonucleotides described herein may be a bacterial cell or an archaeal cell. For example, prokaryotic cells comprising the polyribonucleotides described herein include E coli, halophilic archaea (e.g., Haloferax volcaniii), Sphingomonas, and Sia. Nobacteria (e.g., Synechococcus elongatus, Spirulina (Arthrospira) species, and Synechocystis species), Streptomyces, Actinomycetes tes (e.g., Nonomuraea, Kitasatospora, or Thermobifida), Bacillus species (e.g., Bacillus subtilis, Bacillus Bacillus anthracis, Bacillus cereus), Betaproteobacteria (e.g. Burkholderia), Alphaproteobacteria (e.g. Agrobacterium), Pseudomonas (e.g., Pseudomonas putida), and Enterobacteria. Prokaryotic cells can be grown in culture medium. Prokaryotic cells may be contained in a bioreactor.
일부 실시 형태에서, 세포는 진핵 세포이다. 일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드를 포함하는 진핵 세포는 단세포 진핵 세포이다. 일부 실시 형태에서, 단세포 진핵은 단세포 진균 세포, 예컨대 효모 세포(예를 들어, 사카로미세스 세레비지아에(Saccharomyces cerevisiae) 및 다른 사카로미세스(Saccharomyces) 종, 브레타노미세스(Brettanomyces) 종, 쉬조사카로미세스(Schizosaccharomyces) 종, 토룰라스포라(Torulaspora) 종, 및 피키아(Pichia) 종)이다. 일부 실시 형태에서, 단세포 진핵 세포는 단세포 동물 세포이다. 단세포 동물 세포는 다세포 동물로부터 단리되고 배양에서 성장된 세포, 또는 그의 딸 세포일 수 있다. 일부 실시 형태에서, 단세포 동물 세포는 탈분화될 수 있다. 일부 실시 형태에서, 단세포 진핵 세포는 단세포 식물 세포이다. 단세포 식물 세포는 다세포 식물로부터 단리되고 배양에서 성장된 세포, 또는 그의 딸 세포일 수 있다. 일부 실시 형태에서, 단세포 식물 세포는 탈분화될 수 있다. 일부 실시 형태에서, 단세포 식물 세포는 식물 캘러스로부터의 것이다. 실시 형태에서, 단세포 세포는 식물 세포 원형질체이다. 일부 실시 형태에서, 단세포 진핵 세포는 단세포 진핵 조류 세포, 예컨대 단세포 녹조류, 규조류, 유글레나과, 또는 편모조류이다. 관심 단세포 진핵 조류의 비제한적인 예는 두날리엘라 살리나(Dunaliella salina), 클로렐라 불가리스(Chlorella vulgaris), 클로렐라 조핀기엔시스(Chlorella zofingiensis), 해마토코쿠스 플루비알리스(Haematococcus pluvialis), 네오클로리스 올레오아분단스(Neochloris oleoabundans) 및 다른 네오클로리스(Neochloris) 종, 프로토시폰 보트리오이데스(Protosiphon botryoides), 보트리오코쿠스 브라우니이(Botryococcus braunii), 크립토코쿠스(Cryptococcus) 종, 클라미도모나스 레인하르드티이(Chlamydomonas reinhardtii) 및 다른 클라미도모나스(Chlamydomonas) 종을 포함한다. 일부 실시 형태에서, 단세포 진핵 세포는 원생생물 세포이다. 일부 실시 형태에서, 단세포 진핵 세포는 원충 세포이다.In some embodiments, the cell is a eukaryotic cell. In some embodiments, the eukaryotic cell comprising the polyribonucleotide described herein is a unicellular eukaryotic cell. In some embodiments, the single-celled eukaryote is a single-celled fungal cell, such as a yeast cell (e.g., Saccharomyces cerevisiae and other Saccharomyces species, Brettanomyces species, Sh Schizosaccharomyces species, Torulaspora species, and Pichia species). In some embodiments, the single-celled eukaryotic cell is a single-celled animal cell. Unicellular animal cells can be cells isolated from multicellular animals and grown in culture, or daughter cells thereof. In some embodiments, unicellular animal cells can be dedifferentiated. In some embodiments, the single-celled eukaryotic cell is a single-celled plant cell. Unicellular plant cells can be cells isolated from multicellular plants and grown in culture, or daughter cells thereof. In some embodiments, single-celled plant cells can be dedifferentiated. In some embodiments, the unicellular plant cells are from plant callus. In an embodiment, the unicellular cell is a plant cell protoplast. In some embodiments, the single-celled eukaryotic cell is a single-celled eukaryotic algae cell, such as a single-celled green algae, diatom, euglenaceae, or flagellate algae. Non-limiting examples of unicellular eukaryotic algae of interest include Dunaliella salina, Chlorella vulgaris, Chlorella zofingiensis, Haematococcus pluvialis, Neochloris oleoa Neochloris oleoabundans and other Neochloris species, Protosiphon botryoides, Botryococcus braunii, Cryptococcus species, Chlamydomonas reinhardtii ( Chlamydomonas reinhardtii) and other Chlamydomonas species. In some embodiments, the single-celled eukaryotic cell is a protist cell. In some embodiments, the single-celled eukaryotic cell is a protozoal cell.
일부 실시 형태에서, 진핵 세포는 다세포 진핵생물의 세포이다. 예를 들어, 다세포 진핵생물은 척추 동물, 무척추 동물, 다세포 진균, 다세포 조류, 및 다세포 식물로 이루어진 군으로부터 선택될 수 있다. 일부 실시 형태에서, 진핵 유기체는 인간이다. 일부 실시 형태에서, 진핵 유기체는 비-인간 척추 동물이다. 일부 실시 형태에서, 진핵 유기체는 무척추 동물이다. 일부 실시 형태에서, 진핵 유기체는 다세포 진균이다. 일부 실시 형태에서, 진핵 유기체는 다세포 식물이다. 실시 형태에서, 진핵 세포는 인간의 세포, 또는 비-인간 포유류, 예컨대 비-인간 영장류(예를 들어, 원숭이, 유인원), 유제류(예를 들어, 소, 버팔로, 비손, 양, 염소, 및 사향 소를 포함하는 소과; 돼지; 낙타, 라마, 및 알파카를 포함하는 낙타과; 사슴, 영양; 및 말 및 당나귀를 포함하는 말과), 육식동물(예를 들어, 개, 고양이), 설치류(예를 들어, 래트, 마우스, 기니아 피그, 햄스터, 다람쥐), 또는 토끼목(예를 들어, 토끼, 헤어)의 세포이다. 실시 형태에서, 진핵 세포는 조류, 예컨대 조류 분류군 순계목(예를 들어, 닭, 칠면조, 꿩, 메추라기), 기러기목(예를 들어, 오리, 거위), 고관목(예를 들어, 타조, 에뮤), 비둘기목(예를 들어, 피존, 도브), 또는 앵무새목(예를 들어, 앵무새)의 구성원의 세포이다. 실시 형태에서, 진핵 세포는 절지동물(예를 들어, 곤충류, 거미류, 갑각류), 선충, 환형동물, 연충, 또는 연체동물의 세포이다. 실시 형태에서, 진핵 세포는 다세포 식물, 예컨대 피자 식물(쌍자엽 또는 단자엽일 수 있음) 또는 나자 식물(예를 들어, 침엽수, 소철류, 마황문, 은행나무), 양치식물, 쇠뜨기, 석송, 또는 선태식물의 세포이다. 실시 형태에서, 진핵 세포는 진핵 다세포 조류의 세포이다.In some embodiments, the eukaryotic cell is a cell of a multicellular eukaryote. For example, multicellular eukaryotes can be selected from the group consisting of vertebrates, invertebrates, multicellular fungi, multicellular algae, and multicellular plants. In some embodiments, the eukaryotic organism is a human. In some embodiments, the eukaryotic organism is a non-human vertebrate. In some embodiments, the eukaryotic organism is an invertebrate. In some embodiments, the eukaryotic organism is a multicellular fungus. In some embodiments, the eukaryotic organism is a multicellular plant. In an embodiment, the eukaryotic cell is a human cell, or a non-human mammal, such as a non-human primate (e.g., monkey, ape), ungulate (e.g., cow, buffalo, bison, sheep, goat, and civet) bovine, including cattle; camelids, including camels, llamas, and alpacas; equines, including horses and donkeys; carnivores (e.g., dogs, cats); (e.g., rat, mouse, guinea pig, hamster, squirrel), or lagomorpha (e.g., rabbit, hare). In an embodiment, the eukaryotic cell is a member of a bird, such as an avian taxon, Order Order (e.g., chicken, turkey, pheasant, quail), Order Order (e.g., duck, goose), or Archaea (e.g., ostrich, emu). ), a cell of a member of the order Columbine (e.g., pigeon, dove), or Parrot order (e.g., parrot). In an embodiment, the eukaryotic cell is a cell of an arthropod (e.g., insect, arachnid, crustacean), nematode, annelid, helminth, or mollusk. In an embodiment, the eukaryotic cell is a multicellular plant, such as an angiosperm (which may be dicot or monocot) or a germinal plant (e.g., conifer, cycad, ephedra, ginkgo), fern, horsetail, lycophyte, or bryophyte. It is a cell of In an embodiment, the eukaryotic cell is a cell of eukaryotic multicellular algae.
진핵 세포는 배양 배지에서 성장될 수 있다. 진핵 세포는 생물반응기에 함유될 수 있다.Eukaryotic cells can be grown in culture media. Eukaryotic cells may be contained in a bioreactor.
정제 방법Purification method
하나 이상의 정제 단계는 본원에 기재된 방법에 포함될 수 있다. 예를 들어, 일부 실시 형태에서, 선형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드를 자기-스플라이싱하기 전에 실질적으로 풍부화되거나 순수하다(예를 들어, 정제된다). 다른 실시 형태에서, 선형 폴리리보뉴클레오티드는 선형 폴리리보뉴클레오티드를 자기-스플라이싱하기 전에 정제되지 않는다. 일부 실시 형태에서, 생성된 원형 RNA는 정제된다.One or more purification steps may be included in the methods described herein. For example, in some embodiments, the linear polyribonucleotide is substantially enriched or pure (e.g., purified) prior to self-splicing the linear polyribonucleotide. In another embodiment, the linear polyribonucleotide is not purified prior to self-splicing the linear polyribonucleotide. In some embodiments, the resulting circular RNA is purified.
정제는 원하는 반응 생성물을 하나 이상의 원하지 않는 구성성분, 예컨대 임의의 비반응된 출발 물질, 부산물, 효소, 또는 다른 반응 구성성분으로부터 분리하거나 풍부화하는 것을 포함할 수 있다. 예를 들어, 무세포 시스템에서의 전사(예를 들어, 시험관내 전사) 후의 선형 폴리리보뉴클레오티드의 정제는 선형 폴리리보뉴클레오티드를 자기-스플라이싱하기 전에 DNA 주형으로부터의 분리 또는 풍부화를 포함할 수 있다. 스플라이싱 후의 원형 RNA 생성물의 정제는 원형 RNA를 그의 상응하는 선형 RNA로부터 분리하거나 풍부화하는 데 사용될 수 있다. RNA의 정제 방법은 당업자에게 알려져 있으며, 효소적 정제 또는 크로마토그래피에 의한 정제를 포함한다.Purification may include separating or enriching the desired reaction product from one or more unwanted constituents, such as any unreacted starting materials, by-products, enzymes, or other reaction constituents. For example, purification of linear polyribonucleotides following transcription in a cell-free system (e.g., in vitro transcription) may include separation or enrichment of the linear polyribonucleotides from the DNA template prior to self-splicing. there is. Purification of the circular RNA product after splicing can be used to separate or enrich the circular RNA from its corresponding linear RNA. Methods for purifying RNA are known to those skilled in the art and include enzymatic purification or purification by chromatography.
일부 실시 형태에서, 정제 방법은 50% 미만(예를 들어, 40%, 30%, 20%, 10%, 5%, 4%, 3%, 2%, 또는 1% 미만)의 선형 폴리리보뉴클레오티드를 갖는 원형 폴리리보뉴클레오티드를 발생시킨다.In some embodiments, the purification method purifies less than 50% (e.g., less than 40%, 30%, 20%, 10%, 5%, 4%, 3%, 2%, or 1%) of linear polyribonucleotides. Generates a circular polyribonucleotide with
생물반응기bioreactor
일부 실시 형태에서, 본원에 기재된 원형 폴리리보뉴클레오티드를 생성하는 임의의 방법은 생물반응기에서 수행될 수 있다. 생물반응기는 유기체 또는 이러한 유기체로부터 유래된 생화학적으로 활성인 물질을 수반하는 화학적 또는 생물학적 과정이 수행되는 임의의 용기를 지칭한다. 생물반응기는 본원에 기재된 원형 RNA의 생성을 위한 무세포 방법과 혼화성일 수 있다. 생물반응기를 위한 용기는 단일 사용(일회용), 오토클레이브 가능할, 또는 멸균 가능할 수 있는 배양 플라스크, 디쉬, 또는 백을 포함할 수 있다. 생물반응기는 유리로 제조될 수 있거나, 이는 중합체-기반일 수 있거나, 이는 다른 물질로 제조될 수 있다.In some embodiments, any of the methods for producing circular polyribonucleotides described herein can be performed in a bioreactor. A bioreactor refers to any vessel in which a chemical or biological process involving organisms or biochemically active substances derived from such organisms is performed. The bioreactor may be compatible with the cell-free methods for production of circular RNA described herein. Containers for bioreactors may include culture flasks, dishes, or bags, which may be single-use (disposable), autoclavable, or sterilizable. The bioreactor may be made of glass, it may be polymer-based, or it may be made of other materials.
생물반응기의 예는 제한 없이, 교반 탱크(예를 들어, 잘 혼합된) 생물반응기 및 관상(예를 들어, 플러그 유동) 생물반응기, 에어리프트 생물반응기, 막 교반 탱크, 스핀 필터 교반 탱크, 진동혼합기, 유동층 반응기, 및 막 생물반응기를 포함한다. 생물반응기를 작동하는 방식은 회분식 또는 연속식 과정일 수 있다. 생물반응기는 시약 및 생성물 스트림이 연속적으로 공급되고 있고 시스템으로부터 빼내어지는 경우 연속적이다. 회분식 생물반응기는 연속적 재순환 유동을 가질 수 있지만, 시약 또는 생성물 수확물의 연속적 공급은 갖지 않을 수 있다.Examples of bioreactors include, without limitation, stirred tank (e.g., well-mixed) bioreactors and tubular (e.g., plug flow) bioreactors, airlift bioreactors, membrane stirred tanks, spin filter stirred tanks, and vibratory mixers. , fluidized bed reactors, and membrane bioreactors. The mode of operation of the bioreactor can be a batch or continuous process. A bioreactor is continuous when reagent and product streams are continuously supplied and withdrawn from the system. Batch bioreactors may have a continuous recirculating flow, but may not have a continuous supply of reagents or product harvest.
본 개시내용의 일부 방법은 원형 폴리리보뉴클레오티드의 대규모 생성에 관한 것이다. 대규모 생성 방법을 위해, 방법은 1 리터(L) 내지 50 L, 또는 그 초과(예를 들어, 5 L, 10 L, 15 L, 20 L, 25 L, 30 L, 35 L, 40 L, 45 L, 50 L, 또는 그 초과)의 부피에서 수행될 수 있다. 일부 실시 형태에서, 방법은 5 L 내지 10 L, 5 L 내지 15 L, 5 L 내지 20 L, 5 L 내지 25 L, 5 L 내지 30 L, 5 L 내지 35 L, 5 L 내지 40 L, 5 L 내지 45 L, 10 L 내지 15 L, 10 L 내지 20 L, 10 L 내지 25 L, 20 L 내지 30 L, 10 L 내지 35 L, 10 L 내지 40 L, 10 L 내지 45 L, 10 L 내지 50 L, 15 L 내지 20 L, 15 L 내지 25 L, 15 L 내지 30 L, 15 L 내지 35 L, 15 L 내지 40 L, 15 L 내지 45 L, 또는 15 내지 50 L의 부피에서 수행될 수 있다.Some methods of the present disclosure relate to large-scale production of circular polyribonucleotides. For large-scale production methods, the method can be used to produce volumes ranging from 1 liter (L) to 50 L, or more (e.g., 5 L, 10 L, 15 L, 20 L, 25 L, 30 L, 35 L, 40 L, 45 L). L, 50 L, or more). In some embodiments, the method comprises a L to 45 L, 10 L to 15 L, 10 L to 20 L, 10 L to 25 L, 20 L to 30 L, 10 L to 35 L, 10 L to 40 L, 10 L to 45 L, 10 L to Can be performed in volumes of 50 L, 15 L to 20 L, 15 L to 25 L, 15 L to 30 L, 15 L to 35 L, 15 L to 40 L, 15 L to 45 L, or 15 to 50 L there is.
일부 실시 형태에서, 생물반응기는 적어도 1 g의 원형 RNA를 생성할 수 있다. 일부 실시 형태에서, 생물반응기는 1 내지 200 g의 원형 RNA(예를 들어, 1 내지 10 g, 1 내지 20 g, 1 내지 50 g, 10 내지 50 g, 10 내지 100 g, 50 내지 100 g, 50 내지 200 g의 원형 RNA)를 생성할 수 있다. 일부 실시 형태에서, 생성되는 양은 리터당(예를 들어, 리터당 1 내지 200 g), 회분 또는 반응당(예를 들어, 회분 또는 반응당 1 내지 200 g), 또는 단위 시간당(예를 들어, 시간당 또는 일당 1 내지 200 g) 측정된다.In some embodiments, the bioreactor is capable of producing at least 1 g of circular RNA. In some embodiments, the bioreactor is capable of producing 1 to 200 g of circular RNA (e.g., 1 to 10 g, 1 to 20 g, 1 to 50 g, 10 to 50 g, 10 to 100 g, 50 to 100 g, 50 to 200 g of circular RNA) can be produced. In some embodiments, the amount produced is per liter (e.g., 1 to 200 g per liter), per batch or reaction (e.g., 1 to 200 g per batch or reaction), or per unit time (e.g., per hour or 1 to 200 g per day) is measured.
일부 실시 형태에서, 생성 용량을 증가시키기 위해 하나 초과의 생물반응기가 일련으로 이용될 수 있다(예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 또는 9개의 생물반응기가 일련으로 사용될 수 있다).In some embodiments, more than one bioreactor may be used in series (e.g., 1, 2, 3, 4, 5, 6, 7, 8, or 9 bioreactors) to increase production capacity. can be used in series).
사용 방법How to use
일부 실시 형태에서, 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리리보뉴클레오티드는 바이러스 감염(예를 들어, HIV, SARS-CoV-2, HCV, 인플루엔자 또는 RSV)을 치료하거나 예방하는 데 사용된다.In some embodiments, circular polyribonucleotides encoding antifusogenic polypeptides (e.g., polypeptides in Table 1) are used to treat viral infections (e.g., HIV, SARS-CoV-2, HCV, influenza, or RSV). It is used for or to prevent.
일부 실시 형태에서, 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리뉴클레오티드는 바이러스 진입을 감소시키는 데 사용된다.In some embodiments, a circular polynucleotide encoding an antiviral polypeptide (e.g., a polypeptide of Table 1) is used to reduce viral entry.
일부 실시 형태에서, 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리뉴클레오티드는 바이러스 감염(예를 들어, HIV, SARS-CoV-2, HCV, 인플루엔자 또는 RSV)의 위험을 감소시키기 위해 대상체에게 투여될 수 있다.In some embodiments, circular polynucleotides encoding antifusogenic polypeptides (e.g., polypeptides in Table 1) are used to reduce the risk of viral infection (e.g., HIV, SARS-CoV-2, HCV, influenza, or RSV). It can be administered to a subject to reduce
예를 들어, 본원에 기재된 바와 같은 원형 폴리리보뉴클레오티드는 대상체에게 (예를 들어, 약제학적 조성물로) 투여될 수 있다. 일부 실시 형태에서, 대상체는 척추 동물(예를 들어, 포유류, 조류, 어류, 파충류, 또는 양서류)이다. 일부 실시 형태에서, 대상체는 인간이다. 일부 실시 형태에서, 대상체는 비-인간 포유류다. 실시 형태에서, 대상체는 비-인간 포유류, 예컨대 비-인간 영장류(예를 들어, 원숭이, 유인원), 유제류(예를 들어, 소, 버팔로, 양, 염소, 돼지, 낙타, 라마, 알파카, 사슴, 말, 당나귀), 육식동물(예를 들어, 개, 고양이), 설치류(예를 들어, 래트, 마우스), 또는 토끼목(예를 들어, 토끼)이다. 실시 형태에서, 대상체는 조류, 예컨대 조류 분류군 순계목(예를 들어, 닭, 칠면조, 꿩, 메추라기), 기러기목(예를 들어, 오리, 거위), 고관목(예를 들어, 타조, 에뮤), 비둘기목(예를 들어, 피존, 도브), 또는 앵무새목(예를 들어, 앵무새)의 구성원이다. 실시 형태에서, 대상체는 무척추동물, 예컨대 절지동물(예를 들어, 곤충류, 거미류, 갑각류), 선충, 환형동물, 연충, 또는 연체동물이다.For example, circular polyribonucleotides as described herein can be administered to a subject (e.g., in a pharmaceutical composition). In some embodiments, the subject is a vertebrate (e.g., a mammal, bird, fish, reptile, or amphibian). In some embodiments, the subject is a human. In some embodiments, the subject is a non-human mammal. In an embodiment, the subject is a non-human mammal, such as a non-human primate (e.g., monkey, ape), ungulate (e.g., cow, buffalo, sheep, goat, pig, camel, llama, alpaca, deer, horses, donkeys), carnivores (e.g., dogs, cats), rodents (e.g., rats, mice), or lagomorphs (e.g., rabbits). In an embodiment, the subject is a bird, such as from the avian taxa Order Order (e.g., chickens, turkeys, pheasants, quail), Orchids (e.g., ducks, geese), Archaea (e.g., ostriches, emus). , a member of the order Columbine (e.g., pigeon, dove), or the order Parrot (e.g., parrot). In an embodiment, the subject is an invertebrate, such as an arthropod (e.g., insect, arachnid, crustacean), nematode, annelid, helminth, or mollusk.
일부 실시 형태에서, 본 개시내용은 본원에 기재된 조성물 또는 제형을 대상체에게 제공함으로써 대상체를 변형시키는 방법을 제공한다. 일부 실시 형태에서, 조성물 또는 제형은 핵산 분자(예를 들어, 본원에 기재된 DNA 분자 또는 RNA 분자)이거나 이를 포함하고, 폴리뉴클레오티드는 진핵 대상체에게 제공된다. 일부 실시 형태에서, 조성물 또는 제형은 본원에 기재된 핵산을 포함하는 진핵 또는 원핵 세포이거나 이를 포함한다.In some embodiments, the present disclosure provides a method of modifying a subject by providing the subject with a composition or formulation described herein. In some embodiments, the composition or formulation is or includes a nucleic acid molecule (e.g., a DNA molecule or an RNA molecule described herein), and the polynucleotide is provided to a eukaryotic subject. In some embodiments, the composition or formulation is or comprises a eukaryotic or prokaryotic cell comprising a nucleic acid described herein.
일부 실시 형태에서, 본 개시내용은 본원에 기재된 조성물 또는 제형을 대상체에게 제공함으로써 이를 필요로 하는 대상체에서 바이러스 감염을 치료하는 방법을 제공한다. 일부 실시 형태에서, 조성물 또는 제형은 핵산 분자(예를 들어, 본원에 기재된 DNA 분자 또는 RNA 분자)이거나 이를 포함하고, 폴리뉴클레오티드는 진핵 대상체에게 제공된다. 일부 실시 형태에서, 조성물 또는 제형은 본원에 기재된 핵산을 포함하는 진핵 또는 원핵 세포이거나 이를 포함한다. 일부 실시 형태에서, 폴리리보뉴클레오티드는 예를 들어, 바이러스 감염의 치료를 필요로 하는 대상체에서 바이러스 감염을 치료하기에 충분한 양으로 및 충분한 기간 동안 제공된다.In some embodiments, the present disclosure provides a method of treating a viral infection in a subject in need thereof by providing the subject with a composition or formulation described herein. In some embodiments, the composition or formulation is or includes a nucleic acid molecule (e.g., a DNA molecule or an RNA molecule described herein), and the polynucleotide is provided to a eukaryotic subject. In some embodiments, the composition or formulation is or comprises a eukaryotic or prokaryotic cell comprising a nucleic acid described herein. In some embodiments, the polyribonucleotide is provided in an amount and for a sufficient period of time to treat a viral infection, e.g., in a subject in need thereof.
일부 실시 형태에서, 방법은 HIV를 치료하거나 예방하는 데 사용될 수 있다. 예를 들어, 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 HIV를 표적으로 하는 항푸소제닉 폴리펩티드를 인코딩하고, 조성물은 HIV를 치료하거나 예방하는 데 사용될 수 있다.In some embodiments, the methods can be used to treat or prevent HIV. For example, in some embodiments, the circular polyribonucleotide encodes an antifusogenic polypeptide that targets HIV, and the composition can be used to treat or prevent HIV.
일부 실시 형태에서, 방법은 SARS-CoV-2를 치료하거나 예방하는 데 사용될 수 있다. 예를 들어, 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 SARS-CoV-2를 표적으로 하는 항푸소제닉 폴리펩티드를 인코딩하고, 조성물은 SARS-CoV-2를 치료하거나 예방하는 데 사용될 수 있다.In some embodiments, the methods may be used to treat or prevent SARS-CoV-2. For example, in some embodiments, the circular polyribonucleotide encodes an antifusogenic polypeptide that targets SARS-CoV-2, and the composition can be used to treat or prevent SARS-CoV-2.
일부 실시 형태에서, 방법은 HCV를 치료하거나 예방하는 데 사용될 수 있다. 예를 들어, 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 HCV를 표적으로 하는 항푸소제닉 폴리펩티드를 인코딩하고, 조성물은 HCV를 치료하거나 예방하는 데 사용될 수 있다.In some embodiments, the methods can be used to treat or prevent HCV. For example, in some embodiments, the circular polyribonucleotide encodes an antifusogenic polypeptide that targets HCV, and the composition can be used to treat or prevent HCV.
일부 실시 형태에서, 방법은 RSV를 치료하거나 예방하는 데 사용될 수 있다. 예를 들어, 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 RSV를 표적으로 하는 항푸소제닉 폴리펩티드를 인코딩하고, 조성물은 RSV를 치료하거나 예방하는 데 사용될 수 있다.In some embodiments, the methods can be used to treat or prevent RSV. For example, in some embodiments, the circular polyribonucleotide encodes an antifusogenic polypeptide that targets RSV, and the composition can be used to treat or prevent RSV.
투여 방법Method of administration
세포에 적어도 2회 용량 또는 조성물의 원형 폴리리보뉴클레오티드를 제공한 후에 세포에서 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리리보뉴클레오티드의 수준을 생성하거나 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)의 수준을 발현하기 위한 투여 방법이 본원에 개시된다. 대상체에게 적어도 2회 용량 또는 조성물의 원형 폴리리보뉴클레오티드를 제공(예를 들어, 투여)한 후에 대상체(예를 들어, 포유류, 예를 들어, 인간)에서 원형 폴리리보뉴클레오티드의 수준을 생성하거나 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드, 예를 들어, 표 2 내지 4 중 어느 하나의 폴리펩티드)의 수준을 발현하기 위한 투여 방법이 본원에 개시된다. 조성물은 본원에 기재된 바와 같은 항푸소제닉 폴리펩티드를 인코딩하는 원형 폴리리보뉴클레오티드를 포함한다. 투여 방법은 예를 들어, 단기간에 걸쳐 또는 연장된 기간에 걸쳐 2회 이상 용량의 원형 폴리리보뉴클레오티드의 조성물을 투여하는 것을 포함할 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드를 함유하는 조성물은 약제학적으로 허용되는 담체 또는 부형제를 추가로 포함한다. 원형 폴리리보뉴클레오티드는 예를 들어, 투여 후 세포에서 발현될 수 있는 항푸소제닉 폴리펩티드를 인코딩한다.After providing the cells with at least two doses or compositions of circular polyribonucleotides, the cells produce levels of circular polyribonucleotides encoding an antifusogenic polypeptide (e.g., a polypeptide in Table 1) or an antifusogenic polypeptide ( Disclosed herein are methods of administration for expressing levels of polypeptides (e.g., polypeptides in Table 1). Producing levels of circular polyribonucleotides in a subject (e.g., a mammal, e.g., a human) after providing (e.g., administering) a circular polyribonucleotide of at least two doses or compositions to the subject or antifuso Disclosed herein are methods of administration for expressing levels of a genic polypeptide (e.g., a polypeptide of Table 1, e.g., a polypeptide of any of Tables 2-4). The composition comprises a circular polyribonucleotide encoding an antifusogenic polypeptide as described herein. Methods of administration may include, for example, administering two or more doses of the composition of circular polyribonucleotides over a short period of time or over an extended period of time. In some embodiments, compositions containing circular polyribonucleotides further include a pharmaceutically acceptable carrier or excipient. Circular polyribonucleotides encode, for example, antifusogenic polypeptides that can be expressed in cells after administration.
본원에 기재된 방법은 대상체에서의 항푸소제닉 폴리펩티드의 적어도 500 ng/mL(예를 들어, 적어도 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, 또는 그 초과)의 혈청 농도를 생성하기에 충분한 양으로 약제학적 조성물의 제1 용량을 투여하는 것을 포함할 수 있다.The methods described herein can be used to obtain at least 500 ng/mL (e.g., at least 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL) of an antifusogenic polypeptide in a subject. ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, or and administering the first dose of the pharmaceutical composition in an amount sufficient to produce a serum concentration of greater than 100%.
일부 실시 형태에서, 방법은 제2 용량의 약제학적 조성물을 투여하는 것을 추가로 포함할 수 있다. 방법은 약제학적 조성물의 제3, 제4, 제5, 제6, 제7, 제8, 제9, 제10 또는 그 초과의 용량을 투여하는 것을 추가로 포함할 수 있다. 일부 실시 형태에서, 후속 용량은 대상체에서의 항푸소제닉 폴리펩티드의 적어도 500 ng/mL(예를 들어, 적어도 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, 또는 그 초과)의 혈청 농도를 유지하는 데 도움이 된다. 일부 실시 형태에서, 대상체에서의 항푸소제닉 폴리펩티드의 혈청 농도가 500 ng/mL 미만으로 떨어지기 전에 후속 용량이 투여된다.In some embodiments, the method may further include administering a second dose of the pharmaceutical composition. The method may further include administering a third, fourth, fifth, sixth, seventh, eighth, ninth, tenth or more doses of the pharmaceutical composition. In some embodiments, the subsequent dose is at least 500 ng/mL (e.g., at least 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL) of the antifusogenic polypeptide in the subject. mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL Helps maintain serum concentrations of mL (or more). In some embodiments, subsequent doses are administered before the serum concentration of antifusogenic polypeptide in the subject falls below 500 ng/mL.
일부 실시 형태에서, 세포, 조직 또는 대상체에서 조성물의 수준을 생성하거나 항푸소제닉 폴리펩티드의 수준을 발현하기 위해 다중 용량이 제공된다. 일부 실시 형태에서, 세포, 조직 또는 대상체에서 일정 기간 동안, 예를 들어, 적어도 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150일, 또는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 18, 21, 또는 24개월, 또는 적어도 1, 2, 3, 4, 또는 5년 동안 조성물의 수준을 생성 또는 유지하거나, 항푸소제닉 폴리펩티드의 수준을 생성 또는 유지하기 위해 다중 용량이 제공된다.In some embodiments, multiple doses are provided to produce levels of the composition or express levels of the antifusogenic polypeptide in a cell, tissue or subject. In some embodiments, in the cell, tissue or subject for a period of time, e.g., at least 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150 days, or at least 1, 2, 3 , creates or maintains a level of the composition for 4, 5, 6, 7, 8, 9, 10, 12, 15, 18, 21, or 24 months, or at least 1, 2, 3, 4, or 5 years, or Multiple doses are provided to produce or maintain levels of antifusogenic polypeptide.
일부 실시 형태에서, 제2 용량은 약제학적 조성물의 제1 용량을 투여한지 적어도 1시간(예를 들어, 적어도 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 1일, 2일, 3일, 4일, 5일, 6일, 1주, 2주, 3주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 1년, 또는 그 초과) 후에 투여된다.In some embodiments, the second dose is administered at least 1 hour (e.g., at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours) after administering the first dose of the pharmaceutical composition. Hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hours, 22 hours, 23 hours, 1 day, 2 days, 3 days, 4 days, 5 days, 6 days, 1 week, 2 weeks, 3 weeks, 1 month, 2 months, 3 months, 4 months, 5 months, 6 months, 7 months, 8 months, 9 months, 10 months , 11 months, 1 year, or more).
일부 실시 형태에서, 제2 용량은 약제학적 조성물의 제1 용량을 투여한지 1시간 내지 1년(예를 들어, 1시간 내지 1일, 예를 들어, 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 또는 1일, 예를 들어, 1일 내지 1주, 예를 들어, 2일, 3일, 4일, 5일, 6일, 또는 1주, 예를 들어, 1주 내지 1개월, 예를 들어, 2주, 3주, 또는 1개월, 예를 들어, 1개월 내지 1년, 예를 들어, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 또는 1년) 후에 투여된다. 일부 실시 형태에서, 제2 용량은 약제학적 조성물의 제1 용량을 투여한지 1일 내지 180일(예를 들어, 1일 내지 90일, 1일 내지 45일, 1일 내지 30일, 1일 내지 14일, 1일 내지 7일, 2일 내지 45일, 2일 내지 30일, 2일 내지 14일, 2일 내지 7일, 3일 내지 90일, 3일 내지 45일, 3일 내지 30일, 3일 내지 14일, 3일 내지 7일, 4일 내지 90일, 4일 내지 45일, 4일 내지 30일, 4일 내지 14일, 4일 내지 7일, 5일 내지 90일, 5일 내지 45일, 5일 내지 30일, 5일 내지 14일, 5일 내지 7일, 6일 내지 90일, 6일 내지 45일, 6일 내지 30일, 6일 내지 14일, 6일 내지 7일, 7일 내지 90일, 7일 내지 45일, 7일 내지 30일, 7일 내지 14일, 14일 내지 90일, 14일 내지 45일, 14일 내지 30일, 21일 내지 90일, 21일 내지 60일, 21일 내지 45일, 21일 내지 30일, 30일 내지 90일, 30일 내지 60일, 30일 내지 45일, 45일 내지 180일, 45일 내지 120일, 45일 내지 100일, 45일 내지 90일, 45일 내지 60일, 60일 내지 180일, 60일 내지 120일, 60일 내지 100일, 60일 내지 90일, 90일 내지 100일, 90일 내지 120일, 또는 90일 내지 180일) 후에 투여된다.In some embodiments, the second dose is administered 1 hour to 1 year (e.g., 1 hour to 1 day, e.g., 1 hour, 2 hours, 3 hours, 4 hours) after administering the first dose of the pharmaceutical composition. , 5 hours, 6 hours, 7 hours, 8 hours, 9 hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hour, 22 hours, 23 hours, or 1 day, such as 1 day to 1 week, such as 2 days, 3 days, 4 days, 5 days, 6 days, or 1 week, such as 1 Weeks to 1 month, such as 2 weeks, 3 weeks, or 1 month, such as 1 month to 1 year, such as 1 month, 2 months, 3 months, 4 months, 5 months, 6 months. , 7 months, 8 months, 9 months, 10 months, 11 months, or 1 year). In some embodiments, the second dose is administered 1 to 180 days (e.g., 1 to 90 days, 1 to 45 days, 1 to 30 days, 1 to 180 days) after administering the first dose of the pharmaceutical composition. 14 days, 1 to 7 days, 2 to 45 days, 2 to 30 days, 2 to 14 days, 2 to 7 days, 3 to 90 days, 3 to 45 days, 3 to 30 days , 3 to 14 days, 3 to 7 days, 4 to 90 days, 4 to 45 days, 4 to 30 days, 4 to 14 days, 4 to 7 days, 5 to 90 days, 5 45 days to 45 days, 5 to 30 days, 5 to 14 days, 5 to 7 days, 6 to 90 days, 6 to 45 days, 6 to 30 days, 6 to 14 days, 6 days to 7 days, 7 to 90 days, 7 to 45 days, 7 to 30 days, 7 to 14 days, 14 to 90 days, 14 to 45 days, 14 to 30 days, 21 to 90 days , 21 to 60 days, 21 to 45 days, 21 to 30 days, 30 to 90 days, 30 to 60 days, 30 to 45 days, 45 to 180 days, 45 to 120 days, 45 100 days to 100 days, 45 days to 90 days, 45 days to 60 days, 60 days to 180 days, 60 days to 120 days, 60 days to 100 days, 60 days to 90 days, 90 days to 100 days, 90 days to administered after 120 days, or 90 to 180 days).
일부 실시 형태에서, 제3 용량은 약제학적 조성물의 제2 용량을 투여한지 적어도 1시간(예를 들어, 적어도 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 1일, 2일, 3일, 4일, 5일, 6일, 1주, 2주, 3주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 1년, 또는 그 초과) 후에 투여된다.In some embodiments, the third dose is administered at least 1 hour (e.g., at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours) after administering the second dose of the pharmaceutical composition. Hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hours, 22 hours, 23 hours, 1 day, 2 days, 3 days, 4 days, 5 days, 6 days, 1 week, 2 weeks, 3 weeks, 1 month, 2 months, 3 months, 4 months, 5 months, 6 months, 7 months, 8 months, 9 months, 10 months , 11 months, 1 year, or more).
일부 실시 형태에서, 제3 용량은 약제학적 조성물의 제2 용량을 투여한지 1시간 내지 1년(예를 들어, 1시간 내지 1일, 예를 들어, 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 또는 1일, 예를 들어, 1일 내지 1주, 예를 들어, 2일, 3일, 4일, 5일, 6일, 또는 1주, 예를 들어, 1주 내지 1개월, 예를 들어, 2주, 3주, 또는 1개월, 예를 들어, 1개월 내지 1년, 예를 들어, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 또는 1년) 후에 투여된다. 일부 실시 형태에서, 제3 용량은 약제학적 조성물의 제2 용량을 투여한지 1일 내지 180일(예를 들어, 1일 내지 90일, 1일 내지 45일, 1일 내지 30일, 1일 내지 14일, 1일 내지 7일, 2일 내지 45일, 2일 내지 30일, 2일 내지 14일, 2일 내지 7일, 3일 내지 90일, 3일 내지 45일, 3일 내지 30일, 3일 내지 14일, 3일 내지 7일, 4일 내지 90일, 4일 내지 45일, 4일 내지 30일, 4일 내지 14일, 4일 내지 7일, 5일 내지 90일, 5일 내지 45일, 5일 내지 30일, 5일 내지 14일, 5일 내지 7일, 6일 내지 90일, 6일 내지 45일, 6일 내지 30일, 6일 내지 14일, 6일 내지 7일, 7일 내지 90일, 7일 내지 45일, 7일 내지 30일, 7일 내지 14일, 14일 내지 90일, 14일 내지 45일, 14일 내지 30일, 21일 내지 90일, 21일 내지 60일, 21일 내지 45일, 21일 내지 30일, 30일 내지 90일, 30일 내지 60일, 30일 내지 45일, 45일 내지 180일, 45일 내지 120일, 45일 내지 100일, 45일 내지 90일, 45일 내지 60일, 60일 내지 180일, 60일 내지 120일, 60일 내지 100일, 60일 내지 90일, 90일 내지 100일, 90일 내지 120일, 또는 90일 내지 180일) 후에 투여된다.In some embodiments, the third dose is administered 1 hour to 1 year (e.g., 1 hour to 1 day, e.g., 1 hour, 2 hours, 3 hours, 4 hours) after administering the second dose of the pharmaceutical composition. , 5 hours, 6 hours, 7 hours, 8 hours, 9 hours, 10 hours, 11 hours, 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hour, 22 hours, 23 hours, or 1 day, such as 1 day to 1 week, such as 2 days, 3 days, 4 days, 5 days, 6 days, or 1 week, such as 1 Weeks to 1 month, such as 2 weeks, 3 weeks, or 1 month, such as 1 month to 1 year, such as 1 month, 2 months, 3 months, 4 months, 5 months, 6 months. , 7 months, 8 months, 9 months, 10 months, 11 months, or 1 year). In some embodiments, the third dose is administered 1 to 180 days (e.g., 1 to 90 days, 1 to 45 days, 1 to 30 days, 1 to 180 days) after administering the second dose of the pharmaceutical composition. 14 days, 1 to 7 days, 2 to 45 days, 2 to 30 days, 2 to 14 days, 2 to 7 days, 3 to 90 days, 3 to 45 days, 3 to 30 days , 3 to 14 days, 3 to 7 days, 4 to 90 days, 4 to 45 days, 4 to 30 days, 4 to 14 days, 4 to 7 days, 5 to 90 days, 5 45 days to 45 days, 5 to 30 days, 5 to 14 days, 5 to 7 days, 6 to 90 days, 6 to 45 days, 6 to 30 days, 6 to 14 days, 6 days to 7 days, 7 to 90 days, 7 to 45 days, 7 to 30 days, 7 to 14 days, 14 to 90 days, 14 to 45 days, 14 to 30 days, 21 to 90 days , 21 to 60 days, 21 to 45 days, 21 to 30 days, 30 to 90 days, 30 to 60 days, 30 to 45 days, 45 to 180 days, 45 to 120 days, 45 100 days to 100 days, 45 days to 90 days, 45 days to 60 days, 60 days to 180 days, 60 days to 120 days, 60 days to 100 days, 60 days to 90 days, 90 days to 100 days, 90 days to administered after 120 days, or 90 to 180 days).
일부 실시 형태에서, 제2 용량은 항푸소제닉 폴리펩티드의 혈청 농도가 대상체의 혈청 중 약 500 ng/mL 미만이 되기 전에 투여된다.In some embodiments, the second dose is administered before the serum concentration of the antifusogenic polypeptide is less than about 500 ng/mL in the subject's serum.
일부 실시 형태에서, 방법은 대상체에서 적어도 500 ng/mL(예를 들어, 적어도 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, 또는 그 초과) 항푸소제닉 폴리펩티드의 혈청 농도를, 예를 들어, 적어도 1시간(예를 들어, 적어도 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 1일, 2일, 3일, 4일, 5일, 6일, 1주, 2주, 3주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 1년, 또는 그 초과)동안 유지한다.In some embodiments, the method comprises administering to the subject at least 500 ng/mL (e.g., at least 600 ng/mL, 700 ng/mL, 800 ng/mL, 900 ng/mL, 1,000 ng/mL, 1,100 ng/mL, 1,200 ng/mL, 1,300 ng/mL, 1,400 ng/mL, 1,500 ng/mL, 1,600 ng/mL, 1,700 ng/mL, 1,800 ng/mL, 1,900 ng/mL, 2,000 ng/mL, 2,100 ng/mL, 2,200 ng/mL, 2,300 ng/mL, 2,400 ng/mL, 2,500 ng/mL, 2,600 ng/mL, 2,700 ng/mL, 2,800 ng/mL, 2,900 ng/mL, 3,000 ng/mL, or more) Serum concentrations of the fusogenic polypeptide can be measured, for example, over a period of at least 1 hour (e.g., at least 2 hours, 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours, 10 hours, 11 hours). , 12 hours, 13 hours, 14 hours, 15 hours, 16 hours, 17 hours, 18 hours, 19 hours, 20 hours, 21 hours, 22 hours, 23 hours, 1 day, 2 days, 3 days, 4 days, 5 Day, 6 days, 1 week, 2 weeks, 3 weeks, 1 month, 2 months, 3 months, 4 months, 5 months, 6 months, 7 months, 8 months, 9 months, 10 months, 11 months, 1 year, or longer).
본원에 기재된 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 조성물의 다중 용량을 투여하는 방법은 세포, 조직 또는 대상체(예를 들어, 포유류)에 일정 기간에 걸쳐 2개 이상의 조성물을 제공하는 것을 포함한다. 특정 실시 형태에 따르면, 본원에 기재된 핵산 분자의 조성물의 다중 용량은 정의된 시간 경과에 걸쳐 대상체에게 투여될 수 있다. 본 발명의 이러한 양태에 따른 방법은 본원에 기재된 핵산 분자의 조성물(예를 들어, 약제학적 또는 수의학적 조성물 중의)(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드, 원형 폴리데옥시리보뉴클레오티드, 선형 폴리데옥시리보뉴클레오티드)의 다중 용량을 대상체에게 순차적으로 투여하는 것을 포함한다. 본원에서 사용되는 바와 같이, "순차적으로 투여"는 본원에 기재된 핵산 분자의 조성물의 각각의 용량이 상이한 시점에서, 예를 들어, 사전결정된 간격(예를 들어, 시간, 일, 주 또는 개월)으로 분리된 상이한 날에 대상체에게 투여되는 것을 의미한다. 일부 실시 형태에서, 본 발명은 본원에 기재된 핵산 분자의 조성물의 단회 초기 용량, 이어서 조성물의 하나 이상의 2차 용량, 및 선택적으로 이어서 조성물의 하나 이상의 3차 용량을 대상체에게 순차적으로 투여하는 것을 포함하는 방법을 제공한다.Methods for administering multiple doses of compositions of nucleic acid molecules (e.g., circular polyribonucleotides) described herein include providing two or more compositions over a period of time to a cell, tissue, or subject (e.g., a mammal). Includes. According to certain embodiments, multiple doses of compositions of nucleic acid molecules described herein may be administered to a subject over a defined time course. Methods according to this aspect of the invention include compositions (e.g., in pharmaceutical or veterinary compositions) of nucleic acid molecules described herein (e.g., circular polyribonucleotides, linear polyribonucleotides, circular polydeoxyribonucleotides). , linear polydeoxyribonucleotide) sequentially administered to the subject. As used herein, “sequentially administered” means that each dose of a composition of nucleic acid molecules described herein is administered at different time points, e.g., at predetermined intervals (e.g., hours, days, weeks, or months). It is meant to be administered to the subject on separate and different days. In some embodiments, the invention comprises sequentially administering to a subject a single initial dose of a composition of nucleic acid molecules described herein, followed by one or more secondary doses of the composition, and optionally followed by one or more tertiary doses of the composition. Provides a method.
용어 "초기 용량", "2차 용량", 및 "3차 용량"은 본원에 기재된 핵산 분자의 조성물의 투여의 시간적 순차를 지칭한다. 따라서, "초기 용량"은 치료 양생법의 시작 시에 투여되는 용량이고; "2차 용량"은 초기 용량 후에 투여되는 용량이고; "3차 용량"은 2차 용량 후에 투여되는 용량이다. 초기, 2차, 및 3차 용량은 모두 본원에 기재된 핵산 분자의 조성물의 동일한 양을 함유할 수 있고, 특정 실시 형태에서, 투여 빈도의 측면에서 서로 상이할 수 있다. 특정 실시 형태에서, 초기, 2차 및/또는 3차 용량에 함유된 본원에 기재된 핵산 분자의 조성물의 양은 치료 과정 동안 서로 다르다(예를 들어, 적절하게 상향 또는 하향 조정됨). 특정 실시 형태에서, 1회 이상(예를 들어, 2, 3, 4 또는 5회)의 용량은 치료 양생법의 시작 시에 "로딩 용량"으로서 투여된 후, 덜 빈번한 기준으로 투여되는 후속 용량(예를 들어, "유지 용량")이 투여된다.The terms “initial dose,” “second dose,” and “tertiary dose” refer to the temporal sequence of administration of a composition of nucleic acid molecules described herein. Accordingly, the “initial dose” is the dose administered at the beginning of the treatment regimen; “second dose” is the dose administered after the initial dose; “Third dose” is the dose administered after the second dose. The initial, secondary, and tertiary doses may all contain the same amount of the composition of nucleic acid molecules described herein and, in certain embodiments, may differ from each other in terms of frequency of administration. In certain embodiments, the amount of the composition of nucleic acid molecules described herein contained in the initial, secondary and/or tertiary doses varies (e.g., is adjusted up or down as appropriate) over the course of treatment. In certain embodiments, one or more (e.g., 2, 3, 4, or 5) doses are administered as a “loading dose” at the beginning of the treatment regimen, followed by subsequent doses administered on a less frequent basis (e.g. For example, a “maintenance dose”) is administered.
특정 실시 형태에서, 각각의 2차 및/또는 3차 용량은 직전 용량 후에 투여된다. 본원에서 사용되는 바와 같은 문구 "직전 용량"은 다중 투여의 순차에서, 개재 용량 없이 순차에서 바로 다음 용량의 투여 전에 대상체에게 투여되는 본원에 기재된 핵산 분자의 조성물의 용량을 의미한다. 특정 실시 형태에서, 각각의 2차 및/또는 3차 용량은 직전 용량 후에 매일, 2일, 3일, 4일, 5일, 6일, 또는 7일마다 투여된다. 특정 실시 형태에서, 각각의 2차 및/또는 3차 용량은 직전 용량 후에 0.5주, 1주, 2주, 3주, 또는 4주마다 투여된다.In certain embodiments, each second and/or third dose is administered after the immediately preceding dose. As used herein, the phrase “immediately preceding dose” refers to the dose of a composition of nucleic acid molecules described herein administered to a subject, in a sequence of multiple administrations, prior to the administration of the immediately next dose in the sequence, without intervening doses. In certain embodiments, each second and/or third dose is administered daily, 2 days, 3 days, 4 days, 5 days, 6 days, or 7 days after the immediately preceding dose. In certain embodiments, each second and/or third dose is administered 0.5, 1, 2, 3, or 4 weeks after the previous dose.
본 발명의 이러한 양태에 따른 방법은 본원에 기재된 핵산 분자의 조성물의 임의의 수의 2차 및/또는 3차 용량이 대상체에게 투여되는 것을 포함할 수 있다. 예를 들어, 특정 실시 형태에서, 단회의 2차 용량만이 대상체에게 투여된다. 다른 실시 형태에서, 2회 이상(예를 들어, 2, 3, 4, 5, 6, 7, 8회, 또는 그 초과)의 2차 용량이 대상체에게 투여된다. 마찬가지로, 특정 실시 형태에서, 단회의 3차 용량만이 대상체에게 투여된다. 다른 실시 형태에서, 2회 이상(예를 들어, 2, 3, 4, 5, 6, 7, 8회, 또는 그 초과)의 3차 용량이 대상체에게 투여된다.Methods according to this aspect of the invention may include administering to the subject any number of secondary and/or tertiary doses of a composition of nucleic acid molecules described herein. For example, in certain embodiments, only a single secondary dose is administered to the subject. In other embodiments, two or more (e.g., 2, 3, 4, 5, 6, 7, 8, or more) secondary doses are administered to the subject. Likewise, in certain embodiments, only a single third dose is administered to the subject. In other embodiments, two or more (e.g., 2, 3, 4, 5, 6, 7, 8, or more) tertiary doses are administered to the subject.
특정 실시 형태에서, 2차 및/또는 3차 용량이 대상체에게 투여되는 빈도는 치료 양생법의 과정에 따라 달라질 수 있다. 투여 빈도는 또한 치료 과정 동안 조정될 수 있다.In certain embodiments, the frequency with which secondary and/or tertiary doses are administered to a subject may vary depending on the course of the treatment regimen. The frequency of administration may also be adjusted during the course of treatment.
일부 실시 형태에서, 방법은 적어도 제1 조성물 및 제2 조성물을 세포, 조직 또는, 대상체(예를 들어, 포유류, 예를 들어, 인간)에게 제공(예를 들어, 투여)하는 것을 포함한다. 일부 실시 형태에서, 방법은 제3 조성물, 제4 조성물, 제5 조성물, 제6 조성물, 제7 조성물, 제8 조성물, 제9 조성물, 제10 조성물, 또는 그 초과를 제공(예를 들어, 투여)하는 것을 추가로 포함한다. 일부 실시 형태에서, 추가의 조성물이 세포의 수명 기간 동안 제공된다. 일부 실시 형태에서, 세포, 조직, 또는 대상체가 조성물로부터 이익을 얻는 동안 추가의 조성물이 제공(예를 들어, 투여)된다.In some embodiments, the method includes providing (e.g., administering) at least a first composition and a second composition to a cell, tissue, or subject (e.g., a mammal, e.g., a human). In some embodiments, the method provides (e.g., administers) the third composition, fourth composition, fifth composition, sixth composition, seventh composition, eighth composition, ninth composition, tenth composition, or more. ) is additionally included. In some embodiments, additional composition is provided during the life of the cell. In some embodiments, additional composition is provided (e.g., administered) while the cell, tissue, or subject is benefiting from the composition.
일부 실시 형태에서, 다중 투여 양생법에서 제1 조성물은 본원에 개시된 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양을 포함한다. 일부 실시 형태에서, 다중 투여 양생법에서 제2 조성물은 본원에 개시된 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제2 양을 포함한다. 일부 실시 형태에서, 다중 투여 양생법에서 제3 조성물, 제4 조성물, 제5 조성물, 제6 조성물, 제7 조성물, 제8 조성물, 제9 조성물, 제10 조성물, 또는 그 초과는 본원에 개시된 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제3, 제4, 제5, 제6, 제7, 제8, 제9, 제10 또는 그 초과의 양을 포함한다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제2 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양과 동일하다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제3 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양과 동일하다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제4, 제5, 제6, 제7, 제8, 제9, 제10, 또는 그 초과의 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양과 동일하다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제2 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양보다 적다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제3 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양보다 적다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제4, 제5, 제6, 제7, 제8, 제9, 제10, 또는 그 초과의 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양보다 적다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제2 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양보다 크다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제3 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양보다 크다. 일부 실시 형태에서, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제4, 제5, 제6, 제7, 제8, 제9, 제10, 또는 그 초과의 양은 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 제1 양보다 크다. 일부 실시 형태에서, 제2 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양의 1%, 5%, 10%, 15%, 20%, 또는 25% 이하만큼 변한다. 일부 실시 형태에서, 제2 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 1%, 5%, 10%, 15%, 20%, 또는 25% 이하로 적다. 일부 실시 형태에서, 제2 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배 내지 1000배 더 많다. 일부 실시 형태에서, 제2 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배, 1배, 5배, 10배, 100배, 또는 1000배 더 많다. 일부 실시 형태에서, 후속 조성물(예를 들어, 제1 조성물을 투여한 후에 투여되는 조성물)의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배, 1배, 5배, 10배, 100배 또는 1000배 더 많다. 일부 실시 형태에서, 제2 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배 내지 1000배 더 적다. 일부 실시 형태에서, 제2 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배, 1배, 5배, 10배, 100배, 또는 1000배 더 적다. 일부 실시 형태에서, 후속 조성물(예를 들어, 제1 조성물을 투여한 후에 투여되는 조성물)의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배, 1배, 5배, 10배, 100배, 또는 1000배 더 적다. 일부 실시 형태에서, (예를 들어, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양의 제1 조성물을 투여한 후에) 후속 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배 내지 1000배 더 많거나 더 적다. 일부 실시 형태에서, (예를 들어, 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양의 제1 조성물을 투여한 후) 후속 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양보다 0.1배, 1배, 5배, 10배, 100배, 또는 1000배 더 많거나 더 적다. 예를 들어, 제1 조성물은 1배의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 포함하고, 제2 조성물은 제1 조성물에 비해 5배의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 포함하고, 제3 조성물은 제1 조성물에 비해 0.2배의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 포함한다. 일부 실시 형태에서, 제2 조성물은 제1 조성물의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 양에 비해 적어도 5배의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 포함한다.In some embodiments, the first composition in a multiple dosage regimen comprises a first amount of a nucleic acid molecule (e.g., circular polyribonucleotide) disclosed herein. In some embodiments, the second composition in a multiple dosage regimen comprises a second amount of a nucleic acid molecule (e.g., circular polyribonucleotide) disclosed herein. In some embodiments, the third, fourth, fifth, sixth, seventh, eighth, ninth, tenth, or more nucleic acid molecules disclosed herein in a multiple dosage regimen. and a third, fourth, fifth, sixth, seventh, eighth, ninth, tenth or more amount of (e.g., circular polyribonucleotide). In some embodiments, the second amount of nucleic acid molecule (e.g., circular polyribonucleotide) is the same as the first amount of nucleic acid molecule (e.g., circular polyribonucleotide). In some embodiments, the third amount of nucleic acid molecule (e.g., circular polyribonucleotide) is the same as the first amount of nucleic acid molecule (e.g., circular polyribonucleotide). In some embodiments, the fourth, fifth, sixth, seventh, eighth, ninth, tenth, or more amount of a nucleic acid molecule (e.g., a circular polyribonucleotide) is , circular polyribonucleotide). In some embodiments, the second amount of nucleic acid molecule (e.g., circular polyribonucleotide) is less than the first amount of nucleic acid molecule (e.g., circular polyribonucleotide). In some embodiments, the third amount of nucleic acid molecule (e.g., circular polyribonucleotide) is less than the first amount of nucleic acid molecule (e.g., circular polyribonucleotide). In some embodiments, the fourth, fifth, sixth, seventh, eighth, ninth, tenth, or more amount of a nucleic acid molecule (e.g., a circular polyribonucleotide) is , circular polyribonucleotide). In some embodiments, the second amount of nucleic acid molecule (e.g., circular polyribonucleotide) is greater than the first amount of nucleic acid molecule (e.g., circular polyribonucleotide). In some embodiments, the third amount of nucleic acid molecules (e.g., circular polyribonucleotides) is greater than the first amount of nucleic acid molecules (e.g., circular polyribonucleotides). In some embodiments, the fourth, fifth, sixth, seventh, eighth, ninth, tenth, or more amount of a nucleic acid molecule (e.g., a circular polyribonucleotide) is , circular polyribonucleotide). In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the second composition is 1%, 5%, 10% of the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the first composition. , varies by no more than 15%, 20%, or 25%. In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the second composition is 1%, 5%, 10% greater than the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the first composition. , less than 15%, 20%, or 25%. In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the second composition is 0.1-fold to 1000-fold greater than the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the first composition. In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the second composition is 0.1, 1, or 5 times the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the first composition. , 10 times, 100 times, or 1000 times more. In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) in a subsequent composition (e.g., a composition administered after administering the first composition) is greater than or equal to the amount of nucleic acid molecules (e.g., circular polyribonucleotides) in the first composition. 0.1, 1, 5, 10, 100, or 1000 times more than the amount of polyribonucleotides. In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the second composition is 0.1-fold to 1000-fold less than the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the first composition. In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the second composition is 0.1, 1, or 5 times the amount of nucleic acid molecules (e.g., circular polyribonucleotides) of the first composition. , 10 times, 100 times, or 1000 times less. In some embodiments, the amount of nucleic acid molecules (e.g., circular polyribonucleotides) in a subsequent composition (e.g., a composition administered after administering the first composition) is greater than or equal to the amount of nucleic acid molecules (e.g., circular polyribonucleotides) in the first composition. 0.1, 1, 5, 10, 100, or 1000 times less than the amount of polyribonucleotide). In some embodiments, the amount of nucleic acid molecule (e.g., circular polyribonucleotide) of a subsequent composition (e.g., after administering the first composition of the amount of nucleic acid molecule (e.g., circular polyribonucleotide)) is 0.1 to 1000 times more or less than the amount of nucleic acid molecules (e.g., circular polyribonucleotides) in the first composition. In some embodiments, the amount of nucleic acid molecule (e.g., circular polyribonucleotide) of a subsequent composition (e.g., after administering the first composition of the amount of nucleic acid molecule (e.g., circular polyribonucleotide)) is 0.1, 1, 5, 10, 100, or 1000 times more or less than the amount of nucleic acid molecules (e.g., circular polyribonucleotides) in the first composition. For example, the first composition comprises 1 times as many nucleic acid molecules (e.g., circular polyribonucleotides) and the second composition comprises 5 times as many nucleic acid molecules (e.g., circular polyribonucleotides) as the first composition. ), and the third composition includes 0.2 times more nucleic acid molecules (e.g., circular polyribonucleotides) than the first composition. In some embodiments, the second composition comprises at least 5 times the amount of nucleic acid molecules (e.g., circular polyribonucleotides) compared to the amount of nucleic acid molecules (e.g., circular polyribonucleotides) in the first composition.
일부 실시 형태에서, 제1 조성물은 제2 조성물보다 더 많은 양의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 포함한다. 일부 실시 형태에서, 제1 조성물은 제3, 제4, 제5, 제6, 제7, 제8, 제9, 또는 제10 조성물보다 더 많은 양의 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 포함한다.In some embodiments, the first composition includes a greater amount of nucleic acid molecule (e.g., circular polyribonucleotide) than the second composition. In some embodiments, the first composition contains a greater amount of nucleic acid molecules (e.g., circular polyribonucleotides) than the third, fourth, fifth, sixth, seventh, eighth, ninth, or tenth composition. ) includes.
일부 실시 형태에서, 본원에 기재된 바와 같은 다중 투여 양생법으로 투여되는 항푸소제닉 폴리펩티드를 인코딩하는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 복수(예를 들어, 2개 이상)의 조성물은 동일한 조성물이다. 일부 실시 형태에서, 본원에 기재된 바와 같은 다중 투여 양생법으로 투여되는 항푸소제닉 폴리펩티드를 인코딩하는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 복수(예를 들어, 2개 이상)의 조성물은 상이한 조성물이다. 일부 실시 형태에서, 동일한 조성물은 동일한 항푸소제닉 폴리펩티드를 인코딩하는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 포함한다. 일부 실시 형태에서, 상이한 조성물은 상이한 항푸소제닉 폴리펩티드를 인코딩하는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드), 또는 이들의 조합을 포함한다.In some embodiments, the composition of a plurality (e.g., two or more) of nucleic acid molecules (e.g., circular polyribonucleotides) encoding an antifusogenic polypeptide administered in a multiple dosing regimen as described herein is the same. It is a composition. In some embodiments, the composition of a plurality (e.g., two or more) of nucleic acid molecules (e.g., circular polyribonucleotides) encoding an antifusogenic polypeptide administered in a multiple dosing regimen as described herein are different It is a composition. In some embodiments, the same composition comprises nucleic acid molecules (e.g., circular polyribonucleotides) encoding the same antifusogenic polypeptide. In some embodiments, the different compositions include nucleic acid molecules (e.g., circular polyribonucleotides) encoding different antifusogenic polypeptides, or combinations thereof.
일부 실시 형태에서, 다중 투여 양생법에서, 본원에서 제공된 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 투여하는 방법은 핵산 분자를 이를 필요로 하는 대상체에게 1일 내지 56일, 예컨대 약 49일, 42일, 35일, 28일, 21일, 14일, 또는 7일의 간격으로 다중 횟수(다중 용량), 예를 들어 적어도 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 20, 30, 40, 50, 60, 100, 150, 200, 또는 500회 동안 투여하는 것을 포함한다. 일부 실시 형태에서, 다중 투여 양생법에서, 본원에서 제공된 방법은 핵산 분자를 이를 필요로 하는 대상체에게 약 7일의 간격으로 적어도 3회 동안 투여하는 것을 포함한다. 일부 실시 형태에서, 본원에서 제공된 핵산 분자의 다중 용량(예를 들어, 적어도 3, 4, 5, 6, 7, 8, 또는 9회 용량)의 투여를 제공받는 대상체에서, 항푸소제닉 폴리펩티드(예를 들어, 혈장 항푸소제닉 폴리펩티드)의 수준은 마지막 용량 후 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 또는 20주 초과의 기간 동안 50%, 40%, 30%, 20%, 또는 10% 미만의 변이를 갖는 수준으로 유지된다. 일부 실시 형태에서, 본원에서 제공된 핵산 분자의 다중 용량(예를 들어, 적어도 3, 4, 5, 6, 7, 8, 또는 9회 용량)의 투여를 제공받는 대상체에서, 항푸소제닉 폴리펩티드의 수준(예를 들어, 혈장 항푸소제닉 폴리펩티드 수준)은 제2, 제3, 제4, 제5, 제6, 제7, 제8, 또는 마지막 용량 후 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 19, 또는 20주 초과의 기간 동안 제1 수준으로 유지되고, 여기서 제1 수준은 제1 용량 직후에 측정된(예를 들어, 제1 용량을 투여한지 약 12, 24, 36, 또는 48시간 후에 측정된) 항푸소제닉 폴리펩티드의 수준보다 높다. 일부 실시 형태에서, 약 7일 간격으로 본원에서 제공된 핵산 분자의 다중 용량(예를 들어, 적어도 3회 용량)의 투여를 제공받는 대상체에서, 항푸소제닉 폴리펩티드의 수준(예를 들어, 혈장 항푸소제닉 폴리펩티드 수준)은 제2, 제3, 제4, 제5, 제6, 제7, 제8, 또는 마지막 용량 후 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20주 초과의 기간 동안 제1 수준으로 유지되고, 여기서 제1 수준은 제1 용량 직후에 측정된(예를 들어, 제1 용량을 투여한지 약 12, 24, 36, 또는 48시간 후에 측정된) 항푸소제닉 폴리펩티드의 수준보다 높다.In some embodiments, in a multiple dosing regimen, a method of administering a nucleic acid molecule (e.g., a circular polyribonucleotide) provided herein provides the nucleic acid molecule to a subject in need thereof for 1 to 56 days, such as about 49 days. Multiple doses (multiple doses) spaced 42, 35, 28, 21, 14, or 7 days apart, for example, at least 3, 4, 5, 6, 7, 8, 9, 10, 12, Includes administration for 15, 20, 30, 40, 50, 60, 100, 150, 200, or 500 doses. In some embodiments, in a multiple administration regimen, the methods provided herein include administering the nucleic acid molecule to a subject in need thereof for at least three times, spaced about seven days apart. In some embodiments, in a subject receiving multiple doses (e.g., at least 3, 4, 5, 6, 7, 8, or 9 doses) of a nucleic acid molecule provided herein, an antifusogenic polypeptide (e.g. For example, the level of plasma antifusogenic polypeptide) is 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, or Maintained at a level with less than 50%, 40%, 30%, 20%, or 10% variation for a period of more than 20 weeks. In some embodiments, in a subject receiving multiple doses (e.g., at least 3, 4, 5, 6, 7, 8, or 9 doses) of a nucleic acid molecule provided herein, the level of antifusogenic polypeptide (e.g., plasma antifusogenic polypeptide levels) 1, 2, 3, 4, 5, 6, after the second, third, fourth, fifth, sixth, seventh, eighth, or last dose. maintained at the first level for a period of greater than 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 19, or 20 weeks, wherein the first level is measured immediately after the first dose. is higher than the level of antifusogenic polypeptide (e.g., measured about 12, 24, 36, or 48 hours after administering the first dose). In some embodiments, in a subject receiving administration of multiple doses (e.g., at least three doses) of a nucleic acid molecule provided herein about 7 days apart, the level of antifusogenic polypeptide (e.g., plasma antifusogenic polypeptide) genic polypeptide levels) at 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, after the second, third, fourth, fifth, sixth, seventh, eighth, or last dose. maintained at the first level for a period of greater than 18, 19, or 20 weeks, wherein the first level is measured immediately after the first dose (e.g., about 12, 24, 36, or 48 days after administering the first dose). higher than the level of antifusogenic polypeptide (measured after hours).
전달 방법Delivery method
본원에 기재된 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리리보뉴클레오티드는 담체와 함께 또는 담체 없이 약제학적 조성물에 포함될 수 있다.Circular polyribonucleotides encoding antifusogenic polypeptides described herein (e.g., polypeptides in Table 1) may be included in pharmaceutical compositions with or without a carrier.
본원에 기재된 약제학적 조성물은 예를 들어 약제학적 담체 및/또는 중합체 담체, 예를 들어 리포솜과 같은 담체를 포함하여 제형화될 수 있고, 알려져 있는 방법에 의해 이를 필요로 하는 대상체(예를 들어, 인간 또는 비인간 농업 또는 가축, 예를 들어, 소, 개, 고양이, 말, 가금류)에게 전달될 수 있다. 이러한 방법은 형질감염(예를 들어, 지질-매개, 양이온성 중합체, 인산칼슘, 덴드리머); 전기천공 또는 막 파괴(예를 들어, 뉴클레오펙션), 바이러스 전달(예를 들어, 렌티바이러스, 레트로바이러스, 아데노바이러스, AAV), 미세주입, 미세발사체 포격("유전자 총"), 퓨진, 직접 음파 로딩, 세포 압착, 광학 형질감염, 원형질체 융합, 임팔레펙션(impalefection), 마그네토펙션(magnetofection), 엑소좀-매개 전달, 지질 나노입자-매개 전달, 및 이들의 임의의 조합을 포함하지만, 이에 한정되는 것은 아니다. 전달 방법은 또한 예를 들어, 문헌[Gori et al., Delivery and Specificity of CRISPR/Cas9 Genome Editing Technologies for Human Gene Therapy. Human Gene Therapy. July 2015, 26(7): 443-451. doi:10.1089/hum.2015.074]; 및 [Zuris et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editingin vitro andin vivo. Nat Biotechnol. 2014 Oct 30;33(1):73-80]에 기재되어 있다.The pharmaceutical compositions described herein can be formulated comprising carriers such as, for example, pharmaceutical carriers and/or polymeric carriers, for example, liposomes, and can be formulated by known methods to subjects in need thereof (e.g., It can be transmitted to humans or non-human agricultural or livestock animals (e.g. cattle, dogs, cats, horses, poultry). These methods include transfection (e.g., lipid-mediated, cationic polymer, calcium phosphate, dendrimer); Electroporation or membrane disruption (e.g., nucleofection), viral delivery (e.g., lentivirus, retrovirus, adenovirus, AAV), microinjection, microprojectile bombardment (“gene gun”), fugene, direct including, but not limited to, sonic loading, cell compression, optical transfection, protoplast fusion, impalefection, magnetofection, exosome-mediated delivery, lipid nanoparticle-mediated delivery, and any combination thereof. It is not limited. Delivery methods can also be found in, for example, Gori et al., Delivery and Specificity of CRISPR/Cas9 Genome Editing Technologies for Human Gene Therapy. Human Gene Therapy. July 2015, 26(7): 443-451. doi:10.1089/hum.2015.074]; and [Zuris et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editingin vitro andin vivo . Nat Biotechnol. 2014
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 "네이키드" 전달 제형으로 전달될 수 있다. 네이키드 전달 제형은 담체의 보조 없이 및 원형 폴리리보뉴클레오티드의 공유 변형 또는 원형 폴리리보뉴클레오티드의 부분적 또는 완전한 캡슐화 없이 원형 폴리리보뉴클레오티드를 세포에 전달한다.In some embodiments, circular polyribonucleotides can be delivered in a “naked” delivery formulation. Naked delivery formulations deliver circular polyribonucleotides to cells without the assistance of a carrier and without covalent modification of the circular polyribonucleotide or partial or complete encapsulation of the circular polyribonucleotide.
네이키드 전달 제형은 담체가 없는 제형이고, 여기서 원형 폴리리보뉴클레오티드는 세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없고, 원형 폴리리보뉴클레오티드는 부분적으로 또는 완전히 캡슐화 되지 않는다. 일부 실시 형태에서, 세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없는 원형 폴리리보뉴클레오티드는 세포로의 전달을 보조하는 단백질, 소분자, 입자, 중합체, 또는 생체중합체와 같은 모이어티에 공유적으로 결합되지 않는 폴리리보뉴클레오티드일 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 프로타민 또는 프로타민 염(예를 들어, 프로타민 설페이트)을 갖는 전달 제형으로 전달될 수 있다.Naked delivery formulations are carrier-free formulations, in which the circular polyribonucleotide has no covalent modifications that bind moieties that assist delivery to cells, and the circular polyribonucleotide is not partially or fully encapsulated. In some embodiments, a circular polyribonucleotide free of covalent modifications that binds to a moiety that assists delivery to a cell is covalently bound to a moiety, such as a protein, small molecule, particle, polymer, or biopolymer that assists delivery to a cell. It may be a non-binding polyribonucleotide. In some embodiments, circular polyribonucleotides can be delivered in a delivery formulation with protamine or a protamine salt (e.g., protamine sulfate).
세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없는 폴리리보뉴클레오티드는 변형된 포스페이트 기를 함유하지 않을 수 있다. 예를 들어, 세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없는 폴리리보뉴클레오티드는 포스포로티오에이트, 포스포로셀레네이트, 보라노포스페이트, 보라노포스페이트 에스테르, 히드로겐 포스포네이트, 포스포르아미데이트, 포스포로디아미데이트, 알킬 또는 아릴 포스포네이트, 또는 포스포트리에스테르를 함유하지 않을 수 있다.A polyribonucleotide without a covalent modification that binds to a moiety that aids delivery to the cell may not contain modified phosphate groups. For example, polyribonucleotides without covalent modifications that bind to moieties that aid delivery to cells include phosphorothioate, phosphoroselenate, boranophosphate, boranophosphate ester, hydrogen phosphonate, and phosphoryl. May not contain amidates, phosphorodiamidates, alkyl or aryl phosphonates, or phosphotriesters.
일부 실시 형태에서, 네이키드 전달 제형은 형질감염 시약, 양이온성 담체, 탄수화물 담체, 나노입자 담체, 또는 단백질 담체 중 임의의 것 또는 전부가 없을 수 있다. 예를 들어, 네이키드 전달 제형은 피토글리코겐 옥테닐 숙시네이트, 피토글리코겐 베타-덱스트린, 무수물-변형된 피토글리코겐 베타-덱스트린, 리포펙타민, 폴리에틸렌이민, 폴리(트리메틸렌이민), 폴리(테트라메틸렌이민), 폴리프로필렌이민, 아미노글리코시드-폴리아민, 디데옥시-디아미노-b-시클로덱스트린, 스페르민, 스페르미딘, 폴리(2-디메틸아미노)에틸 메타크릴레이트, 폴리(리신), 폴리(히스티딘), 폴리(아르기닌), 양이온화 젤라틴, 덴드리머, 키토산, 1,2-디올레오일-3-트리메틸암모늄-프로판(DOTAP), N-[1-(2,3-디올레오일옥시)프로필]-N,NN-트리메틸암모늄 클로라이드(DOTMA), l-[2-(올레오일옥시)에틸]-2-올레일-3-(2-히드록시에틸)이미다졸리늄 클로라이드(DOTIM), 2,3-디올레일-N-[2(스페르민카르복스아미도)에틸]-N,N-디메틸-1-프로판아미늄 트리플루오로아세테이트(DOSPA), 3B-[N-(-디메틸아미노에탄)-카르바모일]콜레스테롤 히드로클로라이드(DC-콜레스테롤 HCl), 디헵타데실아미도글리실 스페르미딘(DOGS), N,N-디스테아릴-N,N-디메틸암모늄 브로마이드(DDAB), N-(l,2-디미리스틸옥시프로프-3-일)-N,N-디메틸-N-히드록시에틸 암모늄 브로마이드(DMRIE), N,N-디올레일-N,N-디메틸암모늄 클로라이드(DODAC), 인간 혈청 알부민(HSA), 저-밀도 지단백질(LDL), 고-밀도 지단백질(HDL), 또는 글로불린이 없을 수 있다.In some embodiments, the naked delivery formulation may be free of any or all of the following: transfection reagents, cationic carriers, carbohydrate carriers, nanoparticle carriers, or protein carriers. For example, naked delivery formulations include phytoglycogen octenyl succinate, phytoglycogen beta-dextrin, anhydride-modified phytoglycogen beta-dextrin, lipofectamine, polyethyleneimine, poly(trimethyleneimine), poly(tetramethylene) imine), polypropyleneimine, aminoglycoside-polyamine, dideoxy-diamino-b-cyclodextrin, spermine, spermidine, poly(2-dimethylamino)ethyl methacrylate, poly(lysine), poly (Histidine), poly(arginine), cationized gelatin, dendrimer, chitosan, 1,2-dioleoyl-3-trimethylammonium-propane (DOTAP), N-[1-(2,3-dioleoyloxy) propyl]-N,NN-trimethylammonium chloride (DOTMA), l-[2-(oleoyloxy)ethyl]-2-oleyl-3-(2-hydroxyethyl)imidazolinium chloride (DOTIM), 2,3-dioleyl-N-[2(sperminecarboxamido)ethyl]-N,N-dimethyl-1-propanaminium trifluoroacetate (DOSPA), 3B-[N-( -dimethylaminoethane)-carbamoyl]cholesterol hydrochloride (DC-cholesterol HCl), diheptadecylamidoglycyl spermidine (DOGS), N,N-distearyl-N,N-dimethylammonium bromide ( DDAB), N-(l,2-dimyristyloxyprop-3-yl)-N,N-dimethyl-N-hydroxyethyl ammonium bromide (DMRIE), N,N-dioleyl-N,N- Dimethylammonium chloride (DODAC), human serum albumin (HSA), low-density lipoprotein (LDL), high-density lipoprotein (HDL), or globulin may be absent.
네이키드 전달 제형은 비-담체 부형제를 포함할 수 있다. 일부 실시 형태에서, 비-담체 부형제는 활성 세포-관통 효과를 나타내지 않는 불활성 성분을 포함할 수 있다. 일부 실시 형태에서, 비-담체 부형제는 완충제, 예를 들어 PBS를 포함할 수 있다. 일부 실시 형태에서, 비-담체 부형제는 용매, 비-수성 용매, 희석제, 현탁 조제, 표면 활성제, 등장성제, 증점제, 유화제, 보존제, 중합체, 펩티드, 단백질, 세포, 히알루로니다제, 분산제, 과립화제, 붕해제, 결합제, 완충제, 윤활제, 또는 오일일 수 있다.Naked delivery formulations may include non-carrier excipients. In some embodiments, non-carrier excipients may include inert ingredients that do not exhibit active cell-penetrating effects. In some embodiments, the non-carrier excipient may include a buffering agent, such as PBS. In some embodiments, non-carrier excipients include solvents, non-aqueous solvents, diluents, suspending aids, surface active agents, isotonic agents, thickeners, emulsifiers, preservatives, polymers, peptides, proteins, cells, hyaluronidases, dispersants, granules. It may be a topical agent, disintegrant, binder, buffer, lubricant, or oil.
일부 실시 형태에서, 네이키드 전달 제형은 희석제, 예컨대 비경구적으로 허용되는 희석제를 포함할 수 있다. 희석제(예를 들어, 비경구적으로 허용되는 희석제)는 액체 희석제 또는 고체 희석제일 수 있다. 일부 실시 형태에서, 희석제(예를 들어, 비경구적으로 허용되는 희석제)는 RNA 가용화제, 완충제, 또는 등장성제일 수 있다. RNA 가용화제의 예는 물, 에탄올, 메탄올, 아세톤, 포름아미드, 및 2-프로판올을 포함한다. 완충제의 예는 2-(N-모르폴리노)에탄술폰산(MES), 비스-트리스, 2-[(2-아미노-2-옥소에틸)-(카르복시메틸)아미노]아세트산(ADA), N-(2-아세트아미도)-2-아미노에탄술폰산(ACES), 피페라진-N,N'-비스(2-에탄술폰산)(PIPES), 2-[[1,3-디히드록시-2-(히드록시메틸)프로판-2-일]아미노]에탄술폰산(TES), 3-(N-모르폴리노)프로판술폰산(MOPS), 4-(2-히드록시에틸)-1-피페라진에탄술폰산(HEPES), 트리스, 트리신, Gly-Gly, 비신, 또는 포스페이트를 포함한다. 등장성제의 예는 글리세린, 만니톨, 폴리에틸렌 글리콜, 프로필렌 글리콜, 트레할로스, 또는 수크로스를 포함한다.In some embodiments, the naked delivery formulation may include a diluent, such as a parenterally acceptable diluent. The diluent (e.g., a parenterally acceptable diluent) may be a liquid diluent or a solid diluent. In some embodiments, the diluent (e.g., a parenterally acceptable diluent) may be an RNA solubilizer, buffer, or isotonic agent. Examples of RNA solubilizers include water, ethanol, methanol, acetone, formamide, and 2-propanol. Examples of buffers include 2-(N-morpholino)ethanesulfonic acid (MES), bis-tris, 2-[(2-amino-2-oxoethyl)-(carboxymethyl)amino]acetic acid (ADA), N- (2-acetamido)-2-aminoethanesulfonic acid (ACES), piperazine-N,N'-bis(2-ethanesulfonic acid) (PIPES), 2-[[1,3-dihydroxy-2- (Hydroxymethyl)propan-2-yl]amino]ethanesulfonic acid (TES), 3-(N-morpholino)propanesulfonic acid (MOPS), 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES), tris, tricine, Gly-Gly, bicine, or phosphate. Examples of isotonic agents include glycerin, mannitol, polyethylene glycol, propylene glycol, trehalose, or sucrose.
일부 실시 형태에서, 제형은 세포-침투제를 포함한다. 일부 실시 형태에서, 제형은 국소 제형이고 세포-침투제를 포함한다. 세포-침투제는 하나 이상의 히드록실 작용기를 갖는 알코올과 같은 유기 화합물을 포함할 수 있다. 일부 경우에, 세포-침투제는 1가 알코올, 다가 알코올, 불포화 지방족 알코올, 및 지환족 알코올과 같은 알코올을 포함하지만, 이에 한정되는 것은 아니다. 세포-침투제는 메탄올, 에탄올, 이소프로판올, 페녹시에탄올, 트리에탄올아민, 페네틸 알코올, 부탄올, 펜탄올, 세틸 알코올, 에틸렌 글리콜, 프로필렌 글리콜, 변성 알코올, 벤질 알코올, 특히 변성 알코올, 글리콜, 스테아릴 알코올, 세테아릴 알코올, 멘톨, 폴리에틸렌 글리콜(PEG)-400, 에톡실화 지방산, 또는 히드록시에틸셀룰로스 중 하나 이상을 포함할 수 있다. 특정 실시 형태에서, 세포-침투제는 에탄올을 포함한다. 세포-침투제는 그 전체가 본원에 참조로 포함되는 제WO2020/180751호 또는 제WO2020/180752호에 기재된 바와 같은 임의의 양 또는 임의의 제형의 임의의 세포-침투제를 포함할 수 있다.In some embodiments, the formulation includes a cell-penetrating agent. In some embodiments, the formulation is a topical formulation and includes a cell-penetrating agent. Cell-penetrating agents may include organic compounds, such as alcohols, that have one or more hydroxyl functional groups. In some cases, cell-penetrating agents include, but are not limited to, alcohols such as monohydric alcohols, polyhydric alcohols, unsaturated aliphatic alcohols, and cycloaliphatic alcohols. Cell-penetrating agents include methanol, ethanol, isopropanol, phenoxyethanol, triethanolamine, phenethyl alcohol, butanol, pentanol, cetyl alcohol, ethylene glycol, propylene glycol, denatured alcohol, benzyl alcohol, especially denatured alcohol, glycol, and stearyl alcohol. , cetearyl alcohol, menthol, polyethylene glycol (PEG)-400, ethoxylated fatty acid, or hydroxyethylcellulose. In certain embodiments, the cell-penetrating agent includes ethanol. The cell-penetrating agent may comprise any cell-penetrating agent in any amount or in any formulation as described in WO2020/180751 or WO2020/180752, which are incorporated herein by reference in their entirety.
일부 실시 형태에서, 본원에 개시된 바와 같은 약제학적 조제물, 본원에 개시된 바와 같은 약제학적 조성물, 개시된 바와 같은 약제학적 약물 물질, 또는 본원에 개시된 바와 같은 약제학적 약물 생성물은 비경구 핵산 전달 시스템에 있다. 모 핵산 전달 시스템은 본원에 개시된 바와 같은 약제학적 조제물, 본원에 개시된 바와 같은 약제학적 조성물, 개시된 바와 같은 약제학적 약물 물질, 또는 본원에 개시된 바와 같은 약제학적 약물 생성물, 및 비경구적으로 허용되는 희석제를 포함할 수 있다. 일부 실시 형태에서, 비경구 핵산 전달 시스템에서 본원에 개시된 바와 같은 약제학적 조제물, 본원에 개시된 바와 같은 약제학적 조성물, 개시된 바와 같은 약제학적 약물 물질, 또는 본원에 개시된 바와 같은 약제학적 약물 생성물은 임의의 담체가 없다.In some embodiments, the pharmaceutical preparation as disclosed herein, pharmaceutical composition as disclosed herein, pharmaceutical drug substance as disclosed herein, or pharmaceutical drug product as disclosed herein is in a parenteral nucleic acid delivery system. . The parent nucleic acid delivery system may be a pharmaceutical preparation as disclosed herein, a pharmaceutical composition as disclosed herein, a pharmaceutical drug substance as disclosed herein, or a pharmaceutical drug product as disclosed herein, and a parenterally acceptable diluent. may include. In some embodiments, a pharmaceutical preparation as disclosed herein, a pharmaceutical composition as disclosed herein, a pharmaceutical drug substance as disclosed herein, or a pharmaceutical drug product as disclosed herein can be used in a parenteral nucleic acid delivery system. There is no carrier for
본 개시내용은 추가로 본원에 기재된 원형 폴리리보뉴클레오티드를 포함하는 숙주 또는 숙주 세포에 관한 것이다. 일부 실시 형태에서, 숙주 또는 숙주 세포는 척추동물, 포유류(예를 들어, 인간), 또는 다른 유기체 또는 세포이다.The present disclosure further relates to hosts or host cells comprising the circular polyribonucleotides described herein. In some embodiments, the host or host cell is a vertebrate, mammalian (e.g., human), or other organism or cell.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 참조 화합물, 예를 들어 기재된 원형 폴리리보뉴클레오티드에 상응하는 선형 폴리뉴클레오티드에 의해 유발된 반응과 비교하여, 숙주의 면역계에 의해 바람직하지 않은 반응이 감소되거나 바람직하지 않은 반응을 일으키지 않는다. 실시 형태에서, 원형 폴리리보뉴클레오티드는 숙주에서 비-면역원성이다. 일부 면역 반응은 체액성 면역 반응(예를 들어, 면역원-특이적 항체의 생성) 및 세포-매개 면역 반응(예를 들어, 림프구 증식)을 포함하지만, 이에 한정되는 것은 아니다.In some embodiments, the circular polyribonucleotide elicits reduced or no undesirable response by the immune system of the host compared to a response elicited by a reference compound, e.g., a linear polynucleotide corresponding to the circular polyribonucleotide described herein. In embodiments, the circular polyribonucleotide is non-immunogenic in the host. Some immune responses include, but are not limited to, humoral immune responses (e.g., production of immunogen-specific antibodies) and cell-mediated immune responses (e.g., lymphocyte proliferation).
일부 실시 형태에서, 숙주 또는 숙주 세포는 원형 폴리리보뉴클레오티드와 접촉(예를 들어, 전달 또는 투여)된다. 일부 실시 형태에서, 숙주는 포유류, 예컨대 인간이다. 숙주에서 원형 폴리리보뉴클레오티드 또는 선형, 발현 생성물, 또는 둘 모두의 양은 투여 후 임의의 시간에 측정될 수 있다. 특정 실시 형태에서, 배양물 중의 숙주 성장의 시간 경과가 결정된다. 원형 폴리리보뉴클레오티드 또는 선형의 존재 하에 성장이 증가 또는 감소되는 경우, 원형 폴리리보뉴클레오티드 또는 발현 생성물 또는 둘 모두는 숙주의 성장을 증가 또는 감소시키는 데 효과적인 것으로 확인된다.In some embodiments, a host or host cell is contacted (e.g., delivered or administered) with a circular polyribonucleotide. In some embodiments, the host is a mammal, such as a human. The amount of circular polyribonucleotide or linear, expression product, or both, in the host can be measured at any time following administration. In certain embodiments, the time course of host growth in culture is determined. When growth is increased or decreased in the presence of a circular polyribonucleotide or linear, the circular polyribonucleotide or the expression product or both are found to be effective in increasing or decreasing the growth of the host.
본원에 기재된 바와 같은 원형 폴리리보뉴클레오티드 분자를 세포, 조직, 또는 대상체에 전달하는 방법은 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물을 세포, 조직 또는 대상체에게 투여하는 것을 포함한다.A method of delivering a circular polyribonucleotide molecule as described herein to a cell, tissue, or subject includes administering a pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product as described herein to the cell, tissue, or subject. Includes.
일부 실시 형태에서, 세포는 진핵 세포이다. 일부 실시 형태에서, 세포는 포유동물 세포이다. 일부 실시 형태에서, 세포는 유제류 세포이다. 일부 실시 형태에서, 세포는 동물 세포이다. 일부 실시 형태에서, 세포는 면역 세포이다. 일부 실시 형태에서, 조직은 결합 조직(connective tissue), 근육 조직, 신경 조직, 또는 상피 조직이다. 일부 실시 형태에서, 조직은 기관(예를 들어, 간, 폐, 비장, 신장 등)이다.In some embodiments, the cell is a eukaryotic cell. In some embodiments, the cell is a mammalian cell. In some embodiments, the cells are ungulate cells. In some embodiments, the cells are animal cells. In some embodiments, the cells are immune cells. In some embodiments, the tissue is connective tissue, muscle tissue, nervous tissue, or epithelial tissue. In some embodiments, the tissue is an organ (eg, liver, lung, spleen, kidney, etc.).
일부 실시 형태에서, 전달 방법은 생체내 방법이다. 예를 들어, 본원에 기재된 바와 같은 원형 폴리리보뉴클레오티드의 전달 방법은 이를 필요로 하는 대상체에게 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물을 이를 필요로 하는 대상체에게 비경구로 투여하는 것을 포함한다. 또 다른 예로서, 원형 폴리리보뉴클레오티드를 대상체의 세포 또는 조직에 전달하는 방법은 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물을 세포 또는 조직에 비경구로 투여하는 것을 포함한다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 대상체에서 생물학적 반응을 유도하기에 유효한 양이다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 대상체의 세포 또는 조직에 생물학적 효과를 갖기에 유효한 양이다. 일부 실시 형태에서, 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물은 담체를 포함한다. 일부 실시 형태에서, 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물은 희석제를 포함하고 임의의 담체가 없다.In some embodiments, the delivery method is an in vivo method. For example, a method of delivering a circular polyribonucleotide as described herein may include parenterally delivering a pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product as described herein to a subject in need thereof. Including administration. As another example, a method of delivering a circular polyribonucleotide to a cell or tissue of a subject includes parenterally administering a pharmaceutical composition, pharmaceutical drug substance or pharmaceutical drug product as described herein to the cell or tissue. . In some embodiments, the circular polyribonucleotide is in an amount effective to induce a biological response in the subject. In some embodiments, the circular polyribonucleotide is in an amount effective to have a biological effect on the cells or tissues of the subject. In some embodiments, the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product as described herein includes a carrier. In some embodiments, the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product as described herein includes a diluent and is free of any carrier.
일부 실시 형태에서 약제학적 조성물, 약제학적 약물 물질, 또는 약제학적 약물 생성물은 비경구로 투여된다. 일부 실시 형태에서, 약제학적 조성물, 약제학적 약물 물질, 또는 약제학적 약물 생성물은 정맥내, 동맥내, 복강내, 피내, 두개내, 척추강내, 림프내, 피하, 또는 근육내로 투여된다. 일부 실시 형태에서, 비경구 투여는 정맥내, 근육내, 안과적, 피하, 피내 또는 국소적으로 시행된다.In some embodiments the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product is administered parenterally. In some embodiments, the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product is administered intravenously, intraarterially, intraperitoneally, intradermally, intracranially, intrathecally, intralymphally, subcutaneously, or intramuscularly. In some embodiments, parenteral administration is administered intravenously, intramuscularly, ophthalmically, subcutaneously, intradermally, or topically.
일부 실시 형태에서, 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물은 근육내 투여된다. 일부 실시 형태에서, 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물은 피하 투여된다. 일부 실시 형태에서, 본원에 기재된 바와 같은 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물은 국소적으로 투여된다. 일부 실시 형태에서, 약제학적 조성물, 약제학적 약물 물질, 또는 약제학적 약물 생성물은 기관내 투여된다.In some embodiments, the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product as described herein is administered intramuscularly. In some embodiments, the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product as described herein is administered subcutaneously. In some embodiments, the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product as described herein is administered topically. In some embodiments, the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product is administered intratracheally.
일부 실시 형태에서 약제학적 조성물, 약제학적 약물 물질 또는 약제학적 약물 생성물은 주사에 의해 투여된다. 투여는 전신 투여 또는 국소 투여가 될 수 있다. 일부 실시 형태에서, 본원에 기재된 바와 같은 전달 방법 중 임의의 것은 담체를 사용하여 수행된다. 일부 실시 형태에서, 본원에 기재된 바와 같은 임의의 전달 방법은 담체 또는 세포 침투제의 보조 없이 수행된다.In some embodiments the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product is administered by injection. Administration can be systemic or topical. In some embodiments, any of the delivery methods as described herein are performed using a carrier. In some embodiments, any of the delivery methods as described herein are performed without the assistance of a carrier or cell permeating agent.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드 또는 원형 폴리리보뉴클레오티드로부터 번역된 생성물은 투여 단계 후 적어도 1일, 적어도 2일, 적어도 3일, 적어도 4일, 또는 적어도 5일째에 세포, 조직, 또는 대상체에서 검출된다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드 또는 원형 폴리리보뉴클레오티드로부터 번역된 생성물의 존재는 투여 단계 전에 세포, 조직, 또는 대상체에서 평가된다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드 또는 원형 폴리리보뉴클레오티드로부터 번역된 생성물의 존재는 투여 단계 후에 세포, 조직, 또는 대상체에서 평가된다.In some embodiments, the circular polyribonucleotide or the product translated from the circular polyribonucleotide is in the cell, tissue, or subject at least 1 day, at least 2 days, at least 3 days, at least 4 days, or at least 5 days after the administering step. It is detected. In some embodiments, the presence of a circular polyribonucleotide or a product translated from a circular polyribonucleotide is assessed in the cell, tissue, or subject prior to the administration step. In some embodiments, the presence of a circular polyribonucleotide or a product translated from a circular polyribonucleotide is assessed in the cell, tissue, or subject after the administration step.
제형Formulation
본 개시내용의 일부 실시 형태에서, 본원에 기재된 원형 폴리리보뉴클레오티드는 조성물, 예를 들어, 세포, 식물, 무척추 동물, 비-인간 척추 동물, 또는 인간 대상체에의 전달을 위한 조성물, 예를 들어, 농업, 수의학, 또는 약제학적 조성물로 제형화될 수 있다. 일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 약제학적 조성물로 제형화된다. 일부 실시 형태에서, 조성물은 원형 폴리리보뉴클레오티드 및 희석제, 담체, 보조제, 또는 이들의 조합을 포함한다. 특정 실시 형태에서, 조성물은 본원에 기재된 원형 폴리리보뉴클레오티드 및 담체 또는 임의의 담체가 없는 희석제를 포함한다. 일부 실시 형태에서, 임의의 담체가 없는 희석제를 갖는 원형 폴리리보뉴클레오티드를 포함하는 조성물은 대상체에의 원형 폴리리보뉴클레오티드의 네이키드 전달을 위해 사용된다.In some embodiments of the disclosure, circular polyribonucleotides described herein are used in compositions, e.g., for delivery to cells, plants, invertebrates, non-human vertebrates, or human subjects, e.g. It can be formulated into agricultural, veterinary, or pharmaceutical compositions. In some embodiments, circular polyribonucleotides are formulated into pharmaceutical compositions. In some embodiments, the composition includes a circular polyribonucleotide and a diluent, carrier, adjuvant, or combinations thereof. In certain embodiments, the composition comprises a circular polyribonucleotide described herein and a carrier or a diluent without any carrier. In some embodiments, compositions comprising circular polyribonucleotides with a diluent without any carrier are used for naked delivery of circular polyribonucleotides to a subject.
약제학적 조성물은 선택적으로 하나 이상의 추가의 활성 물질, 예를 들어, 치료적 및/또는 예방적 활성 물질을 포함할 수 있다. 약제학적 조성물은 선택적으로 본원에 기재된 조성물(예를 들어, 원형 폴리리보뉴클레오티드를 포함하는 조성물, 예컨대 미국 식품의약국(FDA)에 의해 승인되고 불활성 성분 데이터베이스에 열거된 불활성 성분 중 임의의 하나)에 대한 비히클 또는 매질로서 역할을 하는 불활성 물질을 포함할 수 있다. 본 발명의 약제학적 조성물은 멸균이고/이거나 발열원이 없을 수 있다. 약제학적 작용제의 제형화 및/또는 제조에 있어서 일반적인 고려사항은 예를 들어, 문헌[Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005(본원에 참조로 포함됨)]에서 확인할 수 있다. 불활성 물질의 비제한적인 예는 용매, 수성 용매, 비-수성 용매, 분산 매질, 희석제, 분산액, 현탁 조제, 표면 활성제, 등장성제, 증점제, 유화제, 보존제, 중합체, 펩티드, 단백질, 세포, 히알루로니다제, 분산제, 과립화제, 붕해제, 결합제, 완충제(예를 들어, 포스페이트 완충 염수(PBS)), 윤활제, 오일 및 이들의 혼합물을 포함한다.The pharmaceutical composition may optionally comprise one or more further active substances, for example therapeutic and/or prophylactic active substances. The pharmaceutical composition may optionally include a composition described herein (e.g., a composition comprising a circular polyribonucleotide, such as any one of the inactive ingredients approved by the U.S. Food and Drug Administration (FDA) and listed in the Inert Ingredient Database). It may contain an inert material that acts as a vehicle or medium for the Pharmaceutical compositions of the invention may be sterile and/or pyrogen-free. General considerations in the formulation and/or manufacture of pharmaceutical agents can be found, for example, in Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005 (incorporated herein by reference). You can. Non-limiting examples of inert substances include solvents, aqueous solvents, non-aqueous solvents, dispersion media, diluents, dispersions, suspending aids, surface active agents, isotonic agents, thickeners, emulsifiers, preservatives, polymers, peptides, proteins, cells, hyaluronic acid. Nidase, dispersing agent, granulating agent, disintegrant, binder, buffering agent (e.g., phosphate buffered saline (PBS)), lubricant, oil and mixtures thereof.
본원에서 제공된 약제학적 조성물의 설명은 주로 인간에의 투여에 적합한 약제학적 조성물에 관한 것이지만, 당업자에 의해 이러한 조성물이 일반적으로 임의의 다른 동물, 예를 들어, 비-인간 동물, 예를 들어, 비-인간 포유류에의 투여에 적합하다는 것이 이해될 것이다. 조성물을 다양한 동물에의 투여에 적합하게 만들기 위한 인간에의 투여에 적합한 약제학적 조성물의 변형은 널리 이해되어 있으며, 통상의 기술을 갖는 수의학 약리학자는 존재하는 경우, 단지 통상적인 실험으로 이러한 변형을 설계하고/거나 수행할 수 있다. 약제학적 조성물의 투여가 고려되는 대상체는 인간 및/또는 다른 영장류; 소, 돼지, 말, 양, 고양이, 개, 마우스 및/또는 래트와 같은 상업적으로 관련된 포유류를 포함하는 포유류; 및/또는 가금류, 닭, 오리, 거위 및/또는 칠면조와 같은 상업적으로 관련된 조류를 포함하는 조류를 포함하지만, 이에 한정되는 것은 아니다.Although the description of pharmaceutical compositions provided herein primarily relates to pharmaceutical compositions suitable for administration to humans, those skilled in the art will generally understand that such compositions are suitable for use in any other animal, e.g., non-human animal, e.g. -It will be understood that it is suitable for administration to human mammals. Modifications of pharmaceutical compositions suitable for administration to humans to render the compositions suitable for administration to a variety of animals are well understood, and veterinary pharmacologists of ordinary skill will be able to design such modifications, if any, using only routine experimentation. and/or can be performed. Subjects contemplated for administration of the pharmaceutical composition include humans and/or other primates; Mammals, including commercially relevant mammals such as cattle, pigs, horses, sheep, cats, dogs, mice and/or rats; and/or birds, including commercially relevant birds such as poultry, chickens, ducks, geese, and/or turkeys.
본원에 기재된 약제학적 조성물의 제형은 약리학 분야에 알려져 있거나 향후 개발될 임의의 방법에 의해 제조될 수 있다. 일반적으로, 이러한 제조 방법은 활성 성분을 부형제 및/또는 하나 이상의 다른 보조 성분과 회합시키고, 그런 다음 필요하고/하거나 바람직한 경우, 제품을 분할, 성형 및/또는 포장하는 단계를 포함한다.Formulations of the pharmaceutical compositions described herein may be prepared by any method known or hereafter developed in the art of pharmacology. Generally, these manufacturing methods involve the steps of bringing the active ingredient into association with excipients and/or one or more other auxiliary ingredients and then, if necessary and/or desirable, dividing, molding and/or packaging the product.
일부 실시 형태에서, 조제물에 존재하는 원형 폴리리보뉴클레오티드 분자의 양에 대한 참조 기준은 약제학적 조제물 중 총 리보뉴클레오티드 분자의 적어도 30%(w/w), 40%(w/w), 50%(w/w), 60%(w/w), 70%(w/w), 80%(w/w), 85%(w/w), 90%(w/w), 91%(w/w), 92%(w/w), 93%(w/w), 94%(w/w), 95%(w/w), 96%(w/w), 97%(w/w), 98%(w/w), 99 %(w/w), 99.1%(w/w), 99.2%(w/w), 99.3%(w/w), 99.4%(w/w), 99.5%(w/w), 99.6%(w/w), 99.7%(w/w), 99.8%(w/w), 99.9%(w/w), 또는 100%(w/w)이다.In some embodiments, the reference standard for the amount of circular polyribonucleotide molecules present in the formulation is at least 30% (w/w), 40% (w/w), 50% of the total ribonucleotide molecules in the pharmaceutical formulation. %(w/w), 60%(w/w), 70%(w/w), 80%(w/w), 85%(w/w), 90%(w/w), 91%( w/w), 92%(w/w), 93%(w/w), 94%(w/w), 95%(w/w), 96%(w/w), 97%(w/ w), 98%(w/w), 99 %(w/w), 99.1%(w/w), 99.2%(w/w), 99.3%(w/w), 99.4%(w/w) , 99.5%(w/w), 99.6%(w/w), 99.7%(w/w), 99.8%(w/w), 99.9%(w/w), or 100%(w/w). .
일부 실시 형태에서, 조제물에 존재하는 선형 폴리리보뉴클레오티드 분자의 양에 대한 참조 기준은 1 ng/ml, 5 ng/ml, 10 ng/ml, 15 ng/ml, 20 ng/ml, 25 ng/ml, 30 ng/ml, 35 ng/ml, 40 ng/ml, 50 ng/ml, 60 ng/ml, 70 ng/ml, 80 ng/ml, 90 ng/ml, 100 ng/ml, 200 ng/ml, 300 ng/ml, 400 ng/ml, 500 ng/ml, 600 ng/ml, 1 μg/ml, 10 μg/ml, 50 μg/ml, 100 μg/ml, 200 g/ml, 300 μg/ml, 400 μg/ml, 500 μg/ml, 600 μg/ml, 700 μg/ml, 800 μg/ml, 900 μg/ml, 1 mg/ml, 1.5 mg/ml 또는 2 mg/ml 이하의 선형 폴리리보뉴클레오티드 분자의 존재이다.In some embodiments, the reference standard for the amount of linear polyribonucleotide molecules present in the preparation is 1 ng/ml, 5 ng/ml, 10 ng/ml, 15 ng/ml, 20 ng/ml, 25 ng/ml. ml, 30 ng/ml, 35 ng/ml, 40 ng/ml, 50 ng/ml, 60 ng/ml, 70 ng/ml, 80 ng/ml, 90 ng/ml, 100 ng/ml, 200 ng/ml ml, 300 ng/ml, 400 ng/ml, 500 ng/ml, 600 ng/ml, 1 μg/ml, 10 μg/ml, 50 μg/ml, 100 μg/ml, 200 g/ml, 300 μg/ ml, 400 μg/ml, 500 μg/ml, 600 μg/ml, 700 μg/ml, 800 μg/ml, 900 μg/ml, 1 mg/ml, 1.5 mg/ml, or 2 mg/ml or less linear poly It is the presence of ribonucleotide molecules.
일부 실시 형태에서, 조제물에 존재하는 선형 폴리리보뉴클레오티드 분자의 양에 대한 참조 기준은 약제학적 조제물 중 총 리보뉴클레오티드 분자의 0.5%(w/w), 1%(w/w), 2%(w/w), 5%(w/w), 10%(w/w), 15%(w/w), 20%(w/w), 25%(w/w), 30%(w/w), 40%(w/w), 50%(w/w) 이하의 선형 폴리리보뉴클레오티드 분자이다.In some embodiments, the reference standard for the amount of linear polyribonucleotide molecules present in the formulation is 0.5% (w/w), 1% (w/w), 2% of the total ribonucleotide molecules in the pharmaceutical formulation. (w/w), 5%(w/w), 10%(w/w), 15%(w/w), 20%(w/w), 25%(w/w), 30%(w) /w), 40% (w/w), 50% (w/w) or less of linear polyribonucleotide molecules.
일부 실시 형태에서, 조제물에 존재하는 닉킹된 폴리리보뉴클레오티드 분자의 양에 대한 참조 기준은 약제학적 조제물 중 총 리보뉴클레오티드 분자의 0.5%(w/w), 1%(w/w), 2%(w/w), 5%(w/w), 10%(w/w), 또는 15%(w/w) 이하의 닉킹된 폴리리보뉴클레오티드 분자이다.In some embodiments, the reference standard for the amount of nicked polyribonucleotide molecules present in the formulation is 0.5% (w/w), 1% (w/w), 2% of the total ribonucleotide molecules in the pharmaceutical formulation. % (w/w), 5% (w/w), 10% (w/w), or 15% (w/w) or less of nicked polyribonucleotide molecules.
일부 실시 형태에서, 조제물에 존재하는 결합된 닉킹 및 선형 폴리리보뉴클레오티드 분자의 양에 대한 참조 기준은 약제학적 조제물 중 총 리보뉴클레오티드 분자의 0.5%(w/w), 1%(w/w), 2%(w/w), 5%(w/w), 10%(w/w), 15%(w/w), 20%(w/w), 25%(w/w), 30%(w/w), 40%(w/w), 50%(w/w) 이하의 결합된 닉킹 및 선형 폴리리보뉴클레오티드 분자이다. 일부 실시 형태에서, 약제학적 조제물은 최종 원형 폴리리보뉴클레오티드 약물 생성물의 중간 약제학적 조제물이다. 일부 실시 형태에서, 약제학적 조제물은 약물 물질 또는 활성 약제학적 성분(API)이다. 일부 실시 형태에서, 약제학적 조제물은 대상체에게 투여하기 위한 약물 생성물이다.In some embodiments, the reference standard for the amount of bound nicked and linear polyribonucleotide molecules present in the formulation is 0.5% (w/w), 1% (w/w) of total ribonucleotide molecules in the pharmaceutical formulation. ), 2%(w/w), 5%(w/w), 10%(w/w), 15%(w/w), 20%(w/w), 25%(w/w), No more than 30% (w/w), 40% (w/w), 50% (w/w) of linked nicked and linear polyribonucleotide molecules. In some embodiments, the pharmaceutical formulation is an intermediate pharmaceutical formulation of the final circular polyribonucleotide drug product. In some embodiments, the pharmaceutical preparation is a drug substance or active pharmaceutical ingredient (API). In some embodiments, the pharmaceutical preparation is a drug product for administration to a subject.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드의 조제물은 (선형 RNA의 환원 전에, 환원 동안, 또는 환원 후에) DNA, 단백질 오염(예를 들어, 숙주 세포 단백질 또는 단백질 공정 불순물과 같은 세포 단백질), 내독소, 모노뉴클레오티드 분자, 및/또는 공정-관련 불순물을 실질적으로 제거하기 위해 추가로 처리된다.In some embodiments, the preparation of circular polyribonucleotides (before, during, or after reduction of linear RNA) contains DNA, protein contamination (e.g., cellular proteins such as host cell proteins or protein processing impurities), It is further processed to substantially remove toxins, mononucleotide molecules, and/or process-related impurities.
일부 실시 형태에서, 본원에 개시된 약제학적 제형은 (i) 본원에 개시된 화합물(예를 들어, 원형 폴리리보뉴클레오티드); (ii) 완충제; (iii) 비-이온성 세제; (iv) 긴장성제; 및/또는 (v) 안정화제를 포함할 수 있다. 일부 실시 형태에서, 본원에 개시된 약제학적 제형은 안정한 액체 약제학적 제형이다. 일부 실시 형태에서, 본원에 개시된 약제학적 제형은 프로타민 또는 프로타민 염(예를 들어, 프로타민 설페이트)을 포함한다.In some embodiments, pharmaceutical formulations disclosed herein comprise (i) a compound disclosed herein (e.g., a circular polyribonucleotide); (ii) buffering agent; (iii) non-ionic detergent; (iv) tonic agents; and/or (v) a stabilizer. In some embodiments, the pharmaceutical formulations disclosed herein are stable liquid pharmaceutical formulations. In some embodiments, the pharmaceutical formulations disclosed herein include protamine or a protamine salt (e.g., protamine sulfate).
보존제preservative
본원에서 제공된 조성물 또는 약제학적 조성물은 단회 투여를 위한 물질을 포함할 수 있거나, 다중 투여를 위한 물질(예를 들어, "다중용량" 키트)을 포함할 수 있다. 폴리리보뉴클레오티드는 선형 또는 원형 형태 중 어느 하나로 존재할 수 있다. 조성물 또는 약제학적 조성물은 티오메르살 또는 2-페녹시에탄올과 같은 하나 이상의 보존제를 포함할 수 있다. 보존제는 사용 동안 미생물의 오염을 방지하기 위해 사용될 수 있다. 적합한 보존제는 벤즈알코늄 클로라이드, 티메로살, 클로로부탄올, 메틸 파라벤, 프로필 파라벤, 페닐에틸 알코올, 에데테이트 디소듐, 소르브산, 오나머 M, 또는 당업자에게 알려져 있는 다른 작용제를 포함한다. 안과용 제품에서, 예를 들어, 이러한 보존제는 0.004% 내지 0.02%의 수준으로 사용될 수 있다. 본원에 기재된 조성물에서 보존제, 예를 들어, 벤즈알코늄 클로라이드는 0.001 중량% 내지 0.01 중량% 미만, 예를 들어, 0.001 중량% 내지 0.008 중량%, 바람직하게는 약 0.005 중량%의 수준으로 사용될 수 있다.Compositions or pharmaceutical compositions provided herein may include materials for single administration, or may include materials for multiple administrations (e.g., “multi-dose” kits). Polyribonucleotides can exist in either linear or circular forms. The composition or pharmaceutical composition may contain one or more preservatives such as thiomersal or 2-phenoxyethanol. Preservatives may be used to prevent microbial contamination during use. Suitable preservatives include benzalkonium chloride, thimerosal, chlorobutanol, methyl paraben, propyl paraben, phenylethyl alcohol, edetate disodium, sorbic acid, Onamer M, or other agents known to those skilled in the art. In ophthalmic products, for example, these preservatives may be used at levels of 0.004% to 0.02%. Preservatives, such as benzalkonium chloride, in the compositions described herein may be used at levels of 0.001% to less than 0.01% by weight, such as 0.001% to 0.008% by weight, preferably about 0.005% by weight. .
폴리리보뉴클레오티드는 주변 환경에서 풍부할 수 있는 RN아제에 감수성일 수 있다. 본원에서 제공된 조성물은 RN아제 활성을 억제하고, 그에 의해 폴리리보뉴클레오티드를 분해로부터 보존하는 시약을 포함할 수 있다. 일부 경우에, 조성물 또는 약제학적 조성물은 당업자에게 알려져 있는 임의의 RN아제 억제제를 포함한다. 대안적으로 또는 추가로, 본원에서 제공된 조성물에서 폴리리보뉴클레오티드, 및 세포-침투제 및/또는 약제학적으로 허용되는 희석제 또는 담체, 비히클, 부형제, 또는 다른 시약은 RN아제가 없는 환경에서 제조될 수 있다. 조성물은 RN아제가 없는 환경에서 제형화될 수 있다.Polyribonucleotides may be susceptible to RNases, which may be abundant in the surrounding environment. Compositions provided herein may include reagents that inhibit RNase activity, thereby preserving polyribonucleotides from degradation. In some cases, the composition or pharmaceutical composition includes any RNase inhibitor known to those skilled in the art. Alternatively or additionally, the polyribonucleotides, and cell-penetrating agents and/or pharmaceutically acceptable diluents or carriers, vehicles, excipients, or other reagents in the compositions provided herein can be prepared in an RNase-free environment. . The composition can be formulated in an RNase-free environment.
일부 경우에, 본원에서 제공된 조성물은 멸균될 수 있다. 조성물은 당업계에 알려져 있는 적합한 비히클에서 멸균 용액 또는 현탁액으로서 제형화될 수 있다. 조성물은 통상적으로 알려져 있는 멸균 기술에 의해 멸균될 수 있으며, 예를 들어, 조성물은 멸균 여과될 수 있다.In some cases, compositions provided herein can be sterilized. Compositions may be formulated as sterile solutions or suspensions in suitable vehicles known in the art. The composition may be sterilized by commonly known sterilization techniques, for example, the composition may be sterile filtered.
염salt
일부 경우에, 본원에서 제공된 조성물 또는 약제학적 조성물은 하나 이상의 염을 포함한다. 긴장성을 제어하기 위해, 생리학적 염, 예컨대 나트륨 염은 본원에서 제공된 조성물에 포함될 수 있다. 다른 염은 염화칼륨, 인산이수소칼륨, 인산이나트륨, 및/또는 염화마그네슘 등을 포함할 수 있다. 일부 경우에, 조성물은 하나 이상의 약제학적으로 허용되는 염으로 제형화된다. 하나 이상의 약제학적으로 허용되는 염은 무기 이온, 예컨대, 예를 들어, 나트륨, 칼륨, 칼슘, 마그네슘 이온 등의 것들을 포함할 수 있다. 이러한 염은 무기 또는 유기 산, 예컨대 염산, 브롬화수소산, 인산, 질산, 황산, 메탄술폰산, p-톨루엔술폰산, 아세트산, 푸마르산, 숙신산, 락트산, 만델산, 말산, 시트르산, 타르타르산, 또는 말레산과의 염을 포함할 수 있다. 폴리리보뉴클레오티드는 선형 또는 원형 형태 중 어느 하나로 존재할 수 있다.In some cases, the compositions or pharmaceutical compositions provided herein include one or more salts. To control tonicity, physiological salts, such as sodium salts, may be included in the compositions provided herein. Other salts may include potassium chloride, potassium dihydrogen phosphate, disodium phosphate, and/or magnesium chloride, etc. In some cases, the composition is formulated with one or more pharmaceutically acceptable salts. One or more pharmaceutically acceptable salts may include inorganic ions such as, for example, sodium, potassium, calcium, magnesium ions, etc. These salts are salts with inorganic or organic acids, such as hydrochloric acid, hydrobromic acid, phosphoric acid, nitric acid, sulfuric acid, methanesulfonic acid, p-toluenesulfonic acid, acetic acid, fumaric acid, succinic acid, lactic acid, mandelic acid, malic acid, citric acid, tartaric acid, or maleic acid. may include. Polyribonucleotides can exist in either linear or circular forms.
완충제/pHBuffer/pH
본원에서 제공된 조성물 또는 약제학적 조성물은 하나 이상의 완충제, 예컨대 트리스 완충제; 보레이트 완충제; 숙시네이트 완충제; 히스티딘 완충제(예를 들어, 수산화알루미늄 보조제를 가짐); 또는 시트레이트 완충제를 포함할 수 있다. 완충제는, 일부 경우에, 5 내지 20 mM 범위로 포함된다.The compositions or pharmaceutical compositions provided herein may contain one or more buffering agents, such as Tris buffer; borate buffer; succinate buffer; histidine buffer (eg, with aluminum hydroxide adjuvant); Or it may include a citrate buffer. Buffering agents, in some cases, are included in the range of 5 to 20 mM.
본원에서 제공된 조성물 또는 약제학적 조성물은 약 5.0 내지 약 8.5, 약 6.0 내지 약 8.0, 약 6.5 내지 약 7.5, 또는 약 7.0 내지 약 7.8의 pH를 가질 수 있다. 조성물 또는 약제학적 조성물은 약 7의 pH를 가질 수 있다. 폴리리보뉴클레오티드는 선형 또는 원형 형태 중 어느 하나로 존재할 수 있다.The compositions or pharmaceutical compositions provided herein may have a pH of from about 5.0 to about 8.5, from about 6.0 to about 8.0, from about 6.5 to about 7.5, or from about 7.0 to about 7.8. The composition or pharmaceutical composition may have a pH of about 7. Polyribonucleotides can exist in either linear or circular forms.
세정제/계면활성제Detergent/Surfactant
본원에서 제공된 조성물 또는 약제학적 조성물은 의도되는 투여 경로에 따라, 하나 이상의 세정제 및/또는 계면활성제, 예를 들어, 폴리옥시에틸렌 소르비탄 에스테르 계면활성제(통상적으로 "Tween"으로 지칭됨), 예를 들어, 폴리소르베이트 20 및 폴리소르베이트 80; DOWFAX™ 상표명 하에 판매되는 에틸렌 옥시드(EO), 프로필렌 옥시드(PO), 및/또는 부틸렌 옥시드(BO)의 공중합체, 예컨대 선형 EO/PO 블록 공중합체; 반복하는 에톡시(옥시-1,2-에탄디일) 기의 수에 있어서 달라질 수 있는 옥톡시놀, 예를 들어, 옥톡시놀-9(트리톤 X-100, 또는 t-옥틸페녹시폴리에톡시에탄올); (옥틸페녹시)폴리에톡시에탄올(IGEPAL CA-630/NP-40); 인지질, 예컨대 포스파티딜콜린(레시틴); 노닐페놀 에톡실레이트, 예컨대 Tergitol™ NP 시리즈; 라우릴, 세틸, 스테아릴 및 올레일 알콜로부터 유래된 폴리옥시에틸렌 지방 에테르(Brij 계면활성제로 알려짐), 예컨대 트리에틸렌글리콜 모노라우릴 에테르(Brij 30); 및 소르비탄 에스테르(통상적으로 "SPAN"으로 알려짐), 예컨대 소르비탄 트리올레에이트(Span 85) 및 소르비탄 모노라우레이트, 옥톡시놀(예컨대 옥톡시놀-9(트리톤 X-100) 또는 t-옥틸페녹시폴리에톡시에탄올), 세틸 트리메틸 암모늄 브로마이드("CTAB"), 또는 나트륨 데옥시콜레이트를 포함할 수 있다. 하나 이상의 세정제 및/또는 계면활성제는 단지 흔적량으로 존재할 수 있다. 일부 경우에, 조성물은 1 mg/ml 미만의 각각의 옥톡시놀-10 및 폴리소르베이트 80을 포함할 수 있다. 비-이온성 계면활성제는 본원에서 사용될 수 있다. 계면활성제는 그들의 "HLB"(친수성/친지질성 균형)에 의해 분류될 수 있다. 일부 경우에, 계면활성제는 적어도 10, 적어도 15, 및/또는 적어도 16의 HLB를 갖는다. 폴리리보뉴클레오티드는 선형 또는 원형 형태 중 어느 하나로 존재할 수 있다.Depending on the intended route of administration, the compositions or pharmaceutical compositions provided herein may be formulated with one or more detergents and/or surfactants, such as polyoxyethylene sorbitan ester surfactants (commonly referred to as "Tween"), such as For example,
희석제diluent
일부 실시 형태에서, 본 개시내용의 조성물은 원형 폴리리보뉴클레오티드 및 희석제를 포함한다. 일부 실시 형태에서, 본 개시내용의 조성물은 선형 폴리리보뉴클레오티드 및 희석제를 포함한다.In some embodiments, compositions of the present disclosure include circular polyribonucleotides and a diluent. In some embodiments, compositions of the present disclosure include a linear polyribonucleotide and a diluent.
희석제는 비-담체 부형제일 수 있다. 비-담체 부형제는 본원에 기재된 바와 같은 조성물, 예컨대 원형 폴리리보뉴클레오티드에 대한 비히클 또는 매질로서 역할을 한다. 비-담체 부형제는 본원에 기재된 바와 같은 조성물, 예컨대 선형 폴리리보뉴클레오티드에 대한 비히클 또는 매질로서 역할을 한다. 비-담체 부형제의 비제한적인 예는 용매, 수성 용매, 비-수성 용매, 분산 매질, 희석제, 분산액, 현탁 조제, 표면 활성제, 등장성제, 증점제, 유화제, 보존제, 중합체, 펩티드, 단백질, 세포, 히알루로니다제, 분산제, 과립화제, 붕해제, 결합제, 완충제(예를 들어, 포스페이트 완충 염수(PBS)), 윤활제, 오일, 및 이들의 혼합물을 포함한다. 비-담체 부형제는 세포-관통 효과를 나타내지 않는 미국 식품의약국(FDA)에 의해 승인되고 불활성 성분 데이터베이스에 열거된 불활성 성분 중 임의의 하나일 수 있다. 비-담체 부형제는 비-인간 동물에의 투여에 적합한, 예를 들어, 수의학 용도에 적합한 임의의 불활성 성분일 수 있다. 조성물을 다양한 동물에의 투여에 적합하게 만들기 위한 인간에의 투여에 적합한 조성물의 변형은 널리 이해되어 있으며, 통상의 기술을 갖는 수의학 약리학자는 존재하는 경우, 단지 통상적인 실험으로 이러한 변형을 설계하고/거나 수행할 수 있다.The diluent may be a non-carrier excipient. Non-carrier excipients serve as a vehicle or medium for compositions as described herein, such as circular polyribonucleotides. Non-carrier excipients serve as a vehicle or medium for compositions as described herein, such as linear polyribonucleotides. Non-limiting examples of non-carrier excipients include solvents, aqueous solvents, non-aqueous solvents, dispersion media, diluents, dispersions, suspending aids, surface active agents, isotonic agents, thickeners, emulsifiers, preservatives, polymers, peptides, proteins, cells, Includes hyaluronidase, dispersants, granulating agents, disintegrants, binders, buffers (e.g., phosphate buffered saline (PBS)), lubricants, oils, and mixtures thereof. The non-carrier excipient may be any of the inert ingredients listed in the Inert Ingredient Database and approved by the Food and Drug Administration (FDA) that do not exhibit cell-penetrating effects. A non-carrier excipient can be any inert ingredient suitable for administration to non-human animals, for example, for veterinary use. Modifications of compositions suitable for administration to humans to render the compositions suitable for administration to a variety of animals are well understood, and veterinary pharmacologists of ordinary skill will be able to design such modifications, if any, by no more than routine experimentation/ It can be done either.
일부 실시 형태에서, 원형 폴리리보뉴클레오티드는 예컨대 희석제를 포함하는 네이키드 전달 제형으로서 전달될 수 있다. 네이키드 전달 제형은 담체의 보조 없이 및 원형 폴리리보뉴클레오티드, 캡핑된 폴리리보뉴클레오티드, 또는 이들의 복합체의 변형 또는 부분적 또는 완전한 캡슐화 없이 원형 폴리리보뉴클레오티드를 세포에 전달한다.In some embodiments, circular polyribonucleotides can be delivered as a naked delivery formulation, such as containing a diluent. Naked delivery formulations deliver circular polyribonucleotides to cells without the assistance of a carrier and without modification or partial or complete encapsulation of the circular polyribonucleotide, capped polyribonucleotide, or complexes thereof.
네이키드 전달 제형은 담체가 없는 제형이고, 여기서 원형 폴리리보뉴클레오티드는 세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없거나, 원형 폴리리보뉴클레오티드의 부분적으로 또는 완전히 캡슐화 되지 않는다. 일부 실시 형태에서, 세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없는 원형 폴리리보뉴클레오티드는 단백질, 소분자, 입자, 중합체, 또는 생체중합체에 공유적으로 결합되지 않는 폴리리보뉴클레오티드이다. 세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없는 원형 폴리리보뉴클레오티드는 변형된 포스페이트 기를 함유하지 않는다. 예를 들어, 세포로의 전달을 보조하는 모이어티에 결합하는 공유 변형이 없는 원형 폴리리보뉴클레오티드는 포스포로티오에이트, 포스포로셀레네이트, 보라노포스페이트, 보라노포스페이트 에스테르, 히드로겐 포스포네이트, 포스포르아미데이트, 포스포로디아미데이트, 알킬 또는 아릴 포스포네이트, 또는 포스포트리에스테르를 함유하지 않는다.Naked delivery formulations are carrier-free formulations in which the circular polyribonucleotide is free of covalent modifications that bind moieties that assist delivery to cells or is not partially or fully encapsulated in the circular polyribonucleotide. In some embodiments, a circular polyribonucleotide free of covalent modifications that binds to a moiety that assists delivery to a cell is a polyribonucleotide that is not covalently bound to a protein, small molecule, particle, polymer, or biopolymer. Circular polyribonucleotides without covalent modifications that bind to moieties that aid delivery to cells do not contain modified phosphate groups. For example, circular polyribonucleotides without covalent modifications that bind to moieties that aid delivery to cells include phosphorothioate, phosphoroselenate, boranophosphate, boranophosphate ester, hydrogen phosphonate, and phosphorothioate. Contains no foramidates, phosphorodiamidates, alkyl or aryl phosphonates, or phosphotriesters.
일부 실시 형태에서, 네이키드 전달 제형은 형질감염 시약, 양이온성 담체, 탄수화물 담체, 나노입자 담체, 또는 단백질 담체 중 임의의 것 또는 전부가 없다. 일부 실시 형태에서, 네이키드 전달 제형은 프토글리코겐 옥테닐 숙시네이트, 피토글리코겐 베타-덱스트린, 무수물-변형된 피토글리코겐 베타-덱스트린, 리포펙타민, 폴리에틸렌이민, 폴리(트리메틸렌이민), 폴리(테트라메틸렌이민), 폴리프로필렌이민, 아미노글리코시드-폴리아민, 디데옥시-디아미노-b-시클로덱스트린, 스페르민, 스페르미딘, 폴리(2-디메틸아미노)에틸 메타크릴레이트, 폴리(리신), 폴리(히스티딘), 폴리(아르기닌), 양이온화 젤라틴, 덴드리머, 키토산, 1,2-디올레오일-3-트리메틸암모늄-프로판(DOTAP), N-[1-(2,3-디올레오일옥시)프로필]-N,N,N-트리메틸암모늄 클로라이드(DOTMA), 1-[2-(올레오일옥시)에틸]-2-올레일-3-(2-히드록시에틸)이미다졸리늄 클로라이드(DOTIM), 2,3-디올레일옥시-N-[2(스페르민카르복스아미도)에틸]-N,N-디메틸-1-프로판아미늄 트리플루오로아세테이트(DOSPA), 3B-[N-(-디메틸아미노에탄)-카르바모일]콜레스테롤 히드로클로라이드(DC-콜레스테롤 HCl), 디헵타데실아미도글리실 스페르미딘(DOGS), N,N-디스테아릴-N,N-디메틸암모늄 브로마이드(DDAB), N-(1,2-디미리스틸옥시프로프-3-일)-N,N-디메틸-N-히드록시에틸 암모늄 브로마이드(DMRIE), N,N-디올레일-N,N-디메틸암모늄 클로라이드(DODAC), 인간 혈청 알부민(HSA), 저-밀도 지단백질(LDL), 고-밀도 지단백질(HDL), 또는 글로불린이 없다.In some embodiments, the naked delivery formulation is free of any or all of the following: transfection reagent, cationic carrier, carbohydrate carrier, nanoparticle carrier, or protein carrier. In some embodiments, the naked delivery formulation is phytoglycogen octenyl succinate, phytoglycogen beta-dextrin, anhydride-modified phytoglycogen beta-dextrin, lipofectamine, polyethyleneimine, poly(trimethyleneimine), poly(tetra) methyleneimine), polypropyleneimine, aminoglycoside-polyamine, dideoxy-diamino-b-cyclodextrin, spermine, spermidine, poly(2-dimethylamino)ethyl methacrylate, poly(lysine), Poly(histidine), poly(arginine), cationized gelatin, dendrimer, chitosan, 1,2-dioleoyl-3-trimethylammonium-propane (DOTAP), N-[1-(2,3-dioleoyloxy) )propyl]-N,N,N-trimethylammonium chloride (DOTMA), 1-[2-(oleoyloxy)ethyl]-2-oleyl-3-(2-hydroxyethyl)imidazolinium chloride ( DOTIM), 2,3-dioleyloxy-N-[2(sperminecarboxamido)ethyl]-N,N-dimethyl-1-propanaminium trifluoroacetate (DOSPA), 3B-[N -( -dimethylaminoethane)-carbamoyl]cholesterol hydrochloride (DC-cholesterol HCl), diheptadecylamidoglycyl spermidine (DOGS), N,N-distearyl-N,N-dimethylammonium bromide ( DDAB), N-(1,2-dimyristyloxyprop-3-yl)-N,N-dimethyl-N-hydroxyethyl ammonium bromide (DMRIE), N,N-dioleyl-N,N- There is no dimethylammonium chloride (DODAC), human serum albumin (HSA), low-density lipoprotein (LDL), high-density lipoprotein (HDL), or globulin.
특정 실시 형태에서, 네이키드 전달 제형은 비-담체 부형제를 포함한다. 일부 실시 형태에서, 비-담체 부형제는 세포-관통 효과를 나타내지 않는 불활성 성분을 포함한다. 일부 실시 형태에서, 비-담체 부형제는 완충제, 예를 들어, PBS를 포함한다. 일부 실시 형태에서, 비-담체 부형제는 용매, 비-수성 용매, 희석제, 현탁 조제, 표면 활성제, 등장성제, 증점제, 유화제, 보존제, 중합체, 펩티드, 단백질, 세포, 히알루로니다제, 분산제, 과립화제, 붕해제, 결합제, 완충제, 윤활제, 또는 오일이다.In certain embodiments, naked delivery formulations include non-carrier excipients. In some embodiments, non-carrier excipients include inert ingredients that do not exhibit cell-penetrating effects. In some embodiments, the non-carrier excipient includes a buffering agent, such as PBS. In some embodiments, non-carrier excipients include solvents, non-aqueous solvents, diluents, suspending aids, surface active agents, isotonic agents, thickeners, emulsifiers, preservatives, polymers, peptides, proteins, cells, hyaluronidases, dispersants, granules. It is a topical agent, disintegrant, binder, buffer, lubricant, or oil.
일부 실시 형태에서, 네이키드 전달 제형은 희석제를 포함한다. 희석제는 액체 희석제 또는 고체 희석제일 수 있다. 일부 실시 형태에서, 희석제는 RNA 가용화제, 완충제, 또는 등장성제이다. RNA 가용화제의 예는 물, 에탄올, 메탄올, 아세톤, 포름아미드, 및 2-프로판올을 포함한다. 완충제의 예는 2-(N-모르폴리노)에탄술폰산(MES), 비스-트리스, 2-[(2-아미노-2-옥소에틸)-(카르복시메틸)아미노]아세트산(ADA), N-(2-아세트아미도)-2-아미노에탄술폰산(ACES), 피페라진-N,N'-비스(2-에탄술폰산)(PIPES), 2-[[1,3-디히드록시-2-(히드록시메틸)프로판-2-일]아미노]에탄술폰산(TES), 3-(N-모르폴리노)프로판술폰산(MOPS), 4-(2-히드록시에틸)-1-피페라진에탄술폰산(HEPES), 트리스, 트리신, Gly-Gly, 비신, 또는 포스페이트를 포함한다. 등장성제의 예는 글리세린, 만니톨, 폴리에틸렌 글리콜, 프로필렌 글리콜, 트레할로스, 또는 수크로스를 포함한다.In some embodiments, the naked delivery formulation includes a diluent. The diluent may be a liquid diluent or a solid diluent. In some embodiments, the diluent is an RNA solubilizer, buffer, or isotonic agent. Examples of RNA solubilizers include water, ethanol, methanol, acetone, formamide, and 2-propanol. Examples of buffers include 2-(N-morpholino)ethanesulfonic acid (MES), bis-tris, 2-[(2-amino-2-oxoethyl)-(carboxymethyl)amino]acetic acid (ADA), N- (2-acetamido)-2-aminoethanesulfonic acid (ACES), piperazine-N,N'-bis(2-ethanesulfonic acid) (PIPES), 2-[[1,3-dihydroxy-2- (Hydroxymethyl)propan-2-yl]amino]ethanesulfonic acid (TES), 3-(N-morpholino)propanesulfonic acid (MOPS), 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES), tris, tricine, Gly-Gly, bicine, or phosphate. Examples of isotonic agents include glycerin, mannitol, polyethylene glycol, propylene glycol, trehalose, or sucrose.
담체carrier
일부 실시 형태에서, 본 개시내용의 조성물은 원형 폴리리보뉴클레오티드 및 담체를 포함한다. 일부 실시 형태에서, 본 개시내용의 조성물은 선형 폴리리보뉴클레오티드 및 담체를 포함한다.In some embodiments, compositions of the present disclosure include circular polyribonucleotides and a carrier. In some embodiments, compositions of the present disclosure include linear polyribonucleotides and a carrier.
특정 실시 형태에서, 조성물은 소낭 또는 다른 막-기반 담체에 본원에 기재된 바와 같은 원형 폴리리보뉴클레오티드를 포함한다. 특정 실시 형태에서, 조성물은 소낭 또는 다른 막-기반 담체에 본원에 기재된 바와 같은 선형 폴리리보뉴클레오티드를 포함한다.In certain embodiments, the composition comprises a circular polyribonucleotide as described herein in a vesicle or other membrane-based carrier. In certain embodiments, the composition comprises a linear polyribonucleotide as described herein in a vesicle or other membrane-based carrier.
다른 실시 형태에서, 조성물은 세포, 소낭 또는 다른 막-기반 담체에 또는 이를 통해 원형 폴리리보뉴클레오티드를 포함한다. 다른 실시 형태에서, 조성물은 세포, 소낭 또는 다른 막-기반 담체에 또는 이를 통해 선형 폴리리보뉴클레오티드를 포함한다. 한 실시 형태에서, 조성물은 리포좀 또는 다른 유사한 소낭에 원형 폴리리보뉴클레오티드를 포함한다. 한 실시 형태에서, 조성물은 리포좀 또는 다른 유사한 소낭에 선형 폴리리보뉴클레오티드를 포함한다. 리포좀은 내부 수성 구획을 둘러싼 단층 또는 다층 지질 이중층 및 상대적으로 비투과성인 외부 친지성 인지질 이중층으로 구성된 구형 소낭 구조이다. 리포좀은 음이온성, 중성 또는 양이온성일 수 있다. 리포좀은 생체적합성, 무독성이며, 친수성 및 친지성 약물 분자 둘 모두를 전달하고, 혈장 효소에 의한 분해로부터 이들의 카고를 보호하고, 이들의 로드(load)를 생물학적 막 및 혈액 뇌 장벽(BBB)을 가로질러 수송할 수 있다(예를 들어, 검토를 위해, 문헌[Spuch and Navarro, Journal of Drug Delivery, vol 2011, Article ID 469679, 12 pages, 2011 doi:101155/2011/469679] 참조).In another embodiment, the composition comprises a circular polyribonucleotide in or through a cell, vesicle, or other membrane-based carrier. In another embodiment, the composition comprises a linear polyribonucleotide in or through a cell, vesicle, or other membrane-based carrier. In one embodiment, the composition comprises circular polyribonucleotides in liposomes or other similar vesicles. In one embodiment, the composition comprises linear polyribonucleotides in liposomes or other similar vesicles. Liposomes are spherical vesicular structures composed of a single or multilayer lipid bilayer surrounding an internal aqueous compartment and a relatively impermeable external lipophilic phospholipid bilayer. Liposomes can be anionic, neutral or cationic. Liposomes are biocompatible, non-toxic, deliver both hydrophilic and lipophilic drug molecules, protect their cargo from degradation by plasma enzymes, and transfer their load across biological membranes and the blood-brain barrier (BBB). (For a review, see, e.g., Spuch and Navarro, Journal of Drug Delivery, vol 2011, Article ID 469679, 12 pages, 2011 doi:101155/2011/469679).
소낭은 몇몇 상이한 유형의 지질로 제조될 수 있지만; 인지질이 약물 담체로서 리포좀을 생성하기 위해 가장 통상적으로 사용된다. 다층 소낭 지질의 제조 방법은 당업계에 알려져 있다(예를 들어, 다층 소낭 지질 제조에 관한 교시가 본원에 참조로 포함되는, 미국 특허 제6,693,086호 참조). 지질막이 수용액과 혼합되는 경우 소낭 형성은 자발적일 수 있지만, 이는 또한 균질화기, 초음파분쇄기, 또는 압출 장치를 사용함으로써 진탕 형태로 힘을 가하여 촉진될 수 있다(예를 들어, 검토를 위해 문헌[Spuch and Navarro, Journal of Drug Delivery, vol 2011, Article ID 469679, 12 pages, 2011 doi:10.1155/2011/469679] 참조). 압출된 지질은 압출된 지질 제조에 관한 교시가 본원에 참조로 포함되는, 문헌[Templeton et al, Nature Biotech, 15:647-652, 1997]에 기재된 바와 같이, 감소하는 크기의 필터를 통해 압출함으로써 제조될 수 있다.Vesicles can be made of several different types of lipids; Phospholipids are most commonly used to create liposomes as drug carriers. Methods for making multilamellar vesicle lipids are known in the art (see, for example, U.S. Pat. No. 6,693,086, the teachings of which are incorporated herein by reference). Vesicle formation can be spontaneous when the lipid membrane is mixed with an aqueous solution, but it can also be promoted by applying force in the form of agitation by using a homogenizer, sonicator, or extrusion device (see, for example, Spuch for a review). and Navarro, Journal of Drug Delivery, vol 2011, Article ID 469679, 12 pages, 2011 doi:10.1155/2011/469679]. Extruded lipids are prepared by extruding them through filters of decreasing size, as described in Templeton et al, Nature Biotech, 15:647-652, 1997, the teachings of which are incorporated herein by reference. can be manufactured.
특정 실시 형태에서, 본 개시내용의 조성물은 원형 폴리리보뉴클레오티드 및 지질 나노입자, 예를 들어, 본원에 기재된 지질 나노입자를 포함한다. 특정 실시 형태에서, 본 개시내용의 조성물은 선형 폴리리보뉴클레오티드 및 지질 나노입자를 포함한다. 지질 나노입자는 본원에 기재된 바와 같은 원형 폴리리보뉴클레오티드 분자에 대한 생체혼화성 및 생체분해성 전달 시스템을 제공하는 담체의 또 다른 예이다. 지질 나노입자는 본원에 기재된 바와 같은 선형 폴리리보뉴클레오티드 분자에 대한 생체혼화성 및 생체분해성 전달 시스템을 제공하는 담체의 또 다른 예이다. 나노구조화된 지질 담체(NLC)는 고체 지질 나노입자(SLN)의 특징을 보유하고, 약물 안정성 및 로딩 용량을 개선시키고, 약물 누출을 방지하는 변형된 SLN이다. 중합체 나노입자(PNP)는 약물 전달의 중요한 구성성분이다. 이들 나노입자는 특이적 표적에 약물 전달을 효과적으로 지정하고 약물 안정성 및 제어된 약물 방출을 개선시킬 수 있다. 리포좀 및 중합체를 조합한 담체의 새로운 유형인 지질-중합체 나노입자(PLN)는 또한 이용될 수 있다. 이들 나노입자는 PNP 및 리포좀의 보완적 이점을 갖는다. PLN은 코어-쉘 구조로 구성되며; 중합체 코어는 안정한 구조를 제공하고, 인지질 쉘은 우수한 생체적합성을 제공한다. 따라서, 2가지 구성성분은 약물 캡슐화 효율을 증가시키고, 표면 변형을 용이하게 하고, 수용성 약물의 누출을 방지한다. 검토를 위해, 예를 들어, 문헌[Li et al. 2017, Nanomaterials 7, 122; doi:10.3390/nano7060122]을 참조한다.In certain embodiments, compositions of the present disclosure include circular polyribonucleotides and lipid nanoparticles, such as those described herein. In certain embodiments, compositions of the present disclosure include linear polyribonucleotides and lipid nanoparticles. Lipid nanoparticles are another example of a carrier that provides a biocompatible and biodegradable delivery system for circular polyribonucleotide molecules as described herein. Lipid nanoparticles are another example of a carrier that provides a biocompatible and biodegradable delivery system for linear polyribonucleotide molecules as described herein. Nanostructured lipid carriers (NLCs) are modified SLNs that retain the characteristics of solid lipid nanoparticles (SLNs), improve drug stability and loading capacity, and prevent drug leakage. Polymeric nanoparticles (PNPs) are important components in drug delivery. These nanoparticles can effectively direct drug delivery to specific targets and improve drug stability and controlled drug release. Lipid-polymer nanoparticles (PLNs), a new type of carrier combining liposomes and polymers, can also be used. These nanoparticles have complementary advantages of PNPs and liposomes. PLN consists of a core-shell structure; The polymer core provides a stable structure, and the phospholipid shell provides excellent biocompatibility. Therefore, the two components increase the drug encapsulation efficiency, facilitate surface modification, and prevent leakage of water-soluble drugs. For review, see, e.g., Li et al. 2017, Nanomaterials 7, 122; doi:10.3390/nano7060122].
담체의 추가적인 비제한적인 예는 탄수화물 담체(예를 들어, 무수물-변형된 피토글리코겐 또는 글리코겐-유형 물질), 단백질 담체(예를 들어, 원형 폴리리보뉴클레오티드에 공유적으로 연결된 단백질 또는 선형 폴리리보뉴클레오티드에 공유적으로 연결된 단백질), 또는 양이온성 담체(예를 들어, 양이온성 지질중합체 또는 형질감염 시약)를 포함한다. 탄수화물 담체의 비제한적인 예는 프토글리코겐 옥테닐 숙시네이트, 피토글리코겐 베타-덱스트린, 및 무수물-변형된 피토글리코겐 베타-덱스트린을 포함한다. 양이온성 담체의 비제한적인 예는 리포펙타민, 폴리에틸렌이민, 폴리(트리메틸렌이민), 폴리(테트라메틸렌이민), 폴리프로필렌이민, 아미노글리코시드-폴리아민, 디데옥시-디아미노-b-시클로덱스트린, 스페르민, 스페르미딘, 폴리(2-디메틸아미노)에틸 메타크릴레이트, 폴리(리신), 폴리(히스티딘), 폴리(아르기닌), 양이온화 젤라틴, 덴드리머, 키토산, 1,2-디올레오일-3-트리메틸암모늄-프로판(DOTAP), N-[1-(2,3-디올레오일옥시)프로필]-N,N,N-트리메틸암모늄 클로라이드(DOTMA), l-[2-(올레오일옥시)에틸]-2-올레일-3-(2-히드록시에틸)이미다졸리늄 클로라이드(DOTIM), 2,3-디올레일옥시-N-[2(스페르민카르복스아미도)에틸]-N,N-디메틸-1-프로판아미늄 트리플루오로아세테이트(DOSPA), 3B-[N-(-디메틸아미노에탄)-카르바모일]콜레스테롤 히드로클로라이드(DC-콜레스테롤 HCl), 디헵타데실아미도글리실 스페르미딘(DOGS), N,N-디스테아릴-N,N-디메틸암모늄 브로마이드(DDAB), N-(1,2-디미리스틸옥시프로프-3-일)-N,N-디메틸-N-히드록시에틸 암모늄 브로마이드(DMRIE), 및 N,N-디올레일-N,N-디메틸암모늄 클로라이드(DODAC)를 포함한다. 단백질 담체의 비제한적인 예는 인간 혈청 알부민(HSA), 저-밀도 지단백질(LDL), 고-밀도 지단백질(HDL), 또는 글로불린을 포함한다.Additional non-limiting examples of carriers include carbohydrate carriers (e.g., anhydride-modified phytoglycogen or glycogen-type materials), protein carriers (e.g., proteins covalently linked to circular polyribonucleotides or linear polyribonucleotides). a protein covalently linked to a protein), or a cationic carrier (e.g., a cationic lipopolymer or transfection reagent). Non-limiting examples of carbohydrate carriers include phytoglycogen octenyl succinate, phytoglycogen beta-dextrin, and anhydride-modified phytoglycogen beta-dextrin. Non-limiting examples of cationic carriers include lipofectamine, polyethyleneimine, poly(trimethyleneimine), poly(tetramethyleneimine), polypropyleneimine, aminoglycoside-polyamine, dideoxy-diamino-b-cyclodextrin. , spermine, spermidine, poly(2-dimethylamino)ethyl methacrylate, poly(lysine), poly(histidine), poly(arginine), cationized gelatin, dendrimer, chitosan, 1,2-dioleo. l-3-trimethylammonium-propane (DOTAP), N-[1-(2,3-dioleoyloxy)propyl]-N,N,N-trimethylammonium chloride (DOTMA), l-[2-(oleoyloxy)propyl]-N,N,N-trimethylammonium chloride (DOTMA) Oiloxy)ethyl]-2-oleyl-3-(2-hydroxyethyl)imidazolinium chloride (DOTIM), 2,3-dioleyloxy-N-[2 (sperminecarboxamido) ethyl]-N,N-dimethyl-1-propanaminium trifluoroacetate (DOSPA), 3B-[N-( -dimethylaminoethane)-carbamoyl]cholesterol hydrochloride (DC-cholesterol HCl), diheptadecylamidoglycyl spermidine (DOGS), N,N-distearyl-N,N-dimethylammonium bromide ( DDAB), N-(1,2-dimyristyloxyprop-3-yl)-N,N-dimethyl-N-hydroxyethyl ammonium bromide (DMRIE), and N,N-dioleyl-N,N -Contains dimethylammonium chloride (DODAC). Non-limiting examples of protein carriers include human serum albumin (HSA), low-density lipoprotein (LDL), high-density lipoprotein (HDL), or globulin.
엑소좀은 또한 본원에 기재된 원형 RNA 조성물 또는 조제물에 대한 약물 전달 비히클로서 사용될 수 있다. 엑소좀은 본원에 기재된 선형 폴리리보뉴클레오티드 조성물 또는 조제물에 대한 약물 전달 비히클로서 사용될 수 있다. 검토를 위해, 문헌[Ha et al. July 2016. Acta Pharmaceutica Sinica B. Volume 6, Issue 4, Pages 287-296]; doi.org/10.1016/j.apsb.2016.02.001을 참조한다. 생체외 분화된 적혈구는 또한 본원에 기재된 원형 RNA 조성물 또는 조제물에 대한 담체로서 사용될 수 있다. 생체외 분화된 적혈구는 또한 본원에 기재된 선형 폴리리보뉴클레오티드 조성물 또는 조제물에 대한 담체로서 사용될 수 있다. 예를 들어, 국제 특허 공개 제WO2015/073587호; 제WO2017/123646호; 제WO2017/123644호; 제WO2018/102740호; 제WO2016/183482호; 제WO2015/153102호; 제WO2018/151829호; 제WO2018/009838호; 문헌[Shi et al. 2014. Proc Natl Acad Sci USA. 111(28): 10131-10136]; 미국 특허 9,644,180; 문헌[Huang et al. 2017. Nature Communications 8: 423]; [Shi et al. 2014. Proc Natl Acad Sci USA. 111(28): 10131-10136]을 참조한다. 예를 들어, 국제 특허 공개 제WO2018/208728호에 기재된 바와 같은 푸소좀 조성물은 또한 본원에 기재된 원형 폴리리보뉴클레오티드 분자를 전달하는 담체로서 사용될 수 있다. 예를 들어, WO2018/208728에 기재된 바와 같은 푸소좀 조성물은 또한 본원에 기재된 선형 폴리리보뉴클레오티드 분자를 전달하는 담체로서 사용될 수 있다.Exosomes can also be used as drug delivery vehicles for the circular RNA compositions or preparations described herein. Exosomes can be used as drug delivery vehicles for the linear polyribonucleotide compositions or formulations described herein. For review, see Ha et al. July 2016. Acta Pharmaceutica Sinica B. Volume 6, Issue 4, Pages 287-296]; See doi.org/10.1016/j.apsb.2016.02.001. In vitro differentiated red blood cells can also be used as carriers for the circular RNA compositions or preparations described herein. In vitro differentiated red blood cells can also be used as a carrier for the linear polyribonucleotide compositions or preparations described herein. For example, International Patent Publication No. WO2015/073587; No. WO2017/123646; No. WO2017/123644; No. WO2018/102740; No. WO2016/183482; No. WO2015/153102; No. WO2018/151829; No. WO2018/009838; Shi et al. 2014. Proc Natl Acad Sci USA. 111(28): 10131-10136]; US Patent 9,644,180; Huang et al. 2017. Nature Communications 8: 423]; [Shi et al. 2014. Proc Natl Acad Sci USA. 111(28): 10131-10136]. For example, fusosome compositions as described in International Patent Publication No. WO2018/208728 can also be used as a carrier to deliver the circular polyribonucleotide molecules described herein. For example, fusosome compositions as described in WO2018/208728 can also be used as carriers to deliver the linear polyribonucleotide molecules described herein.
비로좀 및 바이러스-유사 입자(VLP)는 또한 본원에 기재된 원형 폴리리보뉴클레오티드 분자를 표적화된 세포에 전달하는 담체로서 사용될 수 있다. 비로좀 및 바이러스-유사 입자(VLP)는 또한 본원에 기재된 선형 폴리리보뉴클레오티드 분자를 표적화된 세포에 전달하는 담체로서 사용될 수 있다.Virosomes and virus-like particles (VLPs) can also be used as carriers to deliver the circular polyribonucleotide molecules described herein to targeted cells. Virosomes and virus-like particles (VLPs) can also be used as carriers to deliver the linear polyribonucleotide molecules described herein to targeted cells.
예를 들어, 국제 특허 공개 제WO2011/097480호, 제WO2013/070324호, 제WO2017/004526호, 또는 제WO2020/041784호에 기재된 바와 같은 식물 나노베지클 및 식물 메신저 팩(PMP)은 또한 본원에 기재된 원형 RNA 조성물 또는 조제물을 전달하는 담체로서 사용될 수 있다. 식물 나노베지클 및 식물 메신저 팩(PMP)은 또한 본원에 기재된 선형 폴리리보뉴클레오티드 조성물 또는 조제물을 전달하는 담체로서 사용될 수 있다.Plant nanovesicles and plant messenger packs (PMPs), e.g., as described in International Patent Publication No. WO2011/097480, WO2013/070324, WO2017/004526, or WO2020/041784, are also described herein. It can be used as a carrier to deliver the described circular RNA compositions or preparations. Plant nanovesicles and plant messenger packs (PMPs) can also be used as carriers to deliver the linear polyribonucleotide compositions or formulations described herein.
마이크로버블은 또한 본원에 기재된 원형 폴리리보뉴클레오티드 분자를 전달하는 담체로서 사용될 수 있다. 마이크로버블은 또한 본원에 기재된 선형 폴리리보뉴클레오티드 분자를 전달하는 담체로서 사용될 수 있다. 예를 들어, 제US7115583호; 문헌[Beeri, R. et al., Circulation. 2002 Oct 1;106(14):1756-1759]; [Bez, M. et al., Nat Protoc. 2019 Apr; 14(4): 1015-1026]; [Hernot, S. et al., Adv Drug Deliv Rev. 2008 Jun 30; 60(10): 1153-1166]; [Rychak, J.J. et al., Adv Drug Deliv Rev. 2014 Jun; 72: 82-93]을 참조한다. 일부 실시 형태에서, 마이크로버블은 알부민-코팅된 퍼플루오로카본 마이크로버블이다.Microbubbles can also be used as carriers to deliver the circular polyribonucleotide molecules described herein. Microbubbles can also be used as carriers to deliver the linear polyribonucleotide molecules described herein. For example, US7115583; Beeri, R. et al., Circulation. 2002
본원에 기재된 원형 폴리리보뉴클레오티드를 포함하는 담체는 복수개의 입자를 포함할 수 있다. 입자는 30 내지 700 나노미터(예를 들어, 30 내지 50, 50 내지 100, 100 내지 200, 200 내지 300, 300 내지 400, 400 내지 500, 500 내지 600, 600 내지 700, 100 내지 500, 50 내지 500, 또는 200 내지 700 나노미터)의 중위 입자 크기를 가질 수 있다. 입자의 크기는 세포 내로의 원형 폴리리보뉴클레오티드를 포함하는 페이로드의 침착에 유리하도록 최적화될 수 있다. 특정 세포 유형 내로의 원형 폴리리보뉴클레오티드의 침착은 상이한 입자 크기에 유리할 수 있다. 예를 들어, 입자 크기는 항원 제시 세포 내로의 원형 폴리리보뉴클레오티드의 침착을 위해 최적화될 수 있다. 입자 크기는 수지상 세포 내로의 원형 폴리리보뉴클레오티드의 침착을 위해 최적화될 수 있다. 추가적으로, 입자 크기는 배수 림프절 세포 내로의 원형 폴리리보뉴클레오티드의 침착을 위해 최적화될 수 있다.A carrier comprising circular polyribonucleotides described herein may comprise a plurality of particles. The particles may be 30 to 700 nanometers (e.g., 30 to 50, 50 to 100, 100 to 200, 200 to 300, 300 to 400, 400 to 500, 500 to 600, 600 to 700, 100 to 500, 50 to 500 nanometers). 500, or 200 to 700 nanometers). The size of the particles can be optimized to favor deposition of the payload comprising circular polyribonucleotides into cells. Deposition of circular polyribonucleotides into certain cell types may benefit from different particle sizes. For example, particle size can be optimized for deposition of circular polyribonucleotides into antigen presenting cells. Particle size can be optimized for deposition of circular polyribonucleotides into dendritic cells. Additionally, particle size can be optimized for deposition of circular polyribonucleotides into draining lymph node cells.
지질 나노입자lipid nanoparticles
본 개시내용에 의해 제공된 조성물, 방법, 및 전달 시스템은 특정 실시 형태에서, 지질 나노입자(LNP)를 포함하는 본원에 기재된 임의의 적합한 담체 또는 전달 양상을 이용할 수 있다. 지질 나노입자는 일부 실시 형태에서, 하나 이상의 이온성 지질, 예컨대 비-양이온성 지질(예를 들어, 중성 또는 음이온성 또는 양쪽이온성 지질); 하나 이상의 컨쥬게이트된 지질(예컨대 PEG-컨쥬게이트된 지질 또는 그 전체가 본원에 참조로 포함되는 제WO2019217941호의 표 5에 기재된 중합체에 컨쥬게이트된 지질); 하나 이상의 스테롤(예를 들어, 콜레스테롤)을 포함한다.The compositions, methods, and delivery systems provided by the present disclosure may utilize any suitable carrier or delivery modality described herein, including, in certain embodiments, lipid nanoparticles (LNPs). Lipid nanoparticles, in some embodiments, can be comprised of one or more ionic lipids, such as non-cationic lipids (e.g., neutral or anionic or zwitterionic lipids); One or more conjugated lipids (such as PEG-conjugated lipids or lipids conjugated to polymers described in Table 5 of WO2019217941, which is incorporated herein by reference in its entirety); Contains one or more sterols (e.g. cholesterol).
나노입자 제형(예를 들어, 지질 나노입자)에서 사용될 수 있는 지질은 예를 들어, 참조로 포함되는 제WO2019217941호의 표 4에 기재된 것들을 포함하며-예를 들어, 지질-함유 나노입자는 제WO2019217941호의 표 4의 지질 중 하나 이상을 포함할 수 있다. 지질 나노입자는 추가의 요소, 예컨대 중합체, 예컨대 참조로 포함되는 제WO2019217941호의 표 5에 기재된 중합체를 포함할 수 있다.Lipids that can be used in nanoparticle formulations (e.g., lipid nanoparticles) include, for example, those listed in Table 4 of WO2019217941, which is incorporated by reference - for example, lipid-containing nanoparticles include those of WO2019217941. It may include one or more of the lipids in Table 4. The lipid nanoparticles may comprise additional elements, such as polymers, such as those listed in Table 5 of WO2019217941, which is incorporated by reference.
일부 실시 형태에서, 컨쥬게이트된 지질은 존재하는 경우, PEG-디아실글리세롤(DAG)(예컨대 l-(모노메톡시-폴리에틸렌글리콜)-2,3-디미리스토일글리세롤(PEG-DMG)), PEG-디알킬옥시프로필(DAA), PEG-인지질, PEG-세라미드(Cer), PEG화 포스파티딜에탄올로아민(PEG-PE), PEG 숙시네이트 디아실글리세롤(PEGS-DAG)(예컨대 4-0-(2',3'-디(테트라데카노일옥시)프로필-1-0-(w-메톡시(폴리에톡시)에틸)부탄디오에이트(PEG-S-DMG)), PEG 디알콕시프로필카르밤, N-(카르보닐-메톡시폴리 에틸렌 글리콜 2000)-1,2-디스테아로일-sn-글리세로-3-포스포에탄올아민 나트륨 염, 및 제WO2019051289호(참조로 포함됨)의 표 2에 기재된 것들, 및 이들의 조합 중 하나 이상을 포함할 수 있다.In some embodiments, the conjugated lipid, if present, is PEG-diacylglycerol (DAG) (e.g., l-(monomethoxy-polyethyleneglycol)-2,3-dimyristoylglycerol (PEG-DMG)) , PEG-dialkyloxypropyl (DAA), PEG-phospholipid, PEG-ceramide (Cer), PEGylated phosphatidylethanolamine (PEG-PE), PEG succinate diacylglycerol (PEGS-DAG) (e.g. 4-0 -(2',3'-di(tetradecanoyloxy)propyl-1-0-(w-methoxy(polyethoxy)ethyl)butanedioate (PEG-S-DMG)), PEG dialkoxypropylcar Chestnut, N-(carbonyl-methoxypolyethylene glycol 2000)-1,2-distearoyl-sn-glycero-3-phosphoethanolamine sodium salt, and the table in WO2019051289 (incorporated by reference) 2, and combinations thereof.
일부 실시 형태에서, 지질 나노입자 내로 혼입될 수 있는 스테롤은 콜레스테롤 또는 콜레스테롤 유도체 중 하나 이상, 예컨대 참조로 포함되는 제WO2009/127060호 또는 제US2010/0130588호의 것들을 포함한다. 추가적인 예시적인 스테롤은 본원에 참조로 포함되는 문헌[Eygeris et al(2020), dx.doi.org/10.1021/acs.nanolett.0c01386]에 기재된 것들을 포함하는 피토스테롤을 포함한다.In some embodiments, sterols that can be incorporated into lipid nanoparticles include one or more of cholesterol or cholesterol derivatives, such as those in WO2009/127060 or US2010/0130588, which are incorporated by reference. Additional exemplary sterols include phytosterols, including those described in Eygeris et al (2020), dx.doi.org/10.1021/acs.nanolett.0c01386, which is incorporated herein by reference.
일부 실시 형태에서, 지질 입자는 이온화 가능한 지질, 비-양이온성 지질, 입자의 응집을 억제하는 컨쥬게이트된 지질, 및 스테롤을 포함한다. 이들 구성성분의 양은 독립적으로, 그리고 원하는 특성을 달성하도록 달라질 수 있다. 예를 들어, 일부 실시 형태에서, 지질 나노입자는 총 지질의 약 20 mol% 내지 약 90 mol%의 양(다른 실시 형태에서, 이는 지질 나노입자에 존재하는 총 지질의 20 내지 70%(mol), 30 내지 60%(mol) 또는 40 내지 50%(mol); 약 50 mol% 내지 약 90 mol%일 수 있음)의 이온화 가능한 지질, 총 지질의 약 5 mol% 내지 약 30 mol%의 양의 비-양이온성 지질, 총 지질의 약 0.5 mol% 내지 약 20 mol%의 양의 컨쥬게이트된 지질 및 총 지질의 약 20 mol% 내지 약 50 mol%의 양의 스테롤을 포함한다. 총 지질 대 핵산의 비는 원하는 대로 달라질 수 있다. 예를 들어, 총 지질 대 핵산(질량 또는 중량) 비는 약 10: 1 내지 약 30: 1일 수 있다.In some embodiments, the lipid particles include ionizable lipids, non-cationic lipids, conjugated lipids that inhibit aggregation of the particles, and sterols. The amounts of these components can be varied independently and to achieve the desired properties. For example, in some embodiments, the lipid nanoparticles contain an amount of from about 20 mol% to about 90 mol% of the total lipids (in other embodiments, it ranges from 20 to 70% (mol) of the total lipids present in the lipid nanoparticles). , 30 to 60% (mol) or 40 to 50% (mol); about 50 mol% to about 90 mol%) of the ionizable lipid, in an amount of about 5 mol% to about 30 mol% of the total lipids. non-cationic lipids, conjugated lipids in an amount of from about 0.5 mol% to about 20 mol% of the total lipids, and sterols in an amount of from about 20 mol% to about 50 mol% of the total lipids. The ratio of total lipids to nucleic acids can be varied as desired. For example, the total lipid to nucleic acid (mass or weight) ratio can be from about 10:1 to about 30:1.
일부 실시 형태에서, 지질 대 핵산 비(질량/질량 비; w/w 비)는 약 1:1 내지 약 25:1, 약 10:1 내지 약 14:1, 약 3:1 내지 약 15:1, 약 4:1 내지 약 10:1, 약 5:1 내지 약 9:1 또는 약 6:1 내지 약 9:1의 범위일 수 있다. 지질 및 핵산의 양은 원하는 N/P 비, 예를 들어, 3, 4, 5, 6, 7, 8, 9, 10 또는 그 초과의 N/P 비를 제공하도록 조정될 수 있다. 일반적으로, 지질 나노입자 제형의 전체 지질 함량은 약 5 mg/ml 내지 약 30 mg/mL의 범위일 수 있다.In some embodiments, the lipid to nucleic acid ratio (mass/mass ratio; w/w ratio) is about 1:1 to about 25:1, about 10:1 to about 14:1, about 3:1 to about 15:1. , from about 4:1 to about 10:1, from about 5:1 to about 9:1, or from about 6:1 to about 9:1. The amounts of lipids and nucleic acids can be adjusted to provide the desired N/P ratio, for example, 3, 4, 5, 6, 7, 8, 9, 10 or more. Generally, the total lipid content of the lipid nanoparticle formulation can range from about 5 mg/ml to about 30 mg/ml.
본원에 기재된 조성물, 예를 들어, 본원에 기재된 핵산(예를 들어, RNA(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드))의 전달을 위한 지질 나노입자를 형성하기 위해 (예를 들어, 다른 지질 구성성분과 조합하여) 사용될 수 있는 지질 화합물의 일부 비제한적인 예는 하기를 포함한다:To form lipid nanoparticles for delivery of compositions described herein, e.g., nucleic acids (e.g., RNA (e.g., circular polyribonucleotides, linear polyribonucleotides)) described herein (e.g. Some non-limiting examples of lipid compounds that can be used (in combination with other lipid components) include:
[화학식 i][Formula i]
일부 실시 형태에서, 화학식 i을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula (i) are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 ii][Formula ii]
일부 실시 형태에서, 화학식 ii를 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula ii are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 iii][Formula iii]
일부 실시 형태에서, 화학식 iii을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula iii are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 iv][Formula iv]
[화학식 v][Formula v]
일부 실시 형태에서, 화학식 v를 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula v are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 vi][Formula vi]
일부 실시 형태에서, 화학식 vi을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula vi are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 vii][Formula vii]
[화학식 viii][Formula viii]
일부 실시 형태에서, 화학식 viii을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula viii are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 ix][Formula ix]
일부 실시 형태에서, 화학식 ix를 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula ix are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 x][Formula x]
또는 이의 염or a salt thereof
상기 식에서,In the above equation,
X1은 O, NR1 또는 직접적인 결합이고, X2는 C2-5 알킬렌이고, X3은 C(=0) 또는 직접적인 결합이고, R1은 H 또는 Me이고, R3은 C1-3알킬이고, R2는 C1-3 알킬이거나, R2는 이것이 부착된 질소 원자 및 X2의 1 내지 3개의 탄소 원자와 함께, 4-, 5- 또는 6-원 고리를 형성하거나, X1은 NR1이고, R1 및 R2는 이들이 부착된 질소 원자와 함께 5- 또는 6-원 고리를 형성하거나, R2는 R3 및 이들이 부착된 질소 원자와 함께 5-, 6- 또는 7-원 고리를 형성하고, Y1은 C2-12 알킬렌이고, Y2는X1 is O, NR1 or a direct bond, X2 is C2-5 alkylene, X3 is C(=0) or a direct bond, R1 is H or Me, and R3 is C1-3 alkyl and R2 is C1-3 alkyl, or R2 , together with the nitrogen atom to which it is attached and 1 to 3 carbon atoms of X2 , forms a 4-, 5- or 6-membered ring, or X1 is NR1 , and R1 and R2 together with the nitrogen atom to which they are attached form a 5- or 6-membered ring, or R2 together with R3 and the nitrogen atom to which they are attached form a 5-, 6- or 7-membered ring. Forming, Y1 is C2-12 alkylene, Y2 is
로부터 선택되며,is selected from,
n은 0 내지 3이고, R4는 C1-15 알킬이고, Z1은 C1-6 알킬렌 또는 직접적인 결합이고,n is 0 to 3, R4 is C1-15 alkyl, Z1 is C1-6 alkylene or a direct bond,
Z2는이거나, 부재하되, 단, Z1이 직접적인 결합이면, Z2는 부재하고;Z2 is or is absent, provided that if Z1 is a direct bond, Z2 is absent;
R5는 C5-9 알킬 또는 C6-10 알콕시이며, R6은 C5-9 알킬 또는 C6-10 알콕시이며, W는 메틸렌 또는 직접적인 결합이며, R7은 H 또는 Me이되, 단, R3 및 R2가 C2 알킬이고, X1이 O이고, X2가 선형 C3 알킬렌이고, X3이 C(=0)이고, Y1이 선형 Ce 알킬렌이고, (Y2 )n-R4가R5 is C5-9 alkyl or C6-10 alkoxy, R6 is C5-9 alkyl or C6-10 alkoxy, W is methylene or a direct bond, R7 is H or Me, provided that R3 and R2 isC2 alkyl,X1is O,X2 is linear C3 alkylene,
이고,ego,
R4가 선형 C5 알킬이고, Z1이 C2 알킬렌이고, Z2가 부재하고, W가 메틸렌이고, R7이 H이면, R5 및 R6은 Cx 알콕시가 아니다.If R4 is linear C5 alkyl, Z1 is C2 alkylene, Z2 is absent, W is methylene, and R7 is H, then R5 and R6 are not Cx alkoxy.
일부 실시 형태에서, 화학식 xii를 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula xii are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 xi][Formula xi]
일부 실시 형태에서, 화학식 xi을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula xi are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 xii][Formula xii]
(여기서, R은임)(Here, R is lim)
[화학식 xiii][Formula xiii]
[화학식 xiv][Formula xiv]
일부 실시 형태에서, LNP는 화학식 xiii의 화합물 및 화학식 xiv의 화합물을 포함한다.In some embodiments, the LNPs include compounds of Formula (xiii) and compounds of Formula (xiv).
[화학식 xv][Formula xv]
일부 실시 형태에서, 화학식 xv를 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula xv are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 xvi][Formula xvi]
일부 실시 형태에서, 화학식 xvi을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하는 데 사용된다.In some embodiments, LNPs comprising Formula xvi are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells.
[화학식 xvii][Formula xvii]
[화학식 xviii(a)][Formula xviii(a)]
(여기서, X는임)(Here, lim)
[화학식 xviii(b)][Formula xviii(b)]
[화학식 xix][Formula xix]
일부 실시 형태에서, 본원에 기재된 조성물, 예를 들어, 본원에 기재된 핵산(예를 들어, RNA(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드))의 전달을 위해 지질 나노입자를 형성하기 위해 사용되는 지질 화합물은 하기 반응 중 하나에 의해 제조된다:In some embodiments, forming lipid nanoparticles for delivery of compositions described herein, e.g., nucleic acids (e.g., RNA (e.g., circular polyribonucleotides, linear polyribonucleotides)) described herein. Lipid compounds used for are prepared by one of the following reactions:
[화학식 xx(a)][Formula xx(a)]
[화학식 xx(b)][Formula xx(b)]
일부 실시 형태에서, 화학식 xxi을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하기 위해 사용된다. 일부 실시 형태에서, 화학식 xxi의 LNP는 제WO2021113777호에 기재된 LNP(예를 들어, 화학식 1의 지질, 예컨대 제WO2021113777호의 표 1의 지질)이다.In some embodiments, LNPs comprising Formula xxi are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells. In some embodiments, the LNP of Formula xxi is an LNP described in WO2021113777 (e.g., a lipid of
[화학식 xxi][Formula xxi]
상기 식에서,In the above equation,
각각의 n은 독립적으로 2 내지 15의 정수이며; L1 및 L3은 각각 독립적으로 -OC(O)-* 또는 -C(O)O-*이며, "*"는 R1 또는R3에 대한 부착점을 나타내며;Each n is independently an integer from 2 to 15; L1 and L3 are each independently -OC(O)-* or -C(O)O-* , and "* " is R1 orrepresents the point of attachment to R3 ;
R1 및 R3은 각각 독립적으로 옥소, 할로, 히드록시, 시아노, 알킬, 알케닐, 알데히드, 헤테로시클릴알킬, 히드록시알킬, 디히드록시알킬, 히드록시알킬아미노알킬, 아미노알킬, 알킬아미노알킬, 디알킬아미노알킬, (헤테로시클릴)(알킬)아미노알킬, 헤테로시클릴, 헤테로아릴, 알킬헤테로아릴, 알키닐, 알콕시, 아미노, 디알킬아미노, 아미노알킬카르보닐아미노, 아미노카르보닐알킬아미노, (아미노카르보닐알킬)(알킬)아미노, 알케닐카르보닐아미노, 히드록시카르보닐, 알킬옥시카르보닐, 아미노카르보닐, 아미노알킬아미노카르보닐, 알킬아미노알킬아미노카르보닐, 디알킬아미노알킬아미노카르보닐, 헤테로시클릴알킬아미노카르보닐, (알킬아미노알킬)(알킬)아미노카르보닐, 알킬아미노알킬카르보닐, 디알킬아미노알킬카르보닐, 헤테로시클릴카르보닐, 알케닐카르보닐, 알키닐카르보닐, 알킬술폭시드, 알킬술폭시드알킬, 알킬 술포닐 및 알킬 술폰알킬로 이루어진 군으로부터 선택되는 하나 이상의 치환기에 의해 선택적으로 치환되는 선형 또는 분지형 C9-C20 알킬 또는 C9-C20 알케닐이며;R1 and R3 are each independently oxo, halo, hydroxy, cyano, alkyl, alkenyl, aldehyde, heterocyclylalkyl, hydroxyalkyl, dihydroxyalkyl, hydroxyalkylaminoalkyl, aminoalkyl, alkyl Aminoalkyl, dialkylaminoalkyl, (heterocyclyl)(alkyl)aminoalkyl, heterocyclyl, heteroaryl, alkylheteroaryl, alkynyl, alkoxy, amino, dialkylamino, aminoalkylcarbonylamino, aminocarbonyl Alkylamino, (aminocarbonylalkyl)(alkyl)amino, alkenylcarbonylamino, hydroxycarbonyl, alkyloxycarbonyl, aminocarbonyl, aminoalkylaminocarbonyl, alkylaminoalkylaminocarbonyl, dialkylamino Alkylaminocarbonyl, heterocyclylalkylaminocarbonyl, (alkylaminoalkyl)(alkyl)aminocarbonyl, alkylaminoalkylcarbonyl, dialkylaminoalkylcarbonyl, heterocyclylcarbonyl, alkenylcarbonyl, alkyl linear or branched C9 -C20 alkyl or C9 -C optionally substituted by one or more substituents selected from the group consisting of nylcarbonyl, alkylsulfoxide, alkylsulfoxidealkyl, alkyl sulfonyl and alkyl sulfonalkyl20 alkenyl;
R2는 하기로 이루어진 군으로부터 선택된다:R2 is selected from the group consisting of:
일부 실시 형태에서, 화학식 xxii를 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하기 위해 사용된다. 일부 실시 형태에서, 화학식 xxii의 LNP는 제WO2021113777호에 기재된 LNP(예를 들어, 화학식 2의 지질, 예컨대 제WO2021113777호의 표 2의 지질)이다.In some embodiments, LNPs comprising Formula xxii are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells. In some embodiments, the LNP of Formula xxii is an LNP described in WO2021113777 (e.g., a lipid of
[화학식 xxii][Formula xxii]
상기 식에서,In the above equation,
각각의 n은 독립적으로 1 내지 15의 정수이며;Each n is independently an integer from 1 to 15;
R1 및 R2는 각각 독립적으로 하기로 이루어진 군으로부터 선택되며:R1 and R2 are each independently selected from the group consisting of:
R3은 하기로 이루어진 군으로부터 선택된다:R3 is selected from the group consisting of:
일부 실시 형태에서, 화학식 xxiii을 포함하는 LNP는 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 조성물을 세포에 전달하기 위해 사용된다. 일부 실시 형태에서, 화학식 xxiii의 LNP는 제WO2021113777호에 기재된 LNP(예를 들어, 화학식 3의 지질, 예컨대 제WO2021113777호의 표 3의 지질)이다.In some embodiments, LNPs comprising Formula xxiii are used to deliver polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) compositions described herein to cells. In some embodiments, the LNP of Formula xxiii is an LNP described in WO2021113777 (e.g., a lipid of Formula 3, such as a lipid in Table 3 of WO2021113777).
[화학식 xxiii][Formula xxiii]
상기 식에서,In the above equation,
X는 -O-, -S-, 또는 -OC(O)-*로부터 선택되며,*는 R1에 대한 부착점을 나타내며;X is selected from -O-, -S-, or -OC(O)-* , where* represents the point of attachment to R1 ;
R1은 하기로 이루어진 군으로부터 선택되며:R1 is selected from the group consisting of:
R2는 하기로 이루어진 군으로부터 선택된다:R2 is selected from the group consisting of:
일부 실시 형태에서, 본원에 기재된 조성물(예를 들어, 핵산(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 또는 단백질)은 이온화 가능한 지질을 포함하는 LNP에 제공된다. 일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제US9,867,888호(그 전체가 본원에 참조로 포함됨)의 실시예 1에 기재된 바와 같은; 헵타데칸-9-일 8-((2-히드록시에틸)(6-옥소-6-(운데실옥시)헥실)아미노)옥타노에이트(SM-102)이다. 일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제WO2015/095340호(그 전체가 본원에 참조로 포함됨)의 실시예 13에서 합성되는 바와 같은; 9Z,12Z)-3-((4,4-비스(옥틸옥시)부타노일)옥시)-2-((((3-(디에틸아미노)프로폭시)카르보닐)옥시)메틸)프로필 옥타데카-9,12-디에노에이트(LP01)이다. 일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제US2012/0027803호(그 전체가 본원에 참조로 포함됨)의 실시예 7, 8 또는 9에서 합성되는 바와 같은; 디((Z)-논-2-엔-1-일) 9-((4-디메틸아미노)부타노일)옥시)헵타데칸디오에이트(L319)이다. 일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제WO2010/053572호(그 전체가 본원에 참조로 포함됨)의 실시예 14 및 16에서 합성되는 바와 같은; 1,1'-((2-(4-(2-((2-(비스(2-히드록시도데실)아미노)에틸)(2-히드록시도데실) 아미노)에틸)피페라진-1-일)에틸)아잔디일)비스(도데칸-2-올)(C12-200)이다. 일부 실시 형태에서, 이온화 가능한 지질은 이미다졸 콜레스테롤 에스테르(ICE) 지질 (3S, 10R, 13R, 17R)-10, 13-디메틸-17-((R)-6-메틸헵탄-2-일)-2, 3, 4, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17-테트라데카히드로-lH-시클로펜타[a]페난트렌-3-일 3-(1H-이미다졸-4-일)프로파노에이트, 예를 들어, 제WO2020/106946호(그 전체가 본원에 참조로 포함됨)로부터의 구조 I이다.In some embodiments, a composition described herein (e.g., a nucleic acid (e.g., circular polyribonucleotide, linear polyribonucleotide) or protein) is provided in an LNP comprising an ionizable lipid. In some embodiments, the ionizable lipid is, for example, as described in Example 1 of US9,867,888 (incorporated herein by reference in its entirety); Heptadecan-9-yl 8-((2-hydroxyethyl)(6-oxo-6-(undecyloxy)hexyl)amino)octanoate (SM-102). In some embodiments, the ionizable lipid is, for example, as synthesized in Example 13 of WO2015/095340 (incorporated herein by reference in its entirety); 9Z,12Z)-3-((4,4-bis(octyloxy)butanoyl)oxy)-2-(((((3-(diethylamino)propoxy)carbonyl)oxy)methyl)propyl octadeca -9,12-dienoate (LP01). In some embodiments, the ionizable lipid is, for example, as synthesized in Examples 7, 8 or 9 of US2012/0027803 (incorporated herein by reference in its entirety); It is di((Z)-non-2-en-1-yl) 9-((4-dimethylamino)butanoyl)oxy)heptadecanedioate (L319). In some embodiments, the ionizable lipid is, for example, as synthesized in Examples 14 and 16 of WO2010/053572 (incorporated herein by reference in its entirety); 1,1'-((2-(4-(2-((2-(bis(2-hydroxydodecyl)amino)ethyl)(2-hydroxydodecyl)amino)ethyl)piperazine-1- It is 1) ethyl) azandiyl) bis (dodecane-2-ol) (C12-200). In some embodiments, the ionizable lipid is imidazole cholesterol ester (ICE) lipid (3S, 10R, 13R, 17R)-10, 13-dimethyl-17-((R)-6-methylheptan-2-yl)- 2, 3, 4, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17-tetradecahydro-lH-cyclopenta[a]phenanthren-3-yl 3-(1H- Imidazol-4-yl)propanoate, e.g., structure I from WO2020/106946, incorporated herein by reference in its entirety.
일부 실시 형태에서, 이온화 가능한 지질은 양이온성 지질, 이온화 가능한 양이온성 지질, 예를 들어, pH에 따라 양으로 하전된 또는 중성 형태로 존재할 수 있는 양이온성 지질, 또는 용이하게 양성자화될 수 있는 아민-함유 지질일 수 있다. 일부 실시 형태에서, 양이온성 지질은 예를 들어, 생리학적 조건 하에서 양으로 하전될 수 있는 지질이다. 예시적인 양이온성 지질은 양전하를 보유하는 하나 이상의 아민 기(들)를 포함한다. 일부 실시 형태에서, 지질 입자는 중성 지질, 이온화 가능한 아민-함유 지질, 생체분해성 알킨 지질, 스테로이드, 고도불포화된 지질을 포함하는 인지질, 구조적 지질(예를 들어, 스테롤), PEG, 콜레스테롤 및 중합체 컨쥬게이트된 지질 중 하나 이상을 갖는 제형에서 양이온성 지질을 포함한다. 일부 실시 형태에서, 양이온성 지질은 이온화 가능한 양이온성 지질일 수 있다. 본원에 개시된 바와 같은 예시적인 양이온성 지질은 6.0을 초과하는 유효 pKa를 가질 수 있다. 실시 형태에서, 지질 나노입자는 제1 양이온성 지질과는 상이한(예를 들어, 제1 유효 pKa보다 더 큰) 유효 pKa를 갖는 제2 양이온성 지질을 포함할 수 있다. 지질 나노입자는 지질 나노입자 내에 캡슐화된 또는 이와 회합된, 40 내지 60 mol 퍼센트의 양이온성 지질, 중성 지질, 스테로이드, 중합체 컨쥬게이트된 지질, 및 치료제, 예를 들어, 본원에 기재된 핵산(예를 들어, RNA(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드))을 포함할 수 있다. 일부 실시 형태에서, 핵산은 양이온성 지질과 동시-제형화된다. 핵산은 LNP, 예를 들어, 양이온성 지질을 포함하는 LNP의 표면에 흡착될 수 있다. 일부 실시 형태에서, 핵산은 LNP, 예를 들어, 양이온성 지질을 포함하는 LNP에 캡슐화될 수 있다. 일부 실시 형태에서, 지질 나노입자는 예를 들어, 표적화제로 코팅된 표적화 모이어티를 포함할 수 있다. 실시 형태에서, LNP 제형은 생체분해성이다. 일부 실시 형태에서, 본원에 기재된 하나 이상의 지질, 예를 들어, 화학식 i, ii, ii, vii 및/또는 ix를 포함하는 지질 나노입자는 적어도 1%, 적어도 5%, 적어도 10%, 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 92%, 적어도 95%, 적어도 97%, 적어도 98% 또는 100%의 RNA 분자를 캡슐화한다.In some embodiments, the ionizable lipid is a cationic lipid, e.g., a cationic lipid that can exist in a positively charged or neutral form depending on pH, or an amine that can be readily protonated. -It may be lipid-containing. In some embodiments, a cationic lipid is a lipid that can be positively charged, for example under physiological conditions. Exemplary cationic lipids include one or more amine group(s) that bear a positive charge. In some embodiments, the lipid particles include neutral lipids, ionizable amine-containing lipids, biodegradable alkyne lipids, steroids, phospholipids, including polyunsaturated lipids, structural lipids (e.g., sterols), PEG, cholesterol, and polymer conjugates. Including cationic lipids in formulations with one or more of the gated lipids. In some embodiments, the cationic lipid can be an ionizable cationic lipid. Exemplary cationic lipids as disclosed herein can have an effective pKa greater than 6.0. In an embodiment, the lipid nanoparticle may comprise a second cationic lipid having an effective pKa that is different than the first cationic lipid (e.g., greater than the first effective pKa). Lipid nanoparticles may contain 40 to 60 mol percent of a cationic lipid, a neutral lipid, a steroid, a polymer conjugated lipid, and a therapeutic agent, e.g., a nucleic acid as described herein (e.g. For example, RNA (e.g., circular polyribonucleotide, linear polyribonucleotide)). In some embodiments, the nucleic acid is co-formulated with a cationic lipid. Nucleic acids can be adsorbed to the surface of LNPs, for example, LNPs containing cationic lipids. In some embodiments, nucleic acids can be encapsulated in LNPs, e.g., LNPs comprising cationic lipids. In some embodiments, lipid nanoparticles may include targeting moieties, for example coated with a targeting agent. In an embodiment, the LNP formulation is biodegradable. In some embodiments, lipid nanoparticles comprising one or more lipids described herein, e.g., formulas i, ii, ii, vii and/or ix, have at least 1%, at least 5%, at least 10%, at least 20% , at least 30%, at least 40%, at least 50%, at least 60%, at least 70%, at least 80%, at least 90%, at least 92%, at least 95%, at least 97%, at least 98% or 100% of RNA molecules. Encapsulates.
지질 나노입자 제형에서 사용될 수 있는 예시적인 이온화 가능한 지질은 제한 없이, 본원에 참조로 포함되는 제WO2019051289호의 표 1에 열거된 것들을 포함한다. 추가적인 예시적인 지질은 제한 없이, 하기 화학식 중 하나 이상을 포함한다: 제US2016/0311759호의 X; 제US20150376115호 또는 제US2016/0376224호의 I; 제US20160151284호의 I, II 또는 III; 제US20170210967호의 I, IA, II 또는 IIA; 제US20150140070호의 I-c; 제US2013/0178541호의 A; 제US2013/0303587호 또는 제US2013/0123338호의 I; 제US2015/0141678호의 I; 제US2015/0239926호의 II, III, IV 또는 V; 제US2017/0119904호의 I; 제WO2017/117528호의 I 또는 II; 제US2012/0149894호의 A; 제US2015/0057373호의 A; 제WO2013/116126호의 A; 제US2013/0090372호의 A; 제US2013/0274523호의 A; 제US2013/0274504호의 A; 제US2013/0053572호의 A; 제WO2013/016058호의 A; 제WO2012/162210호의 A; 제US2008/042973호의 I; 제US2012/01287670호의 I, II, III 또는 IV; 제US2014/0200257호의 I 또는 II; 제US2015/0203446호의 I, II 또는 III; 제US2015/0005363호의 I 또는 III; 제US2014/0308304호의 I, IA, IB, IC, ID, II, IIA, IIB, IIC, IID 또는 III 내지 XXIV; 제US2013/0338210호의; 제WO2009/132131호의 I, II, III 또는 IV; 제US2012/01011478호의 A; 제US2012/0027796호의 I 또는 XXXV; 제US2012/0058144호의 XIV 또는 XVII; 제US2013/0323269호의; 제US2011/0117125호의 I; 제US2011/0256175호의 I, II 또는 III; 제US2012/0202871호의 I, II, III, IV, V, VI, VII, VIII, IX, X, XI, XII; 제US2011/0076335호의 I, II, III, IV, V, VI, VII, VIII, X, XII, XIII, XIV, XV 또는 XVI; 제US2006/008378호의 I 또는 II; 제US2013/0123338호의 I; 제US2015/0064242호의 I 또는 X-A-Y-Z; 제US2013/0022649호의 XVI, XVII 또는 XVIII; 제US2013/0116307호의 I, II 또는 III; 제US2013/0116307호의 I, II 또는 III; 제US2010/0062967호의 I 또는 II; 제US2013/0189351호의 I 내지 X; 제US2014/0039032호의 I; 제US2018/0028664호의 V; 제US2016/0317458호의 I; 제US2013/0195920호의 I; 제US10,221,127호의 5, 6 또는 10; 제WO2018/081480호의 III-3; 제WO2020/081938호의 I-5 또는 I-8; 제US9,867,888호의 18 또는 25; 제US2019/0136231호의 A; 제WO2020/219876호의 II; 제US2012/0027803호의 1; 제US2019/0240349호의 OF-02; 제US10,086,013호의 23; 문헌[Miao et al(2020)]의 cKK-E12/A6; 제WO2010/053572호의 C12-200; 문헌[Dahlman et al(2017)]의 7C1; 문헌[Whitehead et al]의 304-O13 또는 503-O13; 제US9,708,628호의 TS-P4C2; 제WO2020/106946호의 I; 제WO2020/106946호의 I; 및 제WO2021/113777호의 (1), (2), (3), 또는 (4). 예시적인 지질은 제WO2021/113777호의 표 1 내지 16 중 어느 하나의 지질을 추가로 포함한다.Exemplary ionizable lipids that can be used in lipid nanoparticle formulations include, without limitation, those listed in Table 1 of WO2019051289, which is incorporated herein by reference. Additional exemplary lipids include, without limitation, one or more of the following formulas: I of US20150376115 or US2016/0376224; I, II or III of US20160151284; I, IA, II or IIA of US20170210967; I-c of US20150140070; A in US2013/0178541; I of US2013/0303587 or US2013/0123338; I of US2015/0141678; II, III, IV or V of US2015/0239926; I of US2017/0119904; I or II of WO2017/117528; A in US2012/0149894; A in US2015/0057373; A in WO2013/116126; A in US2013/0090372; A in US2013/0274523; A in US2013/0274504; A in US2013/0053572; A of WO2013/016058; A of WO2012/162210; I of US2008/042973; I, II, III or IV of US2012/01287670; I or II of US2014/0200257; I, II or III of US2015/0203446; I or III of US2015/0005363; I, IA, IB, IC, ID, II, IIA, IIB, IIC, IID or III to XXIV of US2014/0308304; No. US2013/0338210; I, II, III or IV of WO2009/132131; A in US2012/01011478; I or XXXV of US2012/0027796; XIV or XVII of US2012/0058144; No. US2013/0323269; I of US2011/0117125; I, II or III of US2011/0256175; I, II, III, IV, V, VI, VII, VIII, IX, X, XI, XII of US2012/0202871; I, II, III, IV, V, VI, VII, VIII, X, XII, XIII, XIV, XV or XVI of US2011/0076335; I or II of US2006/008378; I of US2013/0123338; I or X-A-Y-Z of US2015/0064242; XVI, XVII or XVIII of US2013/0022649; I, II or III of US2013/0116307; I, II or III of US2013/0116307; I or II of US2010/0062967; I to X of US2013/0189351; I of US2014/0039032; V of US2018/0028664; I of US2016/0317458; I of US2013/0195920; Nos. 5, 6 or 10 of US 10,221,127; III-3 of WO2018/081480; I-5 or I-8 of WO2020/081938; 18 or 25 of US9,867,888; A of US2019/0136231; II of WO2020/219876; No. 1 of US2012/0027803; OF-02 of No. US2019/0240349; 23 of US 10,086,013; cKK-E12/A6 from Miao et al (2020); C12-200 of WO2010/053572; 7C1 from Dahlman et al (2017); 304-O13 or 503-O13 from Whitehead et al; TS-P4C2 of US9,708,628; I of WO2020/106946; I of WO2020/106946; and (1), (2), (3), or (4) of WO2021/113777. Exemplary lipids further include lipids from any of Tables 1 to 16 of WO2021/113777.
일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제WO2019051289A9호(그 전체가 본원에 참조로 포함됨)의 실시예 9에 기재된 바와 같은 MC3 (6Z,9Z,28Z,3 lZ)-헵타트리아콘타-6,9,28,3l-테트라엔-l9-일-4-(디메틸아미노) 부타노에이트(DLin-MC3-DMA 또는 MC3)이다. 일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제WO2019051289A9호(그 전체가 본원에 참조로 포함됨)의 실시예 10에 기재된 바와 같은 지질 ATX-002이다. 일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제WO2019051289A9호(그 전체가 본원에 참조로 포함됨)의 실시예 11에 기재된 바와 같은(l3Z,l6Z)-A,A-디메틸-3-노닐도코사-l3,l6-디엔-l-아민(화합물 32)이다. 일부 실시 형태에서, 이온화 가능한 지질은 예를 들어, 제WO2019051289A9호(그 전체가 본원에 참조로 포함됨)의 실시예 12에 기재된 바와 같은 화합물 6 또는 화합물 22이다.In some embodiments, the ionizable lipid is MC3 (6Z,9Z,28Z,3 lZ)-heptatriaconta, for example, as described in Example 9 of WO2019051289A9 (incorporated herein by reference in its entirety) -6,9,28,3l-Tetraen-l9-yl-4-(dimethylamino)butanoate (DLin-MC3-DMA or MC3). In some embodiments, the ionizable lipid is lipid ATX-002, for example, as described in Example 10 of WO2019051289A9 (incorporated herein by reference in its entirety). In some embodiments, the ionizable lipid is (l3Z,l6Z)-A,A-dimethyl-3-nonyl, e.g., as described in Example 11 of WO2019051289A9 (incorporated herein by reference in its entirety). It is cosa-l3,l6-dien-l-amine (compound 32). In some embodiments, the ionizable lipid is Compound 6 or Compound 22, for example, as described in Example 12 of WO2019051289A9 (incorporated herein by reference in its entirety).
예시적인 비-양이온성 지질은 디스테아로일-sn-글리세로-포스포에탄올아민, 디스테아로일포스파티딜콜린(DSPC), 디올레오일포스파티딜콜린(DOPC), 디팔미토일포스파티딜콜린(DPPC), 디올레오일포스파티딜글리세롤(DOPG), 디팔미토일포스파티딜글리세롤(DPPG), 디올레오일-포스파티딜에탄올아민(DOPE), 팔미토일올레오일포스파티딜콜린(POPC), 팔미토일올레오일포스파티딜에탄올아민(POPE), 디올레오일-포스파티딜에탄올아민 4-(N-말레이미도메틸)-시클로헥산-1-카르복실레이트(DOPE-mal), 디팔미토일 포스파티딜 에탄올아민(DPPE), 디미리스토일포스포에탄올아민(DMPE), 디스테아로일-포스파티딜-에탄올아민(DSPE), 모노메틸-포스파티딜에탄올아민(예컨대 16-O-모노메틸 PE), 디메틸-포스파티딜에탄올아민(예컨대 16-O-디메틸 PE), 18-1-트랜스 PE, 1-스테아로일-2-올레오일-포스파티딜에탄올아민(SOPE), 수소화된 대두 포스파티딜콜린(HSPC), 난(egg) 포스파티딜콜린(EPC), 디올레오일포스파티딜세린(DOPS), 스핑고미엘린(SM), 디미리스토일 포스파티딜콜린(DMPC), 디미리스토일 포스파티딜글리세롤(DMPG), 디스테아로일포스파티딜글리세롤(DSPG), 디에루코일포스파티딜콜린(DEPC), 팔미토일올레오일포스파티딜글리세롤(POPG), 디엘라이도일-포스파티딜에탄올아민(DEPE), 레시틴, 포스파티딜에탄올아민, 리소레시틴, 리소포스파티딜에탄올아민, 포스파티딜세린, 포스파티딜이노시톨, 스핑고미엘린, 난 스핑고미엘린(ESM), 세팔린, 카르디오리핀, 포스파티드산, 세레브로시드, 디세틸포스페이트, 리소포스파티딜콜린, 디리놀레오일포스파티딜콜린 또는 이들의 혼합물을 포함하지만, 이에 한정되는 것은 아니다. 다른 디아실포스파티딜콜린 및 디아실포스파티딜에탄올아민 인지질도 또한 사용될 수 있는 것이 이해된다. 이들 지질 내의 아실 기는 바람직하게는 C10-C24 탄소 쇄를 갖는 지방산, 예를 들어, 라우로일, 미리스토일, 팔미토일, 스테아로일, 또는 올레오일로부터 유래된 아실 기이다. 추가적인 예시적인 지질은, 특정 실시 형태에서, 제한 없이, 본원에 참조로 포함되는 문헌[Kim et al. (2020) dx.doi.org/10.1021/acs.nanolett.0c01386]에 기재된 것들을 포함한다. 이러한 지질은 일부 실시 형태에서, mRNA(예를 들어, DGTS)로의 간 형질감염을 개선시키는 것으로 관찰된 식물 지질을 포함한다.Exemplary non-cationic lipids include distearoyl-sn-glycero-phosphoethanolamine, distearoylphosphatidylcholine (DSPC), dioleoylphosphatidylcholine (DOPC), dipalmitoylphosphatidylcholine (DPPC), and dioleoylphosphatidylcholine (DPPC). Phosphatidylglycerol (DOPG), dipalmitoylphosphatidylglycerol (DPPG), dioleoyl-phosphatidylethanolamine (DOPE), palmitoyloleoylphosphatidylcholine (POPC), palmitoyloleoylphosphatidylethanolamine (POPE), dioleoyl -Phosphatidylethanolamine 4-(N-maleimidomethyl)-cyclohexane-1-carboxylate (DOPE-mal), dipalmitoyl phosphatidyl ethanolamine (DPPE), dimyristoylphosphoethanolamine (DMPE), Distearoyl-phosphatidyl-ethanolamine (DSPE), monomethyl-phosphatidylethanolamine (e.g. 16-O-monomethyl PE), dimethyl-phosphatidylethanolamine (e.g. 16-O-dimethyl PE), 18-1-trans PE, 1-stearoyl-2-oleoyl-phosphatidylethanolamine (SOPE), hydrogenated soy phosphatidylcholine (HSPC), egg phosphatidylcholine (EPC), dioleoylphosphatidylserine (DOPS), sphingomyelin ( SM), dimyristoyl phosphatidylcholine (DMPC), dimyristoyl phosphatidylglycerol (DMPG), distearoylphosphatidylglycerol (DSPG), dierucoylphosphatidylcholine (DEPC), palmitoyl oleoylphosphatidylglycerol (POPG), Dielaidoyl-phosphatidylethanolamine (DEPE), lecithin, phosphatidylethanolamine, lysolecithin, lysophosphatidylethanolamine, phosphatidylserine, phosphatidylinositol, sphingomyelin, egg sphingomyelin (ESM), cephalin, cardiolipin , phosphatidic acid, cerebroside, dicetyl phosphate, lysophosphatidylcholine, dilinoleoylphosphatidylcholine, or mixtures thereof, but are not limited thereto. It is understood that other diacylphosphatidylcholine and diacylphosphatidylethanolamine phospholipids may also be used. The acyl groups in these lipids are preferably acyl groups derived from fatty acids with a C10-C24 carbon chain, such as lauroyl, myristoyl, palmitoyl, stearoyl, or oleoyl. Additional exemplary lipids, in certain embodiments, can be found in Kim et al., which are incorporated herein by reference, without limitation. (2020) dx.doi.org/10.1021/acs.nanolett.0c01386]. Such lipids, in some embodiments, include plant lipids that have been observed to improve liver transfection with mRNA (e.g., DGTS).
지질 나노입자에 사용하는 데 적합한 비-양이온성 지질의 다른 예는 제한 없이, 인을 함유하지 않는 지질, 예컨대, 예를 들어, 스테아릴아민, 도데실아민, 헥사데실아민, 아세틸 팔미테이트, 글리세롤 리시놀레에이트, 헥사데실 스테아레이트, 이소프로필 미리스테이트, 양쪽성 아크릴계 중합체, 트리에탄올아민-라우릴 술페이트, 알킬-아릴 술페이트 폴리에틸옥실화 지방산 아미드, 디옥타데실 디메틸 암모늄 브로마이드, 세라미드, 스핑고미엘린 등을 포함한다. 다른 비-양이온성 지질은 제WO2017/099823호 또는 미국 특허 공개 제US2018/0028664호에 기재되어 있으며, 이의 내용은 그 전체가 본원에 참조로 포함된다.Other examples of non-cationic lipids suitable for use in lipid nanoparticles include, but are not limited to, lipids that do not contain phosphorus, such as, for example, stearylamine, dodecylamine, hexadecylamine, acetyl palmitate, glycerol. Ricinoleate, hexadecyl stearate, isopropyl myristate, amphoteric acrylic polymer, triethanolamine-lauryl sulfate, alkyl-aryl sulfate polyethyloxylated fatty acid amide, dioctadecyl dimethyl ammonium bromide, ceramide, sphingo. Including myelin, etc. Other non-cationic lipids are described in WO2017/099823 or US Patent Publication No. US2018/0028664, the contents of which are incorporated herein by reference in their entirety.
일부 실시 형태에서, 비-양이온성 지질은 그 전체가 본원에 참조로 포함되는 제US2018/0028664호의 화학식 I, II 또는 IV의 화합물 또는 올레산이다. 비-양이온성 지질은 예를 들어, 지질 나노입자에 존재하는 총 지질의 0 내지 30%(mol)를 구성할 수 있다. 일부 실시 형태에서, 비-양이온성 지질 함량은 지질 나노입자에 존재하는 총 지질의 5 내지 20%(mol) 또는 10 내지 15%(mol)이다. 실시 형태에서, 이온화 가능한 지질 대 중성 지질의 몰비는 약 2:1 내지 약 8:1의 범위(예를 들어, 약 2:1, 3:1, 4:1, 5:1, 6:1, 7:1 또는 8:1)이다.In some embodiments, the non-cationic lipid is oleic acid or a compound of Formula I, II or IV of US2018/0028664, which is incorporated herein by reference in its entirety. Non-cationic lipids can, for example, make up 0 to 30% (mol) of the total lipids present in lipid nanoparticles. In some embodiments, the non-cationic lipid content is 5-20% (mol) or 10-15% (mol) of the total lipids present in the lipid nanoparticle. In an embodiment, the molar ratio of ionizable lipid to neutral lipid ranges from about 2:1 to about 8:1 (e.g., about 2:1, 3:1, 4:1, 5:1, 6:1, 7:1 or 8:1).
일부 실시 형태에서, 지질 나노입자는 임의의 인지질을 포함하지 않는다.In some embodiments, lipid nanoparticles do not include any phospholipids.
일부 양태에서, 지질 나노입자는 막 온전성을 제공하기 위해 스테롤과 같은 구성성분을 추가로 포함할 수 있다. 지질 나노입자에 사용될 수 있는 한 예시적인 스테롤은 콜레스테롤 및 그의 유도체이다. 콜레스테롤 유도체의 비제한적인 예는 5a-콜레스탄올, 53-코프로스탄올, 콜레스테릴-(2'-히드록시)-에틸 에테르, 콜레스테릴-(4'-히드록시)-부틸 에테르 및 6-케토콜레스탄올과 같은 극성 유사체; 5a-콜레스탄, 콜레스테논, 5a-콜레스타논, 5p-콜레스타논 및 콜레스테릴 데카노에이트와 같은 비극성 유사체; 및 이들의 혼합물을 포함한다. 일부 실시 형태에서, 콜레스테롤 유도체는 극성 유사체, 예를 들어, 콜레스테릴-(4'-히드록시)-부틸 에테르이다. 예시적인 콜레스테롤 유도체는 PCT 공개 제WO2009/127060호 및 미국 특허 공개 제US2010/0130588호에 기재되어 있으며, 이의 각각은 그 전체가 본원에 참조로 포함된다.In some embodiments, lipid nanoparticles may further include components such as sterols to provide membrane integrity. One exemplary sterol that can be used in lipid nanoparticles is cholesterol and its derivatives. Non-limiting examples of cholesterol derivatives include 5a-cholestanol, 53-coprostanol, cholesteryl-(2'-hydroxy)-ethyl ether, cholesteryl-(4'-hydroxy)-butyl ether. and polar analogs such as 6-ketocholestanol; Non-polar analogs such as 5a-cholestane, cholesterone, 5a-cholestanone, 5p-cholestanone and cholesteryl decanoate; and mixtures thereof. In some embodiments, the cholesterol derivative is a polar analog, such as cholesteryl-(4'-hydroxy)-butyl ether. Exemplary cholesterol derivatives are described in PCT Publication No. WO2009/127060 and US Patent Publication No. US2010/0130588, each of which is incorporated herein by reference in its entirety.
일부 실시 형태에서, 막 온전성을 제공하는 구성성분, 예컨대 스테롤은 지질 나노입자에 존재하는 총 지질의 0 내지 50%(mol)(예를 들어, 0 내지 10%, 10 내지 20%, 20 내지 30%, 30 내지 40% 또는 40 내지 50%)를 구성할 수 있다. 일부 실시 형태에서, 이러한 구성성분은 지질 나노입자의 총 지질 함량의 20% 내지 50%(mol) 30 내지 40%(mol)이다.In some embodiments, components that provide membrane integrity, such as sterols, are present in the lipid nanoparticles from 0 to 50% (mol) (e.g., 0 to 10%, 10 to 20%, 20 to 50%) of the total lipids present in the lipid nanoparticles. 30%, 30 to 40% or 40 to 50%). In some embodiments, these components are 20% to 50% (mol) or 30 to 40% (mol) of the total lipid content of the lipid nanoparticle.
일부 실시 형태에서, 지질 나노입자는 폴리에틸렌 글리콜(PEG) 또는 컨쥬게이트된 지질 분자를 포함할 수 있다. 일반적으로, 이들은 지질 나노입자의 응집을 억제하고/거나 입체 안정화를 제공하기 위해 사용된다. 예시적인 컨쥬게이트된 지질은 PEG-지질 컨쥬게이트, 폴리옥사졸린(POZ)-지질 컨쥬게이트, 폴리아미드-지질 컨쥬게이트(예컨대, ATTA-지질 컨쥬게이트), 양이온성 중합체-지질(CPL) 컨쥬게이트 및 이들의 혼합물을 포함하지만, 이에 한정되는 것은 아니다. 일부 실시 형태에서, 컨쥬게이트된 지질 분자는 PEG-지질 컨쥬게이트, 예를 들어, (메톡시 폴리에틸렌 글리콜)-컨쥬게이트된 지질이다.In some embodiments, lipid nanoparticles may include polyethylene glycol (PEG) or conjugated lipid molecules. Typically, they are used to inhibit aggregation and/or provide steric stabilization of lipid nanoparticles. Exemplary conjugated lipids include PEG-lipid conjugates, polyoxazoline (POZ)-lipid conjugates, polyamide-lipid conjugates (e.g., ATTA-lipid conjugates), cationic polymer-lipid (CPL) conjugates. and mixtures thereof, but are not limited thereto. In some embodiments, the conjugated lipid molecule is a PEG-lipid conjugate, such as (methoxy polyethylene glycol)-conjugated lipid.
예시적인 PEG-지질 컨쥬게이트는 PEG-디아실글리세롤(DAG)(예컨대, 1-(모노메톡시-폴리에틸렌글리콜)-2,3-디미리스토일글리세롤(PEG-DMG)), PEG-디알킬옥시프로필(DAA), PEG-인지질, PEG-세라미드(Cer), PEG화 포스파티딜에탄올로아민(PEG-PE), PEG 숙시네이트 디아실글리세롤(PEGS-DAG)(예컨대, 4-O-(2',3'-디(테트라데카노일옥시)프로필-1-O-(w-메톡시(폴리에톡시)에틸) 부탄디오에이트(PEG-S-DMG)), PEG 디알콕시프로필카르밤, N-(카르보닐-메톡시폴리에틸렌 글리콜 2000)-l,2-디스테아로일-sn-글리세로-3-포스포에탄올아민 나트륨 염, 또는 이들의 혼합물을 포함하지만, 이에 한정되는 것은 아니다. 추가적인 예시적인 PEG-지질 컨쥬게이트는 예를 들어, 제US5,885,613호, 제US6,287,591호, 제US2003/0077829호, 제US2003/0077829호, 제US2005/0175682호, 제US2008/0020058호, 제US2011/0117125호, 제US2010/0130588호, 제US2016/0376224호, 제US2017/0119904호, 제US2018/0028664호, 및 제WO2017/099823호에 기재되어 있으며, 이들 모두의 내용은 그 전체가 본원에 참조로 포함된다. 일부 실시 형태에서, PEG-지질은 그의 내용 전체가 본원에 참조로 포함되는 제US2018/0028664호의 화학식 III, III-a-I, III-a-2, III-b-1, III-b-2 또는 V의 화합물이다. 일부 실시 형태에서, PEG-지질은 둘 모두의 내용의 전체가 본원에 참조로 포함되는 제US20150376115호 또는 제US2016/0376224호의 화학식 II이다. 일부 실시 형태에서, PEG-DAA 컨쥬게이트는 예를 들어, PEG-디라우릴옥시프로필, PEG-디미리스틸옥시프로필, PEG-디팔미틸옥시프로필, 또는 PEG-디스테아릴옥시프로필일 수 있다. PEG-지질은 PEG-DMG, PEG-디라우릴글리세롤, PEG-디팔미토일글리세롤, PEG-디스테릴글리세롤, PEG-디라우릴글리카미드, PEG-디미리스틸글리카미드, PEG-디팔미토일글리카미드, PEG-디스테릴글리카미드, PEG-콜레스테롤(1-[8'-(콜레스트-5-엔-3[베타]-옥시)카르복스아미도-3',6'-디옥사옥타닐]카르바모일-[오메가]-메틸-폴리(에틸렌 글리콜), PEG-DMB(3,4-디테트라데콕실벤질-[오메가]-메틸-폴리(에틸렌 글리콜)에테르) 및 1,2-디미리스토일-sn-글리세로-3-포스포에탄올아민-N-[메톡시(폴리에틸렌 글리콜)-2000]일 수 있다. 일부 실시 형태에서, PEG-지질은 PEG-DMG, 1,2-디미리스토일-sn-글리세로-3-포스포에탄올아민-N-[메톡시(폴리에틸렌 글리콜)-2000]을 포함한다. 일부 실시 형태에서, PEG-지질은 하기로부터 선택되는 구조를 포함한다:Exemplary PEG-lipid conjugates include PEG-diacylglycerol (DAG) (e.g., 1-(monomethoxy-polyethylene glycol)-2,3-dimyristoylglycerol (PEG-DMG)), PEG-dialkyl Oxypropyl (DAA), PEG-phospholipid, PEG-ceramide (Cer), PEGylated phosphatidylethanolamine (PEG-PE), PEG succinate diacylglycerol (PEGS-DAG) (e.g., 4-O-(2' ,3'-di(tetradecanoyloxy)propyl-1-O-(w-methoxy(polyethoxy)ethyl) butanedioate (PEG-S-DMG)), PEG dialkoxypropylcarbam, N- (carbonyl-methoxypolyethylene glycol 2000)-l,2-distearoyl-sn-glycero-3-phosphoethanolamine sodium salt, or mixtures thereof. Suitable PEG-lipid conjugates include, for example, US5,885,613, US6,287,591, US2003/0077829, US2003/0077829, US2005/0175682, US2008/0020058, US2011/ 0117125, US2010/0130588, US2016/0376224, US2017/0119904, US2018/0028664, and WO2017/099823, the contents of which are all incorporated herein by reference in their entirety. In some embodiments, PEG-lipids are included in Formula III, III-a-I, III-a-2, III-b-1, III-b- of US2018/0028664, the contents of which are incorporated herein by reference in their entirety. 2 or V. In some embodiments, the PEG-lipid is Formula II of US20150376115 or US2016/0376224, the contents of which are both incorporated herein by reference. The conjugate may be, for example, PEG-dilauryloxypropyl, PEG-dimyristyloxypropyl, PEG-dipalmityloxypropyl, or PEG-distearyloxypropyl, PEG-DMG, PEG-dilaurylglycerol, PEG-dipalmitoylglycerol, PEG-disterylglycerol, PEG-dilaurylglycamide, PEG-dimyristylglycamide, PEG-dipalmitoylglycamide, PEG-disterylglycerol Limid, PEG-cholesterol (1-[8'-(cholest-5-en-3[beta]-oxy)carboxamido-3',6'-dioxaoctanyl]carbamoyl-[omega ]-methyl-poly(ethylene glycol), PEG-DMB (3,4-ditetradecoxybenzyl-[omega]-methyl-poly(ethylene glycol)ether) and 1,2-dimyristoyl-sn-glyce It may be rho-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000]. In some embodiments, the PEG-lipid comprises PEG-DMG, 1,2-dimyristoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000]. In some embodiments, the PEG-lipid comprises a structure selected from:
일부 실시 형태에서, PEG 이외의 분자와 컨쥬게이트된 지질이 또한 PEG-지질 대신 사용될 수 있다. 예를 들어, 폴리옥사졸린(POZ)-지질 컨쥬게이트, 폴리아미드-지질 컨쥬게이트(예컨대, ATTA-지질 컨쥬게이트) 및 양이온성 중합체-지질(GPL) 컨쥬게이트가 PEG-지질 대신에 또는 이에 더하여 사용될 수 있다.In some embodiments, lipids conjugated with molecules other than PEG may also be used in place of PEG-lipids. For example, polyoxazoline (POZ)-lipid conjugates, polyamide-lipid conjugates (e.g., ATTA-lipid conjugates), and cationic polymer-lipid (GPL) conjugates can be used instead of or in addition to PEG-lipids. can be used
예시적인 컨쥬게이트된 지질, 즉, PEG-지질, (POZ)-지질 컨쥬게이트, ATTA-지질 컨쥬게이트 및 양이온성 중합체-지질은, 모든 내용의 전체가 본원에 참조로 포함되는 제WO2019051289A9호의 표 2에 열거된 PCT 및 LIS 특허 출원에 기재되어 있다.Exemplary conjugated lipids, i.e., PEG-lipids, (POZ)-lipid conjugates, ATTA-lipid conjugates and cationic polymer-lipids, are listed in Table 2 of WO2019051289A9, the entire contents of which are incorporated herein by reference in their entirety. It is described in the PCT and LIS patent applications listed in .
일부 실시 형태에서, PEG 또는 컨쥬게이트된 지질은 지질 나노입자에 존재하는 총 지질의 0 내지 20%(mol)를 구성할 수 있다. 일부 실시 형태에서, PEG 또는 컨쥬게이트된 지질 함량은 지질 나노입자에 존재하는 총 지질의 0.5 내지 10% 또는 2 내지 5%(mol)이다. 이온화 가능한 지질, 비-양이온성-지질, 스테롤 및 PEG-컨쥬게이트된 지질의 몰비는 필요에 따라 달라질 수 있다. 예를 들어, 지질 입자는 조성물의 총 중량 또는 몰 기준으로 30 내지 70%의 이온화 가능한 지질, 조성물의 총 중량 또는 몰 기준으로 0 내지 60%의 콜레스테롤, 조성물의 총 중량 또는 몰 기준으로 0 내지 30%의 비-양이온성 지질 및 조성물의 총 중량 또는 몰 기준으로 1 내지 10%의 컨쥬게이트된 지질을 포함할 수 있다. 바람직하게는, 조성물은 조성물의 총 중량 또는 몰 기준으로 30 내지 40%의 이온화 가능한 지질, 조성물의 총 중량 또는 몰 기준으로 40 내지 50%의 콜레스테롤, 및 조성물의 총 중량 또는 몰 기준으로 10 내지 20%의 비-양이온성-지질을 포함한다. 일부 다른 실시 형태에서, 조성물은 조성물의 총 중량 또는 몰 기준으로 50 내지 75%의 이온화 가능한 지질, 조성물의 총 중량 또는 몰 기준으로 20 내지 40%의 콜레스테롤, 및 조성물의 총 중량 또는 몰 기준으로 5 내지 10%의 비-양이온성 지질 및 조성물의 총 중량 또는 몰 기준으로 1 내지 10%의 컨쥬게이트된 지질이다. 조성물은 조성물의 총 중량 또는 몰 기준으로 60 내지 70%의 이온화 가능한 지질, 조성물의 총 중량 또는 몰 기준으로 25 내지 35%의 콜레스테롤, 및 조성물의 총 중량 또는 몰 기준으로 5 내지 10%의 비-양이온성 지질을 함유할 수 있다. 조성물은 또한, 조성물의 총 중량 또는 몰 기준으로 최대 90%의 이온화 가능한 지질 및 조성물의 총 중량 또는 몰 기준으로 2 내지 15%의 비-양이온성 지질을 함유할 수 있다. 제형은 또한, 예를 들어, 조성물의 총 중량 또는 몰 기준으로 8 내지 30%의 이온화 가능한 지질, 조성물의 총 중량 또는 몰 기준으로 5 내지 30%의 비-양이온성 지질 및 조성물의 총 중량 또는 몰 기준으로 0 내지 20%의 콜레스테롤; 조성물의 총 중량 또는 몰 기준으로 4 내지 25% 이온화 가능한 지질, 조성물의 총 중량 또는 몰 기준으로 4 내지 25%의 비-양이온성 지질, 조성물의 총 중량 또는 몰 기준으로 2 내지 25%의 콜레스테롤, 조성물의 총 중량 또는 몰 기준으로 10 내지 35%의 컨쥬게이트 지질 및 조성물의 총 중량 또는 몰 기준으로 5%의 콜레스테롤; 또는 조성물의 총 중량 또는 몰 기준으로 2 내지 30%의 이온화 가능한 지질, 조성물의 총 중량 또는 몰 기준으로 2 내지 30%의 비-양이온성 지질, 조성물의 총 중량 또는 몰 기준으로 1 내지 15%의 콜레스테롤, 조성물의 총 중량 또는 몰 기준으로 2 내지 35%의 컨쥬게이트 지질 및 조성물의 총 중량 또는 몰 기준으로 1 내지 20%의 콜레스테롤; 또는 심지어 조성물의 총 중량 또는 몰 기준으로 최대 90%의 이온화 가능한 지질 및 조성물의 총 중량 또는 몰 기준으로 2 내지 10%의 비-양이온성 지질 또는 심지어 조성물의 총 중량 또는 몰 기준으로 100%의 양이온성 지질을 포함하는 지질 나노입자 제형일 수 있다. 일부 실시 형태에서, 지질 입자 제형은 50:10:38.5:1.5의 몰비의 이온화 가능한 지질, 인지질, 콜레스테롤 및 PEG화 지질을 포함한다. 일부 다른 실시 형태에서, 지질 입자 제형은 60:38.5:1.5의 몰비의 이온화 가능한 지질, 콜레스테롤 및 PEG화 지질을 포함한다.In some embodiments, PEG or conjugated lipids may constitute 0 to 20% (mol) of the total lipids present in the lipid nanoparticle. In some embodiments, the PEG or conjugated lipid content is 0.5-10% or 2-5% (mol) of the total lipids present in the lipid nanoparticle. The molar ratios of ionizable lipids, non-cationic-lipids, sterols and PEG-conjugated lipids can be varied as needed. For example, the lipid particles may contain 30 to 70% ionizable lipids by total weight or mole of the composition, 0 to 60% cholesterol by total weight or mole of the composition, and 0 to 30% cholesterol by total weight or mole of the composition. % non-cationic lipid and 1 to 10% conjugated lipid by total weight or mole basis of the composition. Preferably, the composition contains 30 to 40% ionizable lipids by total weight or mole of the composition, 40 to 50% cholesterol by total weight or mole of the composition, and 10 to 20% cholesterol by total weight or mole of the composition. % non-cationic lipids. In some other embodiments, the composition comprises 50 to 75% ionizable lipids by total weight or mole of the composition, 20 to 40% cholesterol by total weight or mole of the composition, and 5% by weight or mole of the composition. to 10% non-cationic lipid and 1 to 10% conjugated lipid by total weight or mole basis of the composition. The composition comprises 60 to 70% by total weight or mole of the composition ionizable lipid, 25 to 35% cholesterol by total weight or mole of the composition, and 5 to 10% by total weight or mole of the composition non- May contain cationic lipids. The composition may also contain up to 90% ionizable lipids by total weight or mole of the composition and 2 to 15% non-cationic lipids by total weight or mole of the composition. The formulation may also include, for example, 8 to 30% by total weight or mole of the composition ionizable lipid, 5 to 30% by total weight or mole of the composition non-cationic lipid and 0 to 20% cholesterol on a baseline; 4 to 25% ionizable lipids by total weight or mole of the composition, 4 to 25% non-cationic lipids by total weight or mole of the composition, 2 to 25% cholesterol by total weight or mole of the composition, 10 to 35% by total weight or mole of the composition conjugated lipid and 5% cholesterol by total weight or mole of the composition; or 2 to 30% by total weight or mole of the composition, ionizable lipid, 2 to 30% by total weight or mole of the composition, non-cationic lipid, 1 to 15% by total weight or mole of the composition. Cholesterol, 2 to 35% by total weight or mole of the composition conjugated lipid and 1 to 20% cholesterol by total weight or mole of the composition; or even up to 90% ionizable lipids by total weight or mole of the composition and 2 to 10% non-cationic lipids by total weight or mole of the composition or even 100% cationic by total weight or mole of the composition. It may be a lipid nanoparticle formulation containing lipids. In some embodiments, the lipid particle formulation includes ionizable lipids, phospholipids, cholesterol, and PEGylated lipids in a molar ratio of 50:10:38.5:1.5. In some other embodiments, the lipid particle formulation includes ionizable lipid, cholesterol, and PEGylated lipid in a molar ratio of 60:38.5:1.5.
일부 실시 형태에서, 지질 입자는 이온화 가능한 지질, 비-양이온성 지질(예를 들어, 인지질), 스테롤(예를 들어, 콜레스테롤) 및 PEG화 지질을 포함하며, 지질의 몰비는 이온화 가능한 지질의 경우 20 내지 70 몰%의 범위(목표는 40 내지 60 몰%임)이고, 비양이온성 지질의 몰%는 0 내지 30몰%의 범위(목표는 0 내지 15몰%임)이고, 스테롤의 몰%는 20 내지 70 몰%의 범위(목표는 30 내지 50 몰%임)이고, PEG화 지질의 몰%는 1 내지 6 몰%의 범위(목표는 2 내지 5 몰%임)이다.In some embodiments, the lipid particle comprises an ionizable lipid, a non-cationic lipid (e.g., phospholipid), a sterol (e.g., cholesterol), and a PEGylated lipid, and the molar ratio of lipids is as follows for the ionizable lipid: The mole % of non-cationic lipids ranges from 0 to 30 mole % (the target is 0 to 15 mole %), and the mole % of sterols ranges from 20 to 70 mole % (the target is 40 to 60 mole %). is in the range of 20 to 70 mole % (target is 30 to 50 mole %), and the mole % of PEGylated lipid is in the range of 1 to 6 mole % (target is 2 to 5 mole %).
일부 실시 형태에서, 지질 입자는 이온화 가능한 지질 / 비-양이온성-지질 / 스테롤 / 컨쥬게이트된 지질을 50:10:38.5:1.5의 몰비로 포함한다.In some embodiments, the lipid particle comprises ionizable lipid/non-cationic lipid/sterol/conjugated lipid in a molar ratio of 50:10:38.5:1.5.
한 양태에서, 본 개시내용은 인지질, 레시틴, 포스파티딜콜린 및 포스파티딜에탄올아민을 포함하는 지질 나노입자 제형을 제공한다.In one aspect, the present disclosure provides a lipid nanoparticle formulation comprising phospholipids, lecithin, phosphatidylcholine, and phosphatidylethanolamine.
일부 실시 형태에서, 하나 이상의 추가적인 화합물이 또한 포함될 수 있다. 이들 화합물은 개별적으로 투여될 수 있거나, 추가적인 화합물은 본 발명의 지질 나노입자에 포함될 수 있다. 다시 말하면, 지질 나노입자는 핵산에 더하여 다른 화합물 또는 적어도 제1 핵산과는 상이한 제2 핵산을 함유할 수 있다. 제한 없이, 다른 추가적인 화합물은 소형 또는 대형 유기 또는 무기 분자, 단당류, 이당류, 삼당류, 올리고당류, 다당류, 펩티드, 단백질, 펩티드 유사체 및 그의 유도체, 펩티드 모방체, 핵산, 핵산 유사체 및 유도체, 생물학적 물질로 제조된 추출물, 또는 이들의 임의의 조합으로 이루어진 군으로부터 선택될 수 있다.In some embodiments, one or more additional compounds may also be included. These compounds can be administered individually, or additional compounds can be included in the lipid nanoparticles of the invention. In other words, the lipid nanoparticle may contain, in addition to the nucleic acid, another compound or at least a second nucleic acid that is different from the first nucleic acid. Without limitation, other additional compounds include small or large organic or inorganic molecules, monosaccharides, disaccharides, trisaccharides, oligosaccharides, polysaccharides, peptides, proteins, peptide analogs and derivatives thereof, peptide mimetics, nucleic acids, nucleic acid analogs and derivatives, biological substances. It may be selected from the group consisting of extracts prepared with, or any combination thereof.
일부 실시 형태에서, LNP는 생체분해성 이온화 가능한 지질을 포함한다. 일부 실시 형태에서, LNP는 3-((4,4-비스(옥틸옥시)부타노일)옥시)-2-((((3-(디에틸아미노)프로폭시)카르보닐)옥시)메틸)프로필(9Z,l2Z)-옥타데카-9,l2-디에노에이트)로도 지칭되는 (9Z,l2Z)-3-((4,4-비스(옥틸옥시)부타노일)옥시)-2-((((3-(디에틸아미노)프로폭시)카르보닐)옥시)메틸)프로필 옥타데카-9,l2-디에노에이트 또는 또 다른 이온화 가능한 지질을 포함한다. 예를 들어, 제WO2019/067992호, 제WO/2017/173054호, 제WO2015/095340호 및 제WO2014/136086호 및 그 안에 제공되는 참고문헌의 지질을 참조한다. 일부 실시 형태에서, LNP 지질의 맥락에서 양이온성 및 이온화 가능한이라는 용어는 상호교환 가능하며, 예를 들어, 이온화 가능한 지질은 pH에 따라 양이온성이다.In some embodiments, the LNPs comprise biodegradable ionizable lipids. In some embodiments, the LNP is 3-((4,4-bis(octyloxy)butanoyl)oxy)-2-((((3-(diethylamino)propoxy)carbonyl)oxy)methyl)propyl (9Z,l2Z)-3-((4,4-bis(octyloxy)butanoyl)oxy)-2-(((( (3-(diethylamino)propoxy)carbonyl)oxy)methyl)propyl octadeca-9,l2-dienoate or another ionizable lipid. See, for example, the lipids in WO2019/067992, WO/2017/173054, WO2015/095340 and WO2014/136086 and the references provided therein. In some embodiments, the terms cationic and ionizable in the context of LNP lipids are interchangeable, e.g., an ionizable lipid is cationic depending on pH.
일부 실시 형태에서, LNP 제형의 평균 LNP 직경은 수십 nm 내지 수백 nm일 수 있으며, 예를 들어, 동적 광 산란(DLS)에 의해 측정된다. 일부 실시 형태에서, LNP 제형의 평균 LNP 직경은 약 40 nm 내지 약 150 nm, 예컨대 약 40 nm, 45 nm, 50 nm, 55 nm, 60 nm, 65 nm, 70 nm, 75 nm, 80 nm, 85 nm, 90 nm, 95 nm, 100 nm, 105 nm, 110 nm, 115 nm, 120 nm, 125 nm, 130 nm, 135 nm, 140 nm, 145 nm 또는 150 nm일 수 있다. 일부 실시 형태에서, LNP 제형의 평균 LNP 직경은 약 50 nm 내지 약 100 nm, 약 50 nm 내지 약 90 nm, 약 50 nm 내지 약 80 nm, 약 50 nm 내지 약 70 nm, 약 50 nm 내지 약 60 nm, 약 60 nm 내지 약 100 nm, 약 60 nm 내지 약 90 nm, 약 60 nm 내지 약 80 nm, 약 60 nm 내지 약 70 nm, 약 70 nm 내지 약 100 nm, 약 70 nm 내지 약 90 nm, 약 70 nm 내지 약 80 nm, 약 80 nm 내지 약 100 nm, 약 80 nm 내지 약 90 nm 또는 약 90 nm 내지 약 100 nm일 수 있다. 일부 실시 형태에서, LNP 제형의 평균 LNP 직경은 약 70 nm 내지 약 100 nm일 수 있다. 특정 실시 형태에서, LNP 제형의 평균 LNP 직경은 약 80 nm일 수 있다. 일부 실시 형태에서, LNP 제형의 평균 LNP 직경은 약 100 nm일 수 있다. 일부 실시 형태에서, LNP 제형의 평균 LNP 직경은 약 1 mm 내지 약 500 mm, 약 5 mm 내지 약 200 mm, 약 10 mm 내지 약 100 mm, 약 20 mm 내지 약 80 mm, 약 25 mm 내지 약 60 mm, 약 30 mm 내지 약 55 mm, 약 35 mm 내지 약 50 mm 또는 약 38 mm 내지 약 42 mm의 범위이다.In some embodiments, the average LNP diameter of the LNP formulation may be tens to hundreds of nm, as measured, for example, by dynamic light scattering (DLS). In some embodiments, the average LNP diameter of the LNP formulation is from about 40 nm to about 150 nm, such as about 40 nm, 45 nm, 50 nm, 55 nm, 60 nm, 65 nm, 70 nm, 75 nm, 80 nm, 85 nm. nm, 90 nm, 95 nm, 100 nm, 105 nm, 110 nm, 115 nm, 120 nm, 125 nm, 130 nm, 135 nm, 140 nm, 145 nm or 150 nm. In some embodiments, the average LNP diameter of the LNP formulation is from about 50 nm to about 100 nm, from about 50 nm to about 90 nm, from about 50 nm to about 80 nm, from about 50 nm to about 70 nm, from about 50 nm to about 60 nm. nm, about 60 nm to about 100 nm, about 60 nm to about 90 nm, about 60 nm to about 80 nm, about 60 nm to about 70 nm, about 70 nm to about 100 nm, about 70 nm to about 90 nm, It may be about 70 nm to about 80 nm, about 80 nm to about 100 nm, about 80 nm to about 90 nm, or about 90 nm to about 100 nm. In some embodiments, the average LNP diameter of the LNP formulation may be from about 70 nm to about 100 nm. In certain embodiments, the average LNP diameter of the LNP formulation may be about 80 nm. In some embodiments, the average LNP diameter of the LNP formulation may be about 100 nm. In some embodiments, the average LNP diameter of the LNP formulation is from about 1 mm to about 500 mm, from about 5 mm to about 200 mm, from about 10 mm to about 100 mm, from about 20 mm to about 80 mm, from about 25 mm to about 60 mm. mm, ranging from about 30 mm to about 55 mm, from about 35 mm to about 50 mm, or from about 38 mm to about 42 mm.
LNP는 일부 경우에, 상대적으로 균질할 수 있다. 다분산 지수는 LNP의 균질성, 예를 들어, 지질 나노입자의 입자 크기 분포를 나타내기 위해 사용될 수 있다. 작은(예를 들어, 0.3 미만) 다분산 지수는 일반적으로 좁은 입자 크기 분포를 나타낸다. LNP는 약 0 내지 약 0.25, 예컨대 0.01, 0.02, 0.03, 0.04, 0.05, 0.06, 0.07, 0.08, 0.09, 0.10, 0.11, 0.12, 0.13, 0.14, 0.15, 0.16, 0.17, 0.18, 0.19, 0.20, 0.21, 0.22, 0.23, 0.24 또는 0.25의 다분산 지수를 가질 수 있다. 일부 실시 형태에서, LNP의 다분산 지수는 약 0.10 내지 약 0.20일 수 있다.LNPs may, in some cases, be relatively homogeneous. The polydispersity index can be used to indicate the homogeneity of LNPs, for example, the particle size distribution of lipid nanoparticles. A small (e.g., less than 0.3) polydispersity index generally indicates a narrow particle size distribution. LNP is from about 0 to about 0.25, such as 0.01, 0.02, 0.03, 0.04, 0.05, 0.06, 0.07, 0.08, 0.09, 0.10, 0.11, 0.12, 0.13, 0.14, 0.15, 0.16, 0.17, 8, 0.19, 0.20, 0.21 , may have a polydispersity index of 0.22, 0.23, 0.24, or 0.25. In some embodiments, the polydispersity index of the LNPs may be from about 0.10 to about 0.20.
LNP의 제타 전위는 조성물의 계면 동전위를 나타내기 위해 사용될 수 있다. 일부 실시 형태에서, 제타 전위는 LNP의 표면 전하를 설명할 수 있다. 더 고도로 하전된 종은 신체의 세포, 조직, 및 다른 요소와 바람직하지 않게 상호작용할 수 있기 때문에, 상대적으로 낮은 양전하 또는 음전하를 갖는 지질 나노입자가 일반적으로 바람직하다. 일부 실시 형태에서, LNP의 제타 전위는 약 -10 mV 내지 약 +20 mV, 약 -10 mV 내지 약 +15 mV, 약 -10 mV 내지 약 +10 mV, 약 -10 mV 내지 약 +5 mV, 약 -10 mV 내지 약 0 mV, 약 -10 mV 내지 약 -5 mV, 약 -5 mV 내지 약 +20 mV, 약 -5 mV 내지 약 +15 mV, 약 -5 mV 내지 약 +10 mV, 약 -5 mV 내지 약 +5 mV, 약 -5 mV 내지 약 0 mV, 약 0 mV 내지 약 +20 mV, 약 0 mV 내지 약 +15 mV, 약 0 mV 내지 약 +10 mV, 약 0 mV 내지 약 +5 mV, 약 +5 mV 내지 약 +20 mV, 약 +5 mV 내지 약 +15 mV 또는 약 +5 mV 내지 약 +10 mV일 수 있다.The zeta potential of LNPs can be used to indicate the interfacial electropotential of the composition. In some embodiments, zeta potential can describe the surface charge of LNPs. Lipid nanoparticles with relatively low positive or negative charges are generally preferred because more highly charged species may interact undesirably with cells, tissues, and other elements of the body. In some embodiments, the zeta potential of the LNP is from about -10 mV to about +20 mV, about -10 mV to about +15 mV, about -10 mV to about +10 mV, about -10 mV to about +5 mV, About -10 mV to about 0 mV, about -10 mV to about -5 mV, about -5 mV to about +20 mV, about -5 mV to about +15 mV, about -5 mV to about +10 mV, about -5 mV to about +5 mV, about -5 mV to about 0 mV, about 0 mV to about +20 mV, about 0 mV to about +15 mV, about 0 mV to about +10 mV, about 0 mV to about It may be +5 mV, about +5 mV to about +20 mV, about +5 mV to about +15 mV, or about +5 mV to about +10 mV.
단백질 및/또는 핵산의 캡슐화의 효율은 제공되는 초기의 양에 비하여, 제조 후에 LNP와 회합되거나 캡슐화된 단백질 및/또는 핵산의 양을 설명한다. 캡슐화 효율은 높은(예를 들어, 100%에 가까운) 것이 바람직하다. 캡슐화 효율은 예를 들어, 지질 나노입자를 하나 이상의 유기 용매 또는 세제로 분해(breaking up)하기 전과 후에 상기 지질 나노입자를 함유하는 용액에서 단백질 또는 핵산의 양을 비교함으로써 측정될 수 있다. 음이온 교환 수지를 사용하여, 용액 중 유리 단백질 또는 핵산(예를 들어, RNA)의 양을 측정할 수 있다. 형광은 용액 중 유리 단백질 및/또는 핵산(예를 들어, RNA)의 양을 측정하는 데 사용될 수 있다. 본원에 기재된 지질 나노입자의 경우, 단백질 및/또는 핵산의 캡슐화 효율은 적어도 50%, 예를 들어, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100%일 수 있다. 일부 실시 형태에서, 캡슐화 효율은 적어도 80%일 수 있다. 일부 실시 형태에서, 캡슐화 효율은 적어도 90%일 수 있다. 일부 실시 형태에서, 캡슐화 효율은 적어도 95%일 수 있다.Efficiency of encapsulation of proteins and/or nucleic acids describes the amount of proteins and/or nucleic acids that are associated with or encapsulated with the LNP after preparation, compared to the initial amount provided. It is desirable for the encapsulation efficiency to be high (e.g. close to 100%). Encapsulation efficiency can be measured, for example, by comparing the amount of protein or nucleic acid in a solution containing lipid nanoparticles before and after breaking them up with one or more organic solvents or detergents. Anion exchange resins can be used to measure the amount of free protein or nucleic acid (e.g., RNA) in solution. Fluorescence can be used to measure the amount of free protein and/or nucleic acid (e.g., RNA) in solution. For the lipid nanoparticles described herein, the encapsulation efficiency of proteins and/or nucleic acids is at least 50%, e.g., 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, It may be 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, or 100%. In some embodiments, the encapsulation efficiency can be at least 80%. In some embodiments, the encapsulation efficiency can be at least 90%. In some embodiments, the encapsulation efficiency can be at least 95%.
LNP는 선택적으로 하나 이상의 코팅을 포함할 수 있다. 일부 실시 형태에서, LNP는 코팅을 갖는 캡슐, 필름 또는 정제로 제형화될 수 있다. 본원에 기재된 조성물을 포함하는 캡슐, 필름 또는 정제는 임의의 유용한 크기, 인장 강도, 경도 또는 밀도를 가질 수 있다.LNPs may optionally include one or more coatings. In some embodiments, LNPs may be formulated into capsules, films, or tablets with a coating. Capsules, films or tablets containing the compositions described herein can have any useful size, tensile strength, hardness or density.
LNP의 추가적인 예시적인 지질, 제형, 방법 및 특성화는 각각의 전체가 본원에 참조로 포함되는 제WO2020/061457호 및 제WO2021/113777호에 교시되어 있다. LNP의 추가의 예시적인 지질, 제형, 방법 및 특성화는 그 전체가 본원에 참조로 포함되는 문헌[Hou et al. Lipid nanoparticles for mRNA delivery. Nat Rev Mater (2021). doi.org/10.1038/s41578-021-00358-0]에 교시되어 있다(예를 들어, 문헌[Hou et al.]의 도 2의 예시적인 지질 및 지질 유도체 참조).Additional exemplary lipids, formulations, methods and characterization of LNPs are taught in WO2020/061457 and WO2021/113777, each of which is incorporated herein by reference in its entirety. Additional exemplary lipids, formulations, methods and characterization of LNPs are described in Hou et al., which are incorporated herein by reference in their entirety. Lipid nanoparticles for mRNA delivery. Nat Rev Mater (2021). doi.org/10.1038/s41578-021-00358-0 (see, e.g., exemplary lipids and lipid derivatives in FIG. 2 in Hou et al.).
일부 실시 형태에서, 시험관내 또는 생체외 세포 리포펙션은 리포펙타민 메신저맥스(Lipofectamine MessengerMax)(써모 피셔(Thermo Fisher)) 또는 TransIT-mRNA 형질감염 시약(미루스 바이오(Mirus Bio))을 사용하여 수행된다. 특정 실시 형태에서, LNP는 GenVoy_ILM 이온화 가능한 지질 믹스(프리시젼 나노시스템즈(Precision NanoSystems))를 사용하여 제형화된다. 특정 실시 형태에서, LNP는 2,2-디리놀레일-4-디메틸아미노에틸-[1,3]-디옥솔란(DLin-KC2-DMA) 또는 디리놀레일메틸-4-디메틸아미노부티레이트(DLin-MC3-DMA 또는 MC3)를 사용하여 제형화되며, 이의 제형 및 생체내 이용은 그 전체가 본원에 참조로 포함되는 문헌[Jayaraman et al. Angew Chem Int Ed Engl 51(34):8529-8533 (2012)]에 교시되어 있다.In some embodiments, in vitro or ex vivo cell lipofection is performed using Lipofectamine MessengerMax (Thermo Fisher) or TransIT-mRNA transfection reagent (Mirus Bio). It is carried out. In certain embodiments, LNPs are formulated using GenVoy_ILM ionizable lipid mix (Precision NanoSystems). In certain embodiments, the LNP is 2,2-dilinoleyl-4-dimethylaminoethyl-[1,3]-dioxolane (DLin-KC2-DMA) or dilinoleylmethyl-4-dimethylaminobutyrate (DLin- MC3-DMA or MC3), the formulation and in vivo use of which are described in Jayaraman et al., which is incorporated herein by reference in its entirety. Angew Chem Int Ed Engl 51(34):8529-8533 (2012).
CRISPR-Cas 시스템, 예를 들어, Cas9-gRNA RNP, gRNA, Cas9 mRNA의 전달을 위해 최적화된 LNP 제형은 둘 모두가 참조로 포함되는 제WO2019067992호 및 제WO2019067910호에 기재되어 있으며, 본원에 기재된 원형 폴리리보뉴클레오티드 및 선형 폴리리보뉴클레오티드의 전달에 유용하다.CRISPR-Cas systems, e.g., LNP formulations optimized for delivery of Cas9-gRNA RNP, gRNA, Cas9 mRNA, are described in WO2019067992 and WO2019067910, both incorporated by reference, and the prototype described herein. It is useful for the delivery of polyribonucleotides and linear polyribonucleotides.
핵산(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드)의 전달에 유용한 추가적인 구체적인 LNP 제형은 둘 모두가 참조로 포함되는 제US8158601호 및 제US8168775호에 기재되어 있으며, 이는 명칭 ONPATTRO 하에 판매되는 파티시란(patisiran)에서 사용되는 제형을 포함한다.Additional specific LNP formulations useful for the delivery of nucleic acids (e.g., circular polyribonucleotides, linear polyribonucleotides) are described in US8158601 and US8168775, both incorporated by reference, which are sold under the name ONPATTRO. Includes dosage forms used in patisiran.
실시 형태에서, 본원에 기재된 단백질 또는 폴리펩티드의 적어도 일부(예를 들어, 항원성 부분)를 인코딩하는 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드)는 LNP로 제형화되며, 여기서: (a) LNP는 양이온성 지질, 중성 지질, 콜레스테롤, 및 PEG 지질을 포함하고, (b) LNP는 80 nm 내지 160 nm의 평균 입자 크기를 가지며, (c) 폴리리보뉴클레오티드. 실시 형태에서, LNP로 제형화된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드)는 백신이다.In an embodiment, a polyribonucleotide (e.g., a circular polyribonucleotide, a linear polyribonucleotide) encoding at least a portion (e.g., an antigenic portion) of a protein or polypeptide described herein is formulated into an LNP; where: (a) the LNPs include cationic lipids, neutral lipids, cholesterol, and PEG lipids, (b) the LNPs have an average particle size of 80 nm to 160 nm, and (c) polyribonucleotides. In an embodiment, the polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) formulated with LNP is a vaccine.
폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) LNP의 예시적인 투여는 약 0.1, 0.25, 0.3, 0.5, 1, 2, 3, 4, 5, 6, 8, 10, 또는 100 mg/kg(RNA)을 포함할 수 있다. 일부 실시 형태에서, 본원에 기재된 폴리리보뉴클레오티드(예를 들어, 원형 폴리리보뉴클레오티드, 선형 폴리리보뉴클레오티드) 항원성 조성물의 용량은 30 내지 200 mcg, 예를 들어, 30 mcg, 50 mcg, 75 mcg, 100 mcg, 150 mcg, 또는 200 mcg이다.Exemplary doses of polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) LNPs include about 0.1, 0.25, 0.3, 0.5, 1, 2, 3, 4, 5, 6, 8, 10, or It may contain 100 mg/kg (RNA). In some embodiments, the dose of the polyribonucleotide (e.g., circular polyribonucleotide, linear polyribonucleotide) antigenic composition described herein is 30 to 200 mcg, e.g., 30 mcg, 50 mcg, 75 mcg, 100 mcg, 150 mcg, or 200 mcg.
키트kit
일부 양태에서, 본 개시내용은 키트를 제공한다. 일부 실시 형태에서, 키트는 (a) 본원에 기재된 항푸소제닉 폴리펩티드(예를 들어, 표 1의 폴리펩티드)를 인코딩하는 원형 폴리리보뉴클레오티드 또는 약제학적 조성물, 및 선택적으로 (b) 정보 자료(informational material)를 포함한다. 정보 자료는 본원에 기재된 방법 및/또는 본원에 기재된 방법에 대한 약제학적 조성물 또는 원형 폴리리보뉴클레오티드의 용도에 관한 설명서, 사용지침서, 홍보물 또는 다른 자료일 수 있다. 약제학적 조성물 또는 원형 폴리리보뉴클레오티드는 단회 투여를 위한 물질(예를 들어, 단회 투여 형태)을 포함할 수 있거나, 다중 투여를 위한 물질(예를 들어, "다중용량" 키트)을 포함할 수 있다.In some aspects, the present disclosure provides kits. In some embodiments, the kit comprises (a) a circular polyribonucleotide or pharmaceutical composition encoding an antifusogenic polypeptide described herein (e.g., a polypeptide in Table 1), and optionally (b) informational material. ) includes. The informational material may be a description, instructions, promotional material, or other material relating to the methods described herein and/or the use of the circular polyribonucleotide or pharmaceutical composition for the methods described herein. The pharmaceutical composition or circular polyribonucleotide may include material for a single administration (e.g., a single dose form) or may include material for multiple administrations (e.g., a “multidose” kit). .
키트의 정보 자료는 그 형태로 제한되지 않는다. 한 실시 형태에서, 정보 자료는 약제학적 조성물, 약제학적 약물 물질, 또는 약제학적 약물 생성물의 생산에 관한 정보, 약제학적 조성물, 약제학적 약물 물질, 또는 약제학적 약물 생성물의 분자량, 농도, 유통기한, 배치(batch) 또는 생산지 정보 등을 포함할 수 있다. 한 실시 형태에서, 정보 자료는 약제학적 조성물의 투여 형태를 시행하는 방법에 관한 것이다. 한 실시 형태에서, 정보 자료는 원형 폴리리보뉴클레오티드의 투여 형태를 시행하는 방법에 관한 것이다.The information material in the kit is not limited to its format. In one embodiment, the information material includes information regarding the production of the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product, the molecular weight, concentration, shelf life of the pharmaceutical composition, pharmaceutical drug substance, or pharmaceutical drug product; It may include batch or production location information, etc. In one embodiment, the information material relates to methods of administering the dosage form of the pharmaceutical composition. In one embodiment, the information material relates to a method of carrying out the dosage form of circular polyribonucleotide.
본원에 기재된 약제학적 조성물 및 원형 폴리리보뉴클레오티드의 투여 형태 이외에, 키트는 다른 성분, 예컨대 용매 또는 완충제, 안정화제, 보존제, 향미제(예를 들어, 쓴맛 길항제 또는 감미제), 향료, 예를 들어, 키트 내의 하나 이상의 구성성분의 색조 또는 착색을 위한 염료 또는 착색제, 또는 다른 화장품 성분, 및/또는 본원에 기재된 질환 또는 장애를 치료하기 위한 제2 작용제를 포함할 수 있다. 대안적으로, 다른 성분은 키트에 포함될 수 있지만, 본원에 기재된 약제학적 조성물 또는 원형 폴리리보뉴클레오티드와는 상이한 조성물 또는 컨테이너에 포함될 수 있다. 이러한 실시 형태에서, 키트는 본원에 기재된 약제학적 조성물 또는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 다른 성분과 혼합하기 위한, 또는 본원에 기재된 약제학적 조성물 또는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)를 다른 성분과 함께 사용하기 위한 사용지침서를 포함할 수 있다.In addition to the pharmaceutical compositions and dosage forms of circular polyribonucleotides described herein, the kits may include other ingredients such as solvents or buffers, stabilizers, preservatives, flavoring agents (e.g., bitter antagonists or sweeteners), flavoring agents, e.g. A dye or colorant, or other cosmetic ingredient, to shade or color one or more components in the kit, and/or a second agent to treat a disease or disorder described herein. Alternatively, other components may be included in the kit, but in a different composition or container than the pharmaceutical composition or circular polyribonucleotide described herein. In this embodiment, the kit is for mixing a pharmaceutical composition or nucleic acid molecule (e.g., a circular polyribonucleotide) described herein with another component, or a pharmaceutical composition or nucleic acid molecule (e.g., a circular polyribonucleotide) described herein. Instructions for use of polyribonucleotide) in combination with other ingredients may be included.
일부 실시 형태에서, 키트의 구성성분은 비활성 조건 하에서(예를 들어, 질소 또는 아르곤과 같은 또 다른 비활성 기체 하에서) 저장된다. 일부 실시 형태에서, 키트의 구성성분은 무수 조건 하에서(예를 들어, 건조제와 함께) 저장된다. 일부 실시 형태에서, 구성성분은 앰버 바이알과 같은 차광 컨테이너에 저장된다.In some embodiments, the components of the kit are stored under inert conditions (eg, under nitrogen or another inert gas such as argon). In some embodiments, the components of the kit are stored under anhydrous conditions (e.g., with a desiccant). In some embodiments, the ingredients are stored in a light-resistant container, such as an amber vial.
본원에 기재된 약제학적 조성물 또는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 투여 형태는 임의의 형태, 예를 들어, 액체, 건조 또는 동결건조된 형태로 제공될 수 있다. 본원에 기재된 약제학적 조성물 또는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)는 실질적으로 순수하고/하거나 멸균인 것이 바람직하다. 본원에 기재된 약제학적 조성물 또는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)가 액체 용액으로 제공되는 경우, 액체 용액은 바람직하게는 수용액이고, 멸균 수용액이 바람직하다. 본원에 기재된 약제학적 조성물 또는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)가 건조된 형태로서 제공되는 경우, 재구성은 일반적으로 적합한 용매의 첨가에 의한 것이다. 용매, 예를 들어, 멸균수 또는 완충제는 키트에 선택적으로 제공될 수 있다.Dosage forms of pharmaceutical compositions or nucleic acid molecules (e.g., circular polyribonucleotides) described herein can be provided in any form, e.g., liquid, dried, or lyophilized form. It is preferred that the pharmaceutical compositions or nucleic acid molecules (e.g., circular polyribonucleotides) described herein are substantially pure and/or sterile. When the pharmaceutical compositions or nucleic acid molecules (e.g., circular polyribonucleotides) described herein are provided in a liquid solution, the liquid solution is preferably an aqueous solution, with sterile aqueous solutions being preferred. If the pharmaceutical compositions or nucleic acid molecules (e.g., circular polyribonucleotides) described herein are provided in dried form, reconstitution is generally by addition of a suitable solvent. A solvent, such as sterile water or a buffer, may optionally be provided in the kit.
키트는 본원에 기재된 투여 형태를 함유하는 조성물을 위한 하나 이상의 컨테이너를 포함할 수 있다. 일부 실시 형태에서, 키트는 조성물 및 정보 자료를 위한 별개의 컨테이너, 칸막이 또는 구획을 포함한다. 예를 들어, 약제학적 조성물 또는 원형 폴리리보뉴클레오티드는 병, 바이알, 또는 주사기에 함유될 수 있고, 정보 자료는 플라스틱 슬리브 또는 패킷에 함유될 수 있다. 다른 실시 형태에서, 키트의 별개의 요소는 단일의 분할되지 않은 컨테이너 내에 포함된다. 예를 들어, 본원에 기재된 약제학적 조성물 또는 핵산 분자(예를 들어, 원형 폴리리보뉴클레오티드)의 투여 형태는 정보 자료가 라벨 형태로 이에 부착된 병, 바이알 또는 주사기에 포함된다. 일부 실시 형태에서, 키트는 복수(예를 들어, 팩)의 개별 컨테이너를 포함하며, 각각은 본원에 기재된 약제학적 조성물 또는 원형 폴리리보뉴클레오티드의 하나 이상의 단위 투여 형태를 포함한다. 예를 들어, 키트는 복수의 주사기, 앰플, 호일 패킷, 또는 블리스터 팩을 포함하며, 각각은 본원에 기재된 단일 단위 용량의 투여 형태를 포함한다.Kits may include one or more containers for compositions containing the dosage forms described herein. In some embodiments, the kit includes separate containers, compartments, or compartments for the composition and information material. For example, the pharmaceutical composition or circular polyribonucleotide may be contained in a bottle, vial, or syringe, and the information material may be contained in a plastic sleeve or packet. In other embodiments, the separate elements of the kit are contained within a single, undivided container. For example, dosage forms of the pharmaceutical compositions or nucleic acid molecules (e.g., circular polyribonucleotides) described herein are contained in a bottle, vial, or syringe with information material attached thereto in the form of a label. In some embodiments, a kit comprises a plurality of individual containers (e.g., packs), each containing one or more unit dosage forms of a pharmaceutical composition or circular polyribonucleotide described herein. For example, a kit may include a plurality of syringes, ampoules, foil packets, or blister packs, each containing a single unit dose of the dosage form described herein.
키트의 컨테이너는 기밀성, 방수성(예를 들어, 습기 또는 증발의 변화에 대해 불투과성), 및/또는 차광성일 수 있다.The container of the kit may be airtight, waterproof (e.g., impermeable to changes in moisture or evaporation), and/or light-proof.
키트는 선택적으로 투여 형태의 사용에 적합한 디바이스, 예를 들어, 주사기, 피펫, 겸자, 계량 스푼, 면봉(예를 들어, 코튼 면봉 또는 나무 면봉), 또는 임의의 이러한 디바이스를 포함한다.The kit optionally includes a device suitable for use with the dosage form, such as a syringe, pipette, forceps, measuring spoon, cotton swab (e.g., a cotton swab or a wooden swab), or any such device.
본 발명의 키트는 본원에 기재된 개시 단계 양생법, 유도 단계 양생법, 또는 유지 단계 양생법 중 하나 이상에 적합한 용량을 대상체에게 제공하기 위해 다양한 강도의 투여 형태를 포함할 수 있다. 대안적으로, 키트는 필요에 따라 사용자가 분할 용량을 투여할 수 있도록 스코어링된 정제를 포함할 수 있다.Kits of the invention may include dosage forms of varying strengths to provide a subject with a dose suitable for one or more of the initiation phase regimen, induction phase regimen, or maintenance phase regimen described herein. Alternatively, the kit may include scored tablets to allow the user to administer divided doses as needed.
실시예Example
하기 실시예는 당업자에게 본원에 기재된 조성물 및 방법을 사용하고, 제조하고, 평가하는 방법의 설명을 제공하기 위해 제시되며, 본 개시내용을 순수하게 예시하는 것으로 의도되고, 본 발명자들이 그들의 발명으로 간주하는 것의 범위를 한정하는 것으로 의도되지 않는다.The following examples are presented to those skilled in the art to provide an illustration of how to use, prepare, and evaluate the compositions and methods described herein, and are intended to be purely illustrative of the present disclosure and are considered by the inventors to be their invention. It is not intended to limit the scope of what is done.
실시예 1: 포유동물 세포 내의 RNA로부터의 항푸소제닉 폴리펩티드의 발현Example 1: Expression of antifusogenic polypeptides from RNA in mammalian cells
본 실시예는 Huh-7 세포에서 하나 이상의 OC43-HR2P 및 EK1 펩티드를 인코딩하는 하나 이상의 오픈 리딩 프레임(ORF)의 발현을 입증한다.This example demonstrates the expression of one or more open reading frames (ORFs) encoding one or more OC43-HR2P and EK1 peptides in Huh-7 cells.
본 실시예에서, 1개의 OC43-HR2P 펩티드(SEQ ID NO: 289), 1개의 EK1 펩티드(SEQ ID NO: 288), 다수의 OC43-HR2P 펩티드, 다수의 EK1 펩티드, 및 OC43-HR2P 펩티드, 펩티드 유사체, 및 EK1 펩티드의 조합을 인코딩하는 원형 RNA를 설계하였다. 원형 RNA는 IRES, 분비 신호, 푸린 부위, 하나 이상의 OC43-HR2P 펩티드, 유사체 및/또는 EK1 서열, 및 스페이서 요소를 포함하도록 설계한다. 원형 RNA를 Lipofectamine MessengerMax(Invitrogen LMRNA001)를 사용하여 제조업체의 사용지침서에 따라 Huh-7 세포에 형질감염시킨다.In this example, one OC43-HR2P peptide (SEQ ID NO: 289), one EK1 peptide (SEQ ID NO: 288), multiple OC43-HR2P peptides, multiple EK1 peptides, and OC43-HR2P peptides, peptides Circular RNAs encoding combinations of analogs, and EK1 peptides were designed. The circular RNA is designed to include an IRES, secretion signal, furin site, one or more OC43-HR2P peptides, analogs and/or EK1 sequences, and spacer elements. Circular RNA was transfected into Huh-7 cells using Lipofectamine MessengerMax (Invitrogen LMRNA001) according to the manufacturer's instructions.
한 연구에서, 펩티드 발현을 시간 경과에 따라 시험관내에서 모니터링한다.In one study, peptide expression is monitored in vitro over time.
실시예 2: MERS-CoV S 단백질 매개 세포-세포 융합의 억제Example 2: Inhibition of MERS-CoV S protein-mediated cell-cell fusion
293T 표적 세포와의 MERS-CoV 융합 억제를 결정하기 위해, MERS-CoV S 단백질-매개 세포-세포 융합 검정을 사용한다. 본 실시예는 EGFP(293T/EGFP)를 인코딩하는 플라스미드 pAAV-IRES-EGFP 또는 MERS-CoV S 단백질 및 EGFP(293T/MERS/EGFP)를 인코딩하는 pAAV-IRES-MERS-EGFP로 형질감염되고 10% FBS를 함유한 DMEM에서 37℃에서 48시간 동안 배양된 293T 세포를 사용한다. 실시예 1에 따라 제조된, MERS-CoV 수용체 DPP4를 발현시키는 Huh-7 세포(5 x 104)를 96-웰 플레이트에서 37℃에서 5시간 동안 인큐베이션한 다음, 각각 1 x 104293T/EGFP 또는 293T/MERS/EGFP 세포를 첨가한다.To determine inhibition of MERS-CoV fusion with 293T target cells, the MERS-CoV S protein-mediated cell-cell fusion assay is used. This example is transfected with plasmid pAAV-IRES-EGFP encoding EGFP (293T/EGFP) or pAAV-IRES-MERS-EGFP encoding MERS-CoV S protein and EGFP (293T/MERS/EGFP) and 10% Use 293T cells cultured for 48 hours at 37°C in DMEM containing FBS. Huh- 7 cells (5 Alternatively, add 293T/MERS/EGFP cells.
37℃에서 4시간 동안 공동-배양한 후, Huh-7 세포와 융합되거나 융합되지 않은 293T/MERS/EGFP 세포(293T/EGFP 세포는 음성 대조군으로서 사용됨)를 도립 형광 현미경(Nikon Eclipse Ti-S) 하에서 계수한다. 융합된 세포는 융합되지 않은 세포보다 2배 이상 큰 것으로 보이며, 융합된 세포에서의 형광 강도의 차이를 융합되지 않은 세포의 것과 비교한다. 세포-세포 융합의 억제%는 다음 식을 사용하여 계산할 수 있다: (1-(E-N)/(P-N)) x 100. 'E'는 실험군의 세포-세포 융합%를 나타낸다. 'P'는 circRNA가 첨가되지 않은 양성 대조군 그룹의 세포-세포 융합%를 나타낸다. 'N'은 음성 대조군 그룹의 세포-세포 융합%이며, 여기서 293T/MERS/EGFP 세포는 293T/EGFP 세포로 대체된다. 50% 억제에 대한 농도(IC50)는 CalcuSyn 소프트웨어를 사용하여 계산될 수 있다. 공동-배양은 37℃에서 48시간 동안 계속될 수 있으며, 예를 들어, 융합체 형성에 대한 측정이 수행될 수 있다. 세포 내 S 단백질 ELISA는 바이러스 시험감염(viral challenge) 후 2일차의 항바이러스 활성을 측정하도록 조정될 수 있다.After co-culture for 4 hours at 37°C, 293T/MERS/EGFP cells fused or unfused with Huh-7 cells (293T/EGFP cells were used as negative control) were analyzed under an inverted fluorescence microscope (Nikon Eclipse Ti-S). Counted below. Fused cells appear to be more than twice as large as unfused cells, and the difference in fluorescence intensity in fused cells is compared to that in unfused cells. The % inhibition of cell-cell fusion can be calculated using the following formula: (1-(E -N )/(P -N )) x 100. 'E ' represents the % cell-cell fusion of the experimental group. 'P ' represents the cell-cell fusion percentage of the positive control group to which circRNA was not added. 'N ' is the % cell-cell fusion of the negative control group, where 293T/MERS/EGFP cells are replaced by 293T/EGFP cells. The concentration for 50% inhibition (IC50 ) can be calculated using CalcuSyn software. Co-culture can be continued for 48 hours at 37°C and measurements, for example, of syncytium formation can be performed. The intracellular S protein ELISA can be adapted to measure
실시예 3: 슈도타입화된 SARS-CoV-2 및 MERS-CoV 감염의 억제Example 3: Inhibition of pseudotyped SARS-CoV-2 and MERS-CoV infections
SARS-CoV-2 또는 MERS-CoV S 단백질을 각각 보유하는 SARS 또는 MERS 슈도바이러스, 및 리포터로서 루시페라제를 발현시키는 결함 있는 HIV-1 게놈은 293T 세포를 플라스미드 pNL4-3.luc.RE(Env-결함, 루시페라제-발현 HIV-1을 인코딩함) 및 pcDNA3.1-MERS-CoV-S 플라스미드로 공동-형질감염시킴으로써 제조된다. SARS 또는 MERS 슈도바이러스에 의한 감염에 대한 발현된 펩티드의 억제 활성을 검출하기 위해, 본 발명의 circRNA로 형질감염된 및 형질감염되지 않은 ACE2-형질감염된 293T(293T/ACE2) 세포 및 Huh-7 세포(96-웰 플레이트에서 웰당 104개)를 각각 SARS 또는 MERS-CoV 슈도바이러스로 감염시켰다. 감염시킨 후, 감염 후 12시간째에 배양물에 새로운 배지를 재공급하고 추가로 72시간 동안 인큐베이션하였다. 세포를 PBS로 세척하고 루시페라제 키트(프로메가(Promega))에 포함된 용해 시약을 사용하여 용해시켰다. 세포 용해물의 분취물을 96-웰의 바닥이 평평한 코스타(Costar) 광도계 플레이트(코닝 코스타(Corning Costar))로 옮긴 다음, 루시페라제 기질(프로메가)을 첨가하였다. 상대광 단위는 울트라(Ultra) 384 광도계(테칸(Tecan) US)에서 즉시 결정되었다.SARS or MERS pseudoviruses carrying the SARS-CoV-2 or MERS-CoV S protein, respectively, and the defective HIV-1 genome expressing luciferase as a reporter were transfected into 293T cells with plasmid pNL4-3.luc.RE (Env -defective, encoding luciferase-expressing HIV-1) and pcDNA3.1-MERS-CoV-S plasmids. To detect the inhibitory activity of the expressed peptides against infection by SARS or MERS pseudoviruses, ACE2-transfected 293T (293T/ACE2) cells transfected and untransfected with the circRNA of the invention and Huh-7 cells (10 per well in a 96-well plate) were infected with SARS or MERS-CoV pseudovirus, respectively. After infection, the cultures were re-supplied with fresh medium at 12 hours post-infection and incubated for an additional 72 hours. Cells were washed with PBS and lysed using the lysis reagent included in the luciferase kit (Promega). Aliquots of cell lysates were transferred to 96-well flat-bottomed Costar photometric plates (Corning Costar), and luciferase substrate (Promega) was added. Relative light units were determined immediately on an Ultra 384 photometer (Tecan US).
실시예 4: SARS-CoV-2 항푸소제닉 폴리펩티드의 발현Example 4: Expression of SARS-CoV-2 antifusogenic polypeptide
본 실시예는 원형 RNA로부터의 SARS-CoV-2 항푸소제닉 폴리펩티드의 발현을 입증한다.This example demonstrates expression of SARS-CoV-2 antifusogenic polypeptides from circular RNA.
몇몇 SARS-CoV-2 항푸소제닉 폴리펩티드를도 1에 도시된 HR2 영역을 기반으로 설계하였다(도 2및 도 3). 원형 RNA를 IRES 및 SARS-CoV-2 항푸소제닉 폴리펩티드를 인코딩하는 뉴클레오티드 서열을 포함하도록 설계하였다. 본 실시예에서, DNA 작제물을 스페이서 요소 및 폴리뉴클레오티드 카고를 포함하도록 설계하였다. 작제물을 폴리뉴클레오티드 카고로서 IRES 및 ORF의 조합을 포함하도록 설계하였다. ORF를 IL-2 분비 신호 서열, SARS-CoV-2 항푸소제닉 폴리펩티드를 인코딩하는 뉴클레오티드 서열, 및 GGGGS 펩티드 링커를 갖는 HiBiT 태그를 인코딩하는 뉴클레오티드 서열을 포함하도록 설계하였다. IRES는 EMCV였다.Several SARS-CoV-2 antifusogenic polypeptides were designed based on the HR2 region shown inFigure 1 (Figures 2 and3 ). Circular RNA was designed to contain nucleotide sequences encoding IRES and SARS-CoV-2 antifusogenic polypeptide. In this example, a DNA construct was designed to include a spacer element and a polynucleotide cargo. The construct was designed to contain a combination of IRES and ORF as polynucleotide cargo. The ORF was designed to contain an IL-2 secretion signal sequence, a nucleotide sequence encoding a SARS-CoV-2 antifusogenic polypeptide, and a nucleotide sequence encoding a HiBiT tag with a GGGGS peptide linker. IRES was EMCV.
사용된 모든 작제물에 대한 아미노산 및 핵산 서열을 아래에 나타낸다.Amino acid and nucleic acid sequences for all constructs used are shown below.
N-말단 IL-2 분비 신호는 대문자로 나타나 있음(20개의 AA 또는 60개의 뉴클레오티드)N-terminal IL-2 secretion signal shown in capital letters (20 AA or 60 nucleotides)
볼드체= 푸린Bold = purine
볼드체이자 이탤릭체= G4S 펩티드 링커를 갖는 HiBiT 태그Bold and italics = HiBiT tag with G4S peptide linker.
원형 RNA를 본원에 기재된 방법을 사용하여 자기-스플라이싱에 의해 생성하였다. 비변형된 선형 RNA를 7.5 mM의 NTP의 존재 하에서 위에 나열된 모티프를 포함하는 DNA 주형으로부터의 T7 RNA 폴리머라제를 사용하여 시험관내 전사에 의해 합성하였다. 주형 DNA를 DN아제로 처리함으로써 제거하였다. 합성된 선형 RNA를 RNA 클린업 키트(뉴 잉글랜드 바이오랩스, T2050)로 정제하였다. 자기-스플라이싱은 전사 동안 일어났다. 항푸소제닉 펩티드를 인코딩하는 원형 RNA를 우레아 폴리아크릴아미드 겔 전기영동(우레아-PAGE) 또는 역상 컬럼 크로마토그래피에 의해 정제하였다.Circular RNA was produced by self-splicing using the methods described herein. Unmodified linear RNA was synthesized by in vitro transcription using T7 RNA polymerase from a DNA template containing the motifs listed above in the presence of 7.5 mM NTP. Template DNA was removed by treatment with DNase. The synthesized linear RNA was purified using an RNA cleanup kit (New England Biolabs, T2050). Self-splicing occurred during transcription. Circular RNA encoding the antifusogenic peptide was purified by urea polyacrylamide gel electrophoresis (urea-PAGE) or reversed-phase column chromatography.
SARS-CoV-2 항푸소제닉 폴리펩티드의 발현을 측정하기 위해, 리포펙타민을 사용하여 0.4 pmol의 원형 RNA를 HEK293 세포에 전달하였다. 발현을 48시간 후에 측정하였다. HEK293 세포에서 다양한 폴리펩티드가 발현되었다. 총 발현(ng/ml 및 nM)을 표 2에 나타내었다.To measure the expression of SARS-CoV-2 antifusogenic polypeptide, 0.4 pmol of circular RNA was delivered to HEK293 cells using lipofectamine. Expression was measured after 48 hours. A variety of polypeptides were expressed in HEK293 cells. Total expression (ng/ml and nM) is shown in Table 2.
표 2: HR2 작제물 발현Table 2: HR2 construct expression
실시예 5: 슈도타입화된 SARS-CoV-2 감염의 억제Example 5: Inhibition of pseudotyped SARS-CoV-2 infection
본 실시예는 원형 RNA로부터 발현된 항푸소제닉 폴리펩티드에 의한 슈도타입화된 SARS-CoV2-감염의 억제를 입증한다.This example demonstrates inhibition of pseudotyped SARS-CoV2-infection by an antifusogenic polypeptide expressed from circular RNA.
원형 RNA를 내부 리보솜 진입 부위(IRES) 및 SARS-CoV-2의 항푸소제닉 폴리펩티드를 인코딩하는 뉴클레오티드 서열을 포함하도록 설계하였다. 본 실시예에서, DNA 작제물을 스페이서 요소 및 폴리뉴클레오티드 카고로서 EMCV IRES 및 ORF의 조합을 포함하도록 설계하였다. ORF를 IL-2 분비 신호 서열 및 HR2 전장 항푸소제닉 폴리펩티드를 인코딩하는 뉴클레오티드 서열, 및 HiBiT 펩티드 태그를 인코딩하는 뉴클레오티드 서열을 포함하도록 설계하였다. ORF를 또한 IL-2 분비 신호 서열 및 HiBiT 펩티드 태그를 인코딩하는 뉴클레오티드 서열이 없는 HR2 전장 항푸소제닉 폴리펩티드를 인코딩하는 뉴클레오티드 서열을 포함하도록 설계하였다.Circular RNA was designed to contain an internal ribosome entry site (IRES) and a nucleotide sequence encoding an antifusogenic polypeptide of SARS-CoV-2. In this example, the DNA construct was designed to contain a combination of the EMCV IRES and ORF as spacer elements and polynucleotide cargo. The ORF was designed to include a nucleotide sequence encoding the IL-2 secretion signal sequence and the HR2 full-length antifusogenic polypeptide, and a nucleotide sequence encoding the HiBiT peptide tag. The ORF was also designed to contain a nucleotide sequence encoding the HR2 full-length antifusogenic polypeptide without the IL-2 secretion signal sequence and the nucleotide sequence encoding the HiBiT peptide tag.
원형 RNA를 본원에 기재된 방법을 사용하여 자기-스플라이싱에 의해 생성하였다. 비변형된 선형 RNA를 7.5 mM의 NTP의 존재 하에서 위에 나열된 모티프를 포함하는 DNA 주형으로부터의 T7 RNA 폴리머라제를 사용하여 시험관내 전사에 의해 합성하였다. 주형 DNA를 DN아제로 처리함으로써 제거하였다. 합성된 선형 RNA를 RNA 클린업 키트(뉴 잉글랜드 바이오랩스, T2050)로 정제하였다. 자기-스플라이싱은 전사 동안 일어났다. HR2 전장 항푸소제닉 폴리펩티드를 인코딩하는 원형 RNA를 우레아 폴리아크릴아미드 겔 전기영동(우레아-PAGE) 또는 역상 컬럼 크로마토그래피에 의해 정제하였다.Circular RNA was produced by self-splicing using the methods described herein. Unmodified linear RNA was synthesized by in vitro transcription using T7 RNA polymerase from a DNA template containing the motifs listed above in the presence of 7.5 mM NTP. Template DNA was removed by treatment with DNase. The synthesized linear RNA was purified using an RNA cleanup kit (New England Biolabs, T2050). Self-splicing occurred during transcription. Circular RNA encoding the HR2 full-length antifusogenic polypeptide was purified by urea polyacrylamide gel electrophoresis (urea-PAGE) or reversed-phase column chromatography.
SARS 슈도바이러스에 의한 감염에 대한 발현된 폴리펩티드의 억제 활성을 검출하기 위해, 원형 RNA로 형질감염된 및 형질감염되지 않은 ACE2-형질감염된 293T(293T/ACE2) 세포(96-웰 플레이트에서 웰당 104개)를 각각 SARS-CoV-2 슈도바이러스로 감염시켰다. 단독의 형질감염 시약(원형 RNA 없음)을 대조군("모의")으로서 사용하였다. 감염시킨 후, 감염 후 12시간째에 배양물에 새로운 배지를 재공급하고 추가로 72시간 동안 인큐베이션하였다. 세포를 PBS로 세척하고 루시페라제 키트(프로메가)에 포함된 용해 시약을 사용하여 용해시켰다. 세포 용해물의 분취물을 96-웰의 바닥이 평평한 코스타 광도계 플레이트(코닝 코스타)로 옮긴 다음, 루시페라제 기질(프로메가)을 첨가하였다. 상대광 단위는 울트라 384 광도계(테칸 US)에서 즉시 결정되었다.To detect the inhibitory activity of the expressed polypeptide against infection by SARS pseudovirus, circular RNA-transfected and untransfected ACE2-transfected 293T (293T/ACE2) cells were grown (104 per well in 96-well plates). ) were each infected with SARS-CoV-2 pseudovirus. Transfection reagent alone (no circular RNA) was used as a control (“mock”). After infection, the cultures were re-supplied with fresh medium at 12 hours post-infection and incubated for an additional 72 hours. Cells were washed with PBS and lysed using the lysis reagent included in the luciferase kit (Promega). Aliquots of cell lysates were transferred to 96-well flat-bottomed Costa photometric plates (Corning Costa), and luciferase substrate (Promega) was added. Relative light units were determined immediately on an Ultra 384 photometer (Tecan US).
오미크론 및 델타 슈도바이러스를 사용하는 시험관내 융합 억제의 효능을 본원에 기재된 항푸소제닉 폴리펩티드를 인코딩하는 원형 폴리리보뉴클레오티드를 사용하여 결정하였다. 세포에서 발현된 HR2 전장 항푸소제닉 폴리펩티드(도 4a), 및 HR2 전장 및 HiBiT 태그 항푸소제닉 폴리펩티드에 컨쥬게이트된 HR2 전장은 델타 및 오미크론 균주의 융합을 억제(도 4a)하는 것으로 나타났다. 세포 생존율(셀티터 글로(cellTiter glo)에 의해 측정됨)(도 4b)에는 변화가 없었으며, 이는 루시페라제 신호전달의 감소(도 4a)가 바이러스 융합의 억제에 기인함을 시사한다.The efficacy of in vitro fusion inhibition using Omicron and Delta pseudoviruses was determined using circular polyribonucleotides encoding antifusogenic polypeptides described herein. HR2 full-length antifusogenic polypeptide expressed in cells (Figure 4A ), and HR2 full-length conjugated to HR2 full-length and HiBiT tag antifusogenic polypeptides were shown to inhibit fusion of Delta and Omicron strains (Figure 4A ). There was no change in cell viability (measured by cellTiter glo) (Figure 4B ), suggesting that the decrease in luciferase signaling (Figure 4A ) is due to inhibition of viral fusion.
생체내 폴리펩티드의 발현을 측정하기 위해, 지질 나노입자에 제형화된 120 pmol의 원형 RNA를 정맥 주사를 통해 마우스에 전달하였다. 발현은 Nano-Glo® HiBiT 세포외 검출 시스템(#N3030, 프로메가) 10% 혈청에 의해 측정되었다. 항푸소제닉 폴리펩티드는 표 3 및도 5에 나타낸 바와 같이 6시간째에 고도로 발현되었고 24시간까지 유의하게 감소하였다.To measure the expression of polypeptides in vivo, 120 pmol of circular RNA formulated in lipid nanoparticles was delivered to mice via intravenous injection. Expression was measured by Nano-Glo® HiBiT extracellular detection system (#N3030, Promega) 10% serum. Antifusogenic polypeptides were highly expressed at 6 hours and significantly decreased by 24 hours, as shown in Table 3 andFigure 5 .
표 3: HR2 발현Table 3: HR2 expression
실시예 6: 슈도타입화된 SARS-CoV-2 감염의 억제Example 6: Inhibition of pseudotyped SARS-CoV-2 infection
본 실시예는 항푸소제닉 폴리펩티드를 사용하는 슈도타입화된 SARS-CoV2-감염을 입증한다.This example demonstrates pseudotyped SARS-CoV2-infection using antifusogenic polypeptides.
SARS-CoV-2 스파이크 폴리펩티드 및 EK1 폴리펩티드의 HR2, HR2A, HR2B, 및 HR2C 영역을 기반으로 SARS-CoV-2의 항푸소제닉 폴리펩티드를 생성하였다(도 2).Antifusogenic polypeptides of SARS-CoV-2 were generated based on the HR2, HR2A, HR2B, and HR2C regions of the SARS-CoV-2 spike polypeptide and EK1 polypeptide (Figure 2 ).
시험관내 EK-1 및 HR2A 폴리펩티드에 의한 슈도바이러스 중화를 측정하기 위해 기능적 검정을 수행하였다. HR2A 폴리펩티드는 우한 및 오미크론 균주에 대해 효능을 나타냈다(도 6a 및도 6b).Functional assays were performed to measure pseudovirus neutralization by EK-1 and HR2A polypeptides in vitro. HR2A polypeptide showed efficacy against Wuhan and Omicron strains (FIGS. 6A and6B ).
HR2A-C 및 및 HR2 전장 폴리펩티드를 사용하여 폴리펩티드에 대한 추가 실험을 수행하였다. 음성 대조군으로는 HIV 펩티드인 IPB19를 사용하였고, 양성 대조군으로는 수용체에 직접 결합하는 항체인 ACE-Fc를 사용하였다. 4배 연속 희석(8회 희석) 및 HEK293 ACE2 세포를 사용하여 폴리펩티드(시작 희석 10 μΜ)를 제조하였다. 모든 폴리펩티드는 오미크론 및 WT 균주를 억제하는 것으로 나타났으며, IC50 값을 표 4에 나타낸다.Additional experiments with polypeptides were performed using HR2A-C and HR2 full length polypeptides. IPB19, an HIV peptide, was used as a negative control, and ACE-Fc, an antibody that directly binds to the receptor, was used as a positive control. Polypeptides (starting
표 4: IC50 값Table 4: IC50 values
전장 HR2 Fc 융합을 또한 테스트하였고 이는 오미크론 및 우한 균주에 대한 억제 활성을 유지하는 것으로 나타났다.The full-length HR2 Fc fusion was also tested and shown to retain inhibitory activity against Omicron and Wuhan strains.
HR2 전장 폴리펩티드("HR2Complete")는 오미크론 BA.4/BA.5, SARS CoV-1, 및 우한 균주의 융합을 성공적으로 억제하는 것으로 나타났다(도 7a, 도 7b, 및 도 8a 내지 도 8d).The HR2 full-length polypeptide (“HR2Complete”) was shown to successfully inhibit fusion of Omicron BA.4/BA.5, SARS CoV-1, and Wuhan strains (FIGS. 7A , 7B , and 8A-D ). .
실시예 7: HIV 항푸소제닉 폴리펩티드의 발현Example 7: Expression of HIV antifusogenic polypeptide
본 실시예는 원형 RNA로부터의 HIV 항푸소제닉 폴리펩티드의 발현을 입증한다.This example demonstrates expression of HIV antifusogenic polypeptides from circular RNA.
여러 개의 HIV 항푸소제닉 폴리펩티드를 설계하였다(도 9). 원형 RNA를 IRES 및 HIV 항푸소제닉 폴리펩티드를 인코딩하는 뉴클레오티드 서열을 포함하도록 설계하였다. 본 실시예에서, DNA 작제물을 스페이서 요소 및 폴리뉴클레오티드 카고를 포함하도록 설계하였다(도 9). 작제물을 폴리뉴클레오티드 카고로서 IRES 및 ORF의 조합을 포함하도록 설계하였다. ORF를 IL-2 분비 신호 서열(SEQ ID NO: 332), HIV 항푸소제닉 폴리펩티드를 인코딩하는 뉴클레오티드 서열, 및 GGS 또는 GGGGS 펩티드 링커를 갖는 HiBiT 태그(서열 VSGWRLFKKIS(SEQ ID NO: 362)를 가짐)를 인코딩하는 뉴클레오티드 서열을 포함하도록 설계하였다. IRES는 EMCV 또는 변형된 CVB3 중 어느 하나였다.Several HIV antifusogenic polypeptides were designed (Figure 9 ). Circular RNA was designed to contain nucleotide sequences encoding IRES and HIV antifusogenic polypeptide. In this example, the DNA construct was designed to include a spacer element and a polynucleotide cargo (Figure 9 ). The construct was designed to contain a combination of IRES and ORF as polynucleotide cargo. The ORF was linked to an IL-2 secretion signal sequence (SEQ ID NO: 332), a nucleotide sequence encoding an HIV antifusogenic polypeptide, and a HiBiT tag with a GGS or GGGGS peptide linker (with sequence VSGWRLFKKIS (SEQ ID NO: 362)). It was designed to contain a nucleotide sequence encoding. IRES was either EMCV or modified CVB3.
원형 RNA를 본원에 기재된 방법을 사용하여 자기-스플라이싱에 의해 생성하였다. 비변형된 선형 RNA를 7.5 mM의 NTP의 존재 하에서 위에 나열된 모티프를 포함하는 DNA 주형으로부터의 T7 RNA 폴리머라제를 사용하여 시험관내 전사에 의해 합성하였다. 주형 DNA를 DN아제로 처리함으로써 제거하였다. 합성된 선형 RNA를 RNA 클린업 키트(뉴 잉글랜드 바이오랩스, T2050)로 정제하였다. 자기-스플라이싱은 전사 동안 일어났다. 항푸소제닉 펩티드를 인코딩하는 원형 RNA를 우레아 폴리아크릴아미드 겔 전기영동(우레아-PAGE) 또는 역상 컬럼 크로마토그래피에 의해 정제하였다.Circular RNA was produced by self-splicing using the methods described herein. Unmodified linear RNA was synthesized by in vitro transcription using T7 RNA polymerase from a DNA template containing the motifs listed above in the presence of 7.5 mM NTP. Template DNA was removed by treatment with DNase. The synthesized linear RNA was purified using an RNA cleanup kit (New England Biolabs, T2050). Self-splicing occurred during transcription. Circular RNA encoding the antifusogenic peptide was purified by urea polyacrylamide gel electrophoresis (urea-PAGE) or reversed-phase column chromatography.
HIV 항푸소제닉 폴리펩티드의 발현을 측정하기 위해, 리포펙타민을 사용하여 0.4 pmol의 원형 RNA를 HEK293 세포에 전달하였다. 발현을 48시간 후에 측정하였다.도 10a 및도 10b에 나타낸 바와 같이, HEK293 세포에서 폴리펩티드가 발현되었다.도 11a 및도 11b에 나타낸 바와 같이, 발현은 원형 RNA 및 DNA 플라스미드 사이에서 유사하였다. 다양한 폴리펩티드에 대한 총 발현(ng/mL 및 nM)을도 12에 나타내었다.To measure the expression of HIV antifusogenic polypeptides, 0.4 pmol of circular RNA was delivered to HEK293 cells using lipofectamine. Expression was measured after 48 hours. As shown inFigures 10A and10B , polypeptides were expressed in HEK293 cells. As shown inFigures 11A and11B , expression was similar between circular RNA and DNA plasmids. Total expression (ng/mL and nM) for various polypeptides is shown inFigure 12 .
HIV 폴리펩티드 및 핵산 서열HIV polypeptide and nucleic acid sequences
다른 실시 형태Other Embodiments
본 발명을 그의 구체적인 실시 형태에 관하여 설명하였지만, 추가의 변형이 가능하고, 본 출원은, 일반적으로 본 발명의 원리를 따르고 본 발명이 속하는 기술 분야 내의 알려지거나 통상적인 실시 내에 해당하며 상기 제시된 본질적인 특징에 적용될 수 있는 본 발명으로부터 벗어난 것들을 포함하는 본 발명의 임의의 변동, 용도, 또는 적응을 포괄하는 것으로 의도되며, 청구범위의 범주에 따른다는 것이 이해될 것이다. 다른 실시 형태는 청구범위 내에 있다.Although the present invention has been described in terms of specific embodiments thereof, further modifications are possible, and the present application generally follows the principles of the invention and falls within known or customary practice within the technical field to which the invention pertains, and retains the essential features set forth above. It will be understood that it is intended to cover, and is subject to the scope of the claims, any variations, uses, or adaptations of the invention, including those departing from the invention as may be applied to it. Other embodiments are within the scope of the claims.
서열목록 전자파일 첨부Sequence list electronic file attached
Claims (36)
Translated fromKoreanApplications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202163293495P | 2021-12-23 | 2021-12-23 | |
| US63/293,495 | 2021-12-23 | ||
| PCT/US2022/082345WO2023122789A1 (en) | 2021-12-23 | 2022-12-23 | Circular polyribonucleotides encoding antifusogenic polypeptides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20240118881Atrue KR20240118881A (en) | 2024-08-05 |
Family
ID=85321278
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020247024156APendingKR20240118881A (en) | 2021-12-23 | 2022-12-23 | Circular polyribonucleotide encoding an antifusogenic polypeptide |
Country Status (10)
| Country | Link |
|---|---|
| EP (1) | EP4452337A1 (en) |
| JP (1) | JP2025500358A (en) |
| KR (1) | KR20240118881A (en) |
| CN (1) | CN118922211A (en) |
| AU (1) | AU2022420620A1 (en) |
| CA (1) | CA3241026A1 (en) |
| IL (1) | IL313714A (en) |
| MX (1) | MX2024007870A (en) |
| TW (1) | TW202342064A (en) |
| WO (1) | WO2023122789A1 (en) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2024235803A1 (en)* | 2023-03-15 | 2025-09-25 | Flagship Pioneering Innovations Vi, Llc | Compositions comprising polyribonucleotides and uses thereof |
| WO2025006684A1 (en)* | 2023-06-28 | 2025-01-02 | Flagship Pioneering Innovations Vi, Llc | Circular polyribonucleotides encoding antifusogenic polypeptides |
| WO2025106915A1 (en)* | 2023-11-17 | 2025-05-22 | Sail Biomedicines, Inc. | Circular polyribonucleotides encoding glucagon-like peptide 1 (glp-1) and uses thereof |
| WO2025106930A1 (en)* | 2023-11-17 | 2025-05-22 | Sail Biomedicines, Inc. | Circular polyribonucleotides encoding glucagon-like peptide 2 (glp-2) and uses thereof |
| WO2025179198A1 (en)* | 2024-02-23 | 2025-08-28 | Sail Biomedicines, Inc. | Circular polyribonucleotides and unmodified linear rnas with reduced immunogenicity |
Family Cites Families (111)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1147812A (en) | 1915-03-09 | 1915-07-27 | George E Pancoast | Web-printing machine. |
| AU649066B2 (en) | 1990-07-25 | 1994-05-12 | Syngene, Inc. | Circular extension for generating multiple nucleic acid complements |
| US5426180A (en) | 1991-03-27 | 1995-06-20 | Research Corporation Technologies, Inc. | Methods of making single-stranded circular oligonucleotides |
| AU683011B2 (en) | 1992-01-13 | 1997-10-30 | Duke University | Enzymatic RNA molecules |
| US5773244A (en) | 1993-05-19 | 1998-06-30 | Regents Of The University Of California | Methods of making circular RNA |
| US5885613A (en) | 1994-09-30 | 1999-03-23 | The University Of British Columbia | Bilayer stabilizing components and their use in forming programmable fusogenic liposomes |
| US5766903A (en) | 1995-08-23 | 1998-06-16 | University Technology Corporation | Circular RNA and uses thereof |
| US5849727A (en) | 1996-06-28 | 1998-12-15 | Board Of Regents Of The University Of Nebraska | Compositions and methods for altering the biodistribution of biological agents |
| EP1027033B1 (en) | 1997-05-14 | 2009-07-22 | The University Of British Columbia | High efficiency encapsulation of nucleic acids in lipid vesicles |
| US6429301B1 (en) | 1998-04-17 | 2002-08-06 | Whitehead Institute For Biomedical Research | Use of a ribozyme to join nucleic acids and peptides |
| US6693086B1 (en) | 1998-06-25 | 2004-02-17 | National Jewish Medical And Research Center | Systemic immune activation method using nucleic acid-lipid complexes |
| US6210931B1 (en) | 1998-11-30 | 2001-04-03 | The United States Of America As Represented By The Secretary Of Agriculture | Ribozyme-mediated synthesis of circular RNA |
| WO2002087541A1 (en) | 2001-04-30 | 2002-11-07 | Protiva Biotherapeutics Inc. | Lipid-based formulations for gene transfer |
| CA2551022C (en) | 2003-09-15 | 2013-06-04 | Protiva Biotherapeutics, Inc. | Polyethyleneglycol-modified lipid compounds and uses thereof |
| JP4380411B2 (en) | 2004-04-30 | 2009-12-09 | 澁谷工業株式会社 | Sterilization method |
| SG158175A1 (en) | 2004-12-27 | 2010-01-29 | Silence Therapeutics Ag | Lipid complexes coated with peg and their use |
| US7404969B2 (en) | 2005-02-14 | 2008-07-29 | Sirna Therapeutics, Inc. | Lipid nanoparticle based compositions and methods for the delivery of biologically active molecules |
| WO2008008230A2 (en) | 2006-07-10 | 2008-01-17 | Memsic, Inc. | A system for sensing yaw rate using a magnetic field sensor and portable electronic devices using the same |
| JP5296328B2 (en) | 2007-05-09 | 2013-09-25 | 独立行政法人理化学研究所 | Single-stranded circular RNA and method for producing the same |
| JP5749494B2 (en) | 2008-01-02 | 2015-07-15 | テクミラ ファーマシューティカルズ コーポレイション | Improved compositions and methods for delivery of nucleic acids |
| NZ588583A (en) | 2008-04-15 | 2012-08-31 | Protiva Biotherapeutics Inc | Novel lipid formulations for nucleic acid delivery |
| WO2009132131A1 (en) | 2008-04-22 | 2009-10-29 | Alnylam Pharmaceuticals, Inc. | Amino lipid based improved lipid formulation |
| PL2350043T3 (en) | 2008-10-09 | 2014-09-30 | Tekmira Pharmaceuticals Corp | Improved amino lipids and methods for the delivery of nucleic acids |
| ES2656516T3 (en) | 2008-10-20 | 2018-02-27 | Alnylam Pharmaceuticals, Inc. | Compositions and methods to inhibit the expression of transthyretin |
| CN104910025B (en) | 2008-11-07 | 2019-07-16 | 麻省理工学院 | Alkamine lipid and its purposes |
| WO2010054384A1 (en) | 2008-11-10 | 2010-05-14 | Alnylam Pharmaceuticals, Inc. | Lipids and compositions for the delivery of therapeutics |
| CN105709229B (en) | 2008-11-10 | 2020-07-28 | 阿布特斯生物制药公司 | Novel lipids and compositions for delivery of therapeutic agents |
| WO2010084371A1 (en) | 2009-01-26 | 2010-07-29 | Mitoprod | Novel circular interfering rna molecules |
| KR102374518B1 (en) | 2009-06-10 | 2022-03-16 | 알닐람 파마슈티칼스 인코포레이티드 | Improved lipid formulation |
| US8569256B2 (en) | 2009-07-01 | 2013-10-29 | Protiva Biotherapeutics, Inc. | Cationic lipids and methods for the delivery of therapeutic agents |
| CA2767127A1 (en) | 2009-07-01 | 2011-01-06 | Protiva Biotherapeutics, Inc. | Novel lipid formulations for delivery of therapeutic agents to solid tumors |
| WO2011022460A1 (en) | 2009-08-20 | 2011-02-24 | Merck Sharp & Dohme Corp. | Novel cationic lipids with various head groups for oligonucleotide delivery |
| EP2506879A4 (en) | 2009-12-01 | 2014-03-19 | Protiva Biotherapeutics Inc | Snalp formulations containing antioxidants |
| AU2010328336B2 (en) | 2009-12-07 | 2017-03-02 | Arbutus Biopharma Corporation | Compositions for nucleic acid delivery |
| US9670487B2 (en) | 2010-01-22 | 2017-06-06 | Sirna Therapeutics, Inc. | Cationic lipids for oligonucleotide delivery |
| US20120315324A1 (en) | 2010-02-05 | 2012-12-13 | University Of Louisville Research Foundation, Inc. | Exosomal compositions and methods for the treatment of disease |
| US10077232B2 (en) | 2010-05-12 | 2018-09-18 | Arbutus Biopharma Corporation | Cyclic cationic lipids and methods of use |
| WO2011141705A1 (en) | 2010-05-12 | 2011-11-17 | Protiva Biotherapeutics, Inc. | Novel cationic lipids and methods of use thereof |
| KR101967411B1 (en) | 2010-06-03 | 2019-04-10 | 알닐람 파마슈티칼스 인코포레이티드 | Biodegradable lipids for the delivery of active agents |
| JP5957646B2 (en) | 2010-06-04 | 2016-07-27 | サーナ・セラピューティクス・インコーポレイテッドSirna Therapeutics,Inc. | Novel low molecular weight cationic lipids for oligonucleotide delivery |
| US9006417B2 (en) | 2010-06-30 | 2015-04-14 | Protiva Biotherapeutics, Inc. | Non-liposomal systems for nucleic acid delivery |
| US20130323269A1 (en) | 2010-07-30 | 2013-12-05 | Muthiah Manoharan | Methods and compositions for delivery of active agents |
| US20130189351A1 (en) | 2010-08-31 | 2013-07-25 | Novartis Ag | Lipids suitable for liposomal delivery of protein coding rna |
| EP3144015B1 (en) | 2010-09-20 | 2021-06-02 | Sirna Therapeutics, Inc. | Low molecular weight cationic lipids for oligonucleotide delivery |
| WO2012044638A1 (en) | 2010-09-30 | 2012-04-05 | Merck Sharp & Dohme Corp. | Low molecular weight cationic lipids for oligonucleotide delivery |
| CA2813024A1 (en) | 2010-10-21 | 2012-04-26 | Merck Sharp & Dohme Corp. | Novel low molecular weight cationic lipids for oligonucleotide delivery |
| US9617461B2 (en) | 2010-12-06 | 2017-04-11 | Schlumberger Technology Corporation | Compositions and methods for well completions |
| DK2663548T3 (en) | 2011-01-11 | 2017-07-24 | Alnylam Pharmaceuticals Inc | PEGYLED LIPIDS AND THEIR USE FOR PHARMACEUTICAL SUPPLY |
| WO2012162210A1 (en) | 2011-05-26 | 2012-11-29 | Merck Sharp & Dohme Corp. | Ring constrained cationic lipids for oligonucleotide delivery |
| WO2013016058A1 (en) | 2011-07-22 | 2013-01-31 | Merck Sharp & Dohme Corp. | Novel bis-nitrogen containing cationic lipids for oligonucleotide delivery |
| AU2012315965A1 (en) | 2011-09-27 | 2014-04-03 | Alnylam Pharmaceuticals, Inc. | Di-aliphatic substituted PEGylated lipids |
| WO2013063468A1 (en) | 2011-10-27 | 2013-05-02 | Massachusetts Institute Of Technology | Amino acid derivates functionalized on the n- terminal capable of forming drug incapsulating microspheres |
| WO2013070324A1 (en) | 2011-11-07 | 2013-05-16 | University Of Louisville Research Foundation, Inc. | Edible plant-derived microvesicle compositions for diagnosis and treatment of disease |
| WO2013073480A1 (en) | 2011-11-18 | 2013-05-23 | 日油株式会社 | Cationic lipid having improved intracellular kinetics |
| JP6305344B2 (en) | 2011-12-07 | 2018-04-04 | アルニラム・ファーマシューティカルズ・インコーポレーテッド | Biodegradable lipids for delivery of active agents |
| US9463247B2 (en) | 2011-12-07 | 2016-10-11 | Alnylam Pharmaceuticals, Inc. | Branched alkyl and cycloalkyl terminated biodegradable lipids for the delivery of active agents |
| US20140308304A1 (en) | 2011-12-07 | 2014-10-16 | Alnylam Pharmaceuticals, Inc. | Lipids for the delivery of active agents |
| JP6182457B2 (en) | 2011-12-12 | 2017-08-16 | 協和発酵キリン株式会社 | Lipid nanoparticles for drug delivery systems containing cationic lipids |
| WO2013116126A1 (en) | 2012-02-01 | 2013-08-08 | Merck Sharp & Dohme Corp. | Novel low molecular weight, biodegradable cationic lipids for oligonucleotide delivery |
| US9352042B2 (en) | 2012-02-24 | 2016-05-31 | Protiva Biotherapeutics, Inc. | Trialkyl cationic lipids and methods of use thereof |
| EP2830594B1 (en) | 2012-03-27 | 2018-05-09 | Sirna Therapeutics, Inc. | DIETHER BASED BIODEGRADABLE CATIONIC LIPIDS FOR siRNA DELIVERY |
| EA030650B1 (en) | 2013-03-08 | 2018-09-28 | Новартис Аг | Lipids and lipid compositions for the delivery of active agents |
| CA2919226C (en) | 2013-07-23 | 2024-05-14 | Protiva Biotherapeutics, Inc. | Compositions and methods for delivering messenger rna |
| KR102096796B1 (en) | 2013-10-22 | 2020-05-27 | 샤이어 휴먼 지네틱 테라피즈 인크. | Lipid formulations for delivery of messenger rna |
| BR112016011195A2 (en) | 2013-11-18 | 2017-09-19 | Rubius Therapeutics Inc | ENUCLEATED ERYTHROID CELLS AND THEIR METHODS OF MANUFACTURING, PHARMACEUTICAL COMPOSITION AND THEIR USE, USE OF AN ERYTHROID CELL POPULATION, BIORACTOR, CELL MIXTURE AND MEDICAL DEVICE |
| KR102095085B1 (en) | 2013-11-18 | 2020-03-31 | 아크투루스 쎄라퓨틱스, 인크. | ionizable cationic lipid for rna delivery |
| US9365610B2 (en) | 2013-11-18 | 2016-06-14 | Arcturus Therapeutics, Inc. | Asymmetric ionizable cationic lipid for RNA delivery |
| EP3083579B1 (en) | 2013-12-19 | 2022-01-26 | Novartis AG | Lipids and lipid compositions for the delivery of active agents |
| PT3083556T (en) | 2013-12-19 | 2020-03-05 | Novartis Ag | Lipids and lipid compositions for the delivery of active agents |
| US10869898B2 (en) | 2014-04-01 | 2020-12-22 | Rubius Therapeutics, Inc. | Methods and compositions for immunomodulation |
| IL289934B2 (en) | 2014-06-25 | 2023-04-01 | Acuitas Therapeutics Inc | Novel lipids and lipid nanoparticle formulations for delivery of nucleic acids |
| WO2016183482A1 (en) | 2015-05-13 | 2016-11-17 | Rubius Therapeutics, Inc. | Membrane-receiver complex therapeutics |
| CA2987066A1 (en) | 2015-06-05 | 2016-12-08 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for transient gene therapy with enhanced stability |
| CN107848988B (en) | 2015-06-19 | 2021-10-22 | 麻省理工学院 | Alkenyl-substituted 2,5-piperazine diones and their use in compositions for delivering pharmaceutical agents to individuals or cells |
| PL3313829T3 (en) | 2015-06-29 | 2024-08-19 | Acuitas Therapeutics Inc. | Lipids and lipid nanoparticle formulations for delivery of nucleic acids |
| CA3029602A1 (en) | 2015-07-02 | 2017-01-05 | University Of Louisville Research Foundation, Inc. | Edible plant-derived microvesicle compositions for delivery of mirna and methods for treatment of cancer |
| LT3350157T (en) | 2015-09-17 | 2022-02-25 | Modernatx, Inc. | COMPOUNDS AND COMPOSITIONS FOR INTRACELLULAR DELIVERY OF THERAPEUTIC SUBSTANCES |
| WO2018081480A1 (en) | 2016-10-26 | 2018-05-03 | Acuitas Therapeutics, Inc. | Lipid nanoparticle formulations |
| HUE061564T2 (en) | 2015-10-28 | 2023-07-28 | Acuitas Therapeutics Inc | New lipids and lipid nanoparticle formulations for nucleic acid delivery |
| CA3007955A1 (en) | 2015-12-10 | 2017-06-15 | Modernatx, Inc. | Lipid nanoparticles for delivery of therapeutic agents |
| WO2017117528A1 (en) | 2015-12-30 | 2017-07-06 | Acuitas Therapeutics, Inc. | Lipids and lipid nanoparticle formulations for delivery of nucleic acids |
| KR20180095713A (en) | 2016-01-11 | 2018-08-27 | 루비우스 테라퓨틱스, 아이엔씨. | Compositions and methods related to multimodal therapeutic cell systems for immunological indications |
| PL3436077T3 (en) | 2016-03-30 | 2025-07-28 | Intellia Therapeutics, Inc. | Lipid nanoparticle formulations for crispr/cas components |
| US20190161730A1 (en) | 2016-07-07 | 2019-05-30 | Rubius Therapeutics, Inc. | Compositions and methods related to therapeutic cell systems expressing exogenous rna |
| CA3045331A1 (en) | 2016-12-02 | 2018-06-07 | Rubius Therapeutics, Inc. | Compositions and methods related to cell systems for penetrating solid tumors |
| US10476876B2 (en) | 2017-01-05 | 2019-11-12 | Mastercard International Incorporated | Systems and methods for use in managing access to user profiles, and content blocks included therein |
| WO2018151829A1 (en) | 2017-02-17 | 2018-08-23 | Rubius Therapeutics, Inc. | Functionalized erythroid cells |
| CN110869507A (en) | 2017-05-08 | 2020-03-06 | 旗舰先锋创新V股份有限公司 | Composition for promoting membrane fusion and use thereof |
| MX2020002501A (en) | 2017-09-08 | 2020-09-17 | Generation Bio Co | FORMULATIONS OF LIPID NANOPARTICLES OF DNA VECTORS FREE OF CAPSIDES, NOT VIRAL. |
| AR113031A1 (en) | 2017-09-29 | 2020-01-15 | Intellia Therapeutics Inc | LIPID NANOPARTICLE COMPOSITIONS (LNP) INCLUDING RNA |
| IL311278A (en) | 2017-09-29 | 2024-05-01 | Intellia Therapeutics Inc | Polynucleotides, compositions, and methods for genome editing |
| MX2020006150A (en) | 2017-12-15 | 2020-11-11 | Flagship Pioneering Innovations Vi Llc | Compositions comprising circular polyribonucleotides and uses thereof. |
| JP7558929B2 (en) | 2018-05-11 | 2024-10-01 | ビーム セラピューティクス インク. | Methods for suppressing pathogenic mutations using a programmable base editor system |
| WO2019236673A1 (en) | 2018-06-06 | 2019-12-12 | Massachusetts Institute Of Technology | Circular rna for translation in eukaryotic cells |
| AU2019310448A1 (en) | 2018-07-24 | 2021-03-11 | Mayo Foundation For Medical Education And Research | Circularized engineered rna and methods |
| AR116016A1 (en) | 2018-08-24 | 2021-03-25 | Flagship Pioneering Innovations Vi Llc | METHODS FOR MANUFACTURING VEGETABLE MESSENGER PACKAGES |
| EP3852728B1 (en) | 2018-09-20 | 2024-09-18 | ModernaTX, Inc. | Preparation of lipid nanoparticles and methods of administration thereof |
| JP7543259B2 (en) | 2018-10-18 | 2024-09-02 | アクイタス セラピューティクス インコーポレイテッド | Lipids for lipid nanoparticle delivery of active agents |
| WO2020106946A1 (en) | 2018-11-21 | 2020-05-28 | Translate Bio, Inc. | TREATMENT OF CYSTIC FIBROSIS BY DELIVERY OF NEBULIZED mRNA ENCODING CFTR |
| US20220142896A1 (en) | 2019-03-01 | 2022-05-12 | Flagship Pioneering Innovations Vi, Llc | Polyribonucleotides and cosmetic uses thereof |
| EP3930683A1 (en) | 2019-03-01 | 2022-01-05 | Flagship Pioneering Innovations VI, LLC | Compositions, methods, and kits for delivery of polyribonucleotides |
| CN114127044A (en) | 2019-04-25 | 2022-03-01 | 英特利亚治疗股份有限公司 | Ionizable amine lipids and lipid nanoparticles |
| EP3920976B1 (en) | 2019-12-04 | 2023-07-19 | Orna Therapeutics, Inc. | Circular rna compositions and methods |
| US11482222B2 (en) | 2020-03-12 | 2022-10-25 | Motorola Solutions, Inc. | Dynamically assigning wake words |
| AU2021276410A1 (en)* | 2020-05-19 | 2023-01-19 | Orna Therapeutics, Inc. | Circular RNA compositions and methods |
| CN116322760A (en)* | 2020-05-20 | 2023-06-23 | 旗舰创业创新第六有限责任公司 | Coronavirus antigen composition and use thereof |
| WO2021263124A2 (en) | 2020-06-25 | 2021-12-30 | The Board Of Trustees Of The Leland Stanford Junior University | Genetic elements driving circular rna translation and methods of use |
| CN117120605A (en) | 2021-03-26 | 2023-11-24 | 旗舰创业创新七公司 | Compositions and methods for producing cyclic polyribonucleotides |
| EP4314289A1 (en) | 2021-03-26 | 2024-02-07 | Flagship Pioneering Innovations VII, LLC | Production of circular polyribonucleotides in a prokaryotic system |
| EP4314281A1 (en) | 2021-03-26 | 2024-02-07 | Flagship Pioneering Innovations VII, LLC | Production of circular polyribonucleotides in a eukaryotic system |
| CN115404240A (en) | 2021-05-28 | 2022-11-29 | 上海环码生物医药有限公司 | Constructs, methods for making circular RNA and uses thereof |
- 2022
- 2022-12-23TWTW111149837Apatent/TW202342064A/enunknown
- 2022-12-23CNCN202280086335.2Apatent/CN118922211A/enactivePending
- 2022-12-23KRKR1020247024156Apatent/KR20240118881A/enactivePending
- 2022-12-23EPEP22859564.1Apatent/EP4452337A1/enactivePending
- 2022-12-23AUAU2022420620Apatent/AU2022420620A1/enactivePending
- 2022-12-23CACA3241026Apatent/CA3241026A1/enactivePending
- 2022-12-23MXMX2024007870Apatent/MX2024007870A/enunknown
- 2022-12-23JPJP2024537429Apatent/JP2025500358A/enactivePending
- 2022-12-23WOPCT/US2022/082345patent/WO2023122789A1/ennot_activeCeased
- 2022-12-23ILIL313714Apatent/IL313714A/enunknown
Also Published As
| Publication number | Publication date |
|---|---|
| TW202342064A (en) | 2023-11-01 |
| CA3241026A1 (en) | 2023-06-29 |
| EP4452337A1 (en) | 2024-10-30 |
| IL313714A (en) | 2024-08-01 |
| MX2024007870A (en) | 2024-08-15 |
| JP2025500358A (en) | 2025-01-09 |
| WO2023122789A1 (en) | 2023-06-29 |
| AU2022420620A1 (en) | 2024-07-04 |
| CN118922211A (en) | 2024-11-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2994006T3 (en) | Compositions and methods for producing circular polyribonucleotides | |
| KR20240118881A (en) | Circular polyribonucleotide encoding an antifusogenic polypeptide | |
| KR20240125931A (en) | Varicella-Zoster Virus Immunogen Composition and Uses Thereof | |
| WO2024192420A1 (en) | Compositions comprising polyribonucleotides and uses thereof | |
| KR20240117569A (en) | Coronavirus immunogen composition and uses thereof | |
| KR20240117149A (en) | Compositions and methods for purifying polyribonucleotides | |
| WO2025006684A1 (en) | Circular polyribonucleotides encoding antifusogenic polypeptides | |
| WO2024102799A1 (en) | Compositions and methods for producing circular polyribonucleotides | |
| WO2024192422A1 (en) | Immunogenic compositions and uses thereof | |
| WO2025042786A1 (en) | Compositions comprising circular polyribonucleotides and uses thereof | |
| AU2023372397A1 (en) | Compositions and methods for purifying polyribonucleotides | |
| WO2025171319A1 (en) | Photoreactive compositions and methods for producing circular polyribonucleotides |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application | St.27 status event code:A-0-1-A10-A15-nap-PA0105 | |
| PG1501 | Laying open of application | St.27 status event code:A-1-1-Q10-Q12-nap-PG1501 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-3-3-R10-R18-oth-X000 |