KR20210058334A - Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a - Google Patents
Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin aDownload PDFInfo
- Publication number
- KR20210058334A KR20210058334AKR1020190145656AKR20190145656AKR20210058334AKR 20210058334 AKR20210058334 AKR 20210058334AKR 1020190145656 AKR1020190145656 AKR 1020190145656AKR 20190145656 AKR20190145656 AKR 20190145656AKR 20210058334 AKR20210058334 AKR 20210058334A
- Authority
- KR
- South Korea
- Prior art keywords
- syndrome
- asherman
- composition
- vascular
- pharmaceutical composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 208000002777GynatresiaDiseases0.000titleclaimsabstractdescription71
- 208000028685Asherman syndromeDiseases0.000titleclaimsabstractdescription63
- 210000000130stem cellAnatomy0.000titleclaimsabstractdescription52
- 239000000203mixtureSubstances0.000titleclaimsabstractdescription36
- 108010072220Cyclophilin AProteins0.000titleclaimsdescription69
- 102100034539Peptidyl-prolyl cis-trans isomerase AHuman genes0.000titleclaimsdescription67
- 239000001963growth mediumSubstances0.000claimsabstractdescription16
- 230000002792vascularEffects0.000claimsdescription47
- 239000006143cell culture mediumSubstances0.000claimsdescription26
- 238000011282treatmentMethods0.000claimsdescription25
- 238000000034methodMethods0.000claimsdescription20
- 206010016654FibrosisDiseases0.000claimsdescription18
- 230000004761fibrosisEffects0.000claimsdescription18
- 239000008194pharmaceutical compositionSubstances0.000claimsdescription18
- 230000033115angiogenesisEffects0.000claimsdescription15
- 239000003381stabilizerSubstances0.000claimsdescription15
- 208000011580syndromic diseaseDiseases0.000claimsdescription15
- 230000002265preventionEffects0.000claimsdescription12
- 208000000509infertilityDiseases0.000claimsdescription11
- 230000036512infertilityEffects0.000claimsdescription11
- 231100000535infertilityToxicity0.000claimsdescription11
- 239000012679serum free mediumSubstances0.000claimsdescription10
- 235000013305foodNutrition0.000claimsdescription9
- 230000006872improvementEffects0.000claimsdescription7
- 238000012258culturingMethods0.000claimsdescription6
- BNJOZDZCRHCODO-UHFFFAOYSA-NdimethyloxalylglycineChemical groupCOC(=O)CNC(=O)C(=O)OCBNJOZDZCRHCODO-UHFFFAOYSA-N0.000claimsdescription6
- 208000037265diseases, disorders, signs and symptomsDiseases0.000claimsdescription6
- 230000001939inductive effectEffects0.000claimsdescription3
- 201000009273EndometriosisDiseases0.000claimsdescription2
- 206010021143HypoxiaDiseases0.000claimsdescription2
- 208000000450Pelvic PainDiseases0.000claimsdescription2
- 206010034238Pelvic adhesionsDiseases0.000claimsdescription2
- 206010046798Uterine leiomyomaDiseases0.000claimsdescription2
- 206010000210abortionDiseases0.000claimsdescription2
- 231100000176abortionToxicity0.000claimsdescription2
- 201000003511ectopic pregnancyDiseases0.000claimsdescription2
- 230000007954hypoxiaEffects0.000claimsdescription2
- 201000010260leiomyomaDiseases0.000claimsdescription2
- 208000025661ovarian cystDiseases0.000claimsdescription2
- 230000002103transcriptional effectEffects0.000claimsdescription2
- 102100032742Histone-lysine N-methyltransferase SETD2Human genes0.000claims1
- 101000654725Homo sapiens Histone-lysine N-methyltransferase SETD2Proteins0.000claims1
- 208000035475disorderDiseases0.000claims1
- 210000004027cellAnatomy0.000description34
- 238000010172mouse modelMethods0.000description30
- 210000004291uterusAnatomy0.000description24
- 210000002540macrophageAnatomy0.000description20
- 101001046870Homo sapiens Hypoxia-inducible factor 1-alphaProteins0.000description17
- 102100022875Hypoxia-inducible factor 1-alphaHuman genes0.000description17
- 230000000694effectsEffects0.000description17
- 230000001965increasing effectEffects0.000description14
- 239000002609mediumSubstances0.000description13
- 230000035935pregnancyEffects0.000description13
- 102000004169proteins and genesHuman genes0.000description13
- 108090000623proteins and genesProteins0.000description13
- 108020004414DNAProteins0.000description12
- 239000000243solutionSubstances0.000description12
- 230000001225therapeutic effectEffects0.000description11
- 238000011156evaluationMethods0.000description10
- 238000004113cell cultureMethods0.000description9
- 238000004458analytical methodMethods0.000description8
- 210000002257embryonic structureAnatomy0.000description8
- 238000002513implantationMethods0.000description8
- 239000000126substanceSubstances0.000description8
- 208000024891symptomDiseases0.000description8
- 210000001519tissueAnatomy0.000description8
- 210000003556vascular endothelial cellAnatomy0.000description8
- 210000004322M2 macrophageAnatomy0.000description7
- 230000013020embryo developmentEffects0.000description7
- 238000004895liquid chromatography mass spectrometryMethods0.000description7
- 239000002953phosphate buffered salineSubstances0.000description7
- 238000001356surgical procedureMethods0.000description7
- 210000005167vascular cellAnatomy0.000description7
- 101000914484Homo sapiens T-lymphocyte activation antigen CD80Proteins0.000description6
- 102100027222T-lymphocyte activation antigen CD80Human genes0.000description6
- 230000004663cell proliferationEffects0.000description6
- 210000003690classically activated macrophageAnatomy0.000description6
- 239000000546pharmaceutical excipientSubstances0.000description6
- 238000002360preparation methodMethods0.000description6
- 230000002441reversible effectEffects0.000description6
- 238000001262western blotMethods0.000description6
- 241001465754MetazoaSpecies0.000description5
- 241000699670Mus sp.Species0.000description5
- 102100024616Platelet endothelial cell adhesion moleculeHuman genes0.000description5
- 201000010099diseaseDiseases0.000description5
- 239000003814drugSubstances0.000description5
- 230000002357endometrial effectEffects0.000description5
- 108090000765processed proteins & peptidesProteins0.000description5
- VTYYLEPIZMXCLO-UHFFFAOYSA-LCalcium carbonateChemical compound[Ca+2].[O-]C([O-])=OVTYYLEPIZMXCLO-UHFFFAOYSA-L0.000description4
- 102100029438Nitric oxide synthase, inducibleHuman genes0.000description4
- 101710089543Nitric oxide synthase, inducibleProteins0.000description4
- 210000004204blood vesselAnatomy0.000description4
- 239000003636conditioned culture mediumSubstances0.000description4
- 230000001276controlling effectEffects0.000description4
- 239000003085diluting agentSubstances0.000description4
- 210000002514epidermal stem cellAnatomy0.000description4
- HQKMJHAJHXVSDF-UHFFFAOYSA-Lmagnesium stearateChemical compound[Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=OHQKMJHAJHXVSDF-UHFFFAOYSA-L0.000description4
- 230000013011matingEffects0.000description4
- 210000004786perivascular cellAnatomy0.000description4
- 229940124597therapeutic agentDrugs0.000description4
- 238000002560therapeutic procedureMethods0.000description4
- 210000003954umbilical cordAnatomy0.000description4
- XLYOFNOQVPJJNP-UHFFFAOYSA-NwaterSubstancesOXLYOFNOQVPJJNP-UHFFFAOYSA-N0.000description4
- 201000000736AmenorrheaDiseases0.000description3
- 206010001928AmenorrhoeaDiseases0.000description3
- AUJXLBOHYWTPFV-BLWRDSOESA-NCS[C@H]1SC[C@H]2N(C)C(=O)[C@@H](C)NC(=O)[C@H](COC(=O)[C@@H](C(C)C)N(C)C(=O)[C@@H]1N(C)C(=O)[C@@H](C)NC(=O)[C@H](COC(=O)[C@@H](C(C)C)N(C)C2=O)NC(=O)c1cnc2ccccc2n1)NC(=O)c1cnc2ccccc2n1Chemical compoundCS[C@H]1SC[C@H]2N(C)C(=O)[C@@H](C)NC(=O)[C@H](COC(=O)[C@@H](C(C)C)N(C)C(=O)[C@@H]1N(C)C(=O)[C@@H](C)NC(=O)[C@H](COC(=O)[C@@H](C(C)C)N(C)C2=O)NC(=O)c1cnc2ccccc2n1)NC(=O)c1cnc2ccccc2n1AUJXLBOHYWTPFV-BLWRDSOESA-N0.000description3
- 108010009858EchinomycinProteins0.000description3
- 241000699666Mus <mouse, genus>Species0.000description3
- 101100260702Mus musculus Tinagl1 geneProteins0.000description3
- DNIAPMSPPWPWGF-UHFFFAOYSA-NPropylene glycolChemical compoundCC(O)CODNIAPMSPPWPWGF-UHFFFAOYSA-N0.000description3
- 206010047289Ventricular extrasystolesDiseases0.000description3
- 231100000540amenorrheaToxicity0.000description3
- 101150088826arg1 geneProteins0.000description3
- 235000013361beverageNutrition0.000description3
- 230000015572biosynthetic processEffects0.000description3
- 230000008859changeEffects0.000description3
- 239000000839emulsionSubstances0.000description3
- 239000002158endotoxinSubstances0.000description3
- 238000002474experimental methodMethods0.000description3
- 238000009472formulationMethods0.000description3
- 230000004941influxEffects0.000description3
- 229920006008lipopolysaccharidePolymers0.000description3
- 230000001404mediated effectEffects0.000description3
- 108020004999messenger RNAProteins0.000description3
- 230000001737promoting effectEffects0.000description3
- AUJXLBOHYWTPFV-UHFFFAOYSA-Nquinomycin ANatural productsCN1C(=O)C(C)NC(=O)C(NC(=O)C=2N=C3C=CC=CC3=NC=2)COC(=O)C(C(C)C)N(C)C(=O)C2N(C)C(=O)C(C)NC(=O)C(NC(=O)C=3N=C4C=CC=CC4=NC=3)COC(=O)C(C(C)C)N(C)C(=O)C1CSC2SCAUJXLBOHYWTPFV-UHFFFAOYSA-N0.000description3
- 230000002829reductive effectEffects0.000description3
- 239000000829suppositorySubstances0.000description3
- 239000000725suspensionSubstances0.000description3
- 230000002195synergetic effectEffects0.000description3
- 238000012795verificationMethods0.000description3
- GUBGYTABKSRVRQ-XLOQQCSPSA-NAlpha-LactoseChemical compoundO[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1OGUBGYTABKSRVRQ-XLOQQCSPSA-N0.000description2
- 229930105110Cyclosporin ANatural products0.000description2
- PMATZTZNYRCHOR-CGLBZJNRSA-NCyclosporin AChemical compoundCC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=OPMATZTZNYRCHOR-CGLBZJNRSA-N0.000description2
- 108010036949CyclosporineProteins0.000description2
- 108010010803GelatinProteins0.000description2
- PEDCQBHIVMGVHV-UHFFFAOYSA-NGlycerineChemical compoundOCC(O)COPEDCQBHIVMGVHV-UHFFFAOYSA-N0.000description2
- 239000000579Gonadotropin-Releasing HormoneSubstances0.000description2
- 101001046686Homo sapiens Integrin alpha-MProteins0.000description2
- 102100022338Integrin alpha-MHuman genes0.000description2
- 102000008070Interferon-gammaHuman genes0.000description2
- 108010074328Interferon-gammaProteins0.000description2
- 108090000978Interleukin-4Proteins0.000description2
- GUBGYTABKSRVRQ-QKKXKWKRSA-NLactoseNatural productsOC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1OGUBGYTABKSRVRQ-QKKXKWKRSA-N0.000description2
- 208000019255Menstrual diseaseDiseases0.000description2
- 208000002193PainDiseases0.000description2
- RJKFOVLPORLFTN-LEKSSAKUSA-NProgesteroneChemical compoundC1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2RJKFOVLPORLFTN-LEKSSAKUSA-N0.000description2
- 101000857870Squalus acanthias GonadoliberinProteins0.000description2
- 229920002472StarchPolymers0.000description2
- CZMRCDWAGMRECN-UGDNZRGBSA-NSucroseChemical compoundO[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1CZMRCDWAGMRECN-UGDNZRGBSA-N0.000description2
- 229930006000SucroseNatural products0.000description2
- 244000299461Theobroma cacaoSpecies0.000description2
- 235000010443alginic acidNutrition0.000description2
- 229920000615alginic acidPolymers0.000description2
- 238000003556assayMethods0.000description2
- 229910000019calcium carbonateInorganic materials0.000description2
- 239000002775capsuleSubstances0.000description2
- 230000010261cell growthEffects0.000description2
- 229960001265ciclosporinDrugs0.000description2
- 235000009508confectioneryNutrition0.000description2
- 238000012790confirmationMethods0.000description2
- 230000006378damageEffects0.000description2
- 239000003937drug carrierSubstances0.000description2
- 210000003038endotheliumAnatomy0.000description2
- 238000000684flow cytometryMethods0.000description2
- 235000015203fruit juiceNutrition0.000description2
- 239000008273gelatinSubstances0.000description2
- 229920000159gelatinPolymers0.000description2
- 235000019322gelatineNutrition0.000description2
- 235000011852gelatine dessertsNutrition0.000description2
- XLXSAKCOAKORKW-AQJXLSMYSA-NgonadorelinChemical compoundC([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1XLXSAKCOAKORKW-AQJXLSMYSA-N0.000description2
- 229940035638gonadotropin-releasing hormoneDrugs0.000description2
- 239000008187granular materialSubstances0.000description2
- 239000003102growth factorSubstances0.000description2
- 239000005556hormoneSubstances0.000description2
- 229940088597hormoneDrugs0.000description2
- 238000001794hormone therapyMethods0.000description2
- 230000006698inductionEffects0.000description2
- 208000014674injuryDiseases0.000description2
- 229960003130interferon gammaDrugs0.000description2
- 239000008101lactoseSubstances0.000description2
- 235000019359magnesium stearateNutrition0.000description2
- 210000001161mammalian embryoAnatomy0.000description2
- 238000004519manufacturing processMethods0.000description2
- 238000005259measurementMethods0.000description2
- 239000007758minimum essential mediumSubstances0.000description2
- -1pH adjustersSubstances0.000description2
- 238000007911parenteral administrationMethods0.000description2
- 239000000843powderSubstances0.000description2
- 239000003755preservative agentSubstances0.000description2
- 102000004196processed proteins & peptidesHuman genes0.000description2
- 230000035755proliferationEffects0.000description2
- 230000008929regenerationEffects0.000description2
- 238000011069regeneration methodMethods0.000description2
- 150000003839saltsChemical class0.000description2
- 239000007787solidSubstances0.000description2
- 239000008107starchSubstances0.000description2
- 235000019698starchNutrition0.000description2
- UCSJYZPVAKXKNQ-HZYVHMACSA-NstreptomycinChemical compoundCN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1OUCSJYZPVAKXKNQ-HZYVHMACSA-N0.000description2
- 239000005720sucroseSubstances0.000description2
- 239000006188syrupSubstances0.000description2
- 235000020357syrupNutrition0.000description2
- 239000003826tabletSubstances0.000description2
- 239000000454talcSubstances0.000description2
- 229910052623talcInorganic materials0.000description2
- 235000012222talcNutrition0.000description2
- 230000008733traumaEffects0.000description2
- 210000001644umbilical arteryAnatomy0.000description2
- 235000013343vitaminNutrition0.000description2
- 239000011782vitaminSubstances0.000description2
- 229940088594vitaminDrugs0.000description2
- 229930003231vitaminNatural products0.000description2
- 238000005406washingMethods0.000description2
- OJYIBEYSBXIQOP-UHFFFAOYSA-N1-methoxy-4-[2-(4-methoxyphenyl)propan-2-yl]benzeneChemical compoundC1=CC(OC)=CC=C1C(C)(C)C1=CC=C(OC)C=C1OJYIBEYSBXIQOP-UHFFFAOYSA-N0.000description1
- JVKRKMWZYMKVTQ-UHFFFAOYSA-N2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]pyrazol-1-yl]-N-(2-oxo-3H-1,3-benzoxazol-6-yl)acetamideChemical compoundC1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C=NN(C=1)CC(=O)NC1=CC2=C(NC(O2)=O)C=C1JVKRKMWZYMKVTQ-UHFFFAOYSA-N0.000description1
- ISTWWSBLMQHYIQ-UHFFFAOYSA-N2-methyl-2-(oxaloamino)propanoic acidChemical compoundOC(=O)C(C)(C)NC(=O)C(O)=OISTWWSBLMQHYIQ-UHFFFAOYSA-N0.000description1
- YLZOPXRUQYQQID-UHFFFAOYSA-N3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-1-[4-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]piperazin-1-yl]propan-1-oneChemical compoundN1N=NC=2CN(CCC=21)CCC(=O)N1CCN(CC1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)FYLZOPXRUQYQQID-UHFFFAOYSA-N0.000description1
- FHVDTGUDJYJELY-UHFFFAOYSA-N6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acidChemical compoundO1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1OFHVDTGUDJYJELY-UHFFFAOYSA-N0.000description1
- 206010000234Abortion spontaneousDiseases0.000description1
- 244000215068Acacia senegalSpecies0.000description1
- 235000006491Acacia senegalNutrition0.000description1
- 208000002874Acne VulgarisDiseases0.000description1
- 208000024827Alzheimer diseaseDiseases0.000description1
- 102100034594Angiopoietin-1Human genes0.000description1
- 108010048154Angiopoietin-1Proteins0.000description1
- 208000004746Atrophic VaginitisDiseases0.000description1
- 206010003693Atrophic vulvovaginitisDiseases0.000description1
- 241000282817BovidaeSpecies0.000description1
- 241000282832CamelidaeSpecies0.000description1
- 241000282472Canis lupus familiarisSpecies0.000description1
- 241000283707CapraSpecies0.000description1
- 102100033601Collagen alpha-1(I) chainHuman genes0.000description1
- FBPFZTCFMRRESA-FSIIMWSLSA-ND-GlucitolNatural productsOC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)COFBPFZTCFMRRESA-FSIIMWSLSA-N0.000description1
- FBPFZTCFMRRESA-KVTDHHQDSA-ND-MannitolChemical compoundOC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)COFBPFZTCFMRRESA-KVTDHHQDSA-N0.000description1
- FBPFZTCFMRRESA-JGWLITMVSA-ND-glucitolChemical compoundOC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)COFBPFZTCFMRRESA-JGWLITMVSA-N0.000description1
- 208000005171DysmenorrheaDiseases0.000description1
- 206010013935DysmenorrhoeaDiseases0.000description1
- LVGKNOAMLMIIKO-UHFFFAOYSA-NElaidinsaeure-aethylesterNatural productsCCCCCCCCC=CCCCCCCCC(=O)OCCLVGKNOAMLMIIKO-UHFFFAOYSA-N0.000description1
- 241000283086EquidaeSpecies0.000description1
- 239000004386ErythritolSubstances0.000description1
- UNXHWFMMPAWVPI-UHFFFAOYSA-NErythritolNatural productsOCC(O)C(O)COUNXHWFMMPAWVPI-UHFFFAOYSA-N0.000description1
- LYCAIKOWRPUZTN-UHFFFAOYSA-NEthylene glycolChemical compoundOCCOLYCAIKOWRPUZTN-UHFFFAOYSA-N0.000description1
- 239000004606Fillers/ExtendersSubstances0.000description1
- 206010016825FlushingDiseases0.000description1
- WQZGKKKJIJFFOK-GASJEMHNSA-NGlucoseNatural productsOC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1OWQZGKKKJIJFFOK-GASJEMHNSA-N0.000description1
- 229920000084Gum arabicPolymers0.000description1
- 208000005176Hepatitis CDiseases0.000description1
- 206010020112HirsutismDiseases0.000description1
- 101000666730Homo sapiens T-complex protein 1 subunit alphaProteins0.000description1
- 102000000521ImmunophilinsHuman genes0.000description1
- 108010016648ImmunophilinsProteins0.000description1
- 208000026350Inborn Genetic diseaseDiseases0.000description1
- 229930195725MannitolNatural products0.000description1
- 208000007101Muscle CrampDiseases0.000description1
- NIPNSKYNPDTRPC-UHFFFAOYSA-NN-[2-oxo-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamideChemical compoundO=C(CNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2NIPNSKYNPDTRPC-UHFFFAOYSA-N0.000description1
- 206010028980NeoplasmDiseases0.000description1
- 241001494479PecoraSpecies0.000description1
- 229920002230Pectic acidPolymers0.000description1
- 239000002202Polyethylene glycolSubstances0.000description1
- 208000005107Premature BirthDiseases0.000description1
- 206010036590Premature babyDiseases0.000description1
- 206010039792SeborrhoeaDiseases0.000description1
- 208000005392SpasmDiseases0.000description1
- 241000282887SuidaeSpecies0.000description1
- 102100038410T-complex protein 1 subunit alphaHuman genes0.000description1
- 244000269722Thea sinensisSpecies0.000description1
- 235000005764Theobroma cacao ssp. cacaoNutrition0.000description1
- 235000005767Theobroma cacao ssp. sphaerocarpumNutrition0.000description1
- 206010046809Uterine painDiseases0.000description1
- 206010046820Uterine ruptureDiseases0.000description1
- 102000005789Vascular Endothelial Growth FactorsHuman genes0.000description1
- 108010019530Vascular Endothelial Growth FactorsProteins0.000description1
- TVXBFESIOXBWNM-UHFFFAOYSA-NXylitolNatural productsOCCC(O)C(O)C(O)CCOTVXBFESIOXBWNM-UHFFFAOYSA-N0.000description1
- 210000001015abdomenAnatomy0.000description1
- 230000003187abdominal effectEffects0.000description1
- 235000010489acacia gumNutrition0.000description1
- 238000009825accumulationMethods0.000description1
- 206010000496acneDiseases0.000description1
- 230000009471actionEffects0.000description1
- 239000004480active ingredientSubstances0.000description1
- 239000000654additiveSubstances0.000description1
- 239000000443aerosolSubstances0.000description1
- 235000013334alcoholic beverageNutrition0.000description1
- 150000001298alcoholsChemical class0.000description1
- 229940072056alginateDrugs0.000description1
- 239000000783alginic acidSubstances0.000description1
- 229960001126alginic acidDrugs0.000description1
- 150000004781alginic acidsChemical class0.000description1
- 108010029483alpha 1 Chain Collagen Type IProteins0.000description1
- 210000001691amnionAnatomy0.000description1
- 230000003444anaesthetic effectEffects0.000description1
- 230000003698anagen phaseEffects0.000description1
- 229940035676analgesicsDrugs0.000description1
- 238000010171animal modelMethods0.000description1
- 239000000730antalgic agentSubstances0.000description1
- 229940124599anti-inflammatory drugDrugs0.000description1
- 239000007864aqueous solutionSubstances0.000description1
- 239000003125aqueous solventSubstances0.000description1
- 239000007900aqueous suspensionSubstances0.000description1
- WQZGKKKJIJFFOK-VFUOTHLCSA-Nbeta-D-glucoseChemical compoundOC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1OWQZGKKKJIJFFOK-VFUOTHLCSA-N0.000description1
- 239000011230binding agentSubstances0.000description1
- 230000033228biological regulationEffects0.000description1
- 238000001574biopsyMethods0.000description1
- 210000001185bone marrowAnatomy0.000description1
- 235000008429breadNutrition0.000description1
- 235000014121butterNutrition0.000description1
- 235000001046cacaoteroNutrition0.000description1
- 235000010216calcium carbonateNutrition0.000description1
- 239000001506calcium phosphateSubstances0.000description1
- 229910000389calcium phosphateInorganic materials0.000description1
- 235000011010calcium phosphatesNutrition0.000description1
- 239000000378calcium silicateSubstances0.000description1
- 229910052918calcium silicateInorganic materials0.000description1
- 235000012241calcium silicateNutrition0.000description1
- OYACROKNLOSFPA-UHFFFAOYSA-Ncalcium;dioxido(oxo)silaneChemical compound[Ca+2].[O-][Si]([O-])=OOYACROKNLOSFPA-UHFFFAOYSA-N0.000description1
- 201000011510cancerDiseases0.000description1
- 235000014171carbonated beverageNutrition0.000description1
- 230000032823cell divisionEffects0.000description1
- 239000002771cell markerSubstances0.000description1
- 230000001413cellular effectEffects0.000description1
- 239000001913celluloseSubstances0.000description1
- 229920002678cellulosePolymers0.000description1
- 235000010980celluloseNutrition0.000description1
- 238000005119centrifugationMethods0.000description1
- 239000003795chemical substances by applicationSubstances0.000description1
- 235000019219chocolateNutrition0.000description1
- 239000003086colorantSubstances0.000description1
- 210000002808connective tissueAnatomy0.000description1
- 238000010276constructionMethods0.000description1
- 239000003433contraceptive agentSubstances0.000description1
- 230000002254contraceptive effectEffects0.000description1
- 238000007796conventional methodMethods0.000description1
- 230000002354daily effectEffects0.000description1
- 235000013365dairy productNutrition0.000description1
- POZRVZJJTULAOH-LHZXLZLDSA-NdanazolChemical compoundC1[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=CC2=C1C=NO2POZRVZJJTULAOH-LHZXLZLDSA-N0.000description1
- 229960000766danazolDrugs0.000description1
- 230000003247decreasing effectEffects0.000description1
- 230000007547defectEffects0.000description1
- 238000011161developmentMethods0.000description1
- 230000018109developmental processEffects0.000description1
- 239000008121dextroseSubstances0.000description1
- 238000010586diagramMethods0.000description1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-Idipotassium trisodium dihydrogen phosphate hydrogen phosphate dichlorideChemical compoundP(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+]LOKCTEFSRHRXRJ-UHFFFAOYSA-I0.000description1
- 239000007884disintegrantSubstances0.000description1
- 229940079593drugDrugs0.000description1
- 239000003792electrolyteSubstances0.000description1
- 238000001962electrophoresisMethods0.000description1
- 230000002996emotional effectEffects0.000description1
- 210000004696endometriumAnatomy0.000description1
- 238000005516engineering processMethods0.000description1
- UNXHWFMMPAWVPI-ZXZARUISSA-NerythritolChemical compoundOC[C@H](O)[C@H](O)COUNXHWFMMPAWVPI-ZXZARUISSA-N0.000description1
- 235000019414erythritolNutrition0.000description1
- 229940009714erythritolDrugs0.000description1
- 150000002148estersChemical class0.000description1
- LVGKNOAMLMIIKO-QXMHVHEDSA-Nethyl oleateChemical compoundCCCCCCCC\C=C/CCCCCCCC(=O)OCCLVGKNOAMLMIIKO-QXMHVHEDSA-N0.000description1
- 229940093471ethyl oleateDrugs0.000description1
- 230000003203everyday effectEffects0.000description1
- 238000010195expression analysisMethods0.000description1
- 206010016256fatigueDiseases0.000description1
- 210000001752female genitaliaAnatomy0.000description1
- 210000004700fetal bloodAnatomy0.000description1
- 210000003754fetusAnatomy0.000description1
- 239000000945fillerSubstances0.000description1
- 238000001914filtrationMethods0.000description1
- 239000000796flavoring agentSubstances0.000description1
- 235000013355food flavoring agentNutrition0.000description1
- 235000003599food sweetenerNutrition0.000description1
- 239000003205fragranceSubstances0.000description1
- 208000016361genetic diseaseDiseases0.000description1
- 235000011187glycerolNutrition0.000description1
- 230000002650habitual effectEffects0.000description1
- 235000013402health foodNutrition0.000description1
- 210000003958hematopoietic stem cellAnatomy0.000description1
- 230000008935histological improvementEffects0.000description1
- 239000003906humectantSubstances0.000description1
- 238000009396hybridizationMethods0.000description1
- 235000015243ice creamNutrition0.000description1
- 238000003125immunofluorescent labelingMethods0.000description1
- 229960003444immunosuppressant agentDrugs0.000description1
- 230000001861immunosuppressant effectEffects0.000description1
- 239000003018immunosuppressive agentSubstances0.000description1
- 230000008595infiltrationEffects0.000description1
- 238000001764infiltrationMethods0.000description1
- 238000013383initial experimentMethods0.000description1
- 238000003780insertionMethods0.000description1
- 230000037431insertionEffects0.000description1
- 239000007928intraperitoneal injectionSubstances0.000description1
- 238000002955isolationMethods0.000description1
- 235000015110jelliesNutrition0.000description1
- 239000008274jellySubstances0.000description1
- VMPHSYLJUKZBJJ-UHFFFAOYSA-Nlauric acid triglycerideNatural productsCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCC)COC(=O)CCCCCCCCCCCVMPHSYLJUKZBJJ-UHFFFAOYSA-N0.000description1
- 230000003902lesionEffects0.000description1
- 230000000670limiting effectEffects0.000description1
- 239000007788liquidSubstances0.000description1
- 229940057995liquid paraffinDrugs0.000description1
- 239000006193liquid solutionSubstances0.000description1
- 239000006194liquid suspensionSubstances0.000description1
- 230000007774longtermEffects0.000description1
- 239000000314lubricantSubstances0.000description1
- 238000004020luminiscence typeMethods0.000description1
- 229960003511macrogolDrugs0.000description1
- 239000000845maltitolSubstances0.000description1
- VQHSOMBJVWLPSR-WUJBLJFYSA-NmaltitolChemical compoundOC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1OVQHSOMBJVWLPSR-WUJBLJFYSA-N0.000description1
- 235000010449maltitolNutrition0.000description1
- 229940035436maltitolDrugs0.000description1
- 239000000594mannitolSubstances0.000description1
- 235000010355mannitolNutrition0.000description1
- 238000004949mass spectrometryMethods0.000description1
- 235000013372meatNutrition0.000description1
- 238000011177media preparationMethods0.000description1
- 230000002175menstrual effectEffects0.000description1
- 210000002901mesenchymal stem cellAnatomy0.000description1
- HEBKCHPVOIAQTA-UHFFFAOYSA-Nmeso ribitolNatural productsOCC(O)C(O)C(O)COHEBKCHPVOIAQTA-UHFFFAOYSA-N0.000description1
- 229920000609methyl cellulosePolymers0.000description1
- 239000001923methylcelluloseSubstances0.000description1
- 235000010981methylcelluloseNutrition0.000description1
- LXCFILQKKLGQFO-UHFFFAOYSA-NmethylparabenChemical compoundCOC(=O)C1=CC=C(O)C=C1LXCFILQKKLGQFO-UHFFFAOYSA-N0.000description1
- 239000002480mineral oilSubstances0.000description1
- 235000010446mineral oilNutrition0.000description1
- 208000015994miscarriageDiseases0.000description1
- 238000002156mixingMethods0.000description1
- 210000001616monocyteAnatomy0.000description1
- 239000013642negative controlSubstances0.000description1
- 239000012457nonaqueous mediaSubstances0.000description1
- 235000012149noodlesNutrition0.000description1
- 235000015097nutrientsNutrition0.000description1
- 230000037312oily skinEffects0.000description1
- 235000008390olive oilNutrition0.000description1
- 239000004006olive oilSubstances0.000description1
- 239000006186oral dosage formSubstances0.000description1
- 150000007524organic acidsChemical class0.000description1
- 235000005985organic acidsNutrition0.000description1
- 230000027758ovulation cycleEffects0.000description1
- 230000036961partial effectEffects0.000description1
- LCLHHZYHLXDRQG-ZNKJPWOQSA-Npectic acidChemical compoundO[C@@H]1[C@@H](O)[C@@H](O)O[C@H](C(O)=O)[C@@H]1OC1[C@H](O)[C@@H](O)[C@@H](OC2[C@@H]([C@@H](O)[C@@H](O)[C@H](O2)C(O)=O)O)[C@@H](C(O)=O)O1LCLHHZYHLXDRQG-ZNKJPWOQSA-N0.000description1
- 239000006187pillSubstances0.000description1
- 235000013550pizzaNutrition0.000description1
- 210000002826placentaAnatomy0.000description1
- 229920001223polyethylene glycolPolymers0.000description1
- 239000010318polygalacturonic acidSubstances0.000description1
- 229920000136polysorbatePolymers0.000description1
- 239000001267polyvinylpyrrolidoneSubstances0.000description1
- 235000013855polyvinylpyrrolidoneNutrition0.000description1
- 229920000036polyvinylpyrrolidonePolymers0.000description1
- 201000010808postmenopausal atrophic vaginitisDiseases0.000description1
- 230000008569processEffects0.000description1
- 239000000186progesteroneSubstances0.000description1
- 229960003387progesteroneDrugs0.000description1
- 230000002062proliferating effectEffects0.000description1
- QELSKZZBTMNZEB-UHFFFAOYSA-NpropylparabenChemical compoundCCCOC(=O)C1=CC=C(O)C=C1QELSKZZBTMNZEB-UHFFFAOYSA-N0.000description1
- 229960003415propylparabenDrugs0.000description1
- 230000001681protective effectEffects0.000description1
- 238000003753real-time PCRMethods0.000description1
- 102000005962receptorsHuman genes0.000description1
- 108020003175receptorsProteins0.000description1
- 230000009467reductionEffects0.000description1
- 230000001105regulatory effectEffects0.000description1
- 230000003252repetitive effectEffects0.000description1
- 238000003757reverse transcription PCRMethods0.000description1
- 235000013580sausagesNutrition0.000description1
- 238000000926separation methodMethods0.000description1
- 210000002966serumAnatomy0.000description1
- 210000003491skinAnatomy0.000description1
- 235000011888snacksNutrition0.000description1
- 239000000600sorbitolSubstances0.000description1
- 235000010356sorbitolNutrition0.000description1
- 235000014347soupsNutrition0.000description1
- 208000000995spontaneous abortionDiseases0.000description1
- 230000000638stimulationEffects0.000description1
- 229960005322streptomycinDrugs0.000description1
- 239000004094surface-active agentSubstances0.000description1
- 238000004114suspension cultureMethods0.000description1
- 239000003765sweetening agentSubstances0.000description1
- 235000013616teaNutrition0.000description1
- 238000012360testing methodMethods0.000description1
- 239000002562thickening agentSubstances0.000description1
- 230000000451tissue damageEffects0.000description1
- 231100000827tissue damageToxicity0.000description1
- 231100000419toxicityToxicity0.000description1
- 230000001988toxicityEffects0.000description1
- YFDSDPIBEUFTMI-UHFFFAOYSA-NtribromoethanolChemical compoundOCC(Br)(Br)BrYFDSDPIBEUFTMI-UHFFFAOYSA-N0.000description1
- 229950004616tribromoethanolDrugs0.000description1
- QORWJWZARLRLPR-UHFFFAOYSA-Htricalcium bis(phosphate)Chemical compound[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=OQORWJWZARLRLPR-UHFFFAOYSA-H0.000description1
- 210000004509vascular smooth muscle cellAnatomy0.000description1
- 235000015112vegetable and seed oilNutrition0.000description1
- 239000008158vegetable oilSubstances0.000description1
- 235000013311vegetablesNutrition0.000description1
- 150000003722vitamin derivativesChemical class0.000description1
- 230000004584weight gainEffects0.000description1
- 235000019786weight gainNutrition0.000description1
- 239000000080wetting agentSubstances0.000description1
- 235000010447xylitolNutrition0.000description1
- 239000000811xylitolSubstances0.000description1
- HEBKCHPVOIAQTA-SCDXWVJYSA-NxylitolChemical compoundOC[C@H](O)[C@@H](O)[C@H](O)COHEBKCHPVOIAQTA-SCDXWVJYSA-N0.000description1
- 229960002675xylitolDrugs0.000description1
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/44—Vessels; Vascular smooth muscle cells; Endothelial cells; Endothelial progenitor cells
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/34—Muscles; Smooth muscle cells; Heart; Cardiac stem cells; Myoblasts; Myocytes; Cardiomyocytes
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/17—Amino acids, peptides or proteins
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/225—Polycarboxylic acids
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/02—Drugs for genital or sexual disorders; Contraceptives for disorders of the vagina
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2200/00—Function of food ingredients
- A23V2200/30—Foods, ingredients or supplements having a functional effect on health
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Reproductive Health (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Cell Biology (AREA)
- Gynecology & Obstetrics (AREA)
- Endocrinology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Developmental Biology & Embryology (AREA)
- Mycology (AREA)
- Food Science & Technology (AREA)
- Nutrition Science (AREA)
- Polymers & Plastics (AREA)
- Gastroenterology & Hepatology (AREA)
- Pregnancy & Childbirth (AREA)
- Vascular Medicine (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Zoology (AREA)
- Emergency Medicine (AREA)
- Cardiology (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean본 발명은 혈관외피줄기세포(perivascular stem cell) 배양액 또는 사이클로필린 A를 포함하는, 아셔만 증후군(Asherman syndrome) 예방 또는 치료용 조성물에 관한 것이다.The present invention relates to a composition for preventing or treating Asherman syndrome, comprising a culture medium of perivascular stem cells or cyclopilin A.
아셔만 증후군은 자궁내강유착증(子宮內腔癒着症)으로도 알려져 있으며, 자궁내막기저층의 박탈(剝奪), 결손이 생기고 자궁강의 부분적 또는 광범한 유착이 발생된 것으로, 불임증, 습관성 유산이나 조산, 무월경, 과소월경, 월경곤란증 등이 증상으로 나타난다.Asherman's syndrome is also known as endometrial adhesion, deprivation of the base of the uterus, defects, and partial or extensive adhesion of the uterine cavity.Infertility, habitual miscarriage or premature birth, Symptoms include amenorrhea, undermenstruation, and dysmenorrhea.
치료방법으로 경질 또는 개복에 의한 유착박리, 자궁내피임기구(IUD)의 삽입, 호르몬제 투여 등이 있으나, 수술 후 상당수 자궁 내 재유착이 발생하게 되어 여러 번의 수술을 필요로 하기도 한다. 또한, 중증의 경우 반복적 수술을 필요로 하기도 하며, 임신이 불가능하게 되기도 한다.Treatment methods include adhesion and detachment by hard or open abdomen, insertion of an intrauterine contraceptive device (IUD), and administration of hormones, but after surgery, a significant number of intrauterine re-adhesion occurs, requiring several surgeries. In addition, in severe cases, repetitive surgery may be required, and pregnancy may become impossible.
또한, 통증완화를 위해 진통제, 소염제를 사용하는 보존적 요법, 및 다나졸(danazol), 프로게스테론(progesterone), 성선자극호르몬분비호르몬(Gonadotropin-releasing hormone, GnRH)을 사용하여 생리주기를 제어하는 호르몬치료 요법이 수행되고 있으나 이들은 근본적 치료법이 아닌 증상의 개선일 뿐인 한계점이 있으며, 이들 호르몬의 장기적 사용은 여러 가지 부작용(체중의 증가, 수분 축적, 피로, 여드름, 지성 피부, 조모증, 위축성 질염, 안면 홍조, 근육 경련, 불안정한 감정 상태, 간세포 독성)을 야기하고, 재발률도 매우 높다.In addition, conservative therapy using analgesics and anti-inflammatory drugs for pain relief, and hormone therapy that controls the menstrual cycle using danazol, progesterone, and gonadotropin-releasing hormone (GnRH). Although therapies are being performed, these are not fundamental treatments, but only symptomatic improvement, and long-term use of these hormones has a number of side effects (weight gain, water accumulation, fatigue, acne, oily skin, hirsutism, atrophic vaginitis, facial Flushing, muscle spasms, unstable emotional state, hepatocellular toxicity), and the recurrence rate is very high.
자궁유착은 극심한 통증으로 인해 일상 생활에 불편함을 발생시키며, 심한 경우 불임에까지 이르는 질환으로써, 여성의'삶의 질'과 '임신'의 문제에서 심각하게 인식되어야 하고 반드시 극복해야 할 질병임에도 불구하고 아직까지 근본적인 예방 및 치료방법이 존재하지 않으며, 관련 연구도 부족한 실정이다. 이에 따라, 단순 대증요법이 아닌 근본적인 치료가 가능한 치료용 조성물의 개발이 요구되고 있다.Uterine adhesions cause discomfort in daily life due to extreme pain, and in severe cases, it is a disease that leads to infertility. Although it is a disease that must be seriously recognized and overcome in the problems of'quality of life' and'pregnancy' of women. There is no fundamental prevention and treatment method yet, and related studies are lacking. Accordingly, there is a need for development of a therapeutic composition capable of fundamental treatment rather than simple symptomatic therapy.
본 발명의 목적은 혈관외피줄기세포(perivascular stem cell) 배양액 또는 사이클로필린 A를 포함하는, 아셔만 증후군(Asherman syndrome) 및/또는 아셔만 증후군 합병증의 예방 또는 치료용 약학적 조성물을 제공하는 것이다.It is an object of the present invention to provide a pharmaceutical composition for the prevention or treatment of complications of Asherman syndrome and/or Asherman syndrome, comprising a culture medium of perivascular stem cells or cyclophilin A.
본 발명의 다른 목적은 혈관외피줄기세포 배양액 또는 사이클로필린 A를 개체에 투여하는 단계를 포함하는, 아셔만 증후군 및/또는 아셔만 증후군 합병증의 치료방법을 제공하는 것이다.Another object of the present invention is to provide a method for treating Asherman syndrome and/or complications of Asherman syndrome, comprising administering to an individual a vascular enveloped stem cell culture medium or cyclopilin A.
본 발명의 또 다른 목적은 혈관외피줄기세포 배양액 또는 사이클로필린 A를 포함하는, 아셔만 증후군 및/또는 아셔만 증후군 합병증의 개선용 식품 조성물을 제공하는 것이다.Another object of the present invention is to provide a food composition for improving the complications of Asherman syndrome and/or Asherman syndrome, comprising a vascular enveloped stem cell culture medium or cyclopilin A.
상기 목적을 달성하기 위한 본 발명의 일 측면은 혈관외피줄기세포(perivascular stem cell) 배양액 또는 사이클로필린 A를 포함하는, 아셔만 증후군(Asherman syndrome) 예방 또는 치료용 약학적 조성물에 관한 것이다.One aspect of the present invention for achieving the above object relates to a pharmaceutical composition for preventing or treating Asherman syndrome, comprising a culture medium of perivascular stem cells or cyclopilin A.
본 발명에서, “혈관외피줄기세포(perivascular stem cell) 배양액”은 혈관외피줄기세포(perivascular stem cell)를 배지에서 배양하여 수득한 액을 말하며, 상기 배지는 혈청 배지, 무혈청 배지 등 세포를 배양할 수 있는 모든 형태의 배지를 말한다.In the present invention, “perivascular stem cell culture solution” refers to a solution obtained by culturing perivascular stem cells in a medium, and the medium is a serum medium, a serum-free medium, etc. to cultivate cells It refers to any type of medium that can be done.
상기 배양액은 혈관외피줄기세포를 배양하면서 세포로부터 분비되어 나오는 성장인자(growth factor), 단백질 등을 포함할 수 있으며, 상기 단백질에는 사이클로필린 A가 포함될 수 있다.The culture medium may contain a growth factor, a protein, and the like secreted from the cells while culturing the vascular envelope stem cells, and the protein may contain cyclophylline A.
또한, 상기 혈관외피줄기세포 배양액에는 혈관외피줄기세포가 포함되거나 포함되지 않은 형태 모두를 포함할 수 있다.In addition, the vascular envelope stem cell culture medium may contain all forms containing or without vascular envelope stem cells.
구체적으로, 상기 혈관외피줄기세포 배양액은 혈관외피줄기세포를 무혈청 배지에서 배양하여 수득한 것일 수 있다. 일 예로, 혈관외피줄기세포를 무혈청 배지에서 배양하여 조건배지(conditioned medium)를 수득하여 사용할 수 있으며, 상기 조건배지는 세포를 액체 현탁 배양하여 세포분열 최성기인 대수성장기에 도달했을 때 분열세포를 원심분리 또는 여과하여 제거하고 배양액만 채취하여 이를 배양기질에 혼합한 배지를 말한다.Specifically, the vascular enveloped stem cell culture medium may be obtained by culturing vascular enveloped stem cells in a serum-free medium. As an example, the vascular envelope stem cells can be cultured in a serum-free medium to obtain a conditioned medium, and the conditioned medium is a liquid suspension culture of the cells to generate dividing cells when reaching the logarithmic growth phase, which is the peak phase of cell division. It refers to a medium that is removed by centrifugation or filtration, and only the culture medium is collected and mixed with the culture medium.
본 발명 일 실시예에서는 상기 혈관외피줄기세포 배양액을 투여한 경우, 섬유화가 억제되며(도 2), 자궁조직 내에서 혈관내피세포 표지인자의 발현이 증가하고(도 9), 자궁 내 대식세포의 극성을 조절함으로써 혈관신생을 촉진함을 확인하였는 바(도 14 내지 도 18), 본 발명의 혈관외피줄기세포 배양액은 섬유화를 억제하고 혈관신생을 촉진함으로써 아셔만 증후군, 이의 관련 증상 및 합병증에 대한 예방, 치료 또는 개선 용도로 활용될 수 있다.In one embodiment of the present invention, when the vascular envelope stem cell culture medium is administered, fibrosis is suppressed (Fig. 2), the expression of vascular endothelial cell markers in the uterine tissue is increased (Fig. 9), and It was confirmed that angiogenesis was promoted by controlling the polarity (FIGS. 14 to 18), and the vascular enveloped stem cell culture solution of the present invention inhibited fibrosis and promoted angiogenesis, thereby preventing Asherman syndrome, its related symptoms, and complications. It can be used for prevention, treatment or improvement purposes.
본 발명에서, “사이클로필린 A(Cyclophilin A)”은 면역억제 사이클로스포린 A(immunosuppressant Cyclosporin A, CsA)에 높은 친화력(high affinity)을 갖는 단백질로서, 이뮤노필린 패밀리(immunophilin family)에 속하는 도처에 편재한다. 사이클로필린 A의 기능은 암세포 저항, 알츠하이머 질환, C형 간염에 대한 치료 용도로 연구된 바 있으며, 혈관 평활근 세포(vascular smooth muscle cell)에서 성장 인자와 같은 역할을 하는 것으로도 보고된 바 있다.In the present invention, "Cyclophilin A" is a protein having high affinity to immunosuppressant Cyclosporin A (CsA), and is ubiquitous throughout the immunophilin family. do. The function of cyclophilin A has been studied for use in the treatment of cancer cell resistance, Alzheimer's disease, and hepatitis C, and has been reported to play the same role as a growth factor in vascular smooth muscle cells.
본 발명 일 실시예에서는 사이클로필린 A를 투여한 경우, 자궁 내 섬유화가억제됨을 확인하였으며(도 6), 아셔만 증후군 생쥐모델에서 착상률 및 배아발달이 모두 개선됨을 확인하였다(도 7 및 도 8). 이에 따라, 본 발명의 사이클로필린 A는 아셔만 증후군, 이의 관련 증상 및 합병증에 대한 예방, 치료 또는 개선 용도로 활용될 수 있다.In one embodiment of the present invention, when cyclophilin A was administered, it was confirmed that intrauterine fibrosis was inhibited (FIG. 6), and both implantation rate and embryonic development were improved in the Asserman syndrome mouse model (FIG. 7 and FIG. 8). . Accordingly, the cyclophilin A of the present invention can be used for prevention, treatment, or improvement of Asherman's syndrome and its related symptoms and complications.
본 발명에서, “아셔만 증후군(Asherman syndrome)”은 자궁내막 기저층이 떨어지고 정상적인 재생이 어려워지면서 자궁에 유착이 생긴 것을 말한다. 자궁내막소파술, 자궁경부 원추형 생검술, 전기소작술 등의 수술 병력이 있는 환자, 골반염, 자궁 내 피임장치 등으로 인한 감염 등 여러 종류의 감염으로 인해 자궁내막의 섬유화, 자궁경관의 손상, 자궁내막의 파괴, 자궁강의 유착이 나타나며, 이로 인하여 월경의 감소, 무월경, 자궁통증 등이 발생하는 일련의 증상을 모두 포함한다. 또한, 중증의 아셔만 증후군이 있는 경우, 불임이 생길 수 있으며, 중증의 아셔만 증후군은 난치성 난임의 원인으로 보고된 바 있다. 자궁 내에서의 아셔만 증후군 병변은 자궁파열, 생리 장애, 무월경, 불임 등의 합병증과 동반되는 경우가 많다.In the present invention, "Asherman syndrome" refers to the occurrence of adhesions to the uterus as the base layer of the endometrium falls and normal regeneration becomes difficult. Patients with a history of surgery such as endometrial sofa surgery, cervical cone biopsy, electrocautery, etc. Destruction and adhesion of the uterine cavity appear, which includes a series of symptoms such as menstrual decrease, amenorrhea, and uterine pain. In addition, in the case of severe Asherman syndrome, infertility may occur, and severe Asherman syndrome has been reported as a cause of refractory infertility. Intrauterine Asherman syndrome lesions are often accompanied by complications such as uterine rupture, menstrual disorders, amenorrhea, and infertility.
구체적으로, 상기 약학적 조성물은 HIF-1α(hypoxia inducible transcriptional factor 1α) 안정제(stabilizer)를 추가로 포함하는 것일 수 있다. 구체적으로 HIF-1α 안정제는 디메틸옥살로글리신(dimethyloxaloylglycine, DMOG)인 것일 수 있으나, 이에 제한되는 것은 아니다.Specifically, the pharmaceutical composition may further include a hypoxia inducible transcriptional factor 1α (HIF-1α) stabilizer. Specifically, the HIF-1α stabilizer may be dimethyloxaloylglycine (DMOG), but is not limited thereto.
본 발명 일 실시예에서는 HIF-1α 안정제 중 하나인 디메틸옥살로글리신이 추가된 경우, 착상률이 증가하고(도 11), 배아발달이 촉진되는 것을 확인하였다(도 12).In an embodiment of the present invention, it was confirmed that when dimethyloxaloglycine, which is one of the HIF-1α stabilizers, was added, the implantation rate was increased (FIG. 11), and embryo development was promoted (FIG. 12).
또한 구체적으로, 본 발명 일 실시예에서는 사이클로필린 A를 투여한 경우, 자궁 내 섬유화가 억제됨을 확인하였는 바(도 6), 본 발명의 조성물은 섬유화를 억제하는 것일 수 있다.In addition, in one embodiment of the present invention, when cyclophilin A is administered, it was confirmed that intrauterine fibrosis is suppressed (FIG. 6), and the composition of the present invention may be to inhibit fibrosis.
또한 구체적으로, 본 발명 일 실시예에서는 혈관내피세포 표지인자의 발현이 증가함을 통해 혈관이 신생되는 것을 확인하였으며(도 9), 자궁 내 대식세포의 극성을 조절함으로써 혈관신생을 촉진함을 확인하였는 바(도 14 내지 도 18), 본 발명의 조성물은 혈관신생을 촉진하는 것일 수 있다.In addition, in one embodiment of the present invention, it was confirmed that blood vessels are formed by increasing the expression of vascular endothelial cell markers (Fig. 9), and it is confirmed that angiogenesis is promoted by controlling the polarity of macrophages in the uterus. As the bar (FIGS. 14 to 18 ), the composition of the present invention may promote angiogenesis.
본 발명의 다른 측면은 혈관외피줄기세포(perivascular stem cell) 배양액 또는 사이클로필린 A를 포함하는, 아셔만 증후군 합병증의 예방 또는 치료용 약학적 조성물에 관한 것이다.Another aspect of the present invention relates to a pharmaceutical composition for preventing or treating complications of Asherman syndrome, comprising a culture medium of perivascular stem cells or cyclopilin A.
본 발명에서, “아셔만 증후군 합병증”은 아셔만 증후군에 의해 동반된 모든 증상 및 질환을 말한다. 구체적으로, 상기 아셔만 증후군 합병증은 자궁유착, 자궁근종, 자궁내막증, 자궁외 임신유산, 난소낭종, 생리장애, 난임, 불임, 골반유착, 골반통 및 골반염으로 이루어진 군에서 선택되는 하나 이상인 것일 수 있으나, 이에 제한되는 것은 아니다.In the present invention, “Asherman syndrome complication” refers to all symptoms and diseases accompanied by Asherman syndrome. Specifically, the Asherman syndrome complication may be one or more selected from the group consisting of uterine adhesions, fibroids, endometriosis, ectopic pregnancy abortion, ovarian cysts, menstrual disorders, infertility, infertility, pelvic adhesions, pelvic pain and pelvicitis, It is not limited thereto.
본 발명 일 실시예에서는 혈관외피줄기세포 배양액 또는 사이클로필린 A를 투여한 경우, 자궁 내 섬유화가 억제됨을 확인하였으며(도 6), 아셔만 증후군 생쥐모델에서 착상률 및 배아발달이 모두 개선됨을 확인하였다(도 7 및 도 8). 또한, 혈관내피세포 표지인자의 발현이 증가함을 통해 혈관이 신생되는 것을 확인하였으며(도 9), 자궁 내 대식세포의 극성을 조절함으로써 혈관신생을 촉진함을 확인하였다(도 14 내지 도 18).In one embodiment of the present invention, it was confirmed that intrauterine fibrosis was suppressed when vascular epidermal stem cell culture medium or cyclophilin A was administered (FIG. 6), and both implantation rate and embryonic development were improved in the mouse model of Asherman syndrome ( 7 and 8). In addition, it was confirmed that blood vessels are newly formed by increasing the expression of vascular endothelial cell markers (FIG. 9), and it was confirmed that angiogenesis was promoted by controlling the polarity of macrophages in the uterus (FIGS. 14 to 18). .
상기와 같은 결과는 본 발명 조성물이 자궁 내 섬유화를 억제시키고, 자궁내막 재생을 촉진할 뿐 아니라 신생혈관 생성을 촉진함으로써 아셔만 증후군 및 아셔만 증후군의 자궁내막 섬유화, 조직 손상 등에 의한 합병증에까지 예방, 치료 또는 개선 효과를 나타낼 수 있음을 나타내는 것이다.The above results show that the composition of the present invention inhibits fibrosis in the uterus, promotes endometrial regeneration, and promotes the production of angiogenesis, thereby preventing complications such as endometrial fibrosis and tissue damage of Asserman syndrome and Asserman syndrome. It indicates that a therapeutic or ameliorating effect may be exhibited.
또한 구체적으로, 상기 조성물은 HIF-1α 안정제를 추가로 포함하는 것일 수 있다. HIF-1α 안정제는 상기 설명된 바와 같다.In addition, specifically, the composition may be one further comprising an HIF-1α stabilizer. The HIF-1α stabilizer is as described above.
본 발명의 아셔만 증후군 및/또는 아셔만 증후군 합병증의 예방 또는 치료용 약학적 조성물은 약학적으로 허용가능한 담체, 부형제 또는 희석제를 추가로 포함할 수 있다.The pharmaceutical composition for the prevention or treatment of Asherman syndrome and/or Asherman syndrome complication of the present invention may further include a pharmaceutically acceptable carrier, excipient, or diluent.
본 발명의 약학적 조성물에 사용될 수 있는 약학적으로 허용가능한 담체, 부형제 및 희석제의 예로는, 락토즈, 덱스트로즈, 수크로즈, 솔비톨, 만니톨, 자일리톨, 에리스리톨, 말티톨, 전분, 아카시아 고무, 알지네이트, 젤라틴, 칼슘 포스페이트, 칼슘 실리케이트, 칼슘 카보네이트, 셀룰로즈, 메틸셀룰로즈, 폴리비닐피롤리돈, 물, 메틸하이드록시벤조에이트, 프로필하이드록시벤조에이트, 탈크, 마그네슘 스테아레이트, 광물유 등을 들 수 있다.Examples of pharmaceutically acceptable carriers, excipients and diluents that can be used in the pharmaceutical composition of the present invention include lactose, dextrose, sucrose, sorbitol, mannitol, xylitol, erythritol, maltitol, starch, gum acacia, alginate. , Gelatin, calcium phosphate, calcium silicate, calcium carbonate, cellulose, methylcellulose, polyvinylpyrrolidone, water, methylhydroxybenzoate, propylhydroxybenzoate, talc, magnesium stearate, mineral oil, and the like.
본 발명의 약학적 조성물은 통상의 방법에 따라 산제, 과립제, 정제, 캡슐제, 현탁액, 에멀젼, 시럽, 에어로졸 등의 경구형 제형, 외용제, 좌제 및 멸균 주사용액의 형태로 제형화하여 사용될 수 있다. 제형화할 경우에는 보통 사용하는 충진제, 증량제, 결합제, 습윤제, 붕해제, 계면활성제 등의 희석제 또는 부형제를 사용하여 조제된다. 경구투여를 위한 고형제제의 예로는 정제, 환제, 산제, 과립제, 캡슐제 등이 있으며, 이러한 고형제제는 적어도 하나 이상의 부형제 예를 들면, 전분, 칼슘 카보네이트, 수크로즈 또는 락토스, 젤라틴 등을 혼합하여 조제될 수 있다. 또한 단순한 부형제 이외에 마그네슘 스테아레이트, 탈크 같은 윤활제들도 사용될 수 있다.The pharmaceutical composition of the present invention can be formulated and used in the form of oral dosage forms such as powders, granules, tablets, capsules, suspensions, emulsions, syrups, aerosols, etc., external preparations, suppositories, and sterile injectable solutions according to conventional methods. . In the case of formulation, it is prepared using diluents or excipients such as fillers, extenders, binders, wetting agents, disintegrants, and surfactants that are usually used. Examples of solid preparations for oral administration include tablets, pills, powders, granules, capsules, and the like, and such solid preparations are prepared by mixing at least one or more excipients such as starch, calcium carbonate, sucrose or lactose, gelatin, etc. Can be prepared. In addition, in addition to simple excipients, lubricants such as magnesium stearate and talc may also be used.
경구투여를 위한 액상제제로는 현탁제, 내용액제, 유제, 시럽제 등이 해당되는데, 흔히 사용되는 단순 희석제인 물, 리퀴드 파라핀 이외에 여러 가지 부형제, 예를 들면 습윤제, 감미제, 방향제, 보존제 등이 포함될 수 있다.Liquid preparations for oral administration include suspensions, liquid solutions, emulsions, and syrups.In addition to water and liquid paraffin, which are commonly used simple diluents, various excipients such as humectants, sweeteners, fragrances, and preservatives are included. I can.
비경구 투여를 위한 제제에는 멸균된 수용액, 비수성용제, 현탁제, 유제, 동결건조 제제, 좌제가포함될 수 있다. 비수성용제, 현탁제로는 프로필렌글리콜(propylene glycol), 폴리에틸렌글리콜, 올리브 오일과 같은 식물성 기름, 에틸올레이트와 같은 주사가능한 에스테르 등이 사용될 수 있다. 좌제의 기제로는 위텝솔(witepsol), 마크로골, 트윈(tween) 61, 카카오지, 라우린지, 글리세로젤라틴 등이 사용될 수 있다.Formulations for parenteral administration may include sterilized aqueous solutions, non-aqueous solutions, suspensions, emulsions, lyophilized formulations, and suppositories. As the non-aqueous solvent and suspension, propylene glycol, polyethylene glycol, vegetable oil such as olive oil, and injectable ester such as ethyl oleate may be used. As a base for suppositories, witepsol, macrogol, tween 61, cacao butter, laurin paper, glycerogelatin, and the like may be used.
본 발명의 약학적 조성물은 개별 치료제로 투여하거나 다른 치료제와 병용하여 투여될 수 있고, 종래의 치료제와 순차적으로 또는 동시에 투여될 수 있다. 또한 본 발명의 약학적 조성물은 단일 또는 다중 투여될 수 있다. 상기 요소를 모두 고려하여 부작용 없이 최소한의 양으로 최대 효과를 얻을 수 있는 양을 투여하는 것이 중요하며, 당업자에 의해 용이하게 결정될 수 있다.The pharmaceutical composition of the present invention may be administered as an individual therapeutic agent or administered in combination with other therapeutic agents, and may be administered sequentially or simultaneously with a conventional therapeutic agent. In addition, the pharmaceutical composition of the present invention may be administered single or multiple. It is important to administer an amount capable of obtaining the maximum effect in a minimum amount without side effects in consideration of all of the above factors, and can be easily determined by a person skilled in the art.
본 발명의 치료용 조성물은 단독으로, 또는 공지의 아셔만 증후군에 대한 치료제를 병용 투여하거나 외과적 수술요법 등의 보조 치료 방법들과 병행하여 사용하여 치료 효과를 증대시킬 수 있다.The therapeutic composition of the present invention can be used alone or in combination with a known therapeutic agent for Asserman's syndrome or used in combination with auxiliary treatment methods such as surgical surgery to increase the therapeutic effect.
본 발명의 또 다른 측면은, 혈관외피줄기세포(perivascular stem cell) 배양액 또는 사이클로필린 A를 개체에 투여하는 단계를 포함하는, 아셔만 증후군 및/또는 아셔만 증후군 합병증의 예방 또는 치료방법에 관한 것이다.Another aspect of the present invention relates to a method for preventing or treating complications of Asherman syndrome and/or Asherman syndrome, comprising administering to an individual a culture medium of perivascular stem cells or cyclophilin A. .
상기 “개체”는, 본 발명에 따른 치료용 조성물의 투여에 의해 증상이 호전될 수 있는 아셔만 증후군 및/또는 아셔만 증후군 합병증을 가진 말, 양, 돼지, 염소, 낙타, 영양, 개 등의 동물 또는 인간을 포함한다. 본 발명에 따른 치료용 조성물을 개체에게 투여함으로써, 아셔만 증후군 및/또는 아셔만 증후군 합병증을 효과적으로 예방 및 치료할 수 있다.The “individual” refers to horses, sheep, pigs, goats, camels, antelopes, dogs, etc. with Asserman syndrome and/or Assherman syndrome complications, which may improve symptoms by administration of the therapeutic composition according to the present invention. Includes animals or humans. By administering the therapeutic composition according to the present invention to an individual, it is possible to effectively prevent and treat the complications of the Assherman syndrome and/or the Assherman syndrome.
본 발명에 따른 상기 치료방법은 인간을 제외한 동물을 치료하는 방법일 수 있으나, 이에 제한되지 않는다. 즉, 인간의 경우 본 발명에 따른 치료용 조성물의 투여에 의해 증상이 호전될 수 있는 아셔만 증후군 및/또는 아셔만 증후군 합병증을 가지는 것을 고려할 때, 인간의 치료에 있어서도 충분히 사용될 수 있다.The treatment method according to the present invention may be a method of treating animals other than humans, but is not limited thereto. That is, in the case of humans, considering that the symptoms can be improved by the administration of the therapeutic composition according to the present invention and/or the complications of the Asherman syndrome, it can be sufficiently used in the treatment of humans.
상기 "투여"는 어떠한 적절한 방법으로 동물에게 소정의 물질을 도입하는 것을 의미하며, 본 발명에 따른 치료용 조성물의 투여 경로는 목적 조직에 도달할 수 있는 한 어떠한 일반적인 경로를 통하여 경구 또는 비경구 투여될 수 있다. 또한, 본 발명에 따른 치료용 조성물은 유효성분이 표적 세포로 이동할 수 있는 임의의 장치에 의해 투여될 수 있다.The "administration" means introducing a predetermined substance to an animal by any suitable method, and the route of administration of the therapeutic composition according to the present invention is oral or parenteral administration through any general route as long as it can reach the target tissue. Can be. In addition, the therapeutic composition according to the present invention may be administered by any device capable of moving the active ingredient to target cells.
본 발명의 또 다른 측면은, 혈관외피줄기세포 배양액 또는 사이클로필린 A를 포함하는, 아셔만 증후군 개선용 식품 조성물에 관한 것이다.Another aspect of the present invention relates to a food composition for improving Asherman syndrome, comprising a vascular envelope stem cell culture medium or cyclopilin A.
또한, 상기 식품 조성물은 아셔만 증후군 합병증을 개선시킬 수 있으며, 구체적인 아셔만 증후군 합병증은 상기 설명한 바와 같다.In addition, the food composition can improve the complications of the Assherman syndrome, and specific complications of the Assherman syndrome are as described above.
구체적으로, 상기 혈관외피줄기세포 배양액은 혈관외피줄기세포를 무혈청 배지에서 배양하여 수득한 것일 수 있다.Specifically, the vascular enveloped stem cell culture medium may be obtained by culturing vascular enveloped stem cells in a serum-free medium.
또한 구체적으로, 상기 조성물은 HIF-1α 안정제를 추가로 포함하는 것일 수 있다.In addition, specifically, the composition may be one further comprising an HIF-1α stabilizer.
혈관외피줄기세포 배양액, HIF-1α 안정제 등은 상기 설명된 바와 같다.Vascular envelope stem cell culture medium, HIF-1α stabilizer, and the like are as described above.
상기 “개선”이란, 치료되는 상태와 관련된 파라미터, 예를 들면 증상의 정도를 적어도 감소시키는 모든 행위를 의미한다.The "improvement" means any action that at least reduces the severity of a parameter related to the condition being treated, for example a symptom.
본 발명의 식품 조성물은 아셔만 증후군 및/또는 아셔만 증후군 합병증을 예방 또는 개선하기 위하여 아셔만 증후군 및/또는 아셔만 증후군 합병증의 발병 단계 이전 또는 발병 후, 질환 치료를 위한 약제와 동시에 또는 별개로서 사용될 수 있다.The food composition of the present invention may be used before or after the onset of Asherman syndrome and/or Asherman syndrome complication in order to prevent or ameliorate complications of Asherman syndrome and/or Asherman syndrome. Can be used.
상기 식품의 종류에는 특별한 제한은 없다. 상기 물질을 첨가할 수 있는 식품의 예로는 육류, 소세지, 빵, 쵸코렛, 캔디류, 스넥류, 과자류, 피자, 라면, 기타 면류, 껌류, 아이스크림류를 포함한 낙농제품, 각종 스프, 음료수, 차, 드링크제, 알콜 음료 및 비타민 복합제 등이 있으며, 통상적인 의미에서의 건강식품을 모두 포함한다.There is no particular limitation on the type of the food. Examples of foods to which the above substances can be added include meat, sausage, bread, chocolate, candy, snacks, confectionery, pizza, ramen, other noodles, gums, dairy products including ice cream, various soups, beverages, tea, drinks, There are alcoholic beverages and vitamin complexes, and all health foods in the usual sense are included.
상기 외에 본 발명의 조성물은 여러 가지 영양제, 비타민, 전해질, 풍미제, 착색제, 펙트산 및 그의 염, 알긴산 및 그의 염, 유기산, 보호성 콜로이드 증점제, pH 조절제, 안정화제, 방부제, 글리세린, 알콜, 탄산 음료에 사용되는 탄산화제 등을 함유할 수 있다. 그 밖에 본 발명의 조성물은 천연 과일주스, 과일주스 음료 및 야채 음료의 제조를 위한 과육을 함유할 수 있다. 이러한 성분은 독립적으로 또는 조합하여 사용할 수 있다. 이러한 첨가제의 비율 또한 당업자에 의해 적절히 선택될 수 있다.In addition to the above, the composition of the present invention includes various nutrients, vitamins, electrolytes, flavoring agents, colorants, pectic acid and salts thereof, alginic acid and salts thereof, organic acids, protective colloidal thickeners, pH adjusters, stabilizers, preservatives, glycerin, alcohols, Carbonating agents used in carbonated beverages and the like may be contained. In addition, the composition of the present invention may contain pulp for the production of natural fruit juice, fruit juice beverage and vegetable beverage. These components may be used independently or in combination. The proportion of these additives can also be appropriately selected by a person skilled in the art.
본 발명의 조성물은 아셔만 증후군 자궁 내 섬유화를 개선하고 혈관신생을 촉진함으로써 아셔만 증후군 및/또는 아셔만 증후군 합병증에 대해 우수한 치료 효과를 나타내어 수술, 호르몬 요법 외 새로운 요법으로 활용될 수 있다.The composition of the present invention can be used as a new therapy in addition to surgery, hormone therapy, as the composition of the present invention exhibits excellent therapeutic effect on the Asherman syndrome and/or the complications of the Asherman syndrome by improving intrauterine fibrosis and promoting angiogenesis.
또한, 자궁 내 대식세포의 극성 조절과 혈관신생 촉진 효과를 나타냄으로써 자궁내막 관련 질환에 광범위하게 적용될 수 있으며, 나아가 난임 또는 불임 치료용도로도 활용될 수 있다.In addition, it can be widely applied to endometrial-related diseases by controlling the polarity of macrophages in the uterus and promoting angiogenesis, and further, it can be used for treatment of infertility or infertility.
본 발명의 효과는 상기 효과로 한정되는 것은 아니며, 본 발명의 상세한 설명 또는 청구범위에 기재된 발명의 구성으로부터 추론 가능한 모든 효과를 포함하는 것으로 이해되어야 한다.The effects of the present invention are not limited to the above effects, and should be understood to include all effects that can be deduced from the configuration of the invention described in the detailed description or claims of the present invention.
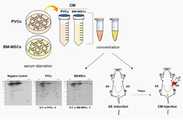
도 1은 2-dimensional electrophoresis(2-DE)-LC/MS 기반 혈관외피줄기세포(PVCs), 골수유래중간엽줄기세포(BM-MSCs), 피부섬유세포(negative control)의 배양액 내 분비단백체 (secretome) 분석 모식도를 나타낸 것이다.
도 2는 아셔만 증후군 자궁에서의 섬유화 및 세포증식에 대한 혈관외피줄기세포 배양액의 효능을 평가한 결과를 나타낸 것이다.
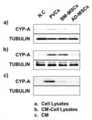
도 3은 LC/MS를 이용한 후보 유효 분비단백체 분석 및 CYP-A(사이클로필린 A) 동정 결과를 나타낸 것이다.
도 4는 웨스턴블롯을 이용한 CYP-A 단백질 발현 분석 결과를 나타낸 것이다.
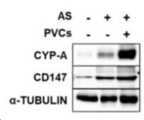
도 5는 아셔만 증후군 생쥐모델에 혈관외피줄기세포 배양액 투여 후 CYP-A 및 CD147 (CYP-A receptor)의 발현 분석 결과를 나타낸 것이다.
도 6은 아셔만 증후군 생쥐모델에서의 CYP-A 투여에 의한 섬유화지표 변화 분석 결과를 나타낸 것이다.
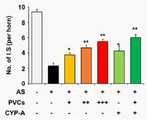
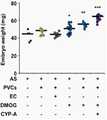
도 7은 아셔만 증후군 생쥐모델에서의 CYP-A 투여에 의한 착상률 영향평가 결과를 나타낸 것이다(임신 12일째, I.S; implantation site).
도 8은 아셔만 증후군 생쥐모델에서의 CYP-A 투여에 의한 배아발달 영향평가 결과를 나타낸 것이다(임신 12일째).
도 9는 아셔만 증후군 생쥐모델에서의 혈관외피줄기세포 배양액 및 CYP-A 투여 후 자궁조직 내 혈관내피세포 표지인자 발현 측정 결과를 나타낸 것이다.
도 10은 아셔만 증후군 생쥐모델에서의 혈관외피줄기세포 배양액 및 CYP-A 투여 후 자궁조직 내 CD31 발현 및 세포증식 영향 평가결과를 나타낸 것이다.
도 11은 아셔만 증후군 생쥐모델에서의 HIF-1α을 매개로 한 CYP-A에 의한 착상률을 평가한 결과를 나타낸 것이다(임신 12일째).
도 12는 아셔만 증후군 생쥐모델에서의 HIF-1α을 매개로 한 CYP-A에 의한 배아발달을 평가한 결과를 나타낸 것이다(임신 12일째).
도 13은 아셔만 증후군 생쥐모델에서 CYP-A의 자궁조직 내 투여가 임신 후 산자수에 미치는 영향을 평가한 결과를 나타낸 것이다.
도 14는 아셔만 증후군 생쥐모델에서 CYP-A 처리에 의한 자궁 내 대식세포 (F4/80, CD11b)의 양적 변화를 확인한 것이다.
도 15는 아셔만 증후군 생쥐모델에서 CYP-A 처리에 의한 자궁 내 대식세포 극성 관련 표지인자 (M1,iNOS, CD80, Il-12; M2,Arg-1, CD206, Il-10) mRNA 발현 변화를 측정한 결과를 나타낸 것이다.
도 16은 아셔만 증후군 생쥐모델에서 CYP-A 처리에 의한 대식세포(M1, F4/80+CD80+; M2, F4/80+CD206+) 빈도 변화를 측정한 결과를 나타낸 것이다.
도 17은 대식세포 (RAW 264.7)에 대식세포 극성조절 인자(LPS, IFNγ, IL-4) 첨가 및 CYP-A에 의한 극성 조절을 mRNA 발현 변화를 측정한 결과이다.
도 18은 CYP-A에 의해 극성이 변화한 대식세포(RAW 264.7)와 혈관내피세포 (HUVEC) 공배양 시 혈관신생 영향평가 결과를 나타낸 것이다(Tube formation assay).1 is a secreted protein in the culture medium of 2-dimensional electrophoresis (2-DE)-LC/MS-based vascular enveloped stem cells (PVCs), bone marrow-derived mesenchymal stem cells (BM-MSCs), and skin fibrous cells (negative control) ( secretome) analysis schematic diagram.
Figure 2 shows the results of evaluating the efficacy of the vascular envelope stem cell culture medium on fibrosis and cell proliferation in the uterus of Asherman syndrome.
3 shows the results of analysis of candidate effective secreted proteins and identification of CYP-A (cyclopilin A) using LC/MS.
4 shows the results of CYP-A protein expression analysis using Western blot.
Figure 5 shows the results of analysis of the expression of CYP-A and CD147 (CYP-A receptor) after administration of vascular epidermal stem cell culture medium to an Asherman syndrome mouse model.
6 shows the results of analysis of changes in fibrosis index by CYP-A administration in a mouse model of Asherman's syndrome.
7 shows the results of evaluation of the impact of implantation rate by administration of CYP-A in a mouse model of Asserman syndrome (at
Fig. 8 shows the results of evaluation of the effect of embryonic development by administration of CYP-A in a mouse model of Asherman's syndrome (the 12th day of pregnancy).
9 shows the results of measuring the expression of vascular endothelial cell markers in uterine tissues after administration of vascular enveloped stem cell culture medium and CYP-A in a mouse model of Asherman syndrome.
FIG. 10 shows the results of evaluation of the effect of CD31 expression and cell proliferation in uterine tissues after administration of vascular epidermal stem cell culture medium and CYP-A in a mouse model of Asherman syndrome.
Figure 11 shows the results of evaluation of the implantation rate by CYP-A mediated by HIF-1α in the mouse model of Asherman syndrome (12th day of pregnancy).
Fig. 12 shows the results of evaluation of embryonic development by CYP-A mediated by HIF-1α in a mouse model of Asserman syndrome (12th day of pregnancy).
13 shows the results of evaluating the effect of intrauterine administration of CYP-A on the number of litters after pregnancy in a mouse model of Asserman syndrome.
14 shows the quantitative change of intrauterine macrophages (F4/80, CD11b) by CYP-A treatment in the Asherman syndrome mouse model.
Figure 15 shows the change in expressionof intrauterine macrophage polarity-related markers (M1, iNOS, CD80, Il-12 ; M2,Arg-1, CD206, Il-10 ) mRNA expression by CYP-A treatment in the Asherman syndrome mouse model. It shows the measurement result.
FIG. 16 shows the results of measuring changes in the frequency of macrophages (M1, F4/80+CD80+; M2, F4/80+CD206+) by CYP-A treatment in the Asherman syndrome mouse model.
FIG. 17 is a result of measuring changes in mRNA expression for addition of macrophage polarity control factors (LPS, IFNγ, IL-4) to macrophages (RAW 264.7) and polarity control by CYP-A.
18 shows the results of angiogenesis effect evaluation when co-cultured with macrophages (RAW 264.7) and vascular endothelial cells (HUVEC) whose polarity was changed by CYP-A (Tube formation assay).
이하, 본 발명을 실시예에 의해 상세히 설명한다. 단, 하기 실시예는 본 발명을 예시하는 것일 뿐, 본 발명이 하기 실시예에 의해 한정되는 것은 아니다.Hereinafter, the present invention will be described in detail by examples. However, the following examples are merely illustrative of the present invention, and the present invention is not limited by the following examples.
실시예 1. 혈관외피줄기세포(perivascular stem cell, PVC) 배양액의 제조Example 1. Preparation of perivascular stem cell (PVC) culture solution
1-1. 인간 탯줄로부터 동맥혈관의 분리1-1. Separation of arterial blood vessels from human umbilical cord
37주 이상의 정상적 임신 기간을 거친 산모 및 태아 모두 내/외과적 질환 및 유전 질환이 없는 산모들에게서 제왕절개수술 후 폐기되는 탯줄을 채취하여 수집하였다. 본 과정은 강원대학교 윤리위원회의 승인 하에 해당 산모들의 동의를 받고 이루어졌다. 약 30cm씩 탯줄을 수집하여 멸균 상태의 pH 7.2 인산염 완충 용액(Phosphate Buffered Saline; PBS, Invitrogen)이 담겨져 있는 시험관에 담아 배양실로 운반하였으며, 수집된 탯줄을 멸균된 100U/mL penicillin(Sigma)과 100㎍/mL streptomycin(Sigma)이 첨가된 멸균된 PBS로 3회 수세(washing)하여 가능한 많은 탯줄 혈액을 제거한 후, 탯줄의 결합조직인 와튼 젤리(Wharton's jelly)를 제거하여 2개의 배꼽 동맥(umbilical artery)을 분리하였다.Umbilical cords that were discarded after cesarean section were collected and collected from both mothers and fetuses who had gone through a normal gestation period of 37 weeks or more without internal/surgical diseases and genetic diseases. This process was carried out with the consent of the mothers under the approval of the Kangwon National University Ethics Committee. Umbilical cords were collected at about 30 cm increments, placed in a test tube containing sterile pH 7.2 phosphate buffered saline (PBS, Invitrogen), and transported to the culture chamber. After removing as much umbilical cord blood as possible by washing 3 times with sterilized PBS with ㎍/mL streptomycin (Sigma) added, two umbilical arteries by removing Wharton's jelly, the connective tissue of the umbilical cord. Was separated.
1-2. 혈관외피세포(PVC)의 분리 및 배양1-2. Isolation and culture of vascular envelope cells (PVC)
상기 1-1에 의해 분리된 배꼽 동맥혈관을 20% Fetal Bovine Serum(FBS,Invitrogen), 100U/mL penicillin, 100㎍/mL streptomycin, 2mM L-glutamine(Invitrogen)가 첨가된 α-Minimum Essential Medium(α-MEM; Invitrogen)이 포함된 배양접시에 옮겨 14일 동안 배양하였다. 동맥혈관으로부터 이동하여 형성된 혈관외피세포(perivascular cell, PVC) 군집을 0.125% trypsin-EDTA 1 mM(Sigma)을 처리하여 분리하였다. 상기 분리된 혈관외피세포를 PBS를 이용하여 2회 수세한 후 상기 배지에서 37℃의 온도 및 5% CO2의 습윤 환경하에 계대배양하였다. 배양접시의 80-90% 정도의 밀집도(confluence)로 세포가 자라면 0.125% trypsin-EDTA 1mM을 첨가하여 세포를 떼어낸 후 PBS로 수세하여 배양접시 1cm2 당 2 x 103개의 세포를 넣어 계대배양하고, 24시간 간격으로 새로운 배지로 교체하였다The umbilical artery vessels separated by 1-1 were added to α-Minimum Essential Medium ( α-MEM; Invitrogen) was transferred to a culture dish and cultured for 14 days. A group of perivascular cells (PVC) formed by moving from arterial blood vessels was isolated by treatment with 0.125% trypsin-
1-3. 혈관외피세포를 이용한 무혈청 조건배지(conditioned medium, CM) 제조1-3. Preparation of serum-free conditioned medium (CM) using vascular envelope cells
상기 1-2에서 계대배양하여 증식된 혈관외피세포를 PBS 수세 후 무혈청배지인 Stemlineⓡ II Hematopoietic Stem Cell Expansion Medium(Sigma)에서 배양하였다. 배양 시 온도는 37℃를 유지하고, 5% CO2의 습윤 환경에서 배양하였다. 배양접시의 80-90% 정도의 밀집도(confluence)로 세포가 자라면 0.125% trypsin-EDTA 1 mM을 첨가하여 세포를 떼어낸 후 PBS로 수세하여 배양접시 1cm2 당 2 x 103의 세포를 넣어 계대배양하고, 24시간 간격으로 새로운 배지로 교체하였으며, 배양액을 회수하였다. 회수된 배양액은 0.22 ㎛의 필터를 이용해 세포부유물을 여과 후 무혈청 조건배지를 완성하여 -80℃에 동결보존 하였다.After washing with water the subculture of vascular cell growth and in the shell 1-2 PBS and incubated in serum-free medium inStemline ⓡ II Hematopoietic Stem Cell Expansion Medium (Sigma). During cultivation, the temperature was maintained at 37° C., and cultured in a humid environment of5% CO 2. If the cells grow at 80-90% confluence of the culture dish, remove the cells by adding 0.125% trypsin-
실시예 2. 사이클로필린 A(CYP-A)의 동정Example 2. Identification of Cyclophilin A (CYP-A)
2-1. 배양액을 이용하여 LC/MS 수행 및 분비단백체 분석2-1. LC/MS and secreted protein analysis using culture medium
상기 1-2에서 확보한 무혈청 혈관외피줄기세포 배양액에 존재하는 단백질을 동정하기 위해서 질량분석법 기반 프로테오믹스 (LC/MS)를 수행하였다. 단백질 동정을 위해서 단백질을 펩타이드로 만들어준 후 질량분석기를 이용하여 펩타이드들의 mass 데이터를 얻었다. 이렇게 얻은 펩타이드의 mass 정보와 데이터베이스에 존재하는 펩타이드들의 이론적인 mass 정보를 비교하여 가장 유사한 후보를 찾아낸 후, 후보 펩타이드를 포함하는 단백질을 데이터베이스내의 정보와 비교 분석하여 동정하였다. 동정된 단백질은 도 3에 나타난 바와 같으며, 사이클로필린 A(CYP-A)이 동정되었다.Mass spectrometry-based proteomics (LC/MS) was performed to identify the protein present in the serum-free vascular envelope stem cell culture medium obtained in 1-2 above. For protein identification, after making the protein into a peptide, mass data of the peptides were obtained using a mass spectrometer. The most similar candidate was found by comparing the mass information of the peptide thus obtained with the theoretical mass information of the peptides present in the database, and then the protein containing the candidate peptide was compared with the information in the database to be identified. The identified protein was as shown in FIG. 3, and cyclophilin A (CYP-A) was identified.
2-2. 배양액 및 세포에서 LC/MS 검증을 통한 CYP-A 동정2-2. Identification of CYP-A through LC/MS verification in culture media and cells
상기 1-3의 무혈청 조건에서 배지 제조 방법으로 분석에 필요한 배지를 확보하여, 2-1에서 LC/MS로 확인된 분비단백체에 대한 검증실험을 수행하였다. 검증실험을 수행하기 위해서 계대배양시 사용하는 배지에서 자란 세포(도 4a), 무혈청배지에서 자란 세포(도 4b) 및 무혈청배지(도 4c)를 확보하였고, 이들을 이용하여 웨스턴 블랏을 진행하였다. 그 결과, 도 4에 나타난 바와 같이 LC/MS 결과와 일치하게 혈관외피세포를 배양한 무혈청배지에서 CYP-A의 발현이 유의적으로 높게 나타남을 확인하였다.In the serum-free condition of 1-3, a medium required for analysis was secured by the medium preparation method, and a verification experiment was performed on the secreted protein identified by LC/MS in 2-1. In order to perform the verification experiment, cells grown in the medium used for subculture (Fig. 4a), cells grown in serum-free medium (Fig. 4b) and serum-free medium (Fig. 4c) were obtained, and Western blot was performed using these. . As a result, it was confirmed that the expression of CYP-A was significantly higher in the serum-free medium in which the vascular envelope cells were cultured consistent with the LC/MS results as shown in FIG. 4.
실시예 3. 아셔만 증후군 생쥐모델의 제작Example 3. Construction of a mouse model of Asherman's syndrome
8주령 암컷 생쥐를 사용하여 아셔만 증후군 생쥐 모델을 만들었다. 이 연구는 동물 관리 및 사용위원회 (IACUC, 승인 번호 160100)의 승인을 받아 실험을 진행하였다. 실험 동물에 대한 제도적 지침에 따라, 생쥐는 매일 12 시간 동안 온도 및 조명 제어 조건하에 차의과학대학교 실험동물센터에서 관리하였다. 복강 내 주사로 마취제(Avertin)를 투여한 후, 생쥐 외/내피를 수직 절개를 하고 자궁을 노출시켰다. 난관 접합부에 위치한 자궁에 작은 절개를 한 후, 자궁 내에 26 게이지 바늘을 삽입 및 회전을 통해 외상을 유도한 뒤 회수하였다. 섬유증을 평가하기 위해 바늘을 이용한 외상을 수행한 초기 실험에서, 섬유화 유도 후 3일, 7일, 14일차에 생쥐 자궁을 절취하여 손상정도를 확인하였다.8-week-old female mice were used to create an Asherman syndrome mouse model. This study was conducted with the approval of the Animal Care and Use Committee (IACUC, Approval No. 160100). In accordance with the institutional guidelines for experimental animals, mice were managed at the Experimental Animal Center at Cha University of Science and Technology under temperature and lighting control conditions for 12 hours every day. After administering an anesthetic (Avertin) by intraperitoneal injection, a vertical incision was made in the mouse outer/endothelium and the uterus was exposed. After a small incision was made in the uterus located at the tubal junction, a 26 gauge needle was inserted and rotated into the uterus to induce trauma and then recovered. In the initial experiment in which a needle trauma was performed to evaluate fibrosis, the mouse uterus was excised on the 3rd, 7th, and 14th days after the induction of fibrosis to check the degree of damage.
실험예 1. 아셔만 증후군 생쥐모델에서의 혈관외피줄기세포 배양액 투여 후 CYP-A 및 CD147(CYP-A receptor)의 발현 분석Experimental Example 1. Analysis of expression of CYP-A and CD147 (CYP-A receptor) after administration of vascular epidermal stem cell culture medium in a mouse model of Asherman syndrome
상기 실시예 3의 방법으로 아셔만 증후군 생쥐 모델을 유도한 뒤 7일 후 상기 실시예 1-3에서 확보한 무혈청 혈관외피줄기세포 배양액을 투여하였다. 배양액을 투여한 후 7일차에 생쥐 자궁을 절취하고, 웨스턴 블랏을 이용하여 CD147의 발현을 확인하였다. 그 결과, 도 5에 나타난 바와 같이 세포 수준에서 확인한 결과 상기 실시예 2-2와 유사하게 동물 수준에서도 무혈청 혈관외피줄기세포 배양액을 투여한 아셔만 증후군 생쥐 모델의 자궁에서 CYP-A의 양이 증가함을 웨스턴 블랏을 통해서 확인하였다. 또한 CYP-A의 수용체로 알려진 CD147의 양 또한 증가함을 확인하였다.After inducing the Asherman syndrome mouse model by the method of Example 3, the serum-free vascular enveloped stem cell culture solution obtained in Example 1-3 was administered 7 days later. On the 7th day after administration of the culture medium, the mouse uterus was excised, and the expression of CD147 was confirmed using Western blot. As a result, the amount of CYP-A in the uterus of the Asherman syndrome mouse model administered with the serum-free vascular enveloped stem cell culture solution was also confirmed at the cell level as shown in FIG. 5 at the animal level similar to Example 2-2. The increase was confirmed through Western blot. In addition, it was confirmed that the amount of CD147, known as a receptor for CYP-A, also increased.
실험예 2. CYP-A 투여에 의한 섬유화지표 변화 분석Experimental Example 2. Analysis of changes in fibrosis index by administration of CYP-A
상기 실시예 1에서 투여한 무혈청 혈관외피줄기세포 배양액을 대신하여 이의 분비단백체로 확인된 CYP-A를 동일한 시점에 주입하였다. 이를 웨스턴 블랏을 통하여 섬유화 관련 인자인 COL1A1, TGFβ1을 분석하였다.In place of the serum-free vascular envelope stem cell culture solution administered in Example 1, CYP-A, which was identified as its secreted protein, was injected at the same time point. This was analyzed for fibrosis-related factors COL1A1 and TGFβ1 through Western blot.
그 결과, 도 6에 나타난 바와 같이 상기 섬유화 관련 인자들의 발현이 CYP-A를 주입한 아셔만 증후군 생쥐 모델의 자궁에서 현저하게 감소함을 확인하였으며, CYP-A를 투여한 경우에도 혈관외피줄기세포 및 무혈청 혈관외피줄기세포 배양액을 투여시와 유사한 효과를 보임을 확인하였다.As a result, as shown in Fig. 6, it was confirmed that the expression of the fibrosis-related factors was significantly reduced in the uterus of the Asherman syndrome mouse model injected with CYP-A. Even when CYP-A was administered, the vascular envelope stem cells And it was confirmed that the serum-free vascular enveloped stem cell culture solution showed a similar effect to that of administration.
실험예 3. CYP-A 투여에 의한 착상률 및 배아발달 영향평가Experimental Example 3. Evaluation of impact of implantation rate and embryonic development by administration of CYP-A
상기 실험예 2에서 확인한 조직학적 개선효과를 기반으로 기능적 개선효과를 확인하고자 아셔만 증후군 생쥐 모델 유도 후 7일차에 CYP-A를 투여하였다. 이후 7일 뒤에 숫컷 생쥐와의 교배를 위해 합사를 시작하였고, 정상적인 교배 후 암컷의 생식기에서 관찰되는 플러그를 매일 아침 확인하였다. 플러그가 확인된 날을 1일로 하였을 때, 임신 12일차(임신 중기)에 착상된 배아의 수와 무게를 관찰하였다. 임신 12일차 오전에 CO2를 이용하여 생쥐를 희생시키고, 복부면에서 외/내피를 수직 절개하여 자궁을 완전히 노출시켰다. 자궁에 착상된 배아의 수를 파악하여 그래프화 하였다. 그 결과, 도 7에 나타난 바와 같이, 혈관외피줄기세포 배양액(PVCs) 또는 CYP-A를 투여한 경우 아셔만 증후군 생쥐 모델에서 자궁에 착상된 배아의 수가유의적으로 증가되었음을 확인하였다.CYP-A was administered on the 7th day after induction of the Asherman syndrome mouse model in order to confirm the functional improvement effect based on the histological improvement effect confirmed in Experimental Example 2. After 7 days, the hybridization was started for mating with male mice, and after normal mating, the plug observed in the female genitalia was checked every morning. When the day when the plug was confirmed was set as
또한, 자궁 내에 있는 배아를 양막과 태반으로부터 분리하여 무게 측정 후 그래프화 하였으며, 도 8에 나타난 바와 같이, 혈관외피줄기세포 배양액(PVCs) 또는 CYP-A를 투여한 경우 아셔만 증후군 생쥐 모델에서 배아의 무게(embryo weight)가 유의하게 증가되었음을 확인하였다.In addition, the embryos in the uterus were separated from the amniotic membrane and placenta, weighed, and then graphed. As shown in FIG. 8, when the vascular enveloped stem cell culture solution (PVCs) or CYP-A was administered, the embryos in the Asherman syndrome mouse model It was confirmed that the weight of (embryo) was significantly increased.
실험예 4. 혈관외피줄기세포 배양액 및 CYP-A 투여 후 자궁조직 내 혈관내피세포 표지인자 발현 측정Experimental Example 4. Measurement of vascular endothelial cell marker expression in uterine tissue after administration of vascular envelope stem cell culture medium and CYP-A
상기 실험예 2에서 섬유화 감소가 확인된 혈관외피줄기세포 배양액 또는 CYP-A를 주입한 아셔만 증후군 생쥐 모델의 자궁에서 혈관세포증식과 관련된 표지인자들의 발현을 웨스턴 블롯으로 확인하였다.In Experimental Example 2, expression of markers related to vascular cell proliferation in the uterus of a vascular enveloped stem cell culture medium or CYP-A-injected Asherman syndrome mouse model in which fibrosis reduction was confirmed in Experimental Example 2 was confirmed by Western blot.
혈관세포증식 관련 표지인자로 HIF-1α, HIF-2α, VEGF, ANG-1, pTIE-2 및 CD31을 확인하였으며, 그 결과 도 9에 나타난 바와 같이 혈관세포증식과 관련된 표지인자들의 발현이 유의적으로 증가하였음을 확인하였다.As markers related to vascular cell proliferation, HIF-1α, HIF-2α, VEGF, ANG-1, pTIE-2, and CD31 were identified, and as a result, the expression of markers related to vascular cell proliferation was significant. It was confirmed that it increased to.
실험예 5. 혈관외피줄기세포 배양액 및 CYP-A 투여 후 자궁조직 내 CD31 발현 및 세포증식 영향 평가Experimental Example 5. Evaluation of the effect of CD31 expression and cell proliferation in uterine tissue after administration of vascular enveloped stem cell culture medium and CYP-A
상기 실험예 4와 동일한 조건하에 혈관세포의 증식을 확인하고자 혈관세포에서 발현하는 CD31과 증식하는 세포에서 발현하는 KI67 항체를 이용하여 면역형광염색을 수행하였다.To confirm the proliferation of vascular cells under the same conditions as in Experimental Example 4, immunofluorescence staining was performed using CD31 expressed in vascular cells and KI67 antibody expressed in proliferating cells.
도 10에 나타난 바와 같이, 혈관외피 줄기세포 배양액 또는 CYP-A를 주입한 아셔만 증후군 생쥐 모델의 자궁에서 세포 증식이 왕성하게 일어나는 것을 KI67 항체의 발광을 통해서 확인하였으며, 특히 CD31이 발현하는 혈관세포의 증식이 유의적으로 증가함을 확인하였다.As shown in FIG. 10, it was confirmed through the luminescence of KI67 antibody that cells proliferate vigorously in the uterus of an Asherman syndrome mouse model injected with vascular envelope stem cell culture medium or CYP-A, and in particular, vascular cells expressing CD31 It was confirmed that the proliferation of was significantly increased.
실험예 6. HIF-1α을 매개로 한 혈관외피줄기세포 배양액 및 CYP-A에 의한 착상률 및 배아발달 평가Experimental Example 6. Evaluation of implantation rate and embryonic development by HIF-1α-mediated vascular enveloped stem cell culture medium and CYP-A
상기 실험예 3과 동일한 방법으로 본 실험을 수행하였다. HIF-1α의 중요성을 확인하고자 HIF-1α 억제제인 Echinomycin(EC)와 안정제인 Dimethyloxaloylglycine (DMOG)를 이용하였다.This experiment was carried out in the same manner as in Experimental Example 3. To confirm the importance of HIF-1α, Echinomycin (EC), an HIF-1α inhibitor, and Dimethyloxaloylglycine (DMOG), a stabilizer, were used.
도 11에 나타난 바와 같이, EC에 의해서 HIF-1α가 억제된 경우, 혈관외피줄기세포 배양액을 주입하여도 착상된 배아의 수가 현저하게 감소한 것을 확인하였다.As shown in FIG. 11, when HIF-1α was inhibited by EC, it was confirmed that the number of implanted embryos was significantly reduced even when the vascular enveloped stem cell culture medium was injected.
반면, DMOG를 통해 HIF-1α를 안정화한 경우, 혈관외피줄기세포 배양액 또는 CYP-A의 시너지 효과로 착상된 배아의 수가 유의적으로 증가함을 확인하였다.On the other hand, when HIF-1α was stabilized through DMOG, it was confirmed that the number of implanted embryos significantly increased due to the synergistic effect of vascular enveloped stem cell culture medium or CYP-A.
또한, 도 12에 나타난 바와 같이 HIF-1α가 억제된 경우, 혈관외피줄기세포 배양액을 주입하여도 배아의 무게가 유의하게 감소한 것을 확인하였다.In addition, as shown in FIG. 12, when HIF-1α was inhibited, it was confirmed that the weight of the embryo was significantly reduced even when the vascular enveloped stem cell culture solution was injected.
반면, DMOG를 통해 HIF-1α를 안정화한 경우, 혈관외피줄기세포 배양액 또는 CYP-A의 시너지 효과로 착상된 배아의 수가 유의적으로 증가함을 확인하였다.On the other hand, when HIF-1α was stabilized through DMOG, it was confirmed that the number of implanted embryos significantly increased due to the synergistic effect of vascular enveloped stem cell culture medium or CYP-A.
실험예 7. CYP-A의 자궁조직 내 투여에 의한 임신 후 산자수(litter size)에 미치는 영향 평가Experimental Example 7. Evaluation of the effect of intrauterine administration of CYP-A on the litter size after pregnancy
상기 실험예 6과 유사하게 CYP-A를 투여한 뒤 7일 후에 숫컷 생쥐와 교배를 시작하여 출산까지 유도하였다. 교배가 확인된 날을 1일로 하였을 때, 임신 18-19일차에 출산이 이루어졌으며 산자수(litter size)를 확인하였다.Similar to Experimental Example 6, after 7 days after CYP-A was administered, mating with male mice was initiated to induce birth. When mating was confirmed as
그 결과, 도 13에 나타난 바와 같이 HIF-1α 안정제인 DMOG 를 함께 주입한 경우, CYP-A와의 시너지 효과에 의해 산자수가 유의적으로 증가함을 확인하였다.As a result, it was confirmed that, as shown in FIG. 13, when DMOG, which is a HIF-1α stabilizer, was injected together, the number of litters was significantly increased due to a synergistic effect with CYP-A.
실험예 8. CYP-A에 의한 대식세포(macrophage) 유입(infiltration) 및 극성(polarity) 조절 확인Experimental Example 8. Confirmation of macrophage infiltration and polarity control by CYP-A
8-1. CYP-A에 의한 대식세포의 유입 조절8-1. Control of influx of macrophages by CYP-A
CYP-A를 주입한 아셔만 증후군 생쥐 모델의 자궁에서 대식세포의 유입을 확인하였다. 자궁 조직을 하나의 세포단위로 분리한 후 형광물질이 탐침된 대식세포의 대표항체(F4/80, CD11b)를 부착하고, 유세포 분석법을 이용하여 특정 항체에 반응하여 항체 특이적 형광물질을 발광하는 각각의 세포를 분류 및 집단화하였다. 프로그램에서 히스토그램을 만들어서 형광물질에 기초하여 분류된 세포들을 좌표로 나타냈으며, 전체 세포 중 각 집단의 비중을 퍼센트로 표기하였다.The influx of macrophages from the uterus of the Asherman syndrome mouse model injected with CYP-A was confirmed. After separating the uterine tissue into one cell unit, a representative antibody (F4/80, CD11b) of macrophages probed with a fluorescent substance is attached, and an antibody-specific fluorescent substance is emitted by reacting to a specific antibody using flow cytometry. Each cell was sorted and grouped. A histogram was created in the program and the cells classified based on the fluorescent substance were expressed as coordinates, and the proportion of each group among the total cells was expressed as a percentage.
그 결과, 도 14에서 나타난 바와 같이 CYP-A를 주입한 아셔만 증후군 생쥐 모델의 자궁에서 대식세포의 유입양이 증가함을 확인하였다.As a result, as shown in FIG. 14, it was confirmed that the amount of influx of macrophages increased in the uterus of the Asherman syndrome mouse model injected with CYP-A.
8-2. CYP-A에 의한 대식세포 극성 조절8-2. Macrophage polarity regulation by CYP-A
CYP-A를 주입한 아셔만 증후군 생쥐 모델의 자궁에서 대식세포의 M1/M2 극성을 대표하는 인자들의 발현을 확인하였다. M1 대식세포의 대표인자로 iNOS, CD80, Il-12가 사용되었고, M2 대식세포의 대표인자로 Arg1, CD206, Il-10이 사용되었다. 실시간 RT-PCR을 통해서 mRNA 수준을 확인하였으며, RT-PCR 사용시 이용한 프라이머는 하기 표 1에 나타난 바와 같다.Expression of factors representing the M1/M2 polarity of macrophages in the uterus of the Asherman syndrome mouse model injected with CYP-A was confirmed. Representative factors of M1 macrophages iNOS, CD80, and Il-12 were used, and representative factors of M2 macrophages were Arg1, CD206, and Il-10. The mRNA level was confirmed through real-time RT-PCR, and the primers used when using RT-PCR are as shown in Table 1 below.
그 결과, 도 15에 나타난 바와 같이 CYP-A를 주입한 아셔만 증후군 생쥐 모델의 자궁에서 M1 대식세포의 대표인자들의 발현은 감소하고, M2 대식세포의 대표인자들의 발현은 증가함을 확인하였다.As a result, it was confirmed that the expression of representative factors of M1 macrophages decreased and the expression of representative factors of M2 macrophages was increased in the uterus of the CYP-A-injected Asherman syndrome mouse model as shown in FIG. 15.
또한, 자궁 조직을 하나의 세포단위로 분리한 후 형광물질이 탐침된 M1/M2 대식세포의 대표항체(F4/80, CD80, CD2016)를 부착하고, 유세포 분석법을 이용하여 특정 항체에 반응하여 항체 특이적 형광물질을 발광하는 각각의 세포를 분류 및 집단화하였다. 프로그램에서 히스토그램을 만들어서 형광물질에 기초하여 분류된 세포들을 좌표로 나타내었으며, 전체 세포 중 각 집단의 비중을 퍼센트로 표기하였다.In addition, after separating the uterine tissue into one cell unit, a representative antibody (F4/80, CD80, CD2016) of M1/M2 macrophages probed with a fluorescent substance was attached, and the antibody was reacted to a specific antibody using flow cytometry. Each cell emitting a specific fluorescent substance was sorted and grouped. A histogram was created in the program and the cells classified based on the fluorescent substance were expressed as coordinates, and the proportion of each group among the total cells was expressed as a percentage.
그 결과, 도 16에 나타난 바와 같이 CYP-A를 주입한 경우, 침윤 단핵구(infiltrated monocytes) 또는 대식세포(macrophage)를 M2-유사 표현형을 가지는 대식세포로 분극(polarize)될 수 있음을 확인하였다.As a result, as shown in FIG. 16, when CYP-A was injected, it was confirmed that infiltrated monocytes or macrophages could be polarized into macrophages having an M2-like phenotype.
실험예 9. CYP-A에 의한 혈관신생 촉진 확인Experimental Example 9. Confirmation of promotion of angiogenesis by CYP-A
상기 8-2와 동일한 생쥐 모델을 이용하여 CYP-A에 의해 대식세포의 극성이 조절됨을 확인하였다. 이를 기반으로 세포 수준에서 지질다당류 (Lipopolysaccharide, LPS)와 인터페론 감마(IFN)로 자극시켜 M1 대식세포를, IL-4로 자극시켜 M2 대식세포를 준비하였다. 대식세포주는 RAW 264.7 세포주를 사용하였다.Using the same mouse model as in 8-2, it was confirmed that the polarity of macrophages was regulated by CYP-A. Based on this, M1 macrophages were stimulated with lipopolysaccharide (LPS) and interferon gamma (IFN) at the cellular level, and M2 macrophages were prepared by stimulation with IL-4. The macrophage cell line was used as the RAW 264.7 cell line.
그 결과, 도 17에서 나타난 바와 같이 CYP-A에 의해서 M1 대식세포로 유도된 RAW 264.7 세포에서 M2 대식세포로의 변화를 확인하였다. 이는 상기 실험예 8-2와 유사한 결과임을 확인할 수 있다.As a result, as shown in FIG. 17, the change from RAW 264.7 cells induced into M1 macrophages by CYP-A to M2 macrophages was confirmed. It can be seen that this is a similar result to Experimental Example 8-2.
상기와 같이 준비된 M1/M2 대식세포를 혈관내피세포(HUVEC)와 공배양 하였으며, 신생혈관생성의 효과를 확인하기 위하여 HUVEC 세포의 튜브 형성을 분석하였다(Tube formation assay). 구체적으로, M1 및 M2의 유사 극성을 유도하고, 형성된 튜브-유사구조의 수를 세었다(도 18 내 녹색 구조). 본 결과는 3중 샘플의 mean ± SEM으로 나타내었다. 또한, 형성된 튜브의 수는 도 18 내의 그래프로 나타내었다.M1/M2 macrophages prepared as described above were co-cultured with vascular endothelial cells (HUVEC), and tube formation of HUVEC cells was analyzed to confirm the effect of angiogenesis (Tube formation assay). Specifically, the similar polarities of M1 and M2 were induced, and the number of formed tube-like structures was counted (green structure in FIG. 18). The results are expressed as mean±SEM of triplicate samples. In addition, the number of tubes formed is shown in a graph in FIG. 18.
그 결과, 도 18에 나타난 바와 같이 M2 대식세포가 혈관내피세포의 혈관신생을 촉진시키며, CYP-A를 처리함에 따라 혈관신생이 촉진되는 것을 확인하였다. 이는 본 발명의 조성물은 혈관신생을 촉진함으로써 아셔만 증후군 및 이의 합병증에 대한 치료 효과를 나타낼 수 있음을 나타내는 것이다.As a result, as shown in FIG. 18, it was confirmed that M2 macrophages promote angiogenesis of vascular endothelial cells, and angiogenesis is promoted by treatment with CYP-A. This indicates that the composition of the present invention can exhibit a therapeutic effect on the Assherman syndrome and its complications by promoting angiogenesis.
전술한 본 발명의 설명은 예시를 위한 것이며, 본 발명이 속하는 기술분야의 통상의 지식을 가진 자는 본 발명의 기술적 사상이나 필수적인 특징을 변경하지 않고서 다른 구체적인 형태로 쉽게 변형이 가능하다는 것을 이해할 수 있을 것이다. 그러므로 이상에서 기술한 실시예들은 모든 면에서 예시적인 것이며 한정적이 아닌 것으로 이해해야만 한다. 예를 들어, 단일형으로 설명되어 있는 각 구성 요소는 분산되어 실시될 수도 있으며, 마찬가지로 분산된 것으로 설명되어 있는 구성 요소들도 결합된 형태로 실시될 수 있다.The above description of the present invention is for illustrative purposes only, and those of ordinary skill in the art to which the present invention pertains will be able to understand that other specific forms can be easily modified without changing the technical spirit or essential features of the present invention. will be. Therefore, it should be understood that the embodiments described above are illustrative and non-limiting in all respects. For example, each component described as a single type may be implemented in a distributed manner, and similarly, components described as being distributed may also be implemented in a combined form.
본 발명의 범위는 후술하는 청구범위에 의하여 나타내어지며, 청구범위의 의미 및 범위 그리고 그 균등 개념으로부터 도출되는 모든 변경 또는 변형된 형태가 본 발명의 범위에 포함되는 것으로 해석되어야 한다.The scope of the present invention is indicated by the claims to be described later, and all changes or modified forms derived from the meaning and scope of the claims and the concept of equivalents thereof should be construed as being included in the scope of the present invention.
<110> KNU-Industry Cooperation Foundation College of Medicine Pochon CHA University Industry-Academic Cooperation Foundation<120> COMPOSITION FOR TREATING ASHERMAN SYNDROME COMPRISING PERIVASCULAR STEM CELL MEDIUM OR CYCLOPHILIN A<130> 19PP30595<160> 12<170> KoPatentIn 3.0<210> 1<211> 24<212> DNA<213> Artificial Sequence<220><223> iNOS forward primer<400> 1ttcacccagt tgtgcatcga ccta 24<210> 2<211> 24<212> DNA<213> Artificial Sequence<220><223> iNOS reverse primer<400> 2tccatggtca cctccaacac aaga 24<210> 3<211> 22<212> DNA<213> Artificial Sequence<220><223> CD80 forward primer<400> 3gctgtgtcgt tcaaaagaag ga 22<210> 4<211> 23<212> DNA<213> Artificial Sequence<220><223> CD80 reverse primer<400> 4tgggaaattg tcgtattgat gcc 23<210> 5<211> 21<212> DNA<213> Artificial Sequence<220><223> Il-12 forward primer<400> 5tggtttgcca tcgttttgct g 21<210> 6<211> 22<212> DNA<213> Artificial Sequence<220><223> Il-12 reverse primer<400> 6ccggagtaat ttggtgcttc ac 22<210> 7<211> 21<212> DNA<213> Artificial Sequence<220><223> Arg1 forward primer<400> 7aacacggcag tggctttaac c 21<210> 8<211> 20<212> DNA<213> Artificial Sequence<220><223> Arg1 reverse primer<400> 8ggttttcatg tggcgcattc 20<210> 9<211> 20<212> DNA<213> Artificial Sequence<220><223> CD206 forward primer<400> 9tctcccggaa ccgactcttc 20<210> 10<211> 21<212> DNA<213> Artificial Sequence<220><223> CD206 reverse primer<400> 10ggtcgagcac ataggtcttc t 21<210> 11<211> 20<212> DNA<213> Artificial Sequence<220><223> Il-10 forward primer<400> 11gctcttgtag acaccttggt 20<210> 12<211> 21<212> DNA<213> Artificial Sequence<220><223> Il-10 reverse primer<400> 12gctcttactg actggcatga g 21<110> KNU-Industry Cooperation Foundation College of Medicine Pochon CHA University Industry-Academic Cooperation Foundation<120> COMPOSITION FOR TREATING ASHERMAN SYNDROME COMPRISING PERIVASCULAR STEM CELL MEDIUM OR CYCLOPHILIN A<130> 19PP30595<160> 12<170> KoPatentIn 3.0<210> 1<211> 24<212> DNA<213> Artificial Sequence<220><223> iNOS forward primer<400> 1ttcacccagt tgtgcatcga ccta 24<210> 2<211> 24<212> DNA<213> Artificial Sequence<220><223> iNOS reverse primer<400> 2tccatggtca cctccaacac aaga 24<210> 3<211> 22<212> DNA<213> Artificial Sequence<220><223> CD80 forward primer<400> 3gctgtgtcgt tcaaaagaag ga 22<210> 4<211> 23<212> DNA<213> Artificial Sequence<220><223> CD80 reverse primer<400> 4tgggaaattg tcgtattgat gcc 23<210> 5<211> 21<212> DNA<213> Artificial Sequence<220><223> Il-12 forward primer<400> 5tggtttgcca tcgttttgct g 21<210> 6<211> 22<212> DNA<213> Artificial Sequence<220><223> Il-12 reverse primer<400> 6ccggagtaat ttggtgcttc ac 22<210> 7<211> 21<212> DNA<213> Artificial Sequence<220><223> Arg1 forward primer<400> 7aacacggcag tggctttaac c 21<210> 8<211> 20<212> DNA<213> Artificial Sequence<220><223> Arg1 reverse primer<400> 8ggttttcatg tggcgcattc 20<210> 9<211> 20<212> DNA<213> Artificial Sequence<220><223> CD206 forward primer<400> 9tctcccggaa ccgactcttc 20<210> 10<211> 21<212> DNA<213> Artificial Sequence<220><223> CD206 reverse primer<400> 10ggtcgagcac ataggtcttc t 21<210> 11<211> 20<212> DNA<213> Artificial Sequence<220><223> Il-10 forward primer<400> 11gctcttgtag acaccttggt 20<210> 12<211> 21<212> DNA<213> Artificial Sequence<220><223> Il-10 reverse primer<400> 12gctcttactg actggcatga g 21
Claims (12)
Translated fromKorean상기 혈관외피줄기세포 배양액은 혈관외피줄기세포를 무혈청 배지에서 배양하여 수득한 것인, 아셔만 증후군 예방 또는 치료용 약학적 조성물.The method of claim 1,
The vascular enveloped stem cell culture medium is obtained by culturing the vascular enveloped stem cells in a serum-free medium, a pharmaceutical composition for preventing or treating Asherman syndrome.
상기 조성물은 HIF-1α(hypoxia inducible transcriptional factor 1α) 안정제(stabilizer)를 추가로 포함하는 것인, 아셔만 증후군 예방 또는 치료용 약학적 조성물.The method of claim 1,
The composition is HIF-1α (hypoxia inducible transcriptional factor 1α) that further comprises a stabilizer (stabilizer), Asherman syndrome prevention or treatment pharmaceutical composition.
상기 HIF-1 안정제는 디메틸옥살로글리신(dimethyloxaloylglycine, DMOG)인 것인, 아셔만 증후군 예방 또는 치료용 약학적 조성물.The method of claim 3,
The HIF-1 stabilizing agent is dimethyloxaloylglycine (DMOG), a pharmaceutical composition for the prevention or treatment of Asherman's syndrome.
상기 조성물은 섬유화를 억제하는 것인, 아셔만 증후군 예방 또는 치료용 약학적 조성물.The method of claim 1,
The composition is to inhibit fibrosis, Asherman syndrome prevention or treatment pharmaceutical composition.
상기 조성물은 혈관신생을 촉진하는 것인, 아셔만 증후군 예방 또는 치료용 약학적 조성물.The method of claim 1,
The composition is to promote angiogenesis, asherman syndrome prevention or treatment pharmaceutical composition.
상기 아셔만 증후군 합병증은 자궁유착, 자궁근종, 자궁내막증, 자궁외 임신, 유산, 난소낭종, 생리장애, 난임, 불임, 골반유착, 골반통 및 골반염으로 이루어진 군에서 선택되는 하나 이상인 것인, 아셔만 증후군 합병증의 예방 또는 치료용 약학적 조성물.The method of claim 7,
The Asherman syndrome complication is one or more selected from the group consisting of uterine adhesions, uterine fibroids, endometriosis, ectopic pregnancy, abortion, ovarian cysts, physiological disorders, infertility, infertility, pelvic adhesions, pelvic pain, and pelvicitis. Pharmaceutical composition for the prevention or treatment of complications.
상기 조성물은 HIF-1α 안정제를 추가로 포함하는 것인, 아셔만 증후군 합병증의 예방 또는 치료용 약학적 조성물.The method of claim 7,
The composition further comprises a HIF-1α stabilizer, a pharmaceutical composition for the prevention or treatment of complications of Assherman syndrome.
상기 혈관외피줄기세포 배양액은 혈관외피줄기세포를 무혈청 배지에서 배양하여 수득한 것인, 아셔만 증후군 개선용 식품 조성물.The method of claim 10,
The vascular envelope stem cell culture medium is obtained by culturing the vascular envelope stem cells in a serum-free medium, Asherman syndrome improvement food composition.
상기 조성물은 HIF-1α 안정제를 추가로 포함하는 것인, 아셔만 증후군 개선용 식품 조성물.The method of claim 10,
The composition further comprises a stabilizer HIF-1α, Asherman's syndrome food composition for improvement.
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020190145656AKR102370535B1 (en) | 2019-11-14 | 2019-11-14 | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a |
| KR1020220025097AKR102477288B1 (en) | 2019-11-14 | 2022-02-25 | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020190145656AKR102370535B1 (en) | 2019-11-14 | 2019-11-14 | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020220025097ADivisionKR102477288B1 (en) | 2019-11-14 | 2022-02-25 | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20210058334Atrue KR20210058334A (en) | 2021-05-24 |
| KR102370535B1 KR102370535B1 (en) | 2022-03-04 |
Family
ID=76152895
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020190145656AActiveKR102370535B1 (en) | 2019-11-14 | 2019-11-14 | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a |
| KR1020220025097AActiveKR102477288B1 (en) | 2019-11-14 | 2022-02-25 | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020220025097AActiveKR102477288B1 (en) | 2019-11-14 | 2022-02-25 | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a |
Country Status (1)
| Country | Link |
|---|---|
| KR (2) | KR102370535B1 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023003130A1 (en)* | 2021-07-23 | 2023-01-26 | 차의과학대학교 산학협력단 | Pharmaceutical composition for preventing or treating asherman's syndrome comprising isolated mitochondria as active ingredient |
| CN116514830A (en)* | 2023-03-09 | 2023-08-01 | 温州医科大学 | Sakura extract analogue and application thereof |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101261279A (en)* | 2008-04-11 | 2008-09-10 | 四川大学 | Endometrial cancer diagnostic reagents, kits and prevention and treatment drugs |
| KR20170128492A (en) | 2015-04-02 | 2017-11-22 | 니뽄 다바코 산교 가부시키가이샤 | Flavor inhaler |
- 2019
- 2019-11-14KRKR1020190145656Apatent/KR102370535B1/enactiveActive
- 2022
- 2022-02-25KRKR1020220025097Apatent/KR102477288B1/enactiveActive
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101261279A (en)* | 2008-04-11 | 2008-09-10 | 四川大学 | Endometrial cancer diagnostic reagents, kits and prevention and treatment drugs |
| KR20170128492A (en) | 2015-04-02 | 2017-11-22 | 니뽄 다바코 산교 가부시키가이샤 | Flavor inhaler |
Non-Patent Citations (1)
| Title |
|---|
| SONG ET AL, FERTILITY _ STERILITY POSTER SESSION, 180(3), SUPPLEMENT, E361, P_666** |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023003130A1 (en)* | 2021-07-23 | 2023-01-26 | 차의과학대학교 산학협력단 | Pharmaceutical composition for preventing or treating asherman's syndrome comprising isolated mitochondria as active ingredient |
| CN116514830A (en)* | 2023-03-09 | 2023-08-01 | 温州医科大学 | Sakura extract analogue and application thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| KR102370535B1 (en) | 2022-03-04 |
| KR102477288B1 (en) | 2022-12-13 |
| KR20220029634A (en) | 2022-03-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12337016B2 (en) | Composition for preventing or treating ocular diseases comprising amniotic epithelial cell derived exosomes | |
| KR101775262B1 (en) | A composition for preventing or treating of skin inflammation disease comprising tonsil-derived mesenchymal stem cell or conditioned medium thereof | |
| KR102477288B1 (en) | Composition for treating asherman syndrome comprising perivascular stem cell medium or cyclophilin a | |
| KR101910733B1 (en) | Composition of treating or preventing multiple sclerosis comprising piperlongumine as active ingredient | |
| KR20210148958A (en) | Pharmaceutical composition for preventing or treating obesity or non-alcoholic fatty liver comprising dental tissue-derived mesenchymal stem cells | |
| CN110862963B (en) | Application of decidua NK cells and cell subsets thereof in preparation of medicines for treating infertility-related diseases | |
| WO2002099081A2 (en) | Methods of using colony stimulating factors in the treatment of tissue damage and ischemia | |
| WO2020163766A1 (en) | Periosteal skeletal stem cells in bone repair | |
| KR20200022789A (en) | Pharmaceutical composition for preventing or treating muscle weakness diseases comprising deoxycholic acid or pharmaceutically acceptable salt thereof | |
| KR102210807B1 (en) | A composition for treating oral mucositis comprising tonsil-derived MSCSs and a method for preparing oral mucositis animal model | |
| JP2024040280A (en) | Pharmaceutical composition for preventing or treating atopic dermatitis containing clonal stem cells | |
| KR101534395B1 (en) | A composition for preventing or treating bone disorders, comprising trapidil | |
| US20250000909A1 (en) | Pharmaceutical composition for preventing or treating asherman's syndrome comprising isolated mitochondria as active ingredient | |
| CN116925186B (en) | Mesenchymal stem cell treatment method for neonatal pulmonary dysplasia | |
| KR102728303B1 (en) | Composition for preventing, improving or treating xerostomia comprising tonsil mesenchymal stem cell-derived extracellular vesicle | |
| JP2025129063A (en) | Method for producing extracellular vesicles derived from immunotolerized fetal stem cells and their use for the treatment of osteoarthritis | |
| WO2019124608A1 (en) | Pharmaceutical composition for preventing or treating rheumatoid arthritis, containing 4'-(p-toluenesulfonylamido)-4-hydroxychalcone as active ingredient | |
| KR20190053019A (en) | A composition for enhancing implantation ability comprising decidual endometrial stromal cells | |
| KR102236635B1 (en) | Composition for promoting bone regeneration of tooth extraction socket comprising Meox2 inhibitor | |
| JP6936496B2 (en) | Graft-versus-host disease therapeutic or prophylactic, fibrosite infiltration inhibitor, and inhibitor of tear loss and goblet cell loss | |
| KR101844816B1 (en) | Composition For Improving Or Treating Anorexia Including Guanabenz And Method Using Thereof | |
| KR101780584B1 (en) | Composition for preventing or treating erectile dysfunction comprising Vasohibin-1 | |
| KR101586336B1 (en) | Pharmaceutical composition for preventing or treating muscle weakness diseases comprising Estropipate | |
| KF | To Compare The Efficacy and Safety of Isosorbide Mononitrate Versus Dinoprostone Gel (Pge2) for Cervical Ripening in Term Pregnant Women | |
| KR101254244B1 (en) | Composition for preventing or treating of irradiation-induced cell damage comprising TGF-β1 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application | Patent event code:PA01091R01D Comment text:Patent Application Patent event date:20191114 | |
| PA0201 | Request for examination | ||
| PE0902 | Notice of grounds for rejection | Comment text:Notification of reason for refusal Patent event date:20201209 Patent event code:PE09021S01D | |
| PG1501 | Laying open of application | ||
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | Comment text:Notification of reason for refusal Patent event date:20210611 Patent event code:PE09021S01D | |
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | Patent event code:PE07011S01D Comment text:Decision to Grant Registration Patent event date:20211126 | |
| PA0107 | Divisional application | Comment text:Divisional Application of Patent Patent event date:20220225 Patent event code:PA01071R01D | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | Comment text:Registration of Establishment Patent event date:20220228 Patent event code:PR07011E01D | |
| PR1002 | Payment of registration fee | Payment date:20220302 End annual number:3 Start annual number:1 | |
| PG1601 | Publication of registration | ||
| PR1001 | Payment of annual fee | Payment date:20241226 Start annual number:4 End annual number:4 |