KR20170076484A - 프로토카데린의 과발현을 이용한 노화 세포를 분리하는 방법 - Google Patents
프로토카데린의 과발현을 이용한 노화 세포를 분리하는 방법Download PDFInfo
- Publication number
- KR20170076484A KR20170076484AKR1020150186785AKR20150186785AKR20170076484AKR 20170076484 AKR20170076484 AKR 20170076484AKR 1020150186785 AKR1020150186785 AKR 1020150186785AKR 20150186785 AKR20150186785 AKR 20150186785AKR 20170076484 AKR20170076484 AKR 20170076484A
- Authority
- KR
- South Korea
- Prior art keywords
- cells
- aging
- cell
- container
- sample
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/0081—Purging biological preparations of unwanted cells
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/12—Type of nucleic acid catalytic nucleic acids, e.g. ribozymes
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
- C12N2310/141—MicroRNAs, miRNAs
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/50—Physical structure
- C12N2310/53—Physical structure partially self-complementary or closed
- C12N2310/531—Stem-loop; Hairpin
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2509/00—Methods for the dissociation of cells, e.g. specific use of enzymes
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2509/00—Methods for the dissociation of cells, e.g. specific use of enzymes
- C12N2509/10—Mechanical dissociation
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2533/00—Supports or coatings for cell culture, characterised by material
- C12N2533/50—Proteins
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Biomedical Technology (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Immunology (AREA)
- Mycology (AREA)
Abstract
Description
프로토카데린의 과발현을 이용하여 노화 세포를 분리하는 방법 및 이를 이용하여 노화 세포를 특이적으로 제거하는 방법에 관한 것이다.
세포는 끊임없이 분열을 할 수 있는 것이 아니라 어느 순간 도달하면 노화에 접어들고, 이러한 현상은 세포 복제 노화(Replicative cell senescence)라고 불린다. 그러나 모든 세포가 동일한 선상에서 노화가 진행되는 것이 아니기 때문에, 포유동물의 조직이나 배양 접시에서 배양한 세포는 노화된 세포의 노화 정도에 따라서 다른 구성을 갖는다(Heterogeneity of senescence).
노화 세포는 세포의 크기가 커지면서 평평해지고 특정 pH에서 베타-갈락토시다제(β-galactosidase)의 활성이 증가되는 것을 특징으로 하는 것으로 알려져 있다. 그러나, 이러한 노화 세포의 특성을 이용하여 노화 세포를 선택적으로 구별할 수 있지만 분리하는 것은 불가능하다.
따라서, 완전히 노화에 도달한 세포를 선택적으로 분리하여 다음 연구에 사용하는 방법이 요구된다.
일 양상은 노화 세포를 포함하는 시료로부터 노화 세포를 분리하는 방법을 제공한다.
다른 양상은 노화 세포를 포함하는 시료 또는 개체로부터 노화 세포를 제거하는 방법을 제공한다.
일 양상은 노화 세포를 포함하는 시료를 전처리되지 않은 용기와 접촉시켜 상기 용기에 노화 세포를 부착시키는 단계; 및
상기 용기에 부착된 노화 세포를 상기 용기로부터 분리하는 단계를 포함하는, 노화 세포를 포함하는 시료로부터 노화 세포를 분리하는 방법을 제공한다.
상기 방법은 노화 세포를 포함하는 시료를 전처리되지 않은 용기와 접촉시켜 상기 용기에 노화 세포를 부착시키는 단계를 포함한다.
노화(senescence)는 시간의 경과에 따라 나타나는 변화 현상을 의미한다. 노화 세포는 표준(reference) 세포에 비하여 프로토카데린(Protocadherin)의 전령 RNA(messenger RNA: mRNA) 또는 프로토카데린 단백질이 젊은 세포에 비해 높게 발현되거나, 프로토카데린 유전자 클러스터에서 DNA 메틸화 수준이 젊은 세포에 비해 증가하거나, 베타-갈락토시다제 활성을 갖는 것이거나, 세포가 평평해지는 것이거나, 또는 이들의 조합일 수 있다. 예를 들면, 노화 세포는 계대수 2의 분열 시간(doubling time)에 비해 분열 시간이 2 배 이상, 3배 이상, 4배 이상, 5배 이상, 6배 이상, 7배 이상, 9배 이상, 10배 이상, 14배 이상, 또는 20배 이상 증가한 경우 그 세포는 노화 세포라고 할 수 있다. 사람의 경우 약 30세 이상, 약 40세 이상, 약 50세 이상, 약 60세 이상, 약 70세 이상, 약 80세 이상, 약 90세 이상, 또는 약 100세 이상의 사람으로부터 수득된 세포는 노화 세포라고 할 수 있다.
프로토카데린(Protocadherin)의 유전자는 인간의 경우 염색체 5번에 위치하고 있으며 하나의 클러스터를 형성하고 있다. 총 52 개의 인간 유전자가 이 클러스터에 속해 있으며 크게 3개의 패밀리로 나뉘고, 15개의 유전자를 포함한 알파 패밀리, 16개의 유전자를 포함한 베타 패밀리, 그리고 21개의 유전자를 포함한 감마 패밀리를 포함한다. 이 중에서 감마 패밀리는 다시 a 형태와 b 형태로 나뉜다. 프로토카데린은 주로 세포의 부착과 세포간 연결에 기능을 한다.
상기 시료는 노화 수준이 상이한 세포들의 이질적인(heterogenous) 집단을 포함하는 것일 수 있다. 모든 세포가 동일한 선상에서 노화가 진행되는 것이 아니기 때문에, 포유동물의 조직이나 배양 접시에서 배양한 세포는 노화된 세포의 노화 정도에 따라서 다른 구성을 가질 수 있다. 상기 시료는 예를 들어 약 1% 내지 약 50%, 약 5% 내지 40%, 또는 약 10% 내지 30%의 노화 세포를 함유할 수 있다.
상기 세포는 예를 들면, 신경 세포, 면역 세포, 상피 세포, 생식 세포, 근육세포, 또는 암세포일 수 있다. 상기 세포는 섬유아세포 또는 조기노화 세포일 수 있다. 상기 조기노화 세포는 조로증(progeria) 환자 유래의 세포일 수 있다.
상기 전처리되지 않은 용기는 세포 배양을 위한 전처리가 되지 않은 것일 수 있다. 상기 세포 배양을 위한 전처리는 겔라틴, 콜라겐, 피브로넥틴, 폴리리신, 비트로넥틴, 오스테오폰틴, 히드로겔, 라미닌, 이들의 단편, 또는 이들의 모방물(mimetic)을 코팅하거나; 히드록시기 또는 카르복시기를 갖는 화합물로 용기의 표면을 개질하거나; 마트리겔을 코팅하거나; 세포외 기질 또는 그의 단편을 코팅하거나; 또는 이들의 조합일 수 있다.
상기 용기는 플라스틱, 유리, 폴리스티렌, 또는 이들의 조합일 수 있다. 상기 용기는 예를 들어 페트리 접시(petri dish)이다.
상기 접촉은 약 30 분 내지 약 24 시간 동안 수행되는 것일 수 있다. 상기 접촉은 약 30 분 내지 약 18 시간, 약 1 시간 내지 약 12 시간, 약 2 시간 내지 약 8 시간, 2 시간 내지 약 6 시간, 또는 2 시간 내지 약 4 시간 동안 수행될 수 있다. 예를 들어, 세포 배양 접시에 접종된 노화 세포를 포함하는 시료에 상기 용기를 위에서 가하여 시료와 용기를 접촉시킬 수 있다. 상기 접촉은 상온, 또는 약 37℃에서 수행될 수 있다. 노화 세포는 전처리되지 않은 용기와 접촉됨으로써 상기 용기에 부착될 수 있고 상기 용기에서 잘 증식할 수 있고, 반면에 젊은 세포는 상기 용기에 부착되지 않거나 부착되어도 잘 증식하지 않을 수 있다.
상기 분리는 용기에 부착된 노화 세포에 트립신(trypsin), 콜라게나제(collagenase), 히알루로니다제(hyaluronidase), DNA 분해 효소(DNase), 엘라스타제(elastase), 파파인(papain), 프로테아제 유형 XIV, 또는 이들의 조합을 가하는 것일 수 있다. 상기 분리된 노화 세포는 노화 세포의 특징을 갖는 것일 수 있다. 예를 들어, 상기 분리된 노화 세포는 프로토카데린의 mRNA 또는 프로토카데린 단백질이 젊은 세포에 비해 높게 발현되거나, 프로토카데린 유전자 클러스터에서 DNA 메틸화 수준이 젊은 세포에 비해 증가하거나, 베타-갈락토시다제 활성을 갖는 것이거나, 세포가 평평해지는 것일 수 있다. 상기 분리된 노화 세포는 예를 들어 약 50% 초과 내지 100%, 약 70% 내지 100%, 또는 약 90% 내지 100%의 노화 세포를 함유할 수 있다.
상기 방법은 분리된 노화 세포를 세포 배양 용기에서 배양하는 단계를 더 포함할 수 있다. 상기 세포 배양 용기는 세포 배양을 위한 전처리가 된 것일 수 있다. 상기 세포 배양을 위한 전처리는 전술된 바와 같다.
다른 양상은 노화 세포를 포함하는 시료 또는 개체에 프로토카데린의 발현 또는 기능을 저해하는 작용제를 투여하는 단계를 포함하는, 노화 세포를 포함하는 시료 또는 개체로부터 노화 세포를 제거하는 방법을 제공한다.
노화, 노화 세포, 시료, 및 프로토카데린은 전술한 바와 같다.
용어 "발현(expression)"은 유전자의 정보로부터 유전자 산물을 합성하는 과정을 말한다. 상기 유전자 산물은 RNA, 폴리펩티드, 또는 단백질일 수 있다. 상기 프로토카데린의 발현은 프로토카데린 유전자로부터 프로토카데린의 RNA, 폴리펩티드, 또는 단백질을 합성하는 과정일 수 있다.
상기 프로토카데린의 발현 또는 기능을 저해하는 작용제는 프로토카데린의 발현을 감소시켜 프로토카데린의 RNA, 폴리펩티드, 또는 단백질의 양을 감소시키거나, 또는 프로토카데린의 활성을 저해하는 작용제를 말한다. 상기 작용제는 작은 헤어핀 RNA(small hairpin RNA: shRNA), 짧은 간섭 RNA(short interfering RNA: siRNA), 마이크로 RNA(microRNA: miRNA), 리보자임, 안티센스 올리고뉴클레오티드, 항체 또는 그의 항원 결합 단편, 및 앱타머로 이루어진 군으로부터 선택될 수 있다. 상기 shRNA는 RNA 간섭(RNA interference)을 통해 표적 유전자의 발현을 억제(silence)할 수 있는 헤어핀 구조를 갖는 RNA 분자일 수 있다. 상기 siRNA는 RNA 간섭에 관여하는 RNA 분자로서, 특정 단백질의 생산을 억제함으로써 유전자 발현을 방해할 수 있다. 상기 shRNA 또는 siRNA의 길이는 10 뉴클레오티드(이하, 'nt'라고 함) 내지 50 nt, 15 nt 내지 40 nt, 20 nt 내지 30 nt, 또는 21 nt 내지 23 nt일 수 있다. 상기 shRNA 또는 siRNA는 상업적으로 입수 가능한 것일 수 있다. miRNA는 생물의 유전자 발현을 제어하는 역할을 하는 작은 RNA로서, 길이가 약 17 nt 내지 약 25 nt이다. miRNA는 mRNA와 상보적으로 결합하여 특정 단백질의 생산을 발현을 증가 또는 감소시키는 역할을 한다. 리보자임은 효소 기능을 하는 RNA로서, RNA 스플라이싱(splicing), tRNA합성, 단백질 합성 등의 생화학 반응을 촉매하는 효소의 기능을 가진 RNA를 말한다. 안티센스 올리고뉴클레오티드는 특성 서열에 상보적인 단일가닥의 DNA 또는 RNA이고, mRNA와 상보적으로 결합하여 특정 단백질의 생산을 발현을 증가 또는 감소시키는 역할을 한다. 상기 항체 또는 그의 항원 결합 단편은 프로토카데린에 결합하여 프로토카데린의 활성을 저해할 수 있다, 상기 항체는 전체 항체일 수 있다. 상기 항원 결합 단편은 단일-도메인 항체(single-domain antibody), Fab, Fab', 또는 단쇄 가변 단편(single-chain variable fragment: scFv)일 수 있다.
상기 개체는 포유동물, 예를 들면, 사람, 소, 말, 돼지, 개, 양, 염소, 래트, 마우스, 래빗, 또는 고양이일 수 있다.
상기 개체는 노화와 연관된 증상 또는 질병에 걸리거나 노화와 연관된 증상 또는 질병에 걸릴 위험이 있는 것일 수 있다. 노화와 연관된 증상 또는 질병은 피부 주름, 상처 재생 저하, 퇴행성 뇌질환, 뇌졸중, 당뇨, 관절염, 동맥경화, 심장병, 탈모, 골다공증, 근감소증, 조로증(progeria), 리소좀 축적 질환(lysosome storage disease), 또는 이들의 조합일 수 있다.
시료에의 투여는 시료에 프로토카데린의 발현 또는 기능을 저해하는 작용제를 가하는 것일 수 있다. 시료에 프로토카데린의 발현 또는 기능을 저해하는 작용제를 가함으로써, 시료 중 노화 세포를 특이적으로 제거할 수 있다.
개체에의 투여는 예를 들면, 성인 기준으로 약 0.001 ㎎/kg 내지 약 100 ㎎/kg, 약 0.01 ㎎/kg 내지 약 10 ㎎/kg, 또는 약 0.1 ㎎/kg 내지 약 1 ㎎/kg의 범위 내일 수 있고, 1일 내지 1년의 기간 동안 1일 1회, 1일 다회, 또는 수일 1회 투여될 수 있다. 상기 투여는 당업계에 알려진 방법에 의하여 투여될 수 있다. 투여는 예를 들면, 경구, 정맥내, 근육내, 경구, 경피(transdermal), 점막, 코안(intranasal), 기관내(intratracheal) 또는 피하 투여와 같은, 임의의 수단에 의하여 개체로 직접적으로 투여될 수 있다. 상기 투여는 국소 또는 전신 투여일 수 있다. 상기 투여는 노화 세포를 포함하는 조직에 국소적으로 투여하는 것일 수 있다.
개체에 프로토카데린의 발현 또는 기능을 저해하는 작용제를 투여할 경우 상기 투여에 의해 노화와 연관된 증상 또는 질병이 예방 또는 치료될 수 있다. 용어 "예방"은 조성물의 투여에 의해 노화와 연관된 증상 또는 질병을 억제하거나 발병을 지연시키는 모든 행위를 말한다. 용어 "치료"는 조성물의 투여에 의해 노화와 연관된 증상 또는 질병의 증세가 호전되거나 이롭게 변경하는 모든 행위를 말한다.
일 양상에 따른 노화 세포를 포함하는 시료로부터 노화 세포를 분리하는 방법 및 노화 세포를 포함하는 시료 또는 개체로부터 노화 세포를 제거하는 방법에 따르면, 시료로부터 노화 세포를 특이적으로 분리할 수 있고, 분리된 노화 세포를 이용하여 후속 실험을 수행할 수 있다. 또한, 시료 또는 개체로부터 노화 세포를 특이적으로 제거하여, 노화와 연관된 증상 또는 질병을 효율적으로 예방 또는 치료할 수 있다.
도 1a는 노화 세포 및 젊은 세포에서 프로토카데린의 qPCR 결과를 나타내는 그래프이고, 도 1b는 항-프로토카데린 항체를 사용한 면역블로팅 결과를 나타내는 그래프이고, 도 1c는 인간 게놈에서 프로토카데린 유전자 클러스터의 DNA 메틸화 수준을 나타내는 그래프이다.
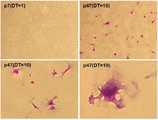
도 2a는 플라스틱 접시에 부착된 세포의 백분율을 나타내는 그래프이고(p; 계대수, DT: 분열 시간), 도 2b 및 도 2c는 각각 플라스틱 접시에 부착된 세포의 현미경 이미지 및 크리스탈 바이올렛 염색된 이미지이다.
도 3a는 플라스틱 접시에 부착된 세포 또는 플라스틱 접시에 부착하지 못하고 부유된 세포로부터 수득된 단백질의 베타-갈락토시다제 활성을 나타내는 그래프이고, 도 3b는 부착된 세포의 단백질을 항-PCDHGA2 항체을 사용하여 면역블로팅한 결과를 나타내는 그래프이다.
도 4a는 노화 세포 및 젊은 세포에 PCDHA shRNA를 가한 경우 배양 접시에 부착된 세포의 생존능(%)을 나타내는 그래프이고, 도 4b는 스타우로스포린의 존재 에서 배양된 세포를 계수하여 세포의 생존능(%)을 나타내는 그래프이다.
도 2a는 플라스틱 접시에 부착된 세포의 백분율을 나타내는 그래프이고(p; 계대수, DT: 분열 시간), 도 2b 및 도 2c는 각각 플라스틱 접시에 부착된 세포의 현미경 이미지 및 크리스탈 바이올렛 염색된 이미지이다.
도 3a는 플라스틱 접시에 부착된 세포 또는 플라스틱 접시에 부착하지 못하고 부유된 세포로부터 수득된 단백질의 베타-갈락토시다제 활성을 나타내는 그래프이고, 도 3b는 부착된 세포의 단백질을 항-PCDHGA2 항체을 사용하여 면역블로팅한 결과를 나타내는 그래프이다.
도 4a는 노화 세포 및 젊은 세포에 PCDHA shRNA를 가한 경우 배양 접시에 부착된 세포의 생존능(%)을 나타내는 그래프이고, 도 4b는 스타우로스포린의 존재 에서 배양된 세포를 계수하여 세포의 생존능(%)을 나타내는 그래프이다.
이하 본 발명을 실시예를 통하여 보다 상세하게 설명한다. 그러나, 이들 실시예는 본 발명을 예시적으로 설명하기 위한 것으로 본 발명의 범위가 이들 실시예에 한정되는 것은 아니다.
실시예 1.프로토카데린의 과발현을 이용한 노화 세포의 분리 또는 제거
1. 노화 세포에서프로토카데린(Protocadherin) 유전자 클러스터의 발현의 확인
(1) 노화 세포에서프로토카데린mRNA 및 단백질의 양의 확인
우선, 신생아 포피(neonatal foreskin)에서 수득된 HDF(human dermal fibroblast) M11 세포를 37℃ 및 5% CO2의 조건 하에서 고농도 글루코스, 글루타민, 및 피루베이트를 함유한 DMEM, 10%(v/v) FBS, 및 1x 페니실린/스트렙토마이신을 함유하는 배지에 배양하여 젊은 세포를 수득하였다. 젊은 세포로서 계대수 10 이하이고 분열 기간이 약 1일인 세포를 이용하였다. 준비된 젊은 세포를 6-웰 플레이트에 약 20,000 개 세포/웰의 농도로 접종하고, 37℃ 및 5% CO2의 조건 하에서 연속 배양하여 분열 기간이 약 14일인 노화 세포(계대수 52)를 준비하였다. 준비된 세포로부터 mRNA 및 단백질을 수득하였다.
젊은 세포 및 노화 세포로부터 수득된 mRNA를 하기 프라이머 세트를 사용하여 정량적 중합효소 연쇄 반응(quantitative polymerase chain reaction: qPCR)을 수행하였다.
PCDH1 정방향 프라이머: 5'-ACGCCACTCGGGTAGTGTA-3' (서열번호 1)
PCDH1 역방향 프라이머: 5'-TCACGGTCGATGGAGGTCTC-3' (서열번호 2)
PCDH9 정방향 프라이머: 5'-CTGCTCTGATTGCCTGTTTAAGG-3' (서열번호 3)
PCDH9 역방향 프라이머: 5'-ACCAGTCTGTAGACAAGGCTG-3' (서열번호 4)
PCDHA4 정방향 프라이머: 5'-ACCTGTCCATCGCGGAATC-3' (서열번호 5)
PCDHA4 역방향 프라이머: 5'-CAAGACCTTTTACCAGCTCGTC-3' (서열번호 6)
PCDHA5 정방향 프라이머: 5'-ATGCCAGATTCGCGGTTTC-3' (서열번호 7)
PCDHA5 역방향 프라이머: 5'-CTGTACCTGTTAGTTCGGGTTTT-3' (서열번호 8)
PCDHA6 정방향 프라이머: 5'-GGAAAGCAATGTCTGCTCCTC-3' (서열번호 9)
PCDHA6 역방향 프라이머: 5'-CCTCCTCGGGTACGGAGTAG-3' (서열번호 10)
PCDHA12 정방향 프라이머: 5'-ATCGGCGTAAACTCTCTTTTGAC-3' (서열번호 11)
PCDHA12 역방향 프라이머: 5'-GCTCTCTGTCCAATAACTTCCG-3' (서열번호 12)
PCDHB11 정방향 프라이머: 5'-GAGCGGGAGTTTTGTAGGCAA-3' (서열번호 13)
PCDHB11 역방향 프라이머: 5'-GTAGCACGCAAGGCTCGAT-3' (서열번호 14)
PCDHB13 정방향 프라이머: 5'-CACCCTACTAACGGAGAGACC-3' (서열번호 15)
PCDHB13 역방향 프라이머: 5'-GTCATTGACATCGGCGATCAG-3' (서열번호 16)
PCDHGA2 정방향 프라이머: 5'-CGGGCAGATTCGCTATTCTGT-3' (서열번호 17)
PCDHGA2 역방향 프라이머: 5'-CCGGTCTATCCTGTTCGCA-3' (서열번호 18)
PCDHGA3 정방향 프라이머: 5'-TTGCCTGAGTTTCCGAAATGG-3' (서열번호 19)
PCDHGA3 역방향 프라이머: 5'-TCAGACACCGAGTAGCGGAT-3' (서열번호 20)
PCDHGA7 정방향 프라이머: 5'-GGCGGGGACTACAGAGGATT-3' (서열번호 21)
PCDHGA7 역방향 프라이머: 5'-CGGAGTAGAGAATACGTCCTGC-3' (서열번호 22)
PCDHGA8 정방향 프라이머: 5'-TTTTCCTCACCCGATTTACCG-3' (서열번호 23)
PCDHGA8 역방향 프라이머: 5'-CGCTGGCTGTTACAGTAAGCA-3' (서열번호 24)
PCDHGA12 정방향 프라이머: 5'-CACCGGGACTACAAAGGGC-3' (서열번호 25)
PCDHGA12 역방향 프라이머: 5'-ATAGCGTATCTGGGTGCATCC-3' (서열번호 26)
qPCR 결과를 도 1a에 나타내었다. PCDHA4, PCDHA5, PCDHA6, 및 PCDHA12는 프로토카데린 알파 패밀리에 속하고, PCDHB11 및 PCDHB13은 프로토카데린 베타 패밀리에 속하고, PCDHGA2, PCDHGA3, PCDHGA7, PCDHGA8, 및 PCDHGA12는 프로토카데린 감마 패밀리에 속한다.
수득된 단백질을 항-프로토카데린 항체(Santa Cruz, sc-109760)을 사용하여 면역블로팅을 수행하고, 그 결과를 도 1b에 나타내었다.
도 1a 및 도 1b에 나타난 바와 같이, 프로토카데린 알파, 베타, 및 감마 패밀리의 프로토카데린 클러스터의 발현이 젊은 세포에 비해 노화 세포에서 현저하게 증가함을 확인하였다. 프로토카데린의 주된 기능은 세포 부착이므로, 노화 세포는 젊은 세포에 비해 강한 세포 부착성을 갖는다는 것을 확인하였다.
(2)DNA 메틸화 여부 확인
DNA 메틸화는 후성유전학적 마커 (epigenetic marker)로 인간 노화 시 그 변화가 예상된다. 젊은 세포와 늙은 세포에서 프로토카데린 유전자의 메틸화 여부를 확인하였다.
1.(1)에서 준비된 젊은 세포와 늙은 세포에서, 게놈 DNA를 분리하였다. DNA 메틸화 어레이(Illumina)를 사용하여 분리된 게놈 DNA 중 프로토카데린 유전자 클러스터의 DNA 메틸화 수준을 검출하였다. 검출된 DNA 메틸화 수준을 UCSC 게놈 생명정보학 브라우저를 이용하여 정렬하고, 그 결과를 도 1c에 나타내었다.
도 1c에 나타난 바와 같이, 프로토카데린 유전자는 젊은 세포에 비해 노화 세포에서 DNA 메틸화 수준이 증가하였음을 확인하였다. 따라서, 프로토카데린의 발현 수준의 증가는 프로토카데린 유전자에서 DNA 메틸화의 증가를 수반한다는 것을 확인하였다.
2. 노화 세포의 부착력의 확인
1.(1)에 기재된 바와 같이, 노화 세포가 젊은 세포에 비해 프로토카데린의 발현이 증가함을 이용하여, 노화 세포가 젊은 세포에 비해 특이적이고 강한 부착력을 갖는지 여부를 확인하였다.
노화 세포를 배양 접시에서 배양할 경우, 노화의 정도를 분열 시간(doubling time: DT)에 따라 구분하였으나, 실제로는 노화 수준이 다른 세포들이 다양하게 섞여 있다. 노화 세포가 젊은 세포에 비해 강한 부착력을 갖는지 확인하기 위해, 약 10,000 개의 노화 세포 및 젊은 세포를 각각 플라스틱 접시(Petri dish, SPL Life Sciences)에 접종하였다. 구체적으로, 계대수 7 (DT 약 1일), 계대수 34 (DT 약 3일), 계대수 47 (DT 약 10일), 및 계대수 50 (DT 약 14일)의 세포를 접종하였고, 사용된 플라스틱 접시는 세포 부착을 위해 전처리되지 않은 플레인(plain) 플라스틱 접시였다.
접종된 세포를 37℃ 및 5% CO2의 조건 하에서 약 2 시간, 약 4 시간, 약 6 시간, 및 약 8 시간 동안 배양하였다. 그 후 부착되지 않은 세포를 제거하기 위해, 상기 플라스틱 접시를 PBS로 2회 세척하고, 플라스틱 접시에 부착된 세포를 현미경 하에서 관찰 및 계수하였다. 또한, 상기 부착된 세포에 크리스탈 바이올렛(Sigma, HT90132)을 가하여 세포를 염색하였다.
플라스틱 접시에 부착된 세포의 백분율을 도 2a에 나타내고, 세포의 이미지 및 크리스탈 바이올렛 염색된 세포의 이미지를 각각 도 2b 및 도 2c에 나타내었다.
도 2a 내지 도 2c에 나타난 바와 같이, 젊은 세포는 초기 시간에는 플라스틱 접시에 거의 부착되지 않거나 장시간 배양을 하여도 소수의 세포만이 플라스틱 접시에 부착되어 자라는 것을 볼 수 있었고, 그 형태는 원래의 젊은 세포처럼 건강해 보이지는 않는 것을 관찰하였다. 반면에, 노화 세포는 노화의 수준이 증가할수록 플라스틱 접시에 부착되어 자라는 세포의 수가 많은 것을 확인하였다. 또한, 노화 세포가 젊은 세포에 비해 플라스틱 접시에 훨씬 더 잘 부착되어 자라는 것을 확인하였다.
따라서, 보통의 세포는 부착력이 약하기 때문에 세포 배양을 위해 전처리된 배양 접시를 사용해야 하지만, 노화 세포는 부착력이 강하기 때문에 전처리되지 않은 플라스틱 접시에서도 잘 붙어서 자라는 것을 확인하였다. 그러므로, 배양되는 세포를 전처리되지 않은 플라스틱 접시에 배양함으로써 노화 수준이 상이한 세포들로부터 노화 세포를 특이적으로 분리할 수 있음을 확인하였다.
3. 플라스틱 접시에서 배양된 노화 세포가 세포 배양 접시에서 자라는지 여부의 확인
2.에서 플라스틱 접시에서 약 6 시간 동안 배양된 노화 세포에 트립신(ThermoFisher Scientific, R-001-100)을 가하여 세포를 분리하였다. 분리된 세포 전부를 세포 배양 접시(Falcon Tissue Culture Dish)에 접종하고, 37℃ 및 5% CO2의 조건 하에서 약 12 시간 동안 배양하였다. 배양된 세포는 보통의 노화 세포처럼 잘 자라는 것을 확인하였다.
따라서, 플라스틱 접시를 이용하여 분리한 노화 세포를 다시 배양하여 유지할 수 있음을 확인하였다.
4. 플라스틱 접시에서 배양된 노화 세포가 노화 특성을 보유하고 있는 세포인지 여부의 확인
노화 마커로서 베타-갈락토시다제 활성을 측정하였다. 2.에서 기재된 바와 같이, 세포의 계대수 별로 세포를 플라스틱 접시에 부착시키고, 플라스틱 접시에 부착되지 않아서 부유된 세포와 부착된 세포를 별도로 수득하였다. 부유된 세포와 부착된 세포로부터 단백질을 수득하였다.
β-갈락토시다제 효소 분석 시스템(Promega, E2000)을 사용하여 수득된 단백질의 베타-갈락토시다제 활성을 측정하고, 그 결과를 도 3a에 나타내었다. 도 3a에 나타난 바와 같이, 플라스틱 접시에 부착된 세포는 부유된 세포에 비해 베타-갈락토시다제 활성이 높았다. 따라서, 분열 시간이 약 14일이나 되는 세포라 할지라도 실제로는 노화의 정도에 따라 다양하게 섞여 있음을 의미한다.
또한, 부유된 세포와 부착된 세포의 단백질을 항-PCDHGA2 항체(Santa Cruz, sc-81818) 및 항-액틴 항체(Sigma, A2228)을 사용하여 면역블로팅하였다. 부유된 세포에서 프로토카데린은 유의하게 검출되지 않았다. 부착된 세포의 프로토카데린의 강도를 덴시토미터로 측정하고 그 결과를 도 3b에 나타내었다. 도 3b에 나타난 바와 같이, 상기 부착된 세포에서 프로토카데린의 양이 증가함을 확인하였다.
그러므로, 플라스틱 접시에 부착된 노화 세포가 노화의 특성인 베타-갈락토시다제 활성을 보유하고, 프로토카데린의 발현이 증가함을 확인하였다.
5.프로토카데린shRNA를 이용한 노화 세포의 제거
노화 세포에서 프로토카데린의 발현을 억제하면 세포의 부착에 어떠한 영향을 미치는지 알아보기 위하여, 노화 세포에 프로토카데린 알파, 베타 11, 및 감마 패밀리를 표적을 하는 작은 헤어핀 RNA(small hairpin RNA: shRNA)를 주입하여 그 영향을 검증하였다.
1.에 기재된 바와 같이 젊은 세포 및 노화 세포를 준비하고, 약 10,000 개의 세포를 세포 배양 접시(Falcon Tissue Culture Dish)에 접종하였다.
접종된 세포에 프로토카데린 프로토카데린 알파, 베타 11, 및 감마 패밀리를 표적을 하는 shRNA를 가하였다. 프로토카데린 알파를 표적으로 하는, 하기 핵산 서열의 3 종의 shRNA(Dharmacon)를 혼합하여 사용하였다.
PCDHA shRNA 번호 1: 5'-CAGCAGTGGCCAACAGTAT-3' (서열번호 27)
PCDHA shRNA 번호 2: 5'-GAGCCTACTAACAGCCAAA-3' (서열번호 28)
PCDHA shRNA 번호 3: 5'-GTAACAAGACCCAGGAGAA-3' (서열번호 29)
또한, 프로토카데린 베타 11을 표적으로 하는, PCDHB11 shRNA(Dharmacon, Cat. No. RHS4533-EG56125)를 혼합하여 사용하였다.
아울러, 프로토카데린 감마를 표적으로 하는, 하기 핵산 서열의 3 종의 shRNA(Dharmacon)를 혼합하여 사용하였다.
PCDHG shRNA 번호 1: 5'-CTGGCAAGCGGGATGGCAA-3' (서열번호 30)
PCDHG shRNA 번호 2: 5'-GCAATGGCAACAAGAAGAA-3' (서열번호 31)
PCDHG shRNA 번호 3: 5'-GCAAGAAGGAGAAGAAGTA-3' (서열번호 32)
상기 shRNA를 포함하는 세포 배양 배지를 약 3일에 한번씩 갈아주면서 37℃ 및 5% CO2의 조건 하에서 약 7 일 동안 배양하였다. 배양 접시에 부착된 세포의 수를 현미경 하에서 계수하고, 세포의 생존능(%)을 도 4a에 나타내었다. 음성 대조군으로서 상기 shRNA를 가하지 않은 세포를 이용하였다.
도 4a에 나타난 바와 같이, PCDHA shRNA를 가한 노화 세포는 시간이 흐르면 세포 배양 접시에서 떨어져 결국 사멸하는 것을 확인하였다. 반면에 젊은 세포는 동일한 PCDHA shRNA에 의하여 그 영향이 미미하였다. 따라서, 프로토카데린에 의한 세포 부착은 노화 세포 특이적인 것으로 확인되었다.
또한, 노화된 세포는 세포 자살(apoptosis)를 유도하는 약물에 저항성을 보이는 것으로 알려져 있다. PCDHG shRNA를 세포에 가한 후, 세포 자살을 유도하는 약물인 스타우로스포린(Staurosporine)(Sigma, S4400)을 50 nM의 농도로 상기 세포에 가하고, 37℃ 및 5% CO2의 조건 하에서 약 24 시간 동안 배양하였다. 그 후, 배양된 세포를 계수하여 세포의 생존능(%)을 산출하고, 그 결과를 도 4b에 나타내었다. 도 4b에 나타낸 바와 같이, 세포 자살에 저항성을 갖는 노화 세포가 사멸하였다.
그러므로, 프로포카데린은 노화 세포의 유지와 생존에 그 역할을 하는 것을 확인하였다.
<110> Samsung Electronics Co., Ltd.<120> Method of isolating senescent cell with high expression of Protocadherin gene<130> PN112579KR<160> 32<170> KopatentIn 2.0<210> 1<211> 19<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDH1<400> 1acgccactcg ggtagtgta 19<210> 2<211> 20<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDH1<400> 2tcacggtcga tggaggtctc 20<210> 3<211> 23<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDH9<400> 3ctgctctgat tgcctgttta agg 23<210> 4<211> 21<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDH9<400> 4accagtctgt agacaaggct g 21<210> 5<211> 19<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHA4<400> 5acctgtccat cgcggaatc 19<210> 6<211> 22<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHA4<400> 6caagaccttt taccagctcg tc 22<210> 7<211> 19<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHA5<400> 7atgccagatt cgcggtttc 19<210> 8<211> 23<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHA5<400> 8ctgtacctgt tagttcgggt ttt 23<210> 9<211> 21<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHA6<400> 9ggaaagcaat gtctgctcct c 21<210> 10<211> 20<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHA6<400> 10cctcctcggg tacggagtag 20<210> 11<211> 23<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHA12<400> 11atcggcgtaa actctctttt gac 23<210> 12<211> 22<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHA12<400> 12gctctctgtc caataacttc cg 22<210> 13<211> 21<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHB11<400> 13gagcgggagt tttgtaggca a 21<210> 14<211> 19<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHB11<400> 14gtagcacgca aggctcgat 19<210> 15<211> 21<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHB13<400> 15caccctacta acggagagac c 21<210> 16<211> 21<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHB13<400> 16gtcattgaca tcggcgatca g 21<210> 17<211> 21<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHGA2<400> 17cgggcagatt cgctattctg t 21<210> 18<211> 19<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHGA2<400> 18ccggtctatc ctgttcgca 19<210> 19<211> 21<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHGA3<400> 19ttgcctgagt ttccgaaatg g 21<210> 20<211> 20<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHGA3<400> 20tcagacaccg agtagcggat 20<210> 21<211> 20<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHGA7<400> 21ggcggggact acagaggatt 20<210> 22<211> 22<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHGA7<400> 22cggagtagag aatacgtcct gc 22<210> 23<211> 21<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHGA8<400> 23ttttcctcac ccgatttacc g 21<210> 24<211> 21<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHGA8<400> 24cgctggctgt tacagtaagc a 21<210> 25<211> 19<212> DNA<213> Artificial Sequence<220><223> Forward primer for PCDHGA12<400> 25caccgggact acaaagggc 19<210> 26<211> 21<212> DNA<213> Artificial Sequence<220><223> Backward primer for PCDHGA12<400> 26atagcgtatc tgggtgcatc c 21<210> 27<211> 19<212> DNA<213> Artificial Sequence<220><223> PCDHA shRNA No. 1<400> 27cagcagtggc caacagtat 19<210> 28<211> 19<212> DNA<213> Artificial Sequence<220><223> PCDHA shRNA No. 2<400> 28gagcctacta acagccaaa 19<210> 29<211> 19<212> DNA<213> Artificial Sequence<220><223> PCDHA shRNA No. 3<400> 29gtaacaagac ccaggagaa 19<210> 30<211> 19<212> DNA<213> Artificial Sequence<220><223> PCDHG shRNA No. 1<400> 30ctggcaagcg ggatggcaa 19<210> 31<211> 19<212> DNA<213> Artificial Sequence<220><223> PCDHG shRNA No. 2<400> 31gcaatggcaa caagaagaa 19<210> 32<211> 19<212> DNA<213> Artificial Sequence<220><223> PCDHG shRNA No. 3<400> 32gcaagaagga gaagaagta 19
Claims (14)
- 노화 세포를 포함하는 시료를 전처리되지 않은 용기와 접촉시켜 상기 용기에 노화 세포를 부착시키는 단계; 및
상기 용기에 부착된 노화 세포를 상기 용기로부터 분리하는 단계를 포함하는, 노화 세포를 포함하는 시료로부터 노화 세포를 분리하는 방법. - 청구항 1에 있어서, 상기 노화 세포는 프로토카데린(Protocadherin)의 전령 RNA(messenger RNA: mRNA) 또는 프로토카데린 단백질이 젊은 세포에 비해 높게 발현되거나, 프로토카데린 유전자 클러스터에서 DNA 메틸화 수준이 젊은 세포에 비해 증가하거나, 베타-갈락토시다제 활성을 갖는 것이거나, 세포가 평평해지는 것이거나, 또는 이들의 조합인 것인 방법.
- 청구항 1에 있어서, 상기 시료는 노화 수준이 상이한 세포들의 이질적인 집단을 포함하는 것인 방법.
- 청구항 1에 있어서, 상기 전처리되지 않은 용기는 세포 배양을 위한 전처리가 되지 않은 것인 방법.
- 청구항 4에 있어서, 상기 세포 배양을 위한 전처리는 겔라틴, 콜라겐, 피브로넥틴, 폴리리신, 비트로넥틴, 오스테오폰틴, 히드로겔, 라미닌, 이들의 단편, 또는 이들의 모방물(mimetic)을 코팅하거나; 히드록시기 또는 카르복시기를 갖는 화합물로 용기의 표면을 개질하거나; 마트리겔을 코팅하거나; 세포외 기질 또는 그의 단편을 코팅하거나; 또는 이들의 조합인 것인 방법.
- 청구항 1에 있어서, 상기 용기는 플라스틱, 유리, 폴리스티렌, 또는 이들의 조합인 것인 방법.
- 청구항 1에 있어서, 상기 접촉은 30분 내지 24 시간 동안 수행되는 것인 방법.
- 청구항 1에 있어서, 상기 분리는 용기에 부착된 노화 세포에 트립신, 콜라게나제, 히알루로니다제, DNA 분해 효소, 엘라스타제, 파파인, 프로테아제 유형 XIV, 또는 이들의 조합을 가하는 것인 방법.
- 청구항 1에 있어서, 상기 방법은 분리된 노화 세포를 세포 배양 용기에서 배양하는 단계를 더 포함하는 것인 방법.
- 노화 세포를 포함하는 시료 또는 개체에 프로토카데린의 발현 또는 기능을 저해하는 작용제를 투여하는 단계를 포함하는, 노화 세포를 포함하는 시료 또는 개체로부터 노화 세포를 제거하는 방법.
- 청구항 10에 있어서, 프로토카데린의 발현 또는 기능을 저해하는 작용제는 작은 헤어핀 RNA(small hairpin RNA: shRNA), 짧은 간섭 RNA(short interfering RNA: siRNA), 마이크로 RNA(microRNA: miRNA), 리보자임, 안티센스 올리고뉴클레오티드, 항체 또는 그의 항원 결합 단편, 및 앱타머로 이루어진 군으로부터 선택된 것인 방법.
- 청구항 10에 있어서, 상기 개체는 노화와 연관된 증상 또는 질병에 걸리거나 노화와 연관된 증상 또는 질병에 걸릴 위험이 있는 것인 방법.
- 청구항 12에 있어서, 노화와 연관된 증상 또는 질병은 피부 주름, 상처 재생 저하, 퇴행성 뇌질환, 뇌졸중, 당뇨, 관절염, 동맥경화, 심장병, 탈모, 골다공증, 근감소증, 조로증(progeria), 리소좀 축적 질환(lysosome storage disease), 또는 이들의 조합인 것인 방법.
- 청구항 10에 있어서, 상기 투여는 국소 또는 전신 투여인 것인 방법.
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020150186785AKR20170076484A (ko) | 2015-12-24 | 2015-12-24 | 프로토카데린의 과발현을 이용한 노화 세포를 분리하는 방법 |
| US15/387,346US9994849B2 (en) | 2015-12-24 | 2016-12-21 | Method of separating senescent cells using overexpression of protocadherin |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020150186785AKR20170076484A (ko) | 2015-12-24 | 2015-12-24 | 프로토카데린의 과발현을 이용한 노화 세포를 분리하는 방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170076484Atrue KR20170076484A (ko) | 2017-07-04 |
Family
ID=59088255
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020150186785AWithdrawnKR20170076484A (ko) | 2015-12-24 | 2015-12-24 | 프로토카데린의 과발현을 이용한 노화 세포를 분리하는 방법 |
Country Status (2)
| Country | Link |
|---|---|
| US (1) | US9994849B2 (ko) |
| KR (1) | KR20170076484A (ko) |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5491069A (en) | 1994-02-18 | 1996-02-13 | The Regents Of The University Of California | Biomarkers of cell senescence |
| US20020192678A1 (en) | 2001-02-09 | 2002-12-19 | Huei-Mei Chen | Genes expressed in senescence |
| US11191789B2 (en)* | 2003-06-27 | 2021-12-07 | DePuy Synthes Products, Inc. | Cartilage and bone repair and regeneration using postpartum-derived cells |
| JP5362219B2 (ja) | 2005-08-23 | 2013-12-11 | 株式会社ファンケル | 皮膚老化マーカーとその利用技術 |
| JP5394409B2 (ja) | 2008-03-14 | 2014-01-22 | ゲノミクトリー インコーポレーテッド | 肺癌特異的メチル化マーカー遺伝子を利用した肺癌検出方法 |
| CA2754392A1 (en) | 2009-03-11 | 2010-09-16 | Nestec S.A. | Tissue-specific aging biomarkers |
| KR101093903B1 (ko) | 2009-06-29 | 2011-12-13 | 영남대학교 산학협력단 | 노화 진단방법 및 노화 진단용 바이오마커 |
| US9409873B2 (en)* | 2009-11-30 | 2016-08-09 | Senex Biotechnology Inc. | CDKI pathway inhibitors and uses thereof |
| US20130040844A1 (en) | 2010-01-28 | 2013-02-14 | The Board Of Trustees Of The Leland Stanford Junior University | Biomarkers of aging for detection and treatment of disorders |
| WO2012075243A2 (en)* | 2010-12-01 | 2012-06-07 | The University Of North Carolina At Chapel Hill | Methods and compositions for targeting sites of neovascular growth |
| KR101508129B1 (ko) | 2013-06-18 | 2015-04-06 | 한국원자력의학원 | 세포 노화 진단용 마커 및 이의 용도 |
| KR102360072B1 (ko) | 2014-12-08 | 2022-02-08 | 삼성전자주식회사 | 미세입자 분리 장치 |
- 2015
- 2015-12-24KRKR1020150186785Apatent/KR20170076484A/konot_activeWithdrawn
- 2016
- 2016-12-21USUS15/387,346patent/US9994849B2/enactiveActive
Also Published As
| Publication number | Publication date |
|---|---|
| US20170183657A1 (en) | 2017-06-29 |
| US9994849B2 (en) | 2018-06-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2024073546A (ja) | 幹細胞微粒子 | |
| US8912158B2 (en) | Method for treating myocardial infarct | |
| US20160194631A1 (en) | Methods for Modulation of Autophagy Through the Modulation of Autophagy-Inhibiting Gene Products | |
| US20130150256A1 (en) | Novel micrornas for the detection and isolation of human embryonic stem cell-derived cardiac cell types | |
| CN102656268A (zh) | 普适性抗癌药物及疫苗的开发 | |
| JP2013532973A (ja) | Rna分子およびその使用 | |
| US20250136936A1 (en) | Nucleic acid modified biological cell with expansion-dependent gene expression | |
| CA3096274A1 (en) | Compositions and methods for somatic cell reprogramming and modulating imprinting | |
| CN105143459B (zh) | 新颖治疗用抗癌药的制造与使用 | |
| US20190085335A1 (en) | In-vitro induction of adult stem cell expansion and derivation | |
| WO2015088162A1 (ko) | 줄기세포로부터 연골세포로의 분화 촉진용 조성물 | |
| KR20170076484A (ko) | 프로토카데린의 과발현을 이용한 노화 세포를 분리하는 방법 | |
| US20170211091A1 (en) | Methods for generating induced pluripotent stem cells | |
| TW201629227A (zh) | 新穎治療用抗癌藥的製造與使用 | |
| JP2023515681A (ja) | 線維症を予防するための線維芽細胞の活性化調節 | |
| EP3822350A1 (en) | Rna interference-inducing nucleic acid inhibiting noncanonical targets of micro rna, and use for same | |
| KR20240020281A (ko) | 세포 재프로그래밍을 위한 방법 및 조성물 | |
| WO2019086515A1 (en) | Skeletal muscle differentiation of mesodermal ipsc derived progenitors | |
| WO2019036375A1 (en) | CARDIOGENIC MESODERMA TRAINING REGULATORS | |
| Li et al. | Reactivation of the progenitor gene Trim71 enhances the mitotic and hair cell-forming potential of cochlear supporting cells | |
| Guanzon | Investigating the role of microRNAs in hypertrophic and keloid scar formation | |
| Allan et al. | Transient gene melting governs the timing of oligodendrocyte maturation | |
| Lopez | Investigating the Molecular Mechanisms Involved in the Mechanosensation of Neural Stem Cell Differentiation | |
| WO2025163033A1 (en) | Compounds for use in the treatment of disorders or diseases through modulation of transcription factor gata4 activity | |
| WO2024249893A1 (en) | Generation of mature neurons differentiated from pluripotent stem cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application | Patent event code:PA01091R01D Comment text:Patent Application Patent event date:20151224 | |
| PG1501 | Laying open of application | ||
| A201 | Request for examination | ||
| PA0201 | Request for examination | Patent event code:PA02012R01D Patent event date:20201218 Comment text:Request for Examination of Application Patent event code:PA02011R01I Patent event date:20151224 Comment text:Patent Application | |
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | Comment text:Notification of reason for refusal Patent event date:20221018 Patent event code:PE09021S01D | |
| PC1202 | Submission of document of withdrawal before decision of registration | Comment text:[Withdrawal of Procedure relating to Patent, etc.] Withdrawal (Abandonment) Patent event code:PC12021R01D Patent event date:20221212 | |
| WITB | Written withdrawal of application |