KR20140103389A - Bone regenerating polymer scaffold - Google Patents
Bone regenerating polymer scaffoldDownload PDFInfo
- Publication number
- KR20140103389A KR20140103389AKR1020130016486AKR20130016486AKR20140103389AKR 20140103389 AKR20140103389 AKR 20140103389AKR 1020130016486 AKR1020130016486 AKR 1020130016486AKR 20130016486 AKR20130016486 AKR 20130016486AKR 20140103389 AKR20140103389 AKR 20140103389A
- Authority
- KR
- South Korea
- Prior art keywords
- scaffold
- vegf
- poly
- calcium phosphate
- phosphate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/56—Porous materials, e.g. foams or sponges
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/02—Inorganic materials
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/02—Inorganic materials
- A61L27/10—Ceramics or glasses
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/02—Inorganic materials
- A61L27/12—Phosphorus-containing materials, e.g. apatite
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- C—CHEMISTRY; METALLURGY
- C04—CEMENTS; CONCRETE; ARTIFICIAL STONE; CERAMICS; REFRACTORIES
- C04B—LIME, MAGNESIA; SLAG; CEMENTS; COMPOSITIONS THEREOF, e.g. MORTARS, CONCRETE OR LIKE BUILDING MATERIALS; ARTIFICIAL STONE; CERAMICS; REFRACTORIES; TREATMENT OF NATURAL STONE
- C04B28/00—Compositions of mortars, concrete or artificial stone, containing inorganic binders or the reaction product of an inorganic and an organic binder, e.g. polycarboxylate cements
- C04B28/34—Compositions of mortars, concrete or artificial stone, containing inorganic binders or the reaction product of an inorganic and an organic binder, e.g. polycarboxylate cements containing cold phosphate binders
- C04B28/344—Compositions of mortars, concrete or artificial stone, containing inorganic binders or the reaction product of an inorganic and an organic binder, e.g. polycarboxylate cements containing cold phosphate binders the phosphate binder being present in the starting composition solely as one or more phosphates
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/02—Materials or treatment for tissue regeneration for reconstruction of bones; weight-bearing implants
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Dermatology (AREA)
- Medicinal Chemistry (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Transplantation (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Inorganic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Ceramic Engineering (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Materials Engineering (AREA)
- Structural Engineering (AREA)
- Organic Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Materials For Medical Uses (AREA)
Abstract
Description
Translated fromKorean본 발명은 인산칼슘계 세라믹으로 표면이 미네랄화되고, 상기 인산칼슘계 세라믹은 VEGF (Vascularendothelial Growth Factor)와 결합하고 있는, 골 재생용 고분자 스캐폴드 및 이의 제조방법에 관한 것이다.
The present invention relates to a scaffold for bone regeneration wherein the surface is mineralized by calcium phosphate type ceramic and the calcium phosphate type ceramic is combined with VEGF (Vascularendothelial Growth Factor) and a method for producing the scaffold.
골 조직은 인체의 골격을 유지시키는 중요 조직으로 골 조직 재생을 위해서 다양한 재료와 형태의 골 조직 대체용, 재생용 골 이식재가 연구 개발되고 있다. 골 이식재의 경우 골 치유기전에 따라 골 형성 재료, 골 전도성 재료, 골 유도성 재로로 분류할 수 있으며, 골 이식(transplataion)이나 매식(implantation)에 사용되는 이식재에 따라 자가이식, 동종이식, 타종이식 등의 방법을 주로 사용하고 있다. 이중 면역반응을 최소화할 수 있는 방법은 자가이식으로서, 자가골을 이용하여 골 손상부위에 이식을 할 경우 면역반응이 최소화되어 안정적인 골 조직 재생이 가능한 장점이 있다. 그러나, 자가골의 채취로 인한 다른 부위의 2차 골 손실과 회복기간 등의 불편을 가지고 있으며 양이 매우 한정되어 있다는 단점이 있다. 이를 보완하기 위하여 다른 사람의 골을 사용하는 타종이식이 있으나, 이는 자가골과 달리 많은 면역반응을 일으키고, 가격도 매우 비싸다는 단점이 있다. 따라서, 면역반응을 최소화하면서 많은 사람들에게 이용되기 위해 합성골을 제조하여 이식하고자 하는 골 조직 공학 연구가 많이 진행되고 있다.
BACKGROUND ART Bone tissue is an important tissue for maintaining the skeleton of human body, and various materials and forms of bone tissue replacement and regenerative bone graft materials have been researched and developed for bone tissue regeneration. Bone graft materials can be classified into osteogenic materials, osteoconductive materials, and bone-inducing materials according to the healing mechanism. According to the graft materials used for transplating or implantation, autografts, allografts, And transplantation. As a method of minimizing the dual immune response, autologous bone grafting using autogenous bone minimizes the immune response when transplanted to the site of bone injury, thereby enabling stable bone tissue regeneration. However, it has disadvantages such as secondary bone loss and recovery period of other parts due to extraction of autogenous bone, and has a disadvantage that its amount is very limited. To compensate for this, there are other transplantations that use other people 's bone. However, unlike autogenous bone, it causes a lot of immune reactions and is very expensive. Therefore, studies on bone tissue engineering to synthesize and transplant synthetic bone to be used by many people while minimizing the immune response are under way.
골 조직 공학에 적용하기 위한 스캐폴드는 숙주 조직의 최적화된 조직 형성을 위해 핵심적인 몇 가지 조건을 만족해야 한다. 이 조건은 세포 친화력, 영양분과 산소가 투과하기 위한 적절한 공극률, 세포 부착 및 분화를 촉진시키기 위한 계면 활성 등을 포함한다. 또한, 이상적으로 스캐폴드는 연속적으로 분해되어 숙주 세포에 의해 대체되어야 한다. 콜라겐과 같은 세포외 기질(ECM) 분자가 적절한 스캐폴드 재료이다. 그러나, 폴리락트산(PLA), 폴리카프로락톤(PCL) 및 이의 공중합체와 같은 합성 분해성 플라스틱은 자연발생 물질에 비하여 정확한 가공이 가능하고, 보다 경제적이어서 임상적으로 널리 사용할 수 있다는 장점이 있다.
The scaffold for application to bone tissue engineering must meet several key requirements for optimized tissue formation of the host tissue. These conditions include cell affinity, proper porosity for nutrients and oxygen permeation, and surface activity to promote cell attachment and differentiation. In addition, ideally the scaffold should be degraded and replaced by host cells in succession. Extracellular matrix (ECM) molecules such as collagen are suitable scaffold materials. However, synthetic degradable plastics such as polylactic acid (PLA), polycaprolactone (PCL), and copolymers thereof are advantageous in that they can be processed more accurately than naturally occurring materials, are more economical, and can be widely used clinically.
그러나, 합성 생체 고분자는 낮은 골 생체활성, 높은 소수성, 생체 단백질 및 세포에 대한 낮은 친화력을 가지기 때문에, 합성 생체고분자 스캐폴드는 골 조직 공학에 적합하도록 최적화될 필요가 있다. 성장인자와 같은 치료적인 분자를 로딩하고 전달하는 능력을 가진 스캐폴드를 설계하는 것은 조직 재생 능력을 강화시킨다. 이러한 목적을 위하여, 스캐폴드 표면 또는 이들의 내부에 성장 인자를 흡착/결합시키는 것을 수반하는 많은 방법이 개발되어 왔다(Ziegler J et al.,J BiomedMaterRes, 2002, 59, 422-428; King WJ et al.,AdvDrugDelivRev, 2012, 64, 1239-1256; Yun YR et al.,JTissueEng, 2010, 1, 218142; Wenk E et al.,Biomaterials, 2009, 30, 2571-2581).
However, because synthetic biopolymers have low bone bioactivity, high hydrophobicity, low affinity for bioproteins and cells, synthetic biopolymer scaffolds need to be optimized for bone tissue engineering. Designing a scaffold with the ability to load and deliver therapeutic molecules, such as growth factors, enhances tissue regeneration capabilities. For this purpose, many methods have been developed involving adsorption / attachment of growth factors to or on the scaffold surface (Ziegler J et al.,J BiomedMaterRes ., 2002,59, 422-428; King WJ et al.,AdvDrugDelivRev , 2012, 64, 1239-1256; Yun YR et al.,JTissueEng , 2010, 1, 218142; Wenk E et al.,Biomaterials , 2009, 30, 2571-2581).
일반적으로, 표면에 흡착된 성장인자는 약한 정전기적 상호작용으로 인하여 상당한 초기 버스트(burst) 효과를 나타낸다. 반면, 성장인자가 스캐폴드의 내부에 결합되는 경우, 이들은 더욱 잘 고정될 수 있고 더욱 우수한 서방형 방출을 나타낼 수 있다. pH, 용매 종류, 온도 및 이온 강도를 포함하는 스캐폴딩 조건은 성장인자의 결합에 영향을 주는 것으로 알려져 있다(Fransson J et al.,I.PharmRes, 1997, 14, 606-612; van de Weert M et al.,PharmRes, 2000, 17, 1159-1167). 이와 같이 스캐폴드 내 성장인자의 로딩에 관한 문제점과 함께, 전달 방식이 최적의 생물학적 기능을 얻기 위하여 특히 중요하다.
Generally, surface-adsorbed growth factors exhibit a considerable initial burst effect due to weak electrostatic interactions. On the other hand, when growth factors are bound to the interior of the scaffold they can be more immobilized and exhibit better sustained release. Scaffolding conditions, including pH, solvent type, temperature and ionic strength, are known to affect binding of growth factors (Fransson J et al.,I.PharmRes , 1997,14, 606-612; van de Weert M et al.,PharmRes . 2000, 17, 1159-1167). As such, along with problems with loading of the growth factor in the scaffold, the delivery mode is particularly important for obtaining optimal biological function.
이러한 배경하에 본 발명자들은, 고분자 스캐폴드의 표면을 인산칼슘계 세라믹으로 미네랄화하고, 상기 인산칼슘계 세라믹에 VEGF (Vascularendothelial Growth Factor)를 연결시키는 경우, VEGF를 스캐폴드에 고용량으로 강하게 결합시킬 수 있는 동시에 장기 지속 방출을 제공하여, 골 형성 및 재생을 효과적으로 유도할 수 있는 것을 확인하고 본 발명을 완성하였다.
Under these circumstances, the present inventors have found that when a surface of a polymer scaffold is mineralized with a calcium phosphate ceramic and VEGF (Vascularendothelial Growth Factor) is connected to the calcium phosphate-based ceramic, VEGF can be strongly bound to a scaffold And at the same time provides long-term sustained release, thereby effectively inducing bone formation and regeneration, thereby completing the present invention.
본 발명은 VEGF를 담지한 골 재생용 고분자 스캐폴드에 있어서, 상기 스캐폴드는 인산칼슘계 세라믹으로 표면이 미네랄화되고, 상기 인산칼슘계 세라믹은 VEGF (Vascularendothelial Growth Factor)와 결합하고 있는 골 재생용 고분자 스캐폴드를 제공하기 위한 것이다.The present invention relates to a polymer scaffold for bone regeneration carrying VEGF, wherein the scaffold is made of a calcium phosphate-based ceramic and the surface of the calcium phosphate-based ceramic is mineralized, and the calcium phosphate-based ceramic is used for bone regeneration combined with VEGF (Vascularendothelial Growth Factor) To provide a polymer scaffold.
또한, 본 발명은 1) 생체 적합성 고분자 스캐폴드를 제조하는 단계; 2) 상기 스캐폴드의 표면을 인산칼슘계 세라믹으로 미네랄화 하는 단계; 및 3) 미네랄화된 스캐폴드에 VEGF (Vascularendothelial Growth Factor)를 담지시키는 단계를 포함하는 VEGF 서방출성 골 재생용 스캐폴드의 제조방법을 제공하기 위한 것이다.
The present invention also provides a process for preparing a biocompatible polymer scaffold comprising: 1) preparing a biocompatible polymer scaffold; 2) mineralizing the surface of the scaffold with calcium phosphate-based ceramics; And 3) supporting VEGF (Vascularendothelial Growth Factor) on the mineralized scaffold. The present invention also provides a method for producing a scaffold for VEGF sustained release bone regeneration.
상기 과제를 해결하기 위하여, 본 발명은 VEGF (Vascularendothelial Growth Factor)를 담지한 고분자 스캐폴드에 있어서, 상기 스캐폴드는 인산칼슘계 세라믹으로 표면이 미네랄화되고, 상기 인산칼슘계 세라믹은 VEGF (Vascularendothelial Growth Factor)와 결합하고 있는 골 재생용 고분자 스캐폴드를 제공한다.
In order to solve the above problems, the present invention provides a polymer scaffold carrying VEGF (Vascularendothelial Growth Factor), wherein the scaffold is made of calcium phosphate ceramics and the surface of the calcium phosphate ceramics is VEGF (Vascularendothelial Growth Factor The present invention provides a polymer scaffold for bone regeneration,
본 발명에서 사용된 용어 '스캐폴드'는, 생체내에서 손상된 장기나 조직의 일부를 대체하며 이들의 기능을 보완 또는 대신할 수 있는 물질을 의미하며, 구체적으로 상기 고분자 스캐폴드는 스캐폴드가 기능과 역할을 충분히 수행할 때까지 유지된 후 생체 내에서 완전히 분해되어 없어질 수 있는 생분해성 고분자 소재가 바람직하다.The term " scaffold " as used herein refers to a substance that can replace or partially replace damaged organs or tissues in vivo, and specifically, the polymer scaffold is a scaffold that functions as a scaffold And a biodegradable polymer material that can be completely decomposed and eliminated in vivo after being maintained until the role is sufficiently performed.
상기 고분자 스캐폴드는 PGA 단사를 이용한 부직포, 가열과 생분해성 코팅을 이용한 PGA 부직포 결합, 염 석출법(Particulate leaching), 용액 캐스팅법(Solution casting), 분사 캐스팅법(Spray casting), 용융 압축 몰딩법(Melt and compression molding), 멤브레닝 적층법(Membrane lamination), 겔 캐스팅법(Gel casting), 고압 가스 팽창법(High pressure gas saturation), 상분리법(Phase separation), 고분자 블렌드법(Polymer blending), 유화동결건조법(Emulsion freeze drying) 등 다양한 방법으로 제조할 수 있으며, 이에 한정하지 않는다. 제조된 고분자 스캐폴드는 조절된 크기와 배열의 기공을 가진 3차원 구조를 가지는 것을 특징으로 한다.The polymer scaffold may be formed by a nonwoven fabric using a PGA monolith, a PGA nonwoven fabric using a heating and biodegradable coating, a Particulate leaching method, a solution casting method, a spray casting method, a melt compression molding method (Melt and Compression Molding), Membrane Lamination, Gel Casting, High Pressure Gas Saturation, Phase Separation, Polymer Blending, , Emulsion freeze drying, and the like, but the present invention is not limited thereto. The fabricated polymer scaffold is characterized by having a three-dimensional structure with pores of controlled size and arrangement.
상기 생분해성 고분자로는 폴리(글리콜산), 폴리(락트산), 폴리(D,L-락트산-co-글리콜산), 폴리(L-락타이드-코-D, L-락타이드), 폴리(히드록시부티레이트), 폴리(히드록시발러레이트), 폴리(발레로락톤), 폴리(카프로락톤), 폴리디옥사논, 이들의 공중합체 및 이들의 혼합물로 구성된 군으로부터 선택되는 하나 이상일 수 있으며, 이에 제한되는 것은 아니다. 바람직하게는 폴리(락트산)일 수 있다.
Examples of the biodegradable polymer include poly (glycolic acid), poly (lactic acid), poly (D, L-lactic acid-co-glycolic acid), poly (L- lactide- (Hydroxybutyrate), poly (hydroxyvalerate), poly (valerolactone), poly (caprolactone), polydioxanone, copolymers thereof, and mixtures thereof, But is not limited thereto. Preferably poly (lactic acid).
구체적인 일 실시예에서, 스캐폴드는 폴리락트산을 이용한 용매 캐스팅법 및 염-용출(salt leaching)법으로 성형하였으며, 제조된 스캐폴드는 스캐폴드를 관통하는 구멍이 잘 발달된 다공성 몰폴로지를 가지는 것을 확인하였다(도 1의 (a)).
In one specific embodiment, the scaffolds were formed by solvent casting methods using polylactic acid and salt leaching, and the scaffolds produced were characterized by having a well-developed porous morphology through the scaffold (Fig. 1 (a)).
본 발명의 고분자 스캐폴드는 그 표면이 생체적합성 무기물인 인산칼슘계 세라믹으로 미네랄화됨으로써, 우수한 생체적합성, 세포적합성, VEGF 로딩 용량의 증가 및 장기 지속 방출성을 갖도록 개질된다. 그 결과, 세포의 부착 및 증식이 촉진되어 골 조직의 재생을 효과적으로 도모할 수 있다.
The polymer scaffold of the present invention is modified to have superior biocompatibility, cell suitability, increased VEGF loading capacity, and long-term sustained release by mineralizing the surface of the polymer scaffold with a biocompatible calcium phosphate ceramics. As a result, cell adhesion and proliferation are promoted, and regeneration of bone tissue can be effectively achieved.
본 발명에서 사용된 용어 '인산칼슘계 세라믹'은, 분말형 고체상의 인산칼슘 화합물 또는 칼슘 및/또는 인산염 화합물의 혼합물로 구성되는 세라믹을 의미하는 것으로, 칼슘과 인의 비율에 따라 다양하게 나뉠 수 있다. 상기 인산칼슘계 세라믹은 산소와 반응하여 화학적으로 안정하게 변한 세라믹으로서 생체불활성으로 체내에서 생화학적 반응이 없기 때문에 골조직의 손상부위 대체로서 유용하게 사용될 수 있는 장점이 있다.The term "calcium phosphate-based ceramic" used in the present invention means a ceramic composed of a powdery solid calcium phosphate compound or a mixture of calcium and / or phosphate compounds, and can be variously divided according to the ratio of calcium and phosphorus . The calcium phosphate-based ceramic is chemically stable and reacts with oxygen, and is biologically inactive and has no biochemical reaction in the body. Therefore, it is advantageously used as a substitute for a damaged region of a bone tissue.
이러한 인산칼슘계 세라믹은 이 분야에서 공지된 인산칼슘계 무기물일 수 있다. 예시적으로 모노칼슘 포스페이트, 디칼슘 포스페이트, 트리칼슘 포스페이트, 테트라칼슘 포스페이트, 하이드록시 아파타이트 등일 수 있다. 인산칼슘계 세라믹의 종류는 표면 개질시 칼슘 이온 및 인산 이온의 농도, 처리조건 또는 처리시간을 조절하여 적절하게 결정할 수 있다.Such calcium phosphate-based ceramics may be a calcium phosphate-based inorganic substance known in the art. Illustratively, it may be monocalcium phosphate, dicalcium phosphate, tricalcium phosphate, tetracalcium phosphate, hydroxyapatite, and the like. The type of the calcium phosphate-based ceramics can be appropriately determined by adjusting the concentration of the calcium ions and the phosphate ions, the treatment conditions or the treatment time during the surface modification.
바람직하게 본 발명의 고분자 스캐폴드는 하이드록시아파타이트로 미네랄화된다. Ca10(PO4)6(OH)2 구조를 갖는 하이드록시아파타이트의 Ca/P 몰비는 1.67으로 인체의 뼈와 가장 유사한 화학구조를 가지고 있다. 따라서, 하이드록시아파타이트 세라믹으로 인체 내 이식되는 고분자 스캐폴드를 미네랄화하여 표면 개질하는 경우, 이식 주위의 뼈나 조직과의 접착력 및 안정성이 우수한 이점이 있다.
Preferably, the polymer scaffold of the present invention is mineralized with hydroxyapatite. The Ca / P molar ratio of hydroxyapatite having the Ca10 (PO4 )6 (OH)2 structure is 1.67, which has the chemical structure most similar to the human bone. Therefore, when the hydroxyapatite ceramic is surface-modified by mineralizing the polymer scaffold implanted in the human body, there is an advantage of excellent adhesion and stability to bone or tissue around the implant.
생체재료로서 사용되는 고분자는 다양한 형태로 제작이 용이하나, 생체 불활성이거나, 생체 활성이 적은 제한적인 단점이 있다. 이에, 본 발명에 따른 고분자 스캐폴드는 그 표면을 인산칼슘계 세라믹으로 미네랄화하는 것을 특징으로 한다.The polymer used as a biomaterial is easy to produce in various forms, but has a disadvantage in that it is inactivated in vivo or less in biological activity. Accordingly, the polymer scaffold according to the present invention is characterized in that its surface is mineralized with calcium phosphate-based ceramics.
상기 미네랄화는 고분자 스캐폴드의 구조를 손상시키지 않으면서, 인산칼슘계 세라믹으로 표면을 코팅하여 고분자의 표면에 세포가 잘 부착할 수 있도록 개질하는 것을 의미하며, 구체적으로는 고분자 스캐폴드 표면에 인산칼슘계 세라믹을 부착하거나 침투하도록 하는 즉, 포함하는 개념을 의미하는 것으로 이해될 수 있다.The mineralization means that the surface is coated with a calcium phosphate-based ceramic without damaging the structure of the polymer scaffold, thereby modifying the surface of the polymer so that the cells adhere well to the surface of the polymer. Specifically, Calcium-based ceramics can be adhered to or impregnated with calcium-based ceramics.
상기 인산칼슘계 세라믹은 조직세포의 유착과 증식이 잘 일어나고 분화된 세포의 기능이 보전되며, 체내 이식 후에도 주위 조직과 잘 융화되어 염증 반응을 유발하지 않는 생체적합성 인산칼슘계 무기물이 형성되도록 한다. 또한, 상기 인산칼슘계 세라믹은 VEGF와 결합하여 VEGF의 로딩율을 높이고, 방출양상을 서방화하여 장기 지속 방출이 가능하도록 한다.
The calcium phosphate-based ceramics are capable of forming a biocompatible calcium phosphate-based mineral that does not cause an inflammatory reaction even after adhesion and proliferation of the tissue cells and the function of the differentiated cells is preserved. In addition, the calcium phosphate ceramics binds with VEGF to increase the loading rate of VEGF, thereby allowing sustained release by sustaining the release pattern.
본 발명에서 사용된 용어 'VEGF (Vascularendothelial growth factor)'는, 혈관내피생장인자라고도 불리며 배양하수체 folliculo-stellate 세포 상층액에서 혈관내피세포에 대한 생장활성을 지표로 하여 분리되는 폴리펩티드를 의미한다. 상기 VEGF는 대식세포, 평활근세포, 종양세포 등 여러 세포에서 생산되며, 강력한 EC 미토젠으로서, 골 형성(osteogenesis)와 혈관신생(angiogenesis)에 중요한 역할을 하는 것으로 알려져 있다(Leach JK, Kaigler D, Wang Z, Krebsbach PH, Mooney DJ. Coating of VEGF-releasing scaffolds with bioactive glass for angiogenesis and bone regeneration. Biomaterials 2006;27:3249-3255). 또한 VEGF의 국소 전달은 neovascularization에 이어서, 골 턴오버(bone turnover), 조골세포 이동(osteoblast migration)과 미네랄화를 촉진시키는 것으로 알려져 있다(Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev 2004;25:581-611).
The term " VEGF (Vascularendothelial growth factor) " used in the present invention refers to a polypeptide which is also called a vascular endothelial growth factor and which is isolated by using the growth activity of vascular endothelial cells as an index in the culture supernatant of folliculo-stellate cells in culture. VEGF is known to play an important role in osteogenesis and angiogenesis as a strong EC mitogen produced in various cells such as macrophages, smooth muscle cells and tumor cells (Leach JK, Kaigler D, Wang Z, Krebsbach PH, Mooney DJ. Coating of VEGF-releasing scaffolds with bioactive glass for angiogenesis and bone regeneration. Biomaterials 2006; 27: 3249-3255). Local delivery of VEGF is also known to promote bone turnover, osteoblast migration and mineralization following neovascularization (Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev 2004; 25: 581-611).
상기 VEGF는 본 발명에 따른 고분자 스캐폴드에 담지되어 있으며, 특히 인산칼슘계 세라믹과 결합되어 있는 것을 특징으로 한다. 인산칼슘계 세라믹으로 미네랄화된 표면은 VEGF와의 결합에 있어서 매우 높은 친화성을 나타내며, 특히 이들 결합은 주로 많은 칼슘과 인 이온의 이온성 잔기에 의한 강력한 많은 이온 결합 자리와 VEGF가 연결되는 것에 의한다.
The VEGF is supported on the polymer scaffold according to the present invention, and is particularly characterized in that it is bonded to a calcium phosphate-based ceramic. Mineralized surfaces of calcium phosphate ceramics exhibit very high affinity for binding to VEGF, and these bonds are mainly due to the presence of many strong ionic sites due to the ionic residues of many calcium and phosphorus ions and VEGF All.
구체적인 일 실시예에서, CaP로 표면 미네랄화된 고분자 스캐폴드에 VEGF를 로딩시켜 VEGF 방출양상을 확인한 결과 약 한달 가량 지속적으로 VEGF가 방출되는 것을 확인할 수 있었다(도 2).
In a specific example, VEGF was loaded into a polymer scaffold surface-mineralized with CaP to confirm the VEGF release pattern, and it was confirmed that VEGF was continuously released for about one month (FIG. 2).
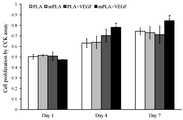
또한, 구체적인 다른 실시예에서, CaP로 표면 미네랄화한 고분자 스캐폴드와 별도의 처리를 하지 않은 고분자 스캐폴드의 세포 증식 수준을 확인한 결과, 7일째 현저하게 세포 증식이 높아지는 것을 확인할 수 있었다(도 3).
In another specific example, the cell proliferation level of the polymer scaffold surface-mineralized with CaP and that of the polymer scaffold not treated separately were confirmed, and it was confirmed that the cell proliferation was remarkably increased on the 7th day (FIG. 3 ).
한편, 상기 과제를 해결하기 위하여 본 발명은 1) 생체 적합성 고분자 스캐폴드를 제조하는 단계; 2) 상기 스캐폴드의 표면을 인산칼슘계 세라믹으로 미네랄화 하는 단계; 및 3) 미네랄화된 스캐폴드에 VEGF (Vascularendothelial Growth Factor)를 담지시키는 단계를 포함하는, 골 재생용 스캐폴드의 제조방법을 제공한다.
In order to solve the above problems, the present invention provides a method for preparing a biocompatible polymer scaffold comprising: 1) preparing a biocompatible polymer scaffold; 2) mineralizing the surface of the scaffold with calcium phosphate-based ceramics; And 3) carrying Vascularendothelial Growth Factor (VEGF) on the mineralized scaffold.
상기 1) 단계는 생체 적합성 고분자 스캐폴드를 제조하는 단계이다. 이때 사용되는 고분자 소재로는 상기에서 설명한 바와 같으며, 바람직하게는 폴리락트산을 사용할 수 있다. 제조된 고분자 스캐폴드는 조절된 크기와 배열의 기공을 가진 3차원 구조를 가진다.
The step 1) is a step of preparing a biocompatible polymer scaffold. The polymer material used herein is as described above, and polylactic acid can be preferably used. The prepared polymer scaffold has a three-dimensional structure with pores of controlled size and arrangement.
상기 2) 단계는 스캐폴드 표면을 인산칼슘계 세라믹으로 미네랄화하는 단계이다. 상기 미네랄화에 의해 스캐폴드의 표면이 개질됨으로써, 스캐폴드의 생리활성이 더욱 증가하며, 나아가 VEGF와 같은 생리활성물질과 결합하여 보다 높은 로딩률을 가질 수 있도록 하며 지속적인 제어방출을 가능하도록 한다.
Step 2) is a step of mineralizing the scaffold surface with a calcium phosphate-based ceramic. The surface of the scaffold is modified by the mineralization to further increase the physiological activity of the scaffold. Further, the scaffold can be combined with a physiologically active substance such as VEGF to have a higher loading rate and enable continuous controlled release.
상기 미네랄화는 스캐폴드를 칼슘 및 인산염의 이온 용액 중에 침지시켜 미네랄 핵을 형성 및 성장시키는 것으로 이루어진다.The mineralization consists of immersing the scaffold in an ionic solution of calcium and phosphate to form and grow mineral nuclei.
상기 칼슘 및 인산염의 이온 용액은 스캐폴드를 미네랄화시킬 목적으로 사용하는 미네랄화 용액으로서, Na+, K+, Mg2+, Ca2+, Cl-, HCO3-, HPO42-, SO42-를 포함하는 유사체액을 사용할 수 있으며, 이에 제한되지 않는다. 바람직하게는 CaCl2 및 NaHPO4 용액을 사용할 수 있다.As mineralization solution ionic solution of the calcium and phosphate is used for the purpose of mineralization ascaffold, Na +, K +, Mg 2 +, Ca 2 +, Cl -, HCO 3 -,
상기 미네랄 핵의 형성은 1 내지 10℃에서 촉진시키고, 미네랄 핵의 성장은 온도를 35 내지 40℃까지 증가시켜 유도할 수 있다. 바람직하게, 미네랄 핵의 형성은 4℃에서 촉진시킬 수 있으며, 핵의 성장은 37℃에서 유도할 수 있다. 또한, 바람직하게, 상기 칼슘 및 인산염 이온 용액 중의 침지시간은 12시간 내지 36시간일 수 있으며, 보다 바람직하게는 24시간일 수 있다.
The formation of the mineral nuclei can be promoted at 1 to 10 ° C and the growth of mineral nuclei can be induced by increasing the temperature to 35 to 40 ° C. Preferably, the formation of mineral nuclei can be promoted at 4 캜, and the growth of nuclei can be induced at 37 캜. Further, preferably, the immersion time in the calcium and phosphate ion solution may be 12 hours to 36 hours, more preferably 24 hours.
상기 3) 단계는 표면이 인산칼슘계 세라믹으로 미네랄화된 스캐폴드에 VEGF (Vascularendothelial Growth Factor) 용액을 침지시켜, 고분자 스캐폴드에 VEGF를 담지시키는 단계이다. 상기 담지는 VEGF가 고분자 스캐폴드에 부착하거나, 침투 또는 포함되는 개념을 의미하는 것이고, 바람직하게는 표면의 인산칼슘계 세라믹과 연결, 결합되는 것을 의미한다.
In step 3), VEGF (Vascularendothelial Growth Factor) solution is immersed in a scaffold whose surface is mineralized with a calcium phosphate-based ceramic to support VEGF on the polymer scaffold. The support means the concept that VEGF attaches to, penetrates into, or is contained in the polymer scaffold, and is preferably connected to and bonded to the surface calcium phosphate ceramics.
상기 침지는 구체적으로 VEGF가 포함된 용액에 일정시간 미네랄화된 스캐폴드를 담가 VEGF가 고분자 스캐폴드에 부착, 침투하면서 동시에 인산칼슘계 세라믹에 연결, 결합되도록 한다. 담지 시간은 특별히 한정할 필요는 없으며 VEGF가 잘 부착가능한 시간이면 족하다.
Specifically, the immersion is carried out by immersing the scaffold minerally for a predetermined time in a solution containing VEGF, thereby allowing VEGF to attach and bind to the polymer scaffold while simultaneously connecting to the calcium phosphate-based ceramic. The holding time is not particularly limited, and it is sufficient that the VEGF can be adhered well.
상기 제조방법에 따라 제조된 스캐폴드는 표면의 인산칼슘계 세라믹으로 인하여 고용량의 VEGF를 담지할 수 있으며 동시에 VEGF의 방출을 서방형으로 조절하여 장기간 방출이 가능한 골 재생용 소재로 유용하게 사용될 수 있다.
The scaffold prepared according to the above manufacturing method can be used as a bone regeneration material capable of supporting a high dose of VEGF due to the calcium phosphate ceramic on the surface and releasing VEGF to a sustained release form for long term release .
본 발명에 따른 골 재생용 고분자 스캐폴드는 표면이 인산칼슘계 세라믹으로 미네랄화되어, 우수한 생체적합성, 세포적합성, VEGF 로딩 용량의 증가 및 장기 지속 방출성을 제공할 수 있으며, 이에 따라 궁극적으로 세포의 부착 및 증식이 촉진되어 골 조직의 재생을 효과적으로 도모할 수 있다.
The polymer scaffold for bone regeneration according to the present invention is mineralized with calcium phosphate ceramics to provide superior biocompatibility, cell suitability, increased VEGF loading capacity and long-term sustained release, And the regeneration of the bony tissue can be effectively promoted.
도 1의 (a)는 본 발명의 일 실시예에 따른 고분자 스캐폴드의 표면이고, 도 1의 (b)는 CaP로 표면이 미네랄화된 고분자 스캐폴드의 표면을 나타낸 그림이다.
도 2는, 본 발명의 일 실시예에 따른 CaP로 미네랄화된 고분자 스캐폴드의 VEGF 방출양상을 시험 결과를 나타낸 그래프이다.
도 3은, 본 발명의 일 실시예에 따른 네 가지 스캐폴드(PLA, mPLA, PLA+VEGF, mPLA+VEGF)의 세포 증식 수준 확인 시험(CCK assay) 결과를 나타낸 그래프이다.
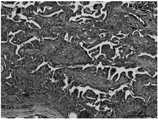
도 4는, 본 발명의 일 실시예에 따른 세 가지 스캐폴드(PLA, mPLA, mPLA-VEGF)의 이식 4주후 실험동물의 조직을 대상으로 한 HE 또는 MT 염색 결과를 나타낸 그림이다.
도 5는, 본 발명의 일 실시예에 따른 mPLA-VEGF 스캐폴드의 vWF 발현 정도를 면역조직화학염색으로 확인한 그림이다(ML: muscle, FT: fibrous tissue, AT: adipose tissue, FB: fibroblasts).
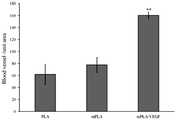
도 6은, 본 발명의 일 실시예에 따른 세 가지 스캐폴드(PLA, mPLA, mPLA-VEGF)의 이식 4주후 실험동물의 조직을 대상으로 한 혈관형성 정도를 나타낸 그래프이다.FIG. 1 (a) is a surface view of a polymer scaffold according to an embodiment of the present invention, and FIG. 1 (b) is a view showing a surface of a polymer scaffold surface mined with CaP.
FIG. 2 is a graph showing the results of VEGF emission test results of a CaP-mineralized polymer scaffold according to an embodiment of the present invention.
FIG. 3 is a graph showing cell proliferation level (CCK) assay results of four scaffolds (PLA, mPLA, PLA + VEGF, mPLA + VEGF) according to an embodiment of the present invention.
FIG. 4 is a graph showing the result of HE or MT staining of tissues of experimental animals after 4 weeks of transplantation of three scaffolds (PLA, mPLA, mPLA-VEGF) according to an embodiment of the present invention.
FIG. 5 is a graph showing the degree of vWF expression of the mPLA-VEGF scaffold according to an embodiment of the present invention by immunohistochemical staining (ML: muscle, FT: fibrotic tissue, AT: adipose tissue, FB: fibroblasts).
FIG. 6 is a graph showing the degree of angiogenesis in tissues of experimental animals after 4 weeks of transplantation of three scaffolds (PLA, mPLA, mPLA-VEGF) according to an embodiment of the present invention.
이하, 실시예를 통하여 본 발명을 더욱 상세히 설명하고자 한다. 이들 실시예는 본 발명을 보다 구체적으로 설명하기 위한 것으로, 본 발명의 범위가 이들 실시예에 의해 제한되는 것은 아니다.
Hereinafter, the present invention will be described in more detail with reference to Examples. These examples are for further illustrating the present invention, and the scope of the present invention is not limited by these examples.
실시예Example 1: One:스캐폴드Scaffold 제조 및 Manufacturing andCaPCaP 처리 process
스캐폴드는 용매 캐스팅법 및 염-용출(salt leaching)법으로 성형하였고, 구체적으로는 논문(Oh SA, Lee WK, Shin US, Kim HW. Poly(lactic acid) porous scaffold with calcium phosphate mineralized surface and bone marrow mesenchymal stem cell growth and differentiation. Mater Sci Eng C 2010;31:612-619)에 기재된 방법과 동일하게 제조하였다. 간략하게, PLA (DL type, Boehringer Ingelheim, Germany) 펠렛을 1,4-디옥산(5% w/v)에 용해시키고, 점성있는 고분자 용액을 200~500 ㎛ 사이즈를 가지는 NaCl을 함유하는 몰드에 부었다. 그리고 나서 샘플들을 즉시 얼리고(-20℃) 동결건조시켰다. 동결건조시킨 매트릭스는 ~1.5 mm의 두께로 잘랐고, 염 제거를 위하여 이중-증류(double distilled)시킨 물에서 6시간 동안 적시고, 건조하였다. 그리고 나서, PLA 스캐폴드의 표면을 CaP로 미네랄화하였다. 구체적으로, 칼슘 및 인산염의 이온 용액을 제조하고, 여과하였다. PLA 스캐폴드를 상기 여과 용액에 완전히 적신 후, 24시간 동안 교반하여 표면을 균일하게 미네랄화시켰다. 이 과정 중에, 온도는 상대적으로 낮은 4℃를 유지하여 CaP 핵 형성을 촉진시켰다. 그 후 온도를 37℃까지 점차 증가시켜 핵의 성장을 유도하였다. CaP로 미네랄화된 스캐폴드는 세적하고 건조시켰다. 제조한 스캐폴드의 표면 몰폴로지는 field emission scanning electron microscopy (FE-SEM; MIRA Ⅱ LMH, Tescan, Czech)로 분석하였다.The scaffold was formed by a solvent casting method and a salt leaching method. Specifically, the scaffold was formed by using a porous scaffold with calcium phosphate mineralized surface and bone (Lee, WK, Shin US, Kim HW, Marrow mesenchymal stem cell growth and differentiation. Mater Sci Eng C 2010; 31: 612-619). Briefly, pellets of PLA (DL type, Boehringer Ingelheim, Germany) were dissolved in 1,4-dioxane (5% w / v) and the viscous polymer solution was added to a mold containing NaCl having a size of 200-500 μm Poured. The samples were then immediately frozen (-20 < 0 > C) and lyophilized. The lyophilized matrix was cut to a thickness of ~1.5 mm and wet-dried for 6 hours in double distilled water for salt removal and dried. The surface of the PLA scaffold was then mineralized with CaP. Specifically, an ionic solution of calcium and phosphate was prepared and filtered. The PLA scaffold was completely wetted with the filtrate solution, and then stirred for 24 hours to uniformly mineralize the surface. During this process, the temperature was maintained at a relatively low temperature of 4 ° C to promote CaP nucleation. Thereafter, the temperature was gradually increased to 37 ° C to induce nuclear growth. CaP minarized scaffolds were clean and dry. The surface morphology of the prepared scaffold was analyzed by field emission scanning electron microscopy (FE-SEM; MIRA II LMH, Tescan, Czech).
또한, CaP-미네랄화 표면의 거칠기 분석을 위하여 PLA 필름을 제조하였고, 표면 거칠기 파라메터(평균값, Ra, 및 root-mean-square value, Rq)는 scanning probe microscopy (SPM; DAFMCL, Digital Instrument)로 확인하였다. 각 샘플의 representative area (20㎛×20㎛)는 SPM 분석에서 고려하였다.
The surface roughness parameters (mean value, Ra , and root-mean-square value, Rq ) were measured by scanning probe microscopy (SPM; DAFMCL, Digital Instrument) Respectively. The representative area (20 μm × 20 μm) of each sample was considered in the SPM analysis.
그 결과, 도 1의 (a)에 나타나듯이 제조된 고분자 스캐폴드는 스캐폴드를 관통하는 구멍이 잘 발달된 다공성 몰폴로지를 가지는 것을 확인할 수 있었다. 상기 구멍들은 200-500 ㎛ 사이즈의 염 입자 침출로 생성된 것이다. 또한, 도 1의 (b)에 나타나듯이, CaP로 미네랄화된 스캐폴드는 표면에 미네랄 나노결정이 형성된 것을 확인할 수 있었다.As a result, it was confirmed that the polymer scaffold prepared as shown in FIG. 1 (a) had a well-developed porous morphology piercing through the scaffold. The holes are produced by salt particle leaching of 200-500 [mu] m size. Further, as shown in Fig. 1 (b), it was confirmed that mineral nanocrystals were formed on the surface of the scaffold mineralized with CaP.
또한, SPM으로 평평한 타입 PLA 필름 표본의 거칠기를 측정한 결과, Ra는 123 nm, Rq는 172 nm를 나타내었고, 이는 PLA 대조군의 값(Ra: 53 nm, Rq: 70 nm)보다 더 높은 값임을 확인할 수 있었다.
As a result of measuring the roughness of the flat type PLA film sample with SPM, Ra and Rq were 123 nm and 172 nm, respectively, which were higher than those of the PLA control (Ra : 53 nm, Rq : 70 nm) And it was confirmed that it is a higher value.
실시예Example 2: 재조합 인간 2: Recombinant humanVEGFVEGF의 발현 및 정제≪ / RTI >
rhVEGF를 인식하기 위한 PCR1 프라이머는 다음과 같이 디자인하였다:The PCR1 primer for recognition of rhVEGF was designed as follows:
VEGF forward primer, 5'-GACGGTACCGCACCCATGGCAGAAGG-3',VEGF forward primer, 5'-GACGGTACCGCACCCATGGCAGAAGG-3 ',
VEGF reverse primer, 5'-AGAATTCTCACCGCCTCGGCTTGTC-3'.VEGF reverse primer, 5'-AGAATTCTCACCGCCTCGGCTTGTC-3 '.
PCR은 50 mM KCl, 10 mM Tris-HCl (pH 8.3), 1.5 mM MgCl2, 100 ㎍/㎖, 젤라틴, 0.2 mM dNTPs, 1.25 유닛의 Taq 폴리머라아제(iNtRON, Seoul, Korea), 및 각 50 pmol의 포워드 및 리버스 프라이머를 포함하는 30 ㎕ 반응 혼합물로 수행하였다. PCR은 55℃에서 1분(annealing), 72℃에서 2분(extension) 및 94℃에서 1분(denaturation)으로 30 사이클 수행하였다. 증폭 산물은 XhoⅠ 및 EcoRⅠ으로 소화시킨 후, pBAD/HisA-VEGF construct가 생기는 pBAD/HisA 벡터(Invitrogen, Carlsbad, CA) 다중 클로닝 사이트와 연결하였다. 재조합 VEGF를 발현시키기 위하여, TOP 10개의 세포들을 37℃, LB-Amp 배지에서 하룻밤 동안 키웠다. 배양액이 0.6의 A600에 다다랐을 때, induction을 0.02% (w/v) L-아라비노스로 초기화시켰다. 여섯 시간 후, 박테리아를 6000 g에서 10분간 원심분리하여 pelleting 하고, 용해시키고 초음파 처리하였다. 가용성 추출물을 4℃ 14,000 g 에서 10분간 원심분리하였고, 얻어진 상청액을 깨끗한 튜브에 옮겼다. 초음파 처리한 박테리아 상청액으로부터 얻어진 조 단백질은 헥사히스티딘 태그(VEGF 아미노 말단에 위치한) 결합을 통하여 제조사(Invitrogen, Carlsbad, CA)의 설명서에 따라 니켈-니트릴로트리아세트산 레진 컬럼으로 정제하였다. VEGF 정제도는 변성조건 하에 12%(v/v) SDS-PAGE 겔의 쿠마신 블루 염색으로 확인하였다.
The PCR was carried out in the presence of 50 mM KCl, 10 mM Tris-HCl (pH 8.3), 1.5 mM MgCl2 , 100 μg / ml, gelatin, 0.2 mM dNTPs, 1.25 units of Taq polymerase (iNtRON, Seoul, Korea) pmol forward and reverse primers. PCR was carried out for 30 cycles at 55 ° C for 1 min (annealing), 72 ° C for 2 min (extension) and 94 ° C for 1 min (denaturation). The amplification products were digested with XhoI and EcoRI and then ligated with the pBAD / HisA vector (Invitrogen, Carlsbad, CA) multiple cloning site resulting in the pBAD / HisA-VEGF construct. For expression of recombinant VEGF,
실시예Example 3: 3:VEGFVEGF 로딩 및 방출 시험 Loading and discharging test
실시예 2로 제조한 VEGF를 CaP-미네랄화 스캐폴드에 로딩하였다. 대조군으로, CaP 처리를 하지 않은 PLA 스캐폴드에도 VEGF를 로딩하였다. 구체적으로 VEGF 10 마이크로그램을 1 ㎖의 완충액에 용해시키고, 각 스캐폴드를 200 ㎕의 VEGF 용액에 담그고, 스캐폴드 위에 VEGF가 로딩되도록 실온에서 4시간 동안 방치하여 스캐폴드에 VEGF를 담지시켰다.VEGF prepared in Example 2 was loaded into a CaP-mineralized scaffold. As a control, VEGF was also loaded into the PLA scaffolds without CaP treatment. Specifically, 10 micrograms of VEGF was dissolved in 1 ml of buffer, each scaffold was immersed in 200 占 퐇 of VEGF solution, and the scaffold was loaded with VEGF by allowing the VEGF to be loaded on the scaffold at room temperature for 4 hours.
한편, 제조된 스캐폴드의 VEGF 방출성을 확인하기 위하여 in vitro 상에서 스캐폴드로부터 VEGF가 방출되는 양상을 시험하였다. 구체적으로 VEGF가 로딩된 스캐폴드를 두 번 세척하고, 37℃로 유지되는 인큐베이터 안에서 1% bovine serem albumin (BSA)를 함유한 1 ㎖의 인산염 완충 식염수(PBS)에 적셨다. 정해진 타임 포인트(1, 4, 8, 12 및 24시간 및 2, 3, 5, 6, 7, 10, 14, 17, 21, 24, 27 및 30일)에, 상청액을 모두 모아 VEGF 방출을 평가하였다. 방출된 VEGF는 인간 VEGF enzyme-linked immunosorbent assay (ELISA) development kit (Peprotech, Rocky Hill, NJ)로 평가하였고, 정량은 표준 곡선을 이용하여 얻었다.
Meanwhile, in order to confirm the VEGF releasability of the prepared scaffold, the manner in which VEGF was released from the scaffold was examined in vitro. Specifically, the VEGF-loaded scaffold was washed twice and soaked in 1 ml of phosphate buffered saline (PBS) containing 1% bovine serem albumin (BSA) in an incubator maintained at 37 ° C. At the defined time points (1, 4, 8, 12 and 24 hours and 2, 3, 5, 6, 7, 10, 14, 17, 21, 24, 27 and 30 days), the supernatants were pooled to assess VEGF release Respectively. The released VEGF was assessed using the human VEGF enzyme-linked immunosorbent assay (ELISA) development kit (Peprotech, Rocky Hill, NJ) and quantification was performed using standard curves.
그 결과, 도 2에 나타나듯이 VEGF의 방출패턴은 매우 지속적이어서 시험 기간동안인 30일 동안 VEGF가 계속적으로 방출되는 것을 알 수 있었다. 따라서, 이로부터 mPLA 스캐폴드가 약 한 달동안 지속적으로 VEGF를 전달할 수 있는 장기 지속방출형 스캐폴드임을 확인할 수 있었다.
As a result, as shown in Fig. 2, the emission pattern of VEGF was very persistent, indicating that VEGF was continuously released for 30 days during the test period. Thus, it was confirmed that the mPLA scaffold was a long-term sustained-release scaffold capable of continuously delivering VEGF for about one month.
실시예Example 4: 4:ECEC 배양 및 성장 양상 Culture and Growth
일차 ECs는 다 자란 수컷 Sprague-Dawley (SD) 래트의 신선한 동맥으로부터 분리하였다. 세포는 1% 페니실린/스트렙토마이신을 함유하고 있는 10% 소태아혈청(FBS)로 보충된 Dulbeco's Modified Eagle Medium (DMEM)의 표준 배양 배지에서 배양하였다. 8×103개의 세포들을 24 웰 플레이트에 각각 시딩하였다. 하루가 지나고, 네 가지 다른 타입의 스캐폴드(PLA; CaP-미네랄화 PLA, mPLA; VEGF가 로딩된 PLA, PLA-VEGF; VEGF가 로딩된 mPLA, mPLA-VEGF)를 각 24 웰에 함유된 세포 배양 insert (0.32㎠, pore diameter 0.4㎛; Millipore, Millicell)에 두었다. 배지는 이틀마다 교체하였다. ECs의 증식은 제조사(Dojindo Molecular Technologies, Japan)의 설명서에 따라 셀 카운팅 키트-8(CCK-8)를 사용하여 평가하였다. 배양 1, 4, 및 7일 후, CCK-8 용액을 각 웰에 첨가하였고, 3시간 동안 37℃에서 배양하였다. 마이크로플레이트 리더기(Molecular Devices, Sunnyvale, CA)를 이용하여 최적의 밀도인 파장 450 nm에서 측정하였다.
Primary ECs were isolated from fresh arteries of adult male Sprague-Dawley (SD) rats. Cells were cultured in a standard culture medium of Dulbecco's Modified Eagle Medium (DMEM) supplemented with 10% fetal bovine serum (FBS) containing 1% penicillin / streptomycin. 8 x 10 <3 > cells were each seeded in 24 well plates. One day later, four different types of scaffolds (PLA; CaP-mineralized PLA, mPLA; VEGF loaded PLA, PLA-VEGF; VEGF loaded mPLA, mPLA-VEGF) (0.32 cm 2, pore diameter 0.4 탆; Millipore, Millicell). The medium was replaced every two days. The proliferation of ECs was assessed using Cell Counting Kit-8 (CCK-8) according to the manufacturer's instructions (Dojindo Molecular Technologies, Japan). After 1, 4, and 7 days of incubation, CCK-8 solution was added to each well and incubated for 3 hours at 37 ° C. The optical density was measured at 450 nm using a microplate reader (Molecular Devices, Sunnyvale, Calif.).
그 결과, 도 3에 나타나듯이 PLA와 mPLA는 세포 증식 수준에 있어서 크게 차이나지 않았으나, 스캐폴드 중에 VEGF를 포함하는 경우, 증식 수준은 시간이 지날 수록 확연하게 차이가 났다. 특히, mPLA+VEGF의 경우, 7일째 가장 높은 세포 증식을 나타내었고, 이로써, 스캐폴드로부터 VEGF의 방출이 안정적이고 효과적으로 이루어져 세포 증식을 촉진하는 것을 확인할 수 있었다.
As a result, as shown in FIG. 3, PLA and mPLA did not differ greatly in cell proliferation level, but when VEGF was included in the scaffold, the proliferation level was significantly different over time. In particular, in the case of mPLA + VEGF, the highest cell proliferation was observed at 7 days, and it was confirmed that the release of VEGF from the scaffold was stably and effectively promoted and cell proliferation was promoted.
실시예Example 5: 인 비보 동물 실험 5: In vivo animal experiment
래트 실험은 한국의 단국대학교 Animal Care and Use Commitee의 승인하에 수행하였다. 실험에는 10주령의 건강한 SD 수컷 래트 세 마리를 사용하였다. 세가지 실험군(PLA, mPLA 및 mPLA-VEGF)에 대하여 각 군당 네 가지 샘플을 실험하였다. 스캐폴드는 에틸렌 옥사이드로 멸균하였다. 모든 수술 절차는 멸균 기술을 이용하여 전신마취 하에 수행하였다. 동물들은 근육 주사(intramuscular injection)으로 80 ㎎/㎏의 케타민 및 10 ㎎/㎏의 자일라진으로 마취하였다. 래트 등 부분의 피부를 준비하고 bard-parker scalpel 장착된 #10 blade를 사용하여 2 cm 길이로 절개하였다. 4가지 작은 피하 임플란트 부위를 blunt dissection으로 만들어내었고, 각 동물들에 스캐폴드(PLA, mPLA 및 mPLA-VEGF)를 삽입하였다. 절개는 4-0 비흡수성 모노필라멘트 봉합 기재(Dafilon, B. Braun, Germany)로 봉합하였다. 수술 중 및 후에, 온기를 유지하도록 하였고 마취에서 회복될 때까지 관찰하였으며, 한 마리당 한 케이지(cage)에서 사육하였다. 동물들은 12시간 낮/12시간 밤의 스케쥴을 유지하였고 표준 펠렛 음식 및 물을 임의 제공하였다.
Rat experiments were conducted with the approval of Animal Care and Use Commitee at Dankook University in Korea. Three 10-week-old healthy SD male rats were used in the experiment. Four samples per group were tested for the three experimental groups (PLA, mPLA and mPLA-VEGF). The scaffold was sterilized with ethylene oxide. All surgical procedures were performed under general anesthesia using sterilization techniques. Animals were anesthetized with intramuscular injection of 80 mg / kg of ketamine and 10 mg / kg of xylazine. The skin of the rats was prepared and cut into 2 cm lengths using a # 10 blade equipped with a bard-parker scalpel. Four small subcutaneous implants were blunt dissected and scaffolds (PLA, mPLA and mPLA-VEGF) were inserted into each animal. Incisions were closed with a 4-0 nonabsorbable monofilament suture (Dafilon, B. Braun, Germany). During and after the operation, warmth was maintained and observed until recovery from anesthesia, and cages were raised in one cage. The animals maintained a 12 hour day / 12 hour night schedule and provided standard pelleted food and water.
실시예Example 6: 조직학적 분석 6: Histological analysis
이식 후 모든 동물들은 염증 반응 없이 정상적인 상처 치유과정을 나타내었고 시험 기간 동안 건강한 상태를 유지하였다. 이식 4주 후, 샘플들 및 주변 조직들은 현미경 관찰상 홍조 또는 염증이 나타나지 않은 것을 확인하고, 실험동물들을 희생하였다. 주변 조직을 포함한 샘플들을 각 래트로부터 분리하여 즉시 4% 완충 포름알데하이드에 24시간 동안 실온 조건에서 적셨다. 그리고 일련의 graded 에탄올로 탈수시켰다. 샘플을 이등분하여 파라핀 중에 내포시켰다. 파라핀 블록들을 로타리 마이크로톰을 이용하여 길이방향으로 5 ㎛의 두께로 절단하였다. 슬라이드는 헤마토실린 및 에오신(HE) 또는 마손스 트리크롬(MT)로 염색하였고, 생분해성 및 혈관 형성을 위해 최적의 현미경으로 관찰하여 도 4에 나타내었다. 또한, 염증 반응의 정도, 섬유성 피막의 두께, 혈관의 존재 및 섬유아세포의 증식(부재~심각한 정도까지 0~3)을 포함하여 점수를 매겼고, 그 결과를 하기 표 1에 나타내었다.
After transplantation, all animals exhibited normal wound healing processes without inflammatory response and remained healthy during the test period. After 4 weeks of transplantation, samples and surrounding tissues were confirmed by microscopic observation of no redness or inflammation, and the animals were sacrificed. Samples containing surrounding tissue were separated from each rat and immediately wetted with 4% buffered formaldehyde for 24 hours at room temperature. And dehydrated with a series of graded ethanol. Samples were bisected and embedded in paraffin. The paraffin blocks were cut to a thickness of 5 mu m in the longitudinal direction using a rotary microtome. The slides were stained with hematocylin and eosin (HE) or maltose trichrome (MT) and were observed under an optimal microscope for biodegradability and angiogenesis and are shown in FIG. The scores were also included, including the extent of inflammation, the thickness of the fibrous coating, the presence of blood vessels, and the proliferation of fibroblasts (0 to 3 to the extent of absence to severity), and the results are shown in Table 1 below.
(1: mild changes or low numbers of infiltrated inflammatory cells, 2: moderate changes or intermediate numbers of infiltrated inflammatory cells, 3: severe changes/numbers of infiltrated inflammatory cells. FC: fibrous capsule, IR: inflammatory response, BV: blood vessel, F: fibroblasts)
(1: mild changes or low numbers of infiltrated inflammatory cells, 2: moderate changes or intermediate numbers of infiltrated inflammatory cells, 3: severe changes / numbers of infiltrated inflammatory cells) , F: fibroblasts)
그 결과, 도 4 및 상기 표 1에 나타나듯이 스캐폴드 주변과 안의 조직 몰폴로지를 관찰한 결과 모든 스캐폴드에서 새롭게 형성된 조직은 기존의 주변 조직들과 잘 융화되었으며, 적절하게 유기화된 얇은 섬유성 과립조직들이 스캐폴드와 주변 연결 조직 및 근육 사이의 공간을 채우고 있었다.As a result, as shown in FIG. 4 and Table 1, it was observed that the scaffold periphery and the internal morphology of the scaffold showed that the newly formed tissues in all the scaffolds were well compatible with the existing peripheral tissues, The tissues filled the space between the scaffold and surrounding connective tissue and muscles.
또한, PLA 및 mPLA 스캐폴드에서는 별다른 차이가 없었으나, mPLA-VEGF 스캐폴드에서는 높은 점수를 내어 혈관 형성이 효과적으로 이루어졌음을 확인할 수 있었다.
In addition, there was no significant difference in PLA and mPLA scaffolds, but it was confirmed that the mPLA-VEGF scaffold was highly scored and angiogenesis was effectively performed.
실시예Example 7: 7:혈관내Intravascular 증식 평가 Proliferation evaluation
스캐폴드에서 새롭게 형성된 혈관의 양을 확인하기 위하여, 슬라이드의 스캐폴드 부분 안의 혈관 갯수를 계산하였다. vWF (von Willebrand factor)는 혈관 기저막과 같은 내피하 매트릭스에 있는 거대 분자량 단백질이기 때문에 새롭게 형성된 혈관을 정량하기 위하셔 널리 사용되어 왔다. 이에 슬라이드를 vWF (von Willebrand factor; Abcam, Cambridge, MA)로 면역조직학적으로 염색하고, 표준 프로토콜에 따라 평가하였다. 일차 항체(1:2000으로 희석한 토끼 항-vWF; Abcam)으로 처리하고, 이차 항-토끼 IgG 항체(Santa Cruz Inc., CA)로 처리하였다. 1시간 처리 후에, 3,3'-디아미노벤지딘(브라운; Dako, Glostrup, Denmark)을 함유한 퍼옥시다아제 기질 용액을 가시화를 위해 사용하였고, 핵 염색을 위하여 헤마톡실린을 사용하였다. vWF-염색 슬라이드는 스캐폴드 면적을 확인하기 위하여 사진촬영 하여 도 5에 나타내었고, 라이트 마이크로스코프를 사용하여 각각 혈관 농도를 확인하였다. 혈관은 Scion Image Software (Media Cybernetics, Carlsbad, CA)를 사용하여 조직 면적을 정상화하였다. 평균 혈관 수는 각 그룹끼리 비교하였다.
To determine the amount of newly formed blood vessels in the scaffold, the number of blood vessels in the scaffold portion of the slide was calculated. The von Willebrand factor (vWF) has been widely used to quantitate newly formed blood vessels because it is a macromolecular protein in the subcutaneous matrix such as the vascular basement membrane. Slides were stained immunohistochemically with vWF (von Willebrand factor; Abcam, Cambridge, MA) and evaluated according to standard protocols. Treated with primary antibody (rabbit anti-vWF; Abcam diluted 1: 2000) and treated with secondary anti-rabbit IgG antibody (Santa Cruz Inc., CA). After 1 hour treatment, a peroxidase substrate solution containing 3,3'-diaminobenzidine (Brown; Dako, Glostrup, Denmark) was used for visualization and hematoxylin was used for nuclear staining. The vWF-stained slides were photographed in order to confirm the scaffold area and are shown in Fig. 5, and the blood vessel concentrations were confirmed using a light microscope. The vessels were normalized in tissue area using Scion Image Software (Media Cybernetics, Carlsbad, Calif.). Mean blood vessel counts were compared among the groups.
그 결과, 도 5 및 도 6에 나타나듯이 mPLA-VEGF 군에서 가장 높은 vWF의 발현이 관찰되었으며, mPLA-VEGF 스캐폴드가 현저하게 많은 혈관을 형성하는 것을 확인할 수 있었다.
As a result, as shown in FIG. 5 and FIG. 6, the highest vWF expression was observed in the mPLA-VEGF group, and it was confirmed that the mPLA-VEGF scaffold formed a remarkable number of blood vessels.
실시예Example 8: 통계 8: Statistics
결과는 평균 ± 표준편차로 나타내엇으며, ANOVA로 분석하였다. p < 0.05 또는 p < 0.01의 A값을 유의미한 것으로 해석하였다.Results were expressed as mean ± standard deviation and analyzed by ANOVA. A value of p <0.05 or p <0.01 was interpreted as meaningful.
<110> Industry-Academic Cooperation Foundation, Dankook University<120> Bone regenerating polymer scaffold<130> PA120998/KR<160> 2<170> KopatentIn 2.0<210> 1<211> 26<212> DNA<213> Artificial Sequence<220><223> VEGF forward primer<400> 1gacggtaccg cacccatggc agaagg 26<210> 2<211> 25<212> DNA<213> Artificial Sequence<220><223> VEGF reverse primer<400> 2agaattctca ccgcctcggc ttgtc 25<110> Industry-Academic Cooperation Foundation, Dankook University<120> Bone regenerating polymer scaffold<130> PA120998 / KR<160> 2<170> Kopatentin 2.0<210> 1<211> 26<212> DNA<213> Artificial Sequence<220><223> VEGF forward primer<400> 1gacggtaccg cacccatggc agaagg 26<210> 2<211> 25<212> DNA<213> Artificial Sequence<220><223> VEGF reverse primer<400> 2agaattctca ccgcctcggc ttgtc 25
Claims (8)
Translated fromKoreanIn a polymer scaffold carrying VEGF (Vascularendothelial Growth Factor), the scaffold is made of calcium phosphate ceramics and the surface of the calcium phosphate ceramics is mineralized, and the calcium phosphate ceramics are bound to VEGF (Vascularendothelial Growth Factor) Scaffold.
The method of claim 1, wherein the polymer is selected from the group consisting of poly (glycolic acid), poly (lactic acid), poly (D, L-lactic acid-co- glycolic acid), poly (L-lactide-co-D, L- , Poly (hydroxybutyrate), poly (hydroxyvalerate), poly (valerolactone), poly (caprolactone), polydioxanone, copolymers thereof and mixtures thereof. A scaffold for bone regeneration.
The scaffold for bone regeneration according to claim 1, wherein the calcium phosphate-based ceramic is monocalcium phosphate, dicalcium phosphate, tricalcium phosphate, tetracalcium phosphate, hydroxyapatite or a combination thereof.
2) 상기 스캐폴드의 표면을 인산칼슘계 세라믹으로 미네랄화 하는 단계; 및
3) 미네랄화된 스캐폴드에 VEGF (Vascularendothelial Growth Factor)를 담지시키는 단계를 포함하는 골 재생용 스캐폴드의 제조방법.
1) preparing a biocompatible polymer scaffold;
2) mineralizing the surface of the scaffold with calcium phosphate-based ceramics; And
3) carrying VEGF (Vascularendothelial Growth Factor) on the mineralized scaffold.
5. The method of claim 4, wherein step (2) is performed by immersing the scaffold in an ionic solution of calcium and phosphate to form and grow mineral nuclei.
6. The method according to claim 5, wherein the formation of the mineral nuclei is promoted at 1 DEG C to 10 DEG C, and the growth of the mineral nucleus is induced by increasing the temperature to 35 DEG C to 40 DEG C.
6. The method according to claim 5, wherein the immersion time is from 12 hours to 36 hours.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020130016486AKR101715438B1 (en) | 2013-02-15 | 2013-02-15 | Bone regenerating polymer scaffold |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020130016486AKR101715438B1 (en) | 2013-02-15 | 2013-02-15 | Bone regenerating polymer scaffold |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20140103389Atrue KR20140103389A (en) | 2014-08-27 |
| KR101715438B1 KR101715438B1 (en) | 2017-03-14 |
Family
ID=51747664
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020130016486AActiveKR101715438B1 (en) | 2013-02-15 | 2013-02-15 | Bone regenerating polymer scaffold |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR101715438B1 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20160069763A (en)* | 2014-12-09 | 2016-06-17 | 고려대학교 산학협력단 | Osteoinductive Molecules-eluting Scaffold and Method for Preparing thereof |
| JP2021010552A (en)* | 2019-07-05 | 2021-02-04 | グンゼ株式会社 | Base material for finger joint cartilage |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20090005683A (en)* | 2007-07-09 | 2009-01-14 | 재단법인서울대학교산학협력재단 | Low Soluble Amorphous Calcium Phosphate Impregnated on a Solid Substrate and its Manufacturing Method |
| KR20100114815A (en)* | 2009-04-16 | 2010-10-26 | 서울대학교산학협력단 | Method for surface modification of polymeric scaffold for stem cell transplantation using decellularized extracellular matrix |
| JP2012016517A (en)* | 2010-07-09 | 2012-01-26 | Inoac Gijutsu Kenkyusho:Kk | Bone regeneration material and method for manufacturing the same |
| JP5071932B2 (en)* | 2006-07-24 | 2012-11-14 | 独立行政法人産業技術総合研究所 | Scaffold for tissue regeneration and method for manufacturing the same |
- 2013
- 2013-02-15KRKR1020130016486Apatent/KR101715438B1/enactiveActive
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5071932B2 (en)* | 2006-07-24 | 2012-11-14 | 独立行政法人産業技術総合研究所 | Scaffold for tissue regeneration and method for manufacturing the same |
| KR20090005683A (en)* | 2007-07-09 | 2009-01-14 | 재단법인서울대학교산학협력재단 | Low Soluble Amorphous Calcium Phosphate Impregnated on a Solid Substrate and its Manufacturing Method |
| KR20100114815A (en)* | 2009-04-16 | 2010-10-26 | 서울대학교산학협력단 | Method for surface modification of polymeric scaffold for stem cell transplantation using decellularized extracellular matrix |
| JP2012016517A (en)* | 2010-07-09 | 2012-01-26 | Inoac Gijutsu Kenkyusho:Kk | Bone regeneration material and method for manufacturing the same |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20160069763A (en)* | 2014-12-09 | 2016-06-17 | 고려대학교 산학협력단 | Osteoinductive Molecules-eluting Scaffold and Method for Preparing thereof |
| JP2021010552A (en)* | 2019-07-05 | 2021-02-04 | グンゼ株式会社 | Base material for finger joint cartilage |
Also Published As
| Publication number | Publication date |
|---|---|
| KR101715438B1 (en) | 2017-03-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Lou et al. | Periosteal tissue engineering: current developments and perspectives | |
| Bi et al. | Reconstruction of goat tibial defects using an injectable tricalcium phosphate/chitosan in combination with autologous platelet-rich plasma | |
| Kang et al. | Surface modification with fibrin/hyaluronic acid hydrogel on solid-free form-based scaffolds followed by BMP-2 loading to enhance bone regeneration | |
| EP2361969B1 (en) | Tissue-engineering scaffolds containing self-assembled-peptide hydrogels | |
| Kroese-Deutman et al. | Bone inductive properties of rhBMP-2 loaded porous calcium phosphate cement implants inserted at an ectopic site in rabbits | |
| Xiong et al. | BMP2-loaded hollow hydroxyapatite microspheres exhibit enhanced osteoinduction and osteogenicity in large bone defects | |
| US6511510B1 (en) | Osteoinductive ceramic materials | |
| Morris et al. | Matricellular proteins and biomaterials | |
| Cheng et al. | Promoting osteogenic differentiation in pre-osteoblasts and reducing tibial fracture healing time using functional nanofibers | |
| Kim et al. | Mineralized poly (lactic acid) scaffolds loading vascular endothelial growth factor and the in vivo performance in rat subcutaneous model | |
| US20110300203A1 (en) | Cartilage regeneration without cell transplantation | |
| Ellermann et al. | In vitro angiogenesis in response to biomaterial properties for bone tissue engineering: a review of the state of the art | |
| US20050260179A1 (en) | Stem and progenitor cell capture for tissue regeneration | |
| La et al. | Systemically replicated organic and inorganic bony microenvironment for new bone formation generated by a 3D printing technology | |
| US20190151510A1 (en) | Trizonal membranes for periosteum regeneration | |
| US20110040388A1 (en) | Biocompatible implant | |
| CN102886075B (en) | Human hard tissue repair material and preparation method thereof | |
| Nathanael et al. | In vitro and in vivo analysis of mineralized collagen-based sponges prepared by a plasma-and precursor-assisted biomimetic process | |
| KR20100085982A (en) | Process for producing particles loaded with growth factors as well as the particles thus obtained | |
| Anil et al. | Biomaterials for craniofacial tissue engineering and regenerative dentistry | |
| Santos Jr | Bioresorbable polymers for tissue engineering | |
| Ma et al. | Optimization of a concentrated growth factor/mesoporous bioactive glass composite scaffold and its application in rabbit mandible defect regeneration | |
| KR101715438B1 (en) | Bone regenerating polymer scaffold | |
| Wang et al. | Introducing copper and collagen (via poly (DOPA)) coating to activate inert ceramic scaffolds for excellent angiogenic and osteogenic capacity | |
| KR100482651B1 (en) | Tissue Engineered Natural/Synthetic Hybrid Scaffolds and its Manufactory Methods |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application | Patent event code:PA01091R01D Comment text:Patent Application Patent event date:20130215 | |
| PG1501 | Laying open of application | ||
| A201 | Request for examination | ||
| PA0201 | Request for examination | Patent event code:PA02012R01D Patent event date:20150528 Comment text:Request for Examination of Application Patent event code:PA02011R01I Patent event date:20130215 Comment text:Patent Application | |
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | Comment text:Notification of reason for refusal Patent event date:20160810 Patent event code:PE09021S01D | |
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | Patent event code:PE07011S01D Comment text:Decision to Grant Registration Patent event date:20170221 | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | Comment text:Registration of Establishment Patent event date:20170306 Patent event code:PR07011E01D | |
| PR1002 | Payment of registration fee | Payment date:20170306 End annual number:3 Start annual number:1 | |
| PG1601 | Publication of registration | ||
| FPAY | Annual fee payment | Payment date:20200102 Year of fee payment:4 | |
| PR1001 | Payment of annual fee | Payment date:20200102 Start annual number:4 End annual number:4 | |
| PR1001 | Payment of annual fee | Payment date:20201228 Start annual number:5 End annual number:5 | |
| PR1001 | Payment of annual fee | Payment date:20220103 Start annual number:6 End annual number:6 | |
| PR1001 | Payment of annual fee | Payment date:20230103 Start annual number:7 End annual number:7 | |
| PR1001 | Payment of annual fee | Payment date:20231227 Start annual number:8 End annual number:8 |