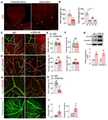
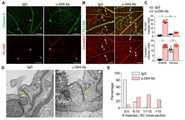
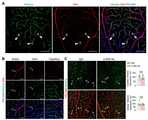
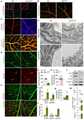
KR102377899B1 - Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage - Google Patents
Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakageDownload PDFInfo
- Publication number
- KR102377899B1 KR102377899B1KR1020200042429AKR20200042429AKR102377899B1KR 102377899 B1KR102377899 B1KR 102377899B1KR 1020200042429 AKR1020200042429 AKR 1020200042429AKR 20200042429 AKR20200042429 AKR 20200042429AKR 102377899 B1KR102377899 B1KR 102377899B1
- Authority
- KR
- South Korea
- Prior art keywords
- dll4
- retinal
- notch1
- shows
- srebp1
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 206010020772HypertensionDiseases0.000titleclaimsabstractdescription167
- 230000002792vascularEffects0.000titleclaimsabstractdescription126
- 239000008194pharmaceutical compositionSubstances0.000titleclaimsabstractdescription24
- 208000037265diseases, disorders, signs and symptomsDiseases0.000titleabstractdescription98
- 201000010099diseaseDiseases0.000titleabstractdescription97
- 102000008078Sterol Regulatory Element Binding Protein 1Human genes0.000titledescription104
- 108010074436Sterol Regulatory Element Binding Protein 1Proteins0.000titledescription104
- 239000003112inhibitorSubstances0.000titledescription61
- 230000001631hypertensive effectEffects0.000claimsabstractdescription86
- 230000002207retinal effectEffects0.000claimsdescription114
- 201000010183PapilledemaDiseases0.000claimsdescription20
- 206010038886Retinal oedemaDiseases0.000claimsdescription19
- 201000011195retinal edemaDiseases0.000claimsdescription19
- ZROSUBKIGBSZCG-UHFFFAOYSA-N4-(4-methylphenyl)-2-(2-propyl-4-pyridinyl)thiazoleChemical compoundC1=NC(CCC)=CC(C=2SC=C(N=2)C=2C=CC(C)=CC=2)=C1ZROSUBKIGBSZCG-UHFFFAOYSA-N0.000claimsdescription8
- 239000004480active ingredientSubstances0.000claimsdescription3
- 238000000034methodMethods0.000abstractdescription43
- 238000012216screeningMethods0.000abstractdescription10
- 108700041286deltaProteins0.000description232
- 101150109170dll4 geneProteins0.000description231
- 210000002889endothelial cellAnatomy0.000description147
- 210000001525retinaAnatomy0.000description117
- 102000001759Notch1 ReceptorHuman genes0.000description112
- 108010029755Notch1 ReceptorProteins0.000description112
- 101100310648Mus musculus Sox17 geneProteins0.000description111
- 241000699670Mus sp.Species0.000description104
- 230000014509gene expressionEffects0.000description100
- 230000000694effectsEffects0.000description92
- 108090000623proteins and genesProteins0.000description91
- 238000011282treatmentMethods0.000description80
- 108010053099Vascular Endothelial Growth Factor Receptor-2Proteins0.000description79
- 102000016549Vascular Endothelial Growth Factor Receptor-2Human genes0.000description79
- 101800001628Notch 1 intracellular domainProteins0.000description63
- 238000012744immunostainingMethods0.000description63
- 102400000552Notch 1 intracellular domainHuman genes0.000description60
- 239000010410layerSubstances0.000description55
- 230000031998transcytosisEffects0.000description51
- 101000620348Homo sapiens Plasmalemma vesicle-associated proteinProteins0.000description46
- 102100022427Plasmalemma vesicle-associated proteinHuman genes0.000description46
- 230000005764inhibitory processEffects0.000description44
- COXVTLYNGOIATD-HVMBLDELSA-NCC1=C(C=CC(=C1)C1=CC(C)=C(C=C1)\N=N\C1=C(O)C2=C(N)C(=CC(=C2C=C1)S(O)(=O)=O)S(O)(=O)=O)\N=N\C1=CC=C2C(=CC(=C(N)C2=C1O)S(O)(=O)=O)S(O)(=O)=OChemical compoundCC1=C(C=CC(=C1)C1=CC(C)=C(C=C1)\N=N\C1=C(O)C2=C(N)C(=CC(=C2C=C1)S(O)(=O)=O)S(O)(=O)=O)\N=N\C1=CC=C2C(=CC(=C(N)C2=C1O)S(O)(=O)=O)S(O)(=O)=OCOXVTLYNGOIATD-HVMBLDELSA-N0.000description43
- 229960003699evans blueDrugs0.000description43
- 102000004169proteins and genesHuman genes0.000description35
- 108020004414DNAProteins0.000description34
- 235000018102proteinsNutrition0.000description34
- 238000002347injectionMethods0.000description32
- 239000007924injectionSubstances0.000description32
- 230000002401inhibitory effectEffects0.000description30
- 210000004155blood-retinal barrierAnatomy0.000description29
- 230000004378blood-retinal barrierEffects0.000description29
- 210000004027cellAnatomy0.000description29
- 206010038926Retinopathy hypertensiveDiseases0.000description28
- 201000001948hypertensive retinopathyDiseases0.000description28
- 239000000203mixtureSubstances0.000description27
- 239000000126substanceSubstances0.000description27
- 238000012217deletionMethods0.000description26
- 230000037430deletionEffects0.000description26
- 230000003993interactionEffects0.000description26
- 210000001927retinal arteryAnatomy0.000description26
- 102000004057Claudin-5Human genes0.000description24
- 108090000582Claudin-5Proteins0.000description24
- 239000003814drugSubstances0.000description24
- 102000005789Vascular Endothelial Growth FactorsHuman genes0.000description23
- 108010019530Vascular Endothelial Growth FactorsProteins0.000description23
- 230000011664signalingEffects0.000description23
- 241000699666Mus <mouse, genus>Species0.000description22
- 229920002307DextranPolymers0.000description20
- 229940079593drugDrugs0.000description20
- 230000002008hemorrhagic effectEffects0.000description20
- 102000005650Notch ReceptorsHuman genes0.000description19
- 108010070047Notch ReceptorsProteins0.000description19
- 241000283973Oryctolagus cuniculusSpecies0.000description19
- 206010038848Retinal detachmentDiseases0.000description19
- 210000001367arteryAnatomy0.000description19
- 210000001210retinal vesselAnatomy0.000description19
- 210000002301subretinal fluidAnatomy0.000description19
- 102000003727Caveolin 1Human genes0.000description18
- 108090000026Caveolin 1Proteins0.000description18
- 241000282414Homo sapiensSpecies0.000description18
- 241001465754MetazoaSpecies0.000description18
- 238000004458analytical methodMethods0.000description18
- 210000001578tight junctionAnatomy0.000description18
- 238000002474experimental methodMethods0.000description17
- 238000012014optical coherence tomographyMethods0.000description17
- 238000011002quantificationMethods0.000description17
- 230000002829reductive effectEffects0.000description17
- 230000036772blood pressureEffects0.000description16
- 238000010586diagramMethods0.000description16
- 239000000463materialSubstances0.000description16
- 102000000591Tight Junction ProteinsHuman genes0.000description15
- 108010002321Tight Junction ProteinsProteins0.000description15
- 239000003642reactive oxygen metaboliteSubstances0.000description15
- 230000002238attenuated effectEffects0.000description14
- 239000012472biological sampleSubstances0.000description14
- 210000001508eyeAnatomy0.000description14
- 238000003119immunoblotMethods0.000description14
- 241000282412HomoSpecies0.000description13
- 108010018828cadherin 5Proteins0.000description13
- 206010015866ExtravasationDiseases0.000description12
- PWKSKIMOESPYIA-BYPYZUCNSA-NL-N-acetyl-CysteineChemical compoundCC(=O)N[C@@H](CS)C(O)=OPWKSKIMOESPYIA-BYPYZUCNSA-N0.000description12
- NKANXQFJJICGDU-QPLCGJKRSA-NTamoxifenChemical compoundC=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1NKANXQFJJICGDU-QPLCGJKRSA-N0.000description12
- 230000033228biological regulationEffects0.000description12
- 230000036251extravasationEffects0.000description12
- 230000032258transportEffects0.000description12
- 241000124008MammaliaSpecies0.000description11
- 210000004204blood vesselAnatomy0.000description11
- 210000004323caveolaeAnatomy0.000description11
- 238000010199gene set enrichment analysisMethods0.000description11
- 230000001404mediated effectEffects0.000description11
- 208000003098Ganglion CystsDiseases0.000description10
- 238000003559RNA-seq methodMethods0.000description10
- 101150037391Slco1c1 geneProteins0.000description10
- 208000005400Synovial CystDiseases0.000description10
- 210000002565arterioleAnatomy0.000description10
- 230000000903blocking effectEffects0.000description10
- 210000000329smooth muscle myocyteAnatomy0.000description10
- 229930040373ParaformaldehydeNatural products0.000description9
- 108010081667afliberceptProteins0.000description9
- 230000003511endothelial effectEffects0.000description9
- 239000006166lysateSubstances0.000description9
- 229920002866paraformaldehydePolymers0.000description9
- 230000001105regulatory effectEffects0.000description9
- 239000000523sampleSubstances0.000description9
- 108091032973(ribonucleotides)n+mProteins0.000description8
- 241000283984RodentiaSpecies0.000description8
- 102000008790VE-cadherinHuman genes0.000description8
- 230000004913activationEffects0.000description8
- 238000003556assayMethods0.000description8
- 230000008859changeEffects0.000description8
- 230000037361pathwayEffects0.000description8
- 238000002360preparation methodMethods0.000description8
- 210000001519tissueAnatomy0.000description8
- 206010012689Diabetic retinopathyDiseases0.000description7
- 101150044441PECAM1 geneProteins0.000description7
- 241000288906PrimatesSpecies0.000description7
- 239000003963antioxidant agentSubstances0.000description7
- 230000015572biosynthetic processEffects0.000description7
- 210000004369bloodAnatomy0.000description7
- 239000008280bloodSubstances0.000description7
- 239000011248coating agentSubstances0.000description7
- 238000000576coating methodMethods0.000description7
- 230000006378damageEffects0.000description7
- 206010012601diabetes mellitusDiseases0.000description7
- 239000003550markerSubstances0.000description7
- 108010054624red fluorescent proteinProteins0.000description7
- 210000003462veinAnatomy0.000description7
- 241000283707CapraSpecies0.000description6
- 102000003952Caspase 3Human genes0.000description6
- 108090000397Caspase 3Proteins0.000description6
- HEDRZPFGACZZDS-UHFFFAOYSA-NChloroformChemical compoundClC(Cl)ClHEDRZPFGACZZDS-UHFFFAOYSA-N0.000description6
- 102000004266Collagen Type IVHuman genes0.000description6
- 108010042086Collagen Type IVProteins0.000description6
- 206010030113OedemaDiseases0.000description6
- 241000700159RattusSpecies0.000description6
- 238000003917TEM imageMethods0.000description6
- 238000002583angiographyMethods0.000description6
- -1antibodiesProteins0.000description6
- 230000003078antioxidant effectEffects0.000description6
- 239000002775capsuleSubstances0.000description6
- 210000000170cell membraneAnatomy0.000description6
- 230000005754cellular signalingEffects0.000description6
- HVYWMOMLDIMFJA-DPAQBDIFSA-NcholesterolChemical compoundC1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2HVYWMOMLDIMFJA-DPAQBDIFSA-N0.000description6
- 238000003384imaging methodMethods0.000description6
- 238000001727in vivoMethods0.000description6
- 230000000415inactivating effectEffects0.000description6
- 230000035772mutationEffects0.000description6
- 210000003668pericyteAnatomy0.000description6
- 239000002243precursorSubstances0.000description6
- 229960001603tamoxifenDrugs0.000description6
- 238000011830transgenic mouse modelMethods0.000description6
- 230000003827upregulationEffects0.000description6
- 238000011144upstream manufacturingMethods0.000description6
- 102100029761Cadherin-5Human genes0.000description5
- 102000004190EnzymesHuman genes0.000description5
- 108090000790EnzymesProteins0.000description5
- HYFMSAFINFJTFH-UHFFFAOYSA-NMitomycin-ANatural productsO=C1C(OC)=C(C)C(=O)C2=C1C(COC(N)=O)C1(OC)N2CC2NC21HYFMSAFINFJTFH-UHFFFAOYSA-N0.000description5
- 229960002833afliberceptDrugs0.000description5
- 238000006243chemical reactionMethods0.000description5
- 150000001875compoundsChemical class0.000description5
- 230000003247decreasing effectEffects0.000description5
- 210000002919epithelial cellAnatomy0.000description5
- 238000011156evaluationMethods0.000description5
- 238000012224gene deletionMethods0.000description5
- 238000012423maintenanceMethods0.000description5
- 230000007246mechanismEffects0.000description5
- HYFMSAFINFJTFH-NGSRAFSJSA-Nmitomycin AChemical compoundO=C1C(OC)=C(C)C(=O)C2=C1[C@@H](COC(N)=O)[C@]1(OC)N2C[C@@H]2N[C@@H]21HYFMSAFINFJTFH-NGSRAFSJSA-N0.000description5
- 150000007523nucleic acidsChemical group0.000description5
- 210000000056organAnatomy0.000description5
- 239000000700radioactive tracerSubstances0.000description5
- 238000011160researchMethods0.000description5
- 238000003757reverse transcription PCRMethods0.000description5
- 230000002441reversible effectEffects0.000description5
- 239000000243solutionSubstances0.000description5
- 230000035882stressEffects0.000description5
- 102000004379AdrenomedullinHuman genes0.000description4
- 101800004616AdrenomedullinProteins0.000description4
- 108010088751AlbuminsProteins0.000description4
- 102000009027AlbuminsHuman genes0.000description4
- 102400000345Angiotensin-2Human genes0.000description4
- 101800000733Angiotensin-2Proteins0.000description4
- 108091023037AptamerProteins0.000description4
- BPYKTIZUTYGOLE-IFADSCNNSA-NBilirubinChemical compoundN1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1BPYKTIZUTYGOLE-IFADSCNNSA-N0.000description4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-NDimethylsulphoxideChemical compoundCS(C)=OIAZDPXIOMUYVGZ-UHFFFAOYSA-N0.000description4
- 102100023226Early growth response protein 1Human genes0.000description4
- 102100033902Endothelin-1Human genes0.000description4
- 101001049697Homo sapiens Early growth response protein 1Proteins0.000description4
- CZGUSIXMZVURDU-JZXHSEFVSA-NIle(5)-angiotensin IIChemical compoundC([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C([O-])=O)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=[NH2+])NC(=O)[C@@H]([NH3+])CC([O-])=O)C(C)C)C1=CC=C(O)C=C1CZGUSIXMZVURDU-JZXHSEFVSA-N0.000description4
- 102000003940OccludinHuman genes0.000description4
- 108090000304OccludinProteins0.000description4
- 102000040945Transcription factorHuman genes0.000description4
- 108091023040Transcription factorProteins0.000description4
- 102000009484Vascular Endothelial Growth Factor ReceptorsHuman genes0.000description4
- 230000001154acute effectEffects0.000description4
- ULCUCJFASIJEOE-NPECTJMMSA-NadrenomedullinChemical compoundC([C@@H](C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)NCC(=O)N[C@@H]1C(N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)NCC(=O)N[C@H](C(=O)N[C@@H](CSSC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)[C@@H](C)O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=CC=C1ULCUCJFASIJEOE-NPECTJMMSA-N0.000description4
- 229950006323angiotensin iiDrugs0.000description4
- 239000005557antagonistSubstances0.000description4
- YPHMISFOHDHNIV-FSZOTQKASA-NcycloheximideChemical compoundC1[C@@H](C)C[C@H](C)C(=O)[C@@H]1[C@H](O)CC1CC(=O)NC(=O)C1YPHMISFOHDHNIV-FSZOTQKASA-N0.000description4
- 238000001514detection methodMethods0.000description4
- SYNDQCRDGGCQRZ-VXLYETTFSA-NdynasoreChemical compoundC1=C(O)C(O)=CC=C1\C=N\NC(=O)C1=CC2=CC=CC=C2C=C1OSYNDQCRDGGCQRZ-VXLYETTFSA-N0.000description4
- MHMNJMPURVTYEJ-UHFFFAOYSA-Nfluorescein-5-isothiocyanateChemical compoundO1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21MHMNJMPURVTYEJ-UHFFFAOYSA-N0.000description4
- 238000009472formulationMethods0.000description4
- 230000003834intracellular effectEffects0.000description4
- 230000007774longtermEffects0.000description4
- 210000004126nerve fiberAnatomy0.000description4
- 230000035755proliferationEffects0.000description4
- 238000003127radioimmunoassayMethods0.000description4
- 230000019491signal transductionEffects0.000description4
- 230000009885systemic effectEffects0.000description4
- 238000012360testing methodMethods0.000description4
- 210000003556vascular endothelial cellAnatomy0.000description4
- 210000004509vascular smooth muscle cellAnatomy0.000description4
- WEVYAHXRMPXWCK-UHFFFAOYSA-NAcetonitrileChemical compoundCC#NWEVYAHXRMPXWCK-UHFFFAOYSA-N0.000description3
- 101150104494CAV1 geneProteins0.000description3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-NEthanolChemical compoundCCOLFQSCWFLJHTTHZ-UHFFFAOYSA-N0.000description3
- 238000000729Fisher's exact testMethods0.000description3
- SXRSQZLOMIGNAQ-UHFFFAOYSA-NGlutaraldehydeChemical compoundO=CCCCC=OSXRSQZLOMIGNAQ-UHFFFAOYSA-N0.000description3
- 208000032843HemorrhageDiseases0.000description3
- 101000583053Homo sapiens NGFI-A-binding protein 1Proteins0.000description3
- 108060001084LuciferaseProteins0.000description3
- 239000005089LuciferaseSubstances0.000description3
- 208000001344Macular EdemaDiseases0.000description3
- 206010025415Macular oedemaDiseases0.000description3
- OKKJLVBELUTLKV-UHFFFAOYSA-NMethanolChemical compoundOCOKKJLVBELUTLKV-UHFFFAOYSA-N0.000description3
- 241000699660Mus musculusSpecies0.000description3
- 102100030407NGFI-A-binding protein 1Human genes0.000description3
- 108091008605VEGF receptorsProteins0.000description3
- 108010073929Vascular Endothelial Growth Factor AProteins0.000description3
- 238000009825accumulationMethods0.000description3
- 229960004308acetylcysteineDrugs0.000description3
- 239000000654additiveSubstances0.000description3
- 230000002491angiogenic effectEffects0.000description3
- 230000004872arterial blood pressureEffects0.000description3
- 210000004618arterial endothelial cellAnatomy0.000description3
- 230000004888barrier functionEffects0.000description3
- 210000002469basement membraneAnatomy0.000description3
- 239000011324beadSubstances0.000description3
- 229910052796boronInorganic materials0.000description3
- 239000000872bufferSubstances0.000description3
- 230000015556catabolic processEffects0.000description3
- 239000003795chemical substances by applicationSubstances0.000description3
- 235000012000cholesterolNutrition0.000description3
- 230000009918complex formationEffects0.000description3
- UQLDLKMNUJERMK-UHFFFAOYSA-Ldi(octadecanoyloxy)leadChemical compound[Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=OUQLDLKMNUJERMK-UHFFFAOYSA-L0.000description3
- 230000003828downregulationEffects0.000description3
- 238000010201enrichment analysisMethods0.000description3
- 239000000284extractSubstances0.000description3
- 239000003889eye dropSubstances0.000description3
- 229940012356eye dropsDrugs0.000description3
- 239000003885eye ointmentSubstances0.000description3
- 230000004438eyesightEffects0.000description3
- 108091006047fluorescent proteinsProteins0.000description3
- 102000034287fluorescent proteinsHuman genes0.000description3
- 239000012634fragmentSubstances0.000description3
- 230000006870functionEffects0.000description3
- 239000008187granular materialSubstances0.000description3
- 238000013537high throughput screeningMethods0.000description3
- 230000013632homeostatic processEffects0.000description3
- 238000010166immunofluorescenceMethods0.000description3
- 238000001114immunoprecipitationMethods0.000description3
- 230000002779inactivationEffects0.000description3
- 229960004657indocyanine greenDrugs0.000description3
- MOFVSTNWEDAEEK-UHFFFAOYSA-Mindocyanine greenChemical compound[Na+].[O-]S(=O)(=O)CCCCN1C2=CC=C3C=CC=CC3=C2C(C)(C)C1=CC=CC=CC=CC1=[N+](CCCCS([O-])(=O)=O)C2=CC=C(C=CC=C3)C3=C2C1(C)CMOFVSTNWEDAEEK-UHFFFAOYSA-M0.000description3
- 230000001788irregularEffects0.000description3
- 239000003446ligandSubstances0.000description3
- 201000010230macular retinal edemaDiseases0.000description3
- 238000005259measurementMethods0.000description3
- 102000039446nucleic acidsHuman genes0.000description3
- 108020004707nucleic acidsProteins0.000description3
- 230000030648nucleus localizationEffects0.000description3
- 210000001711oxyntic cellAnatomy0.000description3
- 238000003068pathway analysisMethods0.000description3
- 239000008363phosphate bufferSubstances0.000description3
- 150000003904phospholipidsChemical class0.000description3
- 238000003752polymerase chain reactionMethods0.000description3
- 238000000513principal component analysisMethods0.000description3
- 230000008569processEffects0.000description3
- 230000004952protein activityEffects0.000description3
- 238000003753real-time PCRMethods0.000description3
- 102000005962receptorsHuman genes0.000description3
- 108020003175receptorsProteins0.000description3
- 210000002966serumAnatomy0.000description3
- 238000010186stainingMethods0.000description3
- 238000010254subcutaneous injectionMethods0.000description3
- 239000007929subcutaneous injectionSubstances0.000description3
- 239000006228supernatantSubstances0.000description3
- 239000000725suspensionSubstances0.000description3
- 229940124597therapeutic agentDrugs0.000description3
- 238000013518transcriptionMethods0.000description3
- 230000035897transcriptionEffects0.000description3
- 238000004627transmission electron microscopyMethods0.000description3
- 238000001262western blotMethods0.000description3
- FWBHETKCLVMNFS-UHFFFAOYSA-N4',6-Diamino-2-phenylindolChemical compoundC1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1FWBHETKCLVMNFS-UHFFFAOYSA-N0.000description2
- 10210003768560S ribosomal protein L22Human genes0.000description2
- 102000002260Alkaline PhosphataseHuman genes0.000description2
- 108020004774Alkaline PhosphataseProteins0.000description2
- GUBGYTABKSRVRQ-XLOQQCSPSA-NAlpha-LactoseChemical compoundO[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1OGUBGYTABKSRVRQ-XLOQQCSPSA-N0.000description2
- 108020000948Antisense OligonucleotidesProteins0.000description2
- IJGRMHOSHXDMSA-UHFFFAOYSA-NAtomic nitrogenChemical compoundN#NIJGRMHOSHXDMSA-UHFFFAOYSA-N0.000description2
- 102100026189Beta-galactosidaseHuman genes0.000description2
- 206010048962Brain oedemaDiseases0.000description2
- 102100032230Caveolae-associated protein 1Human genes0.000description2
- 108010035563Chloramphenicol O-acetyltransferaseProteins0.000description2
- 108010051219Cre recombinaseProteins0.000description2
- 241000699800CricetinaeSpecies0.000description2
- RTZKZFJDLAIYFH-UHFFFAOYSA-NDiethyl etherChemical compoundCCOCCRTZKZFJDLAIYFH-UHFFFAOYSA-N0.000description2
- 238000002965ELISAMethods0.000description2
- 101800004490Endothelin-1Proteins0.000description2
- WQZGKKKJIJFFOK-GASJEMHNSA-NGlucoseNatural productsOC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1OWQZGKKKJIJFFOK-GASJEMHNSA-N0.000description2
- 102000053187GlucuronidaseHuman genes0.000description2
- 108010060309GlucuronidaseProteins0.000description2
- 108010043121Green Fluorescent ProteinsProteins0.000description2
- 102000004144Green Fluorescent ProteinsHuman genes0.000description2
- 101001097555Homo sapiens 60S ribosomal protein L22Proteins0.000description2
- 101000925493Homo sapiens Endothelin-1Proteins0.000description2
- 206010055171Hypertensive nephropathyDiseases0.000description2
- COHYTHOBJLSHDF-UHFFFAOYSA-NIndigoChemical compoundN1C2=CC=CC=C2C(=O)C1=C1C(=O)C2=CC=CC=C2N1COHYTHOBJLSHDF-UHFFFAOYSA-N0.000description2
- 206010061218InflammationDiseases0.000description2
- GUBGYTABKSRVRQ-QKKXKWKRSA-NLactoseNatural productsOC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1OGUBGYTABKSRVRQ-QKKXKWKRSA-N0.000description2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-LMagnesium chlorideChemical compound[Mg+2].[Cl-].[Cl-]TWRXJAOTZQYOKJ-UHFFFAOYSA-L0.000description2
- 108700011259MicroRNAsProteins0.000description2
- 108700037638Neurogenic locus notch homolog protein 1Proteins0.000description2
- 108091028043Nucleic acid sequenceProteins0.000description2
- 108091093037Peptide nucleic acidProteins0.000description2
- 241000669298Pseudaulacaspis pentagonaSpecies0.000description2
- 108700008625Reporter GenesProteins0.000description2
- 108091027967Small hairpin RNAProteins0.000description2
- CDBYLPFSWZWCQE-UHFFFAOYSA-LSodium CarbonateChemical compound[Na+].[Na+].[O-]C([O-])=OCDBYLPFSWZWCQE-UHFFFAOYSA-L0.000description2
- 229920002472StarchPolymers0.000description2
- 229930006000SucroseNatural products0.000description2
- CZMRCDWAGMRECN-UGDNZRGBSA-NSucroseChemical compoundO[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1CZMRCDWAGMRECN-UGDNZRGBSA-N0.000description2
- 239000007983Tris bufferSubstances0.000description2
- 102000009524Vascular Endothelial Growth Factor AHuman genes0.000description2
- 238000007792additionMethods0.000description2
- 230000000996additive effectEffects0.000description2
- 230000002293adipogenic effectEffects0.000description2
- 150000001413amino acidsChemical group0.000description2
- 239000000074antisense oligonucleotideSubstances0.000description2
- 238000012230antisense oligonucleotidesMethods0.000description2
- 230000006907apoptotic processEffects0.000description2
- 230000008901benefitEffects0.000description2
- 108010005774beta-GalactosidaseProteins0.000description2
- 230000000740bleeding effectEffects0.000description2
- 108091005948blue fluorescent proteinsProteins0.000description2
- 208000006752brain edemaDiseases0.000description2
- 210000003169central nervous systemAnatomy0.000description2
- 230000000295complement effectEffects0.000description2
- 230000002596correlated effectEffects0.000description2
- 238000007405data analysisMethods0.000description2
- 235000014113dietary fatty acidsNutrition0.000description2
- 238000009826distributionMethods0.000description2
- 230000002526effect on cardiovascular systemEffects0.000description2
- 238000005516engineering processMethods0.000description2
- 208000001780epistaxisDiseases0.000description2
- 229940011871estrogenDrugs0.000description2
- 239000000262estrogenSubstances0.000description2
- 230000029142excretionEffects0.000description2
- 239000013604expression vectorSubstances0.000description2
- 239000000194fatty acidSubstances0.000description2
- 229930195729fatty acidNatural products0.000description2
- 150000004665fatty acidsChemical class0.000description2
- 238000001914filtrationMethods0.000description2
- 238000000684flow cytometryMethods0.000description2
- 239000012530fluidSubstances0.000description2
- 238000013534fluorescein angiographyMethods0.000description2
- 238000010230functional analysisMethods0.000description2
- 239000000499gelSubstances0.000description2
- 230000002068genetic effectEffects0.000description2
- 239000005090green fluorescent proteinSubstances0.000description2
- 229910052739hydrogenInorganic materials0.000description2
- 201000009939hypertensive encephalopathyDiseases0.000description2
- 238000003018immunoassayMethods0.000description2
- 230000004054inflammatory processEffects0.000description2
- 230000025563intercellular transportEffects0.000description2
- 238000010255intramuscular injectionMethods0.000description2
- 239000007927intramuscular injectionSubstances0.000description2
- 239000007928intraperitoneal injectionSubstances0.000description2
- 238000010253intravenous injectionMethods0.000description2
- 239000008101lactoseSubstances0.000description2
- 230000000670limiting effectEffects0.000description2
- 238000012417linear regressionMethods0.000description2
- 150000002632lipidsChemical class0.000description2
- 239000007788liquidSubstances0.000description2
- HQKMJHAJHXVSDF-UHFFFAOYSA-Lmagnesium stearateChemical compound[Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=OHQKMJHAJHXVSDF-UHFFFAOYSA-L0.000description2
- 239000002609mediumSubstances0.000description2
- 210000004379membraneAnatomy0.000description2
- 239000012528membraneSubstances0.000description2
- 239000002679microRNASubstances0.000description2
- 230000004048modificationEffects0.000description2
- 238000012986modificationMethods0.000description2
- 230000000877morphologic effectEffects0.000description2
- 229910052757nitrogenInorganic materials0.000description2
- 238000007911parenteral administrationMethods0.000description2
- 230000001575pathological effectEffects0.000description2
- 230000035699permeabilityEffects0.000description2
- 229910052698phosphorusInorganic materials0.000description2
- 229920002981polyvinylidene fluoridePolymers0.000description2
- 230000002265preventionEffects0.000description2
- 108090000765processed proteins & peptidesProteins0.000description2
- 230000009467reductionEffects0.000description2
- 210000003705ribosomeAnatomy0.000description2
- 230000011218segmentationEffects0.000description2
- 239000004055small Interfering RNASubstances0.000description2
- 241000894007speciesSpecies0.000description2
- 239000008107starchSubstances0.000description2
- 235000019698starchNutrition0.000description2
- 229940032147starchDrugs0.000description2
- 238000007619statistical methodMethods0.000description2
- 238000003756stirringMethods0.000description2
- 239000000758substrateSubstances0.000description2
- 239000005720sucroseSubstances0.000description2
- CCEKAJIANROZEO-UHFFFAOYSA-NsulfluramidChemical groupCCNS(=O)(=O)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)FCCEKAJIANROZEO-UHFFFAOYSA-N0.000description2
- 238000003786synthesis reactionMethods0.000description2
- 239000006188syrupSubstances0.000description2
- 235000020357syrupNutrition0.000description2
- 239000003826tabletSubstances0.000description2
- WGTODYJZXSJIAG-UHFFFAOYSA-Ntetramethylrhodamine chlorideChemical compound[Cl-].C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=CC=C1C(O)=OWGTODYJZXSJIAG-UHFFFAOYSA-N0.000description2
- 238000011200topical administrationMethods0.000description2
- 230000002103transcriptional effectEffects0.000description2
- 238000013519translationMethods0.000description2
- LENZDBCJOHFCAS-UHFFFAOYSA-NtrisChemical compoundOCC(N)(CO)COLENZDBCJOHFCAS-UHFFFAOYSA-N0.000description2
- 210000003606umbilical veinAnatomy0.000description2
- 208000019553vascular diseaseDiseases0.000description2
- 230000006492vascular dysfunctionEffects0.000description2
- 229940124676vascular endothelial growth factor receptorDrugs0.000description2
- 108091005957yellow fluorescent proteinsProteins0.000description2
- WCWUXEGQKLTGDX-LLVKDONJSA-N(2R)-1-[[4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-5-methyl-6-pyrrolo[2,1-f][1,2,4]triazinyl]oxy]-2-propanolChemical compoundC1=C2NC(C)=CC2=C(F)C(OC2=NC=NN3C=C(C(=C32)C)OC[C@H](O)C)=C1WCWUXEGQKLTGDX-LLVKDONJSA-N0.000description1
- HSINOMROUCMIEA-FGVHQWLLSA-N(2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acidChemical compoundC([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21HSINOMROUCMIEA-FGVHQWLLSA-N0.000description1
- TZCPCKNHXULUIY-RGULYWFUSA-N1,2-distearoyl-sn-glycero-3-phosphoserineChemical compoundCCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCCTZCPCKNHXULUIY-RGULYWFUSA-N0.000description1
- 1021000303881-phosphatidylinositol 4,5-bisphosphate phosphodiesterase beta-3Human genes0.000description1
- LSIXBBPOJBJQHN-UHFFFAOYSA-N2,3-Dimethylbicyclo[2.2.1]hept-2-eneChemical compoundC1CC2C(C)=C(C)C1C2LSIXBBPOJBJQHN-UHFFFAOYSA-N0.000description1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acidChemical compoundC([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1FWMNVWWHGCHHJJ-SKKKGAJSSA-N0.000description1
- 208000020296Abnormal vascular morphologyDiseases0.000description1
- 244000215068Acacia senegalSpecies0.000description1
- 101150020966Acta2 geneProteins0.000description1
- 102100036732Actin, aortic smooth muscleHuman genes0.000description1
- 108010085238ActinsProteins0.000description1
- 102000007469ActinsHuman genes0.000description1
- 102100033346Adenosine receptor A1Human genes0.000description1
- 102000009346Adenosine receptorsHuman genes0.000description1
- 108050000203Adenosine receptorsProteins0.000description1
- 239000012103Alexa Fluor 488Substances0.000description1
- 239000012110Alexa Fluor 594Substances0.000description1
- 239000012099Alexa Fluor familySubstances0.000description1
- ATRRKUHOCOJYRX-UHFFFAOYSA-NAmmonium bicarbonateChemical compound[NH4+].OC([O-])=OATRRKUHOCOJYRX-UHFFFAOYSA-N0.000description1
- 229910000013Ammonium bicarbonateInorganic materials0.000description1
- 102000002659Amyloid Precursor Protein SecretasesHuman genes0.000description1
- 108010043324Amyloid Precursor Protein SecretasesProteins0.000description1
- 206010002091AnaesthesiaDiseases0.000description1
- 208000028185AngioedemaDiseases0.000description1
- 241000586542Aonidiella citrinaSpecies0.000description1
- 206010003445AscitesDiseases0.000description1
- MLDQJTXFUGDVEO-UHFFFAOYSA-NBAY-43-9006Chemical compoundC1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1MLDQJTXFUGDVEO-UHFFFAOYSA-N0.000description1
- 102000053642Catalytic RNAHuman genes0.000description1
- 108090000994Catalytic RNAProteins0.000description1
- 101150047856Cav2 geneProteins0.000description1
- 108050005260Caveolae-associated protein 1Proteins0.000description1
- 102100032231Caveolae-associated protein 2Human genes0.000description1
- 102100024937Caveolae-associated protein 3Human genes0.000description1
- 241000700198CaviaSpecies0.000description1
- 102000008186CollagenHuman genes0.000description1
- 108010035532CollagenProteins0.000description1
- 244000180278Copernicia pruniferaSpecies0.000description1
- 235000010919Copernicia pruniferaNutrition0.000description1
- 229920002261Corn starchPolymers0.000description1
- 102100028233Coronin-1AHuman genes0.000description1
- FBPFZTCFMRRESA-FSIIMWSLSA-ND-GlucitolNatural productsOC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)COFBPFZTCFMRRESA-FSIIMWSLSA-N0.000description1
- FBPFZTCFMRRESA-KVTDHHQDSA-ND-MannitolChemical compoundOC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)COFBPFZTCFMRRESA-KVTDHHQDSA-N0.000description1
- FBPFZTCFMRRESA-JGWLITMVSA-ND-glucitolChemical compoundOC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)COFBPFZTCFMRRESA-JGWLITMVSA-N0.000description1
- 108091027757DeoxyribozymeProteins0.000description1
- 108091005941EBFPProteins0.000description1
- 102000002045EndothelinHuman genes0.000description1
- 108050009340EndothelinProteins0.000description1
- 102100029110Endothelin-2Human genes0.000description1
- 241000283074Equus asinusSpecies0.000description1
- 102000010834Extracellular Matrix ProteinsHuman genes0.000description1
- 108010037362Extracellular Matrix ProteinsProteins0.000description1
- 241000282326Felis catusSpecies0.000description1
- 239000004606Fillers/ExtendersSubstances0.000description1
- 101150112014Gapdh geneProteins0.000description1
- 108010010803GelatinProteins0.000description1
- 208000010412GlaucomaDiseases0.000description1
- 102100031181Glyceraldehyde-3-phosphate dehydrogenaseHuman genes0.000description1
- JZNWSCPGTDBMEW-UHFFFAOYSA-NGlycerophosphorylethanolaminNatural productsNCCOP(O)(=O)OCC(O)COJZNWSCPGTDBMEW-UHFFFAOYSA-N0.000description1
- ZWZWYGMENQVNFU-UHFFFAOYSA-NGlycerophosphorylserinNatural productsOC(=O)C(N)COP(O)(=O)OCC(O)COZWZWYGMENQVNFU-UHFFFAOYSA-N0.000description1
- 229920000084Gum arabicPolymers0.000description1
- 101150092640HES1 geneProteins0.000description1
- 108010081348HRT1 protein HairyProteins0.000description1
- 101710154606HemagglutininProteins0.000description1
- HTTJABKRGRZYRN-UHFFFAOYSA-NHeparinChemical compoundOC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1HTTJABKRGRZYRN-UHFFFAOYSA-N0.000description1
- 101000583069Homo sapiens 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase beta-3Proteins0.000description1
- 101000929319Homo sapiens Actin, aortic smooth muscleProteins0.000description1
- 101000799712Homo sapiens Adenosine receptor A1Proteins0.000description1
- 101000869049Homo sapiens Caveolae-associated protein 1Proteins0.000description1
- 101000869050Homo sapiens Caveolae-associated protein 2Proteins0.000description1
- 101000761506Homo sapiens Caveolae-associated protein 3Proteins0.000description1
- 101000860852Homo sapiens Coronin-1AProteins0.000description1
- 101000841197Homo sapiens Endothelin-2Proteins0.000description1
- 101000978766Homo sapiens Neurogenic locus notch homolog protein 1Proteins0.000description1
- 101001098529Homo sapiens Proteinase-activated receptor 1Proteins0.000description1
- 101000743845Homo sapiens Ras-related protein Rab-10Proteins0.000description1
- 101000629597Homo sapiens Sterol regulatory element-binding protein 1Proteins0.000description1
- 101000652324Homo sapiens Transcription factor SOX-17Proteins0.000description1
- 101000851018Homo sapiens Vascular endothelial growth factor receptor 1Proteins0.000description1
- 101000851007Homo sapiens Vascular endothelial growth factor receptor 2Proteins0.000description1
- 101000851030Homo sapiens Vascular endothelial growth factor receptor 3Proteins0.000description1
- UFHFLCQGNIYNRP-UHFFFAOYSA-NHydrogenChemical compound[H][H]UFHFLCQGNIYNRP-UHFFFAOYSA-N0.000description1
- 229920002153Hydroxypropyl cellulosePolymers0.000description1
- 208000031226HyperlipidaemiaDiseases0.000description1
- 101150088608Kdr geneProteins0.000description1
- YQEZLKZALYSWHR-UHFFFAOYSA-NKetamineChemical compoundC=1C=CC=C(Cl)C=1C1(NC)CCCCC1=OYQEZLKZALYSWHR-UHFFFAOYSA-N0.000description1
- 239000002147L01XE04 - SunitinibSubstances0.000description1
- 239000005511L01XE05 - SorafenibSubstances0.000description1
- 239000002138L01XE21 - RegorafenibSubstances0.000description1
- 108090001090LectinsProteins0.000description1
- 102000004856LectinsHuman genes0.000description1
- 229930195725MannitolNatural products0.000description1
- 229920000168Microcrystalline cellulosePolymers0.000description1
- 108700027649Mitogen-Activated Protein Kinase 3Proteins0.000description1
- 102100024192Mitogen-activated protein kinase 3Human genes0.000description1
- 229920000881Modified starchPolymers0.000description1
- 101100387419Mus musculus Dll4 geneProteins0.000description1
- 101100372766Mus musculus Kdr geneProteins0.000description1
- 101100294417Mus musculus Notch1 geneProteins0.000description1
- 208000006550MydriasisDiseases0.000description1
- WHNWPMSKXPGLAX-UHFFFAOYSA-NN-Vinyl-2-pyrrolidoneChemical compoundC=CN1CCCC1=OWHNWPMSKXPGLAX-UHFFFAOYSA-N0.000description1
- 206010028980NeoplasmDiseases0.000description1
- 238000000636Northern blottingMethods0.000description1
- 102000001753Notch4 ReceptorHuman genes0.000description1
- 108010029741Notch4 ReceptorProteins0.000description1
- 208000008589ObesityDiseases0.000description1
- 235000011205OcimumNutrition0.000description1
- 241001529734OcimumSpecies0.000description1
- 108091034117OligonucleotideProteins0.000description1
- 101710093908Outer capsid protein VP4Proteins0.000description1
- 101710135467Outer capsid protein sigma-1Proteins0.000description1
- JYDNKGUBLIKNAM-UHFFFAOYSA-NOxyallobutulinNatural productsC1CC(=O)C(C)(C)C2CCC3(C)C4(C)CCC5(CO)CCC(C(=C)C)C5C4CCC3C21CJYDNKGUBLIKNAM-UHFFFAOYSA-N0.000description1
- 241000586605Parlatoria proteusSpecies0.000description1
- 108091005804PeptidasesProteins0.000description1
- 241000009328PerroSpecies0.000description1
- 102000004160Phosphoric Monoester HydrolasesHuman genes0.000description1
- 108090000608Phosphoric Monoester HydrolasesProteins0.000description1
- OAICVXFJPJFONN-UHFFFAOYSA-NPhosphorusChemical compound[P]OAICVXFJPJFONN-UHFFFAOYSA-N0.000description1
- 102100040681Platelet-derived growth factor CHuman genes0.000description1
- GOOHAUXETOMSMM-UHFFFAOYSA-NPropylene oxideChemical compoundCC1CO1GOOHAUXETOMSMM-UHFFFAOYSA-N0.000description1
- 239000004365ProteaseSubstances0.000description1
- 229940124158Protease/peptidase inhibitorDrugs0.000description1
- 101710176177Protein A56Proteins0.000description1
- 102100037136Proteinase-activated receptor 1Human genes0.000description1
- 239000012083RIPA bufferSubstances0.000description1
- 238000002123RNA extractionMethods0.000description1
- 238000011529RT qPCRMethods0.000description1
- 102100039103Ras-related protein Rab-10Human genes0.000description1
- 208000017442Retinal diseaseDiseases0.000description1
- 102100037486Reverse transcriptase/ribonuclease HHuman genes0.000description1
- 102000006382RibonucleasesHuman genes0.000description1
- 108010083644RibonucleasesProteins0.000description1
- 102000013968STAT6 Transcription FactorHuman genes0.000description1
- 108010011005STAT6 Transcription FactorProteins0.000description1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-NSilicium dioxideChemical compoundO=[Si]=OVYPSYNLAJGMNEJ-UHFFFAOYSA-N0.000description1
- FAPWRFPIFSIZLT-UHFFFAOYSA-MSodium chlorideChemical compound[Na+].[Cl-]FAPWRFPIFSIZLT-UHFFFAOYSA-M0.000description1
- 235000021355Stearic acidNutrition0.000description1
- 101710172711Structural proteinProteins0.000description1
- 238000000692Student's t-testMethods0.000description1
- 235000019486Sunflower oilNutrition0.000description1
- 102100030243Transcription factor SOX-17Human genes0.000description1
- 239000013504Triton X-100Substances0.000description1
- 229920004890Triton X-100Polymers0.000description1
- BGDKAVGWHJFAGW-UHFFFAOYSA-NTropicamideChemical compoundC=1C=CC=CC=1C(CO)C(=O)N(CC)CC1=CC=NC=C1BGDKAVGWHJFAGW-UHFFFAOYSA-N0.000description1
- 238000010162Tukey testMethods0.000description1
- 108010073923Vascular Endothelial Growth Factor CProteins0.000description1
- 108010073919Vascular Endothelial Growth Factor DProteins0.000description1
- 102100038232Vascular endothelial growth factor CHuman genes0.000description1
- 102100038234Vascular endothelial growth factor DHuman genes0.000description1
- 102100033178Vascular endothelial growth factor receptor 1Human genes0.000description1
- 102100033179Vascular endothelial growth factor receptor 3Human genes0.000description1
- 241000700605VirusesSpecies0.000description1
- ATBOMIWRCZXYSZ-XZBBILGWSA-N[1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoateChemical compoundCCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCCATBOMIWRCZXYSZ-XZBBILGWSA-N0.000description1
- JLCPHMBAVCMARE-UHFFFAOYSA-N[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphatePolymersCc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=OJLCPHMBAVCMARE-UHFFFAOYSA-N0.000description1
- YKTSYUJCYHOUJP-UHFFFAOYSA-N[O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-]Chemical compound[O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-]YKTSYUJCYHOUJP-UHFFFAOYSA-N0.000description1
- 238000010521absorption reactionMethods0.000description1
- QPMSXSBEVQLBIL-CZRHPSIPSA-Nac1mix0pChemical compoundC1=CC=C2N(C[C@H](C)CN(C)C)C3=CC(OC)=CC=C3SC2=C1.O([C@H]1[C@]2(OC)C=CC34C[C@@H]2[C@](C)(O)CCC)C2=C5[C@]41CCN(C)[C@@H]3CC5=CC=C2OQPMSXSBEVQLBIL-CZRHPSIPSA-N0.000description1
- 239000000205acacia gumSubstances0.000description1
- 235000010489acacia gumNutrition0.000description1
- AWUCVROLDVIAJX-UHFFFAOYSA-Nalpha-glycerophosphateNatural productsOCC(O)COP(O)(O)=OAWUCVROLDVIAJX-UHFFFAOYSA-N0.000description1
- 230000004075alterationEffects0.000description1
- XAGFODPZIPBFFR-UHFFFAOYSA-NaluminiumChemical compound[Al]XAGFODPZIPBFFR-UHFFFAOYSA-N0.000description1
- 229910052782aluminiumInorganic materials0.000description1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-Kaluminium tristearateChemical compound[Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=OCEGOLXSVJUTHNZ-UHFFFAOYSA-K0.000description1
- 229940063655aluminum stearateDrugs0.000description1
- 235000012538ammonium bicarbonateNutrition0.000description1
- 239000001099ammonium carbonateSubstances0.000description1
- 230000037005anaesthesiaEffects0.000description1
- 229940121369angiogenesis inhibitorDrugs0.000description1
- 239000004037angiogenesis inhibitorSubstances0.000description1
- 238000010171animal modelMethods0.000description1
- 239000000427antigenSubstances0.000description1
- 108091007433antigensProteins0.000description1
- 102000036639antigensHuman genes0.000description1
- 230000001640apoptogenic effectEffects0.000description1
- 210000003567ascitic fluidAnatomy0.000description1
- WQZGKKKJIJFFOK-VFUOTHLCSA-Nbeta-D-glucoseChemical compoundOC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1OWQZGKKKJIJFFOK-VFUOTHLCSA-N0.000description1
- FVWJYYTZTCVBKE-ROUWMTJPSA-NbetulinChemical compoundC1C[C@H](O)C(C)(C)[C@@H]2CC[C@@]3(C)[C@]4(C)CC[C@@]5(CO)CC[C@@H](C(=C)C)[C@@H]5[C@H]4CC[C@@H]3[C@]21CFVWJYYTZTCVBKE-ROUWMTJPSA-N0.000description1
- MVIRREHRVZLANQ-UHFFFAOYSA-NbetulinNatural productsCC(=O)OC1CCC2(C)C(CCC3(C)C2CC=C4C5C(CCC5(CO)CCC34C)C(=C)C)C1(C)CMVIRREHRVZLANQ-UHFFFAOYSA-N0.000description1
- 239000003613bile acidSubstances0.000description1
- 239000011230binding agentSubstances0.000description1
- 230000031018biological processes and functionsEffects0.000description1
- 238000001574biopsyMethods0.000description1
- 230000017531blood circulationEffects0.000description1
- 210000001124body fluidAnatomy0.000description1
- 239000010839body fluidSubstances0.000description1
- 239000012267brineSubstances0.000description1
- 210000005252bulbus oculiAnatomy0.000description1
- FUFJGUQYACFECW-UHFFFAOYSA-Lcalcium hydrogenphosphateChemical compound[Ca+2].OP([O-])([O-])=OFUFJGUQYACFECW-UHFFFAOYSA-L0.000description1
- CJZGTCYPCWQAJB-UHFFFAOYSA-Lcalcium stearateChemical compound[Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=OCJZGTCYPCWQAJB-UHFFFAOYSA-L0.000description1
- 239000008116calcium stearateSubstances0.000description1
- 235000013539calcium stearateNutrition0.000description1
- 238000004422calculation algorithmMethods0.000description1
- 230000008777canonical pathwayEffects0.000description1
- 229910052799carbonInorganic materials0.000description1
- PFKFTWBEEFSNDU-UHFFFAOYSA-NcarbonyldiimidazoleChemical compoundC1=CN=CN1C(=O)N1C=CN=C1PFKFTWBEEFSNDU-UHFFFAOYSA-N0.000description1
- 210000000748cardiovascular systemAnatomy0.000description1
- 230000000453cell autonomous effectEffects0.000description1
- 239000006143cell culture mediumSubstances0.000description1
- 230000030833cell deathEffects0.000description1
- 230000024245cell differentiationEffects0.000description1
- 230000010261cell growthEffects0.000description1
- 239000013592cell lysateSubstances0.000description1
- 230000004663cell proliferationEffects0.000description1
- 230000009134cell regulationEffects0.000description1
- 239000001913celluloseSubstances0.000description1
- 210000001175cerebrospinal fluidAnatomy0.000description1
- 239000003153chemical reaction reagentSubstances0.000description1
- 230000031154cholesterol homeostasisEffects0.000description1
- 239000003593chromogenic compoundSubstances0.000description1
- 238000011278co-treatmentMethods0.000description1
- 229920001436collagenPolymers0.000description1
- 229940075614colloidal silicon dioxideDrugs0.000description1
- 239000002299complementary DNASubstances0.000description1
- 238000003271compound fluorescence assayMethods0.000description1
- 238000012790confirmationMethods0.000description1
- 239000008120corn starchSubstances0.000description1
- 238000012937correctionMethods0.000description1
- 230000000875corresponding effectEffects0.000description1
- 238000011461current therapyMethods0.000description1
- 108010082025cyan fluorescent proteinProteins0.000description1
- 230000007423decreaseEffects0.000description1
- 230000018044dehydrationEffects0.000description1
- 238000006297dehydration reactionMethods0.000description1
- 239000008121dextroseSubstances0.000description1
- 238000003745diagnosisMethods0.000description1
- 229910003460diamondInorganic materials0.000description1
- 239000010432diamondSubstances0.000description1
- 230000003205diastolic effectEffects0.000description1
- 235000019700dicalcium phosphateNutrition0.000description1
- 235000005911dietNutrition0.000description1
- 230000037213dietEffects0.000description1
- 230000004069differentiationEffects0.000description1
- 238000009792diffusion processMethods0.000description1
- 239000003085diluting agentSubstances0.000description1
- 239000007884disintegrantSubstances0.000description1
- 208000035475disorderDiseases0.000description1
- 238000002224dissectionMethods0.000description1
- 238000004821distillationMethods0.000description1
- 239000002552dosage formSubstances0.000description1
- 230000002222downregulating effectEffects0.000description1
- 239000003651drinking waterSubstances0.000description1
- 235000020188drinking waterNutrition0.000description1
- 239000006196dropSubstances0.000description1
- 229940000406drug candidateDrugs0.000description1
- 238000012377drug deliveryMethods0.000description1
- 230000002497edematous effectEffects0.000description1
- 239000003995emulsifying agentSubstances0.000description1
- 239000000839emulsionSubstances0.000description1
- 230000012202endocytosisEffects0.000description1
- ZUBDGKVDJUIMQQ-UBFCDGJISA-Nendothelin-1Chemical compoundC([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1ZUBDGKVDJUIMQQ-UBFCDGJISA-N0.000description1
- 108010048367enhanced green fluorescent proteinProteins0.000description1
- 238000006911enzymatic reactionMethods0.000description1
- 239000003822epoxy resinSubstances0.000description1
- 210000003743erythrocyteAnatomy0.000description1
- 230000005284excitationEffects0.000description1
- 210000001808exosomeAnatomy0.000description1
- 210000002744extracellular matrixAnatomy0.000description1
- 238000000605extractionMethods0.000description1
- 230000002349favourable effectEffects0.000description1
- 239000000945fillerSubstances0.000description1
- 239000000834fixativeSubstances0.000description1
- GNBHRKFJIUUOQI-UHFFFAOYSA-NfluoresceinChemical compoundO1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21GNBHRKFJIUUOQI-UHFFFAOYSA-N0.000description1
- 229940020947fluorescein sodiumDrugs0.000description1
- 230000003325follicularEffects0.000description1
- 230000037406food intakeEffects0.000description1
- 230000004927fusionEffects0.000description1
- 239000008273gelatinSubstances0.000description1
- 229920000159gelatinPolymers0.000description1
- 235000019322gelatineNutrition0.000description1
- 235000011852gelatine dessertsNutrition0.000description1
- 239000008103glucoseSubstances0.000description1
- 108020004445glyceraldehyde-3-phosphate dehydrogenaseProteins0.000description1
- 150000002327glycerophospholipidsChemical class0.000description1
- 230000003862health statusEffects0.000description1
- 239000000185hemagglutininSubstances0.000description1
- 229960002897heparinDrugs0.000description1
- 229920000669heparinPolymers0.000description1
- 101150030438hes2 geneProteins0.000description1
- 238000007417hierarchical cluster analysisMethods0.000description1
- 230000004402high myopiaEffects0.000description1
- 238000004128high performance liquid chromatographyMethods0.000description1
- 239000012145high-salt bufferSubstances0.000description1
- 238000000265homogenisationMethods0.000description1
- 102000055590human KDRHuman genes0.000description1
- 102000045609human NOTCH1Human genes0.000description1
- 102000049234human SREBF1Human genes0.000description1
- 239000001863hydroxypropyl celluloseSubstances0.000description1
- 235000010977hydroxypropyl celluloseNutrition0.000description1
- 230000036039immunityEffects0.000description1
- 230000000984immunochemical effectEffects0.000description1
- 238000003364immunohistochemistryMethods0.000description1
- 238000010324immunological assayMethods0.000description1
- 239000007943implantSubstances0.000description1
- 238000000338in vitroMethods0.000description1
- 238000009540indirect ophthalmoscopyMethods0.000description1
- 230000006698inductionEffects0.000description1
- 238000001802infusionMethods0.000description1
- 208000014674injuryDiseases0.000description1
- 238000003780insertionMethods0.000description1
- 230000037431insertionEffects0.000description1
- 230000002452interceptive effectEffects0.000description1
- 230000004410intraocular pressureEffects0.000description1
- 238000007912intraperitoneal administrationMethods0.000description1
- 239000007951isotonicity adjusterSubstances0.000description1
- 229960003299ketamineDrugs0.000description1
- 210000003734kidneyAnatomy0.000description1
- 238000002372labellingMethods0.000description1
- 229960001375lactoseDrugs0.000description1
- 238000013532laser treatmentMethods0.000description1
- 210000005240left ventricleAnatomy0.000description1
- MPVGZUGXCQEXTM-UHFFFAOYSA-NlinifanibChemical compoundCC1=CC=C(F)C(NC(=O)NC=2C=CC(=CC=2)C=2C=3C(N)=NNC=3C=CC=2)=C1MPVGZUGXCQEXTM-UHFFFAOYSA-N0.000description1
- 229950002216linifanibDrugs0.000description1
- 230000004322lipid homeostasisEffects0.000description1
- 244000144972livestockSpecies0.000description1
- 230000004807localizationEffects0.000description1
- 238000004020luminiscence typeMethods0.000description1
- 238000010841mRNA extractionMethods0.000description1
- 208000002780macular degenerationDiseases0.000description1
- 208000038015macular diseaseDiseases0.000description1
- 229910001629magnesium chlorideInorganic materials0.000description1
- 235000019359magnesium stearateNutrition0.000description1
- 239000000594mannitolSubstances0.000description1
- 235000010355mannitolNutrition0.000description1
- 238000004519manufacturing processMethods0.000description1
- 230000035800maturationEffects0.000description1
- 108020004999messenger RNAProteins0.000description1
- 230000006609metabolic stressEffects0.000description1
- 238000002493microarrayMethods0.000description1
- 230000007570microbleedingEffects0.000description1
- 229940016286microcrystalline celluloseDrugs0.000description1
- 235000019813microcrystalline celluloseNutrition0.000description1
- 239000008108microcrystalline celluloseSubstances0.000description1
- 239000011859microparticleSubstances0.000description1
- 239000004005microsphereSubstances0.000description1
- 230000005012migrationEffects0.000description1
- 238000013508migrationMethods0.000description1
- 235000013336milkNutrition0.000description1
- 210000004080milkAnatomy0.000description1
- 239000008267milkSubstances0.000description1
- 238000003032molecular dockingMethods0.000description1
- 230000009456molecular mechanismEffects0.000description1
- 230000004660morphological changeEffects0.000description1
- 230000003562morphometric effectEffects0.000description1
- 238000013425morphometryMethods0.000description1
- 239000012120mounting mediaSubstances0.000description1
- 238000010172mouse modelMethods0.000description1
- 239000002105nanoparticleSubstances0.000description1
- 229930014626natural productNatural products0.000description1
- 239000013642negative controlSubstances0.000description1
- 230000009125negative feedback regulationEffects0.000description1
- 239000002547new drugSubstances0.000description1
- 239000012299nitrogen atmosphereSubstances0.000description1
- 238000010606normalizationMethods0.000description1
- 238000012758nuclear stainingMethods0.000description1
- 235000020824obesityNutrition0.000description1
- QIQXTHQIDYTFRH-UHFFFAOYSA-Noctadecanoic acidChemical compoundCCCCCCCCCCCCCCCCCC(O)=OQIQXTHQIDYTFRH-UHFFFAOYSA-N0.000description1
- OQCDKBAXFALNLD-UHFFFAOYSA-Noctadecanoic acidNatural productsCCCCCCCC(C)CCCCCCCCC(O)=OOQCDKBAXFALNLD-UHFFFAOYSA-N0.000description1
- 230000003287optical effectEffects0.000description1
- 239000012044organic layerSubstances0.000description1
- 230000003204osmotic effectEffects0.000description1
- 230000002018overexpressionEffects0.000description1
- 230000036284oxygen consumptionEffects0.000description1
- 230000036961partial effectEffects0.000description1
- 230000008506pathogenesisEffects0.000description1
- 230000001991pathophysiological effectEffects0.000description1
- 230000007310pathophysiologyEffects0.000description1
- 239000008188pelletSubstances0.000description1
- 239000000137peptide hydrolase inhibitorSubstances0.000description1
- 230000010412perfusionEffects0.000description1
- 210000002333peridermal cellAnatomy0.000description1
- 210000004786perivascular cellAnatomy0.000description1
- 238000002823phage displayMethods0.000description1
- 239000000546pharmaceutical excipientSubstances0.000description1
- SONNWYBIRXJNDC-VIFPVBQESA-NphenylephrineChemical compoundCNC[C@H](O)C1=CC=CC(O)=C1SONNWYBIRXJNDC-VIFPVBQESA-N0.000description1
- 229960001802phenylephrineDrugs0.000description1
- 229940102707phenylephrine 5 mgDrugs0.000description1
- WTJKGGKOPKCXLL-RRHRGVEJSA-NphosphatidylcholineChemical compoundCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCCWTJKGGKOPKCXLL-RRHRGVEJSA-N0.000description1
- 150000008104phosphatidylethanolaminesChemical class0.000description1
- 150000003905phosphatidylinositolsChemical class0.000description1
- 239000011574phosphorusSubstances0.000description1
- 239000006187pillSubstances0.000description1
- 210000002381plasmaAnatomy0.000description1
- 108010017992platelet-derived growth factor CProteins0.000description1
- 229920000647polyepoxidePolymers0.000description1
- 102000040430polynucleotideHuman genes0.000description1
- 108091033319polynucleotideProteins0.000description1
- 239000002157polynucleotideSubstances0.000description1
- 210000002729polyribosomeAnatomy0.000description1
- 235000013855polyvinylpyrrolidoneNutrition0.000description1
- 229920000036polyvinylpyrrolidonePolymers0.000description1
- 239000011148porous materialSubstances0.000description1
- 239000013641positive controlSubstances0.000description1
- 238000013105post hoc analysisMethods0.000description1
- 229940069328povidoneDrugs0.000description1
- 239000000843powderSubstances0.000description1
- 235000019814powdered celluloseNutrition0.000description1
- 229920003124powdered cellulosePolymers0.000description1
- 239000002244precipitateSubstances0.000description1
- 239000003755preservative agentSubstances0.000description1
- 102000004196processed proteins & peptidesHuman genes0.000description1
- 238000012545processingMethods0.000description1
- 239000000047productSubstances0.000description1
- 230000017854proteolysisEffects0.000description1
- 229960003876ranibizumabDrugs0.000description1
- 239000011541reaction mixtureSubstances0.000description1
- 108700015048receptor decoy activity proteinsProteins0.000description1
- 108091008598receptor tyrosine kinasesProteins0.000description1
- 102000027426receptor tyrosine kinasesHuman genes0.000description1
- 238000011084recoveryMethods0.000description1
- 230000011514reflexEffects0.000description1
- 208000014733refractive errorDiseases0.000description1
- 229960004836regorafenibDrugs0.000description1
- FNHKPVJBJVTLMP-UHFFFAOYSA-NregorafenibChemical compoundC1=NC(C(=O)NC)=CC(OC=2C=C(F)C(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1FNHKPVJBJVTLMP-UHFFFAOYSA-N0.000description1
- 230000030198regulation of embryonic developmentEffects0.000description1
- 230000024769regulation of transportEffects0.000description1
- 230000004044responseEffects0.000description1
- 238000010839reverse transcriptionMethods0.000description1
- 238000012552reviewMethods0.000description1
- 239000003161ribonuclease inhibitorSubstances0.000description1
- 108091092562ribozymeProteins0.000description1
- 101150043079rpl22 geneProteins0.000description1
- 210000003296salivaAnatomy0.000description1
- 230000009291secondary effectEffects0.000description1
- 230000028327secretionEffects0.000description1
- 230000035945sensitivityEffects0.000description1
- 230000007727signaling mechanismEffects0.000description1
- 229910052709silverInorganic materials0.000description1
- 239000004332silverSubstances0.000description1
- 210000003491skinAnatomy0.000description1
- 150000003384small moleculesChemical class0.000description1
- 229910000029sodium carbonateInorganic materials0.000description1
- 239000011780sodium chlorideSubstances0.000description1
- 238000002415sodium dodecyl sulfate polyacrylamide gel electrophoresisMethods0.000description1
- 229920003109sodium starch glycolatePolymers0.000description1
- 229940079832sodium starch glycolateDrugs0.000description1
- 239000008109sodium starch glycolateSubstances0.000description1
- HPALAKNZSZLMCH-UHFFFAOYSA-Msodium;chloride;hydrateChemical compoundO.[Na+].[Cl-]HPALAKNZSZLMCH-UHFFFAOYSA-M0.000description1
- 239000007787solidSubstances0.000description1
- 239000002904solventSubstances0.000description1
- 229960003787sorafenibDrugs0.000description1
- 239000000600sorbitolSubstances0.000description1
- 230000003595spectral effectEffects0.000description1
- 239000003381stabilizerSubstances0.000description1
- 239000008117stearic acidSubstances0.000description1
- 238000007920subcutaneous administrationMethods0.000description1
- 238000006467substitution reactionMethods0.000description1
- 239000002600sunflower oilSubstances0.000description1
- 229960001796sunitinibDrugs0.000description1
- WINHZLLDWRZWRT-ATVHPVEESA-NsunitinibChemical compoundCCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1CWINHZLLDWRZWRT-ATVHPVEESA-N0.000description1
- 230000000153supplemental effectEffects0.000description1
- 239000000829suppositorySubstances0.000description1
- 239000004094surface-active agentSubstances0.000description1
- 238000001356surgical procedureMethods0.000description1
- 239000000375suspending agentSubstances0.000description1
- 230000002459sustained effectEffects0.000description1
- 210000004243sweatAnatomy0.000description1
- 210000001179synovial fluidAnatomy0.000description1
- 230000035488systolic blood pressureEffects0.000description1
- 239000000454talcSubstances0.000description1
- 229910052623talcInorganic materials0.000description1
- 230000008685targetingEffects0.000description1
- 230000001225therapeutic effectEffects0.000description1
- 238000002560therapeutic procedureMethods0.000description1
- 230000008719thickeningEffects0.000description1
- 238000003325tomographyMethods0.000description1
- 231100000820toxicity testToxicity0.000description1
- 108091008023transcriptional regulatorsProteins0.000description1
- 230000009261transgenic effectEffects0.000description1
- 230000001052transient effectEffects0.000description1
- 230000005945translocationEffects0.000description1
- 230000008733traumaEffects0.000description1
- 230000001960triggered effectEffects0.000description1
- DCXXMTOCNZCJGO-UHFFFAOYSA-NtristearoylglycerolChemical compoundCCCCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCCCCDCXXMTOCNZCJGO-UHFFFAOYSA-N0.000description1
- 229960004791tropicamideDrugs0.000description1
- 229940070684tropicamide 5 mg/mlDrugs0.000description1
- 230000004614tumor growthEffects0.000description1
- 208000001072type 2 diabetes mellitusDiseases0.000description1
- 241000701161unidentified adenovirusSpecies0.000description1
- 210000002700urineAnatomy0.000description1
- 238000010200validation analysisMethods0.000description1
- 230000008728vascular permeabilityEffects0.000description1
- 210000005166vasculatureAnatomy0.000description1
- 230000025033vasoconstrictionEffects0.000description1
- 239000013598vectorSubstances0.000description1
- 239000003981vehicleSubstances0.000description1
- 230000028973vesicle-mediated transportEffects0.000description1
- 230000004304visual acuityEffects0.000description1
- 238000005406washingMethods0.000description1
- 239000000080wetting agentSubstances0.000description1
- BPICBUSOMSTKRF-UHFFFAOYSA-NxylazineChemical compoundCC1=CC=CC(C)=C1NC1=NCCCS1BPICBUSOMSTKRF-UHFFFAOYSA-N0.000description1
- 229960001600xylazineDrugs0.000description1
- 238000001086yeast two-hybrid systemMethods0.000description1
- DGVVWUTYPXICAM-UHFFFAOYSA-Nβ‐MercaptoethanolChemical compoundOCCSDGVVWUTYPXICAM-UHFFFAOYSA-N0.000description1
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/409—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having four such rings, e.g. porphine derivatives, bilirubin, biliverdine
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/136—Screening for pharmacological compounds
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/04—Screening involving studying the effect of compounds C directly on molecule A (e.g. C are potential ligands for a receptor A, or potential substrates for an enzyme A)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Pathology (AREA)
- General Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Hematology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Microbiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Wood Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Physics & Mathematics (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Food Science & Technology (AREA)
- Cell Biology (AREA)
- General Engineering & Computer Science (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean본 발명은 고혈압성 혈관누출로 인한 질병의 예방 또는 치료용 약학적 조성물에 관한 것이다.The present invention relates to a pharmaceutical composition for preventing or treating diseases caused by hypertensive vascular leakage.
고혈압은 혈관과 밀접한 관련이 있어, 혈관 축소(narrowing)는 고혈압을 유발하고, 고혈압은 혈관을 손상시킨다. 따라서, 신장이나 눈과 같은 고밀도의 혈관 구조를 가지고 있는 장기들은 고혈압에 매우 민감하다. 특히, 눈의 망막은 정상적인 상황에서 가장 높은 산소 소비율(oxygen consumption rate)을 가지나 심한 고혈압 환자에서는 혈관이 누출되어 시력을 위협하는 고혈압 망막 병증(hypertensive retinopathy(HR)) 이 발생한다.High blood pressure is closely related to blood vessels, so narrowing of blood vessels causes high blood pressure, and high blood pressure damages blood vessels. Therefore, organs having a dense vascular structure, such as the kidneys or eyes, are very sensitive to hypertension. In particular, the retina of the eye has the highest oxygen consumption rate under normal circumstances, but hypertensive retinopathy (HR), which threatens vision due to blood vessel leakage, occurs in patients with severe hypertension.
당뇨나 고지혈증과 같은 신진대사적 스트레스의 경우 잘 연구되어 있으나, 고혈압에 연관된 혈관 누출의 병리 생리학은 아직 알려진 바가 적다. 따라서, 고혈압 유발 혈관 누출을 가지고 있는 환자에 대한 현재의 치료법은 혈압을 낮추는 약에 제한되어 있고 혈관 누출을 정확히 표적화하는 치료법은 없다. 혈압이 정상화 된 후에도 이러한 혈관 누출은 종종 눈을 멀게 하는 황반 부종을 유발하기 때문에 망막 혈관의 고혈압 유발 누출의 패턴과 이를 타겟하여 치료할 수 있는 약물의 연구가 필요한 실정이다.Metabolic stresses such as diabetes and hyperlipidemia have been well studied, but the pathophysiology of vascular leakage related to hypertension is still little known. Therefore, current therapies for patients with hypertension-induced vascular leakage are limited to drugs that lower blood pressure, and there is no therapy that precisely targets vascular leakage. Even after blood pressure is normalized, such vascular leakage often causes blinding macular edema, so there is a need to study the pattern of hypertension-induced leakage of retinal blood vessels and drugs that can target and treat it.
본 발명의 목적은 VEGFR2(Vascular Endothelial Growth Factor Receptor2), SREBP1(Sterol regulatory element-binding protein 1), 또는 이들 모두의 발현 또는 활성을 억제하는 억제제를 포함하는, 고혈압성 혈관누출(vascular leakage)로 인한 질병의 예방 또는 치료용 약학적 조성물을 제공하는 것이다.An object of the present invention is to include an inhibitor that inhibits the expression or activity of VEGFR2 (Vascular Endothelial Growth Factor Receptor2), SREBP1 (Sterol regulatory element-binding protein 1), or both, due to hypertensive vascular leakage. To provide a pharmaceutical composition for preventing or treating diseases.
본 발명의 다른 목적은 생물학적 시료에서 (1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,Another object of the present invention is that in a biological sample (1) at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated;
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
을 확인하는 단계를 포함하는, VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자 선별에 정보를 제공하는 방법을 제공하는 것이다.It is to provide a method for providing information on patient selection appropriate for the treatment of diseases caused by hypertensive vascular leakage by inhibitors that inhibit the expression or activity of VEGFR2, SREBP1, or both, comprising the step of confirming.
본 발명의 또 다른 목적은 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상과 상호작용하는 물질을 포함하는, VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제 적용 대상 선별용 조성물을 제공하는 것이다.Another object of the present invention is Sox17, Dll4, N1ICD, and a substance that interacts with at least one selected from the group consisting of Notch1, VEGFR2, SREBP1, or an inhibitor that inhibits the expression or activity of all of them To provide a composition for screening.
본 발명의 또 다른 목적은 내피세포 특이적으로 (1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,Another object of the present invention is endothelial cell-specific (1) at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated,
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
의 특징을 갖는 것인, 고혈압성 혈관누출로 인한 질병 모델을 제공하는 것이다.It is to provide a disease model due to hypertensive vascular leakage, which has the characteristics of.
본 발명의 또 다른 목적은 상기 질병 모델에 후보 물질을 처리하는 단계;Another object of the present invention is to process a candidate substance to the disease model;
후보물질이 처리된 질병 모델에서 Sox17, Dll4, Notch1, N1ICD, VEGFR2, 및 SREBP1으로 이루어진 군으로부터 선택되는 1종 이상의 발현 또는 활성 수준을 측정하는 단계; 및Measuring the expression or activity level of one or more selected from the group consisting of Sox17, Dll4, Notch1, N1ICD, VEGFR2, and SREBP1 in the candidate material-treated disease model; and
상기 후보물질이 미처리된 대조군와 상기 후보물질이 처리된 질병 모델에서 측정된 결과를 비교하는 단계를 포함하는, 고혈압성 혈관 누출로 인한 질병 예방 또는 치료용 약물의 스크리닝 방법을 제공하는 것이다.To provide a screening method for a drug for preventing or treating a disease caused by hypertensive vascular leakage, comprising comparing results measured in a control group untreated with the candidate substance and a disease model treated with the candidate substance.
일 양상은 VEGFR2의 발현 또는 활성을 억제하는 억제제를 포함하는, 고혈압성 혈관누출(vascular leakage)로 의한 질병의 예방 또는 치료용 약학적 조성물을 제공한다.One aspect provides a pharmaceutical composition for preventing or treating diseases caused by hypertensive vascular leakage, including an inhibitor for inhibiting the expression or activity of VEGFR2.
상기 VEGFR2의 발현 또는 활성을 억제하는 억제제는 VEGFR2를 암호화하는 유전자의 발현 수준 또는 VEGFR2 단백질의 발현 수준을 감소시키거나 VEGFR2 단백질의 활성을 억제하는 것일 수 있다.The inhibitor for inhibiting the expression or activity of the VEGFR2 may be one that reduces the expression level of the gene encoding VEGFR2 or the expression level of the VEGFR2 protein or inhibits the activity of the VEGFR2 protein.
VEGFR2(Vascular endothelial growth factor receptor 2)는 주로 혈관 내피세포에서 발현되고,KDR 유전자에 의해 암호화되는 것으로 알려진 V형 수용체 티로신 키나아제(type V receptor tyrosine kinase)로서, VEGF(vascular endothelial growth factor; 예를 들면 모든 VEGF-A 이소형, VEGF-C, VEGF-D 및/또는 VEGF-E)와의 결합에 의해 혈관내피세포의 증식과 이동 등의 혈관신생 작용 기작을 유도하는 것으로 알려져 있다. VEGFR2 단백질은 KDR(kinase insert domain receptor), Flk-1(fetal liver kinase 1), 또는 CD309(cluster of differentiation 309)로도 알려져 있다.Vascular endothelial growth factor receptor 2 (VEGFR2) is mainly expressed in vascular endothelial cells and is a type V receptor tyrosine kinase known to be encoded by theKDR gene, VEGF (vascular endothelial growth factor; for example) All VEGF-A isotypes, VEGF-C, VEGF-D and/or VEGF-E) are known to induce angiogenic mechanisms such as proliferation and migration of vascular endothelial cells by binding to them. VEGFR2 protein is also known as KDR (kinase insert domain receptor), Flk-1 (fetal liver kinase 1), or CD309 (cluster of differentiation 309).
일 예에 따르면, 상기 VEGFR2는 인간 등의 영장류, 마우스 등의 설치류 등을 포함하는 포유류 유래의 것일 수 있으며, 예를 들면, VEGFR2는 인간 VEGFR2(유전자: GenBank Accession Nos. NM_002253.3 등; 단백질: GenBank Accession Nos. NP_ 002244.1등), 및/또는 마우스 VEGFR2(유전자: GenBank Accession Nos. NM_010612.3, 또는 NM_001363216.1 등; 단백질: GenBank Accession Nos. NP_034742.2, 또는 NP_ 001350145.1 등))일 수 있다.According to an example, the VEGFR2 may be derived from mammals including primates such as humans and rodents such as mice, for example, VEGFR2 is human VEGFR2 (gene: GenBank Accession Nos. NM_002253.3, etc.; Protein: GenBank Accession Nos. NP_ 002244.1, etc.), and/or mouse VEGFR2 (gene: GenBank Accession Nos. NM_010612.3, or NM_001363216.1, etc.; protein: GenBank Accession Nos. NP_034742.2, or NP_ 001350145.1, etc.)). .
다른 양상은 SREBP1의 발현 또는 활성을 억제하는 억제제를 포함하는, 고혈압성 혈관누출(vascular leakage)로 의한 질병의 예방 또는 치료용 약학적 조성물을 제공한다.Another aspect provides a pharmaceutical composition for preventing or treating diseases caused by hypertensive vascular leakage, comprising an inhibitor for inhibiting the expression or activity of SREBP1.
상기 SREBP1의 발현 또는 활성을 억제하는 억제제는 SREBP1를 암호화하는 유전자의 발현 수준 또는 SREBP1 단백질의 발현 수준을 감소시키거나 SREBP1 단백질의 활성을 억제하는 것일 수 있다.The inhibitor for inhibiting the expression or activity of SREBP1 may reduce the expression level of the gene encoding SREBP1 or the expression level of the SREBP1 protein or inhibit the activity of the SREBP1 protein.
SREBP1(Sterol regulatory element-binding protein 1)는 효소 내인성 콜레스테롤, 지방산(FA), 트리아실글리세롤(triacylglycerol), 및/또는 인지질(phospholipid) 합성에 필요한 범위의 표현을 통제하는 지질 항상성 조절 전사 인자이다.SREBP1 (Sterol regulatory element-binding protein 1) is a lipid homeostasis regulatory transcription factor that regulates the expression of a range of enzymes required for endogenous cholesterol, fatty acid (FA), triacylglycerol, and/or phospholipid synthesis.
일 예에 따르면, 상기 SREBP1은 인간 등의 영장류, 마우스 등의 설치류 등을 포함하는 포유류 유래의 것일 수 있으며, 예를 들면, SREBP1은 인간 SREBP1(유전자: GenBank Accession Nos. NM_001005291.3, NM_004176.4, NM_001321096.3 등; 단백질: GenBank Accession Nos. NP_001005291.1, NP_001308025.1, NP_004167.3 등), 및/또는 마우스 SREBP1(유전자: GenBank Accession Nos. NM_011480.4, NM_001313979.1, NM_001358314.1, 또는 NM_001358315.1 등; 단백질: GenBank Accession Nos. NP_001300908.1, NP_035610.1, NP_001345243.1, 또는 NP_001345244.1 등))일 수 있다.According to an example, the SREBP1 may be derived from mammals including primates such as humans and rodents such as mice. For example, SREBP1 is human SREBP1 (GenBank Accession Nos. NM_001005291.3, NM_004176.4). ; or NM_001358315.1, etc.; Protein: GenBank Accession Nos. NP_001300908.1, NP_035610.1, NP_001345243.1, or NP_001345244.1, etc.)).
또 다른 양상은 VEGFR2 발현 또는 활성을 억제하는 억제제 및 SREBP1 발현 또는 활성을 억제하는 억제제를 포함하는, 고혈압성 혈관누출(vascular leakage)로 의한 질병의 예방 또는 치료용 약학적 조성물을 제공한다.Another aspect provides a pharmaceutical composition for preventing or treating diseases caused by hypertensive vascular leakage, comprising an inhibitor for inhibiting VEGFR2 expression or activity and an inhibitor for inhibiting SREBP1 expression or activity.
또 다른 양상은 VEGFR2 및 SREBP1 모두의 발현 또는 활성을 억제하는 억제제를 포함하는, 고혈압성 혈관누출(vascular leakage)로 의한 질병의 예방 또는 치료용 약학적 조성물을 제공한다.Another aspect provides a pharmaceutical composition for preventing or treating diseases caused by hypertensive vascular leakage, comprising an inhibitor that inhibits the expression or activity of both VEGFR2 and SREBP1.
본 명세서에서, VEGFR2, SREBP1, Sox17, Dll4, N1ICD, 또는 Notch1의 "활성이 약화" 또는 "불활성화"되었다는 것은 VEGFR2, SREBP1, Sox17, Dll4, N1ICD, 또는 Notch1을 암호화하는 각 유전자의 핵산 서열 및/또는 각 VEGFR2, SREBP1, Sox17, Dll4, N1ICD, 또는 Notch1 단백질의 아미노산 서열의 변이(치환, 결실, 부가 등) 및/또는 2차 또는 3차 구조의 변형 등의 변이에 의하여 단백질 활성 정도가 야생형(wildtype)에 비하여 감소되었거나 단백질의 활성이 없는 경우를 의미하고, VEGFR2, SREBP1, Sox17, Dll4, N1ICD, 또는 Notch1을 암호화하는 유전자의 전사(transcription) 저해 또는 번역(translation) 저해 등으로 상기 단백질의 발현 수준이 저하되거나 전혀 발현되지 않아 세포 내에서 전체적인 단백질 활성 정도가 야생형에 비하여 낮거나 전혀 없는 경우, 또는 이들의 조합 역시 포함하는 개념이다.In the present specification, "weakened activity" or "inactivated" of VEGFR2, SREBP1, Sox17, Dll4, N1ICD, or Notch1 means VEGFR2, SREBP1, Sox17, Dll4, N1ICD, or the nucleic acid sequence of each gene encoding Notch1 and / or each VEGFR2, SREBP1, Sox17, Dll4, N1ICD, or mutation of the amino acid sequence of the Notch1 protein (substitution, deletion, addition, etc.) and / or the degree of protein activity by mutation such as modification of secondary or tertiary structure wild type (wildtype) means a case where there is no protein activity or reduced compared to, VEGFR2, SREBP1, Sox17, Dll4, N1ICD, or the transcription of the gene encoding Notch1 (transcription) inhibition or translation (translation) inhibition of the protein, etc. It is a concept including a case where the expression level is reduced or not expressed at all, so that the overall protein activity level in the cell is low or no compared to the wild type, or a combination thereof.
일 예에 따르면, 상기 약학적 조성물은According to one example, the pharmaceutical composition
(1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,(1) At least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated;
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
의 특징을 갖는 환자에 적용하기 위한 것일 수 있다.It may be for application to patients with the characteristics of
상기 "Sox17"는 각각 혈관내피세포에 발현되는 Sox(SRY-related HMG-box) family 전사인자 중 하나로, 배아 발달의 조절 및 세포 운명을 결정한다. 상기 Sox17는 인간 등의 영장류, 마우스 등의 설치류 등을 포함하는 포유류 유래의 것일 수 있으며, 예를 들면, Sox17은 인간 Sox17(유전자: GenBank Accession Nos. NM_022454.4 등; 단백질: GenBank Accession Nos. NP_071899.1 등), 및/또는 마우스 Sox17(유전자: GenBank Accession Nos. NM_001289464.1, NM_001289465.1, NM_001289466.1, NM_001289467.1, NM_011441.5 등; 단백질: GenBank Accession Nos. NP_001276393.1, NP_001276394.1, NP_001276395.1, NP_001276396.1, NP_035571.1 등))일 수 있다.The "Sox17" is one of Sox (SRY-related HMG-box) family transcription factors expressed in vascular endothelial cells, respectively, and determines the regulation of embryonic development and cell fate. The Sox17 may be derived from mammals including primates such as humans and rodents such as mice. For example, Sox17 is human Sox17 (GenBank Accession Nos. NM_022454.4, etc.; Protein: GenBank Accession Nos. NP_071899). .1, etc.), and/or mouse Sox17 (genes: GenBank Accession Nos. NM_001289464.1, NM_001289465.1, NM_001289466.1, NM_001289467.1, NM_011441.5, etc.; proteins: GenBank Accession Nos. NP_001276393.1, NP_001276394. 1, NP_001276395.1, NP_001276396.1, NP_035571.1, etc.)).
상기 "Dll4(델타 유사 리간드 4(delta-like ligand 4)"는 노치 단백질을 수용체로 하는 리간드의 델타 부류의 하나로서, 노치 1 또는 노치 4 수용체에 결합하는 단백질을 의미할 수 있고, Dll4 길항제는 여러 암에서 종양의 성장을 억제하는 데 유용한 것으로 알려져 있다. 일 예에 따르면, 상기 Dll4는 인간 등의 영장류, 마우스 등의 설치류 등을 포함하는 포유류 유래의 것일 수 있으며, 예를 들면, Dll4는 인간 Dll4(유전자: GenBank Accession Nos. NM_019074.4 등; 단백질: GenBank Accession Nos. NP_0619474.1 등), 및/또는 마우스 Dll4(유전자: GenBank Accession Nos. NM_019454.3 등; 단백질: GenBank Accession Nos. NP_062327.2 등))일 수 있다.The "Dll4 (delta-like ligand 4)" is one of the delta class of ligands having a Notch protein as a receptor, and may refer to a protein that binds to a
상기 "Notch1"은 노치 신호 전달을 매개하는 단백질을 의미하며, "노치(Notch) 수용체"와 혼용하여 사용될 수 있다. 상기 노치 수용체는 다세포 유기체에서 리간드-유도 단백질분해에 의해 촉발되는 신호전달 경로를 통하여 정상 세포 성장, 분화 및 사멸을 조절한다고 알려져 있다. 일 예에 따르면, 상기 Notch1은 인간 등의 영장류, 마우스 등의 설치류 등을 포함하는 포유류 유래의 것일 수 있으며, 예를 들면, Notch1은 인간 Notch1(유전자: GenBank Accession Nos. NM_017617.5 등; 단백질: GenBank Accession Nos. NP_060087.3 등), 및/또는 마우스 Notch1(유전자: GenBank Accession Nos. NM_008714.3 등 ; 단백질: GenBank Accession Nos. NP_032740.3 등))일 수 있다.The “Notch1” refers to a protein mediating Notch signal transduction, and may be used interchangeably with “Notch receptor”. The Notch receptor is known to regulate normal cell growth, differentiation and death through signaling pathways triggered by ligand-induced proteolysis in multicellular organisms. According to an example, the Notch1 may be derived from mammals including primates such as humans and rodents such as mice, for example, Notch1 may be human Notch1 (gene: GenBank Accession Nos. NM_017617.5, etc.; protein: GenBank Accession Nos. NP_060087.3, etc.), and/or mouse Notch1 (gene: GenBank Accession Nos. NM_008714.3, etc.; Protein: GenBank Accession Nos. NP_032740.3, etc.)).
상기 "N1ICD(notch intracellular domain)"는 Notch1의 세포내 도메인으로 감마-시크리테이즈(γ-secretase)에 의해 유리되어 핵 안으로 들어가서 다른 전사조절인자와 함께 표적 유전자의 전사를 활성화한다.The "notch intracellular domain (N1ICD)" is an intracellular domain of Notch1 that is released by gamma-secretase and enters the nucleus to activate transcription of a target gene together with other transcriptional regulators.
예를 들면, N1ICD는 인간 등의 영장류, 마우스 등의 설치류 등을 포함하는 포유류 유래의 것일 수 있다.For example, N1ICD may be derived from mammals including primates such as humans and rodents such as mice.
일 예에서, "Dll4와 Notch1의 상호작용의 억제"는 Dll4와 Notch1의 결합을 저해하는 것일 수 있으며, 예를 들면, Dll4에 특이적인 항체가 Dll4에 결합하여 Dll4와 Notch1의 결합(상호작용)을 저해시키거나, Notch1에 특이적인 항체가 Notch1에 결합하여 Dll4와 Notch1의 결합(상호작용)을 저해시키는 것을 의미할 수 있다.In one example, "inhibition of the interaction between Dll4 and Notch1" may be to inhibit the binding of Dll4 to Notch1. For example, an antibody specific for Dll4 binds to Dll4 and the binding (interaction) between Dll4 and Notch1. Inhibits, or may mean that a Notch1-specific antibody binds to Notch1 and inhibits the binding (interaction) of Dll4 and Notch1.
일 예에 따르면, 상기 억제제는 siRNA(small interference RNA), shRNA(short hairpin RNA), miRNA(microRNA), 리보자임(ribozyme), DNAzyme, PNA(peptide nucleic acids), 안티센스 올리고뉴클레오타이드, 항체, 앱타머, 추출물, 및 화합물로 이루어진 군으로부터 선택되는 1종 이상인 것일 수 있다.According to one embodiment, the inhibitor is siRNA (small interference RNA), shRNA (short hairpin RNA), miRNA (microRNA), ribozyme, DNAzyme, PNA (peptide nucleic acids), antisense oligonucleotides, antibodies, aptamers , extract, and may be at least one selected from the group consisting of compounds.
상기 VEGFR2 또는 SREBP1의 발현 또는 활성을 억제하는 억제제는 VEGFR2 또는 SREBP1를 암호화하는 유전자의 발현 수준 또는 VEGFR2 또는 SREBP1 단백질의 발현 수준을 감소시키거나 VEGFR2 또는 SREBP1 단백질의 활성을 억제하는 것일 수 있다.The inhibitor for inhibiting the expression or activity of VEGFR2 or SREBP1 may be to reduce the expression level of the gene encoding VEGFR2 or SREBP1 or the expression level of the VEGFR2 or SREBP1 protein, or to inhibit the activity of the VEGFR2 or SREBP1 protein.
일 예에서, 상기 억제제는 VEGFR2 신호전달 기전을 차단하는 방식의 VEGFR2 경로 억제제 또는 길항제일 수 있고, VEGFR2 에 결합하여 VEGF 가 수용체에 결합하는 것을 방해하거나, 내인성 VEGF에 결합하여 VEGFR2에 결합할 수 있는 VEGF의 세포 내 농도를 낮추는 것 등을 포함하는 다양한 방식에 의해 작용하는 물질이 포함된다.In one example, the inhibitor may be a VEGFR2 pathway inhibitor or antagonist in a manner that blocks the VEGFR2 signaling mechanism, and prevents VEGF from binding to the receptor by binding to VEGFR2, or by binding to endogenous VEGF and binding to VEGFR2. Substances that act in a variety of ways, including by lowering the intracellular concentration of VEGF, are included.
일 예에서, 상기 억제제는 항-VEGF 항체, 항-VEGFR2 항체, 및/또는 VEGFR 타이로신 키나아제 활성을 저해하는 약물일 수 있고, 예를 들면, 베바시주맘, 라니비주맙, 애플리버셉트(aflibercept), 브리바닙, 수니티닙, 리니파닙, 레고라페닙, 및/또는 소라페닙일 수 있다.In one embodiment, the inhibitor may be an anti-VEGF antibody, an anti-VEGFR2 antibody, and / or a drug inhibiting VEGFR tyrosine kinase activity, for example, bevacizumam, ranibizumab, aflibercept (aflibercept) , brivanib, sunitinib, linifanib, regorafenib, and/or sorafenib.
일 예에서, 상기 억제제는 SREBP1 길항제일 수 있고, 구체적으로 항-SREBP1 항체일 수 있고, 예를 들면, 베툴린(Betulin), 파토스타틴(fatostatin), 및/또는 PF429242(Cas NO. 947303-87-9)일 수 있다.In one example, the inhibitor may be a SREBP1 antagonist, specifically an anti-SREBP1 antibody, for example, betulin, fatostatin, and/or PF429242 (Cas NO. 947303-87). -9).
일 예에서, 상기 억제제는 VEGFR2 및 SREBP1 모두의 길항제일 수 있고, 구체적으로 항-VEGFR2/항-SREPB1 항체일 수 있다.In one example, the inhibitor may be an antagonist of both VEGFR2 and SREBP1, and specifically may be an anti-VEGFR2/anti-SREPB1 antibody.
상기 항체는 VEGFR2 및/또는 SREBP1의 단백질에 특이적으로 결합할 수 있는 항체를 포함하고, 이러한 항체는 단일클론항체 및 이에 대한 키메라 항체, 인간화 항체 및 인간 항체를 모두 포함하는 것이고, 신규한 항체 외에 이미 당해 기술분야에서 공지된 항체들도 포함될 수 있다. 상기 항체는 VEGFR2 및/또는 SREBP1에 특이적으로 결합하는 한, 2개의 중쇄와 2개의 경쇄의 전체 길이를 가지는 완전한 형태뿐만 아니라, 항체 분자의 기능적인 단편을 포함한다. 항체의 분자의 기능적인 단편이란, 적어도 항원 결합 기능을 보유하고 있는 단편을 뜻하며, Fab, F(ab'), F(ab')2, 및 Fv 등이 있다.The antibody includes an antibody that can specifically bind to a protein of VEGFR2 and/or SREBP1, and these antibodies include monoclonal antibodies and chimeric antibodies, humanized antibodies and human antibodies thereto, in addition to novel antibodies. Antibodies already known in the art may also be included. As long as the antibody specifically binds to VEGFR2 and/or SREBP1, it includes a complete form having the full length of two heavy chains and two light chains, as well as functional fragments of the antibody molecule. A functional fragment of an antibody molecule means a fragment having at least an antigen-binding function, and includes Fab, F(ab'), F(ab')2, and Fv.
일 예에 따르면, 상기 약학적 조성물은 망막 표피 혈관층(superficial vascular layer; SVL)에서 비출혈성 혈관누출이 발생한 환자에 적용하기 위한 것일 수 있다. 상기 망막 표피 혈관층은 신경절세포 복합체(ganglion cell complex(GCC))를 포함하는 것일 수 있고, 상기 신경절세포 복합체는 망막 신경 섬유층(retinal nerve fiber layer(RNFL)), 신경절 세포층(ganglion cell layer(GCL)), 및 IPL(inner plexiform layer)을 포함할 수 있다. 상기 비출혈성 혈관누출은 혈액망막 장벽(blood-retinal barrier(BRB))을 구성하는 밀착연접(tight junction)의 붕괴에 의한 것이 아니고, 트랜스시토시스 증가에 의한 것일 수 있다.According to an example, the pharmaceutical composition may be for application to a patient in which non-hemorrhagic vascular leakage occurs in the retinal epidermal vascular layer (SVL). The retinal epidermal vascular layer may include a ganglion cell complex (GCC), and the ganglion cell complex may include a retinal nerve fiber layer (RNFL), a ganglion cell layer (GCL). )), and an inner plexiform layer (IPL). The non-hemorrhagic vascular leakage may be due to an increase in transcytosis, not a breakdown of a tight junction constituting the blood-retinal barrier (BRB).
상기 고혈압성 혈관누출로 인한 질병은 고혈압에 의해 유도된 혈관누출(hypertension-induced vascular leakage)로 인해 발생하는 질병을 의미하는 것으로서, 예를 들면, 상기 고혈압성 혈관누출로 인한 질병은 고혈압 망막병증, 고혈압성 망막부종, 고혈압성 혈관기능 장애, 고혈압성 염증, 고혈압성 뇌병증, 고혈압성 뇌부종, 및 고혈압성 신병증로 이루어진 군으로부터 선택되는 1종 이상인 것일 수 있다. 상기 고혈압성 혈관누출로 인한 질병은 당뇨병 망막병증이 아닐 수 있다.The disease caused by hypertensive vascular leakage refers to a disease caused by hypertension-induced vascular leakage. For example, the disease caused by the hypertensive vascular leakage is hypertensive retinopathy, It may be one or more selected from the group consisting of hypertensive retinal edema, hypertensive vascular dysfunction, hypertensive inflammation, hypertensive encephalopathy, hypertensive cerebral edema, and hypertensive nephropathy. The disease caused by the hypertensive vascular leak may not be diabetic retinopathy.
일 예에 따르면, 상기 고혈압성 혈관누출로 인한 질병은 고혈압에 의해 악화된 당뇨망막병증 및/또는 황반변성일 수 있다. According to an example, the disease caused by hypertensive vascular leakage may be diabetic retinopathy and/or macular degeneration aggravated by hypertension.
일 예에서, 상기 고혈압성 혈관누출은 망막 표피 혈관층에서 비출혈성 혈관누출인 것일 수 있고, 비출혈성 혈관누출은 혈액망막 장벽(blood-retinal barrier(BRB))을 구성하는 밀착연접(tight junction)의 붕괴에 의한 것이 아니고, 트랜스시토시스 증가에 의한 것일 수 있다.In one example, the hypertensive vascular leak may be a non-hemorrhagic vascular leak in the retinal epidermal vascular layer, and the non-hemorrhagic vascular leak is a tight junction constituting a blood-retinal barrier (BRB). It may be due to an increase in transcytosis, not due to the breakdown of
상기 약학적 조성물은 약학적으로 허용 가능한 첨가제를 더 포함할 수 있으며, 이때 약제학적으로 허용 가능한 첨가제로는 전분, 젤라틴화 전분, 미결정셀룰로오스, 유당, 포비돈, 콜로이달실리콘디옥사이드, 인산수소칼슘, 락토스, 만니톨, 엿, 아라비아고무, 전호화전분, 옥수수전분, 분말셀룰로오스, 히드록시프로필셀룰로오스, 오파드라이, 전분글리콜산나트륨, 카르나우바 납, 합성규산알루미늄, 스테아린산, 스테아린산마그네슘, 스테아린산 알루미늄, 스테아린산칼슘, 백당, 덱스트로스, 소르비톨, 및/또는 탈크 등이 사용될 수 있다.The pharmaceutical composition may further include a pharmaceutically acceptable additive, wherein the pharmaceutically acceptable additive includes starch, gelatinized starch, microcrystalline cellulose, lactose, povidone, colloidal silicon dioxide, calcium hydrogen phosphate, and lactose. , mannitol, syrup, gum arabic, pregelatinized starch, corn starch, powdered cellulose, hydroxypropyl cellulose, Opadry, sodium starch glycolate, lead carnauba, synthetic aluminum silicate, stearic acid, magnesium stearate, aluminum stearate, calcium stearate , sucrose, dextrose, sorbitol, and/or talc and the like can be used.
상기 약학적 조성물은 경구 투여, 비경구 투여 등의 다양한 경로로 투여될 수 있으며, 각 투여 경로에 적합한 제형으로 제제화될 수 있다. 제제화할 경우에는 보통 사용하는 충진제, 증량제, 결합제, 습윤제, 붕해제, 계면활성제 등의 희석제 또는 부형제를 사용하여 조제될 수 있다.The pharmaceutical composition may be administered by various routes such as oral administration and parenteral administration, and may be formulated in a formulation suitable for each administration route. In the case of formulation, it can be prepared using a diluent or excipient such as a filler, extender, binder, wetting agent, disintegrant, surfactant, etc. commonly used.
일 구체예에 따르면, 상기 조성물은 점안제, 안연고, 주사제, 안구 삽입제, 과립제, 정제, 환제, 캡슐제, 겔제, 시럽, 현탁제, 유제, 점적제, 및 액제로 이루어진 군에서 선택되는 하나 이상의 제형일 수 있다. 주사제에는 용해제, 등장화제, 현탁화제, 유화제, 안정화제, 방부제 등과 같은 종래의 첨가제가 포함될 수 있다.According to one embodiment, the composition is one or more selected from the group consisting of eye drops, ophthalmic ointments, injections, ocular inserts, granules, tablets, pills, capsules, gels, syrups, suspensions, emulsions, drops, and solutions. It may be in the form Injections may contain conventional additives such as solubilizing agents, isotonic agents, suspending agents, emulsifying agents, stabilizing agents, and preservatives.
경구 투여에 적합한 제형의 예는 정제, 캡슐제, 과립제, 세립제, 및 산제 등을 포함하고; 비경구 투여에 적합한 제형은 주사제, 점안제, 안연고, 첩부제, 겔제, 및 안구 삽입제를 포함한다. 이들 제형은 해당 분야에서 범용되어 있는 일반적인 기술을 이용하여 조제할 수 있다. 또한, 이들 제제 외에, 본 발명의 조성물은 안내 이식물용 제제 나 미소구 등의 DDS(Drug delivery System; 약물 전달계)로 제조된 제제로 제제화할 수 있다.Examples of dosage forms suitable for oral administration include tablets, capsules, granules, fine granules, powders, and the like; Formulations suitable for parenteral administration include injections, eye drops, eye ointments, patches, gels, and ocular inserts. These formulations can be prepared using general techniques commonly used in the art. In addition to these preparations, the composition of the present invention may be formulated as a preparation for intraocular implants or a preparation prepared by DDS (Drug Delivery System) such as microspheres.
상기 조성물은 임의의 공지된 전달 시스템 및/또는 투여경로에 의해 투여될 수 있다.The composition may be administered by any known delivery system and/or route of administration.
일 예에 따른 약학 조성물은 목적하는 방법에 따라 경구 투여하거나 비경구 투여(예를 들면, 정맥내 주입, 피하 주입, 근육 주입, 복강 주입, 내피 투여, 국소 투여, 비내 투여, 폐내 투여, 직장내 투여, 유리체 내 투여, 결막낭 내 투여, 결막하 투여, 및/또는 테논낭 하 투여)할 수 있으며, 예를 들면, 상기 조성물의 투여 경로는 유리체 내 투여, 결막낭 내 투여, 결막하 투여, 및 테논낭 하 투여로 이루어진 군으로부터 선택되는 것일 수 있다.The pharmaceutical composition according to an embodiment is administered orally or parenterally according to a desired method (eg, intravenous injection, subcutaneous injection, intramuscular injection, intraperitoneal injection, endothelial administration, topical administration, intranasal administration, intrapulmonary administration, rectal administration administration, intravitreal administration, intraconjunctival sac administration, subconjunctival administration, and/or subtenon's capsule administration), for example, the administration route of the composition is intravitreal administration, intraconjunctival sac administration, subconjunctival administration, and subtenon's capsule administration.
일 예에 따르면, 상기 조성물은 약학적으로 유효한 양으로 투여한다. 본 명세서에서, '약학적으로 유효한 양'은 의학적 치료에 적용 가능한 합리적인 수혜/위험 비율로 질환을 치료하기에 충분한 양을 의미하며, 유효 용량 수준은 환자의 질환의 종류, 중증도, 약물의 활성, 약물에 대한 민감도, 투여 시간, 투여 경로 및 배출 비율, 치료기간, 동시 사용되는 약물을 포함한 요소 및 기타 의학 분야에 잘 알려진 요소에 따라 결정될 수 있다.According to one embodiment, the composition is administered in a pharmaceutically effective amount. As used herein, a 'pharmaceutically effective amount' means an amount sufficient to treat a disease at a reasonable benefit/risk ratio applicable to medical treatment, and the effective dose level includes the patient's type, severity, drug activity, Sensitivity to the drug, administration time, administration route and excretion rate, treatment period, factors including concurrent drugs and other factors well known in the medical field may be determined.
일 구체예에 따르면, 상기 조성물은 개별 치료제로 투여하거나 다른 치료제(예를 들면, 혈관신생 억제제)와 병용하여 투여될 수 있고 종래의 치료제와는 동시에, 별도로, 또는 순차적으로 투여될 수 있으며, 단일 또는 다중 투여될 수 있다. 상기 요소들을 모두 고려하여 부작용 없이 최소한의 양으로 최대 효과를 얻을 수 있는 양을 투여하는 것이 중요하며, 이는 당업자에 의해 용이하게 결정될 수 있다.According to one embodiment, the composition may be administered as a separate therapeutic agent or may be administered in combination with other therapeutic agents (eg, angiogenesis inhibitors), and may be administered simultaneously, separately, or sequentially with a conventional therapeutic agent, a single or multiple administrations. Taking all of the above factors into consideration, it is important to administer an amount capable of obtaining the maximum effect with a minimum amount without side effects, which can be easily determined by those skilled in the art.
일 구체예에 따르면, 상기 조성물의 유효량은 환자의 연령, 성별, 상태, 체중, 체내에 활성 성분의 흡수도, 불활성율, 배설 속도, 질병 종류, 병용되는 약물에 따라 달라질 수 있으며, 투여 경로, 비만의 중증도, 성별, 체중, 연령 등에 따라 증감될 수 있으며, 예를 들면, 유효성분으로서 상기 억제제를 0.0001㎍/kg 내지 1000mg/kg, 0.01㎍/kg 내지 500mg/kg, 0.1㎍/kg 내지 100mg/kg, 1㎍/kg 내지 90mg/kg, 10㎍/kg 내지 80mg/kg, 100㎍/kg 내지 70mg/kg, 1mg/kg 내지 60mg/kg, 또는 10mg/kg 내지 50mg/kg 용량으로 투여할 수 있다.According to one embodiment, the effective amount of the composition may vary depending on the patient's age, sex, condition, weight, absorption of the active ingredient into the body, inactivation rate, excretion rate, disease type, and drugs used in combination, the route of administration, It can be increased or decreased according to the severity of obesity, sex, weight, age, etc., for example, 0.0001 μg/kg to 1000 mg/kg, 0.01 μg/kg to 500 mg/kg, 0.1 μg/kg to 100 mg of the inhibitor as an active ingredient. to be administered at a dose of /kg, 1 μg/kg to 90 mg/kg, 10 μg/kg to 80 mg/kg, 100 μg/kg to 70 mg/kg, 1 mg/kg to 60 mg/kg, or 10 mg/kg to 50 mg/kg can
다른 양상은, VEGFR2의 발현 또는 활성을 억제하는 억제제를 환자에 투여하는 단계를 포함하는 고혈압성 혈관누출(vascular leakage)로 인한 질병의 예방 또는 치료방법을 제공한다. VEGFR2의 발현 또는 활성을 억제하는 억제제에 관한 것은 전술한 바와 같다.Another aspect provides a method for preventing or treating a disease caused by hypertensive vascular leakage, comprising administering to a patient an inhibitor that inhibits the expression or activity of VEGFR2. It relates to an inhibitor that inhibits the expression or activity of VEGFR2 as described above.
다른 양상은, SREBP1의 발현 또는 활성을 억제하는 억제제를 환자에 투여하는 단계를 포함하는 고혈압성 혈관누출(vascular leakage)로 인한 질병의 예방 또는 치료방법을 제공한다. SREBP1의 발현 또는 활성을 억제하는 억제제에 관한 것은 전술한 바와 같다.Another aspect provides a method for preventing or treating a disease caused by hypertensive vascular leakage, comprising administering to a patient an inhibitor that inhibits the expression or activity of SREBP1. An inhibitor for inhibiting the expression or activity of SREBP1 is the same as described above.
다른 양상은, VEGFR2 및 SREBP1 모두의 발현 또는 활성을 억제하는 억제제를 환자에 투여하는 단계를 포함하는 고혈압성 혈관누출(vascular leakage)로 인한 질병의 예방 또는 치료방법을 제공한다.Another aspect provides a method for preventing or treating a disease caused by hypertensive vascular leakage, comprising administering to a patient an inhibitor that inhibits the expression or activity of both VEGFR2 and SREBP1.
다른 양상은, VEGFR2의 발현 또는 활성을 억제하는 억제제 및 SREBP1의 발현 또는 활성을 억제하는 억제제를 환자에 투여하는 단계를 포함하는 고혈압성 혈관누출(vascular leakage)로 인한 질병의 예방 또는 치료방법을 제공한다.Another aspect provides a method for preventing or treating diseases caused by hypertensive vascular leakage, comprising administering to a patient an inhibitor for inhibiting the expression or activity of VEGFR2 and an inhibitor for inhibiting the expression or activity of SREBP1 do.
일 구체예에 따르면, 상기 고혈압성 혈관누출로 인한 질병의 예방 또는 치료방법은 투여하는 단계 이전에, 상기 고혈압성 혈관누출로 인한 질병의 예방 및/또는 치료를 필요로 하는 환자를 확인(선별)하는 단계를 추가로 포함할 수 있다.According to one embodiment, in the method for preventing or treating a disease due to hypertensive vascular leakage, prior to administering, identifying (selecting) a patient in need of prevention and/or treatment of a disease due to hypertensive vascular leakage It may further include the step of
일 예에서, 상기 환자를 확인하는 단계는 상기 환자로부터 채취된 생물학적 시료에서 (1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,In one example, the step of identifying the patient may include (1) attenuating or inactivating at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 in a biological sample collected from the patient;
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
의 특징을 갖는지 확인하여 수행할 수 있다.It can be performed by checking whether it has the characteristics of
일 예에서, 상기 환자를 확인하는 단계는 환자의 망막 표피 혈관층(superficial vascular layers; SVL)에서 비출혈성 혈관누출이 발생한 것인지 확인하여 수행할 수 있다. 상기 비출혈성 혈관누출은 혈액망막 장벽(blood-retinal barrier(BRB))을 구성하는 밀착연접(tight junction)의 붕괴에 의한 것이 아니고, 트랜스시토시스 증가에 의한 것일 수 있다. 상기 환자의 망막 표피 혈관층에서 비출혈성 혈관누출이 발생한 것인지 여부는 형광안저촬영 및/또는 망막빛간섭단층촬영에 의하여 확인될 수 있다.In one example, the step of identifying the patient may be performed by confirming whether a nonhemorrhagic vascular leak has occurred in the patient's superficial vascular layers (SVL). The non-hemorrhagic vascular leakage may be due to an increase in transcytosis, not a breakdown of a tight junction constituting the blood-retinal barrier (BRB). Whether non-hemorrhagic vascular leakage has occurred in the retinal epidermal vascular layer of the patient can be confirmed by fluorescence fundus imaging and/or retinal light coherence tomography.
상기 치료방법이 적용되는 대상 개체는 고혈압성 혈관누출(vascular leakage)로 인한 질병이 발병하였거나 발병할 수 있는 인간을 포함한 쥐, 가축 등을 포함하는 포유 동물을 의미할 수 있다. SREBP1의 발현 또는 활성을 억제하는 억제제 및/또는 VEGFR2의 발현 또는 활성을 억제하는 억제제를 포함하는 약학적 조성물(또는 VEGFR2 및 SREBP1 모두의 발현 또는 활성을 억제하는 억제제를 포함하는 약학적 조성물)을 대상 개체에 투여함으로써, 개체를 효율적으로 치료할 수 있다.The subject subject to which the treatment method is applied may refer to mammals including mice, livestock, etc. including humans that have or may develop diseases due to hypertensive vascular leakage. A pharmaceutical composition comprising an inhibitor for inhibiting the expression or activity of SREBP1 and / or an inhibitor for inhibiting the expression or activity of VEGFR2 (or a pharmaceutical composition comprising an inhibitor for inhibiting the expression or activity of both VEGFR2 and SREBP1) By administering to a subject, the subject can be efficiently treated.
본 명세서에서, "투여"는 어떠한 적절한 방법으로 대상 개체에게 상기 약학적 조성물을 도입하는 것을 의미하며, 투여 경로는 목적 조직에 도달할 수 있는 한 경구 또는 비경구(예를 들면, 정맥내 주입, 피하 주입, 근육 주입, 복강 주입, 내피 투여, 국소 투여, 비내 투여, 폐내 투여, 직장내 투여, 유리체 내 투여, 결막낭 내 투여, 결막하 투여, 및/또는 테논낭 하 투여)의 다양한 경로를 통하여 투여될 수 있다.As used herein, "administration" means introducing the pharmaceutical composition to a subject by any suitable method, and the route of administration is oral or parenteral (eg, intravenous injection, subcutaneous injection, intramuscular injection, intraperitoneal injection, endothelial administration, topical administration, intranasal administration, intrapulmonary administration, rectal administration, intravitreal administration, intraconjunctival sac administration, subconjunctival administration, and/or subtenon's capsule administration). It can be administered through
상기 예방 또는 치료 방법은 SREBP1의 발현 또는 활성을 억제하는 억제제 및/또는 VEGFR2의 발현 또는 활성을 억제하는 억제제를 포함하는 약학적 조성물(또는 VEGFR2 및 SREBP1 모두의 발현 또는 활성을 억제하는 억제제를 포함하는 약학적 조성물)을 약학적 유효량으로 투여하는 것을 포함할 수 있다. 적합한 총 1일 사용량은 올바른 의학적 판단범위 내에서 처치에 의해 결정될 수 있으며, 1회 또는 수회로 나누어 투여할 수 있다. 그러나 특정 환자에 대한 구체적인 치료적 유효량은 달성하고자 하는 반응의 종류와 정도, 경우에 따라 다른 제제가 사용되는지의 여부를 비롯한 구체적 조성물, 환자의 연령, 체중, 일반 건강 상태, 성별 및 식이, 투여 시간, 투여 경로 및 조성물의 분비율, 치료기간, 구체적 조성물과 함께 사용되거나 동시 사용되는 약물을 비롯한 다양한 인자와 의약 분야에 잘 알려진 유사 인자에 따라 다르게 적용할 수 있다.The prevention or treatment method comprises an inhibitor for inhibiting the expression or activity of SREBP1 and / or a pharmaceutical composition comprising an inhibitor for inhibiting the expression or activity of VEGFR2 (or an inhibitor for inhibiting the expression or activity of both VEGFR2 and SREBP1 pharmaceutical composition) in a pharmaceutically effective amount. A suitable total daily amount may be determined by treatment within the scope of correct medical judgment, and may be administered once or divided into several doses. However, a specific therapeutically effective amount for a specific patient depends on the specific composition, age, weight, general health status, sex and diet, administration time of the patient, including the type and extent of the response to be achieved, and whether other agents are used if necessary. , administration route and secretion rate of the composition, treatment period, various factors including drugs used together or concurrently with a specific composition, and similar factors well known in the pharmaceutical field can be applied differently.
다른 양상은 생물학적 시료에서 (1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,Another aspect is that in a biological sample (1) at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated,
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
을 확인(검출)하는 단계를 포함하는, VEGFR2 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자 선별에 정보를 제공하는 방법을 제공하는 것이다.It is to provide a method of providing information for selecting patients suitable for disease treatment due to hypertensive vascular leakage by an inhibitor that inhibits VEGFR2 expression or activity, comprising the step of confirming (detecting).
다른 양상은 생물학적 시료에서 (1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,Another aspect is that in a biological sample (1) at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated,
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
을 확인(검출)하는 단계를 포함하는, SREBP1 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자 선별에 정보를 제공하는 방법을 제공하는 것이다.It is to provide a method for providing information for selecting patients suitable for treating a disease caused by hypertensive vascular leakage by an inhibitor that inhibits SREBP1 expression or activity, comprising the step of identifying (detecting).
다른 양상은 생물학적 시료에서 (1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,Another aspect is that in a biological sample (1) at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated,
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
을 확인(검출)하는 단계를 포함하는, VEGFR2 및 SREBP1 모두의 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자 선별에 정보를 제공하는 방법을 제공하는 것이다.It is to provide a method of providing information for selecting patients suitable for treatment of diseases caused by hypertensive vascular leakage by inhibitors that inhibit the expression or activity of both VEGFR2 and SREBP1, including the step of confirming (detecting).
본 명세서에서, "생물학적 시료" 또는 "시료"는 혈액 및 생물학적 기원의 기타 액상 시료, 생검 표본, 조직 배양과 같은 고형 조직 시료 또는 이로부터 유래된 세포를 의미하고, 개체(예를 들면, 고혈압성 혈관누출로 인한 질병이 있는 개체)로부터 분리된 것일 수 있다. 상기 시료는 예를 들면 조직, 추출물, 세포 용해물, 전혈, 혈장, 혈청, 침, 안구액, 뇌척수액, 땀, 뇨, 젖, 복수액, 활액, 복막액 등일 수 있다. 상기 시료는 동물, 예를 들면, 포유동물, 또는 인간으로부터 수득될 수 있다. 상기 시료는 확인하는 단계 전에 전처리할 수 있다. 예를 들어, 균질화(homogenization), 여과, 증류, 추출, 농축, 방해 성분의 불활성화, 시약의 첨가 등의 전처리 단계를 수행할 수 있다.As used herein, "biological sample" or "sample" refers to a solid tissue sample such as blood and other liquid samples of biological origin, biopsy samples, tissue cultures, or cells derived therefrom, and a subject (eg, hypertensive It may be isolated from an individual with a disease caused by vascular leakage). The sample may be, for example, tissue, extract, cell lysate, whole blood, plasma, serum, saliva, ocular fluid, cerebrospinal fluid, sweat, urine, milk, ascites fluid, synovial fluid, peritoneal fluid, and the like. The sample may be obtained from an animal, eg, a mammal, or a human. The sample may be pre-treated before the step of confirming. For example, pretreatment steps such as homogenization, filtration, distillation, extraction, concentration, inactivation of interfering components, and addition of reagents may be performed.
일 예에서, 상기 생물학적 시료에서 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화된 특징을 갖는지 확인하는 단계는, Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 (mRNA 및/또는 단백질) 발현 수준(level)을 측정하는 것일 수 있다.In one example, the step of determining whether at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 in the biological sample has a weakened or inactivated characteristic includes: Sox17, Dll4, N1ICD, and Notch1 It may be to measure the expression level (level) of one or more (mRNA and / or protein) selected from the group.
일 구체예에 따르면 예를 들면 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 발현 수준(level)을 측정하는 단계는 실시간 PCR, RT-PCR, 웨스턴 블롯팅(western blotting), 방사선면역분석법(radioimmunoassay; RIA), 방사 면역 확산법(radioimmunodiffusion), 효소면역분석법(ELISA), 면역침전법(immunoprecipitation), 유세포분석법(flow cytometry), 면역형광염색법(immunofluorescence), 오우크테로니(ouchterlony), 보체 고정 분석법(complement fixation assay), 및 단백질 칩(protein chip)으로 이루어진 군으로부터 선택되는 방법에 의해서 측정될 수 있다.According to one embodiment, for example, measuring the expression level (level) of one or more selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is real-time PCR, RT-PCR, western blotting, Radioimmunoassay (RIA), radioimmunodiffusion, enzyme immunoassay (ELISA), immunoprecipitation, flow cytometry, immunofluorescence, ouchterlony ), a complement fixation assay, and a protein chip can be measured by a method selected from the group consisting of.
상기 생물학적 시료에서 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화된 특징을 갖는지 확인하는 단계는 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 단백질의 아미노산 서열 및/또는 상기 단백질을 암호화하는 유전자의 핵산 서열의 분석을 통하여 돌연변이 여부를 검출하는 단계에 의하여 수행될 수 있다. 이 때, 생물학적 시료에서 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 단백질의 아미노산 서열 또는 상기 단백질을 암호화하는 유전자의 핵산 서열에 돌연변이(예를 들면, 점 돌연변이, 삽입, 결실)가 검출되는 경우(즉, 돌연변이가 존재하는 경우), Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화된 것으로 확인할 수 있다.In the biological sample, the step of determining whether at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 has a weakened or inactivated characteristic is 1 selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 It may be carried out by the step of detecting whether or not a mutation through the analysis of the amino acid sequence of more than one type of protein and / or the nucleic acid sequence of a gene encoding the protein. In this case, in a biological sample, a mutation (eg, point mutation, insertion, deletion ) is detected (ie, mutation is present), it can be confirmed that at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated.
상기 환자는 인간 등의 영장류, 마우스 등의 설치류 등을 포함하는 포유류일 수 있고 상기 생물학적 시료는 상기 환자로부터 분리된 내피세포(예를 들면, 망막 내피세포)일 수 있다.The patient may be a mammal including primates such as humans and rodents such as mice, and the biological sample may be endothelial cells (eg, retinal endothelial cells) isolated from the patient.
일 예에서, 상기 생물학적 시료에서 Dll4와 Notch1의 상호작용이 억제(저해)되었는지 확인하는 단계는 단백질-단백질 간 또는 단백질-화합물 간의 반응 여부를 확인하기 위하여 당업계에서 통상 사용되는 기술들을 적용하여 확인할 수 있다. 예를 들어, 면역학적 분석법, 형광 분석법, 효모 이중 혼성법(yeast two-hybrid), Dll4 또는 Notch1에 결합하는 파지 디스플레이 펩티드 클론의 검색, 천연물 및 화학물질 라이브러리 등을 이용한 HTS(high throughput screening), 드럭 히트 HTS 또는 세포 기반 스크리닝(cell-based screening) 등을 이용하는 스크리닝 방법 등을 사용할 수 있으나, 이러한 방법에 제한되는 것은 아니다.In one example, the step of determining whether the interaction between Dll4 and Notch1 in the biological sample is inhibited (inhibited) is confirmed by applying techniques commonly used in the art to determine whether the reaction between protein-protein or protein-compound can For example, immunological assay, fluorescence assay, yeast two-hybrid method, search for phage display peptide clones binding to Dll4 or Notch1, HTS (high throughput screening) using natural products and chemical libraries, etc., A screening method using drug hit HTS or cell-based screening, etc. may be used, but is not limited thereto.
일 예에서, Dll4 및/또는 Notch1에 특이적인 항체를 이용하여 Dll4 및/또는 Notch1의 상호작용이 저해되는지 여부를 검출할 수 있다. 예를 들어, 생성된 항원-항체 복합체 형성량을 야생형 또는 정상군 개체(또는 후보 물질을 처리하지 않은 대조군)에서의 항원-항체 복합체 형성량과 비교하여 저해 여부를 결정할 수 있다. 항원-항체 복합체 형성량의 절대적 또는 상대적 차이는 분자생물학적 또는 조직학적 분석으로 확인 가능하며, 이러한 분석법에는 면역탁본, 면역침전, 및 면역염색 등이 포함하나, 이에 제한되지 않는다.In one example, by using an antibody specific for Dll4 and/or Notch1, it can be detected whether the interaction of Dll4 and/or Notch1 is inhibited. For example, by comparing the amount of the generated antigen-antibody complex formation with the amount of antigen-antibody complex formation in a wild-type or normal group individual (or a control group not treated with a candidate substance), it can be determined whether inhibition or not. The absolute or relative difference in the amount of antigen-antibody complex formation can be confirmed by molecular biological or histological analysis, and such analysis methods include, but are not limited to, immunorubbing, immunoprecipitation, and immunostaining.
상기 항원-항체 반응을 이용한 검출 방법에서 항원-항체 복합체의 형성량은 검출 라벨(detection label)의 시그널의 크기를 통해서 정량적으로 측정 가능하다. 본 명세서에서, "검출 라벨"은 분광분석적(spectroscopic), 광화학적(photochemical), 생화학적(biochemical), 면역화학적(immunochemical), 화학적(chemical), 다른 물리화학적(physical) 수단에 의해 검출될 수 있는 조성물을 말한다. 이러한 검출 표지체에는 효소, 형광물, 리간드, 발광물, 미소입자 (microparticle), 레독스 분자, 및 방사선 동위원소 등이 있으며, 이로 제한되는 것은 아니다.In the detection method using the antigen-antibody reaction, the formation amount of the antigen-antibody complex can be quantitatively measured through the magnitude of the signal of the detection label. As used herein, the "detection label" may be detected by spectroscopic, photochemical, biochemical, immunochemical, chemical, or other physicochemical means. composition that has Such detection markers include, but are not limited to, enzymes, fluorescent substances, ligands, luminescent substances, microparticles, redox molecules, and radioisotopes.
일 예에서, Dll4 및/또는 Notch1에 각각 리포터 단백질과 연결한 후 상기 리포터 단백질의 신호 크기에 의하여 Dll4 및/또는 Notch1의 상호작용이 저해되는지 여부를 검출할 수 있다.In one example, after linking with a reporter protein to Dll4 and/or Notch1, respectively, it can be detected whether the interaction of Dll4 and/or Notch1 is inhibited by the signal magnitude of the reporter protein.
상기 리포터 단백질은 루시퍼라제, 클로람페니콜아세틸트랜스퍼라제, 베타-글루쿠로니다제, 베타-갈락토시다제, 알칼라인 포스파타아제, 또는 형광 단백질일 수 있으며, 이 때 형광 단백질은 녹색 형광 단백질(green fluorescent protein), 적색 형광 단백질(red fluorescent protein), 청색 형광 단백질(blue fluorescent protein), 황색 형광 단백질(yellow fluorescent protein), 남색 형광 단백질(cyan fluorescent protein), 증강된 녹색 형광 단백질(enhanced green fluorescent protein), 증강된 적색 형광 단백질, 증강된 청색 형광 단백질, 증강된 황색 형광 단백질, 및/또는 증강된 남색 형광 단백질일 수 있다.The reporter protein may be luciferase, chloramphenicolacetyltransferase, beta-glucuronidase, beta-galactosidase, alkaline phosphatase, or a fluorescent protein, wherein the fluorescent protein is green fluorescent protein (green fluorescent protein). protein, red fluorescent protein, blue fluorescent protein, yellow fluorescent protein, cyan fluorescent protein, enhanced green fluorescent protein , enhanced red fluorescent protein, enhanced blue fluorescent protein, enhanced yellow fluorescent protein, and/or enhanced indigo blue fluorescent protein.
상기 리포터 단백질을 Dll4 및/또는 Notch1과 각각 연결된 형태로 발현시키기 위하여, Dll4 를 암호화하는 유전자 및 리포터 유전자가 작동가능하게 연결된 발현 벡터, 그리고 Notch1을 암호화하는 유전자 및 리포터 유전자가 작동가능하게 연결된 발현 벡터를 세포에 공동 트랜스펙션할 수 있다.In order to express the reporter protein in a form linked to Dll4 and/or Notch1, respectively, an expression vector to which a gene encoding Dll4 and a reporter gene are operably linked, and an expression vector to which a gene encoding Notch1 and a reporter gene are operably linked can be co-transfected into cells.
리포터 단백질이 형광 단백질일 경우 형광 현미경을 이용하여 리포터 단백질의 형광 크기를 측정함으로써 Dll4 및 Notch1의 상호작용이 저해되는지 여부를 확인할 수 있으며, 리포터 단백질로 루시퍼라제와 같은 발광 효소를 사용하는 경우 공지된 루시퍼라제 활성 측정법 내지는 루시퍼라제 발광에 따라 Dll4 및 Notch1의 상호작용이 저해되는지 여부를 확인할 수 있다. 또한, 리포터 단백질로 클로람페니콜아세틸트랜스퍼라제, 베타-글루쿠로니다제, 베타-갈락토시다제, 알칼라인 포스파타아제 등과 같이 기질을 검출 가능한 광을 발광하는 발색 산물로 전환시킬 수 있는 효소를 사용하는 경우 발색 기질을 이용한 효소 반응에 의하여 얻어지는 광 신호에 의해 Dll4 및 Notch1의 상호작용이 억제(저해)되는지 여부를 확인할 수 있다.When the reporter protein is a fluorescent protein, it can be confirmed whether the interaction between Dll4 and Notch1 is inhibited by measuring the fluorescence magnitude of the reporter protein using a fluorescence microscope. It can be confirmed whether the interaction between Dll4 and Notch1 is inhibited according to a luciferase activity assay or luciferase luminescence. In addition, as a reporter protein, an enzyme capable of converting a substrate into a chromogenic product emitting detectable light, such as chloramphenicolacetyltransferase, beta-glucuronidase, beta-galactosidase, and alkaline phosphatase, is used. In this case, it can be checked whether the interaction between Dll4 and Notch1 is inhibited (inhibited) by an optical signal obtained by an enzymatic reaction using a chromogenic substrate.
일 예에서, 상기 VEGFR2 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자 선별에 정보를 제공하는 방법은In one embodiment, the method of providing information to the selection of patients suitable for the treatment of diseases due to hypertensive vascular leakage by the inhibitors that inhibit the VEGFR2 expression or activity is
(1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,(1) At least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated;
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
의 특징을 갖는 생물학적 시료가 유래한 환자를 VEGFR2 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자로 선택하는 단계를 추가로 포함할 수 있다.It may further include the step of selecting a patient from which the biological sample having the characteristics of a suitable patient for the treatment of a disease caused by hypertensive vascular leakage by an inhibitor that inhibits VEGFR2 expression or activity.
일 예에서, 상기 SREBP1 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자 선별에 정보를 제공하는 방법은In one embodiment, the method of providing information for selecting a patient suitable for the treatment of a disease caused by hypertensive vascular leakage by an inhibitor that inhibits the expression or activity of SREBP1 is
(1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,(1) At least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated;
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
의 특징을 갖는 생물학적 시료가 유래한 환자를 SREBP1 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자로 선택하는 단계를 추가로 포함할 수 있다.The method may further include selecting a patient from which the biological sample having the characteristics of is appropriate for treatment of a disease caused by hypertensive vascular leakage by an inhibitor that inhibits SREBP1 expression or activity.
일 예에서, 상기 VEGFR2 및 SREBP1 모두의 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자 선별에 정보를 제공하는 방법은In one example, the method for providing information to the selection of patients suitable for the treatment of diseases caused by hypertensive vascular leakage by an inhibitor that inhibits the expression or activity of both VEGFR2 and SREBP1 is
(1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,(1) At least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated;
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
의 특징을 갖는 생물학적 시료가 유래한 환자를 VEGFR2 및 SREBP1 모두의 발현 또는 활성을 억제하는 억제제에 의한 고혈압성 혈관누출로 인한 질병 치료에 적절한 환자로 선택하는 단계를 추가로 포함할 수 있다.The method may further include selecting a patient from which a biological sample having the characteristics of a patient suitable for treatment of a disease caused by hypertensive vascular leakage by an inhibitor that inhibits the expression or activity of both VEGFR2 and SREBP1.
다른 양상은 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상과 상호작용하는 물질을 포함하는, VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제 적용 대상 선별용 조성물을 제공한다.Another aspect is Sox17, Dll4, N1ICD, and VEGFR2, including a substance that interacts with one or more selected from the group consisting of N1ICD, and Notch1, VEGFR2, SREBP1, or a composition for inhibiting the expression or activity of both of these inhibitor application target selection to provide.
VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제에 대해서는 전술한 바와 같다,VEGFR2, SREBP1, or for inhibitors that inhibit the expression or activity of both, as described above,
상기 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상과 상호작용하는 물질은 예를 들면, (1) 상기 Sox17, Dll4, N1ICD, 및/또는 Notch1와 결합 가능한 화학물질(chemical, small molecule), 항체, 앱타머, 핵산 분자 (폴리뉴클레오타이드, 올리고뉴클레오타이드, 등); 및 (2) 상기 Sox17, Dll4, N1ICD, 및/또는 Notch1를 암호화하는 유전자의 일부 또는 전부에 결합하는 핵산 분자(예를 들면, 프라이머, 프로브, 앱타머 등), 화합물 등으로 이루어진 군에서 선택된 1종 이상일 수 있으며, 이들은 형광 물질, 발색 물질 등의 표지 물질로 표지되거나 표지되지 않은 것일 수 있다.The substance interacting with at least one selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is, for example, (1) a chemical capable of binding to Sox17, Dll4, N1ICD, and/or Notch1 (chemical, small molecules), antibodies, aptamers, nucleic acid molecules (polynucleotides, oligonucleotides, etc.); and (2) a nucleic acid molecule (eg, primer, probe, aptamer, etc.) that binds to some or all of the genes encoding Sox17, Dll4, N1ICD, and/or Notch1, a compound selected from the group consisting of 1 It may be more than one species, and these may be labeled with a labeling material such as a fluorescent material or a color developing material or not labeled.
일 예에서 상기 VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제 적용 대상은 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 정상인(또는 야생형) 보다 약화되었거나 불활성화된 개체를 의미할 수 있다.In one example, the VEGFR2, SREBP1, or an inhibitor applied to inhibit the expression or activity of all of them is Sox17, Dll4, N1ICD, and at least one activity selected from the group consisting of Notch1 is normal (or wild-type) weakened or not It can mean an activated object.
일 예에서, 상기 VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제 적용 대상은 고혈압성 혈관누출로 인한 질병을 가진 환자일 수 있다. VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제; 및 고혈압성 혈관누출에 의해서는 전술 및/또는 후술하는 바와 같다.In one example, the VEGFR2, SREBP1, or an inhibitor that inhibits the expression or activity of both, the target may be a patient having a disease caused by hypertensive vascular leakage. inhibitors that inhibit the expression or activity of VEGFR2, SREBP1, or both; and hypertensive vascular leakage as described above and/or later.
다른 양상은 내피세포 특이적으로 (1) Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화,Another aspect is endothelial cell-specific (1) at least one activity selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is attenuated or inactivated,
(2) Dll4와 Notch1의 상호작용이 억제, 또는(2) inhibition of the interaction of Dll4 and Notch1, or
(3) 상기 (1) 및 (2)의 조합(3) Combination of (1) and (2) above
의 특징을 갖는 것인, 고혈압성 혈관누출로 인한 질병 모델을 제공하는 것이다.It is to provide a disease model due to hypertensive vascular leakage, which has the characteristics of.
상기 고혈압성 혈관누출로 인한 질병은 전술한 바와 같고, 예를 들면, 고혈압 망막병증, 고혈압성 망막부종, 고혈압성 혈관기능 장애, 고혈압성 염증, 고혈압성 뇌병증, 고혈압성 뇌부종, 및 고혈압성 신병증으로 이루어진 군으로부터 선택되는 1종 이상인 것일 수 있다.The disease caused by the hypertensive vascular leak is as described above, for example, hypertensive retinopathy, hypertensive retinal edema, hypertensive vascular dysfunction, hypertensive inflammation, hypertensive encephalopathy, hypertensive cerebral edema, and hypertensive nephropathy. It may be at least one selected from the group consisting of.
상기 "질병(질환) 모델"이란 포유류(예를 들면, 인간, 개, 고양이, 마우스 등)의 질병과 아주 유사한 형태의 질병과 유사한 환경을 가진 분리된 세포, 조직, 기관, 및 동물로 이루어진 군으로부터 선택되는 1종 이상인 것일 수 있다.The "disease (disease) model" refers to a group consisting of isolated cells, tissues, organs, and animals having a disease-like environment in a form very similar to that of a mammal (eg, human, dog, cat, mouse, etc.) It may be at least one selected from
일 예에서, 상기 질병 모델은 질병 동물 모델일 수 있고, 사람의 질병과 아주 유사한 형태의 질병과 유사한 형태의 질병을 가진 인간을 제외한 동물을 의미할 수 있다. 사람과 동물들 간의 생리적 또는 유전적인 유사성에 의해, 질병 연구에 있어 생체의학 질병 모델 동물은 질병의 다양한 원인과 발병과정 및 진단에 대한 연구용 재료를 제공한다. 질병 모델의 연구를 통해 질병에 관련된 유전자들을 알아내고, 유전자들 간의 상호작용을 이해할 수 있게 하고, 개발된 신약후보물질의 실제 효능 및 독성 검사를 통해 실용화 가능성의 여부를 판단하는 기초 자료를 얻을 수 있다.In one example, the disease model may be a disease animal model, and may refer to an animal other than a human having a disease in a form very similar to a human disease. Due to the physiological or genetic similarity between humans and animals, biomedical disease model animals in disease research provide research materials for various causes, pathogenesis and diagnosis of diseases. Through disease model research, it is possible to find out disease-related genes, understand the interactions between genes, and obtain basic data for judging the feasibility of practical use through actual efficacy and toxicity tests of developed new drug candidates. there is.
상기 "동물"은 인간 이외의 임의의 포유류 동물, 예를 들면 마우스, 랫트, 기니피그, 또는 햄스터 등의 설치류일 수 있고, 상업적 소스로부터 수득될 수 있다.The "animal" may be any mammal other than humans, for example, rodents such as mice, rats, guinea pigs, or hamsters, and may be obtained from commercial sources.
일 예에 따르면, 상기 내피세포는 망막 동맥 내피세포일 수 있다.According to an example, the endothelial cells may be retinal artery endothelial cells.
일 예에서, 내피세포 특이적으로 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상의 활성이 약화 또는 불활성화된 질병 모델은 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어진 군으로부터 선택되는 1종 이상을 암호화하는 유전자가 내피세포 특이적으로 결실된 것일 수 있다.In one example, the disease model in which one or more activities selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 specifically for endothelial cells is attenuated or inactivated is selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 Genes encoding one or more types may be endothelial cell-specific deletions.
본 명세서에서, "결실"은 해당 유전자 서열이 완전히 결실된 것뿐만 아니라, 해당 유전자가 암호화하는 단백질의 발현이 야생형(wild type) 단백질에 비해 현저히 감소 또는 완전히 상실된 경우라면 부분적으로 결실된 것도 포함한다. 상기 유전자 결실은 당업계에 잘 알려진 방법으로 수행될 수 있다.As used herein, "deletion" includes not only the complete deletion of the gene sequence, but also the partial deletion if the expression of the protein encoded by the gene is significantly reduced or completely lost compared to the wild type protein. . The gene deletion may be performed by a method well known in the art.
일 구체예에 따르면, 상기 Sox17, Dll4, 또는 Notch1가 내피세포 특이적으로 결실된Sox17i△EC, Dll4i△EC, 또는 Notch1i△EC형질전환 마우스나 Dll4가 망막 동맥 내피세포 특이적으로 결실된Dll4i△RAEC형질전환 마우스는 동맥 혹은 세동맥(소동맥) 주변으로 누출이 나타나고, 이는 고혈압성 혈관질환(예를 들면, 고혈압 망막병증)과 동일하거나 유사한 표현형을 갖고 있는 것을 확인하였다.According to one embodiment, the Sox17, Dll4, or Notch1 is endothelial cell-specific deletionSox17i△EC, Dll4i△EC , orNotch1i△EC transgenic mouse or Dll4 is retinal artery endothelial cell-specific deletionDll4i△RAECTransgenic mice showed leakage around arteries or arterioles (arterioles), and it was confirmed that they had the same or similar phenotype as hypertensive vascular disease (eg, hypertensive retinopathy).
일 구체예에 따르면, α-Dll4 항체, 또는 α-Notch1 항체가 처리된 HUVEC 세포 및/또는 HREC는 상기 항체가 처리되지 않은 대조군 보다 (i) 접합 마커(junctional marker)의 발현은 유의미한 변화가 없거나/없고; (ⅱ) 트랜스시토시스 관련 마커의 발현이 증가된 것을 확인하여, Dll4 및/또는 Notch1의 활성이 약화 또는 불활성화된 세포는 트랜스시토시스 증가에 의한 고혈압성 혈관질환의 특성을 반영하는 것을 확인하였다. 일 예에서 상기 밀착연접 관련 마커는 VE-cadherin, claudin-5, occludin, 및/또는 ZO-1일수 있고, 상기 트랜스시토시스 관련 마커는 PLVAP 및/또는 caveloin-1일 수 있다.According to one embodiment, the HUVEC cells and/or HRECs treated with the α-Dll4 antibody or the α-Notch1 antibody have (i) no significant change in the expression of the junctional marker than the control group not treated with the antibody. /none; (ii) By confirming that the expression of transcytosis-related markers was increased, it was confirmed that cells with weakened or inactivated Dll4 and/or Notch1 activity reflected the characteristics of hypertensive vascular disease due to increased transcytosis. . In one embodiment, the tight junction-related marker may be VE-cadherin, claudin-5, occludin, and/or ZO-1, and the transcytosis-related marker may be PLVAP and/or caveloin-1.
일 예에 따르면, 상기 질병 모델은 망막에서 비출혈성 혈관누출이 발생하는 것일 수 있고, 구체적으로 망막의 동맥에서 비출혈성 혈관누출이 발생한 것일 수 있다. 일 구체예에서 상기 비출혈성 혈관 누출은 상기 질병 모델에서 에반스블루, 덱스트란(예를 들면, 4kD 및/또는 10kD 덱스트란)과 같은 추적자(tracer)에 의해 시각화된 것일 수 있다.According to an example, the disease model may be non-hemorrhagic vascular leakage in the retina, and specifically, non-hemorrhagic vascular leakage in retinal arteries. In one embodiment, the nonhemorrhagic vascular leakage may be visualized by a tracer such as Evans Blue or dextran (eg, 4kD and/or 10kD dextran) in the disease model.
일 예에서, 상기 비출혈성 혈관누출은 트랜스시토시스에 의한 것일 수 있다. 상기 질병 모델은 내피세포에서 세포횡단 소낭(transcellular vesicle)의 수가 야생형에 비해 증가한 것일 수 있다. 상기 비출혈성 혈관누출은 세포사이 수송(paracellular transport)을 통한 것이 아니라, 카베올라(caveolae)에 의한 트랜스시토시스 증가에 의한 것일 수 있고, 따라서 질병 모델은 내피세포에서 트랜스시토시스 마커인 PLVAP 및/또는 caveloin-1의 발현이 야생형 보다 증가된 것일 수 있다.In one example, the non-hemorrhagic vascular leak may be due to transcytosis. The disease model may be an increase in the number of transcellular vesicles in endothelial cells compared to the wild type. The non-hemorrhagic vascular leakage may be due to increased transcytosis by caveolae, not paracellular transport, and thus the disease model is based on PLVAP and/or transcytosis markers in endothelial cells. Alternatively, the expression of caveloin-1 may be increased compared to the wild type.
상기 질병 모델은 접합 마커(junctional marker)인 VE-cadherin, claudin-5, occludin, 및/또는 ZO-1의 발현 수준 및 분포 패턴이 야생형과 동일하거나 유사한 것일 수 있다.In the disease model, expression levels and distribution patterns of junctional markers VE-cadherin, claudin-5, occludin, and/or ZO-1 may be the same as or similar to those of the wild type.
상기 질병 모델은 망막에서 벽 세포(mural cell)(예를 들면, NG2-양성 주피세포(혈관 주위 세포) 및/또는 SMA-양성 평활근 세포)의 범위(coverage)가 야생형과 동일하거나 유사한 것일 수 있다.The disease model may be one in which the coverage of parietal cells (eg, NG2-positive pericytes (perivascular cells) and/or SMA-positive smooth muscle cells) in the retina is the same as or similar to that of the wild type. .
상기 질병 모델은 망막 표피 혈관층(superficial vascular layers; SVL)에서 혈관누출이 발생한 것일 수 있다. 상기 망막 표피 혈관층에서 발생한 혈관누출은 출혈성 혈관누출이 아니라 비출혈성 혈관누출일 수 있다. 상기 질병 모델은 심혈관층(deep vascular layer; DVL)에서 혈관누출이 발생하지 않은 것일 수 있다.The disease model may be a vascular leak in the retinal epidermal vascular layers (SVL). The vascular leak occurring in the retinal epidermal vascular layer may be a non-hemorrhagic vascular leak, not a hemorrhagic vascular leak. The disease model may be one in which vascular leakage does not occur in the deep vascular layer (DVL).
일 예에서, 상기 질병 모델의 망막 표피 혈관층(superficial vascular layers; SVL)은 70 내지 100㎛, 또는 75 내지 95㎛의 두께를 갖는 것일 수 있다.In one example, the retinal epidermal vascular layers (SVL) of the disease model may have a thickness of 70 to 100 μm, or 75 to 95 μm.
일 예에서, 상기 질병 모델은 망막에서 표피 혈관 부종이 발생하고 망막 하액이 축적된 것일 수 있다.In one example, the disease model may be that epidermal angioedema occurs in the retina and subretinal fluid accumulates.
일 구체예에 따르면, 상기 질병 모델은Sox17i△EC, Dll4i△RAEC, Dll4i△EC, 및/또는 Notch1i△EC형질전환 마우스일 수 있다.According to one embodiment, the disease model may be aSox17iΔEC, a Dll4iΔRAEC, a Dll4iΔEC , and/or aNotch1iΔEC transgenic mouse.
일 구체예에 따른 질병 모델은, 기존의 고혈압성 혈관누출로 인한 질병 모델에 비해, 하기와 같은 장점을 가진다:The disease model according to one embodiment has the following advantages over the existing disease model due to hypertensive vascular leakage:
(1) 망막 동맥 및/또는 세동맥(소동맥) 특이적인 트랜스시토시스 증가 및 혈관 누출 재현; 및/또는(1) increased retinal artery and/or arteriole (arteriolar) specific transcytosis and reproduction of vascular leakage; and/or
(2) 고혈압에 의한 비출혈성 혈관 누출 재현.(2) Reproduction of nonhemorrhagic vascular leakage due to hypertension.
다른 양상은 상기 질병 모델에 후보 물질을 처리하는 단계;Another aspect comprises the steps of processing a candidate substance to the disease model;
후보물질이 처리된 질병 모델에서 Sox17, Dll4, Notch1, N1ICD, VEGFR2, 및 SREBP1으로 이루어진 군으로부터 선택되는 1종 이상의 발현 또는 활성 수준을 측정하는 단계; 및Measuring the expression or activity level of one or more selected from the group consisting of Sox17, Dll4, Notch1, N1ICD, VEGFR2, and SREBP1 in the candidate material-treated disease model; and
상기 후보물질이 미처리된 대조군와 상기 후보물질이 처리된 질병 모델에서 측정된 결과를 비교하는 단계를 포함하는, 고혈압성 혈관 누출로 인한 질병 예방 또는 치료용 약물의 스크리닝 방법을 제공한다. 고혈압성 혈관 누출로 인한 질병에 대해서는 전술한 바와 같다.It provides a screening method for a drug for preventing or treating a disease caused by hypertensive vascular leakage, comprising comparing results measured in a control group untreated with the candidate substance and a disease model treated with the candidate substance. Diseases caused by hypertensive vascular leakage are the same as described above.
본 명세서에서, "처리" 란 후보물질이 상기 질병 모델에 직접적으로 접촉하는 것뿐 아니라, 물질이 세포막에 영향을 미치고 그 세포막으로부터 발생한 신호가 Sox17, Dll4, Notch1, N1ICD, VEGFR2, 및 SREBP1으로 이루어진 군으로부터 선택되는 1종 이상에 접촉하거나 영향을 미치는 경우도 포함한다. 따라서 상기 후보물질은 세포막 투과성인 물질뿐만 아니라, 세포막에 불투과성인 물질도 포함한다. 이 때, 후보물질은 유효량의 범위 내에서 처리하도록 한다. "유효량" 이란 반응을 유도하기에 충분한 양을 의미하는 것으로, 유효량 범위 이하에서는, 정확한 결과를 얻을 수 없으므로, 유효량 범위 내에서 억제능을 측정하는 것이 바람직하다.In the present specification, "treatment" means that the candidate material not only directly contacts the disease model, but also the material affects the cell membrane and the signal generated from the cell membrane is Sox17, Dll4, Notch1, N1ICD, VEGFR2, and SREBP1 consisting of It also includes the case of contacting or affecting one or more selected from the group. Accordingly, the candidate material includes not only a material permeable to the cell membrane, but also a material impermeable to the cell membrane. In this case, the candidate substance should be treated within the effective amount. "Effective amount" means an amount sufficient to induce a reaction, and since accurate results cannot be obtained below the effective amount range, it is preferable to measure the inhibitory ability within the effective amount range.
상기 후보물질은 프라이머, 프로브, 압타머, 안티센스 올리고뉴클레오티드, 화합물, 단백질, 펩타이드, 핵산 분자, 바이러스, 항체, 및 추출물로 이루어진 군으로부터 선택되는 1종 이상인 것일 수 있다.The candidate material may be one or more selected from the group consisting of primers, probes, aptamers, antisense oligonucleotides, compounds, proteins, peptides, nucleic acid molecules, viruses, antibodies, and extracts.
일 예에서, 평가 대상이 되는 후보물질은 유리체 내 투여, 결막낭 내 투여, 결막하 투여, 및/또는 테논낭 하 투여로 이루어진 군으로부터 선택된 경로에 의한 것일 수 있다. 그러나, 어떠한 투여 경로의 약물 또는 약제도 평가할 수 있으며 특별히 제한되지 않는다. 비경구적 또는 경구적으로 투여되는 후보 물질을 평가할 수 있다. 비경구적으로 투여되는 약제의 예로는, 전술된 점안제 이외에 눈 연고제, 주사제, 외용제, 좌제를 들 수 있다. 약물의 투여량은 약물의 성질, 투여 대상의 종류, 연령이나 체중 등의 조건을 기초로 종합적으로 판단하여, 최적의 양을 적절하게 결정해야 하며 특별히 한정되지 않는다.In one example, the candidate substance to be evaluated may be by a route selected from the group consisting of intravitreal administration, intraconjunctival sac administration, subconjunctival administration, and/or subtenon's capsule administration. However, the drug or agent of any route of administration can be evaluated and is not particularly limited. Candidates to be administered parenterally or orally can be evaluated. Examples of the parenterally administered drug may include eye ointments, injections, external preparations, and suppositories in addition to the above-mentioned eye drops. The dosage of the drug should be determined comprehensively based on conditions such as the nature of the drug, the type of administration subject, age or weight, and the optimal amount should be appropriately determined, and is not particularly limited.
일 예에 따르면, 투여 시기나 투여 회수 등의 투여 조건은 약물의 성질, 시험 및 평가 목적 등에 따라 적절하게 최적이 되도록 설정할 수 있고, 특별히 제한되지 않는다.According to an example, administration conditions, such as administration time or number of administrations, may be appropriately set to be optimal according to the properties of the drug, the purpose of testing and evaluation, etc., and is not particularly limited.
상기 비교하는 단계는 Sox17, Dll4, Notch1, 및 N1ICD으로 이루어진 군으로부터 선택되는 1종 이상을 암호화하는 유전자 수준 측정, 및/또는 상기 단백질 발현이나 활성 수준을 측정하여 수행할 수 있다. 구체적으로, 상기 비교하는 단계는 중합효소연쇄반응(PCR), 역전사 중합효소연쇄반응(RT-PCR), 실시간 중합효소연쇄반응(Real-time PCR), RNase 보호 분석법(RNase protection assay; RPA), 마이크로어레이(microarray), 노던 블롯팅(northern blotting), 웨스턴 블롯팅(western blotting), 방사선면역분석법(radioimmunoassay; RIA), 방사 면역 확산법(radioimmunodiffusion), 효소면역분석법(ELISA), 면역침강법(immunoprecipitation), 유세포분석법(flow cytometry), 면역형광염색법(immunofluorescence), 오우크테로니(ouchterlony), 보체 고정 분석법(complement fixation assay), 및 단백질 칩(protein chip)으로 이루어진 군으로부터 선택되는 1종 이상인 것일 수 있다.The comparing step may be performed by measuring the level of a gene encoding one or more selected from the group consisting of Sox17, Dll4, Notch1, and N1ICD, and/or measuring the protein expression or activity level. Specifically, the comparing step is a polymerase chain reaction (PCR), a reverse transcription polymerase chain reaction (RT-PCR), a real-time polymerase chain reaction (Real-time PCR), an RNase protection assay (RPA), Microarray, northern blotting, western blotting, radioimmunoassay (RIA), radioimmunodiffusion, enzyme immunoassay (ELISA), immunoprecipitation ), flow cytometry, immunofluorescence, ouchterlony, complement fixation assay, and at least one selected from the group consisting of a protein chip can
일 예에서, 상기 후보물질이 처리된 질병 모델에서 Sox17, Dll4, Notch1, N1ICD, VEGFR2, 및 SREBP1으로 이루어진 군으로부터 선택되는 1종 이상의 발현 또는 활성 수준을 측정하는 단계는 Dll4와 Notch1의 상호작용 정도를 측정하는 것을 포함할 수 있다. Dll4와 Notch1의 상호작용 정도를 측정하는 방법은 단백질-단백질 간 또는 단백질-화합물 간의 반응 여부를 확인하기 위하여 당업계에서 통상 사용되는 기술들을 적용하여 확인할 수 있고, 이에 대해서는 전술한 바와 같다.In one example, the step of measuring the expression or activity level of one or more selected from the group consisting of Sox17, Dll4, Notch1, N1ICD, VEGFR2, and SREBP1 in the disease model treated with the candidate material is the degree of interaction between Dll4 and Notch1 may include measuring A method of measuring the degree of interaction between Dll4 and Notch1 can be confirmed by applying techniques commonly used in the art to determine whether a protein-protein or protein-compound reaction occurs, and this is the same as described above.
일 예에 따르면, 상기 스크리닝 방법은 상기 후보물질이 처리된 질병 모델에서 측정된 Sox17, Dll4, Notch1, 및 N1ICD으로 이루어진 군으로부터 선택되는 1종 이상의 발현 또는 활성 수준이 상기 후보물질이 미처리된 대조군 보다 증가한 경우 상기 후보물질을 고혈압성 혈관 누출로 인한 질병 예방 또는 치료용 약물로 선택하는 단계를 추가로 포함할 수 있다. 상기 후보물질이 처리된 질병 모델에서 측정된 Sox17, Dll4, Notch1, 및 N1ICD으로 이루어진 군으로부터 선택되는 1종 이상의 발현 또는 활성 수준이 상기 후보물질이 미처리된 대조군 보다 증가한 경우는 Dll4와 Notch1의 상호작용이 상기 후보물질이 미처리된 대조군 보다 증가한 것을 포함할 수 있다.According to an example, in the screening method, the expression or activity level of one or more selected from the group consisting of Sox17, Dll4, Notch1, and N1ICD measured in a disease model treated with the candidate substance is higher than that of a control group in which the candidate substance is not treated. In the case of an increase, the method may further include selecting the candidate material as a drug for preventing or treating diseases caused by hypertensive vascular leakage. When the expression or activity level of one or more selected from the group consisting of Sox17, Dll4, Notch1, and N1ICD measured in a disease model treated with the candidate material is increased compared to the control group untreated with the candidate material, Dll4 and Notch1 interaction This may include an increase in the candidate substance compared to the untreated control.
일 예에 따르면, 상기 스크리닝 방법은 상기 후보물질이 처리된 질병 모델에서 측정된 VEGFR2 및 SREBP1으로 이루어진 군으로부터 선택되는 1종 이상의 발현 또는 활성 수준이 상기 후보물질이 미처리된 대조군 보다 감소한 경우 상기 후보물질을 고혈압성 혈관 누출로 인한 질병 예방 또는 치료용 약물로 선택하는 단계를 추가로 포함할 수 있다.According to an example, in the screening method, when the expression or activity level of one or more selected from the group consisting of VEGFR2 and SREBP1 measured in a disease model treated with the candidate substance is lower than that of the control group to which the candidate substance is not treated, the candidate substance It may further include the step of selecting as a drug for preventing or treating diseases caused by hypertensive vascular leakage.
상기 스크리닝 방법으로 획득된 약물은 Sox17, Dll4, Notch1, 및/또는 N1ICD의 활성을 증가시킴으로써, 내피세포(예를 들면, 망막 내피세포, 망막 동맥 내피세포 등)에서 트랜스시토시스에 의한 비출혈성 혈관 누출을 억제하여, 고혈압성 혈관 누출로 인한 질환을 예방 및/또는 치료할 수 있다.The drug obtained by the above screening method increases the activity of Sox17, Dll4, Notch1, and/or N1ICD, thereby transcytosis-induced non-hemorrhagic blood vessels in endothelial cells (eg, retinal endothelial cells, retinal arterial endothelial cells, etc.) By inhibiting leakage, it is possible to prevent and/or treat diseases caused by hypertensive vascular leakage.
상기 스크리닝 방법으로 획득된 약물은 VEGFR2, 및/또는 SREBP1의 활성을 감소시킴으로써, 내피세포(예를 들면, 망막 내피세포, 망막 동맥 내피세포 등)에서 트랜스시토시스에 의한 비출혈성 혈관 누출을 억제하여, 고혈압성 혈관 누출로 인한 질환을 예방 및/또는 치료할 수 있다.The drug obtained by the screening method reduces the activity of VEGFR2, and/or SREBP1, thereby inhibiting non-hemorrhagic vascular leakage due to transcytosis in endothelial cells (eg, retinal endothelial cells, retinal arterial endothelial cells, etc.) , diseases caused by hypertensive vascular leakage can be prevented and/or treated.
다른 양상은 내피세포 특이적으로 Sox17, Dll4, N1ICD, 및 Notch1로 이루어지는 군에서 선택된 1종 이상의 활성을 약화 또는 불활성화시키는 단계를 포함하는, 고혈압성 혈관누출로 인한 질병 모델의 제조 방법을 제공한다. 상기 고혈압성 혈관누출로 인한 질병 및 질병 모델에 대해서는 전술한 바와 같다.Another aspect provides a method for preparing a disease model due to hypertensive vascular leakage, comprising the step of attenuating or inactivating one or more activities selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 specifically for endothelial cells. Diseases and disease models caused by the hypertensive vascular leakage are the same as described above.
상기 질병 모델은 내피세포를 포함하는 것일 수 있다. 상기 내피세포는 혈관내피세포, 예를 들면 망막 동맥 내피세포일 수 있다.The disease model may include endothelial cells. The endothelial cells may be vascular endothelial cells, for example, retinal artery endothelial cells.
상기 내피세포 특이적으로 Sox17, Dll4, N1ICD, 및 Notch1로 이루어지는 군에서 선택된 1종 이상의 활성을 약화 또는 불활성화시키는 단계는, 분리된 세포, 조직, 기관, 및 동물(예를 들면, 인간을 제외한 동물)로 이루어진 군으로부터 선택되는 1종 이상에서 내피세포 특이적으로 특정 유전자를 결실 또는 녹아웃(Knockout)시키기 위한 목적 범위에서 제한 없이 이용될 수 있다.In the endothelial cell-specific step of attenuating or inactivating one or more activities selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1, the isolated cells, tissues, organs, and animals (eg, animals other than humans) ) can be used without limitation in the scope of purpose for deleting or knocking out a specific gene specifically for endothelial cells in one or more selected from the group consisting of.
상기 Sox17, Dll4, N1ICD, 및 Notch1로 이루어지는 군에서 선택된 1종 이상의 활성을 약화 또는 불활성화시키는 단계는 Sox17, Dll4, N1ICD, 및 Notch1로 이루어지는 군에서 선택된 1종 이상을 암호화하는 유전자를 Cre 재조합효소 또는 아데노바이러스를 이용하여 결실시키는 것일 수 있다.The step of attenuating or inactivating one or more activities selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is a gene encoding one or more selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 Cre recombinase or It may be deleted using an adenovirus.
일 구체예에 따르면, 내피세포 특이적으로 Sox17, Dll4, N1ICD, 및 Notch1로 이루어지는 군에서 선택된 1종 이상의 유전자를 결실시키기 위해 상기 조직 특이적으로 발현되는 Cre 재조합효소를 이용하는 경우,Slco1c1 CreERT2 또는Cdh5-CreERT2 라인이 이용될 수 있다.Slco1c1 CreERT2 는 뇌혈관 내피세포 및/또는 망막 동맥내피세포 특이적으로 유전자 결실시키기 위해 사용될 수 있고,Cdh5-CreERT2 는 전체 내피세포 특이적으로 유전자 결실시키기 위해 사용될 수 있다. 보다 구체적으로Cdh5-CreERT2 라인을Dll4fl/fl,Notch1fl/fl, 또는Sox17fl/fl 라인과 교배시키거나Slco1c1-CreERT2 라인을Dll4fl/fl,Notch1fl/fl, 또는Sox17fl/fl 라인과 교배시켜 질병 모델을 제조할 수 있고, 상기 질병 모델은 타목시펜 처리(투여)에 의하여 해당 유전자 결실이 활성화될 수 있다.According to one embodiment, when using the tissue-specifically expressed Cre recombinase to delete one or more genes selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 specifically for endothelial cells,Slco1c1 CreERT2 orThe Cdh5- CreERT2 line may be used.Slco1c1 CreERT2 can be used for gene deletion specifically for cerebrovascular endothelial cells and/or retinal arterial endothelial cells, andCdh5- CreERT2 can be used for gene deletion specifically for whole endothelial cells. More specifically, aCdh5 -CreERT2 line was crossed with aDll4fl/fl ,Notch1fl/fl , orSox17fl/fl line, or aSlco1c1 -CreERT2 line was crossed with aDll4fl/fl ,Notch1fl/fl , orSox17fl/fl line. A disease model may be prepared by crossing with a line, and the corresponding gene deletion may be activated by tamoxifen treatment (administration) in the disease model.
일 구체예에서, 상기 질병 모델은 마우스일 수 있고, 타목시펜이 에스트로겐에 영향을 미치는 것을 방지하기 위하여 수컷 마우스만을 질병 모델 제조에 사용할 수 있다.In one embodiment, the disease model may be a mouse, and in order to prevent tamoxifen from affecting estrogen, only male mice may be used for the preparation of the disease model.
상기 Sox17, Dll4, N1ICD, 및 Notch1로 이루어지는 군에서 선택된 1종 이상의 활성을 약화 또는 불활성화시키는 단계는 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어지는 군에서 선택되는 1종 이상을 타겟으로 하는 항체를 처리하는 것일 수 있다.The step of attenuating or inactivating one or more activities selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is Sox17, Dll4, N1ICD, and the step of inactivating one or more selected from the group consisting of Notch1. it could be
상기 Sox17, Dll4, N1ICD, 및 Notch1으로 이루어지는 군에서 선택되는 1종 이상을 타겟으로 하는 항체를 처리하는 것은 상기 항체가 분리된 세포, 조직, 기관, 및 동물(예를 들면, 인간을 제외한 동물)로 이루어진 군으로부터 선택되는 1종 이상과 접촉시키는 것을 의미할 수 있다. 일 예에서 동물에 상기 항체를 접촉시키는 것은 상기 항체를 포함하는 조성물을 인간을 제외한 동물에 투여하는 것일 수 있으며, 투여에 관한 것은 전술한 바와 같다.Treatment of the antibody targeting at least one selected from the group consisting of Sox17, Dll4, N1ICD, and Notch1 is performed in cells, tissues, organs, and animals from which the antibody is isolated (eg, animals other than humans) It may mean contacting with one or more selected from the group consisting of. In one embodiment, contacting the antibody with the animal may be administering a composition comprising the antibody to an animal other than a human, and administration is the same as described above.
일 구체예에 따르면, 상기 제조 방법은 HUVEC(Human umbilical vein endothelial cell) 및/또는 HREC(Primary human retina endothelial cell)에 α-Sox17 항체, α-Dll4 항체, α-N1ICD 항체, 및 α-Notch1항체로 이루어지는 군에서 선택된 1종 이상의 항체를 처리하여 고혈압성 혈관누출로 인한 질병 모델을 제조할 수 있다.According to one embodiment, the preparation method comprises an α-Sox17 antibody, an α-Dll4 antibody, an α-N1ICD antibody, and an α-Notch1 antibody to human umbilical vein endothelial cells (HUVEC) and/or primary human retina endothelial cells (HREC). It is possible to prepare a disease model due to hypertensive vascular leakage by treating at least one antibody selected from the group consisting of
일 구체예에 따르면, 상기 제조 방법은 마우스의 망막에 α-Sox17 항체, α-Dll4 항체, α-N1ICD 항체, 및 α-Notch1 항체로 이루어지는 군에서 선택된 1종 이상의 항체를 투여(예를 들면, 유리체내 투여)하여 고혈압성 혈관누출로 인한 질병 모델을 제조할 수 있다.According to one embodiment, the preparation method administers one or more antibodies selected from the group consisting of α-Sox17 antibody, α-Dll4 antibody, α-N1ICD antibody, and α-Notch1 antibody to the retina of a mouse (eg, Intravitreal administration) to prepare a disease model due to hypertensive vascular leakage.
상기 방법으로 제조된 질병 모델은 전술한 "고혈압성 혈관누출로 인한 질병 모델"에 대한 바와 동일한 특징을 가질 수 있다. 일 예에서, 상기 고혈압성 혈관누출로 인한 질병 모델은 망막 표피 혈관층(superficial vascular layers; SVL)에서 혈관누출이 발생하는 것일 수 있다.The disease model prepared by the above method may have the same characteristics as for the "disease model due to hypertensive vascular leakage" described above. In one example, the disease model due to hypertensive vascular leakage may be one in which vascular leakage occurs in superficial vascular layers (SVL) of the retina.
또 다른 양상은, VEGFR2, SREBP1, 또는 이들 모두의 발현 또는 활성을 억제하는 억제제를 포함하는, 혈관 누출 저해용 조성물을 제공한다.Another aspect provides a composition for inhibiting vascular leakage, comprising an inhibitor for inhibiting the expression or activity of VEGFR2, SREBP1, or both.
또 다른 양상은, VEGFR2의 발현 또는 활성을 억제하는 억제제와 SREBP1의 발현 또는 활성을 억제하는 억제제를 포함하는, 혈관 누출 저해용 조성물을 제공한다.Another aspect provides a composition for inhibiting vascular leakage, comprising an inhibitor for inhibiting the expression or activity of VEGFR2 and an inhibitor for inhibiting the expression or activity of SREBP1.
상기 혈관 누출 저해용 조성물은 고혈압성 혈관 누출을 저해하는 것일 수 있다. 상기 고혈압성 혈관 누출은 망막 동맥 SVL에서의 비출혈성 혈관 누출일 수 있다.The composition for inhibiting vascular leakage may inhibit hypertensive vascular leakage. The hypertensive vascular leak may be a non-hemorrhagic vascular leak in the retinal artery SVL.
일 예에 따른 약학적 조성물은 고혈압성 혈관 누출로 인한 질병의 예방 또는 치료 효과가 우수하다.The pharmaceutical composition according to an embodiment is excellent in preventing or treating diseases caused by hypertensive vascular leakage.
각 도면에서의 각 결과값은 평균 ± SD로 표시되었으며 **은 P<0.01을 의미하고, *는 P<0.05를 의미하며, NS는 유의하지 않음(not significant)를 의미한다. A는 동맥(artery), V는 정맥(vein), C는 모세혈관(capillary), 및 D는 Deep vessel을 나타낸다. PECAM은 VECAD(Vascular endothelial-cadherin)는 EC 마커이다.
도 1은 Dll4 차단에 따른 성인 망막 혈관에서 형태학적, 구조적, 및 접합부의 변화를 나타낸다.
도 1의 구체적으로, A는 출생 후 5일차(P5) 및 성인(출생 후 70일차; P70) 망막에서 Dll4의 면역 염색결과를 나타내고, 도 1의 B는 Dll4 강도(intensity)를 정량한 결과(그룹마다 6개의 실험결과값에 따른 평균값)를 나타낸다. 도 1의 A 및 B에서 A는 동맥(artery), V는 정맥(vein), C는 모세혈관(capillary), 및 D는 Deep vessel을 나타낸다.
도 1의 C 내지 J는 성인 마우스에 α-Dll4 Ab를 유리체내 주사하고 망막 혈관에서 7일 후에 유의한 형태적 변화는 없었으나 기저막(basement membrane)이 감소한 결과를 나타낸다. 구체적으로, C 및 D는 IgG 투여군 또는 α-Dll4 Ab 투여군의 전체 마운트된 망막에서 각각 α-SMA+ 평활근 세포(smooth muscle cell)(C) 및 NG2+ 주피세포(혈관 주위세포, pericyte)(D)에 대한 면역 염색 결과를 나타내고, E는 C 및 D의 결과를 각각 이를 정량한 그래프(n= 그룹 당 10개의 망막)를 나타낸다. E에서 VSMC는 혈관 평활근 세포(Vascular Smooth Muscle Cell)를 의미한다. F는 IgG 투여군 또는 α-Dll4 Ab 투여군에서 혈관의 밀도(vascular density, %) 및 동맥 지름(arterial diameter, ㎛)을 측정한 결과를 나타낸다(n= 그룹 당 10개의 망막). G는 IgG 투여군 또는 α-Dll4 Ab 투여군에서 Ⅳ형 콜라겐(Col Ⅳ)의 면역염색 결과를 나타내고, H는 G의 결과를 정량한 그래프(n= 그룹 당 10개의 망막)를 나타낸다. I는 덱스트란-관류 망막의 생체 내 이미지(intravital image)를 나타내고, J는 덱스트란-관류 망막에서 혈관의비틀림 지수(tortuosity index; 좌측 그래프) 및 전곡률(integrated curvature) 을 나타낸다(n= 그룹 당 6개의 망막).
도 1의 K는 IgG 투여군 또는 α-Dll4 투여군의 망막 용해물에서 PLVAP 및 caveolin-1(Cav-1)의 면역블롯 결과 및 이를 정량한 그래프(하단 그래프)를 나타낸다(n= 그룹 당 3).
도 1의 A 및 C에서 스케일바는 500㎛를 나타내고, D, G, 및 I에서 스케일바는 100㎛를 나타낸다.
도 2는 Dll4 차단이 성인 마우스 망막에서 풍부하고(abundant) 가역적인 동맥-주위 누출을 유도하는 것을 나타낸다.
구체적으로, 도 2의 A는 성인 마우스에 항-Dll4(α-Dll4 Ab) 또는 대조군(IgG) 항체의 유리체내 주사에 의한 망막 Dll4의 일시적 및 국소적 억제에 대한 모식도를 나타낸다.
도 2의 B는 적층 조직 및 혈관 기관을 갖는 망막의 개략도를 나타낸다. DVP는 심혈관총(deep vascular plexus), GCL은 신경절 세포층(ganglion cell layer), INL은 내핵층(inner nuclear layer), RNFL은 망막 신경 섬유층(retinal nerve fiber layer), SVP는 표피 혈관총(superficial vascular plexus)을 나타낸다.
도 2의 C는 표피 혈관층(superficial vascular layer)에서 추적자의 누출을 나타내는 전체 마운트된 망막의 PECAM-면역염색 및 망막 컵의 전체 이미지를 나타낸다. 화살표는 혈관외유출된 10kD 덱스트란을 나타낸다.
도 2의 D는 누출을 정량화한 그래프를 나타내고, 도 2의 E는 α-Dll4 Ab 처리된 후 일수에 따른 전체-마운트된 망막의 이미지를 나타내며, 도 2의 F는 동맥 주변(periarterial) 및 정맥주변(perivenous)에서 EB 누출을 정량화한 그래프를 나타낸다. 도 2의 E에서 A는 동맥을 나타낸다. 도 2의 C에서 노란색의 스케일바 및 E에서 하얀색의 스케일바는 500㎛를 나타내고 C에서 하얀색의 스케일 바는 100㎛를 나타낸다.
도 3은 성인 망막 혈관의 내피 접합부는 Dll4 차단 후에도 보존되는 것을 나타낸다. 구체적으로 A는 접합 마커인 VE-cadherin, claudin-5, occludin, 및 ZO-1에 대한 면역염색 결과를 나타내고, B는 접합 마커의 강도(intensity, %)를 정량한 결과를 나타낸다(n= 그룹 당 6-10 망막). 스케일 바는 100㎛를 나타낸다.
도 4는 Dll4 차단이 망막 동맥에서 내피 트랜스시토시스를 증가시키나 밀착 연접 불안정성을 강화시키는 것은 아닌 것을 나타낸다. A 및 B는 α-Dll4 Ab 또는 IgG(대조군)의 유리체내 주사 후에 동맥 및 소동맥(arteriole, 세동맥)에서 트랜스시토시스 마커인 PLVAP(A), Caveolin-1(B)와 밀착연접(TJ) 마커인 claudin-5(A)에 대한 면역염색 결과를 나타낸다. A는 동맥 V는 정맥을 나타낸다. C는 A 및 B의 면역염색 결과를 정량한 그래프를 나타낸다. D는 α-Dll4 Ab 처리 7일 후 망막 EC에서 증가된 소낭의 수(화살촉 모양) 및 온전한 TJ(화살표)를 나타내는 TEM 이미지이다. E는 EC-횡단면(cross-section) 당 소포(vesicle) 수를 정량화한 그래프를 나타낸다(그룹 당 n>100 섹션).
도 4의 A 및 B에서 스케일 바는 100㎛를 나타내고 D에서 스케일 바는 200nm를 나타낸다.
도 5는 Notch1을 차단하면 Dll4 차단에서 나타난 바와 같이, 혈관 누출을 표현형 모사하는 것을 나타내고, α-Notch1 Ab 및 IgG를 유리체내 주사하고 7일 차에 전체-마운트된 성인 망막에 대한 결과를 나타낸다.
구체적으로, 도 5의 A는 α-Notch1 Ab 또는 IgG를 유리체내 주사하고 전체 마운트된 성인 망막에서 혈관외유출된 에반스 블루(좌측 이미지), 4kD 덱스트란(중간 이미지) 및 10kD 덱스트란(우측 이미지)의 누출을 나타낸다. 도 5의 B는 A에 나타난 에반스블루의 누출량을 정량한 그래프를 나타내고(n = 그룹 당 10 망막), C는 A에 나타난 덱스트란(4kD: 상단 그래프, 10kD: 하단 그래프)의 누출량을 정량한 그래프를 나타낸다(n = 그룹 당 6 망막).
도 5의 D는 α-Notch1 Ab 또는 IgG를 유리체내 주사하고 전체 마운트된 성인망막에서 접합 마커인 VE-cadherin(좌측 이미지) 및 claudin-5(우측 이미지)에 대한 면역염색 결과를 나타내고, F는 VE-cadherin(상단 그래프) 및 claudin-5(하단 그래프) 강도(intensity, %)를 정량한 그래프를 나타낸다(n = 그룹당 6 망막).
도 5의 E는 α-Notch1 Ab 처리에 의해 망막 동맥에서 트랜스시토시스 마커인 PLVAP(좌측 이미지) 및 caveolin-1(우측 이미지)가 출현한 것을 나타내고, G는 PLVAP(상단 그래프) 및 caveolin-1(하단 그래프)의 강도를 정량한 그래프를 나타낸다(n = 그룹 당 6 망막). E에서 "A"는 동맥(artery)를 의미한다.
도 5의 H는 망막 혈관에서 α-Notch1 Ab 주사에 따른 NG2+ 주피세포(좌측 이미지) 및 α-SMA+ 평활근 세포(우측 이미지) 범위(coverage)를 나타내고, J는 NG2+ 주피세포(상단 그래프) 및 α-SMA+ 평활근 세포(하단 그래프) 범위(%)를 정량한 그래프를 나타낸다(n = 그룹 당 10 망막).
도 5의 I에서 좌측 이미지는 α-Notch1 Ab 주사에 따른 Ⅳ형 콜라겐(ColⅣ) 기저막(basement membrane)을 나타내고 우측 이미지는 덱스트란-관류 망막의 생체 내 이미지(intravital image)를 나타내며, K는 Ⅳ형 콜라겐 강도(%), 덱스트란-관류 망막 혈관의 뒤틀림 지수(tortuosity index), 및 전곡률(integrated curvature)를 나타낸다(n = 그룹 당 9 망막).
도 5의 A, E, H, 및 I에서 스케일 바는 100㎛를 나타내고 D에서 스케일 바는 25㎛를 나타낸다.
도 6은 EC-자율적 Dll4-Notch 1 상호작용이 트랜스시토시스 불활성을 담당하는 것을 나타낸다.
구체적으로, 도 6의 A는 성인 마우스에Dll4 및Notch1을 EC-특이적으로 결실시킨 모델에 대한 실험 모식도를 나타낸다. B는 대조군(Ctrl),Dll4i△EC(EC-특이적으로Dll4결실),Notch1i△EC(EC-특이적으로Notch1결실) 마우스의 망막혈관에서 NG+ 주피세포(상단 이미지) 및 α-SMA+ 평활근 세포(하단 이미지)에 대한 면역 염색 결과를 나타내고, C는 NG+ 주피세포(하단 그래프) 및 α-SMA+ 평활근 세포(상단 그래프) 범위(%)를 정량한 그래프를 나타낸다(n = 그룹 당 6 망막). B에서 스케일 바는 100㎛를 나타낸다.
도 6의 D는 EC에서 Dll4 및 Notch1 결실에 따른 에반스블루(EB)의 혈관외유출 결과를 나타낸다. D에서, 상단 이미지는 성인 대조군(Ctrl),Dll4i△EC,Notch1i△EC마우스의 망막 컵의 총 이미지를 나타내고 하단 이미지는 성인 대조군,Dll4i△EC,Notch1i△EC마우스의 전체-마운트된 망막의 PECAM 면역염색 결과를 나타낸다. D에서 스케일 바는 500㎛를 나타낸다.
도 6의 E는 성인 대조군,Dll4i△EC,Notch1i△EC마우스의 망막 혈관에서 PLVAP 및 caludin-5에 대한 면역 염색 결과를 나타낸다. E에서 스케일 바는 200㎛를 나타낸다.
도 6의 F는 성인 대조군,Dll4i△EC,Notch1i△EC마우스의 망막 EC에서 소낭(하얀색 화살촉 모양) 및 TJ(노란색 화살표)를 보여주는 TEM 이미지를 나타낸다. F에서 스케일 바는 100nm를 나타낸다.
G는 동맥주위(periarterial) 및 정맥주위(perivenous)의 EB 누출을 정량한 결과를 나타내고(상단 그래프; n = 그룹 당 10 망막), 동맥 및 정맥 PLVAP 강도를 정량한 결과(중간 그래프; n = 그룹 당 6 망막) 및 claudin -5 강도를 정량한 결과(하단 그래프; n = 그룹 당 6 망막)를 나타낸다.
H는 EC 횡단면 당 소낭 수를 정량한 결과(n = 그룹 당 20 망막)를 나타낸다.
도 7은 동맥 EC-특이적 Dll4 결실이 마우스 망막에서 풍부한 누출을 유도하는 것을 나타낸다.
구체적으로, 도 7의 A는 tdTomato 발현을 나타내는 Vecad(Cdh5)-CreERT2-tdTomato 마우스 및Slco1c1-CreERT2-tdTomato 마우스에서 PECAM-면역 염색된 망막을 나타내고, B는Cdh5-CreERT2 마우스 및Slco1c1-CreERT2 마우스의 망막에서 Dll4 면역염색 결과를 나타낸다. A에서 스케일 바는 500㎛를 나타내고 B에서 스케일 바는 200㎛를 나타낸다.
도 7의 C는 야생형 마우스(WT) 및 성인 Dll4i△RAEC(Slco1c1-CreERT2;Dll4fl/fl) 마우스의 전체 마운트된 망막에서 에반스블루(EB) 및 Claudin 5에 대한 면역염색 결과를 나타내고, D는 에반스블루의 누출 지역을 정량한 결과를 나타낸다(n = 그룹 당 6 망막). C에서 스케일 바는 200㎛를 나타낸다.
도 7의 E는 야생형 마우스(WT) 및 성인 Dll4i△RAEC 마우스에서 10kD 덱스트란 누출을 나타내고, F는 야생형 마우스(WT) 및 성인 Dll4i△RAEC 마우스에서 PLVAP에 대한 면역염색 결과를 나타내며, G는 10kD 덱스트란의 누출량을 정량한 결과를 나타내며(n = 그룹 당 6 망막), H는 동맥 PLVAP 강도를 정량한 결과를 나타낸다(n = 그룹 당 6 망막). E에서 스케일 바는 100㎛를 나타내고 F에서 스케일 바는 200㎛를 나타낸다.
도 8은 EC Dll4-Notch 신호전달이 선택적으로 세포횡단(trnscellular) 수송을 조절하는 것을 나타낸다.
구체적으로, 도 8의 A는 HUVEC에서 Notch 활성의 조절을 알아보기 위한 BSA 섭취 분석(BSA uptake assay) 및 TEER 평가를 진행하기 위한 실험의 모식도를 나타낸다.
도 8의 B는 HUVEC에서 α-Notch1 Ab 처리 및 Dll4 코팅에 따른 BSA 섭취를 나타내는 이미지이고, C는 6시간 동안 BSA 섭취를 정량한 결과이다. BSA 섭취 분석에서 VEGF는 양성 대조군으로 사용되었다. B에서 스케일 바는 10㎛를 나타낸다.
도 8의 D는 트랜스시토시스 억제제인 다이나솔(dynasore; Dyn) 또는 세포사이 수송(paracellular transport) 저해제인 아드레노메둘린(adrenomedullin; AM) 처리에 따른 BSA 섭취를 나타내는 이미지이다. D에서 스케일 바는 200㎛를 나타낸다.
도 8의 E는 α-Notch1 Ab 처리 및 Dll4 코팅 후 시간에 따른 상대적인 TEER 값을 나타내고, F는 α-Notch1 Ab 처리된 HUVEC에서 세포횡단 수송 또는 세포사이 수송의 억제 후의 시간에 따른 상대적인 TEER 값을 나타낸다.
도 8의 D에서 스케일 바는 20㎛를 나타내고, B에서 스케일 바는 10㎛를 나타낸다.
도 9는 Dll4-Notch 신호전달의 차단은 카베올라 소낭의 구성요소를 상향 조절하는 것을 나타낸다.
구체적으로, 도 9의 A는 α-Notch1 Ab 처리된 망막 EC에서 시간에 따른 PLVAP 단백질 수준을 나타낸다(n = 실험 당 3회). B는 Notch1 활성화(Dll4 코팅) 또는 Notch1 억제(α-Notch1 Ab 처리) 후의 카베올라 구조적 단백질에 대한 면역블롯 결과를 나타내고, C는 각 단백질의 수준 및 phospho/총 Caveolin-1 단백질 수준을 정량한 결과를 나타낸다(n= 실험 당 3회)
도 9의 D는 Notch1 활성화(Dll4 코팅) 또는 Notch1 억제(α-Notch1 Ab 처리)된 망막 EC에서 PLVAP의 면역염색 결과를 나타내고, E는 PLVAP 강도를 정량한 결과를 나타낸다(n = 실험 당 10). D에서 스케일 바는 25㎛를 나타낸다.
도 10은 Mfds2a 발현이 성인 마우스 망막에서 Dll4와 독립적인 것을 나타낸다. 구체적으로, 도 10의 A는 전체 마운트된 성인 망막에서 Mfsd2a 및 Dll4 면역염색 결과를 나타낸다. A는 동맥을 의미하고 V는 정맥을 의미한다. A에서 스케일 바는 200㎛를 나타낸다.
도 10의 B는 Mfsd2a 및 Dll4 발현이 각각 모세혈관 및 동맥/소동맥에 국한된 것을 나타낸다. B에서 스케일 바는 100㎛를 나타낸다.
도 10의 C는 IgG 및 α-Dll4 Ab 처리에 따른 Mfsd2a에 대한 면역염색결과를 나타내고 우측의 그래프는 동맥 또는 모세혈관에서 Mfsd2a 발현을 정량한 그래프를 나타낸다(n=그룹 당 4). C에서 스케일 바는 200㎛를 나타낸다.
도 11은 내피 Sox17 결실이 망막 동맥에서 Dll4를 하향 조절하여 증가된 트랜스시토시스를 유발하는 것을 나타낸다.
구체적으로, 도 11의 A는 타목시펜 처리 2주 후에 성인 대조군(Ctrl) 및Sox17i△EC 마우스의 전체 마운트된 망막의 Dll4에 대한 면역염색 결과를 나타낸다.
도 11의 B는 대조군 및Dll4i△EC 마우스의 성인 망막 동맥에서 Sox 17에 대한 면역 염색 결과를 나타낸다.
도 11의 C는 대조군 및Sox17i△EC 마우스의 동맥에서 에반스 블루 및 10kDa 덱스트란이 혈관외유출된 것을 나타낸다.
도 11의 D는 대조군 및Sox17i△EC 마우스의 망막에서 PLVAP 및 Claudin-5에 대한 면역염색 결과를 나타내고, E는 Caveolin-1에 대한 면역염색 결과를 나타낸다.
도 11의 F는 Sox-17이 결실된 망막 EC에서 소낭 수(화살촉) 및 온전한 TJ(화살표)를 나타내는 TEM 이미지이고, K는 EC 횡단면(cross-section) 당 소낭 수를 정량한 결과이다.
도 11의 G는 A의 Dll4에 대한 면역염색 결과를 정량한 결과이고, H는 B의 동맥 Sox17에 대한 면역염색 결과를 정량한 결과이고, I는 C의 혈관외유출된 추적자(EB 또는 덱스트란)의 양을 정량한 결과이며, J 는 D 및 E의 동맥 PLVAP, Claudin-5, Caveolin-1에 대한 면역염색 결과를 정량한 결과이다(n = 그룹 당 6 망막).
도 11의 L은 성인 대조군 및Sox17i△EC 마우스의 망막 용해물에서, Sox17, Dll4, PLVAP, 및 caveolin-1의 면역블롯 결과를 나타내고, M은 L의 면역블롯 결과를 정량한 결과를 나타낸다.
도 11의 D 및 E에서 스케일 바는 200㎛를 나타내고, A, B, 및 C에서 스케일 바는 100㎛를 나타내며 F에서 스케일 바는 200nm를 나타낸다.
도 12는 Notch 활성의 획득은 Sox-17-결실된 망막에서 BRB를 회복시키는 것을 나타낸다. 구체적으로 도 12의 A는 대조군(Ctrl),Sox17i△EC 마우스, 및Sox17-결실된 EC에서 Notch1 intracellular domain을 과발현시킨 형질전환 마우스(Sox17i△EC N1ICDiOE)의 망막 컵의 이미지를 나타낸다.
도 12의 B는 대조군,Sox17i△EC,Sox17i△ECN1ICDiOE 마우스의 성인 망막에서 동맥 PLVAP 및 혈관외유출된 EB에 대한 면역염색결과를 나타낸다.
도 12의 C는 동맥주변 EB 누출 및 동맥 PLVAP 강도를 정량한 결과를 나타낸다(n = 그룹 당 4 망막).
도 12의 A에서 스케일 바는 500㎛를 나타내고 B에서 스케일 바는 100㎛를 나타낸다.
도 13은 성인 망막 EC에서 Dll4 억제 및 분자 수송 사이의 연관성을 나타낼 수 있는 전사체 프로파일링의 결과를 나타낸다. RNA-시퀀싱을 통해 성인 망막 EC에서 전사체 프로파일링을 수행하였다.
구체적으로, 도 13의 A는 EC-특이적 리보솜(ribosome)-HA(hemagglutinin) tag된 성인 마우스에 IgG(Ctrl) 또는 α-Dll4 Ab를 유리체내 주사한 후의 망막으로부터 분리된 전사체에 대한 실험 개략도를 나타낸다.
도 13의 B는 전체-마운트된 망막에서 EC-특이적 HA 발현을 확인하는 면역염색 결과를 나타내고, 스케일 바는 100㎛를 나타낸다.
도 13의 C는 RNA-seq를 위한 샘플에서 인리치된 EC 전사체를 검증한 결과를 나타낸다.PECAM 및VECAD(Vascular endothelial-cadherin)는 EC 마커이고,Acta2는 VSMC(vascular smooth muscle cell) 마커이다.
도 13의 D는 IgG-(3개의 독립적인 샘플) 및 α-Dll4 Ab-(4개의 독립적인 샘플) 처리된 망막 EC에 대한 RNA-seq 데이터의 3차원 주성분 분석(principal component analysis) 결과를 나타낸다.
도 13의 E는 RNA-seq 데이터 세트의 계층적 클러스터링을 나타낸다.
도 13의 F 내지 H는 Dll4 차단과 분자적 수송 간의 연관성을 나타낸다, 구체적으로 F는 α-Dll4 Ab 처리된 망막 EC에서 차등적으로 발현된 유전자(differentially expressed genes; DEGs)에서 인리치된 상위 랭크 GO 용어(biological process)를 나타내고, G는 활성화 z-점수 및 P 값에 기초한 분자 수송에 대한 최상위-랭크된 기능적 주석을 나타내는 IPA를 나타낸다. P 값은 Fisher의 정확한 테스트에 의해 계산되었다. H는 α-Dll4 Ab 및 IgG 처리된 동맥 EC에서 카베올라 소낭의 구조적 구성요소가 상향조절된 것을 보여주는 RNA-seq 데이터를 나타낸다(n = 3 samples for IgG-treated retinal ECs; n = 4 samples for α-Dll4 Ab-treated retinal ECs).
도 13의 I는 정량적 RT-PCT에 의한 검증을 나타낸다(실험당 n=3).
도 13의 J는 IgG-처리된 망막 EC 대비 α-Dll4 Ab 처리된 망막 EC에서 "세포-세포 접합"과 연관된 유전자 세트의 인리치먼트가 유의미한 차이가 없는 것을 나타내는 GSEA 플롯이다. J에서 NES는 정규화된 인리치먼트 점수(normalized enrichment score)를 나타낸다.
도 14는 Sox17-Dll4 축이 SREBP1-매개된 카베올라 형성을 제한하여 망막 혈관 투과성을 제한하는 결과를 나타낸다.
구체적으로, 도 14의 A는 트랜스시토시스 과정의 개략도(좌측 이미지) 및 IgG 대비 α-Dll4 Ab로 처리된 망막 EC에서 GSEA 결과의 관련 도트 플롯(우측 이미지)을 나타낸다. FDR은 허위 발견율(false discovery rate)을 의미하고, NES는 정규화된 인리치먼트 점수를 나타낸다.
도 14의 B는 IPA 상위 분석(IPA upstream analysis)에 의해 예측된 α-Dll4 Ab 처리 후의 상위(top) 전사인자를 나타낸다. P값은 Fisher의 정확한 테스트에 의해 계산되었다.
도 14의 C는 α-Dll4 Ab 처리된 망막 EC에서 SREBP1 타겟 유전자(SREBP1_Q6 gene set in MSigDB)의 상향조절을 나타내는 히트맵이다.
도 14의 D는 카베올라(cavelolae; Cav) 형성에 호의적이거나 호의적이지 않은 지질 구성성분(lipid composition)과 연관된 GSEA 결과의 도트 플롯을 나타낸다. 도 14의 A 및 D에서 P 값은 색상 그래디언트로 표시되고 FDR 값은 원 크기로 표시되었다. GPLdms 글리세로인지질(glycerophospholipid); PC는 포스파티딜콜린(phosphatidylcholine); PG는 포스파티딜글리세롤(phosphatidylglycerol); PI는 포스파티딜이노시톨(phosphatidylinositol); PS는 포스파티딜세린(phosphatidylserine); PE는 포스파티딜에탄올아민(phosphatidylethanolamine)을 의미한다.
도 14의 E 내지 G는 Dll4 차단에 의해 유도된 망막성 누출에서 EGR1 및 SREBP1의 역할을 검증한 결과를 나타낸다. 구체적으로 E는 α-Dll4 Ab 또는 IgG 단일 유리체내 주사에 이어 미토마이신 A(MMA, EGR1 저해제) 및 파토스타틴(SREBP1 저해제)의 전신 주사의 실험 스케쥴을 나타내는 개략도이고, F는 성인 망막에서 α-Dll4 Ab, MMA, 및 파토스타틴의 주사에 따른 10kD 덱스트란 혈관외유출(혈관외누출) 및 PLVAP 에 대한 면역염색 결과이며 G는 덱스트란 누출양 및 동맥 PLVAP 강도를 정량한 결과를 나타낸다. F에서 스케일 바는 100㎛를 나타낸다.
도 15는 SREBP1이 Dll4 봉쇄(blockade)-유도된 transcytotic vesicle를 약화시키는 것을 나타낸다. 구체적으로 도 15의 a는 α-Dll4 Ab 및 파토스타틴 처리에 따른 망막 EC에서 온전한 TJ(화살표) 및 소낭 수(화살촉)의 변화를 나타내는 TEM 이미지이고, B는 EC 횡단면 당 소낭 수를 정량한 결과를 나타낸다. 스케일 바는 200nm를 나타낸다.
도 16은 망막 EC에서 고혈압과 Dll4 저해의 관련성을 시사하는 결과를 나타내는 전사체 프로파일링에 관한 것이다. 구체적으로 도 16의 A는 α-Dll4 Ab 처리된 망막 EC에서 C5 카테고리의 상위 7개의 인리치된 유전자 세트를 나타낸다. 적색으로 표시된 세 개의 유전자 세트는 동맥 혈압(BP)과 관련된 것을 나타낸다.
도 16의 B는 α-Dll4 Ab 처리된 망막 EC에서 변경된 상위 7개의 IPA-기반 표준 경로(canonical pathway)를 나타낸다. BP 상승에 endothelin-1 신호가 결정적이고, 적색 도트는 분석에서 전체 유전자 중 각 경로에서 발견된 유전자의 비율을 나타내며 청색 바는 Fisher의 테스트에 의한 P값을 의미한다. 점선은 유의성에 대한 임계값을 나타낸다(P = 0.05).
도 16의 C는 α-Dll4 Ab 처리된 망막에서 엔도텔린 경로(endothelin pathway)의 양성 인리치먼트를 보여주는 GSEA 플롯을 나타낸다.
도 16의 D는 표시된 BP-조절 유전자를 갖는 α-Dll4 Ab 처리된 망막 EC에서 DEG의 볼케이노 플롯(Volcano plot)을 나타낸다.
도 16의 E는 α-Dll4 Ab 처리된 망막에서 BP-상승 유전자(BP-elevating gene; 적색)의 상향조절 및 BP-저하 유전자(BP-lowering gene; 청색)의 하향조절을 나타내는 RNA-seq 데이터를 나타낸다.
도 17은 Dll4 억제, ECSox 17 결실, 및 고혈압 스트레스가 성인 망막 혈관에서 비출혈성 누출을 유발하는 것을 나타낸다.
도 17의 A 내지 F는 심각한 고혈압(HT)-유도된 BRB 파괴의 마우스 모델을 나타낸다. 구체적으로, A는 HT-유도된 망막 부종 모델을 제조하기 위한 실험의 개략도를 나타내고, B는 ATⅡ 처리 후에 시간에 따라 측정한 혈압을 나타내고, C는 α-Dll4 Ab 또는 IgG의 유리체내 주사 후에 시간에 따라 측정한 혈압을 나타낸다. ATⅡ는 안지오텐신 Ⅱ를 의미한다.
도 17의 D는 고혈압이 유도된 모델의 전체 마운트된 성인 망막에서 claudin-5에 대해 면역 염색한 결과를 나타낸다.
도 17의 E는 고혈압이 유도된 모델에서 혈관 밀도를 정량한 결과를 나타낸다.
도 17의 F는 풍부한 EB 누출을 나타내는 망막 컵에 대한 이미지를 나타낸다.
도 17의 G 내지 H는 ECSox17 결실, α-Dllb Ab 처리, 및 HT 에 의한 검출 불가능한 미세 출혈을 나타낸다. 구체적으로, G는 전체 마운트된 망막에서 ECSox17 결실, α-Dllb Ab 처리, α-PDGFRβ Ab 처리, 및 HT 에 따른 Ter119 면역 염색 결과를 나타낸다. 비정상적인 혈관 형태 및 심각한 출혈은 α-PDGFRβ Ab 처리(당뇨 망막병증을 모방)시에만 나타났다. H는 Ter119-양성 혈관외유출 출혈 지역에 대한 정량 결과를 나타낸다. I는 비-출혈성 및 출혈성 BRB 파괴를 비교한 도식이다. 도 17의 D 및 F에서 스케일 바는 500㎛를 나타내고, G는 100㎛를 나타낸다.
도 18은 고혈압 스트레스가 Sox17 및 Dll4를 하향조절하여 망막 동맥에서 트랜스시토시스-매개된 투과성을 유도하는 것을 나타낸다.
구체적으로, 도 18의 A 및 B는 정상혈압(normotension ; NT) 대비 안지오텐신 II-유도된 고혈압에 의해 망막 동맥에서 Sox17 및 Dll4 면역 염색 결과를 나타낸다. A에서 EGR은 EC 핵의 마커이고 하얀색 및 노란색 화살촉은 각각 Sox17 발현하는 EC 핵 및 Sox17을 발현하지 않는 EC 핵을 표시한다. B에서 삽입된 이미지는 PECAM 을 나타낸다. 도 18의 C는 망막 동맥에서 Sox 17/ERG 비를 나타낸다.
도 18의 D는 동맥 Dll4 발현과 동맥-주위 EB 누출사이의 역의 관계를 나타내는 산포도 및 선형회귀(linear regression)를 나타낸다. R은 피어슨 상관 계수를 나타낸다.
도 18의 E는 망막 EC에서 ATⅡ 및/또는 NAC 처리에 따른 ROS(reactive oxygen species) 및 Sox17 수준을 분석한 결과를 나타낸다. DCF-DA는 dichlorofluorescin diacetate를 의미한다.
도 18의 F는 망막 EC에서 ATⅡ 및/또는 NAC 처리에 따른 Sox17, Dll4, VEGFR2, SREBP1 precursor(SREBP1-P), 및 핵 형태(SREBP1-N)에 대한 면역블롯 결과를 나타낸다.
도 18의 H 내지 K는 EC Notch 활성의 획득에 의한 BRB 회복에 관한 결과를 나타낸다. 구체적으로, H는 NT 대조군, HT 대조군, 및 HTN1ICDiOE 마우스의 성인 망막에서 혈관외유출 EB(상단 이미지), PLVAP(중간 이미지), 및 claudin-5(하단 이미지)에 대한 면역 염색 결과를 나타내고, I는 동맥주위 EB 누출양, 동맥 PLVAP 강도, 및 동맥 Claudin-5 강도(%)를 정량한 결과를 나타낸다. J는 H는 NT 대조군, HT 대조군, 및 HTN1ICDiOE 마우스의 망막 EC에서 소낭(하얀색 화살촉) 및 TJ(노란색 화살표)를 나타내는 TEM 이미지이고, K는 EC 횡단면 당 소낭 수를 정량한 결과를 나타낸다.
도 18의 H의 상단 이미지에서 스케일 바는 500㎛를 나타내고, A, B, 및 H의 중간 및 하단 이미지에서 스케일 바는 100㎛를 나타내며, E에서 스케일 바는 25㎛를 나타내고, J에서 스케일 바는 200nm를 나타낸다.
도 19는 항산화제가 Sox17 및 Dll4 수준을 복원함으로써 고혈압 유발 망막 부종을 약화시키는 결과를 나타낸다.
도 19의 A는 PEG-빌리루빈(PEGBR)의 화학적 구조를 나타낸다.
도 19의 B는 안지오텐신 Ⅱ-유도된 고혈압 모델에서 PEGBR 처리를 위한 실험의 개략도를 나타낸다.
도 19의 C 내지 G는 NT, HT, 및 PEGBR-처리된 HT(HT PEGBR) 마우스의 전체 마운트된 망막에서 면역염색 결과를 나타낸다. C는 망막 동맥에서 Sox17(하단 이미지는 상단 이미지 중 박스로 표시된 부분을 확대한 것임), D는 망막 동맥에서 Dll4에 대한 면역 염색 결과를 나타낸다. E는 동맥 caveolin-1 및 F의 하단 이미지는 PLVAP 및 claudin-5에 대한 면역 염색 결과를 나타내고, F의 상단 이미지는 EB의 혈관외유출을 나타내고 G는 10kD 덱스트란의 혈관외유출을 나타낸다. H는 PEGBR 처리에 따른 감소된 표피 망막 부종을 나타내는 망막 OCT 이미지를 나타낸다. H에서 흰색 점선은 표면 혈관층을 나타내고 이중 화살표는 및 SVL의 thickening 과 불규칙한 반사(irregular reflection)를 나타낸다. I는 C 및 D의 Sox17 및 Dll4에 대한 면역염색 결과를 정량한 것이다. J는 H에서 SVL 두께를 정량한 결과를 나타낸다. K는 E의 동맥 PLVAP, Claudin-5, 및 caceolin-1에 대한 면역염색 결과를 정량한 것이고 L은 F 및 G에서 혈관외유출된 추적자(에반스블루 및 10kD 덱스트란)의 양을 정량한 결과이다.
도 19의 M 내지 O는 ATⅡ가 Sox17을 하향 조절하는 것을 나타낸다. 구체적으로, M은 ATⅡ 처리된 HUVEC에서 ROS 및 SOX17 수준을 나타낸다. H2O2가 대표적인 ROS 발생기로 사용되었다. N은 ATⅡ 및 H2O2처리된 HUVEC에서 Sox17에 대한 면역 블롯 결과를 나타낸다. O는 N의 Sox17에 대한 면역 블롯 결과(도 19의 N)를 정량한 것이다.
도 20은 장기간 항산화 치료가 고혈압-유도된 BRB 파괴를 개선하는 것을 나타낸다. 구체적으로, 도 20의 A는 고혈압(HT)-유도된 망막 부종 모델에서 장기간 NAC(N-acetylcysteine) 처리를 위한 실험의 개략도를 나타낸다. B는 NAC 처리로 EB 누출이 감소된 것을 나타내는 망막 컵의 이미지를 나타낸다. C는 전체-마운트된 성인 망막에서 PLVAP 및 claudin-5에 대한 면역염색 결과를 나타내고, D는 전체 마운트된 상인 망막에서 혈관외유출된 EB를 나타내며, E는 C 및 D의 면역염색결과를 정량한 결과를 나타낸다. C에서 스케일바는 200㎛을 나타내고 D에서 스케일 바는 100㎛을 나타낸다.
도 21은 SREBP1 억제가 ATⅡ 유도 망막 부종을 약화시키는 결과를 나타낸다. 도 21의 A는 안지오텐신 Ⅱ-유도된 망막 부종 모델에서 파토스타틴 처리를 위한 실험 개략도를 나타낸다. B는 NT, HT, 및 파토스타틴을 주사한 HT(HT + Fatostatin)의 전체-마운트된 망막에서 Claudin-5에 대한 면역 염색 결과 및 망막 컵의 전체 이미지를 나타낸다.
도 21의 C는 NT, HT, HT + Fatostatin에서 파토스타틴 처리에 의한 표피 망막 부종이 감소한 결과를 나타내는 망막 OCT 이미지를 나타낸다. 흰색 점선은 표피 혈관층(superficial vascular layers(SVL))을 나타내고 이중 화살표는 SVL의 두께 및 불규칙한 반사(irregular reflection)을 나타낸다.
도 21의 D는 NT, HT, HT + Fatostatin의 전체 마운트된 망막에서 PLVAP 및 claudin-5에 대한 면역염색 결과를 나타내고, E는 caveolin-1에 대한 면역염색 결과를 나타낸다.
도 21의 F는 B에서 나타난 동맥 주위 EB 누출양을 정량한 결과를 나타내고, G는 C에서 나타난 SVL 두께(㎛)를 정량한 결과를 나타내며, H는 D 및 E에서 동맥 PLVAP, Claudin-5, 및 caveolin-1을 정량한 결과를 나타낸다.
도 21의 B의 상단 이미지에서 스케일 바는 500㎛를 나타내고, B의 하단 이미지, D, 및 E에서 스케일 바는 200㎛를 나타낸다.
도 22는 망막에서 EC 증식 및 세포사멸이 동맥주위 누출에 관여하지 않는 것을 나타낸다.
구체적으로, 도 22의 A는 NT(정상 혈압 마우스) 및 HT(AT-Ⅱ 유도된 고혈압 마우스)의 전체 마운트된 망막에서 Ki67 및 절단된 caspase-3(Casp-3)에 대한 면역 염색 결과를 나타내고, B는 A의 결과를 정량한 그래프이다.
도 22의 C는 타목시펜이 처리되고 2주 후의 대조군(Ctrl) 및Sox17i△EC마우스의 전체-마운트된 망막에서 Ki67 및 절단된 caspase-3(Casp-3)에 대한 면역 염색 결과를 나타내고, D는 C의 결과를 정량한 그래프이다.
도 22의 E는 IgG 또는 α-Dll4 Ab가 유리체 내 주사되고 7일 후에 전체-마운트된 망막에서 Edu 및 절단된 caspase-3에 대한 면역염색 결과를 나타내고, F는 E의 결과를 정량한 그래프이다. 도 22의 각 도면에서 스케일 바는 100㎛를 나타낸다.
도 23은 Dll4 차단과 유사하게, 고혈압이 표면 누출을 유도하여 마우스 및 환자에서 망막 부종을 유발하는 것을 나타낸다.
구체적으로, 도 23의 A는 망막에서 층 조직 해부에 따른 혈관 구조의 개략도 및 이의 분류를 나타낸다. SVL(superficial vascular layer)은 신경절세포 복합체(ganglion cell complex(GCC); RNFL+GCL+IPL)에 혈액을 공급한다. DVL(deep vascular layer)은 INL(inner nuclear layer) 및 IPL(inner plexiform layer)에 혈액을 공급한다. GCL은 신경절 세포층(ganglion cell layer); OPL은 외망상층(outer plexiform layer); RNFL은 망막 신경 섬유층(retinal nerve fiber layer)을 각각 의미한다.
도 23의 B는 망막층 두께 분석의 개략도를 나타낸다. OCT(optical coherence tomography) 이미징 및 자동화된 층 분할(layer segmentation)에 뒤이어 자세한 두께분석이 수행된다.
도 23의 C 및 D는 고혈압 망막병증(hypertensive retinopathy(HR)) 환자에 대한 분석을 나타낸다. C는 HR 또는 당뇨 망막병증(diabetic retinopathy) 환자와 대조군의 혈관조영술(fluorescein angiography(FAG), 상단 이미지) 및 OCT 이미지(하단 이미지)를 나타낸다. HR에서 SVL 두께의 증가는 표층 부종을 나타낸다. C에서 내부 이미지는 확대된 이미지를 나타낸다. 검은색 화살촉은 동맥을 나타내고, 흰색 화살촉은 정맥을 나타내며 노란색 이중 화살표는 부종성 망막층(edematous retinal layer)을 나타낸다. D는 대조군과 HR 환자 사이에서 SVL 두께(좌측 그래프) 및 DVL 두께(우측 그래프)를 비교한 산포도를 나타낸다.
도 23의 E 및 F는 망막 OCT 소견의 비교를 나타낸다. E는 IgG 또는 α-Dll4 Ab로 처리된 마우스(상단이미지); NT 또는 HT 마우스(중간 이미지); 및 대조군 및 HR 환자(하단 이미지)의 망막 OCT 이미지를 나타낸다. 이중 화살표는 불규칙한 반사 및 SVL의 두께를 나타내고, 별표(asterisk)는 축적된 망막하액(accumulated subretinal fluid (SRF))을 나타내며 흰색 점선은 SVL을 나타낸다.
도 23의 F는 α-Dll4 Ab 처리된 마우스 또는 HT 마우스의 망막에서 SVL 두께(좌측 그래프) 및 DVL 두께(우측 그래프)를 나타낸다. E에서 스케일 바는 200㎛를 나타낸다.
도 24는 당뇨병 마우스 및 고혈압 마우스 사이에 성인 망막 혈관에서 Dll4 발현을 비교한 결과를 나타낸다. 구체적으로 도 24의 A는 ATⅡ-유도된 고혈압(HT) 마우스 및 당뇨병(db/db) 마우스의 전체-마운트된 망막에서 혈관 종류(동맥, 표면 모세혈관, 심층 모세혈관)에 따른 Dll4에 대한 면역염색 결과를 나타내고, B는 A의 결과를 정량한 그래프이다.
도 24의 C는 NT, HT, 및 당뇨병 마우스에서 에반스블루(EB)의 누출을 나타내는 망막의 횡단면 이미지이고, F는 SVL 및 DVL에서 EB 누출양을 정량한 그래프이다.
도 24의 D는 대조군 및 당뇨병 마우스에서 모세혈관 및 DVL에서 우세하게 관외로 흘러나온(extravasated) IgG를 나타낸다.
도 24의 E는 대조군 및 당뇨병 마우스에서 측정한 혈당 수준(blood glucose level)을 나타낸다. 도 24에서 스케일 바는 100㎛를 나타낸다.
도 25는 표면 혈관층 부종을 가진 HR 환자 서브세트는 SRF 축적과 유의한 상관관계가 있는 것을 나타낸다.
구체적으로 도 25의 A는 망막 층 두께에 따라 HR 환자를 분류한 결과를 나타낸다. HR 환자와 연령/성별이 매치된 인간 대조군에서 망막 SVL 및 DVL 두께의 산포도를 나타낸다. SVL만 두꺼워진 그룹 1(n = 8), SVL 및 DVL이 모두 두꺼워진 그룹 2(n = 6), 및 SVL과 DVL이 두꺼워지지 않은 그룹 3(n = 24)으로 분류되었다.
도 25의 B는 그룹 1 내지 3에서 측정된 SRF 높이(㎛)를 나타낸다.
도 25의 C는 HR 환자에서 SRF 높이와 SVL 두께 사이의 산포도(좌측 그래프) 및 SRF 높이와 DVL 두께 사이의 산포도(우측 그래프)를 나타낸다. 좌측 그래프는 HR 환자에서 SRF 높이와 SVL 두께 사이에 유의한 양의 상관관계를 나타내는 선형 회귀선이 있는 산포도를 나타낸다.
도 25의 D는 정상 혈압 마우스에 IgG 처리(NT w IgG) 또는 α-Dll4 Ab를 처리(NT w α-Dll4)하거나, 고혈압 마우스에 IgG를 처리(HT w IgG)한 후의 대표적인 망막 FAG(상단 이미지; 망막 누출을 검출하기 위함) 및 ICGA(indocyanine green angiography)(하단 이미지; 맥락막 누출을 검출하기 위함)를 나타낸다.
도 26은 VEGF-VEGFR2 경로의 차단이 EC 트랜스시토시스를 억제하여 Dll4 저해에 의해 유도된 망막 누출을 약화시키는 결과를 나타낸다
구체적으로 도 26의 A는 GSEA 플롯이 α-Dll4 Ab-처리된 망막 EC에서 VEGFR(vascular endothelial growth factor receptor) 신호전달 경로와 관련된 유전자 세트의 상향조절을 나타낸다.
도 26의 B는 정상 혈압 마우스에 IgG 처리(NT w IgG) 또는 α-Dll4 Ab를 처리(NT w α-Dll4)하거나, 고혈압 마우스에 IgG를 처리(HT w IgG)한 후의 동맥 EC에서 증가된 VEGFR2를 나타내는 크리오섹션된 성인 망막의 이미지를 나타낸다. 내부 이미지는 박스로 표시된 부분을 확대한 것이다. C는 B의 결과를 정량한 그래프이다
도 26의 D는 IgG 또는 α-Dll4를 처리하거나(상단 이미지) 정상혈압(NT) 마우스 또는 고혈압(HT) 마우스의 망막 용해물에서 VEGFR2의 면역블롯을 수행한 결과를 나타내고, E는 D의 결과를 정량한 그래프이다.
도 26의 F는 EC-특이적 리보솜-HA tag를 갖는 성인 마우스에 α-Dll4 Ab를 주사한 후 EC-인리치된 전사체에서 VEGF 수용체 및 Notch 하위(downstream) 유전자의 전사체 수준을 시간에 따라 분석한 결과를 나타낸다.
도 26의 G는 α-Dll4 Ab, α-VEGFR2 Ab, 및/또는 VEGF-trap(aflibercept) 처리에 따른 에반스블루 누출을 나타내고, H는 G의 결과를 정량한 그래프이다. VEGF 신호전달의 차단에 의해 Dll4 저해되어 유도된 EB 누출을 약화시킬 수 있다.
도 26의 I는 α-Dll4 Ab-처리된 망막 EC에서 증가된 트랜스시토시스 소낭(화살촉)의 수가 α-VEGFR2 Ab의 처리에 따라 감소한 것을 나타내는 TEM 이미지이고, J는 I의 결과를 정량한 그래프이다.
도 26의 K는 α-Dll4 Ab, 및/또는 VEGF-trap 처리에 따른 망막 PLVAP 및 claudin-5에 대한 면역염색 결과를 나타내고, L은 K의 결과를 정량한 그래프이다.
도 26의 G 및 K에서 스케일 바는 200㎛를 나타내고, B에서 스케일 바는 50㎛를 나타내며, I에서 스케일 바는 200nm를 나타낸다.
도 27은 VEGF가 트랜스시토시스 증가에 의해 망막 누출을 유도하는 것을 나타낸다.
구체적으로, 도 27의 A는 VEGF-처리된 망막에서 에반스블루의 혈관외유출 및 PLVAP의 발현에 대한 면역 염색 결과이고, B는 A의 결과를 정량한 그래프이다.
도 27의 C는 VEGF-처리된 망막에서 VE-cadherin 접합에 대한 면역염색 결과이고, D는 C의 결과를 정량한 그래프이다. A에서 스케일 바는 200㎛을 나타내고 C에서 스케일 바는 25㎛를 나타내었다.
도 28은 EC Notch 활성의 획득 및 VEGFR2 차단에 의한 고혈압-유발 망막 부종의 부가적인 억제를 나타낸다.
도 28의 A 내지 D는 IgG- 또는 α-VEGFR2 Ab-처리된 NT, HT, 및 HTN1ICDiOE마우스에 대한 결과를 나타낸다. A는 각 실험군의 망막에서 혈관외유출된 EB를 나타내고, B는 A의 결과를 정량한 그래프를 나타낸다. C는 각 그룹에 대한 망막 OCT 이미지를 나타내고, 흰색 및 적색 점선은 SVL 및 SRF(subretinal fluid)를 각각 나타낸다. D는 C에서 측정된 SVL 두께(㎛) 및 SRF 높이(㎛)를 나타낸다. A 및 C에서 스케일 바는 200㎛를 나타낸다.
도 29는 VEGF 신호전달을 통해 Dll4-Notch 신호전달의 차단이 SREBP1을 활성화시킬 수 있는 것을 나타낸다
도 29의 A 내지 F는 Dll4-Notch 신호전달의 억제가 망막 EC에서 SREBP1을 활성화시키는 것을 나타낸다. A는 유리체내 IgG- 또는 α-Dll4 Ab 주사된 마우스의 전체-마운트된 망막에서 SREBP1에 대한 면역 염색결과 및 SREBP1 강도를 정량한 그래프를 나타낸다. B는 유리체내 IgG- 또는 α-Dll4 Ab 주사된 마우스의 망막용해물에서 SREBP1에 대해 면역블롯을 수행한 결과 및 SREBP1 수준을 정량한 그래프이다. B에서 P 및 N은 각각 SREBP1의 전구체(125kD) 및 핵(성숙, 64kD) 형태를 나타낸다. C는 α-Notch1 Ab 처리 또는 Notch1 활성화(Dll4 코팅)된 망막 EC 배양에서 SREBP1에 대한 면역 염색결과 및 SREBP1 강도를 정량한 그래프를 나타낸다. D는 α-Notch1 Ab 처리 또는 Notch1 활성화(Dll4 코팅)된 망막 EC 배양에서 SREBP1에 대한 면역 블롯 결과(좌측 이미지) 및 SREBP1 수준(전구체(P) 및 핵(N) 형태)을 정량한 그래프(우측 그래프)이다.
도 29의 E 내지 I는 VEGF가 망막 EC에서 SREBP1을 활성화시키는 것을 나타낸다. E는 IgG 또는 VEGF를 유리체내 주사한 마우스의 전체-마운트된 망막에서 SREBP1에 대한 면역 염색 결과 및 EC SREBP1을 정량한 결과를 나타낸다. F는 IgG 또는 VEGF를 유리체내 주사한 마우스의 망막 용해물에서 SREBP1에 대한 면역블롯 결과 및 이를 정량한 그래프를 나타내다. VEGF 처리에 따라 SREBP1의 성숙한 형태가 증가되었다. G는 VEGF, α-Notch1 Ab, 및/또는 α-VEGFR2 Ab 처리된 망막 EC 배양에서 SREBP1에 대한 면역 염색 결과를 나타내고, H는 G의 결과에 따라 SREBP1 강도를 정량한 그래프를 나타낸다. I는 VEGF, α-Notch1 Ab, 및/또는 α-VEGFR2 Ab 처리된 망막 EC에서 SREBP1 국소화(localization)을 정량한 그래프를 나타낸다.
도 29의 A 및 E에서 스케일 바는 25㎛를 나타내고, C에서 스케일 바는 20㎛을 나타내고 G에서 스케일 바는 10㎛을 나타낸다.
도 30은 정상상태 및 고혈압 상태에서 동맥 장벽에 대한 Dll4 조절을 나타내는 개략도이다.
도 30의 A는 정상(Physiologic) 및 고혈압(Hypertension) 상태 하에서 트랜스시토시스의 조절을 요약한 개략도이다. B는 망막 EC에서 트랜스시토시스 조절에 근본적인 Sox17-Dll4-SREBP1 축을 나타내는 그림이다. C는 고혈압 및 Dll4 차단된 망막에서 공통적인 혈관 표현형을 나타내는 개략도이다. 증가된 트랜스시토시스를 통해 표피 동맥으로부터 비출혈성 누출이 발생한다. DVL은 심혈관층(deep vascular layer); SVL은 표피 혈관층(superficial vascular layer)을 나타낸다.
도 31은 정상상태 및 고혈압 상태에서 동맥 장벽에서 VEGFR2 및 Dll4에 의한트랜스시토시스 조절을 요약한 개략도이다.Each result value in each figure is expressed as mean±SD, ** means P<0.01, * means P<0.05, and NS means not significant. A is an artery, V is a vein, C is a capillary, and D is a deep vessel. PECAM and VECAD (Vascular endothelial-cadherin) are EC markers.
1 shows morphological, structural, and junctional changes in adult retinal blood vessels following Dll4 blockade.
Specifically in FIG. 1, A shows the results of immunostaining of Dll4 in the retina at the 5th day after birth (P5) and adult (70 days after birth; P70), and B in FIG. 1 is the result of quantifying the Dll4 intensity ( The average value according to the six experimental results for each group) is shown. 1A and B, A is an artery, V is a vein, C is a capillary, and D is a deep vessel.
1C to 1J show the result of intravitreal injection of α-Dll4 Ab into adult mice, and there was no significant morphological change in
1K shows the immunoblot results of PLVAP and caveolin-1 (Cav-1) in retinal lysates of the IgG administration group or the α-Dll4 administration group and a graph (lower graph) quantifying them (n=3 per group).
In A and C of FIG. 1 , the scale bar indicates 500 μm, and in D, G, and I, the scale bar indicates 100 μm.
Figure 2 shows that Dll4 blockade induces abundant and reversible peri-arterial leakage in the adult mouse retina.
Specifically, FIG. 2A shows a schematic diagram of transient and local inhibition of retinal Dll4 by intravitreal injection of anti-Dll4 (α-Dll4 Ab) or control (IgG) antibody in adult mice.
2B shows a schematic diagram of the retina with layered tissue and vascular organs. DVP is the deep vascular plexus, GCL is the ganglion cell layer, INL is the inner nuclear layer, RNFL is the retinal nerve fiber layer, and SVP is the superficial vascular plexus. plexus).
Figure 2C shows the PECAM-immunostaining of the whole-mounted retina and the overall image of the retinal cup showing leakage of tracers in the superficial vascular layer. Arrows indicate extravasated 10 kD dextran.
Fig. 2D shows a graph quantifying leakage, Fig. 2E shows images of the whole-mounted retina according to the number of days after α-Dll4 Ab treatment, and Fig. 2F shows periarterial and venous A graph quantifying EB leakage in the perivenous is shown. In FIG. 2E, A represents an artery. In FIG. 2 , a yellow scale bar in C and a white scale bar in E indicate 500 μm, and a white scale bar in C indicates 100 μm.
Figure 3 shows that endothelial junctions in adult retinal vessels are preserved even after Dll4 blockade. Specifically, A shows the results of immunostaining for the splicing markers VE-cadherin, claudin-5, occludin, and ZO-1, and B shows the result of quantifying the intensity (intensity, %) of the splicing marker (n = group). per 6-10 retinas). The scale bar represents 100 μm.
Figure 4 shows that Dll4 blockade increases endothelial transcytosis in retinal arteries but does not enhance tight junctional instability. A and B are transcytosis markers PLVAP (A), Caveolin-1 (B) and tight junction (TJ) markers in arteries and arterioles (arterioles) after intravitreal injection of α-Dll4 Ab or IgG (control). The results of immunostaining for phosphorus claudin-5 (A) are shown. A represents the artery and V represents the vein. C shows a graph quantifying the immunostaining results of A and B. D is a TEM image showing the increased number of exosomes (arrowhead shape) and intact TJ (arrow) in
4A and B, the scale bar represents 100 μm, and the scale bar in D represents 200 nm.
Figure 5 shows that blocking Notch1 phenotypes mimics vascular leakage, as shown in Dll4 blockade, and shows the results for whole-mounted adult retinas at 7 days after intravitreal injection of α-Notch1 Ab and IgG.
Specifically, FIG. 5A shows Evans blue (left image), 4kD dextran (middle image) and 10kD dextran (right image) that were extravasated from whole-mounted adult retinas after intravitreal injection of α-Notch1 Ab or IgG. ) indicates leakage. B of FIG. 5 shows a graph quantifying the leakage amount of Evans blue shown in A (n = 10 retinas per group), and C is dextran (4kD: top graph, 10kD: bottom graph) shown in A quantifying the leakage amount Graphs are shown (n = 6 retinas per group).
5D shows the results of immunostaining for junction markers VE-cadherin (left image) and claudin-5 (right image) in whole-mounted adult retinas after intravitreal injection of α-Notch1 Ab or IgG, F is VE-cadherin (upper graph) and claudin-5 (lower graph) are shown graphs quantifying intensity (intensity, %) (n = 6 retinas per group).
Figure 5E shows the appearance of transcytosis markers PLVAP (left image) and caveolin-1 (right image) in retinal arteries by α-Notch1 Ab treatment, G is PLVAP (upper graph) and caveolin-1 A graph quantifying the intensity of (lower graph) is shown (n = 6 retinas per group). "A" in E means arteries.
5H shows the coverage of NG2+ epithelial cells (left image) and α-SMA+ smooth muscle cells (right image) following injection of α-Notch1 Ab in retinal blood vessels, and J shows NG2+ epithelial cells (top graph) and α -SMA+ smooth muscle cells (bottom graph) shows a graph quantifying coverage (%) (n = 10 retinas per group).
In Fig. 5 I, the left image shows the type IV collagen (ColIV) basement membrane following α-Notch1 Ab injection, and the right image shows an intravital image of the dextran-perfused retina, K is the IV Type collagen intensity (%), tortuosity index of dextran-perfused retinal vessels, and integrated curvature are shown (n = 9 retinas per group).
In A, E, H, and I of FIG. 5, the scale bar represents 100 μm, and in D, the scale bar represents 25 μm.
6 shows that the EC-autonomous Dll4-
Specifically, FIG. 6A shows an experimental schematic diagram for a model in whichDll4 andNotch1 are EC-specifically deleted in adult mice. B is NG+ epithelial cells (top image) and α-SMA+ in retinal blood vessels of control (Ctrl),Dll4 iΔEC( EC-specificallyDll4 deletion),Notch1iΔEC (EC-specificallyNotch1 deletion) mice. Shows the immunostaining results for smooth muscle cells (lower image), and C shows a graph quantifying the range (%) of NG+ epithelial cells (lower graph) and α-SMA+ smooth muscle cells (upper graph) (n = 6 retinas per group) ). The scale bar in B represents 100 μm.
6D shows the extravasation result of Evans blue (EB) according to the deletion of Dll4 and Notch1 in EC. In D, the top image shows total images of retinal cups of adult control (Ctrl),Dll4 iΔEC,Notch1iΔECmice and the bottom image is whole-mount of adult control,Dll4 iΔEC,Notch1iΔECmice . The results of PECAM immunostaining of the retinal retinas are shown. The scale bar in D represents 500 μm.
Figure 6E is adult control,Dll4 iΔEC,Notch1iΔECThe results of immunostaining for PLVAP and caludin-5 in mouse retinal blood vessels are shown. The scale bar in E represents 200 μm.
6F is an adult control group,Dll4 iΔEC,Notch1iΔECTEM images are shown showing vesicles (white arrowheads) and TJs (yellow arrows) in retinal ECs of mice. Scale bar in F represents 100 nm.
G shows the results of quantifying EB leakage in periarterial and perivenous (top graph; n = 10 retinas per group), and quantification of arterial and venous PLVAP intensities (middle graph; n = group).
H represents the result of quantifying the number of vesicles per EC cross-section (n = 20 retinas per group).
7 shows that arterial EC-specific Dll4 deletion induces abundant leakage in the mouse retina.
Specifically, FIG. 7A shows PECAM-immunostained retinas in Vecad(Cdh5 )-CreERT2 -tdTomato mice andSlco1c1 -CreERT2 -tdTomato mice showing tdTomato expression, B showsCdh5 -CreERT2 mice andSlco1c1- The results of Dll4 immunostaining in the retina of CreERT2 mice are shown. In A, the scale bar represents 500 μm, and in B, the scale bar represents 200 μm.
7C shows the immunostaining results for Evans blue (EB) and
Fig. 7E shows 10kD dextran leakage in wild-type mice (WT) and adultDll4iΔRAEC mice, F shows immunostaining results for PLVAP in wild-type mice (WT) and adultDll4 iΔRAECmice , G denotes the result of quantifying the leakage of 10 kD dextran (n = 6 retinas per group), and H denotes the quantification of the arterial PLVAP intensity (n = 6 retinas per group). In E, the scale bar represents 100 μm and in F, the scale bar represents 200 μm.
Figure 8 shows that EC Dll4-Notch signaling selectively modulates trnscellular transport.
Specifically, FIG. 8A shows a schematic diagram of an experiment for performing a BSA uptake assay and TEER evaluation to determine the regulation of Notch activity in HUVECs.
FIG. 8B is an image showing BSA uptake according to α-Notch1 Ab treatment and Dll4 coating in HUVEC, and C is a result of quantifying BSA uptake for 6 hours. In the BSA uptake assay, VEGF was used as a positive control. In B, the scale bar represents 10 μm.
FIG. 8D is an image showing BSA intake following treatment with a transcytosis inhibitor dynasore (Dyn) or a paracellular transport inhibitor adrenomedullin (AM) treatment. The scale bar in D represents 200 μm.
E of FIG. 8 shows the relative TEER values with time after α-Notch1 Ab treatment and Dll4 coating, and F shows the relative TEER values with time after inhibition of transcellular or intercellular transport in α-Notch1 Ab-treated HUVECs indicates.
In FIG. 8D, the scale bar indicates 20 μm, and in B, the scale bar indicates 10 μm.
9 shows that blockade of Dll4-Notch signaling up-regulates components of caveola vesicles.
Specifically, Fig. 9A shows the PLVAP protein level over time in α-Notch1 Ab-treated retinal ECs (n = 3 times per experiment). B shows the immunoblot results for caveola structural proteins after Notch1 activation (Dll4 coating) or Notch1 inhibition (α-Notch1 Ab treatment), and C shows the quantification of the levels of each protein and phospho/total Caveolin-1 protein levels. represents (n = 3 times per experiment)
9D shows the results of immunostaining of PLVAP in retinal ECs with Notch1 activation (Dll4 coating) or Notch1 inhibition (α-Notch1 Ab treatment), and E shows the results of quantifying PLVAP intensity (n = 10 per experiment). . The scale bar in D represents 25 μm.
10 shows that Mfds2a expression is independent of Dll4 in the adult mouse retina. Specifically, FIG. 10A shows the results of Mfsd2a and Dll4 immunostaining in whole-mounted adult retinas. A stands for artery and V stands for vein. The scale bar in A represents 200 μm.
FIG. 10B shows that Mfsd2a and Dll4 expression were localized to capillaries and arteries/arterioles, respectively. The scale bar in B represents 100 μm.
10C shows the immunostaining results for Mfsd2a following treatment with IgG and α-Dll4 Ab, and the graph on the right shows a graph quantifying Mfsd2a expression in arteries or capillaries (n=4 per group). The scale bar in C represents 200 μm.
11 shows that endothelial Sox17 deletion leads to increased transcytosis by downregulating Dll4 in retinal arteries.
Specifically, FIG. 11A shows the immunostaining results for Dll4 of whole-mounted retinas of adult control (Ctrl) andSox17 iΔECmice after 2 weeks of tamoxifen treatment.
11B shows the results of immunostaining for
11C shows the extravasation of Evans blue and 10 kDa dextran in the arteries of control andSox17 iΔECmice .
11D shows the results of immunostaining for PLVAP and Claudin-5 in the retinas of control andSox17 iΔECmice , and E shows the results of immunostaining for Caveolin-1.
11F is a TEM image showing the number of vesicles (arrowhead) and intact TJ (arrow) in Sox-17-deleted retinal EC, and K is the result of quantifying the number of vesicles per EC cross-section.
11G is the result of quantifying the immunostaining result for Dll4 of A, H is the quantification result of immunostaining for the arterial Sox17 of B, I is the extravascularized tracer of C (EB or dextran) ), and J is the result of quantifying the immunostaining results for arterial PLVAP, Claudin-5, and Caveolin-1 in D and E (n = 6 retinas per group).
11 L shows the immunoblot results of Sox17, Dll4, PLVAP, and caveolin-1 in retinal lysates of adult control andSox17 iΔECmice , and M shows the results of quantifying the immunoblot results of L.
In D and E of FIG. 11 , scale bars indicate 200 μm, in A, B, and C, scale bars indicate 100 μm, and in F, scale bars indicate 200 nm.
12 shows that acquisition of Notch activity restores BRB in Sox-17-deleted retinas. Specifically, FIG. 12A shows images of retinal cups of a control (Ctrl),Sox17 iΔECmouse , and a transgenic mouse (Sox17iΔECN1ICDiOE ) overexpressing the Notch1 intracellular domain inSox17 -deleted EC.
12B shows the immunostaining results for arterial PLVAP and extravasated EB in adult retinas of control,Sox17 iΔEC,Sox17iΔECN1ICDiOE mice.
12C shows the results of quantification of peri-arterial EB leakage and arterial PLVAP intensity (n = 4 retinas per group).
A scale bar in FIG. 12A indicates 500 μm and a scale bar in B indicates 100 μm.
13 presents the results of transcriptome profiling that may reveal an association between Dll4 inhibition and molecular transport in adult retinal ECs. Transcript profiling was performed in adult retinal ECs via RNA-sequencing.
Specifically, FIG. 13A shows an experiment on transcripts isolated from the retina after intravitreal injection of IgG (Ctrl) or α-Dll4 Ab into EC-specific ribosome-HA (hemagglutinin) tagged adult mice. A schematic diagram is shown.
13B shows the results of immunostaining confirming EC-specific HA expression in the whole-mounted retina, and the scale bar represents 100 μm.
13C shows the results of verifying the EC transcripts enriched in the sample for RNA-seq.PECAM and vascular endothelial-cadherin (VECAD ) are EC markers, andActa2 is a vascular smooth muscle cell (VSMC) marker.
13D shows the results of three-dimensional principal component analysis of RNA-seq data for retinal ECs treated with IgG- (3 independent samples) and α-Dll4 Ab- (4 independent samples). .
13E shows the hierarchical clustering of the RNA-seq data set.
13F to H show the association between Dll4 blockade and molecular transport. Specifically, F is the upper rank enriched in differentially expressed genes (DEGs) in α-Dll4 Ab-treated retinal ECs. GO represents the biological process, G represents the IPA, which represents the top-ranked functional annotation for molecular transport based on activation z-scores and P values. P values were calculated by Fisher's exact test. H represents RNA-seq data showing upregulation of structural components of caveola vesicles in arterial ECs treated with α-Dll4 Ab and IgG (n = 3 samples for IgG-treated retinal ECs; n = 4 samples for α -Dll4 Ab-treated retinal ECs).
13I shows validation by quantitative RT-PCT (n=3 per experiment).
13J is a GSEA plot showing that there is no significant difference in the enrichment of the gene set associated with "cell-cell junction" in α-Dll4 Ab treated retinal ECs versus IgG-treated retinal ECs. In J, NES stands for normalized enrichment score.
14 shows the results of the Sox17-Dll4 axis limiting SREBP1-mediated caveola formation, thereby limiting retinal vascular permeability.
Specifically, FIG. 14A shows a schematic of the transcytosis process (left image) and a related dot plot (right image) of GSEA results in retinal ECs treated with α-Dll4 Ab versus IgG. FDR denotes a false discovery rate, and NES denotes a normalized enrichment score.
14B shows the top transcription factors after α-Dll4 Ab treatment predicted by IPA upstream analysis. P values were calculated by Fisher's exact test.
14C is a heat map showing the upregulation of the SREBP1 target gene (SREBP1_Q6 gene set in MSigDB) in retinal ECs treated with α-Dll4 Ab.
14D shows a dot plot of GSEA results associated with lipid composition favorable or unfavorable to caveolae (Cav) formation. In A and D of FIG. 14 , P values are indicated by color gradients and FDR values are indicated by circle sizes. GPLdms glycerophospholipid; PC is phosphatidylcholine; PG is phosphatidylglycerol; PI is phosphatidylinositol; PS is phosphatidylserine; PE stands for phosphatidylethanolamine.
14E to 14G show the results of verifying the roles of EGR1 and SREBP1 in retinal leakage induced by Dll4 blockade. Specifically, E is a schematic diagram showing the experimental schedule of single intravitreal injection of α-Dll4 Ab or IgG followed by systemic injection of mitomycin A (MMA, EGR1 inhibitor) and phatostatin (SREBP1 inhibitor), F is α- in the adult retina Immunostaining results for 10 kD dextran extravasation (extravascular leakage) and PLVAP following injections of Dll4 Ab, MMA, and patostatin, and G indicates the results of quantifying the amount of dextran leakage and arterial PLVAP intensity. The scale bar in F represents 100 μm.
15 shows that SREBP1 attenuates Dll4 blockade-induced transcytotic vesicles. Specifically, Fig. 15a is a TEM image showing the change in intact TJ (arrow) and the number of vesicles (arrowhead) in retinal EC according to treatment with α-Dll4 Ab and patostatin, B is the result of quantifying the number of vesicles per EC cross-section indicates Scale bar represents 200 nm.
16 relates to transcriptome profiling showing results suggesting the association between hypertension and Dll4 inhibition in retinal EC. Specifically, FIG. 16A shows the top 7 enriched gene sets of C5 category in α-Dll4 Ab-treated retinal ECs. The three gene sets shown in red are associated with arterial blood pressure (BP).
Figure 16B shows the top 7 IPA-based canonical pathways altered in α-Dll4 Ab-treated retinal ECs. The endothelin-1 signal is crucial for BP elevation, the red dots indicate the proportion of genes found in each pathway among the total genes in the analysis, and the blue bars indicate the P value by Fisher's test. The dotted line represents the threshold for significance (P = 0.05).
FIG. 16C shows a GSEA plot showing positive enrichment of the endothelin pathway in the retina treated with α-Dll4 Ab.
FIG. 16D shows a Volcano plot of DEG in retinal ECs treated with α-Dll4 Ab with the indicated BP-regulated genes.
16E is RNA-seq data showing upregulation of BP-elevating gene (red) and downregulation of BP-lowering gene (blue) in α-Dll4 Ab-treated retina indicates
Figure 17 shows that Dll4 inhibition,
17A-F show a mouse model of severe hypertension (HT)-induced BRB destruction. Specifically, A shows the schematic diagram of the experiment for preparing the HT-induced retinal edema model, B shows the blood pressure measured with time after ATII treatment, and C shows the time after intravitreal injection of α-Dll4 Ab or IgG. blood pressure measured according to ATII means angiotensin II.
FIG. 17D shows the results of immunostaining for claudin-5 in whole-mounted adult retinas of a hypertensive induced model.
17E shows the results of quantifying the blood vessel density in the hypertension-induced model.
17F shows images of retinal cups showing abundant EB leakage.
17G-H show undetectable microbleeding by ECSox17 deletion, α-Dllb Ab treatment, and HT. Specifically, G shows the results of Ter119 immunostaining according to ECSox17 deletion, α-Dllb Ab treatment, α-PDGFRβ Ab treatment, and HT in whole-mounted retinas. Abnormal vascular morphology and severe bleeding were seen only upon α-PDGFRβ Ab treatment (mimicking diabetic retinopathy). H represents quantitative results for Ter119-positive extravasated hemorrhage regions. I is a schematic comparing non-hemorrhagic and hemorrhagic BRB destruction. In D and F of FIG. 17 , the scale bar indicates 500 μm, and G indicates 100 μm.
18 shows that hypertensive stress downregulates Sox17 and Dll4, leading to transcytosis-mediated permeability in retinal arteries.
Specifically, FIGS. 18A and 18B show the results of Sox17 and Dll4 immunostaining in retinal arteries by angiotensin II-induced hypertension versus normotension (NT). In A, EGR is a marker of EC nuclei and white and yellow arrowheads indicate Sox17-expressing and EC nuclei expressing Sox17, respectively. The image inserted in B represents PECAM. 18C shows the
Fig. 18D shows a scatter plot and linear regression showing the inverse relationship between arterial Dll4 expression and peri-arterial EB leakage. R represents the Pearson correlation coefficient.
18E shows the results of analyzing ROS (reactive oxygen species) and Sox17 levels according to ATII and/or NAC treatment in retinal EC. DCF-DA stands for dichlorofluorescin diacetate.
18F shows immunoblot results for Sox17, Dll4, VEGFR2, SREBP1 precursor (SREBP1-P), and nuclear morphology (SREBP1-N) according to ATII and/or NAC treatment in retinal EC.
18H to K show the results of BRB recovery by the acquisition of EC Notch activity. Specifically, H denotes the results of immunostaining for extravasated EB (top image), PLVAP (middle image), and claudin-5 (bottom image) in adult retinas of NT control, HT control, and HTN1ICDiOE mice. , I indicate the results of quantification of the amount of periarterial EB leakage, arterial PLVAP intensity, and arterial Claudin-5 intensity (%). J is a TEM image showing vesicles (white arrowhead) and TJ (yellow arrow) in retinal ECs of NT control, HT control, and HTN1ICDiOE mice, and K is the result of quantifying the number of vesicles per EC cross-section.
In the upper image of FIG. 18H, the scale bar indicates 500 μm, in the middle and bottom images of A, B, and H, the scale bar indicates 100 μm, in E the scale bar indicates 25 μm, and in J the scale bar represents 200 nm.
19 shows the results of antioxidants attenuating hypertension-induced retinal edema by restoring Sox17 and Dll4 levels.
19A shows the chemical structure of PEG-bilirubin (PEGBR).
19B shows a schematic diagram of an experiment for PEGBR treatment in an angiotensin II-induced hypertension model.
19C to 19G show immunostaining results in whole-mounted retinas of NT, HT, and PEGBR-treated HT (HT PEGBR) mice. C shows the results of immunostaining for Sox17 in the retinal artery (lower image is an enlarged boxed portion of the upper image), and D shows the results of immunostaining for Dll4 in retinal arteries. E, lower image of arterial caveolin-1 and F shows immunostaining results for PLVAP and claudin-5, upper image of F shows extravasation of EB and G shows extravasation of 10 kD dextran. H represents retinal OCT images showing reduced epidermal retinal edema following PEGBR treatment. In H, the white dotted line indicates the superficial blood vessel layer, and the double arrow indicates the thickening and irregular reflection of SVL and SVL. I is the quantification of the immunostaining results for Sox17 and Dll4 in C and D. J shows the result of quantifying SVL thickness in H. K is the quantification of the immunostaining results for arterial PLVAP, Claudin-5, and caceolin-1 in E, and L is the quantification of the amount of extravasated tracers (Evans blue and 10 kD dextran) in F and G. .
19M to O indicate that ATII down-regulates Sox17. Specifically, M represents ROS and SOX17 levels in ATII-treated HUVECs. H2 O2 was used as a representative ROS generator. N represents the immunoblot results for Sox17 in ATII and H2 O2 treated HUVECs. O is a quantification of the immunoblot result (N in FIG. 19) of N against Sox17.
20 shows that long-term antioxidant treatment ameliorates hypertension-induced BRB destruction. Specifically, FIG. 20A shows a schematic diagram of an experiment for long-term NAC (N-acetylcysteine) treatment in a hypertensive (HT)-induced retinal edema model. B shows images of retinal cups showing that NAC treatment reduced EB leakage. C shows the immunostaining results for PLVAP and claudin-5 in whole-mounted adult retinas, D shows extravasated EBs in whole-mounted adult retinas, and E shows the immunostaining results of C and D quantified. shows the results. In C, the scale bar represents 200 μm, and in D, the scale bar represents 100 μm.
21 shows the results of SREBP1 inhibition attenuating ATII-induced retinal edema. 21A shows an experimental schematic for patostatin treatment in angiotensin II-induced retinal edema model. B shows the results of immunostaining for Claudin-5 and whole images of retinal cups in whole-mounted retinas of NT, HT, and HT (HT + Fatostatin) injected with patostatin.
21C shows retinal OCT images showing the result of reducing epidermal retinal edema by patostatin treatment in NT, HT, HT + Fatostatin. The white dotted line indicates the superficial vascular layers (SVL) and the double arrow indicates the thickness and irregular reflection of the SVL.
21D shows the results of immunostaining for PLVAP and claudin-5 in the NT, HT, HT + Fatostatin whole-mounted retina, and E shows the immunostaining results for caveolin-1.
21 F shows the results of quantifying the amount of periarterial EB leakage shown in B, G shows the quantification result of SVL thickness (㎛) shown in C, H shows the arterial PLVAP, Claudin-5, and caveolin-1 quantification results.
In the upper image of FIG. 21B , the scale bar indicates 500 μm, and in the lower image of B, D, and E, the scale bar indicates 200 μm.
22 shows that EC proliferation and apoptosis are not involved in periarterial leakage in the retina.
Specifically, FIG. 22A shows the immunostaining results for Ki67 and cleaved caspase-3 (Casp-3) in whole-mounted retinas of NT (normal blood pressure mice) and HT (AT-II induced hypertensive mice). , B is a graph quantifying the results of A.
22C shows the immunostaining results for Ki67 and cleaved caspase-3 (Casp-3) in whole-mounted retinas of control (Ctrl) and
22E shows the immunostaining results for Edu and cleaved caspase-3 in whole-mounted
23 shows that hypertension induces surface leakage, resulting in retinal edema in mice and patients, similar to Dll4 blockade.
Specifically, Fig. 23A shows a schematic diagram of the vasculature according to layer tissue dissection in the retina and its classification. The superficial vascular layer (SVL) supplies blood to the ganglion cell complex (GCC); RNFL+GCL+IPL. The deep vascular layer (DVL) supplies blood to the inner nuclear layer (INL) and the inner plexiform layer (IPL). GCL is a ganglion cell layer (ganglion cell layer); OPL is an outer plexiform layer; RNFL stands for retinal nerve fiber layer, respectively.
23B shows a schematic diagram of retinal layer thickness analysis. Detailed thickness analysis is performed following optical coherence tomography (OCT) imaging and automated layer segmentation.
23C and D show the analysis of hypertensive retinopathy (HR) patients. C shows angiography (fluorescein angiography (FAG), upper image) and OCT images (lower image) of HR or diabetic retinopathy patients and controls. An increase in SVL thickness in HR indicates superficial edema. In C, the inner image represents the enlarged image. Black arrowheads indicate arteries, white arrowheads indicate veins, and yellow double arrows indicate edematous retinal layer. D shows the scatter plot comparing SVL thickness (left graph) and DVL thickness (right graph) between control and HR patients.
23E and F show comparison of retinal OCT findings. E is mice treated with IgG or α-Dll4 Ab (top image); NT or HT mice (middle image); and retinal OCT images of control and HR patients (lower image). Double arrows indicate irregular reflex and thickness of SVL, asterisk indicates accumulated subretinal fluid (SRF), and dotted white line indicates SVL.
23F shows SVL thickness (left graph) and DVL thickness (right graph) in retinas of α-Dll4 Ab-treated mice or HT mice. The scale bar in E represents 200 μm.
24 shows the results of comparing Dll4 expression in adult retinal blood vessels between diabetic mice and hypertensive mice. Specifically, FIG. 24A shows immunity to Dll4 according to blood vessel types (arteries, superficial capillaries, deep capillaries) in whole-mounted retinas of ATII-induced hypertensive (HT) mice and diabetic (db/db) mice. The staining result is shown, and B is a graph quantifying the result of A.
24C is a cross-sectional image of the retina showing Evans blue (EB) leakage in NT, HT, and diabetic mice, and F is a graph quantifying the amount of EB leakage in SVL and DVL.
Figure 24D shows the predominantly extravasated IgG from capillaries and DVL in control and diabetic mice.
24E shows blood glucose levels measured in control and diabetic mice. In FIG. 24, the scale bar represents 100 μm.
25 shows that a subset of HR patients with superficial angiolayer edema significantly correlated with SRF accumulation.
Specifically, FIG. 25A shows the results of classifying HR patients according to the thickness of the retinal layer. Scatter plots of retinal SVL and DVL thickness in HR patients and age/sex matched human controls are shown. Group 1 (n = 8) thickened only in SVL, group 2 (n = 6) in which both SVL and DVL were thickened, and group 3 (n = 24) in which SVL and DVL were not thickened.
25B shows the SRF heights (μm) measured in
25C shows the scatter plot between SRF height and SVL thickness (left graph) and between SRF height and DVL thickness (right graph) in HR patients. The graph on the left shows a scatter plot with a linear regression line indicating a significant positive correlation between SRF height and SVL thickness in HR patients.
Fig. 25D is a representative retinal FAG (top) after treatment of normal blood pressure mice with IgG (NT w IgG) or α-Dll4 Ab (NT w α-Dll4), or hypertensive mice with IgG (HT w IgG). Images; to detect retinal leak) and ICGA (indocyanine green angiography) (bottom image; to detect choroidal leak) are shown.
Figure 26 shows the results of blocking the VEGF-VEGFR2 pathway inhibits EC transcytosis to attenuate retinal leakage induced by Dll4 inhibition.
Specifically, FIG. 26A shows the GSEA plot upregulation of a gene set related to the vascular endothelial growth factor receptor (VEGFR) signaling pathway in α-Dll4 Ab-treated retinal ECs.
Figure 26B shows the increase in arterial EC after treatment of normal blood pressure mice with IgG (NT w IgG) or α-Dll4 Ab (NT w α-Dll4), or hypertensive mice with IgG (HT w IgG). Images of cryosectioned adult retinas showing VEGFR2 are shown. The inside image is an enlarged portion of the box marked. C is a graph quantifying the results of B
26D shows the results of immunoblotting of VEGFR2 in retinal lysates of IgG or α-Dll4 treated (top image) or normotensive (NT) mice or hypertensive (HT) mice, E is the result of D is a quantified graph.
FIG. 26F shows the transcript levels of VEGF receptor and Notch downstream genes in EC-enriched transcripts after injection of α-Dll4 Ab into adult mice with EC-specific ribosome-HA tag over time. The results of the analysis are shown.
26 G is α-Dll4 Ab, α-VEGFR2 Ab, and / or VEGF-trap (aflibercept) represents the Evans blue leakage according to the treatment, H is a graph quantifying the results of G. Dll4 inhibition by blocking VEGF signaling may attenuate induced EB leakage.
26 I is a TEM image showing that the number of increased transcytosis vesicles (arrowheads) in α-Dll4 Ab-treated retinal ECs decreased with the treatment of α-VEGFR2 Ab, J is a graph quantifying the results of I am.
26 K shows the results of immunostaining for retinal PLVAP and claudin-5 according to α-Dll4 Ab, and/or VEGF-trap treatment, and L is a graph quantifying the results of K.
In G and K of FIG. 26 , the scale bar indicates 200 μm, in B the scale bar indicates 50 μm, and in I the scale bar indicates 200 nm.
27 shows that VEGF induces retinal leakage by increasing transcytosis.
Specifically, FIG. 27A is an immunostaining result for Evans blue extravasation and PLVAP expression in VEGF-treated retina, and B is a graph quantifying the result of A. FIG.
27C is a result of immunostaining for VE-cadherin junctions in VEGF-treated retina, and D is a graph quantifying the result of C. FIG. In A, the scale bar represents 200 μm, and in C, the scale bar represents 25 μm.
28 shows the acquisition of EC Notch activity and additional inhibition of hypertension-induced retinal edema by VEGFR2 blockade.
28A to 28D show the results for IgG- or α-VEGFR2 Ab-treated NT, HT, and HTN1ICDiOE mice. A shows EB extravasated from the retina of each experimental group, and B shows a graph quantifying the results of A. C represents retinal OCT images for each group, and white and red dotted lines represent SVL and subretinal fluid (SRF), respectively. D represents the SVL thickness (μm) and SRF height (μm) measured in C. Scale bars in A and C represent 200 μm.
29 shows that blocking Dll4-Notch signaling through VEGF signaling can activate SREBP1.
29A to 29F show that inhibition of Dll4-Notch signaling activates SREBP1 in retinal ECs. A shows a graph quantifying the immunostaining results for SREBP1 and SREBP1 intensity in whole-mounted retinas of mice injected with intravitreal IgG- or α-Dll4 Ab. B is a graph showing the results of immunoblotting and quantification of SREBP1 levels in retinal lysates of mice injected with intravitreal IgG- or α-Dll4 Ab. In B, P and N represent the precursor (125 kD) and nuclear (mature, 64 kD) forms of SREBP1, respectively. C shows a graph quantifying the immunostaining results and SREBP1 intensity for SREBP1 in retinal EC culture treated with α-Notch1 Ab or Notch1 activated (Dll4-coated). D is a graph quantifying the immunoblot results (left image) and SREBP1 levels (precursor (P) and nuclear (N) morphology) for SREBP1 in retinal EC cultures treated with α-Notch1 Ab or Notch1 activated (Dll4-coated) (right). graph).
29E to I show that VEGF activates SREBP1 in retinal EC. E shows the results of immunostaining for SREBP1 and quantification of EC SREBP1 in whole-mounted retinas of mice injected with IgG or VEGF intravitreally. F shows immunoblot results and quantification graphs for SREBP1 in retinal lysates of mice injected with IgG or VEGF intravitreally. The mature form of SREBP1 was increased with VEGF treatment. G shows the results of immunostaining for SREBP1 in retinal EC culture treated with VEGF, α-Notch1 Ab, and/or α-VEGFR2 Ab, and H shows a graph quantifying SREBP1 intensity according to the results of G. I shows a graph quantifying SREBP1 localization in retinal ECs treated with VEGF, α-Notch1 Ab, and/or α-VEGFR2 Ab.
In A and E of FIG. 29, the scale bar represents 25 μm, in C the scale bar represents 20 μm, and in G the scale bar represents 10 μm.
30 is a schematic diagram showing the regulation of Dll4 on the arterial barrier in steady-state and hypertensive conditions.
30A is a schematic diagram summarizing the regulation of transcytosis under normal (Physiologic) and hypertension (Hypertension) conditions. B is a diagram showing the Sox17-Dll4-SREBP1 axis fundamental to transcytosis regulation in retinal ECs. C is a schematic diagram showing a common vascular phenotype in hypertensive and Dll4-blocked retinas. Nonhemorrhagic leakage from the epidermal arteries occurs through increased transcytosis. DVL is a deep vascular layer; SVL stands for superficial vascular layer.
31 is a schematic diagram summarizing transcytosis regulation by VEGFR2 and Dll4 at the arterial barrier in steady-state and hypertensive conditions.
본 발명은 하기 실시예를 들어 더욱 자세히 설명할 것이나, 하기 실시예로 권리범위가 한정되는 의도는 아니다.The present invention will be described in more detail with reference to the following examples, but the scope of the rights is not limited to the following examples.
참고예 1. 마우스Reference Example 1. Mouse
내피세포(endothelial cell; EC)에서Dll4,Notch1, 및Sox17이 결실된 돌연변이 마우스를 제조하기 위하여,Cdh5-CreERT2 line을Dll4fl/fl,Notch1fl/fl, 및Sox17fl/fl 라인과 교배시켰다.To prepare mutant mice in whichDll4 ,Notch1 , andSox17 are deleted in endothelial cells (EC), theCdh5- CreERT2 line was crossed with theDll4fl/fl ,Notch1fl/fl , andSox17fl/fl lines. .
EC에서N1ICD를 과발현시키고 HA-tagged ribosome을 발현시키기 위하여Cdh5-CreERT2 line을 Gt(ROSA)26Sortm1(Notch1)Dam/J및 RPL22tm1.1Psam와 교배시켰다. 망막 동맥(retinal arterial) EC에서Dll4D가 결실된 돌연변이 마우스를 수득하기 위하여Slco1c1-CreERT2 line 과Dll4fl/fl를 교배시켰다.Sox17-결실 EC에서N1ICD을 과발현된 돌연변이 마우스를 제조하기 위하여Cdh5-CreERT2;Sox17fl/fl 라인을Gt(ROSA)26Sortm1(Notch1)Dam/J와 교배시켰다.Cre reporter 라인을 만들기 위해,Cdh5-CreERT2 및Slco1c1-CreERT2 라인을R26-tdTomato 라인과 교배시켰다. 모든 마우스 line은 C57BL/6J background에서 역교배되었다.To overexpressN1ICD and express HA-tagged ribosomes in EC, theCdh5 -CreERT2 line was crossed with Gt(ROSA)26Sortm1(Notch1)Dam/J and RPL22tm1.1Psam . To obtain mutant mice in whichDll4 D is deleted in retinal arterial EC, theSlco1c1- CreERT2 line was crossed withDll4fl/fl . To prepare mutant mice overexpressingN1ICD inSox17 -deleted ECs,Cdh5 -CreERT2 ;The Sox17fl/fl line was crossed withGt(ROSA)26Sortm1(Notch1)Dam/J . To make theCre reporter line, theCdh5 -CreERT2 andSlco1c1 -CreERT2 lines were crossed with theR26-tdTomato line. All mouse lines were backcrossed on C57BL/6J background.
Jackson Laboratory(Bar Harbor, ME, USA)에서 10~12주령의 2형 당뇨병(db/db) 마우스를 구입하였다. 산후(postnatal) 실험(P28 이전)에서는 마우스 성별은 구별되지 않았으나, 성인(adult) 실험(P28 이후)에서는 타목시펜(tamoxifen)이 에스트로겐(estrogen)에 영향을 끼치는 것을 막기 위해서 수컷 마우스만을 실험에 사용하였다. sunflower oil (Sigma-Aldrich)에 용해된 타목시펜을 복강 내(intraperitoneal; 50 mg/kg mouse) 또는 피하(subcutaneous; 100 mg/kg mouse) 주사로 투여하여 Cre-매개 결실(Cre-mediated deletion)이 유도되었다. Nanoliter 2000 micro-injector(World Precision Instruments) 또는33-게이지 니들(33-gauge needle)을 갖는Hamilton Neuros syringe(Hamilton Company) 을 이용하여, 5㎍α-Dll4 Ab, 5㎍ α-Notch1 Ab, 5㎍ DC101(α-VEGFR2 Ab), 5㎍ aflibercept(VEGF-trap, Regeneron), 1㎍ VEGF-A, 또는 5㎍ human IgG을 유리체내(intravitreally) 주사하였고, 그 결과 Antibody- 또는 decoy receptor-based inhibition가 유도되었다. α-Dll4 Ab를 유리체내 주사하거나 ATⅡ 주사에 의한 급성 고혈압 스트레스가 유도된 이후 2일 마다 파토스타틴(Fatostatin; SREBP1 inhibitor, Tocris, 30 mg/kg) 및 미토마이신 A(mitomycin A; MMA, EGR1 inhibitor, Sigma-Aldrich, 0.2 mg/kg)를 복강 내 주사하였다. 장기간 항산화제를 투여하면서, ATⅡ-주입(infusion) 4주 동안 1% NAC(N-acetylcysteine, Sigma-Aldrich)를 식수로 투여하였다. 마취를 위해, 케타민(ketamine; 40 mg/kg) 및 자일라진(xylazine; 5 mg/kg)의 혼합물을 마우스에 복강 내 주사하였다. 모든 마우스는 KAIST의 무균 동물시설에서 사육되었다. 본 실시예에서 모든 동물 처치와 실험절차는 institutional animal care committee(KA2017-06)에 의해 승인되었고, 안구 및 시력 연구(ophthalmic and vision research)를 위한 동물의 사용법에 대하여 규제하고 있는 ARVO(Association for Research in Vision and Ophthalmology) 선언의 규제에 따라 실시하였다.
참고예 2. 고혈압 모델Reference Example 2. Hypertension model
고혈압 상태를 유도하기 위해, 변형된 피하 이식 삼투압 미니펌프(osmotic mini-pumps(Alzet) implanted subcutaneously with modifications)를 사용하여 안지오텐신 Ⅱ(angiotension Ⅱ; ATⅡ) 또는 동등한 부피의 멸균 식염수(대조군)를 4주 동안 1㎍/kg/min(1.44mg/kg/day)의 속도로 투여하였다(도 17의 A). HR(hypertensive retinopathy) 환자에서 BRB를 파괴에 의한 고혈압 유발 망막 부종을 재현하기 위해 3주 후, 피하로 ATⅡ를 피하 주사하여(0.5㎍/g, 하루에 2번(twice per day)), 심각한 급성 고혈압을 제조하였다. 의식이 있고 제한이 없는 마우스(conscious and unrestrained mice)에서 CODA 비침습적 혈압 시스템을 장착한 tail-cuff plethysmography(Kent Scientific)를 이용하여 심장 수축기압을 측정하였다.To induce a hypertensive state, angiotension II (ATII) or an equivalent volume of sterile saline (control) was administered for 4 weeks using osmotic mini-pumps (Alzet) implanted subcutaneously with modifications. It was administered at a rate of 1 μg/kg/min (1.44 mg/kg/day) while ( FIG. 17A ). In order to reproduce the hypertension-induced retinal edema caused by BRB destruction in HR (hypertensive retinopathy) patients, after 3 weeks, ATII was injected subcutaneously (0.5 μg/g, twice per day), a severe acute Hypertension was prepared. Systolic pressure was measured in conscious and unrestrained mice using tail-cuff plethysmography (Kent Scientific) equipped with a CODA non-invasive blood pressure system.
참고예 3. PEG-bilirubin(PEGBR)의 합성 및 투여Reference Example 3. Synthesis and administration of PEG-bilirubin (PEGBR)
0.2mmol의 (ZZ)-빌리루빈-IX-알파((ZZ)-bilirubin-IX-alpha; Tokyo Chemical Industry, Tokyo, Japan) 및 0.26mmol의 카르보닐디이미다졸(carbonyldiimidazole; Sigma-Aldrich, St. Louis, MO, USA)을 5㎖의 DMSO(dimethyl sulfoxide)에 용해시켰다. RT에서 1시간 동안 교반한 후, 혼합물에 0.1mmol의 mPEG2000-NH2(Sigma-Aldrich)를 첨가하고, RT 및 질소 대기(nitrogen atmosphere)에서 4시간 동안 교반하면서 반응을 진행하였다. 혼합물에 클로로포름(200㎖)을 첨가하고, 분별 깔때기(separate funnel)를 이용하여 0.1M 탄산나트륨 용액(sodium carbonate solution) 및 염수(brine)로 세척하였다. 진공 하에서, 유기층을 농축시켰다. 45㎖의 메탄올을 첨가하고 용액을 여과함으로써, 유리 빌리루빈(Free bilirubin)을 제거하였다. 그 후 에테르(Ether)를 농축된 반응 혼합물에 첨가하고, 생성된 침전물은 클로로포름에 용해시키고 증발시켜 PEGBR을 형성하였다. PEGBR은 이전에 공지된 바(Lee et al.,Angew Chemie - Int Ed. 2016;55:7460-7463.)와 같이 처리되었다. PEGBR의 순도는 10mM 중탄산 암모늄 버퍼(ammonium bicarbonate buffer) 및 아세토니트릴(acetonitrile)을 이용한 HPLC(Supplemental Information I)을 통해 확인하였다. BRNP(bilirubin-based nanoparticles)를 준비하기 위해 PEG-BR(2umol)을 클로로포름에 용해시키고, 로터 증발기(rotor evaporator)로 건조시켜 필름 층(film layer)을 제조하였다. 필름 층에 500㎕의 PBS를 첨가하고, 생성된 현탁액을10분 동안 초음파 처리(sonicate)하여, BRNP를 제조하였다. 고혈압 마우스에서의 생체 내(in vivo) 항산화 치료를 위해, ATⅡ의 피하 주사를 통해 급성 고혈압이 유발된 HT 모델의 3주차에 40mg/kg의 PEGBR을 1주일 동안 하루에 두 번 복강 내 주사를 통해 전신적으로 투여하였다(도 19의 A).0.2 mmol of (ZZ)-bilirubin-IX-alpha ((ZZ)-bilirubin-IX-alpha; Tokyo Chemical Industry, Tokyo, Japan) and 0.26 mmol of carbonyldiimidazole; Sigma-Aldrich, St. Louis , MO, USA) was dissolved in 5 ml of DMSO (dimethyl sulfoxide). After stirring at RT for 1 hour, 0.1 mmol of mPEG2000-NH2 (Sigma-Aldrich) was added to the mixture, and the reaction was carried out while stirring at RT and a nitrogen atmosphere for 4 hours. Chloroform (200ml) was added to the mixture, and the mixture was washed with 0.1M sodium carbonate solution and brine using a separate funnel. Under vacuum, the organic layer was concentrated. Free bilirubin was removed by adding 45 ml of methanol and filtering the solution. Ether was then added to the concentrated reaction mixture, and the resulting precipitate was dissolved in chloroform and evaporated to form PEGBR. PEGBR was treated as previously known (Lee et al., Angew Chemie - Int Ed. 2016;55:7460-7463.). The purity of PEGBR was confirmed by HPLC (Supplemental Information I) using 10 mM ammonium bicarbonate buffer and acetonitrile. To prepare BRNP (bilirubin-based nanoparticles), PEG-BR (2umol) was dissolved in chloroform and dried with a rotor evaporator to prepare a film layer. BRNP was prepared by adding 500 μl of PBS to the film layer and sonicating the resulting suspension for 10 minutes. For in vivo antioxidant treatment in hypertensive mice, 40 mg/kg of PEGBR was injected intraperitoneally twice a day for 1 week at 3 weeks of acute hypertension induced by subcutaneous injection of ATII. It was administered systemically (FIG. 19A).
참고예 4. 면역조직화학Reference Example 4. Immunohistochemistry
전체 마운트한 망막(whole-mount retina)을 위해, 안구(eyeball)를 적출하여 RT에서 20분 동안 PBS 중의 4% PFA(paraformaldehyde)에 넣어 고정하였다. 망막을 해부하여, 추가적으로 RT에서 1시간 동안 1% PFA에서 고정시켰다. 망막의 크리오섹션(cryosection)을 위해, 눈을 적출하여 밤새도록 PBS 중 4% PFA 에서 고정시켰다. 수크로스 구배(sucrose gradient)를 이용한 탈수 후에, 아이컵(eyecup)은 OCT 컴파운드에서 스냅-동결(snap-frozen)되었다. 샘플들은 PBST(0.5% Triton X-100 in PBS) 중의 5% 염소(goat) 또는 당나귀(donkey) 혈청(serum)에서 블록킹(block)되었으며, 4℃에서 밤새도록 이소렉틴 B4(isolectin B4; Sigma-Aldrich) 또는 아래 일차 항체들과 함께 인큐베이션되었다.For whole-mount retinas, eyeballs were excised and fixed in 4% paraformaldehyde (PFA) in PBS for 20 minutes at RT. The retinas were dissected and additionally fixed in 1% PFA for 1 h at RT. For cryosection of the retina, eyes were enucleated and fixed in 4% PFA in PBS overnight. After dehydration using a sucrose gradient, the eyecup was snap-frozen in the OCT compound. Samples were blocked in 5% goat or donkey serum in PBST (0.5% Triton X-100 in PBS) and isolectin B4 (Sigma-) overnight at 4°C. Aldrich) or the following primary antibodies.
항체: anti-PECAM(clone 2H8; hamster, Millipore or rat, BD Bioscience); anti-NG2(rabbit, Millipore); anti-PDGFRβ(clone APB5; rat, eBioscience); fluorescein isothiocyanate(FITC)-conjugated anti-SMA(clone 1A4; mouse, Sigma-Aldrich); anti-claudin-5(rabbit, Invitrogen); Alexa Fluor 488-conjugated anti-claudin-5(mouse, Thermo); anti-VE-cadherin(rat, BD Bioscience); anti-PLVAP(MECA-32; rat, BD Biosciences); anti-caveolin-1(rabbit, Cell Signaling); anti-Dll4(goat, R&D Systems); anti-Sox17(goat, R&D system); anti-Jagged1(human, R&D system); anti-VEGFR2(goat, R&D system); anti-SREBP1(rabbit, Invitrogen; mouse, Santa Cruz); anti-Notch1(rabbit, Cell Signaling); anti-Mfsd2a(rabbit, courtesy of David Silver); anti-ERG(rabbit, abcam); anti-Ki67(rabbit, Abcam); anti-cleaved caspase-3(rabbit, Cell Signaling); 및/또는 collagen type IV(rabbit, Abcam)Antibody: anti-PECAM (clone 2H8; hamster, Millipore or rat, BD Bioscience); anti-NG2 (rabbit, Millipore); anti-PDGFRβ (clone APB5; rat, eBioscience); fluorescein isothiocyanate (FITC)-conjugated anti-SMA (clone 1A4; mouse, Sigma-Aldrich); anti-claudin-5 (rabbit, Invitrogen); Alexa Fluor 488-conjugated anti-claudin-5 (mouse, Thermo); anti-VE-cadherin (rat, BD Bioscience); anti-PLVAP (MECA-32; rat, BD Biosciences); anti-caveolin-1 (rabbit, Cell Signaling); anti-Dll4 (goat, R&D Systems); anti-Sox17 (goat, R&D system); anti-Jagged1 (human, R&D system); anti-VEGFR2 (goat, R&D system); anti-SREBP1 (rabbit, Invitrogen; mouse, Santa Cruz); anti-Notch1 (rabbit, Cell Signaling); anti-Mfsd2a (rabbit, courtesy of David Silver); anti-ERG (rabbit, abcam); anti-Ki67 (rabbit, Abcam); anti-cleaved caspase-3 (rabbit, Cell Signaling); and/or collagen type IV (rabbit, Abcam)
0.5% PBST에서 6~8시간 동안 세척한 후 샘플들은 RT에서 4시간 동안 species-specific Alexa Fluor-접합된 이차 항체와 함께 인큐베이션되었다. 핵 염색을 위해, DAPI/Hoechst는 RT에서 5~10분 동안 인큐베이션되었다. 망막을 0.5% PBST에서 6시간 동안 세척하고 마운팅 배지(mounting medium; Vectashield, Vector Laboratories)에서 플랫 마운트하였다. 생체 내(in vivo) 세포 증식(cell proliferation)을 평가하기 위하여, 마우스는 희생되기 4시간 전 복강 내로 EdU (마우스 당 100㎍)가 주사되었다. EdU 염색을 위해, Click-iT Edu imaging kit (C10637, Invitrogen)가 제조사의 지침에 따라 사용되었다. Zeiss LSM 800 confocal microscope(Zeiss)를 사용하여 면역형광사진을 수득하였다. 사진의 밝기(Brightness) 및 대비(contrast) 는 Adobe Photoshop CC 2017를 이용하여 조절되었다.After washing for 6-8 h in 0.5% PBST, samples were incubated with species-specific Alexa Fluor-conjugated secondary antibody for 4 h at RT. For nuclear staining, DAPI/Hoechst was incubated for 5-10 min at RT. The retinas were washed in 0.5% PBST for 6 hours and mounted flat in a mounting medium (Vectashield, Vector Laboratories). To evaluate cell proliferation in vivo, mice were injected with EdU (100 μg per mouse) intraperitoneally 4 hours before sacrifice. For EdU staining, a Click-iT Edu imaging kit (C10637, Invitrogen) was used according to the manufacturer's instructions. Immunofluorescence images were obtained using a
참고예 5. 혈관누출(Vascular leakage) 측정Reference Example 5. Vascular leakage measurement
망막 혈관 누출량을 결정하기 위하여 50㎕의 바람직한(indicated) 크기의 FITC-접합된 덱스트란(conjugated dextran of indicated size; 25 mg/㎖, 4 or 10 kD, Sigma-Aldrich), 테트라메틸로다민-접합된 10kD 덱스트란(tetramethylrhodamine-conjugated 10 kD dextran; 0.5mg/g, Thermo), 또는 100㎕의 2% 에반스 블루(Evans blue (EB); E2129, Sigma-Aldrich)를 정맥주사하였다. 피부 혈관의 색 변화를 확인함으로써 주사가 잘 들어간 것을 확인할 수 있었다. 마우스를 마취시키고, 좌심실을 통해 PBS를 관류하여 혈관으로부터 순환하는 EB를 제거하였다.To determine retinal vascular leakage, 50 μl of FITC-conjugated dextran of indicated size; 25 mg/ml, 4 or 10 kD, Sigma-Aldrich), tetramethylrhodamine-conjugated 10 kD dextran (tetramethylrhodamine-conjugated 10 kD dextran; 0.5 mg/g, Thermo), or 100 μl of 2% Evans blue (EB); E2129, Sigma-Aldrich) was intravenously injected. By checking the color change of the skin blood vessels, it was confirmed that the injection went well. Mice were anesthetized and circulating EBs were removed from the vessels by perfusion of PBS through the left ventricle.
참고예 6. 투과전자현미경(Transmission electron microscopy (TEM))Reference Example 6. Transmission electron microscopy (TEM)
TEM 실험은 마우스의 심장에 인산 완충액 중의 2% 글루타르알데하이드 및 2% PFA(0.1 M PB, pH 7.4)를 관류시키고, 눈을 적출하고, 눈을 동일한 고정액(인산 완충액 중의 2% 글루타르알데하이드 및 2% PFA(0.1 M PB, pH 7.4)에 4℃에서 밤새도록 인큐베이션하였다. 고정된 눈을 OCT 컴파운드에서 동결시키고, 크리오스탯(cryostat; Leica CM 1850, Leica)를 이용하여 14-18㎛의 두께로 크리오섹션하였다. 절단된(sectioned) 샘플은 이후 0.1 M PB (pH 7.4) 중의 2% PFA과 2% 글루타르알데하이드 및 2% OsO4 용액에서 순차적으로 고정시킨 후 에탄올 구배로 탈수시켰다. 다음으로 샘플을 프로필렌 옥사이드(propylene oxide)에 넣고, Quetol 812 에폭시 수지epoxy resin에 포매하였다. 샘플을 다이아몬트 칼을 사용하여 절단하고, 변형된 Sato의 납 용액(Hanaichi T et al., J Electron Microsc (Tokyo). 1986;35:304-6.) 으로 30초 동안 염색하였다. 샘플을 JEM-1011J(JEOL) 또는 Tecnai F20(FEI) 전자현미경을 통해 관찰하였다.TEM experiments were performed by perfusing the hearts of mice with 2% glutaraldehyde and 2% PFA (0.1 M PB, pH 7.4) in phosphate buffer, enucleating the eyes, and reconstructing the eyes with the same fixative (2% glutaraldehyde in phosphate buffer and 2% PFA in phosphate buffer). Incubated in 2% PFA (0.1 M PB, pH 7.4) overnight at 4° C. The fixed eyes were frozen in OCT compound and using a cryostat (Leica CM 1850, Leica) to a thickness of 14-18 μm. Sectioned samples were then sequentially fixed in a solution of 2% PFA, 2% glutaraldehyde and 2% OsO4 in 0.1 M PB (pH 7.4) and dehydrated with an ethanol gradient. Samples were placed in propylene oxide and embedded in Quetol 812 epoxy resin. The samples were cut using a diamond knife, and modified Sato's lead solution (Hanaichi T et al., J Electron Microsc (Tokyo) ).1986;35:304-6.) for 30 s Samples were observed with a JEM-1011J (JEOL) or Tecnai F20 (FEI) electron microscope.
참고예 7. 형태 분석(Morphometric analyses)Reference Example 7. Morphometric analyzes
망막 면역염색의 형태학적 분석을 위해 ImageJ (http://rsb.info.nih.gov/ij) 또는 Zen 2012(Carl Zeiss)이 사용되었다. 혈관 누출(Vascular leakage)과 출혈 영역은 혈관 외부로의 추적 염색된 영역 또는 적혈구를 망막 영역으로 나눈 비율로 정량화하였다. 망막혈관 밀도는 망막혈관 영역(PECAM-positive or claudin-5-positive)을 관심 망막 영역(retinal area of interest)으로 나눈 값의 비율로 나타내었다. 망막혈관 직경은 10개의 연속적인 망막혈관 직경 측정값의 평균값으로 나타내었다. 망막혈관의 전곡률(integrated curvature) 과 비틀림 지수(tortuosity index)는 공지된 바(Scott A et al., Exp Eye Res. 2014;120:55-60.)와 같이 계산되었다. 주피세포(Pericyte)(PDGFRβ-positive or NG2-positive), 평활근 세포(smooth muscle cell)(α-SMA-positive), 및 기저막(basement membrane)(collagen type IV-positive) 범위(coverage)는 임의의 0.2mm2 영역에서 해당 면적을 PECAM-양성 망막 혈관의 총 면적으로 나눈 값으로 정의되었다. 데이터 분석에서 범위 값은 대조군의 평균값으로 표준화되었다. 특정 분자의 염색 강도는 지정된 영역에서 픽셀당 형광강도의 평균값으로 분석되었으며, 망막마다 최소 4개의 대표적인 영역에서 계산되었다. 이러한 값들은 대조군의 평균값에서 non-vascularized area의 background signal의 형광강도의 평균을 뺀 값으로 표준화되었으며, 비교를 위해 배수 또는 퍼센트로 나타내었다. SREBP1의 핵 국소화(nuclear localization)는 DAPI 신호와 함께 결정되었다. 모든 변수들은 그룹마다 쥐 4~10마리에서 분석되었다. 형질전환 마우스의 모든 변수들은 한배에서 태어난 대조군(littermate control)과 비교되었다.ImageJ (http://rsb.info.nih.gov/ij) or Zen 2012 (Carl Zeiss) was used for morphological analysis of retinal immunostaining. Vascular leakage and bleeding area were quantified as the ratio of the area traced to the outside of the blood vessel or red blood cells divided by the retinal area. Retinal blood vessel density was expressed as a ratio of the value obtained by dividing the retinal blood vessel area (PECAM-positive or claudin-5-positive) by the retinal area of interest. The retinal blood vessel diameter was expressed as the average value of ten consecutive retinal blood vessel diameter measurements. The total curvature (integrated curvature) and torsity index (tortuosity index) of retinal blood vessels were calculated as known (Scott A et al., Exp Eye Res. 2014;120:55-60.). Pericyte (PDGFRβ-positive or NG2-positive), smooth muscle cell (α-SMA-positive), and basement membrane (collagen type IV-positive) coverage can be any It was defined as the area of 0.2 mm2 divided by the total area of PECAM-positive retinal vessels. In data analysis, range values were normalized to the mean value of the control group. The staining intensity of a specific molecule was analyzed as the average value of the fluorescence intensity per pixel in the designated area, and was calculated in at least 4 representative areas per retina. These values were normalized by subtracting the average of the fluorescence intensity of the background signal of the non-vascularized area from the average value of the control group, and were expressed as multiples or percentages for comparison. The nuclear localization of SREBP1 was determined along with the DAPI signal. All variables were analyzed in 4-10 rats per group. All parameters of transgenic mice were compared to littermate controls.
참고예 8. 생체 영상Reference Example 8. Bio-imaging
주문 제작된 비디오-속도 레이저 스캐닝 공초점 현미경(Custom-built video-rate laser-scanning confocal microscope)은 이전에 나타난 방법(Ogura S et al. JCI Insight. 2017;2:1-22.)대로 사용되었으며, 마우스 망막을 위해 수정되었다. 2개의 연속파 모듈(continuous-wave laser modules)이 488nm(MLD488, Cobolt) 및 640nm (MLD640, Cobolt)의 출력 파장을 갖는 여기 광원(excitation light sources)으로 사용되었다. 2차원 레이저 스캐닝 패턴을 만들기 위해, 회전 다각형 거울 스캐너(rotating polygonal mirror scanner)(MC-5, aluminum coated, Lincoln Laser) 및 검류계 거울 스캐너(galvanometer mirror scanner)(6230H, Cambridge Technology)의 2개의 스캐닝 거울이 사용되었다. 망막의 광역 이미지를 얻기 위해 높은 NA 대물 렌즈(High NA objective lens)(PlanApoλ, NA = 0.75, Nikon)가 사용되었다. 형광신호는 광전자 증배관(photomultiplier tubes)(R9110, Hamamatsu)을 통해 검출되었다. 광전자 증배관의 전기신호를 프레임 그래버(frame grabber)(Solios, Matrox)로 디지털화하고, 프레임마다 512Х512 픽셀 크기의 이미지로 표현했다. 생체 내에서 망막 혈류 영상화를 위해, 망막혈관을 FITC-접합된 덱스트란(FITC-conjugated dextran)(200 kDa, Sigma-Aldrich) 400㎍(10 mg/ml)으로 주사하여 표지하였다. 형광 혈관조영술(fluorescent angiography (FAG)) 및 인도시아닌 녹색 혈관조영술(indocyanine green angiography (ICGA))을 위해 플루오레세인 나트륨(fluorescein sodium(10mg)) 및 인도시아닌 그린(indocyanine green(0.375 mg))를 복강 내로 주사하였으며, 하이델베르그 망막혈관 조영술(Heidelberg retinal angiography(Heidelberg Engineering, Inc., Heidelberg, Germany))을 이용하여 스캔하였다. 모든 생체 망막 영상화를 위해, 마우스를 마취시키고, 동공을 Mydrin-P(tropicamide 5 mg/ml and phenylephrine 5 mg/ml, Santen Pharmaceuticals)로 확장시켰다.A custom-built video-rate laser-scanning confocal microscope was used as previously presented (Ogura S et al. JCI Insight. 2017;2:1-22.). , modified for the mouse retina. Two continuous-wave laser modules were used as excitation light sources with output wavelengths of 488 nm (MLD488, Cobolt) and 640 nm (MLD640, Cobolt). Two scanning mirrors: a rotating polygonal mirror scanner (MC-5, aluminum coated, Lincoln Laser) and a galvanometer mirror scanner (6230H, Cambridge Technology) to create a two-dimensional laser scanning pattern. this was used A High NA objective lens (PlanApoλ, NA = 0.75, Nikon) was used to obtain a wide-area image of the retina. The fluorescence signal was detected through photomultiplier tubes (R9110, Hamamatsu). The electrical signal of the photomultiplier tube was digitized with a frame grabber (Solios, Matrox) and expressed as an image with a size of 512Х512 pixels per frame. For retinal blood flow imaging in vivo, retinal blood vessels were labeled by injection with 400 μg (10 mg/ml) of FITC-conjugated dextran (200 kDa, Sigma-Aldrich). fluorescein sodium (10 mg) and indocyanine green (0.375 mg) for fluorescent angiography (FAG) and indocyanine green angiography (ICGA) ) was injected intraperitoneally and scanned using Heidelberg retinal angiography (Heidelberg Engineering, Inc., Heidelberg, Germany). For all in vivo retinal imaging, mice were anesthetized and pupils dilated with Mydrin-P (tropicamide 5 mg/ml and
참고예 9. RNA seq와 qPCR을 위한 EC-특이적 리보솜(ribosome) 결합 mRNA 추출Reference Example 9. EC-specific ribosome binding mRNA extraction for RNA seq and qPCR
HA-tagged ribosome을 이용하여 망막 EC로부터 리보솜-관련 전사체(ribosome-associated transcripts)를 얻기 위해Rpl22tm1.1Psam 마우스를Cdh5-CreERT2 형질전환 라인과 교배하였다. 신선한 망막을 절개하고, 액체질소에서 급속 냉동(snap-frozen)하여, 폴리솜 완충액(polysome buffer; 50 mM Tris pH 7.5, 100 mM KCl, 12 mM MgCl2, 1% Nonidet P-40, 1 mM DTT, 200 U/ml RNase inhibitor, protease inhibitor cocktail(P2714, Sigma), 1mg/ml heparin, 및 100mg/ml cycloheximide)에서 펠렛 페슬(pellet pestle)로 균질화시키고, 4℃, 10분 동안 12,000 g 조건에서 원심분리하였다. 상층액의 10%는 input으로 보존되었으며, 즉시 -80℃에 저장되었다. 남아있는 상층액은 항-HA 항체(M180-9, MBL) 자성 비드와 함께 4℃에서 인큐베이션 되었다. 상층액이 흡입된 후, 비드는 고염 완충액(high salt buffer)(50 mM Tris pH 7.5, 300 mM KCl, 12 mM MgCl2, 1 mM DTT, 및100 mg/ml cycloheximide)에서 세척되었고 보충된 RLT buffer(400㎕, with β-mercaptoethanol, Qiagen)에서 재현탁되었다. 현탁액은 'HA-인리치된(HA-enriched)' RNA 추출에 사용되었다. 'input'과 'HA 인리치먼트(HA enrichment)'으로부터 RNA는 RNeasy Plus Mini kit (Qiagen)를 이용하여 추출하였다. RNA의 품질은 Agilent 2100 bioanalyzer (Agilent)에 의해 측정되었고, RNA의 양은 ND-2000 spectrophotometer(Thermo)에 의해 측정되었다. RNA는 GoScriptTM reverse transcription kit (Promega)를 이용하여 cDNA로 역전사되었고 Bio-rad S1000 Thermocycler에서 FastStart SYBR Green Master mix(Roche)를 사용하여 RT-PCR을 수행하였다. 내인성 GAPDH 유전자(endogenous GAPDH gene)를 기준으로 수준(level)을 표준화하였다. 결과는 대조군(control)과 비교하여 상대적인 발현수치로 표현되었다. 사용된 프라이머는 하기 표 1에 기재하였다.To obtain ribosome-associated transcripts from retinal ECs using HA-tagged ribosomes,Rpl22tm1.1Psam mice were crossed with aCdh5 -CreERT2 transgenic line. Fresh retinas were dissected, snap-frozen in liquid nitrogen, and polysome buffer (50 mM Tris pH 7.5, 100 mM KCl, 12 mM MgCl2, 1% Nonidet P-40, 1 mM DTT, In 200 U/ml RNase inhibitor, protease inhibitor cocktail (P2714, Sigma), 1mg/ml heparin, and 100mg/ml cycloheximide), homogenized into a pellet pestle, and centrifuged at 12,000 g for 10 minutes at 4°C. did 10% of the supernatant was preserved as input and immediately stored at -80°C. The remaining supernatant was incubated with anti-HA antibody (M180-9, MBL) magnetic beads at 4°C. After the supernatant was aspirated, the beads were washed in high salt buffer (50 mM Tris pH 7.5, 300 mM KCl, 12 mM MgCl2 , 1 mM DTT, and 100 mg/ml cycloheximide) and supplemented RLT buffer (400 μl, with β-mercaptoethanol, Qiagen) was resuspended. The suspension was used for 'HA-enriched' RNA extraction. RNA from 'input' and 'HA enrichment' was extracted using RNeasy Plus Mini kit (Qiagen). The quality of RNA was measured by an Agilent 2100 bioanalyzer (Agilent), and the amount of RNA was measured by an ND-2000 spectrophotometer (Thermo). RNA was reverse transcribed into cDNA using a GoScript™ reverse transcription kit (Promega), and RT-PCR was performed in a Bio-rad S1000 Thermocycler using FastStart SYBR Green Master mix (Roche). The level was normalized based on the endogenous GAPDH gene. Results were expressed as relative expression values compared to the control group. The primers used are listed in Table 1 below.
참고예 10. 라이브러리(library) 준비 및 RNA 시퀀싱Reference Example 10. Library (library) preparation and RNA sequencing
라이브러리는 QuantSeq 3'mRNA-seq library prep kit(Lexogen)를 이용하여 제조사의 지침에 따라 제조되었다. 간단히, 각각 500ng의 RNA를 제조하고, 5' 말단에 Illumina-compatible sequence 를 포함하는 oligo-dT 프라이머와 혼성화되었으며, 그 다음 역전사되었다. RNA 주형(template)이 분해된 후, second strand는 5' 말단에 Illumina-compatible linker sequence를 포함하는 랜덤 프라이머에 의해 중합되었다. 이중가닥 라이브러리(double-stranded library)는 자성 비드를 사용하여 정제하고, 클러스터 생성에 필요한 완전한 어댑터 시퀀스(complete adapter sequence)를 추가하기 위해 증폭되었다. 완성된 라이브러리는 PCR 성분으로부터 정제되었다. NextSeq500(Illumina)을 이용하여 75bp 길이의 단일-말단 리드(single-end reads)를 제조하였다.The library was prepared according to the manufacturer's instructions using the QuantSeq 3'mRNA-seq library prep kit (Lexogen). Briefly, 500 ng of each RNA was prepared, hybridized with an oligo-dT primer containing an Illumina-compatible sequence at the 5' end, and then reverse transcribed. After the RNA template was digested, the second strand was polymerized with random primers containing an Illumina-compatible linker sequence at the 5' end. The double-stranded library was purified using magnetic beads and amplified to add the complete adapter sequence required for cluster generation. The completed library was purified from PCR components. Single-end reads of 75 bp in length were prepared using NextSeq500 (Illumina).
참고예 11. 바이오인포매틱 데이터(bioinformatic data) 분석Reference Example 11. Bioinformatic data analysis
TopHat2을 사용하여, QuantSeq 3'mRNA-seq 리드를 마우스 참조 게놈(mm10)에 정렬시켰다. 각 유전자의 3' 말단의 1000bp에 정렬된 리드의 개수는 Bedtools을 이용하여 계수하였다. 차등 발현된 유전자(Differentially expressed genes(DEGs))는 DESeq2을 사용하여 정규화를 거친 후 리드 계수(read counts)에 기반하여 결정되었다. Significant DEG는 P < 0.05인 경우, 그리고 absolute log2 fold change > 2인 경우로 정의되었다. 유전자 분류는 DAVID(http://david.abcc.ncifcrf.gov/) 및Medline 데이터베이스(http://www.ncbi.nlm.nih.gov/)를 기반으로 수행하였다. GO enrichment analysis가 significant DEGs with adjusted P value <0.05 based on the Gene Ontology Consortium(http://www.geneontology.org)을 사용하여 수행되었다. 인리치된 유전자 세트를 찾기 위하여 Gene set enrichment analysis(GSEA)가 GSEA software(http://software.broadinstitute.org/gsea/index.jsp)을 사용하여 수행되었다. Enrichment analysis가 Broad Institute(http:// software.broadinstitute.org/gsea/msigdb)에서 얻어진 gene set collections of the molecular signature database(MSigDB v6.2)을 사용하여 수행되었다. Upstream regulator analysis 및 functional analysis가 Ingenuity Pathway Analysis(IPA, Qiagen)을 사용하여 수행되었다. Principal component analysis가 GEnowiazTM ver. 4.0.5.6(Ocimum Biosolutions, India)을 사용하여 수행되었다. Volcano plots, heatmap bubble plots, 및 hierarchical clustering은 R package ggplot2을 사용하여 만들었다.Using TopHat2, QuantSeq 3'mRNA-seq reads were aligned to the mouse reference genome (mm10). The number of reads aligned to 1000bp of the 3' end of each gene was counted using Bedtools. Differentially expressed genes (DEGs) were determined based on read counts after normalization using DESeq2. Significant DEG was defined as P < 0.05 and absolute log2 fold change > 2. Genetic classification was performed based on DAVID (http://david.abcc.ncifcrf.gov/) and Medline database (http://www.ncbi.nlm.nih.gov/). GO enrichment analysis was performed using significant DEGs with adjusted P value <0.05 based on the Gene Ontology Consortium (http://www.geneontology.org). Gene set enrichment analysis (GSEA) was performed using GSEA software (http://software.broadinstitute.org/gsea/index.jsp) to find the enriched gene set. Enrichment analysis was performed using gene set collections of the molecular signature database (MSigDB v6.2) obtained from the Broad Institute (http://software.broadinstitute.org/gsea/msigdb). Upstream regulator analysis and functional analysis were performed using Ingenuity Pathway Analysis (IPA, Qiagen). Principal component analysis was performed by GEnowiazTM ver. 4.0.5.6 (Ocimum Biosolutions, India) was used. Volcano plots, heatmap bubble plots, and hierarchical clustering were created using the R package ggplot2.
참고예 12. 웨스턴 블롯(western blot)Reference Example 12. Western blot
세포들을 프로테아제 및 포스파타제 억제제(protease and phosphatase inhibitors (Roche))가 포함된 RIPA buffer에서 용해되고 수집되었다. 단백질은 SDS-PAGE에서 로딩되고 분리되었으며, PVDF 멤브레인(polyvinylidene difluoride membrane)으로 트랜스퍼되었다. 트랜스퍼된 멤브레인은 BSA로 블록(block)되었으며 이후에 1차 항체와 2차 항체를 넣었다.Cells were lysed and collected in RIPA buffer containing protease and phosphatase inhibitors (Roche). Proteins were loaded on SDS-PAGE, separated, and transferred to a polyvinylidene difluoride membrane (PVDF). The transferred membrane was blocked with BSA, and then a primary antibody and a secondary antibody were added thereto.
항체: rabbit anti-actin(Sigma); goat anti-Sox17(R&D systems); goat anti-Dll4(R&D systems); rabbit anti-Dll4(abcam); rabbit anti-VEGFR2(Cell Signaling); rabbit anti-phospo-VEGFR2(Invitrogen, Cell Signaling); rabbit anti-Caveolin-1(abcam); rabbit anti-Cavin 1(abcam); rabbit anti-PLVAP (Proteintech); rabbit anti-phospo-Caveolin-1(Cell Signaling), rabbit anti-SREBP1(Invitrogen, Santa Cruz); mouse anti-goat IgG-HRP(Santa Cruz Biotechnology); mouse anti-rabbit IgG-HRP (Santa Cruz Biotechnology)Antibody: rabbit anti-actin (Sigma); goat anti-Sox17 (R&D systems); goat anti-Dll4 (R&D systems); rabbit anti-Dll4 (abcam); rabbit anti-VEGFR2 (Cell Signaling); rabbit anti-phospo-VEGFR2 (Invitrogen, Cell Signaling); rabbit anti-Caveolin-1 (abcam); rabbit anti-Cavin 1 (abcam); rabbit anti-PLVAP (Proteintech); rabbit anti-phospo-Caveolin-1 (Cell Signaling), rabbit anti-SREBP1 (Invitrogen, Santa Cruz); mouse anti-goat IgG-HRP (Santa Cruz Biotechnology); mouse anti-rabbit IgG-HRP (Santa Cruz Biotechnology)
신호들은 화학발광 HRP 기질(chemiluminescence HRP substrate)(Immobilon, Millipore)로 발현되었으며Amersham Imager 600(GE Healthcare Life Science)를 이용하여 검출하였다. 단백질 정량분석은 ImageJ 소프트웨어를 이용하여 수행하였으며, 액틴(actin) 수준으로 정규화되었다.Signals were expressed with a chemiluminescence HRP substrate (Immobilon, Millipore) and detected using an Amersham Imager 600 (GE Healthcare Life Science). Protein quantification was performed using ImageJ software and normalized to actin levels.
참고예 13. 세포Reference Example 13. Cells
HUVEC(Human umbilical vein endothelial cell)은 이전에 공지된 바(Min Jet al., J Clin Invest [Internet]. 2011;121:1882-93.)와 같이 분리되었고, 계대(passages) 2-4로부터 사용하였다. 배양을 위해 20% FBS가 보충된 M119 medium(Gibco; Thermo Fisher Scientific, Inc., Waltham)를 사용되었다. 1차 HREC(Primary human retina endothelial cells)은 Celprogen(San Pedro, CA, USA)에서 구입하였고, 혈청(serum)과 함께 human retinal endothelial cell culture media(Celprogen)에서 배양되었다. 이전에 서술한 대로, HUVEC 또는 HREC은 Notch 신호전달(signaling)을 활성화하기 위해 Dll4(R&D systems)가 코팅된 배양 접시에서 배양되거나, 음성 대조군으로서 gelatin(Sigma-Aldrich)으로 코팅된 배양 접시에서 배양되었다(도 8의 A). 반면, Notch 신호전달을 억제하기 위해 HUVEC 또는 HREC은 5㎍/㎖의 α-Notch1 Ab 또는 IgG가 처리되었다. 인비트로 알부민 섭취 분석(in vitro albumin uptake assay)에서, HUVEC은 37℃에서 60분 동안 50㎍/㎖의 AlexaFluor 594-conjugated BSA(Thermo)로 인큐베이션되었으며, PBS로 세척되었다. Notch inhibition에 따른 hyper-permeability의 메카니즘을(기전을) 명확하게 하기 위하여, 세포들은 62.5μM dynasore(Sigma-Aldrich)을 처리하여 세포횡단 수송(transcellular transport)을 억제했고, 100nM adrenomedullin(Bachem)을 처리하여 세포사이 수송(paracellular transport)를 억제하거나, 비히클(vehicle)(DMSO)을 처리하였다. HREC에서 SREBP1 또는 VEGFR2를 억제하기 위하여, 각각 Fatostatin 10uM 또는 DC101(α-VEGFR2 Ab) 50nM을 처리하였다. 세포들은 추가적인 실험을 위하여 4% PFA에서 수확되고 고정되었다. TEER(assess trans-endothelial electrical resistance)를 평가하기 위하여, HUVEC은 트랜스웰(transwells)(12 mm diameter, 0.4 μm pore size, Corning Costar)에서 40 x 103cells/cm2 로 시딩되었다. TEER는 STX-2 전극을 갖는 EVOM2 전압계(World Precision Instrument)를 사용하여 측정되었다. 저항값(Resistance values)는 Ω·cm2 단위로 작성되었으며, 백그라운드로서 블랭크 저항(세포가 없는)을 값에서 뺐다. TEER 값은 α-Notch1 Ab 또는 IgG(대조군)를 처리하고 나서 0, 3, 6, 12, 및 24 hr이 지난 후 측정되었고, 상대적 TEER(relative TEER)는 실험군과 대조군의 TEER 비율로 측정되었다. ROS(reactive oxygen species)를 생성 및 측정하기 위해 세포를 ATⅡ(10μM) 또는 H2O2(200μM)를 포함하는 배지에 2시간 동안 처리하였다. 세포 내 ROS(Intracellular ROS)는 37℃에서 30분 동안 25μM의 DCFDA(2',7'-dicholorofluorescin diacetate, Sigma-Aldrich)와 함께 HUVEC을 배양함으로써 시각화되었다. 항산화제 처리를 위해 40mM NAC(Sigma-Aldrich)를 1시간 동안 전처리한 후 ATⅡ 또는 H2O2에 노출시켰다.Human umbilical vein endothelial cells (HUVECs) were isolated as previously known (Min Jet al., J Clin Invest [Internet]. 2011;121:1882-93.) and used from passages 2-4. did M119 medium (Gibco; Thermo Fisher Scientific, Inc., Waltham) supplemented with 20% FBS was used for culture. Primary human retinal endothelial cells (HREC) were purchased from Celprogen (San Pedro, CA, USA) and cultured in human retinal endothelial cell culture media (Celprogen) together with serum. As previously described, HUVECs or HRECs were cultured in culture dishes coated with Dll4 (R&D systems) to activate Notch signaling, or cultured in culture dishes coated with gelatin (Sigma-Aldrich) as a negative control. became (A in Fig. 8). On the other hand, to inhibit Notch signaling, HUVEC or HREC was treated with 5 μg/ml of α-Notch1 Ab or IgG. In an in vitro albumin uptake assay, HUVECs were incubated with AlexaFluor 594-conjugated BSA (Thermo) at 50 μg/ml at 37° C. for 60 min and washed with PBS. To elucidate the mechanism of hyper-permeability following Notch inhibition, cells were treated with 62.5 μM dynasore (Sigma-Aldrich) to inhibit transcellular transport and treated with 100 nM adrenomedullin (Bachem). to inhibit paracellular transport, or to treat with a vehicle (DMSO). To inhibit SREBP1 or VEGFR2 in HREC, 10 uM of Fatostatin or 50 nM of DC101 (α-VEGFR2 Ab) were treated, respectively. Cells were harvested and fixed in 4% PFA for further experiments. To evaluate the assay trans-endothelial electrical resistance (TEER), HUVECs were seeded in transwells (12 mm diameter, 0.4 μm pore size, Corning Costar) at 40×103 cells/cm2 . TEER was measured using an EVOM2 voltmeter (World Precision Instrument) with STX-2 electrodes. Resistance values were written in units of Ω·cm2 , and the blank resistance (without cells) as a background was subtracted from the value. TEER values were measured 0, 3, 6, 12, and 24 hr after treatment with α-Notch1 Ab or IgG (control), and relative TEER was measured as the ratio of TEER between the experimental group and the control group. In order to generate and measure reactive oxygen species (ROS), cells were treated in a medium containing ATII (10 μM) or H2 O2 (200 μM) for 2 hours. Intracellular ROS (ROS) was visualized by incubating HUVECs with 25 μM DCFDA (2',7'-dicholorofluorescin diacetate, Sigma-Aldrich) at 37 °C for 30 min. For the antioxidant treatment, 40 mM NAC (Sigma-Aldrich) was pre-treated for 1 hour and then exposed to ATII or H2 O2 .
참고예 14. 환자 dataReference Example 14. Patient data
이 연구는 전남대학교 병원 임상 시험 심사위원회(Institutional Review Board of Chonnam National University Hospital)(CNUH-2018-184)에 의해 승인되었다. 2013년과 2018년 사이에 HR 진단을 받은 19명의 피험자 38개의 눈과 연령/성별이 매치된 대조군의 20 피험자의 40개의 눈이 이 연구에서 사용되었다. HR 환자는 처음 방문했을 때 BP ≥ 180/100 mmHg였다. KWB(Keith-Wagener-Barker) 분류 시스템을 기반으로 3등급 또는 4등급으로 분류된 경우, HR환자는 망막 소견에서 혈관 누출을 포함한다. 안구 외상(ocular trauma), 안내 수술(intraocular surgery), 레이저 치료(laser treatment), 황반 질환(macular disease)의 다른 원인, 녹내장(glaucoma), 또는 고근시(high myopia (≥-6D))인 환자들은 제외되었다.This study was approved by the Institutional Review Board of Chonnam National University Hospital (CNUH-2018-184). 38 eyes from 19 subjects diagnosed with HR between 2013 and 2018 and 40 eyes from 20 subjects in an age/sex matched control group were used in this study. HR patients had a BP ≥ 180/100 mmHg at their first visit. When classified as
참고예 15. 의학적 실험Reference Example 15. Medical Experiment
시력(visual acuity), 세극등 생체 현미경(slit-lamp biomicroscopy), 검안경 검사(indirect ophthalmoscopy), 안압(intraocular pressure), 굴절 이상(refractive error) 등을 포함하는 기본적인 안과 검사를 위해 환자 정보를 검토하였다. 안저 촬영(fundus photograph)과 광안저 혈관조영술(fluorescein angiography(FAG))은 두 명의 맹검 망막 전문가(blinded retina specialist)에 의해 KWB grading하는데 사용되었다. 초기 방문시 FAG data와 SD-OCT(spectral domain-optical coherence tomography)(Spectralis; Heidelberg Engineering, Inc., Heidelberg, Germany)가 분석을 위해 모집되었다. 양안은 Mydrin P(tropicamide 1% and phenylephrine 2.5%)로 확장되었고, 장비가 제공하는 내부 타겟에 눈을 고정시킨 상태에서 대상이 스캔되었다. 모든 측정은 전문가에 의해 수행되었다.Patient information was reviewed for basic ophthalmic examinations including visual acuity, slit-lamp biomicroscopy, indirect ophthalmoscopy, intraocular pressure, and refractive error. Fundus photograph and fluorescein angiography (FAG) were used for KWB grading by two blinded retina specialists. At the initial visit, FAG data and spectral domain-optical coherence tomography (SD-OCT) (Spectralis; Heidelberg Engineering, Inc., Heidelberg, Germany) were recruited for analysis. Both eyes were dilated with Mydrin P (tropicamide 1% and phenylephrine 2.5%), and the subject was scanned while the eyes were fixed on the internal target provided by the device. All measurements were performed by experts.
참고예 16. SD-OCT 평가Reference Example 16. SD-OCT evaluation
동물 데이터의 경우 프로토타입 고속 OCT 시스템(prototype high-speed OCT system)이 사용되었다. 사람과 동물 데이터의 자세한 분석을 위해 Heidelberg eye explorer program의 OCT 층의 automated segmentation algorithm 이 사용되었다. 이 프로그램은 망막을 11개의 서로 다른 분리된 층으로 나눈다(도 23의 B). 각각의 분리된 층은 개별적으로 관찰되었고, 잘못된 묘사가 있는 경우 두 명의 망막 전문가에 의해 수동으로 조절되었다. 하기 층의 두께를 측정하였다:For animal data, a prototype high-speed OCT system was used. For detailed analysis of human and animal data, the automated segmentation algorithm of the OCT layer of Heidelberg eye explorer program was used. This program divides the retina into 11 different separate layers (Fig. 23B). Each separate layer was observed individually and manually adjusted by two retinal experts in case of misrepresentation. The thicknesses of the following layers were measured:
층(layer): retinal nerve fiber layer (RNFL), ganglion cell layer (GCL), inner plexiform layer (IPL), outer plexiform layer (OPL), outer nuclear layer (ONL), 및 inner nuclear layer (INL)Layers: retinal nerve fiber layer (RNFL), ganglion cell layer (GCL), inner plexiform layer (IPL), outer plexiform layer (OPL), outer nuclear layer (ONL), and inner nuclear layer (INL)
OCT 스캔에서 GCL 및 IPL 사이의 경계를 구별할 수 없었기 때문에, 두 층은 합쳐져서 분석되었다. SVL(Superficial vascular layer)은 주로 RNFL, GCL, 및 IPL로 구성된 GCC(ganglion cell complex)에 혈액을 공급하고, DVL(deep vascular layer)는 INL 및 OPL에 혈액을 공급한다(도 23의 A). 망막 부종을 평가하기 위해, SVL 및 DVL의 두께를 분석하였다. 망막하액(subretinal fluid(SRF)) 높이 분석을 위해 HR 환자들은 OCT 사진으로 측정된 SVL 및 DVL의 두께에 따라 3개의 그룹으로 나뉘었다: (1) 그룹1 (SVL > 121 μm, DVL < 75 μm), (2) 그룹 2 (SVL > 121 μm, DVL > 75 μm), 및 (3) 그룹 3 (SVL < 121 μm, DVL < 75 μm).Since the boundary between GCL and IPL could not be distinguished in the OCT scan, the two layers were combined and analyzed. Superficial vascular layer (SVL) supplies blood to ganglion cell complex (GCC) mainly composed of RNFL, GCL, and IPL, and deep vascular layer (DVL) supplies blood to INL and OPL (FIG. 23A). To evaluate retinal edema, the thickness of SVL and DVL was analyzed. For subretinal fluid (SRF) height analysis, HR patients were divided into 3 groups according to the thickness of SVL and DVL measured by OCT: (1) Group 1 (SVL > 121 μm, DVL < 75 μm) ), (2) group 2 (SVL > 121 μm, DVL > 75 μm), and (3) group 3 (SVL < 121 μm, DVL < 75 μm).
참고예 17. 통계Reference Example 17. Statistics
통계분석은 SPSS(statistical package for the social sciences software version 22.0)를 사용하여 수행되었다. 수치들은 평균 ± 표준편차로 제시되었다. 실험의 표본 크기를 미리 결정하기 위하여 통계적 방법을 사용하지 않았다. two-tailed student's t-test는 두 그룹의 차이점을 비교하기 위해서 사용되었다. Tukey test로 사후분석(post hoc analysis) 및 분산 검정(variance test) 분석은 3개 이상의 그룹을 비교하기 위해 수행되었다. pearson's correlation test는 2개의 값의 상관관계를 평가하기 위해서 사용되었다. IPA의 업스트림, 기능 및 경로 분석에 대한 P 값은 Fisher의 정확한 테스트로 결정되었다. 조정된 P 값은 benjamin-hochberg 보정(correction)으로 계산되었다. P<0.05인 경우 통계적으로 유의한 것으로 간주되었다.Statistical analysis was performed using SPSS (statistical package for the social sciences software version 22.0). Values are presented as mean ± standard deviation. No statistical method was used to predetermine the sample size of the experiment. A two-tailed student's t-test was used to compare the differences between the two groups. Post hoc analysis and variance test analysis with Tukey test were performed to compare 3 or more groups. Pearson's correlation test was used to evaluate the correlation between two values. P values for upstream, functional and pathway analysis of IPA were determined by Fisher's exact test. The adjusted P values were calculated with the benjamin-hochberg correction. P<0.05 was considered statistically significant.
실시예 1.Example 1.Dll4dll4 억제에 의해 유도된 동맥 주위 누출(peri-arterial leakage) Inhibition-induced peri-arterial leakage
본 실시예에서 BRB 완전성(blood-retinal barrier(BRB) integrity)을 가진 성숙한 혈관에서 Dll4의 역할은 살펴보고자 하였다. 성장하는 마우스의 망막의 동맥 및 혈관 신생성 전방(angiogenic front)에서 Dll4의 발현이 강력하였다. 도 1의 A 및 B에 나타난 바와 같이, 성인 망막에서 지속적인 동맥 Dll4(arterial Dll4)의 발현이 관찰되었다.In this example, the role of Dll4 in mature blood vessels with BRB integrity (blood-retinal barrier (BRB) integrity) was investigated. Expression of Dll4 was robust in the arterial and angiogenic front of the retina of growing mice. As shown in FIGS. 1A and 1B , sustained expression of arterial Dll4 was observed in the adult retina.
혈액망막장벽(BRB) 유지에 있어 Dll4의 역할을 연구하기 위해서, 성인 마우스에 항-Dll4 항체(α-Dll4 Ab) 또는 IgG(대조군)를 1회만(원치않는 전신적 및 장기간의 부차적인 효과를 방지하기 위하여) 유리체내 주사하였고, 7일 후 망막에서 정맥 내 주입된 추적자(tracer)의 혈관외유출(extravasation)을 조사하였다(도 2의 A). 도 2의 B 내지 D에 나타난 바와 같이, α-Dll4 Ab 처리된 망막의 경우, 심혈관총(deep vascular plexus; DVP)에 비하여 표피 혈관총(superficial vascular plexus; SVP)에서 에반스블루(EB)와 덱스트란(4kD와 10kD)의 혈관외유출이 두드러지게 발생하였다. 도 2의 E 및 F에 나타난 바와 같이, 유리체내 α-Dll4 Ab 처리 후, 동맥으로부터 EB 누출은 3일 후에 관찰되었고, 7일 후에는 모세혈관과 정맥까지 증가하였고, 그리고 10일 후에는 감소하여 동맥 주위로 제한되었고, 이는 망막 동맥에서 가역적인 누출이 우세한 것을 의미한다. 이러한 발견들은 Dll4가 동맥 BRB의 항상성을 위해 필수적이라는 것을 의미한다.To study the role of Dll4 in blood-retinal barrier (BRB) maintenance, adult mice were treated with anti-Dll4 antibody (α-Dll4 Ab) or IgG (control) only once (to prevent unwanted systemic and long-term secondary effects). To do this), intravitreal injection was performed, and after 7 days, extravasation of the intravenously injected tracer was investigated in the retina (FIG. 2A). As shown in Figure 2 B to D, in the case of the retina treated with α-Dll4 Ab, Evans Blue (EB) and Dex in the epidermal vascular plexus (SVP) compared to the cardiovascular plexus (deep vascular plexus; DVP) Extravasation of tran (4 kD and 10 kD) occurred markedly. As shown in E and F of FIG. 2 , after intravitreal α-Dll4 Ab treatment, EB leakage from arteries was observed after 3 days, increased to capillaries and veins after 7 days, and decreased after 10 days. It was restricted to the periarterial vein, suggesting a predominance of reversible leakage in the retinal arteries. These findings suggest that Dll4 is essential for arterial BRB homeostasis.
그러나, 유리체내 α-Dll4 Ab 처리는 혈관 패턴과 밀도 및 NG2-양성 주피세포(pericyte)와 SMA-양성 평활근 세포의 범위(coverage)를 변화시키지 않는다(도 1의 C 내지 도 1의 F). Dll4 차단은 유리체 이미지에서 보여준 것과 같이 망막 동맥에서 비틀림(tortuosity) 및 IV형 콜라겐의 손실을 초래하고, 이는 세포 외 기질을 약화시켜 누출된 체액의 확산을 촉진할 수 있음을 시사한다(도 1의 G 내지 J).However, intravitreal α-Dll4 Ab treatment did not change the vascular pattern and density and the coverage of NG2-positive pericytes and SMA-positive smooth muscle cells ( FIGS. 1C to 1F ). Dll4 blockade results in tortuosity and loss of type IV collagen in the retinal arteries, as shown in vitreous images, suggesting that it can weaken the extracellular matrix and promote diffusion of leaked body fluids (Fig. G to J).
실시예 2. 트랜스시토시스(transcytosis) 억제를 통한 내피 Dll4-Notch1 신호전달의 장벽 완전성을 유지Example 2. Maintaining Barrier Integrity of Endothelial Dll4-Notch1 Signaling Through Inhibition of Transcytosis
BRB 완전성(integrity)은 특화된 TJ(tight junction; 밀착 연접)와 EC(내피세포) 내에서 트랜스시토시스 제한을 통해 유지되므로, 성인 망막에서 α-Dll4 Ab 처리가 TJ를 손상시키고/손상시키거나 트랜스시토시스를 촉진시키는지 여부를 살펴보고자 하였다.Since BRB integrity is maintained through transcytosis restriction within specialized tight junctions (TJs) and endothelial cells (ECs), α-Dll4 Ab treatment in the adult retina impairs TJ and/or trans The purpose of this study was to examine whether it promotes cytosis.
실시예 2.1 Dll4 차단에 따른 트랜스시토시스 증가 여부 확인Example 2.1 Confirmation of increase in transcytosis according to blocking Dll4
Dll4 차단(blocking)은 접합 마커(junctional marker)인 VE-cadherin, claudin-5, occludin, 및 ZO-1 면역염색(immunostaining)의 수준 및 분포 패턴을 변화시키지 않았다(도 3의 A 및 B). 그러나, Dll4 차단은 망막 동맥(artery) 및 소동맥(arteriole, 세동맥)에서 카베올라(caveolar) 매개된 트랜스시토시스의 마커인 Caveolin-1 과 PLVAP 에 대한 면역염색(도 4의 A-C) 및 망막 용해물에서 Caveolin-1 과 PLVAP 의 단백질 수준을 증가시켰다(도 1의 K).Blocking Dll4 did not change the level and distribution pattern of the junctional markers, VE-cadherin, claudin-5, occludin, and ZO-1 immunostaining ( FIGS. 3A and 3B ). However, Dll4 blockade was inhibited by immunostaining (Fig. 4 AC) and retinal lysates for Caveolin-1 and PLVAP, markers of caveolar-mediated transcytosis in the retinal arteries and arterioles (arterioles). The protein levels of Caveolin-1 and PLVAP were increased in (Fig. 1K).
투과전자현미경(TEM)을 사용하여, α-Dll4 Ab 처리된 EC에서 TJ 유지와 세포횡단 소낭(transcellular vesicle)의 수의 증가를 확인하였다. 도 4의 D 및 E에 나타난 바와 같이, α-Dll4 Ab 처리에 의해 TJ (노란색 화살표)은 변화 없었으나 세포횡단 소낭의 수는 현저히 증가하였고, 기저부 측(abluminal side) 상에 융합 및 도킹뿐만 아니라 내강측(luminal side)에서 원형질막(plasmalemma) 플라스크 모양의 함입(flask-shaped invagination)도 증가하였다.Transmission electron microscopy (TEM) was used to confirm TJ maintenance and increase in the number of transcellular vesicles in α-Dll4 Ab-treated ECs. As shown in D and E of Figure 4, TJ (yellow arrow) was not changed by α-Dll4 Ab treatment, but the number of transcellular vesicles was significantly increased, and not only fusion and docking on the abluminal side but also Flask-shaped invagination of plasma membrane on the luminal side was also increased.
실시예 2.2 α-Notch1 Ab 주사에 따른 효과Example 2.2 Effects of α-Notch1 Ab injection
참고예 1의 방법과 같이 성인 마우스에 α-Notch1 Ab를 유리체내 주사하여 Dll4 의 1차 수용체(primary receptor)인 망막 Notch1을 억제시켰다. Dll4 차단과 유사하게, α-Notch1 Ab 처리는 VE-cadherin 및 claudin-5 발현의 변화 없이, EC에서 추적자의 혈관외유출(extravasation) 및 동맥의 PLVAP 및 caveolin-1 발현을 유도하였다(도 5의 A-G). α-Notch1 Ab 처리에 의하여 NG2-양성 주피세포(혈관 주위세포, Pericyte)와 SMA-양성 평활근 세포와 같은벽 세포(mural cell)의 범위(coverage)는 변하지 않았으나(도 5의 H 및 J), α-Notch1 Ab 처리 후에 동맥 비틀림과 함께 IV형 콜라겐의 손실이 관찰되었다(도 5의 I 및 K).As in the method of Reference Example 1, α-Notch1 Ab was intravitreally injected into adult mice to inhibit retinal Notch1, a primary receptor of Dll4. Similar to Dll4 blockade, α-Notch1 Ab treatment induced tracer extravasation and arterial PLVAP and caveolin-1 expression in EC without alteration of VE-cadherin and claudin-5 expression (Fig. 5). AG). By treatment with α-Notch1 Ab, NG2-positive pericytes (pericytes) and SMA-positive smooth muscle cellsAlthough the coverage of the parietal cells was not changed (FIG. 5H and J), loss of type IV collagen was observed with arterial torsion after α-Notch1 Ab treatment (FIG. 5I and K).
실시예 2.3 내피세포에서 Dll4와 Notch1 결실에 따른 효과Example 2.3 Effect of Dll4 and Notch1 Deletion in Endothelial Cells
참고예 1의 방법과 같이, EC에서 Dll4와 Notch1 유전자를 각각 결실시킨Dll4i△EC마우스 및Notch1i△EC마우스를 제작하여, Dll4와 Notch1 유전자의 역할을 연구하였다(도 6의 A).As in the method of Reference Example 1,Dll4iΔEC mice andNotch1iΔEC mice in which the Dll4 and Notch1 genes were deleted from EC were prepared, and the roles of the Dll4 and Notch1 genes were studied ( FIG. 6A ).
실시예 1, 2.1, 및 2.2에서의 유리체내 항체 주입의 데이터와 동일하게, EC에서 Dll4 및 Notch1 가 결실된 성인 마우스(각각Dll4i△EC 및Notch1i△EC)는 벽세포 (주피세포 및 평활근 세포) 범위에서 유의한 변화가 나타나지 않았다(도 6의 B 및 C). 게다가,Dll4i△EC 및Notch1i△EC 마우스는α-Dll4 Ab 처리를 통한 에반스 블루 누출, PLVAP 수준 증가, 세포횡단 소낭(Transcytotic vesicle) 수 증가 등의 동맥 BRB 파괴를 표현형 모사하였고(도 6의 D - H), 이는 EC가 성인 BRB 유지에서 DII4-Notch1 신호전달을 위한 주요한 세포 타입임을 의미한다Consistent with the data of intravitreal antibody injection in Examples 1, 2.1, and 2.2, adult mice lacking Dll4 andNotch1 in EC (Dll4iΔEC and
실시예 2.4 망막 내피세포에서 Dll4와 Notch1 결실에 따른 효과Example 2.4 Effect of Dll4 and Notch1 Deletion in Retinal Endothelial Cells
상기 참고예 1의 방법과 같이, 중추신경계(CNS) EC에서 유전자 결실을 위해 제조된Slco1c1 CreERT2 라인을 사용하여, 성인 마우스의 망막에 존재하는 EC로부터 Dll4가 결실된Dll4i△RAEC(Slco1c1 CreERT2;Dll4fl/fl) 마우스를 제조하였다.As in the method of Reference Example 1 above, using theSlco1c1 CreERT2 line prepared for gene deletion in central nervous system (CNS) EC,Dll4iΔRAEC (Slco1c1 CreER)T2 ;Dll4fl/fl ) mice were prepared.
Dll4i△EC마우스 제조에 사용된Cdh5-CreERT2 라인과Dll4i△RAEC마우스 제조에 사용된 Slco1c1-CreERT2 라인을R26-tdTomato 라인과 각각 교배시켜 제작한Cdh5-CreERT2-tdTomato와Slco1c1-CreERT2-tdTomato 마우스의 망막에서 면역염색을 통해 tdTomato 발현을 살펴보았다.Slco1c1-CreERT2-tdTomato 에서는 망막 동맥 EC-특이적으로 tdTomat 신호가 검출되어, Cdh5(Vecad)-CreERT2-tdTomato와 tdTomato 발현 위치가 상이한 것을 알 수 있었다(도 7의 A). (Cdh5-CreERT2-tdTomato의 경우 망막 내피세포 전체에서 tdTomato 발현됨) 따라서,Dll4i△RAEC마우스는 전체-내피의 Dll4(pan-endothelial) 결실을 나타내는Dll4i△EC마우스와 Dll4가 결실된 위치가 상이한 것을 확인하였다.Cdh5-CreERT2 line andDll4i△RAEC used to prepareDll4i△EC miceCdh5-CreERT2 -tdTomato andSlco1c1 -CreERT2 -tdTomato produced by crossing theSlco1c1 -CreERT2 line used for mouse production with theR26-tdTomato line, respectively, and tdTomato expression in the retina of mice were examined through immunostaining.In Slco1c1- CreERT2 -tdTomato, retinal artery EC-specific tdTomat signal was detected, indicating thatCdh5(Vecad) -CreERT2 -tdTomato and tdTomato expression sites were different ( FIG. 7A ). (In the case ofCdh5 -CreERT2 -tdTomato, tdTomato is expressed in all retinal endothelial cells) Therefore,Dll4iΔRAEC mice exhibited total-endothelial Dll4 (pan-endothelial) deletion.Dll4iΔEC mice and Dll4 deletion positions was confirmed to be different.
도 7의 B에 나타난 바와 같이, 면역 염색을 통해 Cdh5-CreERT2및Slco1c1-CreERT2의 망막 동맥에서 Dll4 는 검출되지 않은 것을 확인할 수 있었다(도 7의 B).As shown in FIG. 7B , it was confirmed that Dll4 was not detected in the retinal arteries ofCdh5 -CreERT2 andSlco1c1 -CreERT2 through immunostaining ( FIG. 7B ).
또한,Dll4i△RAEC 마우스는 주로 망막 동맥에서 PLVAP 발현 증가와 동맥 주위에서 추적자(에반스블루 및 10kD 덱스트란) 누출을 나타내었고(도 7의 C-H), 이는 동맥 BRB 항상성에서 Dll4의 중요성을 나타낸다. 또한 도 7의 C-H의 결과는 도 2 및 4의 결과와 일치한다.In addition,Dll4iΔRAEC mice showed increased PLVAP expression mainly in retinal arteries and leakage of tracers (Evans blue and 10 kD dextran) around the arteries (CH in FIG. 7 ), indicating the importance of Dll4 in arterial BRB homeostasis. Also, the results of CH in FIG. 7 are consistent with the results in FIGS. 2 and 4 .
실시예 2.5 Dll-Notch1 신호전달 차단의 주요 누출 경로의 확인Example 2.5 Identification of major leak pathways of blocking Dll-Notch1 signaling
알부민 흡수는 세포사이 수송이 아닌 트랜스시토시스에 의해서만 일어나고, HUVEC에서 α-Notch1 Ab 처리는 알부민 흡수를 증가시켰고(도 8의 B 및 C), 증가된 알부민 흡수량은 Notch1 활성화(Dll4 코팅) 또는 다이나솔(dynasore; transcytosis inhibitor)에 의해 감소되었으나 아드레노메둘린 (adrenomedullin; paracellular transport inhibitor)에 의해서는 감소되지 않았다(도 8의 B-D). 이로부터, Dll4-Notch1 신호전달을 차단할 때 트랜스시토시스가 주요 누출 경로인 것을 확인할 수 있었다.Albumin uptake occurs only by transcytosis, not intercellular transport, and α-Notch1 Ab treatment in HUVECs increased albumin uptake ( FIGS. 8B and C), and the increased albumin uptake resulted from Notch1 activation (Dll4 coating) or dyna It was reduced by dynasore (transcytosis inhibitor) but not by adrenomedullin (paracellular transport inhibitor) ( FIG. 8 BD). From this, it could be confirmed that transcytosis was the major leak pathway when blocking Dll4-Notch1 signaling.
Noch1의 차단(α-Notch1 Ab 처리) 또는 Notch1 활성화((Dll4 코팅)에 따른 TJ에 의해 형성된 저항을 측정하기 위해 TEER를 수행하였다. VEGF 처리시 상대적인 TEER(transepithelial electrical resistances)가 감소된 반면,α-Notch1 Ab 처리, Dll4 코팅, 및 다이나솔은 TEER 에 영향을 미치지 않았고(도 8의 E-F), 이는 세포사이 수송(paracellular transport)이 Notch 조절과 독립적인 것을 나타낸다.TEER was performed to measure the resistance formed by TJ upon Noch1 blockade (α-Notch1 Ab treatment) or Notch1 activation ((Dll4 coating). VEGF treatment reduced relative transepithelial electrical resistances (TEER), whereasα-Notch1 Ab treatment, Dll4 coating, and dynasol did not affect TEER (FIG. 8 EF), indicating that paracellular transport is independent of Notch regulation.
인간 망막 EC(HREC) 배양에서, α-Notch1 Ab는 단백질 수준에서 PLVAP, caveolin-1, phospho-caveolin-1, 및 cavin-1과 같은 카베올라 소낭의 다양한 구조적 요소들을 증가시켰다(도 9). 이러한 발견들은 카베올라 매개된 트랜스시토시스의 세포 자율적인 Dll4-Notch의 조절을 시사한다.In human retinal EC (HREC) cultures, α-Notch1 Ab increased various structural elements of caveola vesicles such as PLVAP, caveolin-1, phospho-caveolin-1, and cavin-1 at the protein level (Fig. 9). These findings suggest cell-autonomous regulation of Dll4-Notch of caveola-mediated transcytosis.
실시예 2.6 Mfsd2a와 독립적인 Dll4의 트랜스시토시스의 조절Example 2.6 Regulation of Dll4 transcytosis independent of Mfsd2a
Mfsd2a는 출생 후 BRB 성숙에 대한 트랜스시토시스를 조절한다고 알려져있으므로, Dll-Notch1 신호전달이 Mfsd2a와 독립적인 방식으로 트랜스시토시스를 조절하는지 살펴보고자 하였다.Since Mfsd2a is known to regulate transcytosis for BRB maturation after birth, we wanted to examine whether Dll-Notch1 signaling regulates transcytosis in a manner independent of Mfsd2a.
Dll4는 주로 성인 망막의 동맥/소동맥(세동맥)에서 발현되는 반면, Mfsd2a는 Dll4 발현과 최소한의 중첩으로 성인 망막의 모세혈관에서 주요하게 발현되었다(도 10의 A-B). 게다가, α-Dll4 Ab 처리는 망막에서 Mfsd2a 발현을 유의미하게 변화시키지 않았고(도 10의 C), 이는 Dll4가 Mfsd2a와 독립적인 방식으로 기능한다는 것을 의미한다.Dll4 was mainly expressed in the arteries/arterioles (arterioles) of the adult retina, whereas Mfsd2a was mainly expressed in the capillaries of the adult retina with minimal overlap with Dll4 expression (Fig. 10A-B). Moreover, α-Dll4 Ab treatment did not significantly alter Mfsd2a expression in the retina ( FIG. 10C ), suggesting that Dll4 functions in an Mfsd2a-independent manner.
실시예 2.1 내지 2.6의 결과를 종합해 볼 때, EC-자율 Dll4-Notch1 상호작용은 선택적으로 트랜스시토시스를 제한하여 망막 동맥의 투과성(permeability)을 낮게 유지하는 것을 알 수 있다.Combining the results of Examples 2.1 to 2.6, it can be seen that the EC-autonomous Dll4-Notch1 interaction selectively restricts transcytosis to keep retinal artery permeability low.
실시예 3. Dll4 차단(blocking)을 통해 트랜스시토시스 매개 동맥 주위 누출을 표현형모사(phenocopy)하는 Sox17 결실Example 3. Sox17 deletion to phenocopy transcytosis-mediated periarterial leakage via Dll4 blocking
본 실시예에서 Dll4-매개된 성인 동맥 BRB 조절에 Sox17이 관여하는지 여부를 살펴보았다.In this example, it was examined whether Sox17 is involved in Dll4-mediated adult arterial BRB regulation.
면역염색 결과, EC에서Sox17이 결실된 성인 마우스(Sox17i△EC)의 망막에서 Dll4 발현이 감소되었으나. EC에서 Dll4이 결실된 성인 마우스(Dll4i△EC)의 망막에서는 Sox17에 대한 발현은 감소되지 않았다(도 11의 A, B, G, H). 이러한 결과는 Sox17이 동맥 Dll4 발현의 상위 조절자(upstream regulator)라는 것을 의미한다.As a result of immunostaining, Dll4 expression was reduced in the retina of adult mice (Sox17iΔEC ) in whichSox17 was deleted in EC. In the retina of adult mice (Dll4 iΔEC ) in which Dll4 is deleted inEC , the expression of Sox17 was not reduced (FIG. 11A, B, G, H). These results suggest that Sox17 is an upstream regulator of arterial Dll4 expression.
Dll4 억제의 표현형과 유사하게 Sox17 결실은 추적자(EB 또는 덱스트란)의 혈관외유출을 초래하고(도 11의 C, I), 트랜스시토시스의 마커인 PLVAP 및 caveolin-1 발현을 증가시켰으며, 접합마커인 claudin-5 의 발현에는 영향을 미치지 않았다(도 11의 D, E, 및 J). Dll4 억제의 표현형과 유사하게 Sox17의 결실은 TJ를 변화시키지 않았으나 동맥에서 세포횡단(transcellular) 소낭의 수를 증가시켰다(도 11의 F).Similar to the phenotype of Dll4 inhibition, Sox17 deletion resulted in extravasation of tracers (EB or dextran) (Fig. 11C, I) and increased expression of PLVAP and caveolin-1, markers of transcytosis, The expression of the splicing marker claudin-5 was not affected (Fig. 11D, E, and J). Similar to the phenotype of Dll4 inhibition, deletion of Sox17 did not change TJ but increased the number of transcellular vesicles in arteries (FIG. 11F).
또한, 면역블롯 분석 결과,Sox17i△EC 마우스의 망막 용해물에서 Dll4 수준이 감소되었고 PLVAP 및 Caveolin-1 수준이 증가된 것을 확인하였다(도 11의 L-M).In addition, as a result of immunoblot analysis, it was confirmed that Dll4 levels were decreased and PLVAP and Caveolin-1 levels were increased in retinal lysates ofSox17iΔEC mice (LM in FIG. 11 ).
게다가, EC에서 N1ICD의 과발현을 통한 Notch활성의 획득(Sox17i△ECN1ICDiOE)은Sox17i△EC 의 망막에서 증가된 동맥 PLVAP 발현과 EB 누출을 감소시켰다(도 12). 이러한 발견들은 Sox17이 Dll4에 의해 조절되는 동맥 BRB 유지의 상위(upstream)라는 것을 의미한다.Moreover, acquisition of Notch activity through overexpression of N1ICD in ECs (Sox17iΔECN1ICDiOE ) reduced increased arterial PLVAP expression and EB leakage in the retina ofSox17iΔEC ( FIG. 12 ). These findings suggest that Sox17 is upstream of arterial BRB maintenance regulated by Dll4.
실시예 4. Dll4 봉쇄(blockade)-유도된 트랜스시토시스를 중재하는 지방 생성 전사 인자 SREBP1Example 4. Adipogenic transcription factor SREBP1 mediating Dll4 blockade-induced transcytosis
근본적인 분자적 메커니즘을 이해하기 위해서, RNA-시퀀싱을 위해 EC-특이적 RiboTag 마우스(Cdh5-CreERT2;RPL22tm1.1Psam)를 제작하고, 제작한 형질전환 마우스에 유리체내 IgG 또는α-Dll4 Ab를 주사하고 3일 후에 고도로 EC-인리치된 전사체(EC-enriched transcript)를 분리하였다(도 13의 A-C). RNA-seq결과에 대한 계층적 군집 분석(hierarchical clustering) 및 주성분 분석(Principal component analysis)은 IgG 및 α-Dll4 Ab 처리된 망막의 EC 사이에서 유전자 발현 프로파일의 명확한 차이를 보여준다(도 13의 D - E). 차등적으로 발현된 12,756개의 유전자들(differentially expressed gene; DEG) 중에서, 801개의 유전자들은 중요한 DEG로 판별되었고, 이는 544개의 상향 조절된 유전자들과 257개의 하향 조절된 유전자들로 구성된다. 유전자 온톨로지 인리치먼트 분석(Gene Ontology (GO) enrichment analysis)은 '수송 조절(Regulation of transport)'을 주요 GO 조건(생물학적 단계) 중에 하나로 판별하였고, IPA(Ingenuity Pathway Analysis)는 Dll4가 억제된 망막 EC에서 '분자의 수송과 배출(transport and export of molecules)'의 활성화를 예측하였다(도 13의 F-G).In order to understand the underlying molecular mechanism, EC-specific RiboTag mice (Cdh5 -Cre ERT2;RPL22tm1.1Psam ) were constructed for RNA-sequencing, and intravitreal IgG or α-Dll4 Abs were injected into the transgenic mice. 3 days after injection, highly EC-enriched transcripts were isolated (FIG. 13 AC). Hierarchical clustering and principal component analysis of RNA-seq results showed clear differences in gene expression profiles between ECs of IgG and α-Dll4 Ab-treated retinas (FIG. 13D- E). Of the 12,756 differentially expressed genes (DEGs), 801 genes were identified as important DEGs, which consist of 544 up-regulated genes and 257 down-regulated genes. Gene Ontology (GO) enrichment analysis identified 'Regulation of transport' as one of the major GO conditions (biological steps), and Ingenuity Pathway Analysis (IPA) revealed Dll4-inhibited retina We predicted the activation of 'transport and export of molecules' in EC (FIG. 13 FG).
유전자 세트 인리치먼트 분석(gene set enrichment analysis(GSEA))은 α-Dll4 Ab 처리된 망막 EC에서, 트랜스시토시스 과정에서 Dll4-조절된 단계를 나타내는, 래프트 형성(raft formation), 소낭 엔드시토시스(endocytosis), 및 소낭 수송과 관련된 유전자의 포지티브 인리치먼트(positive enrichment)를 밝혀냈다(도 14의 A). 이와 관련하여, RNA-seq 데이터는 Dll4 억제가 망막 EC에 있는 카베올라 소낭의 구조적 성분을 상향 조절하는 것을 나타내었고, 이는 정량적 RT-PCR에 의해 검증되었다(도 13의 H-I). 그러나,'세포-세포 접합(cell-cell junction)'과 관련된 유전자 세트는 유의미한 인리치먼트를 나타내지 않았다(도 13의 J).Gene set enrichment analysis (GSEA) showed that in retinal ECs treated with α-Dll4 Ab, raft formation, follicular endcytosis, revealing a Dll4-regulated step in the transcytosis process. (endocytosis), and revealed a positive enrichment (positive enrichment) of genes related to vesicle transport ( FIG. 14A ). In this regard, RNA-seq data indicated that Dll4 inhibition upregulates structural components of caveola vesicles in retinal ECs, which was verified by quantitative RT-PCR (Fig. 13H-I). However, the gene set related to 'cell-cell junction' did not show significant enrichment (FIG. 13J).
DEG의 IPA 상위 분석은 Dll4의 억제가 카베올라(caveolae) 형성에 관여하는 EGR1과 SREBP1(지방 생성 전사 인자 마스터)를 활성화시키는 것을 시사한다(도 14의 B). 더 나아가,STAT6, RAB10, CORO1A, 및PLCB3와 같은 상향 조절된 SREBP1 타겟 유전자들은 카베올라나 트랜스시토시스와 연관되어 있다(도 14의 C). 혈장 막(plasma membrane)과 비교하면, 카베올라(caveolae)는 높은 비율의 콜레스테롤과 스핑고미엘린으로 구성되어 있지만, 인지질의 비율은 더 낮다. Dll4 억제 망막 EC는 콜레스테롤 유지에 필요한 '담즙산 수송' 및 '콜레스테롤 항상성'과 관련된 유전자 세트의 포지티브 인리치먼트와 '인지질'과 관련된 유전자 세트들의 네가티브 인리치먼트를 나타내었다(도 14의 D). 이를 종합하면, 이러한 전사 프로파일 결과는 Dll4 억제가 카베올라 선호(favorable) 지질 환경을 생성함으로써 EC 트랜스시토시스를 개시함을 시사한다.IPA upstream analysis of DEG suggests that inhibition of Dll4 activates EGR1 and SREBP1 (adipogenic transcription factor master) involved in caveolae formation ( FIG. 14B ). Furthermore, up-regulated SREBP1 target genes such asSTAT6, RAB10, CORO1A , andPLCB3 are associated with caveolana transcytosis ( FIG. 14C ). Compared to plasma membrane, caveolae consists of a high proportion of cholesterol and sphingomyelin, but a lower proportion of phospholipids. Dll4-repressed retinal EC showed positive enrichment of gene sets related to 'bile acid transport' and 'cholesterol homeostasis' required for cholesterol maintenance, and negative enrichment of gene sets related to 'phospholipids' (FIG. 14D). Taken together, these transcriptional profile results suggest that Dll4 inhibition initiates EC transcytosis by creating a caveola-favorable lipid milieu.
다음으로, 유리체내 α-Dll4 Ab 주사 후에 미토마이신 A(mitomycin A(MMA), EGR1 억제자) 또는 파토스타틴(fatostatin, SREBP1 억제자)을 전신적으로 주사하여 인비보에서 EGR1 과 SREBP1의 역할을 규명하였다(도 14의 E). 파토스타틴은 동맥 누출, PLVAP 발현(도 14의 F-G), 및 α-Dll4 Ab에 의해 유도된 세포횡단 소낭(transcellular vesicle)의 숫자를 감소시키는데(도 15), 이는 Dll4 신호전달이 망막 EC 내에서 SREBP1을 억제하여 트랜스시토시스를 제한하는 것을 나타낸다. 이와 대조적으로, MMA는 동맥 과투과성(hyperpermeability)을 강화시켰고 이는 EGR1 활성화에 의한 음성 피드백(negative feedback) 조절의 억제로 인한 트랜스사이토시스의 활성화를 의미한다(도 14의 F 및 G).Next, after intravitreal α-Dll4 Ab injection, systemic injection of mitomycin A (mitomycin A (MMA), EGR1 inhibitor) or fatostatin (SREBP1 inhibitor) to elucidate the role of EGR1 and SREBP1 in vivo (E of FIG. 14). Patostatin reduces arterial leakage, PLVAP expression (FIG. 14 FG), and the number of transcellular vesicles induced by α-Dll4 Ab (FIG. 15), indicating that Dll4 signaling is It is shown to limit transcytosis by inhibiting SREBP1. In contrast, MMA enhanced arterial hyperpermeability, indicating activation of transcytosis due to inhibition of negative feedback regulation by EGR1 activation (FIG. 14F and G).
실시예 5. 전사체 프로파일링(transcriptomic profiling)을 통한 EC에서 고혈압과 Dll4 간의 연관성 예측Example 5. Prediction of association between hypertension and Dll4 in EC through transcriptomic profiling
최고 인리치된 유전자 세트(top enriched gene set)(C5 카테고리)는 '동맥 혈압(BP) 조절'과 연관되어 있고, Dll4-억제된 망막 EC에서의 최상위(top-ranked) 경로 중 하나는 BP 증가에 결정적인'EDN1(endothelin-1) signaling'이었다(도 16의 A-C). 일관되게, Dll4 억제는B P-증가 유전자(EDN1,EDN2,F2R,EMG, 및ECE)를 상향 조절하였으나 BP-저하ADORA1(adenosine receptor A)를 하향 조절하였다(도 16의 D-E). 이러한 데이터는 Dll4 억제가 망막 EC에서 고혈압과 관련이 있는 것을 나타낸다. 그러나, α-Dll4 Ab를 이용한 안구 처치는 전신 혈압에 아무런 영향을 미치치 않았다(도 17의 C).The top enriched gene set (C5 category) was associated with 'arterial blood pressure (BP) regulation', and one of the top-ranked pathways in Dll4-repressed retinal EC was BP increased. was decisive for 'EDN1 (endothelin-1) signaling' (FIG. 16 AC). Consistently, Dll4 inhibition upregulated B P-increasing genes (EDN1 ,EDN2 ,F2R ,EMG , andECE ) but down-regulated BP-lowering adenosine receptor A (ADORA1 ) ( FIG. 16 DE ). These data indicate that Dll4 inhibition is associated with hypertension in retinal EC. However, ocular treatment with α-Dll4 Ab had no effect on systemic blood pressure (FIG. 17C).
실시예 6. Sox17과 Dll4를 하향 조절을 통해 망막에서 비출혈 누출을 유도하는 고혈압Example 6. Hypertension that induces epistaxis in the retina through downregulation of Sox17 and Dll4
실시예 6.1 Dll4와 고혈압간의 관계Example 6.1 Relationship between Dll4 and hypertension
GSEA 결과, 마우스에서 Dll4 차단과 유사하게, 인간의 심한 고혈압은 망막에서 주위-동맥성 누출(peri-arterial leakage)을 유발한다. Dll4와 고혈압 간의 관계를 설명하기 위해, 참고예 2의 방법과 같이 급성 ATⅡ 스트레스가 발생되도록 성인 마우스에 ATⅡ를 만성적으로 주입하여 고혈압-유도 망막 부종 모델(hypertension-induced retinal edema model)을 제조하였다(도 17의 A-F).GSEA results, similar to Dll4 blockade in mice, severe hypertension in humans induces peri-arterial leakage in the retina. To explain the relationship between Dll4 and hypertension, a hypertension-induced retinal edema model was prepared by chronically injecting ATII into adult mice to generate acute ATII stress as in the method of Reference Example 2 ( 17 AF).
심각한 고혈압 환자들에게 가끔 발견되는 시력을 위협하는 망막 부종(retinal edema)(황반 부종(macular edema)을 포함)의 일부는 삼출(exudation)을 동반하는 비출혈 BRB 붕괴가 특징이다. 특히, ATⅡ-유도된 고혈압, Sox17 결실, 및 α-Dll4 Ab 처리는 공통적으로 비출혈 누출을 유발하였다. 대조적으로, 당뇨 망막병증 모델에서 α-PDGFRβ Ab 처리에 의해 심각한 접합 붕괴로 인한 방대한 양의 출혈 누출(hemorrhagic leakage)이 발생하였다(도 17의 G-I). 일반적인 누출 표현형은 고혈압-유도된 누출이 메커니즘적으로 Sox17과 Dll4와 연관되어 있는 것을 시사한다.Some of the vision-threatening retinal edemas (including macular edema) that are occasionally found in patients with severe hypertension are characterized by non-haemorrhagic BRB disruption with exudation. In particular, ATII-induced hypertension, Sox17 deletion, and α-Dll4 Ab treatment commonly induced epistaxis. In contrast, massive amounts of hemorrhagic leakage due to severe junction disruption occurred by α-PDGFRβ Ab treatment in the diabetic retinopathy model (FIG. 17G-I). The general leak phenotype suggests that hypertension-induced leak is mechanistically associated with Sox17 and Dll4.
실시예 6.2 고혈압과 활성산소종(ROS)의 관계Example 6.2 Relationship between hypertension and reactive oxygen species (ROS)
ATⅡ-유도된 고혈압은 망막 동맥에서 내피 Sox17과 Dll4를 억제하였다(도 18의 A-C). ATⅡ 처리는 또한 HREC에서 Sox17과 Dll4를 억제하고 SREBP1과 VEGFR2를 상향조절하였다(도 18의 E-G; 도 19의 M-O). ATⅡ는 EC에서 활성산소종(reactive oxygen species(ROS))을 생성하기 때문에 HREC를 NAC(antioxidant N-acetyl cysteine)로 처리하였다. NAC는 세포 내 ROS를 감소시켰고 ATⅡ-처리된 HREC에서 Sox17, Dll4, SREBP1, 및 VEGFR2의 수준을 상당히 회복시켰다(도 18의 E-G). 이러한 결과는 고혈압 손상(hypertensive insult)이 ROS를 통해 Sox17을 감소시킬 수 있고 그 뒤에 하위(downstream) 분자의 발현 변화를 유도할 수 있는 것을 시사한다.ATII-induced hypertension inhibited endothelial Sox17 and Dll4 in retinal arteries ( FIGS. 18A-C ). ATII treatment also inhibited Sox17 and Dll4 in HREC and upregulated SREBP1 and VEGFR2 (E-G in FIG. 18; M-O in FIG. 19). Since ATII generates reactive oxygen species (ROS) in EC, HREC was treated with NAC (antioxidant N-acetyl cysteine). NAC reduced intracellular ROS and significantly restored the levels of Sox17, Dll4, SREBP1, and VEGFR2 in ATII-treated HREC ( FIGS. 18E-G ). These results suggest that hypertensive insult can reduce Sox17 through ROS and subsequently induce changes in the expression of downstream molecules.
망막에서 ROS의 효과를 검증하였다. 개선된 항산화 능력을 갖는 PEG-빌리루빈은 ATⅡ-주입된 마우스로부터 망막 동맥에서 Sox17과 Dll4의 수준을 회복시키고, PLVAP와 caveolin-1 발현을 억제하였다(도 19의 A-F, 도 19의 I-K). PEG-빌리루빈은 또한 망막 부종과 추적자의 혈관외유출을 약화시켰다(도 19의 G-H, J, 및 L). 게다가, 장기간의 NAC의 섭취는 고혈압 망막에서 EB 누출과 동맥 PLVAP 발현을 감소시켰다(도 20).The effect of ROS on the retina was verified. PEG-bilirubin with improved antioxidant capacity restored the levels of Sox17 and Dll4 in retinal arteries from ATII-injected mice, and inhibited PLVAP and caveolin-1 expression (FIG. 19A-F, FIG. 19I-K). PEG-bilirubin also attenuated retinal edema and tracer extravasation (G-H, J, and L in Figure 19). Moreover, long-term ingestion of NAC reduced EB leakage and arterial PLVAP expression in the hypertensive retina ( FIG. 20 ).
EB 누출의 규모는 Dll4 면역 반응성(immunoreactivity)과 정반대의 관계를 나타내었고, Dll4 감소가 고혈압 유도된-BRB 붕괴의 메커니즘 중 하나임을 제시한다(도 18의 D). 고혈압 모델의 EC에서 Notch 활성의 획득(HTN1ICDiOE)은 망막 동맥에서 세포횡단 소낭(transcellular vesicle), PLVAP 발현, 고혈압-유도된 EB 누출을 감소시켰다(도 18의 H-K). 게다가, 파토스타틴 주사에 의한 SREBP1 억제는 α-Dll4 Ab 처리와 유사한 ATII 주입 마우스(HT 마우스)의 망막에서의 PLVAP 발현, 망막 부종, 및 EB 누출을 감소시켰다(도 21). ATⅡ-주입, 관련된 Sox17 결실, 및 Dll4 봉쇄(blockade)는 망막 EC에서 Edu, Ki67, 및 절단된 caspase-3 의 검출 가능한 면역염색을 초래하지 않았다(도 22). Edu, Ki67에 대한 면역염색은 proliferation 평가에 활용되고, Caspase-3 에 대한 면역염색은 apoptosis 평가에 활용된다. 그러므로, 반응적 증식(reactive proliferation)이 뒤따르는 EC에 대한 아포토시스 손상은 ATⅡ-유도된 망막 누출에 관여하지 않는다. 이러한 발견은 망막에서 고혈압 유발 병적인 누출의 근본이 되는 메커니즘 중에 하나로서, SREBP1-매개 트랜스시토시스가 뒤따르는 Sox17과 Dll4의 감소를 시사한다.The magnitude of EB leakage showed the opposite relationship with Dll4 immunoreactivity, suggesting that Dll4 reduction is one of the mechanisms of hypertension-induced-BRB decay ( FIG. 18D ). Acquisition of Notch activity in EC of hypertensive model (HTN1ICDiOE ) reduced transcellular vesicles, PLVAP expression, hypertension-induced EB leakage in retinal arteries (HK in FIG. 18 ). Moreover, SREBP1 inhibition by patostatin injection reduced PLVAP expression, retinal edema, and EB leakage in the retina of ATII-injected mice (HT mice) similar to α-Dll4 Ab treatment ( FIG. 21 ). ATII-injection, associated Sox17 deletion, and Dll4 blockade did not result in detectable immunostaining of Edu, Ki67, and cleaved caspase-3 in retinal ECs ( FIG. 22 ). Immunostaining for Edu and Ki67 is used for proliferation evaluation, and immunostaining for Caspase-3 is used for apoptosis evaluation. Therefore, apoptotic damage to ECs followed by reactive proliferation is not involved in ATII-induced retinal leakage. These findings suggest a decrease in Sox17 and Dll4 followed by SREBP1-mediated transcytosis as one of the mechanisms underlying hypertension-induced pathological leakage in the retina.
실시예 7. 고혈압 망막병증 환자의 동맥 주위 표피 누출(Peri-arterial superficial leakage)Example 7. Peri-arterial superficial leakage in hypertensive retinopathy patients
임상적 타당성(clinical relevance)을 위한 망막에서 누출 패턴을 알기 위해, HR(hypertensive retinopathy) 환자에 대해 광 간섭성 단층촬영기술(optical coherence tomography(OCT)) 및 망막 혈관 조영술(retinal angiography)을 수행하였다. 당뇨 망막병증 환자들이 얼룩진 모세혈관 누출과 심혈관층(deep vascular layer) 부종을 보여주는 반면에, HR환자(표 2)의 상당수는 신경절 세포 복합체(ganglion cell complex)를 포함하는 표피 혈관층(superficial vascular layer)에 특이적인 부종 및 동맥주위 누출을 나타내었고, 이는 α-Dll4 Ab 처리되었거나 고혈압이 유도된 마우스의 망막과 유사하다(도 23).In order to know the leakage pattern in the retina for clinical relevance, optical coherence tomography (OCT) and retinal angiography were performed on HR (hypertensive retinopathy) patients. . While diabetic retinopathy patients show speckled capillary leakage and edema of the deep vascular layer, a significant proportion of HR patients (Table 2) have a superficial vascular layer containing a ganglion cell complex. ) showed specific edema and periarterial leakage, which is similar to the retina of mice treated with α-Dll4 Ab or hypertension induced ( FIG. 23 ).
서로 상이한 누출 위치는 HR과 당뇨 망막병증 사이의 혈관 누출의 실질적인 병리 생리학적 차이점을 제시한다. 이것과 함께, 고혈압이지만 당뇨는 아닌 스트레스는 마우스 망막의 표피(superficial) 동맥에서 Dll4 발현을 감소시켰으나, Dll4는 심혈관에서는 검출되지 않았다(도 24).Different leak locations suggest substantial pathophysiological differences in vascular leak between HR and diabetic retinopathy. Together with this, hypertension but not diabetic stress reduced Dll4 expression in the superficial arteries of the mouse retina, but Dll4 was not detected in the cardiovascular system ( FIG. 24 ).
풍부한 누출은 망막 하액(subretinal fluid; SRF)의 축적으로 이어질 수 있다. 부종이 나타나지 않는 환자(Group 3) 대비 표피 부종을 갖는 환자(Group 1 및 2)의 하위집합에서 SRF 축적이 두드러졌다(도 25의 A 및 B). 게다가, 심혈관 층이 아닌 표피 혈관층의 두께는 HR에 있는 SRF의 높이와 유의하게 양의 상관관계가 있었다(도 25의 C). α-Dll4 Ab 처리된 마우스 또는 고혈압인 마우스 망막에서 SRF는 맥락막 누출 보다 망막 혈관에서 누출에 의해서 축적될 가능성이 있다(도 25의 D). 이러한 누출 패턴은 Dll4 감소와 이후의 표피 혈관 누출은, 누출의 기원이 논란의 여지가 있고 아직 명확히 정의되지 않은 고혈압-유도된 망막 부종(황반 부종 포함)에 기여할 수 있는 것을 의미한다.Abundant leakage can lead to the accumulation of subretinal fluid (SRF). SRF accumulation was prominent in a subset of patients with epidermal edema (
실시예 8. Dll4 억제 또는 고혈압 망막에서, BRB 완전성을 회복할 수 있는 VEGF-VEGFR2 경로의 차단(blocking)Example 8. Blocking of the VEGF-VEGFR2 pathway capable of restoring BRB integrity in Dll4 inhibition or hypertensive retina
활성화된 VEFG 신호전달은 몇몇의 망막 질환을 포함하는 내피 질환(endothelial disorder)에서 혈관 누출의 주요원인이다. GSEA는 Dll4 억제 망막 EC에서 'VEFGR 신호전달 경로'의 인리치먼트를 나타내었다(도 26의 A). VEFGR2 면역염색은 α-Dll4 Ab 처리된 망막의 동맥 EC에서 강력하였으나 IgG 처리된 망막에서 검출할 수 없었고, 망막 용해물의 면역블롯 분석에서도 VEGFR2의 상향조절을 확인하였다(도 26의 B-E). 이전에 보고된 바와 같이 전사적 수준에서 VEGFR2 발현의 Notch 조절과 일치하여, VEGFR2 수준은 α-Dll4 Ab 처리 후 망막 EC에서 Notch 타겟 유전자들의 하향조절 이후에 증가하였다(도 26의 F). IgG 가 아닌 VEGF는 눈에 주사되어 망막 혈관에서 PLVAP의 상향조절 및 EB 혈관외유출을 유발하였고(도 27), 이는 트랜스시토시스-매개 망막 누출에서 VEGF 신호전달을 암시한다. 항-VEGFR2 항체(DC101) 또는 VEGF-trap(aflibercept)의 유리체내 주사는 Dll4 봉쇄-유발된 동맥 EB 누출, 망막 EC에서의 세포횡단 소낭의 수, 그리고 동맥 PLVAP 발현을 감소시켰고(도 26의 G-L), 이는 Dll4 억제에서 트랜스시토시스 매개 망막 누출의 근본적인 기전 중 하나로서 VEGFR2 유도를 제안한다.Activated VEFG signaling is a major cause of vascular leakage in endothelial disorders, including several retinal diseases. GSEA showed the enrichment of the 'VEFGR signaling pathway' in Dll4-inhibited retinal ECs ( FIG. 26A ). VEFGR2 immunostaining was strong in arterial EC of α-Dll4 Ab-treated retina, but could not be detected in IgG-treated retina, and immunoblot analysis of retinal lysate also confirmed upregulation of VEGFR2 (FIG. 26 B-E). Consistent with Notch regulation of VEGFR2 expression at the transcriptional level as previously reported, VEGFR2 levels increased after downregulation of Notch target genes in retinal ECs after α-Dll4 Ab treatment (FIG. 26F). VEGF, but not IgG, was injected into the eye to induce upregulation of PLVAP and EB extravasation in retinal vessels ( FIG. 27 ), suggesting VEGF signaling in transcytosis-mediated retinal leakage. Intravitreal injection of anti-VEGFR2 antibody (DC101) or VEGF-trap (aflibercept) reduced Dll4 blockade-induced arterial EB leakage, number of transcellular vesicles in retinal EC, and arterial PLVAP expression (GL of Figure 26). ), suggesting VEGFR2 induction as one of the fundamental mechanisms of transcytosis-mediated retinal leakage in Dll4 inhibition.
동맥 VEGFR2 발현은 또한 고혈압 망막에서 상향조절되었다(도 26의 B-E). α-VEGFR2 Ab는 고혈압 유발 EB 누출, 표피 혈관 층의 두께, 그리고 SRF의 높이를 상당히 감소시켰다(도 28). 내피 Notch 활성의 획득은 VEGFR2와 독립적인 하위 메커니즘의 존재를 암시하는 이러한 병리학적인 특징을 추가로 억제하였다. 비록 VEFG 신호전달이 Dll4 억제 및 고혈압인 조건 하에서 활성화되었으나, 혈관신생 표현형(angiogenic phenotype)은 관찰되지 않았다. 이를 종합하면, Dll4 신호전달은 정상 상태(steady state)에서 VEGFR2를 억제하여 BRB 항상성을 유지하는 것을 나타내고, VEGF-VEGFR2 신호전달의 봉쇄는 현재 일치된 치료상의 의견이 없는 고혈압 연관 망막 부종을 치료하기 위해 쉽게 적용할 수 있는 치료 수단일 될 수 있는 것을 제시한다.Arterial VEGFR2 expression was also upregulated in the hypertensive retina ( FIGS. 26B-E ). α-VEGFR2 Ab significantly reduced hypertension-induced EB leakage, epidermal vascular layer thickness, and SRF height ( FIG. 28 ). Acquisition of endothelial Notch activity further suppressed this pathological feature suggesting the existence of a sub-mechanism independent of VEGFR2. Although VEFG signaling was activated under the conditions of Dll4 inhibition and hypertension, an angiogenic phenotype was not observed. Taken together, Dll4 signaling indicates that BRB homeostasis is maintained by inhibiting VEGFR2 in a steady state, and blockade of VEGF-VEGFR2 signaling is currently used to treat hypertension-associated retinal edema, which does not have a consistent therapeutic opinion. It suggests what can be a treatment means that can be easily applied for
SREBP1과 VEGF 신호전달이 트랜스시토시스-매개 BRB 붕괴에 중요하게 연관되어 있기 때문에, 이들이 병리 생리학적으로 함께 작용하는 방법을 살펴보았다. α-Dll4 Ab 또는 VEGF를 유리체내 처리하면 생체 내의 망막 동맥에서 SREBP1을 상향 조절시켰다(도 29의 A-E). SREBP1는 처음에 전구체의 형태로 생성되고 그 다음 성숙한 형태로 절단되며 핵으로 이동하여 그 기능을 발휘한다. 면역블롯은 α-Dll4 Ab처리가 망막 용해물에서 SREBP1의 전구체와 성숙한 형태 모두를 증가시킨다는 것을 보여준다(도 29의 B-D). 또한, VEFG 처리는 두가지 형태를 모두 증가시켰지만, 전구체 SREBP1 보다 성숙한 SREBP1을 더 증가시키고 SREBP1의 핵 위치화(localization)를 촉진시켰다(도 29의 F-I). α-Notch1 Ab를 이용한 Notch 억제는 HREC에서 SREBP1 발현 및 핵 위치화를 증가시켰으며 이는 α-VEGFR2 Ab 와의 공동-처리에 의해 약화되었다(도 29의 G-I, 및 도 30).Since SREBP1 and VEGF signaling are critically involved in transcytosis-mediated BRB decay, we investigated how they work together pathophysiologically. Intravitreal treatment with α-Dll4 Ab or VEGF up-regulated SREBP1 in retinal arteries in vivo ( FIGS. 29A-E ). SREBP1 is first produced in the form of a precursor, then cleaved to a mature form, and translocated to the nucleus to exert its function. Immunoblots show that α-Dll4 Ab treatment increases both the precursor and mature forms of SREBP1 in retinal lysates (Fig. 29B-D). In addition, VEFG treatment increased both forms, but increased mature SREBP1 more than the precursor SREBP1 and promoted nuclear localization of SREBP1 (FIG. 29 F-I). Notch inhibition with α-Notch1 Ab increased SREBP1 expression and nuclear localization in HREC, which was attenuated by co-treatment with α-VEGFR2 Ab (G-I in Fig. 29, and Fig. 30).
이러한 발견들은 저해된 Dll4-Notch 신호전달이 VEGF 신호전달을 통해 SREBP1의 핵으로의 위치변경(translocation)을 촉진시키고, SREBP1 발현을 증가시키는 것을 제시한다.These findings suggest that inhibited Dll4-Notch signaling promotes translocation of SREBP1 to the nucleus through VEGF signaling and increases SREBP1 expression.
<110> KOREA ADVANCED INSTITUTE OF SCIENCE AND TECHNOLOGY<120> Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage<130> DPP20200752KR<160> 34<170> KoPatentIn 3.0<210> 1<211> 20<212> DNA<213> Artificial Sequence<220><223> PECAM_Forward<400> 1ggaaagccaa ggccaaacag 20<210> 2<211> 22<212> DNA<213> Artificial Sequence<220><223> PECAM_Reverse<400> 2cataaccgta atggctgttg gc 22<210> 3<211> 19<212> DNA<213> Artificial Sequence<220><223> VECAD_Forward<400> 3aaccatgaca acaccgcca 19<210> 4<211> 20<212> DNA<213> Artificial Sequence<220><223> VECAD_Reverse<400> 4cgttgtctga gatgagcacg 20<210> 5<211> 20<212> DNA<213> Artificial Sequence<220><223> ACTA2_Forward<400> 5ccagacatca gggagtaatg 20<210> 6<211> 20<212> DNA<213> Artificial Sequence<220><223> ACTA2_Reverse<400> 6gctcgttata gaaagagtgg 20<210> 7<211> 21<212> DNA<213> Artificial Sequence<220><223> PLVAP_Forward<400> 7gctggtacta cctgcgctat t 21<210> 8<211> 20<212> DNA<213> Artificial Sequence<220><223> PLVAP_Reverse<400> 8cctgtgaggc agatagtcca 20<210> 9<211> 21<212> DNA<213> Artificial Sequence<220><223> CAV-1_Forward<400> 9gacgacgtgg tcaagattga c 21<210> 10<211> 20<212> DNA<213> Artificial Sequence<220><223> CAV-1_Reverse<400> 10gatgccgtcg aaactgtgtg 20<210> 11<211> 20<212> DNA<213> Artificial Sequence<220><223> CAV-2_Forward<400> 11atctcaagct aggcttcgag 20<210> 12<211> 21<212> DNA<213> Artificial Sequence<220><223> CAV-2_Reverse<400> 12ggtcaggaac ttgtacatca c 21<210> 13<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN1_Forward<400> 13gtcatgatct accagccca 19<210> 14<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN1_Reverse<400> 14gaaagggctc agtctcagg 19<210> 15<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN2_Forward<400> 15gagactggag aacaaccac 19<210> 16<211> 20<212> DNA<213> Artificial Sequence<220><223> CAVIN2_Reverse<400> 16gggatctcac tttcttcctg 20<210> 17<211> 20<212> DNA<213> Artificial Sequence<220><223> CAVIN3_Forward<400> 17gctcttcaag gaggagactg 20<210> 18<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN3_Reverse<400> 18catcctctgg ctgatctgg 19<210> 19<211> 23<212> DNA<213> Artificial Sequence<220><223> VEGFR1_Forward<400> 19cttctcacag gatatggctc agg 23<210> 20<211> 22<212> DNA<213> Artificial Sequence<220><223> VEGFR1_Reverse<400> 20ctcccctctg cacttgagaa ag 22<210> 21<211> 20<212> DNA<213> Artificial Sequence<220><223> VEGFR2_Forward<400> 21ctctgtgggt ttgcctggcg 20<210> 22<211> 22<212> DNA<213> Artificial Sequence<220><223> VEGFR2_Reverse<400> 22gctgtcccct gcaagtaatc tg 22<210> 23<211> 22<212> DNA<213> Artificial Sequence<220><223> VEGFR3_Forward<400> 23gcagccagat attacaactg tg 22<210> 24<211> 23<212> DNA<213> Artificial Sequence<220><223> VEGFR3_Reverse<400> 24catggaggct ttgtaggttg tag 23<210> 25<211> 22<212> DNA<213> Artificial Sequence<220><223> Hes1_Forward<400> 25gaaagatagc tcccggcatt cc 22<210> 26<211> 21<212> DNA<213> Artificial Sequence<220><223> Hes1_Reverse<400> 26ggtatttccc caacacgctc g 21<210> 27<211> 20<212> DNA<213> Artificial Sequence<220><223> Hes2_Forward<400> 27cgaagttgga gaaggcagac 20<210> 28<211> 20<212> DNA<213> Artificial Sequence<220><223> Hes2_Reverse<400> 28gctattcaaa ggcccaggtg 20<210> 29<211> 22<212> DNA<213> Artificial Sequence<220><223> Hey1_Forward<400> 29ggagaggcat catcgagaag cg 22<210> 30<211> 23<212> DNA<213> Artificial Sequence<220><223> Hey1_Reverse<400> 30ggtgatccac agtcatctgc aag 23<210> 31<211> 23<212> DNA<213> Artificial Sequence<220><223> Hey2_Forward<400> 31ggatctgcca agttagaaaa ggc 23<210> 32<211> 22<212> DNA<213> Artificial Sequence<220><223> Hey2_Reverse<400> 32gggcatcaaa gtagccttta cc 22<210> 33<211> 24<212> DNA<213> Artificial Sequence<220><223> GAPDH_Forward<400> 33agtgtttcct cgtcccgtag acaa 24<210> 34<211> 28<212> DNA<213> Artificial Sequence<220><223> GAPDH_Reverse<400> 34ggagtcatac tggaacatgt agaccatg 28<110> KOREA ADVANCED INSTITUTE OF SCIENCE AND TECHNOLOGY<120> Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage<130> DPP20200752KR<160> 34<170> KoPatentIn 3.0<210> 1<211> 20<212> DNA<213> Artificial Sequence<220><223> PECAM_Forward<400> 1ggaaagccaa ggccaaacag 20<210> 2<211> 22<212> DNA<213> Artificial Sequence<220><223> PECAM_Reverse<400> 2cataaccgta atggctgttg gc 22<210> 3<211> 19<212> DNA<213> Artificial Sequence<220><223> VECAD_Forward<400> 3aaccatgaca acaccgcca 19<210> 4<211> 20<212> DNA<213> Artificial Sequence<220><223> VECAD_Reverse<400> 4cgttgtctga gatgagcacg 20<210> 5<211> 20<212> DNA<213> Artificial Sequence<220><223> ACTA2_Forward<400> 5ccagacatca gggagtaatg 20<210> 6<211> 20<212> DNA<213> Artificial Sequence<220><223> ACTA2_Reverse<400> 6gctcgttata gaaagagtgg 20<210> 7<211> 21<212> DNA<213> Artificial Sequence<220><223> PLVAP_Forward<400> 7gctggtacta cctgcgctat t 21<210> 8<211> 20<212> DNA<213> Artificial Sequence<220><223> PLVAP_Reverse<400> 8cctgtgaggc agatagtcca 20<210> 9<211> 21<212> DNA<213> Artificial Sequence<220><223> CAV-1_Forward<400> 9gacgacgtgg tcaagatga c 21<210> 10<211> 20<212> DNA<213> Artificial Sequence<220><223> CAV-1_Reverse<400> 10gatgccgtcg aaactgtgtg 20<210> 11<211> 20<212> DNA<213> Artificial Sequence<220><223> CAV-2_Forward<400> 11atctcaagct aggcttcgag 20<210> 12<211> 21<212> DNA<213> Artificial Sequence<220><223> CAV-2_Reverse<400> 12ggtcaggaac ttgtacatca c 21<210> 13<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN1_Forward<400> 13gtcatgatct accagccca 19<210> 14<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN1_Reverse<400> 14gaaagggctc agtctcagg 19<210> 15<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN2_Forward<400> 15gagactggag aacaaccac 19<210> 16<211> 20<212> DNA<213> Artificial Sequence<220><223> CAVIN2_Reverse<400> 16gggatctcac tttcttcctg 20<210> 17<211> 20<212> DNA<213> Artificial Sequence<220><223> CAVIN3_Forward<400> 17gctcttcaag gaggagactg 20<210> 18<211> 19<212> DNA<213> Artificial Sequence<220><223> CAVIN3_Reverse<400> 18catcctctgg ctgatctgg 19<210> 19<211> 23<212> DNA<213> Artificial Sequence<220><223> VEGFR1_Forward<400> 19cttctcacag gatatggctc agg 23<210> 20<211> 22<212> DNA<213> Artificial Sequence<220><223> VEGFR1_Reverse<400> 20ctcccctctg cacttgagaa ag 22<210> 21<211> 20<212> DNA<213> Artificial Sequence<220><223> VEGFR2_Forward<400> 21ctctgtgggt ttgcctggcg 20<210> 22<211> 22<212> DNA<213> Artificial Sequence<220><223> VEGFR2_Reverse<400> 22gctgtcccct gcaagtaatc tg 22<210> 23<211> 22<212> DNA<213> Artificial Sequence<220><223> VEGFR3_Forward<400> 23gcagccagat attacaactg tg 22<210> 24<211> 23<212> DNA<213> Artificial Sequence<220><223> VEGFR3_Reverse<400> 24catggaggct ttgtaggttg tag 23<210> 25<211> 22<212> DNA<213> Artificial Sequence<220><223> Hes1_Forward<400> 25gaaagatagc tcccggcatt cc 22<210> 26<211> 21<212> DNA<213> Artificial Sequence<220><223> Hes1_Reverse<400> 26ggtatttccc caacacgctc g 21<210> 27<211> 20<212> DNA<213> Artificial Sequence<220><223> Hes2_Forward<400> 27cgaagttgga gaaggcagac 20<210> 28<211> 20<212> DNA<213> Artificial Sequence<220><223> Hes2_Reverse<400> 28gctattcaaa ggcccaggtg 20<210> 29<211> 22<212> DNA<213> Artificial Sequence<220><223> Hey1_Forward<400> 29ggagaggcat catcgagaag cg 22<210> 30<211> 23<212> DNA<213> Artificial Sequence<220><223> Hey1_Reverse<400> 30ggtgatccac agtcatctgc aag 23<210> 31<211> 23<212> DNA<213> Artificial Sequence<220><223> Hey2_Forward<400> 31ggatctgcca agttagaaaa ggc 23<210> 32<211> 22<212> DNA<213> Artificial Sequence<220><223> Hey2_Reverse<400> 32gggcatcaaa gtagccttta cc 22<210> 33<211> 24<212> DNA<213> Artificial Sequence<220><223> GAPDH_Forward<400> 33agtgtttcct cgtcccgtag acaa 24<210> 34<211> 28<212> DNA<213> Artificial Sequence<220><223> GAPDH_Reverse<400> 34ggagtcatac tggaacatgt agaccatg 28
Claims (7)
Translated fromKoreanA pharmaceutical composition for preventing or treating hypertensive retinal edema, comprising fatostatin as an active ingredient.
The pharmaceutical composition according to claim 1, wherein the pharmaceutical composition is for application to a patient who has nonhemorrhagic vascular leakage in the retinal epidermal vascular layers (SVL).
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020200042429AKR102377899B1 (en) | 2020-04-07 | 2020-04-07 | Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020200042429AKR102377899B1 (en) | 2020-04-07 | 2020-04-07 | Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20210124854A KR20210124854A (en) | 2021-10-15 |
| KR102377899B1true KR102377899B1 (en) | 2022-03-23 |
Family
ID=78151145
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020200042429AActiveKR102377899B1 (en) | 2020-04-07 | 2020-04-07 | Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR102377899B1 (en) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116179543B (en)* | 2022-07-06 | 2024-08-13 | 四川农业大学 | CRISPR-specific targeting pig Cavin-1 gene-based sgRNA and application thereof |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101704914B1 (en) | 2015-08-17 | 2017-02-09 | 강원대학교산학협력단 | A pharmaceutical composition comprising dammarenediol-ii for preventing or treating diseases by diabetic vascular leakage |
- 2020
- 2020-04-07KRKR1020200042429Apatent/KR102377899B1/enactiveActive
Non-Patent Citations (3)
| Title |
|---|
| HAI YAN QUAN et al, Betulinic acid alleviates non-alcoholic fatty liver by inhibiting SREBP1 activity via the AMPK-mTOR-SREBP signaling pathway, Biochemical Pharmacology, Vol.85, pp.1330-1340 (2013) |
| MANAR A. NADER et al, Effect of betulinic acid on neutrophil recruitment and inflammatory mediator expression in lipopolysaccharide-induced lung inflammation in rats, European Journal of Pharmaceutic |
| ODYSSEAS GEORGIADIS et al, Bilateral hypertensive retinopathy complicated with retinal neovascularization: panretinal photocoagulation or intravitreal anti-vegf treatment, Case Rep Ophthalmol, Vol.5, |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20210124854A (en) | 2021-10-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Hashimoto et al. | GEP100-Arf6-AMAP1-cortactin pathway frequently used in cancer invasion is activated by VEGFR2 to promote angiogenesis | |
| Bisi et al. | IRSp53 controls plasma membrane shape and polarized transport at the nascent lumen in epithelial tubules | |
| Barro-Soria et al. | Angiotensin-2-mediated Ca2+ signaling in the retinal pigment epithelium: role of angiotensin-receptor-associated-protein and TRPV2 channel | |
| US20150071941A1 (en) | Treatment of ischemic retinopathies | |
| Corum et al. | AKT3 controls mitochondrial biogenesis and autophagy via regulation of the major nuclear export protein CRM-1 | |
| Pose-Utrilla et al. | Excitotoxic inactivation of constitutive oxidative stress detoxification pathway in neurons can be rescued by PKD1 | |
| US20080242608A1 (en) | Methods and compositions for treating and preventing neurologic disorders | |
| Weng et al. | An integral blood–brain barrier in adulthood relies on microglia-derived PDGFB | |
| Wu et al. | Blood vessel epicardial substance (Bves) regulates epidermal tight junction integrity through atypical protein kinase C | |
| US20130333059A1 (en) | Hox compositions and methods | |
| JP6519851B2 (en) | Ophthalmic cell differentiation markers and differentiation control | |
| Yamaguchi et al. | Heterotypic macrophages/microglia differentially contribute to retinal ischaemia and neovascularisation | |
| Wang et al. | Estradiol-mediated small GTP-binding protein GDP dissociation stimulator induction contributes to sex differences in resilience to ferroptosis in takotsubo syndrome | |
| US20160015725A1 (en) | Methods of controlling tumor bioenergetics networks | |
| KR102377899B1 (en) | Pharmaceutical compositions comprising SREBP1 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage | |
| Prabhakar et al. | Reversal of pulmonary veno-occlusive disease phenotypes by inhibition of the integrated stress response | |
| WO2008072781A1 (en) | Method for prevention or treatment of memory disorder in mammal | |
| Lei et al. | Deubiquitinase USP9X controls Wnt signaling for CNS vascular formation and barrier maintenance | |
| He et al. | Smoking aggravates neovascular age-related macular degeneration via Sema4D-PlexinB1 axis-mediated activation of pericytes | |
| Boulan et al. | CRMP4-mediated fornix development involves Semaphorin-3E signaling pathway | |
| KR102392808B1 (en) | Pharmaceutical compositions comprising VEGFR2 inhibitor for preventing or treating of diseases caused by hypertension-induced vascular leakage and methods of screening the same | |
| Zhao et al. | Insulin-like growth factor-I reduces stress-induced gastric mucosal injury by inhibiting neutrophil activation in mice | |
| US10188650B2 (en) | Treatment of neurological disorders | |
| Inokuchi et al. | A Na+/Ca2+ exchanger isoform, NCX1, is involved in retinal cell death after N‐methyl‐d‐aspartate injection and ischemia–reperfusion | |
| TW200831898A (en) | Treatment of insulin resistance |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application | Patent event code:PA01091R01D Comment text:Patent Application Patent event date:20200407 | |
| PA0201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | Comment text:Notification of reason for refusal Patent event date:20211014 Patent event code:PE09021S01D | |
| PG1501 | Laying open of application | ||
| E90F | Notification of reason for final refusal | ||
| PE0902 | Notice of grounds for rejection | Comment text:Final Notice of Reason for Refusal Patent event date:20220215 Patent event code:PE09021S02D | |
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | Patent event code:PE07011S01D Comment text:Decision to Grant Registration Patent event date:20220316 | |
| PR0701 | Registration of establishment | Comment text:Registration of Establishment Patent event date:20220318 Patent event code:PR07011E01D | |
| PR1002 | Payment of registration fee | Payment date:20220318 End annual number:3 Start annual number:1 | |
| PG1601 | Publication of registration |