KR101715520B1 - The pharmaceutical compositions for the treatment of gout - Google Patents
The pharmaceutical compositions for the treatment of goutDownload PDFInfo
- Publication number
- KR101715520B1 KR101715520B1KR1020150158811AKR20150158811AKR101715520B1KR 101715520 B1KR101715520 B1KR 101715520B1KR 1020150158811 AKR1020150158811 AKR 1020150158811AKR 20150158811 AKR20150158811 AKR 20150158811AKR 101715520 B1KR101715520 B1KR 101715520B1
- Authority
- KR
- South Korea
- Prior art keywords
- weight
- parts
- pharmaceutical composition
- gout
- present
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/88—Liliopsida (monocotyledons)
- A61K36/906—Zingiberaceae (Ginger family)
- A61K36/9066—Curcuma, e.g. common turmeric, East Indian arrowroot or mango ginger
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/12—Ketones
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/06—Fungi, e.g. yeasts
- A61K36/07—Basidiomycota, e.g. Cryptococcus
- A61K36/076—Poria
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/28—Asteraceae or Compositae (Aster or Sunflower family), e.g. chamomile, feverfew, yarrow or echinacea
- A61K36/284—Atractylodes
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/54—Lauraceae (Laurel family), e.g. cinnamon or sassafras
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/74—Rubiaceae (Madder family)
- A61K36/744—Gardenia
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/79—Schisandraceae (Schisandra family)
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/88—Liliopsida (monocotyledons)
- A61K36/884—Alismataceae (Water-plantain family)
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Alternative & Traditional Medicine (AREA)
- Microbiology (AREA)
- Medical Informatics (AREA)
- Botany (AREA)
- Biotechnology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Medicines Containing Plant Substances (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean본 발명은 통풍 치료용 약학 조성물에 관한 것으로, 더욱 상세하게는 울금 100 중량부에 대해 오미자 70 ~ 90 중량부, 인지 70 ~ 90 중량부, 치자 70 ~ 90 중량부, 택사 50 ~ 70 중량부, 저령 50 ~ 70 중량부, 백봉령 50 ~ 70 중량부, 백출 50 ~ 60 중량부 및 육계 10 ~ 30 중량부를 혼합한 약재의 추출물을 유효성분으로 포함하는 것을 특징으로 하는 통풍 치료용 약학 조성물에 관한 것이다.The present invention relates to a pharmaceutical composition for the treatment of gout. More particularly, the present invention relates to a pharmaceutical composition for treating gout, which comprises 70 to 90 parts by weight of omija, 70 to 90 parts by weight, 70 to 90 parts by weight of gardenia, 50 to 70 parts by weight, Which comprises 50 to 70 parts by weight of a herbaceous plant, 50 to 70 parts by weight of a bark, 50 to 60 parts by weight of a herbarium and 10 to 30 parts by weight of a herbaceous plant as an active ingredient. .
통풍은 혈액 내에 요산의 농도가 높아지면서 요산염 결정이 관절의 연골, 힘줄, 주위 조직에 침착되는 질병이다. 이러한 현상은 관절의 염증을 유발하여 극심한 통증을 동반하는 재발성 발작을 일으키며, 요산염 결정에 의한 통풍결절이 침착되면서 관절의 변형과 불구가 발생하게 된다. 관절의 이상 외에도 다양한 신장질환을 일으키고 요산에 의해 콩팥에 돌이 생기는 콩팥돌증이 나타나기도 한다.Gout is a disease in which urate crystals are deposited in the cartilage, tendons and surrounding tissues of the joints as the concentration of uric acid in the blood increases. This phenomenon causes inflammation of the joints, resulting in recurrent seizures accompanied by severe pain. Deformations and deformities of the joints occur when the gout nodules are formed by the urate crystals. In addition to abnormal joints, kidney disease caused by various uric acid and kidney stones in the kidneys may appear.
통풍은 나이가 많을수록 혈중 요산 농도가 높을수록 발병할 가능성이 높아지며, 요산은 음식을 통해 섭취되는 퓨린이라는 물질을 인체가 대사하고 남은 산물로 혈액, 체액, 관절액 내에서는 요산염의 형태로 존재한다. 혈액 내 요산 농도가 일정 수치 이상을 넘으면 고요산혈증이라고 하는데, 그 원인을 크게 요산이 과잉 생산되는 경우와 요산의 배설이 감소되는 경우로 나눌 수 있다.The higher the age of gout, the higher the concentration of uric acid in the blood, the more likely it will be. The uric acid is a product of purine metabolism that is ingested through food. It exists in the form of urate in the blood, body fluids and joint fluids. If the concentration of uric acid in the blood exceeds a certain level, it is called hyperuricemia. The cause is hyperuric acid production and decreased excretion of uric acid.
또한 각각의 경우에 대하여 다양한 원인 질환이 있을 수 있지만, 그 원인을 밝힐 수 없는 경우도 있다. 또한 체중 증가는 고요산혈증과 밀접한 연관이 있으며, 통풍은 주로 남성에게서 발생되며, 이는 남성의 콩팥에서 요산 제거 능력이 나이가 들수록 감소하는데 반해 여성은 폐경 이전까지 여성호르몬의 영향으로 요산 제거 능력이 유지되기 때문이다. 고요산혈증을 오래 앓은 환자들은 통풍결절(tophi)이라 불리는 요산 결정체가 귓바퀴 등에 생길 수 있다. 혈액 속에 요산수치가 장기간 높게 올라가면 콩팥, 방광, 각 관절에 침착되고 신장에는 요산결석이 생길 수 있다.In addition, there may be various causative diseases for each case, but the cause of the disease may not be revealed. In addition, weight gain is closely related to hyperuricemia, and gout occurs mainly in men, which decreases with age as the ability to remove uric acid in the male kidneys decreases, while women have the ability to remove uric acid . Patients with long history of hyperuricemia can have uric acid crystals called the gouty nodule (tophi) on the ear orbit. If the uric acid level in the blood goes up for a long time, the kidney, the bladder, and the joints are deposited, and kidney stones may develop uric acid.
통풍은 혈중 요산의 과포화로 인하여 관절과 기타 조직의 monosoudium urate(MUS) 결정의 침착으로 초래되는 염증성 관절염의 형태이다. 또한 통풍과 동반되는 염증은 활성화된 면역세포에 의해 일어나는 일련의 면역반응으로 염증반응이 일어나면 여러가지 염증인자들이 만들어지는데, 염증인자에는 inducible nitric oxide synthase(iNOS)에 의해 만들어지는 nitric oxide(NO)와 cyclooxygenase-2(COX-2)에 의해서 만들어지는 prostagrandin E2(PGE2) 등이 있다. 그 밖에도 염증반응의 전사인자인 nuclear factor-kB(NF-kB)와 TNF-α에 의해 염증이 발생된다. 이들이 통증의 감수성을 높이는 것으로 알려져 있다.Gout is a form of inflammatory arthritis caused by the deposition of monosuduium urate (MUS) crystals in the joints and other tissues due to the supersaturation of serum uric acid. In addition, inflammation accompanied by gout is caused by a series of immune reactions caused by activated immune cells. When the inflammation reaction occurs, various inflammatory factors are produced. The inflammatory factors include nitric oxide (NO) produced by inducible nitric oxide synthase (iNOS) and prostagrandin E2 (PGE2) produced by cyclooxygenase-2 (COX-2). In addition, inflammation is caused by the nuclear factor-kB (NF-kB) and TNF-α, which are transcription factors of the inflammatory response. They are known to increase the sensitivity of pain.
관절의 연골 부위의 연골기질의 대사에는 MMP-1, MMP-3, MMP-13와 같은 matrix methalloproteinase가 중요한 작용을 하고, 또한 염증성 사이토카 인인 인터루킨-1β(IL-1β), IL-6, TNF-α와 그 외 프로스타글란딘, 산화질소(NO) 등의 염증성 물질(inflammatory mediators)들이 관여한다.Molecular methalloproteinases such as MMP-1, MMP-3, and MMP-13 play important roles in the cartilage matrix metabolism of the cartilage of the joints and inflammatory cytokines such as IL-1β, IL-6, -α and other inflammatory mediators such as prostaglandins and nitric oxide (NO).
기계적 자극 등에 의해 활성화된 연골세포(chondrocyte)에서 분비된 MMPs는 연골의 주요 구성 성분인 콜라겐과 프로테오글리칸을 분해시키고, 염증성 사이토카인과 그 외 염증성 물질들은 활성화된 연골세포에서 생성되는 MMPs의 분비를 촉진시켜 MMPs의 활성을 높일 뿐 아니라, 염증세포들을 자극하여 염증을 악화시킨다.MMPs secreted from chondrocyte activated by mechanical stimuli break down collagen and proteoglycans, which are major components of cartilage, and inflammatory cytokines and other inflammatory substances promote the secretion of MMPs produced in activated chondrocytes Not only enhances the activity of MMPs, but also stimulates inflammatory cells to exacerbate inflammation.
국내등록특허공보 제10-0492470호(통풍 치료 및 예방용 조성물), 국내등록특허공보 제10-1346281호(29가지 약재 추출물을 유효성분으로 함유하는 통풍 예방, 개선 또는 치료용 조성물) 및 국내공개특허공보 제10-2013-0130580호(혼합 약재 추출물을 유효성분으로 포함하는 통풍 예방 또는 치료용 조성물 및 그 제조방법)에 대한 기술이 공개되었으나, 상기 종래의 발명은 조성물을 제조함에 있어 사용되는 약재의 종류가 많아 비경제적인 문제점이 있거나, 약재의 종류가 적으나 함량이 적어 통풍 진통 완화 및 항염 작용에 대한 효과가 미미하다는 아쉬움이 있다.Korean Patent Publication No. 10-0492470 (composition for treatment and prevention of gout), Korean Patent Publication No. 10-1346281 (composition for preventing, improving or treating gout containing 29 kinds of extracts as active ingredients) Patent Publication No. 10-2013-0130580 (a composition for preventing or treating gout comprising an active ingredient of a mixed medicinal extract as an active ingredient and a preparation method thereof) has been disclosed. However, the above-mentioned conventional invention is a medicament for use in manufacturing a composition And there are few kinds of medicaments, but the content thereof is small, and thus the effect on relieving gastrointestinal pain and anti-inflammatory effect is insufficient.
상기와 같은 문제점을 해결하기 위해 본 발명은 한방 임상에서 통풍에 대한 항염작용 및 진통완화 효과가 높은 천연물 약재를 조합하여 통풍 치료에 효과가 있으며, 부작용은 적은 약학 조성물을 제조하는 것에 그 목적이 있다.In order to solve the above problems, it is an object of the present invention to provide a pharmaceutical composition which is effective for treatment of gout with a combination of natural herbal medicines having high anti-inflammatory and anti-analgesic effects against gout in oriental medicine and has few side effects .
상기 목적을 달성하기 위해 본 발명에 따른 통풍 치료용 약학 조성물은 울금 100 중량부에 대해 오미자 70 ~ 90 중량부, 인지 70 ~ 90 중량부, 치자 70 ~ 90 중량부, 택사 50 ~ 70 중량부, 저령 50 ~ 70 중량부, 백봉령 50 ~ 70 중량부, 백출 50 ~ 60 중량부 및 육계 10 ~ 30 중량부를 혼합한 약재의 추출물을 유효성분으로 포함하는 것을 특징으로 한다.In order to achieve the above object, the pharmaceutical composition for treating gout according to the present invention comprises 70 to 90 parts by weight of omija, 70 to 90 parts by weight of omija, 70 to 90 parts by weight of germanium, 50 to 70 parts by weight of gum, As an active ingredient, an extract of a medicinal substance obtained by mixing 50 to 70 parts by weight, 50 to 70 parts by weight, 50 to 60 parts by weight, 50 to 70 parts by weight, and 10 to 30 parts by weight of broiler chickens.
또한 상기 혼합한 약재의 추출물은 물 100 중량부에 대해 상기 혼합한 약재 5 ~ 20 중량부를 혼합하여 90 ~ 120℃의 온도에서 2 ~ 5 시간 동안 가열 추출하는 단계, 상기 가열 추출한 추출물을 3,000rpm에서 8 ~ 12분 동안 원심분리하여 침전물을 제거하는 단계, 상기 침전물을 제거한 추출물을 감압 농축하는 단계 및 상기 감압 농축한 농축액을 동결 건조기로 건조하여 약학조성물로 제조하는 단계로 이루어지는 것을 특징으로 한다.The extracted medicinal composition may be prepared by mixing 5 to 20 parts by weight of the medicinal material mixed with 100 parts by weight of water, heating and extracting the mixture at 90 to 120 ° C for 2 to 5 hours, Centrifuging the mixture for 8 to 12 minutes to remove the precipitate, concentrating the extract with the precipitate removed, and drying the concentrated concentrate to a pharmaceutical composition by a freeze drier.
또한 상기 추출물의 유효성분은 커큐민(curcumin), 시잔드린(schisandrin), 카피린(capillin), 게니포사이드(geniposide), 크로신(crocin), 알리솔(alisol), 글루칸(glucan), 에르고스테롤(ergosterol), 파키만(pachyman), 파키믹산(pachymic acid), 아트락틸론(atractylon), 신나믹알데하이드(cinnamic aldehyde) 및 신남산(cinnamic acid)을 포함하는 것을 특징으로 한다.The active ingredients of the extracts may also be selected from the group consisting of curcumin, schisandrin, capillin, geniposide, crocin, alisol, glucan, ergosterol erythromycin, ergosterol, pachyman, pachymic acid, atractylon, cinnamic aldehyde and cinnamic acid.
또한 상기 약학 조성물은 산제, 과립제, 정제, 환제, 캡슐제, 엑스제, 유제, 시럽제, 내용액제, 에어로졸, 트라스트제, 패치제, 비수성용제, 동결건조제제 또는 멸균 주사제로 이루어진 군에서 선택되는 어느 하나의 약제학적 제제로 제제화되는 것을 특징으로 한다.In addition, the pharmaceutical composition may be in the form of a powder, granule, tablet, pill, capsule, excipient, emulsion, syrup, Characterized in that it is formulated into one pharmaceutical preparation.
본 발명에 따라 제조된 약학 조성물은 한방 임상에서 통풍 및 골관절염 치료에 효능이 있는 약재를 사용함으로써 부작용을 최소화하고 항염 및 통증억제 작용이 증대되는 약학 조성물을 통풍 및 골관절염 치료를 목적으로 사용할 수 있는 효과가 있다.The pharmaceutical composition prepared according to the present invention can be used for the treatment of gout and osteoarthritis by minimizing side effects and enhancing the anti-inflammatory and pain-suppressing action by using a medicinal substance which is effective for treating gout and osteoarthritis in oriental medicine. .
도 1은 human chondrocyte cell line인 SW1353에서 MSU에 의해 발현이 증가한 염증 관련 지표들이 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이다.
도 2는 human chondrocyte cell line인 SW1353에서 MSU에 의해 발현이 증가한 matrix metalloproteinase가 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이다.
도 3은 human primary chondrocyte에서 MSU에 의해 발현이 증가한 염증 관련 지표들이 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이다.
도 4는 human primary chondrocyte에서 MSU에 의해 발현이 증가한 matrix metalloproteinase가 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이다.
도 5는 면역세포인 human monocyte cell line인 THP-1에 MSU에 의해 발현이 증가한 염증 관련 지표들이 본 신약 처리 24 시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이다.
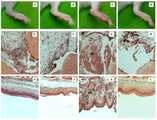
도 6은 마우스 오른쪽 발목 관절에 MSU crystals 및 약학 조성물을 처리하여 변화된 발목 조직을 H&E 염색기법 결과를 나타낸 상태도이다.
도 7은 본 발명에 따른 약학 조성물 및 xylene으로 마우스 오른쪽 귀에 염증 유발 후, 마우스 귀의 무게를 측정한 그래프이다.FIG. 1 is a graph showing q-PCR of the amount of mRNA expressed at 24 hours after the treatment of the present invention with inflammation-related indicators in which the expression of MSU was increased in human chondrocyte cell line SW1353.
FIG. 2 is a graph showing q-PCR of the amount of mRNA expression of the metalloproteinase expressed by MSU in the human chondrocyte cell line SW1353 after 24 hours of treatment with the present drug.
FIG. 3 is a graph showing q-PCR of the amount of mRNA expressed after 24 hours from the treatment of the present invention with inflammation-related indicators in which expression of MSU was increased in human primary chondrocyte.
FIG. 4 is a graph showing q-PCR of mRNA expression levels of matrix metalloproteinase, which is increased by MSU in human primary chondrocyte, after 24 hours of treatment with the new drug.
FIG. 5 is a graph showing the expression level of mRNA expressed by the MSU-induced inflammation-related indicators in the human monocyte cell line THP-1 after 24 hours of treatment with the present invention by q-PCR.
6 is a state diagram showing the result of H & E staining of ankle tissues that have been treated with MSU crystals and a pharmaceutical composition on the right ankle joint.
FIG. 7 is a graph showing the weight of a mouse ear after inducing inflammation in the right ear of a mouse using the pharmaceutical composition and xylene according to the present invention. FIG.
본 발명은 통풍 및 골관절염 치료용 약학 조성물에 관한 것이다.The present invention relates to a pharmaceutical composition for treating gout and osteoarthritis.
본 발명에 따른 통풍 치료용 약학 조성물은 울금 100 중량부에 대해 오미자 70 ~ 90 중량부, 인지 70 ~ 90 중량부, 치자 70 ~ 90 중량부, 택사 50 ~ 70 중량부, 저령 50 ~ 70 중량부, 백봉령 50 ~ 70 중량부, 백출 50 ~ 60 중량부 및 육계 10 ~ 30 중량부를 혼합한 약재의 추출물을 유효성분으로 포함하는 것이 바람직하다.The pharmaceutical composition for treating gout according to the present invention comprises 70 to 90 parts by weight of omija, 70 to 90 parts by weight of omija, 70 to 90 parts by weight of germanium, 50 to 70 parts by weight of gum, 50 to 70 parts by weight of gum, 50 to 70 parts by weight, 50 to 60 parts by weight, and 10 to 30 parts by weight of broiler chickens, as an active ingredient.
또한 상기 혼합한 약재의 추출물은 물 100 중량부에 대해 상기 혼합한 약재 5 ~ 20 중량부를 혼합하여 90 ~ 120℃의 온도에서 2 ~ 5 시간 동안 가열 추출하는 단계, 상기 가열 추출한 추출물을 3,000rpm에서 8 ~ 12분 동안 원심분리하여 침전물을 제거하는 단계, 상기 침전물을 제거한 추출물을 감압 농축하는 단계 및 상기 감압 농축한 농축액을 동결 건조기로 건조하여 약학조성물로 제조하는 단계로 이루어지는 것이 바람직하다.The extracted medicinal composition may be prepared by mixing 5 to 20 parts by weight of the medicinal material mixed with 100 parts by weight of water, heating and extracting the mixture at 90 to 120 ° C for 2 to 5 hours, Centrifuging the mixture for 8 to 12 minutes to remove the precipitate, concentrating the extract from which the precipitate has been removed under reduced pressure, and drying the concentrated concentrate by a freeze dryer to prepare a pharmaceutical composition.
또한 상기 추출물의 유효성분은 커큐민(curcumin), 시잔드린(schisandrin), 카피린(capillin), 게니포사이드(geniposide), 크로신(crocin), 알리솔(alisol), 글루칸(glucan), 에르고스테롤(ergosterol), 파키만(pachyman), 파키믹산(pachymic acid), 아트락틸론(atractylon), 신나믹알데하이드(cinnamic aldehyde) 및 신남산(cinnamic acid)을 포함하는 것이 바람직하다.The active ingredients of the extracts may also be selected from the group consisting of curcumin, schisandrin, capillin, geniposide, crocin, alisol, glucan, ergosterol ergosterol, pachyman, pachymic acid, atractylon, cinnamic aldehyde and cinnamic acid are preferred.
또한 상기 약학 조성물은 산제, 과립제, 정제, 환제, 캡슐제, 엑스제, 유제, 시럽제, 내용액제, 에어로졸, 트라스트제, 패치제, 비수성용제, 동결건조제제 또는 멸균 주사제로 이루어진 군에서 선택되는 어느 하나의 약제학적 제제로 제제화되는 것이 바람직하다.In addition, the pharmaceutical composition may be in the form of a powder, granule, tablet, pill, capsule, excipient, emulsion, syrup, It is preferable to formulate it as a single pharmaceutical preparation.
또한 도 1은 human chondrocyte cell line인 SW1353에서 MSU에 의해 발현이 증가한 염증 관련 지표들이 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이며, 도 2는 human chondrocyte cell line인 SW1353에서 MSU에 의해 발현이 증가한 matrix metalloproteinase가 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이며, 도 3은 human primary chondrocyte에서 MSU에 의해 발현이 증가한 염증 관련 지표들이 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이며, 도 4는 human primary chondrocyte에서 MSU에 의해 발현이 증가한 matrix metalloproteinase가 본 신약 처리 24시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이며, 도 5는 면역세포인 human monocyte cell line인 THP-1에 MSU에 의해 발현이 증가한 염증 관련 지표들이 본 신약 처리 24 시간 후 변화된 mRNA 발현량을 q-PCR로 나타낸 그래프이다.FIG. 1 is a graph showing the expression level of mRNA expressed by the human chondrocyte cell line SW1353 after 24 hours of treatment with the present invention, by q-PCR, and FIG. 2 is a graph showing the expression level of the human chondrocyte cell line SW1353 Fig. 3 is a graph showing the expression of mRNA expressed by the MSU-expressing matrix metalloproteinase after 24 hours of treatment with the present invention. Fig. 3 is a graph showing that the inflammatory indicators, which are expressed by MSU in the human primary chondrocyte, FIG. 4 is a graph showing q-PCR of mRNA expression level of matrix metalloproteinase, which is increased by MSU in human primary chondrocyte, after 24 hours of treatment with the present drug, and FIG. 5 showed that inflammatory markers expressed by MSU in THP-1, a human monocyte cell line, Lt; / RTI > by q-PCR.
또한 도 6은 마우스 오른쪽 발목 관절에 MSU crystals 및 약학 조성물을 처리하여 변화된 발목 조직을 H&E 염색기법 결과를 나타낸 상태도이며, 도 7은 본 발명에 따른 약학 조성물 및 xylene으로 마우스 오른쪽 귀에 염증 유발 후, 마우스 귀의 무게를 측정한 그래프이다.FIG. 6 is a state diagram showing the results of H & E staining of the ankle tissues treated with MSU crystals and a pharmaceutical composition on the right ankle joint of the mouse. FIG. This is a graph measuring ear weight.
이하에서 실시예 및 실험예를 통하여 본 발명을 보다 구체적으로 설명한다. 그러나 하기의 실시예 및 실험예는 본 발명을 구체적으로 예시하기 위한 것일 뿐, 본 발명의 권리범위를 제한하는 것이 아님은 당업자에게 있어서 명백한 사실이다. 즉, 본 발명의 단순한 변형 내지 변경은 당업자에 의하여 용이하게 실시될 수 있으며, 이러한 변형이나 변경은 모두 본 발명의 영역에 포함되는 것으로 볼 수 있다.Hereinafter, the present invention will be described in more detail with reference to Examples and Experimental Examples. However, it should be understood that the following Examples and Experiments are intended only to illustrate the present invention, but do not limit the scope of the present invention. That is, a simple modification or change of the present invention can be easily performed by those skilled in the art, and all such modifications and alterations can be considered to be included in the scope of the present invention.
본 발명에 의해 제조된 약학 조성물은 울금, 오미자, 인진, 치자, 택사, 저령, 백봉령, 백출 및 육계를 일정비율로 혼합하여 추출하는 것이 바람직하다.Preferably, the pharmaceutical composition prepared by the present invention is mixed with a certain ratio of Ulgum, Omija, Injin, Gardenia, Taxa, Lycopersicum, Leuconostoc, Bacillus, and Broiler.
상기 본 발명에 사용하는 울금(주성분;curcumin)은 온울금(溫鬱金), 강황(薑黃), 광서아출(廣西莪朮) 또는 봉아출(蓬莪朮)의 덩이뿌리로서 그대로 또는 주피를 제거하고 쪄서 말린 것이다. 이 생약의 주성분인 커큐민(curcumnin)은 LPS로 유도한 TNF와 IL-1의 생산을 억제하며, 여러 동물모델에서 진통작용을 나타낸다. 또 다른 성분인 ar-tumerone은 쥐의 뇌교세포인 BV-2 세포에서 NF-kB, MAPK 신호전달 체계를 조절하여 항염증 효능을 나타낸다.The curcumin used in the present invention can be used as a root of roots of Ongulgwang, Ganghwang, Gwangseongjip or Roejunggwon as it is, will be. Curcuminin, a major component of this herbal medicine, inhibits the production of LPS-induced TNF and IL-1, and exhibits analgesic activity in several animal models. Another component, ar-tumerone, has anti-inflammatory effects by regulating NF-kB, MAPK signaling in BV-2 cells, the pituitary cells of rats.
상기 본 발명에 사용하는 오미자(주성분;schisandrin)는 Schicandra chinensis Baillon(오미자과)의 잘 익은 열매이다. 이 생약의 주성분인 shisandrin A, B 및 achisanhenol 등은 간의 대사효소계를 활성화시키며, shisandrin B, C 및 schisandrol B는 CCl 4에 의해 유도되는 지질과산화를 억제하며, CCl 4와 liver microsome 내의 지질과의 결합을 억제한다. Gomisin C는 rat 호중구의 산화적파괴현상을 억제하고, gomisin 유도체, shisandrin 유도체 등은 ACAT(acyl-CoA:cholesterol acyltransferase)활성을 억제하며, Gomisin N의 억제활성이 가장 크다.The schizandrin used in the present invention is the ripe fruit of Schicandra chinensis Baillon (Omiza). Shisandrin B, C and schisandrol B inhibit the lipid peroxidation induced by CCl 4, and the binding of CCl 4 to lipids in the liver microsome . Gomisin C inhibits the oxidative destruction of rat neutrophils. Gomisin derivatives and shisandrin derivatives inhibit ACAT (acyl-CoA: cholesterol acyltransferase) activity, and Gomisin N has the highest inhibitory activity.
상기 본 발명에 사용하는 인진(주성분;capillin)은 사철쑥 atremisia capollaris Thunberg (국화과 ; Compositae)의 지상부이다. 봄에 채취한 것을 면인진이라 하고 가을에 채취한 것을 인호진이라 한다. 이 약물의 물추출물은 NF-kB의 활성화를 억제함으로써 LPS로 유도한 염증반응을 억제한다. 또한 EtOH로 유도한 cytokine(TNF-,IL-1α)의 분비를 억제한다. 이 약물의 성분 중 하나인 capillarisin은 항염증효과를 나타낸다.The main ingredient (capillin) used in the present invention is a ground part of atremisia capollaris Thunberg (Compositae). What is collected in the spring is called a champagne. The water extract of this drug inhibits the inflammatory response induced by LPS by inhibiting the activation of NF-kB. It also inhibits the secretion of EtOH-induced cytokines (TNF-, IL-1α). One of the ingredients of this drug, capillarisin, has anti-inflammatory effects.
상기 본 발명에 사용하는 치자(주성분;geniposide, crocin)는 치자나무의 잘 익은 열매로서 그대로 또는 끓는 물에 데치거나 찐 것이다. 이 약물의 성분인 genipin은 항산화작용과 용량 의존적인 형관신생 및 NO 생성 저해작용으로 소염작용을 가지며, crocin은 prostaglandin E2 등의 유리 억제를 통해 항염증 작용을 가진다.The main ingredient (geniposide, crocin) used in the present invention is either ripe fruit of gardenia or it is boiled or boiled in boiling water. Genipin, an ingredient of this drug, has antinociceptive and dose-dependent inhibitory effects on tubulinogenesis and NO production, and crocin has an anti-inflammatory action through inhibition of the free radicals such as prostaglandin E2.
상기 본 발명에 사용하는 택사(주성분;alisol)는 질경이택사의 덩이줄기로서 잔뿌리 및 주피를 제거한 것이다. 이 약물의 MeOH 추출물과 terpenoid 계 성분들은 항체매개 알러지반응과 세포매개 알러지반응을 억제하며 항보체활성을 가지고 있다. 또한 sesquiterpenoid계 성분과 triterpenoid계 성분들은 LPS로 유도한 NO의 생성을 억제하며 그 중에서 alismol과 alisol F는 iNOS 생합성을 억제한다.The main ingredient (alisol) used in the present invention is a rootstock of a plant pathophyte removing the root roots and juniper. MeOH extracts and terpenoids of this drug inhibit antibody-mediated allergic reactions and cell-mediated allergic responses and have anti-complement activity. In addition, sesquiterpenoid and triterpenoid components inhibit the production of NO induced by LPS, among which alismol and alisol F inhibit iNOS biosynthesis.
상기 본 발명에 사용하는 저령(주성분;glucan, ergosterol)은 Poluporus umbellatus Fries의 균핵이다. 오리나무속 또는 참나무속 등의 뿌리에 부착하여 자란다. 물추출물은 세뇨관에서의 전해질과 물의 재흡수를 억제함으로써, 정상인이나 실험동물에 대해서 이뇨작용을 나타내는 것으로 보인다. 또한 알코올 추출물은 황색포도상구균과 대장균에 대한 억제작용이 있다.The minor ingredient (glucan, ergosterol) used in the present invention is sclerotia of Poluporus umbellatus Fries. It grows on the roots of ducks or oaks. Water extracts seem to exhibit diuretic action against normal and experimental animals by inhibiting the reabsorption of electrolytes and water in the tubules. The alcohol extract also has an inhibitory action against Staphylococcus aureus and E. coli.
상기 본 발명에 사용하는 백복령(주성분;pachyman, pachymic acid)은 Poria cocos Wolf의 균핵이다.이 생약의 성분인 3β-phydroxybenzoyldehydrotumulosic acid는 TPA나 arachidonic acid로 유도한 귀의 염증을 억제한다. Dehydrotumulosic acid와 pachymic acid는 피부염과 같은 염증성질환에 효과가 있다. 또한 이 생약의 추출물은 sodium lauryl sulphate로 유도한 자극성 접촉성 피부염에 대해 항염증활성이 있으며, 이는 phospholipase A2의 억제와 관련이 있다.3β-phydroxybenzoyldehydrotumulosic acid, a component of this herbal medicine, inhibits the inflammation of the ear induced by TPA or arachidonic acid. The pachymic acid (pachymic acid) used in the present invention is sclerotia of Poria cocos Wolf. Dehydrotumulosic acid and pachymic acid are effective for inflammatory diseases such as dermatitis. This herbal extract also has anti - inflammatory activity against sodium lauryl sulphate - induced irritant contact dermatitis, which is associated with inhibition of phospholipase A2.
상기 본 발명에 사용하는 백출(주성분;atractylon)은 삽주의 뿌리줄기로서 그대로 또는 주피를 제거한 것이다. 이 생약이 주약인 복합처방의 물추출물은 현저한 면역증강작용을 나타낸다. 또한 추출물은 LPS에 의한 염증반응을 억제하며, 산화적 스트레스에 의한 조골세포 분화억제로부터 보호 작용을 갖는다.The atractylon used in the present invention is the roots of the shoots or the husks are removed. The water extract of the combination prescription, which is a herbal medicine, shows a remarkable immune enhancing action. In addition, the extract inhibits the inflammatory response by LPS and has a protective action against inhibition of osteoblast differentiation by oxidative stress.
상기 본 발명에 사용하는 육계(주성분;cinnamic aldehyde, cinnamic acid)는 육계의 줄기껍질로서 그래도 또는 주피를 약간 제거한 것이다. 이 생약의 성분인 cinnamic aldehyde, cinnamic acid, cinnamic alchol은 LPS로 염증을 유발한 RAW264.7 세포주와 carrageenan으로 처리한 mouse 모델에서 항염증작용을 나타낸다.The broiler (cinnamic aldehyde, cinnamic acid) to be used in the present invention is a stem skin of broiler chickens, but it is still slightly removed. Cinnamic aldehyde, cinnamic acid, and cinnamic alchol, which are components of this herbal medicine, exhibit anti-inflammatory effects in the RAW264.7 cell line that has been induced by LPS and in mouse models treated with carrageenan.
실시예Example
실시예 1Example 1
각 약재를 표 1에 나타난 바와 같이 혼합한 후, 증류수 2000㎖와 혼합하여 3시간 동안 가열 추출한다. 상기 가열 추출한 추출물을 3,000rpm에서 10분 동안 원심분리하여 침전물을 제거한 후, rotary evaporator로 감압 농축한다. 상기 감압 농축한 농축액을 동결건조기로 건조하여 얻은 분말을 실험에 사용하였다.Each pharmaceutical preparation was mixed as shown in Table 1, mixed with 2000 ml of distilled water, and heated for 3 hours. The heat-extracted extract was centrifuged at 3,000 rpm for 10 minutes to remove precipitates, and then concentrated under reduced pressure using a rotary evaporator. The concentrate obtained by drying the concentrate under reduced pressure was freeze-dried and used in the experiment.
실험예Experimental Example
실험예 1 : 세포 배양Experimental Example 1: Cell culture
Human chondrocyte cell line인 SW1353, Mouse Osteoblast cell line인 MC3T3 E-1, 및 Human Monocyte cell line인 THP-1를 각각 DMEM(Invitogen, Carlsbaed, CA) 배지, MEM-α(Invitogen, Carlsbad, CA)배지, RPMI 1640 (Invitogen, Carlsbad, CA) 배지에서 배양한다. 상기 세 종류의 배지 모두 10%의 우태아혈청(FBS)와 100U/㎖의 페니실린과 100U/㎖의 스트렙토마이신을 첨가하여 37℃ 온도, 5% 이산화탄소 농도의 항온항습배양기에서 배양한다.The human chondrocyte cell line SW1353, the mouse osteoblast cell line MC3T3 E-1 and the human monocyte cell line THP-1 were cultured in DMEM (Invitogen, Carlsbaed, CA) medium, MEM-α (Invitogen, Carlsbad, And cultured in RPMI 1640 (Invitogen, Carlsbad, CA) medium. In all three media, 10% fetal bovine serum (FBS), 100 U / ml penicillin and 100 U / ml streptomycin were added and incubated at 37 ° C. and 5
실험예 2 : RNA 분리 및 quantitative-PCR(q-PCR)Experimental Example 2: RNA isolation and quantitative-PCR (q-PCR)
상기 실험예 1에 의해 배양된 세포에 통풍의 유발원으로 알려진 monosoudium urate(MSU)를 처리하여 통풍 시 연골세포에서 일어나는 염증 상황을 만들어 상기 MSU에 의해 유발되는 염증인자들의 mRNA 발현량을 측정한다.The cells cultured according to Experimental Example 1 were treated with monosuiod urate (MSU), which is known as a source of gout, to produce an inflammatory state occurring in chondrocytes during ventilation, and the amount of mRNA expression of the inflammatory factors induced by the MSU is measured.
RNA 분리는 TRIzol 시약을 사용한다. 260/280의 흡광도 비율로 RNA의 순도를 측정한 다음, 2㎍의 RNA를 SuperScript(Invitrogen)을 사용하여 cDNA를 합성한다. 상기 합성된 cDNA의 1/10을 Real-time PCR을 실시하기 위해 EXPRESS SYBR green qPCR Supermix(Bioneer, Korea) PCR 혼합시약을 사용한다. q-PCR은 Roter-Gene Q(Qiagen, Hilden, Germany)기기를 사용하여 수행하는 것이 바람직하며, 반응은 95℃에서 20초, 60℃에서 20초, 72℃에서 25초의 프로그램을 사용하여 총 40cycle 증폭하는 것이 바람직하다. mRNA의 발현량은 GAPDH를 기준으로 하여 △△CT법으로 정량화하는 것이 바람직하다.RNA isolation uses TRIzol reagent. After measuring the purity of the RNA at an absorbance ratio of 260/280, 2 쨉 g of RNA was synthesized using SuperScript (Invitrogen). To perform real-time PCR on 1/10 of the synthesized cDNA, EXPRESS SYBR green qPCR Supermix (Bioneer, Korea) PCR mixing reagent is used. q-PCR is preferably performed using a Roter-Gene Q (Qiagen, Hilden, Germany) apparatus. The reaction is carried out for 20 cycles at 95 ° C for 20 sec, 60 ° C for 20 sec and 72 ° C for 25 sec. Amplification is preferable. The expression level of mRNA is preferably quantified by the △ ΔCT method on the basis of GAPDH.
상기 mRNA의 발현량을 측정한 결과는 하기 도 1 내지 도 5와 같이 나타났다.The expression levels of the mRNA were measured as shown in FIGS. 1 to 5.
하기 도 1은 human chondrocyte cell line인 SW1353에 통풍의 유발원인 MSU를 1㎎/㎖ 처리한 후, 상기 실시예 1에 의해 제조된 약학 조성물을 50㎍/㎖, 100㎍/㎖, 200㎍/㎖씩 농도별로 처리하여 24시간 후 변화된 mRNA 발현량을 q-PCR로 확인한 결과를 나타낸 것으로, 상기 제조된 약학 조성물을 처리한 그룹에서는 발현량이 농도 의존적으로 현저하게 억제되었음을 확인할 수 있다.FIG. 1 shows the results obtained by treating the human chondrocyte cell line SW1353 treated with 1 mg / ml of MSU, which causes gout, with 50 .mu.g / ml, 100 .mu.g / ml and 200 .mu.g / ml And the amount of mRNA expression after 24 hours was analyzed by q-PCR. It can be confirmed that the expression level was significantly inhibited in the group treated with the prepared pharmaceutical composition, in a concentration-dependent manner.
하기 도 2는 human chondrocyte cell line인 SW1353에 MSU를 1㎎/㎖ 처리한 후 증가한 matrix metalloproteses가 상기 실시예 1에 의해 제조된 약학 조성물을 100㎍/㎖, 200㎍/㎖씩 농도별로 처리하여 24시간 후 변화된 mRNA 발현량을 q-PCR로 확인한 결과를 나타낸 것으로, 상기 제조된 약학 조성물을 처리한 그룹에서는 발현량이 농도 의존적으로 억제되는 것을 확인할 수 있다.FIG. 2 shows the results of treatment of MS13 with 1 mg / ml of SW1353, a human chondrocyte cell line, followed by treatment with increasing concentrations of matrix metalloproteases at concentrations of 100 μg / ml and 200 μg / ml, The amount of mRNA expression after the time course was confirmed by q-PCR, and it was confirmed that the expression level was suppressed in a dose-dependent manner in the group treated with the prepared pharmaceutical composition.
하기 도 3은 human Primary chondrocyte에 MSU를 1㎎/㎖ 처리한 후, 상기 실시예 1에 의해 제조된 약학 조성물을 100㎍/㎖, 200㎍/㎖ 씩 농도별로 처리하여 24시간 후 변화된 mRNA 발현량을 q-PCR로 확인할 결과를 나타낸 것으로, 상기 제조된 약학 조성물을 처리한 그룹에서는 발현량이 농도 의존적으로 현저하게 억제되는 것을 확인할 수 있다.FIG. 3 is a graph showing changes in mRNA expression level after 24 hours after treatment of MSU at 1 mg / ml with human primary chondrocyte, followed by treatment with 100 μg / ml and 200 μg / ml of the pharmaceutical composition prepared in Example 1 And the results are confirmed by q-PCR. It can be confirmed that the expression amount is remarkably inhibited in a concentration-dependent manner in the group treated with the pharmaceutical composition prepared above.
하기 도 4는 human Primary chondrocyte에 MSU를 1㎎/㎖ 처리한 후 증가한 matrix metalloproteses가 상기 실시예 1에 의해 제조된 약학 조성물을 100㎍/㎖, 200㎍/㎖씩 농도별로 처리하여 24시간 후 변화된 mRNA 발현량을 q-PCR로 확인한 결과를 나타낸 것으로, 상기 제조된 약학 조성물을 처리한 그룹에서는 발현량이 농도 의존적으로 억제되는 것을 확인할 수 있다.FIG. 4 is a graph showing the results of treatment with MSU of 1 mg / ml in the human primary chondrocyte, and the increased matrix metalloproteases were treated with 100 μg / ml and 200 μg / ml of the pharmaceutical composition prepared in Example 1, The mRNA expression level was confirmed by q-PCR, and it was confirmed that the expression level was inhibited in a concentration-dependent manner in the group treated with the pharmaceutical composition prepared above.
하기 도 5는 human monocyte cell line인 THP-1에 MSU를 200㎍/㎖ 처리한 후, 상기 실시예 1에 의해 제조된 약학 조성물 200㎍/㎖을 처리하여 24시간 후 변화된 mRNA 발현량을 q-PCR로 확인한 결과를 나타낸 것으로 상기 제조된 약학 조성물을 처리한 그룹에서 발현량이 농도 의존적으로 현저하게 억제되는 것을 확인할 수 있다.FIG. 5 shows the results of treatment of 200 μg / ml of MSU with THP-1, a human monocyte cell line, 200 μg / ml of the pharmaceutical composition prepared in Example 1, PCR. As a result, it can be confirmed that the expression level in the group treated with the pharmaceutical composition prepared was remarkably inhibited in a concentration-dependent manner.
실험예 3 : 세포생존능력 실험(MTT 실험)Experimental Example 3: Cell viability test (MTT test)
세포를 96-well plate에 한 well 당 2×104개의 세포를 심고, 안정화 시킨 후 MSU와 본 발명의 신약을 농도(㎍/㎖)별로 처리하고 48시간 후 MTT(5㎍/㎖) 시약을 약물들을 처리된 96-well plate에 첨가하여 2시간 동안 37℃ 온도에서 더 배양한다. 상기 온도에서 배양한 후, 96-well plate안의 모든 매양액을 제거하고 남아있는 formazan crystal을 well당 DMSO 200㎕에 녹인 후, 570㎚의 파장에서 UV-visible spectrophotometer를 사용하여 측정한다.Cells were seeded at 2 × 104 cells per well on a 96-well plate, and after stabilization, MSU and the new drug of the present invention were treated by concentration (㎍ / ㎖) and MTT (5 μg / ml) The drugs are added to the treated 96-well plate and further incubated at 37 ° C for 2 hours. After incubation at this temperature, all the nutrient solution in the 96-well plate is removed and the remaining formazan crystal is dissolved in 200 μl of DMSO per well. The remaining formazan crystal is then measured using a UV-visible spectrophotometer at a wavelength of 570 nm.
실험예 4 : 젖산 탈수소 효소 실험(LDH 실험)Experimental Example 4: Lactic acid dehydrogenase experiment (LDH experiment)
세포를 96-well plate에 한 well당 2×104개의 세포를 심고 안정화시킨 후, MSU와 본 발명의 신약을 농도(㎍/㎖)별로 처리하고 48시간 후, 각 well당 10㎕의 세포 배양액을 새로운 96-well plate로 옮긴 후 각각 40㎕의 PBS를 더 첨가한다. 이 후 각 well당 50㎕의 LDH 시약을 첨가하여 25℃ 온도에서 어두운 곳에서 45분 동안 반응시킨다. 상기 반응액에 50㎕의 반응 종료 용액을 첨가하고 490㎚의 파장에서 UV-visiblespectrophotometer를 사용하여 측정한다.Cells were seeded and stabilized at 2 × 104 cells per well on a 96-well plate. MSU and the new drug of the present invention were treated for each concentration (μg / ml), and after 48 hours, 10 μl of cell culture Is transferred to a new 96-well plate and 40 μl of PBS is added. After that, 50 μl of LDH reagent is added per well and reacted at 25 ° C. for 45 minutes in the dark. 50 mu l of the reaction completion solution is added to the reaction solution, and measurement is made at a wavelength of 490 nm using a UV-visiblespectrophotometer.
실험예 5 : Alkaline phosphate(ALP) 활성 실험Experimental Example 5: Alkaline phosphate (ALP) activity test
MC3T3 E-1을 24 well plate에 한 well당 9×104개의 세포를 심고 안정화시킨 후, MSU(1㎎/㎖)처리 후 통풍과 유사한 시험관 내 환경에서 본 시약을 농도(㎍/㎖)별로 처리하고 48시간 후, 이 세포들을 각각 차가운 PBS로 두 번씩 세척한 뒤, 각 well당 150㎕의 RIPA 버퍼로 용해시킨다. 20㎕의 세포 용해액을 100㎕의 CSPD substrate (Roche, Manneheim, Germany)와 섞은 후, 30분 동안 반응시킨다. 상기 반응시킨 반응물은 발광도를 luminometer(Glomax, Promega, Sunnyvale, CA)를 이용하여 측정한 후, 측정값을 표준화하기 위해 각각의 세포 용해액의 단백질량을 단백질 정량 키트(Bio-Rad, Hercules, CA)로 확인한다.MC3T3 E-1 was seeded and stabilized in a 24-well plate at a density of 9 × 104 cells per well. The cells were treated with MSU (1 mg / ml) After 48 hours of treatment, the cells are washed twice with cold PBS, respectively, and then dissolved in 150 μl of RIPA buffer per well. 20 μl of the cell lysate is mixed with 100 μl of CSPD substrate (Roche, Manneheim, Germany) and reacted for 30 minutes. The reacted reactants were measured for luminescence using a luminometer (Glomax, Promega, Sunnyvale, Calif.), And then protein amounts of each cell lysate were quantified using a protein quantification kit (Bio-Rad, Hercules, CA).
상기 실험예 1 내지 실험예 5의 실험 결과로 본 발명에 의해 제조된 약학 조성물은 COX2, IL1β, TNF-α, iNOS 등의 대표적인 염증 관련 지표의 발현을 억제하고, MMP-1, MMP-9, MMP-13 등의 matrix metalloproteinase의 발현을 억제시켜 통풍 및 골관절염에 있어 항염 및 통증 억제 작용이 있는 것을 확인할 수 있다.As a result of
실험예 6 : MSU crystals을 통해 유발된 마우스 발목 관절염 모델 실험Experimental Example 6: Experiment of mouse ankle arthritis model induced by MSU crystals
MSU crystals(300㎍)을 10㎕ endotoxin-free PBS 또는 PBS(control)에 섞어서 2.5% isoflurane로 마취한 BALB/c 마우스의 발목 관절에 25㎕씩 주사한다. BALB/c 마우스에 MSU crystals (750㎍)을 주사하고 1시간 후 본 신약(500㎎/㎏)을 경구 투여한다. 8시간 간격으로 2회 더 경구 투어를 진행하여 총 3회에 걸쳐 본 발명의 신약을 경구투여한다. MSU crystals (750㎍)을 발목에 주사하고 18시간 후에 각각의 마우스를 희생하여 얻은 발목 조직을 조직병리학적으로 염증 변화를 확인한다.MSU crystals (300 μg) are mixed with 10 μl of endotoxin-free PBS or PBS (control) and injected 25 μl into ankle joints of BALB / c mice anesthetized with 2.5% isoflurane. BALB / c mice were injected with MSU crystals (750 μg) and after 1 hour, the new drug (500 mg / kg) was orally administered. Oral tour is performed twice at 8 hour intervals and the new drug of the present invention is administered orally three times in total. MSU crystals (750 μg) were injected into the ankle and after 18 hours each mouse was sacrificed and the ankle tissue was histopathologically confirmed for inflammatory changes.
실험예 7 : H&E 염색Experimental Example 7: H & E staining
조직학적 평가를 위하여 MSU crystals을 통해 유발된 마우스 발목 관절염 모델에서 발목을 회수 한 후 5% 포르말린용액에 고정한다. 고정한 조직을 파라핀 블록으로 제작하여 2㎛의 두께로 잘라 슬라이드에 고정한다. 조직 절편을 탈파라핀 과정을 거친 후, H&E 염색을 실시한다. 상기 H&E 염색은 세포의 핵에 헤마톡실린이 세포질에 에오신이 염색되는 것으로 MSU crystals을 통해 유발된 마우스 발목 관절염 부위의 염증세포의 침윤을 확인하기 위해 실시하는 것이다.For histological evaluation, the ankle is recovered from mouse ankle arthritis model induced by MSU crystals and fixed in 5% formalin solution. The fixed tissue is made into a paraffin block, cut to a thickness of 2 μm and fixed on the slide. Tissue sections are deparaffinized and H & E stained. The H & E staining is performed to confirm the infiltration of inflammatory cells in the mouse ankle arthritis region induced by MSU crystals, in which the hematoxylin is stained with eosin in the cytoplasm of the cell nucleus.
실험예 7의 결과는 하기 도 6과 같이 나타났으며, 하기 도 6의 A, E, I는 PBS만 주사한 마우스, B, F, J는 상기 실시예 1에 의해 제조된 약학 조성물만 경구 투여한 마우스, C, G, K는 MSU crystals를 주사한 마우스, D, H, L은 MSU crystals를 주사한 후 상기 실시예 1에 의해 제조된 약학 조성물을 경구투여한 마우스이다. A 내지 D는 각 군의 마우스 발목 관절 사진이며, E 내지 H는 각 군의 마우스로부터 얻은 발목 관절 조직을 나타난 사진이며, I 내지 L은 발목 조직의 피부를 H&E 염색을 하여 나타난 조직 사진이다. C, G, K의 화살표는 발목 관절의 부종을 보여주는 것이다. MSU crystals만 주사한 마우스의 발목에 심한 부종이 보이는 것과 비교하여 MSU crystals을 주사한 후 상기 실시예 1에 의해 제조된 약학 조성물을 경구 투여한 마우스의 발목에서는 유의하게 부종이 감소되는 것을 확인할 수 있다.The results of Experimental Example 7 were as shown in FIG. 6, and mice A, E and I of FIG. 6, which were injected with PBS only, and B, F and J were administered orally only the pharmaceutical composition prepared in Example 1 Mice injected with MSU crystals in one mouse, C, G, and K, and mice injected with MSU crystals in D, H, and L, and then orally administered with the pharmaceutical composition prepared in Example 1 above. A to D are mouse ankle joint photographs of each group, E to H are photographs showing ankle joint tissues obtained from mice in each group, and I to L are tissue photographs showing H & E staining of ankle skin. The arrows C, G, and K show the swelling of the ankle joint. It was confirmed that edema was significantly reduced in the ankle of the mice to which the pharmaceutical composition prepared in Example 1 was orally administered after the MSU crystals were injected compared with the severe swelling in the ankle of mice injected with MSU crystals alone .
실험예 8 : 마우스 ear edema 모델 실험Experimental Example 8: Mouse ear edema model experiment
마우스(BALB/c, 6주, Male)를 대조군(n=5)과 양성대조군인 dexamethasone 투여군(n=5) 및 신약 투여군(n=10)으로 나눈다. 본 발명의 신약 투여군은 하루 2회 신약 (500㎎/㎏) 경구 퉁하고, 나머지 두 실험군은 생리식염수를 경구 투여하여 2주 동안 실험을 실시한다. 양성대조군의 경우 마지막 날에만 dexamethasone(1㎎/㎏)을 1회 복강 투여한다. 실험 14일에 본 발명의 신약 투여군에 신약을 경구 투여하고, 양성대조군은 dexamethasone(1㎎/㎏)을 복강 투여한다. 30분 후 마우스 오른쪽 귀를 xylene을 마우스 귀 안쪽과 바깥쪽 각각 15㎕씩 도포하여 염증을 유발시킨다. 30분 후 모든 실험 마우스를 희생하여 일정하게 귀를 잘라 그 무게를 측정한다.Male (BALB / c, 6 weeks, Male) was divided into control (n = 5) and positive control dexamethasone (n = 5) and new drug administration (n = 10). The new drug administration group of the present invention is administered with a new drug (500 mg / kg) twice a day, and the remaining two experimental groups are administered with oral administration of physiological saline for 2 weeks. In the positive control group, dexamethasone (1 mg / kg) is administered once per day only on the last day. On the 14th day, the new drug was orally administered to the new drug administration group of the present invention, and the positive control group was administered with dexamethasone (1 mg / kg) intraperitoneally. After 30 minutes, the right ear of the mouse is sprayed with 15 μl of xylene inside and outside the mouse ear to induce inflammation. After 30 minutes, all the experimental mice are sacrificed and ear is cut constantly and the weight is measured.
무게를 측정한 결과는 하기 도 7과 같이 나타났으며, Xylene으로 염증 유발한 마우스 귀의 무게는 대조군과 비교하여 2배 정도의 무게차ㄹ이를 나타내는 것을 확인 할 수 있으며, 상기 실시예 1에 의해 제조된 약학 조성물을 2주 동안 경구투여한 마우스 귀의 무게는 xylene으로 염증 유발한 귀와 비교하여 유의하게 감소하는 것을 확인할 수 있다.The results of measurement of weight were as shown in FIG. 7, and it was confirmed that the weight of mouse ear induced by Xylene was twice as much as that of the control group. The weight of the mouse ear administered orally for 2 weeks to the manufactured pharmaceutical composition is significantly reduced compared with that of the ear caused by xylene.
상기 실험예 6 내지 실험예 8의 실험 결과로 염증을 유발시킨 동물 모델에서 항염작용을 관찰하였으며, MSU 결정으로 유발된 발목 관절염 모델에서 염증에 의해 나타난 부종이 치료되는 효과를 조직염색법으로 확인할 수 있었으며, 마우스 ear edema모델에서 또한 본 발명에 따라 제조된 약학 조성물을 경구 투여한 마우스에서 유의한 염증 완화 효과가 있는 것으로 나타난 것을 확인할 수 있다.As a result of Experiments 6 to 8, an anti-inflammatory effect was observed in an inflammatory animal model, and the effect of treatment of inflammation-induced edema in MSU-induced ankle arthritis model was confirmed by tissue staining , The mouse ear edema model also showed significant inflammation relieving effects in mice administered orally to the pharmaceutical compositions prepared according to the present invention.
따라서 본 발명에 따라 제조된 약학 조성물을 통풍 치료용으로 사용하여 통증 억제 및 항염 작용을 하며, 부작용이 적은 약학 조성물을 제공할 수 있다.Accordingly, the pharmaceutical composition prepared according to the present invention can be used for treating gout to provide pain relief and anti-inflammatory action, and to provide a pharmaceutical composition with less side effects.
또한 본 발명에 따라 제조된 약학 조성물은 골관절염에 의한 염증과 통증을 완화하는 치료용 약학 조성물로 사용할 수 있다.In addition, the pharmaceutical composition prepared according to the present invention can be used as a therapeutic pharmaceutical composition for relieving inflammation and pain caused by osteoarthritis.
Claims (4)
Translated fromKorean상기 약학 조성물은 울금 100 중량부에 대해 오미자 70 ~ 90 중량부, 인지 70 ~ 90 중량부, 치자 70 ~ 90 중량부, 택사 50 ~ 70 중량부, 저령 50 ~ 70 중량부, 백봉령 50 ~ 70 중량부, 백출 50 ~ 60 중량부 및 육계 10 ~ 30 중량부를 혼합한 약재의 추출물을 유효성분으로 포함하는 것을 특징으로 하는 통풍 치료용 약학 조성물.
A pharmaceutical composition for treating gout,
The pharmaceutical composition is characterized by comprising 70 to 90 parts by weight of omija, 70 to 90 parts by weight of omija, 70 to 90 parts by weight of gardenia, 50 to 70 parts by weight of taxa, 50 to 70 parts by weight, 50 to 70 parts by weight, , 50 to 60 parts by weight of the extract, 10 to 30 parts by weight of the broth, as an active ingredient.
상기 혼합한 약재의 추출물은 물 100 중량부에 대해 상기 혼합한 약재 5 ~ 20 중량부를 혼합하여 90 ~ 120℃의 온도에서 2 ~ 5 시간 동안 가열 추출하는 단계;
상기 가열 추출한 추출물을 3,000rpm에서 8 ~ 12분 동안 원심분리하여 침전물을 제거하는 단계;
상기 침전물을 제거한 추출물을 감압 농축하는 단계; 및
상기 감압 농축한 농축액을 동결 건조기로 건조하여 약학조성물로 제조하는 단계;로 이루어지는 것을 특징으로 하는 통풍 치료용 약학 조성물.
The method according to claim 1,
Mixing the extracted medicinal material with 5 to 20 parts by weight of the medicinal material mixed with 100 parts by weight of water and heating and extracting the mixture at 90 to 120 ° C for 2 to 5 hours;
Centrifuging the heat-extracted extract at 3,000 rpm for 8 to 12 minutes to remove the precipitate;
Concentrating the extract from which the precipitate has been removed under reduced pressure; And
And drying the concentrate by concentration under reduced pressure to prepare a pharmaceutical composition.
상기 추출물의 유효성분은 커큐민(curcumin), 시잔드린(schisandrin), 카피린(capillin), 게니포사이드(geniposide), 크로신(crocin), 알리솔(alisol), 글루칸(glucan), 에르고스테롤(ergosterol), 파키만(pachyman), 파키믹산(pachymic acid), 아트락틸론(atractylon), 신나믹알데하이드(cinnamic aldehyde) 및 신남산(cinnamic acid)을 포함하는 것을 특징으로 하는 통풍 치료용 약학 조성물.
The method according to claim 1,
The active ingredient of the extract is selected from the group consisting of curcumin, schisandrin, capillin, geniposide, crocin, alisol, glucan, ergosterol The pharmaceutical composition according to any one of claims 1 to 7, wherein the composition contains pachyman, pachymic acid, atractylon, cinnamic aldehyde and cinnamic acid.
상기 약학 조성물은 산제, 과립제, 정제, 환제, 캡슐제, 엑스제, 유제, 시럽제, 내용액제, 에어로졸, 트라스트제, 패치제, 비수성용제, 동결건조제제 또는 멸균 주사제로 이루어진 군에서 선택되는 어느 하나의 약제학적 제제로 제제화되는 것을 특징으로 하는 통풍 치료용 약학 조성물.The method according to claim 1,
The pharmaceutical composition may be any one selected from the group consisting of powders, granules, tablets, pills, capsules, excipients, emulsions, syrups, solutions, aerosols, transtrates, patches, nonaqueous solutions, lyophilized preparations, Wherein the composition is formulated as a pharmaceutical preparation of Gout.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020150158811AKR101715520B1 (en) | 2015-11-12 | 2015-11-12 | The pharmaceutical compositions for the treatment of gout |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020150158811AKR101715520B1 (en) | 2015-11-12 | 2015-11-12 | The pharmaceutical compositions for the treatment of gout |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR101715520B1true KR101715520B1 (en) | 2017-03-13 |
Family
ID=58411781
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020150158811AExpired - Fee RelatedKR101715520B1 (en) | 2015-11-12 | 2015-11-12 | The pharmaceutical compositions for the treatment of gout |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR101715520B1 (en) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107823509A (en)* | 2017-11-30 | 2018-03-23 | 云南露源野生真菌研究所(有限合伙) | A kind of traditional Chinese medicine oral liquid for treating gout and preparation method thereof |
| CN109674958A (en)* | 2018-12-21 | 2019-04-26 | 雷允上药业集团有限公司 | A kind of Chinese medicine composition and its preparation method and application with anti-trioxypurine |
| CN111643583A (en)* | 2020-07-08 | 2020-09-11 | 常德市永春堂生物科技有限公司 | Traditional Chinese medicine composition for treating gout disease and preparation method and application thereof |
| CN111714487A (en)* | 2019-03-20 | 2020-09-29 | 苏州凯祥生物科技有限公司 | Hyperuricemia pharmaceutical composition |
| CN111714491A (en)* | 2019-03-20 | 2020-09-29 | 苏州凯祥生物科技有限公司 | New application of sesquiterpene lactone compound |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100492470B1 (en) | 2003-05-20 | 2005-06-02 | 윤병원 | Composition for treating and preventing gout |
| CN101060074A (en)* | 2001-06-29 | 2007-10-24 | 拉姆研究公司 | Apparatus and method for radio frequency decoupling and bias voltage control in a plasma reactor |
| KR20070109004A (en)* | 2006-05-09 | 2007-11-15 | 김성진 | Pharmaceutical composition for the prevention and treatment of bone metabolic diseases, diseases caused by oxidative stress, and inflammatory diseases |
| CN101970021A (en)* | 2008-03-03 | 2011-02-09 | 奥姆里克斯生物药品有限公司 | A gelatin sponge comprising an active ingredient, its preparation and use |
| KR20130130580A (en) | 2012-05-22 | 2013-12-02 | 정진남 | Composition for preventing or treating gout containing mixed medicinal herbs extracts and method of preparing the extracts |
| KR101346281B1 (en) | 2013-08-20 | 2013-12-31 | 강영효 | Compositions for preventing, improving or treating gout, containing extracts of twenty nine medicine plants as active ingredient |
| CN104800696A (en)* | 2015-05-13 | 2015-07-29 | 宋小冰 | Traditional Chinese medicine preparation for treating gout |
- 2015
- 2015-11-12KRKR1020150158811Apatent/KR101715520B1/ennot_activeExpired - Fee Related
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101060074A (en)* | 2001-06-29 | 2007-10-24 | 拉姆研究公司 | Apparatus and method for radio frequency decoupling and bias voltage control in a plasma reactor |
| KR100492470B1 (en) | 2003-05-20 | 2005-06-02 | 윤병원 | Composition for treating and preventing gout |
| KR20070109004A (en)* | 2006-05-09 | 2007-11-15 | 김성진 | Pharmaceutical composition for the prevention and treatment of bone metabolic diseases, diseases caused by oxidative stress, and inflammatory diseases |
| CN101970021A (en)* | 2008-03-03 | 2011-02-09 | 奥姆里克斯生物药品有限公司 | A gelatin sponge comprising an active ingredient, its preparation and use |
| KR20130130580A (en) | 2012-05-22 | 2013-12-02 | 정진남 | Composition for preventing or treating gout containing mixed medicinal herbs extracts and method of preparing the extracts |
| KR101346281B1 (en) | 2013-08-20 | 2013-12-31 | 강영효 | Compositions for preventing, improving or treating gout, containing extracts of twenty nine medicine plants as active ingredient |
| CN104800696A (en)* | 2015-05-13 | 2015-07-29 | 宋小冰 | Traditional Chinese medicine preparation for treating gout |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107823509A (en)* | 2017-11-30 | 2018-03-23 | 云南露源野生真菌研究所(有限合伙) | A kind of traditional Chinese medicine oral liquid for treating gout and preparation method thereof |
| CN109674958A (en)* | 2018-12-21 | 2019-04-26 | 雷允上药业集团有限公司 | A kind of Chinese medicine composition and its preparation method and application with anti-trioxypurine |
| CN109674958B (en)* | 2018-12-21 | 2022-04-05 | 雷允上药业集团有限公司 | Traditional Chinese medicine composition with effect of reducing uric acid and preparation method and application thereof |
| CN111714487A (en)* | 2019-03-20 | 2020-09-29 | 苏州凯祥生物科技有限公司 | Hyperuricemia pharmaceutical composition |
| CN111714491A (en)* | 2019-03-20 | 2020-09-29 | 苏州凯祥生物科技有限公司 | New application of sesquiterpene lactone compound |
| CN111714487B (en)* | 2019-03-20 | 2023-05-12 | 苏州凯祥生物科技有限公司 | Hyperuricemia pharmaceutical composition |
| CN111714491B (en)* | 2019-03-20 | 2023-06-20 | 苏州凯祥生物科技有限公司 | Application of sesquiterpene lactone compound |
| CN111643583A (en)* | 2020-07-08 | 2020-09-11 | 常德市永春堂生物科技有限公司 | Traditional Chinese medicine composition for treating gout disease and preparation method and application thereof |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Gupta | Biological and pharmacological properties of Terminalia chebula Retz.(Haritaki)-An overview | |
| Tadić et al. | Anti-inflammatory, gastroprotective, free-radical-scavenging, and antimicrobial activities of hawthorn berries ethanol extract | |
| Upadhyay et al. | A review on the pharmacological aspects of Terminalia chebula | |
| KR101715520B1 (en) | The pharmaceutical compositions for the treatment of gout | |
| US10967030B2 (en) | Traditional Chinese medicine composition for treating psoriasis and method for preparing the same | |
| Kilari et al. | Biological and phytopharmacological descriptions of Litchi chinensis | |
| KR102182724B1 (en) | Antiinflammatory composition comprising Locusta migratoria extract | |
| CN107530391B (en) | Synergistic composition for osteoarthritis | |
| KR102018221B1 (en) | Composition for preventing, improving or treating of arthritis comprising boswellia extract, grape seed extract, tumericextract, green tea extract, ginger extract and atratum cynanchum extract as effective component | |
| Mahmood et al. | Foeniculum vulgare, Solanum nigrum and Cichorium intybus: A Collectanea of Pharmacological and Clinical uses | |
| Rajalakshmi et al. | Validation of Anti-diabetic Potential of Avirai kudineer a Siddha herbal formulation-A Review | |
| KR20170050523A (en) | Composition for preventing or treating ostarthritis comprising Sargassum serratifolium | |
| KR20200109026A (en) | COMPOSITION FOR IMPROVING IMMUNITY FUNCTION COMPRISING Daphne genkwa AND Euphorbiakansui Liou ex Wanga COMPLEX EXTRACT AS AN EFFECTIVE INGREDIENT | |
| Maroof et al. | Medicinal benefits of propolis | |
| CN108042643A (en) | A kind of preparation method of Traditional Chinese medicine for reducing blood glucose compound | |
| Lestari et al. | Review of traditional use, pharmacological effects and toxicity of medicinal plants for women’s health in Indonesia | |
| KR102856074B1 (en) | Composition for preventing, ameliorating or treating cartilage regeneration, arthritis and pain caused by osteoarthritis comprising Adenocaulon himalaicum Edgew extract as effective component | |
| Yadav et al. | A comprehensive review on therapeutic potentials of Matricaria chamomilla (chamomile) against inflammation-mediated chronic diseases | |
| EP3996814B1 (en) | Use of a herbal extract comprising verbascoside and aucubin for the treatment of osteoarthritis of the knee | |
| Kumar et al. | Assessment of therapeutic potential of Phyllanthus emblica (Amla): A natural Godsend | |
| KR101132110B1 (en) | A composition containing plants extract for diseases associated with periodontitis | |
| KR20180111280A (en) | Composition for preventing and treating inflammatory bowel disease comprising sagassum serratifolium extract | |
| KR20190119020A (en) | A composition for anti-inflammation comprising hemistepta lyrata extract | |
| Juwita et al. | Hepatoprotective effect of Indonesian propolis from Apis mellifera in carbon tetrachloride (CCl4) induced liver injury in mice | |
| Ponmurugan et al. | Biomedical Applications and Health Benefits of Wild Noni and Its Fruits |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application | St.27 status event code:A-0-1-A10-A12-nap-PA0109 | |
| PA0201 | Request for examination | St.27 status event code:A-1-2-D10-D11-exm-PA0201 | |
| D13-X000 | Search requested | St.27 status event code:A-1-2-D10-D13-srh-X000 | |
| D14-X000 | Search report completed | St.27 status event code:A-1-2-D10-D14-srh-X000 | |
| PE0902 | Notice of grounds for rejection | St.27 status event code:A-1-2-D10-D21-exm-PE0902 | |
| P11-X000 | Amendment of application requested | St.27 status event code:A-2-2-P10-P11-nap-X000 | |
| P13-X000 | Application amended | St.27 status event code:A-2-2-P10-P13-nap-X000 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-3-3-R10-R18-oth-X000 | |
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | St.27 status event code:A-1-2-D10-D22-exm-PE0701 | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | St.27 status event code:A-2-4-F10-F11-exm-PR0701 | |
| PR1002 | Payment of registration fee | St.27 status event code:A-2-2-U10-U11-oth-PR1002 Fee payment year number:1 | |
| PG1601 | Publication of registration | St.27 status event code:A-4-4-Q10-Q13-nap-PG1601 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| P22-X000 | Classification modified | St.27 status event code:A-4-4-P10-P22-nap-X000 | |
| FPAY | Annual fee payment | Payment date:20200113 Year of fee payment:4 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:4 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:5 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:6 | |
| PN2301 | Change of applicant | St.27 status event code:A-5-5-R10-R13-asn-PN2301 St.27 status event code:A-5-5-R10-R11-asn-PN2301 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:7 | |
| PC1903 | Unpaid annual fee | St.27 status event code:A-4-4-U10-U13-oth-PC1903 Not in force date:20240307 Payment event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE | |
| PC1903 | Unpaid annual fee | St.27 status event code:N-4-6-H10-H13-oth-PC1903 Ip right cessation event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE Not in force date:20240307 |