KR101707149B1 - Improvement of Viability and Proliferation of Stem Cells by Doxycycline - Google Patents
Improvement of Viability and Proliferation of Stem Cells by DoxycyclineDownload PDFInfo
- Publication number
- KR101707149B1 KR101707149B1KR1020140035610AKR20140035610AKR101707149B1KR 101707149 B1KR101707149 B1KR 101707149B1KR 1020140035610 AKR1020140035610 AKR 1020140035610AKR 20140035610 AKR20140035610 AKR 20140035610AKR 101707149 B1KR101707149 B1KR 101707149B1
- Authority
- KR
- South Korea
- Prior art keywords
- doxycycline
- stem cells
- cell
- cells
- stem cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0662—Stem cells
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/999—Small molecules not provided for elsewhere
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Chemical & Material Sciences (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Cell Biology (AREA)
- Developmental Biology & Embryology (AREA)
- Gynecology & Obstetrics (AREA)
- Reproductive Health (AREA)
- Rheumatology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Transplantation (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean본 발명은 줄기세포의 생존 및 증식을 증대시키는 줄기세포 배양용 조성물 및 줄기세포 배양 방법에 관한 것이다.
The present invention relates to a composition for culturing stem cells and a method for culturing stem cells, which increase the survival and proliferation of stem cells.
줄기세포 특히 hESC(Human embryonic stem cell) 및 iPSCs(induces pluripotent stem cells)는 발생 생물학, 질병 모델링 및 재생 의약에 대한 중요한 도약의 발판을 제공한다(1, 2, 3, 4). 그러나 기술적으로 hESC/iPSCs는 배양하기 어렵고, 특히 세포 분리 및 해리에 있어서, 느린 성장 및 불량한 생존율을 보인다. 그러므로, hESCs는 보조하는 피더 층(2) 상의 클러스터 내에서 고유하게 배양된다. hESC/iPSCs가 화학적으로 정의된 배지(4)를 갖는 매트리겔 내에서 배양된다면, 피더-프리 배양은 가능하다. 게다가 현탁액(5) 내에서, 마이크로 어레이(4, 6)를 가지고 또는 합성 폴리머(7) 상에서, hESC/iPSCs를 배양하는 것과 같은 방법이 소개되었다. 그러나 상기의 새로운 기술들은 비용이 많이 들고, 제한된 확장성을 가지며, 높은 뱃치(batch) 간의 변동성을 갖는다. ROCK 억제제인 Y-27632가 세포 해리 후의 세포 아팝토시스를 방지하고, 플레이트에 도말 후의 세포 생존성을 향상(8, 9)시키기 위해 사용되지만, 상기 화학물질의 이점은 세포 해리 후의 짧은 주기로 제한되며, 세포 생존 및 증식에 대한 그 지속적인 효과가 의심된다(10). 그러므로 낮은 비용으로 가능하고, 강력하며, 확장가능하고, 사용이 쉬우며, 효과가 지속적인 배양 방법들이, 기초 연구 및 임상 응용에서의 hESC/iPSCs의 광범위한 적용을 가능케하기 위하여 더욱 발전되어야 한다.
Stem cells, especially human embryonic stem cells (hESCs) and iPSCs (inducing pluripotent stem cells), provide a significant leap forward in developmental biology, disease modeling and regenerative medicine (1, 2, 3, 4). Technically, however, hESC / iPSCs are difficult to cultivate and exhibit slow growth and poor survival, especially in cell separation and dissociation. Therefore, the hESCs are uniquely cultivated in a cluster on the supporting feeder layer (2). If hESC / iPSCs are cultured in a matrigel with a chemically defined medium (4), feeder-free culture is possible. In addition, methods have been introduced such as culturing hESC / iPSCs in
본 명세서 전체에 걸쳐 다수의 논문 및 특허문헌이 참조되고 그 인용이 표시되어 있다. 인용된 논문 및 특허문헌의 개시 내용은 그 전체로서 본 명세서에 참조로 삽입되어 본 발명이 속하는 기술 분야의 수준 및 본 발명의 내용이 보다 명확하게 설명된다.
Numerous papers and patent documents are referenced and cited throughout this specification. The disclosures of the cited papers and patent documents are incorporated herein by reference in their entirety to better understand the state of the art to which the present invention pertains and the content of the present invention.
본 발명자들은 줄기세포를 배양시 줄기세포의 생존(survival) 및 증식(proliferation)을 증대시키기 위한 줄기세포 배양용 조성물을 개발하고자 예의 연구 노력하였다. 그 결과 독시사이클린을 이용하는 경우 줄기세포의 생존(survival) 및 증식(proliferation)이 증대되는 것을 규명함으로써, 본 발명을 완성하게 되었다.The present inventors have made extensive efforts to develop a stem cell culture composition for enhancing the survival and proliferation of stem cells when culturing stem cells. As a result, the present inventors have completed the present invention by confirming that the survival and proliferation of stem cells are increased when using doxycycline.
따라서, 본 발명의 목적은 줄기세포 배양용 조성물을 제공하는데 있다.Accordingly, an object of the present invention is to provide a composition for culturing stem cells.
본 발명의 다른 목적은 줄기세포의 생존 및 증식을 증대시키는 줄기세포 배양 방법을 제공하는데 있다.
It is another object of the present invention to provide a stem cell culture method for enhancing survival and proliferation of stem cells.
본 발명의 다른 목적 및 이점은 하기의 발명의 상세한 설명, 청구범위 및 도면에 의해 보다 명확하게 된다.
Other objects and advantages of the present invention will become more apparent from the following detailed description of the invention, claims and drawings.
본 발명의 일 양태에 따르면, 본 발명은 독시사이클린을 유효성분으로 포함하는 줄기세포 배양용 조성물을 제공한다.
According to one aspect of the present invention, there is provided a composition for culturing a stem cell, comprising as an active ingredient, a doxycycline.
본 발명자들은 줄기세포를 배양시 줄기세포의 생존(survival) 및 증식(proliferation)을 증대시키기 위한 줄기세포 배양용 조성물을 개발하고자 예의 연구 노력하였다. 그 결과 독시사이클린을 이용하는 경우 줄기세포의 생존(survival) 및 증식(proliferation)이 증대되는 것을 규명하였다.The present inventors have made extensive efforts to develop a stem cell culture composition for enhancing the survival and proliferation of stem cells when culturing stem cells. As a result, it was confirmed that the survival and proliferation of stem cells were increased when doxycycline was used.
본 발명의 줄기세포 배양용 조성물의 유효성분인 독시사이클린은 테트라사이클린 계열의 항생제로서 하기 화학식 1로 나타낸 화합물이다.The active ingredient of the composition for culturing stem cells of the present invention is a tetracycline-based antibiotic represented by the following formula (1).
[화학식 1][Chemical Formula 1]
독시사이클린은 라임병(lyme disease), 만성 전립성염, 부비강염, 골반 연증성 질환, 여드름, 주사비(rosacea), 리케치아(rickettsial) 감염의 치료에 사용되는 것으로 알려져 있다. 본 발명자들은 상기와 같은 용도가 공지되어 있는 독시사이클린을 줄기세포의 배양을 위한 새로운 용도로서 이용하는 경우, 줄기세포의 배양에 효과적이라는 결론을 도출하여 본 발명을 완성하였다.Doxycycline is known to be used for the treatment of lyme disease, chronic prostatitis, sinusitis, pelvic inflammatory disease, acne, rosacea, rickettsial infections. DISCLOSURE OF THE INVENTION The present inventors completed the present invention based on the conclusion that when the above-described uses of doxycycline as a novel use for culturing stem cells are effective for culturing stem cells.
본 발명의 일 구현예에 의하면, 본 발명인 줄기세포 배양용 조성물은 줄기세포의 생존(survival) 및 증식(proliferation)을 증대시킨다. 줄기세포 배양을 위한 조성물은 줄기세포 자체가 단시간 내에 사멸하지 않고 장기간 생존할 수 있도록 해야 하며, 줄기세포의 증식이 활발하게 이루어지도록 해야 한다. 본 발명자들은 줄기세포 배양용 배지에 독시사이클린을 처리하는 경우, 줄기세포가 생존 및 증식하는데 불리한 고농도 인슐린 환경 하에서도 줄기세포의 사멸이 억제되고, 줄기세포의 증식이 증가되는 것을 확인하였다(참조: 도 1). 또한 줄기세포가 저농도로 존재하는 환경이 줄기세포 증식에 불리함에도 불구하고, 독시사이클린을 처리하는 경우에는 저농도의 줄기세포의 생존 및 증식도 증대되는 것을 확인하였다(참조: 도 2). 이는 다른 계열의 항생제에서는 나타나지 않는 효과이며, 같은 테트라사이클린 계열의 항생제 중에서도 뛰어난 효과이다(참조: 도 4). 또한, 이를 통하여 독시사이클린-매개의 세포 생존 증대 효과가 그것의 항생제 효능과 연관되어 있는 것은 아님을 시사한다.According to one embodiment of the present invention, the composition for culturing stem cells according to the present invention increases the survival and proliferation of stem cells. The composition for culturing stem cells should allow the stem cells themselves to survive for a long time without being killed within a short time, and the proliferation of stem cells should be actively performed. The inventors of the present invention confirmed that, in the case of treating the culture medium for stem cell culture with doxycycline, the death of stem cells is inhibited and the proliferation of stem cells is increased even under a high-concentration insulin environment, which is disadvantageous for survival and proliferation of stem cells (cf. One). In addition, although the environment in which the stem cells are present at a low concentration is disadvantageous to the stem cell proliferation, the survival and proliferation of the low-density stem cells is also increased in the case of treatment with the doxycycline (see FIG. 2). This is an effect that does not occur in other classes of antibiotics and is an excellent effect among antibiotics of the same tetracycline family (see FIG. 4). It also suggests that the increase in cell survival of the doxycycline-mediated effect is not associated with its antibiotic efficacy.
본 발명의 일 구현예에 의하면, 본 발명의 줄기세포는 전능성 줄기세포(totipotent stem cell), 다능성 줄기세포(pluripotent stem cell), 중복성 줄기세포(Multipotent stem cell) 또는 단분화성 줄기세포(Unipotent stem cell)이다.According to an embodiment of the present invention, the stem cells of the present invention can be used as a totipotent stem cell, a pluripotent stem cell, a multipotent stem cell or a unipotent stem cell. cell.
본 발명의 일 구체예에 의하면, 전술한 일 구현예의 전능성 줄기세포는 배아줄기세포(embryonic stem cell), 배아생식세포(embryonic germ cells) 또는 배아종양세포(embryonic carcinoma cells)이다. 더욱 구체적으로 상기 전능성 줄기세포는 배아줄기세포이다.According to one embodiment of the present invention, the pluripotent stem cells of one embodiment described above are embryonic stem cells, embryonic germ cells, or embryonic carcinoma cells. More specifically, the pluripotent stem cells are embryonic stem cells.
본 발명의 다른 구체예에 의하면, 전술한 일 구현예의 다능성 줄기세포는 역분화 다능성 줄기세포(induced Pluripotent stem cell)이다. 역분화 다능성 줄기세포는 본 명세서 상에서 iPSCs와 같은 약칭으로도 기재된다.According to another embodiment of the present invention, the pluripotent stem cell of the above-described embodiment is an induced pluripotent stem cell. Degenerative pluripotent stem cells are also referred to herein by abbreviations such as iPSCs.
본 발명의 다른 구체예에 의하면, 전술한 일 구현예의 중복성 줄기세포는 신경 줄기세포(neural stem cell), 조혈 줄기세포(hematopoietic stem cell) 또는 간엽 줄기세포(mesenchymal stem cell)이다. 더욱 구체적으로 상기 중복성 줄기세포는 신경 줄기세포이다. 더욱 더 구체적으로 상기 신경 줄기세포는 바이러스성 역분화 줄기세포 유래의 신경 줄기세포이다. 상기 바이러스성 역분화 줄기세포는 구체적으로 레트로 바이러스성 hiPS-NSCs(Retro human induced Pluripotent stem cell-neural stem cells) 또는 렌티 바이러스성 hiPS-NSCs(Lenti human induced Pluripotent stem cell-neural stem cells)일 수 있다. 상기 바이러스성 역분화 줄기세포 유래의 신경 줄기세포는 도 6에 나타낸 바와 같이 계대 배양을 진행하는 동안 계대 수가 증가하면서, 세포가 사멸함을 알 수 있다. 그러나 독시사이클린을 처리하는 경우 이러한 문제를 극적으로 해결할 수 있음을 확인하였다(참조: 도 6). 이는 역분화 줄기세포 및 이를 이용하여 유도한 새로운 다능성 줄기세포, 중복성 줄기세포 또는 단분화성 줄기세포를 안정적으로 배양할 수 있도록 한다.According to another embodiment of the present invention, the redundant stem cell of the above-described embodiment is a neural stem cell, a hematopoietic stem cell, or a mesenchymal stem cell. More specifically, the redundant stem cells are neural stem cells. More specifically, the neural stem cells are neural stem cells derived from viral dedifferentiated stem cells. Specifically, the viral dedifferentiated stem cells may be retroviral hiPS-NSCs (retrovirus-induced pluripotent stem cell-neural stem cells) or lentiviral hiPS-NSCs (Lenti human induced pluripotent stem cell-neural stem cells) . As shown in FIG. 6, the viral dedifferentiated stem cell-derived neural stem cells show cell death with increasing number of passages during subculture. However, it has been confirmed that this problem can be solved dramatically when treating doxycycline (see FIG. 6). This makes it possible to stably cultivate degenerated stem cells and new multipotent stem cells, redundant stem cells or mononuclear stem cells derived therefrom.
본 발명자들은 대표적인 전능성 줄기세포인 배아줄기세포, 다능성 줄기세포인 역분화 다능성 줄기세포, 중복성 줄기세포인 신경 줄기세포의 배양에 독시사이클린이 효과가 있음을 여러 실시예를 통하여 규명하였다. 각기 다른 발생의 진행 정도를 보이는 여러 줄기세포의 배양에 대하여 예외 없이 독시사이클린이 줄기세포의 생존 및 증식을 증대시키는 효과를 보임을 알 수 있으며, 이를 통해 다양한 줄기세포에 대하여 동일 또는 이에 준하는 생존 및 증식 증대 효과를 보일 것을 쉽게 유추할 수 있다.The present inventors have identified through various examples that the effect of doxycycline on the culture of embryonic stem cells, pluripotent pluripotent stem cells, and pluripotent stem cells, which are representative osmotic stem cells, is demonstrated. It is known that doxycycline has the effect of increasing the survival and proliferation of stem cells except for the cultivation of various stem cells showing different progression of progression. Thus, the same or equivalent survival and proliferation It can be easily deduced to show an increase effect.
본 발명의 줄기세포는 구체적으로 예를 들면, 인간, 마우스, 소, 말, 염소, 양, 개, 고양이, 토끼 또는 조류로부터 유래된 것이다. The stem cells of the present invention are specifically derived from, for example, human, mouse, cow, horse, goat, sheep, dog, cat, rabbit or algae.
본 발명의 다른 구현예에 따르면, 본 발명의 조성물은 독시사이클린을 1 nM-5000 μM 함량으로 포함한다. 본 명세서 상의 도 4에는 MTT assay 결과가 표시되어 있고, 1 nM의 독시사이클린의 첨가로도 배양 세포의 생존력이 향상되는 것을 관찰하였다. 또한, 도 32에는 독시사이클린 무처리 대조군에 대한 상대 생존력을 나타내었으며, 도 29의 PI3 카이네이즈 활성도 측정을 나타내었는바, 이를 통해서도 상기 함량 범위의 독시사이클린을 처리시 배양 세포 생존력 증대 효과를 관찰할 수 있다. 더욱 구체적으로 본 발명의 조성물은 독시사이클린을 0.01 μM-5000 μM 함량으로 포함하고, 더욱 더 구체적으로는 0.1 μM-5000 μM 함량으로 포함하며, 더욱 더 구체적으로는 1 μM-5000 μM 함량으로 포함하고, 더욱 더 구체적으로는 10 μM-5000 μM 함량으로 포함한다.
According to another embodiment of the present invention, the composition of the present invention contains 1 nM-5000 μM of doxycycline. In FIG. 4 of the present specification, MTT assay results are shown, and it was observed that the addition of 1 nM of doxycycline enhances the viability of cultured cells. FIG. 32 shows the relative viability against the untreated control group of doxycycline, and FIG. 29 shows the PI3 kinase activity measurement, and it is also possible to observe the effect of increasing the viability of the cultured cells in treating the above-mentioned content of doxycycline. More specifically, the composition of the present invention comprises doxycycline at a content of 0.01 μM to 5000 μM, more specifically at a content of 0.1 μM to 5000 μM, more specifically at a content of 1 μM to 5000 μM, More specifically from 10 μM to 5000 μM.
본 발명의 일 양태에 따르면, 본 발명은 다음 단계를 포함하는 줄기세포의 생존 및 증식을 증대시키는 줄기세포 배양 방법을 제공한다:According to one aspect of the present invention, there is provided a stem cell culture method for enhancing survival and proliferation of stem cells comprising the steps of:
(a) 줄기세포 배양용 배지를 준비하는 단계;(a) preparing a culture medium for stem cell culture;
(b) 상기 단계 (a)에서 준비된 배지에 독시사이클린을 처리하여 줄기세포를 배양하는 단계.(b) treating the medium prepared in step (a) with doxycycline to cultivate the stem cells.
본 발명의 방법에 있어서, 사용 가능한 줄기세포 배양용 배지는 특별한 제한이 없고, 동물세포의 배양에 통상적으로 이용되는 어떠한 배지도 사용이 가능하다. 구체적으로 예를 들면, Eagles's MEM (Eagle's minimum essential medium, Eagle, H.Science 130:432(1959)), α-MEM (Stanner, C.P. et al.,Nat. New Biol. 230:52(1971)), Iscove's MEM (Iscove, N. et al., J. Exp. Med. 147:923(1978)), 199 배지 (Morgan et al.,Proc. Soc. Exp. Bio. Med., 73:1(1950)), CMRL 1066, RPMI 1640 (Moore et al.,J. Amer. Med. Assoc. 199:519(1967)), F12 (Ham,Proc. Natl. Acad. Sci. USA 53:288(1965)), F10 (Ham, R.G.Exp. Cell Res. 29:515(1963)), DMEM (Dulbecco's modification of Eagle's medium, Dulbecco, R. et al.,Virology 8:396(1959)), DMEM과 F12의 혼합물 (Barnes, D. et al.,Anal. Biochem. 102:255(1980)), Way-mouth's MB752/1 (Waymouth, C.J. Natl. Cancer Inst. 22:1003(1959)), McCoy's 5A (McCoy, T.A., et al.,Proc. Soc. Exp. Biol. Med.100:115(1959)) 및 MCDB 시리즈 (Ham, R.G. et al.,In Vitro 14:11(1978)) 등이 이용될 수 있다. 본 발명의 독시사이클린의 처리는 줄기 세포를 배양하는 동안 1회 또는 2회 이상 처리하는 가능하며, 바람직하게는 2회 이상 처리할 수 있으며, 더 바람직하게는 일정 시간 간격으로 2회 이상 처리할 수 있고, 구체적으로 예를 들면 24시간 간격으로 2회 이상 첨가할 수 있다. 독시사이클린을 최초 1회 만 일반적으로 사용하는 인간배아줄기세포 배지, 구체적으로 예를 들어 시판되는 Stemcell Technology사의 mTESR 배지, Millipore사의 Pluristem 배지 등에 섞어서 배양하더라도, 독시싸이클린을 첨가하지 않은 배지를 대조군으로 봤을 때, 대조군에 비하여 더욱 더 효율적으로 6일간의 배지 교환없이 인간배아줄기세포의 배양이 가능하다(참조: 도 19). 특히 독시싸이클린을 첨가하였을 때, 일주일간 배지 교환없이 사용가능한 제품으로 시판된 Millipore사의 Pluristem 배지보다도 높은 생존율을 보인다.In the method of the present invention, the culture medium for stem cell culture that can be used is not particularly limited, and any medium conventionally used for culturing animal cells can be used. (Eagle's minimum essential medium, Eagle, H.Science 130: 432 (1959)), α-MEM (Stanner, CP et al.,Nat. New Biol. 230: 52 (1971)), , Iscove's MEM (Iscove, N. et al., J. Exp. Med. 147: 923 (1978)), 199 medium (Morgan et al.,Proc. Soc. Exp. Bio. Med. , 73: ), CMRL 1066, RPMI 1640 (Moore et al.,J. Amer. Med. Assoc. 199: 519 (1967)), F12 (Ham,Proc Natl Acad Sci USA 53: 288 , F10 (Ham, RGExp. Cell Res. 29: 515 (1963)), DMEM (Dulbecco's modification of Eagle's medium, Dulbecco, R. et al.,Virology 8: 396Barnes, D. et al, Anal Biochem 102:... 255 (1980)), Waymouth's MB752 / 1 (Waymouth, C. J. Natl Cancer Inst 22:.. 1003 (1959)), McCoy's 5A (McCoy, TA, et al, Proc Soc Exp Biol Med 100:...... 115 (1959)) and MCDB series (. Ham, RG et al, In Vitro 14:11 (1978) may be used, and so on) . The treatment of doxycycline of the present invention can be performed once or twice or more, preferably two times or more, more preferably two times or more at regular time intervals during the culturing of stem cells , Specifically, for example, at least two times at an interval of 24 hours. When a culture medium in which doxycycline was not added was used as a control, even if the culture was carried out by mixing the first single doscisycline with a human embryonic stem cell culture medium, specifically mTESR medium commercially available from Stemcell Technology Co., Ltd. or Pluristem medium from Millipore Co., , Human embryonic stem cells can be cultured more efficiently than the control group for 6 days without medium exchange (see Fig. 19). In particular, when doxycycline is added, the product can be used without exchanging the medium for one week, and the survival rate is higher than that of commercially available Millipore Pluristem medium.
본 발명의 일 구현예에 의하면, 본 발명의 단계 (b)는 Y-27632를 독시사이클린과 함께 처리한다. 본 구현예의 Y-27632는 하기 화학식 2에서 나타낸 화합물에 해당하며, ROCK(rho-associated protein kinase) 억제제로서 구체적으로 p160ROCK를 선택적으로 억제하는 특징이 있다.According to one embodiment of the present invention, step (b) of the present invention treats Y-27632 with doxycycline. Y-27632 of this embodiment corresponds to a compound represented by the following formula (2), and is specifically characterized as a rho-associated protein kinase (ROCK) inhibitor, specifically inhibiting p160ROCK.
[화학식 2](2)
상기 Y-27632는 종래 줄기세포의 배양에 도움을주는 첨가제로서 알려져 있다. 그러나 Y-27632를 사용하는 경우 배양 세포의 형태(morphology)에 변형이 발생하는 문제가 있다(참조: 도 16). 그러나 독시사이클린을 사용하는 경우에는 이러한 문제가 발생하지 않으며, 줄기세포의 생존이나 증식을 증대시키는 효능도 Y-27632에 비하여 더욱 뛰어나다는 결과를 도출하였다(참조: 도 13, 15 및 17). 다만, Y-27632를 장기간 사용시 상술한 세포 형태의 변형 문제가 있음에도 불구하고, Y-27632를 독시사이클린과 병용 사용하는 경우, 줄기 세포의 배양에 가장 효과적임을 알 수 있다(참조: 도 30).The Y-27632 is known as an additive to help cultivate conventional stem cells. However, when Y-27632 is used, there is a problem that deformation occurs in the morphology of the cultured cells (see FIG. 16). However, this problem does not occur when using doxycycline, and the effect of increasing the survival or proliferation of stem cells is also superior to that of Y-27632 (see FIGS. 13, 15 and 17). However, when Y-27632 is used in combination with doxycycline, it is most effective in culturing stem cells, even though there is a problem of deformation of the cell shape described above when using Y-27632 for a long period of time (see FIG. 30).
본 발명의 일 구체예에 의하면, 본 발명의 단계 (b)에서 Y-27632는 매 계대 중 최초 1회에만 처리한다. 구체적으로 예를 들면, 독시사이클린을 24시간 간격으로 줄기세포 배양 배지에 처리하는 경우에 있어서, 독시사이클린의 최초 1회 처리 시에만 Y-27632를 함께 처리한다. 본 구체예에 의하면, Y-27632를 장기간 사용하는 경우 발생할 수 있는 세포 형태의 변형 문제의 발생 우려가 없으면서도, 독시사이클린 또는 Y-27632의 단독 사용시에 비하여 더욱 우수한 줄기 세포의 생존 및 증식 증대 효과를 얻을 수 있다(참조: 도 30).
According to one embodiment of the present invention, in step (b) of the present invention, Y-27632 is processed only once in each pass. Specifically, for example, when treating a stem cell culture medium at a 24-hour interval, doxycycline is treated with Y-27632 only in the first treatment of doxycycline. According to this specific example, there is no fear of generation of a deformed cell form which may occur when Y-27632 is used for a long period of time, and even more excellent survival and proliferation enhancement effect of the stem cell is obtained compared to the case of using doxycycline or Y-27632 alone (See Fig. 30).
본 발명의 특징 및 이점을 요약하면 다음과 같다:The features and advantages of the present invention are summarized as follows:
(a) 본 발명은 줄기세포 배양용 조성물을 제공한다.(a) The present invention provides a composition for culturing stem cells.
(b) 본 발명은 줄기세포의 생존 및 증식을 증대시키는 줄기세포 배양 방법을 제공한다.(b) The present invention provides a stem cell culture method for enhancing survival and proliferation of stem cells.
(c) 본 발명의 줄기세포 배양용 조성물을 이용하는 경우, 다양한 줄기세포의 생존(survival) 및 증식(proliferation)을 모두 증대시킬 수 있다.(c) When the composition for culturing a stem cell of the present invention is used, both the survival and the proliferation of various stem cells can be increased.
(d) 본 발명의 줄기세포 배양용 조성물을 이용하는 경우, 특히 바이러스성 역분화 줄기세포로부터 유도된 다양한 줄기세포들의 장기간 계대배양에 따른 아팝토시스성 세포 사멸 및 조기 노화를 방지할 수 있다.(d) When the composition for culturing a stem cell of the present invention is used, it is possible to prevent apoptotic cell death and premature aging by long-term passaging of various stem cells derived from viral dedifferentiated stem cells.
(e) 본 발명의 줄기세포 배양용 조성물을 이용하는 경우, 배지 교환 시기를 늘리는 효과가 있다. 특히 Millipore 사의 배지교환시기를 늘리는 시판배지인 Pluristem보다 더욱 높은 효율을 보이고, 일반적인 시판 배지에 첨가 사용 시에 배지의 효율을 크게 증대하는 효과가 있다.(e) When the composition for culturing a stem cell of the present invention is used, there is an effect of increasing the time for exchanging the medium. In particular, the efficiency is higher than that of Pluristem, which is a commercially available medium for increasing the period of exchanging the medium of Millipore Co., and it has an effect of greatly increasing the efficiency of the medium when added to general commercial medium.
(f) 본 발명의 줄기세포 배양 방법을 이용하는 경우, 저렴한 비용으로 줄기세포를 안정적으로 배양할 수 있는 방법을 제공할 수 있다.(f) When the stem cell culturing method of the present invention is used, it is possible to provide a method for stably culturing stem cells at low cost.
(g) 본 발명의 줄기세포 배양 방법을 이용하는 경우, 다양한 줄기세포의 생존 및 증식을 획기적으로 증대시킬 수 있다.
(g) When the stem cell culture method of the present invention is used, survival and proliferation of various stem cells can be dramatically increased.
도 1은 hNSC(human neural stem cell) 배양물에 있어서의 고농도의 인슐린에 의해 유발되는 아팝토시스성 세포사멸을 독시사이클린 첨가에 의해 억제할 수 있음을 나타낸다.
도 2는 hNSC(human neural stem cell) 배양물에 있어서의 낮은 세포 농도에 의해 유발되는 아팝토시스성 세포사멸을 독시사이클린 첨가에 의해 억제할 수 있음을 나타낸다.
도 3은 뉴론 생존상의 독시사이클린의 효과를 나타낸다.
도 4 및 도 5는 독시사이클린, 이와 유사체(미노사이클린, 테트라사이클린) 및 다른 항생제의 세포 생존 효과를 비교한 것을 나타낸다.
도 6, 7은 독시사이클린 보충이 세포 계대배양 동안 바이러스성 hiPS-유래 NSCs에 있어서의 이른 노화 및 아팝토시스성 세포 사멸을 예방하는 것을 나타낸다.
도 7은 독시사이클린 처리(우측) 및 비처리(좌측)의 레트로-2-hiPS-NSC 배양물에 있어서, 계대수 4의 마지막 날, 대표적인 β-갈락토시다아제(위, 세포 노화) 및 활성화 캐스페이즈 3(아래, 아팝토시스)-염색 세포를 나타낸다.
도 8 및 도 9는 AP+ 콜로니 형성 효율을 나타낸다.
도 10은 독시사이클린 처리에 의해 수정된 항-/프로-아팝토시스성 유전자에 대한 발현 어레이를 나타낸다.
도 11은 hESC 세포 확장에 대한 장기간(long-term) 배양에 있어서의 세포 성장 곡선을 나타낸다.
도 12는 독시사이클린-보충 배양물의 8 계대 배양 후 H9 세포의 수정되지 않은 핵형을 나타낸다.
도 13은 hESC 생존 및 유지에 있어서의 독시사이클린 및 Y-27632의 효과 비교한 것으로서, 5일간의 세포 생장을 나타낸다.
도 14는 hESC 생존 및 유지에 있어서의 독시사이클린 및 Y-27632의 효과 비교한 것으로서, 형성된 콜로니의 수를 나타낸다.
도 15는 hESC 생존 및 유지에 있어서의 독시사이클린 및 Y-27632의 효과 비교한 것으로서, 형성된 콜로니의 크기를 나타낸다.
도 16은 무처리, Y-27632-처리, 및 독시사이클린-처리한 배양물로부터의 대표적인 콜로니의 위상차 이미지를 나타낸다.
도 17은 AP+ 미분화된 콜로니의 %비율을 나타낸다.
도 18은 독시사이클린으로 처리한 H9 세포 내에서의 인간 줄기 세포 전사 인자를 코딩하는 유전자의 발현 수준을 무처리 배양에서의 발현 수준과 비교한 것을 나타낸다.
도 19는 인간 배아 줄기세포 배양시 독시사이클린의 처리만으로 배지 교환 시기를 늘리는 효과가 있음을 나타낸다.
도 20 내지 22은 세포 해리-유발의 엑토미오신 과활성화가 Y-27632에 의해 방지되었으나, 독시사이클린 처리에 의해서는 방지되지 않는 것을 나타낸다.
도 23은 독시사이클린에 의해 활성화된 세포 내부 신호의 추정을 나타낸다.
도 24는 독시사이클린 처리 0분, 10분 및 30분 후의 상기 신호 활성화를 웨스턴블랏 분석으로 더 측정한 결과를 나타낸다.
도 25 내지 27은 AP+ 콜로니의 수(도 25), 크기(도 26), 및 퍼센트 비율(도 27)에 대한 독시사이클린-유발 효과가 PI3K-Akt 신호에 특이적인 차단제에 의해 차단되었음을 나타낸다.
도 28은 일반적인 방사능 사진 기반 PI3K 활성 분석을 나타낸다.
도 29는 PI3K 활성에 대한 독시사이클린의 효과를 PI3 kinase activity/inhibiter assay kitR를 이용하여 측정한것을 나타낸다.
도 30은 독시사이클린과 함께 매 계대의 첫날에 Y-27632를 처리하여 준 경우에 줄기세포의 생존 및 증식이 증대되는 결과를 나타낸다.
도 31은 독시싸이클린을 첨가하여 20계대까지 배양하여도 기본적인 인간배아줄기세포의 성질이 변하지 않음을 나타낸다.
도 32는 독시사이클린 무처리 대조군에 대한 독시사이클린 처리 실시예에 있어서의 배양 줄기세포의 상대 생존력을 나타낸다.FIG. 1 shows that apoptosis-induced apoptosis induced by high-density insulin in hNSC (human neural stem cell) cultures can be inhibited by addition of doxycycline.
Figure 2 shows that apoptotic cell death induced by low cell concentration in hNSC (human neural stem cell) cultures can be inhibited by the addition of doxycycline.
Figure 3 shows the effect of doxycycline on neuronal survival.
Figures 4 and 5 show a comparison of cell survival effects of doxycycline, analogs (minocycline, tetracycline) and other antibiotics.
Figures 6 and 7 show that doxycycline supplements prevent premature aging and apoptotic cell death in viral hiPS-derived NSCs during cell passaging.
Figure 7 shows the final day of
Figures 8 and 9 show AP + colony formation efficiency.
Figure 10 shows an expression array for an anti- / pro-apoptotic gene modified by doxycycline treatment.
Figure 11 shows the cell growth curves in long-term cultures for hESC cell expansion.
Figure 12 shows the unmodified karyotype of H9 cells after 8 passages of doxycycline-supplemented cultures.
Figure 13 is a comparison of the effects of doxycycline and Y-27632 on hESC survival and maintenance, showing cell growth for 5 days.
Figure 14 shows the effect of doxycycline and Y-27632 on hESC survival and maintenance, showing the number of colonies formed.
Figure 15 compares the effect of doxycycline and Y-27632 on hESC survival and maintenance, showing the size of colonies formed.
Figure 16 shows phase contrast images of representative colonies from untreated, Y-27632-treated, and doxycycline-treated cultures.
Figure 17 shows the percentage of AP + undifferentiated colonies.
FIG. 18 shows the expression levels of genes encoding human stem cell transcription factors in H9 cells treated with doxycycline compared with the level of expression in untreated cultures.
FIG. 19 shows that the cultivation of human embryonic stem cells has an effect of increasing the culture medium exchange time only by treatment with doxycycline.
Figures 20-22 show that cell dissociation-induced excomyosis and activation were prevented by Y-27632 but not by the treatment with doxycycline.
Figure 23 shows the estimation of intracellular signals activated by doxycycline.
FIG. 24 shows the result of further measurement of the signal activation at 0 minute, 10 minutes, and 30 minutes after the doxycycline treatment by Western blot analysis.
Figures 25-27 show that the doxycycline-induced effect on the number of AP + colonies (Figure 25), size (Figure 26), and percentage (Figure 27) was blocked by a blocker specific to the PI3K-Akt signal.
Figure 28 shows a general radiographic photo based PI3K activity assay.
FIG. 29 shows the effect of doxycycline on PI3K activity measured using the
Figure 30 shows the results of increasing survival and proliferation of stem cells when treated with Y-27632 on the first day of each passage with doxycycline.
FIG. 31 shows that even when doxycycline is added and cultured to the 20th passage, the properties of basic human embryonic stem cells are not changed.
Figure 32 shows the relative viability of cultured stem cells in the doxycycline treatment example for the untreated control group of doxycycline.
이하, 실시예를 통하여 본 발명을 더욱 상세히 설명하고자 한다. 이들 실시예는 오로지 본 발명을 보다 구체적으로 설명하기 위한 것으로, 본 발명의 요지에 따라 본 발명의 범위가 이들 실시예에 의해 제한되지 않는다는 것은 당업계에서 통상의 지식을 가진 자에 있어서 자명할 것이다.
Hereinafter, the present invention will be described in more detail with reference to Examples. It is to be understood by those skilled in the art that these embodiments are only for describing the present invention in more detail and that the scope of the present invention is not limited by these embodiments in accordance with the gist of the present invention .
실시예Example
실험 재료 및 방법Materials and Methods
세포 배양Cell culture
HYE-08-02하의 한양대학교(서울, 대한민국)의 IRB(institutional review board)에 의해 승인된 hESC 리서치 가이드라인을 기초로 hESCs 및 hiPSCs를 배양하였다. 본 실험에서 사용된 hESCs 및 hiPSCs는 하기 표 1 및 표2에 나타내었다.HESCs and hiPSCs were cultured based on the hESC research guidelines approved by IRB (institutional review board) of Hanyang University (Seoul, Korea) under HYE-08-02. The hESCs and hiPSCs used in this experiment are shown in Table 1 and Table 2 below.
(인간)source
(human)
(harvard)Harvard
(harvard)
(harvard)Harvard
(harvard)
(harvard)Harvard
(harvard)
(harvard)Harvard
(harvard)
미분화 hESC/iPSC의 확장 및 유지를 위해, 4 ng/mL의 염기성 섬유아세포증식인자(basic fibroblast growth factor, bFGF)(R&D Systems)가 보충된 KSR-배지(세럼 대체물 결실)(Invitrogen) 내의 MEF 세포(CF1 mouse, Charles River Kingston)의 피더층(feeder layer) 상에서 세포를 배양하였다. 새롭게 준비한 MEF 피더층 상으로 hESC/iPSC 집락을 기계적으로 분할 및 이동시키는 것에 의해 매주 계대 배양하였다. 콜로니 형성 분석 및 확실한 다른 실험들을 위하여, hESC/iPSC 집락을 TrypLE(Invitrogen) 또는 콜라겐분해효소 IV(0.1 mg/mL; STEMCELL technology)를 이용한 1-5 세포 내로 분리하였고, 피더층없이, TESR 배지(STEMCELL technology)를 이용하여 MatrigelTM 상에서 배양하였다. 배지 교체 및 bFGF 보충을 특별한 언급없이 매일 수행하였다. hNSC 집락은 종래 알려진 hESCs 및 hiPSCs의 in vitro 분화(16, 18)에 의해 유래되었다. hNSCs를 ITSA 배지(13, 18) 내의 bFGF(20 ng/mL) 확장하였고, 장기간 확장을 위해 매주 계대배양하였다. hNSCs의 최종 분화는 bFGF가 없지만, 뇌-유래 신경영양인자(brain-derived neurotrophic factor)(20 ng/mL)(R&D Systems), 신경 아교 세포계 유도 신경영양인자(glial cell line derived neurotrophic factor)(20 ng/mL)(R&D Systems), 또는 디부티릴 cAMP(0.5 mmol/L)(Sigma)가 존재하는 조건에서 유도되었다. 다음의 화합물들을 사용하였다: 독시사이클린(Sigma), 미노사이클린(Sigma), 테트라사이클린(Sigma), 카나마이신(Sigma), 블라스티시딘(Invitrogen), 클로람페니콜(Sigma), Y-27632(Calniochem), LY294002(Calbiochem), Wortmannin(Millipore), PD98059(Calbiochem).
MEF cells (Invitrogen) in KSR-medium (Invitrogen) supplemented with 4 ng / mL basic fibroblast growth factor (bFGF) (R & D Systems) for expansion and maintenance of undifferentiated hESC / iPSC (CF1 mouse, Charles River Kingston) on the feeder layer. The hESC / iPSC colonies were subcultured weekly by mechanically dividing and transferring onto the freshly prepared MEF feeder layer. HESC / iPSC colonies were isolated into 1-5 cells using TrypLE (Invitrogen) or collagenase IV (0.1 mg / mL; STEMCELL technology) for colony formation assays and other assured assays. TESR medium using STEMCELL technology) was cultured on MatrigelTM. Media replacement and bFGF supplementation were performed daily without any mention. The hNSC colonies were derived from in vitro differentiation of hESCs and hiPSCs (16, 18), previously known. hNSCs were expanded bFGF (20 ng / mL) in ITSA medium (13, 18) and subcultured weekly for long term expansion. Although the final differentiation of hNSCs is not bFGF, brain-derived neurotrophic factor (20 ng / mL) (R & D Systems), glial cell line derived neurotrophic factor (20 ng / mL) (R & D Systems), or dibutyryl cAMP (0.5 mmol / L) (Sigma). The following compounds were used: doxycycline (Sigma), minocycline (Sigma), tetracycline (Sigma), kanamycin (Sigma), blasticidin (Invitrogen), chloramphenicol (Sigma), Y-27632 (Calniochem), LY294002 Calbiochem), Wortmannin (Millipore), PD98059 (Calbiochem).
독시사이클린 단독 사용에 따른 효과 분석Effects of single use of doxycycline
인간배아줄기세포 및 역분화 줄기세포(표 1 및 표 2 참조)에 동일한 효과를 보이나, 구체적으로 H9(WA-09) 인간 배아줄기세포를 계대배양하면서 하나의 그룹에는 독시사이클린을 처리하지 않았고(대조구), 또 다른 하나의 그룹에는 매일 독시사이클린을 첨가하여 배양하였다. 계대 배양은 콜라지네이즈를 이용하여 세포를 떼어내고, 중력에 의해 배아줄기세포를 가라앉히는 방법을 사용하여 1:5 로 분할 계대배양하였다. AccutaseTM 나 트립신을 이용하여 떼어내어도 독시싸이클린의 세포 생존의 효과를 볼 수 있었다. 매 계대 배양시 동일한 효과가 관찰되었고 8 계대까지 관찰하였으며, 계대 배양 후 6일째에 그 효과를 비교 관찰하였다. 향후 20 계대까지의 실험에서도 세포 생존의 지속적인 효과를 볼 수 있었고, 세포의 특성이 변하지 않았다.
Human Embryonic Stem Cells and Degenerated Stem Cells (see Table 1 and Table 2) showed the same effect, but specifically, H9 (WA-09) human embryonic stem cells were subcultured while one group was not treated with doxycycline ) And another group was supplemented with doxycycline daily. In the subculture, the cells were removed using collagenase, and the embryonic stem cells were subse- quently subcultured to 1: 5 by gravity. The effect of doxycycline on cell survival was observed even when the cells were detached using Accutase™ or trypsin. The same effect was observed in each subculture and observed up to 8 passages, and the effect was observed at 6 days after subculture. In the experiments up to 20 passages, we could see the continuous effect of cell survival, and the cell characteristics did not change.
독시사이클린 사용으로 배지 교환없이 배양 효과 분석Analysis of culture effect by using doxycycline without medium change
구체적으로 H9(WA-09) 인간 배아줄기세포를 배양하면서 하나의 그룹에는 독시사이클린을 처리하지 않았고(대조구), 또 다른 하나의 그룹에는 독시사이클린을 첨가하여 배지 교환 없이 6일간 배양하였다. 배양은 콜라지네이즈를 이용하여 세포를 떼어내고, 중력에 의해 배아줄기세포를 가라앉히는 방법을 사용하여 1:5로 분할 배양시 배지를 첨가하여 교환 없이 6일간 배양하였다. AccutaseTM 나 트립신을 이용하여 떼어내어도 독시싸이클린의 세포 생존의 효과를 볼 수 있었다. 피더층없이, TESR 배지(STEMCELL technology)를 이용하여, 혹은 Pluristem 배지 (Millipore)를 이용하여 MatrigelTM 상에서 배양하거나 마우스 피더층에 보통의 배아줄기세포 배지를 사용하여 배양하여 세포 생존 효과를 비교하였다.
Specifically, H9 (WA-09) human embryonic stem cells were cultured while one group was not treated with doxycycline (control), and another group was supplemented with doxycycline and cultured for 6 days without medium exchange. The cells were cultured using collagenase and the embryonic stem cells were submerged by gravity. The cells were cultured for 6 days without addition of medium when the cells were divided into 1: 5. The effect of doxycycline on cell survival was observed even when the cells were detached using Accutase™ or trypsin. Cell viability was evaluated by culturing on Matrigel™ using TESR medium or Millipore or using normal embryonic stem cell medium in the mouse feeder layer, using TESR medium (STEMCELL technology) without feeder layer.
면역 염색법Immunostaining
배양된 세포를 PBS 내의 4% 파라포름알데히드로 고정하였고, 표 3에 기재된 1차 항체와 함께 4℃에서 하루 동안 배양하였다. 시각화를 위해 적절한 형광-표지된 2차 항체(Jackson Immunoresearch Laboratories)를 이용하였다. 염색된 샘플을 DAPI 마운트 용액(Vector Laboratories)을 이용한 VECTASHIELD 내에 마운트 하였다.The cultured cells were fixed with 4% paraformaldehyde in PBS and incubated with the primary antibody described in Table 3 at 4 캜 for one day. Appropriate fluorescence-labeled secondary antibodies (Jackson Immunoresearch Laboratories) were used for visualization. Dyed samples were mounted in VECTASHIELD using DAPI mount solution (Vector Laboratories).
세포 주기 및 사멸 분석Cell cycle and death analysis
세포 생존능력은 종래 알려진 MTT 분석(28)에 의해 결정하였다. 아팝토시스성(apoptotic) 세포 사멸은, 아팝토시스성 세포-특이적 표지자인 절단된 캐스페이즈-3(cleaved Caspase-3) 및 아넥신(Annexin) V/PI에 대하여 양성인 세포의 현미경 상에서의 직접 계수(counting)에 의한 백분율에 의해 추정하였다. 아넥신 V/PI-염색된 세포를 FACS(CantoTMII)(Chemometec) 및 NucleoCounterㄾ (NC-3000TM)(Chemometec)를 이용하여 더 계수하였다. 각각의 세포 주기 단계 상에 축적된 세포 분포를 결정하기 위하여 FACS 분석을 적용하였다. 노화 β-갈락토시다아제 염색 킷(Senescence β-Galactosidase Staining Kit(Cell Signaling)를 이용하여 제조자의 지침에 따라 세포 노화를 결정하였다.
Cell viability was determined by a known MTT assay (28). Apoptotic apoptosis is induced by microscopic examination of cells positive for apoptotic cell-specific markers, cleaved Caspase-3 and Annexin V / PI And estimated by the percentage by direct counting. Annexin V / PI-stained cells were further counted using FACS (Canto™ II) (Chemometec) and NucleoCounter ™ (NC-3000™ ) (Chemometec). FACS analysis was applied to determine the cumulative cell distribution on each cell cycle phase. Cell senescence was determined using the senescence β-galactosidase staining kit (Cell Signaling) according to the manufacturer's instructions.
알칼리 포스파타아제 활성 분석Alkaline phosphatase activity assay
알칼리 포스파타아제 기질 킷 I(벡터)을 제조자의 지침에 따라 집락 내의 알칼리 포스파타아제 활성을 분석하기위해 사용하였다.
Alkaline phosphatase substrate kit I (vector) was used to analyze alkaline phosphatase activity in colonies according to the manufacturer's instructions.
전분화능의 측정Measurement of total differentiation ability
2주간 피더-프리(feeder-free) 배양물로부터 dFGF를 제거하는것에 의해 3개의 생식 계통으로의 hESCs의In vitro 분화를 유도하였고, 그 후 세포를 내배엽(Foxa2, α-태아 단백질(Feroprotein), 중배엽(smooth muscle actin(SAM)) 및 , 외배엽(Tuj1, GFAP)에 대해 특이적인 마커를 위해 면역 염색하였다. 6주령 NOD/SCID 마우스의 생식선 하에 1×106 H9 hESCs(독시사이클린의 존재하에 8계대수로 56일간 배양)를 주사하는 것에 의해, In vivo 기형종(teratoma) 형성을 유도하였다. 8주 후, 얻어진 종양을 제거하고, 파라핀에 침지시켰다. 구획은 해마톡실린 및 에오신(H&E)을 이용하여 염색하였다.
In vitro differentiation of hESCs into three germline lines was induced by removing dFGF from a 2-week feeder-free culture, after which the cells were incubated with endoderm (Foxa2, alpha-fetoprotein, Were immunostained for specific markers for smooth muscle actin (SAM) and ectoderm (Tuj1, GFAP). 6 x 106 H9 hESCs (8 passages in the presence of doxycycline) After 8 weeks, the obtained tumor was removed and immersed in paraffin The compartment was filled with hyaline toxicillin and eosin (H & E) < RTI ID = 0.0 > .
염색체분석(Karyotying)Karyotying
대한민국 서울의 네오딘 의학 연구소(NEODIN medical institute)에서의 표준 G 밴딩(standard G banding)에 의해, 독시사이클린(1 μg/mL)의 존재하에서 보존된 hESCs(H9) 상에서 염색체분석이 수행되었다.
Chromosome analysis was performed on hESCs (H9) stored in the presence of doxycycline (1 μg / mL) by standard G banding at the NEODIN medical institute in Seoul, Korea.
정량적 PCR 분석Quantitative PCR analysis
공지된 방법을 통해(29) 총 RNA 준비 및 cDNA 합성을 수행하였다. RT2 Profiler PCR ArrayR(Qiagen)를 사용하는 세포 아팝토시스-관련 단백질(cat. 330231 PAHS-012ZA) 및 인간 줄기 세포 전사인자(cat. 330231 PAHS-501ZA)에 대하여 고-처리율 유전자 발현 프로파일링을 수행하였다. 일반적인 리얼-타임 PCR 분석을 이용하여 결과를 더 확인하였다.
Total RNA preparation and cDNA synthesis were performed (29) through known methods. High-throughput gene expression profiling for cell apoptosis-related proteins (cat. 330231 PAHS-012ZA) and human stem cell transcription factors (cat. 330231 PAHS-501ZA) using RT2 Profiler PCR ArrayR (Qiagen) Respectively. Results were further confirmed using general real-time PCR analysis.
세포 내의 신호 활성화의 측정Measurement of intracellular signal activation
인간 포스포-키나아제 분석(Proteome ProfilerTM 분석)(R&D systems) 및 CBA 복합화 비드-기반 면역 분석(560005, 560010, 560012, 560013, 560015, 560059, 560065, 560093, 560150, 560792, BD)을 이용하여 제조자의 지침에 따라, 독시사이클린의 처리에 의해 활성화된 세포 내의 신호를 검출하였다. 상기 검출에 의해 얻은 결과를 확인하거나, 엑틴미오신 과활성화와 관련된 E-캐드헤린 및 pMLC와 같은 단백질의 수준을 확인하기 위해, 공지된 방법을 통해(30) 웨스턴 블랏 분석을 수행하였다.
Using based immunoassay (560005, 560010, 560012, 560013 , 560015, 560059, 560065, 560093, 560150, 560792, BD) - human phospho-kinase assay (Proteome ProfilerTM analysis) (R & D systems) and CBA complexed bead In accordance with the manufacturer's instructions, intracellular signals activated by treatment with doxycycline were detected. Western blot analysis was performed (30) through known methods to confirm the results obtained by the detection, or to ascertain levels of proteins such as E-cadherin and pMLC associated with actin myosin and activation.
PI3 키나아제 활성 분석PI3 kinase activity assay
공지된 방법에 의해(31) 일반적인 방사선사진-기반 PI3K 활성 분석을 수행하였다. 요컨대, 독시사이클린의 존재 또는 부재 하에 배양된 H9 hESCs로부터의 총 세포 추출물로부터, 항-PI3K 항체(antip85)를 이용하여 PI3K를 면역 침강시켰다. 효소 반응은 [γ-32P]ATP 및 L-a17 포스파티딜이노시톨(기질)을 침전물에 첨가하는 것에 의해 개시하였고, 반응에 의해 방사능표지된 물질은 방사능 사진을 이용하여 검출하였다. PI3K 활성에 대한 독시사이클린의 효과는, 세포 추출물의 부재에서 재조합 클래스 I PI3K 효소 단백질 및 기질(PIP2)이 결합되는 상업적으로 이용가능한 키트(PI3 kinase activity/inhibitor assay kitR(Millipore))를 이용하여 더 확인하였다. PI3K 활성자/억제자 활성은 약간 변형된 제조자의 지침에 따라 측정하였다.
General radiographic-based PI3K activity assays were performed by (31) a known method. In short, PI3K was immunoprecipitated with anti-PI3K antibody (antip85) from total cell extracts from H9 hESCs cultured in the presence or absence of doxycycline. The enzymatic reaction was initiated by adding [? -32P] ATP and L-a17 phosphatidylinositol (substrate) to the precipitate and the radioactively labeled substance by reaction was detected using radioactivity. The effect of the doxycycline on PI3K activity was further assessed using a commercially available kit (PI3 kinase activity / inhibitor assay kitR (Millipore)) in which the recombinant class I PI3K enzyme protein and substrate (PIP2) Respectively. The PI3K activator / inhibitor activity was measured according to the manufacturer's instructions with a slight modification.
독시사이클린과 Y-27632 병용 사용에 따른 효과 분석Analysis of Effects of Combined Use of Doxycycline and Y-27632
인간배아줄기세포 및 역분화 줄기세포 (표1 및 표2 참조)에 동일한 효과를 보이나, 구체적으로 H9(WA-09) 인간 배아줄기세포를 계대배양하면서 하나의 그룹에는 독시사이클린과 Y27632를 처리하지 않았고(대조구), 다른 하나의 그룹에는 독시사이클린(1 μg/ml)만을 매일 처리하였으며, 또 다른 하나의 그룹에는 Y-27632(10 μM)를 매일 처리하였고, 또 다른 하나의 그룹에는 매 계대 첫날에 독시사이클린과 Y-27632를 동시에 첨가하고, 다음 날부터는 독시사이클린 만을 첨가하여 배양하였다.
Human Embryonic Stem Cells and Degenerated Stem Cells (see Table 1 and Table 2) showed the same effect, but specifically, H9 (WA-09) human embryonic stem cells were subcultured while one group did not treat doxycycline and Y27632 (1 μg / ml) was treated daily in the other group, Y-27632 (10 μM) was treated in the other group daily, and the other group was treated with doxycycline And Y-27632 were added at the same time, and from the following day, only doxycycline was added and cultured.
통계 분석Statistical analysis
두 그룹의 통계적인 비교는 스튜던트 양측(2-tailed) t 검정 또는 양측 짝지은(2-tailed paired) t 검정에 의해 수행하였다. 둘 이상의 그룹을 비교하기 위해, 셰페(Scheffe) 또는 투키 사후 분석(Tukey post-hoc analysis)(SPSS Inc)을 이용한 1원 분산분석(one-way ANOVA)을 적용하였다.
Statistical comparisons of the two groups were performed by Student's two-tailed t-test or two-tailed paired t-test. One-way ANOVA with Scheffe or Tukey post-hoc analysis (SPSS Inc) was applied to compare two or more groups.
실험 결과Experiment result
인간 NSCs(hNSCs)가 hESC/iPSCs의in vitro 분화에 의해 유래되었다. hESC/iPSC-유래의 NSCs(hES/iPS-NSCs)는 대표적인 NSC-특이적 표지자(13)인 네스틴(nestin)을 균질하게 발현하였다. 상기 네스틴+hNSCs는 bFGF(basic fibroblast growth factor)에 의해 확장될 수 있고, bFGF의 제거 및 결합성 신경영양인자의 존재하에서 뉴론 세포로 분화된다(13, 14).
Human NSCs (hNSCs) are derived byin vitro differentiation of hESC / iPSCs. hESC / iPSC-derived NSCs (hES / iPS-NSCs) homogeneously expressed a representative NSC-specific marker (13) nestin. The nestin + hNSCs can be expanded by basic fibroblast growth factor (bFGF) and are differentiated into neuronal cells in the presence of bFGF and binding neurotrophic factor (13, 14).
도 1 내지 도 71 to 7
도 1 내지 도 7은 hNSCs의 배양물 및 hESC/iPSCs로부터 유도된 뉴론 상의 독시사이클린 보충의 효과를 나타낸다.
Figures 1-7 show the effect of the doxycycline supplementation on cultures of hNSCs and neurons derived from hESC / iPSCs.
독시사이클린은 hNSC 배양물에 있어서의 고농도의 인슐린(참조: 도 1) 또는 낮은 세포 농도(참조: 도 2)에 의해 유발되는 아팝토시스성 세포 사멸을 방지한다. (a) 1.4×105/cm2 또는 (b) 3.4×104/cm2로 도말된 H9 hESC-유래의 NSCs를 독시사이클린 보충(1μg/mL)과 함께 또는 보충 없이 배양하였다. 생존가능한 세포 계수 및 활성화된(절단된) 캐스페이즈 3에 대해 양성인 세포에 의해 아팝토시스성 세포 사멸을 측정하였다. 높은 인슐린 농도를 갖는 배양물에서의, 대표적인 위상차 및 절단된 캐스페이즈 3 염색된 이미지는 왼쪽 패널에 나타내었다. 스케일바는 50 μm를 나타낸다.Doxycycline prevents apoptotic cell death induced by high levels of insulin (Fig. 1) or low cell concentration (Fig. 2) in hNSC cultures. H9 hESC-derived NSCs plated with (a) 1.4 x 105 / cm2 or (b) 3.4 x 104 / cm2 were cultured with or without supplementation with doxycycline supplement (1 μg / mL). Apoptotic cell death was measured by viable cell counts and cells positive for activated (truncated)
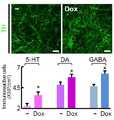
도 3은 뉴론 생존상의 독시사이클린의 효과를 나타낸다. 뉴론의 하위유형은 9일간 H9 hESC-NSCs의 분화에 의하여 유도되었다. 뉴론 배양물은 5일간 독시사이클린의 보충에 의해 또는 보충 없이 유지하였다. 배양 마지막 날, 도파민 활성(TH), 세로톤 활성(serotonin) 및 GABA활성(GABA) 뉴론을 구별하기 위하여 면역 염색을 수행하였다. 스케일바는 50 μm를 나타낸다.Figure 3 shows the effect of doxycycline on neuronal survival. Subtypes of neurons were induced by differentiation of H9 hESC-NSCs for 9 days. Neuron cultures were maintained for 5 days with or without supplementation of doxycycline. On the last day of culture, immunostaining was performed to distinguish between dopamine activity (TH), serotonin activity and GABA activity (GABA) neurons. The scale bar represents 50 μm.
도 4 및 도 5는 독시사이클린, 이와 유사체(미노사이클린, 테트라사이클린) 및 다른 항생제의 세포 생존 효과를 비교한 것을 나타낸다. H9 hESCs 유래 hNSCs의 분화 동안, 정해진 농도의 항생제를 배양배지에 보충하였다. 세포 생존력은 MTT 분석에 의해 분화 5일째날 측정하였다. 각각의 항생제-처리된 배양물로부터의 가장 높은 MTT 값(세포 생존능)은 도 5에서 비교하였다. 무처리 대조구(점선)와 p<0.01에서 매우 달랐다. 미노사이클린, 테트라사이클린과 같은 유사체에 비하여 독시사이클린의 세포 생존 증진 효과가 더욱 우수하였으며, 다른 항생제의 경우에는 이러한 효과를 발휘하지 못하였다. 이는 독시사이클린-매개의 세포 생존 증대 효과가 그것의 항생제 효과와 연관되어 있지는 않은 것을 보여준다.Figures 4 and 5 show a comparison of cell survival effects of doxycycline, analogs (minocycline, tetracycline) and other antibiotics. During the differentiation of H9 hESCs-derived hNSCs, a defined concentration of antibiotics was added to the culture medium. Cell viability was measured on the 5th day of differentiation by MTT assay. The highest MTT values (cell viability) from each antibiotic-treated culture were compared in FIG. (P <0.01) compared to the untreated control (dotted line). The effect of doxycycline on cell survival was better than that of minocycline and tetracycline, and other antibiotics did not show this effect. Suggesting that the increase in cell survival of the doxycycline-mediated is not associated with its antibiotic effect.
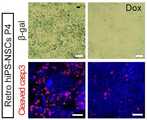
도 6, 7은 독시사이클린 보충이 세포 계대배양 동안 바이러스성 hiPS-유래 NSCs에 있어서의 이른 노화 및 아팝토시스성 세포 사멸을 예방하는 것을 나타낸다. 레트로바이러스성(Retro-2, 가운데 도), 렌티바이러스성 hiPSC 주(line)(Lenti-1, 우측 도) 및 H9 hESCs(대조구, 좌측 도)로부터 유래된 NSCs는 독시사이클린 보충의 존재 또는 부존재 하에서 매 7일마다 계대배양 하는 것에 의해 확장되었다. 도 6에 나타낸 세포 생장 곡선은 매 계대의 마지막 날에 총 생존 가능한 세포의 수를 계수하는 것에 의해 표시하였다. p<0.01에서의 독시사이클린-보충된 배양물에 있어서, 생존 가능한 세포 수의 대폭적인 증가를 보였다.Figures 6 and 7 show that doxycycline supplements prevent premature aging and apoptotic cell death in viral hiPS-derived NSCs during cell passaging. NSCs derived from retroviral (Retro-2, middle), lentiviral hiPSC lines (Lenti-1, right) and H9 hESCs (control, left hand) It was expanded by subculturing every 7 days. The cell growth curve shown in Fig. 6 was indicated by counting the total viable cells on the last day of each passage. In doxycycline-supplemented cultures at p < 0.01, the number of viable cells was significantly increased.
도 7은 독시사이클린 처리(우측) 및 비처리(좌측)의 레트로-2-hiPS-NSC 배양물에 있어서, 계대수 4의 마지막 날, 대표적인 β-갈락토시다아제(위, 세포 노화) 및 활성화 캐스페이즈 3(아래, 아팝토시스)-염색 세포를 나타낸다. 스케일바는 50μm를 나타낸다.Figure 7 shows the final day of
바이러스 유래 iPSCs의 NSC로의 분화는 7계대 이상의 생존이 어려운 제약이 있었으나, 독시사이클린의 처리로 이 문제를 해결하였다.
The differentiation of viral-derived iPSCs into NSCs has been limited by the difficulty of survival over 7 passages, but the problem has been solved by treatment with doxycycline.
도 8 내지 도 188 to 18
독시사이클린 보충은, 배양에 있어서 세포 생존 및 미분화 hESC/iPSCs의 유지를 강화하였다.The doxycycline supplement enhanced cell viability and retention of undifferentiated hESC / iPSCs in culture.
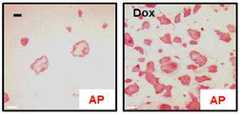
도 8 및 도 9는 AP+ 콜로니 형성 효율을 나타낸다. 해리된 hESC/iPSCs는 4×104 세포/6 cm 접시로 도말하고, 독시사이클린(1 μg/ml)의 존재 또는 부존재 하에서, mTESR 배지를 이용한 피더-프리 매트리겔에서 배양하였다. 5일 후 배양물을 염색하고, 알칼리 포스파테이즈(alkaline phosphatase, AP), 미분화 hESC/iPSC 표지자, 및 AP+ 콜로니를 계수하였다. p<0.01, n=5-8, 스튜던트 양측 t 검정을 이용하였다. 도 9는 대표적인 H9 hESCs로부터의 AP+ 콜로니이다. 스케일바는 100 μm이다.Figures 8 and 9 show AP + colony formation efficiency. The dissociated hESCs / iPSCs were plated in 4 × 104 cells / 6 cm dishes and cultured in feeder-free matrigel using mTESR medium in the presence or absence of doxycycline (1 μg / ml). After 5 days, the culture was stained and alkaline phosphatase (AP), undifferentiated hESC / iPSC markers, and AP + colonies were counted. p <0.01, n = 5-8, Student's t-test was used. Figure 9 is AP + colonies from representative H9 hESCs. The scale bar is 100 μm.
도 10은 독시사이클린 처리에 의해 수정된 항-/프로-아팝토시스성 유전자에 대한 발현 어레이를 나타낸다. H9 hESCs를 독시사이클린의 존재 또는 부존재하에서 배양하였고, RT2 PCR Profiler ArrayR를 이용하여 항-/프로-아팝토시스성 유전자의 발현 수준을 추정하였다. 좌측에 나타낸 것은 독시사이클린-처리된 배양물에 있어서의 증가된 항-아팝토시스성(빨간 점들) 및 감소된 프로-아팝토시스성(파란 점들) 전사의 경향을 보여주는 'volcano plot'이다. 수직의 분홍색 선은 유전자 발현 역치(threshold)에서의 1.5배 변화를 나타낸다. p<0.05(수평의 파란선)에서 독시사이클린 처리에 의해 상당히 증가- 또는 감소-조절된 유전자는 각각의 막대 그래프로 나타내었다.Figure 10 shows an expression array for an anti- / pro-apoptotic gene modified by doxycycline treatment. To estimate the level of expression of apoptosis genes - H9 hESCs were cultured in the presence or absence of doxycycline, wherein using the RT2 Profiler PCR ArrayR - / pro. On the left is a 'volcano plot' showing the tendency of increased anti-apoptosis (red dots) and reduced pro-apoptotic (blue dots) transcription in the doxycycline-treated cultures. The vertical pink line represents a 1.5-fold change in gene expression threshold. Significantly increased or decreased by the treatment with doxycycline at p < 0.05 (horizontal blue line) The regulated genes are indicated by respective bar graphs.
도 11은 hESC 세포 확장에 대한 장기간(long-term) 배양에 있어서의 세포 성장 곡선을 나타낸다. 독시사이클린(1 μg/ml)이 포함된 또는 포함되지 않은 bFGF-보충된 KSR 배지 내의 MEF 피더 상에서, 56일 동안 8 계대수로, H9 hESCs를 배양하였다. 곡선은 매 계대의 마지막 날에 총 생존 가능한 세포 수를 계수하는 것에 의해 나타내었다. p<0.001에서의 동일한 세포 계대에 있어서의, 각각의 무처리 대조구와 상당히 달랐다. 독시사이클린의 처리에 의하여 세포 수의 뚜렸한 증가를 확인하였다.Figure 11 shows the cell growth curves in long-term cultures for hESC cell expansion. H9 hESCs were cultured in 8 passages for 56 days on MEF feeders in bFGF-supplemented KSR medium with or without doxycycline (1 μg / ml). The curves are indicated by counting the total viable cell counts at the last day of each passage. 0.0 > p < 0.001. < / RTI > A significant increase in cell number was confirmed by treatment with doxycycline.
도 12는 독시사이클린-보충 배양물의 8 계대 배양 후 H9 세포의 수정되지 않은 핵형을 나타낸다. 20개의 무작위-선정한 핵 내에서 염색체 분석을 수행하였다. 독시사이클린에 의하여 염색체의 손상이나 변화가 유발되지 않았다.Figure 12 shows the unmodified karyotype of H9 cells after 8 passages of doxycycline-supplemented cultures. Chromosome analysis was performed in 20 randomly selected nuclei. Doxycycline did not cause damage or change of chromosome.
도 13 내지 18은 hESC 생존 및 유지에 있어서의 독시사이클린 및 Y-27632의 효과 비교한 것을 나타낸다. 해리된 H9 세포를 낮은 세포 농도(500 세포/웰, 96-웰 플레이트)에서 도말하였고, 메트리겔-mTeSR에서, 독시사이클린(1 μg/ml) 또는 Y-27632(10 μM)를 사용하거나 사용함이 없이 5일 동안 배양하였다. 5일간의 세포 생장은 도 13에 나타내었다. 독시사이클린을 처리하는 경우, 무처리의 대조구는 물론이고, Y-27632에 비하여도 확연한 세포 수의 증가를 확인할 수 있었다. 형성된 콜로니의 수(참조: 도 14) 및 크기(참조: 도 15)를 비교하였다. 클론의 수는 세포 생존과 관계되어 있으며, 콜론의 크기는 세포의 증식과 관계되어 있다. 독시사이클린을 처리하는 경우 무처리 대조군에 비하여 세포의 생존 및 증식이 상당히 증대됨을 확인하였고, Y-27632에 비하여 세포의 증식 증대 효과가 월등함을 확인하였다. *p<0.001 대조구와 비교, #p<0.05 Y-27632 처리군과 비교, 투키 포스트-호크 분석을 이용한 1원 분산분석(One-way ANOVA), n=5 독립 연구를 수행하였다(도 13 내지 도 15).Figures 13 to 18 show a comparison of the effects of doxycycline and Y-27632 on hESC survival and maintenance. Dissociated H9 cells were plated at low cell density (500 cells / well, 96-well plate) and either in the metrygel-mTeSR with or without the use of either doxycycline (1 ug / ml) or Y-27632 And cultured for 5 days. The cell growth for 5 days is shown in Fig. In the case of treatment with doxycycline, it was confirmed that the increase in the number of cells was noticeable in comparison with that of Y-27632 as well as the untreated control. The number of colonies formed (see FIG. 14) and size (see FIG. 15) were compared. The number of clones is related to cell survival, and the size of colon is related to cell proliferation. In the case of treatment with doxycycline, it was confirmed that the survival and proliferation of cells were significantly increased compared to the untreated control group, and that the cell proliferation increase effect was superior to that of Y-27632. One-way ANOVA with n = 5 independent studies was performed (p < 0.001 compared with control, # p < 0.05 compared with Y- 27632 treated group, one- way ANOVA with Tukey Post- 15).
도 16은 무처리, Y-27632-처리, 및 독시사이클린-처리한 배양물로부터의 대표적인 콜로니의 위상차 이미지를 나타낸다. 지정된 세포의 고성능 이미지이며, 스케일바는 50μm를 나타낸다. Y-27632를 처리하는 경우 세포의 형태(morphology)에 변화가 발생함을 관찰하였고, 이는 세포에 좋지 않은 영향을 미침을 의미한다. 그러나 독시사이클린을 처리하는 경우에 이러한 형태의 변화가 관찰되지 않았으며, 이는 독시사이클린의 처리가 Y-27632 처리로 인한 문제를 해결할 수 있음을 의미한다.Figure 16 shows phase contrast images of representative colonies from untreated, Y-27632-treated, and doxycycline-treated cultures. It is a high-performance image of the designated cell, and the scale bar represents 50 μm. It was observed that the morphology of Y-27632 cells was changed, which means that they had a bad influence on the cells. However, this type of change was not observed when treating doxycycline, which means that the treatment of doxycycline can solve the problem caused by treatment with Y-27632.
도 17은 AP+ 미분화된 콜로니의 %비율을 나타낸다. *p<0.01 대조구와 비교, #p<0.05 Y-27632 처리군과 비교, 각각의 그룹에서 n=9, 분산분석(ANOVA)을 수행하였다. 독시사이클린을 처리하는 경우 미분화된 클론의 %비율이 무처리 대조구 및 Y-27632를 처리하는 경우에 비하여 높게 측정되었다.Figure 17 shows the percentage of AP + undifferentiated colonies. * p <0.01 compared with control, #p <0.05 compared with Y-27632 treated group, n = 9, ANOVA was performed in each group. The percentage of undifferentiated clones treated with doxycycline was higher than that of untreated control and Y-27632.
도 18은 독시사이클린으로 처리한 H9 세포 내에서의 인간 줄기 세포 전사 인자를 코딩하는 유전자의 발현 수준을 무처리 배양에서의 발현 수준과 비교한 것을 나타낸다. 산포도에서, 분홍색 직선은 유전자 발현 역치(threshold)에서의 2배 변화를 나타낸다. 전분화능(빨간 점)과 연관된 유전자의 발현을 선정하고, 대조구와 상대되는 독시사이클린 처리 배양물 내의 배율 변화(fold change)는 오른쪽 그래프에 나타내었다.FIG. 18 shows the expression levels of genes encoding human stem cell transcription factors in H9 cells treated with doxycycline compared with the level of expression in untreated cultures. In the scatter plot, the pink straight line represents a 2-fold change in gene expression threshold. The expression of the genes associated with pre-differentiation potential (red dot) was selected and the fold change within the treated dog versus control cultures was shown in the right graph.
hESC와 iPSCs의 배양시 독시사이클린의 처리만으로 줄기세포의 생존율을 높일 수 있음을 확인하였다. 특히, 종래의 배아줄기세포 생존 향상에 우수한 효과가 알려져 있고 상용화된 Y-27632와 비교하는 경우에도 월등한 효과를 확인할 수 있었다.
It was confirmed that the survival rate of stem cells can be increased only by treating with hESC and iPSCs by treatment with doxycycline. In particular, it has been known that an excellent effect is obtained in improving survival of embryonic stem cells in the past, and even when compared with commercialized Y-27632, a superior effect can be confirmed.
도 1919
인간 배아 줄기세포는 매일 싸이토카인의 첨가와 배지 교환을 해 줘야하는 불편으로 많은 연구자들이 배양이 어려움을 겪고 있으나, 단순히 독시사이클린의 처리만으로 배지 교환 시기를 늘리는 효과를 확인하였다(참조: 도 19). 이는 배지를 교환하기 어려운 실험 조건, 예를 들면 배지교체 없이 지속적인 세포 성장 관측이 필요한 실험에 있어서 매우 유용하며, 배지를 교체해야하는 실험자의 수고를 덜 수 있다. 현재 배지교환 없이 배아줄기세포를 7일간 생존시킬수 있다고 알려진 Millipore사의 Pluristem 배지에 독시싸이클린을 첨가하여도 월등한 배양향상 효과를 볼 수 있으며, 다른 배지에 독시싸이클린을 첨가하는 것만으로도 Pluristem 배지에 비해 더욱 효율적인 배아줄기세포 배양이 가능하다.
Although human embryonic stem cells have difficulty in culturing because of the inconvenience of daily addition of cytokines and medium exchange, many researchers have found the effect of increasing the time of medium replacement only by treatment with doxycycline (see FIG. 19). This is very useful in experimental conditions where it is difficult to exchange the medium, for example, in experiments in which continuous cell growth observation is required without replacing the medium, and labor of the operator who needs to change the medium can be reduced. Addition of doxycycline to Millipore's Pluristem medium, which is known to be able to survive embryonic stem cells for 7 days without replacing the current medium, provides superior culture enhancement, and the addition of doxycycline to other media is equivalent to the Pluristem medium More efficient embryonic stem cell culture is possible.
도 20 내지 도 2920 to 29
독시사이클린은 PI3K-Akt 신호 활성화를 통해 미분화 hESCs의 세포 생존과 유지를 가능하게 한다.
Doxycycline enables the cell survival and maintenance of undifferentiated hESCs through PI3K-Akt signal activation.
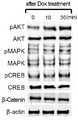
도 20 내지 22은 세포 해리-유발의 엑토미오신 과활성화가 Y-27632에 의해 방지되었으나, 독시사이클린 처리에 의해서는 방지되지 않는 것을 보여준다. H9 hESCs를 독시사이클린 또는 Y-27632와 함께 또는 상기 화합물 없이(대조군), 세포 해리 전 1시간 동안 배양하였다. 세포는 세포 해리 0분, 10분 및 30분 후 회수하였고, 세포-해리-유발의 아팝토시스와 연관된 단백질을 검출하기 위하여 웨스턴블랏을 실시하였다(참조: 도 20). 도 21 및 22은 Y-27632 또는 독시사이클린 처리된 배양물 내에서의 대표적인 pMLC-면역염색 이미지 및 해리된 hESCs의 위상차 이미지를 나타낸다. Y-27632 또는 독시사이클린으로 전처리된 세포를 해리시켰고, 직접 mTESR를 갖는 메트리겔 상에 도말하였으며, 상기 화학물질의 계속적인 존재하에 배양하였다. 상기 이미지는 도말(해리) 후 지정된 시간에 수집하였다. 스케일바는 10 μm이다. 도 20에서 볼 수 있듯이, Y-27632를 전처리하는 경우에는 E-캐드헤린은 감소하지 않고, pMLC는 감소하는 것을 관찰할 수 있으나, 대조적으로 독시사이클린을 전처리하는 경우에는 무처리의 대조구와 마찬가지로 E-캐드헤린은 감소하고 pMLC는 증가하는 것을 확인할 수 있다. 이는 독시사이클린이 Y-27632와 같은 ROCK 억제제가 아님을 보여준다.Figures 20-22 show that cell dissociation-induced excomyosis and activation were prevented by Y-27632 but not by the treatment with doxycycline. H9 hESCs were incubated with or without doxycycline or Y-27632 (control) for 1 hour before cell dissociation. Cells were harvested at 0, 10 and 30 minutes after cell dissociation and Western blot was performed to detect proteins associated with cell-dissociation-induced apoptosis (see Fig. 20). Figures 21 and 22 show representative pMLC-immunostained images and dissociated hESCs phase contrast images in Y-27632 or doxycycline treated cultures. Cells pretreated with Y-27632 or doxycycline were dissociated and plated on a matrigel with direct mTESR and cultured in the presence of the same chemical. The images were collected at designated times after smearing (dissociation). The scale bar is 10 μm. As can be seen from FIG. 20, when Y-27632 was pretreated, E-cadherin did not decrease and pMLC decreased, but in contrast, when pretreating didxycycline, the E- Cadherine decreases and pMLC increases. This shows that doxycycline is not a ROCK inhibitor such as Y-27632.
도 23은 독시사이클린에 의해 활성화된 세포 내부 신호의 추정을 나타낸다. H9 hESCs는 획득 전에 독시사이클린(1 μg/ml)과 함께 또는 독시사이클린 없이(대조군) 30분간 배양하였고, 46 인산화된 세포내 단백질을 검출하기 위해 고안된 인간 포스포키나아제 블랏 어레이R를 이용하여 면역블랏 분석하는데 이용하였다. 상기 어레이 분석은 3회 수행되었다. 무처리 대조구 및 독시사이클린 처리 세포의 블랏의 대표 쌍을 나타내었다. 블랏에 있어서, 독시사이클린-처리군 중 대조구와 비교하여 그 강도가 1.5배 이상인 점 들은 점선 원으로 표시하였다. 참조 점은 밑줄로 표시하였다. 오른쪽의 그래프는 세 개의 블랏으로부터 표시된 점의 강도의 수치적으로 분석된 값을 나타낸다. p<0.001** 및 p<0.05* 에서의 짝 비교 t 검정(paired t-test) 결과가 대조구와 상당히 달랐다. 독시사이클린 처리 0분, 10분 및 30분 후의 상기 신호 활성화를 웨스턴블랏 분석으로 더 측정하였다(참조: 도 24). 도 20에서도 독시사이클린 처리시 pAKT 신호의 증가를 관찰할 수 있었듯이, 도 23에 있어서 독시사이클린-매개의 생존 및 미분화 hESCs의 유지에 대하여 어떠한 세포 내부 신호 단백질이 영향을 미치는가 결정하기 위하여 46개 세포 내부 신호 단백질의 활성을 인간 포스포-키나아제 분석(Proteome ProfilerTM, R&D Systems)를 이용하여 스크린하였다(참조: 도 23). 그 결과 독시사이클린 처리 배양물에 있어서 pAKT의 두드러진 활성화를 관찰할 수 있었다. PI3K-AKt 세포 내부 신호가 hESC 다능성 및 자기-재생의 유지에 대한 가장 중요한 신호 경로로서 밝혀졌다.Figure 23 shows the estimation of intracellular signals activated by doxycycline. H9 hESCs were incubated with doxycycline (1 μg / ml) or without doxycycline (control) for 30 min prior to acquisition and immunoblot analyzes were performed using human phosphokinase blot arrayR designed to detect 46 phosphorylated intracellular proteins Respectively. The array analysis was performed three times. Representative pairs of blots of untreated control and doxycycline treated cells. In the blot, points in the doxycycline-treated group whose intensity was 1.5 times or more as compared with the control were indicated by dotted circles. The reference points are underlined. The graph on the right shows the numerically analyzed values of the intensity of the displayed points from the three blots. The paired t-test results at p <0.001 ** and p <0.05 * were significantly different from the control. The signal activation at 0, 10 and 30 minutes after the treatment with doxycycline was further determined by western blot analysis (see FIG. 24). 20, as shown in Fig. 23, in order to determine the influence of the intracellular signal proteins on the survival of the doxycycline-mediated survival and undifferentiated hESCs, as shown in Fig. 23, Protein activity was screened using a human phospho-kinase assay (Proteome Profiler, R & D Systems) (see Figure 23). As a result, significant activation of pAKT was observed in the doxycycline treated cultures. PI3K-AKt cell internal signals have been identified as the most important signal pathways for the maintenance of hESC pluripotency and self-renewal.
본 발명자들은 hESC 생존(참조: 도 25), 자기-재생(참조: 도 26), 및 미분화 상태의 유지(참조: 도 27)에 대한 독시사이클린의 효과가 PI3K 억제제인 LY29007 및 워트만닌(Wortmannin)에 의해 감소 또는 제거됨을 확인하였다.
We have shown that the effects of doxycycline on hESC survival (Fig. 25), self-regeneration (Fig. 26), and retention of undifferentiated state (Fig. 27) are inhibited by PI3K inhibitors LY29007 and Wortmannin And it was confirmed that it was reduced or eliminated by
도 25 내지 27은 AP+ 콜로니의 수(도 25), 크기(도 26), 및 퍼센트 비율(도 27)에 대한 독시사이클린-유발 효과가 PI3K-Akt 신호에 특이적인 차단제에 의해 차단되었음을 나타낸다. PI3K-Akt 차단제인 LY29002(20 μM) 또는 워트만닌(wortmannin)(100 μM) 또는 Raf-Erk 차단제인 PD98059(10 μM)를 포함하거나 또는 포함하지 않는 독시사이클린(1 μg/ml) 또는 비히클(DMSO)의 존재 하에서 5일 동안 해리된 H9 세포를 배양하는 것에 의해 콜로니 형성 분석을 수행하였다. n=3 독립 실험이며, 투키 포스트-호크 분석을 이용한 1원 분산분석(one-way ANOVA)에 있어서, *p<0.001에서 비히클로 처리한 대조구 배양물 및 #p<0.005에서 독시사이클린 단독으로 처리한 배양물과 상당히 달랐다.Figures 25-27 show that the doxycycline-induced effect on the number of AP + colonies (Figure 25), size (Figure 26), and percentage (Figure 27) was blocked by a blocker specific to the PI3K-Akt signal. (1 μg / ml) or vehicle (DMSO) containing or not containing PI3K-Akt blocker LY29002 (20 μM) or wortmannin (100 μM) or Raf-Erk blocker PD98059 Lt; RTI ID = 0.0 > H9 < / RTI > cells for 5 days. In the one-way ANOVA with Tukey Post-Hawk analysis, n = 3 independent experiments, the control cultures treated with vehicle at p < 0.001 and treated with doxycycline alone at #p < 0.005 It was significantly different from the culture.
도 28 및 29는 독시사이클린에 의해 강화된 PI3K 효소 활성을 나타낸다. 도 28은 일반적인 방사능 사진 기반 PI3K 활성 분석을 나타낸다. 분석을 위한 양성 대조구로서, PI3K 활성은, 알려진 PI3K 억제제(엑콜)(31)(왼쪽 도)를 포함하는 또는 포함하지 않는 대조세포주(인간 유방 암 세포 MDA-MB-231)에서 동시에 결정하였다. 도 29는 PI3K 활성에 대한 독시사이클린의 효과를 PI3 kinase activity/inhibiter assay kitR를 이용하여 측정한것을 나타낸다. 분석은 또한 다른 항생제 또는 알려진 PI3k 억제제(대조구)의 존재하에서 수행되었다: 독시사이클린(Dox); 테트라사이클린(Tet); 미노사이클린(Mino); 카나마이신(Kan); Chloramphenicol(Chlor); Blastcidine(Blas). 그래프는 억제제/활성제 없는 활성을 제외한 후의 계산된 PI3K 효소 활성을 나타낸다. 독시사이클린 복용량-의존 PI3K 활성 곡선도 표시하였다.Figures 28 and 29 show PI3K enzyme activity enhanced by doxycycline. Figure 28 shows a general radiographic photo based PI3K activity assay. As a positive control for analysis, PI3K activity was determined simultaneously in a control cell line (human breast cancer cell MDA-MB-231) with or without a known PI3K inhibitor (Ecol) (31) (left hand diagram). FIG. 29 shows the effect of doxycycline on PI3K activity measured using the
독시사이클린 처리에 의해 직접적으로 포스포-AKT가 증가되는 PI3-키나아제를 활성화 시킴으로서 인간 줄기세포 생존력 증대 등의 주역할을 야기하게 됨을 확인하였다.
It has been confirmed that activation of PI3-kinase, which directly increases phospho-AKT by the treatment of doxycycline, leads to a major role in increasing human stem cell viability.
도 3030
독시사이클린과 함께 매 계대의 첫날에 Y-27632를 처리하여 준 경우에 줄기세포의 생존 및 증식이 증대됨을 관찰할 수 있었다(참조: 도 30).
When Y-27632 was treated on the first day of each passage with doxycycline, it was observed that the survival and proliferation of stem cells were increased (see FIG. 30).
도 3131
독시사이클린과 함께 20 계대 배양시에도 인간배아줄기세포의 마커인 알칼라인포스포테이즈(AP), TRA 1-60, Oct4 가 발현됨을 관찰할 수 있었다(참조: 도 31).
It was observed that alkaline phosphatase (AP), TRA 1-60, and Oct4, which are markers of human embryonic stem cells, were also expressed when cultured with 20 passages with doxycycline (see FIG. 31).
이상으로 본 발명의 특정한 부분을 상세히 기술하였는 바, 당업계의 통상의 지식을 가진 자에게 있어서 이러한 구체적인 기술은 단지 바람직한 구현 예일 뿐이며, 이에 본 발명의 범위가 제한되는 것이 아닌 점은 명백하다. 따라서, 본 발명의 실질적인 범위는 첨부된 청구항과 그의 등가물에 의하여 정의된다고 할 것이다.
While the present invention has been particularly shown and described with reference to exemplary embodiments thereof, it is to be understood that the same is by way of illustration and example only and is not to be construed as limiting the scope of the present invention. Accordingly, the actual scope of the present invention will be defined by the appended claims and their equivalents.
1. Yu J, Thomson JA. Pluripotent stem cell lines. Genes Dev 22, 1987-1997 (2008).1. Yu J, Thomson JA. Pluripotent stem cell lines. Genes Dev 22, 1987-1997 (2008).
2. Reubinoff BE, Pera MF, Fong CY, Trounson A, Bongso A. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol 18, 399-404 (2000).2. Reubinoff BE, Pera MF, Fong CY, Trounson A, Bongso A. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol 18,399-404 (2000).
3. Thomson JA, et al. Embryonic stem cell lines derived from human blastocysts. Science 282, 1145-1147 (1998).3. Thomson JA, et al. Embryonic stem cell lines derived from human blastocysts. Science 282, 1145-1147 (1998).
4. Ludwig TE, et al. Derivation of human embryonic stem cells in defined conditions. Nat Biotechnol 24, 185-187 (2006).4. Ludwig TE, et al. Derivation of human embryonic stem cells in defined conditions. Nat Biotechnol 24, 185-187 (2006).
5. Steiner D, et al. Derivation, propagation and controlled differentiation of human embryonic stem cells in suspension. Nat Biotechnol 28, 361-364 (2010).5. Steiner D, et al. Derivation, propagation and controlled differentiation of human embryonic stem cells in suspension. Nat Biotechnol 28, 361-364 (2010).
6. Rodin S, et al. Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511. Nat Biotechnol 28, 611-615 (2010). 6. Rodin S, et al. Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511. Nat Biotechnol 28, 611-615 (2010).
7. Villa-Diaz LG, Ross AM, Lahann J, Krebsbach PH. Concise review: The evolution of human pluripotent stem cell culture: from feeder cells to synthetic coatings. Stem Cells 31, 1-7 (2013). 7. Villa-Diaz LG, Ross AM, Lahann J, Krebsbach PH. Concise review: The evolution of human pluripotent stem cell culture: from feeder cells to synthetic coatings. Stem Cells 31, 1-7 (2013).
8. Watanabe K, et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat Biotechnol 25, 681-686 (2007). 8. Watanabe K, et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells.
9. Ohgushi M, et al. Molecular pathway and cell state responsible for dissociation-induced apoptosis in human pluripotent stem cells. Cell Stem Cell 7, 225-239 (2010). 9. Ohgushi M, et al. Molecular pathway and cell state responsible for dissociation-induced apoptosis in human pluripotent stem cells.
10. Harb N, Archer TK, Sato N. The Rho-Rock-Myosin signaling axis determines cell-cell integrity of self-renewing pluripotent stem cells. PLoS One 3, e3001 (2008). 10. Harb N, Archer TK, Sato N. The Rho-Rock-Myosin signaling axis determines cell-cell integrity of self-renewing pluripotent stem cells. PLoS One 3, e3001 (2008).
11. Bendall SC, et al. IGF and FGF cooperatively establish the regulatory stem cell niche of pluripotent human cells in vitro. Nature 448, 1015-1021 (2007). 11. Bendall SC, et al. IGF and FGF cooperatively establish the regulatory stem cell niche of pluripotent human cells in vitro. Nature 448, 1015-1021 (2007).
12. Singh AM, et al. Signaling network crosstalk in human pluripotent cells: a Smad2/3-regulated switch that controls the balance between self-renewal and differentiation. Cell Stem Cell 10, 312-326 (2012). 12. Singh AM, et al. Signaling network crosstalk in human pluripotent cells: a Smad2 / 3-regulated switch that controls the balance between self-renewal and differentiation.
13. Park CH, et al. In vitro and in vivo analyses of human embryonic stem cell-derived dopamine neurons. Journal of neurochemistry 92, 1265-1276 (2005). 13. Park, CH et al. In vitro and in vivo analyzes of human embryonic stem cell-derived dopamine neurons. Journal of neurochemistry 92, 1265-1276 (2005).
14. Perrier AL, et al. Derivation of midbrain dopamine neurons from human embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America 101, 12543-12548 (2004). 14. Perrier AL, et al. Derivation of midbrain dopamine neurons from human embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America 101, 12543-12548 (2004).
15. Rhee YH, et al. Insulin concentration is critical in culturing human neural stem cells and neurons. Cell death & disease 4, e766 (2013). 15. Rhee YH, et al. Insulin concentration is critical for culturing human neural stem cells and neurons. Cell death &
16. Ko JY, et al. Human embryonic stem cell-derived neural precursors as a continuous, stable, and on-demand source for human dopamine neurons. Journal of neurochemistry 103, 1417-1429 (2007). 16. Ko JY, et al. Human embryonic stem cell-derived neural precursors as a continuous, stable, and on-demand source for human dopamine neurons. Journal of neurochemistry 103,1417-1429 (2007).
17. Hong S, Kang UJ, Isacson O, Kim KS. Neural precursors derived from human embryonic stem cells maintain long-term proliferation without losing the potential to differentiate into all three neural lineages, including dopaminergic neurons. Journal of neurochemistry 104, 316-324 (2008). 17. Hong S, Kang UJ, Isacson O, Kim KS. Neural precursors derived from human embryonic stem cells maintain long-term proliferation without losing the potential to differentiate into all three neural lineages, including dopaminergic neurons. Journal of neurochemistry 104, 316-324 (2008).
18. Rhee YH, et al. Protein-based human iPS cells efficiently generate functional dopamine neurons and can treat a rat model of Parkinson disease. The Journal of clinical investigation 121, 2326-2335 (2011). 18. Rhee YH, et al. Protein-based human iPS cells produce a functional model of dopamine neurons and a rat model of Parkinson disease. The Journal of Clinical Investigation 121, 2326-2335 (2011).
19. Feng Q, et al. Hemangioblastic derivatives from human induced pluripotent stem cells exhibit limited expansion and early senescence. Stem Cells 28, 704-712 (2010). 19. Feng Q, et al. Hemangioblastic derivatives from human induced pluripotent stem cells exhibit limited expansion and early senescence. Stem Cells 28, 704-712 (2010).
20. Jantzie LL, Cheung PY, Todd KG. Doxycycline reduces cleaved caspase-3 and microglial activation in an animal model of neonatal hypoxia-ischemia. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism 25, 314-324 (2005). 20. Jantzie LL, Cheung PY, Todd KG. Doxycycline reduced cleaved caspase-3 and microglial activation in an animal model of neonatal hypoxia-ischemia. Journal of Cerebral Blood Flow and
21. Yrjanheikki J, Keinanen R, Pellikka M, Hokfelt T, Koistinaho J. Tetracyclines inhibit microglial activation and are neuroprotective in global brain ischemia. Proceedings of the National Academy of Sciences of the United States of America 95, 15769-15774 (1998). 21. Yrjanheikki J, Keinanen R, Pellikka M, Hokfelt T, Koistinaho J. Tetracyclines inhibit microglial activation and are neuroprotective in global brain ischemia. Proceedings of the National Academy of Sciences of the United States of America 95, 15769-15774 (1998).
22. Kim HS, Suh YH. Minocycline and neurodegenerative diseases. Behavioural brain research 196, 168-179 (2009). 22. Kim HS, Suh YH. Minocycline and neurodegenerative diseases. Behavioral brain research 196, 168-179 (2009).
23. Sakata H, et al. Minocycline-preconditioned neural stem cells enhance neuroprotection 1 after ischemic stroke in rats. The Journal of neuroscience : the official journal of the Society for Neuroscience 32, 3462-3473 (2012).23. Sakata H, et al. Minocycline-preconditioned neural stem cells enhance
24. Wang AL, et al. Minocycline inhibits LPS-induced retinal microglia activation. Neurochemistry international 47, 152-158 (2005). 24. Wang AL, et al. Minocycline inhibits LPS-induced retinal microglia activation. Neurochemistry international 47, 152-158 (2005).
25. Hu X, et al. Minocycline protects against myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1 protein in rats. Eur J Pharmacol 638, 84-89 (2010). 25. Hu X, et al. Minocycline protects against myocardial ischemia and reperfusion injury by high
26. Garrido-Mesa N, Zarzuelo A, Galvez J. Minocycline: far beyond an antibiotic. British journal of pharmacology 169, 337-352 (2013). 26. Garrido-Mesa N, Zarzueloa, Galvez J. Minocycline: far beyond an antibiotic. British journal of pharmacology 169, 337-352 (2013).
27. Lee HH, O'Malley MJ, Friel NA, Chu CR. Effects of doxycycline on mesenchymal stem cell chondrogenesis and cartilage repair. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society 21, 385-393 (2013). 27. Lee HH, O'Malley MJ, Friel NA, Chu CR. Effects of doxycycline on mesenchymal stem cell chondrogenesis and cartilage repair. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society 21, 385-393 (2013).
28. Twentyman PR, Luscombe M. A study of some variables in a tetrazolium dye (MTT) based assay for cell growth and chemosensitivity. Br J Cancer 56, 279-285 (1987). 28. Twentyman PR, Luscombe M. A study of some variables in a tetrazolium dye (MTT) based assay for cell growth and chemosensitivity. Br J Cancer 56, 279-285 (1987).
29. Brederlau A, et al. Transplantation of human embryonic stem cell-derived cells to a rat model of Parkinson's disease: effect of in vitro differentiation on graft survival and teratoma formation. Stem Cells 24, 1433-1440 (2006). 29. Brederlaue, et al. Transplantation of human embryonic stem cell-derived cells to a rat model of Parkinson's disease: effect of in vitro differentiation on graft survival and teratoma formation. Stem Cells 24, 1433-1440 (2006).
30. Chang MY, et al. Bcl-XL/Bax proteins direct the fate of embryonic cortical precursor cells. Mol Cell Biol 27, 4293-4305 (2007). 30. Chang MY, et al. Bcl-XL / Bax proteins direct the fate of embryonic cortical precursor cells. Mol Cell Biol 27, 4293-4305 (2007).
31. Hyun KH, et al. Eckol suppresses maintenance of stemness and malignancies in glioma stem-like cells. Toxicology and applied pharmacology 254, 32-40 (2011). 31. Hyun KH, et al. Eckol suppresses maintenance of stemness and malignancies in glioma stem-like cells. Toxicology and applied pharmacology 254, 32-40 (2011).
Claims (13)
Translated fromKoreanA composition for stem cell line culture comprising doxycycline as an active ingredient.
The composition according to claim 1, wherein the composition for stem cell passage culture increases survival and proliferation of stem cells.
The stem cell according to claim 1, wherein the stem cell is a totipotent stem cell, a pluripotent stem cell, a multipotent stem cell, or a unipotent stem cell .
[4] The composition of claim 3, wherein the pluripotent stem cells are embryonic stem cells, embryonic germ cells or embryonic carcinoma cells.
5. The composition according to claim 4, wherein said pluripotent stem cells are embryonic stem cells.
4. The composition of claim 3, wherein the pluripotent stem cell is an induced pluripotent stem cell.
[4] The composition of claim 3, wherein the stem cell is a neural stem cell, a hematopoietic stem cell, or a mesenchymal stem cell.
8. The composition according to claim 7, wherein the redundant stem cells are neural stem cells.
9. The composition according to claim 8, wherein the neural stem cells are neural stem cells derived from viral dedifferentiated stem cells.
2. The composition of claim 1, wherein said isocycline is included in an amount of 1 nM to 5000 uM.
(a) 줄기세포 배양용 배지를 준비하는 단계;
(b) 상기 단계 (a)에서 준비된 배지에 독시사이클린을 처리하여 줄기세포를 계대 배양하는 단계.
Stem cell passage culture method for enhancing survival and proliferation of stem cells comprising the following steps:
(a) preparing a culture medium for stem cell culture;
(b) treating the medium prepared in the step (a) with doxycycline to subculture the stem cells.
12. The method of claim 11, wherein step (b) comprises treating Y-27632 with doxycycline.
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020140035610AKR101707149B1 (en) | 2014-03-26 | 2014-03-26 | Improvement of Viability and Proliferation of Stem Cells by Doxycycline |
| PCT/KR2015/002992WO2015147574A1 (en) | 2014-03-26 | 2015-03-26 | Improvement in survival and proliferation of stem cells by doxycycline |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020140035610AKR101707149B1 (en) | 2014-03-26 | 2014-03-26 | Improvement of Viability and Proliferation of Stem Cells by Doxycycline |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20150112141A KR20150112141A (en) | 2015-10-07 |
| KR101707149B1true KR101707149B1 (en) | 2017-02-28 |
Family
ID=54195993
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020140035610AExpired - Fee RelatedKR101707149B1 (en) | 2014-03-26 | 2014-03-26 | Improvement of Viability and Proliferation of Stem Cells by Doxycycline |
Country Status (2)
| Country | Link |
|---|---|
| KR (1) | KR101707149B1 (en) |
| WO (1) | WO2015147574A1 (en) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050176140A1 (en)* | 2004-02-10 | 2005-08-11 | Benedict Daniel J. | Method and apparatus for cell culture using a two liquid phase bioreactor |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2103685A1 (en)* | 2008-03-20 | 2009-09-23 | Helmholtz Zentrum München Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH) | Vectors and methods for generating vector-free induced pluripotent stem (iPS) cells using site-specific recombination |
| US20100062534A1 (en)* | 2008-09-09 | 2010-03-11 | The General Hospital Corporation | Inducible lentiviral vectors for reprogramming somatic cells |
- 2014
- 2014-03-26KRKR1020140035610Apatent/KR101707149B1/ennot_activeExpired - Fee Related
- 2015
- 2015-03-26WOPCT/KR2015/002992patent/WO2015147574A1/enactiveApplication Filing
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050176140A1 (en)* | 2004-02-10 | 2005-08-11 | Benedict Daniel J. | Method and apparatus for cell culture using a two liquid phase bioreactor |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2015147574A1 (en) | 2015-10-01 |
| KR20150112141A (en) | 2015-10-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20250019653A1 (en) | Induced pluripotent cell-derived oligodendrocyte progenitor cells for the treatment of myelin disorders | |
| ES2590036T3 (en) | Method for inducing differentiation of pluripotent stem cells into neural precursor cells | |
| JP7107510B2 (en) | Method for producing cerebellar precursor tissue | |
| JP6185907B2 (en) | Prestimulation of pluripotent stem cells for neural differentiation | |
| KR102210850B1 (en) | Compositions and methods for reprograming non-pluripotent cells into pluripotent stem cells | |
| ES2677319T3 (en) | Medium and method of stem cell culture | |
| JP2022078245A (en) | Method for differentiating pluripotent cell | |
| JP7465569B2 (en) | Induction of differentiation of human pluripotent stem cells into hypothalamic neurons | |
| JP2017511153A (en) | Production and use of midbrain dopaminergic neurons | |
| JP7523885B2 (en) | Methods for differentiating stem cell-derived ectodermal lineage precursors - Patents.com | |
| CN101563449A (en) | Stem cell culture medium and method | |
| US20200362303A1 (en) | Maintenance-and-amplification method and differentiation induction method for primordial germ cells/primordial germ cell-like cells | |
| US20210123017A1 (en) | Method for producing dopaminergic neurons | |
| Moraveji et al. | Inhibition of glycogen synthase kinase-3 promotes efficient derivation of pluripotent stem cells from neonatal mouse testis | |
| KR101707149B1 (en) | Improvement of Viability and Proliferation of Stem Cells by Doxycycline | |
| AU2013389474A1 (en) | Transplantation adjuvant in cell therapy using neural progenitor cells | |
| Fernández et al. | Isolation of rat embryonic stem‐like cells: A tool for stem cell research and drug discovery | |
| Shin et al. | Derivation of primitive neural stem cells from human‐induced pluripotent stem cells | |
| HK40045021A (en) | Induced pluripotent cell-derived oligodendrocyte progenitor cells for the treatment of myelin disorders | |
| HUI | INVESTIGATING THE ROLES OF ZFP322A AND PATZ1 IN ES CELL IDENTITY AND REPROGRAMMING | |
| Chaddah | Clonal derivation of neural stem cells from human embryonic stem cells | |
| Sana | Isolation and culturing of zebrafish pluripotent cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| PA0109 | Patent application | St.27 status event code:A-0-1-A10-A12-nap-PA0109 | |
| PA0201 | Request for examination | St.27 status event code:A-1-2-D10-D11-exm-PA0201 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-3-3-R10-R18-oth-X000 | |
| D13-X000 | Search requested | St.27 status event code:A-1-2-D10-D13-srh-X000 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-3-3-R10-R18-oth-X000 | |
| D14-X000 | Search report completed | St.27 status event code:A-1-2-D10-D14-srh-X000 | |
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | St.27 status event code:A-1-2-D10-D21-exm-PE0902 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| PG1501 | Laying open of application | St.27 status event code:A-1-1-Q10-Q12-nap-PG1501 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| P11-X000 | Amendment of application requested | St.27 status event code:A-2-2-P10-P11-nap-X000 | |
| P13-X000 | Application amended | St.27 status event code:A-2-2-P10-P13-nap-X000 | |
| E90F | Notification of reason for final refusal | ||
| PE0902 | Notice of grounds for rejection | St.27 status event code:A-1-2-D10-D21-exm-PE0902 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| R17-X000 | Change to representative recorded | St.27 status event code:A-3-3-R10-R17-oth-X000 | |
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | St.27 status event code:A-1-2-D10-D22-exm-PE0701 | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | St.27 status event code:A-2-4-F10-F11-exm-PR0701 | |
| PR1002 | Payment of registration fee | St.27 status event code:A-2-2-U10-U11-oth-PR1002 Fee payment year number:1 | |
| PG1601 | Publication of registration | St.27 status event code:A-4-4-Q10-Q13-nap-PG1601 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| FPAY | Annual fee payment | Payment date:20200102 Year of fee payment:4 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:4 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:5 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:6 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:7 | |
| PC1903 | Unpaid annual fee | St.27 status event code:A-4-4-U10-U13-oth-PC1903 Not in force date:20240210 Payment event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE | |
| PC1903 | Unpaid annual fee | St.27 status event code:N-4-6-H10-H13-oth-PC1903 Ip right cessation event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE Not in force date:20240210 |