KR101585947B1 - Targeting agents for cancer cells or cancer-associated fibroblasts - Google Patents
Targeting agents for cancer cells or cancer-associated fibroblastsDownload PDFInfo
- Publication number
- KR101585947B1 KR101585947B1KR1020097020305AKR20097020305AKR101585947B1KR 101585947 B1KR101585947 B1KR 101585947B1KR 1020097020305 AKR1020097020305 AKR 1020097020305AKR 20097020305 AKR20097020305 AKR 20097020305AKR 101585947 B1KR101585947 B1KR 101585947B1
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- carrier
- targeting agent
- cells
- drug
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/07—Retinol compounds, e.g. vitamin A
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/20—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids
- A61K31/203—Retinoic acids ; Salts thereof
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6905—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion
- A61K47/6911—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion the form being a liposome
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Synthetic bilayered vehicles, e.g. liposomes or liposomes with cholesterol as the only non-phosphatidyl surfactant
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/88—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation using microencapsulation, e.g. using amphiphile liposome vesicle
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2799/00—Uses of viruses
- C12N2799/02—Uses of viruses as vector
- C12N2799/04—Uses of viruses as vector in vivo
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2810/00—Vectors comprising a targeting moiety
- C12N2810/10—Vectors comprising a non-peptidic targeting moiety
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Dispersion Chemistry (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Dermatology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean본 발명은 암세포 또는 암 관련 섬유아세포(cancer-associated fibroblast, CAF 또는 carcinoma-associated fibroblast)로 이루어진 군으로부터 선택되는 세포용 표적화제(targeting agent), 상기 표적화제를 포함하는 상기 세포용 물질전달 담체 및 이것을 이용한 항암 조성물, 항 CAF 조성물 및 암치료 방법에 관한 것이다.The present invention relates to a targeting agent for cells selected from the group consisting of cancer cells or cancer-associated fibroblasts (CAF or carcinoma-associated fibroblasts), the cell mass transfer carrier comprising the targeting agent, An anti-CAF composition, and a method for treating cancer.
암은 인류가 직면하고 있는 가장 중대한 질병 중의 하나이며, 암치료를 위해 막대한 연구가 진행되고 있다. 암 치료, 특히 암의 내과적 치료에 있어서 암세포의 증식을 억제하는 다양한 항암제가 개발되어 어느 정도의 성과를 거두고 있지만, 이러한 약제는 암세포뿐만 아니라 정상적인 세포의 증식을 억제하여 구역질, 구토, 탈모, 골수억제, 신장장애, 신경장애 등 다양한 부작용을 일으키는 문제가 있다. 이러한 부작용을 줄이는 방법으로써, 항암제를 암세포 또는 암조직에 특이적으로 전달하려는 시도가 최근 이루어지고 있다. 항암제의 특이적 전달에 의해, 항암제 가 정상세포에 도달하는 것을 막고 부작용을 줄일 수 있을 뿐만 아니라 항암제의 투여량을 줄일 수 있어 경제적인 이점도 얻을 수 있다.Cancer is one of the most serious diseases facing humanity, and massive research is underway to treat cancer. Although various anti-cancer drugs have been developed to inhibit the proliferation of cancer cells in cancer therapy, in particular, in the medical treatment of cancer, these drugs inhibit not only cancer cells but also normal cell proliferation, thereby suppressing nausea, vomiting, Inhibition, renal disorder, neurological disorder, and the like. As a method of reducing such side effects, attempts have been recently made to specifically transmit cancer drugs to cancer cells or cancer tissues. By the specific transfer of the anticancer agent, the anticancer agent can be prevented from reaching the normal cell, the side effect can be reduced, and the dosage of the anticancer agent can be reduced, which is economically advantageous.
구체적인 전달 방법으로는, 예를 들면, EPR(enhanced permeability and retention) 효과를 이용한 수동적 표적화(passive targeting)와 암세포에 특이적으로 발현하는 표면분자의 리간드 등으로 약물을 제한하는 능동적 표적화(active targeting) 등의 기술이 개발되고 있다. 능동적 표적화(active targeting)로 사용할 수 있는 분자로는 리간드를 결합하여 세포내에 엔도사이토시스(endocytosis)하는 분자, 예를 들면, CD19, HER2, 트랜스페린 수용체, 엽산 수용체, VIP 수용체, EGFR(비특허문헌 1 참조), RAAG10(특허문헌 1 참조), PIPA(특허문헌 2 참조), KID3(특허문헌 3 참조) 등이 보고되고 있다. 그러나 아직 어떠한 전달방법도 만족할만하지 않기 때문에 앞으로의 암세포 특이적인 전달 방법의 개발이 요구된다.Specific delivery methods include, for example, passive targeting using an enhanced permeability and retention (EPR) effect and active targeting using a ligand of a surface molecule specifically expressed in cancer cells, Have been developed. Examples of molecules that can be used for active targeting include molecules that bind ligands and endocytosis in cells such as CD19, HER2, transferrin receptors, folate receptors, VIP receptors, EGFR 1), RAAG10 (see Patent Document 1), PIPA (see Patent Document 2), and KID3 (see Patent Document 3). However, since any delivery method is not satisfactory, future development of cancer cell-specific delivery methods is required.
또한, 암의 내과적 치료에 있어서, 암세포 자체를 사멸시키면 암을 치료할 수 있는 것으로 생각하여 지금까지 암세포를 표적으로 하는 다양한 항암제가 개발, 사용되어왔다. 그러나 이러한 시도는 상기와 같은 부작용 문제와 남아있는 미세 종양의 재발, 종양세포의 항암제에 대한 내성 등의 부가적인 현상의 발생 등에 의해 방해받아 만족스러운 성과를 얻을 수 없었다.In addition, in the medical treatment of cancer, various cancer medicines targeting cancer cells have been developed and used so far, considering that cancer cells themselves can be cured by treating cancer. However, such attempts have been hampered by the above-mentioned side effects and the occurrence of additional phenomena such as the recurrence of the remaining micro-tumors and the resistance of the tumor cells to the anticancer drugs, and thus, satisfactory results have not been obtained.
한편, 암 주변환경, 예를 들면 혈관, 세포외기질, 섬유아세포 등을 포함하는 주변환경이 암 발병 및 진행에 중요한 역할을 하고 있다는 것이 최근 연구에 의해 점차 밝혀지고 있다. 예를 들면, Camps 등(비특허문헌 2)은 단독으로 종양을 형성하지 않거나 종양 형성 속도가 느린 종양 세포를 종양 형성이 가능한 섬유아세포와 함께 무흉선 누드마우스에 접종했을 때, 빠르고 현저하게 종양이 형성됨을 보고하였고, Olumi 등(비특허문헌 3 참조)은 전립선 종양 환자의 종양 주변 섬유아세포(즉, CAF)를 인간 전립선 세포와 함께 무흉선 동물에 이식했을 때, 그 종양 증식이 현저하게 촉진되는 것을 보고하였다. 또한, 이와 같은 종양 증식에 주변에서 생산되는 PDGF(platelet-derived growth factor), TGFβ(transforming growth factor-β), HGF(hepatocyte growth factor), SDF-1(stromal cell-derived factor-1) 등의 생리활성물질이 관여하고 있다는 것도 밝혀졌다(비특허문헌 4 참조).On the other hand, recent studies have revealed that the environment surrounding the cancer, such as blood vessels, extracellular matrix, fibroblasts, etc., plays an important role in cancer development and progression. For example, Camps et al. (Non-patent document 2) show that when tumor cells that do not form tumors alone or have slow tumor formation are inoculated into athymic nude mice together with fibroblasts capable of forming tumors, Olumi et al. (See non-patent reference 3) reported that when transplanting fibroblasts around the tumor (i.e., CAF) in prostate tumor patients with human prostate cells into athymic animals, the tumor proliferation is markedly accelerated Respectively. In addition, it is known that PDGF (platelet-derived growth factor), TGFβ (transforming growth factor-β), HGF (hepatocyte growth factor) and SDF-1 (stromal cell-derived factor-1) It has been found that physiologically active substances are involved (see Non-Patent Document 4).
이러한 보고를 통하여 암 주변환경의 중요성이 부각되기 시작하였으며, 암세포 자체가 아니라 그 주변환경을 표적으로 하는 새로운 치료법이 고려되고 있다. 특히, 다양한 생리활성물질을 분비하고 암의 발병 및 진행에 깊이 영향을 미치는 CAF가 최근 주목받고 있으나, 본격적인 연구의 역사는 아직 십몇 년에 불과하고, CAF를 분비하는 생리활성물질을 표적으로 하는 암치료에는 어느 정도의 효과가 확인된 것은 있으나 CAF 자체를 표적으로 하는 암치료 방법으로 어떠한 성과가 인정된 것은 아직 없는 실정이다(비특허문헌 4 참조).Through these reports, the importance of the environment surrounding the cancer has begun to be emphasized, and a new treatment method targeting the surrounding environment as well as the cancer cells itself is being considered. In particular, CAF, which secretes a variety of physiologically active substances and has a profound effect on the onset and progression of cancer, has recently been attracting attention, but the history of the earliest studies has been only a few decades, and cancer that targets CAF-releasing physiologically active substances Although some effects have been confirmed in the treatment, no achievement has been recognized as a cancer treatment method targeting CAF itself (see Non-Patent Document 4).
참고 문헌references
특허문헌 1. 일본 특허공표 2005-532050
특허문헌 2. 일본 특허공표 2006-506071
특허문헌 3. 일본 특허공표 2007-529197
특허문헌 4. 국제공개 제 2006/068232호 브로셔
비특허문헌 1. Torchilin, AAPS J. 2007; 9 (2) : E128 - 47Non-Patent
비특허문헌 2. Camps et al., Proc Natl Acad Sci US A. 1990; 87 (1) :75 - 9Non-patent
비특허문헌 3. Olumi et al., Cancer Res 1999; 59 (19) :5002 - 11Non-patent
비특허문헌 4. Micke et al., Expert Opin Ther Targets 2005; 9 (6) :1217 - 33Non-Patent
개요summary
본 발명의 과제는 새로운 암 치료제 및 치료 방법에 관한 것이다.The present invention relates to a novel cancer therapeutic agent and a therapeutic method.
상기 과제는 레티노이드를 포함하는, 암세포 및 암 관련 섬유아세포로 이루어진 군으로부터 선택되는 세포용 표적화제, 상기 표적화제를 포함하는 상기 세포용 물질전달 담체, 상기 표적화제 또는 담체를 이용한 항암 조성물 및 항암 관련 섬유아세포 조성물, 및 암치료 방법에 의해 해결된다.The object is achieved by a cell targeting agent selected from the group consisting of a cancer cell and a cancer-associated fibroblast, which comprises a retinoid, an anticancer composition using the targeting agent or carrier, and an anticancer composition comprising the targeting agent A fibroblast composition, and a method of treating cancer.
발명이 해결하고자 하는 과제Problems to be solved by the invention
본 발명이 목적은 암세포 특이적으로 약물 등의 물질을 전달할 수 있는 담체, 이것을 이용한 암 치료제 및 치료 방법을 제공하는 것이고, 또한, CAF 특이적으로 약물을 전달할 수 있는 담체, 이것을 이용한 암치료제 및 치료 방법을 제공하는 것이다.The object of the present invention is to provide a carrier capable of delivering a substance such as a drug specifically to a cancer cell, a cancer treatment agent and a treatment method using the same, and also to provide a carrier capable of specifically delivering a drug, Method.
과제를 해결하기 위한 수단Means for solving the problem
본 발명자들은 새로운 암치료 방법을 연구하던 중, 암 관련 섬유아세포(cancer-associated fibroblast, CAF)에 특이적으로 약물을 전달할 수 있는 담체가 아직 존재하지 않는다는 것을 깨닫고 이에 대한 담체를 개발하기 위하여 열심히 연구를 계속한 결과, 레티노이드를 표적화제로 포함하는 담체가 CAF로의 물질전달을 특이적으로 촉진하는 것을 찾아냈다. 또한, 상기 담체에 대한 연구를 더욱 진행시킨 결과, 상기 담체가 암세포로의 물질전달도 특이적으로 촉진하는 것을 찾아냄으로써 본 발명을 완성하였다.The inventors of the present invention have been studying a new method for treating cancer, realizing that a carrier capable of specifically delivering a drug to cancer-associated fibroblast (CAF) is not yet present, As a result, it was found that the carrier containing the retinoid as a targeting agent specifically promotes the mass transfer to the CAF. Further, as a result of further study on the carrier, the present inventors have found that the carrier specifically promotes mass transfer to cancer cells, thereby completing the present invention.
레티놀을 포함하는 담체가 레티놀을 저장하는 성상세포에 약물을 전달하는 것은 알려져 있었지만(특허문헌 4 참조), 암세포 또는 CAF로의 물질전달을 특이적으로 촉진하는 것은 아직까지 알려져 있지 않았다.Although it has been known that a carrier containing retinol is capable of delivering a drug to astrocytes that store retinol (see Patent Document 4), it has not yet been known to specifically promote mass transfer to cancer cells or CAF.
즉, 본 발명은 하기에 관한 것이다:That is, the present invention relates to the following:
(1) 레티노이드(retinoid)를 포함하는, 암세포 및 암 관련 섬유아세포로 이루어진 군으로부터 선택되는 세포용 표적화제(targeting agent);(1) a targeting agent for cells selected from the group consisting of cancer cells and cancer-associated fibroblasts, including retinoids;
(2) 레티노이드가 레티놀(retinol)을 포함하는 상기 (1)의 표적화제;(2) the targeting agent of (1) above, wherein the retinoid comprises retinol;
(3) 상기 (1) 또는 (2)의 표적화제를 포함하는, 암세포 및 암 관련 섬유아세포로 이루어진 군으로부터 선택되는 세포용 물질전달 담체;(3) a cell mass transporting carrier selected from the group consisting of cancer cells and cancer-associated fibroblasts, which comprises the targeting agent of (1) or (2);
(4) 표적화제의 함유량이 담체 전체의 0.2 ~ 20 중량%인 상기 (3)의 담체;(4) the carrier of (3), wherein the content of the targeting agent is 0.2 to 20% by weight of the whole carrier;
(5) 표적화제와 담체의 표적화제 이외의 구성 성분의 몰비가 8:1 ~ 1:4인 상기 (3) 또는 (4)의 담체;(5) the carrier of (3) or (4), wherein the molar ratio of the targeting agent to the carrier other than the targeting agent is from 8: 1 to 1: 4;
(6) 상기 (1) 또는 (2)의 표적화제 또는 상기 (3) ~ (5) 중 어느 하나의 담체, 암세포 및/또는 암 관련 섬유아세포의 활성 또는 증식을 억제하는 약물을 포함하는 항암 조성물;(6) An anticancer composition comprising the above targeting agent of (1) or (2) or a drug inhibiting the activity or proliferation of the carrier, cancer cell and / or cancer-associated fibroblast of any one of (3) ;
(7) 상기 (1) 또는 (2)의 표적화제 또는 상기 (3) ~ (5) 중 어느 하나의 담체, 암 관련 섬유아세포의 활성 또는 증식을 억제하는 약물을 포함하는 항암 관련 섬유아세포 조성물;(7) An anticancer-related fibroblast composition comprising a targeting agent as described in (1) or (2) above, a carrier according to any one of (3) to (5), and a drug inhibiting the activity or proliferation of cancer-associated fibroblasts;
(8) 암세포의 활성 또는 증식을 억제하는 약물이 항암제인 상기 (6)의 조성물;(8) The composition of (6) above, wherein the drug that inhibits the activity or proliferation of cancer cells is an anticancer drug;
(9) 암 관련 섬유아세포의 활성 또는 증식을 억제하는 약물이 TGFβ, HGF, PDGF, VEGF(vascular endothelial growth factor), IGF(insulin-like growth factor), MMP(matrix metalloproteinase), FGF(fibroblast growth factor), uPA(urokinase-type plasminogen activator), 카텝신 및 SDF-1로 이루어진 군으로부터 선택되는 생리활성물질의 활성 또는 합성 저해제, 세포 활성 억제제, 증식 저해제, 아포토시스(apoptosis) 유도제 및 암 관련 섬유아세포에 의해 합성되는 세포외기질 구성분자, 또는 상기 세포외기질 구성분자의 합성 또는 분비에 관여하는 분자 중 하나 또는 그 이상을 표적으로 하는 siRNA, 리보자임, 안티센스 핵산, DNA/RNA 키메라 폴리뉴클레오티드 및 이것들을 발현하는 벡터로 이루어진 군으로부터 선택되는 것을 특징으로 하는 상기 (6)∼ (8)의 조성물;(9) The use of a medicament for inhibiting the activity or proliferation of cancer-associated fibroblasts comprising TGFβ, HGF, PDGF, vascular endothelial growth factor (VEGF), insulin-like growth factor (IGF), matrix metalloproteinase (MMP), fibroblast growth factor ), uracil-type plasminogen activator (uPA), cathepsin, and SDF-1, or a synthetic inhibitor, a cytokine inhibitor, a proliferation inhibitor, an apoptosis inducer, and a cancer-associated fibroblast SiRNAs, ribozymes, antisense nucleic acids, DNA / RNA chimeric polynucleotides, and the like, which target one or more of molecules involved in the synthesis or secretion of the extracellular matrix component molecules, (6) to (8), wherein the composition is selected from the group consisting of:
(10) 세포외기질 구성분자의 합성 또는 분비에 관여하는 분자가 HSP47인 상기 (9)의 조성물;(10) The composition of (9) above, wherein the molecule involved in the synthesis or secretion of extracellular matrix constituent molecules is HSP47;
(11) 약물, 표적화제 또는 담체를 의료의 현장 또는 그 근방에서 혼합하는 상기 (6) ~ (10)의 조성물;(11) The composition according to any one of (6) to (10) above, wherein the drug, the targeting agent or the carrier is mixed at or near the site of medical treatment;
(12) 약물, 표적화제 및 필요에 따라서 표적화제 이외의 담체 구성물질을 단독으로 또는 조합하여 포함하고 1개 또는 그 이상의 용기를 포함하는 상기 (6) ~ (11) 중 어느 하나의 조성물의 조제 키트.(12) A method for preparing a composition of any one of (6) to (11), which comprises a drug, a targeting agent and, if necessary, a carrier constituting substance other than the targeting agent, either singly or in combination, Kits.
발명의 효과Effects of the Invention
본 발명의 담체는 암세포 및 CAF를 특이적인 표적으로 하는 것이며, 원하는 물질이나 물체, 예를 들면 암세포 또는 CAF의 활성 또는 증식을 억제하는 약물 등을 암세포 및/또는 CAF에 효율적으로 전달함으로써, 최대의 효율과 최소의 부작용으로 원하는 효과, 예를 들면, 암세포 또는 CAF의 활성 또는 증식 억제, 및 이에 따른 암치료, 진행 억제 또는 발병의 예방을 가능하게 한다.The carrier of the present invention is intended to specifically target cancer cells and CAF, and efficiently deliver a desired substance or substance such as a cancer cell or a drug that inhibits the activity or proliferation of CAF to cancer cells and / or CAF, The efficiency and minimal side effects enable the desired effect, for example, the inhibition of the activity or proliferation of cancer cells or CAF, and thus the prevention, inhibition or onset of cancer treatment.
본 발명의 항암 조성물은 암세포뿐만 아니라 CAF에도 작용하여 암을 치료한다는 완전히 새로운 접근에 근거하는 것이기 때문에, 종래의 치료법에서는 만족할만한 결과를 얻을 수 없었던 암에 있어서도 유효성을 기대할 수 있고 또한, 종래의 항암제 또는 혈관신생 저해제 등과의 병용에 의한 상승 효과도 기대된다.Since the anticancer composition of the present invention is based on a totally novel approach of treating cancer not only with cancer cells but also with CAF, it can be expected to be effective in cancer which can not obtain satisfactory results in the conventional therapy, Or an angiogenesis inhibitor or the like.
또한, 본 발명의 담체는 암세포 및 CAF에 특이적으로 물질을 전달하기 위해 암세포 및 CAF에 특이적인 표지 또는 유전자 도입 등에 이용할 수 있다.In addition, the carrier of the present invention can be used for labeling specific to cancer cells and CAF or for introducing a gene for transferring substances specifically to cancer cells and CAF.
발명을 실시하기Carrying out the invention 위한 최선의 형태 Best form for
이하, 본 발명에 대해 상세하게 설명한다.Hereinafter, the present invention will be described in detail.
본 발명의 암세포는 특별히 한정되지 않고, 예를 들면, 섬유육종, 악성섬유성 조직구종, 지방육종, 횡문근육종, 평활근육종, 혈관육종, 악성피부암, 림프혈관육종, 활막육종, 연골육종, 골육종 등의 육종, 뇌종양, 두경부암, 유방암, 폐암, 식도암, 위암, 십이지장암, 충수암, 대장암, 직장암, 간암, 췌장암, 담낭암, 담관암, 항문암, 신암, 수뇨관암, 방광암, 전립선암, 음경암, 정소암, 자궁암, 난소암, 외음암, 질암, 피부암 등의 암종, 또한 백혈병 또는 악성임파종 등에 있어서의 암세포를 들 수 있다. 또한, 본 발명의 "암"은 상피성 악성종양 및 비상피성 악성종양을 포함한다. 따라서, 본 발명의 암세포는 임의의 부위, 예를 들면, 뇌, 두경부, 흉부, 사지, 폐, 심장, 흉선, 식도, 위, 소장(십이지장, 공장, 회장), 대장(결장, 맹장, 충수, 직장), 간장, 췌장, 담낭, 항문, 신장, 수뇨관, 방광, 전립선, 음경, 정소, 자궁, 난소, 외음, 질, 피부, 횡문근, 평활근, 활막, 연골, 뼈, 갑상선, 부신, 복막, 장간막, 골수, 혈액, 혈관계, 림프절 등의 림프액계, 림프액 등에 존재한다.The cancer cells of the present invention are not particularly limited, and examples thereof include fibrosarcoma, malignant fibrous histiocytoma, liposarcoma, rhabdomyosarcoma, leiomyosarcoma, angiosarcoma, malignant skin cancer, lymphangiosarcoma, synovial sarcoma, chondrosarcoma, osteosarcoma Cancer of the lungs, cancer of the esophagus, cancer of the duodenum, cancer of the appendix, colon cancer, rectum cancer, liver cancer, pancreatic cancer, gallbladder cancer, cholangiocarcinoma, anal cancer, renal cancer, ureter cancer, bladder cancer, prostate cancer, penile cancer , Ovarian cancer, ovarian cancer, ovarian cancer, vaginal cancer, skin cancer, and cancer cells such as leukemia or malignant lymphoma. The "cancer" of the present invention also includes epithelial malignant tumors and non-epithelial malignant tumors. Accordingly, the cancer cells of the present invention can be used for the treatment of any part, for example, brain, head and neck, chest, limb, lung, heart, thymus, esophagus, stomach, small intestine (duodenum, Rectum, rectum, smooth muscle, synovial, cartilage, bone, thyroid, adrenal, peritoneum, mesentery, rectum, pancreas, gallbladder, anus, kidney, urethra, bladder, prostate, penis, testes, uterus, ovary, , Bone marrow, blood, lymphatic system such as blood vessels and lymph nodes, and lymphatic fluid.
본 발명의 하나의 실시태양에 있어서, 암세포는 간장 및 췌장 이외의 부위에 존재하는 것이 바람직하다. 따라서, 이 실시태양의 암세포는 바람직하게는, 예를 들면, 뇌, 두경부, 흉부, 사지, 폐, 심장, 흉선, 식도, 위, 소장(십이지장, 공장, 회장), 대장(결장, 맹장, 충수, 직장), 담낭, 항문, 신장, 수뇨관, 방광, 전립선, 음경, 정소, 자궁, 난소, 외음, 질, 피부, 횡문근, 평활근, 활막, 연골, 뼈, 갑상선, 부신, 복막, 장간막, 골수, 혈액, 혈관계, 림프절 등의 림프액계, 림프액 등에 존재할 수 있다. 또한, 본 발명의 하나의 실시태양에 있어서, 암세포는 간암 세포 및 췌장암 세포 이외의 것이 바람직하다.In one embodiment of the present invention, the cancer cells are preferably present in a region other than the liver and the pancreas. Therefore, the cancer cells of this embodiment are preferably used for the treatment of cancer, such as brain, head and neck, chest, limb, lung, heart, thymus, esophagus, stomach, small intestine (duodenum, , Rectum, rectum, smooth muscle, synovial, cartilage, bone, thyroid, adrenal, peritoneum, mesentery, bone marrow, ovary, Lymphatic system such as blood, blood vessel system, lymph node system, lymph system, and the like. Further, in one embodiment of the present invention, the cancer cells are preferably those other than liver cancer cells and pancreatic cancer cells.
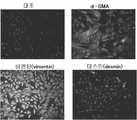
본 발명의 암 관련 섬유아세포(cancer-associated fibroblast, CAF)는 암 병변의 내부 및/또는 주변에 존재하는 α-SMA(α-평활근엑틴) 양성 섬유아세포를 의미한다. CAF는 대장암, 폐암, 전립선암, 유방암, 위암, 담관암, 기저세포암 등의 다양한 암에서 그 존재가 확인되고 있다.Cancer-associated fibroblast (CAF) of the present invention means? -SMA (a-smooth muscle actin) positive fibroblasts existing in and / or around cancer lesions. CAF has been identified in a variety of cancers, including colon cancer, lung cancer, prostate cancer, breast cancer, gastric cancer, cholangiocarcinoma, and basal cell carcinoma.
본 발명에서는 어느 세포가 CAF인가에 대해서 하기의 방법으로 판정한다. 즉, 암 병변의 내부 및/또는 주변에 존재하는 세포를 CAF의 마커인 α-SMA 표지된 항체, 예를 들면, FITC 표지된 항 α-SMA 항체 또는 Cy3 표지된 항 α-SMA 항체로 면역염색하여 α-SMA이 검출되는 것을 CAF라고 판정한다.In the present invention, determination of which cells are CAF is determined by the following method. Namely, cells present inside and / or around the cancerous lesion are treated with α-SMA labeled antibody such as FITC-labeled anti-α-SMA antibody or Cy3-labeled anti-α-SMA antibody which is a marker of CAF And judges that? -SMA is detected as CAF.
본 발명의 CAF와 관련된 암은 특별히 한정되지 않고, 예를 들면, 뇌종양, 두경부암, 유방암, 폐암, 식도암, 위암, 십이지장암, 충수암, 대장암, 직장암, 간암, 췌장암, 담낭암, 담관암, 항문암, 신암, 수뇨관암, 방광암, 전립선암, 음경암, 정소암, 자궁암, 난소암, 외음암, 질암, 피부암 등의 고형암을 들 수 있다. 또는 CAF는 일반적으로는 암에 관련된 것이지만 비슷한 성질이 있는 한, 암 이외의 악성고형종양, 예를 들면, 섬유육종, 악성섬유성조직구종, 지방육종, 횡문근육종, 평활근육종, 혈관육종, 악성피부암, 림프혈관육종, 활막육종, 연골육종, 골육종 등의 육종에 관련된 것도 또한 본 발명의 범위에 포함된다.The CAF-related cancer of the present invention is not particularly limited and includes, for example, brain tumor, head and neck cancer, breast cancer, lung cancer, esophageal cancer, gastric cancer, duodenal cancer, appendix cancer, colon cancer, rectal cancer, liver cancer, pancreatic cancer, Cancers such as cancer, new cancers, ureter cancer, bladder cancer, prostate cancer, penile cancer, colon cancer, uterine cancer, ovarian cancer, external tingling cancer, vaginal cancer and skin cancer. Or CAF is generally associated with cancer but, as long as similar properties are present, malignant solid tumors other than cancer, such as fibrosarcoma, malignant fibrous histiocytoma, liposarcoma, rhabdomyosarcoma, leiomyosarcoma, angiosarcoma, , Lymphangiosarcoma, synovial sarcoma, chondrosarcoma, osteosarcoma and the like are also included in the scope of the present invention.
본 발명의 하나의 실시태양에 있어서, CAF는 간장 및 췌장 이외의 부위에 존재한다. 따라서, 이 실시태양의 CAF는 예를 들면, 뇌, 두경부, 흉부, 사지, 폐, 심장, 흉선, 식도, 위, 소장(십이지장, 공장, 회장), 대장(결장, 맹장, 충수, 직장), 담낭, 항문, 신장, 수뇨관, 방광, 전립선, 음경, 정소, 자궁, 난소, 외음, 질, 피부, 횡문근, 평활근, 활막, 연골, 뼈, 갑상선, 부신, 복막, 장간막 등에 존재하는 것이다.In one embodiment of the invention, the CAF is present at sites other than the liver and pancreas. Therefore, the CAF of this embodiment can be used for the treatment of various diseases such as brain, head and neck, chest, limb, lung, heart, thymus, esophagus, stomach, duodenum, Such as gallbladder, anus, kidney, ureter, bladder, prostate, penis, testes, uterus, ovary, vulva, vagina, skin, rhabdomyosus, smooth muscle, synovial membrane, cartilage, bone, thyroid, adrenal gland, peritoneum and mesentery.
레티노이드는 4개의 이소프레노이드 단위가 헤드-투-테일(head-to-tail) 식으로 연결된 골격을 가지는 화합물 군 중 하나이다(G. P. Moss, “Biochemical Nomenclature and Related Documents, ” 2nd Ed. Portland Press, pp. 247-251, 1992). 비타민A는 레티놀의 생물학적 활성을 정성적으로 가리키는 레티노이드의 일반적인 용어이다. 본 발명의 레티노이드는 암세포 및 CAF로의 특이적인 물질전달을 촉진하는(즉, 물질을 이러한 세포에 표적화함) 것이다. 상기 레티노이드는 특별히 한정되지 않고, 예를 들면 레티놀(retinol), 레티날(retinal), 레티노인산(retinoic acid), 레티놀과 지방산의 에스터, 지방족알코올과 레티노인산의 에스터, 에트레치나트, 트레티노인, 이소트레티노인, 아다팔렌, 아시트레틴, 타자로텐, 팔미틴산 레티놀 등의 레티노이드 유도체, 및 펜레티니드(4-HPR), 베타카로틴 등의 비타민A 동족체(analog)를 이용할 수 있다.Retinoids are one of a group of compounds with four isoprenoid units linked head-to-tail (GP Moss, " Biochemical Nomenclature and Related Documents, " 2nd Ed. Portland Press, 247-251,1992). Vitamin A is a generic term for retinoids that qualitatively indicate the biological activity of retinol. The retinoids of the invention are those that promote specific mass transfer to cancer cells and CAF (i. E., Target a substance to such cells). The retinoid is not particularly limited and includes, for example, retinol, retinal, retinoic acid, ester of retinol and fatty acid, ester of aliphatic alcohol and retinoic acid, etrechinat, tretinoin, isotretinoin, Retinoid derivatives such as naringin, folin, acitretin, tazarotene, and retinol palmitate, and vitamin A analogs such as fenretinide (4-HPR) and beta carotene.
또한, 본 발명의 레티노이드는 레티노이드 유도체 및/또는 비타민A 동족체와 같은 의미이다. 레티노이드의 암세포 및 CAF로의 특이적인 물질전달을 촉진하는 메커니즘은 완전히 밝혀지지 않았지만, 암세포 및 CAF 표면상의 어떤 종류의 수용체(receptor)를 통해 받아들여지는 것으로 여겨진다.The retinoids of the present invention are synonymous with retinoid derivatives and / or vitamin A analogs. The mechanism by which retinoids promote specific cell mass transfer to cancer cells and CAF is not fully understood, but is believed to be accepted through cancer cells and some type of receptor on the CAF surface.
이 중, 레티놀(retinol), 레티날(retinal), 레티노인산(retinoic acid), 레티놀과 지방산의 에스터(예를 들면 레티닐아세테이트, 레티닐팔미테이트, 레티날스테아레이트 및 레티닐라우레이트) 및 지방족 알코올과 레티노인산의 에스터(예를 들면 에틸레티노에이트)는 암세포 및 CAF로의 특이적인 물질전달의 효율성 측면에서 바람직하다.Among these, retinol, retinal, retinoic acid, esters of retinol and fatty acids (for example, retinyl acetate, retinyl palmitate, retinyl stearate and retinyl laurate) and aliphatic Esters of alcohol and retinoic acid (for example, ethyl retinoate) are preferable in terms of the efficiency of mass transfer specific to cancer cells and CAF.
레티노이드의 시스-트랜스를 포함한 이성질체 모두는 본 발명의 범위에 포함된다. 또한, 레티노이드는 1개 또는 2개 이상의 치환기로 치환될 수도 있다. 본 발명의 레티노이드는 단독인 것은 물론, 이것을 용해 또는 유지할 수 있는 용매에 용해 또는 혼합한 상태의 레티노이드도 포함한다.All isomers, including cis-trans, of retinoids are included within the scope of the present invention. In addition, the retinoid may be substituted with one or two or more substituents. The retinoid of the present invention includes not only a single retinoid but also a retinoid dissolved or mixed in a solvent capable of dissolving or retaining it.
본 발명의 하나의 측면은, 레티노이드를 포함하는 암세포 및 암 관련 섬유아세포로 이루어진 군으로부터 선택되는 세포용 표적화제이다. 상기 표적화는 약물이나 약물 담체와 같은 물질이 특정 표적, 예를 들면 특정 세포나 조직(본 발명에서는 암세포 및 암 관련 섬유아세포로 이루어진 군으로부터 선택되는 세포)으로, 표적화 하지 않는 세포나 조직보다, 표적화 하지 않는 상기 물질과 비교하여, 빠르고 효율적으로 및/또는 대량으로 전달하는 것, 즉 표적에 특이적으로 전달할 수 있게 하는 것을 말하고, 표적화제(targeting agent)란, 물질과 결합 또는 반응할 경우, 해당 물질을 상기와 같이 표적화 할 수 있는 물질을 의미한다. 따라서, 본 명세서에서는 예를 들면, 암세포에 특이적인 담체 또는 조성물, 암세포에 표적화된 담체 또는 조성물과 동일한 의미로 사용될 수 있다. 한편, 표적화제가 분자형태인 경우에는 표적화 분자와 같은 의미이다.One aspect of the present invention is a cell targeting agent selected from the group consisting of cancer cells comprising retinoids and cancer-associated fibroblasts. Such targeting can be accomplished by targeting a substance such as a drug or drug carrier to a specific target, such as a specific cell or tissue (a cell selected from the group consisting of cancer cells and cancer-associated fibroblasts in the present invention) Refers to delivering in a fast, efficient and / or massive manner, that is to say, specifically delivering to a target, as compared with the above-mentioned materials, and a targeting agent means a Means a material that can be targeted as described above. Thus, in this specification, for example, a carrier or a composition specific for cancer cells, a carrier or a composition targeted for cancer cells may be used in the same sense. On the other hand, when the targeting agent is in the form of a molecule, it has the same meaning as the targeting molecule.
본 발명의 표적화제는 상기 레티노이드 단독으로 구성될 수 있고, 레티노이드 이외의 다른 구성성분, 예를 들면, 표적화제, 담체 또는 약물과의 결합을 촉진시키거나 안정화시키는 성분과 저장시, 제제 제조에 사용시 또는 제제의 저장시에 레티노이드를 보호하는 성분, 레티노이드, 담체 또는 약물을 공간적으로 떨어뜨리는 스페이서(spacer) 등을 포함할 수 있다. 본 발명의 표적화제는 임의의 담체 또는 약물과 결합시켜 상기 담체 또는 약물을 암세포 및 암 관련 섬유아세포로 이루어진 군으로부터 선택되는 세포에 표적화할 수 있다.The targeting agent of the present invention may be composed of the retinoid alone and may contain components that promote or stabilize binding with other components other than retinoids, such as a targeting agent, carrier, or drug, Or a component that protects the retinoid upon storage of the preparation, a spacer that spatially drops the retinoid, carrier, or drug, and the like. The targeting agent of the present invention can be conjugated to any carrier or drug to target the carrier or drug to cells selected from the group consisting of cancer cells and cancer-associated fibroblasts.
또한, 본 발명은 상기 표적화제를 포함하는, 암세포 및 암 관련 섬유아세포로 이루어진 군으로부터 선택되는 세포용 물질전달 담체에 관한 것이다. 본 발명의 담체는 상기 표적화제 단독으로 구성될 수 있고, 표적화제와는 다른, 담체의 표적화제 이외의 구성성분에 결합 또는 포함시켜 구성할 수 있다. 따라서 본 발명의 담체는 표적화제 이외의 구성성분을 포함할 수 있다. 이러한 성분은 특별히 한정되지 않고, 의약 및 약학 분야에 알려진 임의의 것들을 이용할 수 있으나, 표적화제 특히 레티노이드를 포함하거나 이와 결합하는 것이 바람직하다.The present invention also relates to a mass transfer carrier for cells selected from the group consisting of cancer cells and cancer-associated fibroblasts, which comprises the targeting agent. The carrier of the present invention may be constituted by the above-mentioned targeting agent alone, and may be constituted by binding to or incorporating components other than the targeting agent of the carrier different from the targeting agent. Thus, the carrier of the present invention may contain components other than the targeting agent. These components are not particularly limited, and any of those known in the medical and pharmaceutical arts can be used, but it is preferable to include or bind the targeting agent, particularly the retinoid.
이러한 성분으로서는, 지방질, 예를 들면, 글리세로인지질(glycerophospholipid) 등의 인지질, 스핑고미엘린(sphingomyelin) 등의 스핑고지질(sphingolipids), 콜레스테롤(cholesterol) 등의 스테롤(sterol), 콩기름, 양귀비유 등의 식물유, 미네랄유, 난황 레시틴 등의 레시틴류 등이 있으나, 이에 한정되지 않는다. 이 중, 리포솜을 구성할 수 있는 것, 예를 들면, 레시틴 등의 천연 인지질, 디미리스토일포스파티딜콜린(dimyristoylphosphatidylcholine, DMPC), 디팔미토일포스파티딜콜린(dipalmitoylphosphatidylcholine, DPPC), 디스테아로일포스파티딜콜린(distearoylphosphatidylcholine, DSPC) 등의 반합성 인지질, 디올레일포스파티딜에탄올아민(dioleoylphosphatidylethanolamine, DOPE), 디라우로일포스파티딜콜린(dilauroylphosphatidylcholine, DLPC), 콜레스테롤 등이 바람직하다.Examples of such components include lipids such as phospholipids such as glycerophospholipid, sphingolipids such as sphingomyelin, sterols such as cholesterol, soybean oil, And lecithins such as vegetable oil, mineral oil, egg yolk lecithin, and the like, but are not limited thereto. Among them, those capable of forming liposomes, for example, natural phospholipids such as lecithin, dimyristoylphosphatidylcholine (DMPC), dipalmitoylphosphatidylcholine (DPPC), distearoylphosphatidylcholine, DSPC), dioleoylphosphatidylethanolamine (DOPE), dilauroylphosphatidylcholine (DLPC), cholesterol, and the like are preferable.
특히 바람직한 성분으로는 세망내피계에 걸리는 것을 방지할 수 있는 성분, 예를 들면, N-(α-트리메틸암모니오아세틸)-디도데실-D-글루타메이트클로라이드(TMAG), N,N',N'',N'''-테트라메틸-N,N',N'',N'''-테트라팔미토일스퍼민(TMTPS), 2,3-디올레일옥시-N-[2-(스페르민카보자미드-O-에틸]-N,N-다이메틸-프로판아미늄 트리플루오로아세테이트(DOSPA), N-[1-(2,3-디올레일옥시) 프로필]-N,N,N-트리메틸암모늄 클로라이드(DOTMA), 디옥타데실디메틸암모늄 클로라이드(DODAC), 디도데실디메틸암모늄 브로마이드(DDAB), 1,2-디오레일옥시 3-트리메틸암모니오프로판(DOTAP), 3β-[N-(N',N'-디메틸아미노에탄) 카르바모일]콜레스테롤(DC-Chol), 1,2-디미리스틸옥시)프로필]-3-디메틸 히드록시 에틸 암모늄 브로마이드(DMRIE), O,O'-디테트라데카노일 N-(α-트리메틸암모니오아세틸) 디에탄올 아민 염화물(DC-6-14) 등의 양이온성 지질을 들 수 있다.Particularly preferred components include components which can prevent the reticuloendothelial system from attacking, for example, N- (α-trimethylammonioacetyl) -idodecyl-D-glutamate chloride (TMAG), N, N ' (TMTPS), 2,3'-dioleyloxy-N- [2- (spermine carboxylate), N '' '- tetramethyl-N, N', N ' Propylaminium trifluoroacetate (DOSPA), N- [1- (2,3-dioleyloxy) propyl] -N, N, N-trimethylammonium (DOTMA), dioctadecyldimethylammonium chloride (DODAC), didodecyldimethylammonium bromide (DDAB), 1,2-diorailoxy 3-trimethylammoniopropane (DOTAP), 3? - [N- (Dimethylaminoethyl) carbamoyl] cholesterol (DC-Chol), 1,2-dimyristyloxy) propyl] -3-dimethylhydroxyethylammonium bromide (DMRIE), O, O'-ditetradeca 0.0 > N- (a-trimethylammonio Acetyl) diethanolamine chloride (DC-6-14), and the like.
본 발명의 담체에 표적화제의 결합 또는 포함은, 화학적 및/또는 물리적인 방법에 따라 표적화제를 담체의 표적화제 이외의 구성 성분에 결합시키거나 또는 포함시킬 수 있다. 또한, 본 발명의 담체에 표적화제의 결합 또는 포함은, 상기 담체의 제작시 표적화제와 담체의 표적화제 이외의 구성성분을 혼합할 수도 있다. 본 발명의 담체에 결합시키거나 또는 포함시키는 표적화제의 양은 표적화제를 포함한 담체 구성성분 중 중량비가 0.01% ~ 100%이고, 바람직하게는 0.2% ~ 20%이며, 더욱 바람직하게는 1 ~ 5%로 할 수 있다. 담체에 표적화제의 결합 또는 포함은, 상기 담체에 약물 등을 넣기 전에 실시할 수 있고, 담체, 표적화제 및 약물 등을 동시에 혼합하는 것 등에 의해 실시할 수 있으며, 또는, 약물 등을 이미 넣은 상태의 담체와 표적화제를 혼합하는 것 등에 의해 실시할 수 있다. 또한, 본 발명은 기존의 임의의 약물결합 담체 또는 약물봉입 담체, 예를 들면, DaunoXome®, Doxil, Caelyx®, Myocet® 등의 리포솜 제제에 표적화제를 결합시키는 공정을 포함하는 암세포 및 CAF로 이루어진 군으로부터 선택되는 세포용 표적화 제제의 제조 방법에 관한 것이다.The binding or inclusion of the targeting agent to the carrier of the present invention may involve or involve the targeting agent on components other than the targeting agent of the carrier, depending on chemical and / or physical methods. In addition, the binding or incorporation of the targeting agent to the carrier of the present invention may be carried out by mixing constituent components other than the targeting agent and the targeting agent when the carrier is prepared. The amount of the targeting agent to be incorporated or included in the carrier of the present invention is 0.01% to 100%, preferably 0.2% to 20%, more preferably 1 to 5% by weight of the carrier component including the targeting agent, . The binding or incorporation of the targeting agent to the carrier may be carried out before the drug or the like is added to the carrier, or may be carried out by simultaneously mixing the carrier, the targeting agent and the drug, or the like, And mixing the carrier with the targeting agent. The present invention also relates to a pharmaceutical composition comprising a cancer cell comprising a process for binding a targeting agent to a liposomal formulation such as any of the conventional drug conjugate carriers or drug encapsulating carriers, for example, DaunoXome® , Doxil, Caelyx® , Myocet® and CAF Lt; RTI ID = 0.0 > a < / RTI > targeting agent for cells.
본 발명의 담체의 형태는 원하는 물질이나 물체를, 표적으로 하는 암세포 또는 CAF에 운반할 수 있으면 어느 형태라도 가능하고, 예를 들면, 한정되지 않지만, 고분자 미셀, 리포솜, 에멀젼, 미소공, 나노소공 등의 형태 중 어느 하나를 사용할 수 있다. 본 발명의 담체의 크기는 약물의 종류 등에 의존하여 변화될 수 있다. 이러한 크기는 특별히 한정되지 않지만, 직경이 예를 들면 50 ~ 200 ㎛인 것이 바람직하고, 75 ~ 150 ㎛인 것이 더욱 바람직하다. 이것은 이러한 크기가 암조직으로의 집적을 촉진하는 EPR 효과의 발현에 매우 적합하여 하기에 기재한 세포 및/또는 CAF의 활성 또는 증식을 억제하는 약물의 전달에 적절하기 위해서이다. 이러한 직경은 동적광산란법(dynamic light scattering method)으로 측정한 값이다.The form of the carrier of the present invention can be any form as long as it can carry a desired substance or object to a target cancer cell or CAF and includes, for example, polymeric micelles, liposomes, emulsions, microspheres, Or the like can be used. The size of the carrier of the present invention can be changed depending on the type of drug and the like. Such a size is not particularly limited, but it is preferable that the diameter is, for example, 50 to 200 占 퐉, more preferably 75 to 150 占 퐉. This is in order to be suitable for the delivery of drugs inhibiting the activity or proliferation of the cells and / or CAF described below, which is well suited for the expression of the EPR effect which promotes the accumulation of these sizes into cancer tissues. This diameter is a value measured by a dynamic light scattering method.
본 발명의 담체에 있어서는, 표적화제와 담체의 표적화제 이외의 구성성분의 몰비(존재비)는 투여시에 있어 바람직하게는 8:1 ~ 1:4이고, 더욱 바람직하게는 4:1 ~ 1:2이며, 더욱 더 바람직하게는 3:1 ~ 1:1이며, 특히 바람직하게는 2:1이다. 어떤 이론에 제한되는 일 없이, 이러한 몰비는 표적화제의 담체에 유효한(즉, 표적화제의 표적화 기능을 해치지 않음) 결합 또는 포함, 및 물질의 암세포 또는 CAF에 특이적인 전달에 효과적이라고 믿을 수 있다.In the carrier of the present invention, the molar ratio (abundance ratio) of the components other than the targeting agent of the targeting agent to the carrier is preferably 8: 1 to 1: 4, more preferably 4: 1 to 1: 2, still more preferably from 3: 1 to 1: 1, and particularly preferably 2: 1. Without wishing to be bound by any theory, it is believed that such a molar ratio is effective for binding (i.e., not harming the targeting function of the targeting agent) to the carrier of the targeting agent, and for delivery of the agent to cancer cells or CAF.
본 발명에 있어서는, 전달 효율의 정도, 전달할 수 있는 물질의 선택사항의 범위 또는 제제화의 용이성 등의 관점에 의해서 리포솜 형태가 바람직하고, 이 중에서도 특히 양이온성 지질을 포함하는 양이온성 리포솜이 바람직하다.In the present invention, a liposome form is preferable from the viewpoints of the degree of the transfer efficiency, the range of the substance to be delivered, the ease of formulation, and the like. Among these, cationic liposomes containing a cationic lipid are particularly preferable.
본 발명의 담체는 이것에 포함된 표적화제가 표적화 기능을 발휘할 수 있는 형태로 존재하면 전달물질을 내부에 포함하거나 전달물질의 외부에 부착하여 존재하거나 또는 전달물질과 혼합될 수 있다. 여기서 표적화 기능을 발휘한다는 것은 표적화제를 포함한 담체가 이것을 포함하지 않는 담체보다 빠르고 효율적으로 및/또는 대량으로 표적 세포에 있는 암세포 및/또는 CAF에 도달하고 및/또는 받아들여지는 것을 의미하며 이것은, 예를 들면, 표지를 붙이거나 또는 표지를 포함한 담체를 암세포 및/또는 CAF 배양물에 첨가하여 얼마의 시간 후에 표지의 존재 부위를 분석하는 것으로 쉽게 확인할 수 있다. 예측할 수 없는 표적화제를, 늦어도 암세포 및/또는 CAF에 도달할 때까지, 담체를 포함한 제제의 외부에 적어도 부분적으로라도 노출시킴으로써, 암세포 및/또는 CAF 특이적인 물질전달이 효율적으로 일어나는 것을 본 발명자들은 찾아냈다. 이것은, 담체를 포함하는 제제의 외부에 노출한 표적화제가, 암세포 및/또는 CAF 표면상이 있는 어떤 종류의 수용체(receptor)를 통해 통상의 확산보다 더 효율적으로 암세포 및/또는 CAF에 받아들여지는 현상에 의한 것으로 본 발명자는 고찰하고 있다. 담체를 포함하는 제제의 외부에 표적화제를 노출시키는 방법은 특별히 한정되지 않지만, 예를 들면 담체 조제시, 표적화제를 담체의 표적화제 이외의 구성성분에 비해 과도하게 배합하는 것을 들 수 있다. 더욱 구체적으로는, 표적화제를 담체를 포함하는 제제의 외부에 효율적으로 노출시키기 위해서는, 표적화제와 담체의 표적화제 이외의 구성성분과의 몰비(배합비)는, 배합시에 있어서 바람직하게는 8:1 ~ 1:4이고, 더욱 바람직하게는 4:1 ~ 1:2이며, 더욱 더 바람직하게는 3:1 ~ 1:1이며, 특히 바람직하게는 2:1이다.The carrier of the present invention may be present in the form of a substance capable of exhibiting a targeting function when it is contained in the carrier, or may be attached to the outside of the carrier material or may be mixed with the carrier material. Wherein the targeting function means that the carrier containing the targeting agent is delivered to and / or received by the cancer cells and / or the CAF in the target cell faster and more efficiently and / or in a larger amount than the carrier which does not contain the targeting agent, For example, it can be easily confirmed that a carrier containing a label or a label is added to a cancer cell and / or a CAF culture to analyze the presence of the label after a certain period of time. By exposing the unpredictable targeting agent to the outside of the formulation containing the carrier at least partially until the cancer cells and / or CAFs are reached at the latest, the inventors find that the cancer cell and / or CAF specific mass transfer is efficiently produced I got it. This means that the targeting agent exposed to the outside of the formulation containing the carrier is more efficiently absorbed into the cancer cells and / or CAF than the normal diffusion through certain types of receptors on cancer cells and / or CAF surfaces The present inventors have considered this by the inventors of the present invention. The method of exposing the targeting agent to the outside of the preparation containing the carrier is not particularly limited. For example, when the carrier is prepared, the targeting agent is excessively blended with the components other than the targeting agent of the carrier. More specifically, in order to efficiently expose the targeting agent to the outside of the preparation containing the carrier, the molar ratio (mixing ratio) of the targeting agent to the constituents other than the targeting agent of the carrier is preferably 8: 1 to 1: 4, more preferably 4: 1 to 1: 2, even more preferably 3: 1 to 1: 1, and particularly preferably 2: 1.
본 발명의 담체가 전달하는 물질이나 물체는 특별히 한정되지 않지만, 투여 부위로부터 암세포 및/또는 CAF가 존재하는 병변 부위까지 생물의 체내를 물리적으로 이동할 수 있는 크기인 것이 바람직하다. 따라서, 본 발명의 담체는 원자, 분자, 화합물, 단백질, 핵산 등의 물질은 물론, 벡터, 바이러스 입자, 세포 중 어느 하나 이상의 요소로 구성된 약물방출시스템, 마이크로 머신 등의 물체도 전달할 수 있다. 상기 물질 또는 물체는, 바람직하게는 암세포 및/또는 CAF에 어떠한 영향을 주는 성질이 있고, 예를 들면, 암세포 및/또는 CAF를 표지하거나, 암세포 및/또는 CAF의 활성 또는 증식을 억제하는(예를 들면, 이것을 증강 또는 억제) 것을 포함한다.The substance or object to be delivered by the carrier of the present invention is not particularly limited, but is preferably a size capable of physically moving the biological body from the administration site to the lesion site where cancer cells and / or CAF exist. Therefore, the carrier of the present invention can deliver not only substances such as atoms, molecules, compounds, proteins, and nucleic acids but also substances such as drug release systems and micromachines composed of any one or more of vectors, viral particles and cells. The substance or the object preferably has a property of affecting cancer cells and / or CAF, for example, a cancer cell and / or CAF, or a cancer cell and / or CAF that inhibits the activity or proliferation of cancer cells and / For example, enhancing or inhibiting it).
따라서 본 발명의 하나의 실시태양에 있어서, 담체가 전달하는 것은 "암세포 및/또는 CAF의 활성 또는 증식을 억제하는 약물"이다. 여기서 암세포의 활성은, 암세포가 나타내는 분비, 흡수,이동 등의 다양한 활성을 가리키지만, 본 발명에서는 일반적으로, 이 중 특히 암의 발병, 진행, 재발 및/또는 전이, 악액질 등의 증상의 발현이나 악화 등에 관여하는 활성을 의미한다. 이러한 활성으로서는 예를 들면, 한정되지 않고, 부갑상선 호르몬 관련 단백질(PTHrP)이나 면역억제 산성 단백(IAP) 등을 합성 및 분비를 들 수 있다.Thus, in one embodiment of the present invention, the carrier is "a drug that inhibits the activity or proliferation of cancer cells and / or CAF ". Herein, the activity of cancer cells is determined by the secretion, absorption, And the like. However, the present invention generally refers to an activity involved in the expression or aggravation of symptoms such as onset, progression, recurrence and / or metastasis of cancer, and cachexia. Examples of such activities include, but are not limited to, synthesis and secretion of a parathyroid hormone-related protein (PTHrP) or an immunosuppressive acidic protein (IAP).
또한, CAF의 활성은 CAF가 나타내는 분비, 흡수, 이동 등의 다양한 활성을 가리키지만, 본 발명에서는 일반적으로, 이 중 특히 암의 발병 및/또는 진행에 관여하는 활성을 의미한다. 이러한 활성으로는, 예를 들면, TGFβ, HGF, PDGF, VEGF, IGF(IFG1, IGF2 등), MMP(MMP1, 2, 3, 9, 11, 13, 14 등), FGF(FGF7, bFGF 등), uPA, 카텝신, SDF-1 등의 생리활성물질, 또는 콜라겐, 프로테오글리칸, 테나신, 파이브로넥틴, 트롬보스폰딘, 오스테오폰틴, 오스테오넥틴, 엘라스틴 등의 세포외기질 성분 등의 합성 및 분비를 들 수 있다.In addition, CAF activity refers to various activities such as secretion, absorption, migration and the like exhibited by CAF, but in the present invention, in particular, it refers to an activity involved in onset and / or progression of cancer. These activities include, for example, TGFβ, HGF, PDGF, VEGF, IGF (IFG1, IGF2 etc.), MMP (MMP1,2,3,9,11,13,14), FGF (FGF7, , uPA, cathepsin, and SDF-1, or extracellular matrix components such as collagen, proteoglycan, tenascin, fibronectin, thrombospondin, osteopontin, austenectin, Secretion.
따라서, 암세포의 활성 또는 증식을 억제하는 약물은 암의 발병, 진행 및/또는 재발에 관계되는 세포의 물리적, 화학적 및/또는 생리적인 작용 등을 직접 또는 간접적으로 억제하는 어떠한 약물이라면 이에 한정되지 않고, 암의 발병, 진행 및/또는 재발을 억제하는 항암제, 예를 들면, 한정되지 않고, 이포스파미드, 염산니무스틴, 시크로포스파미드, 다카바진, 멜파란, 라니무스틴 등의 알킬화제, 염산겜시타빈, 에노시타빈, 시타라빈옥포스페이트, 시타라빈 제제, 테가푸르·우라실, 테가푸르·기메라실·오테라실칼륨 배합제, 드키시후르리진, 하이드록시카바미드, 플루오로우라실, 메토트렉사트, 머캡토퓨린 등의 대사 길항제, 염산아이다루비신, 염산에피루비신, 염산다우노루비신, 구연산다우노루비신, 염산독소루비신, 염산피라루비신, 염산블레오마이신, 황산페프로마이신, 염산마이토잔트론, 마이토마이신 C 등의 항종양성 항생제, 에토포시드, 염산이리노테칸, 주석산비노렐빈, 도세탁셀수화물, 파크리탁셀, 황산빈크리스틴, 황산빈데신, 황산빈브라스틴 등의 알칼로이드, 아나스트로졸, 구연산타목시펜, 구연산토레미펜, 비칼루타마이드, 프루타마이드, 인산에스트라무스틴 등의 호르몬 요법제, 카보플라틴, 시스플라틴, 네다플라틴 등의 백금착체, 탈리도마이드, 네오바스타토, 베바시주맙 등의 혈관신생저해제, L-아스파라기나아제 등 상기 생리활성물질의 활성 또는 합성을 저해하는 약물, 예를 들면, 상기 생리활성물질을 중화하는 항체 및 항체 단편, 상기 생리활성물질의 발현을 억제하는 siRNA, 리보자임, 안티센스 핵산(RNA, DNA, PNA, 또는 이러한 복합물을 포함) 등의 물질 또는 도미넌트 네가티브 변이체 등의 도미넌트 네가티브 효과를 가지는 물질 또는 이들을 발현하는 벡터, 나트륨채널 저해제 등의 세포활성 억제제, 세포증식 억제제 및 컴파운드 861(compound 861), 글리오톡신(gliotoxin) 등의 아포토시스(apoptosis) 유도제를 포함한다. 또한, 본 발명의 "암세포의 활성 또는 증식을 억제하는 약물"은 암의 발병, 진행 및/또는 재발의 억제에 직접 또는 간접적으로 관계되는 암세포의 물리적, 화학적 및/또는 생리적인 작용 등을 직접 또는 간접적으로 촉진하는 어떠한 약물일 수 있다. 상기 약물 중 항암제가 치료 효과 등의 측면에서 특히 바람직하다.Thus, the drug that inhibits the activity or proliferation of cancer cells is not limited to any drug that directly or indirectly inhibits the physical, chemical, and / or physiological actions of the cells involved in the onset, progression, and / An anticancer agent that inhibits the onset, progression and / or recurrence of cancer such as, but not limited to, an alkylating agent such as iospamide, nimustine hydrochloride, cyclophosphamide, dacarbazine, melaran, ranimustine, Gemcitabine hydrochloride, enocitabine, cytarabine oxophosphate, cytarabine preparation, tegafur uracil, tegafur gimeraceil, ortheracil potassium compounding agent, dexycurfuridine, hydroxycarbamide, fluoro Metabolic antagonists such as ralacil, methotrexate, and mercapturidine, idarubicin hydrochloride, epirubicin hydrochloride, daunorubicin hydrochloride, daunorubicin citrate, doxorubicin hydrochloride, doxorubicin hydrochloride, Antibiotics such as mitoxantrone hydrochloride, mitoxantrone hydrochloride, mitomycin C, etoposide, irinotecan hydrochloride, vinorelbine hydrochloride, docetaxel hydrate, paclitaxel, sulfuric acid binchristine, sulfuric acid, Plastid complexes such as carboplatin, cisplatin, nedaplatin, etc .; and hormones such as corticosteroids, corticosteroids, corticosteroids, Drugs that inhibit the activity or synthesis of the above-mentioned physiologically active substances, such as angiogenesis inhibitors such as thalidomide, neovastanto, and bevacizumab, and L-asparaginase, such as antibodies and antibody fragments , A substance such as an siRNA, a ribozyme, an antisense nucleic acid (including RNA, DNA, PNA, or a complex thereof) that inhibits the expression of the above physiologically active substance, Or a vector expressing them, a cell activity inhibitor such as a sodium channel inhibitor, an apoptosis inducer such as a cell proliferation inhibitor and a compound 861, gliotoxin, or the like, . In addition, the "drug that inhibits the activity or proliferation of cancer cells" of the present invention can directly or indirectly treat the physiological, chemical, and / or physiological actions of cancer cells involved in the inhibition of the onset, progression and / It may be any drug which indirectly promotes. Among these drugs, anticancer agents are particularly preferable in terms of therapeutic effects and the like.
또한, CAF의 활성 또는 증식을 억제하는 약물은, 암의 발병 및/또는 진행에 관계되는 CAF의 물리적, 화학적 및/또는 생리적인 작용 등을 직접 또는 간접적으로 억제하는 어떠한 약물이라면 이에 한정되지 않고, 상기 생리활성물질의 활성 또는 합성을 저해하는 약물, 예를 들면, TGFβ에 대항하는 TGFβ Ⅱ형 수용체(절단형 TGFβ Ⅱ형 수용체, 가용성 TGFβ Ⅱ형 수용체 등), 바치마스타토 등의 MMP 저해제 및 상기 생리활성물질을 중화시키는 항체 및 항체 단편, 상기 생리활성물질의 발현을 억제하는 siRNA, 리보자임, 안티센스 핵산(RNA, DNA, PNA, 또는 이러한 복합물을 포함) 등의 물질 또는 도미넌트 네가티브 변이체 등의 도미넌트 네가티브 효과를 가지는 물질 또는 이것들을 발현하는 벡터, 나트륨채널 저해제 등의 세포활성 억제제, 알킬화제(예를 들면, 이포스파미드, 염산니무스틴, 시크로포스파미드, 다카바진, 멜파란, 라니무스틴 등), 항종양성 항생제(예를 들면, 염산아이다루비신, 염산에피루비신, 염산다우노루비신, 구연산다우노루비신, 염산독소루비신, 염산피라루비신, 염산블레오마이신, 황산페프로마이신, 염산마이토잔트론, 마이토마이신 C 등), 대사 길항제(예를 들면, 염산겜시타빈, 에노시타빈, 시타라빈·옥포스페이트, 시타라빈 제제, 테가푸르·우라실, 테가푸르·기메라실·오테라실칼륨 배합제, 드키시후르리진, 하이드록시카바미드, 플루오로우라실, 메토트렉사트, 머캡토퓨린 등), 에토포시드, 염산이리노테칸, 주석산비노렐빈, 도세탁셀수화물, 파크리탁셀, 황산빈크리스틴, 황산빈데신, 황산빈브라스틴 등의 알카로이드, 및 카보플라틴, 시스플라틴, 네다플라틴 등의 백금착체 등의 세포증식 억제제 및 컴파운드 861(compound 861), 글리오톡신(gliotoxin) 등의 아포토시스(apoptosis) 유도제를 포함한다. 또한, 본 발명의 "CAF의 활성 또는 증식을 억제하는 약물"은 암의 발병 및/또는 진행의 억제에 직접 또는 간접적으로 관계되는 CAF의 물리적, 화학적 및/또는 생리적인 작용 등을 직접 또는 간접으로 촉진하는 어떠한 약물일 수 있다.In addition, the drug that inhibits the activity or proliferation of CAF is not limited to any drug that directly or indirectly inhibits the physical, chemical and / or physiological actions of CAF related to the onset and / or progression of cancer, A drug that inhibits the activity or synthesis of the physiologically active substance, for example, a TGF? Type II receptor (truncated TGF? Type II receptor, soluble TGF? Type receptor, etc.) against TGF?, An MMP inhibitor such as bacimastate, An antibody and an antibody fragment which neutralize the physiologically active substance, a substance such as an siRNA, a ribozyme, an antisense nucleic acid (including RNA, DNA, PNA, or a complex thereof) or a dominant negative mutant A substance having a negative effect or a vector expressing them, a cell activity inhibitor such as a sodium channel inhibitor, an alkylating agent (for example, Antibiotics such as idarubicin hydrochloride, epirubicin hydrochloride, daunorubicin hydrochloride, daunorubicin hydrochloride, quinacridone hydrochloride, (Eg, doxorubicin hydrochloride, pyruvicin hydrochloride, bromomycin hydrochloride, pepromycin sulfate, mitoxantrone hydrochloride, and mitomycin C), metabolic antagonists (eg, gemcitabine hydrochloride, enocitabine, cytarabine Oxalate, oxalate, cytarabine, tegafur, uracil, tegafur, gemelac, oteracil potassium compounding agent, dexycurfuridine, hydroxycarbamide, fluorouracil, methotrexate, mercaptopurine, etc. ), Etoposide, irinotecan hydrochloride, vinorelbine tartrate, docetaxel hydrate, paclitaxel, binocristine sulfate, alkaloids such as sulfuric acid vindesine and binaphthylsulfate, and platinum complexes such as carboplatin, cisplatin and nedaplatin Cell proliferation Include apoptosis (apoptosis) inducing agent, such as preparation and compound 861 (compound 861), article Rio toxin (gliotoxin). In addition, the "agent that inhibits the activity or proliferation of CAF" of the present invention is a drug that inhibits the physiological, chemical, and / or physiological actions of CAF directly or indirectly related to the inhibition of cancer onset and / It may be any medication that promotes.
본 발명의 "CAF의 활성 또는 증식을 억제하는 약물"의 다른 예로서는 세포외기질, 예를 들면 콜라겐의 대사를 억제하는 약물일 수 있고, 이것은 예를 들면, CAF에 의해 합성되는 세포외기질 구성분자를 표적으로 하거나 상기 세포외기질 구성분자의 합성 또는 분비에 관여하는 분자 중 하나 또는 그 이상을 표적으로 하는 siRNA, 리보자임, 안티센스 핵산(RNA, DNA, PNA, 또는 이러한 복합물을 포함) 등의 표적 분자의 발현을 억제하는 효과를 가지는 물질 또는 도미넌트 네가티브 변이체 등의 도미넌트 네가티브 효과를 가지는 물질 또는 이들을 발현하는 벡터 등이 포함된다.Another example of the "agent for inhibiting the activity or proliferation of CAF" of the present invention may be a drug for inhibiting the metabolism of the extracellular matrix, for example, collagen. For example, the extracellular matrix constituent molecule Such as siRNA, ribozyme, antisense nucleic acid (including RNA, DNA, PNA, or a complex thereof) targeting one or more of molecules involved in the synthesis or secretion of the extracellular matrix constituent molecules A substance having an effect of inhibiting the expression of a molecule or a dominant negative effect such as a dominant negative mutant, or a vector expressing them.
siRNA는 mRNA와 같은 표적 분자에 특이적인 서열을 가지는 이중 가닥 RNA이고, 표적 분자의 분해를 촉진함으로써, 그것에 의해 형성되는 물질, 예를 들면 단백질의 발현을 억제한다(RNA 간섭). Fire 등에 의해 그 원리가 발표된 이래(Nature, 391:806-811, 1998), siRNA의 최적화에 관해서는 이미 광범위하게 연구가 진행되고 있어, 당업자는 해당 기술에 정통하고 있다. 또한, siRNA 이외의 RNA 간섭 또는 그 외의 유전자 발현 저해반응을 가져오는 물질에 대해서도 활발한 연구가 이루어지고 있어, 현재는 이러한 물질도 많이 생겨나고 있다.siRNA is a double-stranded RNA having a sequence specific to a target molecule such as mRNA and promotes degradation of a target molecule, thereby suppressing the expression of a substance, for example, a protein formed thereby (RNA interference). Since the principles were published by Fire et al. (Nature, 391: 806-811, 1998), optimization of siRNA has already been extensively studied, and the person skilled in the art is familiar with the technology. In addition, active research has been carried out on substances that cause RNA interference or other gene expression inhibition reactions other than siRNA, and such substances are now being produced.
예를 들면, 특허 제 2003-219893호 공보에는 표적 유전자의 발현을 저해하는 DNA 및 RNA로 이루어진 이중 가닥 폴리뉴클레오티드가 기재되어 있다. 이 폴리뉴클레오티드는 이중 가닥 중 한편이 DNA이고, 다른 한편은 RNA인 DNA/RNA 하이브리드(hybrid)일 수 있고, 같은 가닥의 일부 DNA에서 다른 부분이 RNA인 DNA/RNA 키메라일 수 있다. 이 폴리뉴클레오티드는 바람직하게는 19 ~ 25, 더욱 바람직하게는 19 ~ 23, 가장 바람직하게는 19 ~ 21 뉴클레오티드로 구성될 수 있고, DNA/RNA 하이브리드(hybrid)의 경우에는 센스 가닥이 DNA이고 안티센스 가닥이 RNA인 것이 바람직하고 또한, DNA/RNA 키메라의 경우에는 이중 가닥 폴리뉴클레오티드의 상측의 일부가 RNA인 것이 바람직하다. 이 폴리뉴클레오티드는 잘 알려진 화학 합성법의 정해진 방법에 따라 임의의 서열을 가지도록 제작할 수 있다.For example, Japanese Patent No. 2003-219893 discloses a double-stranded polynucleotide consisting of DNA and RNA that inhibits the expression of a target gene. The polynucleotide may be a DNA / RNA hybrid in which one of the double strands is DNA and the other is RNA, and the DNA / RNA chimera in which the other part of the same strand is RNA is RNA. The polynucleotide may preferably be composed of 19 to 25 nucleotides, more preferably 19 to 23 nucleotides, and most preferably 19 to 21 nucleotides. In the case of DNA / RNA hybrid, the sense strand is DNA and the antisense strand It is preferable that the RNA is an RNA, and in the case of a DNA / RNA chimera, an upper part of the double-stranded polynucleotide is preferably RNA. These polynucleotides can be prepared to have any sequence according to a predetermined method of a well-known chemical synthesis method.
상기 표적분자로서는, 예를 들면, 세포외기질 구성분자의 합성 및/또는 분비를 모두 억제할 수 있는 분자가 바람직하고 이러한 분자의 예로서 한정되지 않지만, HSP47가 포함된다. HSP47 또는 그 상동체(homolog)의 유전자 서열은 예를 들면, GenBank accession No. AB010273(인간), X60676(마우스), M69246(래트, gp46)로서 공개되어 있다.The target molecule is preferably a molecule capable of inhibiting the synthesis and / or secretion of extracellular matrix constituent molecules. Examples of such molecules include, but are not limited to, HSP47. The gene sequence of HSP47 or homologues thereof is described in, for example, GenBank accession No. AB010273 (human), X60676 (mouse), M69246 (rat, gp46).
따라서, 본 발명의 CAF의 활성 또는 증식을 억제하는 약물로서는, 예를 들면, HSP47를 표적으로 하는 siRNA, DNA/RNA 하이브리드(hybrid) 또는 키메라 폴리뉴클레오티드, 안티센스 핵산 등이 바람직하다.Therefore, examples of drugs that inhibit the activity or proliferation of CAF of the present invention include siRNA, Hsp47-targeted siRNA, DNA / RNA hybrid or chimeric polynucleotide, and antisense nucleic acid.
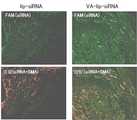
본 발명의 담체가 전달하는 물질이나 물체는 표지되거나 표지되어 있지 않을 수 있다. 표지화에 의해, 전달의 성공 여부, 암세포 또는 CAF의 증감 등을 모니터링하는 것이 가능해지고, 특히 시험 연구 수준에서 유용하다. 표지는 당업자에게 공지된 임의의 것, 예를 들면, 임의의 방사성 동위체, 자성체, 표지화된 물질에 결합하는 물질(예를 들면 항체), 형광물질, 플루오르포, 화학발광물질 및 효소 등으로부터 선택할 수 있다.The substance or object delivered by the carrier of the present invention may or may not be labeled. By marking, it is possible to monitor the success or failure of delivery, the increase or decrease of cancer cells or CAF, and is particularly useful at the level of the test study. The label may be selected from any of those known to those skilled in the art, for example, any radioisotope, a magnetic substance, a substance that binds to the labeled substance (such as an antibody), a fluorescent substance, a fluorophore, a chemiluminescent substance, have.
본 발명의 "암세포용" 또는 "암 관련 섬유아세포용"은, 암세포 또는 암 관련 섬유아세포를 표적으로 사용하는데도 적합한 것을 의미하고, 이것은 예를 들면, 표적세포, 즉, 암세포 또는 암 관련 섬유아세포에서 다른 세포(비표적세포), 예를 들면 암화하지 않고 있는 세포 또는 정상적인 섬유아세포보다 더욱 빠르고 효율적으로 및/또는 대량으로 전달하는 것을 포함한다. 예를 들면, 본 발명의 담체는 암세포 또는 암 관련 섬유아세포에서 다른 세포에 비해 1.1, 1.2, 1.3, 1.5, 2 또는 3배 이상의 속도 및/또는 효율로 물질을 전달할 수 있다. 한편, 여기서 "효율"은 평가 대상이 되는 세포 전체 중 물질이 전달된 세포의 비율을 의미한다.The term "for cancer cells" or "for cancer-associated fibroblasts" of the present invention means suitable for use as a target of cancer cells or cancer-associated fibroblasts. For example, it may be a target cell, And more rapidly and efficiently and / or in a larger quantity than other cells (non-target cells), such as non-carcinogenic cells or normal fibroblasts. For example, the carrier of the present invention can deliver a substance at rates and / or efficiencies of 1.1, 1.2, 1.3, 1.5, 2 or 3 times or more as compared to other cells in cancer cells or cancer-associated fibroblasts. The term "efficiency" as used herein means the ratio of the cells to which the substance is transferred among the cells to be evaluated.
또한, 본 발명은 상기 표적화제 또는 담체, 상기 암세포 및/또는 CAF의 활성 또는 증식을 억제하는 1종 또는 2종 이상의 약물을 포함하는 암세포의 활성 또는 증식 억제용 또는 암치료용 조성물(항암 조성물), CAF의 활성 또는 증식 억제용 조성물(항 CAF 조성물) 및 CAF와 관련된 암치료용 조성물, 및 상기 표적화제 또는 담체의 이러한 조성물의 제조에의 용도에 관한 것이다.The present invention also provides a composition (anticancer composition) for inhibiting the activity or proliferation of cancer cells, which comprises the above targeting agent or carrier, one or more drugs inhibiting the activity or proliferation of the cancer cells and / or CAF, , A composition for inhibiting the activity or proliferation of CAF (an anti-CAF composition) and a composition for treating cancer associated with CAF, and the use of the targeting agent or carrier in the production of such a composition.
본 발명의 암은 모든 악성종양, 예를 들면, 섬유육종, 악성섬유성 조직구종, 지방육종, 횡문근육종, 평활근육종, 혈관육종, 악성피부암, 림프혈관육종, 활막육종, 연골육종, 골육종, 또한, 뇌종양, 두경부암, 유방암, 폐암, 식도암, 위암, 십이지장암, 충수암, 대장암, 직장암, 간암, 췌장암, 담낭암, 담관암, 항문암, 신암, 수뇨관암, 방광암, 전립선암, 음경암, 정소암, 자궁암, 난소암, 외음암, 질암, 피부암, 백혈병, 악성임파종 등도 포함한다. 상기 암은 CAF를 수반하거나 수반하지 않을 수 있다. 본 발명의 하나의 실시태양에 있어서, 암은 간암 및 췌장암 이외의 암인 것이 바람직하다. 또한, 다른 실시태양에 있어서, 암치료는 간암 및 췌장암의 예방 이외의 것이 바람직하다.The cancer of the present invention can be used for all malignant tumors such as fibrosarcoma, malignant fibrous histiocytoma, liposarcoma, rhabdomyosarcoma, leiomyosarcoma, angiosarcoma, malignant skin cancer, lymphangiosarcoma, synovial sarcoma, chondrosarcoma, osteosarcoma , Cancer of the head, cancer of the head, cancer of the head, cancer of the breast, cancer of the lung, cancer of the esophagus, cancer of the stomach, cancer of the duodenum, cancer of the appendix, colon cancer, rectum cancer, liver cancer, pancreatic cancer, gallbladder cancer, cholangiocarcinoma, Small bowel cancer, uterine cancer, ovarian cancer, external tingling cancer, vaginal cancer, skin cancer, leukemia, malignant lymphoma and the like. The cancer may or may not involve CAF. In one embodiment of the present invention, the cancer is preferably cancer other than liver cancer and pancreatic cancer. Further, in another embodiment, cancer treatment is preferably other than prevention of liver cancer and pancreatic cancer.
또한, 본 발명에서 CAF와 관련된 암, 그 내부 또는 주변에 CAF가 존재하는, "CAF에 수반된 암" 뿐만 아니라, CAF와는 공간적으로 멀리 떨어져 있지만 CAF이 방출하는 상기의 생리활성물질에 의해 그 증식이나 활성이 촉진되는 암도 포함한다. 따라서, CAF와 관련된 암은 넓게는 악성종양을 의미하고 상피성의 악성종양인 모든 암, 예를 들면, 뇌종양, 두경부암, 유방암, 폐암, 식도암, 위암, 십이지장암, 충수암, 대장암, 직장암, 간암, 췌장암, 담낭암, 담관암, 항문암, 신암, 수뇨관암, 방광암, 전립선암, 음경암, 정소암, 자궁암, 난소암, 외음암, 질암 및 피부암, 또는, 비상피성의 악성종양인 상기 이외의 임의의 악성고형종양, 예를 들면, 섬유육종, 악성섬유성조직구종, 지방육종, 횡문근육종, 평활근육종, 혈관육종, 악성피부암, 림프혈관육종, 활막육종, 연골육종, 골육종 등도 포함한다. 본 발명에서는 유리하게는 CAF의 증식에 대한 기여도가 높은 결장 직장암, 폐암, 유방암, 전립선암, 위암, 담관암, 기저세포암 등의 피부암으로부터 선택되는 CAF와 관련된 암을 치료할 수 있다. 본 발명의 하나의 실시태양에 있어서, CAF와 관련된 암은 간암 및 췌장암은 포함하지 않는다. 또한, 다른 실시태양에 있어서, CAF와 관련된 암 치료는 간암 및 췌장암의 예방을 포함하지 않는다.In addition, in the present invention, not only "cancer accompanied by CAF" in which cancer associated with CAF, CAF in the inside or the periphery thereof exists, but also proliferation of cancer caused by the above-mentioned physiologically active substance which is spaced apart from CAF, Or cancer whose activity is promoted. Thus, cancer associated with CAF broadly refers to malignant tumors, which are all cancerous epithelial tumors such as brain tumors, head and neck cancer, breast cancer, lung cancer, esophageal cancer, gastric cancer, duodenal cancer, appendix cancer, Or a non-epithelial malignant tumor which is a malignant tumor of the non-epithelial origin, including, but not limited to, hepatocellular carcinoma, liver cancer, pancreatic cancer, gallbladder cancer, cholangiocarcinoma, anal cancer, neoplasm, ureteral cancer, bladder cancer, prostate cancer, penile cancer, Malignant solid tumors such as fibrous sarcoma, malignant fibrous histiocytoma, liposarcoma, rhabdomyosarcoma, leiomyosarcoma, angiosarcoma, malignant skin cancer, lymphangiosarcoma, synovial sarcoma, chondrosarcoma, osteosarcoma and the like. The present invention can advantageously treat CAF-related cancers selected from skin cancers such as colorectal cancer, lung cancer, breast cancer, prostate cancer, stomach cancer, cholangiocarcinoma, basal cell carcinoma, etc. which have a high contribution to the proliferation of CAF. In one embodiment of the invention, the cancer associated with CAF does not include liver cancer and pancreatic cancer. Further, in another embodiment, the cancer treatment associated with CAF does not include the prevention of liver cancer and pancreatic cancer.
본 발명의 항암 조성물의 하나의 실시태양은, 상기 표적화제 또는 담체 및 암세포의 활성 또는 증식을 억제하는 약물을 포함하고, 이것을 암세포에 직접 전달함으로써 항암 작용을 발휘한다. 본 발명의 항암 조성물의 다른 실시태양은, 상기 표적화제 또는 담체 및 CAF의 활성 또는 증식을 억제하는 약물을 포함하고, 이것을 CAF에 전달하여 그 활성 또는 증식을 억제함으로써 간접적으로 항암 작용을 발휘한다. 본 발명의 항암 조성물의 또 다른 실시태양은, 상기 표적화제 또는 담체 및 암세포의 활성 또는 증식을 억제하는 약물 및 CAF의 활성 또는 증식을 억제하는 약물 중 어느 하나 또는 그 둘 모두를 포함하고, 암세포의 활성 또는 증식을 억제하는 약물이 암세포에, 또한, CAF의 활성 또는 증식을 억제하는 약물이 CAF에 각각 작용함으로써 이중 항암 작용을 발휘한다. 이 실시태양에 있어서, 암세포의 활성 또는 증식을 억제하는 약물과 CAF의 활성 또는 증식을 억제하는 약물은 동일하거나 서로 다른 물질일 수 있다.One embodiment of the anticancer composition of the present invention includes a drug that inhibits the activity or proliferation of the targeting agent or carrier and cancer cells, and exerts an anticancer effect by directly delivering the drug to cancer cells. Another embodiment of the anticancer composition of the present invention includes the above targeting agent or carrier and a drug which inhibits the activity or proliferation of CAF and transmits it to CAF to inhibit its activity or proliferation to exert an anti-cancer action indirectly. Another embodiment of the anticancer composition of the present invention comprises a drug that inhibits the activity or proliferation of the targeting agent or carrier and cancer cells, and / or a drug that inhibits the activity or proliferation of CAF, A drug that inhibits activity or proliferation acts on cancer cells, and a drug that inhibits the activity or proliferation of CAF acts on CAF, thereby exerting a dual anti-cancer effect. In this embodiment, the drug that inhibits the activity or proliferation of cancer cells and the drug that inhibits the activity or proliferation of CAF may be the same or different substances.
본 발명의 조성물에 있어서는, 표적화제가 표적화 기능을 발휘하는 형태로 존재하는 한, 담체는 전달물질을 그 내부에 포함하거나 전달물질의 외부에 부착하거나, 또는 전달물질과 혼합할 수 있다. 따라서, 투여 경로 및 약물 방출 방식 등에 따라 상기 조성물을 적절한 재료, 예를 들면, 장용성 코팅 또는 시한 붕괴성 재료로 피복할 수 있고 또한, 적절한 약물 방출 시스템에 포함시킬 수 있다.In the composition of the present invention, as long as the targeting agent is present in a form that exerts a targeting function, the carrier may contain the carrier material therein, adhere to the outside of the carrier material material, or may be mixed with the carrier material. Thus, the composition can be coated with an appropriate material, such as an enteric coating or a time-collapsible material, depending on the route of administration and the manner of drug release, and can also be included in a suitable drug release system.
본 발명의 조성물은 경구 및 비경구 모두를 포함하는 다양한 경로, 예를 들면, 한정되지 않고, 경구, 정맥내, 근육내, 피하, 국소, 직장, 동맥내, 문맥내, 심실내, 불경 점막, 경피, 비내, 복강내, 종양내, 폐내 및 자궁내 등의 경로로 투여할 수 있고, 각 투여 경로에 적절한 제형으로 제제화할 수 있다. 이러한 제형 및 제제 방법은 모든 공지된 것들을 적당하게 사용할 수 있다(예를 들면, 표준약제학, 와타나베희테루 등, 南江堂, 2003 등 참조).The compositions of the present invention may be administered by any of a variety of routes including oral and parenteral, including, but not limited to, oral, intravenous, intramuscular, subcutaneous, topical, rectal, intraarterial, intracorporeal, Transdermal, intranasal, intraperitoneal, intratracheal, intrapulmonary, and intrauterine routes, and may be formulated into a formulation suitable for each route of administration. Such formulations and preparation methods can be suitably used for all known methods (see, for example, standard pharmaceuticals, Hiramatsu Watanabe, et al., Nanjo, 2003, etc.).
예를 들면, 경구 투여의 적절한 제형으로서는, 한정되지 않고, 가루약, 과립제, 정제, 캡슐제, 물약, 현탁제, 유제, 겔제, 시럽제 등이 있고, 또한 비경구 투여에 적절한 제형으로서는, 용액성 주사제, 현탁성 주사제, 유탁성 주사제, 용시 조제형 주사제 등의 주사제가 있다. 비경구 투여 제제는 수용성 또는 비수용성의 등장성 무균 용액 또는 현탁액의 형태일 수 있다.Examples of suitable formulations for oral administration include, but are not limited to, powders, granules, tablets, capsules, potions, suspensions, emulsions, gels, syrups and the like. Formulations suitable for parenteral administration include solutions , Suspension injections, emulsion injections, injection preparations, and the like. The parenteral dosage form may be in the form of a water-soluble or water-insoluble isotonic solution or suspension.
본 발명의 표적화제, 담체 또는 조성물은 어떠한 형태로도 공급될 수 있고, 저장 안정성의 측면에서 바람직하게는 사용시 조제 가능한 형태, 예를 들면, 의료 현장 또는 그 근방에서 의사 및/또는 약사, 간호사 또는 그 외의 치료사 등에 의해 조제될 수 있는 형태로 제공된다. 이 경우, 본 발명의 표적화제, 담체 또는 조성물은 이것들의 필수 구성요소 중 적어도 1개를 포함하는 1개 또는 그 이상의 용기로서 제공되며, 사용 전에, 예를 들면, 24시간 전 이내, 바람직하게는 3시간 전 이내, 더욱 바람직하게는 사용 직전에 조제된다. 조제함에 있어서, 조제하는 장소에서 통상 입수 가능한 시약, 용매, 조제기구 등을 적절하게 사용할 수 있다.The targeting agent, carrier or composition of the present invention may be supplied in any form and may be in the form of a formulation which is preferably formulated at the time of use, for example in terms of storage stability, such as a physician and / or pharmacist, And is provided in a form that can be prepared by other therapists or the like. In this case, the targeting agent, carrier or composition of the present invention is provided as one or more containers containing at least one of these essential components, and may be used before use, for example, within 24 hours, Preferably within 3 hours, more preferably immediately before use. In the preparation, a reagent, a solvent, a preparation apparatus, and the like which are usually available at the preparation site can be appropriately used.
또한, 본 발명은 표적화제 및/또는 전달물질 및/또는 표적화제 이외의 담체 구성물질을 단독으로 또는 조합하여 포함하는 1개 또는 그 이상의 용기를 포함하는 담체 또는 조성물의 조제 키트 및 그러한 키트 형태로 제공되는 담체 또는 조성물의 필요 구성요소에 관한 것이다. 본 발명의 키트는 상기의 것들 이외에 본 발명의 표적화제, 담체 및 조성물의 조제 방법이나 투여 방법 등에 대한 설명서나 CD, DVD 등의 전자기록매체 등을 포함할 수 있다. 또한, 본 발명의 키트는 본 발명의 표적화제, 담체 또는 조성물을 완성하기 위한 구성요소 모두를 포함할 수 있고, 반드시 모든 구성요소를 포함할 필요는 없다. 따라서, 본 발명의 키트는 의료 현장이나 실험실 등에서 통상 입수 가능한 시약이나 용매, 예를 들면, 무균수나 생리 식염수, 포도당 용액 등을 포함하지 않을 수도 있다.The present invention also relates to a kit for preparing a carrier or a composition comprising one or more containers containing the targeting agent and / or the carrier substance other than the carrier substance and / or the targeting agent, either singly or in combination, and in the form of such kit To the required components of the carrier or composition provided. In addition to the above, the kit of the present invention may include instructions for preparing and administering the targeting agent, carrier and composition of the present invention, and electronic recording media such as CDs and DVDs. In addition, the kit of the present invention may include all of the components for accomplishing the targeting agent, carrier, or composition of the present invention, and need not necessarily include all the components. Therefore, the kit of the present invention may not contain a reagent or a solvent ordinarily available in a medical field or a laboratory, for example, sterile water, physiological saline solution, glucose solution and the like.
또한, 본 발명은 상기 조성물의 유효량을 그것을 필요로 하는 개체에 투여하는 단계를 포함하는 암세포의 활성 또는 증식의 억제 또는 암 치료 방법 및 CAF의 활성 또는 증식의 억제 또는 CAF와 관련된 암 치료 방법에 관한 것이다. 여기서 유효량이란, 예를 들면, 암치료 방법에 있어서는, 암의 발병을 감소시켜 증상을 경감시키거나 진행을 지연 또는 정지시키는 양이며, 바람직하게는 암의 발병을 예방하거나 암을 치료할 수 있는 양이다. 또한, 투여에 의한 이점을 넘는 악영향이 생기지 않게 하는 양이 바람직하다. 이러한 유효량은 배양세포 등을 이용한 시험관 내(in vitro) 실험이나 마우스, 래트, 개 또는 돼지 등의 모델 동물에 있어서의 실험에 의해 적절하게 결정할 수 있고, 이러한 실험법은 당업자에게 잘 알려져 있다. 또한, 담체에 포함되는 표적화제 및 본 발명의 방법에 대한 약물의 용량은 당업자에게 공지된 것이거나 또는 상기의 실험 등에 의해 적절하게 결정될 수 있다.In addition, the present invention relates to a method of inhibiting the activity or proliferation of cancer cells or administering an effective amount of the composition to a subject in need thereof, a method of treating cancer, an inhibition of CAF activity or proliferation, or a method of treating cancer associated with CAF will be. Herein, the effective amount means an amount that reduces the incidence of cancer and alleviates symptoms or delays or stops the progression of cancer, for example, in the method of treating cancer, and is preferably an amount capable of preventing cancer or treating cancer . It is also preferable that the amount is such that an adverse effect beyond the advantage due to administration does not occur. Such an effective amount can be suitably determined by in vitro experiments using cultured cells or the like, or by experiments in model animals such as mice, rats, dogs or pigs, and such experiments are well known to those skilled in the art. In addition, the dose of the targeting agent contained in the carrier and the drug for the method of the present invention may be appropriately determined by those skilled in the art, or by the above-described experiment and the like.
본 발명의 암치료 방법의 하나의 실시태양에서, 상기 표적화제 또는 담체 및 암세포의 활성 또는 증식을 억제하는 약물을 포함하는 항암 조성물을 투여하여 약물을 암세포에 직접 전달함으로써 암을 치료한다. 본 발명의 암 치료 방법의 다른 실시태양에서는, 상기 표적화제 또는 담체 및 CAF의 활성 또는 증식을 억제하는 약물을 포함하는 항암 조성물을 투여하고 약물을 CAF에 전달함으로써 그 활성 또는 증식을 억제하여 간접적으로 암을 치료한다. 본 발명의 암 치료 방법의 또 다른 실시태양에서는, 상기 표적화제 또는 담체 및 암세포의 활성 또는 증식을 억제하는 약물 및 CAF의 활성 또는 증식을 억제하는 약물 중 어느 하나 또는 그 둘 모두를 포함하는 항암 조성물을 투여하고 암세포의 활성 또는 증식을 억제하는 약물을 암세포에, 그리고 CAF의 활성 또는 증식을 억제하는 약물을 CAF에 각각 전달함으로써 2개 루트로 암을 치료한다. 이 실시양태에서는, 암세포의 활성 또는 증식을 억제하는 약물과 CAF의 활성 또는 증식을 억제하는 약물은 동일하거나 각각 다른 물질일 수 있다.In one embodiment of the cancer treatment method of the present invention, the cancer is treated by administering the anticancer composition comprising the targeting agent or the carrier and a drug that inhibits the activity or proliferation of the cancer cells and directly delivering the drug to the cancer cells. In another embodiment of the cancer treatment method of the present invention, an anti-cancer composition comprising the targeting agent or carrier and a drug that inhibits the activity or proliferation of CAF is administered and the drug is delivered to CAF to inhibit its activity or proliferation, Treat cancer. In another embodiment of the cancer treatment method of the present invention, the anticancer composition comprising any one or both of a drug that inhibits the activity or proliferation of the targeting agent or carrier and cancer cells, and a drug that inhibits the activity or proliferation of CAF And the cancer is treated in two routes by delivering a drug that inhibits the activity or proliferation of cancer cells to cancer cells and a drug that inhibits the activity or proliferation of CAF to CAF, respectively. In this embodiment, the drug that inhibits the activity or proliferation of cancer cells and the drug that inhibits the activity or proliferation of CAF may be the same or different substances.
본 발명의 방법에 있어서, 투여하는 조성물의 구체적인 용량은 치료를 필요로 하는 개체에 관한 다양한 조건, 예를 들면, 증상의 심각한 정도, 개체의 일반 건강상태, 연령, 체중, 개체의 성별, 식사, 투여의 시기 및 빈도, 병용하고 있는 의약, 치료에 대한 반응성 및 치료에 대한 적합성 등을 고려해서 결정될 수 있다.In the methods of the present invention, the specific dose of the composition to be administered will vary depending on a variety of conditions relating to the individual in need of treatment, for example, the severity of the symptoms, the general health status of the individual, the age, weight, The timing and frequency of administration, the medicinal product used, the responsiveness to treatment, and the suitability for treatment.
투여 경로는 경구 및 비경구 모두를 포함하는 다양한 경로, 예를 들면, 경구, 정맥내, 근육내, 피하, 국소, 직장, 동맥내, 문맥내, 심실내, 불경 점막, 경피, 비내, 복강내, 종양내, 폐내 및 자궁내 등의 경로가 포함된다.The route of administration may be by any of a variety of routes including oral and parenteral routes such as oral, intravenous, intramuscular, subcutaneous, topical, rectal, intraarterial, intracorporeal, intrathecal, , Intratumoral, intrapulmonary, and intrauterine routes.
투여 빈도는 이용하는 조성물의 성상 또는 상기와 같은 개체의 조건에 따라서 다르지만, 예를 들면, 1일 수차례(즉, 1일 2, 3, 4회 또는 5회 이상), 1일 1회, 수일(즉, 2, 3, 4, 5, 6, 7 매일 등), 1주일에 수차례(예를 들면, 1주간에 2, 3, 4회 등), 1주일마다, 수 주일마다(즉, 2, 3, 4주마다 등)일 수 있다.The frequency of administration varies depending on the properties of the composition to be used or the condition of the individual as described above. For example, the frequency of administration may be several times per day (i.e., 2, 3, 4 or 5 times or more per day) (Eg, 2, 3, 4, 5, 6, 7 daily, etc.), several times per week (for example, 2, 3 or 4 times per week), every week, , Every three weeks, etc.).
본 발명의 방법에 있어서, 용어 "개체"는 모든 생물의 개체를 의미하고 바람직하게는 동물, 더욱 바람직하게는 포유동물, 가장 바람직하게는 인간의 개체이다. 본 발명의 개체는 정상인이거나 어떠한 질환이 발병하고 있을 수 있지만, 암치료를 실시하는 경우에는 일반적으로 암이 발병하고 있거나 발병 위험을 가지는 개체를 의미한다.In the method of the present invention, the term "individual" means an individual of all organisms and is preferably an animal, more preferably a mammal, most preferably a human individual. An individual of the present invention may be a normal person or may have any disease, but in the case of cancer treatment, generally refers to an individual who has or is at risk of developing cancer.
또한, 용어 "치료"는 질환의 치유, 일시적 완화 또는 예방 등을 목적으로 하는 의학적으로 허용되는 모든 종류의 예방적 및/또는 치료적 개입을 포함하는 것이다. 예를 들면, "치료"의 용어는 암 진행의 지연 또는 정지, 종양의 축소 또는 소실, 암 발병의 예방 또는 재발의 방지 등을 포함하여 다양한 목적에 대해 의학적으로 허용가능한 것들을 포함한다.In addition, the term "treatment" encompasses all types of medically acceptable prophylactic and / or therapeutic interventions for the purpose of curing, palliating or preventing a disease. For example, the term "treatment" includes medically acceptable for a variety of purposes, including delaying or stopping cancer progression, reducing or eliminating tumors, preventing or preventing recurrence of cancer,
또한, 본 발명은 상기 담체를 이용한, 암세포 및/또는 CAF로의 약물전달 방법에 관한 것이다. 이 방법은 한정되지 않고, 예를 들면, 상기 담체에 전달물질을 포함시키는 공정과 전달물질을 포함한 담체를 암세포 및/또는 CAF를 포함한 생물이나 매체, 예를 들면 배양 배지 등에 투여 또는 첨가하는 공정을 포함한다. 이러한 공정은 공지된 모든 방법이나 본 명세서에 기재된 방법 등에 따라서 적절하게 수행할 수 있다. 상기 전달 방법은 또 다른 전달 방법, 예를 들면, 암세포 및/또는 CAF가 존재하는 장기를 표적으로 하는 다른 전달 방법 등과 조합할 수 있다. 또한, 상기 방법은 시험관 내(in vitro)에서 이루어지는 실시태양과 체내의 암세포 및/또는 CAF를 표적으로 하는 실시태양도 포함한다.The present invention also relates to a method for delivering a drug to cancer cells and / or CAF using the carrier. The method is not limited, and includes, for example, a step of adding a carrier substance to the carrier and a step of administering or adding a carrier containing the carrier substance to an organism or medium containing cancer cells and / or CAF, for example, . Such a process can be suitably carried out according to all known methods or methods described herein. The delivery method may be combined with another delivery method, such as, for example, cancer cells and / or other delivery methods targeting organs in which CAF is present. The method also includes embodiments that are performed in vitro, and embodiments that target cancer cells and / or CAF in the body.
도 1은 암조직 유래의 세포를 α-SMA, 비멘틴(vimentin) 및 데스민(desmin) 에 대해 면역염색한 그림이다.Fig. 1 shows immunostaining of cells derived from cancer tissues against? -SMA, vimentin and desmin.
도 2는 CAF 또는 정상 섬유아세포와 암세포를 공배양했을 때의 암세포의 세포수 변화를 나타낸 그래프이다.FIG. 2 is a graph showing cell numbers of cancer cells when co-cultured with CAF or normal fibroblasts and cancer cells.
도 3은 CAF 또는 정상 섬유아세포에 다양한 리포솜에 의한 siRNA를 전달했을 때의 도입율을 경과시간에 따라 나타낸 그래프이다.Fig. 3 is a graph showing the introduction rate when siRNAs are transferred to CAF or normal fibroblasts by various liposomes according to elapsed time. Fig.
도 4는 VA-lip-siRNA 또는 lip-siRNA와 반응시킨 CAF에 있어서 siRNA의 편재를 나타낸 그림이다.Figure 4 is a diagram showing the ubiquitination of siRNA in CAF reacted with VA-lip-siRNA or lip-siRNA.
도 5는 VA-lip-siRNA, lip-siRNA 또는 VA-lip와 반응시킨 CAF 또는 정상 섬유아세포에 있어서 siRNA의 편재를 나타낸 그림이다.FIG. 5 is a diagram showing the omnipresentation of siRNA in CAF or normal fibroblasts reacted with VA-lip-siRNA, lip-siRNA or VA-lip.
도 6은 VA-lip-DNR 또는 lip-DNR과 반응시킨 CAF에 있어서 DNR의 편재를 나타낸 그림이다. 도의 숫자는 반응시작으로부터의 경과시간(분)을 나타낸다. 배율은 200배(확대상은 400배)이다.FIG. 6 is a diagram showing the localization of DNR in CAF reacted with VA-lip-DNR or lip-DNR. The figure shows the elapsed time (minutes) from the start of the reaction. The magnification is 200 times (magnified image is 400 times).
도 7은 VA-lip-DNR 또는 lip-DNR과 반응시킨 정상 섬유아세포에 있어서 DNR의 편재를 나타낸 그림이다. 도의 숫자는 반응시작으로부터의 경과시간(분)을 나타낸다. 배율은 200배이다.FIG. 7 is a diagram showing the localization of DNR in normal fibroblasts reacted with VA-lip-DNR or lip-DNR. The figure shows the elapsed time (minutes) from the start of the reaction. The magnification is 200 times.
도 8은 VA-lip-DNR 또는 lip-DNR과 반응시킨 피부 섬유아세포(skin fibroblast)에 있어서 DNR의 편재를 나타낸 그림이다. 도의 숫자는 반응시작으로부터의 경과시간(분)을 나타낸다. 배율은 200배이다.FIG. 8 is a diagram showing the localization of DNR in skin fibroblast reacted with VA-lip-DNR or lip-DNR. The figure shows the elapsed time (minutes) from the start of the reaction. The magnification is 200 times.
도 9는 VA-lip-DNR(왼쪽) 또는 lip-DNR(오른쪽)과 반응시킨 CAF에 있어서 DNR의 편재를 나타낸 그림이다. 배율은 400배(확대상은 800배)이다.Figure 9 is an illustration of DNR localization in CAF reacted with VA-lip-DNR (left) or lip-DNR (right). Magnification is 400 times (magnification is 800 times).
도 10은 녹색광 하에서 붉은 형광을 나타내는 다우노루비신(왼쪽), UV 광 하에서 청색 형광을 나타내는 DAPI(4', 6-diamino-2-phenylindole)(오른쪽), 및 보라색을 나타내는 병합상(아래)을 나타낸 그림이다.FIG. 10 is a graph showing the results of a fluorescence spectrometry analysis of the fluorescence spectra of daunorubicin (left) showing red fluorescence under green light, DAPI (4 ', 6-diamino-2-phenylindole) (right) showing blue fluorescence under UV light, Fig.
도 11은 무처리(No treatment:왼쪽 위), DaunoXome®(VA-:오른쪽 위), DaunoXome®+레티놀(VA+:왼쪽 아래) 또는 DaunoXome®+레티노인산(Retinoic acid + : 오른쪽 아래)과 반응시킨 CAF에 있어서 DNR의 편재를 나타낸 그림이다. 배율은 400배이다.11 is a non-treated (No treatment: upper left), DaunoXome® (VA-: upper right), DaunoXome® + retinol (VA +: lower left), or DaunoXome® + retinoinsan: in which (Retinoic acid + right) and the reaction CAF In which DNR is dominant. The magnification is 400 times.
도 12는 무처리(No treatment:왼쪽 위), DaunoXome®(VA-:오른쪽 위), DaunoXome®+레티놀(VA+:왼쪽 아래) 또는 DaunoXome®+레티노인산(Retinoic acid +:오른쪽 아래)과 반응시킨 HT-1080에 있어서 DNR의 편재를 나타낸 그림이다. 배율은 400배이다.12 is a non-treated (No treatment: upper left), DaunoXome® (VA-: upper right), DaunoXome® + retinol (VA +: lower left), or DaunoXome® + retinoinsan: HT was (Retinoic acid + right) and the reaction Figure 10 shows the dominance of DNR in -1080. The magnification is 400 times.
도 13은 무처리(No treatment:왼쪽 위), DaunoXome®(VA-:오른쪽 위), DaunoXome®+레티놀(VA+:왼쪽 아래) 또는 DaunoXome®+레티노인산(Retinoic acid +:오른쪽 아래)과 반응시킨 HepG2에 있어서 DNR의 편재를 나타낸 그림이다. 배율은 400배이다.13 is a non-treated (No treatment: upper left), DaunoXome® (VA-: upper right), DaunoXome® + retinol (VA +: lower left), or DaunoXome® + retinoinsan: in which (Retinoic acid + right) and the reaction HepG2 In which DNR is dominant. The magnification is 400 times.
도 14는 CAF 또는 정상 섬유아세포에 대한 VA-lip-siRNA의 증식 저해 활성을 평가한 결과를 나타낸 그래프이다. 세로축은 처리 전의 살아있는 세포수를 100 으로 했을 경우의 처리 후 살아있는 세포수의 비율을 나타낸다.14 is a graph showing the results of evaluating the proliferation inhibitory activity of VA-lip-siRNA against CAF or normal fibroblasts. The vertical axis represents the ratio of the number of living cells after the treatment when the number of living cells before treatment is 100.
도 15는 CAF 또는 정상 섬유아세포에 대한 VA-lip-DNR의 증식 저해 활성을 평가한 그래프이다. 세로축은 처리 전의 살아있는 세포수를 100으로 했을 경우의 처리 후 살아있는 세포수의 비율을 나타낸다.15 is a graph showing evaluation of the inhibitory activity of VA-lip-DNR on CAF or normal fibroblasts. The vertical axis represents the ratio of the number of living cells after the treatment when the number of living cells before treatment is 100.
도 16은 인간 섬유 육종 유래 세포주 HT-1080에 있어서의 리포화 DNR(VA-) 또는 VA 결합 리포화 DNR(VA+)의 세포내 편재를 나타낸 그림이다. 상단은 DNR의 편재, 하단은 DAPI에서 핵 염색한 세포, 숫자는 처리 후의 시간을 나타낸다.16 is a diagram showing intracellular localization of lipidated DNR (VA-) or VA-bound lipidated DNR (VA +) in human fibrosarcoma-derived cell line HT-1080. The upper part is the ubiquitous substance of DNR, the lower part is nuclear stained cells in DAPI, and the number indicates the time after treatment.
도 17은 인간 섬유 육종 유래 세포주 HS913T에 있어서의 리포화 DNR(VA-) 또는 VA 결합 리포화 DNR(VA+)의 세포내 편재를 나타낸 그림이다. 상단은 DNR의 편재, 하단은 DAPI에서 핵 염색한 세포, 숫자는 처리 후의 시간을 나타낸다.17 is a diagram showing intracellular localization of lipidated DNR (VA-) or VA-bound lipidated DNR (VA +) in human fibrosarcoma-derived cell line HS913T. The upper part is the ubiquitous substance of DNR, the lower part is nuclear stained cells in DAPI, and the number indicates the time after treatment.
도 18은 인간 섬유 육종 유래 세포주 Sw684에 있어서 리포화 DNR(VA-) 또는 VA 결합 리포화 DNR(VA+)의 세포내 편재를 나타낸 그림이다. 상단은 DNR의 편재, 하단은 DAPI에서 핵 염색한 세포, 숫자는 처리 후의 시간을 나타낸다.18 is an illustration showing intracellular localization of lipidated DNR (VA-) or VA-bound lipidated DNR (VA +) in human fibrosarcoma-derived cell line Sw684. The upper part is the ubiquitous substance of DNR, the lower part is nuclear stained cells in DAPI, and the number indicates the time after treatment.
도 19는 HT-1080, HS913T, Sw684, Huh7, MCF7 및 Saos2 세포에 있어서 리포화 DNR(VA(-)) 또는 VA 결합 리포화 DNR(VA(+))의 세포내 편재를 나타낸 그림이다(처리 후 15분 뒤). Blank는 리포화 DNR 또는 VA 결합 리포화 DNR의 중 어느 것도 첨가하지 않은 경우의 거울 검사 상이다.19 is a diagram showing intracellular localization of lipidated DNR (VA (-)) or VA-bound lipidated DNR (VA (+)) in HT-1080, HS913T, Sw684, Huh7, MCF7 and Saos2 cells After 15 minutes). Blank is a mirror examination when either lipidated DNR or VA-bound lipidated DNR is not added.
도 20은 인간 섬유 육종 유래 세포주 HT-1080, HS913T 또는 Sw684에 대한 리포화 DNR 또는 VA 결합 리포화 DNR의 증식 억제 활성을 나타낸 그래프이다.20 is a graph showing the proliferation inhibitory activity of lipidated DNR or VA-bound lipid DNR against human fibrosarcoma-derived cell line HT-1080, HS913T or Sw684.
도 21은 VA-lip-siRNA 또는 lip-siRNA를 정맥내 투여한 담암 마우스의 종 양조직에 있어서 siRNA의 편재를 나타낸 그림이다. 우측이 VA-lip-siRNA 투여 개체이고, 좌측이 lip-siRNA 투여 개체이며, 위쪽이 FAM상, 아래쪽이 FAM와 Cy3의 병합상이다. 배율은 200배이다.Fig. 21 is a diagram showing the ubiquitination of siRNA in the tumor tissues of giant arm cancer mice administered intravenously with VA-lip-siRNA or lip-siRNA. The right side is a VA-lip-siRNA administration body, the left side is a lip-siRNA administration body, the upper side is a FAM phase, and the lower side is a fusion phase of FAM and Cy3. The magnification is 200 times.
도 22는 VA-lip-siRNA를 정맥내 투여한 담암 마우스의 종양조직에 있어서 siRNA의 편재를 나타낸 그림이다. 왼쪽 위가 FAM상, 오른쪽 위가 Cy3상, 왼쪽 아래가 FAM과 Cy3의 병합상, 오른쪽 아래가 FAM, Cy3 및 DAPI의 병합상이다. 배율은 200배이다.FIG. 22 is a diagram showing the ubiquitination of siRNA in the tumor tissue of dendritic mouse in which VA-lip-siRNA was intravenously administered. The upper left is the FAM phase, the upper right is the Cy3 phase, the lower left is the merged phase of FAM and Cy3, and the lower right is the merged phase of FAM, Cy3, and DAPI. The magnification is 200 times.
도 23은 VA-lip-DNR(주 2회 투여)의 생체 내(in vivo)에서의 항종양 활성을 평가한 결과를 나타내는 그래프이다. 세로축은 종양 덩어리의 체적(㎜3), 가로축은 처리 시작 후로부터의 날짜를 각각 가리킨다.23 is a graph showing the results of evaluating antitumor activity in vivo of VA-lip-DNR (twice a week administration). The vertical axis indicates the volume of the tumor mass (mm3 ), and the horizontal axis indicates the date from the start of treatment.
본 발명을 이하의 실시예를 통하여 보다 구체적으로 설명하나, 본 발명의 범위는 실시예에 한정되지 않는다.The present invention will be described more specifically with reference to the following examples, but the scope of the present invention is not limited to these examples.
<<실시예Example 1> 1>CAFCAF의 분리Separation of
대장암 환자로부터 분리한 조직 또는 주변 정상 조직(암조직으로부터 2 ㎝이상 떨어진 부위로부터 분리한 정상 조직)을 1×1×1 ㎜로 자른 후, 인산완충식염수(phosphate buffered saline, PBS)에서 2회 원심분리하여 얻은 펠릿(pellet)을 배양액{콜라게나제 type Ⅰ(225 U/㎖), 히아루로니다아제 125 U/㎖), 10% FBS(fetal bovine serum), 스트렙토마이신·페니실린이 첨가된 DMEM(Dulbecco's Modified Eagle Medium)}에서 24시간 배양했다. 배양한 후, 상층액을 제거하고 배양액을 10% FBS/DMEM으로 교체하여 배양을 계속했다. 배양세포를 CAF의 마커인 α-SMA 및 간엽계 세포 마커인 비멘틴(vimentin)에 대해 FITC 표지 항체로 면역염색하여 암조직 유래의 세포에서만 α-SMA가 검출되어 이 세포가 CAF인 것을 확인하였다(도 1 참조). 또한, 비멘틴은 모든 조직에서 유래한 세포에서 양성이었으며, 상피계 세포 마커인 데스민(desmin)은 음성이었다.Tissue isolated from patients with colorectal cancer or peripheral normal tissue (normal tissue isolated from a
<<실시예Example 2> 2>CAFCAF의 종양 증식 활성Tumor growth activity
상기 <실시예 1>로부터 수득한 CAF 또는 정상 섬유아세포를 6 웰 플레이트에 1×105개/웰의 밀도로 각각 분주하고, 10% FBS/DMEM에서 배양하여 3일째에 세포밀도가 높아진 상태에서 배양액을 0.5% FBS/DMEM으로 교체하여, 대장암 세포주인 M7609 세포(2×105개)를 배양액에 분주하여 7일간 함께 배양했다. 0, 3 및 5일째에 M7609 세포의 세포수를 쿨터카운터(coulter counter, 베크만 사)로 측정했다. 그 결과를 도 2에 나타냈다. 이를 통하여, CAF가 암세포의 증식을 촉진한다는 것을 알 수 있었다.CAF or normal fibroblasts obtained from the above <Example 1> were dispensed in a 6-well plate at a density of 1 x 105 cells / well, respectively, and cultured in 10% FBS / DMEM. The culture medium was replaced with 0.5% FBS / DMEM, and M7609 cells (2 × 105 ), a colon cancer cell line, were added to the culture medium and cultured for 7 days together. On
<<실시예Example 3> 3>siRNAsiRNA의 제작Production
인간 HSP47의 래트 호모로그인 gp46(GenBank Accession No. M69246)를 표적으로 하는 3종류의 siRNA 및 대조군의 랜덤 siRNA를 홋카이도 시스템 사이언스에서 구입했다. 각각의 siRNA는 3'측에 돌출부(overhang)를 가지는 27개의 염기로 이루어져있으며, 서열은 하기와 같다.Three types of siRNAs targeting human HSP47 rat homotypic gp46 (GenBank Accession No. M69246) and a control siRNA random siRNA were purchased from Hokkaido System Science. Each siRNA is composed of 27 bases having an overhang on the 3 'side, and the sequence is as follows.
서열 A:5'-GUUCCACCAUAAGAUGGUAGACAACAG-3'(센스, 서열 번호:1)Sequence A: 5'-GUUCCACCAUAAGAUGGUAGACAACAG-3 '(sense, SEQ ID NO: 1)
5'-GUUGUCUACCAUCUUAUGGUGGAACAU-3'(안티센스, 서열 번호:2)5'-GUUGUCUACCAUCUUAUGGUGGAACAU-3 '(antisense, SEQ ID NO: 2)
서열 B:5'-CCACAAGUUUUAUAUCCAAUCUAGCAG-3'(센스, 서열 번호:3)Sequence B: 5'-CCACAAGUUUUAUAUCCAAUCUAGCAG-3 '(sense, SEQ ID NO: 3)
5'-GCUAGAUUGGAUAUAAAACUUGUGGAU-3'(안티센스, 서열 번호:4)5'-GCUAGAUUGGAUAUAAAACUUGUGGAU-3 '(antisense, SEQ ID NO: 4)
서열 C:5'-CUAGAGCCAUUACAUUACAUUGACAAG-3'(센스, 서열 번호:5)Sequence C: 5'-CUAGAGCCAUUACAUUACAUUGACAAG-3 '(sense, SEQ ID NO: 5)
5'-UGUCAAUGUAAUGUAAUGGCUCUAGAU-3'(안티센스, 서열 번호:6)5'-UGUCAAUGUAAUGUAAUGGCUCUAGAU-3 '(antisense, SEQ ID NO: 6)
랜덤 siRNA:5'-CGAUUCGCUAGACCGGCUUCAUUGCAG-3'(센스, 서열 번호:7)Random siRNA: 5'-CGAUUCGCUAGACCGGCUUCAUUGCAG-3 '(sense, SEQ ID NO: 7)
5'-GCAAUGAAGCCGGUCUAGCGAAUCGAU-3'(안티센스, 서열 번호:8)5'-GCAAUGAAGCCGGUCUAGCGAAUCGAU-3 '(antisense, SEQ ID NO: 8)
또한, 형광색소 6'-카르복시플루오레세인(6-FAM)을 5'측에 표지한 siRNA도 제작했다.In addition, siRNA labeled with fluorescent dye 6'-carboxyfluorescein (6-FAM) on the 5 'side was also prepared.
<<실시예Example 4> 4>siRNAsiRNA 함유 containVAVA 결합 리포솜의 제작 Fabrication of binding liposome
리포솜은 DC-6-14, 콜레스테롤 및 DOPE를 4:3:3의 몰비로 포함하는 양이온성 리포솜(Lipotrust, 홋카이도 시스템 사이언스)을 사용했다. 1.5 ㎖ 튜브에서 10 nmol의 리포솜과 20 nmol의 총 트랜스레티놀(이하, "VA"라고 기재함)을 디메틸설폭시드(Dimethyl sulfoxide, DMSO)에 혼합한 후, 클로로포름으로 용해하여 1회 증발시킨 후, PBS에 현탁했다. 그 후, 상기 <실시예 3>에서 수득한 siRNA(10 ㎍/㎖)와 리포솜 현탁액을 1:1(w/w)의 비율로 혼합했다. 수득한 리포솜 현탁액에 포함된 유리의 VA 및 siRNA를 마이크로 파티션 시스템(Sartorion VIVASPIN 5000MWCO PES)으로 제거하여 siRNA 함유 VA 결합 리포솜(VA-lip-siRNA)을 얻었다. 첨가한 VA의 양과 정제 리포솜 내에 결합된 VA의 양을 HPLC법으로 측정하여 리포솜에 결합된 VA의 비율을 확인하였는데, VA의 대부분(95.6±0.42%)이 리포솜에 결합된 것으로 나타났다. 또한, siRNA가 리포솜에 함유된 효율은 리보그린 분석(RiboGreen assay)(분자탐침, Molecular Probes)으로 측정했는데, 94.4±3.0%로 높게 나타났다. 또한, VA의 일부는 리포솜 표면에 노출되어 있었다.Liposomes were cationic liposomes (Lipotrust, Hokkaido System Science) containing DC-6-14, cholesterol and DOPE in a molar ratio of 4: 3: 3. In a 1.5 ml tube, 10 nmol of liposome and 20 nmol of total trans retinol (hereinafter referred to as "VA") were mixed with dimethyl sulfoxide (DMSO), dissolved in chloroform and evaporated once, Suspended in PBS. Thereafter, the siRNA (10 mu g / ml) obtained in Example 3 and the liposome suspension were mixed at a ratio of 1: 1 (w / w). The VA and siRNA of the glass contained in the obtained liposome suspension were removed with a micropartition system (Sartorion VIVASPIN 5000MWCO PES) to obtain siRNA-containing VA-bound liposomes (VA-lip-siRNA). The amount of VA added and the amount of VA bound in the purified liposomes were measured by HPLC to determine the proportion of VA bound to the liposome. The majority of VA (95.6 ± 0.42%) was found to be bound to the liposome. In addition, the efficiency of siRNA in liposomes was measured by RiboGreen assay (molecular probe, Molecular Probes), which was as high as 94.4 ± 3.0%. In addition, part of the VA was exposed on the surface of the liposome.
상기와 같은 방법으로 siRNA 함유 리포솜(lip-siRNA) 및 VA 결합 리포솜(VA-lip)도 제작했다.SiRNA-containing liposomes (lip-siRNA) and VA-bound liposomes (VA-lip) were also prepared as described above.
<<실시예Example 5> 5>VAVA--liplip--siRNAsiRNA의 도입Introduction of
6 웰 플레이트에 CAF 또는 정상 섬유아세포를 각각 5×105개/웰의 밀도로 분주하여 10% FBS/DMEM에서 배양하고, 배양 2일 후, 세포밀도가 높아진 상태에서 무혈청 배지로 1회 세척하고 배지를 혈청 첨가 OPTI-MEM으로 교체했다. 그런 다음, 상기 <실시예 4>에서 사용한 siRNA(최종농도 50 pmol/㎖)를 함유한 리포솜 현탁액을 배지에 첨가하여 37℃에서 24시간 반응시켰다. 또한, VA 결합 리포솜을 첨가하는 경우는 VA의 최종농도가 40 nmol/㎖이 되도록 했다. 또한, siRNA는 6-FAM으로 표지한 랜덤 siRNA를 사용했다. 반응 시작 후 0, 0.5, 1, 3, 6, 12, 18 및 24시간째에, 각 세포주의 siRNA 도입을 플로우사이토메트리(Flow Cytometry)로 평가했다(도 3). 반응 종료 후, 세포를 DAPI(분자탐침, Molecular Probe) 및 Cy3 표지 항α-SMA 항체로 염색하여 siRNA의 편재를 분석했다(도 4 및 도 5).CAF or normal fibroblasts were each seeded at a density of 5 × 105 cells / well in a 6-well plate and cultured in 10% FBS / DMEM. After 2 days of culture, cells were washed once with serum-free medium And the medium was replaced with serum-supplemented OPTI-MEM. Then, the liposome suspension containing the siRNA (
도 3에서 명백히 나타난 바와 같이, VA가 결합된 담체를 이용했을 경우, CAF로의 siRNA의 도입 속도는 정상 섬유아세포에의 도입 속도에 비해 3배 이상이었으며, 24시간이 경과한 시점에서도 CAF로의 도입은 거의 100% 유지되어 특이성 및 도입 효율이 현저히 높아진 것으로 밝혀졌다. 또한, 도 4는 siRNA의 편재를 평가할 수 있는 대표적인 그림을 나타내는 것이고 이것에 따르면, VA 결합 리포솜(VA-lip-siRNA-FAM)을 사용했을 경우, 시야 안에 있는 모든 CAF에 siRNA가 도입된 반면, VA가 결합되지 않은 리포솜(lip-siRNA-FAM)을 이용했을 경우에는 시야 안의 5개의 CAF 중 단 1개에만 siRNA가 도입되었다. 또한, 도 5는 VA가 결합되지 않은 리포솜(lip-siRNA-FAM)에서는 siRNA가 CAF의 세포내에 거의 존재하지 않는 반면, VA 결합 리포솜(VA-lip-siRNA-FAM)에서는 대부분의 siRNA가 세포내에 존재하는 것으로 나타나, siRNA의 CAF내로의 고효율의 도입은 VA 의존성인 것을 알 수 있다. 이상의 결과를 통하여, VA가 결합된 담체가 CAF로의 물질의 도입을 특이적이고 현저하게 촉진하는 것으로 확인되었다.As clearly shown in Fig. 3, when the carrier conjugated with VA was used, the introduction rate of siRNA into CAF was 3 times or more as compared with the rate of introduction into normal fibroblasts, and introduction of CAF into CAF at 24 hours It was found that the specificity and the introduction efficiency were remarkably increased. Figure 4 also shows a representative picture for evaluating the localization of siRNA. According to this, when VA-lip-siRNA-FAM was used, siRNA was introduced into all CAFs in the visual field, When liposomes with unconjugated liposomes (lip-siRNA-FAM) were used, siRNA was introduced into only one of the five CAFs in the visual field. 5 shows that siRNA is almost absent in CAF cells in VA-untreated liposomes (lip-siRNA-FAM), whereas in VA-liposomes (VA-lip-siRNA-FAM) And the introduction of high efficiency into the CAF of the siRNA is VA dependent. From the above results, it was confirmed that the carrier to which VA binds specifically and remarkably promotes the introduction of the substance into CAF.
<<실시예Example 6> 6>VAVA--liplip--DNRDNR의 도입Introduction of
siRNA 대신에 다우노루비신(DNR)을 함유한 VA 결합 리포솜을 이용하여 CAF로 의 도입을 검토했다.The introduction into CAF was examined using VA-bound liposomes containing daunorubicin (DNR) instead of siRNA.
DNR 함유 리포솜(lip-DNR, DaunoXome®, 이하 리포화 DNR이라고도 기재)과 VA를 리포솜:VA = 1:2의 몰비로 DMSO에 혼합한 후, 클로로포름으로 용해하여 1회 증발시킨 후, PBS에 현탁했다. 수득한 리포솜 현탁액에 포함된 유리의 VA를 마이크로 파티션 시스템(Sartorion VIVASPIN 5000MWCO PES)으로 제거하여 DNR 함유 VA 결합 리포솜(VA-lip-DNR, 이하 VA 결합 리포화 DNR이라고도 기재)을 얻었다. 첨가한 VA의 양과 정제 리포솜 내에 포함된 VA 양을 HPLC법으로 측정하여 리포솜에 결합된 VA의 비율을 확인하였는데, VA의 대부분(98%)이 리포솜에 결합되어 있었다. 또한, VA의 일부는 리포솜 표면에 노출되어 있었다. 또한, DaunoXome®은 구연산다우노루비신을 디스테아로일포스파티딜콜린(DSPC)과 콜레스테롤(Chol)로부터 이루어지는 리포솜에 도입한 것으로, DSPC:Chol:구연산다우노루비신의 몰비는 10:5:1이었다.The mixture of DNR-containing liposomes (lip-DNR, DaunoXome® , also referred to as lipid DNR) and VA in DMSO at a molar ratio of liposome: VA = 1: 2 was dissolved in chloroform and evaporated once. did. The VA of the glass contained in the resulting liposome suspension was removed with a micropartitioning system (Sartorion VIVASPIN 5000MWCO PES) to obtain a VA-lipid DNR (VA-lip-DNR, hereinafter also referred to as VA-bound lipid DNR) containing DNR. The amount of added VA and the amount of VA contained in the purified liposome were determined by HPLC method, and the ratio of VA bound to the liposome was confirmed. Most of VA (98%) was bound to the liposome. In addition, part of the VA was exposed on the surface of the liposome. In DaunoXome® , daunorubicin citrate was introduced into liposomes composed of distearoylphosphatidylcholine (DSPC) and cholesterol (Chol). The molar ratio of DSPC: Chol: daunorubicin citrate was 10: 5: 1.
챔버(chamber) 슬라이드에 상기 <실시예 1>로부터 수득한 CAF, 정상 섬유아세포, 또는 시판되는 섬유아세포(skin fibroblast, 세르즈시스템사, 제품 번호 CS-2 FO-101)를 각각 2×104개/챔버의 밀도로 분주하여 10% FBS/DMEM에서 하룻밤 배양한 후, 세포밀도가 높아진 상태에서 무혈청 배지로 1회 세척하고, 배지를 혈청 첨가 OPTI-MEM로 교체했다. 그럼 다음, lip-DNR 또는 상기로부터 얻은 VA-lip-DNR를 DaunoXome®의 농도로서 5 ㎍/㎖을 함유하는 리포솜 현탁액을 배지에 첨가하 여 37℃에서 반응시켰다. 또한, 핵은 DAPI로 염색했다. 반응 시작 전(0분), 반응 시작 5, 15 및 30분 후, 형광 현미경하에서 적색을 나타내는 DNR의 편재를 관찰했다. 그 결과를 도 6 내지 도 9에 나타냈다.Chamber (chamber) above the slide <Example 1> obtained from CAF, normal fibroblasts, or commercial fibroblasts that (skin fibroblast, Cergy Systems Inc., product number CS-2 FO-101) for each 2 × 104 The cells were cultured overnight in 10% FBS / DMEM at a density of dog / chamber, washed once with serum-free medium at high cell density, and replaced with serum-supplemented OPTI-MEM. Then, a liposome suspension containing lip-DNR or VA-lip-DNR obtained above as a concentration of DaunoXome® was added to the medium and reacted at 37 ° C. The nuclei were also stained with DAPI. Before the start of the reaction (0 min), at 5, 15 and 30 minutes after the start of the reaction, the ubiquitination of DNR showing red color under a fluorescence microscope was observed. The results are shown in Fig. 6 to Fig.
VA-lip-DNR를 첨가한 CAF에 대해서는 첨가 후 15분의 시점에서 벌써 세포 내에 DNR의 적색이 확인되었지만, lip-DNR 첨가군에 대한 세포 내에의 DNR의 편재는 확인되지 않았다(도 6 및 도 9). 또한, 정상 섬유아세포(도 7) 및 피부 섬유아세포(skin fibroblast)(도 8)에서는 VA-lip-DNR 첨가군 및 lip-DNR 첨가군도 DNR의 편재는 확인되지 않았다. 이상의 결과는 VA 결합 담체가 CAF 특이적으로 약물전달을 하는 것을 나타낸다.For CAF supplemented with VA-lip-DNR, red color of DNR was already observed in the cells at 15 minutes after the addition, but DNR localization in the cells to the lip-DNR added group was not confirmed (FIGS. 6 and 9). In addition, in the normal fibroblasts (Fig. 7) and the skin fibroblast (Fig. 8), the ubiquitination of DNR was not confirmed in the VA-lip-DNR addition group and the lip-DNR addition group. The above results indicate that the VA-conjugated carrier carries CAF-specific drug delivery.
<<실시예Example 7> 7>VAVA 유도체인 Derivative레티노인산(RA)의Of retinoic acid (RA) 암세포 및 Cancer cells andCAFCAF에 대한For표적화Targeting
<7-1> 세포 배양<7-1> Cell culture
CAF 세포는 인간 암 환자의 임상 검체를 더 복제하여 수립했다. 인간 섬유 육종 세포인 HT-1080(fibrosarcoma) 및 인간 간암 유래 세포인 HepG2 세포는 아메리칸 타입 컬쳐 콜렉션(American Type Culture Collection, ATCC)에서 구입했다. 모든 세포는 10% 소태아혈청(fetal bovine serum, FBS)을 첨가한 DMEM 배지(Sigma Aldrich)에서 배양했다. 이것을 트립신 처리한 후, 4 웰 배양 슬라이드(BD Falcon #354114)에 2×105 세포수/㎖로 분주하여, 37℃, 5% CO2 조건하에서 하룻밤 배양했다.CAF cells further replicated the clinical specimens of human cancer patients. Human fibrosarcoma HT-1080 (fibrosarcoma) and HepG2 cells derived from human liver cancer were purchased from the American Type Culture Collection (ATCC). All cells were cultured in DMEM medium (Sigma Aldrich) supplemented with 10% fetal bovine serum (FBS). This was treated with trypsin, and the cells were then divided into 2 × 105 cells / ml in a 4-well culture slide (BD Falcon # 354114) and cultured overnight at 37 ° C. under 5% CO2 .
<7-2><7-2>VAVA 첨가 리포솜 제제의 제조 Preparation of Additive Liposomal Formulations
모델 약물로서 리포솜에 다우노루비신이 포함된 제제인 DaunoXome®(Gilead Sciences, Inc.)을 이용했다. DaunoXome®에는 약물 다우노루비신이 2 ㎎/㎖의 농도로 포함되어 있다. DaunoXome® 10㎕에 10% FBS 첨가 DMEM를 990 ㎕ 혼합하여 20 ㎕/㎖의 용액을 제조했다. 여기에 100 mM이 되도록 DMSO에 용해한 총 트랜스레티놀(VA) 또는 총 트랜스레티노인산(Retinoic acid, RA)을 7.14 ㎕ 첨가하고 혼합하여, 각각 VA 첨가 리포솜 제제(VA+) 및 RA 첨가 리포솜 제제(retinoic acid+)를 얻었다. 또한, VA 또는 RA의 적어도 어느 한 부위는 리포솜 표면에 노출하고 있었다. 이러한 리포솜 제제 이외에 대조군으로서 VA도 RA도 결합되지 않은 DaunoXome® 용액 제제(VA-)도 제작했다.DaunoXome® (Gilead Sciences, Inc.), a formulation containing daunorubicin in liposomes, was used as a model drug. DaunoXome® contains the drug daunorubicin at a concentration of 2 mg / ml. To 10占 of DaunoXome 占, 990 占 퐇 of DMEM supplemented with 10% FBS was mixed to prepare a 20 占 퐇 / ml solution. 7.14 μl of total trans retinol (VA) or total trans retinoic acid (RA) dissolved in DMSO to 100 mM was added and mixed to obtain VA-added liposomal preparation (VA +) and RA-added liposomal preparation (retinoic acid + . Also, at least one of VA or RA was exposed on the surface of the liposome. In addition to these liposomal preparations, DaunoXome® solution formulations (VA-), which neither bound VA nor RA, were prepared as control.
<7-3><7-3>VAVA 또는 orRARA 리포솜 제제의 투여 Administration of liposomal formulation
배양 슬라이드의 배지를 제거하고 다시 신선한 10% FBS 첨가 DMEM 750 ㎕를 추가했다. 여기에 무처리(No treatment) 배양 슬라이드를 제외하고, 각각 250 ㎕의 VA도 RA도 결합되지 않은 DaunoXome® 용액 제제(VA-), VA 첨가 리포솜 제제(VA+) 또는 RA 첨가 리포솜 제제(retinoic acid+)를 첨가하고 37℃, 5% CO2 조건하에서 15분간 배양했다. 각각의 배양 슬라이드의 배지를 제거하고 1 ㎖의 PBS로 2회 세척한 후, 1 ㎖의 4% 파라포름알데히드 용액(와코우순약)을 첨가해 실온에서 5분간 세포를 고정시켰다. 그리고나서 고정액을 제거하고 PBS로 세포를 3회 세척했다. 그런 다음, 각각의 배양 슬라이드 위의 슬라이드 글라스를 꺼내어 Prolong Gold(Invitrogen)를 떨어뜨린 후 커버 글라스를 덮었다.The medium of the culture slides was removed and 750 μl of DMEM supplemented with fresh 10% FBS was added. Here the non-treatment (No treatment) cultured except slide, are each not also coupling of 250 ㎕ VA RA DaunoXome® solution formulation (VA-), VA added liposomal formulation (VA +) or RA added liposomal formulation (retinoic acid +) for And the cells were incubated at 37 ° C and 5% CO2 for 15 minutes. The culture medium of each culture slide was removed and washed twice with 1 ml of PBS. Then, 1 ml of a 4% paraformaldehyde solution (Wako Pure Chemical) was added and the cells were fixed at room temperature for 5 minutes. The fixative was then removed and the cells were washed 3 times with PBS. Then, the slide glass on each culture slide was taken out, Prolong Gold (Invitrogen) was dropped, and the cover glass was covered.
<7-4> 현미경 관찰<7-4> Microscopic observation
상기 슬라이드 글라스를 형광 현미경(키엔스 BZ8000)으로 관찰했다. 다우노루비신은 세포의 핵에 들어가서 녹색광 하에서 붉은 형광을 발하는 것으로 알려져있다(도 10 왼쪽 위). 또한, 봉입시 사용한 Prolong Gold는 형광 색소 DAPI를 포함하고 있다. DAPI도 세포의 핵에 결합하여 UV광 하에서 청색 형광을 나타낸다(도 10 오른쪽 위). 따라서, 현미경 관찰에서 리포솜 제제의 도입이 일어나면 빨강 및 파랑의 두 형광이 모두 관찰되고 그 결과, 두 사진을 병합하면 보라색을 나타낸다(도 10 아래). 한편, 리포솜 제제가 세포내에 받아들여지지 않는 경우는 DAPI 유래의 청색 형광만 검출된다.The slide glass was observed with a fluorescence microscope (Keynes BZ8000). Daunorubicin is known to enter the nucleus of cells and emit red fluorescence under green light (upper left in FIG. 10). The Prolong Gold used in the encapsulation also contains the fluorescent dye DAPI. DAPI also binds to the nucleus of the cells and shows blue fluorescence under UV light (upper right of FIG. 10). Therefore, when the introduction of the liposome preparation occurs under the microscope observation, both red and blue fluorescence are observed, and as a result, the two photographs are merged to produce a purple color (below the bottom of FIG. 10). On the other hand, when the liposomal preparation is not accepted into cells, only blue fluorescence derived from DAPI is detected.
상기 슬라이드 글라스를 위상차 현미경 및 상기 형광 현미경으로 관찰했다. 상기 슬라이드 글라스를 위상차 현미경의 명시야 하에서 촬영한 이미지, 상기 형광 현미경의 녹색광 하에서 촬영한 이미지 및 UV광 하에서 촬영한 이미지를 전자정보적으로 병합했다(merge). 병합한 화상을 도 11 내지 도 13, 관찰 결과를 표 1 내지 표 3에 나타냈다. 또한, 표에서 +는 형광이 관찰된 것을, -는 형광이 관찰되지 않은 것을 나타낸다.The slide glass was observed with a phase difference microscope and the fluorescence microscope. The image obtained by photographing the slide glass under the light of a phase contrast microscope, the image obtained under the green light of the fluorescence microscope, and the image obtained under UV light were electronically merged. The merged images are shown in Figs. 11 to 13, and the observation results are shown in Tables 1 to 3. In the table, + indicates that fluorescence was observed, and - indicates that no fluorescence was observed.
(청색 형광)DAPI
(Blue fluorescence)
(적색 형광)Daunorubicin
(Red fluorescence)
(청색 형광)DAPI
(Blue fluorescence)
(적색 형광)Daunorubicin
(Red fluorescence)
(청색 형광)DAPI
(Blue fluorescence)
(적색 형광)Daunorubicin
(Red fluorescence)
결과에서 명백히 나타난 것과 같이, DAPI의 청색 형광의 유무에 따라 모든 슬라이드 글라스에서 세포핵의 존재가 확인되었다. 다우노루비신의 적색 형광의 유무에 따라 VA 또는 RA를 이용한 슬라이드 글라스에서는 15분이라는 짧은 배양에도 불구하고 다우노루비신이 세포핵에 존재하였다. 반면에 VA와 RA를 적용하지 않았던 슬라이드 글라스에서는 다우노루비신이 세포핵에 존재하지 않았다. 이것은 레티노이드가 CAF 또는 암세포의 표적화제로서 사용할 수 있음을 나타내고 있다.As evident from the results, the presence of nuclei in all slide glasses was confirmed by the presence or absence of blue fluorescence of DAPI. Depending on the presence or absence of red fluorescence of daunorubicin, daunorubicin was present in the nucleus of a slide glass using VA or RA in spite of a short incubation time of 15 minutes. On the other hand, daunorubicin was not present in the nucleus in the slide glass where VA and RA were not applied. This indicates that the retinoid can be used as a targeting agent for CAF or cancer cells.
<<실시예Example 8> 8>VAVA 결합 리포솜 봉입 약제에 의한 By binding liposome encapsulating agentCAFCAF 특이적인 증식 저해 Specific inhibition of proliferation
gp46에 대한 siRNA 또는 DNR를 포함한 VA 결합 리포솜의 CAF 증식 억제 활성을 알아보았다.The CAP proliferation inhibitory activity of siRNA or DNR-containing VA-binding liposomes against gp46 was examined.
<8-1><8-1>VAVA--liplip--siRNAsiRNA에 의한 증식 억제Inhibition by
siRNA는 상기 <실시예 3>에 기재된 서열 A를 사용했다. 24 웰 디쉬(dish)에 CAF 또는 정상 섬유아세포를 각각 1×104개 분주하고 10% FBS/DMEM에서 24시간 배양한 후, VA-lip-siRNA를 최종농도 50 pmol/㎖로 하여 첨가하고, 1시간 배양한 후, 세포를 세척했다. 10% FBS/DMEM에서 48시간 배양한 후, WST-1법에 따라 살아있는 세포수를 측정했다. 또한, 대조군으로서 lip-siRNA 및 랜덤 siRNA를 포함한 VA 결합 또는 비결합 리포솜{VA-lip-siRNA(ran) 또는 lip-siRNA(ran)}을 이용하였고, 유의차의 평가는 U검정을 이용했다. 그 결과를 도 14에 나타낸다. 이 도에서, VA-lip-siRNA를 첨가한 CAF의 살아있는 세포수는 처리 전의 50% 미만으로 현저하게 감소하고 있는 한편, 그 외의 처리군에서는 살아있는 세포수의 변화가 거의 나타나지 않았다.The siRNA used was the sequence A described in Example 3 above. CAF or normal fibroblasts were each seeded in a 24-well dish at a density of 1 × 104 cells and cultured in 10% FBS / DMEM for 24 hours. VA-lip-siRNA was added at a final concentration of 50 pmol / After incubation for 1 hour, the cells were washed. After 48 hours of culture in 10% FBS / DMEM, the number of living cells was measured according to the WST-1 method. In addition, VA-bound or non-conjugated liposome (VA-lip-siRNA (ran) or lip-siRNA (ran)) containing lip-siRNA and random siRNA was used as a control group. The results are shown in Fig. In this figure, the number of viable cells of CAF supplemented with VA-lip-siRNA was significantly reduced to less than 50% before treatment, while the number of living cells in other treatment groups hardly changed.
<8-2><8-2>VAVA--liplip--DNRDNR에 의한 증식 억제Inhibition by
96 웰 디쉬(dish)에 CAF 또는 정상 섬유아세포를 각각 2×103개 분주하고, 10% FBS/DMEM에서 24시간 배양한 후, 상기 <실시예 6>으로부터 수득한 VA-lip-DNR 또는 lip-DNR를 DaunoXome®의 최종농도를 5 ㎍/㎖로 하여 첨가하고, 15분간 노출시킨 후, 세포를 세척했다. 10% FBS/DMEM에서 24시간 배양한 후, WST-1법에 따라 살아있는 세포수를 측정했다. 유의차의 평가는 U검정을 이용했다. 그 결과를 도 15에 나타낸다. 같은 도에서, VA-lip-DNR를 첨가한 CAF의 살아있는 세포수는 처리 전의 약 40%로 현저하게 감소하고 있는 한편, lip-DNR를 첨가한 CAF 또는 정상 섬유아세포의 살아있는 세포수의 변화는 거의 나타나지 않았다.After the cells were cultured in 10% FBS / DMEM for 24 hours, the cells were cultured in a 96-well dish with 2 × 103 CAF or normal fibroblasts. was added to a final concentration of -DNR DaunoXome® to 5 ㎍ / ㎖, and exposed for 15 minutes, and washed the cells. After 24 hours of culture in 10% FBS / DMEM, the number of viable cells was measured according to the WST-1 method. The significance difference was evaluated using U test. The results are shown in Fig. In the same figure, the number of viable cells of CAF supplemented with VA-lip-DNR was significantly reduced to about 40% before treatment whereas the number of viable cells of CAF or normal fibroblasts supplemented with lip- It did not appear.
이상의 결과는, VA 결합 담체에 담지된 약제가 CAF 특이적인 증식 저해 활성을 가짐을 나타내는 것이다.The above results show that the drug loaded on the VA binding carrier has the CAF-specific proliferation inhibitory activity.
<<실시예Example 9> 9>VAVA--liplip--DNRDNR의 암세포 내 도입 효율의 확인Confirmation of introduction efficiency in cancer cells
인간 섬유 육종 유래 세포주 HT-1080, HS913T 또는 Sw684, 인간 유방암 유래 세포주 MCF7, 인간 골육종 유래 세포주 Saos2(모두 ATCC에서 구입) 또는 사람 간암 유래 세포주 Huh7(JCRB 세포 은행에서 구입)를 챔버(chamber) 슬라이드(Falcon 사)에 1×104개/웰의 세포밀도로 분주하여 하룻밤 배양한 후, 10% FBS가 첨가된 DMEM로 세척했다. 그런 다음, lip-DNR(DaunoXome®) 5 ㎍/㎖(다우노루비신으로서 8.85 μM, 리포솜으로서 89.25 μM) 또는 상기 <실시예 6>으로부터 수득한 VA-lip-DNR 5 ㎍/㎖(레티놀 178.5 μM를 포함)을 첨가하고, 첨가한 15분 후 및/또는 30분 후에 세포를 세척하고 4% 포름알데히드로 고정했다. PBS로 세척한 후, Prolong Gold(Invitrogen 사)로 봉입하여 형광 현미경하에서 DNR의 존재를 관찰했다.Human breast cancer cell line MCF7, human osteosarcoma-derived cell line Saos2 (all purchased from ATCC), or human liver cancer cell line Huh7 (purchased from JCRB cell bank) were placed on a chamber slide Falcon) at a cell density of 1 x 104 cells / well and cultured overnight, followed by washing with DMEM supplemented with 10% FBS. Then, 5 μg / ml of lip-DNR (DaunoXome® ) (8.85 μM as daunorubicin, 89.25 μM as liposome) or 5 μg / ml of VA-lip-DNR obtained from the above Example 6 Was added, and after 15 minutes and / or 30 minutes after the addition, the cells were washed and fixed with 4% formaldehyde. Washed with PBS, sealed with Prolong Gold (Invitrogen), and the presence of DNR was observed under a fluorescence microscope.
도 16 내지 도 18에 나타낸 결과와 같이, VA-lip-DNR 첨가군의 모든 세포에서는 형광 현미경하에서 적색을 나타내는 DNR은 첨가하고 불과 15분 안에 대부분의 세포내에 존재하고 있는 반면에, lip-DNR은 30분이 경과해도 거의 받아들여지지 않았음을 알 수 있다. 이것은 VA 결합에 의해 리포화 DNR의 세포로의 도입이 현저하게 촉진된 것을 나타내는 것이다. 또한, 도 19에 나타낸 결과와 같이, 상기 촉진 효과가 육종 및 암 종양을 포함한 다양한 암세포에서 나타나는 것을 알 수 있었다.As shown in Figs. 16 to 18, in all the cells of the VA-lip-DNR addition group, DNR which shows red color under a fluorescence microscope was added and was present in most of the cells within 15 minutes, whereas lip- It can be seen that it was not accepted even after 30 minutes. This indicates that the introduction of the lipidated DNR into the cells was remarkably promoted by VA binding. In addition, as shown in Fig. 19, it can be seen that the promoting effect appears in various cancer cells including sarcoma and cancerous tumors.
<<실시예Example 10> 10>VAVA 결합 Combination리포화Lipoization다우노루비신의Daunorubicin 항종양 효과의 확인 Identification of antitumor effect
인간 섬유 육종 유래 세포주 HT-1080, HS913T 또는 Sw684를 2×103개/웰의 세포밀도로 96 웰 플레이트에 분주하고 하룻밤 배양한 후, 상기 <실시예 6>으로부터 수득한 lip-DNR 5 ㎍/㎖ 또는 VA-lip-DNR 5 ㎍/㎖를 첨가하고 15분간 배양했다. 그 후, 세포를 세척하여 세포 외의 약제를 제거한 후, 10% FBS가 첨가된 DMEM에서 22시간 배양했다. WST-1 Cell Proliferation Assay Kit(Cayman Chemical사)를 2시간 첨가한 후, 흡광도를 측정하여 무처리시의 세포수에 대한 비율을 계산했다. 도 20에 나타내 결과와 같이, VA의 결합에 의해 리포화 DNR의 항종양 활성이 현저하게 증가하는 것을 알 수 있다.The human fibrosarcoma-derived cell line HT-1080, HS913T or Sw684 was dispensed into a 96-well plate at a cell density of 2 × 103 / well and cultured overnight. Then, the lip-DNR obtained from the above Example 6 Ml or VA-lip-DNR at 5 / / ml was added and incubated for 15 minutes. Subsequently, the cells were washed to remove the extracellular drug, and then cultured in DMEM supplemented with 10% FBS for 22 hours. After adding the WST-1 Cell Proliferation Assay Kit (Cayman Chemical Co.) for 2 hours, the absorbance was measured and the ratio to the number of cells in the untreated was calculated. As shown in Fig. 20, it can be seen that the antitumor activity of the lipidated DNR is remarkably increased by the binding of VA.
<<실시예Example 11> 생체 내( 11> In vivo (ininvivovivo)에 있어서의)CAFCAF 특이적 전달 Specific delivery
누드-스키드(NOD-scid) 마우스(6주령, 암컷, n=8, 삼협 레이버레이토리 서비스에서 구입)에 위암 세포주 KATO-Ⅲ 2×106개를 피하접종하여 담암 마우스를 제작했다. 접종 후 28일째에 상기 <실시예 5>에서 사용한 VA 결합 리포솜(VA-lip-siRNA-FAM) 또는 VA가 결합되지 않은 리포솜(lip-siRNA-FAM)을 VA 200 nmol, lip 100 nmol, siRNA 100 ㎍의 용량으로 꼬리에 정맥 투여했다. 또한, 상기 VA 결합 리포솜은 투여시에 이미 리포솜 표면에 VA의 일부가 노출되어 있었다. 투여하고 24시간 후에 종양 조직을 채취해 조직 표본을 제작하고, 이것을 DAPI(분자탐침, Molecular Probe) 및 Cy3 표지 항α-SMA 항체로 염색하여 siRNA의 존재를 분석했다. 그 결과를 도 21 및 도 22에 나타내었다.2 × 106 gastric cancer cell lines KATO-Ⅲ were subcutaneously inoculated into nude-skid mice (6 weeks old, female, n = 8, purchased from Samchon Labyrinth Service) (VA-lip-siRNA-FAM) or non-VA-conjugated liposome (lip-siRNA-FAM) used in Example 5 on the 28th day after inoculation was incubated with 200 nmol of VA, 100 nmol of lip,
도 21로부터 알 수 있듯이, VA가 결합되지 않은 리포솜에서는 조직 중에 Cy3의 적색이 나타나는 CAF의 존재에도 불구하고, FAM의 녹색이 나타나는 siRNA는 거의 확인되지 않는 반면, VA 결합 리포솜에서는 CAF와 siRNA가 공위치함이 확인되었다.As can be seen from FIG. 21, in the case of the liposomes not bound with VA, the siRNA showing green color of FAM is hardly recognized, despite the presence of CAF in which Cy3 red appears in the tissue, whereas in the VA-bound liposome, The location was confirmed.
<<실시예Example 12> 생체 내( 12> In vivo (ininvivovivo)에 있어서의)VAVA--liplip--DNRDNR의 항종양 활성Antitumor activity
누드 마우스(6주령, 암컷, n=10, 삼협 레이버레이토리 서비스에서 구입)에 대장 암 세포주 M7609세포 2×106개를 피하접종하여 담암 마우스를 제작했다. 접종 후 14일째부터 VA-lip-DNR 또는 lip-DNR를 DaunoXome®의 통상 항암투여량의 1/40의 용량(마우스의 체중 1 g 당 0.05 ㎍)으로 주 2회 꼬리에 정맥 투여했다. 또한, 이 VA-lip-DNR은 투여시에 이미 리포솜 표면에 VA의 일부가 노출되어 있었다. 투여 시작 후의 종양 체적의 변화를 도 23에 나타내었다. 상기 도 23에서 나타낸 바와 같이, VA 결합 담체에 담지된 약제가 종양의 증식을 현저하게 억제하는 것을 알 수 있다.A dumbbell mouse was prepared by subcutaneous inoculation of 2 × 106 colon cancer cell line M7609 cells in nude mice (6 weeks old, female, n = 10, purchased from Samchon Laboratory Laboratories). On day 14 post-inoculation, VA-lip-DNR or lip-DNR was intravenously administered to the tail twice weekly at a dose of 1/40 (0.05 ug / g body weight of mouse) of the usual anti-cancer dose of DaunoXome® . Further, at the time of administration of this VA-lip-DNR, part of the VA was already exposed on the surface of the liposome. The change in tumor volume after the start of administration is shown in Fig. As shown in FIG. 23, it can be seen that the drug loaded on the VA-binding carrier remarkably inhibits the proliferation of the tumor.
이상의 결과는, 본 발명의 조성물이 암의 치료에 대해 지극히 유효한 것임을 나타내는 것이다.The above results indicate that the composition of the present invention is extremely effective for the treatment of cancer.
<110> Nitto Denko Corporation<120> Targeting agent to a cancer cell and a cancer-associated fibroblast<130> 9fpi-08-03<150> PCT/JP2008/056735<151> 2008-03-28<150> JP2007-091808<151> 2007-03-30<150> JP2007-261202<151> 2007-10-04<150> JP2007-324459<151> 2007-12-17<160> 8<170> KopatentIn 1.71<210> 1<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of gp46siRNAseqA<400> 1guuccaccau aagaugguag acaacag 27<210> 2<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of gp46siRNAseqA<400> 2guugucuacc aucuuauggu ggaacau 27<210> 3<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of gp46siRNAseqB<400> 3ccacaaguuu uauauccaau cuagcag 27<210> 4<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of gp46siRNAseqB<400> 4gcuagauugg auauaaaacu uguggau 27<210> 5<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of gp46siRNAseqC<400> 5cuagagccau uacauuacau ugacaag 27<210> 6<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of gp46siRNAseqC<400> 6ugucaaugua auguaauggc ucuagau 27<210> 7<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of random siRNA<400> 7cgauucgcua gaccggcuuc auugcag 27<210> 8<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of random siRNA<400> 8gcaaugaagc cggucuagcg aaucgau 27<110> Nitto Denko Corporation<120> Targeting agents to a cancer cell and a cancer-associated fibroblast<130> 9fpi-08-03<150> PCT / JP2008 / 056735<151> 2008-03-28<150> JP2007-091808<151> 2007-03-30<150> JP2007-261202<151> 2007-10-04<150> JP2007-324459<151> 2007-12-17<160> 8<170> Kopatentin 1.71<210> 1<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of gp46 siRNAseqA<400> 1guuccaccau aagaugguag acaacag 27<210> 2<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of gp46 siRNAseqA<400> 2guugucuacc aucuuauggu ggaacau 27<210> 3<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of gp46siRNAseqB<400> 3ccacaaguuu uauauccaau cuagcag 27<210> 4<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of gp46siRNAseqB<400> 4gcuagauugg auauaaaacu uguggau 27<210> 5<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of gp46siRNAseqC<400> 5cuagagccau uacauuacau ugacaag 27<210> 6<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of gp46siRNAseqC<400> 6ugucaaugua auguaauggc ucuagau 27<210> 7<211> 27<212> RNA<213> Artificial Sequence<220><223> Sense strand of random siRNA<400> 7cgauucgcua gaccggcuuc auugcag 27<210> 8<211> 27<212> RNA<213> Artificial Sequence<220><223> Antisense strand of random siRNA<400> 8gcaaugaagc cggucuagcg aaucgau 27
Claims (19)
Translated fromKoreanApplications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2007-091808 | 2007-03-30 | ||
| JP2007091808 | 2007-03-30 | ||
| JPJP-P-2007-261202 | 2007-10-04 | ||
| JP2007261202 | 2007-10-04 | ||
| JPJP-P-2007-324459 | 2007-12-17 | ||
| JP2007324459 | 2007-12-17 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20090130010A KR20090130010A (en) | 2009-12-17 |
| KR101585947B1true KR101585947B1 (en) | 2016-01-15 |
Family
ID=39808395
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097020305AExpired - Fee RelatedKR101585947B1 (en) | 2007-03-30 | 2008-03-28 | Targeting agents for cancer cells or cancer-associated fibroblasts |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US8686052B2 (en) |
| EP (1) | EP2135600B1 (en) |
| JP (4) | JP5302187B2 (en) |
| KR (1) | KR101585947B1 (en) |
| CN (1) | CN101674810B (en) |
| AR (1) | AR065878A1 (en) |
| AU (1) | AU2008233550B2 (en) |
| CA (1) | CA2682493A1 (en) |
| ES (1) | ES2793673T3 (en) |
| TW (1) | TWI407971B (en) |
| WO (1) | WO2008120815A1 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200063014A (en) | 2018-11-27 | 2020-06-04 | 가톨릭대학교 산학협력단 | Peptides for targeting skin cells and use thereof |
| KR20230072259A (en) | 2021-11-17 | 2023-05-24 | 사회복지법인 삼성생명공익재단 | Pharmaceutical composition for preventing or treating for cancer comprising PRRX1 inhibitor |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7685050B2 (en)* | 2001-12-13 | 2010-03-23 | Bgc Partners, Inc. | Systems and methods for improving the liquidity and distribution network for luxury and other illiquid items |
| US7358223B2 (en)* | 2004-10-04 | 2008-04-15 | Nitto Denko Corporation | Biodegradable cationic polymers |
| US20120269886A1 (en) | 2004-12-22 | 2012-10-25 | Nitto Denko Corporation | Therapeutic agent for pulmonary fibrosis |
| JP2009221164A (en)* | 2008-03-17 | 2009-10-01 | Nitto Denko Corp | Drug for treating pulmonary fibrosis |
| SI2727583T1 (en) | 2004-12-22 | 2022-01-31 | Nitto Denko Corporation | Drug carrier and drug carrier kit for inhibiting fibrosis |
| US9572886B2 (en) | 2005-12-22 | 2017-02-21 | Nitto Denko Corporation | Agent for treating myelofibrosis |
| JP5342834B2 (en)* | 2008-09-05 | 2013-11-13 | 日東電工株式会社 | Treatment agent for myelofibrosis |
| TWI407971B (en) | 2007-03-30 | 2013-09-11 | Nitto Denko Corp | Cancer cells and tumor-related fibroblasts |
| US20080312174A1 (en)* | 2007-06-05 | 2008-12-18 | Nitto Denko Corporation | Water soluble crosslinked polymers |
| AU2008298592A1 (en)* | 2007-09-14 | 2009-03-19 | Nitto Denko Corporation | Drug carriers |
| RU2596495C2 (en)* | 2008-09-12 | 2016-09-10 | Нитто Денко Корпорейшн | Imaging agents for fibrous diseases |
| RU2711531C2 (en)* | 2010-06-17 | 2020-01-17 | Нитто Денко Корпорейшн | Agent for treating renal fibrosis |
| JP5950428B2 (en) | 2010-08-05 | 2016-07-13 | 日東電工株式会社 | Composition for regenerating normal tissue from fibrotic tissue |
| AU2011329066B2 (en)* | 2010-11-15 | 2017-03-09 | The Ohio State University Research Foundation | Controlled release mucoadhesive systems |
| RU2639459C2 (en) | 2011-06-21 | 2017-12-21 | Нитто Денко Корпорейшн | Apoptosis-inducing means |
| AU2012337691B2 (en)* | 2011-11-18 | 2017-10-12 | Nitto Denko Corporation | Intestinal fibrosis treatment agent |
| JP6340162B2 (en) | 2012-12-20 | 2018-06-06 | 日東電工株式会社 | Apoptosis inducer |
| JP6076076B2 (en) | 2012-12-21 | 2017-02-08 | 日東電工株式会社 | Tissue regeneration promoter |
| BR112015026298A8 (en)* | 2013-04-19 | 2019-12-24 | Univ Saskatchewan | dispensing vehicle for dispensing an aromatase inhibitor |
| US10471267B2 (en) | 2013-05-06 | 2019-11-12 | Medtronic, Inc. | Implantable cardioverter-defibrillator (ICD) system including substernal lead |
| US10532203B2 (en) | 2013-05-06 | 2020-01-14 | Medtronic, Inc. | Substernal electrical stimulation system |
| US10556117B2 (en) | 2013-05-06 | 2020-02-11 | Medtronic, Inc. | Implantable cardioverter-defibrillator (ICD) system including substernal pacing lead |
| CN104374918B (en)* | 2013-08-17 | 2016-11-09 | 复旦大学 | Heat shock protein 47 glioma-associated tumor antigen and its application |
| US20170173005A1 (en) | 2014-03-27 | 2017-06-22 | Research Foundation Of The City University Of New York | Method for detecting or treating triple negative breast cancer |
| US9976142B2 (en) | 2014-04-02 | 2018-05-22 | Nitto Denko Corporation | Targeting molecule and a use thereof |
| WO2015155810A1 (en) | 2014-04-07 | 2015-10-15 | Nitto Denko Corporation | Novel polymer-based hydrotropes for hydrophobic drug delivery |
| CN106573062B (en) | 2014-06-17 | 2020-08-25 | 日东电工株式会社 | apoptosis inducer |
| US10792299B2 (en) | 2014-12-26 | 2020-10-06 | Nitto Denko Corporation | Methods and compositions for treating malignant tumors associated with kras mutation |
| US10264976B2 (en) | 2014-12-26 | 2019-04-23 | The University Of Akron | Biocompatible flavonoid compounds for organelle and cell imaging |
| US20180002702A1 (en) | 2014-12-26 | 2018-01-04 | Nitto Denko Corporation | Methods and compositions for treating malignant tumors associated with kras mutation |
| US11045488B2 (en) | 2014-12-26 | 2021-06-29 | Nitto Denko Corporation | RNA interference agents for GST-π gene modulation |
| CN104825394B (en)* | 2015-04-17 | 2018-08-17 | 北京大学 | The liposome drug-loading system of target tumor associated fibroblast cell |
| WO2017062990A1 (en)* | 2015-10-09 | 2017-04-13 | Case Western Reserve University | Compositions and methods for the delivery of nucleic acids |
| US10358647B2 (en) | 2015-12-13 | 2019-07-23 | Nitto Denko Corporation | siRNA structures for high activity and reduced off target |
| CA3056797A1 (en) | 2017-03-16 | 2018-09-20 | Children's Medical Center Corporation | Engineered liposomes as cancer-targeted therapeutics |
| CN112739382A (en)* | 2018-08-22 | 2021-04-30 | 日东电工株式会社 | Enhanced sensitivity to chemotherapeutic agents using HSP47 inhibitory substances |
| RU2733230C1 (en)* | 2019-12-16 | 2020-09-30 | Федеральное государственное бюджетное учреждение "Национальный медицинский исследовательский центр онкологии имени Н.Н. Петрова" Министерства здравоохранения Российской Федерации | Human bladder cancer cell line 198 blcan rla |
| RU2742245C1 (en)* | 2020-05-20 | 2021-02-04 | Федеральное государственное бюджетное учреждение "Национальный медицинский исследовательский центр онкологии имени Н.Н. Петрова" Министерства здравоохранения Российской Федерации | Human bladder cancer cell line 398 blcan kae |
| RU2742244C1 (en)* | 2020-05-20 | 2021-02-04 | Федеральное государственное бюджетное учреждение "Национальный медицинский исследовательский центр онкологии имени Н.Н. Петрова" Министерства здравоохранения Российской Федерации | Human bladder cancer cell line 587 blcan tvv |
| EP4173639A4 (en)* | 2020-06-26 | 2024-03-13 | RaQualia Pharma Inc. | METHOD FOR SELECTING A CANCER PATIENT FOR WHICH COMBINATION THERAPY OF A RETINOID AND A CANCER TREATMENT AGENT WILL BE EFFECTIVE, AND COMBINATION DRUG OF A RETINOID AND A CANCER TREATMENT AGENT |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006068232A1 (en) | 2004-12-22 | 2006-06-29 | Sapporo Medical University | Drug carrier and drug carrier kit for inhibiting fibrosis |
Family Cites Families (141)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4665913A (en)* | 1983-11-17 | 1987-05-19 | Lri L.P. | Method for ophthalmological surgery |
| US4669466A (en)* | 1985-01-16 | 1987-06-02 | Lri L.P. | Method and apparatus for analysis and correction of abnormal refractive errors of the eye |
| US4911928A (en) | 1987-03-13 | 1990-03-27 | Micro-Pak, Inc. | Paucilamellar lipid vesicles |
| US5811119A (en)* | 1987-05-19 | 1998-09-22 | Board Of Regents, The University Of Texas | Formulation and use of carotenoids in treatment of cancer |
| US5585112A (en)* | 1989-12-22 | 1996-12-17 | Imarx Pharmaceutical Corp. | Method of preparing gas and gaseous precursor-filled microspheres |
| US5733572A (en)* | 1989-12-22 | 1998-03-31 | Imarx Pharmaceutical Corp. | Gas and gaseous precursor filled microspheres as topical and subcutaneous delivery vehicles |
| US6610841B1 (en) | 1997-12-18 | 2003-08-26 | Gilead Sciences, Inc. | Nucleotide-based prodrugs |
| US5258791A (en)* | 1990-07-24 | 1993-11-02 | General Electric Company | Spatially resolved objective autorefractometer |
| US5668117A (en) | 1991-02-22 | 1997-09-16 | Shapiro; Howard K. | Methods of treating neurological diseases and etiologically related symptomology using carbonyl trapping agents in combination with previously known medicaments |
| US6746678B1 (en) | 1991-02-22 | 2004-06-08 | Howard K. Shapiro | Method of treating neurological diseases and etiologically related symptomology using carbonyl trapping agents in combination with medicaments |
| US5144630A (en)* | 1991-07-29 | 1992-09-01 | Jtt International, Inc. | Multiwavelength solid state laser using frequency conversion techniques |
| CA2073802C (en)* | 1991-08-16 | 2003-04-01 | John Shimmick | Method and apparatus for combined cylindrical and spherical eye corrections |
| US5472954A (en) | 1992-07-14 | 1995-12-05 | Cyclops H.F. | Cyclodextrin complexation |
| DE4232915A1 (en)* | 1992-10-01 | 1994-04-07 | Hohla Kristian | Device for shaping the cornea by removing tissue |
| US5583020A (en)* | 1992-11-24 | 1996-12-10 | Ribozyme Pharmaceuticals, Inc. | Permeability enhancers for negatively charged polynucleotides |
| US5520679A (en)* | 1992-12-03 | 1996-05-28 | Lasersight, Inc. | Ophthalmic surgery method using non-contact scanning laser |
| US5753261A (en)* | 1993-02-12 | 1998-05-19 | Access Pharmaceuticals, Inc. | Lipid-coated condensed-phase microparticle composition |
| US5820879A (en)* | 1993-02-12 | 1998-10-13 | Access Pharmaceuticals, Inc. | Method of delivering a lipid-coated condensed-phase microparticle composition |
| US5785976A (en)* | 1993-03-05 | 1998-07-28 | Pharmacia & Upjohn Ab | Solid lipid particles, particles of bioactive agents and methods for the manufacture and use thereof |
| US5460627A (en)* | 1993-05-03 | 1995-10-24 | O'donnell, Jr.; Francis E. | Method of evaluating a laser used in ophthalmological surgery |
| CO4230054A1 (en)* | 1993-05-07 | 1995-10-19 | Visx Inc | METHOD AND SYSTEMS FOR LASER TREATMENT OF REFRACTIVE ERRORS USING TRAVELING IMAGES FORMATION |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| US5942230A (en)* | 1994-05-06 | 1999-08-24 | The United States Of America As Represented By The Department Of Health And Human Services | Composition of immunotoxins and retinoids and use thereof |
| JPH08180824A (en)* | 1994-12-22 | 1996-07-12 | Hitachi Ltd | Electron beam source, manufacturing method thereof, electron beam source device, and electron beam device using the same |
| US5646791A (en)* | 1995-01-04 | 1997-07-08 | Visx Incorporated | Method and apparatus for temporal and spatial beam integration |
| US5534261A (en)* | 1995-01-17 | 1996-07-09 | University Of Southern California | Retinoid-based compositions and method for preventing adhesion formation using the same |
| US6187315B1 (en) | 1995-03-03 | 2001-02-13 | Atajje, Inc. | Compositions and methods of treating cancer with tannin complexes |
| US5666117A (en)* | 1995-08-31 | 1997-09-09 | The United State Of American As Represented By The Secretary Of The Navy | Non-Return to Zero Level to Bi-Phase signal converter |
| US6120794A (en) | 1995-09-26 | 2000-09-19 | University Of Pittsburgh | Emulsion and micellar formulations for the delivery of biologically active substances to cells |
| US5782822A (en)* | 1995-10-27 | 1998-07-21 | Ir Vision, Inc. | Method and apparatus for removing corneal tissue with infrared laser radiation |
| CA2250295C (en) | 1996-03-12 | 2008-12-30 | Pg-Txl Company L.P. | Water soluble paclitaxel prodrugs |
| US6441025B2 (en) | 1996-03-12 | 2002-08-27 | Pg-Txl Company, L.P. | Water soluble paclitaxel derivatives |
| US6238917B1 (en) | 1996-04-02 | 2001-05-29 | Commonwealth Scientific Industrial Research Organizaion | Asymmetric hammerhead ribozymes |
| US5742626A (en)* | 1996-08-14 | 1998-04-21 | Aculight Corporation | Ultraviolet solid state laser, method of using same and laser surgery apparatus |
| US6056973A (en) | 1996-10-11 | 2000-05-02 | Sequus Pharmaceuticals, Inc. | Therapeutic liposome composition and method of preparation |
| US6331289B1 (en) | 1996-10-28 | 2001-12-18 | Nycomed Imaging As | Targeted diagnostic/therapeutic agents having more than one different vectors |
| US6271914B1 (en)* | 1996-11-25 | 2001-08-07 | Autonomous Technologies Corporation | Objective measurement and correction of optical systems using wavefront analysis |
| US20010041884A1 (en)* | 1996-11-25 | 2001-11-15 | Frey Rudolph W. | Method for determining and correcting vision |
| US5777719A (en)* | 1996-12-23 | 1998-07-07 | University Of Rochester | Method and apparatus for improving vision and the resolution of retinal images |
| US6090102A (en)* | 1997-05-12 | 2000-07-18 | Irvision, Inc. | Short pulse mid-infrared laser source for surgery |
| FR2763853B1 (en) | 1997-05-28 | 2000-01-07 | Oreal | ASSOCIATION OF A RETINOIDE WITH A POLYAMINE POLYMER |
| AU707186B2 (en) | 1997-07-01 | 1999-07-01 | Transgene S.A. | Compositions useful for transferring therapeutically active substances into a target cell, and their use in gene therapy |
| US6037481A (en)* | 1997-08-08 | 2000-03-14 | Industria E Comercio De Cosmeticos Natura Ltda | Process for stabilizing levogyre ascorbic acid (LAA), a stable aqueous LAA composition, a process for preparing a stable topical solution, an emulsion, a vitamin product, and a method for cosmetic, pharmaceutical or nutritional treatment |
| US6072101A (en)* | 1997-11-19 | 2000-06-06 | Amcol International Corporation | Multicomponent superabsorbent gel particles |
| CA2329147A1 (en) | 1998-05-20 | 1999-11-25 | Feng Liu | A hepatocyte targeting polyethylene glyco-grafted poly-l-lysine polymeric gene carrier |
| US6099125A (en)* | 1998-12-07 | 2000-08-08 | Schepens Eye Research Foundation | Coaxial spatially resolved refractometer |
| US6000800A (en)* | 1998-06-22 | 1999-12-14 | Schepens Eye Research Institute | Coaxial spatially resolved refractometer |
| US6004313A (en)* | 1998-06-26 | 1999-12-21 | Visx, Inc. | Patient fixation system and method for laser eye surgery |
| GB9814527D0 (en) | 1998-07-03 | 1998-09-02 | Cyclacel Ltd | Delivery system |
| US6347549B1 (en)* | 1998-07-09 | 2002-02-19 | Ryan International Corporation | Enhancement of storm location from a single moving platform |
| EP1117720A4 (en) | 1998-07-13 | 2001-11-14 | Expression Genetics Inc | Polyester analogue of poly-l-lysine as a soluble, biodegradable gene delivery carrier |
| CA2338457C (en) | 1998-07-24 | 2009-11-17 | Seo Hong Yoo | Preparation of aqueous clear solution dosage forms with bile acids |
| KR100274842B1 (en) | 1998-10-01 | 2001-03-02 | 김효근 | Sustained-release Drug Release System of Retinoic Acid Using Microspheres |
| US7223724B1 (en) | 1999-02-08 | 2007-05-29 | Human Genome Sciences, Inc. | Use of vascular endothelial growth factor to treat photoreceptor cells |
| US6248363B1 (en) | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| FR2790405B1 (en) | 1999-03-02 | 2001-04-20 | Oreal | NANOCAPSULES BASED ON DENDRITIC POLYMERS |
| US6245059B1 (en)* | 1999-04-07 | 2001-06-12 | Visx, Incorporated | Offset ablation profiles for treatment of irregular astigmation |
| US6328988B1 (en) | 1999-04-23 | 2001-12-11 | Rutgers, The State University Of New Jersey | Hyperbranched polymeric micelles for encapsulation and delivery of hydrophobic molecules |
| HK1045700B (en) | 1999-04-28 | 2007-07-27 | 德克萨斯大学董事会 | Compositions an methods for cancer treatment by selectively inhibiting vegf |
| US7276348B2 (en) | 1999-04-30 | 2007-10-02 | Regents Of The University Of Michigan | Compositions and methods relating to F1F0-ATPase inhibitors and targets thereof |
| US6395300B1 (en) | 1999-05-27 | 2002-05-28 | Acusphere, Inc. | Porous drug matrices and methods of manufacture thereof |
| US6050687A (en)* | 1999-06-11 | 2000-04-18 | 20/10 Perfect Vision Optische Geraete Gmbh | Method and apparatus for measurement of the refractive properties of the human eye |
| US7098030B2 (en) | 1999-12-31 | 2006-08-29 | Mirus Bio Corporation | Polyampholytes for delivering polyions to a cell |
| US20020041898A1 (en) | 2000-01-05 | 2002-04-11 | Unger Evan C. | Novel targeted delivery systems for bioactive agents |
| US6234631B1 (en)* | 2000-03-09 | 2001-05-22 | Lasersight Technologies, Inc. | Combination advanced corneal topography/wave front aberration measurement |
| DE10012151A1 (en) | 2000-03-13 | 2001-09-27 | Gsf Forschungszentrum Umwelt | Aerosol inhalant containing vitamin A compound in liposomes based on phosphatidylcholine, useful for treatment of tracheo-bronchial illnesses, especially chronic obstructive pulmonary disease |
| KR20010100194A (en) | 2000-03-13 | 2001-11-14 | 박호군 | Composition and formulation for solubilization of various compounds and preparation method thereof |
| US6673062B2 (en)* | 2000-03-14 | 2004-01-06 | Visx, Inc. | Generating scanning spot locations for laser eye surgery |
| AU2001247924A1 (en) | 2000-03-29 | 2001-10-08 | Aradigm Corporation | Cationic liposomes |
| EP1210002B1 (en)* | 2000-04-19 | 2007-12-12 | Alcon RefractiveHorizons, Inc. | Eye registration control method |
| US6338559B1 (en)* | 2000-04-28 | 2002-01-15 | University Of Rochester | Apparatus and method for improving vision and retinal imaging |
| US6603012B2 (en) | 2000-05-02 | 2003-08-05 | Hoffmann-La Roche Inc. | RAR selective retinoid agonists |
| US6896890B2 (en) | 2000-05-05 | 2005-05-24 | R.P. Scherer Technologies, Inc. | Oil-in-water emulsion formulation containing free and entrapped hydroquinone and retinol |
| US6460997B1 (en)* | 2000-05-08 | 2002-10-08 | Alcon Universal Ltd. | Apparatus and method for objective measurements of optical systems using wavefront analysis |
| US6471968B1 (en) | 2000-05-12 | 2002-10-29 | Regents Of The University Of Michigan | Multifunctional nanodevice platform |
| KR20080068147A (en)* | 2000-08-29 | 2008-07-22 | 제넨테크, 인크. | How to increase the efficacy of cancer treatment |
| US6696038B1 (en) | 2000-09-14 | 2004-02-24 | Expression Genetics, Inc. | Cationic lipopolymer as biocompatible gene delivery agent |
| US20040142474A1 (en) | 2000-09-14 | 2004-07-22 | Expression Genetics, Inc. | Novel cationic lipopolymer as a biocompatible gene delivery agent |
| US7276249B2 (en) | 2002-05-24 | 2007-10-02 | Elan Pharma International, Ltd. | Nanoparticulate fibrate formulations |
| WO2002028387A1 (en)* | 2000-10-03 | 2002-04-11 | Oncopharmaceutical, Inc. | Inhibitors of angiogenesis and tumor growth for local and systemic administration |
| US7427394B2 (en) | 2000-10-10 | 2008-09-23 | Massachusetts Institute Of Technology | Biodegradable poly(β-amino esters) and uses thereof |
| US6998115B2 (en) | 2000-10-10 | 2006-02-14 | Massachusetts Institute Of Technology | Biodegradable poly(β-amino esters) and uses thereof |
| WO2002032413A2 (en)* | 2000-10-17 | 2002-04-25 | Board Of Regents, The University Of Texas System | A method to incorporate n-(4-hydroxyphenyl) retinamide in liposomes |
| US7265186B2 (en) | 2001-01-19 | 2007-09-04 | Nektar Therapeutics Al, Corporation | Multi-arm block copolymers as drug delivery vehicles |
| TWI246524B (en) | 2001-01-19 | 2006-01-01 | Shearwater Corp | Multi-arm block copolymers as drug delivery vehicles |
| WO2002066646A2 (en) | 2001-02-16 | 2002-08-29 | Incyte Genomics, Inc. | Neurotransmission-associated proteins |
| US6652886B2 (en) | 2001-02-16 | 2003-11-25 | Expression Genetics | Biodegradable cationic copolymers of poly (alkylenimine) and poly (ethylene glycol) for the delivery of bioactive agents |
| EP1243276A1 (en) | 2001-03-23 | 2002-09-25 | Franciscus Marinus Hendrikus De Groot | Elongated and multiple spacers containing activatible prodrugs |
| EP1392366A4 (en) | 2001-04-13 | 2005-01-19 | Population Council Inc | INTRODUCTION EFFECTED THROUGH A NUCLEAR RECEPTOR OF A PNA PROTEIN IN CELL NUCLES |
| US6472954B1 (en)* | 2001-04-23 | 2002-10-29 | Agilent Technologies, Inc. | Controlled effective coupling coefficients for film bulk acoustic resonators |
| US6609794B2 (en)* | 2001-06-05 | 2003-08-26 | Adaptive Optics Associates, Inc. | Method of treating the human eye with a wavefront sensor-based ophthalmic instrument |
| JP4547696B2 (en) | 2001-06-07 | 2010-09-22 | 第一三共株式会社 | Cirrhosis prevention / treatment agent |
| KR20040029359A (en) | 2001-07-12 | 2004-04-06 | 루트거스, 더 스테이트 유니버시티 오브 뉴 저지 | Amphiphilic Star-Like Macromolecules for Drug Delivery |
| US6586524B2 (en) | 2001-07-19 | 2003-07-01 | Expression Genetics, Inc. | Cellular targeting poly(ethylene glycol)-grafted polymeric gene carrier |
| US7101995B2 (en) | 2001-08-27 | 2006-09-05 | Mirus Bio Corporation | Compositions and processes using siRNA, amphipathic compounds and polycations |
| DE60222160T2 (en) | 2001-10-12 | 2008-06-12 | Elan Pharma International Ltd., Athlone | COMPOSITIONS COMPRISING PROPERTIES OF IMMEDIATE RELEASE AND CONTROLLED RELEASE |
| US7297515B1 (en) | 2001-10-26 | 2007-11-20 | Myriad Genetics, Inc. | Zinc finger proteins |
| ES2284959T3 (en) | 2001-10-30 | 2007-11-16 | Nektar Therapeutics Al, Corporation | SOLUBLE POLYMERIC CONJUGATES IN RETINOIC ACID WATER. |
| JP3803318B2 (en) | 2001-11-21 | 2006-08-02 | 株式会社RNAi | Gene expression inhibition method |
| EP1445312B1 (en) | 2001-11-21 | 2012-12-26 | Astellas Pharma Inc. | Method of inhibiting gene expression |
| US7060498B1 (en) | 2001-11-28 | 2006-06-13 | Genta Salus Llc | Polycationic water soluble copolymer and method for transferring polyanionic macromolecules across biological barriers |
| US6637884B2 (en)* | 2001-12-14 | 2003-10-28 | Bausch & Lomb Incorporated | Aberrometer calibration |
| US20030147958A1 (en) | 2002-01-29 | 2003-08-07 | Cheol-Hee Ahn | Biodegradable multi-block copolymers of poly(amino acid)s and poly(ethylene glycol) for the delivery of bioactive agents |
| MXPA04007576A (en)* | 2002-02-11 | 2004-11-10 | Visx Inc | Closed loop system and method for ablating lenses with aberrations. |
| US20040106125A1 (en) | 2002-02-15 | 2004-06-03 | Duggan Brendan M | Neurotransmission-associated proteins |
| US7018655B2 (en) | 2002-03-18 | 2006-03-28 | Labopharm, Inc. | Amphiphilic diblock, triblock and star-block copolymers and their pharmaceutical compositions |
| US6740676B2 (en) | 2002-03-19 | 2004-05-25 | Allergan, Inc. | 4-[(8-ethynyl, 8-vinyl or 8-ethynyl-methyl)-6-chromanoyl]-benzoic and 2-[4-[(8-ethynyl, 8-vinyl or 8-ethynyl-methyl)-6-chromanoyl]-phenyl]-acetic acid, their esters and salts having cytochrome p450rai inhibitory activity |
| US7101576B2 (en) | 2002-04-12 | 2006-09-05 | Elan Pharma International Limited | Nanoparticulate megestrol formulations |
| US20030215395A1 (en) | 2002-05-14 | 2003-11-20 | Lei Yu | Controllably degradable polymeric biomolecule or drug carrier and method of synthesizing said carrier |
| EP2060272A3 (en)* | 2002-05-15 | 2009-05-27 | Endocyte, Inc. | Vitamin-mitomycin conjugates |
| JP4488512B2 (en) | 2002-06-19 | 2010-06-23 | レイベン バイオテクノロジーズ,インコーポレイティド | Novel RAAG10 cell surface target and antibody family that recognizes the target |
| WO2004013307A2 (en) | 2002-08-05 | 2004-02-12 | Mirus Corporation | Compounds for targeting hepatocytes |
| JP2004083436A (en) | 2002-08-23 | 2004-03-18 | Minofuaagen Seiyaku:Kk | Stellate cell activation inhibitor, and preventive or therapeutic agent for organ fibrosis |
| CA2496547A1 (en) | 2002-08-29 | 2004-03-11 | University Of Southampton | Use of apoptosis inducing agents in the preparation of a medicament for the treatment of liver diseases |
| US6740336B2 (en) | 2002-10-04 | 2004-05-25 | Mirus Corporation | Process for generating multilayered particles |
| CA2505633A1 (en) | 2002-11-13 | 2004-05-27 | Raven Biotechnologies, Inc. | Antigen pipa and antibodies that bind thereto |
| EP1581583B1 (en) | 2002-12-30 | 2010-03-24 | Nektar Therapeutics | Multi-arm polypeptide-poly(ethylene glycol) block copolymers as drug delivery vehicles |
| US20040138154A1 (en) | 2003-01-13 | 2004-07-15 | Lei Yu | Solid surface for biomolecule delivery and high-throughput assay |
| WO2004090108A2 (en) | 2003-04-03 | 2004-10-21 | Alnylam Pharmaceuticals | Irna conjugates |
| US20050002999A1 (en)* | 2003-06-04 | 2005-01-06 | Rahul Mehta | Long-circulating liposomal compositions |
| EP1663171B9 (en) | 2003-08-26 | 2009-08-19 | SmithKline Beecham Corporation | Heterofunctional copolymers of glycerol and polyethylene glycol, their conjugates and compositions |
| WO2005028498A2 (en) | 2003-09-18 | 2005-03-31 | Raven Biotechnologies, Inc. | Kid3 and kid3 antibodies that bind thereto |
| US7064127B2 (en) | 2003-12-19 | 2006-06-20 | Mount Sinai School Of Medicine Of New York University | Treatment of hepatic fibrosis with imatinib mesylate |
| CA2549966A1 (en)* | 2003-12-24 | 2005-07-07 | Ltt Bio-Pharma Co., Ltd. | Drug-containing nanoparticle, process for producing the same and parenterally administered preparation from the nanoparticle |
| WO2006085987A2 (en) | 2004-07-09 | 2006-08-17 | University Of Iowa Research Foundation | Rna interference in respiratory epitheial cells |
| US7358223B2 (en) | 2004-10-04 | 2008-04-15 | Nitto Denko Corporation | Biodegradable cationic polymers |
| US8057821B2 (en) | 2004-11-03 | 2011-11-15 | Egen, Inc. | Biodegradable cross-linked cationic multi-block copolymers for gene delivery and methods of making thereof |
| DE602005012155D1 (en) | 2004-11-03 | 2009-02-12 | Liplasome Pharma As | LIPID BASED DRUG DISPOSAL SYSTEMS USING UNSATURATIVE PHOSPHOLIPASE-A2 ABBAUBARANT LIPID DERIVATIVES AND THEIR THERAPEUTIC USE |
| US7964571B2 (en) | 2004-12-09 | 2011-06-21 | Egen, Inc. | Combination of immuno gene therapy and chemotherapy for treatment of cancer and hyperproliferative diseases |
| JP2009221164A (en) | 2008-03-17 | 2009-10-01 | Nitto Denko Corp | Drug for treating pulmonary fibrosis |
| JP4533420B2 (en) | 2004-12-22 | 2010-09-01 | 日東電工株式会社 | Drug carrier and drug carrier kit for suppressing fibrosis |
| US20120269886A1 (en) | 2004-12-22 | 2012-10-25 | Nitto Denko Corporation | Therapeutic agent for pulmonary fibrosis |
| US7404969B2 (en) | 2005-02-14 | 2008-07-29 | Sirna Therapeutics, Inc. | Lipid nanoparticle based compositions and methods for the delivery of biologically active molecules |
| WO2007028154A2 (en)* | 2005-09-02 | 2007-03-08 | Northwestern University | Encapsulated arsenic drugs |
| JP5342834B2 (en) | 2008-09-05 | 2013-11-13 | 日東電工株式会社 | Treatment agent for myelofibrosis |
| US7700541B2 (en) | 2006-04-06 | 2010-04-20 | Nitto Denko Corporation | Biodegradable cationic polymers |
| US8808681B2 (en) | 2006-06-05 | 2014-08-19 | Massachusetts Institute Of Technology | Crosslinked, degradable polymers and uses thereof |
| TWI407971B (en)* | 2007-03-30 | 2013-09-11 | Nitto Denko Corp | Cancer cells and tumor-related fibroblasts |
| US20080312174A1 (en) | 2007-06-05 | 2008-12-18 | Nitto Denko Corporation | Water soluble crosslinked polymers |
| AU2008298592A1 (en) | 2007-09-14 | 2009-03-19 | Nitto Denko Corporation | Drug carriers |
| JP2011529492A (en) | 2008-07-30 | 2011-12-08 | 日東電工株式会社 | Drug carrier |
- 2008
- 2008-03-27TWTW097111089Apatent/TWI407971B/ennot_activeIP Right Cessation
- 2008-03-28CACA002682493Apatent/CA2682493A1/ennot_activeAbandoned
- 2008-03-28WOPCT/JP2008/056735patent/WO2008120815A1/enactiveApplication Filing
- 2008-03-28CNCN200880010916.8Apatent/CN101674810B/ennot_activeExpired - Fee Related
- 2008-03-28USUS12/450,571patent/US8686052B2/enactiveActive
- 2008-03-28KRKR1020097020305Apatent/KR101585947B1/ennot_activeExpired - Fee Related
- 2008-03-28EPEP08739842.6Apatent/EP2135600B1/ennot_activeNot-in-force
- 2008-03-28AUAU2008233550Apatent/AU2008233550B2/ennot_activeCeased
- 2008-03-28ESES08739842Tpatent/ES2793673T3/enactiveActive
- 2008-03-28JPJP2009507561Apatent/JP5302187B2/ennot_activeExpired - Fee Related
- 2008-03-28ARARP080101305Apatent/AR065878A1/ennot_activeApplication Discontinuation
- 2013
- 2013-06-19JPJP2013128089Apatent/JP2013224311A/ennot_activeWithdrawn
- 2014
- 2014-01-08USUS14/150,478patent/US20140127187A1/ennot_activeAbandoned
- 2015
- 2015-02-25JPJP2015035066Apatent/JP2015134789A/enactivePending
- 2016
- 2016-11-02JPJP2016215119Apatent/JP2017048225A/enactivePending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006068232A1 (en) | 2004-12-22 | 2006-06-29 | Sapporo Medical University | Drug carrier and drug carrier kit for inhibiting fibrosis |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200063014A (en) | 2018-11-27 | 2020-06-04 | 가톨릭대학교 산학협력단 | Peptides for targeting skin cells and use thereof |
| KR20230072259A (en) | 2021-11-17 | 2023-05-24 | 사회복지법인 삼성생명공익재단 | Pharmaceutical composition for preventing or treating for cancer comprising PRRX1 inhibitor |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2682493A1 (en) | 2008-10-09 |
| JP2013224311A (en) | 2013-10-31 |
| CN101674810A (en) | 2010-03-17 |
| JPWO2008120815A1 (en) | 2010-07-15 |
| JP5302187B2 (en) | 2013-10-02 |
| US20100144659A1 (en) | 2010-06-10 |
| TW200846022A (en) | 2008-12-01 |
| EP2135600A1 (en) | 2009-12-23 |
| US20140127187A1 (en) | 2014-05-08 |
| JP2017048225A (en) | 2017-03-09 |
| EP2135600B1 (en) | 2020-04-29 |
| KR20090130010A (en) | 2009-12-17 |
| JP2015134789A (en) | 2015-07-27 |
| AU2008233550A1 (en) | 2008-10-09 |
| AU2008233550B2 (en) | 2013-02-21 |
| CN101674810B (en) | 2014-07-16 |
| AR065878A1 (en) | 2009-07-08 |
| TWI407971B (en) | 2013-09-11 |
| US8686052B2 (en) | 2014-04-01 |
| EP2135600A4 (en) | 2013-10-16 |
| ES2793673T3 (en) | 2020-11-16 |
| WO2008120815A1 (en) | 2008-10-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101585947B1 (en) | Targeting agents for cancer cells or cancer-associated fibroblasts | |
| RU2678968C2 (en) | Therapeutic agent for pulmonary fibrosis | |
| TWI504411B (en) | A therapeutical agent for treating myelofibrosis | |
| US9926561B2 (en) | Composition for regenerating normal tissue from fibrotic tissue | |
| KR102059054B1 (en) | Intestinal fibrosis treatment agent | |
| JP6023824B2 (en) | Composition for regenerating normal tissue from fibrotic tissue | |
| KR102759878B1 (en) | Drugcarrier comprising RGD ligand and MNPs for Preventing or Treating of Pancreas cancer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application | St.27 status event code:A-0-1-A10-A15-nap-PA0105 | |
| PG1501 | Laying open of application | St.27 status event code:A-1-1-Q10-Q12-nap-PG1501 | |
| A201 | Request for examination | ||
| PA0201 | Request for examination | St.27 status event code:A-1-2-D10-D11-exm-PA0201 | |
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | St.27 status event code:A-1-2-D10-D21-exm-PE0902 | |
| E13-X000 | Pre-grant limitation requested | St.27 status event code:A-2-3-E10-E13-lim-X000 | |
| P11-X000 | Amendment of application requested | St.27 status event code:A-2-2-P10-P11-nap-X000 | |
| P13-X000 | Application amended | St.27 status event code:A-2-2-P10-P13-nap-X000 | |
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | St.27 status event code:A-1-2-D10-D21-exm-PE0902 | |
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | St.27 status event code:A-1-2-D10-D22-exm-PE0701 | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | St.27 status event code:A-2-4-F10-F11-exm-PR0701 | |
| PR1002 | Payment of registration fee | St.27 status event code:A-2-2-U10-U12-oth-PR1002 Fee payment year number:1 | |
| PG1601 | Publication of registration | St.27 status event code:A-4-4-Q10-Q13-nap-PG1601 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:4 | |
| FPAY | Annual fee payment | Payment date:20200106 Year of fee payment:5 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:5 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:6 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:7 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:8 | |
| PC1903 | Unpaid annual fee | St.27 status event code:A-4-4-U10-U13-oth-PC1903 Not in force date:20240112 Payment event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| PC1903 | Unpaid annual fee | St.27 status event code:N-4-6-H10-H13-oth-PC1903 Ip right cessation event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE Not in force date:20240112 |