KR100869589B1 - Quantitative Measurement of Biological Materials Using Biosensors - Google Patents
Quantitative Measurement of Biological Materials Using BiosensorsDownload PDFInfo
- Publication number
- KR100869589B1 KR100869589B1KR1020060130475AKR20060130475AKR100869589B1KR 100869589 B1KR100869589 B1KR 100869589B1KR 1020060130475 AKR1020060130475 AKR 1020060130475AKR 20060130475 AKR20060130475 AKR 20060130475AKR 100869589 B1KR100869589 B1KR 100869589B1
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- antigen
- immune response
- sample
- electrochemical signal
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
- G01N33/54346—Nanoparticles
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/403—Cells and electrode assemblies
- G01N27/406—Cells and probes with solid electrolytes
- G01N27/411—Cells and probes with solid electrolytes for investigating or analysing of liquid metals
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/62—Detectors specially adapted therefor
- G01N30/64—Electrical detectors
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/544—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being organic
- G01N33/545—Synthetic resin
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/551—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being inorganic
- G01N33/553—Metal or metal coated
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Hematology (AREA)
- Pathology (AREA)
- Biochemistry (AREA)
- Urology & Nephrology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Electrochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nanotechnology (AREA)
- Inorganic Chemistry (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean도 1 및 2는 통상적인 경쟁 면역반응 및 샌드위치 면역반응의 개략적인 반응 메커니즘을 도시한 도면이다.1 and 2 show schematic reaction mechanisms of conventional competitive and sandwich immune responses.
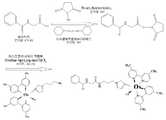
도 3은 카르복실기 함유 신호발생원과 아민기 함유 표준 항원 (또는 항체)과의 아미드 결합을 통한 커플링 방법에 대한 반응 메카니즘을 도시한 도면이다.FIG. 3 is a diagram illustrating a reaction mechanism for a coupling method through amide bonding between a carboxyl group-containing signal source and an amine group-containing standard antigen (or antibody).
도 4는 표준 항원으로서 히푸르산 (hippuric acid)에, N-히드록시숙신이미드를 부착시킨 후, 신호발생원으로서 오스뮴 함유 유무기 복합체 [Os(dme-bpy)2(ap-im)Cl]Cl2를 부착시키는 반응에 대한 개략적인 반응도이다.Figure 4 shows the osmium-containing organic-inorganic complex [Os (dme-bpy)2 (ap-im) Cl] as a signal source after attaching N-hydroxysuccinimide to hippuric acid as a standard antigen. A schematic diagram of the reaction for attaching Cl2 .
도 5는 나노금 입자 (nanogold particle) 또는 라텍스 비드 (lataex bead)에 결합된 항체를 사용하여 경쟁 면역 반응에 의한 전기화학적 신호발생을 유도하는 개략적인 방법을 도시한 도면이다.FIG. 5 shows a schematic method of inducing electrochemical signaling by a competitive immune response using antibodies bound to nanogold particles or latex beads.
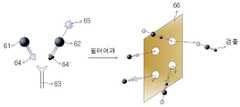
도 6은 소정 크기의 세공을 갖는 여과 필터를 사용하여 경쟁 면역 반응에 의한 전기화학적 신호발생을 유도하는 개략적인 방법을 도시한 도면이다.FIG. 6 illustrates a schematic method of inducing electrochemical signaling by a competitive immune response using a filtration filter having pores of a predetermined size.
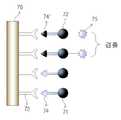
도 7은 항체를 전극 표면에 직접 고정한 다음, 경쟁 면역 반응에 의한 전기화학적 신호발생을 유도하는 개략적인 방법을 도시한 도면이다.FIG. 7 shows a schematic method of immobilizing an antibody directly on an electrode surface and then inducing electrochemical signaling by a competitive immune response.
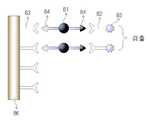
도 8은 항체를 전극 표면에 직접 고정한 다음, 샌드위치 면역 반응에 의한 전기화학적 신호발생을 유도하는 개략적인 방법을 도시한 도면이다.8 shows a schematic method of immobilizing an antibody directly on an electrode surface and then inducing electrochemical signaling by a sandwich immune response.
도 9는 본 발명에 따른 합성예 1에 있어서, 페로센카르복스알데히드 (1), 히푸릴-라이신 (2), 페로센카르복스알데히드를 소듐 보로하이드라이드로 환원시킨 것 (3) 및 페로센카르복스아미드-라이신-히푸르산 (4)에 대한 TLC 결과를 나타낸 사진이다.Figure 9 shows the synthesis of ferrocenecarboxaldehyde (1), hypofuryl-lysine (2), ferrocenecarboxaldehyde with sodium borohydride (3) and ferrocenecarboxamide in Synthesis Example 1 according to the present invention. TLC results for lysine-hypuric acid (4).
도 10a 및 10b는 본 발명에 따른 합성예 1에 있어서, 각각 페로센카르복스아미드 및 페로센카르복스아미드-라이신-히푸르산에 대한 NMR 측정 데이터를 도시한 그래프이다.10A and 10B are graphs showing NMR measurement data for ferrocenecarboxamide and ferrocenecarboxamide-lysine-hypuric acid in Synthesis Example 1 according to the present invention, respectively.
도 11은 본 발명에 따른 합성예 1에 있어서, 페로센카르복스아미드 및 페로센카르복스아미드-라이신-히푸르산에 대한 FT-IR 측정 데이터를 도시한 그래프이다.FIG. 11 is a graph showing FT-IR measurement data for ferrocenecarboxamide and ferrocenecarboxamide-lysine-hypuric acid in Synthesis Example 1 according to the present invention. FIG.
본 발명은 바이오센서를 이용한 생체 물질의 정량적 측정 방법에 관한 것으로서, 더욱 구체적으로는 표준 항원 또는 제2 항체에 분자량이 작은 전기화학적 신호발생원을 직접 결합시킴으로써 표준 항원 또는 제2 항체의 물리적 특성 변화를 최소화하고, 또한 표준 항원에 결합되는 전기화학적 신호발생원의 수를 임의로 조절가능하여 신호발생원으로부터의 신호 검출을 위한 추가적 시약 도입 없이도 정확 한 정량적 측정이 가능하며, 여러 종류의 신호발생원을 사용하여 다양한 분석물을 한 종류의 테스트 스트립만으로도 편리하고 신속하게 측정할 수 있는 바이오센서를 이용한 생체 물질의 정량적 측정 방법에 관한 것이다.The present invention relates to a quantitative measurement method of a biological material using a biosensor, and more particularly, by directly binding a small molecular weight electrochemical signal source to a standard antigen or a second antibody to change the physical properties of the standard antigen or the second antibody. Minimize and arbitrarily control the number of electrochemical signal sources bound to standard antigens, enabling accurate quantitative measurements without introducing additional reagents for signal detection from signal sources, and using a variety of signal sources The present invention relates to a method for quantitatively measuring biomaterials using a biosensor, which can conveniently and quickly measure water using only one type of test strip.
바이오센서 (biosensor)라는 용어는 일반적으로 피측정 생체 물질, 즉 분석물 (analyte)에 대해 생물학적 특이성을 갖는 센서를 의미하며, 이러한 분석물을 선택적으로 검출하기 위한 생물학적 분자들, 예컨대 항체, 효소 등을 지지체 또는 전극에 고정하여, 분석물의 수용기와 결합에 의해서 생성되거나 소멸되는 전자를 광학 신호 등과 같은 측정가능한 양으로 변환시킴으로써 분석물의 존재 여부 또는 함량을 측정하는 기기를 말한다.The term biosensor generally refers to a biological material to be measured, i.e. a sensor having biological specificity for an analyte, and biological molecules for selectively detecting such an analyte, such as antibodies, enzymes, etc. Refers to a device for measuring the presence or content of an analyte by fixing an electron to a support or an electrode and converting electrons generated or dissipated by binding to an analyte's acceptor into a measurable amount such as an optical signal.
분석물이 단백질일 경우, 단백질 중의 항원과 항체 사이의 면역 반응이 이러한 특이성을 결정하며, 면역 반응을 이용한 측정 방법은 분석물의 유무를 판별하는 정성적 방법과 분석물의 양을 측정하기 위한 정량적 혹은 반정량적인 방법으로 분류되고, 분광학적 검출에 의한 정량적 혹은 반정량적 방법은 형광 분석계 등과 같은 고가의 분석 장비를 필요로 하므로, 고가의 장비 없이 간단한 조작으로 측정이 용이하다는 면에서 최근에는 전기화학적 반응을 이용한 정량적 혹은 반정량적 방법이 선호되고 있다.If the analyte is a protein, the immune response between the antigen and the antibody in the protein determines this specificity, and the measurement method using the immune response is a qualitative method for determining the presence or absence of an analyte and a quantitative or semi-quantitative measure for the amount of the analyte. Since quantitative or semiquantitative methods by spectroscopic detection require expensive analytical equipment such as fluorescence spectrometers, electrochemical reactions have recently been performed in terms of easy measurement without simple equipment. Quantitative or semiquantitative methods used are preferred.
바이오센서에 응용되는 면역 반응은 경쟁 반응 및 샌드위치 반응으로 분류될 수 있는데, 도 1 및 2에는 경쟁 반응 및 샌드위치 반응의 개략적인 반응 메커니즘을 도시하였다.Immune responses applied to biosensors can be classified into competition reactions and sandwich reactions. FIGS. 1 and 2 show schematic reaction mechanisms of competition reactions and sandwich reactions.
도 1을 참조하면, 경쟁 반응의 경우, 검사 대상 시료 중의 분석물에 존재하 는 검체 항원 (11)은 항체 (13)와의 결합 부위 (epitope) (14)를 포함하고, 분석물과 혼합되며 신호발생원 (15)이 부착된 표준 항원 (검체 항원과 동일한 구조를 갖지는 않지만, 항체와의 결합 부위를 갖는 경우는 유사 표준 항원이라 하며, 이하, 표준 항원은 유사 표준 항원을 포함하는 개념으로 해석한다) (12) 역시 상기 항체 (13)와의 결합 부위 (14')를 포함하기 때문에, 검체 항원 (11)과 표준 항원 (12)이 항체 (13)와의 결합에 대해서 상호 경쟁하게 된다.Referring to FIG. 1, in the case of a competitive reaction, the
도 2를 참조하면, 샌드위치 반응의 경우, 검사 대상 시료 중의 분석물에 존재하는 검체 항원 (21)은 항체 (23)와의 결합 부위 (epitope) (24) 이외에도, 신호발생원 (25)이 부착된 제2 항체 (22)와의 결합 부위 (24')를 포함하기 때문에, 하나의 검체 항원 (21)에 항체 (23) 및 제2 항체 (22)가 함께 결합된 형태를 갖는다.Referring to FIG. 2, in the case of the sandwich reaction, the
경쟁 반응에서는 분석물 중에 검체 항원의 함량이 많을수록 항체와 결합하는 표준 항원의 양이 적어지고 결과적으로 신호발생원에 의한 신호발생량이 적어지며, 샌드위치 반응에서는 분석물 중에 항원의 함량이 많을수록 항체와 결합하는 검체 항원 및 이에 결합하는 제2 항체의 양이 많아지고 결과적으로 신호발생원에 의한 신호발생량이 많아지게 된다.In competitive reactions, the higher the content of the sample antigen in the analyte, the smaller the amount of standard antigen binding to the antibody, and as a result, the lesser the signal generated by the signal source.In the sandwich reaction, the higher the content of the antigen in the analyte, The amount of the sample antigen and the second antibody binding thereto increases, and as a result, the amount of signal generated by the signal source increases.
한편, 종래기술에 따른 면역반응을 응용한 바이오센서에 있어서 가장 큰 특징은 전자전달 매개체가 사용된다는 점이며, 종래 이러한 전자전달 매개체로는 페로센 및 페로센 유도체; 퀴논 및 퀴논 유도체; 헥사아민 루테늄, 오스뮴 함유 고분자 및 포타슘 페리시아나이드 등과 같은 전이금속 함유 유무기 물질; 유기 전도성 염 또는 바이오로젠 등과 같은 전자전달 유기물 등이 사용되어 왔다. 그러나, 상 술한 전자전달 매개체들은 혈액 중의 아스코르브산, 아세토아미노펜 또는 요산 등과 같은 다양한 방해물질의 방해를 받게 되므로, 정확한 측정이 불가능하다는 문제점이 있다.On the other hand, the biggest feature in the biosensor applying the immune response according to the prior art is that the electron transfer mediator is used, conventionally such electron transfer mediators such as ferrocene and ferrocene derivatives; Quinones and quinone derivatives; Transition metal-containing organic-inorganic materials such as hexaamine ruthenium, osmium-containing polymers and potassium ferricyanide; Organic conducting salts or electron transfer organic materials such as biologen and the like have been used. However, the above-mentioned electron transfer mediators are subject to various interferences such as ascorbic acid, acetoaminophen or uric acid in the blood, and thus there is a problem in that accurate measurement is impossible.
더욱이, 상술한 경쟁 반응 및 샌드위치 반응을 이용한 종래의 바이오센서들에 있어서, 신호발생원으로 형광 물질 또는 방사성 동위 원소를 사용하게 되면 고가의 측정 장비가 필요하게 되고, 표준 항원에 효소 또는 콜로이드 금속 등의 신호발생원을 부착하게 되면 표준 항원의 물리적 특성 변화를 초래하여 정확한 측정이 불가능해지며, 일반적으로 저분자 물질인 표준 항원에 캐리어 단백질 등을 부착시키게 되면 반응 동력학적인 측면에 오차가 발생될 수 있고, 신호발생원에 부착되는 표준 항원의 숫자를 임의로 조절할 수가 없어서 제조 로트 (lot) 간의 차이를 초래할 염려가 있다는 문제점이 있다.Furthermore, in the conventional biosensors using the competitive and sandwich reactions described above, the use of fluorescent materials or radioactive isotopes as signal sources requires expensive measurement equipment, and enzymes or colloidal metals such as standard antigens. Attaching a signal source causes changes in the physical properties of the standard antigen, making accurate measurements impossible. Attaching a carrier protein to a standard antigen, which is generally a low molecular substance, can cause errors in the reaction kinetics. There is a problem that there is a fear that the number of standard antigens attached to the source can not be arbitrarily adjusted, resulting in a difference between the production lot.
따라서, 본 발명은 상기 종래 기술의 문제점을 해결하기 위한 것으로서, 표준 항원 또는 제2 항체에 분자량이 작은 전기화학적 신호발생원을 직접 결합시킴으로써 표준 항원 또는 제2 항체의 물리적 특성 변화를 최소화하고, 또한 표준 항원에 결합되는 전기화학적 신호발생원의 수를 임의로 조절가능하여 신호발생원으로부터의 신호 검출을 위한 추가적 시약 도입 없이도 정확한 정량적 측정이 가능하며, 여러 종류의 신호발생원을 사용하여 다양한 분석물을 한 종류의 테스트 스트립만으로도 편리하고 신속하게 측정할 수 있는 바이오센서를 이용한 생체 물질의 정량적 측정 방법을 제공하고자 한다.Accordingly, the present invention is to solve the problems of the prior art, by minimizing changes in physical properties of the standard antigen or the second antibody by directly binding a small molecular weight electrochemical signal source to the standard antigen or the second antibody, The number of electrochemical signal sources bound to the antigen can be arbitrarily controlled to enable accurate quantitative measurement without introducing additional reagents for signal detection from the signal source, and to test various analytes using different types of signal sources. The present invention aims to provide a quantitative measurement method of a biomaterial using a biosensor which can be conveniently and quickly measured with a strip alone.
본 발명은 상기 목적을 달성하기 위해서,In order to achieve the above object,
검체로부터 분석 대상이 되는 분석물을 채취하는 단계;Collecting an analyte to be analyzed from the sample;
상기 분석물 중의 검체 항원과 항체 사이의 제1 면역반응 및 상기 제1 면역반응을 위한 결합 부위와 동일한 결합 부위를 포함하는 표준 항원과 상기 항체 사이의 제2 면역반응을 수행하는 단계; 및Conducting a first immune response between the sample antigen and the antibody in the analyte and a second immune response between the antibody and a standard antigen comprising the same binding site as the binding site for the first immune response; And
상기 제1 및 제2 면역반응으로부터의 전기화학적 신호를 검출하는 단계를 포함하는 생체 물질의 정량적 측정 방법에 있어서,In the quantitative measurement method of a biological material comprising the step of detecting the electrochemical signal from the first and second immune response,
상기 표준 항원이 공유 결합에 의해서 부착된 신호발생원을 포함하는 것을 특징으로 하는 생체 물질의 정량적 측정 방법을 제공한다.It provides a method for quantitative measurement of a biological material, characterized in that the standard antigen comprises a signal source attached by covalent bonds.
본 발명의 바람직한 일 구현예에 따르면, 상기 신호발생원과 상기 표준 항원의 공유 결합은 아민 커플링 방법, 티올 커플링 방법, 아비딘-비오틴 커플링 방법, 또는 알데히드 커플링 방법에 의해서 수행된다.According to a preferred embodiment of the present invention, the covalent binding of the signal source and the standard antigen is carried out by an amine coupling method, a thiol coupling method, an avidin-biotin coupling method, or an aldehyde coupling method.
본 발명의 바람직한 다른 구현예에 따르면, 상기 신호발생원의 분자량은 100 내지 1,000 Da이다.According to another preferred embodiment of the present invention, the molecular weight of the signal source is 100 to 1,000 Da.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 신호발생원은 페로시아니드 (ferrocyanide), 오스뮴 또는 루테늄 함유 유무기 복합체이다.According to another preferred embodiment of the invention, the signal source is ferrocyanide (ferrocyanide), osmium or ruthenium-containing organic-inorganic complex.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 제1 및 제2 면역반응으로부터의 전기화학적 신호 검출 단계는, 나노금 입자 (nanogold particle) 또는 라텍스 비드 (lataex bead)에 상기 항체를 결합시키는 단계; 상기 검체 항원 및 상기 표준 항원을 상기 나노금 입자 또는 라텍스 비드를 포함하는 용액과 혼합하는 단계; 상기 용액에 대해서 원심분리를 수행하는 단계; 및 상기 원심분리 결과물의 상층액을 수거한 후, 전기화학적 신호를 검출하는 단계에 의해서 수행된다.According to another preferred embodiment of the invention, the step of detecting the electrochemical signal from the first and second immune response, the step of binding the antibody to the nanogold particles (nanogold particles) or latex beads (lataex bead); Mixing the sample antigen and the standard antigen with a solution comprising the nanogold particles or latex beads; Performing centrifugation on the solution; And after collecting the supernatant of the centrifugation result, detecting the electrochemical signal.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 제1 및 제2 면역반응으로부터의 전기화학적 신호 검출 단계는, 상기 검체 항원과 상기 항체의 면역반응 결과물 및 상기 표준 항원과 상기 항체의 면역반응 결과물을 세공을 갖는 여과 필터에 통과시키는 단계; 및 상기 통과 결과물을 수거한 후, 전기화학적 신호를 검출하는 단계에 의해서 수행된다.According to another preferred embodiment of the present invention, the step of detecting the electrochemical signal from the first and second immune response, the immunoreaction product of the sample antigen and the antibody and the immunoreaction product of the standard antigen and the antibody Passing through a filtration filter having pores; And after collecting the pass result, detecting an electrochemical signal.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 세공의 직경은 0.1 내지 5 nm이다.According to another preferred embodiment of the invention, the diameter of the pores is from 0.1 to 5 nm.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 제1 및 제2 면역반응으로부터의 전기화학적 신호 검출 단계는, 상기 항체를 전극 표면에 고정하는 단계; 상기 검체 항원 및 상기 표준 항원과, 상기 전극 표면에 고정된 항체와의 면역반응을 수행하는 단계; 및 상기 면역반응 결과물을 수거한 후, 전기화학적 신호를 검출하는 단계에 의해서 수행된다.According to another preferred embodiment of the invention, the step of detecting the electrochemical signal from the first and second immune response, the step of fixing the antibody to the electrode surface; Performing an immune reaction with the sample antigen and the standard antigen with an antibody immobilized on the electrode surface; And after collecting the result of the immune response, detecting the electrochemical signal.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 항체의 전극 표면에의 고정 단계는 펩타이드 커플링 방법, 티올 커플링 방법 또는 흡착 방법에 의해서 수행된다.According to another preferred embodiment of the present invention, the fixing of the antibody to the electrode surface is carried out by a peptide coupling method, a thiol coupling method or an adsorption method.
또한, 본 발명은 상기 목적을 달성하기 위해서,In addition, the present invention to achieve the above object,
검체로부터 분석 대상이 되는 분석물을 채취하는 단계;Collecting an analyte to be analyzed from the sample;
상기 분석물 중의 검체 항원과 항체 사이의 제1 면역반응 및 상기 제1 면역반응을 위한 결합 부위와는 다른 결합 부위에서 상기 검체 항원과 제2 면역반응에 의해 결합되는 제2 항체와 상기 검체 항원 사이의 제2 면역반응을 수행하는 단계; 및A first immune response between the sample antigen and the antibody in the analyte and between the sample antigen and the second antibody bound by the second antigen and the sample antigen at a binding site different from the binding site for the first immune response Performing a second immune response of; And
상기 제1 및 제2 면역반응으로부터의 전기화학적 신호를 검출하는 단계를 포함하는 생체 물질의 정량적 측정 방법에 있어서,In the quantitative measurement method of a biological material comprising the step of detecting the electrochemical signal from the first and second immune response,
상기 제2 항체가 공유 결합에 의해서 부착된 신호발생원을 포함하는 것을 특징으로 하는 생체 물질의 정량적 측정 방법을 제공한다.It provides a method for quantitative measurement of a biological material, characterized in that the second antibody comprises a signal source attached by covalent bonds.
본 발명의 바람직한 일 구현예에 따르면, 상기 신호발생원과 상기 제2 항체의 공유 결합은 아민 커플링 방법, 티올 커플링 방법, 아비딘-비오틴 커플링 방법, 또는 알데히드 커플링 방법에 의해서 수행된다.According to a preferred embodiment of the present invention, the covalent binding of the signal source and the second antibody is carried out by an amine coupling method, a thiol coupling method, an avidin-biotin coupling method, or an aldehyde coupling method.
본 발명의 바람직한 다른 구현예에 따르면, 상기 신호발생원의 분자량은 100 내지 1,000 Da이다.According to another preferred embodiment of the present invention, the molecular weight of the signal source is 100 to 1,000 Da.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 신호발생원은 페로시아니드 (ferrocyanide), 오스뮴 또는 루테늄 함유 유무기 복합체이다.According to another preferred embodiment of the invention, the signal source is ferrocyanide (ferrocyanide), osmium or ruthenium-containing organic-inorganic complex.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 면역반응으로부터의 전기화학적 신호 검출 단계는, 상기 항체를 전극 표면에 고정하는 단계; 상기 검체 항원과 상기 전극 표면에 고정된 항체와의 제1 면역반응을 수행하는 단계; 상기 검체 항원과 상기 제2 항체와의 제2 면역반응을 수행하는 단계; 및 상기 제2 면역반응 결과물을 수거한 후, 전기화학적 신호를 검출하는 단계에 의해서 수행된다.According to another preferred embodiment of the invention, the step of detecting the electrochemical signal from the immune response, the step of fixing the antibody to the electrode surface; Performing a first immune response between the sample antigen and an antibody immobilized on the electrode surface; Performing a second immune response between the sample antigen and the second antibody; And after collecting the second immune response product, detecting an electrochemical signal.
본 발명의 바람직한 또 다른 구현예에 따르면, 상기 항체의 전극 표면에의 고정 단계는 펩타이드 커플링 방법, 티올 커플링 방법, 흡착 등에 의해서 수행된다.According to another preferred embodiment of the present invention, the fixing of the antibody to the electrode surface is carried out by a peptide coupling method, a thiol coupling method, adsorption and the like.
본 발명에 따르면, 표준 항원 또는 제2 항체에 분자량이 작은 전기화학적 신호발생원을 직접 결합시킴으로써 표준 항원 또는 제2 항체의 물리적 특성 변화를 최소화하고, 또한 표준 항원에 결합되는 전기화학적 신호발생원의 수를 임의로 조절가능하여 신호발생원으로부터의 신호 검출을 위한 추가적 시약 도입 없이도 정확한 정량적 측정이 가능하며, 여러 종류의 신호발생원을 사용하여 다양한 분석물을 한 종류의 테스트 스트립만으로도 편리하고 신속하게 측정할 수 있는 바이오센서 및 이를 이용한 생체 물질의 정량적 측정 방법을 제공할 수 있다.According to the present invention, direct binding of a small molecular weight electrochemical signal source to a standard antigen or a second antibody minimizes physical property changes of the standard antigen or a second antibody, and also reduces the number of electrochemical signal sources bound to the standard antigen. It can be arbitrarily adjusted to enable accurate quantitative measurement without the introduction of additional reagents for signal detection from the signal source.By using various kinds of signal sources, various analytes can be conveniently and quickly measured with only one type of test strip. A sensor and a method of quantitatively measuring a biological material using the same can be provided.
이하, 본 발명에 대해서 더욱 상세하게 설명하기로 한다.Hereinafter, the present invention will be described in more detail.
본 발명에 따른 생체 물질의 정량적 측정 방법은 상술한 경쟁 반응 또는 샌드위치 반응 모두에 적용될 수 있다. 따라서, 본 발명 제1 형태에서는 경쟁 반응 메카니즘을 이용한 생체 물질의 정량적 측정 방법을 제공하고, 이는 검체로부터 분석 대상이 되는 분석물을 채취하는 단계; 상기 분석물 중의 검체 항원과 항체 사이의 제1 면역반응 및 상기 제1 면역반응을 위한 결합 부위와 동일한 결합 부위를 포함하는 표준 항원과 상기 항체 사이의 제2 면역반응을 수행하는 단계; 및 상기 제1 및 제2 면역반응으로부터의 전기화학적 신호를 검출하는 단계를 포함하며, 상기 표준 항원이 공유 결합에 의해서 부착된 신호발생원을 포함하는 것을 특징으로 한다.The quantitative measuring method of the biological material according to the present invention can be applied to both the competitive reaction or the sandwich reaction described above. Accordingly, the first aspect of the present invention provides a method for quantitatively measuring a biological material using a competitive reaction mechanism, comprising: collecting an analyte to be analyzed from a sample; Conducting a first immune response between the sample antigen and the antibody in the analyte and a second immune response between the antibody and a standard antigen comprising the same binding site as the binding site for the first immune response; And detecting an electrochemical signal from said first and second immune responses, wherein said standard antigen comprises a signaling source attached by covalent bonds.
본 발명에 따른 바이오센서를 이용한 생체 물질의 정량적 측정 방법은, 신호 발생원의 부착을 위한 별도의 캐리어 (운반체)를 채용하지 않고, 표준 항원 또는 제2 항체에 공유 결합에 의해서 저분자량의 신호발생원을 직접 부착시킨다는 특징을 갖는다.The quantitative measurement method of a biological material using a biosensor according to the present invention does not employ a separate carrier (carrier) for attachment of a signal source, and provides a low molecular weight signal source by covalent binding to a standard antigen or a second antibody. Direct attachment.
신호발생원과 표준 항원 또는 제2 항체와의 공유 결합은 아민 커플링 (amine coupling) 방법, 티올 커플링 방법, 아비딘-비오틴 커플링 방법, 또는 알데히드 커플링 방법 등과 같은 당업계에 공지된 방법에 의해서 수행될 수 있다. 이중, 아민 커플링 방법을 예로 들면, 신호 발생원에 아민기 (또는 카르복실기)를 부착하고, 표준 항원 또는 제2 항체에 카르복실기 (또는 아민기)를 부착시킨 후, EDC (N-에틸-N'-(디메틸아미노프로필)카르보디이미드) 및 NHS (N-히드록시숙신이미드) 등을 사용한 커플링 반응을 수행하게 된다. 도 3에는 이러한 반응의 일 예를 도시하였다. 이때, 신호발생원의 아민기 (또는 카르복실기)의 개수를 조절함으로써 신호발생원과 표준 항원과의 결합수를 원하는 만큼 제어할 수 있게 되고, 따라서 종래기술과는 상이하게 신호발생원의 당량적 결합이 가능해지게 된다.Covalent linkage of the signaling source with a standard antigen or a second antibody may be accomplished by methods known in the art such as amine coupling method, thiol coupling method, avidin-biotin coupling method, or aldehyde coupling method. Can be performed. For example, the amine coupling method is exemplified by attaching an amine group (or carboxyl group) to a signal source, and attaching a carboxyl group (or amine group) to a standard antigen or a second antibody, followed by EDC (N-ethyl-N'-). Coupling reaction using (dimethylaminopropyl) carbodiimide), NHS (N-hydroxysuccinimide) and the like. 3 shows an example of such a reaction. At this time, by controlling the number of amine groups (or carboxyl groups) of the signal source, it is possible to control the number of bonds between the signal source and the standard antigen as desired, thus enabling equivalent binding of the signal source differently from the prior art. do.
상기 신호발생원으로는, 분자량 100 내지 1,000 Da 정도의 저분자량 물질이 바람직한데, 분자량이 100 Da 미만인 경우에는 치환을 통한 합성의 문제점이 있어서 바람직하지 않고, 분자량이 1,000 Da를 초과하는 경우에는 상술한 바와 같이 부착된 신호발생원이 표준 항원 또는 제2 항체의 물리적 특성, 특히 운동학적 특성에 영향을 주어 정확한 측정을 불가능하게 하므로 바람직하지 않다.As the signal source, a low molecular weight substance having a molecular weight of about 100 to 1,000 Da is preferable, but when the molecular weight is less than 100 Da, there is a problem of synthesis through substitution, which is not preferable, and when the molecular weight exceeds 1,000 Da, As such, the attached signal source is undesirable because it affects the physical properties of the standard antigen or the second antibody, in particular the kinematic properties, making accurate measurements impossible.
상술한 분자량 범위를 만족시키는 신호발생원의 구체적인 예로는, 이에 제한되는 것은 아니지만, 페로시아니드 (ferrocyanide), 오스뮴 또는 루테늄 함유 유무 기 복합체 등을 들 수 있다. 상기 유무기 복합체는 신호발생부로 기능하는 금속 부분 이외에 표준 항원 또는 제2 항체와의 공유 결합을 위한 유기물 작용기 부분을 포함한다.Specific examples of signal sources satisfying the above-described molecular weight range include, but are not limited to, ferrocyanide, osmium or ruthenium-containing organic-inorganic complexes, and the like. The organic-inorganic complex includes an organic functional group moiety for covalent binding with a standard antigen or a second antibody in addition to the metal moiety serving as a signaling part.
종래에는 표준 항원 등에 운반 단백질 등을 이용하여 신호발생원을 부착시키는 바, 이 경우 신호발생원이 부착된 표준 항원 등과 신호발생원이 미부착된 표준 항원 등의 분자량 차이가 매우 커지게 되고, 양자 사이에 운동학적인 측면에서 결합능의 차이가 과다하게 커지는 문제점이 있었다. 그러나, 본 발명에서는 이와 같이 저분자량의 신호발생원을 표준 항원 등에 직접 부착시키게 되므로, 운동성의 차이에 기인한 측정 오차를 대부분 제거할 수 있다는 장점이 있다. 또한, 본 발명에서는 신호발생원의 결합시 정확한 농도 조절이 가능하여 제조 로트 (lot) 간의 차이를 초래할 가능성이 거의 없다는 장점도 있다.Conventionally, a signal source is attached using a transport protein or the like to a standard antigen. In this case, the molecular weight difference between the standard antigen to which the signal source is attached and the standard antigen to which the signal source is not attached becomes very large. There was a problem in that the difference in binding capacity is excessively large. However, in the present invention, since the low molecular weight signal source is directly attached to a standard antigen or the like, there is an advantage that most measurement errors due to differences in motility can be eliminated. In addition, the present invention has the advantage that it is almost impossible to cause a difference between the production lot (lot) can be adjusted precisely when the signal source is combined.
예를 들어, 도 4에는 표준 항원으로서 히푸르산 (hippuric acid) (분자량: 179.18)에, N-히드록시숙신이미드 (분자량: 115)를 부착시킨 후, 신호발생원으로서 오스뮴 함유 유무기 복합체 [Os(dme-bpy)2(ap-im)Cl]Cl2 (분자량: 896.58)를 부착시키는 반응에 대한 개략적인 반응도를 도시하였다.For example, in Fig. 4, N-hydroxysuccinimide (molecular weight: 115) is attached to hippuric acid (molecular weight: 179.18) as a standard antigen, and then an osmium-containing organic-inorganic complex as a signal source [ A schematic diagram of the reaction for attaching Os (dme-bpy)2 (ap-im) Cl] Cl2 (molecular weight: 896.58) is shown.
본 발명에 따른 생체 물질의 정량적 측정 방법에 있어서, 검체로부터의 분석물 채취는 채혈 및 채뇨 등과 같은 당업계에 통상적인 다양한 방법에 의해서 이루어질 수 있다. 한편, 신호발생원과 부착된 표준 항원은 동결건조 등의 형태로 저장부에 일정량 분주되어 있고, 분석물 채취에 의해서 검체로부터의 혈액 등과 같은 분석물이 유입되면 저장부에 분주되어 있던 표준 항원이 검체로부터의 분석물과 혼합된다. 뒤이어 검체 항원과 항체 사이의 제1 면역반응 및 표준 항원과 항체 사이의 제2 면역 반응이 수행된다.In the quantitative measuring method of a biological material according to the present invention, analyte collection from a sample may be performed by various methods conventional in the art such as blood collection and urine collection. On the other hand, the signal generator and the attached standard antigen are divided into a certain amount in the storage unit in the form of lyophilization, and when the analyte such as blood from the sample is introduced by the analyte collection, the standard antigen distributed in the storage unit is sampled. Mixed with analyte from This is followed by a first immune response between the sample antigen and the antibody and a second immune response between the standard antigen and the antibody.
이어서, 검체 항원과 항체 또는 표준 항원과 항체 사이의 면역 반응 및 이러한 면역 반응과 상관 관계를 갖는 전기화학적 신호의 발생 및 그 검출 단계가 수행된다. 상기 면역 반응과 전기화학적 신호발생을 연관짓는 데에는 다양한 방법이 채용될 수 있는 바, 이하에서는 도면을 참고하여 그 비제한적인 예들에 대해서 설명하기로 한다.Subsequently, the immune response between the sample antigen and the antibody or the standard antigen and the antibody and the generation and detection of the electrochemical signal correlating with this immune response are performed. Various methods may be employed for associating the immune response with electrochemical signaling. Hereinafter, non-limiting examples will be described with reference to the accompanying drawings.
도 5에는 나노금 입자 (nanogold particle) 또는 라텍스 비드 (lataex bead)에 결합된 항체를 사용하여 면역 반응에 의한 전기화학적 신호발생을 유도하는 개략적인 방법이 도시되어 있다. 도 5를 참조하면, 분석물 채취부로부터 유입된 검체 항원 (51) 및 표준 항원 (52)의 혼합물은, 각각 항체 (53)에 대한 결합 부위 (54 및 54')를 포함하고 있으므로, 나노금 입자 또는 라텍스 비드 (56)에 결합된 항체 (53)에 경쟁적으로 결합하게 된다. 이어서, 상기 검체 항원 (51)과 항체 (53)의 면역반응물 및 상기 표준 항원 (52)과 항체 (53)의 면역반응물의 혼합물에 대해서 원심분리를 수행하면 항체 (53)와 결합된 검체 항원 (51) 또는 표준 항원 (52)은 나노금 입자 또는 라텍스 비드 (56)의 무게에 의해서 하층액에 위치하게 되고, 항체 (53)와 미결합된 검체 항원 (51) 또는 표준 항원 (52)은 상층액에 위치하게 된다. 따라서, 신호발생원 (55)이 부착된 표준 항원 (52)이 상층액에 많이 존재하여 전기화학적 신호의 검출량이 클 경우, 상대적으로 분석물 중의 검체 항원 (51) 함량이 많다는 것을 의미하고, 반대로 신호발생원 (55)이 부착된 표준 항원 (52)이 하층액에 많이 존재하여 전기화학적 신호의 검출량이 작을 경우, 상대적으로 분석물 중의 검체 항원 (51) 함량이 적다는 것을 의미하게 된다.FIG. 5 shows a schematic method of inducing electrochemical signaling by an immune response using antibodies bound to nanogold particles or latex beads. Referring to FIG. 5, since the mixture of the
한편, 도 6에는 소정 크기의 세공을 갖는 여과 필터를 사용하여 면역 반응에 의한 전기화학적 신호발생을 유도하는 개략적인 방법이 도시되어 있다. 도 6을 참조하면, 분석물 채취부로부터 유입된 검체 항원 (61) 및 표준 항원 (62)의 혼합물은, 각각 항체 (63)에 대한 결합 부위 (64 및 64')를 포함하고 있으므로, 항체 (63)에 경쟁적으로 결합하게 된다. 이어서, 상기 검체 항원 (61)과 항체 (63)의 면역반응물 및 상기 표준 항원 (62)과 항체 (63)의 면역반응물의 혼합물을 소정 크기의 세공을 갖는 여과 필터 (66)에 통과시키면 항체 (63)와 결합된 검체 항원 (61) 또는 표준 항원 (62)은 여과 필터를 통과하지 못하게 되고, 항체 (63)와 미결합된 검체 항원 (61) 또는 표준 항원 (62)은 여과 필터를 통과하게 된다. 따라서, 신호발생원 (65)이 부착된 표준 항원 (62)이 여과 필터를 통과한 여과액에 많이 존재하여 전기화학적 신호의 검출량이 클 경우, 상대적으로 분석물 중의 검체 항원 (61) 함량이 많다는 것을 의미하고, 반대로 신호발생원 (65)이 부착된 표준 항원 (62)이 여과 필터를 통과한 여과액에 적게 존재하여 전기화학적 신호의 검출량이 작을 경우, 상대적으로 분석물 중의 검체 항원 (61) 함량이 적다는 것을 의미하게 된다.6 illustrates a schematic method of inducing electrochemical signaling by an immune response using a filtration filter having pores of a predetermined size. Referring to FIG. 6, since the mixture of the
한편, 여과 필터를 사용한 분석 방법에 있어서는 상기 여과 필터의 세공 크기가 측정 대상이 되는 검체 항원 또는 표준 항원의 크기보다는 크고, 항체의 크기 보다는 작아야 한다는 점이 매우 중요하다. 이는 항체와 미결합된 검체 항원 또는 표준 항원만이 여과 필터를 통과할 수 있도록 하기 위해서이며, 검체 항원 및 표준 항원은 100 내지 1,000 Da 정도의 분자량을 갖고, 항체의 분자량은 150,000 내지 160,000 Da이며, 통상적인 투석용 멤브레인의 경우 80,000 MWCO라면 대략 2 내지 3 nm의 세공 크기 (pore size)를 갖는다는 점을 감안할 때, 0.1 내지 5 nm 정도의 직경을 갖는 여과 필터를 사용하는 것이 바람직하다.On the other hand, in the analysis method using a filtration filter, it is very important that the pore size of the filtration filter is larger than the size of the sample antigen or standard antigen to be measured and smaller than the size of the antibody. This is to ensure that only the sample antigen or standard antigen unbound with the antibody can pass through the filtration filter, the sample antigen and the standard antigen have a molecular weight of about 100 to 1,000 Da, and the molecular weight of the antibody is 150,000 to 160,000 Da, In the case of a conventional dialysis membrane, it is preferable to use a filtration filter having a diameter of about 0.1 to 5 nm, considering that 80,000 MWCO has a pore size of approximately 2 to 3 nm.
특히, 종래의 통상적인 바이오센서를 이용한 분석 방법으로는 상술한 바와 같은 여과 필터를 사용한 분석 방법을 적용하는 것 자체가 불가능한데, 이는 캐리어 단백질 등을 이용하여 표준 항원에 신호발생원을 부착시키게 되면, 그 부착 결과물의 분자량이 매우 커져서 전극 표면으로의 확산이 용이하지 않기 때문이다.In particular, it is impossible to apply an analysis method using a filtration filter as described above using a conventional conventional biosensor. When a signal source is attached to a standard antigen by using a carrier protein, This is because the molecular weight of the resultant adhesion becomes very large and diffusion to the electrode surface is not easy.
한편, 도 7에는 항체를 전극 표면에 직접 고정한 다음, 면역 반응에 의한 전기화학적 신호발생을 유도하는 개략적인 방법이 도시되어 있다. 도 7을 참조하면, 전극 (76) 표면에 2-머캅토에틸아민 등을 이용하여 아민기를 부여하고, 카르복실기를 갖는 항체 (73)를, 펩타이드 커플링 방법, 티올 커플링 방법, 흡착 등에 의해서 결합시킨다. 분석물 채취부로부터 유입된 검체 항원 (71) 및 표준 항원 (72)의 혼합물은, 각각 항체 (73)에 대한 결합 부위 (74 및 74')를 포함하고 있으므로, 항체 (73)에 경쟁적으로 결합하게 된다. 전기화학적 신호의 검출은 신호발생원 (75)이 결합된 표준 항원 (72)에 의해서 발생되며, 전기화학적 신호의 검출량이 클 경우, 상대적으로 분석물 중의 검체 항원 (71) 함량이 적다는 것을 의미하고, 반대로 전기화학적 신호의 검출량이 작을 경우, 상대적으로 분석물 중의 검체 항원 (71) 함 량이 많다는 것을 의미하게 된다.On the other hand, Figure 7 shows a schematic method of immobilizing the antibody directly on the electrode surface, and then inducing electrochemical signaling by the immune response. Referring to FIG. 7, an amine group is given to the surface of the
또한, 본 발명의 제2 형태에서는 경쟁 반응 메카니즘을 이용한 생체 물질의 정량적 측정 방법을 제공하고, 이는 검체로부터 분석 대상이 되는 분석물을 채취하는 단계; 상기 분석물 중의 검체 항원과 항체 사이의 제1 면역반응 및 상기 제1 면역반응을 위한 결합 부위와는 다른 결합 부위에서 상기 검체 항원과 제2 면역반응에 의해 결합되는 제2 항체와 상기 검체 항원 사이의 제2 면역반응을 수행하는 단계; 및 상기 제1 및 제2 면역반응으로부터의 전기화학적 신호를 검출하는 단계를 포함하며, 상기 제2 항체는 공유 결합에 의해서 부착된 신호발생원을 포함하는 것을 특징으로 한다.In addition, a second aspect of the present invention provides a method for quantitatively measuring a biological material using a competitive reaction mechanism, which comprises: collecting an analyte to be analyzed from a sample; A first immune response between the sample antigen and the antibody in the analyte and between the sample antigen and the second antibody bound by the second antigen and the sample antigen at a binding site different from the binding site for the first immune response Performing a second immune response of; And detecting electrochemical signals from the first and second immune responses, wherein the second antibody comprises a signal source attached by covalent bonds.
상기 신호발생원과 상기 제2 항체의 공유 결합은, 상술한 상기 신호발생원과 상기 표준 항원의 공유 결합과 마찬가지로, 아민 커플링 방법, 티올 커플링 방법, 아비딘-비오틴 커플링 방법, 또는 알데히드 커플링 방법과 같은 다양한 커플링 방법에 의해서 수행된다.The covalent linkage between the signal source and the second antibody is similar to the covalent bond between the signal source and the standard antigen described above, such as an amine coupling method, a thiol coupling method, an avidin-biotin coupling method, or an aldehyde coupling method. It is carried out by various coupling methods such as.
또한, 상기 신호발생원의 분자량은 100 내지 1,000 Da이고, 이는 페로시아니드 (ferrocyanide), 오스뮴 또는 루테늄 함유 유무기 복합체인 것이 바람직하다.In addition, the molecular weight of the signal source is 100 to 1,000 Da, which is preferably a ferrocyanide (ferrocyanide), osmium or ruthenium-containing organic-inorganic complex.
검체로부터의 분석물 채취는 채혈 및 채뇨 등과 같은 당업계에 통상적인 다양한 방법에 의해서 이루어질 수 있으며, 이어서 검체 항원과 항체 사이의 제1 면역반응 및 검체 항원과 제2 항체 사이의 제2 면역반응이 수행되고, 이중 제2 면역반응과 상관 관계를 갖는 전기화학적 신호의 발생 및 그 검출 단계가 수행된다. 상기 제2 면역 반응과 전기화학적 신호발생을 연관짓는 데에는 다양한 방법이 채용 될 수 있으며, 도 8에는 그 일 예가 도시되어 있다.The analyte collection from the sample can be accomplished by a variety of methods conventional in the art, such as blood collection and urine collection, and then a first immune response between the sample antigen and the antibody and a second immune response between the sample antigen and the second antibody And the step of generating and detecting the electrochemical signal correlated with the double second immune response. Various methods may be employed to associate the second immune response with electrochemical signaling, an example of which is illustrated in FIG. 8.
도 8을 참조하면, 전극 (86) 표면에 2-머캅토에틸아민 등을 이용하여 아민기를 부여하고, 카르복실기를 갖는 항체 (83)를, 상술한 펩타이드 커플링 방법, 티올 커플링 방법, 흡착 등에 의해서 결합시킨다. 분석물 채취부로부터 유입된 검체 항원 (81)이 전극 (86)에 고정된 항체 (83)에 제1 면역반응에 의해서 결합되면, 제2 면역반응에 의해서 검체 항원 (81)과 제2 항체 (82)가 결합된다. 전기화학적 신호의 검출은 신호발생원 (85)이 결합된 제2 항체 (82)에 의해서 발생되며, 전기화학적 신호의 검출량이 클 경우, 상대적으로 분석물 중의 검체 항원 (81) 함량이 많다는 것을 의미하고, 반대로 전기화학적 신호의 검출량이 작을 경우, 상대적으로 분석물 중의 검체 항원 (81) 함량이 적다는 것을 의미하게 된다.Referring to Fig. 8, an amine group is given to the surface of the
한편, 검체 항원과 항체 사이의 제1 면역반응 및 검체 항원과 제2 항체 사이의 제2 면역반응의 발생 순서는 상술한 바와 같이, 제1 면역반응이 먼저 발생되고 이어서 제2 면역반응이 발생될 수도 있지만, 반대로 제2 면역반응이 먼저 발생되고 이어서 제1 면역반응이 발생되는 경우도 가능하다.On the other hand, the order of occurrence of the first immune response between the sample antigen and the antibody and the second immune response between the sample antigen and the second antibody, as described above, the first immune response is generated first, and then the second immune response is generated. Alternatively, it is also possible for the second immune response to occur first, followed by the first immune response.
이하, 본 발명을 실시예를 통하여 더욱 구체적으로 설명하기로 하되, 하기 실시예는 본 발명의 이해를 돕기 위한 것일 뿐, 본 발명의 범위가 하기 실시예로만 한정되는 것으로 해석되어서는 아니될 것이다.Hereinafter, the present invention will be described in more detail with reference to Examples, but the following Examples are only to aid the understanding of the present invention, and the scope of the present invention should not be construed as being limited only to the following Examples.
실시예Example
재료material
페로센카르복스알데히드 (Ferrocenecarboxaldehyde), 히푸릴-라이신 (hippuryl-Lys) 및 소듐 보로하이드라이드 (Sodium borohydride)는 Aldrich사의 제품을 사용하였고, 더 이상의 정제 없이 시약급을 그대로 사용하였다. 용매로 사용한 클로로포름 (Aldrich)은 MgSO4를 이용하여 수분을 제거한 후 사용하였고, NaOH는 덕산사의 제품을 사용하였다.Ferrocenecarboxaldehyde (Ferrocenecarboxaldehyde), Hypuryl-Lysine (hippuryl-Lys) and Sodium borohydride (Sodium borohydride) was used as the product of Aldrich, reagent grade was used as it is without further purification. Chloroform (Aldrich) used as a solvent was used after removing water using MgSO4 , NaOH was used as a product of Duksan.
합성예Synthesis Example 1. One.페로센카르복스아미드Ferrocenecarboxamide-라이신-Lysine히푸르산Mount Hipur ( (FerrocenecarboxamideFerrocenecarboxamide-lys-hippuric-lys-hippuricacidacid)의 합성) Synthesis
100 mL의 둥근바닥 플라스크에 페로센카르복스알데히드 (21.4 mg, 0.5 mmol)를 수분이 제거된 클로로포름 (20 mL)에 녹이고, 히푸릴-라이신 (30.7 mg, 0.1 mmol)을 첨가하였다. 상기 혼합용액을 환류냉각기에 플라스크를 연결하고 3시간 동안 교반하면서 환류시킨 후, 회전증발기를 이용하여 용매를 제거하고, 클로로포름 30 mL에 녹였다. 반응물이 녹아있는 혼합용액에 소듐 보로하이드라이드 (15mg, 0.4mmol)를 넣고 30분 가량 교반한 뒤, NaOH (1 mol, 1 ml)를 넣어 pH가 12 정도 되게 염기성으로 만들어 주었다. 이 혼합물에 클로로포름 30 mL를 넣고, 유기층의 물질을 추출하여, 회전증발기를 이용해 용매를 제거하고, 노란색의 고체를 얻을 수 있었다. 얻은 고체물질은 TLC를 통하여 확인하고 컬럼크로마토그래피를 사용하여 정제되었다.Ferrocenecarboxaldehyde (21.4 mg, 0.5 mmol) was dissolved in water-free chloroform (20 mL) in a 100 mL round bottom flask, and hypuryl-lysine (30.7 mg, 0.1 mmol) was added. The mixed solution was refluxed with a flask connected to a reflux condenser and stirred for 3 hours, and then the solvent was removed using a rotary evaporator, and dissolved in 30 mL of chloroform. Sodium borohydride (15mg, 0.4mmol) was added to the mixed solution in which the reactants were dissolved, stirred for about 30 minutes, and NaOH (1 mol, 1 ml) was added to make the pH about 12. 30 mL of chloroform was added to the mixture, the material of the organic layer was extracted, the solvent was removed using a rotary evaporator, and yellow solid was obtained. The obtained solid material was confirmed by TLC and purified using column chromatography.
1H-NMR(D2O, 200MHz, ppm): δ 8.05 (s, 1H, CHNHCO), 4.0 (s, 2H, COCH2NH), 7.0-7.5 (m, 5H, 페닐)1 H-NMR (D2 O, 200 MHz, ppm): δ 8.05 (s, 1H, CHNHCO), 4.0 (s, 2H, COCH2 NH), 7.0-7.5 (m, 5H, phenyl)
FT-IR (KBr, cm-1) : 1500~1700 (CONH), 1000~1200 (C-N), 3300 (CH2NHCH2)FT-IR (KBr, cm-1 ): 1500 ~ 1700 (CONH), 1000 ~ 1200 (CN), 3300 (CH2 NHCH2 )
평가기기Evaluation device
수득된 합성물에 대한1H-NMR 스펙트럼은 실온에서 용매로써 D2O를 사용하여 200MHz의 Varian Mercury plus로 측정하였고, FT-IR스펙트럼은 Bio-Rad FT-IR FTS3000MX를 사용하여 KBr 펠렛 방법으로 측정하였다. 순환전압전류법 (CV) 실험은 CH Instruments (미국, 텍사스)사의 model 660B Electrochemical Workstation을 사용하여 수행하였다. 모든 실험에서 3-전극을 사용하였으며, 이때 상대전극으로는 백금 와이어, 작업전극으로는 스크린 프린팅 탄소 전극 (screen printed carbon electrodes; SPEs), 기준전극으로는 은/염화은 전극 (ESA, EE009)을 사용하였다.The1 H-NMR spectrum of the obtained compound was measured by Varian Mercury plus at 200 MHz using D2 O as solvent at room temperature, and the FT-IR spectrum was measured by KBr pellet method using Bio-Rad FT-IR FTS3000MX. It was. Cyclic voltammetry (CV) experiments were performed using a model 660B Electrochemical Workstation from CH Instruments (Texas, USA). In all experiments, three electrodes were used, with platinum wires as counter electrodes, screen printed carbon electrodes (SPEs) as working electrodes, and silver / silver chloride electrodes (ESA, EE009) as reference electrodes. It was.
TLC는 산화알루미늄 (60 F254, 0.2 mm, Merck)판을 이용하여 고정상으로 이용하였고, 이동상으로는 n-헥산 : 에틸아세테이트 = 3 : 1로 용액을 제조하여 이용하였다.TLC was used as a stationary phase using an aluminum oxide (60 F254 , 0.2 mm, Merck) plate, and the solution was prepared by using n-hexane: ethyl acetate = 3: 1 as the mobile phase.
평가결과Evaluation results
도 9에는 페로센카르복스알데히드 (1), 히푸릴-라이신 (2), 페로센카르복스알데히드를 소듐 보로하이드라이드로 환원시킨 것 (3) 및 페로센카르복스아미드-라이신-히푸르산 (4)에 대한 TLC 결과를 나타낸 사진을 도시하였으며, 도 9에서 볼 수 있는 바와 같이, TLC 상에서 Rf 값이 다른 화합물들이 생성된 것을 확인할 수 있다.9 shows ferrocenecarboxaldehyde (1), hypuryl-lysine (2), ferrocenecarboxaldehyde reduced with sodium borohydride (3) and ferrocenecarboxamide-lysine-hypuric acid (4). The TLC results are shown for the photographs, and as shown in FIG. 9, it can be seen that compounds having different Rf values were generated on the TLC.
상기 TLC 결과의 각 도트에 해당하는 화합물을 정제하여 NMR 및 FT-IR로 확인하였다. 도 10a에는 페로센카르복스아미드에 대한 NMR 측정 데이터를 도시하였으며, 도 10b에는 페로센카르복스아미드-라이신-히푸르산에 대한 NMR 측정 데이터를 도시하였다. 또한, 도 11에는 페로센카르복스아미드 및 페로센카르복스아미드-라이신-히푸르산에 대한 FT-IR 측정 데이터를 도시하였다. 도 10a, 10b 및 도 11을 참조하면, 펩타이드 결합이 형성된 것을 확인할 수 있으므로, 페로센에 히푸르산 화합물이 결합되었다는 것을 알 수 있다.The compound corresponding to each dot of the TLC result was purified and confirmed by NMR and FT-IR. FIG. 10A shows NMR measurement data for ferrocenecarboxamide, and FIG. 10B shows NMR measurement data for ferrocenecarboxamide-lysine-hypuric acid. FIG. 11 also shows FT-IR measurement data for ferrocenecarboxamide and ferrocenecarboxamide-lysine-hypuric acid. Referring to Figures 10a, 10b and 11, it can be seen that the peptide bond is formed, it can be seen that the hypofuric acid compound is bound to ferrocene.
상기 페로센-카르복스아미드-라이신-히푸르산 화합물을 단계별로 희석하여 단클론 항체인 항-히푸르산 항체를 이용하여 경쟁반응을 확인한 결과, 항-히푸르산 항체와 결합하는 것을 확인할 수 있었으며, 이로부터 히푸르산이 화합물 성분 중에 포함되어 있는 것을 확인할 수 있었다. 또한, CV를 이용한 전기화학적인 방법으로 신호가 발생하는 사실로부터, 페로센 부분도 화합물에 존재하는 것을 재차 확인할 수 있었다.Diluting the ferrocene-carboxamide-lysine-hyfuric acid compound step by step and confirming a competition reaction using an anti-hypuric acid antibody which is a monoclonal antibody, it was confirmed that the binding to the anti-hypuric acid antibody, From this, it was confirmed that hypuric acid was contained in the compound component. In addition, from the fact that the signal is generated by the electrochemical method using CV, it was confirmed again that the ferrocene moiety is also present in the compound.
본 발명에 따르면, 표준 항원 또는 제2 항체에 분자량이 작은 전기화학적 신호발생원을 직접 결합시킴으로써 표준 항원 또는 제2 항체의 물리적 특성 변화를 최소화하고, 또한 표준 항원에 결합되는 전기화학적 신호발생원의 수를 임의로 조절가능하여 신호발생원으로부터의 신호 검출을 위한 추가적 시약 도입 없이도 정확한 정량적 측정이 가능하며, 여러 종류의 신호발생원을 사용하여 다양한 분석물을 한 종류의 테스트 스트립만으로도 편리하고 신속하게 측정할 수 있는 바이오센서 및 이를 이용한 생체 물질의 정량적 측정 방법을 제공할 수 있다.According to the present invention, direct binding of a small molecular weight electrochemical signal source to a standard antigen or a second antibody minimizes physical property changes of the standard antigen or a second antibody, and also reduces the number of electrochemical signal sources bound to the standard antigen. It can be arbitrarily adjusted to enable accurate quantitative measurement without the introduction of additional reagents for signal detection from the signal source.By using various kinds of signal sources, various analytes can be conveniently and quickly measured with only one type of test strip. A sensor and a method of quantitatively measuring a biological material using the same can be provided.
Claims (15)
Translated fromKoreanPriority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020060130475AKR100869589B1 (en) | 2006-12-19 | 2006-12-19 | Quantitative Measurement of Biological Materials Using Biosensors |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020060130475AKR100869589B1 (en) | 2006-12-19 | 2006-12-19 | Quantitative Measurement of Biological Materials Using Biosensors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20080057113A KR20080057113A (en) | 2008-06-24 |
| KR100869589B1true KR100869589B1 (en) | 2008-11-21 |
Family
ID=39803105
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020060130475AExpired - Fee RelatedKR100869589B1 (en) | 2006-12-19 | 2006-12-19 | Quantitative Measurement of Biological Materials Using Biosensors |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR100869589B1 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014030985A1 (en)* | 2012-08-24 | 2014-02-27 | 단국대학교 산학협력단 | Microparticles for analyzing biomolecules, method for preparing same, kit for analyzing biomolecules, and method for analyzing biomolecules using the kit |
| KR101486149B1 (en) | 2013-07-12 | 2015-01-26 | 한양대학교 에리카산학협력단 | Method of detecting a marker for diagnosing a desease using a competetive immunoassay based on a surface-enhanced raman scattering |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101226655B1 (en)* | 2011-01-28 | 2013-01-25 | 서강대학교산학협력단 | Detection of Cell Cycle Progression Based on Electrochemical Approaches |
| CN113607944B (en)* | 2021-08-26 | 2022-07-08 | 深圳市亚辉龙生物科技股份有限公司 | Colloidal gold chromatography reagent strip, preparation method and neocorona antigen detection kit |
| KR102695332B1 (en)* | 2022-12-16 | 2024-08-16 | 주식회사 다이아슈어바이오 | Enzyme-substrate reaction-based biosensor for component detection of biological analytes and detection method using the same |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0580979A2 (en) | 1984-10-31 | 1994-02-02 | Igen, Inc. | Luminescent metal chelate labels and means for detection |
| US5585279A (en) | 1986-01-23 | 1996-12-17 | Davidson; Robert S. | Time-resolved luminescence binding assays using a fluorescent transition metal label other than ruthenium |
| KR20000070821A (en)* | 1997-02-06 | 2000-11-25 | 프란시스 제이 메이어 | Electrochemical probes for detection of molecular interactions and drug discovery |
| US20040039178A1 (en)* | 1994-07-25 | 2004-02-26 | Christoph Seidel | Metal chelate-labelled peptides |
- 2006
- 2006-12-19KRKR1020060130475Apatent/KR100869589B1/ennot_activeExpired - Fee Related
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0580979A2 (en) | 1984-10-31 | 1994-02-02 | Igen, Inc. | Luminescent metal chelate labels and means for detection |
| US5585279A (en) | 1986-01-23 | 1996-12-17 | Davidson; Robert S. | Time-resolved luminescence binding assays using a fluorescent transition metal label other than ruthenium |
| US20040039178A1 (en)* | 1994-07-25 | 2004-02-26 | Christoph Seidel | Metal chelate-labelled peptides |
| KR20000070821A (en)* | 1997-02-06 | 2000-11-25 | 프란시스 제이 메이어 | Electrochemical probes for detection of molecular interactions and drug discovery |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014030985A1 (en)* | 2012-08-24 | 2014-02-27 | 단국대학교 산학협력단 | Microparticles for analyzing biomolecules, method for preparing same, kit for analyzing biomolecules, and method for analyzing biomolecules using the kit |
| US10281461B2 (en) | 2012-08-24 | 2019-05-07 | Industry-Academic Cooperation Foundation, Dankook University | Microparticles for analyzing biomolecules, method for preparing same, kit for analyzing biomolecules, and method for analyzing biomolecules using the kit |
| KR101486149B1 (en) | 2013-07-12 | 2015-01-26 | 한양대학교 에리카산학협력단 | Method of detecting a marker for diagnosing a desease using a competetive immunoassay based on a surface-enhanced raman scattering |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20080057113A (en) | 2008-06-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Ahmad et al. | An electrochemical sandwich immunosensor for the detection of HER2 using antibody-conjugated PbS quantum dot as a label | |
| Hassani et al. | A sensitive aptamer-based biosensor for electrochemical quantification of PSA as a specific diagnostic marker of prostate cancer | |
| US8198039B2 (en) | Biosensors and related methods | |
| US5149629A (en) | Coulometric assay system | |
| Hu et al. | Boronate affinity-based electrochemical aptasensor for point-of-care glycoprotein detection | |
| US6682648B1 (en) | Electrochemical reporter system for detecting analytical immunoassay and molecular biology procedures | |
| Aydın et al. | Electrochemical immunosensor for CDH22 biomarker based on benzaldehyde substituted poly (phosphazene) modified disposable ITO electrode: A new fabrication strategy for biosensors | |
| Trojanowicz et al. | Electrochemical and piezoelectric enantioselective sensors and biosensors | |
| CN102959397B (en) | Method for electrochemically detecting binding reactions | |
| US20090270266A1 (en) | Method for Electrocatalytic Protein Detection | |
| KR101670032B1 (en) | Optical Biosensor | |
| KR100869589B1 (en) | Quantitative Measurement of Biological Materials Using Biosensors | |
| WO2007026731A1 (en) | Biochip and immunological analysis method | |
| Si et al. | Sensitive electrochemical detection of A549 exosomes based on DNA/ferrocene-modified single-walled carbon nanotube complex | |
| Zhang et al. | Universal and high-speed zeptomolar protein serum assay with unprecedented sensitivity | |
| Popov et al. | Ultra-sensitive electrochemical immunosensors for clinically important biomarker detection: Prospects, opportunities, and global trends | |
| JP3993049B2 (en) | Element for electrochemical analysis of physiologically active substance and analysis method using the same | |
| KR100838323B1 (en) | Impedance Immune Sensor for Bisphenol A Detection and Detection Method Using the Same | |
| Benkert et al. | Size Exclusion Redox‐Labeled Immunoassay (SERI): a new format for homogeneous amperometric creatinine determination | |
| Wang et al. | Electrochemical immunoassay for breast cancer markers CA153 determination based on carbon nanotubes modified electrode | |
| Wang et al. | Individually addressable electrode array for multianalyte electrochemiluminescent immunoassay based on a sequential triggering strategy | |
| AU2012304199A1 (en) | Electrochemical affinity sensor | |
| Lim et al. | Miniaturized amperometric flow immunoassay system using a glass fiber membrane modified with anion | |
| JPH04118554A (en) | Electrochemical method for measuring enzyme and bio-sensor | |
| Beiranvand et al. | Direct detection of lymphoma cancer cells based on impedimetric immunosensors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| PA0109 | Patent application | St.27 status event code:A-0-1-A10-A12-nap-PA0109 | |
| PA0201 | Request for examination | St.27 status event code:A-1-2-D10-D11-exm-PA0201 | |
| D13-X000 | Search requested | St.27 status event code:A-1-2-D10-D13-srh-X000 | |
| D14-X000 | Search report completed | St.27 status event code:A-1-2-D10-D14-srh-X000 | |
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | St.27 status event code:A-1-2-D10-D21-exm-PE0902 | |
| T11-X000 | Administrative time limit extension requested | St.27 status event code:U-3-3-T10-T11-oth-X000 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-3-3-R10-R18-oth-X000 | |
| AMND | Amendment | ||
| E13-X000 | Pre-grant limitation requested | St.27 status event code:A-2-3-E10-E13-lim-X000 | |
| P11-X000 | Amendment of application requested | St.27 status event code:A-2-2-P10-P11-nap-X000 | |
| P13-X000 | Application amended | St.27 status event code:A-2-2-P10-P13-nap-X000 | |
| PG1501 | Laying open of application | St.27 status event code:A-1-1-Q10-Q12-nap-PG1501 | |
| E601 | Decision to refuse application | ||
| PE0601 | Decision on rejection of patent | St.27 status event code:N-2-6-B10-B15-exm-PE0601 | |
| J201 | Request for trial against refusal decision | ||
| PJ0201 | Trial against decision of rejection | St.27 status event code:A-3-3-V10-V11-apl-PJ0201 | |
| AMND | Amendment | ||
| E13-X000 | Pre-grant limitation requested | St.27 status event code:A-2-3-E10-E13-lim-X000 | |
| P11-X000 | Amendment of application requested | St.27 status event code:A-2-2-P10-P11-nap-X000 | |
| P13-X000 | Application amended | St.27 status event code:A-2-2-P10-P13-nap-X000 | |
| PB0901 | Examination by re-examination before a trial | St.27 status event code:A-6-3-E10-E12-rex-PB0901 | |
| B701 | Decision to grant | ||
| PB0701 | Decision of registration after re-examination before a trial | St.27 status event code:A-3-4-F10-F13-rex-PB0701 | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | St.27 status event code:A-2-4-F10-F11-exm-PR0701 | |
| PR1002 | Payment of registration fee | St.27 status event code:A-2-2-U10-U11-oth-PR1002 Fee payment year number:1 | |
| PG1601 | Publication of registration | St.27 status event code:A-4-4-Q10-Q13-nap-PG1601 | |
| P14-X000 | Amendment of ip right document requested | St.27 status event code:A-5-5-P10-P14-nap-X000 | |
| P16-X000 | Ip right document amended | St.27 status event code:A-5-5-P10-P16-nap-X000 | |
| Q16-X000 | A copy of ip right certificate issued | St.27 status event code:A-4-4-Q10-Q16-nap-X000 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:4 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| FPAY | Annual fee payment | Payment date:20121011 Year of fee payment:5 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:5 | |
| FPAY | Annual fee payment | Payment date:20131004 Year of fee payment:6 | |
| PR1001 | Payment of annual fee | St.27 status event code:A-4-4-U10-U11-oth-PR1001 Fee payment year number:6 | |
| PN2301 | Change of applicant | St.27 status event code:A-5-5-R10-R13-asn-PN2301 St.27 status event code:A-5-5-R10-R11-asn-PN2301 | |
| LAPS | Lapse due to unpaid annual fee | ||
| PC1903 | Unpaid annual fee | St.27 status event code:A-4-4-U10-U13-oth-PC1903 Not in force date:20141114 Payment event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE | |
| PC1903 | Unpaid annual fee | St.27 status event code:N-4-6-H10-H13-oth-PC1903 Ip right cessation event data comment text:Termination Category : DEFAULT_OF_REGISTRATION_FEE Not in force date:20141114 | |
| P22-X000 | Classification modified | St.27 status event code:A-4-4-P10-P22-nap-X000 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 | |
| R18-X000 | Changes to party contact information recorded | St.27 status event code:A-5-5-R10-R18-oth-X000 |