KR100791512B1 - Membrane and scaffold for hybrid tissue regeneration consisting of nanostructures and their manufacturing method - Google Patents
Membrane and scaffold for hybrid tissue regeneration consisting of nanostructures and their manufacturing methodDownload PDFInfo
- Publication number
- KR100791512B1 KR100791512B1KR1020060131563AKR20060131563AKR100791512B1KR 100791512 B1KR100791512 B1KR 100791512B1KR 1020060131563 AKR1020060131563 AKR 1020060131563AKR 20060131563 AKR20060131563 AKR 20060131563AKR 100791512 B1KR100791512 B1KR 100791512B1
- Authority
- KR
- South Korea
- Prior art keywords
- collagen
- hours
- bioactive glass
- prepared
- solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000012528membraneSubstances0.000titleclaimsabstractdescription51
- 239000002086nanomaterialSubstances0.000titleclaimsabstractdescription35
- 238000004519manufacturing processMethods0.000titleclaimsabstractdescription25
- 230000017423tissue regenerationEffects0.000titleclaimsdescription12
- 239000002121nanofiberSubstances0.000claimsabstractdescription92
- 239000005313bioactive glassSubstances0.000claimsabstractdescription88
- 210000000988bone and boneAnatomy0.000claimsabstractdescription20
- 229920001436collagenPolymers0.000claimsdescription102
- 102000008186CollagenHuman genes0.000claimsdescription89
- 108010035532CollagenProteins0.000claimsdescription89
- 239000000243solutionSubstances0.000claimsdescription74
- 239000000203mixtureSubstances0.000claimsdescription56
- LFQSCWFLJHTTHZ-UHFFFAOYSA-NEthanolChemical compoundCCOLFQSCWFLJHTTHZ-UHFFFAOYSA-N0.000claimsdescription50
- 239000002131composite materialSubstances0.000claimsdescription46
- 239000000725suspensionSubstances0.000claimsdescription28
- 239000011521glassSubstances0.000claimsdescription26
- LOKCTEFSRHRXRJ-UHFFFAOYSA-Idipotassium trisodium dihydrogen phosphate hydrogen phosphate dichlorideChemical compoundP(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+]LOKCTEFSRHRXRJ-UHFFFAOYSA-I0.000claimsdescription25
- 239000002953phosphate buffered salineSubstances0.000claimsdescription25
- FPQQSJJWHUJYPU-UHFFFAOYSA-N3-(dimethylamino)propyliminomethylidene-ethylazanium;chlorideChemical compoundCl.CCN=C=NCCCN(C)CFPQQSJJWHUJYPU-UHFFFAOYSA-N0.000claimsdescription24
- 239000002114nanocompositeSubstances0.000claimsdescription24
- 238000004132cross linkingMethods0.000claimsdescription22
- 229920001343polytetrafluoroethylenePolymers0.000claimsdescription22
- 239000004810polytetrafluoroethyleneSubstances0.000claimsdescription22
- 239000002243precursorSubstances0.000claimsdescription22
- 229920002037poly(vinyl butyral) polymerPolymers0.000claimsdescription21
- BOTDANWDWHJENH-UHFFFAOYSA-NTetraethyl orthosilicateChemical compoundCCO[Si](OCC)(OCC)OCCBOTDANWDWHJENH-UHFFFAOYSA-N0.000claimsdescription18
- ZCCIPPOKBCJFDN-UHFFFAOYSA-Ncalcium nitrateChemical compound[Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=OZCCIPPOKBCJFDN-UHFFFAOYSA-N0.000claimsdescription18
- 238000000034methodMethods0.000claimsdescription18
- 238000002156mixingMethods0.000claimsdescription15
- 238000002347injectionMethods0.000claimsdescription14
- 239000007924injectionSubstances0.000claimsdescription14
- 230000008569processEffects0.000claimsdescription14
- XLYOFNOQVPJJNP-UHFFFAOYSA-NwaterSubstancesOXLYOFNOQVPJJNP-UHFFFAOYSA-N0.000claimsdescription13
- -1polytetrafluoroethylenePolymers0.000claimsdescription11
- NQTADLQHYWFPDB-UHFFFAOYSA-NN-HydroxysuccinimideChemical compoundON1C(=O)CCC1=ONQTADLQHYWFPDB-UHFFFAOYSA-N0.000claimsdescription10
- 239000002253acidSubstances0.000claimsdescription10
- 238000004108freeze dryingMethods0.000claimsdescription10
- 238000001035dryingMethods0.000claimsdescription9
- 238000001523electrospinningMethods0.000claimsdescription9
- DQWPFSLDHJDLRL-UHFFFAOYSA-Ntriethyl phosphateChemical compoundCCOP(=O)(OCC)OCCDQWPFSLDHJDLRL-UHFFFAOYSA-N0.000claimsdescription9
- 239000011148porous materialSubstances0.000claimsdescription8
- 239000000126substanceSubstances0.000claimsdescription8
- 230000005684electric fieldEffects0.000claimsdescription7
- IDGUHHHQCWSQLU-UHFFFAOYSA-Nethanol;hydrateChemical compoundO.CCOIDGUHHHQCWSQLU-UHFFFAOYSA-N0.000claimsdescription7
- 229910052751metalInorganic materials0.000claimsdescription7
- 239000002184metalSubstances0.000claimsdescription7
- 239000004745nonwoven fabricSubstances0.000claimsdescription7
- 230000011164ossificationEffects0.000claimsdescription7
- 238000003756stirringMethods0.000claimsdescription7
- 239000010409thin filmSubstances0.000claimsdescription7
- 230000000399orthopedic effectEffects0.000claimsdescription5
- 238000010791quenchingMethods0.000claimsdescription5
- 239000000758substrateSubstances0.000claimsdescription3
- 238000007598dipping methodMethods0.000claims1
- 238000007654immersionMethods0.000claims1
- 239000011159matrix materialSubstances0.000abstractdescription5
- 210000001519tissueAnatomy0.000abstractdescription5
- 229920005615natural polymerPolymers0.000abstractdescription3
- 239000012620biological materialSubstances0.000abstractdescription2
- 238000002054transplantationMethods0.000abstractdescription2
- 239000008279solSubstances0.000description17
- 210000004027cellAnatomy0.000description11
- 102000002260Alkaline PhosphataseHuman genes0.000description9
- 108020004774Alkaline PhosphataseProteins0.000description9
- 230000010478bone regenerationEffects0.000description4
- 239000006185dispersionSubstances0.000description4
- 230000000694effectsEffects0.000description4
- 239000007788liquidSubstances0.000description4
- 229920000642polymerPolymers0.000description4
- 230000000171quenching effectEffects0.000description4
- 238000001878scanning electron micrographMethods0.000description4
- 230000001954sterilising effectEffects0.000description4
- 238000004659sterilization and disinfectionMethods0.000description4
- 230000004071biological effectEffects0.000description3
- 230000000536complexating effectEffects0.000description3
- 239000000463materialSubstances0.000description3
- 210000000963osteoblastAnatomy0.000description3
- 230000004044responseEffects0.000description3
- 238000003917TEM imageMethods0.000description2
- 229910052586apatiteInorganic materials0.000description2
- 238000005452bendingMethods0.000description2
- 210000002449bone cellAnatomy0.000description2
- 239000001506calcium phosphateSubstances0.000description2
- 239000000919ceramicSubstances0.000description2
- 238000010668complexation reactionMethods0.000description2
- XLYOFNOQVPJJNP-UHFFFAOYSA-MhydroxideChemical compound[OH-]XLYOFNOQVPJJNP-UHFFFAOYSA-M0.000description2
- 238000011534incubationMethods0.000description2
- 230000003256osteocytic effectEffects0.000description2
- VSIIXMUUUJUKCM-UHFFFAOYSA-Dpentacalcium;fluoride;triphosphateChemical compound[F-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=OVSIIXMUUUJUKCM-UHFFFAOYSA-D0.000description2
- 230000008929regenerationEffects0.000description2
- 238000011069regeneration methodMethods0.000description2
- KZNICNPSHKQLFF-UHFFFAOYSA-NsuccinimideChemical compoundO=C1CCC(=O)N1KZNICNPSHKQLFF-UHFFFAOYSA-N0.000description2
- QORWJWZARLRLPR-UHFFFAOYSA-Htricalcium bis(phosphate)Chemical compound[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=OQORWJWZARLRLPR-UHFFFAOYSA-H0.000description2
- 102000004190EnzymesHuman genes0.000description1
- 108090000790EnzymesProteins0.000description1
- 238000002835absorbanceMethods0.000description1
- 230000003213activating effectEffects0.000description1
- 238000004458analytical methodMethods0.000description1
- 239000012227artificial bone substituteSubstances0.000description1
- 239000012237artificial materialSubstances0.000description1
- 239000011324beadSubstances0.000description1
- 230000000975bioactive effectEffects0.000description1
- 239000003462bioceramicSubstances0.000description1
- 229920002988biodegradable polymerPolymers0.000description1
- 239000004621biodegradable polymerSubstances0.000description1
- 230000005540biological transmissionEffects0.000description1
- 230000015572biosynthetic processEffects0.000description1
- 239000008280bloodSubstances0.000description1
- 210000004369bloodAnatomy0.000description1
- 229910000389calcium phosphateInorganic materials0.000description1
- 235000011010calcium phosphatesNutrition0.000description1
- 230000024245cell differentiationEffects0.000description1
- 230000000052comparative effectEffects0.000description1
- 230000018044dehydrationEffects0.000description1
- 238000006297dehydration reactionMethods0.000description1
- 238000006911enzymatic reactionMethods0.000description1
- 238000002474experimental methodMethods0.000description1
- 239000000835fiberSubstances0.000description1
- 238000000445field-emission scanning electron microscopyMethods0.000description1
- 238000011049fillingMethods0.000description1
- 239000010408filmSubstances0.000description1
- 239000002241glass-ceramicSubstances0.000description1
- 230000012010growthEffects0.000description1
- 238000010438heat treatmentMethods0.000description1
- 238000009396hybridizationMethods0.000description1
- 208000015181infectious diseaseDiseases0.000description1
- 229910010272inorganic materialInorganic materials0.000description1
- 239000011147inorganic materialSubstances0.000description1
- 230000005012migrationEffects0.000description1
- 238000013508migrationMethods0.000description1
- 235000015097nutrientsNutrition0.000description1
- 238000001543one-way ANOVAMethods0.000description1
- 239000005416organic matterSubstances0.000description1
- 229920000620organic polymerPolymers0.000description1
- 230000002138osteoinductive effectEffects0.000description1
- 239000002245particleSubstances0.000description1
- 230000035515penetrationEffects0.000description1
- 229920000307polymer substratePolymers0.000description1
- 238000002360preparation methodMethods0.000description1
- 230000001737promoting effectEffects0.000description1
- 102000004169proteins and genesHuman genes0.000description1
- 108090000623proteins and genesProteins0.000description1
- 230000001172regenerating effectEffects0.000description1
- 238000001338self-assemblyMethods0.000description1
- 229960002317succinimideDrugs0.000description1
- 229920001059synthetic polymerPolymers0.000description1
- 229910000391tricalcium phosphateInorganic materials0.000description1
- 235000019731tricalcium phosphateNutrition0.000description1
- 229940078499tricalcium phosphateDrugs0.000description1
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/28—Bones
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61C—DENTISTRY; APPARATUS OR METHODS FOR ORAL OR DENTAL HYGIENE
- A61C8/00—Means to be fixed to the jaw-bone for consolidating natural teeth or for fixing dental prostheses thereon; Dental implants; Implanting tools
- A61C8/0012—Means to be fixed to the jaw-bone for consolidating natural teeth or for fixing dental prostheses thereon; Dental implants; Implanting tools characterised by the material or composition, e.g. ceramics, surface layer, metal alloy
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2/3094—Designing or manufacturing processes
- A61F2/30942—Designing or manufacturing processes for designing or making customized prostheses, e.g. using templates, CT or NMR scans, finite-element analysis or CAD-CAM techniques
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/30—Joints
- A61F2/3094—Designing or manufacturing processes
- A61F2/30965—Reinforcing the prosthesis by embedding particles or fibres during moulding or dipping
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03B—MANUFACTURE, SHAPING, OR SUPPLEMENTARY PROCESSES
- C03B37/00—Manufacture or treatment of flakes, fibres, or filaments from softened glass, minerals, or slags
- C03B37/01—Manufacture of glass fibres or filaments
- C03B37/011—Manufacture of glass fibres or filaments starting from a liquid phase reaction process, e.g. through a gel phase
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C1/00—Ingredients generally applicable to manufacture of glasses, glazes, or vitreous enamels
- C03C1/006—Ingredients generally applicable to manufacture of glasses, glazes, or vitreous enamels to produce glass through wet route
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C13/00—Fibre or filament compositions
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C3/00—Glass compositions
- C03C3/04—Glass compositions containing silica
- C03C3/076—Glass compositions containing silica with 40% to 90% silica, by weight
- C03C3/097—Glass compositions containing silica with 40% to 90% silica, by weight containing phosphorus, niobium or tantalum
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C4/00—Compositions for glass with special properties
- C03C4/0007—Compositions for glass with special properties for biologically-compatible glass
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2310/00—Prostheses classified in A61F2/28 or A61F2/30 - A61F2/44 being constructed from or coated with a particular material
- A61F2310/00005—The prosthesis being constructed from a particular material
- A61F2310/00329—Glasses, e.g. bioglass
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Materials Engineering (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Geochemistry & Mineralogy (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Transplantation (AREA)
- Cardiology (AREA)
- Manufacturing & Machinery (AREA)
- Ceramic Engineering (AREA)
- General Life Sciences & Earth Sciences (AREA)
- Molecular Biology (AREA)
- Dispersion Chemistry (AREA)
- Dentistry (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Geometry (AREA)
- Materials For Medical Uses (AREA)
Abstract
Translated fromKoreanDescription
Translated fromKorean도1 본 발명의 실험 개략도Figure 1 Experimental schematic of the present invention
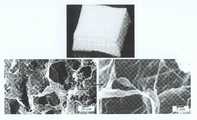
도2 본 발명의 무기질 성분으로 이용될 생체활성 유리 나노섬유의 모폴로지를 보여주는 주사전자현미경 사진Figure 2 Scanning electron micrograph showing the morphology of the bioactive glass nanofibers to be used as the inorganic component of the present invention
도3 본 발명의 실시예에 의해 제조된 생체활성 유리 나노섬유와 콜라젠을 하이브리드화하여 제조된 나노구조 복합체 얇은 막 멤브레인 (a) 및 그 미세구조를 보여주는 주사전자현미경 사진 (b)3 is a scanning electron micrograph (b) showing a nanostructured composite thin film membrane (a) prepared by hybridizing bioactive glass nanofibers and collagen prepared according to an embodiment of the present invention and its microstructure;
도4 본 발명의 실시예에 의해 제조된 생체활성 유리 나노섬유와 콜라젠을 하이브리드화하여 제조된 나노구조 복합체 다공성 스캐폴드 (a) 및 그 미세구조를 보여주는 주사전자현미경 사진 (b)4 is a scanning electron micrograph (b) showing a nanostructure composite porous scaffold (a) prepared by hybridizing bioactive glass nanofibers and collagen prepared according to an embodiment of the present invention and its microstructure.
도5 본 발명의 실시예에 의해 제조된 생체활성 유리 나노섬유와 콜라젠 나노구조 하이브리드체의 내부 미세구조를 보여주는 투과전자현미경 사진5 is a transmission electron micrograph showing the internal microstructure of the bioactive glass nanofibers and collagen nanostructure hybrid prepared by the embodiment of the present invention
도6 본 발명의 실시예에 의해 제조된 생체활성 유리 나노섬유와 콜라겐을 하이브리드화하여 제조된 나노구조 복합체 얇은 막 멤브레인 (a,b)과 다공성 스캐폴드 (c,d) 위에서 3일 동안 성장한 골형성 세포의 모습을 보여주는 주사전자현미 경 사진FIG. 6 Bones grown for 3 days on a nanostructured composite thin membrane membrane (a, b) and a porous scaffold (c, d) prepared by hybridizing bioactive glass nanofibers and collagen prepared according to an embodiment of the present invention Scanning electron micrograph showing the appearance of forming cells
도6 본 발명의 실시예에 의해 제조된 생체활성 유리 나노섬유와 콜라겐을 복합화하여 제조된 나노구조 하이브리드형 멤브레인 상에서 7일 동안 자란 골형성 세포의 Alkaline Phosphatase 활성도를 나타낸 그래프.6 is a graph showing Alkaline Phosphatase activity of osteoblasts grown for 7 days on a nanostructured hybrid membrane prepared by complexing the bioactive glass nanofibers and collagen prepared according to the embodiment of the present invention.
본 발명은 치아 및 골의 경조직을 재생할 수 있는 이식용 생체재료로서의 쓰임을 위해 천연고분자 기질 내에 생체활성 유리의 나노섬유(BGNF)를 복합화하여 제조한 나노구조를 지닌 하이브리드형 얇은 막 멤브레인과 다공성 스캐폴드 및 이들의 제조방법에 관한 것이다.The present invention is a hybrid thin membrane membrane and porous scaffold with nanostructures prepared by incorporating bioactive glass nanofibers (BGNF) in a natural polymer matrix for use as a biomaterial for transplantation that can regenerate hard tissues of teeth and bone. The present invention relates to a fold and a method of manufacturing the same.
인체의 뼈는 궁극적으로 콜라젠의 유기물에 수산화아파타이트의 무기물로 이루어진 유-무기 나노복합체, 또는 하이브리드체라고 할 수 있다. 이러한 유-무기의 나노복합체의 구조로 인해 뼈는 높은 하중에 견디는 강도와 쉽게 부러지지 않는 파괴인성, 그리고 적절한 탄성계수 등의 역학적 물성을 지니게 된다.The bones of the human body can be said to be organic-inorganic nanocomposites, or hybrids, which ultimately consist of organic matter of collagen and inorganic matter of apatite hydroxide. Due to the structure of the organic-inorganic nanocomposite, the bone has mechanical properties such as high load-bearing strength, fracture toughness that is not easily broken, and appropriate modulus of elasticity.
오랫동안 이러한 뼈를 인공적인 재료로서 대체하고자 하는 노력들은 많이 있어 왔다. 대표적인 인공골 대체 재료로서는 인산칼슘계통의 수산화아파타이트와 인산삼칼슘, 그리고 생체활성 유리 및 유리세라믹스가 있다. 이들은 골을 재생해내는 능력이 뛰어나 오랫동안 치과 및 정형외과 분야에서 임상적 승인을 얻어 왔다. 그 리나 이들 생체활성 세라믹스 계통은 강도나 파괴인성 등의 역학적 물성이 매우 취약하여, 그 쓰임이 하중을 받지 않는 부위나 매우 작은 크기의 골 손상 부위의 충진용으로 국한되었다. 또한 세라믹스이기 때문에 쓰임에 맞는 다양한 형태로의 제조가 용이하지 않다는 단점이 있다.There have been many efforts to replace these bones with artificial materials for a long time. Representative artificial bone substitutes include calcium phosphate apatite hydroxide and tricalcium phosphate, and bioactive glass and glass ceramics. Their ability to regenerate bone has long earned clinical approval in the dental and orthopedic fields. However, these bioactive ceramic systems are very weak in mechanical properties such as strength and fracture toughness, and their use is limited to filling unloaded or very small bone damage sites. In addition, because of the ceramics there is a disadvantage that it is not easy to manufacture in a variety of forms for use.
이에 반해, 생분해성 고분자, 특히 천연고분자라 할 수 있는 콜라젠 또한 골을 재생하는 재료로 사용되어 왔다. 콜라젠은 인체의 뼈를 구성하는 가장 많은 단백질로서 조직유도재생용 멤브레인 등으로 쓰이고 있다. 콜라젠은 유기질의 고분자이기 때문에 쉽게 성형이 가능하고 다양한 형태로의 제조가 가능하다 그러나 콜라젠 멤브레인의 경우 탄성이 낮고 체내에서 효소에 의해 쉽게 용해된다는 단점이 있다.On the other hand, biodegradable polymers, especially collagen, which can be called natural polymers, have also been used as bone regeneration materials. Collagen is the most protein constituting the human bone is used as a tissue-induced regeneration membrane. Since collagen is an organic polymer, it can be easily molded and manufactured in various forms. However, collagen membranes have low elasticity and are easily dissolved by enzymes in the body.
이처럼 생체세라믹스와 콜라젠은 각기 장단점이 있는데, 이를 복합화함으로서 서로의 단점을 극복하고 장점을 살려 역학적 및 생물학적 특성을 극대화시킬 필요가 있다. 이는 인체의 뼈가 유-무기의 나노복합체이기 때문에 지니는 역학적 및 생물학적 우수성을 모방하고자 하는 데에서 비롯된다고 할 수 있다.As such, bioceramic and collagen have advantages and disadvantages, and by combining them, it is necessary to maximize the mechanical and biological properties by overcoming the disadvantages of each other and utilizing the advantages. This is because the human bone is an organic-inorganic nanocomposite that attempts to imitate its mechanical and biological excellence.
중요한 것은 복합화를 할 때 나노단위의 복합화를 통해서만이 그 구조적 특성으로 인해 복합체의 역학적 생물학적 특성을 극대화할 수 있다. 그러나 생체 유-무기 복합화에 관한 대부분의 연구는 나노단위의 복합화 수준에 미치지 못한 것이 많다. 이는 주로 사용한 무기물 성분이 나노단위로 제조하는데 어려움이 있거나, 나노단위로 제조하여도 무기물 성분이 심하게 응집이 일어나기 때문에, 이를 콜라젠과의 복합화를 할 경우 무기물 성분은 수~수십 마이크론 수준으로 분포되게 되는 문제점이 있다.Importantly, when complexing, only the nanoscale complexation can maximize the mechanical and biological properties of the complex due to its structural properties. However, most of the studies on bio-inorganic complexation have fallen short of the level of nanoscale complexion. This is because the inorganic components used are difficult to prepare in nano units, or even when manufactured in nano units, since the inorganic components are agglomerated severely, when combined with collagen, the inorganic components are distributed in the level of several tens to several microns. There is a problem.
본 발명에서는 골을 재생하는 능력이 탁월한 생체 나노복합체를 제조하기 위한 것인데, 이를 위해 무기물 성분으로는 생체활성유리의 나노섬유를 이용하여 용액 상태의 콜라젠과의 하이브리드화를 통해 수십~수백 나노미터 단위로 분산시켜, 결국 생체활성 유리 나노섬유와 콜라젠 섬유상의 독특한 나노구조를 지닌 유-무기 나노하이브리드체를 제조하고자 하는데 있다.In the present invention, to produce a bio-nanocomposite excellent in the ability to regenerate bone, for this purpose, using the nanofiber of the bioactive glass as an inorganic component through the hybridization with collagen in solution state of tens to hundreds of nanometers It is intended to produce organic-inorganic nanohybrid bodies having unique nanostructures on bioactive glass nanofibers and collagen fibers.
여기서 사용된 생체활성유리는 그 성분이 골을 생성하는 능력이 탁월하기 때문에 마이크로수준의 입자나 큰 블록 형태로서 이미 골재생용 재료로 20년이 넘게 치과와 정형외과적으로 다양하게 응용되고 있는 재료이다. 그러나 아직까지 이러한 생체활성유리를 나노단위로 제조한 보고는 없기 때문에 나노단위의 생체활성유리를 콜라젠 등의 고분자들과 복합화를 한 경우도 없다. 따라서 본 발명에서는 생체활성유리의 나노섬유를 이용하여 콜라젠과의 복합화를 하였기 때문에, 결국 나노구조의 무기물 성분을 이용한 새로운 형태의 유-무기 나노복합체라고 할 수 있다.The bioactive glass used here is an excellent material for bone formation, so it is a micro-level particle or a large block, which has been used for bone regeneration for over 20 years. . However, since there are no reports of producing such bioactive glass in nano units, there is no case in which nano bioactive glass is complexed with polymers such as collagen. Therefore, in the present invention, since the composite with collagen using the nanofibers of the bioactive glass, it can be said to be a new type of organic-inorganic nanocomposite using the inorganic component of the nanostructure.
나노섬유를 고분자 기질에 첨가하여 제조한 것으로는, 고분자 나노섬유를 이용한 국내등록특허공보 등록번호 제10-439871호에는 고분자매트릭스 10~90체적%와 직경 10~500나노미터인 생체 분해성 나노섬유 90~10체적%로 구성되며 굽힘강력이 290MPa이상이고 굽힘 탄성율이 17GPa 이상인 나노섬유로 강화된 의료기구용 복합재료 및 그의 제조방법이 기술되어 있지만,As prepared by adding nanofibers to a polymer substrate, Korean Patent Publication No. 10-439871 using polymer nanofibers shows that the biodegradable nanofibers having a polymer matrix of 10 to 90% by volume and a diameter of 10 to 500 nanometers 90 Although the composite material for medical devices and its manufacturing method are reinforced with nanofibers composed of ˜10% by volume and having bending strength of 290 MPa or more and bending elastic modulus of 17 GPa or more,
이는 무기물 성분이 아닌 합성고분자 성분의 나노섬유를 이용한 것으로, 골세포를 활성화하거나 골을 재생할 수 있는 능력은 극히 제한되어 있다. 이에 반해, 본 발명에서 이루게 될 나노섬유형으로 이루어진 생체활성유리의 조성은 골세포 반응이 우수하고, 골전도성이 있으며, 심지어 골유도성이 있다고 알려진 조성으로 골을 형성하는 능력이 고분자에는 비할 수 없을 만큼 탁월하다고 할 수 있다.It uses nanofibers of synthetic polymer components, not inorganic components, and the ability to activate bone cells or regenerate bone is extremely limited. On the contrary, the composition of the bioactive glass made of the nanofiber form according to the present invention is excellent in osteocytic response, bone conduction, and even the ability to form bone with a composition known to be osteoinductive is incomparable to that of the polymer. It can be said to be excellent.
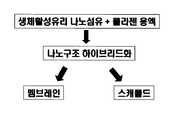
상기 목적을 달성하기 위하여 본 발명은 우수한 골 재생 능력을 지닌 나노구조의 무기물인 생체활성 유리 나노섬유를 이용하여 뼈의 유기물 성분인 콜라젠과의 복합화를 통해 골 유도재생용으로서 얇은 멤브레인 형태뿐 아니라 다공성 스캐폴드 형태로 제조된 나노구조로 이루어진 하이브리드형 조직재생용 멤브레인과 스캐폴드 및 그들의 제조방법을 제공하는 것이 본 발명이 이루고자 하는 기술적 과제인 것이다.In order to achieve the above object, the present invention utilizes bioactive glass nanofibers, which are nano-structured inorganic materials having excellent bone regeneration ability, and composites with collagen, which is an organic component of bone, to form bone as well as porous membrane for regeneration. It is a technical object of the present invention to provide a hybrid tissue regeneration membrane, a scaffold, and a method of manufacturing the nanostructures made of a scaffold.
상기와 같은 목적을 달성하기 위하여, 우선 생체활성을 지닌 유리 나노섬유를 제조하고, 이를 용액상태의 콜라젠과 하이브리드를 시켜, 건조시킨 후 나노복합체를 제조하는 것이다. 이 때 건조시키는 과정에 따라 멤브레인 형태 및 스캐폴드 형태로 제조하는 두께가 수십~수백 마이크론으로 된 치밀한 얇은 막 형태의 멤브레인과 기공이 수십~수백 마이크론 크기인 나노구조로 이루어진 하이브리드형 조직재생용 멤브레인과 스캐폴드 및 그들의 제조방법에 관한 것이다.In order to achieve the above object, first, glass nanofibers having bioactivity are prepared, and then hybridized with collagen in solution, followed by drying, to prepare nanocomposites. At this time, according to the drying process, the membrane for the tissue and the scaffold is a hybrid thin tissue membrane of tens to hundreds of microns thick and nanostructures of tens to hundreds of microns in pore size for hybrid tissue regeneration membrane and It relates to a scaffold and a method of manufacturing the same.
콜라젠과 복합화를 위한 생체활성 유리 나노섬유 및 이의 제조방법에 관해서는 다른 특허에 상세히 설명되어 있다.Bioactive glass nanofibers for complexing with collagen and methods for their preparation are described in detail in other patents.
본 발명에서는 유리의 전구체들로서 테트라에틸 오르토실리케이트(TEOS), 질 산칼슘, 트리에틸 포스페이트를 사용하였으며, 생체활성을 나타내는 유리조성으로 테트라에틸 오르토실리케이트(TEOS): 질산칼슘: 트리에틸 포스페이트 = 0.58:0.37:0.05 로 한 조성하여 1000을 선택하였다. 본 조성에서 졸을 제조하고 전기방사를 행한 후 열처리를 통하여 생체활성 유리 나노섬유를 제조하였다.In the present invention, tetraethyl orthosilicate (TEOS), calcium nitrate, and triethyl phosphate were used as precursors of the glass, and tetraethyl orthosilicate (TEOS): calcium nitrate: triethyl phosphate = 0.58: The composition of 0.37: 0.05 was selected and 1000 was selected. In the present composition, a sol was prepared, electrospinning was performed, and bioactive glass nanofibers were prepared through heat treatment.
1)One)생체활성Bioactivity 유리 나노섬유 - Glass Nanofiber-콜라젠Collagen 나노구조체 형성 Nanostructure Formation
콜라젠 용액을 생성된 유리 나노섬유와 혼합하기 이전에 미리 준비하였다. 콜라젠 (Type I, 분자량 300,000) 0.1~10 g 을 산 용액 10~1000 ml에 용해시켰다. 콜라젠 용액 10~1000 ml를 천연 섬유상 구조체로 형성시키기 위해 포스페이트 완충 염수 (PBS) 50~5000 ml 용액에 첨가한 후, 37℃에서 24 시간 동안 배양하였다. 미리 만들어진 생체활성 유리 나노섬유를 PBS에 분산시킨 후, 콜라겐 섬유상 용액과 혼합하였다. 이때, 혼합비율은 콜라젠에 들어가는 생체활성 유리 나노섬유의 양이 질량비로 0% 초과 100% 미만으로 사용될 수 있지만, 본 실시 예에서는 생체활성 유리 나노섬유: 콜라젠 = 20:80 및 40:60 (중량비)의 2가지 조성으로 제조하여, 결국 생체활성 유리 나노섬유 20wt% + 콜라젠 80wt% 와 생체활성 유리 나노섬유 40wt% + 콜라젠 60wt% 의 나노구조 복합체의 현탁액을 준비하였다.The collagen solution was prepared before mixing with the resulting glass nanofibers. 0.1-10 g of collagen (Type I, molecular weight 300,000) were dissolved in 10-1000 ml of an acid solution. 10-1000 ml of collagen solution was added to 50-5000 ml of phosphate buffered saline (PBS) to form a natural fibrous structure, and then incubated at 37 ° C. for 24 hours. Pre-made bioactive glass nanofibers were dispersed in PBS and then mixed with collagen fibrous solution. At this time, the mixing ratio of the bioactive glass nanofibers in the collagen may be used in a mass ratio of more than 0% and less than 100%, in the present embodiment, the bioactive glass nanofibers: collagen = 20:80 and 40:60 (weight ratio ), A suspension of 20 wt% bioactive glass nanofibers + 80 wt% collagen and 40 wt% bioactive glass nanofibers + 60 wt% collagen was prepared.
2) 나노복합2) Nanocomposite멤브레인Membrane 및 And스캐폴드Scaffold 형상 제조 Shape manufacturing
만들어진 생체활성 유리 나노섬유 - 콜라젠 나노구조 복합체의 현탁액을 얇은 멤브레인 및 다공성 스캐폴드로 형상화하였다.The suspension of the resulting bioactive glass nanofiber-collagen nanostructured composite was shaped into a thin membrane and porous scaffold.
우선 나노구조 복합 멤브레인을 제조하기 위하여 현탁액을 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 이를 24 시간 동안 laminar flow (층류) 내에서 건조시킨 후, 동결 건조시키고, 최종적으로 100~500kg 의 하중을 가해 균일한 두께를 지닌 얇은 막으로 제조하였다. 완전히 건조된 멤브레인은 콜라젠의 가교결합을 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM}용액이며, 이 용액 내에서 12 시간 동안 처리하였다.First, to prepare a nanostructured composite membrane, the suspension is poured into a polytetrafluoroethylene (PTFE) container designed to 50 mm x 50 mm x 10 mm, dried in a laminar flow for 24 hours, and then frozen. It was dried and finally applied to a load of 100 ~ 500kg to prepare a thin film having a uniform thickness. The fully dried membrane was used for the crosslinking of collagen. The crosslinking solution was 100 mM EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol and NHS (N-hydroxy). Succinimide) 100 mM} solution and treated in this solution for 12 hours.
또한 나노구조 복합 다공성 스캐폴드를 제조하기 위해서 상기 현탁액을 -70℃의 냉동기 내에서 급냉시킨 후 동결건조처리를 하였다. 완전히 건조된 다공성 스캐폴드는 콜라젠의 가교결합을 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM} 용액이며, 이 용액 내에서 12 시간 동안 처리하였다.In addition, to prepare a nanostructured composite porous scaffold, the suspension was quenched in a freezer at -70 ° C and then lyophilized. The fully dried porous scaffold was used for the crosslinking of collagen. The crosslinking solution was 100 mM of EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in 95% ethanol and NHS (N- Hydroxysuccinimide) 100 mM} solution and treated in this solution for 12 hours.
도 1에서는 본 발명의 실시 예에 의한 생체활성 유리 나노섬유 - 콜라젠 나노복합 멤브레인 및 스캐폴드의 제조공정을 나타내었다.Figure 1 shows the manufacturing process of the bioactive glass nanofibers-collagen nanocomposite membrane and scaffold according to an embodiment of the present invention.
이하 본 발명을 실시예를 통하여 상세히 설명하면 다음과 같다.Hereinafter, the present invention will be described in detail with reference to the following Examples.
실시예1Example 1
제1공정(생체활성 유리 나노섬유 제조)First step (manufacturing bioactive glass nanofibers)
생체활성을 나타내는 유리조성으로 테트라에틸 오르토실리케이트(TEOS): 질 산칼슘: 트리에틸 포스페이트 = 0.58:0.37:0.05 몰비율로 각각 100g 씩 HCl (1 N) 1g을 포함하는 물-에탄올 혼합물 (몰 비 = 1:1) 1000ml 에 첨가하여 제조된 졸 혼합물인 유리전구체를 물+에탄올에 대한 몰 비는 유리전구체/물+에탄올 = 1.00(중량대비)로 제조하고,Tetraethyl orthosilicate (TEOS): calcium nitrate: triethyl phosphate = 0.58: 0.37: 0.05 Mole ratio of water-ethanol mixture containing 1 g of HCl (1 N) in a molar ratio (molar ratio) = 1: 1) The glass precursor, a sol mixture prepared by adding to 1000 ml, was prepared with a glass precursor / water + ethanol = 1.00 (by weight),
제조된 유리전구체인 졸 혼합물 1000ml을 24 시간 교반한 후 25℃에서 24시간 및 추가로 40~70℃에서 48시간 동안 숙성한 다음, 숙성된 졸을 전기 방사중의 섬유 생성에 적합하도록 졸의 유동학적 성질을 조절하기 위하여, 10 % 폴리비닐-부티랄 (PVB) 1000ml 와 졸혼합물:PVB = 1:2~2:1의 중량대비로 혼합한 후, 졸 혼합물 10ml를 취해 주사기에 넣고, 0.5~2 kV/㎝의 DC 전기장 강도 및 0.01~1 ㎖/h의 주입 속도하에서 금속컬렉터에 주입하여 전기방사시켜 형성된 나노섬유 부직포를 600~900 ℃에서 1~6 시간 동안 공기중에서 열 처리하여 유기 공급원을 완전 제거된 생체활성 유리 나노섬유를 제조하여 준비한 다음,After stirring 1000 ml of the prepared glass precursor sol mixture for 24 hours, the mixture was aged at 25 ° C. for 24 hours and further at 40 to 70 ° C. for 48 hours. In order to control the chemical properties, 1000 ml of 10% polyvinyl-butyral (PVB) and a sol mixture: PVB = 1: 2 ~ 2: 1 were mixed by weight, and then 10 ml of the sol mixture was taken into a syringe, and 0.5 ~ The nanofiber nonwoven fabric formed by electrospinning by injection into a metal collector under a DC electric field strength of 2 kV / cm and an injection rate of 0.01-1 ml / h was heat treated in air at 600-900 ° C. for 1-6 hours to provide an organic source. After preparing and preparing completely removed bioactive glass nanofibers,
제2공정(나노구조 복합체의 현탁액제조)Second Step (Manufacturing Suspension of Nanostructured Composite)
콜라젠 (Type I, 분자량 300,000) 10 g 을 산 용액 1000 ml에 용해시킨 후에, 콜라젠 용액 1000 ml를 천연 섬유상 구조체로 형성시키기 위해 포스페이트 완충 염수 (PBS) 5000 ml 용액에 첨가한 후, 37℃에서 24 시간 동안 배양한 액과,After dissolving 10 g of collagen (Type I, molecular weight 300,000) in 1000 ml of acid solution, 1000 ml of collagen solution was added to 5000 ml solution of phosphate buffered saline (PBS) to form a natural fibrous structure, followed by 24 at 37 ° C. The liquid incubated for a time,
상기 제1공정에서 제조된 생체활성 유리 나노섬유를 PBS에 분산시킨 분산액을 혼합하되, 혼합비율은 콜라젠에 들어가는 생체활성 유리 나노섬유의 양이 중량대비 생체활성 유리 나노섬유:콜라젠 = 10:90으로 혼합하여 나노구조복합체의 현탁 액을 제조하고,The dispersion of the bioactive glass nanofibers prepared in the first step is dispersed in PBS, but the mixing ratio is the amount of bioactive glass nanofibers in the collagen is bioactive glass nanofibers: collagen = 10:90 Mixing to prepare a suspension of the nanostructured composite,
제3공정(나노복합 멤브레인 형태 제조)Third Process (Manufacture of Nanocomposite Membrane Shape)
상기 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 10~20 도 자외선 멸균 분위기에서 24 시간 동안 laminar flow (층류) 내에서 건조시킨 후, -40-50 도에서 24시간 동안 동결건조기 내에서 동결 건조를 한 후, 이를 유압프레스 내에 장착한 후 500kg 의 기계적 하중을 가한 후 균일한 두께를 지니도록 만들어, 얇은 막형상인 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.20 ml of the suspension of the nanostructured composite prepared in the second step is poured into a polytetrafluoroethylene (PTFE) container designed at 50 mm x 50 mm x 10 mm, and laminar for 24 hours in a 10-20 degree UV sterilization atmosphere. After drying in the flow (laminar flow), freeze-drying in the lyophilizer for 24 hours at -40-50 degrees, it was mounted in a hydraulic press and subjected to a mechanical load of 500 kg to have a uniform thickness. A hybrid membrane having a thin film nanostructure was prepared.
완전히 건조된 멤브레인은 콜라젠 성분의 가교결합을 시행하였는데, 이를 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM}용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.The fully dried membrane was subjected to crosslinking of collagen components. The crosslinking solution used was 100 mM of EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol and NHS. (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid membrane having a nanostructure.
제4공정 (다공성 스캐폴드 형태 제조)4th process (made of porous scaffold type)
상기 실시예1의 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 취해 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 이를 -70℃의 순간 냉동기 내에서 급냉시킨 후 -40-50 도 온도로 72 시간 동안 동결 건조기 내에서 동결건조처리를 하였다. 이 과정 중 잔류하는 용액이 완전히 없어지고, 생체활성유리 나노섬유 - 콜라젠 나노복합체 내부에 다량의 기공들이 생겨 나서, 나노구조복합체는 다공성 스캐폴드의 형상으로 제작된다.20 ml of the suspension of the nanostructured composite prepared in the second step of Example 1 was taken and poured into a polytetrafluoroethylene (PTFE) container designed to be 50 mm x 50 mm x 10 mm, and the freezer at -70 ° C. After quenching in the freeze-drying treatment for 72 hours at a temperature of -40-50 degrees. During this process, the remaining solution is completely eliminated, and a large amount of pores are generated inside the bioactive glass nanofiber-collagen nanocomposite, so that the nanostructured composite is manufactured in the shape of a porous scaffold.
완전히 건조된 다공성 스캐폴드는 콜라젠 성분의 가교결합을 시행하였는데, 이를 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM} 용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 스캐폴드를 제조하였다.The fully dried porous scaffold was subjected to crosslinking of collagen components. The crosslinking solution used for this was 100 mM EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol. And NHS (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid scaffold having nanostructures.
실시예2Example 2
제1공정(생체활성 유리 나노섬유 제조)First step (manufacturing bioactive glass nanofibers)
생체활성을 나타내는 유리조성으로 테트라에틸 오르토실리케이트(TEOS): 질산칼슘: 트리에틸 포스페이트 = 0.58:0.37:0.05 몰비율로 각각 100g 씩 HCl (1 N) 1g을 포함하는 물-에탄올 혼합물 (몰 비 = 1:1) 1000ml 에 첨가하여 제조된 졸 혼합물인 유리전구체를 물+에탄올에 대한 몰 비는 유리전구체/물+에탄올 = 1.00(중량대비)로 제조하고,Tetraethyl orthosilicate (TEOS): calcium nitrate: triethyl phosphate = 0.58: 0.37: 0.05 water-ethanol mixture containing 1 g of HCl (1 N) at a molar ratio of 100 g each (molar ratio = 1: 1) The glass precursor, which is a sol mixture prepared by adding to 1000 ml, of the molar ratio of water + ethanol is prepared as glass precursor / water + ethanol = 1.00 (by weight),
제조된 유리전구체인 졸 혼합물 1000ml을 24시간 교반한 후 25℃에서 24시간 및 추가로 40~70℃에서 48시간 동안 숙성한 다음, 숙성된 졸을 전기 방사중의 섬유 생성에 적합하도록 졸의 유동학적 성질을 조절하기 위하여, 10 % 폴리비닐-부티랄 (PVB) 1000ml 와 졸혼합물:PVB = 1:2~2:1의 중량대비로 혼합한 후, 졸 혼합물 10ml를 취해 주사기에 넣고, 0.5~2 kV/㎝의 DC 전기장 강도 및 0.01~1 ㎖/h의 주입 속도하에서 금속컬렉터에 주입하여 전기방사시켜 형성된 나노섬유 부직포를 600~900 ℃에서 1~6 시간 동안 공기중에서 열 처리하여 유기 공급원을 완전 제거된 생체활성 유리 나노섬유를 제조하여 준비한 다음,After stirring 1000 ml of the prepared glass precursor sol mixture for 24 hours, the mixture was aged at 25 ° C. for 24 hours and further 40 to 70 ° C. for 48 hours. In order to control the chemical properties, 1000 ml of 10% polyvinyl-butyral (PVB) and a sol mixture: PVB = 1: 2 ~ 2: 1 were mixed by weight, and then 10 ml of the sol mixture was taken into a syringe, and 0.5 ~ The nanofiber nonwoven fabric formed by electrospinning by injection into a metal collector under a DC electric field strength of 2 kV / cm and an injection rate of 0.01-1 ml / h was heat treated in air at 600-900 ° C. for 1-6 hours to provide an organic source. After preparing and preparing completely removed bioactive glass nanofibers,
제2공정(나노구조 복합체의 현탁액제조)Second Step (Manufacturing Suspension of Nanostructured Composite)
콜라젠 (Type I, 분자량 300,000) 0.1 g 을 산 용액 10 ml에 용해시킨 후에, 콜라젠 용액 10 ml를 천연 섬유상 구조체로 형성시키기 위해 포스페이트 완충 염수 (PBS) 50 ml 용액에 첨가한 후, 37℃에서 24 시간 동안 배양한 액과,After dissolving 0.1 g of collagen (Type I, molecular weight 300,000) in 10 ml of acid solution, 10 ml of collagen solution was added to 50 ml solution of phosphate buffered saline (PBS) to form a natural fibrous structure, followed by 24 at 37 ° C. The liquid incubated for a time,
상기 제1공정에서 제조된 생체활성 유리 나노섬유를 PBS에 분산시킨 분산액을 혼합하되, 혼합비율은 콜라젠에 들어가는 생체활성 유리 나노섬유의 양이 중량대비 생체활성 유리 나노섬유:콜라젠 = 90:10으로 혼합하여 나노구조복합체의 현탁액을 제조하고,Mix the dispersion obtained by dispersing the bioactive glass nanofibers prepared in the first step in PBS, the mixing ratio is the amount of bioactive glass nanofibers into the collagen bioactive glass nanofibers: collagen = 90:10 Mixing to prepare a suspension of the nanostructured composite,
제3공정(나노복합 멤브레인 형태 제조)Third Process (Manufacture of Nanocomposite Membrane Shape)
상기 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 10~20도 자외선 멸균 분위기에서 24시간 동안 laminar flow (층류) 내에서 건조시킨 후, -40-50 도에서 24시간 동안 동결건조기 내에서 동결 건조를 한 후, 이를 유압프레스 내에 장착한 후 500kg 의 기계적 하중을 가한 후 균일한 두께를 지니도록 만들어, 얇은 막형상인 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.20 ml of the suspension of the nanostructured composite prepared in the second step is poured into a polytetrafluoroethylene (PTFE) container designed at 50 mm x 50 mm x 10 mm, and laminar for 24 hours in a 10-20 degree UV sterilization atmosphere. After drying in the flow (laminar flow), freeze-drying in the lyophilizer for 24 hours at -40-50 degrees, it was mounted in a hydraulic press and subjected to a mechanical load of 500 kg to have a uniform thickness. A hybrid membrane having a thin film nanostructure was prepared.
완전히 건조된 멤브레인은 콜라젠 성분의 가교결합을 시행하였는데, 이를 위 해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM}용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.The fully dried membrane was subjected to crosslinking of collagen components. The crosslinking solution used was 100 mM of EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol. NHS (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid membrane having a nanostructure.
제4공정 (다공성 스캐폴드 형태 제조)4th process (made of porous scaffold type)
상기 실시예2의 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 취해 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 이를 -70℃의 순간 냉동기 내에서 급냉시킨 후 -40-50 도 온도로 72 시간 동안 동결 건조기 내에서 동결건조처리를 하였다. 이 과정 중 잔류하는 용액이 완전히 없어지고, 생체활성유리 나노섬유 - 콜라젠 나노복합체 내부에 다량의 기공들이 생겨나서, 나노구조복합체는 다공성 스캐폴드의 형상으로 제작된다.20 ml of the suspension of the nanostructured composite prepared in the second step of Example 2 was taken and poured into a polytetrafluoroethylene (PTFE) container designed to be 50 mm x 50 mm x 10 mm, and the freezer at -70 ° C. After quenching in the freeze-drying treatment for 72 hours at a temperature of -40-50 degrees. During this process, the remaining solution is completely eliminated, and a large amount of pores are generated inside the bioactive glass nanofiber-collagen nanocomposite, so that the nanostructured composite is manufactured in the shape of a porous scaffold.
완전히 건조된 다공성 스캐폴드는 콜라젠 성분의 가교결합을 시행하였는데, 이를 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM} 용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 스캐폴드를 제조하였다.The fully dried porous scaffold was subjected to crosslinking of collagen components. The crosslinking solution used for this was 100 mM EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol. And NHS (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid scaffold having nanostructures.
실시예3Example 3
제1공정(생체활성 유리 나노섬유 제조)First step (manufacturing bioactive glass nanofibers)
생체활성을 나타내는 유리조성으로 테트라에틸 오르토실리케이트(TEOS): 질산칼슘: 트리에틸 포스페이트 = 0.58:0.37:0.05 몰비율로 각각 100g 씩 HCl (1 N) 1g을 포함하는 물-에탄올 혼합물 (몰 비 = 1:1) 1000ml 에 첨가하여 제조된 졸 혼합물인 유리전구체를 물+에탄올에 대한 몰 비는 유리전구체/물+에탄올 = 1.00(중량대비)로 제조하고,Tetraethyl orthosilicate (TEOS): calcium nitrate: triethyl phosphate = 0.58: 0.37: 0.05 water-ethanol mixture containing 1 g of HCl (1 N) at a molar ratio of 100 g each (molar ratio = 1: 1) The glass precursor, which is a sol mixture prepared by adding to 1000 ml, of the molar ratio of water + ethanol is prepared as glass precursor / water + ethanol = 1.00 (by weight),
제조된 유리전구체인 졸 혼합물 1000ml을 24시간 교반한 후 25℃에서 24시간 및 추가로 40~70℃에서 48시간 동안 숙성한 다음, 숙성된 졸을 전기 방사중의 섬유 생성에 적합하도록 졸의 유동학적 성질을 조절하기 위하여, 10 % 폴리비닐-부티랄 (PVB) 1000ml 와 졸혼합물:PVB = 1:2~2:1의 중량대비로 혼합한 후, 졸 혼합물 10ml를 취해 주사기에 넣고, 0.5~2 kV/㎝의 DC 전기장 강도 및 0.01~1 ㎖/h의 주입 속도하에서 금속컬렉터에 주입하여 전기방사시켜 형성된 나노섬유 부직포를 600~900 ℃에서 1~6 시간 동안 공기중에서 열 처리하여 유기 공급원을 완전 제거된 생체활성 유리 나노섬유를 제조하여 준비한 다음,After stirring 1000 ml of the prepared glass precursor sol mixture for 24 hours, the mixture was aged at 25 ° C. for 24 hours and further 40 to 70 ° C. for 48 hours. In order to control the chemical properties, 1000 ml of 10% polyvinyl-butyral (PVB) and a sol mixture: PVB = 1: 2 ~ 2: 1 were mixed by weight, and then 10 ml of the sol mixture was taken into a syringe, and 0.5 ~ The nanofiber nonwoven fabric formed by electrospinning by injection into a metal collector under a DC electric field strength of 2 kV / cm and an injection rate of 0.01-1 ml / h was heat treated in air at 600-900 ° C. for 1-6 hours to provide an organic source. After preparing and preparing completely removed bioactive glass nanofibers,
2공정(나노구조 복합체의 현탁액제조)2nd step (suspension of nanostructured composite)
콜라젠 (Type I, 분자량 300,000) 0.1 g 을 산 용액 10 ml에 용해시킨 후에, 콜라젠 용액 10 ml를 천연 섬유상 구조체로 형성시키기 위해 포스페이트 완충 염수 (PBS) 50 ml 용액에 첨가한 후, 37℃에서 24 시간 동안 배양한 액과,After dissolving 0.1 g of collagen (Type I, molecular weight 300,000) in 10 ml of acid solution, 10 ml of collagen solution was added to 50 ml solution of phosphate buffered saline (PBS) to form a natural fibrous structure, followed by 24 at 37 ° C. The liquid incubated for a time,
상기 제1공정에서 제조된 생체활성 유리 나노섬유를 PBS에 분산시킨 분산액을 혼합하되, 혼합비율은 콜라젠에 들어가는 생체활성 유리 나노섬유의 양이 중량 대비 생체활성 유리 나노섬유:콜라젠 = 20:80으로 혼합하여 나노구조복합체의 현탁액을 제조하고,The dispersion of the bioactive glass nanofibers prepared in the first step is dispersed in PBS, but the mixing ratio is the amount of bioactive glass nanofibers in the collagen is bioactive glass nanofibers: collagen = 20:80 Mixing to prepare a suspension of the nanostructured composite,
제3공정(나노복합 멤브레인 형태 제조)Third Process (Manufacture of Nanocomposite Membrane Shape)
상기 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 10~20 도 자외선 멸균 분위기에서 24 시간 동안 laminar flow (층류) 내에서 건조시킨 후, -40-50 도에서 24시간 동안 동결건조기 내에서 동결 건조를 한 후, 이를 유압프레스 내에 장착한 후 500kg 의 기계적 하중을 가한 후 균일한 두께를 지니도록 만들어, 얇은 막형상인 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.20 ml of the suspension of the nanostructured composite prepared in the second step is poured into a polytetrafluoroethylene (PTFE) container designed at 50 mm x 50 mm x 10 mm, and laminar for 24 hours in a 10-20 degree UV sterilization atmosphere. After drying in the flow (laminar flow), freeze-drying in the lyophilizer for 24 hours at -40-50 degrees, it was mounted in a hydraulic press and subjected to a mechanical load of 500 kg to have a uniform thickness. A hybrid membrane having a thin film nanostructure was prepared.
완전히 건조된 멤브레인은 콜라젠 성분의 가교결합을 시행하였는데, 이를 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM}용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.The fully dried membrane was subjected to crosslinking of collagen components. The crosslinking solution used was 100 mM of EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol and NHS. (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid membrane having a nanostructure.
제4공정 (다공성 스캐폴드 형태 제조)4th process (made of porous scaffold type)
상기 실시예3의 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 취해 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 이를 -70℃의 순간 냉동기 내에서 급냉시킨 후 -40-50 도 온도로 72 시간 동안 동 결 건조기 내에서 동결건조처리를 하였다. 이 과정 중 잔류하는 용액이 완전히 없어지고, 생체활성유리 나노섬유 - 콜라젠 나노복합체 내부에 다량의 기공들이 생겨나서, 나노구조복합체는 다공성 스캐폴드의 형상으로 제작된다.20 ml of the suspension of the nanostructured composite prepared in the second step of Example 3 was taken and poured into a polytetrafluoroethylene (PTFE) container designed to be 50 mm x 50 mm x 10 mm, which was instantaneous freezer at -70 ° C. After quenching in the freeze-drying was carried out in a freeze dryer for 72 hours at a temperature of -40-50 degrees. During this process, the remaining solution is completely eliminated, and a large amount of pores are generated inside the bioactive glass nanofiber-collagen nanocomposite, so that the nanostructured composite is manufactured in the shape of a porous scaffold.
완전히 건조된 다공성 스캐폴드는 콜라젠 성분의 가교결합을 시행하였는데, 이를 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM} 용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 스캐폴드를 제조하였다.The fully dried porous scaffold was subjected to crosslinking of collagen components. The crosslinking solution used for this was 100 mM EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol. And NHS (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid scaffold having nanostructures.
실시예4Example 4
제1공정(생체활성 유리 나노섬유 제조)First step (manufacturing bioactive glass nanofibers)
생체활성을 나타내는 유리조성으로 테트라에틸 오르토실리케이트(TEOS): 질산칼슘: 트리에틸 포스페이트 = 0.58:0.37:0.05 몰비율로 각각 100g 씩 HCl (1 N) 1g을 포함하는 물-에탄올 혼합물 (몰 비 = 1:1) 1000ml 에 첨가하여 제조된 졸 혼합물인 유리전구체를 물+에탄올에 대한 몰 비는 유리전구체/물+에탄올 = 1.00(중량대비)로 제조하고,Tetraethyl orthosilicate (TEOS): calcium nitrate: triethyl phosphate = 0.58: 0.37: 0.05 water-ethanol mixture containing 1 g of HCl (1 N) at a molar ratio of 100 g each (molar ratio = 1: 1) The glass precursor, which is a sol mixture prepared by adding to 1000 ml, of the molar ratio of water + ethanol is prepared as glass precursor / water + ethanol = 1.00 (by weight),
제조된 유리전구체인 졸 혼합물 1000ml을 24 시간 교반한 후 25℃에서 24시간 및 추가로 40~70℃에서 48시간 동안 숙성한 다음, 숙성된 졸을 전기 방사중의 섬유 생성에 적합하도록 졸의 유동학적 성질을 조절하기 위하여, 10 % 폴리비닐-부티랄 (PVB) 1000ml 와 졸혼합물:PVB = 1:2~2:1의 중량대비로 혼합한 후, 졸 혼합물 10ml를 취해 주사기에 넣고, 0.5~2 kV/㎝의 DC 전기장 강도 및 0.01~1 ㎖/h의 주입 속도하에서 금속컬렉터에 주입하여 전기방사시켜 형성된 나노섬유 부직포를 600~900 ℃에서 1~6 시간 동안 공기중에서 열 처리하여 유기 공급원을 완전 제거된 생체활성 유리 나노섬유를 제조하여 준비한 다음,After stirring 1000 ml of the prepared glass precursor sol mixture for 24 hours, the mixture was aged at 25 ° C. for 24 hours and further at 40 to 70 ° C. for 48 hours. In order to control the chemical properties, 1000 ml of 10% polyvinyl-butyral (PVB) and a sol mixture: PVB = 1: 2 ~ 2: 1 were mixed by weight, and then 10 ml of the sol mixture was taken into a syringe, and 0.5 ~ The nanofiber nonwoven fabric formed by electrospinning by injection into a metal collector under a DC electric field strength of 2 kV / cm and an injection rate of 0.01-1 ml / h was heat treated in air at 600-900 ° C. for 1-6 hours to provide an organic source. After preparing and preparing completely removed bioactive glass nanofibers,
제2공정((나노구조 복합체의 현탁액제조)2nd process ((Suspension of nano structure composite)
콜라젠 (Type I, 분자량 300,000) 0.1 g 을 산 용액 10 ml에 용해시킨 후에, 콜라젠 용액 10 ml를 천연 섬유상 구조체로 형성시키기 위해 포스페이트 완충 염수 (PBS) 50 ml 용액에 첨가한 후, 37℃에서 24 시간 동안 배양한 액과,After dissolving 0.1 g of collagen (Type I, molecular weight 300,000) in 10 ml of acid solution, 10 ml of collagen solution was added to 50 ml solution of phosphate buffered saline (PBS) to form a natural fibrous structure, followed by 24 at 37 ° C. The liquid incubated for a time,
상기 제1공정에서 제조된 생체활성 유리 나노섬유를 PBS에 분산시킨 분산액을 혼합하되, 혼합비율은 콜라젠에 들어가는 생체활성 유리 나노섬유의 양이 중량대비 생체활성 유리 나노섬유;콜라젠 = 40:60으로 혼합하여 나노구조복합체의 현탁액을 제조하고,Mix the dispersion obtained by dispersing the bioactive glass nanofibers prepared in the first step in PBS, the mixing ratio is the amount of bioactive glass nanofibers into the collagen bioactive glass nanofibers by weight; collagen = 40:60 Mixing to prepare a suspension of the nanostructured composite,
제3공정(나노복합 멤브레인 형태 제조)Third Process (Manufacture of Nanocomposite Membrane Shape)
상기 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 10~20 도 자외선 멸균 분위기에서 24 시간 동안 laminar flow (층류) 내에서 건조시킨 후, -40-50 도에서 24시간 동안 동결건조기 내에서 동결 건조를 한 후, 이를 유압프레스 내에 장착한 후 500kg 의 기계적 하중을 가한 후 균일한 두께를 지니도록 만들어, 얇은 막형상인 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.20 ml of the suspension of the nanostructured composite prepared in the second step is poured into a polytetrafluoroethylene (PTFE) container designed at 50 mm x 50 mm x 10 mm, and laminar for 24 hours in a 10-20 degree UV sterilization atmosphere. After drying in the flow (laminar flow), freeze-drying in the lyophilizer for 24 hours at -40-50 degrees, it was mounted in a hydraulic press and subjected to a mechanical load of 500 kg to have a uniform thickness. A hybrid membrane having a thin film nanostructure was prepared.
완전히 건조된 멤브레인은 콜라젠 성분의 가교결합을 시행하였는데, 이를 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM}용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 멤브레인을 제조하였다.The fully dried membrane was subjected to crosslinking of collagen components. The crosslinking solution used was 100 mM of EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol and NHS. (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid membrane having a nanostructure.
제4공정 (다공성 스캐폴드 형태 제조)4th process (made of porous scaffold type)
상기 실시예4의 제2공정에서 제조된 나노구조 복합체의 현탁액 20 ml를 취해 50 mm x 50 mm x 10 mm 로 설계한 폴리테트라플루오로에틸렌(PTFE) 용기에 붓고, 이를 -70℃의 순간 냉동기 내에서 급냉시킨 후 -40-50 도 온도로 72 시간 동안 동결 건조기 내에서 동결건조처리를 하였다. 이 과정 중 잔류하는 용액이 완전히 없어지고, 생체활성유리 나노섬유 - 콜라젠 나노복합체 내부에 다량의 기공들이 생겨나서, 나노구조복합체는 다공성 스캐폴드의 형상으로 제작된다.20 ml of the suspension of the nanostructured composite prepared in the second step of Example 4 was taken and poured into a polytetrafluoroethylene (PTFE) container designed to be 50 mm x 50 mm x 10 mm, and the freezer at -70 ° C. After quenching in the freeze-drying treatment for 72 hours at a temperature of -40-50 degrees. During this process, the remaining solution is completely eliminated, and a large amount of pores are generated inside the bioactive glass nanofiber-collagen nanocomposite, so that the nanostructured composite is manufactured in the shape of a porous scaffold.
완전히 건조된 다공성 스캐폴드는 콜라젠 성분의 가교결합을 시행하였는데, 이를 위해 사용한 가교액은 {95% 에탄올중의 EDC (1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염) 100 mM과 NHS (N-히드록시숙신이미드) 100 mM} 용액이며, 이 용액 내에서 12 시간 동안 침지 처리하여 나노구조를 지닌 하이브리드형 스캐폴드를 제조하였다.The fully dried porous scaffold was subjected to crosslinking of collagen components. The crosslinking solution used for this was 100 mM EDC (1-ethyl-3- [3-dimethylaminopropyl] carbodiimide hydrochloride) in {95% ethanol. And NHS (N-hydroxysuccinimide) 100 mM} solution, which was immersed in this solution for 12 hours to prepare a hybrid scaffold having nanostructures.
실험예1Experimental Example 1
상기 실시예1에서 제조된 생체활성 유리 나노섬유 및 이와 콜라겐의 나노복합체의 모폴로지는 주사 전자 현미경 (SEM, JSM6330F, JEOL)을 사용하여 관찰하였으며, 그 내부구조는 투과 전자 현미경 (TEM, CM20, 필립스)을 사용하여 관찰하였다.Morphology of the bioactive glass nanofibers prepared in Example 1 and the nanocomposites of collagen was observed using a scanning electron microscope (SEM, JSM6330F, JEOL), the internal structure of the transmission electron microscope (TEM, CM20, Philips) ) Was observed.
생체활성 유리 나노섬유 - 콜라겐 나노복합체의 생물학적 특성은 유사골모세포 (MG63)의 반응으로 알아보았다.The biological properties of the bioactive glass nanofiber-collagen nanocomposites were determined by the response of pseudo-osteoblasts (MG63).
이를 위해 준비한 멤브레인 및 스캐폴드 시편에 세포를 각각 2×104 및 6× 105 세포/㎖ 씩 넣어 인큐베이터에서 배양하였다. 3일 동안 배양 후 시편 위에서 성장한 세포의 모폴로지를 세포 고정 및 탈수 처리 후 FESEM를 사용하여 관찰하였다.Cells were placed in the membrane and scaffold specimens prepared for this purpose and cultured in an incubator at 2 × 104 and 6 × 105 cells / mL, respectively. Morphology of cells grown on specimens after 3 days of incubation was observed using FESEM after cell fixation and dehydration.
세포 분화능은 알칼리성 인산분해효소 (ALP) 활성을 측정하여 관찰하였다. 7 일간 배양 후, ALP 효소 반응에 의한 흡광도를 측정하여 ALP활성 농도를 얻었다. 조건 당 4 개의 반복 샘플 (n = 4)을 사용하였고, 데이터를 p < 0.05 및 p < 0.01에서의 통계적 유의도를 갖는 일방향 ANOVA 분석을 사용하여 비교분석 하였다.Cell differentiation was observed by measuring alkaline phosphatase (ALP) activity. After incubation for 7 days, the absorbance by the ALP enzyme reaction was measured to obtain an ALP activity concentration. Four replicate samples per condition (n = 4) were used and the data were compared using one-way ANOVA analysis with statistical significance at p <0.05 and p <0.01.
실험결과Experiment result
모폴로지Morphology 및 And기질화Temperament
도 2에는 본 발명의 실시 예의 공정 1인 전기방사법에 의해 제조된 생체활성 유리 나노섬유의 모폴로지를 나타내었다. 어떠한 비드(bead)도 형성하지 않고 나노 섬유를 성공적으로 생성함을 알 수 있다. 본 실시 예에 의한 생체활성 유리 나노섬유의 평균 직경은 320 ㎚ (± 87 ㎚)로 측정되었지만, 직경은 나노섬유 제조방법을 달리하여 수십~수백 나노미터 크기로 얼마든지 조절이 가능하다.Figure 2 shows the morphology of the bioactive glass nanofibers produced by the electrospinning method of step 1 of the embodiment of the present invention. It can be seen that nanofibers are produced successfully without forming any beads. The average diameter of the bioactive glass nanofibers according to the present embodiment was measured to be 320 nm (± 87 nm), but the diameter can be adjusted to any number of tens to hundreds of nanometers by varying the nanofiber manufacturing method.
이처럼 제조된 생체활성 유리 나노섬유는 실시 예에서 설명한 바와 같이 콜라겐 용액을 사용하여 하이브리드화 하였으며, 각각 다른 건조 방법을 택하여 멤브레인 및 스캐폴드 형태로 제작하였다.The bioactive glass nanofibers prepared as described above were hybridized using a collagen solution as described in the examples, and each of the different drying methods was prepared in the form of a membrane and a scaffold.
도 3에서는 본 발명의 실시 예3과 4에 의해 제조된 생체활성 유리 나노섬유 - 콜라젠의 멤브레인을 나타내었다. 나노복합체 용액을 자연 건조 후 압축하여 얻어진 막은 상당히 조밀하며, 평균 두께가 약 181 ㎛ (± 64 ㎚)이었다. 막의 표면은 도 2에서 관찰되는 바와 같이 해당 직경 (평균 320 ㎚)을 갖는 나노섬유 유리의 존재를 명백히 나타내며, 잘 분리되어 콜라겐 매트릭스내에 균일하게 분포된 것을 보여준다. 이와 같은 나노구조의 얇은 막 멤브레인 형태는 조직유도재생 멤브레인으로 그 대표적 쓰임을 찾을 수 있다.3 shows a membrane of bioactive glass nanofibers-collagen prepared by Examples 3 and 4 of the present invention. The membrane obtained by compressing the nanocomposite solution after natural drying was quite dense and had an average thickness of about 181 μm (± 64 nm). The surface of the film clearly shows the presence of nanofiber glass having the corresponding diameter (average 320 nm) as observed in FIG. 2 and shows well separated and evenly distributed in the collagen matrix. Such thin membrane-type membranes with nanostructures can be found to be representative of tissue-induced regenerative membranes.
도 4에서는 본 발명의 실시 예 4와 5에 의해 제조된 생체활성 유리 나노섬유 - 콜라젠의 다공성 스캐폴드를 나타내었다. 동결건조를 통해 얻어진 스캐폴드는 수십~수백 마이크론 크기의 기공들을 지녔으며, 멤브레인과 같이 표면에 생체활성 유리 나노섬유의 존재를 명백히 드러내고 있다.4 shows a porous scaffold of bioactive glass nanofibers-collagen prepared by Examples 4 and 5 of the present invention. Scaffolds obtained through lyophilization have pores ranging in size from tens to hundreds of microns and clearly reveal the presence of bioactive glass nanofibers on the surface as membranes.
이러한 다공체 구조의 나노복합 스캐폴드는 혈액과 영양분 공급 및 세포의 침투와 이동에 필요한 충분한 공간을 제공하기 때문에 조직재생용 지지체로서 커다란 응용을 찾을 수 있다.The nanocomposite scaffolds of this porous structure provide great space for blood and nutrient supply, as well as for cell penetration and migration, and thus find great application as a scaffold for tissue regeneration.
도 5에는 본 발명의 실시 예 3과 4에 의해 제조된 생체활성 유리 나노섬유 - 콜라젠 나노구조 복합체의 내부 미세구조를 보여주는 투과전자현미경 사진을 나타내었다. 사진에서 보는바와 같이 생체활성 유리 나노섬유는 300~400나노미터 크기이고, 콜라젠 또한 self assembly되어 이루어진 100 나노미터 크기보다 작은 수십 나노미터 크기의 잘 발달된 섬유상으로 이루어져 있다. 즉, 본 나노구조 복합체는 뼈의 유기질인 콜라젠의 self assembly 로 이루어진 나노섬유 기질에, 골 형성을 촉진할 수 있는 성분인 생체활성 유리의 무기질 나노섬유 상이 균일하게 분포된 그 동안 보고되지 않은 독특한 구조라 할 수 있다.5 is a transmission electron micrograph showing the internal microstructure of the bioactive glass nanofibers-collagen nanostructure composite prepared by Examples 3 and 4 of the present invention. As you can see in the picture, the bioactive glass nanofibers are 300-400 nanometers in size, and collagen is made up of well-developed fibrous forms of tens of nanometers smaller than 100 nanometers of self-assembled. In other words, the nanostructured composite is a unique structure that has not been reported since the nanofiber matrix consisting of self-assembly of collagen, which is an organic substance of bone, is uniformly distributed in the inorganic nanofiber phase of bioactive glass, a component capable of promoting bone formation. can do.
도 6에는 본 발염의 실시 예 3과 4에 의해 제조된 생체활성 유리 나노섬유 - 콜라젠 나노복합 멤브레인 (a,b)과 스캐폴드(c,d) 위에서 3일 동안 자라고 있는 골모세포의 형상을 잘 보여주고 있다. 멤브레인 및 스캐폴드 모두에서 세포들은 매우 활발한 성장을 보이고 있다.6 shows the shape of osteoblasts growing for 3 days on the bioactive glass nanofiber-collagen nanocomposite membranes (a, b) and scaffolds (c, d) prepared by Examples 3 and 4 of the present infection. Is showing. At both the membrane and the scaffold, the cells are showing very active growth.
도 7에는 본 발명의 실시 예 3과 4에 의해 제조된 나노복합체 멤브레인 상에서 자란 세포의 알칼리성 인산분해효소 (ALP)의 발현치를 나타내었다. 비교 샘플로서 순수한 콜라젠 멤브레인도 사용하였다. ALP는 세포의 골 형성 능력의 중요한 지표로서 간주되며, 골세포 활성 능력을 말해주는 지표로서 사용되어 왔다. 7 일간의 배양 후, 생체활성 유리 나노섬유 - 콜라겐 나노복합체 (20% 및 40% 생체활성 유리 나노섬유 모두)상의 세포는 순수한 콜라겐에 비해 훨씬 우수한 ALP발현을 보였다 (20% 생체활성 유리 나노섬유의 경우: p < 0.05 및 40% 생체활성 유리 나노섬유의 경유: p < 0.01).Figure 7 shows the expression value of alkaline phosphatase (ALP) of cells grown on the nanocomposite membrane prepared by Examples 3 and 4 of the present invention. Pure collagen membranes were also used as comparative samples. ALP is regarded as an important indicator of the bone formation ability of cells and has been used as an indicator of osteoblast activity. After 7 days of culture, the cells on the bioactive glass nanofibers-collagen nanocomposite (both 20% and 40% bioactive glass nanofibers) showed much better ALP expression than pure collagen (20% bioactive glass nanofibers). When: p <0.05 and via 40% bioactive glass nanofibers: p <0.01).
이는 세포와 반응하는 접촉 계면이 골 형성능력이 우수한 생체활성 유리의 존재로 인해 골세포를 활성화하는데 결정적인 역할을 하였기 때문이다.This is because the contact interface reacting with the cells played a decisive role in activating bone cells due to the presence of bioactive glass having good bone formation ability.
상기와 같이 본원 발명은 뼈의 유기질 성분인 콜라젠과 골의 형성을 촉진할 수 있는 무기질 성분이 나노단위로 복합화된 독특한 구조인 콜라젠 섬유 상 기질 내에 생체활성 유리의 나노섬유가 균일하게 분포된 나노구조 복합체를 제조할 수 있었으며,As described above, the present invention is a nanostructure in which nanofibers of bioactive glass are uniformly distributed in a collagen fiber-like substrate, which is a unique structure in which collagen, which is an organic component of bone, and an inorganic component that can promote bone formation, are composited in nano units. Composites could be prepared,
나노구조 복합체는 치과 및 정형외과적 구체적 응용을 위해 얇은 막 형태의 멤브레인과 매크로 기공이 잘 발달된 다공성 스캐폴드 형태로 형상화될 수 있었으며,Nanostructured composites could be shaped into porous scaffolds with well-developed membrane and macropores for dental and orthopedic specific applications.
제조된 나노구조 복합체 멤브레인과 다공성 스캐폴드는 뛰어난 골세포 반응을 보임을 실험으로 확인함으로써,By experimentally confirming that the prepared nanostructured membrane and porous scaffold exhibit excellent osteocytic response,
본 발명의 나노구조 복합체는 향 후 치과 및 정형외과적 영역의 골 재생 및 대체물질 분야에서 큰 쓰임이 있을 것으로 판단된다.The nanostructured composite of the present invention is expected to be of great use in the field of bone regeneration and replacement materials in the dental and orthopedic areas in the future.
Claims (6)
Translated fromKoreanPriority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020060131563AKR100791512B1 (en) | 2006-12-21 | 2006-12-21 | Membrane and scaffold for hybrid tissue regeneration consisting of nanostructures and their manufacturing method |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020060131563AKR100791512B1 (en) | 2006-12-21 | 2006-12-21 | Membrane and scaffold for hybrid tissue regeneration consisting of nanostructures and their manufacturing method |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR100791512B1true KR100791512B1 (en) | 2008-01-04 |
Family
ID=39216653
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020060131563AActiveKR100791512B1 (en) | 2006-12-21 | 2006-12-21 | Membrane and scaffold for hybrid tissue regeneration consisting of nanostructures and their manufacturing method |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR100791512B1 (en) |
Cited By (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101436722B1 (en)* | 2013-02-12 | 2014-09-11 | 고려대학교 산학협력단 | Method for preparing nanofibrous biopolylmer/bioactive glass hybrid scaffolds and biopolylmer/bioactive glass hybrid scaffolds prepared by the method |
| CN104324410A (en)* | 2014-09-26 | 2015-02-04 | 湖北华中医用材料有限公司 | Raw material composition of multi-component active wound repair material and preparation method |
| KR20150058844A (en)* | 2013-11-21 | 2015-05-29 | 서울대학교산학협력단 | Organic-inorganic hybrid material and method for manufacturing the same |
| KR20150103970A (en)* | 2014-03-04 | 2015-09-14 | 단국대학교 천안캠퍼스 산학협력단 | Hydrogel comprising collagen and surface-aminated nanobioactive glass |
| KR20150106329A (en)* | 2014-03-11 | 2015-09-21 | 명지대학교 산학협력단 | Composite nanofiber membrane for adsorbing lithium, method of manufacturing the same and apparatus and method for recovering lithium using the same |
| KR20160058620A (en)* | 2014-11-17 | 2016-05-25 | 경상대학교산학협력단 | Bone regeneration apparatus |
| KR20160073811A (en)* | 2014-12-17 | 2016-06-27 | 단국대학교 천안캠퍼스 산학협력단 | fibrous scaffolds containing bioactive glass nanosphere, preparation method and use thereof |
| WO2016195152A1 (en)* | 2015-06-03 | 2016-12-08 | 세원셀론텍(주) | Method for manufacturing collagen film using ultraviolet light, collagen film manufactured by using same, and biomaterial prepared using collagen film |
| US9745644B2 (en) | 2014-03-11 | 2017-08-29 | Myongji University Industry And Academia Cooperation Foundation | Composite nanofiber membrane for adsorbing lithium, method of manufacturing the same and apparatus and method for recovering lithium using the same |
| CN111617320A (en)* | 2020-04-20 | 2020-09-04 | 广州迈普再生医学科技股份有限公司 | Bone induction regeneration membrane and preparation method and application thereof |
| CN115581806A (en)* | 2022-10-18 | 2023-01-10 | 上海交通大学医学院附属第九人民医院 | 3D printing biological scaffold capable of promoting regeneration of periodontal tissues and preparation method and application thereof |
| CN116115834A (en)* | 2023-03-02 | 2023-05-16 | 宁夏医科大学总医院 | A material film of RGD+nano bioactive glass and its preparation method and application |
| CN116575184A (en)* | 2023-07-11 | 2023-08-11 | 山东森荣新材料股份有限公司 | Preparation method of polytetrafluoroethylene nanofiber membrane |
| CN119015516A (en)* | 2024-08-14 | 2024-11-26 | 成都美益博雅材料科技有限公司 | Double-layer oral repair membrane material and preparation method thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6517857B2 (en) | 1998-12-11 | 2003-02-11 | Ylaenen Heimo | Bioactive product and its use |
- 2006
- 2006-12-21KRKR1020060131563Apatent/KR100791512B1/enactiveActive
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6517857B2 (en) | 1998-12-11 | 2003-02-11 | Ylaenen Heimo | Bioactive product and its use |
Cited By (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101436722B1 (en)* | 2013-02-12 | 2014-09-11 | 고려대학교 산학협력단 | Method for preparing nanofibrous biopolylmer/bioactive glass hybrid scaffolds and biopolylmer/bioactive glass hybrid scaffolds prepared by the method |
| KR101667444B1 (en) | 2013-11-21 | 2016-10-18 | 서울대학교산학협력단 | Organic-inorganic hybrid material and method for manufacturing the same |
| KR20150058844A (en)* | 2013-11-21 | 2015-05-29 | 서울대학교산학협력단 | Organic-inorganic hybrid material and method for manufacturing the same |
| KR101629547B1 (en) | 2014-03-04 | 2016-06-10 | 단국대학교 천안캠퍼스 산학협력단 | Hydrogel comprising collagen and surface-aminated nanobioactive glass |
| KR20150103970A (en)* | 2014-03-04 | 2015-09-14 | 단국대학교 천안캠퍼스 산학협력단 | Hydrogel comprising collagen and surface-aminated nanobioactive glass |
| KR20150106329A (en)* | 2014-03-11 | 2015-09-21 | 명지대학교 산학협력단 | Composite nanofiber membrane for adsorbing lithium, method of manufacturing the same and apparatus and method for recovering lithium using the same |
| KR101691089B1 (en)* | 2014-03-11 | 2017-01-09 | 명지대학교 산학협력단 | Composite nanofiber membrane for adsorbing lithium, method of manufacturing the same and apparatus and method for recovering lithium using the same |
| US9745644B2 (en) | 2014-03-11 | 2017-08-29 | Myongji University Industry And Academia Cooperation Foundation | Composite nanofiber membrane for adsorbing lithium, method of manufacturing the same and apparatus and method for recovering lithium using the same |
| CN104324410A (en)* | 2014-09-26 | 2015-02-04 | 湖北华中医用材料有限公司 | Raw material composition of multi-component active wound repair material and preparation method |
| KR20160058620A (en)* | 2014-11-17 | 2016-05-25 | 경상대학교산학협력단 | Bone regeneration apparatus |
| US10314709B2 (en) | 2014-11-17 | 2019-06-11 | Industry-Academic Cooperation Foundation Gyeongsang National University | Bone regeneration device |
| KR101675414B1 (en) | 2014-11-17 | 2016-11-11 | 경상대학교산학협력단 | Bone regeneration apparatus |
| KR20160073811A (en)* | 2014-12-17 | 2016-06-27 | 단국대학교 천안캠퍼스 산학협력단 | fibrous scaffolds containing bioactive glass nanosphere, preparation method and use thereof |
| KR101684744B1 (en) | 2014-12-17 | 2016-12-08 | 단국대학교 천안캠퍼스 산학협력단 | fibrous scaffolds containing bioactive glass nanosphere, preparation method and use thereof |
| WO2016195152A1 (en)* | 2015-06-03 | 2016-12-08 | 세원셀론텍(주) | Method for manufacturing collagen film using ultraviolet light, collagen film manufactured by using same, and biomaterial prepared using collagen film |
| CN111617320A (en)* | 2020-04-20 | 2020-09-04 | 广州迈普再生医学科技股份有限公司 | Bone induction regeneration membrane and preparation method and application thereof |
| CN115581806A (en)* | 2022-10-18 | 2023-01-10 | 上海交通大学医学院附属第九人民医院 | 3D printing biological scaffold capable of promoting regeneration of periodontal tissues and preparation method and application thereof |
| CN115581806B (en)* | 2022-10-18 | 2024-04-23 | 上海交通大学医学院附属第九人民医院 | 3D printing biological scaffold capable of promoting periodontal tissue regeneration and preparation method and application thereof |
| CN116115834A (en)* | 2023-03-02 | 2023-05-16 | 宁夏医科大学总医院 | A material film of RGD+nano bioactive glass and its preparation method and application |
| CN116575184A (en)* | 2023-07-11 | 2023-08-11 | 山东森荣新材料股份有限公司 | Preparation method of polytetrafluoroethylene nanofiber membrane |
| CN116575184B (en)* | 2023-07-11 | 2023-09-05 | 山东森荣新材料股份有限公司 | Preparation method of polytetrafluoroethylene nanofiber membrane |
| CN119015516A (en)* | 2024-08-14 | 2024-11-26 | 成都美益博雅材料科技有限公司 | Double-layer oral repair membrane material and preparation method thereof |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100791512B1 (en) | Membrane and scaffold for hybrid tissue regeneration consisting of nanostructures and their manufacturing method | |
| Rad et al. | Fabrication and characterization of two-layered nanofibrous membrane for guided bone and tissue regeneration application | |
| Atrian et al. | Silk-Laponite® fibrous membranes for bone tissue engineering | |
| Sun et al. | Hydroxyapatite nanowire@ magnesium silicate core–shell hierarchical nanocomposite: Synthesis and application in bone regeneration | |
| Kim et al. | Production and potential of bioactive glass nanofibers as a next‐generation biomaterial | |
| Okamoto et al. | Synthetic biopolymer nanocomposites for tissue engineering scaffolds | |
| Elangomannan et al. | Carbon nanofiber/polycaprolactone/mineralized hydroxyapatite nanofibrous scaffolds for potential orthopedic applications | |
| Fu et al. | Enhanced proliferation and osteogenic differentiation of MC3T3-E1 pre-osteoblasts on graphene oxide-impregnated PLGA–gelatin nanocomposite fibrous membranes | |
| Zou et al. | Preparation and characterization of porous β-tricalcium phosphate/collagen composites with an integrated structure | |
| Tabatabaee et al. | Fabrication and characterization of PHEMA–gelatin scaffold enriched with graphene oxide for bone tissue engineering | |
| Mobika et al. | Substantial effect of silk fibroin reinforcement on properties of hydroxyapatite/silk fibroin nanocomposite for bone tissue engineering application | |
| Zhang et al. | A novel composite scaffold comprising ultralong hydroxyapatite microtubes and chitosan: preparation and application in drug delivery | |
| Yang et al. | Bioinspired porous octacalcium phosphate/silk fibroin composite coating materials prepared by electrochemical deposition | |
| Noh et al. | Composite nanofiber of bioactive glass nanofiller incorporated poly (lactic acid) for bone regeneration | |
| Narimani et al. | Synthesis, characterization and biocompatible properties of novel silk fibroin/graphene oxide nanocomposite scaffolds for bone tissue engineering application | |
| Akiyama et al. | Tubular nanomaterials for bone tissue engineering | |
| Zhu et al. | Fabrication and characterization of bioactive silk fibroin/wollastonite composite scaffolds | |
| Ghomi et al. | A novel investigation on characterization of bioactive glass cement and chitosan-gelatin membrane for jawbone tissue engineering | |
| WO2008075824A1 (en) | Bioactive glass nanofibers and method of manufacturing the same | |
| WO2007115388A1 (en) | A composite comprising collagen and carbon nanotubes, process of produing same and uses thereof | |
| Kim et al. | Preparation of a porous chitosan/fibroin-hydroxyapatite composite matrix for tissue engineering | |
| Kandel et al. | A bimetallic load-bearing bioceramics of TiO2@ ZrO2 integrated polycaprolactone fibrous tissue construct exhibits anti bactericidal effect and induces osteogenesis in MC3T3-E1 cells | |
| KR100889593B1 (en) | Heteropolymer of biopolymer and bioceramic and preparation method thereof | |
| KR101047897B1 (en) | Protein-bound bioactive glass nanofibers and preparation method thereof | |
| Zhang et al. | Preparation of chitosan/hydroxyapatite guided membrane used for periodontal tissue regeneration |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| PA0109 | Patent application | Patent event code:PA01091R01D Comment text:Patent Application Patent event date:20061221 | |
| PA0201 | Request for examination | ||
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | Patent event code:PE07011S01D Comment text:Decision to Grant Registration Patent event date:20070927 | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | Comment text:Registration of Establishment Patent event date:20071227 Patent event code:PR07011E01D | |
| PR1002 | Payment of registration fee | Payment date:20071228 End annual number:3 Start annual number:1 | |
| PG1601 | Publication of registration | ||
| PR1001 | Payment of annual fee | Payment date:20101222 Start annual number:4 End annual number:4 | |
| PR1001 | Payment of annual fee | Payment date:20111031 Start annual number:5 End annual number:5 | |
| FPAY | Annual fee payment | Payment date:20121025 Year of fee payment:6 | |
| PR1001 | Payment of annual fee | Payment date:20121025 Start annual number:6 End annual number:6 | |
| FPAY | Annual fee payment | Payment date:20140102 Year of fee payment:7 | |
| PR1001 | Payment of annual fee | Payment date:20140102 Start annual number:7 End annual number:7 | |
| FPAY | Annual fee payment | Payment date:20141027 Year of fee payment:8 | |
| PR1001 | Payment of annual fee | Payment date:20141027 Start annual number:8 End annual number:8 | |
| FPAY | Annual fee payment | Payment date:20151223 Year of fee payment:9 | |
| PR1001 | Payment of annual fee | Payment date:20151223 Start annual number:9 End annual number:9 | |
| FPAY | Annual fee payment | Payment date:20161024 Year of fee payment:10 | |
| PR1001 | Payment of annual fee | Payment date:20161024 Start annual number:10 End annual number:10 | |
| FPAY | Annual fee payment | Payment date:20180412 Year of fee payment:11 | |
| PR1001 | Payment of annual fee | Payment date:20180412 Start annual number:11 End annual number:11 | |
| FPAY | Annual fee payment | Payment date:20181211 Year of fee payment:12 | |
| PR1001 | Payment of annual fee | Payment date:20181211 Start annual number:12 End annual number:12 | |
| FPAY | Annual fee payment | Payment date:20191202 Year of fee payment:13 | |
| PR1001 | Payment of annual fee | Payment date:20191202 Start annual number:13 End annual number:13 | |
| PR1001 | Payment of annual fee | Payment date:20201214 Start annual number:14 End annual number:14 | |
| PR1001 | Payment of annual fee | Payment date:20211214 Start annual number:15 End annual number:15 | |
| PR1001 | Payment of annual fee | Payment date:20221227 Start annual number:16 End annual number:16 | |
| PR1001 | Payment of annual fee | Payment date:20241211 Start annual number:18 End annual number:18 |