KR100696236B1 - Production method of antithrombotic antibody - Google Patents
Production method of antithrombotic antibodyDownload PDFInfo
- Publication number
- KR100696236B1 KR100696236B1KR1020050026811AKR20050026811AKR100696236B1KR 100696236 B1KR100696236 B1KR 100696236B1KR 1020050026811 AKR1020050026811 AKR 1020050026811AKR 20050026811 AKR20050026811 AKR 20050026811AKR 100696236 B1KR100696236 B1KR 100696236B1
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- serum
- culture
- cells
- medium
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
- A—HUMAN NECESSITIES
- A47—FURNITURE; DOMESTIC ARTICLES OR APPLIANCES; COFFEE MILLS; SPICE MILLS; SUCTION CLEANERS IN GENERAL
- A47G—HOUSEHOLD OR TABLE EQUIPMENT
- A47G1/00—Mirrors; Picture frames or the like, e.g. provided with heating, lighting or ventilating means
- A47G1/16—Devices for hanging or supporting pictures, mirrors, or the like
- A47G1/17—Devices for hanging or supporting pictures, mirrors, or the like using adhesives, suction or magnetism
Landscapes
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Translated fromKoreanDescription
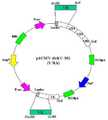
Translated fromKorean도 1은 항혈전 항체 발현 벡터 pdCMV-dhfrC-310의 맵을 나타낸 그림이다.1 is a diagram showing a map of the anti-thrombotic antibody expression vector pdCMV-dhfrC-310.
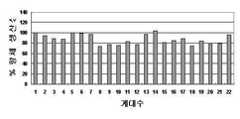
도 2는 MTX 존재 하에서 제조용 세포은행의 항체 생산 안정성을 나타낸 그래프이다.Figure 2 is a graph showing the antibody production stability of the cell bank for preparation in the presence of MTX.
도 3은 MTX 부재 하에서 제조용 세포은행의 항체 생산 안정성을 나타낸 그래프이다.3 is a graph showing the antibody production stability of the cell bank for preparation in the absence of MTX.
도 4는 pH에 따른 항혈전 항체의 생산량의 차이를 나타낸 그래프이다.Figure 4 is a graph showing the difference in the production of anti-thrombotic antibodies according to pH.
도 5는 배양기간 중 자동 제어와 수동 제어 시 배지의 pH 변화를 나타낸 그래프이다.5 is a graph showing the pH change of the medium during the automatic control and manual control during the culture period.
도 6은 pH의 자동 및 수동 적정이 항혈전 항체의 생산성에 미치는 영향을 나타낸 그래프이다.6 is a graph showing the effect of automatic and manual titration of pH on the productivity of antithrombotic antibodies.
본 발명은 항혈전 항체를 pH 7.3 내지 7.5의 무혈청 배지에서 부유 배양하여 항혈전 항체를 생산하는 방법에 관한 것이다.The present invention relates to a method of producing anti-thrombotic antibodies by floating culture of anti-thrombotic antibodies in serum-free medium at pH 7.3 to 7.5.
혈액은 정상적인 혈관 안에서는 액체 상태로 있어야 하고, 혈관의 상처부위에서는 빨리 응고하여 손상된 혈관으로부터의 혈액손실을 중단하여 항상성을 유지해야 한다. 정상 상태에서는 혈관 내 혈전 (thrombus)이 생기면 혈전 용해작용이 활성화되어 유동성을 회복하게 되며, 혈전이 생기는 것과 혈전이 생기는 것을 막는 기전의 균형이 여러 요인으로 인해 깨어나게 되어 정상 지혈 기전의 병리적 현상으로 나타나는 것이 혈전증 (thrombosis)이다. 혈전증은 혈액이 생체의 심혈관계 내에서 응고된 덩어리를 형성하는 것을 말하며, 그 혈액응고 덩어리를 혈전이라 한다. 큰 혈관이 파열되든가 또는 손상을 받았을 때 혈액이 자발적으로 응고하는 현상은 더 이상의 출혈을 방지하여 생명을 구하는 중요한 과정이다. 그러나 파열되지 않은 심맥관계 내 혈전의 형성은 생명을 위협할 수도 잇다. 즉, 파열되지 않은 심맥관계 내에서 혈전이 생기면 혈류감소 또는 차단으로 장기나 조직에 허혈성 손상을 유발하고, 혈전의 일부 또는 전부가 떨어져 나와 그 부서진 혈전이 색전 (embolism)을 형성한다. 심장질환 중 일부 질환이나 심장에 인공 물질을 삽입한 경우는 혈전이 잘 형성되게 되는데 이렇게 생겨난 혈전은 마비 등의 합병증이 발생하기 쉬워 이를 예방하기 위하여 항혈전제가 필요하다.Blood must be in a liquid state within normal blood vessels, and coagulate quickly in the wounds of blood vessels to stop blood loss from damaged blood vessels and maintain homeostasis. In the normal state, when a blood vessel in the blood vessel (thrombus) occurs, the thrombolytic action is activated to restore fluidity, and the balance between the formation of the blood clot and the mechanism of preventing the blood clot wakes up due to various factors, so that the pathological phenomenon of the normal hemostatic mechanism It is known as thrombosis. Thrombosis refers to the formation of solidified mass in the cardiovascular system of a living body, and the blood clot mass is called a thrombus. The spontaneous coagulation of blood when large vessels are ruptured or damaged is an important process that saves lives by preventing further bleeding. However, the formation of blood clots in the unbroken cardiovascular system can be life threatening. That is, when a blood clot is formed in an unruptured cardiovascular system, ischemic damage is caused to organs or tissues by blood flow reduction or blockage, and some or all of the blood clots fall off to form embolism. Some diseases of the heart disease or artificial substances inserted into the heart, the blood clot is formed well. Thus, the resulting blood clots are prone to complications such as paralysis, anti-thrombotic drugs are needed to prevent this.
혈소판이 활성화되어 혈소판끼리 접착하여 큰 응집덩어리를 형성하는 (혈소판응집) 기전은 막 표면에 분포하는 GPⅡbⅢa (glycoprotein ⅡbⅢa) 분자가 혈장 중이나 혈소판에서 방출된 피브리노겐 (fibrinogen) 또는 vWF (von Willerbrand Factor)와 결합하고 그것들이 중개역할을 하여 GPⅡbⅢa-피브리노겐 (또는 vWF)―GPⅡbⅢa 3자 복합체가 형성되는 것에 의한다.The mechanism by which platelets are activated and platelets adhere to each other to form large aggregates (platelet aggregation) is characterized by the fact that GPIIbIIIa (glycoprotein IIbIIIa) molecules, which are distributed on the membrane surface, are associated with fibrinogen or vWF (von Willerbrand Factor) released from the platelets. By binding and they act as an intermediary to form a GPIIbIIIa-fibrinogen (or vWF) -GPIIbIIIa trivalent complex.
상기한 바와 같은 복합체의 형성을 억제할 수 있는 물질로서 항혈전 항체가 사용될 수 있으며, 이러한 항혈전 항체는 이를 발현하는 벡터로 형질전환(transfection)된 세포를 배양함으로써 배양물 중에 포함된 항체를 분리하여 대량 생산할 수 있다.An antithrombotic antibody may be used as a substance capable of inhibiting the formation of a complex as described above, and the antithrombotic antibody isolates the antibody contained in the culture by culturing cells transfected with the vector expressing it. Mass production.
재조합 단백질을 인체 치료 목적의 의약품으로 사용하기 위해서는 인간 세포와 유사한 성질을 갖는 동물세포를 사용하여 재조합 단백질을 생산하는 것이 가장 효율적으로 알려져 있고, 현재 대부분의 재조합 단백질 치료제는 동물세포 배양을 통해 생산된다. 대부분의 동물세포는 소 태아의 혈청 (fetal bovine serum; FBS)이 존재하는 환경에서 매우 활발히 증식하는데 최근 광우병 등의 문제가 심각하게 제기되면서 미국식품의약국 (Food and Drug Administration; FDA) 등 허가기관은 의약품 단백질 생산을 위한 동물세포의 배양에서 혈청을 제거할 것을 강력히 권장하고 있다.In order to use recombinant protein as a medicine for human treatment, it is most efficient to produce recombinant protein using animal cells having properties similar to those of human cells. Currently, most recombinant protein therapeutics are produced through animal cell culture. . Most animal cells multiply very actively in the presence of fetal bovine serum (FBS). Recently, due to serious problems such as mad cow disease, licensed agencies such as the US Food and Drug Administration (FDA) Strongly recommends removing serum from the culture of animal cells for drug protein production.
동물 세포 배양 시 혈청 배지의 사용이 일반적이나 상기한 바와 같은 동물 유래 인자에 의한 오염, 비용 등의 문제를 해결하고자 무혈청 배지의 이용을 시도하고 있으나, 통상적으로 종균 배양은 혈청 배지에서 수행한 후 본 배양 시 단계적인 무혈청 배지로의 전환을 시도하고 있다. 그러나 단계적 무혈청 배지로의 전환에서도 혈청 배지의 오염 문제를 완전히 배제할 수 없기 때문에 종균 배양 단계에서 무혈청 배양이 가능하다면 상기한 문제를 해소할 수 있을 것이다.Serum medium is generally used in culturing animal cells, but attempts to use serum-free medium to solve problems such as contamination and cost caused by animal-derived factors as described above. Attempts to switch to a serum-free medium in this culture are attempted. However, even when switching to a serum-free medium, the contamination of the serum medium cannot be completely ruled out. Therefore, if the serum-free culture is possible in the seed culture step, the above problem can be solved.
현재, 의학적 사용에 적합하게 고도로 순수하고, 다른 미생물 또는 불순물로의 오염 염려가 없으며, 배양 세포가 안정한 생산능을 나타내는 항혈전 항체의 제조 방법이 절실히 요구되고 있다.At present, there is an urgent need for a method for producing an antithrombotic antibody, which is highly pure for medical use, free from contamination by other microorganisms or impurities, and in which cultured cells exhibit stable production capacity.
본 발명자는 항혈전 항체를 발현할 수 있는 발현벡터로 형질전환된 진핵세포를 pH를 7.4로 조절한 무혈청 배지에서 부유 배양으로 적응시켜 종균 배양한 후 이렇게 적응된 세포를 직접 본 배양에서 부유 배양하여, 혈청으로의 오염 없이 안정적인 항혈전 항체의 생산을 확인함으로써 본 발명을 완성하였다.The present inventors adapted to eukaryotic cells transformed with an expression vector capable of expressing anti-thrombotic antibodies in suspension-free culture in a serum-free medium having a pH of 7.4, followed by spawn culture, and then directly adapted to the cells in suspension culture. Thus, the present invention was completed by confirming the production of a stable anti-thrombotic antibody without contamination with serum.
따라서 본 발명의 목적은 항혈전 항체를 무혈청 배지에서 부유식 유가 배양하는 방법을 제공하는 것이다.Accordingly, it is an object of the present invention to provide a method for cultivating anti-thrombotic antibodies in floating milk culture in serum-free medium.
하나의 양태로서, 본 발명은 항혈전 항체를 발현하는 진핵세포를 pH 7.3 내지 7.5의 무혈청 배지에서 부유 배양하는 항혈전 항체의 생산방법에 관한 것이다.In one embodiment, the present invention relates to a method for producing antithrombotic antibodies by suspension culture of eukaryotic cells expressing antithrombotic antibodies in a serum-free medium of pH 7.3 to 7.5.
구체적 양태에서, 본 발명의 생산 방법은 항혈전 항체를 발현하는 진핵 세포를 pH 7.3 내지 7.5의 무혈청 부유 배양으로 종균 배양하는 단계; 및 상기 단계의 종균 배양물을 pH 7.3 내지 7.5의 무혈청 부유 배양으로 본 배양하는 단계를 포함한다.In a specific embodiment, the production method of the present invention comprises the steps of culturing the eukaryotic cells expressing the antithrombotic antibody in a serum-free floating culture of pH 7.3 to 7.5; And main culture of the seed culture of the above step in a serum-free floating culture of pH 7.3 to 7.5.
상기한 항혈전 항체를 발현하는 진핵세포는, 항혈전 항체를 발현하는 벡터로 형질전환된 세포이다.Eukaryotic cells expressing the above antithrombotic antibodies are cells transformed with a vector expressing the antithrombotic antibody.
바람직한 양태에서, 항혈전 항체를 발현하는 진핵 세포는 차이니즈 햄스터 난소 세포주 (Chinese Hamster Ovary; CHO)이다.In a preferred embodiment, the eukaryotic cell expressing the antithrombotic antibody is a Chinese Hamster Ovary (CHO).
차이니즈 햄스터 난소 세포주 CHO는 FDA로부터 안정성과 효용성이 승인된 재조합 단백질 생산의 숙주 동물세포로서 가장 널리 사용된다. CHO 세포가 숙주세포로 널리 사용된 주된 이유는 첫째, 소아마비 (Polio), B형 간염 (Hepatitis B), 인체면역결핍 바이러스 (Human Immunodeficiency Virus), 홍역 (Measles), 아데노바이러스 (Adenovirus) 등의 인간에 해로운 바이러스가 CHO 세포에서는 복제가 안 되어 안전하고, 둘째, 부착 배양뿐만 아니라 부유 배양이 가능하여 대량 배양이 용이하며, 셋째, 무혈청 배지에서 다른 세포에 비하여 상대적으로 고농도 배양이 가능하며, 넷째, 효율적인 유전자 증폭 시스템이 있어 미생물에 비해 낮은 동물세포주의 단위 세포당 생산성을 높일 수 있으며, 다섯째, 단백질의 번역 후 수정과정 (post translational modification), 즉 글리코실화 (glycosylation) 과정이나 인산화 (phosphorylation) 과정이 인간세포와 유사하다는 장점이 있다.The Chinese hamster ovary cell line CHO is most widely used as a host animal cell for recombinant protein production, which has been approved by the FDA for its stability and utility. The main reasons for the widespread use of CHO cells as host cells are: humans such as polio, hepatitis B, human immunodeficiency virus, measles and adenovirus, etc. It is safe because harmful viruses are not replicated in CHO cells. Second, it is easy to mass cultivate because it is possible to float culture as well as adherent culture. Third, relatively high concentration culture is possible compared to other cells in serum-free medium. In addition, efficient gene amplification system can increase productivity per unit cell of animal cell line lower than that of microorganism. Fifth, post translational modification of protein, that is, glycosylation or phosphorylation process. It has the advantage of being similar to this human cell.
재조합 단백질의 발현량을 증가시키기 위해 CHO 세포의 디히드로폴레이트 리덕타제 (dihydrofolate reductase: DHFR) 효소 유전자의 일부를 결손시킨 변이주인 DHFR- CHO 세포주 (예: CHO-DG44)가 숙주세포로서 자주 널리 이용된다. 본 발명의 구체적 실시에서는 CHO-DG44를 사용하였으며, 이 세포주에 DHFR과 항체 유전자를 포함하는 발현벡터를 도입한 후 DHFR 효소의 기질 저해제인 메토트렉세이트 (methotrexate; MTX)를 낮은 농도에서 높은 농도로 점차적으로 높여주었다. MTX의 세포독성에 저항성을 갖도록 DHFR 유전자의 증폭을 유도하면 함께 도입된 항체 유전자도 함께 증폭되기 때문에 고생산성 세포주를 최종단계에서 한계희석 (limiting dilution) 방법으로 선별할 수 있다.The DHFR-CHO cell line (e.g. CHO-DG44), which is a variant that lacks a part of the dihydrofolate reductase (DHFR) enzyme gene of CHO cells to increase the expression level of recombinant protein, is widely used as a host cell. Is used. In the specific embodiment of the present invention, CHO-DG44 was used, and after introducing an expression vector including DHFR and antibody genes into the cell line, a method of inhibiting methotrexate (MTX), a substrate inhibitor of DHFR enzyme, was gradually performed at a low concentration and at a high concentration. Raised. Inducing amplification of the DHFR gene to resist cytotoxicity of MTX also amplifies the antibody genes introduced together, so high-productivity cell lines can be selected at the end by limiting dilution.
상기한 항혈전 항체를 발현하는 벡터는 항혈전 항체를 코딩하는 유전자가 삽입된 플라스미드 벡터일 수 있다.The vector expressing the anti-thrombotic antibody may be a plasmid vector into which a gene encoding the anti-thrombotic antibody is inserted.
바람직한 양태에서, 항혈전 항체를 발현하는 진핵세포는 도 1에 도시된 pdCMV-dhfrC-301 발현 벡터로 형질전환된 CHO 세포이다.In a preferred embodiment, the eukaryotic cells expressing antithrombotic antibodies are CHO cells transformed with the pdCMV-dhfrC-301 expression vector shown in FIG. 1.
구체적 실시에서 항혈전 항체를 발현시키는 플라스미드 벡터 pdCMV-dhfrC-7E3(도 1)을 사용하여 CHO 세포를 형질전환시켜 완전한 형태의 IgG 항혈전 항체를 발현하는 재조합 세포 은행을 제조하였다. 이 재조합 세포 은행으로부터 생산된 항체를 파파인 처리한 항체 단편이 항혈전 항체 ISU301이다.In a specific run, a plasmid vector pdCMV-dhfrC-7E3 (FIG. 1) expressing an antithrombotic antibody was used to transform CHO cells to prepare a recombinant cell bank expressing a complete form of IgG antithrombotic antibody. The antibody fragment which papain-treated the antibody produced from this recombinant cell bank is anti-thrombotic antibody ISU301.
항혈전 항체 ISU301은 혈전 생성에 관여하는 당단백질 ⅡbⅢa (glycoprotein ⅡbⅢa; GPⅡbⅢa)에 대한 항체 절편으로서 가변영역의 염기서열은 7E3 항체 (ATCC HB8832)와 동일한 서열을 가지며 불변영역의 염기서열은 인간 면역글로불린 IgG1 (감마 1 중쇄영역과 카파 경쇄영역 포함)과 동일한 서열을 가지고 파파인 처리 공정에 의해 제조된다. ISU301은 피브리노겐, vWF 및 다른 부착 분자들이 활성화된 혈소판 내 GPⅡbⅢa에 결합하는 것을 방지하여 혈소판 응집을 억제한다. ISU301은 투명, 무색, 멸균, 비발열성의 정맥 주사용 용액으로 투여할 수 있으며, 분자량 47kDa의 Fab 절편이다. ISU301은 GPⅡbⅢa 결합 부위의 RGD에는 직접적으로 결합하지 않으나 피브리노겐과 vWF의 접근을 억제하는 입체적 장애 및/ 또는 구조적 효 과와 관련이 있다.Antithrombotic antibody ISU301 is an antibody fragment against glycoprotein IIbIIIa (GPIIbIIIa) that is involved in thrombus generation. The base sequence of the variable region has the same sequence as that of the 7E3 antibody (ATCC HB8832) and the constant sequence of the human immunoglobulin Prepared by papain treatment with the same sequence as IgG1 (including
ISU301은 관동맥 혈관 확장술 (Percutaneous Transluminal Coronary Angioplasty; PTCA) 시술 중이나 시술 후에 급작스럽게 발생하는 허혈성 심합병증이나 재협착을 방지할 목적으로 급성혈관 혈전증의 High-risk환자들에게 사용할 수 있다. PTCA 시술에 있어서 항혈소판제의 사용은 매우 중요하다. 그 이유는 PTCA 시술 중이나 시술 후에 급작스럽게 발생하는 협착(closure)이나 허혈성 심합병증을 방지해주기 때문인데, 이러한 협착 등의 증상은 시술중이나 시술 후의 심각한 부작용을 일으켜 죽음이나 심근경색(myocardial infarction)을 일으킬 수 있기 때문이다.ISU301 may be used in high-risk patients with acute vascular thrombosis to prevent ischemic heart complications or restenosis that occur suddenly during or after Percutaneous Transluminal Coronary Angioplasty (PTCA). The use of antiplatelet agents in the PTCA procedure is very important. The reason for this is to prevent sudden stenosis or ischemic cardiomyopathy during or after the PTCA procedure, which can cause serious side effects during and after the procedure, leading to death or myocardial infarction. Because it can.
ISU301을 0.25㎎/㎏의 일시 정맥주입 후 12시간에서 96시간 동안의 10㎍/min의 연속 정맥 주입으로 대부분의 환자에게서 지속적이고 강력한 GPⅡbⅢa 수용체 차단효과를 80% 이상으로 보이며, 5mM과 20mM 사이의 ADP에 대한 시험관 내 (Ex vivo) 혈소판 응집효과가 기준선 (Baseline)의 20% 이하로 나타났으며, 출혈시간(bleeding time)이 30분 이상으로 증가된 효과를 보이는 등 혈소판의 응고 저해효과가 뚜렷하게 나타난다. 손상된 혈관 부위에서의 혈소판 응집 및 혈전은 성공적인 PTCA 시술 후 및 혈전 용해 후의 불안정한 협심증 (Unstable Angina), 심근경색증, 재폐색 발생에 중요한 유발 인자이다. 특히 ISU301은 고위험군의 환자와 당뇨병 환자에게 우선적으로 선택되어지고 있으며, 급성 심근 경색 (Acute Myocardial Infarction; AMI) 환자와 특히 허혈성 뇌경색(Ischemic Stoke) 환자에게로 치료영역이 확대될 수 있다.Continuous intravenous infusion of 10 μg / min between 12 and 96 hours after 0.25 mg / kg transient intravenous infusion of ISU301 resulted in sustained and strong GPIIbIIIa receptor blocking effects of more than 80% in most patients, between 5 and 20 mM. Ex vivo platelet aggregation effect on ADP was less than 20% of baseline, and platelet coagulation inhibitory effect was obvious, such as bleeding time increased to more than 30 minutes. appear. Platelet aggregation and thrombi at damaged vascular sites are important triggers for the development of unstable angina, myocardial infarction, and re-obstruction after successful PTCA procedures and after thrombolysis. In particular, ISU301 is preferentially selected for high-risk patients and diabetic patients, and can be extended to Acute Myocardial Infarction (AMI) patients and especially Ischemic Stoke patients.
바람직한 양태에서, 무혈청 배지의 pH는 약 7.4로 조절한다. 이러한 pH는 일반적인 세포 배양에 이용되는 적정 pH인 6.8 보다 높은 것으로, 도 4에 도시된 바와 같이 pH 6.8 및 pH 7.1에서 배양한 것보다 pH 7.4에서 배양한 결과 항체 역가가 가장 높게 나타났다.In a preferred embodiment, the pH of the serum free medium is adjusted to about 7.4. This pH is higher than 6.8, which is a proper pH used for general cell culture, and as shown in FIG. 4, the antibody titer was highest when cultured at pH 7.4 than at pH 6.8 and pH 7.1.
한편, 상기한 범위의 pH를 조절하는 방식으로, 자동 제어 및 수동 제어를 이용하였으며, 자동 제어에 비해 1일 2회 염기를 첨가하는 방식의 수동 제어가 보다 높은 항체 역가를 나타내었다 (도 6). 이를 토대로 할 때, pH 제어를 위한 염기의 첨가는 1일 수회, 바람직하게는 2 내지 10회, 보다 바람직하게는 1.5 내지 5회, 가장 바람직하게는 2회 수행한다.On the other hand, in the manner of adjusting the pH of the above range, automatic control and manual control was used, and the manual control of the method of adding a base twice a day showed higher antibody titers than the automatic control (FIG. 6). . Based on this, the addition of a base for pH control is carried out several times a day, preferably 2 to 10 times, more preferably 1.5 to 5 times and most preferably twice.
선별된 세포주를 이용하여 항체를 산업적으로 대량 생산하기 위해선 무혈청 배지의 사용과 부유 배양이 필수적이다. 일반적으로 대량생산을 위한 무혈청 배양에서는 혈청함유 배지에서 일정 농도로 자라게 하는 종균배양 단계와 종균배양을 무혈청 배지로 옮겨 배양하는 본 배양 단계로 구성되어진다.The use of serum-free media and suspension culture are essential for the industrial mass production of antibodies using selected cell lines. In general, serum-free culture for mass production consists of a seed culture step of growing to a certain concentration in a serum-containing medium and the main culture step of transferring the seed culture to a serum-free medium.
그러나 본 발명의 항혈전 항체의 생산 방법은 상기한 바와 같이 pH를 7.3 내지 7.5로 조절하면서 종균 배양 및 본 배양 모두를 무혈청 배지에서 수행한다는 것이 특징적이다. 종래의 진핵세포의 배양법이 종균 배양단계에서는 혈청 함유 배지를 이용하다가 본 배양 단계에 가서 단계적으로 무혈청 배지로 전환시키는 배양법인 것에 비해, 본 발명은 종균 배양 단계에서 상기한 항혈전 항체를 발현하는 진핵세포를 상기한 pH 범위에서 무혈청 배양에 적응시키는 종균 배양 단계를 거쳐 이를 무혈청 본 배양에 적용하였다. 그럼에도 불구하고, 도 2 및 도 3에 나타난 바와 같이 약 90일간의 배양 시에도 항체 생산성이 초기 생산성의 90 ± 10% 수준을 유지하였다. 이는 항체 생산의 배양기간이 통상 30일임을 고려할 때, 항혈전 항체의 생산 세포주가 안정적으로 배양할 수 있다는 것을 나타낸다.However, the anti-thrombotic antibody production method of the present invention is characterized in that both the seed culture and the main culture are performed in a serum-free medium while adjusting the pH to 7.3 to 7.5 as described above. Compared to the conventional method of culturing eukaryotic cells, the serum-containing medium is used in the seed culture step, and then the culture step is performed in which the serum-free medium is gradually converted to the serum-free medium. Eukaryotic cells were subjected to a seed-free culturing step after the spawn step of adapting to a serum-free culture in the above pH range. Nevertheless, antibody productivity remained at 90 ± 10% of the initial productivity even after about 90 days of culture as shown in FIGS. 2 and 3. This indicates that the production cell line of antithrombotic antibodies can be stably cultured, given that the incubation period of antibody production is usually 30 days.
본원에서 사용된 용어 “무혈청 배지(또는 무단백 배지)”는 포유동물 기원의 혈청 (예: 소태아 혈청 (FBS))을 실질적으로 함유하지 않은 영양액을 가리킨다. 용어 “실질적으로 함유하지 않는”은 세포 배양 배지가 약 0.5% 미만의 혈청, 바람직하게는 약 0 내지 0.1% 혈청을 함유함을 의미한다. 세포의 성장을 위한 영양액은 전형적으로 탄수화물 형태(예, 글루코즈)의 에너지원, 모든 필수 아미노산, 비타민 및/또는 기타 저농도로 요구되는 유기 화합물, 유리 지방산 및 미량 원소 (보통 마이크로몰 범위의 아주 낮은 농도로 요구되는 유기 화합물 또는 천연 원소)를 함유할 수 있으며, 임의로 호르몬 및 기타 성장 인자(예, 인슐린, 트랜스페린 및 표피 성장 인자), 염 및 완충액 (예, 칼슘, 마그네슘 및 포스페이트), 뉴클레오사이드 및 염기 (예, 아데닌, 티미딘 및 하이폭산틴) 및 단백질 및 조직 가수분해물 중에서 선택된 하나 이상의 성분으로 보충될 수 있다.As used herein, the term “serum free medium (or protein free medium)” refers to a nutrient solution that is substantially free of serum of mammalian origin (eg, fetal bovine serum (FBS)). The term “substantially free” means that the cell culture medium contains less than about 0.5% serum, preferably about 0 to 0.1% serum. Nutrients for cell growth typically include energy sources in the form of carbohydrates (e.g. glucose), all essential amino acids, vitamins and / or other low concentrations of organic compounds, free fatty acids and trace elements (usually very low concentrations in the micromolar range). Organic compounds or natural elements as required, and optionally include hormones and other growth factors (e.g. insulin, transferrin and epidermal growth factor), salts and buffers (e.g. calcium, magnesium and phosphate), nucleosides and Base (eg, adenine, thymidine and hypooxanthin) and one or more components selected from proteins and tissue hydrolysates.
무혈청 배지의 사용은 세포 배양 이후 배지로부터 항체의 분리 정제를 쉽게 할 뿐 아니라 프라이온(Prion)이나 바이러스의 감염을 피할 수 있다. 광우병이 알려진 이후, 최근에는 무혈청 배지에 동물 유래 성장 인자를 사용하지 않으며, 미생물에서 생산된 성장인자를 배지에 포함할 경우 미생물 배양 배지 성분도 고려될 만큼 안정성에 대한 규제가 강화되고 있다. 무혈청 배지에는 많은 배지 성분이 포함되므로 통계적 방법을 사용하여 기초 배지를 제작하고 값비싼 성장인자를 식물이나 미생물 유래의 첨가물로 대체해 제조할 수 있다. 따라서 이러한 무혈청 배지의 사용은 재조합 단백질의 생산 비용을 크게 낮출 수 있다.The use of serum-free media not only facilitates the purification of antibodies from the medium after cell culture, but also avoids the infection of prions or viruses. Since mad cow disease is known, recently, animal-derived growth factors are not used in serum-free medium, and when the growth factor produced in the microorganism is included in the medium, the regulation on stability is strengthened so that the microbial culture medium component may be considered. Serum-free media contains many media components, so statistical methods can be used to prepare basal media and replace expensive growth factors with plant or microbial additives. Therefore, the use of such serum-free medium can significantly lower the production cost of recombinant protein.
본원에서 사용된 용어 “종균 배양”은 본 배양을 하기 전 단계로 활력이 좋은 종균을 계속적으로 유지, 사용하기 위해 배양하는 것을 일컫으며, “본 배양”은 제품 생산을 위해 배양탱크에서 배양하여 대량 생산하기 위한 배양을 일컫는다.As used herein, the term "seed cultivation" refers to culturing to maintain and use a viable seed at a stage prior to the main cultivation, and "main cultivation" refers to culturing in a culture tank to produce a large amount of product. Refers to culture for production.
본 발명은 항혈전 항체를 배양하기 위해 부유식 배양법을 이용한다. 본원에서 “부유식 배양”은 배양액 중에 세포가 부유한 상태에서 배양하는 것으로, 각반자를 회전시키거나, 배양병마다 진탕하거나 배양기를 회전시켜 배양할 수 있다.The present invention uses floating culture to culture antithrombotic antibodies. As used herein, "floating culture" is cultured in a state in which cells are suspended in a culture medium, and can be cultured by rotating each half, shaking each culture bottle, or rotating an incubator.
바람직하게는, 본 발명의 항혈전 항체의 배양은 유가식 배양한다. 본원에서 “유가식(fed-batch) 배양”은 회분식 배양에서 연속적으로 배지를 첨가하고 배양이 끝날 때까지 배양액을 빼내지 않는 반연속식 또는 가변체적식 연속 배양을 포함한다. 다양한 방법으로 세포의 생장에 필요한 영양분을 공급하며, 점차적으로 농축된 영양분을 첨가하여 전체 계의 부피가 증가한다. 유가식 배양은 비생산적인 시간(휴지시간)을 단축할 수 있고, 접종 후 세포가 새로운 환경에 적응하는 시간을 최소화하면, 높은 배지의 농도에 의한 저해 등의 부정적인 반응을 줄일 수 있다. 또한, 배양 시에 고갈되는 영양분을 첨가함으로써 생산성이 높아 고농도로 재조합 항체를 생산할 수 있다.Preferably, the culture of the antithrombogenic antibody of the present invention is fed-batch culture. “Fed-batch culture” as used herein includes semicontinuous or variable volume continuous culture in which the medium is added continuously in a batch culture and the culture is not withdrawn until the end of the culture. There are various ways to supply the nutrients necessary for the growth of cells, and gradually the concentrated nutrients are added to increase the volume of the whole system. The fed-batch culture can shorten the nonproductive time (rest time) and minimize the time for the cell to adapt to the new environment after inoculation, thereby reducing negative reactions such as inhibition by high concentration of medium. In addition, by adding nutrients depleted at the time of cultivation, productivity can be high and recombinant antibodies can be produced at high concentration.
이하 본 발명을 하기 실시예에 의하여 보다 상세히 설명한다. 단 하기 실시예는 본 발명을 예시하는 것으로 본 발명의 내용이 실시예에 의해 한정되는 것은 아니다.Hereinafter, the present invention will be described in more detail with reference to the following examples. However, the following examples are illustrative of the present invention, and the content of the present invention is not limited by the examples.
<실시예 1> 생산세포주 제조Example 1 Production of Cell Line
pSV2-neo 벡터 (Clontech, U. S.)를 모체로 하여 원래 있던 SV40 early 프로모터 대신 CMV 프로모터, PCR 증폭하여 수득한 선별표식 유전자인 디히드로폴레이트 리덕테이즈 유전자, 화학적으로 합성된 멀티클로닝 사이트 (multicloning site: MCS), PCR 증폭하여 수득한 인간 항체 불변영역인 중쇄 감마 유전자(gi2765420)와 경쇄 카파 유전자 (gi49522599), 화학적으로 합성된 7E3 생쥐 하이브리도마 세포 (ATCC HB-8832)의 항체 유전자와 동일한 항체 중쇄 및 경쇄의 가변영역 유전자를 삽입하여, 재조합 항체 발현용 pdCMV-dhfrC-301 벡터(도 1)를 제조하였다.Using the pSV2-neo vector (Clontech, US) as a parent, instead of the SV40 early promoter, the CMV promoter, PCR amplification, the dihydrofolate reductase gene, a chemically synthesized multicloning site. : MCS), heavy antibody gamma gene (gi2765420), light chain kappa gene (gi49522599), human antibody constant regions obtained by PCR amplification, and antibodies identical to antibody genes of chemically synthesized 7E3 mouse hybridoma cells (ATCC HB-8832) The variable region genes of the heavy and light chains were inserted to prepare pdCMV-dhfrC-301 vectors (FIG. 1) for recombinant antibody expression.
투석하여 염, 호르몬 및 여러 작은 단백질을 제거한 소태아 혈청(dialyzed fetal bovine serum, dFBS) 10%와 하이포잔틴, 티민 (Hypoxanthin, Thymidine)이 함유된 IMDM(Iscove's modified dulbecco's medium, Invitrogen, U. S. A)이 들어있는 6 웰 디시 (well dish)에 CHO/DHFR(-) DG44세포(1×106cells) (Dr.Chasin, Columbia University, U. S.) 를 접종하고 37℃, 5% CO2 인큐베이터에서 배양하였다 (이하 배양의 조건은 모두 동일).IMDM (Iscove's modified dulbecco's medium, Invitrogen, US A) containing 10% dialyzed fetal bovine serum (dFBS) with dialysis to remove salts, hormones, and several small proteins, and hypoxanthine, thymine (Hypoxanthin, Thymidine) CHO / DHFR (-) DG44 cells (1 × 10 6 cells) (Dr. Chasin, Columbia University, US) were inoculated into a 6 well dish containing 6 well dishes and cultured in a 37 ° C., 5% CO2 incubator (hereinafter cultured). The conditions are all the same).
24시간 이상 배양한 후, CHO/DHFR- 세포들을 리포펙타민 (Lipofectamine, Invitrogen)을 사용하여 2㎍의 재조합 플라스미드(pdCMV-dhfrC-7E3)와 6㎕ 리포펙 타민을 첨가해 형질전환 (transfection) 시켰다. 형질전환 후, 20% dFBS 및 HT 함유 IMDM에서 1일 동안 배양하고 세포들을 회수하여 선별배지인 10% 혈청함유 IMDM(HT 불포함, 항생제 제네티신 (Geneticin) G418 포함, JRH Biosciences, U.S.A)에서 1:5 비율로 계대배양하였다. 다음 계대에선 선별배지에서 성장하는 CHO/DHFR+ 형질전환체 세포군들을 회수하여 한계희석법(limiting dilution)으로 96 웰 플레이트(96 well plate)에서 클론화한 다음, 선별배지에서 계속 배양하였다. 각각의 CHO/DHFR+ 형질전환체 클론 배양액에서 항혈전 항체를 효소면역측정법 (Enzyme-Linked ImmunoSorbent Assay; ELISA) 방법으로 정량하였다. 약 30개의 DHFR+ 고농도 항혈전 항체를 생산하는 클론들을 1차로 선별하였다.After incubation for 24 hours or more, CHO / DHFR-cells were transfected with 2 μg of recombinant plasmid (pdCMV-dhfrC-7E3) and 6 μl lipofectamine using Lipofectamine (Invitrogen). I was. After transformation, incubated for one day in IMDM containing 20% dFBS and HT and cells were harvested to recover the selected cells in 10% serum-containing IMDM (without HT, including antibiotic Geneticin G418, JRH Biosciences, USA). Subcultured at a: 5 ratio. In the next passage, the CHO / DHFR + transformant cell populations growing in the selective medium were recovered, cloned into 96 well plates by limiting dilution, and then cultured in the selective medium. Antithrombotic antibodies were quantified by Enzyme-Linked ImmunoSorbent Assay (ELISA) method in each CHO / DHFR + transformant clone culture. Clones producing about 30 DHFR + high concentration antithrombotic antibodies were selected first.
1차로 선별된 생성 DHFR+ 형질전환체 클론들의 항혈전 항체 생산성 향상을 위해 MTX(Methotrexate)를 사용하여 항혈전 항체 유전자 증폭을 수행하여 다시 한계희석법으로 96 웰 플레이트에서 클론화한 다음, 선별배지에서 계속 배양하였다.Anti-thrombotic antibody gene amplification was performed using MTX (Methotrexate) to improve anti-thrombotic antibody productivity of primary selected production DHFR + transformant clones, which were then cloned in 96-well plates by limiting dilution, and then continued in selection medium. Incubated.
<실시예 2> 현탁배양 적응Example 2 Suspension Culture Adaptation
앞서 선별한 고생산성 클론 4개를 무단백 배지 (JBI)에 플라스크 상에서 배양하여 무혈청 현탁배양 조건에 적응시켰다. 이때 무단백 배지의 pH를 pH 7.4로 적정하였다. 초기 접종 세포 농도를 5 x 105cells/㎖ 로 하여 3일 간격으로 배지를 교환하며, 3일 후 생존 세포 농도가 1.5 x 106cells/㎖ 이상이 되면, 초기 접종 세 포농도를 2 x 105cells/㎖ 로 낮추고 배지 교환 주기를 4일로 하여 계대배양하였다.Four previously selected high productivity clones were cultured on flasks in protein-free medium (JBI) to adapt to serum-free suspension culture conditions. At this time, the pH of the protein-free medium was titrated to pH 7.4. Change the medium every 3 days with the initial inoculation cell concentration of 5 x 105 cells / ml. After 3 days, if the viable cell concentration reaches 1.5 x 106 cells / ml, the initial inoculation cell concentration is 2 x 10 Lowered to5 cells / ㎖ and subcultured with a medium change cycle of 4 days.
4일 후 무혈청 배지에서 생존 세포 농도가 2.0 x 106cells/㎖ 이상을 10 계대 이상을 기록하는 클론들 중 높은 생산성을 보이는 클론들을 선별적으로 골라 동결하였다. 동결 시 동결 배지는 1㎖ 크라이오바이알 (cryovial, Corning)에 10% dFBS와 10% 디메틸설폭시드 (dimethylsulfoxide; DMSO, Sigma)가 첨가된 IMDM을 사용하였다. 동결 바이알은 1.8㎖ 크라이오바이알을 사용하는데, 1㎖의 동결배지에 1 내지 2 x 107 의 생존 세포를 현탁하여 크라이오바이알에 주입하였다. -20℃에서 5 시간, -70℃에서 16 시간 보관한 후에 액체질소가 충진된 액체질소 탱크에 넣어 보관하였다.Four days later, the free-grown clones were selectively picked out of those clones that record more than 10 passages with a viable cell concentration of 2.0 × 106 cells / ml or more in serum-free medium. The freezing medium used for freezing was IMDM in which 10% dFBS and 10% dimethylsulfoxide (DMSO, Sigma) were added to 1 ml cryovial (Corning). Frozen vial 1.8㎖ cryo vial to the use and suspended from 1 to 2 x 107 viable cells of a freezing medium of 1㎖ was fed to a cryo-vial. After 5 hours at -20 ° C and 16 hours at -70 ° C it was stored in a liquid nitrogen filled liquid nitrogen tank.
<실시예 3> 세포주 서브클로닝Example 3 Cell Line Subcloning
현탁배양에 적응되는 동안 개개의 세포들이 특성 면에서 비균질화 (heterogeneous) 되었을 것이므로, 서브클로닝 (subcloning)을 통해 균질성을 확보하기 위해 서브클로닝을 수행하였다. 이때, 재선별된 클론들의 생산성과 안정성을 고려하여 최종 생산세포주를 선정하여 마스터 재조합 세포은행(master cell bank)을 제조하여 액체질소 중(-196℃)에 동결 보존하였다.Since individual cells would have been heterogeneous in character during adaptation to suspension culture, subcloning was performed to ensure homogeneity through subcloning. At this time, considering the productivity and stability of the reselected clones, the final production cell line was selected to prepare a master recombinant cell bank (master cell bank) and cryopreserved in liquid nitrogen (-196 ℃).
<실시예 4> 무혈청 계대배양의 생산능 비교Example 4 Comparison of Production Capacity of Serum-free Passage Cultures
제조용 세포은행의 크라이오바이알 하나를 녹여 3개월, 22계대 동안의 항체생산성을 조사하였다. 4일을 1계대로 하고, 매 계대마다 접종농도를 2 x 105개/㎖ 로 하여 무혈청 배지를 사용한 부유배양법으로 세포를 배양하였다. 항체 농도는 기준 및 시험방법의 역가시험으로 정의한 고압액체크로마토그래피(HPLC)법을 사용하여 측정하였다. 선택압 (MTX)이 제거된 환경에서도 재조합 세포주는 90일 동안 초기생산성의 90 ± 10% 수준의 생산성을 안정적으로 유지함을 확인하였다. ISU301 항체의 생산을 위한 배양기간이 30 일임을 고려할 때 생산세포주로서 요구되는 충분한 안정성을 갖추었음을 확인하였다.One cryovial of the manufacturing cell bank was dissolved and antibody productivity was examined for 3 months and 22 passages. The cells were cultured by suspension culture using serum-free medium at 4 passages in 1 passage and inoculation concentration of 2 × 105 cells / ml for each passage. Antibody concentrations were determined using high pressure liquid chromatography (HPLC), which was defined by potency tests of standards and test methods. Recombinant cell lines were found to maintain a stable 90 ± 10% productivity of the initial productivity for 90 days even in the environment where the selective pressure (MTX) is removed. Considering that the incubation period for the production of the ISU301 antibody is 30 days, it was confirmed that it had sufficient stability as a production cell line.
22계대 동안 항체 생산성의 변화를 도 2 및 도 3에 나타내었다.Changes in antibody productivity during the 22 passages are shown in FIGS. 2 and 3.
<실시예 5> 적정 pH 탐지Example 5 Proper pH Detection
ISU301 생산성 향상에 적합한 배지의 pH를 탐지하기 위하여 유가배양 도중에 서로 다른 세 pH (6.8, 7.1, 7.4) 로 1일 2회 (오전 9시, 오후 5시) 적정하였다. 그 결과, 7.4 로 적정하였을 때 가장 높은 항체의 생산성을 보임을 확인하였다 (도 4).To detect the pH of the medium suitable for ISU301 productivity improvement, titration was performed twice a day (9 AM and 5 PM) at three different pH values (6.8, 7.1, 7.4) during the incubation. As a result, it was confirmed that the highest productivity of the antibody when titrated to 7.4 (Fig. 4).
<실시예 6> pH 자동 제어와 수동 적정이 생산성에 미치는 영향 비교Example 6 Comparison of the Effects of Automatic pH Control and Manual Titration on Productivity
ISU301을 생산하는 CHO-DG44 세포를 배양함에 있어, 생물반응기의 pH 탐침과 자동 제어 시스템을 이용하여 본 배양 4일째부터 14일째까지 배양액의 pH를 7.4 ± 0.1 로 자동제어 한 경우와 같은 기간 동안 동일한 시간 간격으로 매일 2회 배양액에 1N NaOH를 첨가함으로써 pH를 7.4 로 적정한 경우 ISU301의 최종 생산성을 관찰하였다. 그 결과, pH를 수동 제어하는 경우 생산성이 향상되었다 (도 6).In culturing CHO-DG44 cells producing ISU301, using the pH probe of the bioreactor and the automatic control system, the pH of the medium was automatically controlled to 7.4 ± 0.1 from
본 발명의 항혈전 항체 생산 방법은 단백질의 안정적 생산이 가능하며, 이로부터 생산되는 단백질은 혈청으로의 오염 없이 안전하게 사용할 수 있으며, 생산 비용을 절감할 수 있다.Anti-thrombotic antibody production method of the present invention can be a stable production of protein, the protein produced therefrom can be used safely without contamination with serum, it is possible to reduce the production cost.
Claims (6)
Translated fromKoreanPriority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020050026811AKR100696236B1 (en) | 2005-03-30 | 2005-03-30 | Production method of antithrombotic antibody |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020050026811AKR100696236B1 (en) | 2005-03-30 | 2005-03-30 | Production method of antithrombotic antibody |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20060104552A KR20060104552A (en) | 2006-10-09 |
| KR100696236B1true KR100696236B1 (en) | 2007-03-20 |
Family
ID=37634589
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020050026811AExpired - LifetimeKR100696236B1 (en) | 2005-03-30 | 2005-03-30 | Production method of antithrombotic antibody |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR100696236B1 (en) |
- 2005
- 2005-03-30KRKR1020050026811Apatent/KR100696236B1/ennot_activeExpired - Lifetime
Non-Patent Citations (2)
| Title |
|---|
| Biotechnol. Bioeng. Vol. 80(6), pp. 706-716 * |
| J. Biosci. Bioeng. Vol. 95(3), pp. 231-238 * |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20060104552A (en) | 2006-10-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Butler | Animal cell cultures: recent achievements and perspectives in the production of biopharmaceuticals | |
| JP2011521660A (en) | Method for producing erythropoietin by fermentation | |
| UA47428C2 (en) | Process for controlling sialic acid content, process for preparation of chimerical glycoprotein (variants), a preparation containing chimerical glycoprotein (variants), a therapeutic composition | |
| US20230323420A1 (en) | Perfusion medium | |
| JP2009509514A (en) | Improved cell culture medium | |
| EA036178B1 (en) | Process for manipulating the level of glycan content of a glycoprotein | |
| PL192072B1 (en) | Method of obtaining recombined factor viii, human- or animal-protein-free culture medium therefor and recombined factor viii as such | |
| US20250115890A1 (en) | Improved media for the expression of recombinant vitamin k-dependent proteins | |
| KR20200133240A (en) | Metabolic enzyme activity and disulfide bond reduction during protein production | |
| WO2001044442A1 (en) | Arginine-enriched medium composition used for mass-producing recombinant protein in animal cell culture | |
| US5576194A (en) | Recombinant protein production | |
| US20150353883A1 (en) | Medium Supplements for Improved Process Performance | |
| KR100696236B1 (en) | Production method of antithrombotic antibody | |
| CN117222668A (en) | Method for preparing SPESOLIMAB | |
| CN105732814B (en) | People's mouse chimeric mAb in the area anti-human von willebrand disease factor A3 and its preparation method and application | |
| CN114621909A (en) | Culture medium for rapidly expressing protein and application thereof | |
| US20220048984A1 (en) | Mammalian Cell Culture-Produced Neublastin Antibodies | |
| KR20220066970A (en) | Concentrated perfusion medium | |
| CA2576464A1 (en) | Methods and compositions for increasing longevity and protein yield from a cell culture | |
| US10717965B2 (en) | Mammalian cell culture-produced neublastin antibodies | |
| KR20230170728A (en) | Perfusion culture method of mammalian cells | |
| Yi et al. | Effects of osmotic pressure on recombinant BHK cell growth and von willebrand factor (vWF) expression | |
| US20170029859A1 (en) | Medium supplements for improved process performance | |
| KR100708403B1 (en) | Purification of Antithrombotic Antibodies | |
| AU2016374304A1 (en) | Method for increasing the heterogeneity of O-glycosylation of recombinant factor VII |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application | Patent event code:PA01091R01D Comment text:Patent Application Patent event date:20050330 | |
| A201 | Request for examination | ||
| A302 | Request for accelerated examination | ||
| PA0201 | Request for examination | Patent event code:PA02012R01D Patent event date:20060628 Comment text:Request for Examination of Application Patent event code:PA02011R01I Patent event date:20050330 Comment text:Patent Application | |
| PA0302 | Request for accelerated examination | Patent event date:20060628 Patent event code:PA03022R01D Comment text:Request for Accelerated Examination Patent event date:20050330 Patent event code:PA03021R01I Comment text:Patent Application | |
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection | Comment text:Notification of reason for refusal Patent event date:20060913 Patent event code:PE09021S01D | |
| PG1501 | Laying open of application | ||
| E90F | Notification of reason for final refusal | ||
| PE0902 | Notice of grounds for rejection | Comment text:Final Notice of Reason for Refusal Patent event date:20061208 Patent event code:PE09021S02D | |
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration | Patent event code:PE07011S01D Comment text:Decision to Grant Registration Patent event date:20070105 | |
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment | Comment text:Registration of Establishment Patent event date:20070312 Patent event code:PR07011E01D | |
| PR1002 | Payment of registration fee | Payment date:20070312 End annual number:3 Start annual number:1 | |
| PG1601 | Publication of registration | ||
| PR1001 | Payment of annual fee | Payment date:20100218 Start annual number:4 End annual number:4 | |
| PR1001 | Payment of annual fee | Payment date:20110310 Start annual number:5 End annual number:5 | |
| PR1001 | Payment of annual fee | Payment date:20120221 Start annual number:6 End annual number:6 | |
| FPAY | Annual fee payment | Payment date:20130208 Year of fee payment:7 | |
| PR1001 | Payment of annual fee | Payment date:20130208 Start annual number:7 End annual number:7 | |
| FPAY | Annual fee payment | Payment date:20140219 Year of fee payment:8 | |
| PR1001 | Payment of annual fee | Payment date:20140219 Start annual number:8 End annual number:8 | |
| FPAY | Annual fee payment | Payment date:20150209 Year of fee payment:9 | |
| PR1001 | Payment of annual fee | Payment date:20150209 Start annual number:9 End annual number:9 | |
| FPAY | Annual fee payment | Payment date:20160307 Year of fee payment:10 | |
| PR1001 | Payment of annual fee | Payment date:20160307 Start annual number:10 End annual number:10 | |
| FPAY | Annual fee payment | Payment date:20170303 Year of fee payment:11 | |
| PR1001 | Payment of annual fee | Payment date:20170303 Start annual number:11 End annual number:11 | |
| FPAY | Annual fee payment | Payment date:20180305 Year of fee payment:12 | |
| PR1001 | Payment of annual fee | Payment date:20180305 Start annual number:12 End annual number:12 | |
| FPAY | Annual fee payment | Payment date:20181218 Year of fee payment:13 | |
| PR1001 | Payment of annual fee | Payment date:20181218 Start annual number:13 End annual number:13 | |
| FPAY | Annual fee payment | Payment date:20200310 Year of fee payment:14 | |
| PR1001 | Payment of annual fee | Payment date:20200310 Start annual number:14 End annual number:14 | |
| PR1001 | Payment of annual fee | Payment date:20210304 Start annual number:15 End annual number:15 | |
| PR1001 | Payment of annual fee | Payment date:20220302 Start annual number:16 End annual number:16 | |
| PR1001 | Payment of annual fee | Payment date:20230303 Start annual number:17 End annual number:17 | |
| PR1001 | Payment of annual fee | Payment date:20240112 Start annual number:18 End annual number:18 |