JP7205041B2 - Polio vaccine encapsulating microneedle array - Google Patents
Polio vaccine encapsulating microneedle arrayDownload PDFInfo
- Publication number
- JP7205041B2 JP7205041B2JP2019097405AJP2019097405AJP7205041B2JP 7205041 B2JP7205041 B2JP 7205041B2JP 2019097405 AJP2019097405 AJP 2019097405AJP 2019097405 AJP2019097405 AJP 2019097405AJP 7205041 B2JP7205041 B2JP 7205041B2
- Authority
- JP
- Japan
- Prior art keywords
- needle
- polio vaccine
- mold
- microneedle array
- water
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Media Introduction/Drainage Providing Device (AREA)
Description
Translated fromJapanese本発明は、マイクロニードルアレイに関する。本発明は、特にポリオワクチンを含有した自己溶解型マイクロニードルアレイに関する。 The present invention relates to microneedle arrays. The present invention particularly relates to a self-dissolving microneedle array containing a polio vaccine.
近年、生体内溶解性の物質からなる基材に薬物を含有させた溶解型マイクロニードルアレイが開発されている。マイクロニードルアレイの針は細く、短いことから、神経への刺激が少ない。このため、マイクロニードルアレイは、「痛くない注射」とも称される。 In recent years, a soluble microneedle array has been developed in which a drug is contained in a base material made of a substance that dissolves in vivo. Since the needles of the microneedle array are thin and short, they are less likely to irritate nerves. For this reason, microneedle arrays are also referred to as "painless injections."
非特許文献1には、スクロース、トレオニンおよびゼラチンで構成されるマイクロニードルアレイ、ならびにマルトデキストリン、スクロースおよびゼラチンで構成されるマイクロニードルアレイが開示されている。 Non-Patent Document 1 discloses a microneedle array composed of sucrose, threonine and gelatin, and a microneedle array composed of maltodextrin, sucrose and gelatin.
特許文献1には、水溶性高分子と、グルコース、フルクトース、シュクロース、ラクトース、トレハロースからなる群から選ばれた1種若しくは複数種の糖類との混合物をマイクロニードル素材とし、マイクロニードル刺入後30分以内に溶解することを特徴とするマイクロニードルが記載されている。 In Patent Document 1, a mixture of a water-soluble polymer and one or more saccharides selected from the group consisting of glucose, fructose, sucrose, lactose, and trehalose is used as a microneedle material, and after microneedle insertion Microneedles are described which are characterized by dissolution within 30 minutes.
特許文献2には、シート部、及び、シート部の上面に存在する複数の針部、を有するマイクロニードルアレイであって、針部が、水溶性高分子及び薬物を含み、針部の全固形分の50質量%以上が水溶性高分子であり、針部先端を含む領域であって、針部全体の高さの20%の長さに相当する高さを有する針部先端領域において、水溶性高分子と薬物とが、所定の質量比率で存在し、シート部が、水溶性高分子を含む、マイクロニードルアレイが記載されている。
非特許文献1ではサルに対する有効性を評価しているが、水溶性高分子としてゼラチンを使用していることから、動物由来試料によるアレルギー発症の観点で、安全性に懸念がある。また、医薬品用のゼラチンは非常に高価な為、製造コストも高くなる。特許文献1では、先端部への薬物の局所化と速やかな溶解性を課題としているが、ポリオワクチンを用いた検討はなされていない。また、特許文献2においてもポリオワクチンを用いた検討はなされていない。 Non-Patent Document 1 evaluates the efficacy for monkeys, but since gelatin is used as a water-soluble polymer, there are concerns about safety from the viewpoint of allergy development due to animal-derived samples. In addition, since pharmaceutical gelatin is very expensive, the manufacturing cost is also high. In Patent Document 1, localization of the drug to the tip and rapid dissolution are the subjects, but examination using polio vaccine is not made. Also,
本発明の課題は、マイクロニードルアレイの製造時の、ポリオワクチンにおける有効成分の活性(以下、ワクチン活性とする)低下を抑制することができ、さらに高温環境におけるポリオワクチンの安定性が向上したマイクロニードルアレイを提供することである。 An object of the present invention is to suppress the reduction in the activity of the active ingredient in the polio vaccine (hereinafter referred to as vaccine activity) during the production of the microneedle array, and to improve the stability of the polio vaccine in a high-temperature environment. To provide a needle array.
本発明者らは上記課題を解決するために鋭意検討した結果、ポリオワクチンを含有するマイクロニードルアレイにおいて、ポリオワクチンを含有する針部に、所定の水溶性高分子と、二糖類とを含めることによって、上記課題を解決したマイクロニードルアレイを提供できることを見出し、本発明を完成するに至った。 As a result of intensive studies to solve the above problems, the present inventors have found that, in a polio vaccine-containing microneedle array, the needle portion containing the polio vaccine contains a predetermined water-soluble polymer and a disaccharide. Thus, the inventors have found that a microneedle array that solves the above problems can be provided, and have completed the present invention.
即ち、本発明によれば、以下の発明が提供される。
(1) シート部、及び、シート部の上面に存在する複数の針部、を有するマイクロニードルアレイであって、針部が、水溶性高分子と二糖類とポリオワクチンとを含み、シート部が、水溶性高分子を含み、上記針部およびシート部の水溶性高分子が、ポリビニルピロリドン、コンドロイチン硫酸、デキストラン、およびヒドロキシエチルスターチからなる群より選ばれる少なくとも一種である、マイクロニードルアレイ。
(2) 二糖類が、スクロースまたはトレハロースである、(1)に記載のマイクロニードルアレイ。
(3) 水溶性高分子が、ヒドロキシエチルスターチである、(1)または(2)に記載のマイクロニードルアレイ。
(4) ポリオワクチンが、不活化ポリオワクチンI型、不活化ポリオワクチンII型および不活化ポリオワクチンIII型の混合ワクチンである、(1)から(3)のいずれか一に記載のマイクロニードルアレイ。
(5) ポリオワクチンがセービン株由来である、(1)から(4)のいずれか一に記載のマイクロニードルアレイ。That is, according to the present invention, the following inventions are provided.
(1) A microneedle array having a sheet and a plurality of needles present on the upper surface of the sheet, wherein the needle contains a water-soluble polymer, a disaccharide, and a polio vaccine, and the sheet contains , a water-soluble polymer, wherein the water-soluble polymer of the needle portion and the sheet portion is at least one selected from the group consisting of polyvinylpyrrolidone, chondroitin sulfate, dextran, and hydroxyethyl starch.
(2) The microneedle array according to (1), wherein the disaccharide is sucrose or trehalose.
(3) The microneedle array according to (1) or (2), wherein the water-soluble polymer is hydroxyethyl starch.
(4) The microneedle array according to any one of (1) to (3), wherein the polio vaccine is a combined vaccine of inactivated polio vaccine type I, inactivated polio vaccine type II and inactivated polio vaccine type III. .
(5) The microneedle array according to any one of (1) to (4), wherein the polio vaccine is derived from Sabin strain.
本発明によれば、マイクロニードルアレイの製造時のポリオワクチンの活性低下を抑制することができる。さらに本発明によれば、高温環境におけるポリオワクチンの安定性を向上することができる。 ADVANTAGE OF THE INVENTION According to this invention, the activity fall of polio vaccine at the time of manufacture of a microneedle array can be suppressed. Furthermore, according to the present invention, the stability of polio vaccines in high-temperature environments can be improved.
以下、本発明の実施の形態について詳細に説明する。
本発明のマイクロニードルアレイは、針部が、水溶性高分子と二糖類とポリオワクチンとを含み、シート部が、水溶性高分子を含み、上記針部およびシート部の水溶性高分子が、ポリビニルピロリドン、コンドロイチン硫酸、デキストラン、およびヒドロキシエチルスターチからなる群より選ばれる少なくとも一種であるという構成を有している。上記構成を採用したことにより、マイクロニードルアレイの製造時のポリオワクチンの活性低下を抑制することができ、さらに高温環境におけるポリオワクチンの安定性を向上することができる。マイクロニードルアレイにおけるポリオワクチンの活性低下の抑制並びに安定性の向上については、従来報告がなく、本発明により初めて見出された知見である。本発明のマイクロニードルアレイは、ポリオワクチンの経皮吸収製剤として有用である。BEST MODE FOR CARRYING OUT THE INVENTION Hereinafter, embodiments of the present invention will be described in detail.
In the microneedle array of the present invention, the needle portion contains a water-soluble polymer, a disaccharide, and a polio vaccine, the sheet portion contains a water-soluble polymer, and the needle portion and the water-soluble polymer of the sheet portion contain: At least one selected from the group consisting of polyvinylpyrrolidone, chondroitin sulfate, dextran, and hydroxyethyl starch. By adopting the above configuration, it is possible to suppress the decrease in the activity of the polio vaccine during the production of the microneedle array, and to improve the stability of the polio vaccine in a high-temperature environment. This is the first finding of the present invention regarding suppression of activity reduction and improvement of stability of a polio vaccine in a microneedle array, which has not been previously reported. The microneedle array of the present invention is useful as a polio vaccine transdermal preparation.
[マイクロニードルアレイの構成]
本発明において複数とは、1つ以上のことを意味する。[Configuration of microneedle array]
In the present invention, plural means one or more.
本発明のマイクロニードルアレイは、ポリオワクチンを効率的に皮膚中に投与するために、シート部及び針部を少なくとも含み、針部にポリオワクチンを担持させている。 The microneedle array of the present invention includes at least a sheet portion and a needle portion in order to efficiently administer the polio vaccine into the skin, and the needle portions carry the polio vaccine.
本発明のマイクロニードルアレイとは、シート部の上面側に、複数の針部がアレイ状に配置されているデバイスである。針部は、シート部の上面側に配置されていることが好ましい。針部は、シート部の上面に直接配置されていてもよいし、あるいは針部は、シート部の上面に配置された錐台部の上面に配置されていてもよい。 The microneedle array of the present invention is a device in which a plurality of needle portions are arranged in an array on the upper surface side of a sheet portion. The needle portion is preferably arranged on the upper surface side of the sheet portion. The needle may be placed directly on the upper surface of the seat, or the needle may be placed on the upper surface of a frustum placed on the upper surface of the seat.
シート部は、針部を支持するための土台であり、図1~8に示すシート部116のような平面状の形状を有する。このとき、シート部の上面とは、面上に複数の針部がアレイ状に配置された面を指す。
シート部の面積は、特に限定されないが、0.005~1000mm2であることが好ましく、0.05~500mm2であることがより好ましく、0.1~400mm2であることがさらに好ましい。The seat portion is a base for supporting the needle portion, and has a planar shape like the
Although the area of the sheet portion is not particularly limited, it is preferably 0.005 to 1000 mm2 , more preferably 0.05 to 500 mm2 and even more preferably 0.1 to 400 mm2 .
シート部の厚さは、錐台部又は針部と接している面と、反対側の面の間の距離で表す。シート部の厚さとしては、1μm以上2000μm以下であることが好ましく、3μm以上1500μm以下であることがより好ましく、5μm以上1000μm以下であることがさらに好ましい。 The thickness of the sheet portion is expressed by the distance between the surface in contact with the frustum portion or the needle portion and the opposite surface. The thickness of the sheet portion is preferably 1 μm or more and 2000 μm or less, more preferably 3 μm or more and 1500 μm or less, and even more preferably 5 μm or more and 1000 μm or less.
シート部は、水溶性高分子を含む。シート部は、水溶性高分子から構成されていてもよいし、それ以外の添加物(例えば、二糖類など)を含んでいてもよい。なお、シート部にはポリオワクチンを含まないことが好ましい。 The sheet portion contains a water-soluble polymer. The sheet portion may be composed of a water-soluble polymer, or may contain other additives (eg, disaccharides, etc.). In addition, it is preferable that the sheet portion does not contain a polio vaccine.
シート部に含まれる水溶性高分子としては、ポリビニルピロリドン、コンドロイチン硫酸、デキストラン、およびヒドロキシエチルスターチからなる群より選ばれる少なくとも一種である。上記の成分は、1種単独で用いてもよいし、2種以上の混合物として用いてもよい。水溶性高分子は特に好ましくは、ヒドロキシエチルスターチである。
シート部には、二糖類を添加してもよく、二糖類としては、スクロース、ラクツロース、ラクトース、マルトース、トレハロースまたはセロビオースなどが挙げられ、特にスクロースまたはトレハロースが好ましい。The water-soluble polymer contained in the sheet portion is at least one selected from the group consisting of polyvinylpyrrolidone, chondroitin sulfate, dextran, and hydroxyethyl starch. The above components may be used singly or as a mixture of two or more. A particularly preferred water-soluble polymer is hydroxyethyl starch.
A disaccharide may be added to the sheet portion, and examples of the disaccharide include sucrose, lactulose, lactose, maltose, trehalose and cellobiose, with sucrose and trehalose being particularly preferred.
シート部に含まれる水溶性高分子の含有量は、特に限定されないが、シート部の固形分質量に対して、好ましくは50質量%以上であり、より好ましくは60質量%以上であり、特に好ましくは80質量%以上である。
シート部に含まれる二糖類の含有量は、特に限定されないが、シート部の固形分質量に対して、好ましくは30質量%以下であり、より好ましくは20質量%以下であり、特に好ましくは10質量%以下である。The content of the water-soluble polymer contained in the sheet portion is not particularly limited, but is preferably 50% by mass or more, more preferably 60% by mass or more, and particularly preferably with respect to the solid content mass of the sheet portion. is 80% by mass or more.
The content of the disaccharide contained in the sheet portion is not particularly limited, but is preferably 30% by mass or less, more preferably 20% by mass or less, and particularly preferably 10% by mass relative to the solid content mass of the sheet portion. % by mass or less.
マイクロニードルアレイは、シート部の上面側に、アレイ状に配置された複数の針部から構成される。針部は、先端を有する凸状構造物であって、鋭い先端を有する針形状に限定されるものではなく、先の尖っていない形状であってもよい。
針部の形状の例としては、円錐状、多角錐状(四角錐状など)、又は紡錘状などが挙げられる。例えば、図1~8に示す針部112のような形状を有し、針部の全体の形状が、円錐状又は多角錐状(四角錐状など)であってもよいし、針部側面の傾き(角度)を連続的に変化させた構造であってもよい。また、針部側面の傾き(角度)が非連続的に変化する、二層又はそれ以上の多層構造をとることもできる。
本発明のマイクロニードルアレイを皮膚に適用した場合、針部が皮膚に挿入され、シート部の上面又はその一部が皮膚に接するようになることが好ましい。The microneedle array is composed of a plurality of needles arranged in an array on the upper surface of the sheet. The needle part is a convex structure having a tip, and is not limited to a needle shape with a sharp tip, and may be a shape with a blunt tip.
Examples of the shape of the needle include conical, polypyramidal (such as quadrangular pyramidal), and spindle shapes. For example, it has a shape like the
When the microneedle array of the present invention is applied to the skin, it is preferable that the needles are inserted into the skin so that the upper surface of the sheet or a portion thereof comes into contact with the skin.
針部の高さ(長さ)は、針部の先端から、錐台部又はシート部(錐台部が存在しない場合)へ下ろした垂線の長さで表す。針部の高さ(長さ)は特に限定されないが、好ましくは50μm以上3000μm以下であり、より好ましくは100μm以上1500μm以下であり、さらに好ましくは100μm以上1000μm以下である。針部の長さが50μm以上であれば、ポリオワクチンの経皮投与を行うことができ、針部の長さが3000μm以下であれば、針部が神経に接触することによる痛みの発生を防止できるだけでなく、出血も回避できるため、好ましい。 The height (length) of the needle portion is represented by the length of a perpendicular drawn from the tip of the needle portion to the frustum portion or the sheet portion (when the frustum portion does not exist). The height (length) of the needle portion is not particularly limited, but is preferably 50 μm or more and 3000 μm or less, more preferably 100 μm or more and 1500 μm or less, and still more preferably 100 μm or more and 1000 μm or less. If the length of the needle is 50 μm or more, the polio vaccine can be administered transdermally, and if the length of the needle is 3000 μm or less, pain due to contact of the needle with nerves can be prevented. Not only is this possible, but bleeding can also be avoided, which is preferable.
錐台部(ただし、錐台部が存在しない場合には針部)とシート部の界面を基底部と呼ぶ。1つの針部の基底における最も遠い点間の距離は、50μm以上2000μm以下であることが好ましく、100μm以上1500μm以下であることがより好ましく、200μm以上1000μm以下であることがさらに好ましい。 The interface between the frustum (or the needle if the frustum does not exist) and the sheet is called the base. The distance between the farthest points at the base of one needle is preferably 50 μm or more and 2000 μm or less, more preferably 100 μm or more and 1500 μm or less, and even more preferably 200 μm or more and 1000 μm or less.
針部は、1つのマイクロニードルアレイあたり1~2000本配置されることが好ましく、3~1000本配置されることがより好ましく、5~500本配置されることがさらに好ましい。1つのマイクロニードルアレイあたり2本の針部を含む場合、針部の間隔は、針部の先端から錐台部又はシート部(錐台部が存在しない場合)へ下ろした垂線の足の間の距離で表す。1つのマイクロニードルアレイあたり3本以上の針部を含む場合、配列される針部の間隔は、全ての針部においてそれぞれ最も近接した針部に対して先端から錐台部又はシート部(錐台部が存在しない場合)へ下ろした垂線の足の間の距離を求め、その平均値で表す。針部の間隔は、0.1mm以上10mm以下であることが好ましく、0.2mm以上5mm以下であることがより好ましく、0.3mm以上3mm以下であることがさらに好ましい。 Preferably, 1 to 2000 needles are arranged, more preferably 3 to 1000 needles, and even more preferably 5 to 500 needles are arranged in one microneedle array. When two needles are included per microneedle array, the distance between the needles is the distance between the legs of a vertical line drawn from the tip of the needle to the frustum or seat (if there is no frustum). Expressed as a distance. When three or more needles are included in one microneedle array, the interval between the arrayed needles is the frustum or sheet portion (frustum Calculate the distance between the legs of the vertical line that descends to (if there is no part), and express the average value. The distance between the needles is preferably 0.1 mm or more and 10 mm or less, more preferably 0.2 mm or more and 5 mm or less, and even more preferably 0.3 mm or more and 3 mm or less.
針部は、水溶性高分子と二糖類とポリオワクチンとを含む。
針部に含まれる水溶性高分子としては、ポリビニルピロリドン、コンドロイチン硫酸、デキストラン、およびヒドロキシエチルスターチからなる群より選ばれる少なくとも一種である。上記の成分は、1種単独で用いてもよいし、2種以上の混合物として用いてもよい。水溶性高分子は特に好ましくは、ヒドロキシエチルスターチである。
なお、針部に含まれる水溶性高分子は、シート部に含まれる水溶性高分子と同一であってもよいし、異なっていてもよい。The needle contains a water-soluble polymer, a disaccharide and a polio vaccine.
The water-soluble polymer contained in the needle is at least one selected from the group consisting of polyvinylpyrrolidone, chondroitin sulfate, dextran, and hydroxyethyl starch. The above components may be used singly or as a mixture of two or more. A particularly preferred water-soluble polymer is hydroxyethyl starch.
The water-soluble polymer contained in the needle portion may be the same as or different from the water-soluble polymer contained in the sheet portion.
針部は、二糖類を含む。二糖類としては、スクロース、ラクツロース、ラクトース、マルトース、トレハロースまたはセロビオースなどが挙げられ、特にスクロースまたはトレハロースが好ましい。 The needle contains a disaccharide. Examples of disaccharides include sucrose, lactulose, lactose, maltose, trehalose and cellobiose, with sucrose and trehalose being particularly preferred.
ポリオワクチンとしては、ポリオウイルスの弱毒株または不活化されたポリオウイルス(不活化ポリオウイルス)を使用することができる。本明細書では、不活化ポリオウイルスを、不活化ポリオワクチンと呼称する。
ポリオウイルスの弱毒株(セービン株)は経口ワクチンとして用いられている。Attenuated strains of poliovirus or inactivated poliovirus (inactivated poliovirus) can be used as polio vaccines. Inactivated poliovirus is referred to herein as inactivated polio vaccine.
An attenuated strain of poliovirus (Sabin strain) is used as an oral vaccine.
不活化ポリオワクチンは、ポリオウイルスをホルマリンにより不活化し、感染力を失わせたワクチンである。不活化ポリオワクチンは、被接種者の体内での増殖も、被接種者の周囲のヒトへの感染もしないので、ワクチン関連麻痺を起こすことはない。不活化ポリオワクチンの製造には、従来より強毒株が用いられているが、近年では弱毒株(セービン株)も用いられている。 An inactivated polio vaccine is a vaccine in which the poliovirus is inactivated with formalin to make it infective. Inactivated polio vaccine does not cause vaccine-associated paralysis because it neither multiplies in the body of the recipient nor infects people around the recipient. In the production of inactivated polio vaccines, virulent strains have conventionally been used, but in recent years, attenuated strains (Sabin strains) have also been used.
好ましくは、ポリオワクチンは、不活化ポリオワクチンI型、不活化ポリオワクチンII型、および不活化ポリオワクチンIII型の混合ワクチンである。
好ましくは、ポリオワクチンは、セービン株由来である。Preferably, the polio vaccine is a combined vaccine of inactivated polio vaccine type I, inactivated polio vaccine type II and inactivated polio vaccine type III.
Preferably, the polio vaccine is derived from the Sabin strain.
針部に含まれる水溶性高分子の含有量は、特に限定されないが、針部の固形分質量に対して、好ましくは50質量%以上であり、より好ましくは60質量%以上であり、特に好ましくは70質量%以上である。
針部に含まれる二糖類の含有量は、特に限定されないが、シート部の固形分質量に対して、好ましくは50質量%以下であり、より好ましくは40質量%以下であり、特に好ましくは30質量%以下である。
針部全体におけるポリオワクチンの含有量は、特に限定されないが、針部の固形分質量に対して、好ましくは0.001~20質量%であり、より好ましくは0.005~15質量%であり、特に好ましくは0.01~10質量%である。The content of the water-soluble polymer contained in the needle is not particularly limited, but is preferably 50% by mass or more, more preferably 60% by mass or more, and particularly preferably 60% by mass or more, based on the mass of the solid content in the needle. is 70% by mass or more.
The content of the disaccharide contained in the needle portion is not particularly limited, but is preferably 50% by mass or less, more preferably 40% by mass or less, and particularly preferably 30% by mass, based on the solid content mass of the sheet portion. % by mass or less.
The polio vaccine content in the entire needle is not particularly limited, but is preferably 0.001 to 20% by mass, more preferably 0.005 to 15% by mass, based on the solid content mass of the needle. , particularly preferably 0.01 to 10% by mass.
以下、添付の図面に従って、本発明の好ましい実施の形態について説明するが、本発明はこれに限定されない。 Preferred embodiments of the present invention will be described below with reference to the accompanying drawings, but the present invention is not limited thereto.
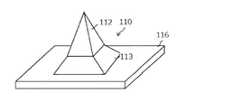
図1~図8は、マイクロニードルアレイの一部拡大図であるマイクロニードル110を示している。本発明のマイクロニードルアレイは、シート部116の表面に複数個の針部112が形成されることで、構成される(図においては、シート部116上に1つの針部112のみ、あるいは1つの錘台部113と1つの針部112を表示し、これをマイクロニードル110と称する)。 1-8
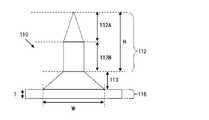
図1Aにおいて、針部112は円錐状の形状を有し、図1Bにおいて、針部112は四角錐状の形状を有している。図1Cにおいて、Hは針部112の高さを、Wは針部112の直径(幅)を、Tはシート部116の高さ(厚み)を示す。 In FIG. 1A, the
図2及び図3は、シート部116の表面に、錐台部113及び針部112が形成された別の形状を有するマイクロニードル110を示している。図2において、錐台部113は、円錐台の形状を有し、針部112は円錐の形状を有している。また、図3において、錐台部113は、四角錐台の形状を有し、針部112は四角錐の形状を有している。ただし、針部の形状は、これらの形状に限定されるものではない。 2 and 3 show a microneedle 110 having another shape in which a
図4は、図2及び図3に示されるマイクロニードル110の断面図である。図4において、Hは針部112の高さを、Wは基底部の直径(幅)を、Tはシート部116の高さ(厚み)を示す。 FIG. 4 is a cross-sectional view of the
本発明のマイクロニードルアレイは、図1Cのマイクロニードル110の形状よりも、図4のマイクロニードル110の形状とすることが好ましい。このような構造をとることで、針部全体の体積が大きくなり、マイクロニードルアレイの製造時において、より多くのポリオワクチンを針部の上端に集中させることができる。 The microneedle array of the present invention preferably has the shape of the
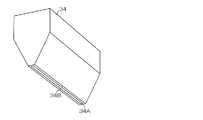
図5及び図6は、さらに別の形状を有するマイクロニードル110を示している。 5 and 6
図5に示される針部第1層112Aは円錐状の形状を有し、針部第2層112Bは円柱状の形状を有している。図6に示される針部第1層112Aは四角錐状の形状を有し、針部第2層112Bは四角柱状の形状を有している。ただし、針部の形状は、これらの形状に限定されるものではない。 The
図7は、図5及び図6に示されるマイクロニードル110の断面図である。図7において、Hは針部112の高さを、Wは基底部の直径(幅)を、Tはシート部116の高さ(厚み)を示す。 FIG. 7 is a cross-sectional view of the
図8は、針部112の側面の傾き(角度)が連続的に変化した別の形状のマイクロニードルの断面図である。図8において、Hは針部112の高さを、Tはシート部116の高さ(厚み)を示す。 FIG. 8 is a cross-sectional view of another microneedle in which the inclination (angle) of the side surface of the
本発明のマイクロニードルアレイにおいて、針部は、横列について1mm当たり約0.1~10本の間隔で配置されていることが好ましい。マイクロニードルアレイは、1cm2当たり1~10000本のマイクロニードルを有することがより好ましい。マイクロニードルの密度を1本/cm2以上とすることにより効率良く皮膚を穿孔することができ、またマイクロニードルの密度を10000本/cm2以下とすることにより、マイクロニードルアレイが十分に穿刺することが可能になる。針部の密度は、好ましくは10~5000本/cm2であり、さらに好ましくは25~1000本/cm2であり、特に好ましくは25~400本/cm2である。In the microneedle array of the present invention, needles are preferably arranged at intervals of about 0.1 to 10 needles per mm per row. More preferably, the microneedle array has 1-10000 microneedles per cm2 . By setting the density of the microneedles to 1/cm2 or more, the skin can be efficiently pierced, and by setting the density of the microneedles to 10,000/cm2 or less, the microneedle array can sufficiently pierce the skin. becomes possible. The needle density is preferably 10 to 5000/cm2 , more preferably 25 to 1000/cm2 , particularly preferably 25 to 400/cm2 .
本発明のマイクロニードルアレイは、乾燥剤と一緒に密閉保存されている形態で供給することができる。乾燥剤としては、公知の乾燥剤(例えば、シリカゲル、生石灰、塩化カルシウム、シリカアルミナ、シート状乾燥剤など)を使用することができる。 The microneedle array of the present invention can be supplied in a sealed storage form together with a desiccant. As the desiccant, a known desiccant (for example, silica gel, quicklime, calcium chloride, silica alumina, sheet-like desiccant, etc.) can be used.
[マイクロニードルアレイの製造方法]
本発明のマイクロニードルアレイは、例えば、特開2013-153866号公報又は国際公開WO2014/077242号公報に記載の方法に準じて以下の方法により製造することができる。[Method for producing microneedle array]
The microneedle array of the present invention can be produced, for example, by the following method according to the method described in JP-A-2013-153866 or WO2014/077242.
(モールドの作製)
図9Aから9Cは、モールド(型)の作製の工程図である。図9Aに示すように、モールドを作製するための原版を先ず作製する。この原版11の作製方法は2種類ある。(Preparation of mold)
Figures 9A to 9C are process diagrams for making a mold. As shown in FIG. 9A, a master for making a mold is first made. There are two methods for producing the
1種類目の方法は、Si基板上にフォトレジストを塗布した後、露光、現像を行う。そして、RIE(リアクティブイオンエッチング)等によるエッチングを行うことにより、原版11の表面に円錐の形状部(凸部)12のアレイを作製する。尚、原版11の表面に円錐の形状部を形成するようにRIE等のエッチングを行う際には、Si基板を回転させながら斜め方向からのエッチングを行うことにより、円錐の形状を形成することが可能である。2種類目の方法は、Ni等の金属基板に、ダイヤモンドバイト等の切削工具を用いた加工により、原版11の表面に四角錐などの形状部12のアレイを形成する方法である。 In the first method, a Si substrate is coated with a photoresist, then exposed and developed. Then, an array of conical shaped portions (convex portions) 12 is produced on the surface of the
次に、モールドの作製を行う。具体的には、図9Bに示すように、原版11よりモールド13を作製する。方法としては以下の4つの方法が考えられる。
1つ目の方法としては、原版11にPDMS(ポリジメチルシロキサン、例えば、ダウコーニング社製のシルガード184(登録商標))に硬化剤を添加したシリコーン樹脂を流し込み、100℃で加熱処理し硬化した後に、原版11より剥離する方法である。2つ目の方法としては、紫外線を照射することにより硬化するUV(Ultraviolet)硬化樹脂を原版11に流し込み、窒素雰囲気中で紫外線を照射した後に、原版11より剥離する方法である。3つ目の方法としては、ポリスチレンやPMMA(ポリメチルメタクリレート)等のプラスチック樹脂を有機溶剤に溶解させた溶液を剥離剤の塗布された原版11に流し込み、乾燥させることにより有機溶剤を揮発させて硬化させた後に、原版11より剥離する方法である。4つ目の方法としては、Ni電鋳により反転品を作成する方法である。Next, a mold is produced. Specifically, as shown in FIG. 9B, a
As a first method, a silicone resin obtained by adding a curing agent to PDMS (polydimethylsiloxane, for example, Sylgard 184 (registered trademark) manufactured by Dow Corning) was poured into the
これにより、原版11の円錐形又は角錐形の反転形状である針状凹部15が2次元配列で配列されたモールド13を作製した。このようにして作製したモールド13を図9Cに示す。 As a result, a
図10は他の好ましいモールド13の態様を示したものである。針状凹部15は、モールド13の表面から深さ方向に狭くなるテーパ状の入口部15Aと、深さ方向に先細りの先端凹部15Bとを備える。入口部15Aをテーパ形状とすることで、水溶性高分子溶解液を針状凹部15に充填しやすくなる。 FIG. 10 shows another
図11は、マイクロニードルアレイの製造を行う上で、より好ましいモールド複合体18の態様を示したものである。図11中、(A)部はモールド複合体18を示す。図11中、(B)部は、(A)部のうち、円で囲まれた部分の拡大図である。 FIG. 11 shows a preferred embodiment of the
図11の(A)部に示すように、モールド複合体18は、針状凹部15の先端(底)に空気抜き孔15Cが形成されたモールド13、及び、モールド13の裏面に貼り合わされ、気体は透過するが液体は透過しない材料で形成された気体透過シート19と、を備える。空気抜き孔15Cは、モールド13の裏面を貫通する貫通孔として形成される。ここで、モールド13の裏面とは、空気抜き孔15Cが形成された側の面を言う。これにより、針状凹部15の先端は空気抜き孔15C、及び気体透過シート19を介して大気と連通する。
このようなモールド複合体18を使用することで、針状凹部15に充填される高分子溶解液は透過せず、針状凹部15に存在する空気のみを針状凹部15から追い出すことができる。これにより、針状凹部15の形状を高分子に転写する転写性が良くなり、よりシャープな針部を形成することができる。As shown in part (A) of FIG. 11 , the
By using such a
空気抜き孔15Cの径D(直径)としては、1~50μmの範囲が好ましい。空気抜き孔15Cの径Dが1μm未満の場合には、空気抜き孔としての役目を十分に果たせない。また、空気抜き孔15Cの径Dが50μmを超える場合には、成形されたマイクロニードルの先端部のシャープ性が損なわれる。 The diameter D (diameter) of the
気体は透過するが液体は透過しない材料で形成された気体透過シート19としては、例えば気体透過性フィルム(住友電気工業社製、ポアフロン(登録商標)、FP-010)を好適に使用できる。 As the gas-
モールド13に用いる材料としては、弾性素材又は金属製素材を用いることができ、弾性素材が好ましく、気体透過性の高い素材がさらに好ましい。気体透過性の代表である酸素透過性は、1×10-12(mL/s・m2・Pa)以上が好ましく、1×10-10(mL/s・m2・Pa)以上がさらに好ましい。なお、1mLは、10-6 m3である。気体透過性を上記範囲とすることにより、モールド13の凹部に存在する空気を型側から追い出すことができ、欠陥の少ないマイクロニードルアレイを製造することができる。このような材料として、具体的には、シリコーン樹脂(例えば、ダウコーニング社製のシルガード184(登録商標)、信越化学工業株式会社のKE-1310ST(品番))、紫外線硬化樹脂、プラスチック樹脂(例えば、ポリスチレン、PMMA(ポリメチルメタクリレート))を溶融、又は溶剤に溶解させたものなどを挙げることができる。これらの中でもシリコーンゴム系の素材は、繰り返し加圧による転写に耐久性があり、かつ素材との剥離性がよいため好ましい。また、金属製素材としては、Ni、Cu、Cr、Mo、W、Ir、Tr、Fe、Co、MgO、Ti、Zr、Hf、V、Nb、Ta、α-酸化アルミニウム、酸化ジルコニウム、ステンレス(例えば、ボーラー・ウッデホルム社(Bohler-Uddeholm KK)のスタバックス材(STAVAX)(商標))などやその合金を挙げることができる。枠の材質としては、モールド13の材質と同様の材質のものを用いることができる。As a material used for the
(水溶性高分子溶解液)
本発明においては、針部の一部を形成するためのポリオワクチン含有液、及び、針部の一部とシート部とを形成するための水溶性高分子溶解液、を準備することが好ましい。
水溶性高分子の種類は、本明細書中で上記した通りである。
上記の液には、二糖類を混合してもよく、二糖類の種類は、本明細書中で上記した通りである。
水溶性高分子溶解液中の水溶性高分子の濃度は、使用する水溶性高分子の種類によっても異なるが、一般的には1~50質量%であることが好ましい。また、溶解に用いる溶媒は、水であってもよいし、水以外であっても揮発性を有するものであればよく、メチルエチルケトン(MEK)、アルコールなどを用いることができる。(Water-soluble polymer solution)
In the present invention, it is preferable to prepare a polio vaccine-containing liquid for forming a portion of the needle portion and a water-soluble polymer solution for forming a portion of the needle portion and the sheet portion.
Types of water-soluble polymers are as described herein above.
The above liquid may be mixed with a disaccharide, the type of disaccharide being as described herein above.
Although the concentration of the water-soluble polymer in the water-soluble polymer solution varies depending on the type of water-soluble polymer used, it is generally preferably 1 to 50% by mass. The solvent used for dissolution may be water, or any solvent other than water as long as it has volatility, such as methyl ethyl ketone (MEK) and alcohol.
(針部の形成)
図12Aに示すように、2次元配列された針状凹部15を有するモールド13が、基台20の上に配置される。モールド13には、5×5の2次元配列された、2組の複数の針状凹部15が形成されている。ポリオワクチン含有液22を収容するタンク30、タンクに接続される配管32、及び、配管32の先端に接続されたノズル34、を有する液供給装置36が準備される。なお、本例では、針状凹部15が5×5で2次元配列されている場合を例示しているが、針状凹部15の個数は5×5に限定されるものではなく、M×N(M及びNはそれぞれ独立に1以上の任意の整数を示し、好ましくは2~30、より好ましくは3~25、さらに好ましくは3~20である)で2次元配列されていればよい。(Formation of needle portion)
As shown in FIG. 12A , a
図13はノズルの先端部の概略斜視図を示している。図13に示すように、ノズル34の先端には平坦面であるリップ部34A及びスリット形状の開口部34Bを備えている。スリット形状の開口部34Bにより、例えば、1列を構成する複数の針状凹部15に同時に、ポリオワクチン含有液22を充填することが可能となる。開口部34Bの大きさ(長さと幅)は、一度に充填すべき針状凹部15の数に応じて適宜選択される。開口部34Bの長さを長くすることで、より多くの針状凹部15に一度にポリオワクチン含有液22を充填することができる。これにより、生産性を向上させることが可能となる。 FIG. 13 shows a schematic perspective view of the tip of the nozzle. As shown in FIG. 13, the tip of the
ノズル34に用いる材料としては、弾性素材又は金属製素材を用いることができる。例えば、テフロン(登録商標)、ステンレス鋼(SUS(Steel Special Use Stainless))、チタン等が挙げられる。 As a material used for the
図12Bに示すように、ノズル34の開口部34Bが針状凹部15の上に位置調整される。ノズル34のリップ部34Aとモールド13の表面とは接触している。タンク30からポリオワクチン含有液22がノズル34に供給され、ノズル34の開口部34Bからポリオワクチン含有液22を針状凹部15に充填する。本実施形態では、1列を構成する複数の針状凹部15にポリオワクチン含有液22を同時に充填する。ただし、これに限定されず、針状凹部15に一つずつ充填するようにすることもできる。 As shown in FIG. 12B, the
モールド13が気体透過性を有する素材で構成される場合、モールド13の裏面から吸引することでポリオワクチン含有液22を吸引でき、針状凹部15内へのポリオワクチン含有液22の充填を促進することができる。 When the
図12Bに示す充填工程に次いで、図12Cに示すように、ノズル34のリップ部34Aとモールド13の表面とを接触させながら、開口部34Bの長さ方向と垂直方向に液供給装置36を相対的に移動し、ノズル34を、ポリオワクチン含有液22が充填されていない針状凹部15に移動する。ノズル34の開口部34Bが針状凹部15の上に位置調整される。本実施の形態では、ノズル34を移動させる例で説明したが、モールド13を移動させてもよい。 After the filling step shown in FIG. 12B, as shown in FIG. 12C, the
ノズル34のリップ部34Aとモールド13の表面とを接触させて移動しているので、ノズル34がモールド13の針状凹部15以外の表面に残るポリオワクチン含有液22を掻き取ることができる。ポリオワクチン含有液22をモールド13の針状凹部15以外に残らないようにすることができる。 Since the
モールド13へのダメージを減らし、かつモールド13の圧縮による変形をできるだけ抑制するため、移動する際のノズル34のモールド13への押付け圧はできる限り小さい方が好ましい。また、ポリオワクチン含有液22がモールド13の針状凹部15以外に残らないようにするため、モールド13もしくはノズル34の少なくとも一方がフレキシブルな弾性変形する素材であることが望ましい。 In order to reduce damage to the
図12Bの充填工程と、図12Cの移動工程とを繰り返すことで、5×5の2次元配列された針状凹部15にポリオワクチン含有液22が充填される。5×5の2次元配列された針状凹部15にポリオワクチン含有液22が充填されると、隣接する5×5の2次元配列された針状凹部15に液供給装置36を移動し、図12Bの充填工程と、図12Cの移動工程とを繰り返す。隣接する5×5の2次元配列された針状凹部15にもポリオワクチン含有液22が充填される。 By repeating the filling step of FIG. 12B and the moving step of FIG. 12C, the polio vaccine-containing
上述の充填工程と移動工程は、(1)ノズル34を移動しながらポリオワクチン含有液22を針状凹部15に充填する態様でもよいし、(2)ノズル34の移動中に針状凹部15の上でノズル34を一旦静止してポリオワクチン含有液22を充填し、充填後にノズル34を再度移動させる態様でもよい。充填工程と移動工程との間、ノズル34のリップ部34Aはモールド13の表面に接触している。 The above-described filling step and moving step may be (1) filling the polio vaccine-containing
図14は、ポリオワクチン含有液22を針状凹部15に充填する際のノズル34の先端とモールド13との部分拡大図である。図14に示すように、ノズル34内に加圧力P1を加えることで、針状凹部15内にポリオワクチン含有液22を充填するのを促進することができる。さらに、針状凹部15内にポリオワクチン含有液22を充填する際の、ノズル34をモールド13の表面に接触させる押付け力P2を、ノズル34内の加圧力P1以上とすることが好ましい。押付け力P2≧加圧力P1とすることにより、ポリオワクチン含有液22が針状凹部15からモールド13の表面に漏れ出すのを抑制することができる。 FIG. 14 is a partially enlarged view of the tip of the
図15は、ノズル34の移動中における、ノズル34の先端とモールド13との部分拡大図である。ノズル34をモールド13に対して相対的に移動する際は、ノズル34をモールド13の表面に接触させる押付け力P3を、充填中のノズル34をモールド13の表面に接触させる押付け力P2より小さくすることが好ましい。モールド13へのダメージを減らし、モールド13の圧縮による変形を抑制するためである。 FIG. 15 is a partially enlarged view of the tip of the
5×5で構成される複数の針状凹部15への充填が完了すると、ノズル34は、隣接する5×5で構成される複数の針状凹部15へ移動する。液供給に関して、隣接する5×5で構成される複数の針状凹部15へ移動する際は、ポリオワクチン含有液22の供給を停止するのが好ましい。5列目の針状凹部15から次の1列目の針状凹部15までは距離があるため、その距離をノズル34が移動する間に、ポリオワクチン含有液22を供給し続けると、ノズル34内の液圧が高くなりすぎる場合がある。その結果、ノズル34からポリオワクチン含有液22がモールド13の針状凹部15以外に流れ出る場合があり、これを抑制するため、ノズル34内の液圧を検出し、液圧が高くなりすぎると判定した際にはポリオワクチン含有液22の供給を停止するのが好ましい。 When the filling of the plurality of 5×5 needle-
なお、上記においてはノズルを有するディスペンサーを用いてポリオワクチン含有液を供給する方法を説明したが、ディスペンサーによる塗布に加えて、バー塗布、スピン塗布、スプレーなどによる塗布などを適用することもできる。 In the above description, a method of supplying the polio vaccine-containing liquid using a dispenser having a nozzle has been described.
本発明においては、ポリオワクチン含有液を針状凹部に供給した後、乾燥処理を実施することが好ましい。
好ましくは、本発明のマイクロニードルアレイは、ポリオワクチン含有液を充填した針部形成用モールドを、乾燥することによって針部の一部を形成する工程;及び水溶性高分子溶解液を、上記で形成された針部の一部の上面に充填して乾燥する工程によって製造することができる。In the present invention, it is preferable to carry out a drying treatment after supplying the polio vaccine-containing liquid to the needle-shaped concave portions.
Preferably, the microneedle array of the present invention comprises a step of forming part of the needles by drying a needle-forming mold filled with a polio vaccine-containing liquid; It can be manufactured by a process of filling a part of the upper surface of the formed needle portion and drying it.
ポリオワクチン含有液を充填した針部形成用モールドを乾燥する際の条件としては、乾燥開始後30分から300分間経過してから、ポリオワクチン含有液の含水率が20質量%以下に到達する条件であることが好ましい。
特に好ましくは、上記の乾燥は、ポリオワクチンが失活しない温度以下に保ち、かつ乾燥開始後60分以上経過してから、ポリオワクチン含有液の含水率が20質量%以下に到達するように制御する。The conditions for drying the needle portion forming mold filled with the polio vaccine-containing liquid are such that the moisture content of the polio vaccine-containing liquid reaches 20% by mass or less 30 to 300 minutes after the start of drying. Preferably.
Particularly preferably, the drying is controlled so that the polio vaccine is kept at a temperature below which the polio vaccine is not inactivated, and the water content of the polio vaccine-containing liquid reaches 20% by mass or less after 60 minutes or more have passed since the start of drying. do.
上記した乾燥速度の制御の方法としては、例えば、温度、湿度、乾燥風量、容器の使用、容器の容積及び/又は形状など、乾燥を遅らすことが可能な任意の手段を取ることができる。 As a method for controlling the drying speed described above, any means capable of delaying drying, such as temperature, humidity, drying air volume, use of container, volume and/or shape of container, can be taken.
乾燥は、好ましくは、ポリオワクチンを含む第一の水溶性高分子溶解液を充填した針部形成用モールドを、容器を被せた状態又は容器に収容した状態で、行うことができる。
乾燥の際の温度は、好ましくは1~45℃であり、より好ましくは1~40℃である。
乾燥の際の相対湿度は、好ましくは10~95%であり、より好ましくは20~95%であり、さらに好ましくは30~95%である。Drying can preferably be carried out with the needle portion forming mold filled with the first water-soluble polymer solution containing the polio vaccine covered with a container or housed in a container.
The temperature during drying is preferably 1 to 45°C, more preferably 1 to 40°C.
The relative humidity during drying is preferably 10-95%, more preferably 20-95%, still more preferably 30-95%.
(針部の下端部およびシート部の形成)
針部の下端部およびシート部を形成する工程について、いくつかの態様を説明する。
針部の下端部およびシート部を形成する工程について、第1の態様について図16Aから16Dを参照して説明する。モールド13の針状凹部15にポリオワクチン含有液22をノズル34から充填する(図16A)。次いで、図16Bに示すように、ポリオワクチン含有液22を乾燥固化させることで、針状凹部15内にポリオワクチンを含む層120が形成される。次いで、図16Cに示すように、ポリオワクチンを含む層120が形成されたモールド13に、水溶性高分子溶解液24をディスペンサーにより塗布する。ディスペンサーによる塗布に加えて、バー塗布、スピン塗布、スプレーなどによる塗布などを適用することができる。ポリオワクチンを含む層120は固化されているので、ポリオワクチンが、水溶性高分子溶解液24に拡散するのを抑制することができる。次いで、図16Dに示すように、水溶性高分子溶解液24を乾燥固化させることで、複数の針部112、錐台部113及び、シート部116から構成されるマイクロニードルアレイ1が形成される。(Formation of the lower end of the needle portion and the sheet portion)
Several aspects of the process of forming the lower end of the needle portion and the seat portion will be described.
The process of forming the lower end portion of the needle portion and the seat portion will now be described for a first aspect with reference to FIGS. 16A to 16D. The polio vaccine-containing
第1の態様において、ポリオワクチン含有液22、及び水溶性高分子溶解液24の針状凹部15内への充填を促進させるために、モールド13の表面からの加圧、及び、モールド13の裏面からの減圧吸引を行うことも好ましい。 In the first embodiment, in order to promote the filling of the polio vaccine-containing
次に、第2の態様について図17Aから17Cを参照して説明する。図17Aに示すように、モールド13の針状凹部15にポリオワクチン含有液22をノズル34から充填する。次いで、図16Bと同様に、ポリオワクチン含有液22を乾燥固化させることで、ポリオワクチンを含む層120が針状凹部15内に形成される。次に、図17Bに示すように、別の支持体29の上に、水溶性高分子溶解液24を塗布する。支持体29は限定されるものではないが、例えば、ポリエチレン、ポリエチレンテレフタレート、ポリカーボネート、ポリプロピレン、アクリル樹脂、トリアセチルセルロース、ガラス等を使用することができる。次に、図17Cに示すように、針状凹部15にポリオワクチンを含む層120が形成されたモールド13に、支持体29の上に形成された水溶性高分子溶解液24を重ねる。これにより、水溶性高分子溶解液24を針状凹部15の内部に充填する。ポリオワクチンを含む層は固化されているので、ポリオワクチンが、水溶性高分子溶解液24に拡散するのを抑制することができる。次に、水溶性高分子溶解液24を乾燥固化することで、複数の針部112、錐台部113及びシート部116から構成されるマイクロニードルアレイ1が形成される。 A second aspect will now be described with reference to FIGS. 17A to 17C. As shown in FIG. 17A, needle-
第2の態様において、水溶性高分子溶解液24の針状凹部15内への充填を促進するために、モールド13の表面からの加圧及びモールド13の裏面からの減圧吸引を行うことも好ましい。 In the second aspect, it is also preferable to pressurize from the front surface of the
水溶性高分子溶解液24を乾燥させる方法としては、高分子溶解液中の溶媒を揮発させる工程であればよい。その方法は特に限定されず、例えば加熱、送風、減圧等の方法が用いられる。乾燥処理は、1~50℃で1~72時間の条件で行うことができる。送風の場合には、0.1~10m/秒の温風を吹き付ける方法が挙げられる。乾燥温度は、ポリオワクチン含有液22内のポリオワクチンを熱劣化させない温度であることが好ましい。 As a method for drying the water-
(剥離)
マイクロニードルアレイをモールド13から剥離する方法は特に限定されない。剥離の際に針部が曲がったり折れたりしないことが好ましい。具体的には、図18に示すように、マイクロニードルアレイの上に、粘着性の粘着層が形成されているシート状の基材40を付着させた後、端部から基材40をめくるように剥離を行うことができる。ただし、この方法では針部が曲がる可能性がある。そのため、図19に示すように、マイクロニードルアレイの上の基材40に吸盤(図示せず)を設置し、エアーで吸引しながら垂直に引き上げる方法を適用することができる。なお、基材40として支持体29を使用してもよい。(peeling)
A method for separating the microneedle array from the
図20はモールド13から剥離されたマイクロニードルアレイ2を示している。マイクロニードルアレイ2は、基材40、基材40の上に形成された針部112、錐台部113及びシート部116で構成される。針部112は、円錐形状又は多角錐形状を少なくとも先端に有しているが、針部112はこの形状に限定されるものではない FIG. 20 shows the
以下に、本発明の実施例を挙げて本発明をさらに具体的に説明する。なお、以下の実施例に示される材料、使用量、割合、処理内容、処理手順等は、本発明の趣旨を逸脱しない限り適宜変更することができる。したがって、本発明の範囲は以下に示す具体例により限定的に解釈されるべきものではない。 EXAMPLES The present invention will be described in more detail below with reference to Examples of the present invention. The materials, amounts used, proportions, processing details, processing procedures, etc. shown in the following examples can be changed as appropriate without departing from the gist of the present invention. Therefore, the scope of the present invention should not be construed to be limited by the specific examples shown below.
本発明のマイクロニードルアレイの製造法としては、特に限定されないが、(1)モールドの製造工程、(2) ポリオワクチン含有液及び水溶性高分子溶解液を調製する工程、(3) ポリオワクチン含有液をモールドに充填し、針部の上端部を形成する工程、(4)水溶性高分子溶解液をモールドに充填し、針部の下端部およびシート部を形成する工程、(5)モールドから剥離する工程、を含む製造法によって得ることが好ましい。 The method for producing the microneedle array of the present invention is not particularly limited, but includes (1) a step of producing a mold, (2) a step of preparing a polio vaccine-containing solution and a water-soluble polymer solution, and (3) containing a polio vaccine. (4) filling the mold with a solution of water-soluble polymer to form the lower end of the needle and the sheet; (5) starting from the mold; It is preferably obtained by a manufacturing method including a peeling step.
略称は以下を示す。
HES:ヒドロキシエチルスターチ
DEX:デキストラン
CS:コンドロイチン硫酸
Suc:スクロース
Tre:トレハロース
MD:マルトデキストリン
MC:メチルセルロース
CMC:カルボキシメチルセルロース
PVP:ポリビニルピロリドン
sIPV:不活化ポリオワクチン(セービン株由来)
ELISA:酵素結合免疫吸収アッセイAbbreviations are as follows.
HES: Hydroxyethyl Starch DEX: Dextran CS: Chondroitin Sulfate Suc: Sucrose Tre: Trehalose MD: Maltodextrin MC: Methylcellulose CMC: Carboxymethylcellulose PVP: Polyvinylpyrrolidone sIPV: Inactivated polio vaccine (derived from Sabin strain)
ELISA: enzyme-linked immunosorbent assay
不活化ポリオワクチン内包マイクロニードルアレイの作製
(モールドの製造)
一辺40mmの平滑なNi板の表面に、図21に示すような、底面が500μmの直径D1で、150μmの高さH1の円錐台50上に、300μmの直径D2で、500μmの高さH2の円錐52が形成された針状構造の形状部12を、1000μmのピッチL1にて四角形状に100本の針を2次元正方配列に研削加工することで、原版11を作製した。この原版11の上に、シリコンゴム(ダウ・コーニング社製SILASTIC MDX4-4210)を0.6mmの厚みで膜を形成し、膜面から原版11の円錐先端部50μmを突出させた状態で熱硬化させ、剥離した。これにより、約30μmの直径の貫通孔を有するシリコンゴムの反転品を作製した。このシリコンゴム反転品の、中央部に10列×10行の2次元配列された針状凹部が形成された、一辺30mmの平面部外を切り落としたものをモールドとして用いた。針状凹部の開口部が広い方をモールドの表面とし、30μmの直径の貫通孔(空気抜き孔)を有する面をモールドの裏面とした。Fabrication of microneedle array containing inactivated polio vaccine (manufacture of mold)
On the surface of a smooth Ni plate with a side of 40 mm, as shown in FIG. The
(ポリオワクチン含有液の調製)
セービン株由来の不活化ポリオワクチン(不活化ポリオワクチンI型、II型、およびIII型を含む)を限外濾過法によって濃縮した後、表1に示す成分と混合した水溶液を調製し、ポリオワクチン含有液とした。各成分の使用量については、下記表に記載した通りである。(Preparation of Polio Vaccine-Containing Liquid)
An inactivated polio vaccine derived from the Sabin strain (including inactivated polio vaccine types I, II, and III) was concentrated by ultrafiltration, and then mixed with the ingredients shown in Table 1 to prepare an aqueous solution, and the polio vaccine was prepared. contained liquid. The amount of each component used is as shown in the table below.
(針部の下端部およびシート部を形成する水溶性高分子溶解液の調製)
表2に示す成分を、マイクロニードルアレイ成形時に表2の組成となるように任意の濃度比率で水に溶解し、針部の下端部およびシート部を形成する水溶性高分子溶解液を調製した。(Preparation of water-soluble polymer solution forming lower end of needle and sheet)
The components shown in Table 2 were dissolved in water at an arbitrary concentration ratio so that the composition shown in Table 2 was obtained when the microneedle array was molded, to prepare a water-soluble polymer solution for forming the lower ends of the needles and the sheet. .
(ポリオワクチン含有液の充填及び乾燥)
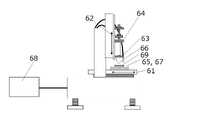
図22に示す充填装置を使用した。充填装置は、モールドとノズルの相対位置座標を制御するX軸駆動部61及びZ軸駆動部62、ノズル63を取り付け可能な液供給装置64(武蔵エンジニアリング社製超微量定量ディスペンサーSMP-III)、モールド69を固定する吸引台65、モールド表面形状を測定するレーザー変位計66(パナソニック社製HL-C201A)、ノズル押し込み圧力を測定するロードセル67(共和電業製LCX-A-500N)、及び表面形状及び押し付け圧力の測定値のデータを基にZ軸を制御する制御機構68を備える。(Filling and Drying of Polio Vaccine Containing Liquid)
A filling apparatus as shown in FIG. 22 was used. The filling device includes an
水平な吸引台上に一辺15mmの気体透過性フィルム(住友電気工業社製、ポアフロン(登録商標)、FP-010)を置き、その上に表面が上になるようにモールドを設置した。モールド裏面方向からゲージ圧90kPaの吸引圧で減圧して、気体透過性フィルムとモールドをバキューム台に固定した。 A gas-permeable film (Poreflon (registered trademark), FP-010, manufactured by Sumitomo Electric Industries, Ltd.) of 15 mm on a side was placed on a horizontal suction table, and a mold was placed thereon so that the surface faced upward. The gas-permeable film and the mold were fixed to a vacuum stand by reducing the pressure from the back side of the mold with a suction pressure of 90 kPa gauge pressure.
図13に示すような形状のSUS製(ステンレス鋼)のノズルを準備し、長さ20mm、幅2mmのリップ部の中央に、長さ12mm、幅0.2mmのスリット状の開口部を形成した。このノズルを液供給装置に接続した。3mLのポリオワクチン含有液を、液供給装置とノズル内部に装填した。開口部を、モールドの表面に形成された複数の針状凹部で構成される1列目と平行となるようにノズルを調整した。1列目に対して2列目と反対方向に2mmの間隔をおいた位置で、ノズルを1.372×104Pa(0.14kgf/cm2)の圧力でモールドに押し付けた。ノズルを押し付けたまま、押し付け圧の変動が±0.490×104Pa(0.05kgf/cm2)に収まるようにZ軸を制御しつつ、0.5mm/秒で開口部の長さ方向に対して垂直な方向に移動させながら、液供給装置にて、ポリオワクチン含有液を、0.15μL/秒で20秒間、開口部から放出した。2次元配列された複数の針状凹部の孔パターンを通過して、2mm間隔を置いた位置でノズルの移動を停止し、ノズルをモールドから離した。A SUS (stainless steel) nozzle having a shape as shown in FIG. 13 was prepared, and a slit-shaped opening having a length of 12 mm and a width of 0.2 mm was formed in the center of a lip portion having a length of 20 mm and a width of 2 mm. . This nozzle was connected to a liquid feeder. 3 mL of polio vaccine-containing liquid was loaded inside the liquid supply device and the nozzle. The nozzle was adjusted so that the opening was parallel to the first row composed of a plurality of needle-like recesses formed on the surface of the mold. The nozzles were pressed against the mold with a pressure of 1.372×104 Pa (0.14 kgf/cm2 ) at a position spaced 2 mm from the first row in the direction opposite to the second row. While pressing the nozzle, while controlling the Z-axis so that the variation of the pressing pressure is within ±0.490 × 104 Pa (0.05 kgf/cm2 ), the nozzle is moved along the length of the opening at 0.5 mm/sec. The polio vaccine-containing liquid was discharged from the opening at 0.15 μL/sec for 20 seconds by the liquid feeder while moving in a direction perpendicular to the opening. After passing through the two-dimensionally arranged hole pattern of a plurality of needle-like recesses, the movement of the nozzle was stopped at a position with an interval of 2 mm, and the nozzle was separated from the mold.
ポリオワクチン含有液を充填したモールドを、温度23℃、相対湿度45%の環境下で、容器を被せた状態で静置し、乾燥した。このとき、ポリオワクチン含有液は、徐々に乾燥され、60分以上経過した後に、含水率が20質量%以下となるようにした。 The mold filled with the polio vaccine-containing liquid was allowed to stand while covered with a container in an environment of 23° C. and 45% relative humidity to dry. At this time, the polio vaccine-containing liquid was gradually dried so that after 60 minutes or more had passed, the water content was 20% by mass or less.
(針部の下端部およびシート部の形成及び乾燥)
シート部を形成する支持体としては、ポリエチレンテレフタレート(PET)シート(175μm)をクラウドリムーバー(Victor jvc社)を用いて、以下条件(使用ガス:O2、ガス圧:13Pa、高周波(RF)電力:100W、照射時間:3分、O2流量:SV250、目標真空度(CCG):2.0×10-4Pa)にて親水化プラズマ処理したものを用いた。処理を施したPET上に、水溶性高分子溶解液を、表裏面に対して75μmの膜厚で塗布した。一方で、ポリオワクチン含有液を充填したモールドを吸引台に吸引固定した。水溶性高分子溶解液を塗布したPETの表面側が、モールド表面と向かい合わせになるように配置し、更にPETとモールド間の空隙、および、PETのモールドと反対側の空間を2分間減圧した。減圧後、PETのモールドと反対側の空間のみを大気圧開放することで、水溶性高分子溶解液を塗布したPETと、モールドを貼り合せた。10分間接触状態を維持した後、PETとモールドが貼り合わさって一体となったものを乾燥した。(Formation and drying of lower end of needle portion and sheet portion)
As a support for forming the sheet portion, a polyethylene terephthalate (PET) sheet (175 μm) was used with a cloud remover (Victor Jvc) under the following conditions (used gas: O2 , gas pressure: 13 Pa, high frequency (RF) power : 100 W, irradiation time: 3 minutes, O2 flow rate: SV250, target degree of vacuum (CCG): 2.0×10−4 Pa). A water-soluble polymer solution was applied on the treated PET to a film thickness of 75 μm on the front and back surfaces. On the other hand, the mold filled with the polio vaccine-containing liquid was fixed to the suction table by suction. The surface side of the PET coated with the water-soluble polymer solution was arranged to face the mold surface, and the space between the PET and the mold and the space on the opposite side of the PET mold were evacuated for 2 minutes. After the pressure was reduced, only the space on the opposite side of the PET mold was released to atmospheric pressure, and the PET coated with the water-soluble polymer solution and the mold were bonded together. After maintaining the contact state for 10 minutes, the PET and mold bonded together were dried.
(剥離)
乾燥固化したマイクロニードルアレイをモールドから慎重に剥離することで、ポリオワクチンを内包したマイクロニードルアレイを作製した。本マイクロニードルアレイは、シート部と錘台部と針部から構成されており、針部が、高さ:約460μm、基底部の幅:約270μm、錘台部が、高さ約130μm、上底面直径約270μm、下底面直径約460μmの円錐台構造であり、シート部厚さ約205μm(このうちポリエチレンテレフタレート約175μm)、針本数100本、針の間隔約1mmで正方配置されている。(peeling)
A polio vaccine-encapsulated microneedle array was prepared by carefully peeling the dried and solidified microneedle array from the mold. This microneedle array is composed of a sheet portion, a frustum portion, and a needle portion. It has a truncated cone structure with a bottom diameter of about 270 μm and a lower bottom diameter of about 460 μm, a sheet portion thickness of about 205 μm (of which polyethylene terephthalate is about 175 μm), and 100 needles arranged in a square with an interval of about 1 mm.
試験例1:マイクロニードルアレイ製造前後のポリオワクチンの活性
作製したマイクロニードルアレイの針部を回収し、溶解液(Tween(登録商標)20 0.5質量%および牛血清アルブミン1.0質量%を含有するリン酸緩衝生理食塩水(PBS))0.5mLで溶解した後、ポリオワクチンのD抗原に特異的に反応する抗体を固相化して試験系を構築したELISA法を用いて、ポリオワクチンの活性を以下の判定基準により評価した。結果を表3に示す。Test Example 1: Activity of polio vaccine before and after microneedle array production After dissolving in 0.5 mL of phosphate-buffered saline (PBS) containing polio vaccine, an antibody that specifically reacts with the D antigen of the polio vaccine was immobilized, and a test system was constructed using the ELISA method to construct a polio vaccine. was evaluated according to the following criteria. Table 3 shows the results.
<判定基準>
マイクロニードルアレイ溶解液をELISAで測定して得られた定量結果が、予想含量(充填液中のポリオワクチン濃度(μg/mL)×モールドへの充填重量(mg))に対し、ポリオワクチンI型、II型およびIII型のいずれもが70%以上の場合をAとし、何れか一つ以上の型が70%未満の場合をBとした。<Judgment Criteria>
The quantitative results obtained by measuring the microneedle array lysate by ELISA showed that the expected content (polio vaccine concentration in the filling solution (μg/mL) × filling weight of the mold (mg)) was positive for polio vaccine type I. , Type II and III were rated as A when both were 70% or more, and B when at least one type was less than 70%.
試験例2:ワクチンの経時安定性
実施例1および2と同様にして、ポリオワクチン含有液の基材としてスクロースもしくはトレハロースを使用し、シート部の基材としてHESを使用して、ポリオワクチンI型、II型またはIII型を含有したポリオワクチンを内包したマイクロニードルアレイを作製した。Test Example 2: Vaccine Stability Over Time In the same manner as in Examples 1 and 2, sucrose or trehalose was used as the base material for the polio vaccine-containing liquid, and HES was used as the base material for the sheet portion. A microneedle array encapsulating a polio vaccine containing , type II or type III was produced.
作製したマイクロニードルアレイを、45℃環境の恒温室に保管し、所定の期間ごとにマイクロニードルアレイの針部を回収し、溶解液(Tween(登録商標)20 0.5質量%、牛血清アルブミン1.0質量%を含有するPBS)0.5mLで溶解した後、ポリオワクチンのD抗原に特異的に反応する抗体を固相化して試験系を構築したELISA法を用いて、ワクチン活性を評価した。
比較対象として、sIPV標準物質(一般財団法人阪大微生物病研究会:力価試験用参照品)を同時評価した。
結果を図23に示す。The prepared microneedle array is stored in a constant temperature room at 45° C., the needles of the microneedle array are collected at predetermined intervals, and dissolved in a solution (Tween (registered trademark) 20 0.5% by mass, bovine serum albumin After dissolving in 0.5 mL of PBS containing 1.0% by mass, vaccine activity is evaluated using the ELISA method in which a test system is constructed by immobilizing an antibody that specifically reacts with the D antigen of the polio vaccine. bottom.
As a comparative object, an sIPV standard substance (General Incorporated Foundation for Microbial Disease Research, Osaka University: reference product for potency test) was simultaneously evaluated.
The results are shown in FIG.
1 マイクロニードルアレイ
2 マイクロニードルアレイ
110 マイクロニードル
112 針部
112A 針部第1層
112B 針部第2層
113 錐台部
116 シート部
120 ポリオワクチンを含む層
122 ポリオワクチンを含まない層
W 直径(幅)
H 高さ
T 高さ(厚み)
11 原版
12 形状部
13 モールド
15 針状凹部
15A 入口部
15B 先端凹部
15C 空気抜き孔
D 径(直径)
18 モールド複合体
19 気体透過シート
20 基台
22 ポリオワクチン含有液
24 水溶性高分子溶解液
29 支持体
30 タンク
32 配管
34 ノズル
34A リップ部
34B 開口部
36 液供給装置
P1 加圧力
P2 押付け力
P3 押付け力
40 基材
50 円錐台
52 円錐
D1 直径
D2 直径
L1 ピッチ
H1 高さ
H2 高さ
61 X軸駆動部
62 Z軸駆動部
63 ノズル
64 液供給装置
65 吸引台
66 レーザー変位計
67 ロードセル
68 制御機構
69 モールド1
H height T height (thickness)
11
18
Claims (5)
Translated fromJapanesePriority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019097405AJP7205041B2 (en) | 2019-05-24 | 2019-05-24 | Polio vaccine encapsulating microneedle array |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019097405AJP7205041B2 (en) | 2019-05-24 | 2019-05-24 | Polio vaccine encapsulating microneedle array |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020189038A JP2020189038A (en) | 2020-11-26 |
| JP7205041B2true JP7205041B2 (en) | 2023-01-17 |
Family
ID=73454163
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019097405AActiveJP7205041B2 (en) | 2019-05-24 | 2019-05-24 | Polio vaccine encapsulating microneedle array |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7205041B2 (en) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017213169A1 (en) | 2016-06-07 | 2017-12-14 | 富士フイルム株式会社 | Microneedle array |
| WO2018005769A1 (en) | 2016-06-29 | 2018-01-04 | Duke University | Compositions and methods for activating antigen presenting cells with chimeric poliovirus |
| WO2019028526A1 (en) | 2017-08-10 | 2019-02-14 | Vaxxas Pty Limited | Differential coating of microprojections and microneedles on arrays |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102494544B1 (en)* | 2015-09-15 | 2023-02-02 | 주식회사 엘지생활건강 | Soluble microneedle patch for Polio vaccine delivery |
- 2019
- 2019-05-24JPJP2019097405Apatent/JP7205041B2/enactiveActive
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017213169A1 (en) | 2016-06-07 | 2017-12-14 | 富士フイルム株式会社 | Microneedle array |
| WO2018005769A1 (en) | 2016-06-29 | 2018-01-04 | Duke University | Compositions and methods for activating antigen presenting cells with chimeric poliovirus |
| WO2019028526A1 (en) | 2017-08-10 | 2019-02-14 | Vaxxas Pty Limited | Differential coating of microprojections and microneedles on arrays |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020189038A (en) | 2020-11-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6736337B2 (en) | Micro needle array | |
| AU2016320947B2 (en) | Microneedle array | |
| WO2015174161A1 (en) | Transdermal absorption sheet and method of manufacturing transdermal absorption sheet | |
| KR102264647B1 (en) | microneedle array | |
| JP2016030072A (en) | Microneedle array | |
| JP6482323B2 (en) | Transdermal absorption sheet | |
| WO2019163805A1 (en) | Manufacturing method for microneedle array | |
| US20210121674A1 (en) | Japanese encephalitis vaccine-containing microneedle array | |
| JP6778296B2 (en) | Microneedle array | |
| US20210378951A1 (en) | Microneedle array and method of producing microneedle array | |
| JP2016067681A (en) | Microneedle array | |
| JP7205041B2 (en) | Polio vaccine encapsulating microneedle array | |
| WO2017179613A1 (en) | Method for manufacturing microneedle array | |
| US20230201108A1 (en) | Japanese encephalitis preventive agent and japanese encephalitis vaccine agent |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination | Free format text:JAPANESE INTERMEDIATE CODE: A621 Effective date:20210714 | |
| A977 | Report on retrieval | Free format text:JAPANESE INTERMEDIATE CODE: A971007 Effective date:20220722 | |
| A131 | Notification of reasons for refusal | Free format text:JAPANESE INTERMEDIATE CODE: A131 Effective date:20220726 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20220906 | |
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) | Free format text:JAPANESE INTERMEDIATE CODE: A01 Effective date:20221206 | |
| A711 | Notification of change in applicant | Free format text:JAPANESE INTERMEDIATE CODE: A711 Effective date:20221209 | |
| A61 | First payment of annual fees (during grant procedure) | Free format text:JAPANESE INTERMEDIATE CODE: A61 Effective date:20221209 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A821 Effective date:20221212 | |
| R150 | Certificate of patent or registration of utility model | Ref document number:7205041 Country of ref document:JP Free format text:JAPANESE INTERMEDIATE CODE: R150 |