JP4312955B2 - Peptide antagonists of vascular endothelial growth factor - Google Patents
Peptide antagonists of vascular endothelial growth factorDownload PDFInfo
- Publication number
- JP4312955B2 JP4312955B2JP2000524433AJP2000524433AJP4312955B2JP 4312955 B2JP4312955 B2JP 4312955B2JP 2000524433 AJP2000524433 AJP 2000524433AJP 2000524433 AJP2000524433 AJP 2000524433AJP 4312955 B2JP4312955 B2JP 4312955B2
- Authority
- JP
- Japan
- Prior art keywords
- vegf
- gst
- polypeptide
- cells
- exon
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 108010019530Vascular Endothelial Growth FactorsProteins0.000titleclaimsdescription260
- 108090000765processed proteins & peptidesProteins0.000titleclaimsdescription79
- 239000005557antagonistSubstances0.000titleclaimsdescription40
- 102000005789Vascular Endothelial Growth FactorsHuman genes0.000titleclaims10
- 108010073929Vascular Endothelial Growth Factor AProteins0.000titledescription252
- 102000004196processed proteins & peptidesHuman genes0.000claimsdescription71
- 229920001184polypeptidePolymers0.000claimsdescription64
- 206010028980NeoplasmDiseases0.000claimsdescription42
- 230000000694effectsEffects0.000claimsdescription31
- 230000033115angiogenesisEffects0.000claimsdescription28
- 208000037265diseases, disorders, signs and symptomsDiseases0.000claimsdescription28
- 201000010099diseaseDiseases0.000claimsdescription16
- 239000000203mixtureSubstances0.000claimsdescription16
- 208000035475disorderDiseases0.000claimsdescription12
- 239000008194pharmaceutical compositionSubstances0.000claimsdescription12
- 102000039446nucleic acidsHuman genes0.000claimsdescription8
- 108020004707nucleic acidsProteins0.000claimsdescription8
- 150000007523nucleic acidsChemical class0.000claimsdescription8
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acidChemical compoundC([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1FWMNVWWHGCHHJJ-SKKKGAJSSA-N0.000claimsdescription6
- 125000003275alpha amino acid groupChemical group0.000claimsdescription6
- 238000002360preparation methodMethods0.000claimsdescription6
- 206010027476MetastasesDiseases0.000claimsdescription5
- 239000003814drugSubstances0.000claimsdescription5
- 230000009401metastasisEffects0.000claimsdescription5
- 239000007787solidSubstances0.000claimsdescription4
- 239000003937drug carrierSubstances0.000claimsdescription3
- 206010039073rheumatoid arthritisDiseases0.000claimsdescription3
- 230000000699topical effectEffects0.000claimsdescription3
- 206010012689Diabetic retinopathyDiseases0.000claimsdescription2
- 208000037976chronic inflammationDiseases0.000claimsdescription2
- 230000006020chronic inflammationEffects0.000claimsdescription2
- 201000008482osteoarthritisDiseases0.000claimsdescription2
- 101000830383Oryctolagus cuniculus Corticostatin-3Proteins0.000claims1
- 206010039491SarcomaDiseases0.000claims1
- 102000009524Vascular Endothelial Growth Factor AHuman genes0.000description251
- 210000004027cellAnatomy0.000description104
- 108010053099Vascular Endothelial Growth Factor Receptor-2Proteins0.000description78
- 230000027455bindingEffects0.000description64
- 108020001507fusion proteinsProteins0.000description50
- 102000037865fusion proteinsHuman genes0.000description50
- 102100033177Vascular endothelial growth factor receptor 2Human genes0.000description42
- 102000016549Vascular Endothelial Growth Factor Receptor-2Human genes0.000description35
- 102000005962receptorsHuman genes0.000description33
- 108020003175receptorsProteins0.000description33
- 108090000623proteins and genesProteins0.000description28
- 235000001014amino acidNutrition0.000description27
- 238000000034methodMethods0.000description26
- 150000001413amino acidsChemical class0.000description25
- 239000013598vectorSubstances0.000description22
- 230000002401inhibitory effectEffects0.000description21
- 230000035755proliferationEffects0.000description20
- 102000005720Glutathione transferaseHuman genes0.000description19
- 108010070675Glutathione transferaseProteins0.000description19
- 230000009467reductionEffects0.000description19
- 125000000151cysteine groupChemical groupN[C@@H](CS)C(=O)*0.000description18
- 102000004169proteins and genesHuman genes0.000description18
- 210000002889endothelial cellAnatomy0.000description17
- 235000018102proteinsNutrition0.000description17
- 108010029485Protein IsoformsProteins0.000description16
- 102000001708Protein IsoformsHuman genes0.000description16
- 238000004132cross linkingMethods0.000description16
- 230000014509gene expressionEffects0.000description15
- 108020004414DNAProteins0.000description14
- 230000005764inhibitory processEffects0.000description14
- 230000015572biosynthetic processEffects0.000description12
- 206010029113NeovascularisationDiseases0.000description11
- 230000012010growthEffects0.000description11
- 229960002897heparinDrugs0.000description10
- 229920000669heparinPolymers0.000description10
- 239000013604expression vectorSubstances0.000description9
- 238000009472formulationMethods0.000description9
- 239000012634fragmentSubstances0.000description9
- 230000001965increasing effectEffects0.000description9
- 239000003112inhibitorSubstances0.000description9
- VPFUWHKTPYPNGT-UHFFFAOYSA-N3-(3,4-dihydroxyphenyl)-1-(5-hydroxy-2,2-dimethylchromen-6-yl)propan-1-oneChemical compoundOC1=C2C=CC(C)(C)OC2=CC=C1C(=O)CCC1=CC=C(O)C(O)=C1VPFUWHKTPYPNGT-UHFFFAOYSA-N0.000description8
- HTTJABKRGRZYRN-UHFFFAOYSA-NHeparinChemical compoundOC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1HTTJABKRGRZYRN-UHFFFAOYSA-N0.000description8
- 102000009484Vascular Endothelial Growth Factor ReceptorsHuman genes0.000description8
- 238000011534incubationMethods0.000description8
- 230000002297mitogenic effectEffects0.000description8
- 230000001225therapeutic effectEffects0.000description8
- 108090000379Fibroblast growth factor 2Proteins0.000description7
- 102000003974Fibroblast growth factor 2Human genes0.000description7
- 108091008605VEGF receptorsProteins0.000description7
- 238000012217deletionMethods0.000description7
- 230000037430deletionEffects0.000description7
- 238000002474experimental methodMethods0.000description7
- 239000000499gelSubstances0.000description7
- 239000003102growth factorSubstances0.000description7
- 108010038082heparin proteoglycanProteins0.000description7
- 210000001519tissueAnatomy0.000description7
- 238000004458analytical methodMethods0.000description6
- 238000001516cell proliferation assayMethods0.000description6
- 238000002347injectionMethods0.000description6
- 239000007924injectionSubstances0.000description6
- 238000002415sodium dodecyl sulfate polyacrylamide gel electrophoresisMethods0.000description6
- 238000006467substitution reactionMethods0.000description6
- 231100000765toxinToxicity0.000description6
- 210000003606umbilical veinAnatomy0.000description6
- 108091003079Bovine Serum AlbuminProteins0.000description5
- 241000588724Escherichia coliSpecies0.000description5
- 108010010803GelatinProteins0.000description5
- 238000003556assayMethods0.000description5
- 201000011510cancerDiseases0.000description5
- 239000012894fetal calf serumSubstances0.000description5
- 229920000159gelatinPolymers0.000description5
- 239000008273gelatinSubstances0.000description5
- 235000019322gelatineNutrition0.000description5
- 235000011852gelatine dessertsNutrition0.000description5
- 230000001404mediated effectEffects0.000description5
- 239000013612plasmidSubstances0.000description5
- 230000003389potentiating effectEffects0.000description5
- 239000003053toxinSubstances0.000description5
- 108700012359toxinsProteins0.000description5
- 238000012546transferMethods0.000description5
- 241000894006BacteriaSpecies0.000description4
- 206010006187Breast cancerDiseases0.000description4
- 208000026310Breast neoplasmDiseases0.000description4
- 101100381481Caenorhabditis elegans baz-2 geneProteins0.000description4
- 108700032819Croton tiglium crotin IIProteins0.000description4
- 102000018233Fibroblast Growth FactorHuman genes0.000description4
- 108050007372Fibroblast Growth FactorProteins0.000description4
- 241000238631HexapodaSpecies0.000description4
- 101100372762Rattus norvegicus Flt1 geneProteins0.000description4
- 206010038933Retinopathy of prematurityDiseases0.000description4
- IQFYYKKMVGJFEH-XLPZGREQSA-NThymidineChemical compoundO=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1IQFYYKKMVGJFEH-XLPZGREQSA-N0.000description4
- 239000011324beadSubstances0.000description4
- 230000004071biological effectEffects0.000description4
- 210000004204blood vesselAnatomy0.000description4
- 210000004899c-terminal regionAnatomy0.000description4
- 229940126864fibroblast growth factorDrugs0.000description4
- 230000006698inductionEffects0.000description4
- 210000004962mammalian cellAnatomy0.000description4
- 238000004519manufacturing processMethods0.000description4
- 239000000463materialSubstances0.000description4
- 239000003226mitogenSubstances0.000description4
- 108091033319polynucleotideProteins0.000description4
- 102000040430polynucleotideHuman genes0.000description4
- 239000002157polynucleotideSubstances0.000description4
- 230000008569processEffects0.000description4
- 102000035025signaling receptorsHuman genes0.000description4
- 108091005475signaling receptorsProteins0.000description4
- 239000000243solutionSubstances0.000description4
- 230000000638stimulationEffects0.000description4
- 238000003786synthesis reactionMethods0.000description4
- 230000004614tumor growthEffects0.000description4
- 230000003612virological effectEffects0.000description4
- 229920000936AgarosePolymers0.000description3
- 201000004569BlindnessDiseases0.000description3
- 230000006820DNA synthesisEffects0.000description3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-NEthanolChemical compoundCCOLFQSCWFLJHTTHZ-UHFFFAOYSA-N0.000description3
- 108700024394ExonProteins0.000description3
- 108091028043Nucleic acid sequenceProteins0.000description3
- 201000004681PsoriasisDiseases0.000description3
- 240000004808Saccharomyces cerevisiaeSpecies0.000description3
- 241000700605VirusesSpecies0.000description3
- 238000001042affinity chromatographyMethods0.000description3
- -1amino, carboxylChemical group0.000description3
- 230000002491angiogenic effectEffects0.000description3
- IQFYYKKMVGJFEH-UHFFFAOYSA-Nbeta-L-thymidineNatural productsO=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1IQFYYKKMVGJFEH-UHFFFAOYSA-N0.000description3
- 238000004113cell cultureMethods0.000description3
- KRKNYBCHXYNGOX-UHFFFAOYSA-Ncitric acidChemical compoundOC(=O)CC(O)(C(O)=O)CC(O)=OKRKNYBCHXYNGOX-UHFFFAOYSA-N0.000description3
- 150000001875compoundsChemical class0.000description3
- 239000003636conditioned culture mediumSubstances0.000description3
- 230000000875corresponding effectEffects0.000description3
- XUJNEKJLAYXESH-UHFFFAOYSA-NcysteineNatural productsSCC(N)C(O)=OXUJNEKJLAYXESH-UHFFFAOYSA-N0.000description3
- 235000018417cysteineNutrition0.000description3
- 238000011161developmentMethods0.000description3
- 229940079593drugDrugs0.000description3
- 230000006870functionEffects0.000description3
- 239000001963growth mediumSubstances0.000description3
- 230000036541healthEffects0.000description3
- 230000003993interactionEffects0.000description3
- 230000000670limiting effectEffects0.000description3
- 230000004807localizationEffects0.000description3
- 230000007246mechanismEffects0.000description3
- 239000002609mediumSubstances0.000description3
- 230000004048modificationEffects0.000description3
- 238000012986modificationMethods0.000description3
- 239000000178monomerSubstances0.000description3
- 230000010807negative regulation of bindingEffects0.000description3
- 238000010647peptide synthesis reactionMethods0.000description3
- 210000004881tumor cellAnatomy0.000description3
- 241000701447unidentified baculovirusSpecies0.000description3
- 239000013603viral vectorSubstances0.000description3
- QTBSBXVTEAMEQO-UHFFFAOYSA-MAcetateChemical compoundCC([O-])=OQTBSBXVTEAMEQO-UHFFFAOYSA-M0.000description2
- 108010074415Angiogenic ProteinsProteins0.000description2
- 102000012936AngiostatinsHuman genes0.000description2
- 108010079709AngiostatinsProteins0.000description2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-NAscorbic acidChemical compoundOC[C@H](O)[C@H]1OC(=O)C(O)=C1OCIWBSHSKHKDKBQ-JLAZNSOCSA-N0.000description2
- 101000669426Aspergillus restrictus Ribonuclease mitogillinProteins0.000description2
- 125000001433C-terminal amino-acid groupChemical group0.000description2
- 208000009458Carcinoma in SituDiseases0.000description2
- 241000254171CurculionidaeSpecies0.000description2
- FBPFZTCFMRRESA-KVTDHHQDSA-ND-MannitolChemical compoundOC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)COFBPFZTCFMRRESA-KVTDHHQDSA-N0.000description2
- 102000016607Diphtheria ToxinHuman genes0.000description2
- 108010053187Diphtheria ToxinProteins0.000description2
- 241000255925DipteraSpecies0.000description2
- 241000196324EmbryophytaSpecies0.000description2
- 201000009273EndometriosisDiseases0.000description2
- 102400001047EndostatinHuman genes0.000description2
- 108010079505EndostatinsProteins0.000description2
- 208000010412GlaucomaDiseases0.000description2
- WQZGKKKJIJFFOK-GASJEMHNSA-NGlucoseNatural productsOC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1OWQZGKKKJIJFFOK-GASJEMHNSA-N0.000description2
- 101001024703Homo sapiens Nck-associated protein 5Proteins0.000description2
- 101000808011Homo sapiens Vascular endothelial growth factor AProteins0.000description2
- ZDXPYRJPNDTMRX-VKHMYHEASA-NL-glutamineChemical compoundOC(=O)[C@@H](N)CCC(N)=OZDXPYRJPNDTMRX-VKHMYHEASA-N0.000description2
- 241000124008MammaliaSpecies0.000description2
- 229930195725MannitolNatural products0.000description2
- 241001465754MetazoaSpecies0.000description2
- 125000001429N-terminal alpha-amino-acid groupChemical group0.000description2
- 102100036946Nck-associated protein 5Human genes0.000description2
- 108700020796OncogeneProteins0.000description2
- 229910019142PO4Inorganic materials0.000description2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-NPhenolChemical compoundOC1=CC=CC=C1ISWSIDIOOBJBQZ-UHFFFAOYSA-N0.000description2
- 239000002202Polyethylene glycolSubstances0.000description2
- 208000007135Retinal NeovascularizationDiseases0.000description2
- 108010039491RicinProteins0.000description2
- FAPWRFPIFSIZLT-UHFFFAOYSA-MSodium chlorideChemical compound[Na+].[Cl-]FAPWRFPIFSIZLT-UHFFFAOYSA-M0.000description2
- 229930006000SucroseNatural products0.000description2
- CZMRCDWAGMRECN-UGDNZRGBSA-NSucroseChemical compoundO[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1CZMRCDWAGMRECN-UGDNZRGBSA-N0.000description2
- 102000004887Transforming Growth Factor betaHuman genes0.000description2
- 108090001012Transforming Growth Factor betaProteins0.000description2
- 208000025865UlcerDiseases0.000description2
- 230000002159abnormal effectEffects0.000description2
- 208000009956adenocarcinomaDiseases0.000description2
- 125000000539amino acid groupChemical group0.000description2
- 206010003246arthritisDiseases0.000description2
- FZCSTZYAHCUGEM-UHFFFAOYSA-Naspergillomarasmine BNatural productsOC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=OFZCSTZYAHCUGEM-UHFFFAOYSA-N0.000description2
- QVGXLLKOCUKJST-UHFFFAOYSA-Natomic oxygenChemical compound[O]QVGXLLKOCUKJST-UHFFFAOYSA-N0.000description2
- 230000001580bacterial effectEffects0.000description2
- 210000002469basement membraneAnatomy0.000description2
- 230000033228biological regulationEffects0.000description2
- 230000008859changeEffects0.000description2
- 238000006243chemical reactionMethods0.000description2
- 239000003795chemical substances by applicationSubstances0.000description2
- 238000010367cloningMethods0.000description2
- 239000006071creamSubstances0.000description2
- 231100000433cytotoxicToxicity0.000description2
- 229940127089cytotoxic agentDrugs0.000description2
- 230000001472cytotoxic effectEffects0.000description2
- 230000001419dependent effectEffects0.000description2
- 206010012601diabetes mellitusDiseases0.000description2
- 230000002538fungal effectEffects0.000description2
- 239000008103glucoseSubstances0.000description2
- 230000035876healingEffects0.000description2
- 239000000710homodimerSubstances0.000description2
- 102000058223human VEGFAHuman genes0.000description2
- 238000002513implantationMethods0.000description2
- 238000001727in vivoMethods0.000description2
- 238000010348incorporationMethods0.000description2
- 239000000411inducerSubstances0.000description2
- 238000003780insertionMethods0.000description2
- 230000037431insertionEffects0.000description2
- 208000032839leukemiaDiseases0.000description2
- 239000003446ligandSubstances0.000description2
- 239000002502liposomeSubstances0.000description2
- 239000000594mannitolSubstances0.000description2
- 235000010355mannitolNutrition0.000description2
- 108020004999messenger RNAProteins0.000description2
- 238000010369molecular cloningMethods0.000description2
- 201000003142neovascular glaucomaDiseases0.000description2
- 239000002773nucleotideSubstances0.000description2
- 125000003729nucleotide groupChemical group0.000description2
- 235000015097nutrientsNutrition0.000description2
- 210000001672ovaryAnatomy0.000description2
- 229910052760oxygenInorganic materials0.000description2
- 239000001301oxygenSubstances0.000description2
- 239000000546pharmaceutical excipientSubstances0.000description2
- 239000012071phaseSubstances0.000description2
- NBIIXXVUZAFLBC-UHFFFAOYSA-KphosphateChemical compound[O-]P([O-])([O-])=ONBIIXXVUZAFLBC-UHFFFAOYSA-K0.000description2
- 239000010452phosphateSubstances0.000description2
- 230000026731phosphorylationEffects0.000description2
- 238000006366phosphorylation reactionMethods0.000description2
- 229920002401polyacrylamidePolymers0.000description2
- 229920001223polyethylene glycolPolymers0.000description2
- 108040000983polyphosphate:AMP phosphotransferase activity proteinsProteins0.000description2
- 210000002307prostateAnatomy0.000description2
- 230000002829reductive effectEffects0.000description2
- 108091008146restriction endonucleasesProteins0.000description2
- 150000003839saltsChemical class0.000description2
- 238000001542size-exclusion chromatographyMethods0.000description2
- 229910052708sodiumInorganic materials0.000description2
- 239000011734sodiumSubstances0.000description2
- 239000011780sodium chlorideSubstances0.000description2
- 239000001488sodium phosphateSubstances0.000description2
- 229910000162sodium phosphateInorganic materials0.000description2
- 241000894007speciesSpecies0.000description2
- 239000003381stabilizerSubstances0.000description2
- UCSJYZPVAKXKNQ-HZYVHMACSA-NstreptomycinChemical compoundCN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1OUCSJYZPVAKXKNQ-HZYVHMACSA-N0.000description2
- 239000000126substanceSubstances0.000description2
- 239000005720sucroseSubstances0.000description2
- 239000000725suspensionSubstances0.000description2
- 238000013268sustained releaseMethods0.000description2
- 239000012730sustained-release formSubstances0.000description2
- 230000008685targetingEffects0.000description2
- 238000012360testing methodMethods0.000description2
- ZRKFYGHZFMAOKI-QMGMOQQFSA-NtgfbetaChemical compoundC([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1ZRKFYGHZFMAOKI-QMGMOQQFSA-N0.000description2
- 230000001131transforming effectEffects0.000description2
- 230000010474transient expressionEffects0.000description2
- RYFMWSXOAZQYPI-UHFFFAOYSA-Ktrisodium phosphateChemical compound[Na+].[Na+].[Na+].[O-]P([O-])([O-])=ORYFMWSXOAZQYPI-UHFFFAOYSA-K0.000description2
- 230000005747tumor angiogenesisEffects0.000description2
- 231100000397ulcerToxicity0.000description2
- 239000003981vehicleSubstances0.000description2
- 230000029663wound healingEffects0.000description2
- SXOUIMVOMIGLHO-AATRIKPKSA-N(E)-3-(indol-2-yl)acrylic acidChemical compoundC1=CC=C2NC(/C=C/C(=O)O)=CC2=C1SXOUIMVOMIGLHO-AATRIKPKSA-N0.000description1
- FBUTXZSKZCQABC-UHFFFAOYSA-N2-amino-1-methyl-7h-purine-6-thioneChemical compoundS=C1N(C)C(N)=NC2=C1NC=N2FBUTXZSKZCQABC-UHFFFAOYSA-N0.000description1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N7553-56-2Chemical compound[I]ZCYVEMRRCGMTRW-UHFFFAOYSA-N0.000description1
- 108010066676AbrinProteins0.000description1
- 102000008076Angiogenic ProteinsHuman genes0.000description1
- 208000002109ArgyriaDiseases0.000description1
- 108010002913AsialoglycoproteinsProteins0.000description1
- 206010003571AstrocytomaDiseases0.000description1
- WPYMKLBDIGXBTP-UHFFFAOYSA-NBenzoic acidNatural productsOC(=O)C1=CC=CC=C1WPYMKLBDIGXBTP-UHFFFAOYSA-N0.000description1
- 239000005711Benzoic acidSubstances0.000description1
- DWRXFEITVBNRMK-UHFFFAOYSA-NBeta-D-1-ArabinofuranosylthymineNatural productsO=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1DWRXFEITVBNRMK-UHFFFAOYSA-N0.000description1
- 241000283690Bos taurusSpecies0.000description1
- 239000004255Butylated hydroxyanisoleSubstances0.000description1
- 239000004322Butylated hydroxytolueneSubstances0.000description1
- NLZUEZXRPGMBCV-UHFFFAOYSA-NButylhydroxytolueneChemical compoundCC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1NLZUEZXRPGMBCV-UHFFFAOYSA-N0.000description1
- 102100021935C-C motif chemokine 26Human genes0.000description1
- 101710158575Cap-specific mRNA (nucleoside-2'-O-)-methyltransferaseProteins0.000description1
- CURLTUGMZLYLDI-UHFFFAOYSA-NCarbon dioxideChemical compoundO=C=OCURLTUGMZLYLDI-UHFFFAOYSA-N0.000description1
- 201000009030CarcinomaDiseases0.000description1
- 241000282693CercopithecidaeSpecies0.000description1
- 101100007328Cocos nucifera COS-1 geneProteins0.000description1
- 108010035532CollagenProteins0.000description1
- 102000008186CollagenHuman genes0.000description1
- 206010052360Colorectal adenocarcinomaDiseases0.000description1
- 241000699802Cricetulus griseusSpecies0.000description1
- 241000192700CyanobacteriaSpecies0.000description1
- FBPFZTCFMRRESA-FSIIMWSLSA-ND-GlucitolNatural productsOC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)COFBPFZTCFMRRESA-FSIIMWSLSA-N0.000description1
- FBPFZTCFMRRESA-JGWLITMVSA-ND-glucitolChemical compoundOC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)COFBPFZTCFMRRESA-JGWLITMVSA-N0.000description1
- WQZGKKKJIJFFOK-QTVWNMPRSA-ND-mannopyranoseChemical compoundOC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1OWQZGKKKJIJFFOK-QTVWNMPRSA-N0.000description1
- 102000004163DNA-directed RNA polymerasesHuman genes0.000description1
- 108090000626DNA-directed RNA polymerasesProteins0.000description1
- 229920002307DextranPolymers0.000description1
- 241000255581Drosophila <fruit fly, genus>Species0.000description1
- 239000006144Dulbecco’s modified Eagle's mediumSubstances0.000description1
- 108010041308Endothelial Growth FactorsProteins0.000description1
- 102000004190EnzymesHuman genes0.000description1
- 108090000790EnzymesProteins0.000description1
- 206010014967EpendymomaDiseases0.000description1
- 241000206602EukaryotaSpecies0.000description1
- 101710082714Exotoxin AProteins0.000description1
- 108010037362Extracellular Matrix ProteinsProteins0.000description1
- 102000010834Extracellular Matrix ProteinsHuman genes0.000description1
- 108090000386Fibroblast Growth Factor 1Proteins0.000description1
- 102100031706Fibroblast growth factor 1Human genes0.000description1
- 241000287828Gallus gallusSpecies0.000description1
- 108700004714Gelonium multiflorum GELProteins0.000description1
- 108700007698Genetic Terminator RegionsProteins0.000description1
- 102100035108High affinity nerve growth factor receptorHuman genes0.000description1
- 101000897493Homo sapiens C-C motif chemokine 26Proteins0.000description1
- 101000669513Homo sapiens Metalloproteinase inhibitor 1Proteins0.000description1
- 101000645296Homo sapiens Metalloproteinase inhibitor 2Proteins0.000description1
- 108091006905Human Serum AlbuminProteins0.000description1
- 102000008100Human Serum AlbuminHuman genes0.000description1
- VEXZGXHMUGYJMC-UHFFFAOYSA-NHydrochloric acidChemical compoundClVEXZGXHMUGYJMC-UHFFFAOYSA-N0.000description1
- CPELXLSAUQHCOX-UHFFFAOYSA-NHydrogen bromideChemical compoundBrCPELXLSAUQHCOX-UHFFFAOYSA-N0.000description1
- 206010021143HypoxiaDiseases0.000description1
- XQFRJNBWHJMXHO-RRKCRQDMSA-NIDURChemical compoundC1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1XQFRJNBWHJMXHO-RRKCRQDMSA-N0.000description1
- 102000006992Interferon-alphaHuman genes0.000description1
- 108010047761Interferon-alphaProteins0.000description1
- KDXKERNSBIXSRK-YFKPBYRVSA-NL-lysineChemical compoundNCCCC[C@H](N)C(O)=OKDXKERNSBIXSRK-YFKPBYRVSA-N0.000description1
- QIVBCDIJIAJPQS-VIFPVBQESA-NL-tryptophaneChemical compoundC1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1QIVBCDIJIAJPQS-VIFPVBQESA-N0.000description1
- OUYCCCASQSFEME-QMMMGPOBSA-NL-tyrosineChemical compoundOC(=O)[C@@H](N)CC1=CC=C(O)C=C1OUYCCCASQSFEME-QMMMGPOBSA-N0.000description1
- 239000004166LanolinSubstances0.000description1
- OFOBLEOULBTSOW-UHFFFAOYSA-LMalonateChemical compound[O-]C(=O)CC([O-])=OOFOBLEOULBTSOW-UHFFFAOYSA-L0.000description1
- 102000005741MetalloproteasesHuman genes0.000description1
- 108010006035MetalloproteasesProteins0.000description1
- 102100039364Metalloproteinase inhibitor 1Human genes0.000description1
- 102100026262Metalloproteinase inhibitor 2Human genes0.000description1
- 206010028289Muscle atrophyDiseases0.000description1
- 241001477931Mythimna unipunctaSpecies0.000description1
- 206010029260NeuroblastomaDiseases0.000description1
- 108091005461Nucleic proteinsProteins0.000description1
- 241000283973Oryctolagus cuniculusSpecies0.000description1
- 241001631646PapillomaviridaeSpecies0.000description1
- 229930182555PenicillinNatural products0.000description1
- JGSARLDLIJGVTE-MBNYWOFBSA-NPenicillin GChemical compoundN([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1JGSARLDLIJGVTE-MBNYWOFBSA-N0.000description1
- 102000035195PeptidasesHuman genes0.000description1
- 108091005804PeptidasesProteins0.000description1
- OAICVXFJPJFONN-UHFFFAOYSA-NPhosphorusChemical compound[P]OAICVXFJPJFONN-UHFFFAOYSA-N0.000description1
- 235000009074Phytolacca americanaNutrition0.000description1
- 240000007643Phytolacca americanaSpecies0.000description1
- 101100413173Phytolacca americana PAP2 geneProteins0.000description1
- 241000709664PicornaviridaeSpecies0.000description1
- 102000013566PlasminogenHuman genes0.000description1
- 108010051456PlasminogenProteins0.000description1
- 102000004211Platelet factor 4Human genes0.000description1
- 108090000778Platelet factor 4Proteins0.000description1
- 102100040681Platelet-derived growth factor CHuman genes0.000description1
- 108010039918PolylysineProteins0.000description1
- 241001505332Polyomavirus sp.Species0.000description1
- 102000003946ProlactinHuman genes0.000description1
- 108010057464ProlactinProteins0.000description1
- XBDQKXXYIPTUBI-UHFFFAOYSA-MPropionateChemical compoundCCC([O-])=OXBDQKXXYIPTUBI-UHFFFAOYSA-M0.000description1
- 206010060862Prostate cancerDiseases0.000description1
- 208000000236Prostatic NeoplasmsDiseases0.000description1
- 239000004365ProteaseSubstances0.000description1
- 241000589517Pseudomonas aeruginosaSpecies0.000description1
- 101900161471Pseudomonas aeruginosa Exotoxin AProteins0.000description1
- 230000006819RNA synthesisEffects0.000description1
- 241000283984RodentiaSpecies0.000description1
- 241000235070SaccharomycesSpecies0.000description1
- 241000700584SimplexvirusSpecies0.000description1
- 229920002125Sokalan®Polymers0.000description1
- 241001655322StreptomycetalesSpecies0.000description1
- 208000006011StrokeDiseases0.000description1
- QAOWNCQODCNURD-UHFFFAOYSA-LSulfateChemical compound[O-]S([O-])(=O)=OQAOWNCQODCNURD-UHFFFAOYSA-L0.000description1
- 239000004098TetracyclineSubstances0.000description1
- 102000002938ThrombospondinHuman genes0.000description1
- 108060008245ThrombospondinProteins0.000description1
- 102100033663Transforming growth factor beta receptor type 3Human genes0.000description1
- 101710132313Transforming growth factor beta receptor type 3Proteins0.000description1
- QIVBCDIJIAJPQS-UHFFFAOYSA-NTryptophanNatural productsC1=CC=C2C(CC(N)C(O)=O)=CNC2=C1QIVBCDIJIAJPQS-UHFFFAOYSA-N0.000description1
- 241000700618Vaccinia virusSpecies0.000description1
- 108010073925Vascular Endothelial Growth Factor BProteins0.000description1
- 108010073923Vascular Endothelial Growth Factor CProteins0.000description1
- 108010073919Vascular Endothelial Growth Factor DProteins0.000description1
- 108010053096Vascular Endothelial Growth Factor Receptor-1Proteins0.000description1
- 102100038217Vascular endothelial growth factor BHuman genes0.000description1
- 102100038232Vascular endothelial growth factor CHuman genes0.000description1
- 102100038234Vascular endothelial growth factor DHuman genes0.000description1
- 240000001866Vernicia fordiiSpecies0.000description1
- 206010052428WoundDiseases0.000description1
- 208000027418Wounds and injuryDiseases0.000description1
- 239000012190activatorSubstances0.000description1
- 238000007792additionMethods0.000description1
- 210000001789adipocyteAnatomy0.000description1
- 210000000577adipose tissueAnatomy0.000description1
- 239000002671adjuvantSubstances0.000description1
- 239000000443aerosolSubstances0.000description1
- 108010001818alpha-sarcinProteins0.000description1
- VREFGVBLTWBCJP-UHFFFAOYSA-NalprazolamChemical compoundC12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1VREFGVBLTWBCJP-UHFFFAOYSA-N0.000description1
- 230000004075alterationEffects0.000description1
- 229960000723ampicillinDrugs0.000description1
- AVKUERGKIZMTKX-NJBDSQKTSA-NampicillinChemical compoundC1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1AVKUERGKIZMTKX-NJBDSQKTSA-N0.000description1
- 239000002870angiogenesis inducing agentSubstances0.000description1
- 239000004037angiogenesis inhibitorSubstances0.000description1
- 229940121369angiogenesis inhibitorDrugs0.000description1
- 210000004102animal cellAnatomy0.000description1
- 238000010171animal modelMethods0.000description1
- 238000005571anion exchange chromatographyMethods0.000description1
- 239000003242anti bacterial agentSubstances0.000description1
- 230000001772anti-angiogenic effectEffects0.000description1
- 230000000692anti-sense effectEffects0.000description1
- 239000002246antineoplastic agentSubstances0.000description1
- 239000003963antioxidant agentSubstances0.000description1
- 235000006708antioxidantsNutrition0.000description1
- 238000013459approachMethods0.000description1
- 239000007864aqueous solutionSubstances0.000description1
- 239000011668ascorbic acidSubstances0.000description1
- 229960005070ascorbic acidDrugs0.000description1
- 235000010323ascorbic acidNutrition0.000description1
- 235000010233benzoic acidNutrition0.000description1
- WQZGKKKJIJFFOK-VFUOTHLCSA-Nbeta-D-glucoseChemical compoundOC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1OWQZGKKKJIJFFOK-VFUOTHLCSA-N0.000description1
- 238000002306biochemical methodMethods0.000description1
- 230000031018biological processes and functionsEffects0.000description1
- 238000001574biopsyMethods0.000description1
- 210000004369bloodAnatomy0.000description1
- 239000008280bloodSubstances0.000description1
- 230000017531blood circulationEffects0.000description1
- 230000037396body weightEffects0.000description1
- 239000000872bufferSubstances0.000description1
- 239000004067bulking agentSubstances0.000description1
- 235000019282butylated hydroxyanisoleNutrition0.000description1
- 235000010354butylated hydroxytolueneNutrition0.000description1
- 230000005907cancer growthEffects0.000description1
- 235000011089carbon dioxideNutrition0.000description1
- 239000000969carrierSubstances0.000description1
- 210000000845cartilageAnatomy0.000description1
- 230000015556catabolic processEffects0.000description1
- 239000006143cell culture mediumSubstances0.000description1
- 230000010261cell growthEffects0.000description1
- 210000003169central nervous systemAnatomy0.000description1
- 210000003679cervix uteriAnatomy0.000description1
- 238000012512characterization methodMethods0.000description1
- 239000013522chelantSubstances0.000description1
- 238000001311chemical methods and processMethods0.000description1
- 230000035605chemotaxisEffects0.000description1
- 210000003711chorioallantoic membraneAnatomy0.000description1
- 238000004587chromatography analysisMethods0.000description1
- 230000004087circulationEffects0.000description1
- 229960004106citric acidDrugs0.000description1
- 235000015165citric acidNutrition0.000description1
- 229920001436collagenPolymers0.000description1
- 210000001072colonAnatomy0.000description1
- 230000002860competitive effectEffects0.000description1
- 230000000295complement effectEffects0.000description1
- 239000002299complementary DNASubstances0.000description1
- 238000007796conventional methodMethods0.000description1
- 210000004087corneaAnatomy0.000description1
- 230000002596correlated effectEffects0.000description1
- 150000001944cysteine derivativesChemical class0.000description1
- 239000002254cytotoxic agentSubstances0.000description1
- 230000007423decreaseEffects0.000description1
- 238000006731degradation reactionMethods0.000description1
- 230000008021depositionEffects0.000description1
- 229930191339dianthinNatural products0.000description1
- 239000000539dimerSubstances0.000description1
- 238000006471dimerization reactionMethods0.000description1
- 208000037765diseases and disordersDiseases0.000description1
- ZWIBGKZDAWNIFC-UHFFFAOYSA-Ndisuccinimidyl suberateChemical compoundO=C1CCC(=O)N1OC(=O)CCCCCCC(=O)ON1C(=O)CCC1=OZWIBGKZDAWNIFC-UHFFFAOYSA-N0.000description1
- 230000009977dual effectEffects0.000description1
- 238000004520electroporationMethods0.000description1
- 230000000408embryogenic effectEffects0.000description1
- 239000000839emulsionSubstances0.000description1
- 230000009764endothelial cell sproutingEffects0.000description1
- 238000005516engineering processMethods0.000description1
- 230000002708enhancing effectEffects0.000description1
- 108010028531enomycinProteins0.000description1
- 230000007515enzymatic degradationEffects0.000description1
- 210000003238esophagusAnatomy0.000description1
- 210000003527eukaryotic cellAnatomy0.000description1
- 210000002744extracellular matrixAnatomy0.000description1
- 210000004996female reproductive systemAnatomy0.000description1
- 238000000855fermentationMethods0.000description1
- 230000004151fermentationEffects0.000description1
- 210000004700fetal bloodAnatomy0.000description1
- 230000003325follicularEffects0.000description1
- 230000004927fusionEffects0.000description1
- 210000005095gastrointestinal systemAnatomy0.000description1
- 238000001502gel electrophoresisMethods0.000description1
- 238000001415gene therapyMethods0.000description1
- 208000005017glioblastomaDiseases0.000description1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-NglutamineNatural productsOC(=O)C(N)CCC(N)=OZDXPYRJPNDTMRX-UHFFFAOYSA-N0.000description1
- 229960002743glutamineDrugs0.000description1
- 229960003180glutathioneDrugs0.000description1
- 230000013595glycosylationEffects0.000description1
- 238000006206glycosylation reactionMethods0.000description1
- 229910001385heavy metalInorganic materials0.000description1
- 238000004128high performance liquid chromatographyMethods0.000description1
- 229940088597hormoneDrugs0.000description1
- 239000005556hormoneSubstances0.000description1
- 125000002887hydroxy groupChemical group[H]O*0.000description1
- 230000007954hypoxiaEffects0.000description1
- 229960004716idoxuridineDrugs0.000description1
- 230000006872improvementEffects0.000description1
- 201000004933in situ carcinomaDiseases0.000description1
- 238000000099in vitro assayMethods0.000description1
- 238000005462in vivo assayMethods0.000description1
- PLVPPLCLBIEYEA-UHFFFAOYSA-Nindoleacrylic acidNatural productsC1=CC=C2C(C=CC(=O)O)=CNC2=C1PLVPPLCLBIEYEA-UHFFFAOYSA-N0.000description1
- 239000004615ingredientSubstances0.000description1
- 210000004347intestinal mucosaAnatomy0.000description1
- 238000007918intramuscular administrationMethods0.000description1
- 238000010255intramuscular injectionMethods0.000description1
- 239000007927intramuscular injectionSubstances0.000description1
- 238000001990intravenous administrationMethods0.000description1
- 238000010253intravenous injectionMethods0.000description1
- 108091005979iodinated proteinsProteins0.000description1
- 229910052740iodineInorganic materials0.000description1
- 239000011630iodineSubstances0.000description1
- XMBWDFGMSWQBCA-RNFDNDRNSA-Miodine-131(1-)Chemical compound[131I-]XMBWDFGMSWQBCA-RNFDNDRNSA-M0.000description1
- 208000028867ischemiaDiseases0.000description1
- 238000002955isolationMethods0.000description1
- FZWBNHMXJMCXLU-BLAUPYHCSA-NisomaltotrioseChemical compoundO[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1FZWBNHMXJMCXLU-BLAUPYHCSA-N0.000description1
- 229940039717lanolinDrugs0.000description1
- 235000019388lanolinNutrition0.000description1
- 208000003849large cell carcinomaDiseases0.000description1
- 230000029226lipidationEffects0.000description1
- 238000004811liquid chromatographyMethods0.000description1
- 210000003141lower extremityAnatomy0.000description1
- 208000020816lung neoplasmDiseases0.000description1
- 239000008176lyophilized powderSubstances0.000description1
- 239000006166lysateSubstances0.000description1
- 230000003211malignant effectEffects0.000description1
- 239000003550markerSubstances0.000description1
- 239000011159matrix materialSubstances0.000description1
- 201000001441melanomaDiseases0.000description1
- 210000004379membraneAnatomy0.000description1
- 239000012528membraneSubstances0.000description1
- 206010027191meningiomaDiseases0.000description1
- 229910052751metalInorganic materials0.000description1
- 239000002184metalSubstances0.000description1
- 208000037819metastatic cancerDiseases0.000description1
- 208000011575metastatic malignant neoplasmDiseases0.000description1
- 108010010621modeccinProteins0.000description1
- 238000000329molecular dynamics simulationMethods0.000description1
- 230000004660morphological changeEffects0.000description1
- 201000010879mucinous adenocarcinomaDiseases0.000description1
- 210000003205muscleAnatomy0.000description1
- 210000000663muscle cellAnatomy0.000description1
- 230000035772mutationEffects0.000description1
- 230000002107myocardial effectEffects0.000description1
- 208000010125myocardial infarctionDiseases0.000description1
- 230000014399negative regulation of angiogenesisEffects0.000description1
- 230000017095negative regulation of cell growthEffects0.000description1
- 230000001537neural effectEffects0.000description1
- 239000002547new drugSubstances0.000description1
- 201000002575ocular melanomaDiseases0.000description1
- 239000002674ointmentSubstances0.000description1
- 239000003883ointment baseSubstances0.000description1
- 230000003204osmotic effectEffects0.000description1
- 230000001575pathological effectEffects0.000description1
- 229940049954penicillinDrugs0.000description1
- 230000002093peripheral effectEffects0.000description1
- 230000035699permeabilityEffects0.000description1
- 230000002085persistent effectEffects0.000description1
- 108010076042phenomycinProteins0.000description1
- 210000002826placentaAnatomy0.000description1
- 230000003169placental effectEffects0.000description1
- 108010017992platelet-derived growth factor CProteins0.000description1
- 229920000729poly(L-lysine) polymerPolymers0.000description1
- 229920000656polylysinePolymers0.000description1
- 229920000642polymerPolymers0.000description1
- 238000003752polymerase chain reactionMethods0.000description1
- 108010005828preferredoxinProteins0.000description1
- 239000003755preservative agentSubstances0.000description1
- 230000002265preventionEffects0.000description1
- 230000009465prokaryotic expressionEffects0.000description1
- 229940097325prolactinDrugs0.000description1
- 230000001737promoting effectEffects0.000description1
- 210000001938protoplastAnatomy0.000description1
- 238000000746purificationMethods0.000description1
- 230000002285radioactive effectEffects0.000description1
- 239000011541reaction mixtureSubstances0.000description1
- 238000003259recombinant expressionMethods0.000description1
- 238000010188recombinant methodMethods0.000description1
- 230000001105regulatory effectEffects0.000description1
- 230000010076replicationEffects0.000description1
- 230000001850reproductive effectEffects0.000description1
- 238000011160researchMethods0.000description1
- 230000004044responseEffects0.000description1
- 210000001525retinaAnatomy0.000description1
- 230000001177retroviral effectEffects0.000description1
- 230000002441reversible effectEffects0.000description1
- 125000003607serino groupChemical group[H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H]0.000description1
- 230000011664signalingEffects0.000description1
- 229940099261silvadeneDrugs0.000description1
- UEJSSZHHYBHCEL-UHFFFAOYSA-Nsilver(1+) sulfadiazinateChemical compound[Ag+].C1=CC(N)=CC=C1S(=O)(=O)[N-]C1=NC=CC=N1UEJSSZHHYBHCEL-UHFFFAOYSA-N0.000description1
- 208000000649small cell carcinomaDiseases0.000description1
- 210000000813small intestineAnatomy0.000description1
- 239000007790solid phaseSubstances0.000description1
- 239000000600sorbitolSubstances0.000description1
- 238000001179sorption measurementMethods0.000description1
- 206010041823squamous cell carcinomaDiseases0.000description1
- 230000003068static effectEffects0.000description1
- 210000004500stellate cellAnatomy0.000description1
- 210000002784stomachAnatomy0.000description1
- 229960005322streptomycinDrugs0.000description1
- 238000007920subcutaneous administrationMethods0.000description1
- 238000010254subcutaneous injectionMethods0.000description1
- 239000007929subcutaneous injectionSubstances0.000description1
- 230000002311subsequent effectEffects0.000description1
- 230000001629suppressionEffects0.000description1
- 238000001356surgical procedureMethods0.000description1
- 230000009885systemic effectEffects0.000description1
- 210000001550testisAnatomy0.000description1
- 229960002180tetracyclineDrugs0.000description1
- 229930101283tetracyclineNatural products0.000description1
- 235000019364tetracyclineNutrition0.000description1
- 150000003522tetracyclinesChemical class0.000description1
- 229940104230thymidineDrugs0.000description1
- 230000036964tight bindingEffects0.000description1
- 230000000451tissue damageEffects0.000description1
- 231100000827tissue damageToxicity0.000description1
- 231100000331toxicToxicity0.000description1
- 230000002588toxic effectEffects0.000description1
- 231100000419toxicityToxicity0.000description1
- 230000001988toxicityEffects0.000description1
- 238000013518transcriptionMethods0.000description1
- 230000035897transcriptionEffects0.000description1
- 238000001890transfectionMethods0.000description1
- 230000009466transformationEffects0.000description1
- 238000013519translationMethods0.000description1
- 201000007423tubular adenocarcinomaDiseases0.000description1
- 241001430294unidentified retrovirusSpecies0.000description1
- 210000004291uterusAnatomy0.000description1
- 230000002792vascularEffects0.000description1
- 210000003556vascular endothelial cellAnatomy0.000description1
- 230000006444vascular growthEffects0.000description1
- 235000015112vegetable and seed oilNutrition0.000description1
- 239000008158vegetable oilSubstances0.000description1
- 230000002861ventricularEffects0.000description1
- 239000002699waste materialSubstances0.000description1
- XLYOFNOQVPJJNP-UHFFFAOYSA-NwaterSubstancesOXLYOFNOQVPJJNP-UHFFFAOYSA-N0.000description1
- 230000037314wound repairEffects0.000description1
- 210000005253yeast cellAnatomy0.000description1
Images
Classifications
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Gastroenterology & Hepatology (AREA)
- Cardiology (AREA)
- Oncology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
Translated fromJapanese【0001】
(連邦政府委託研究に関する声明)
本明細書において記載する本発明は、一部には、National Institute of Health 助成金 CA37392およびCA45548により後援されている。米国政府は、本発明に対して特定の権利を有する。
【0002】
(発明の分野)
本発明は、血管内皮増殖因子(VEGF)に関する。より詳細には、本発明は、VEGFに関連する障害の処置におけるVEGFのアンタゴニストおよびそれらのアンタゴニストの使用に関する。
【0003】
(発明の背景)
血管は、酸素および栄養が生体組織に供給され、そして廃棄物が生体組織から除去される手段である。血管形成(angiogenesis)とは、新しい血管が形成される工程をいう。例えば、FolkmanおよびShingの総説、J.Biol.Chem.267,10931〜10934(1992)、DvorakらJ.Exp.Med.,174,1275〜1278(1991)を参照のこと。従って、適切な場合、血管形成とは重要な生物学的工程である。これは生殖、発生および創傷修復において重要である。しかし、不適切な血管形成は、重篤な負の結果を有し得る。例えば、腫瘍が迅速に増殖および転移することを可能にする酸素および栄養の十分な供給を有するのは、血管形成の結果として、多くの固体腫瘍が血管新生する後のみである。適切な平衡で血管形成の速度を維持することは、機能の範囲に非常に重要なので、健康を維持するためにはこれを注意深く調節するべきである。この血管形成工程は、血管内皮増殖因子(VEGF)および塩基性線維芽細胞増殖因子(bFGF)のような分裂促進因子により活性化される内皮細胞(EC)から分泌されたプロテアーゼによる基底膜の分解から開始すると考えられる。この細胞は、遊走および増殖し、間質性間隙への固体内皮細胞出芽の形成を誘導し、次いで、血管ループが形成され、そして毛細血管が発生し、新しい基底膜の緊密な結合および沈着の形成を伴う。
【0004】
成人では、内皮細胞の増殖速度は、代表的には体内の他の細胞型と比べて遅い。これらの細胞の回転時間は1000日を超え得る。血管形成が迅速な増殖を生じる生理学的な例外は、代表的には、雌性の生殖系および創傷治癒過程で見られるような緻密な調節下で生じる。
【0005】
血管形成の速度は、微小血管の増殖の正の調節因子と負の調節因子との間の局所平衡における変化に関与する。血管形成増殖因子の治療的意図は、20年以上前にFolkmanおよび共同研究者らによって最初に記載された(Folkman,N.Engl.J.Med.,285:1182〜1186(1971))。身体が血管形成の制御の少なくともいくつかを消失した場合、異常な血管形成が生じ、これは過度の血管増殖または不充分な血管増殖のいずれかを生じる。例えば、潰瘍、脳卒中、および心臓発作のような状態は、自然な治癒に通常必要とされる血管形成の欠如に起因し得る。対照的に、過度の血管増殖は、腫瘍増殖、腫瘍伝播、失明、乾癬および慢性関節リウマチを生じ得る。
【0006】
従って、血管形成のより大きい程度が所望される場合がある(血液循環増加、創傷治癒、および潰瘍治癒)。例えば、現在の研究者らは、線維芽細胞増殖因子(FGF)ファミリー(Yanagisawa−Miwaら、Science、257:1401〜1403(1992)およびBaffourら、J Vasc Surg,16;181〜191(1992))、内皮細胞増殖因子(ECGF)(Puら、J Surg Res,54:575〜583(1993))、ならびにより最近では、心筋および後肢虚血の動物モデルにおいて側副動脈発生を促進および/または増強する血管内皮増殖因子(VEGF)(Takeshitaら、Circulation,90:228〜234(1994)およびTakeshitaら、J.Clin Invest,93:662〜670(1994))のような組換えの血管形成増殖因子の使用の可能性を証明している。
【0007】
逆に、血管形成の阻害が所望される場合がある。例えば、多くの疾患が永続的な調節されない血管形成(これはときに、「新血管新生(neovascularization)」といわれる)により進行される。関節炎において、新しい毛細血管は、関節を侵襲し、そして軟骨を破壊する。糖尿病では、新しい毛細血管は、ガラス質を侵襲し、出血し、そして失明を生じる。眼球の新血管新生は、失明の最も普通の原因である。腫瘍増殖および転移は、血管形成依存性である。腫瘍は、腫瘍自体を増殖させるために新しい毛細血管の増殖を持続的に刺激するはずである。
【0008】
VEGFは、血管形成の主な調節因子であり得るという証拠が高まっている(Ferraraら、Endocr.Rev.,13,18〜32(1992);Klagsbrunら、Curr.Biol.,3,699〜702(1993);Klagsbrunら、Ferraraら、Biochem.Biophys.Res.Commun.,161,851〜858(1989)に概説された)。VEGFは、最初に、小胞星状(folliculostellate)細胞の馴化培地から(Ferraraら、Biochem.Biopsy.Res.Commun.,161,851〜858(1989)、および種々の腫瘍細胞株から(Myokenら、Proc.Natl.Acad.Sci.USA,88:5819〜5823(1991);Plouetら、EMBO.J.8:3801〜3806(1991))精製された。VEGFは、血管透過性因子、つまり同時にU937細胞の馴化培地から精製された血透過性の調節因子、と同一であることが見出された(Keckら,Science,246:1309〜1312(1989))。VEGFは、インビトロにおいて内皮細胞(EC)の特異的分裂促進因子であり、そしてインビボにおいて強力な血管形成因子である。VEGFの発現は、胚形成および雌性の生殖周期中の血管新生下の組織において上方制御される(Brierら、Development,114:521〜532(1992);Shweikiら,J.Clin.Invest.,91:2235〜2243(1993))。高レベルのVEGFは、腫瘍誘発性の低酸素に応答して、種々のタイプの腫瘍において発現されるが、正常な組織では発現されない(Shweikiら,Nature 359:843〜846(1992);Dvorakら.,J.Exp.Med.,174:1275〜1278(1991);Plateら、Cancer Res.,53:5822〜5827;Ikeaら、J.Biol.Chem.,270:19761〜19766(1986))。VEGFに対するモノクローナル抗体を用いる腫瘍の処置は、腫瘍血管形成の抑制に起因して腫瘍量の劇的な減少を生じた(Kimら,Nature,382:841〜844(1993))。VEGFは、新血管新生に関連する多くの病理的状態およびプロセスにおいて主要な役割を果たすようである。従って、罹患した組織におけるVEGF発現の調節は、VEGFに誘導される新血管新生/血管形成の処置または予防に重要となり得る。
【0009】
VEGFは、40〜45Kの分泌型ホモダイマーである(Tischer Eら、J.Biol.Chem.266:11947〜11954(1991)。これは、胎盤由来増殖因子(PIGF)、VEGF−B、VEGF−C、VEGF−DおよびVEGF−Eを含む拡大ファミリーのメンバーである(Olofssonら、Proc.Natl.Acad.Sci.USA 93:2576〜2581(1996)、Joukovら,EMBO J.15:290〜298(1996),Achenら、Proc.Natl.Acad.Sci.USA 95:548〜553(1998)、Ogawaら,J.Biol.Chem.273:31273〜31282(1998))。VEGFは、8つのエキソンを含む単独の遺伝子からの選択的スプライシングにより産生される多数の異なるアイソフォームで存在する(Ferraraら、Endocr.Rev.13:18〜32(1992);Tischerら,J.Biol.Chem.,806:11947〜11954(1991);Ferraraら、Trends Cardio Med.,3:244〜250(1993);Polterakら,J.Biol.Chem.272:7151〜7158(1997))。ヒトVEGFアイソフォームは、それぞれ活性なホモダイマーを作製し得る、121、145、165、189、および206アミノ酸のモノマーからなる(Polterakら,J.Biol.Chem,272:7151〜7158(1997);Houckら、Mol.Endocrinol.,8:1806〜1814(1991))。このVEGF121およびVEGF165アイソフォームが、最も大量である。VEGF121は、ヘパリンに結合しない唯一のVEGFアイソフォームであり、そしてすべて培養培地に分泌される。VEGF165は、それがヘパリンおよび細胞表面の硫酸ヘパリンプロテオグリカン(HSPG)に結合するという点でVEGF121と機能的に異なり、そして培養培地にほんの部分的に放出される(Houckら、J.Biol.Chem.247:28031〜28037(1992);Parkら,Mol.Biol.Chem.,4:1317〜1326(1993))。残りのアイソフォームは、完全に細胞表面および細胞外マトリックスHSPGに会合している(Houckら,J.Biol.Chem.247:28031〜28037(1992);Parkら,Mol.Biol.Chem.,4:1317〜1326(1993))。
【0010】
VEGFレセプターチロシンキナーゼであるKDR/Flk−1および/またはFlt−1は、ほとんどECによって発現される(Termanら、Biochem.Biophys.Res.Commun.,187:1579〜1586(1992);Shibuyaら、Oncogene,5:519〜524(1990);De Vriesら,Science,265:989〜991(1992);Gitay−Goranら,J.Biol.Chem.、287:6003〜6096(1992);Jakemanら,J.Clin.Invest.,89:244〜253(1992))。たとえ両方のレセプターがVEGFの結合の際にリン酸化を起こしても、VEGF活性(例えば、分裂促進性、走化性、および形態学的変化の誘導)は、Flt−1でなく、KDR/Flk−1により媒介されるようである(Millauerら、Cell,72:835〜846(1993);Waltenbergerら,J.Biol.Chem.,269:26988〜26995(1994);Seetharamら、Oncogene、10:135〜147(1995);Yoshidaら,Growth Factors、7:131〜138(1996))。最近、Sokerらは、ECおよび種々の腫瘍由来細胞株(例えば、乳癌由来MDA−MB−231(231)細胞)上で発現される新しいVEGFレセプターを同定した(Sokerら,J.Biol.Chem.,271:5761〜5767(1996)。このレセプターは、第7エキソンにコードされる部分を含むためにVEGFアイソフォームを必要とする。例えば、VEGF121およびVEGF165Rの両方は、KDR/Flk−1およびFlt−1に結合するが、VEGF165のみが新しいレセプターに結合する。従って、これはアイソフォーム特異的レセプターであり、そしてVEGF165レセプター(VEGF165R)と名付けられた。これはまた、189アイソフォームおよび206アイソフォームと結合する。構造機能分析において、VEGF165がVEGF121には存在しない第7エキソンコードドメインを介してVEGF165Rに結合することが直接示された(Sokerら、J.Biol.Chem.,271:5761〜5767(1996))。しかし、このレセプターの機能は明確ではなかった。
【0011】
血管形成的な疾患の現在の処置は十分でない。持続的血管形成を予防する薬剤(例えば、薬物(TNP−470)、モノクローナル抗体、アンチセンス核酸およびタンパク質(アンギオスタチン(angiostatin)およびエンドスタチン(endostatin))は、現在、試験中である。Battegay,J.Mol.Med.73,333〜346(1995);Hanahanら、Cell、86.353〜364(1996);Folkman、N.Engl.J.Med.、333、1757〜1763(1995)を参照のこと。抗血管形成性タンパク質を用いた以前の結果は有望であるが、それらのサイズは比較的大きく、従って使用および作製するのに困難である。さらに、タンパク質は、酵素的分解に供される。従って、血管形成を阻害する新しい薬剤が必要である。サイズ、作製の容易さ、安定性および/または力価において改善を示す新しい血管形成性のタンパク質またはペプチドが、所望される。
【0012】
(発明の要旨)
本発明者らは、VEGF165の第7エキソンの一部分がすべてのVEGFアイソフォームに対してアンタゴニストとして作用することを発見した。すべてのVEGFの形態が第7エキソンを有しているわけではないので、これは驚くべきことである。例えば、本発明者らは、第7エキソンにコードされる44アミノ酸に対応するペプチドを含むグルタチオンS−トランスフェラーゼ(GST)融合タンパク質、および第8エキソンでコードされるペプチド(VEGF165のアミノ酸116〜160(配列番号1))の第一システインを調製した。この融合タンパク質は、ヒト臍帯静脈由来EC(HUVEC)および231細胞上のレセプターへの125I−VEGF165の結合を阻害した。この阻害活性は、第7エキソンコードドメイン(アミノ酸22〜44)のC末端部分に局在化していた。さらに、この融合タンパク質は、HUVECのVEGF誘導化増殖を阻害した。この融合タンパク質はまた、VEGF121誘導化分裂促進性を阻害し、これはVEGF121が第7エキソンを含まないことを考慮すると、予期せぬ結果であった。従って、本発明のポリペプチドは、VEGFの主要なアイソフォームに対するアンタゴニストであり、そしてVEGF誘発性の新血管新生または血管形成に関連する疾患および状態の処置に用いられ得る。
【0013】
さらに、理論によって拘束されることを望まないが、VEGFは、VEGF165R/NP−1を発現する多くの癌と直接関連しており(Sokerら、Cell92,735〜745(1998))、そしてこのレセプターに対するVEGF結合の阻害がこのような癌の処置に用いられ得ると考えられる。
【0014】
本発明は、例えば、以下の実施例に記載するようにVEGF165を用いるヒト臍帯静脈内皮細胞(HUVEC)増殖アッセイによって、決定されたように、VEGFアンタゴニスト活性を有する配列番号1の一部分を有するポリペプチドを提供する。好ましくは、この一部分は、HUVEC増殖の少なくとも25%の減少、より好ましくは50%の減少、さらにより好ましくは75%の減少、最も好ましくは95%の減少を有する。好ましくは、この一部分は、多くのシステイン残基さえ有する。
【0015】
VEGFアンタゴニスト活性はまた、Sokerら、J.Biol.Chem.271、5761〜5767(1996)に開示され、そして以下の実施例に示されるように、VEGF165Rに対する標識されたVEGF165の結合の阻害によって決定され得る。好ましくは、この一部分は、結合を少なくとも25%、より好ましくは50%、最も好ましくは75%阻害する。
【0016】
本発明はさらに、例えば、以下の実施例に記載するようにVEGF165を用いるヒト臍帯静脈内皮細胞(HUVEC)増殖アッセイにより決定されるように、VEGFアンタゴニスト活性を有する配列番号2(CSCKNTDSRCKARQLELNERTCRC)を含むポリペプチド、またはその一部分を提供する。好ましくは、この一部分は、HUVEC増殖において、少なくとも25%減少、より好ましくは50%減少、さらにより好ましくは75%減少、最も好ましくは95%の減少を有する。好ましくは、この一部分は、多くのシステイン残基さえ有する。
【0017】
本発明の1つの好ましいポリペプチドは、以下の式(I)の構造を有する:
(X1−(CSCKNTDSRCKARQLELNERT(配列番号3))−X2)I :
ここで、X1は、Hまたは配列番号1のアミノ酸2〜21の任意の部分である。例えば、配列番号1のアミノ酸3〜21、4〜21、5〜21、6〜21など。そしてX2は、HまたはC、CR、RCまたはCRCである。式(I)のポリペプチドは、例えば、以下の実施例に記載するようにVEGF165を用いるヒト臍帯静脈内皮細胞(HUVEC)増殖アッセイによって、決定されるように、VEGFアンタゴニスト活性を有する。好ましくは、このポリペプチドは、HUVEC増殖において、少なくとも25%減少、より好ましくは50%減少、さらにより好ましくは75%減少、最も好ましくは95%の減少を有する。好ましくは、このポリペプチドは、多数のシステイン残基さえ有する。式(I)のポリペプチドはアナログを含む。
【0018】
「アナログ」とは、本発明のペプチドのうちの1つの配列と異なるポリペプチドであるが、以下の実施例に記載するようにVEGF165を用いるヒト臍帯静脈内皮細胞(HUVEC)増殖アッセイにおいて、配列番号2のポリペプチドの少なくとも50%のVEGFアンタゴニスト活性をなお示すポリペプチドをいう。好ましくは、このアナログは、配列番号2のポリペプチドのVEGFアンタゴニスト活性の75%、最も好ましくは95%を示す。差異は好ましくは保存的アミノ酸置換であり、ここでアミノ酸は、同様の特徴の別の天然に存在するアミノ酸と置きかえられる。例えば、以下の置換が「保存的」であると考えられる:Gly←→Ala;Val←→Ile;Asp←→Glu;Lys←→Arg;Asn←→Gln;およびPhe←→Trp←→Tyr。非保存的変化は、一般に異なる群からのアミノ酸での上記のアミノ酸の1つの置換(例えば、GluをAsnで置換)または、上記アミノ酸のいずれかをCys、Met、HisもしくはProで置換することである。
【0019】
好ましい形態では、本発明のポリペプチドは、融合タンパク質の一部であるか、あるいは精製度をあげるため、安定性を増すため、および/または生物学的活性を提供する部分に結合している。
【0020】
別の実施態様では、本発明のポリペプチド(単独でも融合タンパク質の一部としてのいずれでも)は、VEGF165R/NP−1を発現する標的細胞に用いられる。この標的化は、診断のためにおよび治療的適用のために用いられ得る。例えば、診断目的で、このポリペプチドは放射線標識され、そしてVEGF165R/NP−1を発現する細胞を検出するために用いられる。本発明者らは、このレセプターの発現が前立腺癌および乳癌、特に転移性癌のような多くの癌において疾患状態に高い相関を有していることを発見した。従って、さらなる実施態様において、このポリペプチドは、特定の癌について予知的な様式で用いられ得る。
【0021】
治療的適用のために、このポリペプチドは、VEGF165R/NP−1を発現する細胞に薬剤を送達するために用いられ得る。例えば、このポリペプチドは、細胞へ所望の化学的または細胞傷害性部分を送達するためにキャリアとして用いられ得る。この細胞傷害性部分は、細菌、真菌もしくは植物起源の細胞傷害性薬物または酵素的に活性な毒素、あるいはこのような毒素の酵素的に活性なポリペプチド鎖またはフラグメント(「A鎖」)であり得る。酵素的に活性な毒素およびそれらのフラグメントが好ましく、そしてジフテリア毒素Aフラグメント、ジフテリア毒素の非結合性活性フラグメント、外毒素A(Pseudomonas aeruginosa由来)、Aリッチ鎖、アブリンA鎖、モデシン(modeccin)A鎖、アルファサルシン(alphasarcin)、特定のAleurites fordiiタンパク質、特定のDianthinタンパク質、Phytolacca americanaタンパク質(PAP、PAPIIおよびPAP−S)、Momordica charatiaインヒビター、カルシン(curcin)、クロチン(crotin)、Saponaria officinalisインヒビター、ゲロニン(gelonin)、ミトゲリン(mitogellin)、レストリクトシン(restrictocin)、フェノマイシン(phenomycin)、およびエノマイシン(enomycin)により例示される。Ricin A鎖、Pseudomonas aeruginosa外毒素AおよびPAPが好ましい。
【0022】
本発明は、VEGF誘導性の新血管新生または血管形成に関連する疾患または障害/状態を処置する方法をさらに提供する。本明細書において用いられる、用語「新血管新生」は、血管および毛細血管の増殖をいう。VEGF誘導性の新血管新生または血管形成に関連する疾患、障害または状態としては、網膜の新血管新生、血管腫(hemagioma)、固体癌増殖、白血病、転移、乾癬、血管新生緑内障、糖尿病性網膜症、慢性関節リウマチ、変形性関節症、子宮内膜症、筋変性、および未熟児網膜症(ROP)が挙げられるがこれらに限定されない。
【0023】
本発明の方法において、本発明のポリペプチドの治療量は、VEGFに関連する疾患もしくは状態を有するか、またはVEGF165R/NP−1を発現する腫瘍を有する宿主(例えば、ヒトまたは他の哺乳動物)に投与される。VEGF165R/NP−1の発現を検出するための方法は、Sokerら、Cell 92:735〜745(1998)に記載されている。
【0024】
本発明はまた、薬学的に受容可能なキャリアと組み合わせた本発明のポリペプチドの有効量を含む組成物を提供する。
【0025】
本発明の他の局面は、以下に開示される。
【0026】
(発明の詳細な説明)
本発明は、VEGFアンタゴニスト活性を有する単離されたポリペプチド、ペプチドをコードする核酸、このポリペプチドおよび核酸を含む薬学的組成物、ならびにVEGFに関連する疾患および障害(例えば、血管形成を誘導するVEGF165R/NP−1およびVEGFを発現する腫瘍)を処置するための方法を提供する。本発明のポリペプチドは、上記の、VEGFアンタゴニスト活性を有する配列番号1の一部を含有するポリペプチド、VEGFアンタゴニスト活性を有する配列番号2(CSCKNTDSRCKARQLELNERTCRC)またはその一部を含有するポリペプチド、および式(I)の構造を有するポリペプチドを含む。本発明はさらに、VEGFアンタゴニスト活性を有するこれらのポリペプチドのアナログおよび誘導体を含む。エキソン7およびエキソン8をコードするDNA配列は、それぞれ配列番号17および18として配列リストに記載される。
【0027】
VEGFアンタゴニスト活性は、当該分野で公知の技術を使用して決定され得る。例えば、VEGFアンタゴニスト活性は、アンタゴニストポリペプチドが使用される場合、野生型のVEGF活性を調べ、そしてこのような活性の阻害または減少を比較することによって決定され得る。配列番号2のポリペプチドは、基準として使用され得る。任意のVEGF活性を使用し得る。例えば、以下の実施例に記載されるように、VEGF165を使用するヒト臍帯血静脈血管内皮細胞(HUVEC)増殖アッセイを使用し得る。好ましくは、この一部は、HUVEC増殖において少なくとも25%の減少、より好ましくは50%の減少、さらにより好ましくは75%の減少、最も好ましくは95%の減少を有する。好ましくは、この一部は、偶数個のシステイン残基を有する。
【0028】
VEGFアンタゴニスト活性はまた、Sokerら、J.Biol.Chem. 271、5761〜5767(1996)において開示され、そして以下の実施例に記載されるように、標識されたVEGF165のVEGF165Rに対する結合の阻害によって決定され得る。好ましくは、この一部は少なくとも25%、より好ましくは50%、最も好ましくは75%まで結合を阻害する。
【0029】
血管形成に影響を与えるためのVEGFアンタゴニストポリペプチドの能力はまた、多くの公知のインビボおよびインビトロアッセイを使用して決定され得る。このようアッセイは、Jainら、Nature Medicine 3、1203〜1208(1997)に開示され、この開示は本明細書中で参考として援用される。例えば、インビボで血管形成を阻害する能力に対するアッセイは、ニワトリ絨毛尿膜アッセイおよびマウス、ラットまたはウサギ角膜嚢(corneal pocket)アッセイを含む。Polveriniら、1991、Methods Enzymol. 198:440〜450を参照のこと。角膜嚢アッセイに従って、選択される腫瘍は、角膜嚢の形で試験動物の角膜内に移植される。可能性のある血管形成インヒビターは、角膜嚢に適用され、そして角膜嚢は慣用的に新血管新生について検査される。
【0030】
本明細書中で使用されるように、VEGFアンタゴニストポリペプチドの「誘導体」は、1以上の物理的、化学的、または生物学的な特性が変化しているポリペプチドである。このような改変は、以下:アミノ酸置換、修飾、付加または欠失;脂質化(lipidation)、グリコシル化またはリン酸化のパターンにおける変化;他の有機分子および非有機分子と、ポリペプチド中に存在するアミノ酸残基の遊離のアミノ側鎖、カルボキシル側鎖、またはヒドロキシル側鎖との反応;および他の修飾(これらのいずれかは、一次構造、二次構造、または三次構造の変化を生じ得る)を含むがこれらに限定されない。さらにこのような誘導体は、上述のVEGFアンタゴニスト活性の少なくとも一つを示す。
【0031】
本発明のポリペプチドは、好ましくは組換え方法によって産生される。以下の実施例1に開示される手順を参照のこと。広範な多様な分子学的および生化学的方法が、本発明のポリペプチドを生成し、そして発現するために利用可能である。例えば、Molecular Cloning、A Laboratory Manual(第2版、Sambrook、FritschおよびManiatis、Cold Spring Harbor)、Current Protocols in Molecular Biology(Aufubel、Brent、Kingston、More、Feidman、SmithおよびStuhl編、Greene Publ.Assoc.,Wiley−Insterscience、NY、N.Y.1992)に開示される手順またはそうでなくても当該分野で公知な他の手順を参照のこと。例えば、本発明のポリペプチドは、化学合成、E.Coliのような細菌および酵母のような真核生物における発現、バキュロウイルスまたは哺乳動物細胞に基づく発現系などによって得られ得、ポリペプチドの大きさ、性質および量に依存する。
【0032】
用語「単離された」は、ポリペプチドがその元の環境(例えば、天然VEGF分子)から取り除かれることを意味する。例えば、天然に存在するポリヌクレオチドまたはポリペプチドは、単離されていない生きている動物中に存在するが、天然の系において、いくつかのまたは全ての共存する物質から分離されている同一のポリヌクレオチドまたはDNAまたはポリペプチドは、単離されている。このようなポリヌクレオチドは、ベクターの一部であり得、および/またはこのようなポリヌクレオチドもしくはポリペプチドは、組成物の一部であり得、そしてさらにこのようなベクターまたは組成物がその天然の環境の一部ではないように単離される。
【0033】
本発明のポリペプチドを発現することが所望される場合、任意の適切な系が使用され得る。適切なベクターの一般的な性質、発現ベクターおよびそれに対する構築物は、当業者に明らかである。
【0034】
適切な発現ベクターは、ファージまたはプラスミドに基づき得、これらはしばしば他の宿主に設計され得るが、これらの両方は一般に宿主特異的である。他の適切なベクターは、コスミドおよびレトロウイルス、ならびに任意の他のウイルスを含み、これらは所定の系に対して特異的であり得るか、または特異的であり得ない。コントロール配列(例えば、認識配列、プロモータ配列、オペレータ配列、インデューサ配列、ターミネータ配列および発現の調節に必須な、および/または有用な他の配列)は、当業者に容易に明らかである。
【0035】
ヌクレオチド配列の適切な調製は、例えば、Sangerら(Proc.Natl.Acad.Sci.USA 74:5463〜7(1977))の方法によって確認され得る。
【0036】
本発明のポリペプチドをコードするDNAフラグメント、レセプターまたはそのフラグメントは、適切なベクター中に容易に挿入され得る。理想的に、受容ベクターは、リーディングフレームおよび挿入の位置にわたって不確実性を誘導し得るが、挿入の容易さのために適切な制限部位を有し、例えば、用いられ得る平滑末端ライゲーションを有さない。このような例において、発現について形質転換株を試験することは当然のことであり、この6中の1は、適切なリーディングフレームを有するべきである。適切なベクターは、所望の発現系に従って、当業者によって選択され得ることは当然のことである。
【0037】
適切な生物または好ましくは、アンピシリンを有する形質転換株を選択し、得られるプラスミドを有する真核細胞株(例えば、HeLa)を形質転換することによって、または必要であれば他の適切な手段、および必要であればトリプトファンまたは他の適切なプロモータインデューサ(例えば、インドールアクリル酸)を添加することによって、所望のポリペプチドまたはタンパク質が発現され得る。発現の程度は、SDSポリアクリルアミドゲル電気泳動−SDS−PAGE(Lemelli、Nature 227:680〜685(1970))によって分析し得る。
【0038】
増殖および形質転換する培養物などについて適切な方法は、通常、例えば、Maniatis(Molecular Cloning、A Laboratory Notebook、Maniatisら(編)、Cold Spring Harbor Labs、N.Y.(1989))に例証される。
【0039】
ポリペプチドまたはタンパク質の産生のための有用な培養物は、適切には任意の生細胞の培養物であり得、そして原核生物発現系から真核生物発現系まで変化し得る。一つの好ましい原核生物系は、その操作の容易さのためにE.Coliの系である。しかし、真核タンパク質の発現のために、哺乳動物細胞株のようなより高度の系を使用することもまた可能である。一過性の発現のための現在好ましい細胞株には、HeLa細胞株およびCos細胞株である。他の発現系としては、チャイニーズハムスター卵巣(CHO)細胞株およびバキュロウイルス系が挙げられる。
【0040】
使用され得る他の発現系には、例えば、streptomycetes、および酵母(例えばSaccharomyces spp.特にS.cerevisiae)が挙げられる。任意の系は、所望されるように使用され得、一般にオペレータによって要求されるものに依存する。適切な系をまた使用しても、遺伝的物質を増幅し得るが、一般にDNAの増殖のみが要求される場合、この目的のためにE.coliを使用することが都合よい。
【0041】
これらのポリペプチドおよびタンパク質は、発酵または細胞培養物から単離され得、以下を含む任意の種々の従来の方法を使用して精製され得る:HPLC、FPLCなどを使用する液体クロマトグラフィー(例えば、順相または逆相);アフィニティークロマトグラフィー(例えば、無機リガンドまたはモノクローナル抗体を用いて);サイズ排除クロマトグラフィー;固定化金属キレートクロマトグラフィー;ゲル電気泳動;など。当業者は、本発明の範囲から逸脱することなしに、最も適切な単離および精製技術を選択し得る。
【0042】
これらのポリペプチドはまた、任意のいくつかの化学的技術によって生成され得る。例えば、これらは、本来R.B.Merrifield、「Solid Phase Peptide Synthesis.I.The Synthesis Of A Tetrapeptide」、J.Am.Chem.Soc.、83、2149〜54頁(1963)によって記載された固相合成技術を使用して調製され得、またはこれらは溶液中の合成によって調製され得る。ペプチド合成技術の概要は、E.GrossおよびH.J.Meinhofer、4 The Peptides:Analysis、Synthesis、Biology;Modern Techniques Of Peptide And Amino Acid Analysis、John WileyおよびSons、(1981)ならびにM.Bodanszky、Principles Of Peptide Synthesis、Springer−Verlag(1984)において見出され得る。
【0043】
上記で議論されるように、処置の一つの方法は、ペプチドに対する適切な毒素の吸着に次いで、腫瘍の範囲を標的することを包含する。このような毒素は、当該分野で周知であり、そして有毒な放射性同位体、重金属、酵素および補体活性化剤ならびに1細胞あたり1または2分子のみのレベルで作用し得るリシンのような天然毒素を含み得る。このような技術を、例えば癌を処置するために使用され得る適切な薬学的に活性な化合物の局在された用量を送達するために使用することはまた、可能であり得る。
【0044】
本発明が、例えば、患者に対するペプチドの投与のために提供される場合、次いでこれは任意の適切な経路によってなされ得る。腫瘍がさらに局在される(または診断される)と考えられる場合、次いで投与の適切な方法は、その部位に直接注射することによってなされ得る。投与はまた、皮下の、筋内の、静脈内の、および皮内の注射を含む注射によってなされ得る。
【0045】
処方物は、投与の経路に適切である任意のものであり得、そして当業者に明白である。この処方物は、適切なキャリア(例えば生理食塩水)を含み得、そしてまたバルク剤、他の医学的製剤、アジュバントおよび任意の他の適切な薬学的材料を含み得る。カテーテルは、投与の別の好ましい様式である。
【0046】
用語「有効量」とは、検出可能な治療的効果を示すために十分なVEGFアンタゴニストポリペプチドまたはこのポリペプチドをコードする核酸の量をいう。この治療的効果は、例えば、所望されない組織または悪性細胞の増殖を阻害すること、不適切な血管形成(新血管新生)を阻害すること、慢性の炎症によって生じる組織の損傷を制限すること、腫瘍細胞の増殖の阻害などを、限定されることなく含み得る。被験体に対する正確な有効量は、被験体の大きさおよび健康、処置されるための条件の性質および重篤度などに依存する。従って、あらかじめ正確な有効量を特定することは不可能である。しかし、与えられた状態における有効量は、本明細書中で提供される情報に基づく慣習的な実験によって決定され得る。
【0047】
用語「薬学的に受容される」とは、過度の毒性なしに哺乳動物に投与され得る化合物および組成物をいう。例示的な薬学的に受容される塩には、塩酸塩、臭化水素酸塩、リン酸塩、硫酸塩などのような無機酸塩;および酢酸塩、プロピオン酸塩、マロン酸塩、安息香酸塩などのような有機酸塩が挙げられる。
【0048】
VEGFアンタゴニストポリペプチドは、経口的、局所的、または皮下注射および筋内注射、持続性の放出貯蔵物の移植、静脈注射、鼻腔内投与などを含む非経口的な手段によって投与される。従って、VEGFアンタゴニストは、薬学的に受容されるキャリアと組み合わせて、VEGFアンタゴニストを含む薬学的組成物として投与され得る。このような組成物は、水溶液、エマルジョン、クリーム、軟膏、懸濁液、ゲル、リポソーム懸濁液などであり得る。適切なキャリア(賦形剤)には、水、生理食塩水、Ringer溶液、ブドウ糖溶液、およびエタノール、グルコース、スクロース、デキストラン、マンノース、マンニトール、ソルビトール、ポリエチレングリコール(PEG)、リン酸塩、酢酸塩、ゼラチン、コラーゲン、Carbopol Registered TM、植物性油脂などの溶液が挙げられ得る。さらに、適切な保存薬、安定薬、抗酸化薬、抗菌剤、および緩衝剤(例えば、BHA、BHT、クエン酸、アスコルビン酸、テトラサイクリン)などが挙げられ得る。処方物に有用なクリームまたは軟膏基剤には、ラノリン、Silvadene Registered TM(Marion)、Aquaphor Registered TM(Duke Laboratories)などが挙げられる。他の代表的な処方物には、エーロゾル、包帯、および他の創傷包帯剤が挙げられる。あるいは、VEGFアンタゴニストを、適切なポリマーマトリックスまたは膜に組み込むかまたは被包し得、従って局所的に処置させるために部位の近傍に移植するのに適切な持続性の放出送達デバイスを提供する。他のデバイスには、留置カテーテルおよびAlzet Registered TMミニポンプのようなデバイスが挙げられる。目の製剤は、Sorbi−care Registered TM(Allergan)、Neodecadron Registered TM(Merck、Sharp&Dohme)、Lacrilube Registered TMなどのような市販のビヒクルを使用して処方され得、または米国特許番号第5,124,155号(これは、本明細書中で参考として援用される)に記載されるような代表的な製剤を使用し得る。さらに、VEGFアンタゴニストを固形、特に凍結乾燥粉末として提供し得る。凍結乾燥された処方物には、代表的に、安定化剤またはバルク剤、例えば、ヒト血清アルブミン、スクロース、マンニトールなどが挙げられる。薬学的に受容される賦形剤の詳細な議論は、Remington’s Pharmaceutical Sciences(Mark Pub.Co.)において入手可能である。
【0049】
本発明のアンタゴニストポリペプチドは、局所的または血管内に使用され得る。局所的な適用について、この処方物は、約10ng/cm2/日から約1mg/cm2/日の割合で直接的に適用される。血管内の適用について、このインヒビターは、体重に対して、約1mg/kg/日から約10mg/kg/日の割合で使用される。体内の使用について、この処方物は、移植される緩徐放出(slow release)の重合体物質から、または緩徐放出のポンプもしくは反復注射からのいずれかで処置される領域に直接放出され得る。各々の場合における放出速度は、約100ng/日/cm3から約100mg/日/cm3である。
【0050】
本発明のVEGFアンタゴニストポリペプチドは、治療的な有効量の他の分子と組み合わせられ得、この分子は消極的に血管形成を調節し、この分子はTNP−470、血小板第4因子、トロンボスポンジン−1、メタロプロテアーゼの組織インヒビター(TIMP1およびTIMP2)、プロラクチン(16−Kdフラグメント)、アンジオスタチン(プラスミノゲンの38−Kdフラグメント)、エンドスタチン、bFGF可溶性レセプター、トランスホーミング増殖因子β、インターフェロンα、可溶性KDRおよびFLT−1レセプターならびに胎盤の増殖関連タンパク質であり得るがこれらに限定されない。
【0051】
本発明のVEGFアンタゴニストポリペプチドはまた、化学療法剤と組み合わせられ得る。
【0052】
異常な血管形成または新血管新生に関連し、そして本発明の治療的化合物で処置され得る疾患、障害、または状態には、網膜の新血管新生、腫瘍の増殖、血管腫(hemagioma)、固体の腫瘍、白血病、転移、乾癬、血管新生緑内障、糖尿病性網膜症、関節炎、子宮内膜症、および未熟児網膜症(ROP)が挙げられるが、これらに限定されない。
【0053】
本発明のVEGFアンタゴニストポリペプチドをコードする核酸(例えば、DNA)は、当業者に公知な任意の方法によって宿主へ送達されて、VEGFに関連する障害を処置し得る。本発明の好ましい実施態様は、固体の腫瘍の血管形成を阻害して、さらなる腫瘍の増殖および結果として生じる転移を予防する方法に関する。この目的のために、遺伝子トランスファーしやすい任意の固体の腫瘍または腫瘍の周囲の領域が、開示された治療的適用の標的となり得る。本発明のVEGFアンタゴニストポリペプチドまたはその誘導体もしくはそのアナログをコードする、組換えウイルスまたは非ウイルスに基づく遺伝子トランスファー系内に格納されるDNAは、当該分野で公知のいくつかの手順によって腫瘍の近傍内の標的細胞に配向され得る。これらの手順には、(a)有効量のDNAを腫瘍中の部位またはその周囲に対して投与することと組み合わせた外科的手順(可能であれば、腫瘍の一部または全体の最初の除去を含む);(b)腫瘍部位内または近傍に対する直接的な遺伝子転移ビヒクルの注射;および(c)当該分野で公知の技術を使用する、遺伝子転移系ベクターおよび/または遺伝子産物の局所的または全身的送達が挙げられるがこれらに限定されない。
【0054】
従って、VEGFまたはVEGF165R/NP−1もしくはVEGF165R/NP−2発現細胞を含む任意の固体の腫瘍は、処置について可能性のある標的である。遺伝子治療の適用に対して特に攻撃されやすい固体の腫瘍の例には、以下が挙げられるが決して限定として列挙するものではない(a)中枢神経系の新生物(例えば、神経膠芽細胞腫、星状細胞腫、神経芽細胞腫、髄膜腫、脳室上衣細胞腫、しかしここでも限定される必要はない);(b)ホルモン依存性である癌(インサイチュ癌、上皮内癌、髄様癌、管状腺癌、浸潤(invasive)(浸潤(infiltrating)癌および粘液性癌腫を含むがこれらに限定されない前立腺、精巣、子宮、頸、卵巣、乳癌のような組織);(c)黒色腫(癌および眼の黒色腫を含むがこれらに限定されない);(d)少なくとも扁平上皮細胞癌腫、紡錘体癌(spindle carcinoma)、小細胞癌、腺癌および大細胞癌を含む肺の癌;ならびに(e)胃腸系(例えば、少なくとも大腸の腺癌を含む食道、胃、小腸、結腸、結腸直腸、直腸および肛門領域)の癌。
【0055】
発現ベクターは、本明細書中で、適切な宿主において遺伝子のクローン化されたコピーの転写およびこれらのmRNAの翻訳について要求されるDNA配列として規定される。このようなベクターを使用して、種々の宿主(例えば、細菌、藍藻、真菌細胞、酵母細胞、植物細胞、昆虫細胞および動物細胞)において真核生物の遺伝子を発現し得る。
【0056】
特異的に設計されたベクターは、宿主間(例えば、細菌−酵母細胞または細菌−動物細胞または細菌−昆虫細胞)のDNAのシャトルを可能にする。適切に構築された発現ベクターには、以下:宿主細胞において自律増殖に対する複製起点、選択マーカー、限定数の有用な制限酵素部位、高いコピー数に対する可能性、および活性なプロモーター、を含むべきである。プロモーターは、DNAに結合し、そしてRNA合成を開始するためのRNAポリメラーゼに配向するDNA配列として定義される。強力なプロモーターは、高頻度で開始されるmRNAを生じるものである。
【0057】
発現ベクターには、クローニングベクター、改変されたクローニングベクター、特異的に設計されたプラスミドまたはウイルスが挙げられ得るがこれらに限定されない。
【0058】
種々の哺乳動物の発現ベクターを使用して、哺乳動物細胞における組換えVEGFアンタゴニストを発現し得る。市販されている哺乳動物の発現ベクターは、組換え発現について適切であり得、以下:pcDNA3.1(Invitrogen)、pBlueBacHis2(Invitrogen)、pLITMUS28、pLITMUS29、pLITMUS38およびpLITMUS39(New England BioLabs)、pcDNAI、pcDNAlamp(Invitrogen)、pcDNA3(Invitrogen)、pMC1neo(Stratagene)、pXT1(Stratagene)、pSG5(Stratagene)、EBO−pSV2−neo(ATCC37593)、pBPV−1(8−2)(ATCC37110)、pdBPV−MMTneo(342−12)(ATCC37224)、pRSVgpt(ATCC37199)、pRSVneo(ATCC37198)、pSV2−dhfr(ATCC37146)、pUCTag(ATCC37460)、ならびに?LZD35(ATCC37565)を含むがこれらに限定されない。
【0059】
本発明のVEGFアンタゴニストをコードするDNAはまた、組換え宿主細胞中の発現に対する発現ベクター内でクローン化され得る。組換え宿主細胞は、原核生物または真核生物(細菌、酵母、哺乳動物細胞(ヒト、ウシ、ブタ、サルおよび齧歯類起源の細胞株を含むがこれらに限定されない)、ならびに昆虫細胞(細胞株由来のショウジョウバエ(drosophila)、ガ、カおよびヨトウムシ(の幼虫:armyworm)を含むがこれらに限定されない))を含み得るがこれらに限定されない。この発現ベクターは、多くの技術の任意の一つ(形質転換、トランスフェクション、Ad/ポリリジンDNA複合体、プロトプラスト融合、およびエレクトロポレーションを含むがこれらに限定されない)によって宿主細胞内に導入され得る。哺乳動物種由来の細胞株(これは適切であり得、そして市販されている)には、以下の細胞、CV−1(ATCC CCL70)、COS−1(ATCC CRL1650)、COS−7(ATCC CRL1651)、CHO−K1(ATCC CCL61)、3T3(ATCC CCL92)、NIH/3T3(ATCC CRL1658)、HeLa(ATCC CCL2)、C1271(ATCC CRL1616)、BS−C−1(ATCC CCL26)およびMRC−5(ATCC CCL171)ならびにHEK293細胞が挙げられるがこれらに限定されない。昆虫細胞株(これは適切であり得、そして市販されている)には、3M−S(ATCC CRL8851)、ガ(ATCC CCL80)、カ(ATCC CCL194および195;ATCC CRL1660および1591)ならびにヨトウムシ(Sf9、ATCC CRL1711)が挙げられるがこれらに限定されない。
【0060】
VEGFアンタゴニストポリペプチドをコードするDNAフラグメントは、ウイルスまたは非ウイルスに基づく方法により、全身的にか、または哺乳動物宿主の固形腫瘍の近傍にある標的細胞のいずれかに送達され得る。本発明において利用され得るウイルスベクター系は、(a)アデノウイルスベクター;(b)レトロウイルスベクター;(c)アデノ関連ウイルスベクター;(d)単純ヘルペスウイルスベクター;(e)SV40ベクター;(f)ポリオーマウイルスベクター;(g)パピローマウイルスベクター;(h)ピコルナウイルス(picarnovirus)ベクター;および(i)ワクシニアウイルスベクターを含むが、これらに限定されない。
【0061】
本発明のVEGFアンタゴニストをコードするDNAを含む組換えウイルスまたは組換えベクターは、固形腫瘍および/または固形腫瘍に近接する静態組織(例えば、脂肪組織または筋肉組織)内への直接注射により、宿主に好ましくは投与される。腫瘍細胞を標的化された脂肪細胞および筋肉細胞の領域中にトランスフェクトすることは、もちろん有用である。これらの周辺細胞におけるVEGFアンタゴニストの一過性の発現は、これらのペプチドの局所的な細胞外増加を生じ、そしてVEGFレセプターとの結合を促進し、従ってそのレセプターへのVEGFの結合を阻害する。
【0062】
また適切である非ウイルスベクターは、DNA−脂質複合体、例えば、アシアログリコプロテイン媒介送達系のようなリポソーム−媒介結合体またはリガンド/ポリ−L−リシン結合体を含む(例えば、Felgnerら、1994、J.Biol.Chem.269:2550−2561;Derossiら、1995、Restor.Neurol.Neuros.8:7−10;およびAbcallahら、1995、Biol.Cell 85:1−7を参照のこと)。
【0063】
本発明はまた、本発明の薬学的組成物の1つ以上の成分で満たされた1つ以上の容器を含む、薬学的パックまたはキットを提供する。必要に応じて薬学的もしくは生物学的製品の製造、使用または販売の行政機関規制により規定される形態での注意書きが、そのような容器に付随し得、その注意書きは、ヒト投与物に対する製造、使用または販売についての行政機関による認可を反映した注意書きである。
【0064】
本願を通して引用された参考文献は、本明細書中で参考として援用される。
【0065】
本発明は、以下の実施例によりさらに例示される。これらの実施例は、本発明の理解を補助するために提供され、そしてその制限としては解釈されない。
【0066】
(実施例1)
(実験手順)
(材料)
ヒト組換えVEGF165およびVEGF121を、以前に記載されたように(Sokerら、J.Biol.Chem.、271、5761−5767(1996)、Cohenら、Growth Factors、7、131−138(1992))、ヒトVEGF165またはVEGF121をコードする組換えバキュロウイルスで感染させたSf−21昆虫細胞において産生した。VEGF165を、感染されたSf−21細胞の馴化培地からヘパリンアフィニティークロマトグラフィーにより精製し、そしてVEGF121を陰イオン交換クロマトグラフィーにより精製した。塩基性FGFは、Judith Abraham博士(Scios、Sunnyvale、CA)の御厚意により提供された。細胞培養培地をLife Technologies,Inc.より購入した。125I−ナトリウムをNEN Life Science Productsより購入した。ジスクシニミジルスベリン酸塩(Disuccinimidyl suberate)およびIODO−BEADSをPierceより購入した。G−グルタチオンアガロース、NAP−5カラム、およびpGEX−2TKプラスミドをPharmacia Biotech Inc.より購入した。TSK−ヘパリンカラムをTosoHass(Tokyo、Japan)より購入した。分子量マーカーをAmersham Corp.(IL)より購入した。ブタ腸粘膜由来ヘパリンをSigmaより購入した。
【0067】
(細胞培養)
ヒト臍静脈内皮細胞(HUVEC)を、American Type Culture Collection(ATCC)(Rockville MD)より入手し、そしてゼラチン被覆ディッシュ上で、20%ウシ胎仔血清(FCS)ならびにグルタミン、ペニシリン、およびストレプトマイシンの混合物(GPS)を含有するM−199培地中で増殖させた。塩基性FGF(1ng/ml)を一日おきに培養培地に添加した。親の、およびKDR/Flk−1(PAE−KDR)を発現するようトランスフェクトされたブタ内皮細胞(PAE)は、Lema Claesson−Welsh博士の御厚意により提供され、そしてこれを記載されたように10%FCSおよびGPSを含有するF12培地において増殖させた(Waltenbergerら、J.Biol.Chem.、269、26988−26995(1994))。MDA−MB−231(231)細胞をATCCより入手し、そして10%のFCSおよびGPSを含有するダルベッコ(Bulbecco’s)変法イーグル培地で増殖した。
【0068】
(内皮細胞増殖アッセイ)
HUVECを、ゼラチン被覆96ウェルディッシュにおいて、4,000細胞/200Ul/ウェルの濃度で5%FCSおよびGPSを含有するM−199中に播種した。24時間後、VEGFアイソフォームおよびVEGFエキソン7−GST融合タンパク質を同時にウェルに添加した。この細胞を72時間インキュベートし、そして[3H]チミジン(1μC/ml)を10〜12時間添加した。培地を吸引し、そしてこの細胞をトリプシン処理し、そして自動セルハーベスター(cell harvester)(TOMTEC)により採集し、そしてフィルターマット(Filtermats)(Wallac)にのせた。フィルターマットをスキャンし、そしてカウント毎分(cpm)をMicroBeta計数器(Wallac)により測定した。結果は、3連でアッセイされたサンプルの平均を表し、そして標準偏差(standard derivation)を決定した。全ての実験は少なくとも3回繰り返され、そして同様の結果が得られた。
【0069】
(VEGFの放射性ヨウ素結合)
VEGF165およびVEGF121の放射性ヨウ素結合を、IODO−BEADSを使用し、製造業者の指示に従って実施した。簡潔には、1つのIODO−BEADを100μlの0.1Mリン酸ナトリウム(pH7.2)でリンスし、乾燥させ、そして100μlの0.1Mリン酸ナトリウム(pH7.2)中で125I−ナトリウム(0.2mCi/μgタンパク質)と共に5分間室温でインキュベートした。VEGF(1〜3μg)を反応混合物に添加し、そして5分後に、ビーズを除去することによりその反応を停止した。125I−VEGFを含有する溶液を2mg/mlゼラチンに調整し、そして2mg/mlゼラチンを含有するPBSで予め平衡したNAP−5カラムを使用するサイズ排除クロマトグラフィーにより精製した。ヨウ素化タンパク質のアリコートをドライアイスで凍結し、そして−80℃に保存した。その比活性は40,000〜100,000cpm/ngタンパク質の範囲であった。
【0070】
(125I−VEGFの結合および架橋)
125I−VEGF165および125I−VEGF121を使用する結合ならびに架橋実験を以前に記載されたように実施した(Gitay−Gorenら、J.Biol.Chem.、287、6003−6096(1992)、Sokerら、J.Biol.Chem.、271、5761−5767(1996))。VEGF結合を、y−計数器(Beckman、Gamma 5500)における細胞に付随する放射能を測定することにより定量した。この計数は3つのウェルの平均を表す。全ての実験は少なくとも3回繰り返され、そして同様の結果が得られた。125I−VEGF架橋複合体を6%SDS−PAGEにより分離し、そしてこのゲルをリン光体スクリーンに曝露し、そして24時間後にPhosphorImager(Molecular Dynamics)により走査した。引き続いて、このゲルをX線フィルムに曝露した。
【0071】
(GST−VEGFエキソン7および8融合タンパク質の調製)
VEGFのエキソン7および8の異なるセグメントを、以下のプライマーを使用するヒトVEGF cDNAからのポリメラーゼ連鎖反応により増幅した:
【0072】
【表1】
増幅産物をBamHIおよびEcoRI制限酵素で消化し、そしてプラスミドp2TK−エキソン7+8およびその誘導体を産生するように、GST(Smithら、Gene(Amst.)、87、31−40(1988)をコードするpGEK−2TKベクター(Pharmacia Biotech Inc.)中にクローン化した。Escherichia coli(DH4a)をp2TK−エキソン7+8および誘導体で形質転換し、GST融合タンパク質を産生した(配列については、図5Bを参照のこと)。引き続き、細菌溶解物をグルタチオン−アガロースアフィニティ−クロマトグラフィーにより分離した(Smithら、Gene(Amst.)、87、31−40(1988))。グルタチオン−アガロースから溶出されたサンプルを、15%SDS−PAGEおよび銀染色により分析した。GST融合タンパク質をさらに、記載されるようにTSK−ヘパリンカラムに載せた。
【0073】
(結果)
(HUVECに対する、VEGF165およびVEGF121の示差的レセプター結合および分裂促進活性)
VEGF165およびVEGF121は、HUVEC上で発現されるVEGFレセプターと相互作用するそれら能力において異なる(Sokerら、J.Biol.Chem.、271、5761−5767(1996)、Gitay−Gorenら、J.Biol.Chem.271、5519−5523(1996))。VEGF121はKDR/Flk−1に結合して240−kDaの標識複合体を形成し(図1、レーン2)、一方VEGF165はこのサイズの複合体を形成するのに加えて、165−175kDaのより低分子量の複合体をまた形成する(図1、レーン1)。このアイソフォーム特異的レセプターをVEGF165レセプター(VEGF165R)と命名した。これらの示差的レセプター結合特性は、VEGF165およびVEGF121が、示差的な分裂促進活性もまた有し得ることを示唆する。従って、HUVEC増殖を刺激するこの2つのVEGFアイソフォームの能力を試験した。VEGF165はVEGF121よりもHUVECに対してより強力な分裂促進剤であった(図2)。VEGF165は1ng/mlで最大DNA合成の半分を刺激し、そして4ng/mlでの最大刺激は対照に対して8倍の増加を生じた。他方、2ng/mlのVEGF121が最大刺激の半分に必要とされ、そして最大刺激のための20ng/mlはHUVEC増殖において、対照に対して4倍の増加を生じた。従って、VEGF165と比較してちょうど2倍のVEGF121が、最大刺激の半分を達成するために必要とされ、そしてVEGF121に誘導される増殖はVEGF165に誘導されるレベルの約半分で飽和に達する。総合すると、これらの結果は、VEGF121と、比較されたECに対するVEGF165の増強された分裂促進活性と、HUVEC上のさらなるレセプター(VEGF165R)に結合するVEGF165の能力との間に相関が存在し得ることを示唆する。
【0074】
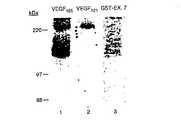
(エキソン7−および8−コードドメインを含有する融合タンパク質は、HUVECおよび231細胞上レセプターへの125I−VEGF165の結合を阻害する)
本発明者らの以前の研究は、VEGF165のVEGF165Rへの結合がエキソン7によりコードされる44のアミノ酸(VEGFアミノ酸116〜158)(これは、VEGF165に存在するが、VEGF121には存在しない)により媒介されることを示した(Sokerら、J.Biol.Chem.、271、5761−5767(1996))。VEGFエキソン7またはVEGFエキソン7および8によりコードされるペプチドを含有するGST融合タンパク質が調製された。エキソン7に対してC末端であるエキソン8によりコードされる6つのアミノ酸が、融合タンパク質の調製を促進するために含まれたが、いずれにしても結果に影響を与えなかった(データ示さず)。エキソン7融合タンパク質は、直接的に231細胞上のVEGF165Rに結合する(Sokerら、J.Biol.Chem.、271、5761−5767(1996))。それはまた、HUVEC上のKDR/FLK−1にではなく、HUVEC上のVEGF165Rに直接的に結合する(図1、レーン3)。HUVEC(KDR/Flk−1およびVEGF165Rを両方とも発現する)への125I−VEGF165の結合、PAE−KDR細胞(KDR/Flk−1のみを発現する(Waltenbergerら、J.Biol.Chem.、269、26988−26995(1994))への125I−VEGF165の結合、および231細胞(VEGF165Rのみ発現する(Sokerら、J.Biol.Chem.、271、5761−5767(1996))への125I−VEGF165の結合と競合するGST−VEGF165エキソン7−および8−コードペプチド(GST−Ex 7&8)の能力を試験した(図3)。GST−Ex 7+8の濃度の増加は、125I−VEGF165のHUVECへの結合を約85〜95%(図3A)、および231細胞への結合を97〜98%、著しく阻害した(図3B)。しかし、この融合タンパク質はPAE−KDR細胞(これはVEGF165Rを全く発現しない)への125I−VEGF165の結合を阻害しなかった(図3C)。GSTタンパク質単独では20μg/mlの濃度でさえ、125I−VEGF165の任意の細胞型への結合において有意な効果を有さなかった。総合すると、これらの結合研究は、GST−EX 7+8が125I−VEGF165結合に対して、KDRではなくVEGF165Rと直接的に相互作用することにより競合することを示唆した。
【0075】
これらの結合実験は、架橋による個々のVEGFレセプター種への125I−VEGFの結合におけるGST−Ed 7+8の効果を分析するために拡大された(図4)。231細胞への125I−VEGF165の架橋はVEGF165Rを有する標識複合体の形成を生じた(図4、レーン3)。これらの複合体の形成は、15μg/mlのGST−Ex 7+8の存在下で著しく阻害された(図4、レーン4)。HUVECへの125I−VEGF165の架橋は、KDR/Flk−1を伴う、より高分子量の標識複合体、およびVEGF165Rを伴う、より低分子量の標識複合体の形成を生じた(図4、レーン1)。GST−Ex 7+8は、VEGF165Rを含有するVEGF165−175−kDaの標識複合体の形成を著しく阻害した(図4、レーン2)。他方、融合タンパク質は、PAR/KDR細胞上のKDR/Flk−1への125I−VEGF165の架橋を阻害しなかった(示さず)。総合すると、(i)VEGF165はエキソン4(40)によりコードされるアミノ酸を介してKDR/Flk−1に結合し、(ii)VEGF165はエキソン7によりコードされるアミノ酸を介してVEGF165Rに結合し、そして(iii)GST−Ex 7+8はKDRではなくVEGF165Rに結合するから(図1および図8)、これらの結果は、VEGF165Rへの125I−VEGF165の結合と直接的に整合することにより、GST−Ex 7+8がKDR/Flk−1への125I−VEGF165の結合をまた間接的に阻害することを示唆した。
【0076】
(エキソン7−コードドメインを伴うコア阻害性領域の局在化)
GST−Ex 7融合タンパク質は、44アミノ酸のエキソン7コードドメイン全体を含む。コア阻害性領域が存在するか否かを決定するため、エキソン7のN末端およびC末端での欠失が作製され、そしてHUVECへの125I−VEGF165の結合に対する効果が測定された(図5)。これらの実験において、エキソン8の位置でエキソン7コードドメイン+システイン残基を含有する融合タンパク質が、融合タンパク質のVEGF部分におけるシステイン残基の数を、等しく維持するために含まれる。GST−Ex 7融合タンパク質は、2μg/ml融合タンパク質でHUVECへの125I−VEGF165の結合を80%阻害した(図5)。HUVECおよび231細胞への125I−VEGF165の結合の阻害はGST−Ex 7+8の結合の阻害と比較された(データ示さず)。最初の10のN末端アミノ酸の欠失(GST−Ex 7d−(1−10))または21のN末端アミノ酸の欠失(GST−Ex 7d−(1−21))は、融合タンパク質の阻害活性を減少しなかった。実際、1μg/mlのGST−Ex 7d−(1−21)は、同じ濃度のGST−Ex 7よりも大きな阻害活性を有した。このことは、エキソン7のアミノ酸1〜21残基内に阻害活性を干渉する領域が存在し得ることを示唆する。他方、エキソン7における22位のシステイン残基の欠失(GST−Ex 7d(1−22))は、阻害活性の完全な喪失を生じた。15のC末端アミノ酸の欠失(GST−Ex 7d−(30−44))もまた、阻害活性の完全な喪失を生じた(図5)。これらの結果は、阻害性のコアがエキソン7のアミノ酸22−44内に見出されることを示した。さらに、エキソン7の位置22のシステイン残基(VEGF内のCys137)は、阻害に必要とされる特異的な構造を維持するために重要であるように思われる。
【0077】
(GST−Ex 7+8はVEGF165誘導のHUVEC増殖を阻害する) GST−Ex 7+8融合タンパク質によるKDR/Flk−1へのVEGF165の結合の阻害は、図4に示されるように、KDR/Flk−1がVEGF分裂促進活性を媒介するため、GST−Ex 7+8融合タンパク質はVEGF165の分裂促進性のインヒビターでもまたあり得ることを示唆した(Waltenbergerら、J.Biol.Chem.、269、26988−26995(1994))。HUVECへの1〜5ng/mlのVEGF165の添加は、増殖率における5.5倍増、2.5ng/mlでのピークを生じた(図6)。15μg/mlのGST−Ex 7+8をVEGF165にさらに添加した場合、HUVEC増殖は約60%減少した。同様の様式により調製されたGSTタンパク質は、25μg/mlでさえも、HUVEC増殖を阻害せず、この阻害効果が単に融合タンパク質内のエキソン7+8コードドメインの存在に起因することを示した。エキソン7+8ペプチドに媒介されるHUVEC上のVEGFレセプターへのVEGF165の結合の阻害は、HUVEC増殖阻害と相関すると結論付けられた。
【0078】
(GST−Ex 7+8はVEGF121誘導のHUVEC増殖を阻害する) GST−Ex 7+8は、VEGF165誘導の分裂促進性のレベルを、約2倍から、VEGF121誘導の分裂促進性のおよそのレベルにまで阻害する(図7)。15μg/mlでGST−Ex 7+8はまた、VEGF121媒介のHUVEC増殖を約2倍阻害した。VEGF121はエキソン7を含まないことを考慮すると、これは予想外の結果であった。VEGF121阻害の性質をより理解するために、VEGFレセプターへの125I−VEGF121の結合におけるGST−EX 7+8の効果を架橋研究により分析した。HUVECへの125I−VEGF121の架橋は、240−kDaの標識複合体(図8、レーン1)(これはVEGF121およびKDR/Flk−1を含むことが示されている)の形成を生じた(Sokerら、J.Biol.Chem.、271、5761−5767(1996)、Gitay−Gorenら、J.Biol.Chem.、271、5519−5523(1996))これらの複合体の形成は、15μg/mlのGST−Ex 7+8により有意に阻害された(図8、レーン2)。GST−Ex 7+8は、おそらくそのKDR/Flk−1への結合を阻害することにより、VEGF121誘導の分裂促進性を阻害すると結論付けられた。
【0079】
(考察)
最も大量にあるVEGFアイソフォームは、VEGF165およびVEGF121である。VEGF生物学の理解の点からの重要な疑問は、これらのアイソフォームが生化学特性および生物学的特性において異なるか否かということである。現在までに、VEGF121ではなくVEGF165は、細胞表面HSPGに結合すること(Houckら、Mol.Endocrinol.、8、1806−1814(1991)、Houckら、J.Biol.Chem.、247、28031−28037(1992)、Parkら、Mol.Biol.Cell、4、1317−1326(1993))およびVEGF165はVEGF121よりもより強力なEC分裂促進剤であること(Smithら、Gene(Amst.)、87、31−49(1988))が証明されている(図2)。さらに、本発明者らは最近、VEGF121ではなくVEGF165に結合するという点で特異的な、HUVEC、および腫瘍細胞の表面上で見出された新規の130−kDaのVEGFレセプターを特徴付けた(Sokerら、J.Biol.Chem.、271、5761−5767(1996))。VEGF165はこのレセプター(VEGF165Rと呼ばれる)に、エキソン7によりコードされる44のアミノ酸を介して結合する。このエキソンはVEGF165に存在するがVEGF121には存在しない。対照的に、KDR/Flk−1およびFlt−1は、VEGF165およびVEGF121の両方に結合し、そしてそれぞれVEGFエキソン4および3を介して結合する(Keytら、J.Biol.Chem.、271、5638−5646(1996))。本発明の研究における、本発明者らの目標は、エキソン7がVEGF165活性、特にHUVECについての分裂促進活性を調節するか否か、およびいかなる機構によって調節されるかを決定することであった。そのため、本発明者らはエキソン7コードドメインを含むGST融合タンパク質を使用してVEGF165RへのVEGF165の結合を阻害し、そしてHUVEC増殖において引き続く効果を調べる戦略を進展させた。架橋実験は、予想通り、エキソン7融合タンパク質がKDR/Flk−1ではなくVEGF165Rに結合し得ることを立証した。エキソン7融合タンパク質は125I−VEGF165の、231細胞(これは、VEGF165Rを単独で発現する)への結合を98%、およびHUVEC(これは、KDR/Flk−1およびVEGF165Rの両方を発現する)への結合を85〜95%阻害する強力なインヒビターであることが見出された。しかしエキソン7融合タンパク質は、KDR/Flk−1を発現するがVEGF165Rは発現しないPAE−KDR細胞への125I−VEGF165の全ての結合を阻害はしなかった。GSTタンパク質単独では、いずれの細胞型への結合も阻害しなかった。このことは、この阻害が単に融合タンパク質のエキソン7部分に起因したことを立証する。特定の125I−VEGF165レセプター複合体の形成を立証した架橋分析は、GST−Ex 7+8がHUVECおよび231細胞上のVEGF165Rへの125I−VEGF165の結合を著しく阻害したことを確認した。総合すると、これらの結果は、エキソン7融合タンパク質がVEGF165Rと直接的に相互作用し、そしてこのレセプターへの125I−VEGF165の結合の競合インヒビターとして作用し得ることを示す。
【0080】
GST−Ex 7+8融合タンパク質はVEGF165誘導のHUVEC増殖を約60%、VEGF121により誘導されるのに等価なレベルにまで阻害し、このことは、KDR/Flk−1チロシンキナーゼレセプターの活性が、どうやら反対方向に影響されることを示唆する。確かに、架橋分析は、GST−Ex 7+8融合タンパク質は、VEGF165Rへの125I−VEGF165の架橋を阻害するのみでなく、KDR/Flk−1への架橋もまた阻害することを示した。本発明者らの架橋研究は、VEGF165はそのエキソン4コードドメインを介してKDR/Flk−1と相互作用するという以前の証明(Keytら、J.Biol.Chem.、271、5519−5523(1996))に一致して、エキソン7融合タンパク質が直接的にはKDR/Flk−1に結合しないことを示したため、この結果は予想外であった。従って、エキソン7コードドメインを介したVEGF165Rへの125I−VEGF165の結合は、KDR/Flk−1と増殖因子の間接的な相互作用を調節するように思われる。HUVEC増殖におけるGST−Ex 7+8のこの阻害効果についての可能なメカニズムは、KDR/Flk−1およびVEGF165Rが細胞表面上できわめて近接して同時に局在化するということである。このモデルにおいて、VEGF165ダイマーは、エキソン4ドメインを介してKDR/Flk−1と、およびエキソン7ドメインを介してVEGF165Rと同時に相互作用し、3つの成分の複合体を産生する。GST−Ex 7+8融合タンパク質はVEGF165RへのVEGF165の結合と直接的に競合することにより、シグナリングレセプターKDR/Flk−1へ結合するVEGF165の能力を間接的に損なう。従って、KDR/Flk−1へのVEGF165の効率的な結合は、VEGF165Rとの首尾よい相互作用に部分的に依存し得る。他の代替的な可能性は、エキソン7コードドメインがヘパリン結合ドメインを含むこと(Sokerら、J.Biol.Chem.、271、5761−5767(1996))および過剰なGST−Ex 7+8が、VEGF165のそのレセプターへの効率的な結合に必要とされる、VEGF165の細胞表面HSPGへの結合を阻止すること(Gitay−Gorenら、J.Biol.Chem.、287、6003−6096(1992))である。
【0081】
驚くべきことに、VEGF121はVEGF165Rに結合しないにもかかわらず、GST−Ex 7+8はHUVECに対するVEGF121の分裂促進活性もまた、約50%阻害した(Sokerら、J.Biol.Chem.、271、5761−5767(1996))。可能な説明は、VEGF165RおよびKDR/Flk−1が細胞表面上で近接していること、ならびにVEGF165Rに結合する過剰なGST−Ex 7+8が、KDR/Flk−1へのVEGF121の接近を立体的に阻害することである。架橋分析は、実際、直接的にはKDR/Flk−1に結合しないGST−Ex 7+8の存在下で、KDR/Flk−1への125I−VEGF121の減少した結合を示した。これは、KDR/Flk−1へのVEGF121の結合における融合タンパク質の間接的効果を示唆する。
【0082】
GST−Ex 7+8はまた、231乳癌細胞(これは、KDR/Flk−1ではなくVEGF165Rを発現する)へのVEGF165の結合を阻害する。
【0083】
HUVEC上のより高親和性のレセプターおよびより低親和性のレセプター(それぞれ、KDR/Flk−1およびVEGF165R)への対等なVEGF165の結合(Sokerら、J.Biol.Chem.、271、5761−5767(1996))ならびにこれらの2つのレセプターへのVEGF165の結合におけるGST−Ex 7+8融合タンパク質の阻害効果は、VEGF165活性を媒介する際に作用する両特異性レセプター(dual receptor)系が存在することを示唆する。いくつかの他の増殖因子が、高親和性レセプターおよび低親和性レセプターに結合することが示されている。形質転換増殖因子−βは3つのレセプターを有する複合体を産生する;そのうちの2つ(レセプターIおよびII)はシグナリングレセプターであり、一方、形質転換増殖因子−βレセプターIII/βグリカンはより低親和性の付属結合分子(accessory binding molecule)である(Lopez−Casillasら、Cell、47、785−796(1991))。神経因子ファミリーについての低親和性レセプター、p75は、シグナリングTRKレセプターを有する複合体の一部である(Barbacid,M、Curr.Opin.Cell Biol.、7、148−155(1995))。両特異性レセプター認識の異なるタイプは、細胞表面HSPGおよびそのシグナリングレセプターへのbFGFの結合である(Yayonら、Cell、64,841−848(1991)、Klagsbrunら、Cell、67、229−231(1991))。その低親和性レセプター(HSPGS)へのbFGFの結合は、HSPG結合bFGFがその高親和性のシグナリングレセプターに効率的に提示され得るように、bFGF内のコンフォメーション変化を誘導し得ることが示唆された(Yayonら、Cell、64,841−848(1991)、Klagsbrunら、Cell、67、229−231(1991))。従って、VEGF165RおよびKDR/Flk−1の両方へのVEGF165の結合は、一般的なメカニズム(ここで、2つの異なるタイプのレセプターは増殖因子活性を調節するために使用される)の一部であるように思われる。
【0084】
レセプター結合研究を、エキソン7によりコードされる44のアミノ酸内の阻害性コア(inhibitory core)を同定するために使用した。エキソン7のN末端残基およびC末端残基の両方において欠失を作製し、そしてその阻害活性はエキソン7のC末端部分の23アミノ酸(アミノ酸22−44)に局在化された。これらの23のアミノ酸のうち、5つはシステイン残基である。高い割合のシステイン残基は、このドメインが、VEGF165Rへの効率的な結合のために必要とされる規定された三次元構造を有することを示唆する。エキソン7ドメインの22位のシステイン残基は阻害性活性に重要なため、おそらく必要な三次元構造の維持のために重要である。VEGF165における異なる位置のシステイン残基の役割を調べた研究は、システイン146(エキソン7のコア阻害性ドメイン内に存在する(エキソン7中の31位))のセリン残基による置換が、VEGF165の浸透活性において60%の減少およびEC分裂促進性の全損失を生じたことを示した(Claffeyら、Biochim,Biophys.Acta.、1246、1−9(1995))。システイン146の変異は、VEGFの二量体化において全く効果を有しなかった(Claffeyら、Biochim,Biophys.Acta.、1246、1−9(1995))。従って、このシステイン残基は2つのVEGFモノマー間の分子間ジスルフィド(interdisulfide)結合の形成に関与するのではなく、むしろそのモノマー内の分子内ジスルフィド(intradisulfide)結合に関与し得るように思われる。これらの結果は、システイン残基により安定化される三次元構造がエキソン7のC末端の半分において存在し、それがVEGF165Rとの相互作用のようなVEGF165の生物学的活性に寄与するという、本発明者らの仮説を支持する。興味深いことに、エキソン7によりコードされるN末端21アミノ酸残基の欠失に対応する融合タンパク質は、インタクトなエキソン7コードペプチドよりもより強力なインヒビターであった。このN末端部分はVEGF165Rへの増強された結合を生じ、そしてVEGF165のより良好な競合者を産生することがあり得る。
【0085】
本明細書を通して引用された参考文献は、本明細書中で参考として援用される。
【0086】
本発明は、特定の実施態様への参照を伴って記載された。しかし、本願は、添付される特許請求の範囲の精神および範囲から逸脱することなく当業者によりなされ得るそれらの変更および置換を包含することが意図される。
【図面の簡単な説明】
【図1】 図1は、125I−VEGF165、125I−VEGF121、および125I−GST−EX7のHUVECに対する架橋を示す。125I−VEGF165(5ng/ml)(レーン1)または125I−VEGF121(10ng/ml)(レーン2)または125I−GST−EX7(50ng/ml)(レーン3)を、6−cmディッシュにおいてHUVECのサブコンフルエントな培養物に結合した。この結合は、1μg/mlのヘパリンの存在下で実施した。2時間のインキュベーションの最後に、各々の125I−VEGFアイソフォームを、細胞表面に化学的に架橋した。これらの細胞を溶解し、そしてタンパク質を6%SDS−PAGEによって分離した。このポリアクリルアミドゲルを乾燥し、そしてX線フィルムに曝露した。
【図2】 図2は、VEGF165およびVEGF121に対応するHUVEC増殖を示す。HUVECを、24時間、96−ウェルディッシュ(5,000細胞/ウェル)に培養した。VEGF165(黒丸)またはVEGF121(白丸)の増加する量を、培養物に添加し、そしてこの細胞をさらに3日間インキュベートした。HUVEC DNA内の[3H]チミジンの取り込みに基づくDNA合成を、実施例に記載されるように測定した。これらの結果を3つのウェルにおける平均数で表し、そしてこの標準偏差を決定した。
【図3A】 図3Aは、HUVEC細胞に結合する125I−VEGF165のGST−EX7+8による
阻害を示す。125I−VEGF165(5ng/ml)を、GST−EX7+8(黒四角)またはコントロールGSTタンパク質(白四角)の増加する量の存在下で、48−ウェルディッシュにおいてHUVEC(3A)のサブコンフルエントな培養物に結合させた。2時間のインキュベーションの最後に、これらの細胞を洗浄し、そして溶解し、そして細胞に関連する放射能をγ−計数管で決定した。得られた数をGSTまたは融合タンパク質を付加することなしにPBSの存在下で得られる数の百分率として表す。
【図3B】 図3Bは、MDA−MB−231細胞に結合する125I−VEGF165のGST−EX7+8による阻害を示す。125I−VEGF165(5ng/ml)を、GST−EX7+8(黒四角)またはコントロールGSTタンパク質(白四角)の増加する量の存在下で、48−ウェルディッシュにおいてMDA−MB−231細胞(3B)のサブコンフルエントな培養物に結合させた。2時間のインキュベーションの最後に、これらの細胞を洗浄し、そして溶解し、そして細胞に関連する放射能をγ−計数管で決定した。得られた数をGSTまたは融合タンパク質を付加することなしにPBSの存在下で得られる数の百分率として表す。
【図3C】 図3Cは、PAE−KDR細胞に結合する125I−VEGF165のGST−EX7+8による阻害を示す。125I−VEGF165(5ng/ml)を、GST−EX7+8(黒四角)またはコントロールGSTタンパク質(白四角)の増加する量の存在下で、48−ウェルディッシュにおいてPAE−KDR細胞(3C)のサブコンフルエントな培養物に結合させた。2時間のインキュベーションの最後に、これらの細胞を洗浄し、そして溶解し、そして細胞に関連する放射能をγ−計数管で決定した。得られた数をGSTまたは融合タンパク質を付加することなしにPBSの存在下で得られる数の百分率として表す。
【図4】 図4は、GST−EX7+8融合タンパク質が、125I−VEGF165の、VEGF165Rに対する架橋およびKDR/F1K−1に対する架橋を阻害することを示す。125I−VEGF165(5ng/ml)を、6−cmディッシュにおいてHUVEC(レーン1および2)およびMDA−MB−231細胞(レーン3および4)のサブコンフルエントな培養物に結合した。この結合を、15μg/ml GST−Ex7+8の存在下(レーン2および4)または非存在下(レーン1および3)で実施した。ヘパリン(1μg/ml)を各々のディッシュに添加した。2時間のインキュベートの最後に、125I−VEGF165を細胞表面に化学的に架橋した。これらの細胞を溶解し、そしてタンパク質を6%SDS−PAGEによって分離した。このゲルを乾燥し、そしてX線フィルムに曝露した。
【図5A】 図5Aおよび5Bは、エキソン7内のコア阻害性領域の局在性を示す。N末端およびC末端で全長エキソン7にコードされるドメインまたは切断を含むGST−Ex7融合タンパク質を、実施例に記載されるように調製した。125I−VEGF165(5ng/ml)を、図3に記載されるように、GST融合タンパク質の増加する濃度の存在下でサブコンフルエントなHUVEC培養物に結合した。2時間のインキュベーションの最後に、この細胞を洗浄し、そして溶解し、そして細胞に関連する放射能をγ−計数管で決定した。得られた数を融合タンパク質B(VEGFエキソン7誘導体のアミノ酸配列)なしにPBSの存在下で得られる数の百分率として表す。これらの誘導体を、これらのC末端においてエキソン8の第一のシステイン残基を含むように調製し、偶数個のシステイン残基を保持させた。
【図5B】 図5Aおよび5Bは、エキソン7内のコア阻害性領域の局在性を示す。N末端およびC末端で全長エキソン7にコードされるドメインまたは切断を含むGST−Ex7融合タンパク質を、実施例に記載されるように調製した。125I−VEGF165(5ng/ml)を、図3に記載されるように、GST融合タンパク質の増加する濃度の存在下でサブコンフルエントなHUVEC培養物に結合した。2時間のインキュベーションの最後に、この細胞を洗浄し、そして溶解し、そして細胞に関連する放射能をγ−計数管で決定した。得られた数を融合タンパク質B(VEGFエキソン7誘導体のアミノ酸配列)なしにPBSの存在下で得られる数の百分率として表す。これらの誘導体を、これらのC末端においてエキソン8の第一のシステイン残基を含むように調製し、偶数個のシステイン残基を保持させた。
【図6】 図6は、GST−Ex7+8融合タンパク質が、VEGF165に刺激されるHUVEC増殖を阻害することを示す。HUVECを、図2に記載されるように96−ウェルディッシュ(5,000細胞/ウェル)において培養した。VEGF165(白丸)の増加する濃度を、15μg/mlのGST−Ex7+8(黒丸)または25μg/mlのGST(四角)と共に培養物に添加し、そしてこれらの細胞をさらに4日間インキュベートした。DNA合成を、図2に記載されるようにHUVECにおいて測定した。これらの結果は3つのウェルにおける平均数を表し、そしてこの標準偏差を決定した。
【図7】 図7は、GST−Ex7+8融合タンパク質が、VEGF165およびVEGF121に刺激されるHUVEC増殖を阻害することを示す。VEGF165(丸)またはVEGF121(四角)の増加する濃度を、15μg/ml GST−Ex7+8とともに(黒)またはGST−Ex7+8なしで(白)、HUVECに添加し、そしてDNA内への[*H]チミジンの取り込みを図2に記載されるように測定した。これらの結果は3つのウェルにおける平均数を表し、そしてこの標準偏差を決定した。
【図8】 図8は、GST−Ex7+8融合タンパク質が、HUVECのKDR/F1k−1に対する125I−VEGF121の架橋を阻害することを示す。125I−VEGF121(20ng/ml)を、6−cmディッシュにおいてHUVECのサブコンフルエントな培養物に結合した。この結合を、15μg/ml GST−Ex7+8の存在下(レーン2)または非存在下(レーン1)で実施した。ヘパリン(1μg/ml)を各々のディッシュに添加した。2時間のインキュベーションの最後に、125I−VEGFを、細胞表面に化学的に架橋した。これらの細胞を溶解し、そしてタンパク質を、6%SDS−PAGEによって分離した。このゲルを乾燥し、そしてX線フィルムに曝露した。
【配列表】
[0001]
(Statement on federal research)
The invention described herein is supported in part by the National Institute of Health grants CA37392 and CA45548. The US government has certain rights to the invention.
[0002]
(Field of Invention)
The present invention relates to vascular endothelial growth factor (VEGF). More particularly, the invention relates to antagonists of VEGF and the use of those antagonists in the treatment of disorders associated with VEGF.
[0003]
(Background of the Invention)
Blood vessels are the means by which oxygen and nutrients are supplied to living tissue and waste is removed from living tissue. Angiogenesis refers to the process by which new blood vessels are formed. See, eg, Folkman and Shing, J. Biol. Chem. 267, 10931-10934 (1992), Dvorak et al. Exp. Med. 174, 1275-1278 (1991). Thus, where appropriate, angiogenesis is an important biological process. This is important in reproduction, development and wound repair. However, inappropriate angiogenesis can have severe negative consequences. For example, it is only after many solid tumors are vascularized as a result of angiogenesis that they have a sufficient supply of oxygen and nutrients that allow the tumor to grow and metastasize rapidly. Maintaining the rate of angiogenesis at the right balance is critical to the range of functions and should be carefully adjusted to maintain health. This angiogenesis process involves degradation of the basement membrane by proteases secreted from endothelial cells (EC) activated by mitogenic factors such as vascular endothelial growth factor (VEGF) and basic fibroblast growth factor (bFGF). It is thought to start from. This cell migrates and proliferates and induces the formation of solid endothelial cell sprouting into the interstitial space, then vascular loops are formed and capillaries develop, with tight binding and deposition of new basement membranes With formation.
[0004]
In adults, the proliferation rate of endothelial cells is typically slow compared to other cell types in the body. The rotation time of these cells can exceed 1000 days. Physiological exceptions where angiogenesis results in rapid growth typically occur under close regulation as seen in the female reproductive system and wound healing processes.
[0005]
The rate of angiogenesis is responsible for the change in local equilibrium between the positive and negative regulators of microvascular growth. The therapeutic intent of angiogenic growth factors was first described by Folkman and coworkers over 20 years ago (Folkman, N. Engl. J. Med., 285: 1182-1186 (1971)). If the body loses at least some of the control of angiogenesis, abnormal angiogenesis occurs, which results in either excessive or insufficient blood vessel growth. For example, conditions such as ulcers, strokes, and heart attacks can be attributed to the lack of angiogenesis normally required for natural healing. In contrast, excessive vascular growth can result in tumor growth, tumor spread, blindness, psoriasis and rheumatoid arthritis.
[0006]
Thus, a greater degree of angiogenesis may be desired (increased blood circulation, wound healing, and ulcer healing). For example, current investigators have shown that the fibroblast growth factor (FGF) family (Yanagisawa-Miwa et al., Science, 257: 1401-1403 (1992) and Baffour et al., J Vasc Surg, 16; 181-191 (1992) ), Endothelial growth factor (ECGF) (Pu et al., J Surg Res, 54: 575-583 (1993)), and more recently, promoting collateral arterial development in animal models of myocardial and hindlimb ischemia and / or Recombinant angiogenic growth such as enhancing vascular endothelial growth factor (VEGF) (Takeshita et al., Circulation, 90: 228-234 (1994) and Takeshita et al., J. Clin Invest, 93: 662-670 (1994)). Use of factors We have demonstrated the potential.
[0007]
Conversely, inhibition of angiogenesis may be desired. For example, many diseases are progressed by permanent unregulated angiogenesis (sometimes referred to as “neovascularization”). In arthritis, new capillaries invade joints and destroy cartilage. In diabetes, new capillaries invade the vitreous, bleed, and cause blindness. Ocular neovascularization is the most common cause of blindness. Tumor growth and metastasis are angiogenesis-dependent. The tumor should continuously stimulate the growth of new capillaries in order to grow the tumor itself.
[0008]
There is growing evidence that VEGF can be a major regulator of angiogenesis (Ferrara et al., Endocr. Rev., 13, 18-32 (1992); Klagsbrun et al., Curr. Biol., 3, 699-702). (1993); reviewed in Klagsbrun et al., Ferrara et al., Biochem. Biophys. Res. Commun., 161, 851-858 (1989)). VEGF is first derived from conditioned medium of follicular stellate cells (Ferrara et al., Biochem. Biopsi. Res. Commun., 161, 851-858 (1989)) and from various tumor cell lines (Myoken et al. Proc. Natl. Acad. Sci. USA, 88: 5819-5823 (1991); Plouet et al., EMBO. J. 8: 3801-3806 (1991)) VEGF is a vascular permeability factor, ie at the same time. It was found to be identical to a blood permeability regulator purified from conditioned media of U937 cells (Keck et al., Science, 246: 1309-1312 (1989)). EC) is a specific mitogen And is a potent angiogenic factor in vivo: VEGF expression is upregulated in embryogenic and subangiogenic tissues during the female reproductive cycle (Brier et al., Development, 114: 521-532 (1992)). Shweiki et al., J. Clin. Invest., 91: 2235-2243 (1993)) High levels of VEGF are expressed in various types of tumors in response to tumor-induced hypoxia, but normal (Shweiki et al., Nature 359: 843-846 (1992); Dvorak et al., J. Exp. Med., 174: 1275-1278 (1991); Plate et al., Cancer Res., 53: 5822-). 5827; Ikea et al., J. Biol. , 270: 19761-19766 (1986)) Treatment of tumors with monoclonal antibodies to VEGF resulted in a dramatic reduction in tumor burden due to suppression of tumor angiogenesis (Kim et al., Nature, 382: 841). 844 (1993)) VEGF appears to play a major role in many pathological conditions and processes associated with neovascularization, and thus modulation of VEGF expression in affected tissues is induced by VEGF. It can be important in the treatment or prevention of neovascularization / angiogenesis.
[0009]
VEGF is a 40-45K secreted homodimer (Tischer E, et al., J. Biol. Chem. 266: 11947-11954 (1991), which is a placenta-derived growth factor (PIGF), VEGF-B, VEGF-C. , Members of an extended family including VEGF-D and VEGF-E (Olofsson et al., Proc. Natl. Acad. Sci. USA 93: 2576-2581 (1996), Jukov et al., EMBO J. 15: 290-298 ( 1996), Achen et al., Proc. Natl. Acad. Sci. USA 95: 548-553 (1998), Ogawa et al., J. Biol. Chem. 273: 31273-3182 (1998)) VEGF contains 8 exons. From a single gene containing It exists in a number of different isoforms produced by alternative splicing (Ferrara et al., Endocr. Rev. 13: 18-32 (1992); Tischer et al., J. Biol. Chem., 806: 11947-11945 (1991) Ferrara et al., Trends Cardio Med., 3: 244-250 (1993); Polterak et al., J. Biol. Chem. 272: 7151-7158 (1997)), each human VEGF isoform produces an active homodimer. Obtained, consisting of monomers of 121, 145, 165, 189 and 206 amino acids (Polterak et al., J. Biol. Chem, 272: 7151-7158 (1997); Hook et al., Mol. Endocri ol, 8:.. 1806~1814 (1991)) This VEGF121 And VEGF165 Isoforms are the most abundant. VEGF121 Is the only VEGF isoform that does not bind to heparin and is all secreted into the culture medium. VEGF165 VEGF in that it binds to heparin and cell surface heparin sulfate proteoglycan (HSPG).121 And is only partially released into the culture medium (Houck et al., J. Biol. Chem. 247: 28031-28037 (1992); Park et al., Mol. Biol. Chem., 4: 1317- 1326 (1993)). The remaining isoforms are fully associated with the cell surface and extracellular matrix HSPG (Houck et al., J. Biol. Chem. 247: 28031-28037 (1992); Park et al., Mol. Biol. Chem., 4 : 1317-1326 (1993)).
[0010]
The VEGF receptor tyrosine kinases KDR / Flk-1 and / or Flt-1 are almost expressed by EC (Terman et al., Biochem. Biophys. Res. Commun., 187: 1579-1586 (1992); Shibuya et al., Oncogene, 5: 519-524 (1990); De Vries et al., Science, 265: 989-991 (1992); Gitay-Goran et al., J. Biol. Chem., 287: 6003-6096 (1992); Jakeman et al., J. Clin. Invest., 89: 244-253 (1992)). Even though both receptors undergo phosphorylation upon VEGF binding, VEGF activity (eg, induction of mitogenic, chemotaxis, and morphological changes) is not Klt / Flk but Flt-1. -1 (Millauer et al., Cell, 72: 835- 846 (1993); Waltenberger et al., J. Biol. Chem., 269: 26988-26995 (1994); Seetharam et al., Oncogene, 10: 135-147 (1995); Yoshida et al., Growth Factors, 7: 131-138 (1996)). Recently, Soker et al. Identified a new VEGF receptor expressed on EC and various tumor-derived cell lines (eg, breast cancer-derived MDA-MB-231 (231) cells) (Soker et al., J. Biol. Chem. 271: 5761-5767 (1996) This receptor requires a VEGF isoform to contain the portion encoded by the seventh exon.121 And VEGF165 Both R bind to KDR / Flk-1 and Flt-1, but VEGF165 Only binds to new receptors. This is therefore an isoform-specific receptor and VEGF165 Receptor (VEGF165 R). This also binds to the 189 and 206 isoforms. VEGF in structure function analysis165 Is VEGF121 Through the seventh exon coding domain that is not present in165 It was shown directly to R (Soker et al., J. Biol. Chem., 271: 5761-5767 (1996)). However, the function of this receptor was not clear.
[0011]
Current treatment of angiogenic diseases is not sufficient. Agents that prevent persistent angiogenesis, such as drugs (TNP-470), monoclonal antibodies, antisense nucleic acids and proteins (angiostatin and endostatin) are currently in trials. See J. Mol. Med. 73, 333-346 (1995); Hanahan et al., Cell, 86.353-364 (1996); Folkman, N. Engl. J. Med., 333, 1757-1763 (1995). Although previous results with anti-angiogenic proteins are encouraging, their size is relatively large and therefore difficult to use and produce.In addition, proteins are subject to enzymatic degradation. Therefore, new drugs that inhibit angiogenesis Is a principal. Size, ease of fabrication, the new angiogenic proteins or peptides that exhibit improvement in stability and / or potency is desired.
[0012]
(Summary of the Invention)
We have VEGF165 Was found to act as an antagonist to all VEGF isoforms. This is surprising because not all VEGF forms have a seventh exon. For example, we have a glutathione S-transferase (GST) fusion protein comprising a peptide corresponding to 44 amino acids encoded by the seventh exon, and a peptide encoded by the eighth exon (VEGF165 The first cysteine of amino acids 116 to 160 (SEQ ID NO: 1) was prepared. This fusion protein is directed to human umbilical vein derived EC (HUVEC) and receptors on 231 cells.125 I-VEGF165 Binding was inhibited. This inhibitory activity was localized in the C-terminal part of the seventh exon coding domain (amino acids 22-44). Furthermore, this fusion protein inhibited VEGF-induced proliferation of HUVEC. This fusion protein is also VEGF121 Inhibits mitogenicity, which is VEGF121 Was unexpected, considering that does not contain the seventh exon. Thus, the polypeptides of the present invention are antagonists to the major isoforms of VEGF and can be used to treat diseases and conditions associated with VEGF-induced neovascularization or angiogenesis.
[0013]
Furthermore, without wishing to be bound by theory, VEGF is165 It is directly associated with many cancers expressing R / NP-1 (Soker et al., Cell 92, 735-745 (1998)) and inhibition of VEGF binding to this receptor can be used to treat such cancers. it is conceivable that.
[0014]
The invention can be used, for example, as described in the examples below.165 A polypeptide having a portion of SEQ ID NO: 1 with VEGF antagonist activity is provided, as determined by a human umbilical vein endothelial cell (HUVEC) proliferation assay using Preferably, this portion has at least a 25% reduction in HUVEC proliferation, more preferably a 50% reduction, even more preferably a 75% reduction, most preferably a 95% reduction. Preferably, this portion has even many cysteine residues.
[0015]
VEGF antagonist activity is also described by Soker et al. Biol. Chem. 271, 5761-5767 (1996) and as shown in the examples below, VEGF165 Labeled VEGF for R165 Can be determined by inhibition of binding. Preferably, this portion inhibits binding by at least 25%, more preferably 50%, most preferably 75%.
[0016]
The invention further includes VEGF as described, for example, in the Examples below.165 A polypeptide comprising SEQ ID NO: 2 (CSCKNTDSRCKARQLELNERTCRC) having VEGF antagonist activity, or a portion thereof, is provided as determined by a human umbilical vein endothelial cell (HUVEC) proliferation assay using Preferably, this portion has at least a 25% reduction, more preferably a 50% reduction, even more preferably a 75% reduction, most preferably a 95% reduction in HUVEC proliferation. Preferably, this portion has even many cysteine residues.
[0017]
One preferred polypeptide of the present invention has the following structure of formula (I):
(X1 -(CSCKNTDSRCKARQLELNERT (SEQ ID NO: 3))-X2 ) I:
Where X1 Is H or any part of
[0018]
An “analog” is a polypeptide that differs from the sequence of one of the peptides of the invention, but VEGF as described in the Examples below.165 In a human umbilical vein endothelial cell (HUVEC) proliferation assay using a polypeptide that still exhibits at least 50% VEGF antagonist activity of the polypeptide of SEQ ID NO: 2. Preferably, the analog exhibits 75%, most preferably 95% of the VEGF antagonist activity of the polypeptide of SEQ ID NO: 2. The difference is preferably a conservative amino acid substitution, where an amino acid is replaced with another naturally occurring amino acid of similar characteristics. For example, the following substitutions are considered “conservative”: Gly ← → Ala; Val ← → Ile; Asp ← → Glu; Lys ← → Arg; Asn ← → Gln; and Phe ← → Trp ← → Tyr. A non-conservative change is typically a substitution of one of the above amino acids with an amino acid from a different group (eg, replacing Glu with Asn) or replacing any of the amino acids with Cys, Met, His or Pro. is there.
[0019]
In a preferred form, the polypeptides of the present invention are part of a fusion protein or linked to a moiety that increases purity, increases stability, and / or provides biological activity.
[0020]
In another embodiment, the polypeptide of the present invention (either alone or as part of a fusion protein) is VEGF.165 Used for target cells that express R / NP-1. This targeting can be used for diagnostics and for therapeutic applications. For example, for diagnostic purposes, the polypeptide is radiolabeled and VEGF165 Used to detect cells that express R / NP-1. The inventors have discovered that the expression of this receptor is highly correlated with disease status in many cancers such as prostate and breast cancer, particularly metastatic cancer. Thus, in a further embodiment, the polypeptide can be used in a prognostic manner for a particular cancer.
[0021]
For therapeutic applications, the polypeptide is VEGF.165 It can be used to deliver drugs to cells that express R / NP-1. For example, the polypeptide can be used as a carrier to deliver a desired chemical or cytotoxic moiety to a cell. The cytotoxic moiety is a cytotoxic drug or enzymatically active toxin of bacterial, fungal or plant origin, or an enzymatically active polypeptide chain or fragment (“A chain”) of such toxin. obtain. Enzymatically active toxins and fragments thereof are preferred, and diphtheria toxin A fragment, non-binding active fragment of diphtheria toxin, exotoxin A (from Pseudomonas aeruginosa), A-rich chain, abrin A chain, modeccin A Chain, alphasarcin, certain Aleurites fordii protein, certain Dianthin protein, Phytolacca americana protein (PAP, PAPII and PAP-S), Modica charatia inhibitor, calcin, curtin, crotin (crotin inhibitor, crotin (crotin inhibitor) , Gelonin, mitogelin ( itogellin), restrictocin (restrictocin), phenol mycin (phenomycin), and is exemplified by Enomaishin (enomycin). Ricin A chain, Pseudomonas aeruginosa exotoxin A and PAP are preferred.
[0022]
The invention further provides methods of treating diseases or disorders / conditions associated with VEGF-induced neovascularization or angiogenesis. As used herein, the term “neovascularization” refers to the growth of blood vessels and capillaries. Diseases, disorders or conditions associated with VEGF-induced neovascularization or angiogenesis include retinal neovascularization, hemagoma, solid cancer growth, leukemia, metastasis, psoriasis, neovascular glaucoma, diabetic retina Disease, rheumatoid arthritis, osteoarthritis, endometriosis, muscle degeneration, and retinopathy of prematurity (ROP).
[0023]
In the methods of the invention, the therapeutic amount of the polypeptide of the invention has a disease or condition associated with VEGF, or VEGF.165 It is administered to a host (eg, a human or other mammal) having a tumor that expresses R / NP-1. VEGF165 A method for detecting the expression of R / NP-1 is described in Soker et al., Cell 92: 735-745 (1998).
[0024]
The invention also provides a composition comprising an effective amount of a polypeptide of the invention in combination with a pharmaceutically acceptable carrier.
[0025]
Other aspects of the invention are disclosed below.
[0026]
(Detailed description of the invention)
The present invention relates to isolated polypeptides having VEGF antagonist activity, nucleic acids encoding the peptides, pharmaceutical compositions comprising the polypeptides and nucleic acids, and diseases and disorders associated with VEGF (eg, induce angiogenesis). VEGF165 A method for treating R / NP-1 and VEGF expressing tumors) is provided. The polypeptide of the present invention includes the above-mentioned polypeptide containing a part of SEQ ID NO: 1 having VEGF antagonist activity, polypeptide containing SEQ ID NO: 2 (CSCKNTDSRCKARQLELNERTCRC) having VEGF antagonist activity, and a part thereof, and a formula A polypeptide having the structure (I) is included. The invention further includes analogs and derivatives of these polypeptides having VEGF antagonist activity. The DNA
[0027]
VEGF antagonist activity can be determined using techniques known in the art. For example, VEGF antagonist activity can be determined by examining wild type VEGF activity and comparing inhibition or reduction of such activity, if an antagonist polypeptide is used. The polypeptide of SEQ ID NO: 2 can be used as a reference. Any VEGF activity can be used. For example, as described in the Examples below, VEGF165 A human umbilical cord blood vascular endothelial cell (HUVEC) proliferation assay can be used. Preferably, this portion has at least a 25% reduction in HUVEC proliferation, more preferably a 50% reduction, even more preferably a 75% reduction, most preferably a 95% reduction. Preferably, this part has an even number of cysteine residues.
[0028]
VEGF antagonist activity is also described by Soker et al. Biol. Chem. 271, 5761-5767 (1996) and labeled VEGF as described in the Examples below.165 VEGF165 It can be determined by inhibition of binding to R. Preferably, this portion inhibits binding by at least 25%, more preferably 50%, most preferably 75%.
[0029]
The ability of a VEGF antagonist polypeptide to affect angiogenesis can also be determined using a number of known in vivo and in vitro assays. Such assays are disclosed in Jain et al.,
[0030]
As used herein, a “derivative” of a VEGF antagonist polypeptide is a polypeptide that has altered one or more physical, chemical, or biological properties. Such alterations are present in the polypeptide as follows: amino acid substitutions, modifications, additions or deletions; changes in lipidation, glycosylation or phosphorylation patterns; other organic and non-organic molecules Reaction of amino acid residues with free amino, carboxyl, or hydroxyl side chains; and other modifications, any of which can result in changes in primary, secondary, or tertiary structure Including but not limited to. In addition, such derivatives exhibit at least one of the VEGF antagonist activities described above.
[0031]
The polypeptides of the present invention are preferably produced by recombinant methods. See the procedure disclosed in Example 1 below. A wide variety of molecular and biochemical methods are available for producing and expressing the polypeptides of the invention. For example, Molecular Cloning, A Laboratory Manual (2nd edition, Sambrook, Fritsch and Maniatis, Cold Spring Harbor, Fehr, Ren, S., B., and A.), Current Protocols in Molecular Biology, Au. , Wiley-Interscience, NY, NY 1992) or other procedures otherwise known in the art. For example, the polypeptides of the invention can be synthesized by chemical synthesis, E. coli. It can be obtained by expression in bacteria such as Coli and eukaryotic organisms such as yeast, expression systems based on baculovirus or mammalian cells, etc., depending on the size, nature and quantity of the polypeptide.
[0032]
The term “isolated” means that the polypeptide is removed from its original environment (eg, a native VEGF molecule). For example, a naturally occurring polynucleotide or polypeptide is present in a living animal that is not isolated, but is the same polynucleotide that has been separated from some or all coexisting material in a natural system. The nucleotide or DNA or polypeptide has been isolated. Such a polynucleotide can be part of a vector, and / or such a polynucleotide or polypeptide can be part of a composition, and further such a vector or composition can be its natural form. Isolated so that it is not part of the environment.
[0033]
If it is desired to express a polypeptide of the invention, any suitable system can be used. The general nature of suitable vectors, expression vectors and constructs thereto will be apparent to those skilled in the art.
[0034]
Suitable expression vectors can be based on phage or plasmids, which can often be designed for other hosts, but both are generally host specific. Other suitable vectors include cosmids and retroviruses, as well as any other virus, which may or may not be specific for a given system. Control sequences (eg, recognition sequences, promoter sequences, operator sequences, inducer sequences, terminator sequences and other sequences essential and / or useful for regulating expression) will be readily apparent to those skilled in the art.
[0035]
Appropriate preparation of the nucleotide sequence can be confirmed, for example, by the method of Sanger et al. (Proc. Natl. Acad. Sci. USA 74: 5463-7 (1977)).
[0036]
A DNA fragment encoding the polypeptide of the present invention, a receptor or a fragment thereof can be easily inserted into an appropriate vector. Ideally, the acceptor vector can induce uncertainty across the reading frame and the position of the insertion, but has appropriate restriction sites for ease of insertion, e.g., blunt end ligation that can be used. Absent. In such instances, it is natural to test the transformant for expression, 1 in 6 should have the appropriate reading frame. It will be appreciated that suitable vectors can be selected by those skilled in the art according to the desired expression system.
[0037]
By selecting a suitable organism or, preferably, a transformant with ampicillin, transforming a eukaryotic cell line (eg, HeLa) with the resulting plasmid, or, if necessary, other suitable means, and If desired, the desired polypeptide or protein can be expressed by adding tryptophan or other suitable promoter inducer (eg, indoleacrylic acid). The extent of expression can be analyzed by SDS polyacrylamide gel electrophoresis-SDS-PAGE (Lemelli, Nature 227: 680-685 (1970)).
[0038]
Appropriate methods for growing and transforming cultures and the like are typically illustrated, for example, in Maniatis (Molecular Cloning, A Laboratory Notebook, Maniatis et al. (Ed.), Cold Spring Harbor Labs, NY (1989)). .
[0039]
Useful cultures for the production of polypeptides or proteins can suitably be any living cell culture and can vary from prokaryotic expression systems to eukaryotic expression systems. One preferred prokaryotic system is E. coli due to its ease of operation. The system of Coli. However, it is also possible to use higher systems such as mammalian cell lines for the expression of eukaryotic proteins. Currently preferred cell lines for transient expression are the HeLa cell line and the Cos cell line. Other expression systems include the Chinese hamster ovary (CHO) cell line and the baculovirus system.
[0040]
Other expression systems that can be used include, for example, streptomycetes, and yeast (eg, Saccharomyces spp., Especially S. cerevisiae). Any system can be used as desired and generally depends on what is required by the operator. Although the appropriate system can also be used to amplify the genetic material, but generally only DNA growth is required, E. coli can be used for this purpose. It is convenient to use E. coli.
[0041]
These polypeptides and proteins can be isolated from fermentation or cell culture and purified using any of a variety of conventional methods including: liquid chromatography using HPLC, FPLC, etc. (eg, Normal phase or reverse phase); affinity chromatography (eg, using inorganic ligands or monoclonal antibodies); size exclusion chromatography; immobilized metal chelate chromatography; gel electrophoresis; One skilled in the art can select the most appropriate isolation and purification techniques without departing from the scope of the invention.
[0042]
These polypeptides can also be produced by any of a number of chemical techniques. For example, they are originally R.I. B. Merrifield, “Solid Phase Peptide Synthesis. I. The Synthesis Of A Tetrapeptide”, J. Am. Am. Chem. Soc. 83, pages 2149-54 (1963), or they can be prepared by synthesis in solution. An overview of peptide synthesis techniques is given in E. Gross and H.C. J. et al. Meinhofer, 4 The Peptides: Analysis, Synthesis, Biology; Modern Techniques of Peptide And Amino Acid Analysis, John Wiley and Sons, (1981). It can be found in Bodanssky, Principles of Peptide Synthesis, Springer-Verlag (1984).
[0043]
As discussed above, one method of treatment involves targeting the tumor area following adsorption of the appropriate toxin to the peptide. Such toxins are well known in the art and are toxic radioisotopes, heavy metals, enzymes and complement activators and natural toxins such as ricin that can act at the level of only one or two molecules per cell. Can be included. It may also be possible to use such techniques to deliver localized doses of suitable pharmaceutically active compounds that may be used, for example, to treat cancer.
[0044]
If the present invention is provided, for example, for administration of a peptide to a patient, then this can be done by any suitable route. If the tumor is considered to be further localized (or diagnosed) then a suitable method of administration can be done by direct injection at the site. Administration can also be made by injection, including subcutaneous, intramuscular, intravenous, and intradermal injection.
[0045]
The formulation can be any that is appropriate for the route of administration and will be apparent to those skilled in the art. The formulation may include a suitable carrier (eg, saline) and may also include bulk agents, other medical preparations, adjuvants and any other suitable pharmaceutical material. A catheter is another preferred mode of administration.
[0046]
The term “effective amount” refers to the amount of VEGF antagonist polypeptide or nucleic acid encoding this polypeptide sufficient to exhibit a detectable therapeutic effect. This therapeutic effect may include, for example, inhibiting unwanted tissue or malignant cell growth, inhibiting inappropriate angiogenesis (neovascularization), limiting tissue damage caused by chronic inflammation, tumors Inhibition of cell growth and the like can be included without limitation. The exact effective amount for a subject will depend on the size and health of the subject, the nature and severity of the condition to be treated, and the like. Therefore, it is impossible to specify an exact effective amount in advance. However, the effective amount in a given state can be determined by routine experimentation based on the information provided herein.
[0047]
The term “pharmaceutically acceptable” refers to compounds and compositions that can be administered to a mammal without undue toxicity. Exemplary pharmaceutically acceptable salts include inorganic acid salts such as hydrochloride, hydrobromide, phosphate, sulfate, etc .; and acetate, propionate, malonate, benzoic acid Organic acid salts such as salts and the like can be mentioned.
[0048]
The VEGF antagonist polypeptide is administered by parenteral means including oral, topical, or subcutaneous and intramuscular injection, sustained release reservoir implantation, intravenous injection, intranasal administration, and the like. Thus, a VEGF antagonist can be administered as a pharmaceutical composition comprising a VEGF antagonist in combination with a pharmaceutically acceptable carrier. Such compositions can be aqueous solutions, emulsions, creams, ointments, suspensions, gels, liposome suspensions, and the like. Suitable carriers (excipients) include water, saline, Ringer's solution, glucose solution, and ethanol, glucose, sucrose, dextran, mannose, mannitol, sorbitol, polyethylene glycol (PEG), phosphate, acetate , Gelatin, collagen, Carbopol Registered TM, vegetable oils and the like. In addition, suitable preservatives, stabilizers, antioxidants, antibacterial agents, and buffers (eg, BHA, BHT, citric acid, ascorbic acid, tetracycline) and the like may be mentioned. Cream or ointment bases useful in the formulation include lanolin, Silvadene Registered TM (Marion), Aqua Registered TM (Duke Laboratories), and the like. Other exemplary formulations include aerosols, bandages, and other wound dressings. Alternatively, the VEGF antagonist can be incorporated or encapsulated in a suitable polymer matrix or membrane, thus providing a sustained release delivery device suitable for implantation near the site for local treatment. Other devices include devices such as indwelling catheters and Alzet Registered ™ mini pumps. Eye formulations can be formulated using commercially available vehicles such as Sorbi-care Registered ™ (Allergan), Neocadedron Registered ™ (Merck, Sharp & Dohme), Lacribe Registered ™, etc., or US Pat. No. 5,124. A typical formulation as described in No. 155, which is incorporated herein by reference, may be used. Furthermore, the VEGF antagonist can be provided as a solid, in particular as a lyophilized powder. Lyophilized formulations typically include stabilizers or bulking agents such as human serum albumin, sucrose, mannitol and the like. A detailed discussion of pharmaceutically acceptable excipients is available at Remington's Pharmaceutical Sciences (Mark Pub. Co.).
[0049]
The antagonist polypeptides of the present invention may be used locally or intravascularly. For topical application, this formulation is about 10 ng / cm.2 / Day to about 1mg / cm2 Applied directly at the rate of / day. For intravascular application, the inhibitor is used at a rate of about 1 mg / kg / day to about 10 mg / kg / day of body weight. For internal use, the formulation can be released directly from the implanted slow release polymeric material or directly into the area to be treated, either from a slow release pump or multiple injections. The release rate in each case is about 100 ng / day / cm.Three To about 100 mg / day / cmThree It is.
[0050]
The VEGF antagonist polypeptides of the present invention can be combined with therapeutically effective amounts of other molecules that negatively regulate angiogenesis, which molecules include TNP-470,
[0051]
The VEGF antagonist polypeptides of the invention can also be combined with chemotherapeutic agents.
[0052]
Diseases, disorders, or conditions associated with abnormal angiogenesis or neovascularization and that can be treated with the therapeutic compounds of the present invention include retinal neovascularization, tumor growth, hemagoma, solid Tumor, leukemia, metastasis, psoriasis, neovascular glaucoma, diabetic retinopathy, arthritis, endometriosis, and retinopathy of prematurity (ROP).
[0053]
Nucleic acid (eg, DNA) encoding a VEGF antagonist polypeptide of the invention can be delivered to a host by any method known to those of skill in the art to treat VEGF-related disorders. A preferred embodiment of the present invention relates to a method of inhibiting solid tumor angiogenesis to prevent further tumor growth and resulting metastasis. For this purpose, any solid tumor or region surrounding the tumor that is amenable to gene transfer can be a target for the disclosed therapeutic applications. DNA stored in a recombinant viral or non-viral based gene transfer system encoding a VEGF antagonist polypeptide of the invention or a derivative or analog thereof can be transformed into the vicinity of a tumor by several procedures known in the art. Of target cells. These procedures include a surgical procedure combined with (a) administering an effective amount of DNA to or around the site in the tumor (if possible, initial removal of part or all of the tumor). (B) direct gene transfer vehicle injection in or near the tumor site; and (c) local or systemic transfer of gene transfer vectors and / or gene products using techniques known in the art. Delivery, including but not limited to delivery.
[0054]
Therefore, VEGF or VEGF165 R / NP-1 or VEGF165 Any solid tumor containing R / NP-2 expressing cells is a potential target for treatment. Examples of solid tumors that are particularly vulnerable to gene therapy applications include, but are in no way listed as limiting: (a) neoplasms of the central nervous system (eg glioblastoma, Astrocytoma, neuroblastoma, meningioma, ventricular ependymoma, but need not be limited here); (b) cancer that is hormone dependent (in situ cancer, carcinoma in situ, medullary) Cancer, tubular adenocarcinoma, invasive (prostate, testis, uterus, cervix, ovary, breast cancer, including but not limited to infiltrating and mucinous carcinomas); (c) melanoma ( Cancers and ocular melanomas); (d) lung cancers, including at least squamous cell carcinoma, spindle carcinoma, small cell carcinoma, adenocarcinoma and large cell carcinoma And (e) cancers of the gastrointestinal system (eg, esophagus, stomach, small intestine, colon, colorectal, rectal and anal areas including at least adenocarcinoma of the large intestine);
[0055]
Expression vectors are defined herein as the DNA sequences required for transcription of cloned copies of genes and translation of these mRNAs in a suitable host. Such vectors can be used to express eukaryotic genes in a variety of hosts (eg, bacteria, cyanobacteria, fungal cells, yeast cells, plant cells, insect cells and animal cells).
[0056]
Specifically designed vectors allow for shuttle of DNA between hosts (eg, bacteria-yeast cells or bacteria-animal cells or bacteria-insect cells). A properly constructed expression vector should include the following: origin of replication for autonomous growth in the host cell, selectable marker, a limited number of useful restriction enzyme sites, the possibility for high copy number, and an active promoter. . A promoter is defined as a DNA sequence that binds to DNA and directs RNA polymerase to initiate RNA synthesis. A strong promoter is one that results in a highly initiated mRNA.
[0057]
Expression vectors can include, but are not limited to, cloning vectors, modified cloning vectors, specifically designed plasmids or viruses.
[0058]
A variety of mammalian expression vectors can be used to express recombinant VEGF antagonists in mammalian cells. Commercially available mammalian expression vectors may be suitable for recombinant expression, including: pcDNA3.1 (Invitrogen), pBlueBacHis2 (Invitrogen), pLITMUS28, pLITMUS29, pLITMUS38 and pLITMUS39 (New England BioLabs, p (Invitrogen), pcDNA3 (Invitrogen), pMC1neo (Stratagene), pXT1 (Stratagene), pSG5 (Stratagene), EBO-pSV2-neo (ATCC37593), pBPV-1 (8-2) (ATCC37110), pneBPV-M -12) (ATCC 37224), pRSVg t (ATCC37199), pRSVneo (ATCC37198), pSV2-dhfr (ATCC37146), pUCTag (ATCC37460), as well? Including but not limited to LZD35 (ATCC 37565).
[0059]
DNA encoding a VEGF antagonist of the invention can also be cloned into an expression vector for expression in a recombinant host cell. Recombinant host cells include prokaryotes or eukaryotes (bacteria, yeast, mammalian cells (including but not limited to cell lines of human, bovine, porcine, monkey and rodent origin), and insect cells (cells). Including, but not limited to, Drosophila, moths, mosquitoes and weevil (armyworm) from the strain). This expression vector can be introduced into a host cell by any one of a number of techniques, including but not limited to transformation, transfection, Ad / polylysine DNA complex, protoplast fusion, and electroporation. . Cell lines derived from mammalian species (which may be appropriate and commercially available) include the following cells: CV-1 (ATCC CCL70), COS-1 (ATCC CRL1650), COS-7 (ATCC CRL1651) ), CHO-K1 (ATCC CCL61), 3T3 (ATCC CCL92), NIH / 3T3 (ATCC CRL1658), HeLa (ATCC CCL2), C1271 (ATCC CRL1616), BS-C-1 (ATCC CCL26) and MRC-5 ( ATCC CCL171) as well as HEK293 cells, but are not limited to these. Insect cell lines (which may be appropriate and commercially available) include 3M-S (ATCC CRL8851), moth (ATCC CCL80), mosquito (ATCC CCL194 and 195; ATCC CRL1660 and 1591) and weevil (Sf9) , ATCC CRL 1711).
[0060]
DNA fragments encoding VEGF antagonist polypeptides can be delivered either systemically by viral or non-viral based methods, or to target cells in the vicinity of a solid tumor in a mammalian host. Viral vector systems that can be utilized in the present invention include: (a) adenoviral vectors; (b) retroviral vectors; (c) adeno-associated viral vectors; (d) herpes simplex virus vectors; (e) SV40 vectors; Including, but not limited to, polyoma virus vectors; (g) papillomavirus vectors; (h) picornavirus vectors; and (i) vaccinia virus vectors.
[0061]
A recombinant virus or recombinant vector comprising a DNA encoding a VEGF antagonist of the present invention can be injected into a host by direct injection into a solid tumor and / or static tissue adjacent to the solid tumor (eg, adipose tissue or muscle tissue). Preferably it is administered. It is of course useful to transfect tumor cells into the area of targeted adipocytes and muscle cells. Transient expression of VEGF antagonists in these peripheral cells results in a local extracellular increase of these peptides and promotes binding to the VEGF receptor and thus inhibits VEGF binding to that receptor.
[0062]
Non-viral vectors that are also suitable include DNA-lipid complexes, eg, liposome-mediated conjugates such as asialoglycoprotein-mediated delivery systems or ligand / poly-L-lysine conjugates (eg, Felgner et al., 1994). J. Biol. Chem. 269: 2550-2561; Derossi et al., 1995, Restor. Neurol. Neuros. 8: 7-10; and Abcallah et al., 1995, Biol. Cell 85: 1-7).
[0063]
The present invention also provides a pharmaceutical pack or kit comprising one or more containers filled with one or more ingredients of the pharmaceutical composition of the present invention. A precautionary statement in the form prescribed by the administrative regulations for the manufacture, use or sale of a pharmaceutical or biological product may be attached to such a container, if necessary, for the human dosage. It is a cautionary statement reflecting the approval by the governmental agency for manufacturing, use or sales.
[0064]
References cited throughout this application are hereby incorporated by reference.
[0065]
The invention is further illustrated by the following examples. These examples are provided to aid the understanding of the present invention and are not to be construed as limiting thereof.
[0066]
Example 1
(Experimental procedure)
(material)
Human recombinant VEGF165 And VEGF121 As described previously (Soker et al., J. Biol. Chem., 271, 5761-5767 (1996), Cohen et al., Growth Factors, 7, 131-138 (1992)).165 Or VEGF121 In Sf-21 insect cells infected with recombinant baculovirus encoding. VEGF165 Is purified by heparin affinity chromatography from conditioned medium of infected Sf-21 cells and VEGF121 Was purified by anion exchange chromatography. Basic FGF was kindly provided by Dr. Judith Abraham (Scios, Sunnyvale, CA). Cell culture media were purchased from Life Technologies, Inc. We purchased more.125 I-sodium was purchased from NEN Life Science Products. Disuccinimidyl suberate and IODO-BEADS were purchased from Pierce. G-glutathione agarose, NAP-5 column, and pGEX-2TK plasmid were purchased from Pharmacia Biotech Inc. We purchased more. TSK-heparin column was purchased from TosoHass (Tokyo, Japan). Molecular weight markers were obtained from Amersham Corp. (IL) purchased. Porcine intestinal mucosa-derived heparin was purchased from Sigma.
[0067]
(Cell culture)
Human umbilical vein endothelial cells (HUVEC) were obtained from the American Type Culture Collection (ATCC) (Rockville MD) and on gelatin coated dishes, a mixture of 20% fetal calf serum (FCS) and glutamine, penicillin, and streptomycin ( Grown in M-199 medium containing GPS). Basic FGF (1 ng / ml) was added to the culture medium every other day. Parental and porcine endothelial cells (PAE) transfected to express KDR / Flk-1 (PAE-KDR), courtesy of Dr. Lema Claesson-Welsh, and as described Grown in F12 medium containing 10% FCS and GPS (Waltenberger et al., J. Biol. Chem., 269, 26988-26995 (1994)). MDA-MB-231 (231) cells were obtained from ATCC and grown in Dulbecco's modified Eagle medium containing 10% FCS and GPS.
[0068]
(Endothelial cell proliferation assay)
HUVECs were seeded in M-199 containing 5% FCS and GPS at a concentration of 4,000 cells / 200 Ul / well in gelatin-coated 96-well dishes. After 24 hours, VEGF isoform and VEGF exon 7-GST fusion protein were added simultaneously to the wells. The cells were incubated for 72 hours and [3H] thymidine (1 μC / ml) was added for 10-12 hours. The medium was aspirated and the cells were trypsinized and collected by an automated cell harvester (TOMTEC) and placed on a filtermat (Wallac). The filter mat was scanned and counts per minute (cpm) were measured with a MicroBeta counter (Wallac). The results represent the average of samples assayed in triplicate and standard deviations were determined. All experiments were repeated at least 3 times and similar results were obtained.
[0069]
(Radioactive iodine binding of VEGF)
VEGF165 Radioiodine binding of VEGF121 and VEGF121 was performed using IODO-BEADS according to the manufacturer's instructions. Briefly, one IODO-BEAD is rinsed with 100 μl 0.1 M sodium phosphate (pH 7.2), dried and in 100 μl 0.1 M sodium phosphate (pH 7.2).125 Incubated with I-sodium (0.2 mCi / μg protein) for 5 minutes at room temperature. VEGF (1-3 μg) was added to the reaction mixture and after 5 minutes the reaction was stopped by removing the beads.125 The solution containing I-VEGF was adjusted to 2 mg / ml gelatin and purified by size exclusion chromatography using a NAP-5 column pre-equilibrated with PBS containing 2 mg / ml gelatin. An aliquot of iodinated protein was frozen on dry ice and stored at -80 ° C. Its specific activity ranged from 40,000 to 100,000 cpm / ng protein.
[0070]
(125 Binding and cross-linking of I-VEGF)
125 I-VEGF165 and125 I-VEGF121 As well as cross-linking experiments were performed as previously described (Gitay-Goren et al., J. Biol. Chem., 287, 6003-6096 (1992), Soker et al., J. Biol. Chem., 271). 5761-5767 (1996)). VEGF binding was quantified by measuring the radioactivity associated with the cells in a y-counter (Beckman, Gamma 5500). This count represents the average of three wells. All experiments were repeated at least 3 times and similar results were obtained.125 The I-VEGF cross-linked complex was resolved by 6% SDS-PAGE and the gel was exposed to a phosphor screen and scanned 24 hours later with a PhosphorImager (Molecular Dynamics). Subsequently, the gel was exposed to X-ray film.
[0071]
(Preparation of GST-
Different segments of
[0072]
[Table 1]
PGEK encoding GST (Smith et al., Gene (Amst.), 87, 31-40 (1988) to digest the amplified product with BamHI and EcoRI restriction enzymes and produce plasmid p2TK-
[0073]
(result)
(VEGF against HUVEC165 And VEGF121 Differential receptor binding and mitogenic activity of
VEGF165 And VEGF121 Differ in their ability to interact with VEGF receptors expressed on HUVEC (Soker et al., J. Biol. Chem., 271, 5761-5767 (1996), Gitay-Goren et al., J. Biol. Chem. 271. 5519-5523 (1996)). VEGF121 Binds to KDR / Flk-1 to form a 240-kDa labeled complex (FIG. 1, lane 2), while VEGF165 In addition to forming a complex of this size,165 A lower molecular weight complex of -175 kDa is also formed (Figure 1, lane 1). This isoform-specific receptor is expressed as VEGF.165 Receptor (VEGF165 R). These differential receptor binding properties are related to VEGF165 And VEGF121 Suggests that it may also have differential mitogenic activity. Therefore, the ability of the two VEGF isoforms to stimulate HUVEC proliferation was tested. VEGF165 Is VEGF121 It was a more potent mitogen against HUVEC than (Figure 2). VEGF165 Stimulated half of maximal DNA synthesis at 1 ng / ml and maximal stimulation at 4 ng / ml produced an 8-fold increase over the control. On the other hand, 2 ng / ml VEGF121 Was required for half of maximal stimulation, and 20 ng / ml for maximal stimulation produced a 4-fold increase in HUVEC proliferation over controls. Therefore, VEGF165 VEGF just twice compared to121 Is required to achieve half of maximum stimulation and VEGF121 -Induced proliferation is VEGF165 Saturation is reached at about half of the level induced. Taken together, these results show that VEGF121 And VEGF for the compared EC165 Enhanced mitogenic activity and additional receptors on HUVEC (VEGF165 VEGF binding to R)165 It suggests that there may be a correlation with the ability of
[0074]
(Fusion proteins containing exon 7- and 8-coding domains are bound to HUVEC and 231 on-cell receptors.125 I-VEGF165 Inhibits binding)
Our previous work has shown that VEGF165 VEGF165 44 amino acids whose binding to R is encoded by exon 7 (VEGF amino acids 116-158) (this is VEGF165 Is present in VEGF121 (Soker et al., J. Biol. Chem., 271, 5761-5767 (1996)). GST fusion proteins containing peptides encoded by
[0075]
These binding experiments show that cross-linking to individual VEGF receptor species125 Enlarged to analyze the effect of GST-
[0076]
(Localization of core inhibitory region with exon 7-coding domain)
The GST-
[0077]
(GST-
[0078]
(GST-
[0079]
(Discussion)
The most abundant VEGF isoform is VEGF165 And VEGF121 It is. An important question from an understanding of VEGF biology is whether these isoforms differ in biochemical and biological properties. To date, VEGF121 VEGF instead165 Binds to cell surface HSPG (Houck et al., Mol. Endocrinol., 8, 1806-1814 (1991), Hook et al., J. Biol. Chem., 247, 28031-28037 (1992), Park et al.,
[0080]
GST-
[0081]
Surprisingly, VEGF121 Is VEGF165 Despite not binding to R, GST-
[0082]
GST-
[0083]
Higher and lower affinity receptors on HUVEC (KDR / Flk-1 and VEGF, respectively)165 Equivalent VEGF to R)165 (Soker et al., J. Biol. Chem., 271, 5761-5767 (1996)) and VEGF to these two receptors165 The inhibitory effect of the GST-
[0084]
Receptor binding studies were used to identify an inhibitory core within 44 amino acids encoded by
[0085]
References cited throughout this specification are hereby incorporated by reference.
[0086]
The invention has been described with reference to specific embodiments. However, this application is intended to cover those modifications and substitutions that may be made by those skilled in the art without departing from the spirit and scope of the appended claims.
[Brief description of the drawings]
FIG. 1 shows125 I-VEGF165 ,125 I-VEGF121 ,and125 The cross-linking with respect to HUVEC of I-GST-EX7 is shown.125 I-VEGF165 (5 ng / ml) (lane 1) or125 I-VEGF121 (10 ng / ml) (lane 2) or125 I-GST-EX7 (50 ng / ml) (lane 3) was bound to a subconfluent culture of HUVEC in a 6-cm dish. This binding was performed in the presence of 1 μg / ml heparin. At the end of the 2 hour incubation, each125 The I-VEGF isoform was chemically cross-linked to the cell surface. These cells were lysed and the proteins were separated by 6% SDS-PAGE. The polyacrylamide gel was dried and exposed to X-ray film.
FIG. 2 shows VEGF165 And VEGF121 HUVEC proliferation corresponding to is shown. HUVEC were cultured in 96-well dishes (5,000 cells / well) for 24 hours. VEGF165 (Black circle) or VEGF121 Increasing amounts of (open circles) were added to the culture and the cells were incubated for an additional 3 days. DNA synthesis based on [3H] thymidine incorporation within HUVEC DNA was measured as described in the Examples. These results were expressed as the average number in 3 wells and this standard deviation was determined.
FIG. 3A binds to HUVEC cells.125 I-VEGF165 According to GST-
Shows inhibition.125 I-VEGF165 (5 ng / ml) was bound to subconfluent cultures of HUVEC (3A) in 48-well dishes in the presence of increasing amounts of GST-EX7 + 8 (black squares) or control GST protein (white squares). . At the end of the 2 hour incubation, the cells were washed and lysed and the radioactivity associated with the cells was determined in a γ-counter. The number obtained is expressed as a percentage of the number obtained in the presence of PBS without adding GST or fusion protein.
FIG. 3B binds to MDA-MB-231 cells.125 I-VEGF165 Shows inhibition by GST-
FIG. 3C binds to PAE-KDR cells.125 I-VEGF165 Shows inhibition by GST-
FIG. 4 shows that the GST-EX7 + 8 fusion protein is125 I-VEGF165 VEGF165 Inhibition of cross-linking to R and cross-linking to KDR / F1K-1.125 I-VEGF165 (5 ng / ml) was bound to sub-confluent cultures of HUVEC (
FIGS. 5A and 5B show the localization of the core inhibitory region within
FIGS. 5A and 5B show the localization of the core inhibitory region within
FIG. 6 shows that the GST-
FIG. 7 shows that the GST-
FIG. 8 shows that GST-
[Sequence Listing]
Claims (15)
Translated fromJapanese(X1−(CSCKNTDSRCKARQLELNERT(配列番号3))−X2)I
の構造を有するペプチドからなる単離されたポリペプチドであって、
ここで、X1は、Hであり、そしてX2は、CRまたはCRCである、
ポリペプチド。The following formula (I):
(X1 - (CSCKNTDSRCKARQLELNERT (SEQ ID NO: 3)) - X2) I
An isolated polypeptide comprising a peptide having the structure:
Wherein, X1is H, and X2is CR oris CRC,
Polypeptide.
請求項12に記載の単離された核酸 The isolated nucleic acid of claim 12.
を含む、組成物。A composition comprising:
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US6915597P | 1997-12-09 | 1997-12-09 | |
| US60/069,155 | 1997-12-09 | ||
| US6968797P | 1997-12-12 | 1997-12-12 | |
| US60/069,687 | 1997-12-12 | ||
| PCT/US1998/026103WO1999029861A1 (en) | 1997-12-09 | 1998-12-09 | Peptide antagonists of vascular endothelial growth factor |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009052725ADivisionJP2009148293A (en) | 1997-12-09 | 2009-03-05 | Peptide antagonists of vascular endothelial growth factor |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2001526032A JP2001526032A (en) | 2001-12-18 |
| JP4312955B2true JP4312955B2 (en) | 2009-08-12 |
Family
ID=26749747
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000524433AExpired - LifetimeJP4312955B2 (en) | 1997-12-09 | 1998-12-09 | Peptide antagonists of vascular endothelial growth factor |
| JP2009052725AWithdrawnJP2009148293A (en) | 1997-12-09 | 2009-03-05 | Peptide antagonists of vascular endothelial growth factor |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009052725AWithdrawnJP2009148293A (en) | 1997-12-09 | 2009-03-05 | Peptide antagonists of vascular endothelial growth factor |
Country Status (5)
| Country | Link |
|---|---|
| EP (1) | EP1037994A1 (en) |
| JP (2) | JP4312955B2 (en) |
| AU (2) | AU1810899A (en) |
| CA (1) | CA2313390A1 (en) |
| WO (2) | WO1999030157A2 (en) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7727761B2 (en) | 1995-08-01 | 2010-06-01 | Vegenics Limited | Vascular endothelial growth factor C (VEGF-C) protein and gene, mutants thereof, and uses thereof |
| US6635421B1 (en)* | 1997-12-09 | 2003-10-21 | Children's Medical Center Corporation | Neuropilins and use thereof in methods for diagnosis and prognosis of cancer |
| AU783683B2 (en)* | 2000-01-18 | 2005-11-24 | Vegenics Limited | VEGF-D/VEGF-C/VEGF peptidomimetic inhibitor |
| ATE377081T1 (en) | 2000-02-25 | 2007-11-15 | Ludwig Inst Cancer Res | MATERIALS AND METHODS CONTAINING HYBRID VASCULAR DOTHELIAL GROWTH FACTORS DNA AND PROTEINS AND SCREENING METHODS FOR MODULATORS |
| US8263739B2 (en) | 2000-06-02 | 2012-09-11 | Bracco Suisse Sa | Compounds for targeting endothelial cells, compositions containing the same and methods for their use |
| WO2001091805A2 (en) | 2000-06-02 | 2001-12-06 | Bracco Research Usa | Compounds for targeting endothelial cells |
| JP2004508048A (en)* | 2000-09-05 | 2004-03-18 | カロリンスカ イノベーションズ アクティーエボラーグ | Materials and Methods for Endothelial Cell Growth Inhibitors |
| GB0029015D0 (en) | 2000-11-28 | 2001-01-10 | Univ London | Medical device |
| US7611711B2 (en) | 2001-01-17 | 2009-11-03 | Vegenics Limited | VEGFR-3 inhibitor materials and methods |
| US7211240B2 (en) | 2002-03-01 | 2007-05-01 | Bracco International B.V. | Multivalent constructs for therapeutic and diagnostic applications |
| US7794693B2 (en) | 2002-03-01 | 2010-09-14 | Bracco International B.V. | Targeting vector-phospholipid conjugates |
| AU2003278807A1 (en) | 2002-03-01 | 2004-08-13 | Bracco International B.V. | Kdr and vegf/kdr binding peptides and their use in diagnosis and therapy |
| US7261876B2 (en) | 2002-03-01 | 2007-08-28 | Bracco International Bv | Multivalent constructs for therapeutic and diagnostic applications |
| US8623822B2 (en) | 2002-03-01 | 2014-01-07 | Bracco Suisse Sa | KDR and VEGF/KDR binding peptides and their use in diagnosis and therapy |
| GB0207644D0 (en)* | 2002-04-02 | 2002-05-15 | Ark Therapeutics Ltd | Peptides and their use |
| EP2284180B1 (en) | 2003-03-03 | 2015-09-09 | Dyax Corp. | Uses of peptides that specifically bind HGF receptor (cMET) |
| CN101237880B (en)* | 2005-08-12 | 2011-09-21 | 瑞泽恩制药公司 | Treatment of diseases by subcutaneous administration of VEGF antagonists |
| AU2006279462A1 (en) | 2005-08-15 | 2007-02-22 | Vegenics Limited | Modified VEGF and PDGF with improved angiogenic properties |
| US20090221010A1 (en)* | 2005-10-21 | 2009-09-03 | Elting James J | Methods for Prediction and Prognosis of Cancer, and Monitoring Cancer Therapy |
| UA96139C2 (en) | 2005-11-08 | 2011-10-10 | Дженентек, Інк. | Anti-neuropilin-1 (nrp1) antibody |
| WO2011087066A1 (en)* | 2010-01-14 | 2011-07-21 | 株式会社三和化学研究所 | Pharmaceutical for preventing or treating disorders accompanied by ocular angiogenesis and/or elevated ocular vascular permeability |
| CA2803792A1 (en) | 2010-07-09 | 2012-01-12 | Genentech, Inc. | Anti-neuropilin antibodies and methods of use |
| CN113226367B (en) | 2018-04-06 | 2025-05-06 | Atyr医药公司 | Compositions and methods comprising anti-NRP2 antibodies |
| US11807687B2 (en) | 2019-10-03 | 2023-11-07 | Atyr Pharma, Inc. | Therapeutic compositions comprising anti-NRP2 antibodies |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1701814A (en)* | 1992-11-13 | 2005-11-30 | 马克斯普朗克科学促进协会 | F1K-1 is a receptor for vascular endothelial growth factor |
| US6020473A (en)* | 1995-08-25 | 2000-02-01 | Genentech, Inc. | Nucleic acids encoding variants of vascular endothelial cell growth factor |
- 1998
- 1998-12-09JPJP2000524433Apatent/JP4312955B2/ennot_activeExpired - Lifetime
- 1998-12-09WOPCT/US1998/026127patent/WO1999030157A2/enactiveApplication Filing
- 1998-12-09WOPCT/US1998/026103patent/WO1999029861A1/ennot_activeApplication Discontinuation
- 1998-12-09AUAU18108/99Apatent/AU1810899A/ennot_activeAbandoned
- 1998-12-09CACA002313390Apatent/CA2313390A1/ennot_activeAbandoned
- 1998-12-09AUAU19060/99Apatent/AU1906099A/ennot_activeAbandoned
- 1998-12-09EPEP98963815Apatent/EP1037994A1/ennot_activeWithdrawn
- 2009
- 2009-03-05JPJP2009052725Apatent/JP2009148293A/ennot_activeWithdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| JP2001526032A (en) | 2001-12-18 |
| CA2313390A1 (en) | 1999-06-17 |
| WO1999030157A9 (en) | 1999-10-21 |
| WO1999029861A1 (en) | 1999-06-17 |
| WO1999030157A2 (en) | 1999-06-17 |
| AU1810899A (en) | 1999-06-28 |
| AU1906099A (en) | 1999-06-28 |
| JP2009148293A (en) | 2009-07-09 |
| WO1999030157A3 (en) | 1999-07-22 |
| EP1037994A1 (en) | 2000-09-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4312955B2 (en) | Peptide antagonists of vascular endothelial growth factor | |
| US8153585B2 (en) | Peptide antagonists of vascular endothelial growth factor and methods of use thereof | |
| US7335357B2 (en) | Antagonists of neuropilin receptor function and use thereof | |
| JP4404479B2 (en) | Soluble inhibitors of vascular endothelial growth factor and uses thereof | |
| US6635421B1 (en) | Neuropilins and use thereof in methods for diagnosis and prognosis of cancer | |
| US7223731B2 (en) | Thrombospondin-1 type 1 repeat polypeptides | |
| WO2000005356A1 (en) | Methods and compositions for inhibition of angiogenesis | |
| AU2005200547A1 (en) | Vascular Endothelial Growth Factor 2 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination | Free format text:JAPANESE INTERMEDIATE CODE: A621 Effective date:20051125 | |
| A131 | Notification of reasons for refusal | Free format text:JAPANESE INTERMEDIATE CODE: A131 Effective date:20080905 | |
| A601 | Written request for extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A601 Effective date:20081120 | |
| A602 | Written permission of extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A602 Effective date:20081128 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20090305 | |
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) | Free format text:JAPANESE INTERMEDIATE CODE: A01 Effective date:20090501 | |
| A01 | Written decision to grant a patent or to grant a registration (utility model) | Free format text:JAPANESE INTERMEDIATE CODE: A01 | |
| A61 | First payment of annual fees (during grant procedure) | Free format text:JAPANESE INTERMEDIATE CODE: A61 Effective date:20090514 | |
| FPAY | Renewal fee payment (event date is renewal date of database) | Free format text:PAYMENT UNTIL: 20120522 Year of fee payment:3 | |
| R150 | Certificate of patent or registration of utility model | Free format text:JAPANESE INTERMEDIATE CODE: R150 | |
| FPAY | Renewal fee payment (event date is renewal date of database) | Free format text:PAYMENT UNTIL: 20130522 Year of fee payment:4 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| EXPY | Cancellation because of completion of term |