JP4299967B2 - Intratubal administration of the composition to the extravascular tissue of a mammal - Google Patents
Intratubal administration of the composition to the extravascular tissue of a mammalDownload PDFInfo
- Publication number
- JP4299967B2 JP4299967B2JP2000524995AJP2000524995AJP4299967B2JP 4299967 B2JP4299967 B2JP 4299967B2JP 2000524995 AJP2000524995 AJP 2000524995AJP 2000524995 AJP2000524995 AJP 2000524995AJP 4299967 B2JP4299967 B2JP 4299967B2
- Authority
- JP
- Japan
- Prior art keywords
- catheter
- cardiac
- lumen
- blood
- vena cava
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3621—Extra-corporeal blood circuits
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/1858—Platelet-derived growth factor [PDGF]
- A61K38/1866—Vascular endothelial growth factor [VEGF]
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3613—Reperfusion, e.g. of the coronary vessels, e.g. retroperfusion
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3621—Extra-corporeal blood circuits
- A61M1/3653—Interfaces between patient blood circulation and extra-corporal blood circuit
- A61M1/3659—Cannulae pertaining to extracorporeal circulation
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/14—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis
- A61M1/16—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis with membranes
- A61M1/1698—Blood oxygenators with or without heat-exchangers
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Cardiology (AREA)
- Anesthesiology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Marine Sciences & Fisheries (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Materials For Medical Uses (AREA)
Abstract
Description
Translated fromJapanese【0001】
発明の分野
本発明の分野は、遺伝治療及び心臓治療である。
【0002】
発明の背景
ウイルスは本来的に核酸を細胞に供給するものであり、従って、遺伝子投与ビヒクルとして利用されてきたことはよく知られている。しかしながら、組換えウイルスが核酸を細胞に供給するためには、ウイルスは、先ず、その細胞に対するアクセスを有さなければならない。哺乳動物内でウイルスを循環させることによっては、それに対して核酸を供給することが望まれる細胞へのアクセスが容易になるとは限らない。本発明は、核酸を供給することが望まれる細胞に対するウイルスのアクセスを提供する手段を提供する。
【0003】
いくつかの筋ジストロフィー症に関わる遺伝子産物の全長cDNAの細菌のクローニング(リム(Lim)他,1995,Nature Gnetics 11:257−265;ピッコロ(Piccolo)他,1995,Nature Genetics,10:266−273;ニグロ(Nigro)他,1996,Nature Genetics 14:195−198;ボンネマン(Bonnemann)他,1995,Nature Genetics 11:266−273及び及びヘルブリング‐レクラーク(Helbling−Leclerc)他,1995,Nature Genetics 11:216−218)は、体細胞遺伝子転移用の様々なウイルスベースのベクターの改良と平行してきた。(ヤン(Yang)他,1994,Nature Genetics 7:362−368; イェー(Yeh)他,196,J.Virology 70:559−565;及びウィルソン(Wilson),1996,New Eng. J.Med. 334:1185−1187)。これらの疾患に於ける一般的な筋肉の関わりとその結果発生する呼吸機能不全は、哺乳類組織及び器官に対する組織ベクターのイン・ヴィヴォ導入に対する必要性が注目されてきた(ボランド(Boland)他,1996,Pediatric Nerology,14:7−12;ステッドマン(Stedman)他,1991,Nature 352:536−539;シュレンカー(Schlenker)他,1991,J.Appl. Physiol.71:1655−1662及びスミス(Smith)他,1987, New Engl.J.Med.316:1197−1205)。生理的条件下に於いて、骨格筋巨大分子の連続内皮は、アルブミンよりも大きなたん白質に対して実質的に不透過であり(Stokes半径3.5ナノメータ;バーン(Berne)他,1992,In:Physiology,Mosby,St.Louis)、その下の基底板は、より大きな巨大分子凝結物の拡散を規制する(マイノ(Majno)他,1961,J.Biophys.Biochem.Cytol.11:571−597)。
【0004】
そのような組成物を必要とする哺乳動物に対して治療効果を有する組成物の導入の目的のために、筋肉に対する大きな巨大分子のアクセスを容易にする組成物と方法とを開発する早急な必要性が存在する。
【0005】
筋ジストロフィー及びその他の筋疾患は、遺伝し、筋遺伝子の非発現又は異常発現によって、正常な筋肉制御の弱化、異常発達、および/又は損失が生じる一般に進行性の障害である。その内のいくつか(たとえば、ミトコンドリアミオパシー)は、ミトコンドリアDNAの欠失に関連するものではあるが、これらの障害の多くは、染色体突然変異に関連付けられてきた。たとえば、デュシェンヌ筋ジストロフィー(DMD)は、ジストロフィンたん白質をコードするヒト遺伝子に於ける突然変異に関連付けられてきた。
【0006】
末期DMDの臨床過程に於いては呼吸compromiseが支配的になるが、そのようなDMS患者に於いてその背後の心筋障害が普遍的に存在する。ジストロフィノパシに関連するもの(たとえば、ベッカー筋ジストロフィー)やsarcoglycanopathyに関連するもの(たとえば、肢帯筋ジストロフィー)を含めて、いくつかの筋ジストロフィーに於いては、移植を必要とするのに十分重度の心不全が時に観察される(ピッコロ(Piccolo)他,1994,Neuromusc.Diord.4−143−146;ファディック(Fadic)他,1996,N.Engl.J.Med.334:362−366)。更に、少なくとも12のその他の遺伝子産物が、ヒトに於ける劣性遺伝拡張心筋症の発病に関連している(ファディック(Fadic)他,1996,N.Engl.J.Med.334:362−366;ピッコロ(Piccolo)他,1995,Nature Genet.10:243−245;リム(Lim)他,1995,Nature Genet.11:257−265;ノグチ(Noguchi)他,1995,Science 270:819−822;ニグロ(Nigro)他,1996,Nature Genet.14:195−198;ニグロ(Nigro)他,1997,Hum.Mol.Genet.6:610−607;ビオネ(Bione)他,1994,Nature Genet.8:323−327;タローニ(Taroni)他,1992,Proc.Nat.Acad.Sci.U.S.A.89:8429−8433;ウィット(Witt)他,1992,J.Neurol.239;302−306;ホー(Ho)他,1985.,1994,Cell 77:869−880;ライヒマン(Reichmann)他,1991,Eur.Heart J.12(Suppl.D):169−170;エイシ(Eishi)他,1985,Hum.Pathol.16:193−197;ビオネ(Bione)他,1996,Nature Genet.12:385−389;ヨコヤマ(Yokoyama)他,1987,Br.Heart J.57:296−299;エレダー(Elleder)他,1990,Virchows Arch.A.Pathol.Anat.Histopathol.417:449−455;ナガオ(Nagao)他,1991,Clin.Genet.39:233−237;シュルテイス(Schultheiss)他,1996,Mol.Cell Biochem.163−164:319−327)。
【0007】
たとえば、全ての心臓筋細胞中におけるトランスジェニック発現を達成するために生殖細胞系遺伝子転移の能力を開発するために、一般的なヒト心臓疾患がネズミに於いて再生されている。その他に依る二つの研究は、その遺伝子転移が心臓筋細胞の大部分又は全部に於いて発生するということを前提として、成体の哺乳動物に於ける体細胞遺伝子転移後に於いて心臓中のトランス遺伝子の発現の潜在的治療上の利点を示唆している。心臓肥大症や拡張心筋障害等の広範囲に渡る疾患を対象とする、これら両方の研究に於いて、Gたん白質介在シグナリング経路がターゲットとされている。
【0008】
第1の研究に於いて、ベータアドレナリン受容体キナーゼ1(bARK1)のペプチドインヒビターをコードするcDNAが、心筋特異アルファミオシン長鎖プロモータの制御下で発現された(ポックマン(Pockman)他,1998,Proc.Natl.Acad.Sci.USA95:7000−7005)。この構造物を組み込んだトランスジェニックマウスを、最近開発された心筋症系(筋LIMたん白質欠乏{MLP-1-})からのマウスと交雑することによって、その子に於いて心筋障害が防止されるという驚くべき知見が得られた。トランスジェニックコード化されたインヒビターは、LIMたん白質の正常に作用に直接には関連しない一般的メカニズムを通じてこれらの異常を防止した。この研究は、ヒトの心臓組織に類似の遺伝子構造物を導入することが、そのような遺伝子構造物をヒトの心筋細胞に対して効率良く特異的に導入されるだけで、様々な心筋障害に苦しむヒトに対して大きな治療上の利点を持ちうる、ということを示唆している。
【0009】
第2の研究に於いて、心筋細胞アドレナリン受容体と、Gqサブクラスのたん白質との間の結合のペプチドインヒビターをコード化するcDNAが、心筋−特異性アルファミオシン長鎖プロモータの制御下に於いて発現された(アクター(Akhter)他,1998,Science280:574−577)。この構造物を組み込まれたトランスジェニックマウスが、術中外科横断大動脈収縮によって心圧過負荷を受けた。このインヒビターの心臓過剰発現によって、圧力過負荷に対する心臓肥大応答が大幅に減少した。心臓過負荷に対するヒトの心臓疾患応答に関連するいくつかのシグナル伝達経路が、前記外科処置の結果、活性化されたことが示された。強いシグナル活性化のセッティングに於いて、前記ペプチドインヒビターの発現に関連する心臓肥大の減少は、前記インヒビターが複数のシグナル伝達カスケードに共通する一つの位置に於いて作用する、ということを示している。この研究は、又、ヒトの心臓組織に類似の遺伝子構造物を導入することが、そのような遺伝子構造物をヒトの心筋細胞に対して効率良く特異的に導入されるだけで、様々な心筋障害に苦しむヒトに対して大きな治療上の利点を持ちうる、ということも示唆している。
【0010】
その他の心臓障害(たとえば、心不全、心筋硬塞、リューマチ熱、リューマチ熱、不整脈、うっ血性心不全、伝染性心内膜炎、及び心嚢炎)は、様々な非先天的な原因と関連していることが知られているが、それでも、もしも有用な遺伝子産物をコードする核酸を有する遺伝子ベクターが、心臓組織に対して特異的かつ安全に提供されうるならば、遺伝子治療法から恩恵を受けるかもしれない。
【0011】
残念ながら、人体内に於ける心臓の位置により、従来は、心臓組織に対して直接又は局所的に治療を提供するために侵入性が高い処置が必要とされた。時としてそのような侵入性の高い処置に伴う重大な生理学的な合併症に加えて、これらの介入処置によって、それらを受ける患者は大きな心理的負担を受ける可能性もある。これらの患者は、肉体的トラウマと侵入的心臓処置に関連する長い回復器官とに耐え、しばしば、回復後に於いて、肉体的及び精神的に痛手をおった状態となる。
【0012】
心臓及びその他の筋組織に於ける局所遺伝子療法を行う方法が深刻に不足していることにより、心臓及びその他の筋疾患を患う患者は、遺伝子ベクターに対してなされた改良の多くと、それらの悩みが、いかにして遺伝子治療法を使用することによって軽減されるかに関するより大きな理解とから、恩恵を受けることが出来ないのである。本発明は、この危急の必要性に答える、局所的筋肉遺伝子治療法、組成物、キット及び装置を提供するものである。
【0013】
発明の要旨
本発明は、哺乳動物の大静脈内に挿入可能な心臓遮断カテーテルに関する。当該カテーテルは以下を有する、
(a)その内部で長手方向に延出する静脈血液流ルーメンと、近端と、遠端部と、近端ポートと、遠端ポートとを備える中空筒状本体、
(b)前記本体に取り付けられた遠端導管シート、そして
(c)前記本体に取り付けられた近端導管シート。
【0014】
前記カテーテルは、哺乳動物の大静脈内に於いて、一方の導管シートが右心房と、腕頭静脈の接合部との間の前記哺乳動物の上大静脈内に位置し、他方の導管シートが、右心房と肝静脈との間の下大静脈内に位置するように、位置決め可能である。前記遠端ポートは、前記遠端導管シートに対して遠端側に位置する。前記近端ポートは、前記近端導管シートに対して近端側に位置する。前記カテーテルが、哺乳動物の大静脈内にすえつけられた時、腕頭静脈の接合部の血液と、肝静脈の血液が、前記両ポートを介して前記静脈血液流ルーメンと流体連通する。
【0015】
本発明の前記心臓遮断カテーテルの一好適実施例に於いて、前記遠端導管シートと前記近端導管シートとの少なくとも一つは、前記本体の周囲に延出する隆起面を有する。たとえば、前記導管シートは、一対の互いに近接離間配置された隆起面とすることができ、これにより、大静脈は、これら一対の隆起面の間で大静脈を包囲することによって前記導管シートに於いて確実に着座される。或いは、前記導管シートを、一対の互いに近接離間配置された隆起面から構成し、前記カテーテルの本体に、その内部に於いて長手方向に延出するとともに、前記一対の近接離間隆起面間に位置する吸入ポートと連通する吸入ルーメンを備えたものとし、これによって、大静脈が、前記吸引ルーメンに対して吸引力を付与することによって前記導管シートに確実に着座されるように構成することも可能である。
【0016】
別の実施例に於いて、前記遠端導管シートと前記近端導管シートとの内の少なくとも一方は伸張可能である。この伸張可能導管シートは、前記本体に取り付けられるとともに、この本体内で長手方向に延出する膨張ルーメンと連通する内部を有するバルーンとすることが可能であり、これにより、大静脈は、カテーテルを哺乳動物の大静脈内に位置決めした後、前記バルーンを膨張させることによって前記導管シートにしっかりと着座することが可能である。前記遠端導管シートと遠端導管シートとの両方を、前記本体に取り付けられるとともに、前記膨張ルーメンと連通する内部を有するバルーンとして構成することも可能である。
【0017】
本発明の前記心臓遮断カテーテルの別実施例に於いて、前記カテーテルの前記本体は、その内部に於いて長手方向に延出するアクセスルーメンと、前記遠端導管シートと近端導管シートとの間に位置するアクセスポートとを備える。前記アクセスポートは、前記アクセスルーメンと連通している。この実施例に於いて、請求項8の心臓遮断カテーテルは、更に、遠端部を備える第2カテーテルを有する。該第2カテーテルは、前記アクセスルーメン内に位置決め可能で、かつ、前記アクセスポートを通して付勢可能である。前記第2カテーテルの遠端部は、この第2カテーテルの遠端部を、哺乳動物の肺大動脈内に位置決めするための湾曲部とすることができる。たとえば、該第2カテーテルの遠端部は、ヒトの心臓の形状に適合したものとすることができる。或いは、又はそれに加えて、第2カテーテルの遠端部は、この第2カテーテルの遠端部を哺乳動物の肺大動脈内に位置決めするための変形可能部とすることができる。該第2カテーテルは、ワイヤ巻きカテーテルとすることができ、その遠端部に肺動脈バルーンを有し、および/又は、その内部に於いて長手方向に延出する圧力放出ルーメンと、この圧力放出ルーメンと流体連通する右心室圧力放出ポートを備えたものとすることができる。
【0018】
更に別の実施例に於いて、本発明の前記心臓遮断カテーテルは、その本体内に於いて長手方向に延出する流体流ルーメンと、前記本体内の、前記遠端導管シートと近端導管シートとの間に配置される右心房流体アクセスポートとを有する。前記本体は、この本体周りに配置された複数の右心房流体アクセスポートを有するものとしてもよい。
【0019】
本発明の前記心臓遮断カテーテルは、更に、少なくとも一つの非侵入性検出可能マーカを有するものとすることができる。
【0020】
本発明は、更に、本発明の前記心臓遮断カテーテルを有する外科キットにも関する。
【0021】
本発明は、更に、哺乳動物の心臓を、その哺乳動物の循環系の残りの部分から遮断するためのキットにも関する。このキットは以下を有する、
(a)その内部に於いてその近端部から延出する少なくとも一つのアクセスルーメンを備える本発明の心臓遮断カテーテル、
(b)前記アクセスルーメン内に挿入可能な第2カテーテル、そして
(c)大動脈内(endoaortic)カテーテル。
【0022】
前記第2カテーテルは、遠端部と、その内部で長手方向に延出する膨張ルーメンとを有し、その遠端部にバルーンを有する。該第2カテーテルの前記バルーンの内部は、第2カテーテルの前記膨張バルーンと流体連通している。前記大動脈内カテーテルは、遠端部と、遠端チップとを備えるフレキシブルロッドと、このフレキシブルロッドの前記遠端部に取り付けられた大動脈内導管シートとを有する。前記大動脈内導管シートは、前記フレキシブルロッドの遠端チップに取付け可能である。一つの実施例に於いて、前記フレキシブルロッドは中空であり、その内部に長手方向に延出する拡張ルーメンを有する。この実施例に於いて、前記大動脈内導管シートは、前記フレキシブルロッドに取り付けられるとともに、前記拡張ルーメンと連通する内部を有するバルーンを有し、これにより、前記大動脈内カテーテルの遠端部を哺乳動物の大動脈内に位置決めした後、前記バルーンを膨張させることによって、大動脈を、前記大動脈導管シートに確実に着座させることができる。別の実施例に於いて、前記バルーンは、フレキシブル本体の遠端チップには配置されず、該フレキシブル本体は、その内部に長手方向に延出する液体アクセスルーメンと、フレキシブル本体の遠端部に配置された液体アクセスポートとを有する。前記液体アクセスポートは、前記アクセスルーメンと流体連通し、前記バルーンよりも、前記フレキシブル本体の遠端チップの近傍に配置される。前記キットの更に別の実施例に於いて、前記第2カテーテルは、その内部に長手方向に延出する流体吸収ルーメンと、該第2カテーテルの遠端部に設けられた流体吸収ポートとを有し、前記流体吸収ポートは前記流体吸収ルーメンと連通している。
【0023】
このキットは、以下の内の単数又は複数のその他のコンポーネントを有するものとできる。
(d)哺乳動物の大腿動脈に挿入されるカニューレ、該カニューレは、その内部に長手方向に延出する動脈血液流ルーメンを備える、
(e)前記心臓遮断カテーテルの静脈血液流ルーメンから血液を引き出し、前記カニューレの前記動脈血液流ルーメンに血液を供給するポンプ、
(f)前記哺乳動物から取出された血液に酸素を供給する血液酸素供給器、そして
(g)止血剤、交差金具、バルーンカテーテル、及び止血用具かな成るグループから選択されるもののような、奇静脈オクルダー。
【0024】
前記キットは、更に、血管透過性促進剤(たとえば、ヒスタミン)および/又は血管拡張剤(たとえば、パパベリン)から成るグループから選択される炎症調整物質を有するものとすることができる。
【0025】
本発明は、巨大分子アセンブリと、血管透過性促進剤とを有する、哺乳動物の管外組織に巨大分子アセンブリを導入するための組成物に関する。一実施例に於いて、前記巨大分子アセンブリは、遺伝子ベクターである。別の実施例に於いて、前記血管透過性促進剤は、ヒスタミン、アセチルコリン、アデノシンヌクレオチド、arachiodonic酸、ブラジキニン、シアニド、エンドセリン、エンドトキシン、インターロイキン−2、イオン透過担体A23187、ニトロプルシド、ロイコトリエン、酸素ラジカル、ホスホリパーゼ、血小板活性化因子、プロタミン、セロトニン、腫瘍壊死因子、管内皮生長因子、バチ毒、及び血管活性アミンから成るグループから選択され、好ましくは、ヒスタミン又は管内皮生長因子である。
【0026】
本発明の別の態様に於いて、前記組成物は、前記巨大分子アセンブリと、血管透過性促進剤と、血管拡張剤とを有する。一実施例に於いて、前記血管拡張剤は、パパバリン、ニモジピン、ヒドララジン、窒素酸化物、エポプロステノール、トラゾリン、アムリノン、ミルリノン、ニトログリセリン、脱硝イソソルビド、イソソルビド一硝酸塩、及び有機硝酸化合物から成るグループから選択され、好ましくはパパバリンである。
【0027】
本発明の更に別の態様に於いて、前記組成物は、前記巨大分子アセンブリと、血管透過性促進剤と、酸素輸送剤とを有する。
【0028】
本発明は、更に、巨大分子アセンブリを、動物の管外組織に供給するためのキットも提供する。該キットは、血管透過性促進剤と血管拡張剤とを有する。一実施例に於いて、前記キットは、更に、前記巨大分子アセンブリを有する。別の実施例に於いて、前記巨大分子アセンブリは、遺伝子コード化ジストロフィンと、遺伝子コード化エウトロフィン(eutrophin)と、サルコグリカン(sarcoglycan)をコード化する遺伝子と、ミニジストロフィン(minidystrophin)をコード化する遺伝子からなるグループから選択されるヒト遺伝子を有する遺伝子ベクターである。
【0029】
更に別の態様に於いて、前記キットは、血管透過性促進剤と、血管拡張剤と、体外循環支持装置及び酸素供給システムの少なくとも一つの使い捨て部材、とを有する。一実施例に於いて、前記少なくとも一つの使い捨て部材は、中空本体と、この本体の内部と流体連通する液体入口と、前記本体の内部と連通する液体出口と、ガス室の内部にガスを供給するガス入口と、前記ガス室を前記本体の内部から分離する少なくとも一つのガス透過性膜と、前記ガス室からガスが出ることを許容するガス出口とを備える酸素供給器であって、これによって、前記本体の内部の流体と前記ガス室のガスとの間でガス交換が可能とされる。前記キット別実施例に於いて、該キットは、酸素供給器であり、前記本体はチューブであり、前記ガス透過性膜は、前記チューブのすくなくとも一部内に延出するポリテトラフルオロエチレン(PTFE)チューブであり、前記ガス室は前記PTFEチューブの内部である。
【0030】
本発明は、更に、動物、好ましくはヒト、の管外組織に巨大分子アセンブリを導入する方法に関する。該方法は、その組織に関連する血管に対して、該血管の内皮層の透過性を増大するために、血管拡張剤を供給する工程と、前記巨大分子を前記血管に供給する工程とを有し、これにより、前記アセンブリは、前記血管の前記内皮層を介して前記組織に導入される。該方法の一実施例に於いて、前記巨大分子アセンブリは、遺伝子ベクター、好ましくは、アデノウイルス遺伝子ベクターである。前記遺伝子ベクターは、好ましくは、遺伝子コード化ジストロフィンと、遺伝子コード化エウトロフィン(eutrophin)と、サルコグリカン(sarcoglycan)をコード化する遺伝子と、ミニジストロフィン(minidystrophin)をコード化する遺伝子からなるグループから選択されるヒト遺伝子等のヒト遺伝子である。別実施例に於いて、前記遺伝子ベクターは、前記ヒト遺伝子に作動リンクされたプロモータ/調節領域を有し、前記プロモータ/エンハンサ領域は、ヒト骨格筋クレアチンホスホキナーゼプロモータ/調節領域と、ネズミ骨格筋クレアチンホスホキナーゼプロモータ/調節領域と、ヒト骨格筋細胞に於いて通常発現される遺伝子のプロモータ/調節領域と、ヒト構成プロモータ領域とから成るグループから選択される。
【0031】
本発明の別の態様に於いて、前記方法は、更に、前記血管に血管拡張剤を供給する工程を有する。
【0032】
本発明の別の態様に於いて、前記巨大分子アセンブリが導入される前記組織は、筋組織、好ましくは、横紋筋組織である。
【0033】
更に別の態様に於いて、前記方法は、前記巨大分子アセンブリの前記血管への供給後に、前記血管内のかん流圧を、正常な生理的かん流圧以上に増大させる工程を有する。
【0034】
更に別の態様に於いて、前記方法は、更に、前記巨大分子アセンブリの前記血管への供給前に、前記動物の血液循環系から前記血管を遮断する工程を有する。一実施例に於いて、前記血管を動物の血液循環系から遮断する工程は、前記血管に対して前記血管透過性促進剤を供給する前に行われる。別実施例に於いて、前記方法は、更にね前記巨大分子アセンブリを前記血管に供給した後で、前記血管に対して除去溶液を供給する工程を有し、前記除去溶液は、実質的に前記血管拡張剤を含まない。
【0035】
別の態様に於いて、前記方法は、更に、前記血管の前記血管循環系からの遮断後に、前記血管に対して酸素輸送剤を供給する工程を有する。
【0036】
別の態様に於いて、前記方法は、更に、前記血管拡張剤を供給する前に、前記動物を、体外循環支持と酸素供給とに晒す工程を有する。
【0037】
更に別の態様に於いて、前記方法は、前記巨大分子アセンブリを供給する前に、前記動物の肝臓への血液供給を閉鎖する工程を有する。
【0038】
本発明は、更に、動物の管外組織に遺伝子ベクターを導入する方法に関し、該方法は以下の工程を有する、
a)前記組織に関連する血管を、前記動物の血管循環系から遮断する、
b)その後、前記血管に血管拡張剤を供給する、
c)その後、前記血管の内皮層の透過性を増加させるべく前記血管に血管透過性促進剤を供給する、
前記遺伝子ベクターを前記血管に供給する、これにより、前記ベクターは前記血管の前記内皮層を介して前記組織に導入される、
前記血管内のかん流圧を正常な生理的かん流圧以上に増大させる、そして
前記血管に酸素輸送剤を供給する、そして
d)その後、前記血管に除去溶液を提供する、該除去溶液は実質的に前記血管透過性促進剤を含まない。
【0039】
本発明は、更に、動物の実質的にすべての筋組織に遺伝子ベクターを供給する方法に関し、該方法は以下の工程を有する、
a)前記動物に体外循環支持と酸素供給とに晒す、
b)その後、前記動物の血液循環系に血管拡張剤を供給する、
【0040】
前記血管の内皮層の透過性を増加させるべく前記血管に血管透過性促進剤を供給する、
【0041】
前記遺伝子ベクターを前記血管に供給する、これにより、前記ベクターは前記血管の前記内皮層を介して実質的にすべての筋組織に導入される、そして
前記血管内のかん流圧を正常な生理的かん流圧以上に増大させる。
【0042】
本発明は、更に、筋ジストロフィーを患うヒトを治療するための治療用遺伝子ベクターに関する。該治療用遺伝子ベクターは、ジストロフィン遺伝子と、エウトロフィン(eutrophin)遺伝子と、サルコグリカン(sarcoglycan)遺伝子と、ミニジストロフィン(minidystrophin)遺伝子とからなるグループから選択されるヒト遺伝子のコード化領域に作動リンクされたプロモータを有する核酸を有する。
【0043】
本発明は、更に、大静脈血液吸収キットに関する。このキットは、カテーテルと、それに取り付けられた一対の導管シートとを有する。前記カテーテルは、該カテーテル内に於いて、静脈血液吸収ポートからカテーテルの近端部へ長手方向に延出する静脈血液流ルーメンと連通する一対の静脈血液吸収ポートを有する。前記カテーテルは、哺乳動物の大静脈に挿入可能である。前記キットの一実施例に於いて、前記カテーテルは哺乳動物の前記心臓遮断カテーテルである。別実施例に於いて、前記カテーテルは、その外面にノッチを有し、該ノッチは、第2カテーテルの本体にフィットするように構成されている。更に別の実施例に於いて、前記キットは、更に、奇静脈オクルーダを有する。
【0044】
本発明は、更に、別の大静脈血液吸収キットを含む。このキットは一対のカテーテルを有する。各カテーテルは、それに取り付けられた導管シートと、該カテーテル内に於いて、静脈血液吸収ポートからカテーテルの近端部へ長手方向に延出する静脈血液流ルーメンと連通する一対の静脈血液吸収ポートを有する。各カテーテルは、哺乳動物の大静脈に挿入可能である。一実施例に於いて、前記カテーテルの少なくも一つは、その外面にノッチを有し、該ノッチは、第2カテーテルの本体にフィットするように構成されている。更に別の実施例に於いて、前記キットには、更に、奇静脈オクルーダを設けることができる。
【0045】
本発明は、更に、哺乳動物の大静脈から静脈血液流を転送する方法に関する。この方法は、本発明の心臓遮断カテーテルを前記哺乳動物の大静脈内に設置する工程を有する。この方法の一実施例に於いて、前記カテーテルの静脈血液流ルーメンは、体外酸素供給装置と流体連通している。
【0046】
本発明は、更に、哺乳動物の大静脈から静脈血液流を転送する方法に関し、この方法は、上静脈戻りカテーテルを、前記哺乳動物の上大静脈内に設置する工程と、下静脈戻りカテーテルを、前記哺乳動物の下大静脈内に設置する工程とを有し、前記上静脈戻りカテーテルと下静脈戻りカテーテルとはそれぞれ、以下を有する、
(i)遠端部と、ポートと、本体内に於いて前記ポートから前記本体の近端部へ長手方向に延出する静脈血液吸収ルーメンとを有する中空筒状本体、そして
(ii)前記本体に取り付けられた導管シート、該導管シートは前記ポートよりも前記本体の遠端部の近傍に位置する。
【0047】
前記上静脈戻りカテーテルは、哺乳動物の上大静脈内に於いて、前記上静脈戻りカテーテルの導管シートが右心房と、腕頭静脈の接合部との間に位置するように位置決め可能である。前記下静脈戻りカテーテルは、哺乳動物の下大静脈内に於いて、前記下静脈戻りカテーテルの導管シートが右心房と、肝静脈の接合部との間に位置するように位置決め可能である。前記哺乳動物の上下大静脈が前記両導管シートに当接して着座された時、哺乳動物の大静脈のからの大静脈血液流は、両ポート及び両大静脈血液流ルーメンへと転送される。この方法の一実施例に於いて、前記下静脈戻りカテーテルと前記上静脈戻りカテーテルとの少なくとも一方は、前記本体の遠端チップから近端部へと延出するアクセスルーメンを有する。このカテーテルの前記本体は、更に、前記アクセスルーメンを介して前記本体の前記遠端チップから近端部への静脈血液の通過を禁止しながら、前記シールを介した体の通過を許容するために前記アクセスルーメン内に配置された少なくとも一つの貫通可能シールを有する。たとえば、前記貫通可能シールは少なくとも一つのバルーンから構成することができる。
【0048】
本発明は、更に、哺乳動物の心臓循環、及び哺乳動物の非心臓循環、非肺循環から成るグループから選択される一つのコンパートメントに薬剤を供給する方法に関する。この方法は、前記心臓循環を、非心臓循環、非肺循環から遮断する工程と、前記薬剤を前記一つのコンパートメントに供給する工程を有する。この方法の一実施例に於いて、前記心臓循環は、以下の工程によって、非心臓循環、非肺循環から遮断される、
(1)本発明の心臓遮断カテーテルを、前記哺乳動物の大静脈に挿入する、
(2)前記大静脈を、前記遠端及び近端導管シートに対して着座させる、
(3)大動脈導管シートを有する大動脈カテーテルを、前記哺乳動物の大動脈に挿入する、そして
(4)前記大動脈を前記導管シートに対して着座させる。
【0049】
これにより、心臓循環は、前記全身系循環から遮断される。前記心臓遮断カテーテルは、少なくとも二つの導管シートを備える一つのカテーテル、或いは、ここに記載されているように、少なくとも一つの導管シートを有する一対のカテーテルから構成することができる。この方法の一実施例に於いて、哺乳動物の肺動脈は、たとえば、動脈導管シートを有する第2カテーテルを、前記大静脈カテーテル内で長手方向に延出するルーメンと、前記大静脈カテーテルの両導管シート間に配置されたアクセスポートと、その哺乳動物の心臓の右心房と右心室とを介して、哺乳動物の肺動脈にねじ込み、その後肺動脈を動脈導管シシートに着座させることによっても閉鎖される。この方法の別実施例に於いて、哺乳動物の奇静脈も閉鎖される。この方法によって導入される薬剤は、たとえば、薬剤組成物、画像形成物質、及び遺伝子ベクター(たとえば、アデノウイルスベクター又はアデノ関連ベクター)から成るグループから選択することができる。この方法に依れば、心臓循環と非心臓循環との少なくとも一方を、体外酸素供給装置と接続することができる。
【0050】
本発明は、更に、哺乳動物の心臓の静脈血液腔に、装置を供給する方法も含む。この方法は、少なくとも一つのカテーテルを哺乳動物の大静脈に挿入する工程と、哺乳動物の大静脈から血液流を転送する工程と、前記装置を前記腔に供給する工程とを有する。前記カテーテルは、哺乳動物の大静脈内に位置決め可能な少なくとも二つの導管シートと、アクセスポートと、前記カテーテル内に於いて、該カテーテルのアクセスポートから近端部へ長手方向に延出するアクセスルーメンとを有する。大静脈からの血液流は、大静脈を前記導管シートに対して着座させることによって転送され、これにより、静脈血液流は、大静脈から、前記血液吸収ポートを介して前記静脈血液流ルーメンへと流れる。該装置は、この装置を、前記アクセスルーメンを介して前記アクセスポートを通って前記腔内へと通過させることによって、この腔に供給される。
【0051】
発明の詳細な記載
本発明は、遺伝子ベクター等の巨大分子アクセスを、筋組織等の管外組織に導入するための、組成物、方法、及び装置を含む。本発明のこれら組成物、方法、及び装置は、血管系の血管の内皮層を透過性を変化させるために、血管透過性促進剤を使用する。本発明のいくついの態様に於いて、前記組成物、方法、及び装置は、血管拡張剤が不在の場合、前記アセンブリを収納するのに狭すぎるであろう、血間の部分に導入される前記巨大分子アセンブリの能力を改善するために血管拡張剤を使用する。従って、いくつかの態様に於いて、本発明の組成物、方法、及び装置は、血管の通常アクセス不能部分への遺伝子転送ベクターの導入を改善するための血管拡張剤の使用と、前記ベクターの、血管の内皮層を介した通過を改善するための血管透過性促進剤の使用との両方を含む。本発明の方法を実行するのに有効な組成物と、酸素供給装置と、本発明の本発明方法を実行するための、単数又は複数の組成物および/又は装置(単数又は複数)を有するキットとを有する装置も提供される。
【0052】
本発明は、遺伝子導入ベクターとして、アデノウイルスベクター及アデノ関連ベクターとの(独立的)使用、微小血管アクセス及び透過性を改善するための、ヒスタミン等の血管透過性促進剤の使用と、パパバリン等の血管拡張剤の使用とによって例示される。従って、本発明は、遺伝子導入ビヒクルとしてこれらのウイルスベクターの使用に限定されるものではないが、本発明は、巨大分子アセンブリに対して微小血管アクセスと透過性を促進するべく開発されたこれらの組成物、方法及び装置の有効性を示すべく、これらのウイルスベクターの使用によって例示されるものである。従って、本発明は、遺伝子導入ビヒクルとしてこれらのウイルスの使用、又は、微小血管アクセス及び透過性を改変する手段としてヒスタミン及びパパバリンの使用のみに限定さるものと解釈されてはならない。
【0053】
骨格筋に血液供給を提供する血管の連続内皮は、血管空間から筋組織へアデノウイルスが出ることを阻止する。マーカが筋繊維の間質に直接的に注入された後に発生する染色パターンと比較して、マーカウイルスを一連の筋繊維の上流側で大腿動脈に注入した後には、異なる染色パターンが現れる。
【0054】
他者によって、管外組織の細胞によるアデノウイルスベクターの吸収は、そのベクターによって特異的に結合されるウイルスレセプタたん白質のそれらの細胞上に於けるその存在に、完全又は主に依存し、これによって吸収を容易にするものである、という仮説が立てられている。従って、従来では、筋細胞上に於ける適当なアデノウイルスレセプタたん白質の不足の為に、アデノウイルスベクターは、哺乳動物の血液循環系を介して筋組織に遺伝子を導入するためのベクターとして不良である、と考えられていた。ここに提示されたデータ、更に、たとえば、筋組織へのベクター懸濁液の直接注入によって、アデノウイルスベクターが筋組織に直接導入されるという観察は、アデノウイルスベクターの遺伝子を血液流を介して筋組織に導入する能力が、曽木の細胞の表面上に於けるアデノウイルスレセプタたん白質の存在よりも、そのベクターの、血管の内皮層を貫通する能力に遥かに大きく依存している、ということを示すものである。
【0055】
血液流を介したアデノウイルス遺伝子導入後の検死に於いてマウスの肝臓の外観、そのマウス肝臓の外観に対するプリングル操作の影響、及び肝臓微小血管の不連続性によって、肝臓に供給する毛細血管の内皮壁が、直径1ミクロンの不連続性を有することが照明される。これらの不連続性は、それらが血管空間から肝細胞の周囲の空間へと自由に通過するという事実によって示されるように、直径で600ナノメータ以下の乳糜脂粒を含むものである。従って、肝臓は、濾過に類似のプロセスによって、たとえば、循環するアデノウイルス遺伝子ベクターを含むなんらかの粒子を除去する。横紋筋等の管外組織に対してアデノウイルス遺伝子ベクターを導入することが望まれる場合、肝臓に於けるこのベクターのゼクエストレーションは望ましくない。従って、本発明に於いて、アデノウイルス遺伝子ベクター等の巨大分子アセンブリを、哺乳動物の血液流に供給することとの関係に於いてプリングル操作を行うことにより、アセンブリの肝臓ゼクエストレーションが低減し、これによって、筋組織等の所望の管外組織に対するアセンブリのより効率的な導入が可能になる、ことが発見された。
【0056】
骨格筋は高度に血管的な組織である。哺乳動物にとって筋肉は、独自の生理学的役割を果すものであるので、極端な脈管質は遺伝子セラピストにとって有利であると考えられる。その組織は、全ての組織の中で最も大きな代謝範囲を有するが、この代謝範囲は、最大刺激化後のその代謝率との比較に於ける非刺激化組織の基礎代謝率の比率である。たとえば、骨格筋組織の休息中の代謝率は、毎分ウエット組織当たり2マイクロモルのアデノシン三燐酸の加水分解と等価である。最大刺激化時、代謝率は、毎分ウェット組織当たり約120マイクロモルのアデノシン三燐酸の加水分解と等価である。無酸素スプリント中、代謝率は、毎分ウェット組織当たり約480マイクロモルのアデノシン三燐酸の加水分解と等価である。より重要なこととして、骨格筋組織の大半の毛細管は、休息状態ではかん流されない。それにもかかわらず、骨格筋は、その脈管質の為に、再建手術に於ける自由組織転移のための好適な組織である。
【0057】
横紋筋は、遺伝子転移にとって恐るべき標的である。これは、大半の哺乳動物の体重の約半分を構成する。心筋は、横紋筋の一種である。筋ジストロフィーを患う患者は、心臓疾患も患う。筋肉は、連続内皮を有する血管によって血液を供給される。通常の生理学的条件下では、これらの血管の内皮層は、約70−90ナノメータのストーク径を有するアデノウイルスの半径の約1/13である約3ナノメータのストーク径を有するたん白質である、アルブミンに対して実質的に非透過性である。従って、アデノウイルス遺伝子ベクターを、その層を通過可能とするためには、筋組織に対して血液を供給する血管の内皮層の透過性を、通常の生理学的条件下に於けるその層の透過性に対して大幅に増大させることが必要である。
【0058】
筋肉は、哺乳動物の体の全毛細表面積の半分を遥かに超える非常に脈管質の組織である。その結果、もしも筋肉の内皮が、アルブミンサイズの分子に対して透過性になれば、体外循環支持装置がなければ循環系は崩壊し、その哺乳動物はショックを受ける。従って、循環する血液の量のホメオスタシスにとって内皮バリアが必須である。正常な循環系ホメオスタシス中に於いて、体内の個々の細胞を通過する血液の流量は、その細胞のそれぞれの需要を満たすのに適した率で酸素を供給する。ショック中に於いて、この流量は、そのレベルから維持不能レベルに低下し、これによつて、細胞の酸素欠乏が発生し、もしそのショックが十分な時間続くならば、細胞死が起こる。
【0059】
内皮病態生理学、即ち、体内の微小循環通路の壁の機能障害、は、炎症、体過敏症、敗血症ショック、心肺バイパス、カルチノイド症候群、そしてカルチノイドクリーシス等を含む広範囲の生理学的状態で発生する。これらの状態のそれぞれが、水、陽イオン、陰イオン、のみならず、大きな巨大分子も内皮バリアを透過することを許容してしまう血管内皮透過性の増加を伴う。
【0060】
本発明は、血管内皮易透化によって、アデノウイルス遺伝子ベクター等の巨大分子アセンブリ、血管空間から血管内皮を介して、筋組織等の管外組織への転移が容易になる、という観察に基づくものである。ここに記載されているように、血管内皮透過性は、生理学的に増大させることができる。従って、炎症調製剤又はその誘導体等の血管透過性促進剤を使用して、必ずしもアナフィラキシーショックを起こすことなく、内皮透過性を操作することが可能である。血管透過性促進剤は、それらが、内皮透過性を変化させるべく作用する急速度と、その作用の可逆性とに依り、選択される調節剤である。
【0061】
本発明の組成物は、遺伝子導入ベクター等の巨大分子アセンブリと、血管透過性促進剤とを有する。好適な遺伝子導入ベクターは、ウイルスベクター、より具体的には、アデノウイルスベクターである。
【0062】
好ましくは、そのような遺伝子ベクターは、遺伝子コード化ジストロフィンと、遺伝子コード化エウトロフィン(eutrophin)と、サルコグリカン(sarcoglycan)をコード化する遺伝子と、ミニジストロフィン(minidystrophin)をコード化する遺伝子等の、ヒト遺伝子を有する。前記遺伝子ベクターは、ヒト骨格筋クレアチンホスホキナーゼプロモータ/調節領域と、ネズミ骨格筋クレアチンホスホキナーゼプロモータ/調節領域と、ヒト骨格筋細胞に於いて通常発現される遺伝子のプロモータ/調節領域と、ヒト構成プロモータ領域等の、前記ヒト遺伝子に作動リンクされたプロモータ/調節領域を有するものとできる。遺伝子ベクターを構築する方法は当該技術に於いて周知である。
【0063】
好適な血管透過性促進剤は、内皮が、約150−200ナノメータの直径のウイルスベクターを収納するようになるような程度に、血管内皮の透過性を変化させるものである。ヒスタミン、アセチルコリン、アデノシンヌクレオチド、arachiodonic酸、ブラジキニン、シアニド、エンドセリン、エンドトキシン、インターロイキン−2、イオン透過担体A23187、ニトロプルシド、ロイコトリエン、酸素ラジカル、ホスホリパーゼ、血小板活性化因子、プロタミン、セロトニン、腫瘍壊死因子、管内皮生長因子(VEGF)、バチ毒、及び血管活性アミン等、を含み、但しこれらに限定されない様々な前記血管透過性促進剤が知られている。これらのリストした物質の内、二つ、即ち、ヒスタミンとVEGFとが好ましい。
【0064】
ヒスタミンは広範囲に特徴付けられており、その薬理特性は、比較的よく理解されている。ここに記載されているように、ヒスタミンは、血管内皮透過性を、アデノウイルス遺伝子ベクターが、血液流から管外組織へと通過することができる程度に促進させるのに有効な薬剤である。従って、ヒスタミンは、本発明の好適な血管透過性促進剤である。哺乳動物にヒスタミンを投与することには、様々な公知の望ましくない副作用がある。哺乳動物に於けるこれら副作用を逆転又は軽減するのに有効な、抗ヒスタミン剤及びヒスタミンレセプタ拮抗剤が知られている。これらの組成物を、哺乳動物に対して、ヒスタミンの下記の投与と組み合わせて、又はその投与後に使用することは、本発明の変形例として考慮される。いかなる特定の理論に制約させることを望むものではないが、或る種の抗ヒスタミン剤は、ヒスタミンの単数又は複数の他のヒスタミン受容体との相互作用に影響することなく、ヒスタミンのH1又はH2受容体等の、単数又は複数種のヒスタミン受容体に対するヒスタミンの結合を、阻止、逆転、又は拮抗するこにとよって作用するものと、考えられる。従って、或る種の抗ヒスタミン剤は、ヒスタミンの血管透過性促進特性に影響を与えることなく、哺乳動物に慰するヒスタミンの投与の望ましくない副作用を防止、又は逆転させるのに特に有効であるかもしれない。そのような抗ヒスタミン剤を、哺乳動物の組成物、方法、及び方法に於いてヒスタミンの投与と平行して、又はその投与後に投与することが本発明において考慮される。
【0065】
VEGFは、ヒスタミンよりもはるかに低い濃度で有効な血管透過性促進剤であることが示されている。更に、VEGFは、ヒスタミンによって誘発される望ましくない副作用の全てを有するものではない(ロバーツ(Roberts)他,1995,J.Cell Sci.108:2369−2379;ロバーツ(Roberts)他,1997,Cancer Res.57:765−772;サンガー(Sanger)他,1990,Cancer Res.50:1774−1778)。従って、VEGFは、本発明の好適な血管透過性促進剤である。
【0066】
本発明は、又、毛細管の血管拡張によって、血管空間から血管内皮を介して管外組織への遺伝子転移の効率が改善させるという観察にも基づいている。この効果は、肝臓では、この器官の開口性に依り、それほど重要ではないが、毛細管の大半が休息時に於いてかん流されない、筋組織等のその他の管外組織に於いては極めて重要である。血管拡張は毛細管のルーメンの拡張を起こし、なんらかの特定の作動原理によって制約されるものではないが、更に、血管内皮の開口性を引きこす又は改善する可能性がある。従って、血管拡張によって、血管から管外組織への出液が改善される。ここに記載されているように、血管拡張組成物は血管の一部を狭めるべく血管透過性促進剤の導入を改善し、これによって、それがその血管の内皮表面のより大きな部分に作用することを可能とすることによって、その薬剤の有効性を改善する。血管拡張は、又、血管の一部を狭めるべく巨大分子アセンブリの導入も改善し、これによって、その導入に対してより大きな内皮表面領域が利用可能となることにより、そのアセンブリの経皮導入を改善する。パパバリン、ニモジピン、ヒドララジン、窒素酸化物、エポプロステノール、トラゾリン、アムリノン、ミルリノン、ニトログリセリン、脱硝イソソルビド、イソソルビド一硝酸塩、及び有機硝酸化合物等を含み、但しこれらに限定されない多くの血管拡張剤が当該技術に於いて知られている。
【0067】
従って、本発明は、遺伝子導入ベクター等の巨大分子アセンブリと、血管透過性促進剤と、血管拡張剤とを有する組成物を含む。好ましくは、前記血管拡張剤はパパバリンである。
【0068】
一実施例に於いて、本発明の前記組成物は、アイソトニック緩衝剤等の、薬剤的に許容可能なキャリアを有する。前記組成物は、日当たり体重キログラム当たり1ナノグラムから、日当たり体重キログラム当たり100ミリグラムの範囲の量の前記巨大分子アセンブリを導入するべく哺乳動物に投与することができる。該組成物は、単数又は複数の供与で、投与することができ、複数の供与は、数日、数週間、又は数ヶ月に渡って行われる。
【0069】
本発明の前記組成物の前記血管透過性促進剤又は血管拡張剤、あるいはこれらの両方は、薬用組成物として哺乳動物の血管に供給することができる。本発明の方法に於いて有用な薬用組成物は、経口固形製剤として、目薬、座薬、エアゾル、塗布又はその他の製剤として体に投与することができる。前記血管透過性促進剤又は前記血管拡張剤、あるいはこれら両方に加えて、それら薬用組成物は、薬用許容可能キャリア、及び、薬剤投与を促進、容易化することが知られているその他の成分を含むことができる。ナノパーティクル、リポソーム、再密封赤血球、及び免疫ベースシステム等のその他可能な製剤も、本発明の方法に依って、前記血管透過性促進剤又は血管拡張剤あるいはこれら両方を投与するのに使用することができる。
【0070】
別実施例に於いて、本発明の前記組成物は、更に、たとえば組織の遺伝子導入ベクターに対する露出中に、その管外組織に対して酸素が供給されるように、酸素輸送剤を有する。その組成物が投与されている哺乳動物の血液、同じタイプの哺乳動物の異なる個体からの血液、過フルオロ化合物液、ヘモグロビン含有組成物、等、の当該技術に於いて知られているすべての酸素輸送剤を使用することができる。
【0071】
本発明の前記組成物は、巨大分子アセンブリを、哺乳動物の管外組織に導入するためのキットとして提供することができ、該キットは、血管透過性促進剤と血管拡張剤とを有する。好ましくは、前記血管透過性促進剤は、ヒスタミン又は血管内皮生長因子であり、前記血管拡張剤はハパバリンである。前記キットが管外組織に遺伝子ベクターを導入するのに使用される場合には、前記キットは、更に、アデノウイルスベクター等の遺伝子ベクターを含むことができる。好ましくは、そのような遺伝子ベクターは、遺伝子コード化ジストロフィン、遺伝子コード化エウトロフィン(eutrophin)、サルコグリカン(sarcoglycan)をコード化する遺伝子、ミニジストロフィン(minidystrophin)をコード化する遺伝子等のヒト遺伝子である。前記遺伝子ベクターは、更に、ヒト骨格筋クレアチンホスホキナーゼプロモータ/調節領域、ネズミ骨格筋クレアチンホスホキナーゼプロモータ/調節領域、ヒト骨格筋細胞に於いて通常発現される遺伝子のプロモータ/調節領域、ヒト構成プロモータ領域前記ヒト遺伝子に作動リンクされたプロモータ/調節領域等の、前記ヒト遺伝子に作動リンクされたプロモータ/調節領域を有する。これら遺伝子ベクターを構築する方法は当該技術に於いて周知である。
【0072】
本発明のその他の組成物は、心筋層に巨大分子アセンブリを導入するキットとして提供することができる。このキットの好適な巨大分子アセンブリは、たとえば、心筋症を治療するのに有用な薬用又はその他治療用組成物がある。そのような組成物は、心筋層中で発現された時に、治療効果を発する遺伝子産物をコード化するポリヌクレオチドを有する遺伝子ベクターを含む。遺伝子産物の例には、例として、非限定的に、アンギオテンシン1受容体、又はVEGF等のたん白質、アンギオテンシン1,アンギオテンシン2,ベータ−アドレナリン受容体、ベータ−アドレナリン受容体キナーゼ、ベータ−アドレナリン受容体キナーゼインヒビター、又はアルファ−アドレナリン受容体等をコード化する核酸と相互作用することが可能なもの等の、アンチセンスオリゴヌクレオチドがある。
【0073】
本発明は、更に、機械的循環系支持装置と体外酸素供給装置とによって、本発明の前記組成物の薬理的範囲が広がる、と観察にも基づいている。換言すると、哺乳動物が心肺装置に接続されると、それは次の全部を行うことができる。心臓は、前記組成物に含まれる血管透過性促進剤の作用と血管拡張剤の作用から機能的に保護される。体外支持装置の不在状態で大幅な血管拡張を行うと、反射性頻拍と、心臓に対する収縮性の増加とが起こり、これらは共に、筋ジストロフィー等を患うヒトの心臓等の、既に遺伝的に欠損した心臓に対してダメージを与える。更に、体外循環によって、肺動脈内のそれを含めて、肺かん流圧を独立的に制御することが可能になる。ヒトの心臓の右心室に大きなカニューレを設置することによって、心拡張中に右心室を満たす前に、右心房から血液を引き出すことが可能となる。これによって、シストリック肺動脈が低下し、肺柔組織内への血管からの出液が減少し、これによって、ヒトの肺に流体が蓄積されることが防止される。これは、介入処置の急性罹病率を最小化するために重要である。体外回路によって、更に、出液中に於いて血液流から管外組織へ通過する流体の急速な置換への血管アクセスを確保し、その処置中に於いて体全体を通じて適切な組織酸素供給が維持させることを可能にする。前記心肺装置によって提供される酸素供給は、肺−動脈変化率とは独立しており、これによって、肺水腫に関連する低酸素血症が回避される。換言すると、前記体外ポンプを通って循環する血液は、体への導入の前に十分に酸素供給される。体外回路は、又、最小限の侵入性アクセスルートによっても設定される。
【0074】
従って、本発明の前記キットは、更に、酸素輸送剤又は、体外循環系支持装置及び酸素供給装置の少なくとも一つの使い捨て部材を有することができる。たとえば、前記少なくとも一つの使い捨て部材は、中空本体と、該本体の内部と流体連通する液体入口と、ガス室の内部にガスを供給するガス入口と、前記本体の内部から前記ガス室を分離する少なくとも一つのガス透過膜と、前記ガス室からのガスの流出を許容するガス出口とを有し、これによって、前記本体内部とガス室のガスとの間でガス交換が行われる。前記酸素供給装置は、図8及び9に図示したものに類似に構成することができ、ここで、前記ガス透過膜は前記チューブの少なくとも一部の内部で延出するPTFEチューブであり、前記ガス室は前記PTFEチューブの内部である。
【0075】
本発明の前記組成物に加えて、体外循環系支持装置及び酸素供給装置の少なくとも一つの使い捨て部材と、本発明の前記組成物を哺乳動物の血管に供給するための少なくとも一つのカニューレとを有する、本発明の方法を実行するために有効なキットも提案される。好ましくは、このキットは、巨大分子アクセスと、血管透過性促進剤と、注射器又は一定長の蠕動ポンプのチューブと、注射器にフィットするように構成された中空ボアニードル等のカニューレとを含む、哺乳動物の方法を実行するために必要な単用コンポーネントの全てを有する。このキットは、更に、血管拡張剤と、薬学的許容可能キャリアと、第2カニューレと、酸素輸送剤と、実質的に前記血管透過性促進剤を含まない除去剤と、クランプ、止血鉗子又は止血帯、使い捨て酸素供給装置、等のような単数又は複数の血管閉塞装置とを有するものとすることができる。
【0076】
本発明の方法は、遺伝子ベクター等の巨大分子アセンブリを哺乳動物の管外組織に供給するための方法である。前記管外組織は、オプションとして、体循環系から遮断することができる(たとえば、体循環系から遮断された心筋組織又は肢筋組織)。前記方法は、前記血管の内皮層の透過性を増大させるべく前記組織に関連する血管に血管透過性促進剤を供給する工程を有し、これによって、前記ベクターは、血管の前記内皮層を介して前記組織に供給される。前記血管透過性促進剤は、ベクターと同時に前記血管に供給されるか、若しくは、ベクターの供給前又は後に、血管に供給することができる。好ましくは、前記血管透過性促進剤は、ヒスタミン又はVEGFである。たとえば、10ミリモルのヒスタミンとアデノウイルスとをゆうする組成物を、哺乳動物の血管に供給することができ、ここで前記ヒスタミンは、血管の透過性を向上させ、これによって、前記アデノウイルスは、血管の内皮を介して、この血管の近傍の筋等の、管外組織へと通過することができる。前記方法に使用される前記血管透過性促進剤の濃度は、その薬剤の種類に応じているが、その薬剤への露出後におテンションニング、血管がその薬剤に対する露出以前よりも大きな透過性を有するように、血管の透過性を高めるのに十分なものでなければならない。血管透過性促進剤の有効な濃度は当該技術に於いて公知である。
【0077】
別実施例に於いて、本発明の前記方法は、更に、好ましくは前記遺伝子ベクターを血管に供給する前に、又、好ましくは、前記血管透過性促進剤を供給する前に、前記血管に対して血管拡張剤を供給する工程を有する。この血管拡張剤は、本発明の組成物の供給の前、その間、又はその後に供給することができる。前記血管拡張剤の濃度は重要ではない、但し、それは、血管中の血管拡張を誘発させるのに十分大きなものでなければならない。ここに記載のように、様々な血管拡張剤が当該技術に於いて公知であり、血管拡張を促進するのに有効なそれら薬剤の濃度も同様である。その血管拡張剤が投与される哺乳動物が、その血管拡張剤の生理学的副作用を補償するために機械的な循環系支持装置を適用される場合には、より高い濃度の血管拡張剤を使用することが可能である、と考察される。本発明の方法にパパバインを使用することが好適である。
【0078】
本発明の前記方法は、非限定的に、筋組織、横紋筋組織、心筋組織、骨組織、骨髄組織、皮膚組織、脳組織、等を含む、全ての管外組織に巨大分子アセンブリを供給するのに使用することができる。ここに記載のように、そのようなアセンブリを、肝臓や脾臓等のある種の有窓管外組織に供給するために本発明の方法を使用する必要はない。しかしながら、本発明の方法は、それが有窓であってもなくても、全ての管外組織に巨大分子アセンブリを供給するのに使用可能である。
【0079】
本発明の前記組成物が供給される前記哺乳動物は、好ましくは、哺乳動物であり、より好ましくはヒトである。本発明の前記組成物を筋ジストロフィーを患うヒトに供給することが特に考察される。
【0080】
本発明の方法の一変形例に於いて、前記遺伝子ベクターを血管に供給した後、血管内のかん流圧は、正常生理的かん流圧以上に高められる。かん流圧の増加は、平方インチ当たり5ないし80ポンド、又はそれ以上とすることができる。しかしながら、当業者は、ここに開示された情報を使用して、かん流圧を増大させること、及びそれに対応する組織損傷のリスクによって得られる利点を評価することができる。血管から哺乳動物の血液循環系、特に哺乳動物の心臓、から遮断される状況に於いては、その哺乳動物に対する損傷のリスクは、血管が遮断されない状況と比較して、かん流圧の増加に対する依存性が低い、と考察される。
【0081】
本発明の方法に於いて、多数の理由に依り血管の閉塞は有用である。前記段落に記載したように、その血管の圧力を増加させる前に、血管を遮断することによって、哺乳動物のその他の血管及び組織における圧力を最小限にすることができる。本発明の組成物を供給される血管の閉塞によって、更に、その哺乳動物の循環系又は哺乳動物のその他の組織にとって利用可能のその組成物の量を最小限にすることができる。組成物が、もしも哺乳動物の循環系に供給されるならば有害となるであろう一定量の血管透過性促進剤又は血管拡張剤である場合には、血管に対する組成物のゼクエストレーションが有効であり、これは、組成物をその血管に供給前にその所望の血管を閉塞することによって達成することができる。もしも閉塞状態が数分間以上続く場合には、その血管に対して酸素輸送剤を供給することも有用である。更に、血管透過性促進剤、血管拡張剤、又はそれらの両方が無害なレベルにまで代謝されるまで、血管の閉塞を継続することも有効であるかもしれない。
【0082】
或いは、本発明の組成物の血管への供給後に、その血管に対して除去剤を供給することができる。この除去剤は、実質的に、前記血管透過性促進剤を含まず、好ましくは、本発明の組成物中に存在したいななる血管拡張剤も含まない。本発明の組成物の供給後に血管に対して前記除去組成物を供給することによって、その血管に供給されたが、代謝又は哺乳動物の組織によって吸収されなかった血管透過性促進剤又は血管拡張剤を希釈又は「洗い流す」ことができる。好ましくは、前記除去組成物は、複数の個々のアリコットで連続的に血管に供給される。
【0083】
特に、本発明の組成物が哺乳動物の血液循環系、又は、肝臓血液流血管を含むその系の一部に供給される場合には、組成物の前記巨大分子アセンブリを封鎖させることが可能な組織を供給する血管を閉鎖することが有効であるかもしれない。たとえば、ここに記載されているように、一時的な肝臓流閉塞によってアデノウイルスのゼクエストレーションが最小化される。前記プリングル操作は、親指によって肝臓に対して血液を供給する二つの主要な血管、即ち、肝動脈及び門静脈、を閉塞することができるように、外科医の人差し指を肝十二指腸間膜の後に位置させるものである。この処置は、ヒトに於いて1歳時から行うことが可能であり、1時間以内の肝臓流入閉塞が許容可能であることが知られている。
【0084】
本発明の方法において、血管を通過する流れを閉塞する方法はいかなる方法も使用可能である。外科医が指圧を与えることによる指による閉塞、止血鉗子の使用、止血帯の使用、血管造影的又はX線造営的に配置されたバルーン等、によって血管を閉塞する、等の様々な閉塞方法が知られている。
【0085】
前記組成物を、哺乳動物の肺臓にではなく、哺乳動物の体血液循環系に供給する事が望まれる場合、本発明の前記方法は、更に、前記血管透過性促進剤を供給する前に、前記哺乳動物を、体外循環系支持装置及び酸素供給装置にかける工程を有する。好ましくは、公知の方法に於いて、心肺装置が使用される。体外循環系支持装置と酸素供給装置によって、哺乳動物の肺への血液流を最小限にし、これによって、その哺乳動物の肺血管から肺への出液が最小化される。
【0086】
ヒトを体外循環系支持装置及び酸素供給装置にかける方法が図5に示されている。この方法に於いて、ECLSポンプ酸素供給装置が、図3に示すようにヒトに挿入された一対のカニューレに接続され、一方のカニューレはヒトの右心房に挿入され、他方のカニューレはヒトの大動脈内に延出している。血液は右心房から引き出され、体外的に酸素供給され、制御された圧力と流量でヒトの体組織(たとえば、大動脈弓又は大腿動脈)に戻される。この方法を使用すると、肺への血液流が最小化され、肺血管から肺の柔組織内への出液が最小化される。図4に図示されているように、ヒトの肝血液流も閉塞される。
【0087】
本発明の前記方法の一つの考案される実施例は、哺乳動物の管外組織に遺伝子ベクターを供給する方法である。この方法は下記の工程を有する。前記組織に関連する血管を、哺乳動物の血管循環系から遮断する。その後、血管に血管拡張剤を供給する。その後、血管の内皮層の透過性を増大させるべく血管に血管透過性促進剤を供給し、前記遺伝子ベクターを血管に供給し、これによって、前記ベクターは血管の内皮層を介して前記組織に供給される。血管内のかん流圧を正常な生理的かん流圧以上に高め、酸素輸送剤を血管に供給する。その後、血管に除去剤を供給する。この除去剤は実質的に前記血管透過性促進剤を含まない。
【0088】
従って、本発明の方法のこの実施例に依れば、管外組織に対する遺伝子ベクターを供給は、前記血管拡張剤の存在、前記血管透過性促進剤の存在、及び、哺乳動物の血管内のかん流圧の増大、によって向上する。更に、前記遺伝子ベクターと両薬剤とは、これらベクター及び薬剤の供給前に於ける、血管の閉塞によって遮断された状態に留まる。血管に対して酸素輸送剤が供給されるので、血管は閉塞状態に留まることができ、前記ベクターと薬剤とは長い時間血管内に留まることができる。又、血管に対して除去剤が供給されるので、哺乳動物の体血液循環が再び形成される前に、余分なベクターと薬剤とが血管から除去され、これによって、これらベクター又は薬剤の、前記血管以外の哺乳動物の体の領域に於ける存在によって引き起こされる望ましくない副作用が最小化される。
【0089】
本発明の前記方法は、本発明の実質的に全ての筋組織に対して遺伝子ベクターを供給するのに使用することができる。該方法は下記の工程を有する。哺乳動物を体外循環支持装置と酸素吸収装置にかける。その後、哺乳動物の血液循環系に血管拡張剤を供給し、血液循環系の血管の内皮層の透過性を増大させるために前記血液循環系に血管透過性促進剤を供給し、遺伝子ベクターを血液循環系に供給する。これによつてね前記ベクターは、血液循環系の血管の内皮層を通って実質的にすべての筋組織に供給される。そして、血液循環系内のかん流圧を正常な生理的かん流圧以上に高める。哺乳動物の肝臓中に於ける前記遺伝子ベクターのゼクエストレーションを低減させるために、プリングル操作を行って、肝臓に対する肝血液流を閉塞させることができる。哺乳動物の内蔵中に於ける前記遺伝子ベクターのゼクエストレーションを低減させるために、完全な内蔵流入閉塞を行うことができる。完全な内蔵流入閉塞は、たとえば、腹腔軸つい骨、上腸間膜動脈、及び下腸間膜動脈を通過する血液流を閉塞することによって可能であり、これを少なくとも15分間維持することができる。これら三つの血管は、たとえば、laporoscopic又は外科処置によって、或いは、大腿動脈にバルーンを通過させることによって、アクセスすることが可能である。
【0090】
哺乳動物の別の重要な実施例は、流体(たとえば、遺伝子ベクターを有するもの)を、その体のその他の筋組織にはほとんど供給せずに、哺乳動物の心筋組織に供給する方法である。この方法は、哺乳動物の心臓循環系を体循環系から遮断する工程を有する。哺乳動物の心臓循環系は、体循環系から、例6に於いてここに記載の方法のいずれかを使用して遮断することができる。ここに記載されているように、本発明の心臓遮断カテーテルを使用する最小侵入性法が好適である。これらの方法は、とりわけ、心筋組織に遺伝子ベクターを供給する目的で使用することができる。遮断された心筋組織に対する遺伝子ベクターの供給を向上させるために、本発明の炎症調整物質を心臓内に使用して、心臓循環系と体循環系を再び混合させる前に、心臓循環系から洗い流すことができる。
【0091】
本発明の前記装置は、本発明の血液等の、酸素輸送剤を、本発明の血管に対する薬剤の供給前に供給するのに使用可能な酸素供給装置を有する。本発明の酸素供給装置は、中空本体と、該本体の内部と流体連通する液体入口と、ガス室の内部にガスを供給するガス入口と、前記本体の内部から前記ガス室を分離する少なくとも一つのガス透過膜と、前記ガス室からのガスの流出を許容するガス出口とを有し、これによって、前記本体内部とガス室のガスとの間でガス交換が行われる。前記酸素供給装置は、図8及び9に図示したものに類似に構成することができ、ここで、前記ガス透過膜は前記チューブの少なくとも一部の内部で延出するPTFEチューブであり、前記ガス室は前記PTFEチューブの内部である。本発明の酸素供給装置の単純な構造により、それは、低コストに構成することができ、体外酸素供給装置の単用使い捨て部材として扱うことができる。本発明の酸素供給装置のこん単純な構造によって、更に、それを、哺乳動物の血管の内容物の量等の非常に小さな量の液体の酸素供給に適合された寸法で製造することが可能となる。前記酸素供給装置の寸法比率、特に、前記液相を酸素供給装置の本体と接触させることが可能な前記ガス透過膜の表面積、を変えることによって、この酸素供給装置は、実質的にあらゆる液相流量を支持することが可能に構成することができる。このようなプロポーショニング法は当該技術に於いて周知である。
【0092】
本発明の前記酸素供給装置は、酸素供給剤を酸素供給装置の本体を通して通過させることによって使用され、これにより、薬剤が前記ガス透過膜に接触する。前記ガス室に供給される酸素、空気又はその他の気体は、前記ガス透過膜を通って前記薬剤中に拡散可能であり、これを哺乳動物の血管に供給することができる。ここに記載されているように、すべての酸素供給剤を使用することができる。閉塞された血管に供給されるべき薬剤の量が小さい場合には、その中空本体内に比較的少量を有する酸素供給装置が使用され、同様に、酸素供給装置がより大量の薬剤に酸素を供給するのに使用される場合には、それに比例して大きな量を有する酸素供給装置が使用される。
【0093】
機械的循環支持装置及び体外酸素供給によつて前記炎症調節物/血管拡張剤混合物の薬用範囲が広がるという仮設の裏付けは以下の情報に見られる。本発明に於いて、遮断拡散された心臓は、骨格筋に使用されるのと同じヒスタミン及びパパバリン投与量に耐え、これらの投与量は、前記調節物質が体循環が回復される前に洗い流される限り、許容される、ということが判った。もしもこれらの化合物が、支持装置を付けられていない心臓の体循環系に侵入するならば、心臓ショックが発生する。
【0094】
ヒスタミンとパパバリンの投与中に於いて心臓を支持するために、二つの方法が使用可能である。第1に、適当なドナーの心臓は、その治療される哺乳動物の心臓の移植の前に、遮断し、体外で拡散させることができる。第2に、先ず、大腿部循環系に移植を行い、上腹部系の支流血管にカニューレ挿入し、心臓をその場で拡散し、カニューレを前記系から除去する前に、それを、体循環系に薬剤が漏出することを防止する後肢止血帯を使用して洗浄する。これら処置の両方によって、哺乳動物ののその他に対してなんら循環支持装置を使用する必要なく、改造されたポンプ酸素供給装置によって可能な上生理的(supraphysiologic)拡散圧を非常に過渡的に使用することが可能となる。従って、処置される哺乳動物の心臓と肺臓とはまだ正常な状態で機能し続けている。
【0095】
血管に組成物を供給するための装置と方法とは当該技術に追いいて周知であり、たとえば、カニューレ挿入法、注射器取付け中空ボアニードル供給、蠕動ポンプによって係合される一定長のフレキシブルチューブを介した供給、等がある。しかしながら、本発明は、ここに記載の方法を行うためのいくつかの新規で有用な装置を含む。
【0096】
たとえば、本発明は、ヒト等の哺乳動物の大静脈に挿入可能な心臓遮断カテーテルを含む。この心臓遮断カテーテルは以下を有する、
(a)その内部で長手方向に延出する静脈血液流ルーメンと、近端と、遠端部と、近端ポートと、遠端ポートとを備える中空筒状本体、
(b)前記本体に取り付けられた遠端導管シート、そして
(c)前記本体に取り付けられた近端導管シート。
【0097】
前記カテーテルは、哺乳動物の大静脈内に於いて、一方の導管シートが右心房と、腕頭静脈の接合部との間の前記哺乳動物の上大静脈内に位置し、他方の導管シートが、右心房と肝静脈との間の下大静脈内に位置するように、位置決め可能である。この構成によって、右心房の非心臓、非肺静脈循環系からの遮断が可能となるが、右心房を非心臓血液循環系から完全に遮断するためには、奇静脈の閉塞も必要であるかもしれない、と認識される。前記心臓遮断カテーテルの前記遠端ポートは、前記遠端導管シートに対して遠端側に位置する。前記近端ポートは、前記近端導管シートに対して近端側に位置する。心臓遮断カテーテルの近端ポートと遠端ポートとの両方が、カテーテルの静脈血液流ルーメンと連通しているので、腕頭静脈の結合部の血液と、肝静脈の血液とがこれらポートを介して静脈血液流ルーメンと流体連通する。従って、前記心臓遮断カテーテルを患者の大静脈内に設置することによって、心臓循環系が非肺体循環系から遮断される。
【0098】
一実施例に於いて、前記心臓遮断カテーテルは、カテーテルの両ポートから近端部へカテーテル内に於いて長手方向に延出する流体アクセスルーメンと連通する単数又は複数の右心房流体アクセスポートを有する。右心房、右心室、及び肺動脈の近端部の流体を、これらのポートを介して心臓から取出すことができる。このような流体流は、心臓内圧力、前記流体アクセスルーメンに加えられる体外的に発生された吸引力、又はこれらの両方によって駆動することができる。流体アクセスルーメンに吸引力が加えられた時、この流体アクセスルーメンは、そのカテーテルの導管シート(単数又は複数)に関連する吸引ポート(単数又は複数)とも連通することができる(或いは、別の吸引ルーメンを使用することができる)。複数の右心房流体アクセスポートが存在する場合には、それらは、好ましくは、全てのポートが静脈又は心組織によってブロックされる可能性を最小限にするべく、前記カテーテルの二本体の周りに周方向に配設される。
【0099】
前記心臓遮断カテーテルが、心臓循環系に対して液体(たとえば、遺伝子ベクターを含む流体)を供給するのに使用される場合、心循環系を肺静脈から遮断する必要はない。心臓内の弁によって、左心房及び左心室から肺静脈内への流体の逆流が防止される。しかしながら、液体が心臓から肺循環系に入ることを防止するために、肺循環系を、肺動脈を閉塞させることによって、心臓循環系の液体から遮断することができる。肺動脈は、本発明の前記心臓遮断カテーテルと、閉塞装置を取り付けた第2のカテーテルとを使用することによって閉塞可能である。
【0100】
たとえば、前記第2カテーテルは、遠端部と、この遠端部に設けられた導管シートとを有するカテーテルとすることができる。該第2カテーテルは、前記心臓遮断カテーテルの少なくとも一つのルーメン(たとえば、その流体流ルーメン)内に挿入可能であり、そこから、アクセスポートを介して延出する。この第2カテーテルは、該第2カテーテルの前記導管シートが前記アクセスポートから右心室を通って肺動脈の根元に貫通するように患者の心臓内に位置決め可能である。該第2カテーテルは、当該技術に於いて周知の方法を使用して「操作可能」とすることができる。このような方法は、一般に、カテーテルを硬質なフィラメント(たとえば、ワイヤ)と関連つけることを含み、これによって、このフィラメントに対して長手方向の又はトルク力を加えると、カテーテルの先端部が湾曲、変位又は変形するか、あるいは、カテーテル内に湾曲が発生し、これによって、カテーテルを、まっすぐでない通路をより容易に案内することが可能となる。同様に、前記カテーテルは、カテーテルのルーメン内に硬質なフィラメントを挿入することによって案内可能とすることができ、これにより、カテーテルの形状は、その硬質フィラメントの形状となり、カテーテルを、まっすぐでない通路をより容易に案内することが可能とする。
【0101】
前記第2カテーテルは、更に、或いはそれに代えて、患者の心臓の形状に適合した形状(たとえば、ヒトの心臓の内部に適合した形状)にすることができる。第2カテーテルがそのように適合された形状を有する時、該カテーテルは、それをカバーする取り外し可能なシースを備えさせることができ、これによって、このシースは、該シースの取り外し時に、その適合形状を形成するようにすることが可能である。好ましくは、前記導管シートは、肺動脈弁の遠端側の位置に於いて肺動脈内に位置する。肺動脈を、第2カテーテルの導管シートに対して着座させることによって、肺動脈を通過する流体流が閉塞される。前記導管シートは、第2カテーテルの遠端先端部に配置させてもよいし、或いは、該カテーテルの遠端部の周囲を取り囲むように配置して、第2カテーテルの遠端部がその導管シートを超えて遠端側に延出するように配置することも可能である。
【0102】
或いは、前記心臓遮断カテーテルは、その外表面に、前記第2カテーテルの本体の形状に適合されたノッチ又は凹部を有するものとすることができる。図17Bに図示されているように、前記第2カテーテル40Bは、前記心臓遮断カテーテル10から独立的に(かつ、好ましくは、心臓遮断カテーテルの前に)大静脈に挿入可能であり、第2カテーテル40の本体が、大静脈が心臓遮断カテーテルの導管シートに対して着座するポイントに於いてこの心臓遮断カテーテルに形成された前記ノッチ内に嵌入するように、配置することができる。
【0103】
前記第2カテーテルの遠端先端部が前記導管シートを超えて遠端側に延出する場合、前記遠端先端部に、肺動脈のルーメンから流体を引き出すべく前記第2カテーテル内に長手方向に延出するルーメンと連通するオリフィスを設けることができる。前記第2カテーテルは、これに代えて、或いは追加的に、右心房、右心室、肺動脈の根元(即ち、前記導管シートに対して近端側に位置する肺動脈の部分)から流体を引き出すために、第2カテーテル内に長手方向に延出するルーメンと連通する、前記導管シートに対して近端側に位置する単数又は複数のポートを有するものとすることができる。肺動脈から流体を引き抜くことによって、前記導管シートを通過して漏出する可能性のある流体流が最小化され、従って、又、心臓循環系と肺循環系との混合が防止される。右心房、右心室、又は肺動脈の根元から流体を予め抜き取ることによって、更に、両循環系の再混合時に、遮断された心臓循環系に供給された流体と体循環系とが混合されることが防止される。
【0104】
患者の心臓循環系をその患者の静脈及び動脈循環系から遮断するために、本発明の心臓遮断カテーテルを使用して、大静脈を通って心臓に至る体静脈血液流を閉塞し、第2カテーテルを使用して肺動脈血液流を閉塞し、そして、大動脈根元から体動脈循環系への動脈血液流を閉塞することが必要である。大動脈血液流を閉塞するためには、知られている(たとえば、クランプ、縫合線、動脈内バルーン、等)又は今後開発される実質的にいかなる方法も使用することが可能である。患者に対するトラウマを最小限にするために、大動脈導管シートを有し、その導管シートが冠状動脈の上方で、但し、大動脈弓の下方に位置するように(即ち、心臓に対して、腕頭動脈の近端側)、患者の大動脈中に位置決め可能な動脈内カテーテルを使用して動脈血液流を閉塞することが好ましい。大動脈を、前記動脈導管シートに着座させることによって、前記動脈内カテーテルがすえつけられ、大動脈を通る流体流が閉塞される。
【0105】
前記動脈内カテーテルは、好ましくは、その内部に於いて、その近端部から、前記動脈導管シートに対して遠端側に位置する排出ポートへ長手方向に延出する液体アクセスルーメンを有する。この液体アクセスルーメンに供給された流体は、前記動脈内カテーテルを通過してね心臓又は大動脈(その動脈内カテーテルがすえつけらた時の前記排出ポートの位置に応じて)に流入する。左心室又は動脈根元に供給された流体は、そこから、冠状動脈に流入し、更に、そこから心臓内のより小さな血管に流入する。
【0106】
前記動脈内カテーテルは、更に、その内部に於いて、その近端部から、前記動脈導管シートに対して遠端側に位置する左心室ベントポートへ長手方向に延出するベントルーメンを備えることができる。その内部に前記左心室ベントポートを有するカテーテルの部分は、オプションとして、すえつけられた動脈内カテーテルに対して延長可能に構成し、これによって、この部分を前記左心室ベントポートを超えて左心室内へと延長可能とすることができる。オプションとして、前記排出ポートと左心室ベントポートとは、前記動脈内カテーテルのすえつけ時に於いて、両方のポートが左心室内に位置するか、若しくは、排出ポートが動脈根元に位置し、左心室ベントポートが左心室に位置する、ように相対的に固定位置に配置することができる。左心室ベントポートから流体を引き抜くことによって、二尖弁を介した流体の逆流を最小化し、肺静脈への流体の逆流を防止することができる。
【0107】
ここに記載のカテーテルの導管シートは、当該技術に於いて周知のように、いかなる形状のものであってもよい。これら導管シートは、管外部材の必要性無く血管を閉塞する部材(たとえば、バルーン)とすることができ、或いは、それらは、血管を導管シートに着座させる管外部材(たとえば、管外クランプ又は係蹄)との協動で血管を閉塞させるように構成された部材(たとえば、カテーテル本体の隆起部)とすることができる。具体的な導管シートとしては、非限定的に、バルーン、カテーテル本体の隆起部、カテーテル本体の膨張可能部、カテーテル本体の凹部、カテーテル本体のラフ又は不規則部、一対の近接離間配置された隆起面、等が挙げられる。バルーンが使用される場合には、カテーテルが、そのバルーンを流体(たとえば、空気又は燐酸緩衝生理食塩水)によって膨張させるために、バルーンの内部と連通する膨張ルーメンを有することが重要である。前記カテーテルは、更に、導管シートに関連付けられた単数又は複数の吸引ポートを備えることができ、これによって、この吸引ポート(即ち、吸引ルーメン)に吸引力を加えると、その内部にカテーテルが位置する血管の壁が前記導管シートに対してより強固に着座される。これら導管シートの重要な特性は、それらが、支持を供給することであり、これによって、管外部材(たとえば、係蹄又はクランプ)とは独立的に、又は、それとの協動で、血管を閉塞させることができる。
【0108】
本発明の前記カテーテルは、更に、単数又は複数の検出可能な印(indicia)を備えることができ、これによって、これらカテーテルの患者の体内に於ける位置決めと案内が容易になる。これらの印は、非限定的に、螢光透視法、X線写真術、気管内超音波心臓検診法、又は音波ホログラフィー法の公知の画像化技術のいずれかを使用して検出可能な印とすることができる。このような印の使用は当該技術に於いて周知である。この印は、好ましくは、先端部、導管シート、ポート、オリフィス、等のカテーテルの特徴部分の近傍に配置される。
【0109】
ここに記載のカテーテルを製造するのに使用される材料の種類は重要ではない。ここに記載のカテーテルは、管こう内カテーテルの製造用に現在知られている、又は、開発されている実質的にいかなる材料からも製造することができる。そのような材料としては、たとえば、ポリエチレン、酢酸ビニルから成るグループから選択される生物学的適合材、酢酸ビニルを含むコポリマ、エチレン酢酸ビニルコポリマ、ポリ塩化ビニル、アクリレート、アクリレートを含むコポリマ、ポリメチレンメタクリレート、ポリエチレンメタクリレート、ポリメタクリレート、エチレングリコールジメタクリレート、エチレンジメタクリレート、ヒドロキシメチルメタクリレート、ポリウレタン、ポリビニルピロリドン、2−ピロリドン、ポリアクリロニトリルブタジエン、ポリカーボネート、ポリアミド、フルオロポリマ、ポリふっ化ビニル、ポリテトラフルオロエチレン、ポリテトラフルオロエチレンとポリふっ化ビニルのコポリマ、ポリスチレン、スチレンアクリロニトリル、スチレンアクリロニトリル、アクリロニトリルブタジエンスチレンを有するコポリマ、アクリロニトリルブタジエンスチレンのコポリマ、ポリメチルペンタン、ポリスルフホン、ポリエステル、ポリイミド、ポリイソブチレン、ポリメチルスチレン、シリコーンゴム、ポリ塩化ビニルエラストマ、ポリオレフィンエラストマ、ウレタンベースエラストマ、ラテックス、及び合成ゴム、がある。
【0110】
「ワイヤ巻き」カテーテル(即ち、比較的硬質のフィラメントがそのカテーテルの壁に通常は埋設されたカテーテル)の使用が考察される。カテーテルの捩じれ又は(たとえば、吸引力による)挫折を防止するために、知られている又は、今後開発されるいかなるその他の方法も使用可能である。
【0111】
奇静脈と、下大静脈との間の接合部の部位は、個人個人によって大幅に異なることが知られている。奇静脈が大静脈に合流する位置に応じて、心臓循環系を体循環系から遮断するために、奇静脈を閉塞することが必要かもしれない。奇静脈と大静脈の接合部の位置を測定する方法(たとえば、血管造影法)は周知である。もしも奇静脈が、前記心臓遮断カテーテルの導管シートに着座された上大静脈と下大静脈との位置の間に位置するポイントで大静脈と合流しているのであれば、その場合には、心臓循環系に対して炎症調節剤(単数又は複数)を供給する前に、奇静脈を閉塞させることが必要である。奇静脈は、血管を閉塞させる実質的にいかなる方法によっても閉塞させることができる。たとえば、それは外科的に結紮、クランプ、又は止血することができ、或いは、バルーンカテーテルを、心臓遮断カテーテルのアクセスポートを通して奇静脈内へとネジ込み、このバルーンを膨張させてもよい。
【0112】
ここに記載のカテーテルの最初の実施例は、遺伝子ベクターを体筋組織ではなく心筋組織に対して特異的に供給する目的で、心臓循環系を体循環系から遮断することを可能とするように構成されたものであったが、本発明の装置が、その他多種多様な目的のためにも使用可能であることは明白である。更に、比較的小さな改変によって、本発明のこれらカテーテルは、更に多様な目的のための使用することができる。
【0113】
たとえば、本発明の心臓遮断カテーテルは哺乳動物(特にヒト)の大静脈からヒトの右心房内に通過する静脈血液流を阻止するように構成されたものであるため、このカテーテルは、右心房への静脈血液流が望ましくない様々な状況に於いて使用することが可能である。ここに記載された心臓バイパスに加えて、そのような状況としては、非限定的に、開胸、及びその他の侵入性の低いthoracic(特に、心臓)な外科処置が挙げられる。
【0114】
本発明の心臓遮断カテーテルは外科患者の大静脈内にすえ付けられるものであるため、大静脈を通る静脈血液流を、分岐、最小化又は閉塞するために前記心臓遮断カテーテルを使用することによって、解剖学的に大静脈近くに位置する部位の視認性を、従来の外科的処置と比較して、改善することができる。更に、本発明の心臓遮断カテーテルは、心筋を切開する形成することなく、それを介して外科医が、心臓の静脈キャビティー(即ち、右心房、右心室、肺動脈、冠静脈洞)の内部に、装置(たとえば、カテーテル、小さな外科器具、等)、組成物(たとえば、薬剤組成物、画像形成剤、遺伝子ベクター、等)を供給できる単数又は複数のアクセスポートを有するものとすることができる。本発明の心臓遮断カテーテルが有利に利用可能なその他の外科処置としては、本発明の開示に鑑みて当業者にとって明らかなように、非限定的に、僧帽弁外科手術、三尖弁の修復、心房中隔欠損の治療、及びその他の心臓障害、が挙げられる。たとえば、本発明の心臓遮断カテーテルは、外科手術部位に挿入される一対の単段カニューレの代りに使用することができ、これによって、外科医に対して、その手術部位のよりすっきりした視界を提供し、その部位に於いて必要な切開部の数を低減させる。
【0115】
本発明の心臓遮断カテーテルは、様々な公知の動脈内カテーテル(そして、オプションとして、様々な奇静脈オクルダー)と併用されることによって、哺乳動物の心臓循環系を、非心臓、非肺体循環系から遮断することができる。更に、ここに記載されているように、肺動脈を通る流体流を閉塞させるために肺内動脈カテーテルを使用して、心臓循環系を、哺乳動物の肺循環系からも遮断することができる。このような方法は、開業医に、非心臓、非肺体循環系、心臓及び肺の循環系の組み合わせ、又は、遮断された心臓循環系に、特定的に薬剤を供給することを可能とする。当業者は、適当な薬剤、及び、それらをこれらのコンパートメントに供給する適当な状況を選択することができる。
【0116】
従って、「心臓遮断カテーテル」という用語は、これらのカテーテルの使用が非心臓、非肺循環系からの心臓循環系の完全な遮断が望まれる状況に限定するものであるいとうことを意味するものではない。たとえば、該心臓遮断カテーテルは、心臓循環系を遮断することなく、右心房から大静脈血液流を転送するために動脈内カテーテルを使用することなく使用することができる。
【0117】
本発明の心臓遮断カテーテルの重要な実施例が図21に図示されている。この実施例に於いて、心臓遮断カテーテルは、ここでは、上大静脈戻りカテーテル90と下大静脈戻りカテーテル100とされた、一対のカテーテルを有する。これらカテーテルはそれぞれ、その遠端部近くに設けられた導管シート92,102と、静脈血液入口ポート96,106と、該静脈血液入口ポートからカテーテルの近端部へと血液を搬送するべくその内部に於いて長手方向に延出する静脈血液流ルーメンとを有する。
【0118】
このルーメンは、オプションとしてポンプ、酸素供給装置、等の外部装置に接続することができる。図21に図示されているように、前記静脈戻りカテーテルの一方又は両方に、アクセスポートからカテーテルの近端部へとその内部に長手方向に延出するアクセスルーメンを備えさせることができる。該アクセスポートは、図21に示されているように、カテーテルの遠端先端部に設けることができるが、或いは、それ以外の場所に設けることもできる、但し、好ましくは、カテーテルの遠端部に設けられる。組成物又は装置(たとえば、ここに記載されている第2カテーテル)を、前記アクセスルーメンとアクセスポートとを介して、そのアクセスポートの位置に応じて、患者の心臓、又は、患者の大静脈の一部に挿入することができる。
【0119】
前記アクセスポートは、好ましくは、前記アクセスルーメン内、オプションとして前記アクセスポート、に、配設された貫通可能シールを備える。この貫通可能シール104は、前記アクセスルーメンに沿って遠端方向に装置又は組成物の通過を許容するが、カテーテルの遠端部から近端部に向かう方向に於ける流体流は許容しない。単使用又は再使用可能シール等、様々な貫通可能シールを使用することができる。たとえば、この貫通可能シールは、ワックス、パラフィン、又は、ゴム隔膜、又は単数又は複数の膨張可能バルーンとすることができる。バルーンが貫通可能隔膜として使用される場合、それは、好ましくは、カテーテル内のその他の膨張ルーメンとは別の膨張ルーメンに接続され、更に、好ましくは、前記アクセスルーメンを通る組成物又は装置の通過又は移動を許容し、膨張されて近端側の流体流を阻止する。
【0120】
たとえば、図19Bには、本発明の心臓遮断法に於ける、すえつけられた上大静脈戻りカテーテルとすえつけられた下大静脈カテーテルとの使用が図示されている。この図に示されているように、前記上大静脈戻りカテーテルは、患者の右頚静脈を介してすえつけられ、下大静脈戻りカテーテルは患者の右大腿静脈を介してすえつけられている。これら両大静脈戻りカテーテルは、体外血液酸素供給装置の十脈肢に接続され、下大静脈戻りカテーテルは、心臓から流体を収集し、該下大静脈戻りカテーテル内に於いて長手方向に延出するアクセスルーメンを介して体外流体回路の静脈肢へそれを転送する、その導管シートに対して遠端側に位置するアクセスポートを有する。
【0121】
同様に、本発明の心臓遮断カテーテルは、患者の大静脈からの静脈血液の吸収を向上させるべく、標準式大腿静脈又は頚静脈カテーテルと併用することができる。これは、患者の静脈解剖学的構造が、のその患者の大静脈から静脈血液を効率的に除去するのに十分な大きさを有する心臓遮断カテーテルの使用を許容しない場合に、特に有利である。そのような場合、心臓遮断カテーテルは、患者の大腿静脈又は頚静脈いずれかを介して、ここに記載されているように(即ち、一つの導管シートを上大静脈にセットし、他方を下大静脈にセットし、カテーテルをこれら二つの導管シート間に延出させて)すえつけられ、前記標準式カテーテルは、別の静脈、好ましくは、心臓遮断の遠端部がすえつけられた静脈、にすえつけられる。前記静脈血液吸収ルーメンと、前記標準式カテーテルの遠端部のポートと流体連通するルーメンとの両方が、体外酸素供給装置の静脈肢に接続される。患者の静脈血液がその酸素供給供給装置に供給可能な速度が、これによって高められる。
【0122】
ここに記載のカテーテル、特に、本発明の前記心臓遮断カテーテル、は、本発明の心臓をその本発明の体循環系から遮断するための外科キットとして提供することができる。このようなキットは、たとえば、以下を備えることができる、
(a)本発明の心臓遮断カテーテル、
(b)前記哺乳動物の肺動脈を閉塞させるべく前記心臓遮断カテーテル内に挿入可能な第2カテーテル、そして
(c)哺乳動物の大動脈を閉塞させる動脈内カテーテル。
前記キットは、更に、哺乳動物の心臓循環系を遮断するため、又は、ここに記載の方法を実行するため、に有用な追加の組成物又は化合物を備えることができる。そのような追加の組成物及び化合物としては、非限定的に以下が挙げられる。
(d)哺乳動物の体循環系を体外血液酸素供給装置に接続するための単数又は複数のカニューレ、
(e)前記心臓心臓カテーテルから静脈血液流を引き出し、前記カニューレの動脈血液流ルーメンに血液を供給するポンプ、
(f)哺乳動物から取出された血液に酸素供給する血液酸素供給装置、
(g)奇静脈オクルーダ(たとえば、止血帯、クロスクランプ、バルーンカテーテル、又は止血用具)、
(h)血管透過性促進剤(たとえば、ヒスタミン)又は血管拡張剤(たとえばパパバリン)等の炎症調節物質。
【0123】
定義
或る種の用語は以下のように定義される。
【0124】
「管外組織」とは、高血管透過性条件下に於いて血管からの出液がその組織に接触することが可能な血管の十分近傍に位置する組織をいう。たとえば、高度に導管化された、筋組織は、筋細胞が血管の近傍に位置し、それら血管からの出液が筋細胞に説職可能であるため、管外組織である。
【0125】
「血管透過性促進剤」とは、哺乳動物、好ましくは哺乳動物、の血管に供給された時に、血管の内皮の浸透性を、その血管内の物質が内皮層を通過できる程度に高める、組成物である。
【0126】
「血管拡張剤」とは、哺乳動物、好ましくは哺乳動物、の血管に供給された時に、その血管のルーメン径を増大させる組成物である。換言すると、血管拡張剤は、哺乳動物の血管に投与された時、血管の内径を増加させる。
【0127】
血管内の「かん流圧」とは、血管のルーメン内の流体と、その血管の周囲の流体との間のピーク圧力差を意味する。血管内のピーク圧は、哺乳動物の心臓の鼓動によって、その血管を通して血液流を駆動する力に対応するもの、と理解される。
【0128】
血管内の「正常な生理学的」かん流圧とは、休息状態にある健全な哺乳動物の血管内のかん流圧を意味する。
【0129】
「酸素輸送剤」とは、液体又は溶液状態である時に、酸素分子(O2)を捕捉し、その酸素分子を、ヘモグロビンやミオグロビン等の生物酸素キャリアに供給することができる組成物を意味する。たとえば、様々な人造血液代替物や過フルオロ化合物液は、酸素輸送剤である。
【0130】
「薬学的許容可能キャリア」とは、本発明の組成物が混合可能で、その混合後、本発明の組成物を、哺乳動物、特に哺乳動物、に投与するのに使用可能な化学的組成物を意味する。
【0131】
血管透過性促進剤の「上生理学的レベル」とは、休息状態にあり正常な循環系ホメオスタシス状態にある哺乳動物に存在する物質のレベルである。
【0132】
二つの核酸配列を「作動リンクされた」と記載することによって、1本鎖又は2本鎖核酸moietyがこれら二つの核酸配列をそれぞれ有し、かつ、それら二つの配列が、その核酸moiety内に於いて、前記二つの配列の少なくとも一方が、他方に基づいてとくちょうつけられる生理的作用を発揮することができる、ということを意味している。
【0133】
「巨大分子アセンブリ」とは、複数の分子が、上生理学レベルの血管透過性促進剤の不在状態に於いては、哺乳動物、好ましくは哺乳動物、より好ましくはヒトの血管の内皮層を通して通過することが出来ないほど十分に大きいような、単数又は複数複数の分子を意味する。たとえば、巨大分子アセンブリは、1本鎖たん白質、多重結合たん白質、リポソーム、直線状の核酸、アデノウイルス、ピコルナウイルス、又はアデノ関連ウイルス等のウイルス、又は、プラスミド又はウイルスベクター等の遺伝子ベクター、等でありうる。又、たとえば、前記巨大分子アセンブリは、記載されているような(ラゴット(Ragot)他,1993,Nature361:647−650)、ヒトミニジストロフィン遺伝子を有するアデノウイルスとすることができる。更に、たとえば、前記巨大分子アセンブリは、そのプラスミドが全長ジストロフィンcDNAを有する点においてモディファイされたプラスミドpAdDeltaRSVとすることでき(ケーニング(Koening)他,1988,Cell53:219−228)、ここで、前記pAdDeltaRSVプラスミドは、前記ジストロフィンcDNAに作動リンクされたRSVプロモータであるpBSA−2ベクターバックボーンを有し、前記プロモータcDNAは、アデノウイルス5‘及び3’−ITR配列に挟まれている。
【0134】
「遺伝子ベクター」とは、前記プロモータ/調節配列に作動リンクされた遺伝子の発現に必要なDNA配列を意味する。いくつかの場合に於いてねこの配列は、コアプロモータ配列とすることができ、その他の場合に於いては、この配列は、組織特異的に前記遺伝子の発現に必要なエンハンサ配列及びその他の調節エレメントも有するものとすることができる。
【0135】
「体外循環系支持装置」とは、哺乳動物の心臓からの助けを借りずに哺乳動物の循環系の全部又は一部を通して、その哺乳動物の血液を循環させることができる機械装置を意味する。たとえば、当該技術に於いて周知の心肺装置は、体外循環系支持を提供するのに有用な装置である。
【0136】
「venorrhaphy」とは、たとえば、出血無しで、静脈の開通性を維持するように静脈の切開部を縫合することによる、静脈の外科的修復を意味する。
【0137】
特に記載のない限り、カテーテルの「遠端」部とは、そのカテーテルの使用中に於いて患者の体内にあるカテーテルの端部を意味する。カテーテルの「近端」部とは、カテーテルの使用中に於いて患者の体の内部にないカテーテルの端部のことである。前記カテーテルは、一般に一つの遠端部と一つの近端部とを有するものと理解されるが、但し、特に、その近端部に於いて、フォーク状又は分岐した、カテーテルの使用も同様に認められる。
【0138】
ルーメンは、そのルーメンの長手軸心(ルーメンがカテーテルのポートと連通する場合は含まない)がカテーテルの長手軸心に対してほぼ平行である場合に、そのカテーテル内に於いて「長手方向に延出する」。
【0139】
「非侵入性検出可能マーカ」とは、カテーテルのポート又はその他の特徴部分等、カテーテルに使用されて、患者の体内に於けるマーカの位置を、患者の組織の穿孔又は切開を必要としない方法によって測定することが可能な、組成物である。
【0140】
第1カテーテルは、血管のルーメン又は第2カテーテルのルーメン内に於いて、その第1カテーテルの形状に依り、第1カテーテルを前記ルーメン内に於いて移動可能である場合に、そのルーメン内に「挿入可能」である。第1カテーテルが第2カテーテルのルーメン内に「挿入可能」である場合、これら二つのカテーテルが分離可能であることは必要でない(即ち、第1カテーテルは第2カテーテルのルーメン内に恒久的に配置することができる)。
【0141】
物質又はルーメンは、別の物質又はルーメンと、流体がその物質又はルーメンから、破断又は物理的障害無しでその他方の物質又はルーメンへと流れることができる場合に、その別の物質又はルーメンと「流体連通」状態にある。
【0142】
「ロッド」とは、円形又は非円形(たとえば、楕円、四角、三角又は不規則)の断面を有する長手部材を意味する。ロッドは、そのな内部に長手方向に延出する単数又は複数のルーメンを備えることができる。
【0143】
カテーテル、ロッド又は導管シートの一部は、もしもその部分の周部(非円形の断面のカテーテル、ロッド及び導管シートを含む)が増加又は減少可能である場合に、「膨張可能」とされる。
【0144】
流体「酸素供給装置」とは、その流体中に溶解している酸素の濃度を増加させる装置のことである。
【0145】
「ポンプ」とは、すべての流体排出装置のことである。
【0146】
薬剤は、もしもその薬剤を、疾患を患う哺乳動物の少なくとも一つの組織への供給によって、その哺乳動物がその疾患の重度又は、その疾患の症候の頻度の低下を経験する場合に、「治療作用を有する」。
【0147】
「大静脈」とは、哺乳動物の上大静脈と下大静脈とを、それぞれ個々に、又はそれらを集合的に記載する形容詞である。
【0148】
「ノッチ」は、もしもそのノッチの内部形状が、体がノッチの長手軸心に沿って長手方向に移動可能である場合に、その体に「フィットするように適合されている」。
【0149】
「画像形成剤」とは、哺乳動物の体内のキャビティ、組織又は表面に供給された時に、そのキャビティ、組織又は表面の検出を容易にする組成物である。様々な画像形成剤が知られており、文献に記載されている。たとえば、ガンマ放射線又は蛍光する組成物や等のその存在が直接的に検出可能な組成物や、公知の検出装置を使用して検出可能な組成物を使用することができる。
【0150】
本発明を、以下の例を参照して説明するが、これらの例は、例示の目的のみのために提供されるものであり、本発明はこれらの例に限定されるものと解釈されてはならず、むしろ、それは、ここに提供される教示内容により明らかとなるすべてのバリエーションを含むものと解釈されるべきである。
【0151】
例1: アデノウイルスを微小血管バリアを介して対流輸送することによって体遺伝子転移を促進する
過渡的な肝臓流入の閉塞によって、不要なウイルスのゼクエストレーションが最小化されるという仮説を裏付けるデータが提供される。その中央循環系に組換えアデノウイルスを投与したラットに実験的プリングル操作を行った。これによって、プリングル操作を行わなかった対照哺乳動物に対して、肝臓染色強度が大幅に低減した。
【0152】
次に、この例に提示される実験に使用された方法を説明する。
【0153】
AdCMVlacZとされる前記E1,E3欠失組換えアデノウイルスの構造と増幅は既に記載されている(コザルスキー(Kozarsky)他、1993,Som.Cell Molec.Genet.5:449−458)。組換えアデノウイルスを、ラットに対して、ラットの体重グラム当たり約109粒子の総投与量で投与した。10%(v/v)のグリセロールを有する前記ウイルス株の凍結アリコットを、注入直前に解凍し、PBS中で1:5に希釈し、ミリリットル当たり1012のタイターを得た。哺乳動物を体重キログラム当たり75ミリグラムのケタミンと、体重キログラム当たり5ミリグラムのキシラジンの前肢への筋肉注射によって麻酔した。C57B110マウスとFisher355ラットを使用した。
【0154】
この例に提示される例は、毛細血管のルーメンから筋肉組織間質へのアデノウイルスの懸濁液の対流輸送に於ける違いを調べるためのものであり、これらの違いは、使用された哺乳動物の年齢の違い、前記哺乳動物に対して懸濁液を供給する方法、懸濁液の組成、又はこれらの要因の組み合わせ、から生じたものである。体重グラム当たり約5x1010のAdCMVlacZを、これらの実験の全ての哺乳動物に投与した。これらの実験に於いてAdCMVlacZを投与するために使用されたマイクロピペットとマイクロカニューレの流出抵抗に依り、適用された注入圧は、常に、血管床に於いて達成される圧力よりも遥かに高いものである、と理解される。これらの装置を通って流体流を駆動するために制御された圧力を使用することによって一貫性を維持した。これらの実験に使用された哺乳動物から得られた組織標本を、検死に於いてPBS中での0.2%(v/v)のグルタールアルデヒド、2%(v/v)のパラフォルムアルデヒドによるかん流−固定後、記載されているように(セインズ(Sanes)他、1986,EMBOJ.5:3133−3142)β−ガラクトシダーゼ活性に関して、whole mount染色した。これらの実験の結果は表1に要約されている。
【0155】
AdCMVlacZを、表1のシリーズAの新生ラットのそれぞれに、ガラスマイクロピペットの先端を使用してそのラットの眼窩後方静脈にウイルスベクターを注射することによって、投与した。ここで、ウイルスベクター懸濁液流は、フットペダル制御のピコポンプによって駆動された。
【0156】
AdCMVlacZを、表1のシリーズBの新生ラットのそれぞれに、ガラスマイクロピペットの先端を使用してそのラットの総大腿動脈にウイルスベクターを注射することによって、投与した。ここで、ウイルスベクター懸濁液流は、フットペダル制御のピコポンプによって駆動された。
【0157】
AdCMVlacZを、表1のシリーズCの2週齢ラットのそれぞれに、腹壁切開と、肝臓流入血管への閉塞クランプ設置直後に、投与した。前記ウイルスベクターは、大腿静脈に注射され、前記クランプを、取り外し前に30分間放置した。
【0158】
表1のシリーズDの2週齢ラットは、シリーズCの哺乳動物に対する対照哺乳動物として作用することを意図したものであった。これらシリーズDのラットには、シリーズCのラット同量のウイルスベクターを注射したが、これらシリーズDのラットには肝臓流入閉塞は行わなかった。
【0159】
表1のシリーズEの成体ラットは、大腿動脈及び静脈遮断を受け、3−0プロリン止血帯を、その近位側腿のレベルに設置た。体重キログラム当たり100単位のヘパリンを、前記各ラットの血液循環系に筋肉注射し、それぞれの大腿動脈を、そのルーメンが、前記動脈に挿入されなていないチューブの端部に取り付けられた30ゲージのニードルのルーメンと流体連通された、加熱テーパポリエチレンチューブ(PE10,Becton Dickinson,Sparks,MD)を使用してカニューレ挿入した。前記止血帯の締付け後、微小血管クランプを設置して、大腿血管を通過する血液流を閉塞した。前記チューブと動脈へのAdCMVlacZ懸濁液と、1ミリリットルの「追加(chase)」量のPBSとを、標準平方インチゲージ圧当たり20ポンドで連続的に前記ウイルスベクター懸濁液を供給する制御された圧力供給装置によって駆動した。前記クランプと止血帯とを、45分間その位置に維持し、その後、それらを除去し、11−0縫合糸(Sharpoint,Reading,PA)を使用して動脈切開部を修復した。前記小さな鼠蹊部の切開部を、吸収可能縫合糸を使用して閉じた。
【0160】
表1のシリーズFのラットは、制御圧力供給装置が、ウイルスベクター懸濁液を標準平方インチゲージ圧当たり80ポンドで連続供給したことを除いては、シリーズEのラットと同様に処理された。
【0161】
表1のシリーズGのラットは、シリーズBのラットに関して記載したように大腿動脈注射を行ったが、但しここでは、大腿動脈を通過する血液流を閉塞させる近位腿止血帯とクランプとを、ウイルスベクターの供給の前に使用した。100マイクロリットルのウイルスベクターを、ガラスマイクロピペットを使用して供給し、その後、1ミリリットルのアリコットの塩水を供給した。これらのアリコットを、動脈内で5分間滞留させた。
【0162】
表1のシリーズHのマウスは、シリーズGのマウスと同様に処置されたが、但しここでは10マイクロモルのヒスタミン又は0.3ミリグラムのパパバリンのいずれかを有する100マイクロリットルの溶液を、前記ウイルスベクターの注入直後に、前記動脈に供給した。
【0163】
表1のシリーズIのマウスは、シリーズHのマウスと同様に処置されたが、但しここでは、ヒスタミンとパパバリンの両方を各マウスに投与した。
【0164】
表1のシリーズJのマウスは、シリーズIのマウスと同様に処置されたが、但しここでは、止血帯の除去直前に、各マウスに対してvenorrhaphyを行った。
【0165】
表1のシリーズKのラットは、大腿動脈及び静脈遮断を受け、その近位腿のレベルに3−0プロリン止血帯がセットされた。後肢循環を、前記動脈に、pH7.4のPBS500マイクロリットル中に150マイクログラムのパパバリン、又は、pH7.4のPBS500マイクロリットル中に10ミリモルのヒスタミンを500マイクロリットル含む組成物を注入することによってプライミングした。500マイクロリットルの前記組成物中に懸濁された6x1010のAdCMVlacZ粒子を、前記動脈に注入し、その後、標準平方インチゲージ当たり80ポンドに維持されたタンクから駆動された1ミリリットルの追加量のPBSを注入した。前記クランプと止血帯は、総時間5分間、その場所に維持され、その後、肢循環系を、3ミリリットルのPBSで洗浄した。
【0166】
表1のシリーズLのラットは、組成物がヒスタミンとパパバリンとの両方を前述した濃度で含んでいたことを除いて、シリーズKのラットと同様に処置された。
【0167】
表1のシリーズMのラットのそれぞれに於いてシリーズKのラットに於いてと同様に肢かん流を行った。但しここでは、二つの重なる止血帯を経筋配置するとともに、表皮下上腹部血管を介する血管アクセスによる完全な遮断を可能にするべく互いに重なる二つの止血帯を使用した。これには、第2カテーテルを、この側支管と伏在静脈との間の結合部において静脈弁を介して進行させることが必要であった。更に、前記組成物は、ヒスタミンとパパバリンの両方を前述した濃度で有し、前記止血帯の除去の直前に各ラットに対してvenorrhapnyを行った。
【0168】
光学的コントラストを提供する目的で、その胃がミルクで充満されていることを確実にするために給餌した後、新生マウスの子を麻酔した。それぞれのマウスの皮膚を、腹壁に渡って切開し、上腹壁動脈に分布に於ける直腹筋へのアクセスを提供するべく側方に反射させた。約100倍の倍率の解剖顕微鏡を通して、単赤血球が、骨格筋毛細管を通って一列に並ぶことによって、容易に可視化された。PBSに溶解されたヒスタミン、パパバリン又はそれらの両方が、前記毛細管に局所的に塗布された。取り付けられたカメラによって、時間線に対してビデオ記録を行った。閉介筋の遠端部に於いて潅流された成体マウスと成体ラットに於いても、それらが、近位脛節上に重なり、ここでも類似の観察が行われ、ここでも、薄い筋肉に対する光コントラストが最適化された。
【0169】
次に例1に提示されたこれらの実験の結果を説明する。
【0170】
組換えヒトアクセスベクターAdCMVlacZ(これは、約70ナノメータのStoke径を有する;スチュワート(Stewart)他、1993,EMBO J.12:2589−2599)が、イン・ヴィヴォで哺乳動物血管の内皮バリアを横切る能力を評価するために、微小血管ダイナミクスの研究用の新規なシステムが使用された。微小血管透過性に対する相乗効果を有するいくつかの介入処置が明らかになり、前記成体ラット後肢に於ける大半の筋組織への効率的な遺伝子転移のための戦略が開発された。哺乳動物筋肉組織間の類似性を考慮すると、本システムが、全ての哺乳動物、あるいは恐らく全ての哺乳動物に於いても同様に使用可能であることは明白である。
【0171】
治療用途用に考慮された遺伝子転移ベクター間で、組換えアデノウイルスが、新生マウス中の筋肉注射後に於ける極めて効率的な局所的遺伝子転移により、特記される(クアンティン(Quantin)他、1992,Proc.Natl.Acad.Sci.89:2581−2584;アクサディ(Acsadi)他、1994,Hum.Molec.Genet.33:579−584)。いくつかのヒトの疾患用のネズミモデルに於いて遺伝子発現を形質導入するためにねアデノウイルスが使用されている(コザルスキー(Kozarsky)他,1996,Nature Genet.13:54−62,ラゴット(Ragot)他,1993,Nature361:647−650)。前記新生マウスの後肢の筋肉のマスは、約30ミリグラムの組織を有する。新生マウス筋組織の未成熟細胞外マトリクスに、数ミリメータに渡ってアデノウイルスを拡散させることによって、初期筋組織の大半の形質導入が可能となる。しかしながら、より高齢のマウス又はラットに於いては、局所的供給の限界が明らかとなり、それではねアデノウイルスベクターの筋肉注射によって行われる遺伝子形質導入は徐々に低効率となり、注射部位の周囲数立方ミリメータに限定されたままとなる。
【0172】
経静脈アデノウイルスベクター供給によって、主として肝臓へのアクセスが提供され、そこでは、不連続な内皮が、血管空間から実質細胞マスへの遺伝子転移が容易にするものと考えられている(コザルスキー(Kozarsky),1996前出;コザルスキー(Kozarsky)他、1994,J.Biol.Chem.268:13695−13702)。
【0173】
直接注射又は血管内供給によるアデノウイルスベクター供給の欠点は、可能なところに於いては、経内皮供給用に有用なアデノウイルスベクター供給方法を開発することによって解決することができる(たとえば、レイパー(Raper)他、1996,Pancreas12:401−410)。
【0174】
骨格筋の連続的内皮バリアを介するアデノウイルスベクター搬送は、三つの供給コンポーネント、即ち、対流的、拡散的、及び小胞交換供給、の総計として記載することができる(ウェインバウム(Weinbaum)他、1995,Symp.Soc.Exp.Biol.49:323−345)。スターリング(Starling)(1896,J.PHysiol.19:312)、クロー(Krogh)(1919,J.Physiol.52:409)及びパッペンハイマー(Pappenheimer)他(1951,Am.J.Physiol.167:13−28)の古典的研究は、分子寸法と、脂質溶解性が異なる溶質について搬送速度が量化された骨格筋での実験からの関連データを提供している。
【0175】
より大きな巨大分子の振る舞いについてはより最近になって量化され、3万個の孔の内一つだけがそのアデノウイルスの直径の1/4以下の粒子を通過させるのに十分大きい、という2−孔理論が生まれた(リッペ(Rippe)他,1994,Physiol.Rev.74:163−219)。これらのデータの推論から予想されるように、図1a中に於いて筋組織の染色によって確認されているように、経血管投与された組換えアデノウイルスは、骨格筋に対する最小のアクセスしか提供しない。アデノウイルスベクターの血管内投与は、図1bに示された染色パターンによって示され、又、表1に提示されたデータによっても示されているように、浸出のためにStarling力を増大させるべくベクター投与と同時に上生理学的潅流圧を供給することによっては大幅に改善されなかった。これらの結果は、血管内皮が顕著な簡完結性を有するものであることを示し、又、ウイルスベクターの、間質からの筋組織への小胞及び対流搬送の速度は重要ではない、ということを暗示している。これらの結果は、更に、アデノウイルスベクターの経血管投与は、非効率的な体遺伝子転移戦略である、ということも示唆している。
【0176】
【表1】
【0177】
ヒスタミン又はその他の血管透過性促進剤を局部塗布によって再生可能な骨格筋に於ける炎症の病態生理に基づく、別のアプローチを調べた。そのような薬剤の内皮組織への塗布後に於ける隣接する内皮細胞間のギャップの過渡的出現の超微細構造的証拠が存在し、前記ギャップは約1マイクロメータの幅を有する。更に、電子顕微鏡写真によって、直径35ナノメータ以下及びそれよりも大きなキロミクロンのコロイド状HgS粒子がこれらの細胞間ギャップを横切る能力を記録する(マイノ(Majno)他、1961前出)。
【0178】
炎症性出液の誘発されたプロセスによって、血管内皮を介するベクターの対流搬送を向上させることによって、イン・ヴィヴォでの循環系から成体骨格筋へのベクター供給が促進されるであろう、という仮説が立てられた。血管作用調節物質の体副作用は、遮断された肢潅流システムを使用することによって避けられた。表1に提示されたデータによって示されているように、ヒスタミン、パパバリン(強力な内皮独立血管拡張剤;ウェンマーム(Wennmalm),1994,J.Int.Med.235:317−327)と、上生理学的潅流圧の適用の相乗効果によって、全般的に、血管空間から筋組織へ効率的に遺伝子が転送された。
【0179】
これらの操作に応答する遺伝子形質導入の均質性が、図2に図示されており、ここで、成体ラット後肢中の筋組織の大半のXgal染色が複数レベルの倍率で見られる。毛細血管基底板に於けるアデノウイルスよりも小さな粒子の保持が電子顕微鏡によつて記録されているが(マイノ(Majno)他、1961前出)、ここに記載される結果は、このバリアが横断されたことを示している。
【0180】
ヒスタミン、パパバリン及び上生理学的潅流圧を使用する組み合わせ介入処置は、その介入処置が行われた肢の循環系遮断が不完全なものであった場合には致死的であった。しかしながら、肢の循環系遮断が適切であった哺乳動物は、その処置に良好に耐え、正常な歩行状態に戻った。アデノウイルスベクター投与のこの方法によって、筋ジストロフィー等の様々な遺伝子疾患の遺伝子治療のために必須である遺伝子分布の効率性と量とが達成される。
【0181】
図2、パネルBに示されているように、大腿四頭筋の二つの近接する筋肉の組織学的外観は、潅流されなかった組織に於ける人造的染色の不在を示している。図2パネルBに於いてね大腿直筋に対する血液供給を、止血体を使用して閉塞した。ここに記載の結果は、更に、図2、パネルA及びBに示されているように、アデノウイルス拡散に対する筋外膜組織バリアを存在も実証するものである。
【0182】
この例に提示される実験に於いて、図2、パネルC及びDに示されているように、肢血管系に対する遺伝子供給の劇的な減少も銘記された。この観察は、筋組織血管系の内皮細胞が、前記調節物質抽入の過渡的な副作用としてウイルスを吸収するその能力を失ったか、若しくは、間質への流体の対流によって効果的にバイパスされた、ということを示唆している。この観察は、更に、本発明の方法が、その組織を供給する血管(単数又は複数)の内皮細胞によるベクターの大幅な吸収無く、管外組織に特異的にアデノウイルスベクターを供給するのに使用可能である、ということも示唆している。
【0183】
解剖顕微鏡を通してリアルタイムで見られる微小血管潅流を、最初、複数の薬剤を評価するために使用した。10ミリモルのヒスタミンの局所塗布によって、血管拡張が急速に誘発され、局所的潅流が増大し、その後、数秒以内で、毛細管血液停滞が起こった。パパバリン1ミリリットル当たり300マイクログラムの塗布によって、毛細血管が漸増し、局部的潅流が増加した。両方の薬剤の局所塗布によって、毛細管の潅流が長時間維持され、局所的な浮腫の形成が観察された。これらの知見は、これら調節物質の遺伝子投与に対する相乗効果が、パパバリンが前毛細血管抵抗血管の自己調節性又は浮腫誘発閉鎖を克服する能力に関係していることを示唆している。不適切な後肢遮断中に於ける上記調節物質の急性毒性は、その血行力学的副作用に関連している(トム(Thom)他,1995,J.Clin.Oncol.13:264−273)。
【0184】
これら調節物質の血行力学的副作用は、試みられる体遺伝子供給中に於ける中央循環系へのその利用を複雑にするものである(たとえば、アイア(Eyre),1970,J.Pharm.Pharmacol.22:104−109;シルヴァーマン(Silverman)他、1988,J.Appl.Physiol.64:210−217)。更に、循環系をサポートするたのアドレナリンアゴニストの同時使用は、遺伝子供給に対する所望の効果を逆転させ、かつ、又は、特に、心筋症の場合に於いては、心筋損傷を引き起こすかもしれない。
【0185】
ここに記載の血管閉塞技術、又は、その他の当該技術に於いて知られている技術を使用して、前記調節物質の体供給から生じる前記副作用を、最小化又は回避することができる。更に、これらの副作用は、理論的には、調節物質の体注入の前に体外循環支持装置を設置することによって克服することが可能であろう。この点に関して、肝臓による、循環するウイルスベクターの急速な除去が第2の問題として現れる。しかしながら、肝臓流入閉塞による肝臓ウイルス吸収の減少に関する表1に提示されるデータは、腹腔鏡処置等の最小侵入性外科処置によってこの問題を大幅に克服すること可能かもしれない、ということを示唆している。
【0186】
この例に記載した外科的及び薬学的アプローチの提案した組み合わせは、体遺伝子供給のための一般的方法を表わすものである。この方法の臨床的重要性は、その手続きがこの例に使用されたよりも大きな動物に於いていかに良好に耐えられるか、に依存している。この問題は、例3に於いて更に詳細に記載される。
【0187】
例2: 微細血管透過性を向上するのに有効なその他の化合物
ヒスタミン及びパパバリン以外に微細血管透過性を向上させる作用を有する化合物としては、非限定的に、血小板活性化因子、セロトニン、ブラジキニン、及びニトロプルシドが挙げられる。これらの化合物の投与後に誘発される微細血管透過性は、蛍光ラベル化された直径70−100ナノメータのデキストラン粒子の吸収を測量によって評価することができる。
【0188】
ここに記載されたデータに基づき、本発明は以下のように拡張することができる。
【0189】
体遺伝子転移は、ヒトを含む大型の動物に於いて、体外支持装置が設置されることを前提として、炎症剤及び血管拡張剤の組み合わせを使用することによって達成することができる。
【0190】
適切な循環系支持及び酸素供給装置の提供は、相対生長測定、即ち、サイズの異なる哺乳動物の器官機能を支配する数学的関係、に依る。ネズミの心臓と横隔膜の各筋細胞又は繊維は、ヒトの心臓及び横隔膜の速度の約10−15倍の速度で作動している。従って、小さな齧歯動物用の心肺バイパス回路は、ヒトに於いて必要な速度の10−15倍の速度で酸素と血液を輸送しなければならない。ポアズイユの法則によって測定される、流体動的抵抗は、カニューレの壁厚により、速度制限的になる。
【0191】
この問題に対する簡単な解決法は、ヒトに於いて達成可能な流速をモデル化するために十分に大きな動物で実験を行い、小児及び成人の心筋救急ケアマネージメントのパラダイムを使用することである。哺乳動物に於けるカニューレ挿入部位が、流速を支配する。頚動脈及び頚静脈アプローチが、その最小侵入性に依り、更に、それが小児体外膜酸素供給(ECMO)に於いて長年成功裏に使用されてきたという事実に依り、優先的に使用される。必要な場合には、心臓切開手術に使用されているように、大動静脈カニューレ挿入を使用することができる。カニューレ挿入の種類及びポンプの位置、等が図3,4及び5に図示されている。
【0192】
炎症調節物質が新抗原発現に対する免疫応答を変化させるものであるか否かを判定することが重要である。更に、達成される遺伝転移のレベルと、初期介入処置から生じる生理的障害の大きさとの関係を判定することが重要である。筋ジストロフィーの場合、遺伝子投与量の閾値効果が存在することが知られており、もしもこの投与量を達成することが可能でないならば、その処置が有効である可能性は低い。遺伝子発現を駆動するより強力なプロモータ配列を使用することによって、遺伝子転移の低効率を補い、遺伝子治療効果を高めることが可能である。組織特異的発現も、組織特異的プロモータ配列を使用することで可能である。
【0193】
ここに記載の処置を必要とする患者が、一般的な気管内挿管麻酔を受け、現在、体外膜酸素供給用に使用されているように、首部の切開を受け、プリングル操作をタイムリーに行うために腹腔鏡ポートの設置を受けることが予想される。前記ECMO回路を通る流れは、血管拡張剤の注入後に始まり、その後、収縮過多性循環を達成するために必要な流速と追加量とで、ウイルスとその次に炎症調節物質とが注入される。5分程度の短いものでありうる短時間の出液の完了後、ECMOからの急速な離脱を促進するために、血液から、残りの炎症調節物質が除去される。これは、細胞セイバー、直列に接続された単数又は複数の血液ろ過又は血液透析装置、又はその他の回復装置を使用することによって達成されるであろう。その後、患者は、体外酸素供給装置から徐々に離脱される。これまで研究されている哺乳動物モデルに於いて、処置された哺乳動物は、手術後短期間で歩行可能となる。
【0194】
例3: ヒツジに於ける体外循環支持及び血液酸素供給
この例の実験は、マウス又はラットよりも大きな哺乳動物の循環系が、アデノウイルスベクター等の巨大分子アセンブリの供給のためにここに記載の条件下で体外サポート可能であることを確認するために行われた。ヒツジに、心肺バイパスを行い、次に、体重キログラム当たり3.75又は7.5ミリグラムのパパバリンと、体重キログラム当たり25マイクログラム又は125マイクログラムのヒスタミンとを投与した。これらのヒツジの関連生理学的特性を、リアルタイムでモニタした。
【0195】
この例に示されるこれらの実験に於いて使用された材料と方法とを次に説明する。
【0196】
外科処置
ここに記載の体外循環支持システムを、前記哺乳動物が、ヒスタミンとパパバリンの影響下に於いて大量の流体流出に耐えられるように構成した。
【0197】
健全なヒツジに、空気による腸管拡張を最小限にするために、手術の前夜に、1グラムのエリスロマイシンと、1グラムのネオマイシンベースとから成るニコールのprepを経口投与した。これらのヒツジを、水を自由に採らせながら、一晩(即ち、少なくとも12時間)絶食させた。野生動物保護檻を使用した拘束後、これらの哺乳動物を、体重キログラム当たり10ミリグラムのケタミンの筋肉投与によって鎮静させ、体重キログラム当たり30ミリグラムの投与量のペンタバービタルの静脈内ボーラスを使用して麻酔した。それぞれの声帯に、2%(v/v)のリドカインを噴霧し、その後、これらの哺乳動物を、気管内挿管し、機械通気装置に接続した。呼吸速度を毎分20として潮せき量(tidal volume)を、体重キログラム当たり15ミリリットルに設定した。麻酔は、3%(v/v)イソフルランを使用して開始し、1−2%(v/v)イソフルランを使用して維持した。
【0198】
麻酔の深さを、処置全体を通じて15分間隔で哺乳動物の尾を軽く摘まむことによって測定した。もしも鎮痛薬反応が見られた場合には、動物に、5分間、前記イソフルランの百分率を倍にすることによって追加の麻酔を与え、その尾の摘みに対する鎮痛薬反応が無くなった時にだ、元の百分率に戻した。
【0199】
各哺乳動物を、背部横臥状態にし、心電図リード線を末端部に取り付けた。全ての哺乳動物に、ここに記載したカテーテル挿入を行った。心肺バイパスのためのアクセスに加えて、血管空間のリンパ漿に取り代る生理食塩水の拡散のために、麻酔後、カニューレを使用した。全てのケースに於いて、前記哺乳動物は、前記通気装置を生理食塩水拡散の直前、10分間遮断することによって、バルビツール酸塩過量服用後の実験的ポンプ作動後、安楽死させた。
【0200】
右肋骨下切開によって腹膜腔に入り、肝十二指腸間膜を同定し、移動させた。門脈と肝動脈を最終的に閉塞させるために、Rammel止血帯を設置したが、クランプは開口位置に残された。次に、腹部切開の筋膜縁部にタオルクリップを緩く当てた。
【0201】
触知可能な左頚動脈パルスに渡って小さな垂直の切開を入れ、圧力モニタの目的のために動脈カテーテルを設置するのに十分なだけ深くした。次に、右総頸動脈のパルスに渡って長手切開を形成した。この切開は、右外頸静脈と総頸動脈を完全に露出させることを可能にする深さに形成した。29インチワイヤ巻き静脈カニューレを、右頸静脈に入れ、その先端部が右心房内にあると推定される位置に来るまで、注意深く下方に進行させた、ここで、前記推定は、表面の印と、カテーテルが進行された距離とに基づいて行われた。次に、14インチワイヤ巻きカニューレを、右総頸動脈に入れた。両方のケースに於いて、血管カニューレ挿入は、近位及び遠位側制御の達成を前提とした。動脈カニューレを、その先端が動脈根元、大動脈弁の近傍、にあると推定される位置に来るまで進行させた。
【0202】
左外頚静脈に、心脂肪(cordis)ポートによってカニューレ挿入し、その後、Swan−Ganzカテーテルを、その先端部が肺動脈内に来るまで進行させた。次に、肺動脈圧と、中央静脈圧との同時測定を可能とするべく、前記Swan−Ganzカテーテルの適当なポートを圧力トランスデューサーに取り付けた。
【0203】
次に、右鼠蹊部を、触知可能な右大腿動脈パルスに渡って長手方向に切開し、14インチのワイヤ巻きカニューレを、近位側制御ポイントと遠位側制御ポイント間に挿入し、その先端部が右総骨動脈に来るポイントへ動脈流に逆らって進行させた。
【0204】
全てのカニューレが位置固定されると、それらを、7.4のpHが達成されるまで、120ミリモルの塩化ナトリウム、5ミリモルの塩化カリウム、3ミリモルの塩化マグネシウム、24ミリモルの重炭酸ナトリウム、を含む溶液でプライミングされ、5%(v/v)の二酸化炭素、95%(v/v)の酸素、を含むカルボゲン(carbogen)混合物でバブリングされるたポンプ酸素供給装置の回路に取付けた。この実験の残り部分を通じて、前記カルボゲン混合物を、40 torrの二酸化炭素分圧を確保するのに十分に高い実験によって決定された流速で前記バブル酸素供給装置に流した。これによって、ポンプ運転の全時間を通じて動脈pHが約7.4に固定された。
【0205】
100立方cmの血液を、それぞれ6単位のヘパリンを含む一対の60立方cmの注射器に取り入れた。前記ヘパリン処理血液を、リンパ漿から赤血球を分離するべく急速に遠心分離処理した。次に、リンパ漿を、5ミリリットルのPBS中に約0.5グラムのプラズマで、PBS中でエバンスプルー染料の濾過溶液と混合した。肝臓流入閉塞は、予め肝臓−十二指腸靱帯に巻き付けておいた前記Rammel止血体を締め付けることによって行われた。前記エバンスブルー染料をリンパ漿とゆっくり混合するするための1分間の旋回後、前記リンパ漿を分離された赤血球と再混合し、全溶液を、左外頚静脈を通して中央静脈心脂肪(centraql venous cordis)経由で哺乳動物の血液流に戻した。前記エバンスブルー染料の注入の完了を時間ポイントt=1分とした。t=0分に於いて、バイパスを、毎分3リットルのポンプ流速で開始した。t=2分に於いて、前記哺乳動物に、5ミリリットルの媒質中150ミリグラムのパパバリンのボーラスを、前記ポンプ酸素供給装置から出る動脈ラインの最遠位側ポートから、注入した。この強力なNO独立血管拡張剤によって、哺乳動物の血圧が即座に低下する、と予測された。その後の2分間に渡って、哺乳動物の血圧を、前記ポンプを通過する流量を増加し、ポンプをプライミングするのに使用された同じ溶液の追加量を注入することによって、正常化した。t=4分に於いて体重キログラム当たり25マイクログラムのヒスタミンのボーラスを、前記ポンプ酸素供給装置の動脈ラインのポンプから最も遠位側のポイントを介して動脈内注入した。
【0206】
30分間のポンプ運転後、心臓の収縮性をひょうかし、追加の体外循環が無い状態に於ける、肺動脈、中央静脈、及び大動脈圧を測定するために、ポンプを2分間停止させた。これらの値が得られると、すぐに、哺乳動物を、バルビツール酸塩の過剰投与によって慈悲的に安楽死させた。
【0207】
動脈カニューレによって、10ミリモルのトリス塩酸を使用して、pH7.4に調節された140ミリモルの塩化ナトリウム溶液の注入を可能にするべく前記ポンプ酸素供給装置の構造を改造した。放血の直前に、肝臓流入を閉塞されていた前記Rammel止血帯を取り外した。前記安楽死された哺乳動物の適当な容器への完全な放血を可能とするために、静脈カニューレを別のローラポンプに取り付けた。前記哺乳動物を、10リットルの塩化ナトリウム溶液を使用して放血させた。放血後、組織標本を得るべく、次の器官に対するアクセスを可能にするために切開を行った。即ち、心臓、肺臓、肝臓、腎臓、大小腸、脳、精巣、及び、次の骨格筋、即ち、横隔膜、胸部末端からの左右二頭筋及び三頭筋、左大腿四頭筋、大腿二頭筋、腓腹筋ヒラメ筋、骨盤末端からの総指伸筋頚長筋、腸腰筋、手術台に哺乳動物の体重をかけることによる最大圧縮点に於ける後部体壁筋。上にリストした最後の筋肉の標本によって、哺乳動物を手術台上に置く時の圧力点によって導入される変動性が確立された。これら各標本を重量測定し、約2グラムの組織を含むフラグメントを、刻みとホルムアミド抽出のために取り外した。エバンスブルー染料勧誘率を、分光測光法で計量し、組織湿及び乾重量に正規化した。
【0208】
次に、この例に提示した実験の結果を説明する。
【0209】
この例の実験は、2匹のヒツジを使用して行われ、それらの実験の血管は、図6aと6bとに要約されている。
【0210】
1匹の40キログラムのヒツジに、150ミリグラムのパパバリンと、1ミリグラムのヒスタミンとを静脈投与し、このヒツジを使用して記録された生理学的データを図6aに示す。予想されたように、ヒツジの血圧は、前記血管拡張剤パパバリンと、前記血管透過性促進剤ヒスタミンの投与後低下した。しかしながら、図6aに示されているように、前記体外循環系支持システムは、ヒツジの血行力学状態が、前記両化合物の投与の約10分後に於いて、投与前の血圧にほぼ等しくなる程度に、安定化させることができた。この図に示されているように、前記体外循環系支持システムは、ヒツジに対して6リットルのPBSを供給し、これは、約6リットルの流体が、ヒツジの血管系から管外組織に流出していたということを示唆している。
【0211】
第2の40キログラムのヒツジに、300ミリグラムのパパバリンと、5グラムのヒスタミンとを静脈投与し、このヒツジを使用して記録された生理学的データを図6bに示す。予想されたように、ヒツジの血圧は、前記血管拡張剤パパバリンと、前記血管透過性促進剤ヒスタミンの投与後低下した。しかしながら、図6bに示されているように、前記体外循環系支持システムは、ヒツジの血行力学状態が、前記両化合物の投与の少なくとも約25分後に於いて、投与前の血圧にほぼ等しくなる程度に、安定化させることができた。この図に示されているように、前記体外循環系支持システムは、ヒツジに対して11リットルのPBSを供給し、これは、約11リットルの流体が、ヒツジの血管系から管外組織に流出していたということを示唆している。
【0212】
これらの結果は、こに記載の体外循環系支持システムがねアデノウイルスベクター等の巨大分子アセンブリの供給のために、ここに記載された条件下に於いて哺乳動物の血行力学状態を安定化させることができるということを確証するものである。
【0213】
ラットの実験は、アルブミンと結合されたエバンスブルー染料の分布は、血液流経由で供給される組換えマーカアデノウイルスによる組織感染性を予測させるものであることを示した。AdCMVlacZの血管内投与とXgal染色後、肝臓全体を通じて青色を検出することができたが、骨格筋には検出することができなかった。エバンスブルーの場合には、肝臓と骨格筋の間の1000:1以上の分布の推定数量比により、その結果は類似したものであった。プリングル操作によって、骨格筋による吸収を増加させることなく、この比率が約200:1(肝臓:骨格筋)にまで低下することが判った。この比率は、150ミリグラムのパパバリンと1ミリグラムのヒスタミンを投与したヒツジに於いては約6:1であり、300ミリグラムのパパバリンと5グラムのヒスタミンを投与したヒツジに於いては約2:1であった。これらのデータは、哺乳動物の血管空間経由によるアデノウイルスベクターの骨格筋への広範囲な全体的転移を強く予測させるものである。
【0214】
例4: ラット筋組織へのヒトミニ−ジストロフィンの転移とその内部での発現
AdCMVΔ17−48dysとするアデノウイルスベクターを、次のように構築した。記載されたているように(アクサディ(Acsadie)他、1991,Nature352:815−819)pUC18にクローンされたSal I結合Δエクソン17−48ミニ−ジストロフィンcDNAを有するプラスミドを得た。記載されている(コザルスキー(Kozarsky)他、1994,J.Biol.Chem.268:13695−13702)前記プラスミドpAdCMVlacZも得た。pAdCMVlacZは、E.coli lac Z遺伝子の構成発現を駆動するサイトメガロウイルス(CMV)−ベースの転写カセットの側部に位置するヒトアデノウイルス5のマップ単位9−16を有するシャトルプラスミドである。pAdCMVlacZを、Xho Iエンドヌクレアーゼ部位で切り裂き、前記cDNAを含む前記プラスミドからのcDNAを、Sal I制限フラグメントとしてpAdCMVlacZのCMVプロモータに対してセンス方向でサブクローンして、pADCMVMini−1というプラスミドを得た。
【0215】
AdCMVΔ17−48dysを、記載されているように(グラハム(Graham)他,1977,J.Gen.Virol.36:59−74)、特異部位切断エンドヌクレアーゼPvu IによるプラスミドpADCMVMini−1の線形化によって作り、Cla I−制限アデノウイルスゲノムd1327とコトランスフェクションして293の細胞とした。成長組換えウイルスから発生するプラークを、単離し、記載されているように(グラハム(Graham)他、1991,In:Methods in Molecular Biology,Murray,ed.,Hamana,Clifton,NJ,109−128)拡張した。前記プラーク拡張物からのライセートを使用して293の細胞に感染させ、それらを収集し、一次抗体NCL−Dys−2(Novocastra Laboratories,Newcastle,Tyne,UK)による免疫蛍光染色を行った。293の細胞の内、ジストロフィンの存在に関して陽に染色された組換えウイルスを、ウェスタンブロッチング分析し、予想サイズのミニ−ジストロフィンたん白質を発現するウイルスを、増幅のために選択した。3ラウンドの純化後、前記ウイルス株を拡張し、標準方法を使用してアデノウイルス調製物を作成した。293の細胞を、各細胞当たり約100粒子の感染を複数回行うことによって感染され、その導入細胞を、免疫蛍光及びウェスタンブロット分析によって分析した。これらの調製物を、例1のシリーズMのラットに記載したように、ラットの後肢に於ける潅流にAdCMVlacZの代りに使用した。
【0216】
AdCMVΔ17−48dysでの潅流の1週間後のラットから得られた腓腹筋の低温切片を、ヒトジストロフィンのエピトープには結合するが、ラットのジストロフィンには結合しない、NCL−Dys−2によって免疫蛍光染色した。図11aに示されているように、前記ベクターを、ラットの腓腹筋の細胞に供給し、AdCMVΔ17−48dysによってコードされた前記ミニ−ジストロフィンたん白質がそれらの細胞に於いて発現された。更に、その染色パターンは、ラット細胞における内生のジストロフィン産生について予想されるものと同じである。ウイルスベクターが供給されなかったラット腓腹筋と、AdCMVlacZベクターが供給された(図11bに示されているように)ラット腓腹筋細胞とは、NCL−Dys−2を使用した免疫蛍光染色を示さなかった。
【0217】
この例に提示した結果は、ここに記載の組成物と方法が、哺乳動物の筋細胞への遺伝子ベクターの管内供給に有用であり、そのような筋細胞は、それによって供給された遺伝子を発現することができる、ということを証明している。
【0218】
例5: 筋組織への遺伝子転移のためのアデノ関連ウイルスベクター
ここに記載したように、骨格筋へのアデノウイルス介在遺伝子転移に関する実験によって、微細血管内皮が、哺乳動物の血管空間から筋繊維へのアクセスを制限することが立証された。ヒスタミン(及びその他の血管透過性促進剤)は、微細血管内皮を一時的に透過性にし、これによって、骨格筋へのアデノウイルス介在遺伝子転移の効率の劇的な増加をもたらし、この効果はパパバリン等の血管拡張剤を同時使用することによって大幅に高められる。アデノウイルスベクターを使用した遮断潅流心筋組織に於ける高効率の遺伝子療法も示された。
【0219】
他者による、ヒトアデノ−関連ウイルス(AAV)から誘導されたベクターを使用した組織の導入後に於ける、筋組織の於ける持続的トランスゲニック発現に関する最近の発表は、AAVベクターが、っ各及び心筋組織に対する遺伝子転移のためのここに記載の方法において有用であるかもしれない、ということを示唆している。たとえば、筋組織への遺伝子転移のためのAAVベクターは、デルタ−サルコグリカン等のヒトサルコグリカンの全部又は一部をコードする核酸を含むものとすることができる。
【0220】
ここにAAV−CMV−デルタ−サルコグリカンと称するベクターが、構築され、これが図12に示されている。このベクターは、前記遺伝子、プロモータに作動リンクされたヒトデルタ−サルコグリカン(受入番号#X95191)のためのcDNAのコピーを有し、pA領域がAAV逆末端反復(AAV−ITR)間に介在し、AAVベクターキャプシッドを充填するべく前記構造体には十分な「中うめ(stuffer)」DNAが含まれている。使用された前記「中うめ」DNAは、転写的に不活性で、哺乳動物の細胞における公知の転写因子結合特性を有さない、ヒト未成熟ミオシン長鎖cDNAの3‘最500−1000塩基対の一部を含んでいた。
【0221】
BIO14.6と称する心筋障害性シリアンハムスター株は、変異デルタ−サルコグリカン遺伝子を有し、従って、ヒトの肢−肢帯筋ジストロフィーの哺乳動物モデルである(ニグロ(Nigro)他,1997,Hum.Mol.Genet.6:601−607)。前記BIO 14.6ハムスターに於いて、前記変異デルタ−サルコグリカン遺伝子の発現は、作動不能サルコグリカン複合体の形成をもたらす。前記AAV−CMV−デルタ−サルコグリカンをBIO15.6ハムスターの筋組織に供給することによって、このハムスターの前記サルコグリカン複合体は、ハムスターが正常なデルタ−サルコグリカンたん白質を発現し、免疫蛍光的に検出可能な、アルファ−、ガンマ−、デルタ−サルコグリカンを有する作動サルコグリカン複合体を形成したという意味に於いて、「救済」された。
【0222】
齧歯動物の心臓が異所移植される心臓潅流実験に於いて、その心臓の収縮性は、心筋内皮透過化及び遺伝子転移中に於いて心臓低体温が維持される場合に、維持される。異所移植とは、提供動物のある部位から得られた組織を、受容動物の別部位に移植することをいう。この例に於いては、1匹のラットからの心臓を別のラットの大腿部位に移植した。
【0223】
これらの実験の結果は、本開示に記載の方法を使用して、治療用遺伝子構造物を筋組織に供給するために前記AAVベクターを使用することが可能であることを示している。導入遺伝子構造体に対するAAVのサイズ制限は認められるが、それでも、AAVウイルスベクターのサイズ(即ち、約1ないし4.5キロベース)内で遺伝子構造体を供給することは可能である。従って、比較的小さなたん白質、又は、より大きなたん白質の生物学的に活性的な部分、をコードする遺伝子構造体を使用することができる。たとえば、正常な及び病的な血管形成中に於ける内皮細胞増殖の制御に於ける中心的媒体として血管内皮成長因子(VEGF)が関係つけられている(ファーララ(Ferrara)他、Nature380:439−442)。121のアミノ酸残基を有するVEGFイソ型は、AAVベクター中の核酸によってコード可能であり、これは、そのようなベクターを使用してトランスホームされた筋繊維中のVEGF生物活性を示す。更に、前記121アミノ酸VEGFイソ型は、そのトランスフェクト筋組織のみに対するイソ型の特異性を高めるべく、細胞筋−特異転写カセット(たとえば、クレアチンキナーゼプロモータ/エンハンサカセット:ジェインズ(Jaynes)他、1988,Mol.Cell.Biol.8:62−70)に作動リンク可能である。
【0224】
この例に記載の実験の結果は、更に、体循環系から遮断された心筋組織への遺伝子転移を行う間に心臓(又は全身)の低体温状態を維持することの有用性も示唆している。
【0225】
例6: 体遮断心筋組織への遺伝子ベクターのインビボ供給
この例は、遺伝子材料の心臓血管を介した成体心筋層への体転移を容易にするのに有用な方法と装置を記載するものである。この方法に依れば、別の心臓循環系がイン・ヴィヴォに形成され、これは心臓循環系を体血液循環系から有効に遮断する。心臓組織の体循環系からの遮断によって、心筋層がその遺伝子ベクターに、心筋層への新鮮な遺伝子ベクター含有ビヒクルをより長時間の供給によって、或いは、心筋層を通過する遺伝子ベクター含有ビヒクルの再循環(オプションとして、酸素供給と組み合わせられる)により、長時間晒されることが可能であるため、心筋層への遺伝子ベクターの転移の効率を大幅に向上させることが可能となる。この方法の特に有利な点は、ここに記載されているように、血管拡張剤(たとえば、パパバリン)や血管透過性促進剤(たとえば、ヒスタミン)等の炎症調節物質を、ビヒクルに含ませて、これを、それらの調節物質を大量又は有害な量、体循環系に供給することなく、心筋層内の循環用に供給することが可能なことにある。更に、この方法を使用して心臓循環系が体循環系から遮断されているので、心臓循環系内の圧力を、体循環系内の圧力に大きな影響を与えることなく、変化させることが可能である。従って、この方法に依れば、炎症調節物質を、それら調節物質の体作用を最小限に留めながら、遺伝子ベクターの心臓特異的吸収を大幅に向上させるのに十分な量で使用することが可能となる。
【0226】
この方法は、少なくとも二つの異なるタイプの心臓循環系遮断処置の一つを使用して行われる。「開胸」処置は、公知の大動脈、静脈、左右心室ベントカテーテル及び外科器具を使用して行われる。「最小侵入性」処置は、ここに記載の心臓遮断カテーテルを使用して行われる。この方法に使用される心臓遮断処置のタイプの如何に拘わらず、対象体の非心臓組織の潅流は、体外酸素供給装置及び血液循環ポンプを使用して維持される。静脈血液は、たとえば、対象体の大腿静脈にカニューレ挿入することによって採取され、前記酸素供給装置とポンプとを通される。酸素供給された血液は、たとえば、図19A及び19Bに図示されているように、対象体の大腿動脈にカニューレ挿入することによって供給される。
【0227】
開胸心臓循環系遮断処置
心臓循環系は、少なくとも二つの異なった開胸外科処置を使用してイン・ヴィヴォに遮断される。これら二つの処置の第1のものは、次のように行われる。
(i)正中胸骨切開によって、パースストリング(purse strings)縫合糸を、近位上行大動脈と、遠位上行大動脈と、近位上大静脈と、下大静脈の近傍の右心房とに挿入する。
(ii)前記遠位大動脈にカニューレ挿入し、前記パースストリング縫合糸をカニューレの周りにしっかりと引き、この遠位大動脈カニューレを、血液酸素供給装置とポンプとを有する体外体心肺バイパス回路の動脈枝に接続する。前記遠位大動脈カニューレは、たとえば、6.5ミリの湾曲した金属先端のSarnカニューレとすることができる。
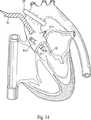
(iii)近位大動脈カニューレ(図14の部材18、たとえば、標準式DLP心臓麻痺カニューレ)を、前記上行大動脈のパースストリング縫合糸に通し、縫合糸をしっかりと引く、前記近位大動脈カニューレの遺伝子ベクター供給ルーメン82を、大動脈弁の遠位側の大動脈基部と、前記遺伝子ベクターを受ける遺伝子ベクターリザーバ(たとえば、容器、一片のフレキシブルチューブ、等)と、前記大動脈内カテーテルのルーメンに流体を供給するポンプとを有する遺伝子ベクター供給回路との両方に流体連通させる。前記近位大動脈カニューレのベントルーメン84を、圧力解除装置(たとえば、液体によって一部充填されたリザーバ)と、大動脈基部の内部とに流体連通させる。
(iv)直角の静脈カニューレを、前記上大静脈のパースストリング縫合糸に通し、第2の直角の静脈カニューレを、下大静脈の近傍の右心房のパースストリング縫合糸のルーメンに通す。前記両パースストリング縫合糸を、それらの周りにしっかりと巻き付け、これら二つの直角のカニューレを、Yコネクタを介して、前記体心肺バイパス回路の静脈枝に接続する。止血帯を、前記直角カニューレの周囲の部分、又は、直角カニューレと右心房との間の部分に於いて上下大動脈に巻き付け、冠静脈洞とテベジウス静脈とから出るもの以外のすべての帯静脈戻り流が、前記帯心肺バイパス回路の静脈枝に転送させることを可能にする。上下大動脈の周りの前記止血帯を、締め付ける。これにより、体循環系からのすべての血液戻り流は、上下大動脈カニューレを介して体外体心肺バイパス回路に運ばれ、そこから、遠位大動脈カニューレに送られる。心肺バイパスを、対象体の血液を37℃に維持しながら開始する。
(v)次に、心室ベントカテーテルを、右心室と左心室とに挿入する。これらのベントカテーテルは、パースストリング縫合糸によって固定され、Yコネクタを介して前記遺伝子供給回路の静脈枝に接続されている。
(vi)奇静脈を閉塞させる(たとえば、それをクランプ、ensnare、括る、又は、そのルーメン内でバルーンを膨張させることによって)。
(vii)上行大動脈を、たとえばクランプ100を使用して、或いは、その内部でバルーンを膨張させるとによって、左右冠動脈の遠位側で閉塞させる。
(viii)心臓麻痺誘発溶液(たとえば、Plegisol(登録商標))を、前記近位大動脈カニューレを介して心筋(たとえば、大動脈基部を介して)に導入し、心臓麻酔を起こさせる。
(ix)肺動脈を、肺動脈弁の遠位側で閉塞させる。これら各工程を行った後、酸素供給流体および/又は前記遺伝子ベクターを含有する流体を近位大動脈カニューレを介して供給し、左右冠動脈を介して心臓循環系を潅流する。前記左心室ベントカテーテルは、大動脈弁を介して逆流される心臓大動脈流を回収する。回路のこの部分は、脳室拡大を避けるべく遺伝子供給の効率を高めるために高大動脈圧が使用される場合には重要である。冠静脈洞又はテベジウス静脈を介して心臓から戻る全ての血液又はクリスタロイドは、前記右心室ベントカテーテルを介して、前記遺伝子供給回路の静脈枝に搬送される。血液又はクリスタロイドは酸素供給され、近位大動脈カニューレを介して心臓循環系に戻される。
【0228】
或いは、心臓循環系を遮断するための前記二つの開胸外科処置の内の第2のものとが行われる。この第2の処置は、遺伝子供給回路への流体の取り入れのために、前記右心室ベントカテーテルの代りに冠静脈洞流出カテーテルが使用されることを除いて、第1の処置と実質的に同じである。前記冠静脈洞流出カテーテルは、冠静脈洞(図13中のCS)を露出させるために、上下大動脈上に止血帯を締め付けた後、右心房を外科切開することによって挿入される。パースストリング縫合糸を、冠静脈洞の心門の周りに設置する。前記冠静脈洞流出カテーテルの遠端部を、心門を通して挿入し、そのカテーテルの端部のバルーンを膨張させ、パースストリング縫合糸を締付け、これによって、冠静脈洞流出カテーテルを冠静脈洞に固定する。この第2の方法に於いて、前記右心室ベントカテーテルは使用する必要はなく、肺動脈は閉塞する必要がない。
【0229】
心臓循環系が体循環系から遮断されると、炎症調節物質を、遺伝子ベクターと共に、心臓循環系に注入し、これによって、心臓循環系から心筋間質への前記遺伝子ベクターの流出の効率を高め、心筋細胞による前記遺伝子の吸収と発現の効率を高める。このシステムは、遺伝子ベクターを含有する前記液体が、ほとんど心臓循環系のみを介して再循環されることを可能にする。前記液体は、それによって筋細胞の生存と、筋細胞による遺伝子ベクターの吸収とが向上するように、心臓循環系のより長時間に渡る遮断を可能にするべく、高いレベルの溶解酸素を含有することが可能な酸素輸送物質(たとえば、過フルオロ化合物液)としたり、或いは、酸素含有液(たとえば、酸素供給血液又はクリスタロイド)を時々又は常時補給されるものとすることができる。温度も筋細胞へのベクター仲介遺伝子供給の効率に影響するものであることから(たとえば、心筋細胞による遺伝子ベクターの吸収は、遮断された細胞及び生体外で処理された心筋層において、4−10℃よりも37℃でより効率的である)、前記遺伝子供給回路中の流体の温度も制御することができる。
【0230】
所定時間心臓循環系を遮断した後、前記遺伝子ベクターを含有する液体と、炎症調節物質(単数又は複数種)とを、これらベクターと炎症調節物質(単数又は複数種)とを実質的に含有しない別の液体によって置き換えることによって遺伝子ベクター供給を一時停止する。この別の液体は、1回の通過で心臓循環系を洗浄するのに使用したり、或いは、再循環させることができる。前記上下大動脈の周りの止血帯と、大動脈と(使用され場合には)肺動脈とに取り付けられたクランプとは、残存するベクターと炎症調節物質(単数又は複数種)が、体露出にとって安全なレベルにあると測定又は推定された時に、取り外される。この時点に於いて、体循環系が心臓循環系とが一つの循環系に合流される。次に、対象体を、この明細書の他の箇所に記載した、そして、残存炎症調節物質(単数又は複数種)及びベクターを血液流から取り除くための改変された限外瀘過法を含みうる、適当な支持技術を使用して、心肺バイパスから切り離す。
【0231】
この処置の前記開胸法は、犬に対して行われた。予備実験に於いて、エバンスブルーラベルされたアルブミンを、犬の遮断された心臓循環系に注入した。表2は、上述した遮断システムを使用して心臓潅流を20分間行った後に於ける心臓及び体循環系中のエバンスブルーラベル化アルブミンの濃度を示している。これらの結果は、エバンスブルーラベル化アルブミンの濃度が、心臓循環系に於いて体循環系に於けるよりも約50ないし100倍高く、この方法を使用した場合のイン・ヴィヴォの心臓循環系の遮断の98ないし99パーセントの効率を示している。
【0232】
【表2】
【0233】
図20は、イン・ヴィヴォ心臓循環系遮断を受けた犬から得られた心筋と横隔膜の断面を図示している。ヒスタミン、パパバリン、及びエバンスブルーラベル化アルブミンを有するカクテルを、遮断された心臓循環系に注入し、それらの犬の体循環系には注入しなかった。図20C及び20Dに示されているように、心臓細胞間の間質へのエバンスブルーラベル化アルブミンの広範囲のいっ出は、心間質へのラベル化アルブミンの特異的供給に一致している。これに対して、図20A及び20Bに図示されているように、横隔膜の骨格筋細胞間での間質には染色は少ない。これらのデータは、ここに記載の開胸心臓循環系遮断方法が、イン・ヴィヴォで心臓循環系を遮断を効果的に行うことに使用可能であり、更に、炎症調節物質が遮断された心臓循環系に供給される時、巨大分子物質の、横隔膜等の体組織の間質へではなく、心臓間質への特異的いっ出、が達成される、ということを示している。従って、これらの結果は、本方法の、遺伝子ベクター(たとえば、プラスミド、ウイルスベクター、等)の心筋への供給することにおける有用性を立証するものである。
【0234】
最小侵入性処置
心臓循環系の遮断は、又、様々な最小侵入性処置を使用しても達成することができ、これらの処置に於いては、様々なカテーテルが、対象体の血管(たとえば、頚静脈、大腿静脈、大腿動脈、上大静脈、下大静脈のいずれか一つ又は複数)に挿入される。これらのカテーテルは、前記開胸処置に於いてここに記載された或る種のカテーテル及びクランプの代りに使用可能であるので、これらの最小侵入性処置は、最小限の切開を使用して行うことができる。前記開胸処置に記載された方法とここに記載の最小侵入性処置との組み合わせを使用することも可能である、と理解される。
【0235】
心臓循環系を遮断するための最小侵入性処置の一実施例は、heartport EndoCPB System(Heartport Inc.,Palo Alto,CA)のもの等の公知の装置を使用して行うことができる。この実施例に於いて、対象体の体循環系は、対象体の大静脈(好ましくは、右心房のレベル、もしくはその下)と、対象体の大腿動脈とにカニューレ挿入することによって維持される。大腿カニューレは、体外ポンプ/酸素供給装置の動脈枝に接続され、静脈カニューレはその装置の静脈枝に接続される。対象体の心臓循環系は、Hearport Endocoronary Sinus(登録商標)カテーテル、Hearport Endopulmonary Vent(登録商標)カテーテル、及びHeartport Endoaortic Clamp(登録商標)カテーテルを使用して遮断される。
【0236】
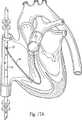
この方法に依れば、前記Hearport Endocoronary Sinus(登録商標)カテーテルが、対象体の内頚静脈、上大静脈を介して右心房に、そして冠静脈洞を通して挿入される。次に、このHearport Endocoronary Sinus(登録商標)カテーテルに取り付けられたバルーンを膨張させてカテーテルを位置固定する。前記Hearport Endopulmonary Vent(登録商標)カテーテルも、前記内頚静脈、上大静脈を介して対象体の右心房に挿入される。次に、このカテーテルは、三尖弁を介して肺動脈の基部に、好ましくはは、この肺動脈弁を貫通して延出する状態で案内される。前記Heartport Endoaortic Clamp(登録商標)カテーテルは、対象体の大腿動脈に挿入され、下行大動脈に沿って上行大動脈へと進行される。このHeartport Endoaortic Clamp(登録商標)カテーテルのバルーンを、上行大動脈内の、心臓動脈への大動脈基部からの流体流は閉塞させないが、大動脈の弓(即ち、図18に示されているように)への流体流は閉塞させるレベルに於いて、膨張される。或いは、Heartport Endoaortic Clamp(登録商標)カテーテルの、そのバルーンに対して遠位側の部分を、大動脈弁を介して左心室へと延出させる。
【0237】
これらカニューレ及びカテーテルが位置決めされると、前記静脈及び大腿カニューレを使用して対象体に於いて心臓バイパスが形成される。心臓麻酔誘発溶液が、Heartport Endoaortic Clamp(登録商標)カテーテルを介して大動脈基部に供給され、心臓の鼓動を停止させる。遺伝子供給回路が形成され、これによって、次に、遺伝子ベクターを含有する液体が、Heartport Endoaortic Clamp(登録商標)カテーテルを介して大動脈基部に供給され、冠状動脈と冠状静脈とを介して冠静脈洞へと流れ、ここから、前記Hearport Endocoronary Sinus(登録商標)カテーテルを介して前記遺伝子供給組回路に戻る。この遺伝子供給装置は、重力(たとえば、対象体上の懸架された前記液体を収納するレザーバ)又はポンプによって作動させることができる。遺伝子供給回路がポンプ駆動される場合には、それは、単流システムとしてもよいし、或いは循環システムとして、前記Hearport Endocoronary Sinus(登録商標)カテーテルによって回収された液体が大動脈基部に戻されるように構成してもよい。この液体は、更に、ここに記載の、単数又は複数種の炎症調節物質を含むことができる。
【0238】
この処置(即ち、Hearport装置を使用した)には大きな欠点がある、と理解される。心臓動脈に供給されるすべての血液が冠静脈洞を介して右心房に戻されるわけではない。この血液の約5パーセントは、「テベシウス」静脈と称される通路を経由して右心房と右心室に流入する。従って、この方法に依れば、前記遺伝子供給回路によって大動脈基部に供給される液体の一部が、右心房と右心室の静脈血液と混合し、これによって、前記心臓バイパス回路によって体系に供給される血液と混合される。遺伝子供給回路の液体と、心臓バイパス回路の静脈血液との混合は、前記Heartport Endopulmonary Vent(登録商標)カテーテルから流体を引き出すことによって最小化することは出来ず、これによって、遺伝子供給回路液体と混合された静脈血液が肺動脈と右心室から引き出される。もちろん、このカテーテルを通じて引き出される静脈血液は、心臓バイパス回路に追加の血液を供給することによって置き換えられなければならない。従って、置き換えられる必要のある血液の量を考慮すれば、この方法は実用的ではない。少なくとも一つのカテーテル(即ち、前記Hearport Endocoronary Sinus(登録商標)カテーテル)と、好ましくは、第2(即ち、前記Heartport Endopulmonary Vent(登録商標)カテーテル)とが、大静脈の一つの腕と右心房とを横切る必要があるため、このHeartport装置を使用して、大静脈又は右心房を閉塞させることは実用的ではない。もちろん、これらHeartportカテーテルの一方又は両方を、右心房のパースストリング縫合糸を通して挿入することも可能であろうが、これには、対象体の胸骨切開が必要であり、これによって、この方法の最小侵入特性が失われてしまう。
【0239】
Heartport装置を使用する処置の更に別の欠点は、冠静脈洞内カテーテルによって、心臓中の心臓血液流が減少することにある。多数の心臓静脈が、冠静脈洞の心門に於いて、又はその間近で冠静脈洞内に開口している。カテーテルを冠静脈洞内に据え付けるためには、その洞内に於いてバルーン又はそれに類似の装置を膨張させる必要があり、そこを通過する血液を閉塞するために、このバルーンを心門に対して着座させなければならない。しかしながら、バルーンを心門に着座させることによって、心門又はその近くで冠静脈洞内に開口する心臓静脈が閉塞され、これによつて、これら静脈を通る血液流が阻止又は減少する。これらの静脈を介して心筋組織に物質(たとえば、遺伝子ベクター)を供給する場合、それら静脈に関連する心筋へのその物質の供給は、抑制又は阻止される。従って、冠静脈洞内カテーテルの使用によって、心筋組織の少なくとも一部への物質の供給が抑制されるが、これは回避されることが好ましい。Hearport装置を使用する前記処置は、冠静脈洞内カテーテルの使用に依るものであり、従って、好ましくない。
【0240】
上述した(即ち、Heartport装置を使用した)処置の欠点を有さない別の最小侵入性処置を使用することができる。この別方法に於いて、前記前記Heartport Endopulmonary Vent(登録商標)カテーテルと、前記Hearport Endocoronary Sinus(登録商標)カテーテルとは、多機能静脈戻りカニューレ(ここでは、「心臓遮断カテーテル」と別称する)によって置き換えられる。この心臓遮断カテーテルは、上下大静脈に挿入され、これら上下大静脈を閉塞させるのに使用可能な導管シート(たとえば、バルーン又は隆起部)を有し、又、少なくとも一対のポートと流体連通する静脈血液流ルーメンを有し、少なくとも一つのポートは、上大静脈に於いて前記導管シートの上に位置し、少なくとも一つのポートは、下大静脈に於いて前記導管シートの下に位置する。それらを導管シートに着座させることによって両大静脈が閉塞さると、両大静脈を通過する静脈血液流が、前記心臓遮断カテーテルの静脈血液理由ルーメンを通過する。
【0241】
前記心臓遮断カテーテルの別の実施例が図15と図16Aとに図示されている。図15に於いて、近位ポート14と遠位ポート16との両方は前記静脈血液流ルーメン(図15には図示されていない)と連通するカテーテル本体10に貫通形成された径方向の孔である。図16Aに於いて、前記遠位ポート16は、前記静脈血液流ルーメン24の延長部である前記カテーテル本体10の遠端部に形成された単なる開口部である。図15に示されているように、両大静脈は、上大静脈の上部から近位ポート14への血液流、又は、下大静脈の下部から遠位ポート16への血液流を閉塞させることなく、カテーテルの両バルーン12を膨張させることによって閉塞させることができる。前記心臓遮断カテーテルの静脈血液流ルーメンは、心臓バイパス装置の一部等の、体外ポンプ/酸素供給装置の静脈枝に接続することができる。
【0242】
図15及び16に図示されているように、前記心臓遮断カテーテルは、更に、単数又は複数のアクセスポート20と前記遠位導管シート17と近位導管シート15との間に位置する単数又は複数の右心房流体アクセスポート22と、単数又は複数の吸引ポート18とを備えることができる。前記右心房流体アクセスポート22は、それを通して流体が右心房から回収可能な、単数又は複数の流体流ルーメン30と連通している。好ましくは、右心房からの流体の吸収を促進するために、少なくとも緩やかな吸引力(たとえば、−0.5ued−5psig)が、前記流体流ルーメン30に加えられる。前記吸引ポート18は、図16に示すように、オプションとして流体流ルーメン30と同じものとすることができる、単数又は複数の吸引ルーメン26と連通している。前記吸引ルーメン(単数又は複数)26に少なくとも緩やかな吸引力を加えることによって、両大静脈の導管シート(たとえば、図15及び16のバルーン12対)での着座を促進することができる。前記アクセスポート20は、アクセスポート20専用のルーメン、又は、前記心臓遮断カテーテルの他のルーメンの一つ(たとえば、前記静脈血液流ルーメン24、前記吸引ルーメン26又は前記流体流ルーメン30)と連通可能である。これらのアクセスポート20は、それを通して組成物、カテーテル、又はその他の装置が対象体の右心房の領域に挿入可能なオリフィス(たとえば、図17Aに図示されているように)を提供するために設けられている。
【0243】
前記心臓遮断カテーテルは、上下方向又はその反対(即ち下上)方向で大静脈に挿入することができる。カテーテルが上下方向に挿入される場合は、それは、好ましくは、右頚静脈を介してヒト対象体に挿入れるが、但し、それを左頚静脈又は上大静脈と連通する別の血管、を通して挿入させることも可能である。カテーテルが下上方向に挿入される場合は、それは、好ましくは、対象体の大腿静脈を介してヒト対象体に挿入されるが、但し、それを下大静脈と連通する別の血管を介して挿入することも可能である。或いは、カテーテルを、対象体を完全に通して(たとえば、患者の大腿静脈とその患者の頚静脈とから延出して)挿入することも可能である。全ての患者の静脈の解剖学的構造は、或る程度異なり、ある場合に於いては、一つの方向でのカテーテルを挿入が不可能である場合もあることから、カテーテルが挿入可能な方向に於けるフレキシビリティが好ましい。そのような場合、カテーテルを別の位置から、同じ又は異なる方向で挿入することができる。このフレキシビリティは、前記カテーテルの重要な特徴である。
【0244】
前記心臓遮断カテーテルの方向の如何に拘わらず、それは、下記のように実質的に同様に使用される。
【0245】
心臓遮断カテーテルを、対象体の上下大静脈を通して挿入し、遠位導管シート17が上下大静脈の一方の上に位置し、近位導管シート15がその他方の上に位置するようにする。次に、カテーテルを位置固定する。好ましくは、上大静脈の導管シートは、右心房と、腕頭静脈の接合部との間に位置し、下大静脈の導管シートは、右心房と、肝静脈と下大静脈との接合部との間に位置する。前記両導管シート15,17は、たとえば、バルーン12、カテーテル本体10の隆起部、カテーテル本体10の拡張可能部、カテーテル本体10に形成された凹部、カテーテル本体10のラフ又は不規則部、等とすることができる。前記心臓遮断カテーテルは、更に、一つの導管シートと関連付けられた単数又は複数の吸引ポートを備えることができ、これにより、吸引ポートに吸引力を与えると、大静脈の壁が導管シートに対してより強固に着座される。前記導管シートの重要な特徴は、それらが支持を提供することにあり、これにより、管外部材(たとえば、スネア又はクランプ)とは独立的に、或いは、それとの協動で、心臓遮断カテーテルを対象体の大静脈内に位置固定することができる。
【0246】
図18に示すように、動脈内カテーテルを、対象体の動脈を介して上行大動脈に挿入する。この動脈内カテーテルは、フレキシブルロッド50と動脈導管シート52とを有する。前記ロッド50は、遠端部と近端部とを有し、前記動脈導管シートに対して遠位側に位置して、前記遠端部には排出ポート55が設けられている。前記ロッドは、オプションとして、このロッドの遠端部又はその近傍に左心室ベントポート57を有する。前記排出ポート55と左心室ベントポート57とは、オプションとして同じポートであってよく、その場合、排出ポート55に供給された流体には、左心室又は動脈基部内に於ける圧力の増加を防止するべく圧力解除装置が適用される。前記動脈内カテーテルの前記排出ポート55は、かの動脈内カテーテル内で長手方向に延出する液体アクセスルーメン54と流体連通している。従って、この液体アクセスルーメン54に供給された液体は、動脈内カテーテルの長手方向に沿って流れて、排出ポート55からカテーテルを出ることができる。前記動脈導管シートは、表面動脈内カテーテルを対象体の大動脈内で位置固定する作用を有する、動脈内カテーテルに取り付けられた装置、その表面部分、又はその表面処理部、とすることができる。たとえば、前記心臓遮断カテーテル用として記載された導管シートのいずれも、動脈内カテーテルに使用することが可能である。大動脈を前記動脈導管シートに着座させることによって、大動脈内のこの動脈導管シートを通過する流体流が閉塞される。前記動脈内カテーテルは、たとえば、ここに記載したHeartport Endoaortic Clamp(登録商標)カテーテル等の市販のものであってよい。
【0247】
動脈内カテーテルの遠端部は、動脈基部内、又は、左心室内にセットされ、大動脈が、心臓動脈と大動脈の弓との間で動脈導管シートに着座される。動脈内カテーテルの適切な配置の一例が図18に図示されている。この図に於いて、前記排出ポート55は左心室内にあり、大動脈を通過する流体流は、大動脈を動脈導管シート12、この場合に於いては動脈内バルーン、に対して着座させることによって閉塞されている。
【0248】
前記心臓遮断カテーテルの流体流ルーメン30は、体外流体流回路の静脈枝と流体連通されている。この流体流回路の動脈枝は、前記動脈内カテーテルの前記流体アクセスルーメン54に接続されている。前記流体流回路は、たとえば、遺伝子ベクターを収納するレザーバ、ポンプ、流体、及び、流体酸素供給装置等とすることができる。流体は、対象体の心臓の内部又は心臓血管に対して、それらに重大な害を与えることなく、供給可能な実質的にどのような流体であってもよい。たとえば、この流体は、りん酸緩衝生理食塩水、その他の緩衝液、対象体又は提供体から得た血液、酸素輸送物質、過フルオロ化合物液、等とすることができる。この流体は、又、ここに記載されているように、非排他的に、ヒスタミン等の血管透過性促進剤と、パパバリン等の血管拡張剤を含む単数又は複数種の炎症調節物質を含むものとすることができる。
【0249】
前記対象体の非心臓組織は、前記心臓遮断カテーテルの静脈血液流ルーメン24を経由して対象体から体静脈血液を得て、この血液に、体外血液酸素供給装置によつて酸素供給し、この酸素供給された血液を、たとえば、大腿動脈カテーテル、を使用して対象体の動脈に供給することによって、潅流される。この体血液酸素供給法は、図19Aに図示されている。これに代えて、前記動脈内カテーテルは、酸素供給血液流ルーメンと、その遠端部近くで、但し、前記動脈導管シートに対して近位側、に設けられた酸素供給血液ディフューザ靴とを設けることも可能である。酸素供給された血液を前記酸素供給血液流ルーメンに供給することによって、酸素供給された血液が、動脈弓から始まって対象体の動脈を流れ、これによって、対象体のその他の点に於いて血液を供給することによって起こされる流れよりも正常な生理的血液供給に近い血液供給を提供することができる。
【0250】
前記心臓遮断カテーテルを対象体の大静脈に位置固定すると、遠端部を有する第2のカテーテルを、心臓遮断カテーテルのルーメン、このルーメンと連通するアクセスポート20を介して、対象体の右心房へと挿入することができる。心臓の内部から肺動脈への血液のパッシブな流れを最小化又は阻止するべく、この第2カテーテルを、三尖弁を通して、肺動脈の基部、或いは、更に、肺動脈弁を超えて挿入することができる。この第2カテーテルに、図17Aに図示されているように、その遠端部又はその近くにバルーン42又はのその他の血管閉塞装置を備えさせることができる。この第2カテーテルに、更に、その遠端部、又は、右心室へと侵入可能な湾曲部、に流体取り込みポートを設けることができ、ここで、肺動脈又は右心室からの流体を、当該第2カテーテルの内部で長手方向に延出し前記開口部と連通する流体取り込みルーメンを通して取り込むことができる。この流体の取出しは、左心室又は肺動脈弁の近位側で蓄積する炎症調節物質(単数又は複数種)によって引き起こされる可能性のある、体、肺又はその他の損傷を防止するのに有効である。
【0251】
ここに記載した全てのカテーテルは、当該技術に於いて周知の螢光透視法、X線写真術、気管内超音波心臓検診法、又は音波ホログラフィー法等によって据え付けることができる。そのような据え付けを容易にするために、これらカテーテルの内部又は外部に、単数又は複数の、超音波的に不透明、X線写真術的不透明、又はその他の検出可能なマーカを設けることができる。これらのマーカは当該技術に於いて周知である。
【0252】
前記心臓遮断カテーテル、第2カテーテル、及び動脈内カテーテルが据え付けられ(たとえば、図17及び18のように)、必要な場合には奇静脈が閉塞されると、遮断された心臓循環系を介した流体流が開始される。流体は、前記流体アクセスルーメン54と排出ポート55を通って、ここに記載のように、大気圧又は僅かにそれを上回る圧力(たとえば、0.1ないし5psig)、或いは、大幅に高められた圧力で供給することができる。閉塞心臓循環系に供給される前記流体は、合成のもの(たとえば、過フルオロ化合物液、又はpH7.4のTris−Cl等の緩衝液)、あるいは、天然のもの(たとえば、対象体の血液)、あるいはそれらの組み合わせ(たとえば、緩衝液を添加した血液)とすることができる。この流体は、心臓循環系に対して、1回のパスで供給することも(即ち、流体は心臓循環系から出たあと破棄される)、或いは、循環モード(即ち、これによって心臓循環系からでた流体は、心臓循環系に再供給される)で供給されることも可能である。遮断された心臓循環系が維持される時間は、もしもその遮断心臓循環系に供給される液体が、赤血球細胞又は過フルオロ化合物液を含むものである場合には、増加させることが可能である。前記遮断心臓循環系に供給される前記液体は、最初から、ヒスタミン又はパパバリン等の炎症調節物質を含むものであってもよいし、或いは、それらの調節物質を、遮断心臓循環系への流体流が開始された後に液体に添加してもよい。同様に、この液に、最初から、遺伝子ベクターを含ませてもよいし、或いは、遺伝子ベクターを遮断心臓循環が始まった後で添加してもよい。
【0253】
心臓循環系と体循環系とを再合流させる前に、それらの組成物への望ましくない体の露出を防止するために、遮断心臓循環系から遺伝子ベクター(単数又は複数)又は炎症調節物質(単数又は複数)を洗浄除去することが望ましいかもしれない。それらの組成物は、動脈内カテーテルの前記液体アクセスルーメンにそれらの組成物を含まない液体を供給することによって循環系から洗浄除去することが可能である。心臓循環系と体循環系とを合流させる前に、少なくとも数回分の心臓循環量を、遮断心臓循環系に通過させるべきである。たとえば、約0.5ないし1リットルの液体を、ヒトの対象体の心臓循環系を通してフラッシングさせることができる。
【0254】
もしも炎症調節物質が遮断心臓循環系に供給されている場合には、本明細書の他の箇所に記載したように、対象体に対して体外循環系支持装置を提供することが推奨される。
【0255】
ここに挙げた、各及びすべての特許、特許出願、及び刊行物の開示内容の全体を、ここに参考文献として合体させる。
【0256】
以上、本発明を、具体的な実施例を参照しながら開示したが、本発明の真の精神及び範囲から離脱することなく、本発明のその他の実施例及び改変を、当業者は考案することが可能であることが明らかである。添付の特許請求の範囲は、そのような実施例及び均等な改変例の全てを含むものと解釈される。
【図面の簡単な説明】
【図1】図1は、炎症調整物質の不在状態に於けるラットの筋肉中の遺伝子転移のパターンを図示し、アデノウイルスに対する血管内皮バリアの完全性を示している。
【図1a】図1aは、AdCMVlacZ(表1,シリーズC)の動脈注入4日後の成体ラットの大腿二頭筋に於けるマーカ遺伝子活動を、Xgal染色による評価したものを500倍の倍率で示す画像である。
【図1b】図1bは、成体ラットの前脛骨筋に於けるマーカ遺伝子活動を、より高い圧力の注入でのXgal染色によって評価したものを350倍の倍率で示す画像である(表1,シリーズe)。
【図1c】図1cは、成体ラットの前脛骨筋に於けるマーカ遺伝子活動を、全マウント標本のXgal染色によって評価したものを500倍の倍率で示す画像である。この画像を得る3日前に、5x1010粒子のAdCMVlacZを筋肉注射したことによって、前脛骨筋のこの部分に限定された集中遺伝子導入が起こった。
【図2】図2は、パネルA−Fから成り、これは、ヒスタミンとパパバリンの存在下に於ける遺伝子ベクター導入後の成体ラット骨格筋繊維への高効率の遺伝子転移を示す一連の画像である。パネルAは、複数の断面を露出させるための全マウント染色の前に解剖されたラットからの後肢全体を示す画像である。パネルBは、100倍の倍率での光学顕微鏡検査での評価に依る、大腿四頭筋(パネルAの最上列)中にマーカ遺伝子分布を示す画像である。この画像は、共通大腿動脈のレベルに於いて止血用具を設置することによって、大腿直筋への主要血液供給が遮断されることを示している。パネルCは、図2にまとめて図示されている画像中に示された筋肉グループの相対位置を示す画像である。パネルDは、25倍の倍率で、半膜様筋、短内転筋、その近傍の伏在動脈(該パネルの右上)を示す画像である。パネルEは、前脛骨筋の一部を300倍のNormarskiマイクログラフで示す画像であり、小動脈(パネルの左中央部分)の染色されていない壁と、多くの均一に染色された筋繊維組織とを示している。パネルFは、25倍の倍率で、それに対する遺伝子導入後の腓腹筋を示す画像である。
【図3】図3は、ヒトの患者に対するポンプ酸素供給装置の位置を示す図である。
【図4】図4は、カニューレ挿入位置と、ヒトの患者の肝臓血液流閉塞に有効な位置とを示す図である。
【図5】図5は、ヒト患者に於ける、ミニマルアクセス血管クランプと、ECLPポンプ酸素供給装置と、腹腔鏡ビデオモニタとの相対位置を示す図である。
【図6a】図6aは、150ミリグラムのパパバリンと、1ミリグラムのヒスタミンとを投与した約40キログラムのヒツジから得られた生理データを要約するグラフである。HRは、毎分当たりの心拍数を意味する。BPは、torr単位測定での平均血圧を意味する。CVPは、torr単位測定での中央静脈圧を意味する。PAPは、torr単位測定での肺動脈圧を意味する。FAPは、torr単位測定での大腿動脈圧を意味する。CPBPは、毎分リットル単位での心臓肺バイパス流量を意味する。
【図6b】図6bは、300ミリグラムのパパバリンと、5ミリグラムのヒスタミンとを投与した約40キログラムのヒツジから得られた生理データを要約するグラフである。略語は図6aと同様である。
【図7】図7は、閉塞齧歯動物後脚に対して遺伝子ベクターを導入するための、ポンプ、酸素供給装置、圧力レギュレータの使用を示す図である。齧歯動物後脚の動脈及び静脈は、その齧歯動物の循環系から、止血装置等を使用して遮断される。前記遺伝子ベクターが前記動脈に導入される。静脈カテーテルによっ、前記静脈がポンプの入口に接続される。このポンプは、酸素供給装置を介して静脈から引き出された血液を、第2カテーテルを介して動脈に通過させる。圧力レギュレータによって、齧歯動物の動脈のかん流圧が一定に維持される。
【図8】図8は、図7に示した酸素供給装置の一実施例の作動を示す図である。
【図9】図9は、図7に示した酸素供給装置の構造を示す図である。
【図10】図10は、図7に示した前記圧力レギュレータと導入メカニズムとの相手だのインターフェースの一実施例の構造を示す図である。
【図11a】図11aは、アデノウイルスベクターAdCMVΔ17−48dysを導入し、ヒトのジストロフィンには存在するが、ラットのジストロフィンには存在しないエピトープに特異的に結合する蛍光ラベル抗体であるNCL−Dys−2を使用して免疫蛍光染色されたラットの腓腹筋の断面を示す画像である。
【図11b】図11bは、アデノウイルスベクターAdCMVΔ17−48dysを導入しNCL−Dys−2を使用して免疫蛍光染色されたラット腓腹筋の断面を示す画像である。
【図12】図12は、ここに記載の「AVL−CMV―デルタ−サルコグリカン」と表示されるアデノ関連ウイルス遺伝子ベクターの図である。
【図13】図13は、ヒトの心臓の図であって、ここでは、明瞭性の為に、下降大動脈が変位され、いくつかの表面が除去されている。ラベルは以下の解剖学的部分を示す、SVC,上大静脈;IVC,下大静脈;RA,右心房;CS,冠静脈洞(この図では冠静脈洞の心門のみが見える);TV,三尖弁;RV,右心室;PV,肺動脈弁;PA,肺動脈;LA,左心房;BV,二尖弁;LV,左心室;AV,大動脈弁;A,大動脈。
【図14】図14は、その大動脈を貫通するカニューレ80と、大動脈を閉塞するクランプ100とを有するヒトの心臓を示す。RCAは、右冠状動脈のおよその位置を示し、LCAは、左冠状動脈のおよその位置を示す。
【図15】図15は、ここに記載の、それに関連する大静脈を通してねじ込まれた心臓遮断カテーテルを有するヒトの心臓を示している。
【図16】図16は、図16A,16B,16C及び16Dから成り、本発明の前記心臓遮断カテーテルの一実施例の構造を示す4つの図面である。図16Aは、前記カテーテルの遠端部の構造を示し、カテーテルの近端部は図示されていない。図16B,16C及び16Dは、図16A中に示された平面に沿った、図16Aに図示されたカテーテルの断面を示している。
【図17】図17は、図17A及び17Bから成り、それに関連する大静脈を通してねじ込まれた心臓遮断カテーテルと、肺動脈内に設置された第2カテーテルとを有するヒトの心臓を示している。図17Aに於いて、前記第2カテーテル40は、ここに記載されているように、前記心臓遮断カテーテルのアクセスポート20を通してねじ込まれている。図17Bに於いて、前記第2カテーテル40は、前記心臓遮断カテーテルとは独立して、但し、スネアSが心臓遮断カテーテルの導管シートに対して上大静脈を載置させている位置においてこの心臓遮断カテーテルの外面に形成されたノッチ又は凹部内にフィットした状態で、上大静脈を通して設置されている。
【図18】図18は、ここに記載されているように、その大動脈基部内に配置された大動脈内カテーテルを有するヒト心臓を示している。
【図19】図19は、図19Aと19Bとから成り、ここに記載の心臓循環遮断方法の実施例に於ける装置の構成の一対の図である。図19Aに於いて、大動脈内カテーテル(EC)と、心臓遮断カテーテル(CIC)とが、患者内に設置され、ここに記載のように、これらに対して、体外血液酸素供給装置(EBO)と体外流体回路(EFC)とが接続されている。図19Bに於いて、大動脈内カテーテル(EC)と、上大静脈戻りカテーテル(SCRC)と、下大静脈戻りカテーテル(ICRC)とが、患者内に設置され、ここに記載のように、これらに対して、体外血液酸素供給装置(EBO)と体外流体回路(EFC)とが接続されている。
【図20】図20は、図20A,20B,20C及び20Dから成り、犬の遮断された心臓循環系へのエバンスブルーラベルアルブミンの導入後に於ける、イヌの心筋及び横隔膜組織のエバンスブルー色素標識化を示す4つの画像である。横隔膜組織が、異なる倍率で、図20Aと20Bとに図示されている。心筋組織(左右心室心筋層)が、図20C及び20Dに図示されている。
【図21】図21は、本発明の前記心臓遮断化の一実施例を示す断面画像であって、ここで、カテーテルは、スネアSを介して、それぞれ、上大静脈SVCと下大静脈IVCとに着座された導管シート92,102を備える一対の大静脈戻りカテーテル90,100を有する。カテーテル40は、前記両大静脈戻りカテーテルの一つのアクセスポートから右心房RA内に延出している。設置された大静脈戻りカテーテルの遠端部のみが図示されている。[0001]
Field of Invention
The field of the invention is genetic therapy and heart therapy.
[0002]
Background of the Invention
It is well known that viruses inherently supply nucleic acids to cells and thus have been used as gene delivery vehicles. However, in order for a recombinant virus to supply nucleic acid to a cell, the virus must first have access to the cell. Circulating a virus in a mammal does not always facilitate access to cells for which it is desired to supply nucleic acids. The present invention provides a means for providing viral access to cells in which it is desired to supply nucleic acids.
[0003]
Bacterial cloning of full-length cDNAs of several muscular dystrophy disease gene products (Lim et al., 1995, Nature Genetics 11: 257-265; Piccolo et al., 1995, Nature Genetics, 10: 266-273; Nigro et al., 1996, Nature Genetics 14: 195-198; Bonnemann et al., 1995, Nature Genetics 11: 266-273, and Helbling-Leclerc et al., 1995, Nature 11: et al. -218) has been in parallel with improvements of various virus-based vectors for somatic gene transfer. (Yang et al., 1994, Nature Genetics 7: 362-368; Yeh et al., 196, J. Virology 70: 559-565; and Wilson, 1996, New Eng. J. Med. 334. : 1185-1187). The general muscle involvement in these diseases and the resulting respiratory dysfunction has attracted attention for the in vivo introduction of tissue vectors into mammalian tissues and organs (Boland et al., 1996). , Pediatric Neurology, 14: 7-12; Stetman et al., 1991, Nature 352: 536-539; Schlenker et al., 1991, J. Appl. Physiol. 71: 1655-1662 and Smith. Et al., 1987, New Engl. J. Med. 316: 1197-1205). Under physiological conditions, the continuous endothelium of skeletal muscle macromolecules is substantially impervious to proteins larger than albumin (Stokes radius 3.5 nanometer; Berne et al., 1992, In : Physiology, Mosby, St. Louis), the underlying basement plate regulates the diffusion of larger macromolecular aggregates (Majno et al., 1961, J. Biophys. Biochem. Cytol. 11: 571-597. ).
[0004]
There is an urgent need to develop compositions and methods that facilitate access of large macromolecules to muscles for the purpose of introducing compositions that have therapeutic effects on mammals in need of such compositions. Sex exists.
[0005]
Muscular dystrophy and other muscular diseases are generally progressive disorders that are inherited and result in a weakening, abnormal development, and / or loss of normal muscle control due to non-expression or abnormal expression of muscle genes. Some of them (eg, mitochondrial myopathy) are associated with mitochondrial DNA deletion, but many of these disorders have been associated with chromosomal mutations. For example, Duchenne muscular dystrophy (DMD) has been associated with mutations in the human gene encoding dystrophin protein.
[0006]
In the clinical course of end-stage DMD, respiratory compromise becomes dominant, but the myocardial damage behind it is universally present in such DMS patients. Some muscular dystrophy, including those associated with dystrophinopathy (eg, Becker muscular dystrophy) and those associated with sarcoglycopathies (eg, limb girdle muscular dystrophy), are severe enough to require transplantation Are sometimes observed (Piccolo et al., 1994, Neuromusc. Diord. 4-143-146; Fadic et al., 1996, N. Engl. J. Med. 334: 362-366). In addition, at least 12 other gene products are associated with the pathogenesis of recessive inherited dilated cardiomyopathy in humans (Fadic et al., 1996, N. Engl. J. Med. 334: 362-366. Piccolo et al., 1995, Nature Genet. 10: 243-245; Lim et al., 1995, Nature Genet. 11: 257-265; Noguchi et al., 1995, Science 270: 819-822; Nigro et al., 1996, Nature Genet.14: 195-198; Nigro et al., 1997, Hum.Mol.Genet.6: 610-607; Bione et al., 1994, Nature Genet.8: 323-327; Taroni et al., 1992, Proc. Nat. Acad. Sci. U.S.A. 89: 8429-8433; Witt et al., 1992, J. Neurol. 239; 302-306; 1985., 1994, Cell 77: 869-880; Reichmann et al., 1991, Eur. Heart J. 12 (Suppl. D): 169-170; Eishi et al., 1985, Hum. 16: 193-197; Bione et al., 1996, Nature Genet.12: 385-389; Yokoyama et al., 1987, Br.Heart J.57: 296-299; Elderer et al., 1990, Virchows A Ch. A. Pathol. Anat. Histopathol.417: 449-455; Nagao et al., 1991, Clin.Genet.39: 233-237; Schultheiss et al., 1996, Mol.Cell Biochem.163-164. : 319-327).
[0007]
For example, common human heart disease has been regenerated in mice to develop the ability of germline gene transfer to achieve transgenic expression in all cardiac myocytes. Two other studies have shown that transgenes in the heart after somatic cell transfer in adult mammals, assuming that the gene transfer occurs in most or all of the cardiac muscle cells. Suggests a potential therapeutic benefit of the expression of. In both of these studies, which target a wide range of diseases such as cardiac hypertrophy and dilated myocardial injury, the G protein-mediated signaling pathway is targeted.
[0008]
In the first study, a cDNA encoding a peptide inhibitor of beta-adrenergic receptor kinase 1 (bARK1) was expressed under the control of a myocardial specific alpha myosin long chain promoter (Pockman et al., 1998, Proc Natl.Acad.Sci.USA95: 7000-7005). Transgenic mice incorporating this structure were introduced into a recently developed cardiomyopathy system (muscle LIM protein deficiency {MLP-1- }) The surprising finding that crossing with mice from) prevents myocardial damage in the offspring. Transgenic encoded inhibitors prevented these abnormalities through a general mechanism that is not directly related to the normal action of LIM proteins. This study shows that introduction of a similar gene structure into human heart tissue can effectively and specifically introduce such a gene structure into human cardiomyocytes, thereby causing various myocardial disorders. It suggests that it can have significant therapeutic benefits for suffering humans.
[0009]
In a second study, a cDNA encoding a peptide inhibitor of binding between cardiomyocyte adrenergic receptors and Gq subclass proteins is under the control of a myocardial-specific alpha myosin long chain promoter. Expressed (Akhter et al., 1998, Science 280: 574-577). Transgenic mice incorporating this construct were subjected to cardiac pressure overload due to intraoperative surgical aortic contraction. Cardiac overexpression of this inhibitor significantly reduced the cardiac hypertrophy response to pressure overload. Several signaling pathways associated with the human heart disease response to cardiac overload have been shown to be activated as a result of the surgical procedure. In a strong signal activation setting, a decrease in cardiac hypertrophy associated with the expression of the peptide inhibitor indicates that the inhibitor acts at a single position common to multiple signaling cascades. . This study also shows that the introduction of similar gene structures into human heart tissue can be efficiently and specifically introduced into human cardiomyocytes. It also suggests that it can have significant therapeutic benefits for people suffering from disabilities.
[0010]
Other heart disorders (eg, heart failure, myocardial infarction, rheumatic fever, rheumatic fever, arrhythmia, congestive heart failure, contagious endocarditis, and pericarditis) are associated with various non-congenital causes However, it is still possible to benefit from gene therapy if a gene vector having a nucleic acid encoding a useful gene product can be provided specifically and safely to heart tissue. Absent.
[0011]
Unfortunately, due to the location of the heart in the human body, traditionally, highly invasive procedures have been required to provide therapy directly or locally to the heart tissue. In addition to the serious physiological complications that sometimes accompany such highly invasive procedures, these interventional procedures can also place a significant psychological burden on patients receiving them. These patients withstand physical trauma and the long recovery organs associated with invasive heart procedures, and often become physically and mentally painful after recovery.
[0012]
Due to the serious lack of methods for local gene therapy in the heart and other muscle tissues, patients suffering from heart and other muscle diseases are unaware of many of the improvements made to gene vectors and their They cannot benefit from a greater understanding of how worries are alleviated by using gene therapy. The present invention provides local muscle gene therapy methods, compositions, kits and devices that answer this critical need.
[0013]
Summary of the Invention
The present invention relates to a cardiac isolation catheter that can be inserted into the vena cava of a mammal. The catheter has:
(A) a hollow tubular body comprising a venous blood flow lumen extending longitudinally therein, a near end, a far end, a near end port, and a far end port;
(B) a far end conduit sheet attached to the body; and
(C) A near-end conduit sheet attached to the body.
[0014]
The catheter is located in the mammalian vena cava, with one conduit sheet located in the mammal's superior vena cava between the right atrium and the brachiocephalic junction, and the other conduit sheet Positionable to be located in the inferior vena cava between the right atrium and the hepatic vein. The far end port is located on the far end side with respect to the far end conduit sheet. The near end port is located on the near end side with respect to the near end conduit sheet. When the catheter is installed in the vena cava of a mammal, the blood at the junction of the brachiocephalic vein and the blood in the hepatic vein are in fluid communication with the venous blood flow lumen via the ports.
[0015]
In a preferred embodiment of the cardiac interception catheter of the present invention, at least one of the distal end conduit sheet and the proximal end conduit sheet has a raised surface extending around the body. For example, the conduit sheet may be a pair of closely spaced raised surfaces so that the vena cava is in the conduit sheet by surrounding the vena cava between the pair of raised surfaces. And be seated securely. Alternatively, the conduit sheet is composed of a pair of closely spaced raised surfaces that extend longitudinally within the catheter body and positioned between the pair of closely spaced raised surfaces. It is also possible to provide a suction lumen that communicates with a suction port that allows the vena cava to be securely seated on the conduit seat by applying a suction force to the suction lumen. It is.
[0016]
In another embodiment, at least one of the far end conduit sheet and the near end conduit sheet is extensible. The extensible conduit sheet may be a balloon attached to the body and having an interior in communication with an inflation lumen extending longitudinally within the body, whereby the vena cava can After positioning within the vena cava of a mammal, it is possible to seat firmly on the conduit sheet by inflating the balloon. Both the far-end conduit sheet and the far-end conduit sheet may be configured as balloons attached to the body and having an interior in communication with the inflation lumen.
[0017]
In another embodiment of the cardiac interception catheter of the present invention, the body of the catheter is disposed between an access lumen extending longitudinally therein and between the distal and near end conduit sheets. And an access port located in the area. The access port is in communication with the access lumen. In this embodiment, the cardiac interception catheter of
[0018]
In yet another embodiment, the cardiac isolation catheter of the present invention comprises a fluid flow lumen extending longitudinally within the body thereof, and the distal and proximal conduit sheets within the body. And a right atrial fluid access port disposed therebetween. The body may have a plurality of right atrial fluid access ports disposed about the body.
[0019]
The cardiac interception catheter of the present invention may further have at least one non-invasive detectable marker.
[0020]
The present invention further relates to a surgical kit comprising the cardiac interception catheter of the present invention.
[0021]
The invention further relates to a kit for blocking a mammalian heart from the rest of the mammalian circulatory system. This kit has:
(A) the cardiac interception catheter of the present invention comprising at least one access lumen extending therein from its proximal end;
(B) a second catheter insertable into the access lumen; and
(C) Endoaortic catheter.
[0022]
The second catheter has a distal end portion and an inflation lumen extending in the longitudinal direction therein, and a balloon at the distal end portion. The interior of the balloon of the second catheter is in fluid communication with the inflation balloon of the second catheter. The intra-aortic catheter has a flexible rod having a distal end portion and a distal end tip, and an intra-aortic conduit sheet attached to the distal end portion of the flexible rod. The intra-aortic conduit sheet can be attached to the distal tip of the flexible rod. In one embodiment, the flexible rod is hollow and has an expansion lumen extending longitudinally therein. In this embodiment, the intra-aortic conduit sheet has a balloon attached to the flexible rod and having an interior in communication with the dilatation lumen, whereby the distal end of the intra-aortic catheter is attached to a mammal. After positioning in the aorta, the balloon can be inflated to ensure that the aorta is seated on the aortic conduit sheet. In another embodiment, the balloon is not disposed on the distal tip of the flexible body, the flexible body having a liquid access lumen extending longitudinally therein and a distal end of the flexible body. And a disposed liquid access port. The liquid access port is in fluid communication with the access lumen and is disposed nearer the distal tip of the flexible body than the balloon. In yet another embodiment of the kit, the second catheter has a fluid absorption lumen extending longitudinally therein and a fluid absorption port provided at the distal end of the second catheter. The fluid absorption port communicates with the fluid absorption lumen.
[0023]
The kit may have one or more of the following other components:
(D) a cannula inserted into the femoral artery of a mammal, the cannula comprising an arterial blood flow lumen extending longitudinally therein;
(E) a pump that draws blood from the venous blood flow lumen of the cardiac interception catheter and supplies blood to the arterial blood flow lumen of the cannula;
(F) a blood oxygenator for supplying oxygen to blood drawn from said mammal; and
(G) An odd vein occluder, such as one selected from the group consisting of hemostatic agents, cross fittings, balloon catheters, and hemostatic devices.
[0024]
The kit may further comprise an inflammation modifier selected from the group consisting of a vascular permeability enhancer (eg histamine) and / or a vasodilator (eg papaverine).
[0025]
The present invention relates to a composition for introducing a macromolecular assembly into mammalian extravascular tissue having the macromolecular assembly and a vascular permeability enhancer. In one embodiment, the macromolecular assembly is a gene vector. In another embodiment, the vascular permeability promoter is histamine, acetylcholine, adenosine nucleotide, arachiodonic acid, bradykinin, cyanide, endothelin, endotoxin, interleukin-2, ion permeation carrier A23187, nitroprusside, leukotriene, oxygen radical , Phospholipase, platelet activating factor, protamine, serotonin, tumor necrosis factor, vascular endothelial growth factor, bee venom, and vasoactive amine, preferably histamine or vascular endothelial growth factor.
[0026]
In another embodiment of the present invention, the composition comprises the macromolecular assembly, a vascular permeability enhancer, and a vasodilator. In one embodiment, the vasodilator is a group consisting of papavarine, nimodipine, hydralazine, nitrogen oxides, epoprostenol, tolazoline, amrinone, milrinone, nitroglycerin, denitrated isosorbide, isosorbide mononitrate, and organic nitrate compounds. And is preferably papavarin.
[0027]
In yet another embodiment of the present invention, the composition comprises the macromolecular assembly, a vascular permeability enhancer, and an oxygen transport agent.
[0028]
The present invention further provides kits for delivering macromolecular assemblies to the extravascular tissues of animals. The kit has a vascular permeability promoter and a vasodilator. In one embodiment, the kit further comprises the macromolecular assembly. In another embodiment, the macromolecular assembly encodes a gene encoding dystrophin, a gene encoding eutrophin, a gene encoding a sarcoglycan, and a minidystrophin. A gene vector having a human gene selected from the group consisting of genes.
[0029]
In yet another embodiment, the kit includes a vascular permeability enhancer, a vasodilator, and at least one disposable member for an extracorporeal circulation support device and an oxygen supply system. In one embodiment, the at least one disposable member supplies gas to a hollow body, a liquid inlet in fluid communication with the interior of the body, a liquid outlet in communication with the interior of the body, and the interior of the gas chamber. An oxygen supply device comprising: a gas inlet, at least one gas permeable membrane that separates the gas chamber from the interior of the main body, and a gas outlet that allows gas to exit from the gas chamber, The gas can be exchanged between the fluid inside the main body and the gas in the gas chamber. In the embodiment according to the kit, the kit is an oxygen supply device, the main body is a tube, and the gas permeable membrane is a polytetrafluoroethylene (PTFE) extending into at least a part of the tube. A tube, and the gas chamber is inside the PTFE tube.
[0030]
The invention further relates to a method for introducing a macromolecular assembly into the extravascular tissue of an animal, preferably a human. The method comprises the steps of supplying a vasodilator to a blood vessel associated with the tissue to increase the permeability of the endothelial layer of the blood vessel and supplying the macromolecule to the blood vessel. Thus, the assembly is introduced into the tissue through the endothelial layer of the blood vessel. In one embodiment of the method, the macromolecular assembly is a gene vector, preferably an adenoviral gene vector. The gene vector is preferably selected from the group consisting of a gene encoding dystrophin, a gene encoding eutrophin, a gene encoding sarcoglycan, and a gene encoding minidystrophin. It is a human gene such as a human gene. In another embodiment, the gene vector has a promoter / regulatory region operatively linked to the human gene, the promoter / enhancer region comprising a human skeletal muscle creatine phosphokinase promoter / regulatory region and a murine skeletal muscle. A creatine phosphokinase promoter / regulatory region, a promoter / regulatory region of a gene normally expressed in human skeletal muscle cells, and a human constitutive promoter region are selected.
[0031]
In another embodiment of the invention, the method further comprises supplying a vasodilator to the blood vessel.
[0032]
In another aspect of the invention, the tissue into which the macromolecular assembly is introduced is muscle tissue, preferably striated muscle tissue.
[0033]
In yet another embodiment, the method comprises increasing the perfusion pressure in the blood vessel beyond normal physiological perfusion pressure after delivery of the macromolecular assembly to the blood vessel.
[0034]
In yet another embodiment, the method further comprises blocking the blood vessel from the animal's blood circulatory system prior to delivery of the macromolecular assembly to the blood vessel. In one embodiment, the step of blocking the blood vessel from the blood circulation system of the animal is performed before supplying the blood vessel permeability enhancer to the blood vessel. In another embodiment, the method further comprises the step of supplying a removal solution to the blood vessel after supplying the macromolecular assembly to the blood vessel, wherein the removal solution is substantially the Does not contain vasodilators.
[0035]
In another embodiment, the method further comprises supplying an oxygen transport agent to the blood vessel after blockage of the blood vessel from the vascular circulatory system.
[0036]
In another embodiment, the method further comprises exposing the animal to extracorporeal circulation support and oxygen supply prior to supplying the vasodilator.
[0037]
In yet another embodiment, the method comprises closing the blood supply to the animal's liver prior to supplying the macromolecular assembly.
[0038]
The present invention further relates to a method for introducing a gene vector into the extravascular tissue of an animal, which method comprises the following steps:
a) blocking blood vessels associated with the tissue from the vascular circulatory system of the animal;
b) then supplying a vasodilator to the blood vessel;
c) then supplying a vascular permeability promoter to the blood vessel to increase the permeability of the endothelial layer of the blood vessel;
Supplying the gene vector to the blood vessel, whereby the vector is introduced into the tissue through the endothelial layer of the blood vessel;
Increasing the perfusion pressure in the blood vessel above normal physiological perfusion pressure; and
Supplying an oxygen transport agent to the blood vessel; and
d) then providing a removal solution to the blood vessel, the removal solution being substantially free of the vascular permeability enhancer.
[0039]
The present invention further relates to a method of supplying a gene vector to substantially all muscle tissue of an animal, the method comprising the following steps:
a) subjecting the animal to extracorporeal circulation support and oxygen supply;
b) then supplying a vasodilator to the blood circulation of the animal;
[0040]
Supplying a blood vessel permeability enhancer to the blood vessel to increase the permeability of the endothelial layer of the blood vessel;
[0041]
Supplying the gene vector to the blood vessel, whereby the vector is introduced into substantially all muscle tissue via the endothelial layer of the blood vessel; and
Increase the perfusion pressure in the blood vessel above normal physiological perfusion pressure.
[0042]
The invention further relates to a therapeutic gene vector for treating a human suffering from muscular dystrophy. The therapeutic gene vector is operatively linked to a coding region of a human gene selected from the group consisting of a dystrophin gene, an eutrophin gene, a sarcoglycan gene, and a minidystrophin gene. A nucleic acid having a promoter.
[0043]
The present invention further relates to a vena cava blood absorption kit. The kit has a catheter and a pair of conduit sheets attached thereto. The catheter has a pair of venous blood absorption ports in the catheter that communicate with a venous blood flow lumen that extends longitudinally from the venous blood absorption port to the proximal end of the catheter. The catheter can be inserted into a mammalian vena cava. In one embodiment of the kit, the catheter is the mammalian cardiac isolation catheter. In another embodiment, the catheter has a notch on the outer surface, the notch being configured to fit the body of the second catheter. In yet another embodiment, the kit further comprises an azygous occluder.
[0044]
The present invention further includes another vena cava blood absorption kit. The kit has a pair of catheters. Each catheter has a conduit sheet attached thereto and a pair of venous blood absorption ports in the catheter that communicate with a venous blood flow lumen extending longitudinally from the venous blood absorption port to the proximal end of the catheter. Have. Each catheter can be inserted into a mammalian vena cava. In one embodiment, at least one of the catheters has a notch on its outer surface, the notch being configured to fit the body of the second catheter. In yet another embodiment, the kit can further include an ostial occluder.
[0045]
The invention further relates to a method for transferring venous blood flow from a mammalian vena cava. This method comprises the step of placing the cardiac interception catheter of the present invention in the vena cava of the mammal. In one embodiment of this method, the venous blood flow lumen of the catheter is in fluid communication with an extracorporeal oxygenator.
[0046]
The present invention further relates to a method of transferring venous blood flow from a mammalian vena cava, the method comprising: placing an superior venous return catheter in the superior vena cava of said mammal; And placing in the inferior vena cava of the mammal, the upper venous return catheter and the inferior venous return catheter each have the following:
(I) a hollow tubular body having a distal end, a port, and a venous blood absorption lumen extending longitudinally from the port to the proximal end of the body within the body; and
(Ii) A conduit sheet attached to the main body, and the conduit sheet is positioned closer to the far end of the main body than the port.
[0047]
The superior venous return catheter can be positioned in the superior vena cava of a mammal such that the conduit sheet of the superior venous return catheter is located between the right atrium and the brachiocephalic junction. The inferior vein return catheter can be positioned in the inferior vena cava of a mammal so that the conduit sheet of the inferior vein return catheter is located between the right atrium and the junction of the hepatic vein. When the mammal's upper and lower vena cava is seated against both conduit sheets, vena cava blood flow from the vena cava of the mammal is transferred to both ports and both vena cava blood flow lumens. In one embodiment of this method, at least one of the lower venous return catheter and the upper venous return catheter has an access lumen that extends from the distal tip of the body to the proximal end. The catheter body further permits passage of the body through the seal while prohibiting passage of venous blood from the distal tip to the proximal end of the body through the access lumen. And having at least one penetrable seal disposed within the access lumen. For example, the penetrable seal can comprise at least one balloon.
[0048]
The present invention further relates to a method of delivering a drug to a compartment selected from the group consisting of mammalian cardiac circulation, and non-cardiac circulation, non-pulmonary circulation of mammals. The method includes the steps of blocking the cardiac circulation from non-cardiac circulation, non-pulmonary circulation, and supplying the drug to the one compartment. In one embodiment of this method, the cardiac circulation is blocked from non-cardiac circulation, non-pulmonary circulation by the following steps:
(1) The cardiac interception catheter of the present invention is inserted into the vena cava of the mammal,
(2) seat the vena cava with respect to the far end and near end conduit sheets;
(3) inserting an aortic catheter having an aortic conduit sheet into the mammalian aorta; and
(4) The aorta is seated against the conduit sheet.
[0049]
Thereby, the cardiac circulation is blocked from the systemic circulation. The cardiac isolation catheter can be comprised of a single catheter with at least two conduit sheets, or a pair of catheters having at least one conduit sheet as described herein. In one embodiment of this method, a mammalian pulmonary artery includes, for example, a second catheter having an arterial conduit sheet, a lumen extending longitudinally within the vena cava catheter, and both conduits of the vena cava catheter. It is also closed by screwing into the pulmonary artery of the mammal through the access port located between the seats and the right atrium and right ventricle of the mammal's heart, and then seating the pulmonary artery in the arterial conduit sito. In another embodiment of this method, the mammalian venous vein is also closed. The drug introduced by this method can be selected, for example, from the group consisting of a drug composition, an imaging agent, and a gene vector (eg, an adenovirus vector or an adeno-associated vector). According to this method, at least one of cardiac circulation and non-cardiac circulation can be connected to the extracorporeal oxygen supply device.
[0050]
The present invention further includes a method of delivering a device to a venous blood cavity of a mammalian heart. The method includes the steps of inserting at least one catheter into the vena cava of a mammal, transferring blood flow from the vena cava of the mammal, and supplying the device to the cavity. The catheter includes at least two conduit sheets positionable within a mammalian vena cava, an access port, and an access lumen extending longitudinally from the catheter access port to a proximal end within the catheter. And have. Blood flow from the vena cava is transferred by seating the vena cava against the conduit sheet, so that the venous blood flow is from the vena cava through the blood absorption port to the venous blood flow lumen. Flowing. The device is supplied to the cavity by passing the device through the access lumen through the access port and into the cavity.
[0051]
Detailed Description of the Invention
The present invention includes compositions, methods, and devices for introducing macromolecular access, such as gene vectors, into extravascular tissues, such as muscle tissue. These compositions, methods, and devices of the present invention use a vascular permeability enhancer to alter the permeability of the vascular endothelial layer. In some embodiments of the present invention, the composition, method, and device are introduced into a blood section that would be too narrow to house the assembly in the absence of a vasodilator. Vasodilators are used to improve the capacity of the macromolecular assembly. Accordingly, in some embodiments, the compositions, methods, and devices of the present invention comprise the use of a vasodilator to improve the introduction of a gene transfer vector into a normally inaccessible portion of a blood vessel, and Including the use of vascular permeability enhancers to improve passage through the endothelial layer of blood vessels. A kit comprising a composition effective for carrying out the method of the invention, an oxygen supply device, and one or more composition and / or device (s) for carrying out the method of the invention. There is also provided an apparatus comprising:
[0052]
The present invention relates to (independent) use of adenovirus vectors and adeno-related vectors as gene transfer vectors, use of vascular permeability promoters such as histamine to improve microvascular access and permeability, papabarin and the like And the use of other vasodilators. Thus, although the present invention is not limited to the use of these viral vectors as gene transfer vehicles, the present invention has been developed to promote microvascular access and permeability for macromolecular assemblies. This is exemplified by the use of these viral vectors to demonstrate the effectiveness of the compositions, methods and devices. Accordingly, the present invention should not be construed as limited to the use of these viruses as gene transfer vehicles, or the use of histamine and papabaline as a means of modifying microvascular access and permeability.
[0053]
The continuous endothelium of the blood vessels that provides blood supply to skeletal muscle prevents adenovirus from exiting the vascular space into muscle tissue. A different staining pattern appears after the marker virus is injected into the femoral artery upstream of a series of muscle fibers, compared to the staining pattern that occurs after the markers are injected directly into the muscle fiber stroma.
[0054]
By others, the absorption of adenoviral vectors by cells of extravascular tissue depends entirely or mainly on their presence on those cells of the viral receptor protein specifically bound by the vector. It has been hypothesized that it facilitates absorption. Thus, conventionally, adenoviral vectors have been poorly used as vectors for introducing genes into muscle tissue through the mammalian blood circulation because of the lack of appropriate adenoviral receptors on muscle cells. It was thought that. The data presented here, as well as the observation that adenoviral vectors are directly introduced into muscle tissue, for example, by direct injection of the vector suspension into muscle tissue, shows that the genes of adenoviral vectors are transferred via blood flow. The ability to introduce into muscle tissue is much more dependent on the ability of the vector to penetrate the endothelial layer of the blood vessel than the presence of adenovirus receptor protein on the surface of the cells of the tree. Is shown.
[0055]
Capillary endothelium supplying the liver by autopsy after adenoviral gene transfer via blood flow, the appearance of the mouse liver, the effect of pringle manipulation on the mouse liver appearance, and the discontinuity of the liver microvessel It is illuminated that the wall has a discontinuity of 1 micron in diameter. These discontinuities are those that contain milk fistula particles that are 600 nanometers or less in diameter, as shown by the fact that they pass freely from the vascular space to the space surrounding the hepatocytes. Thus, the liver removes any particles containing, for example, circulating adenoviral gene vectors by a process similar to filtration. If it is desired to introduce an adenoviral gene vector into extravascular tissues such as striated muscle, the vector's questing in the liver is undesirable. Therefore, in the present invention, performing a pringling operation in relation to supplying a macromolecular assembly, such as an adenoviral gene vector, to the blood stream of a mammal reduces the liver request of the assembly. It has been discovered that this allows for a more efficient introduction of the assembly into the desired extravascular tissue such as muscle tissue.
[0056]
Skeletal muscle is a highly vascular tissue. Because muscle plays a unique physiological role for mammals, extreme vascular qualities are considered advantageous for gene therapists. The tissue has the largest metabolic range of all tissues, which is the ratio of the basal metabolic rate of unstimulated tissue compared to its metabolic rate after maximal stimulation. For example, resting metabolic rate of skeletal muscle tissue is equivalent to hydrolysis of 2 micromole adenosine triphosphate per wet tissue per minute. Upon maximum stimulation, the metabolic rate is equivalent to hydrolysis of about 120 micromoles of adenosine triphosphate per wet tissue per minute. During anoxic splints, the metabolic rate is equivalent to hydrolysis of about 480 micromoles of adenosine triphosphate per wet tissue per minute. More importantly, most capillaries of skeletal muscle tissue are not perfused at rest. Nevertheless, skeletal muscle is the preferred tissue for free tissue metastasis in reconstruction surgery because of its vascular quality.
[0057]
The striated muscle is a formidable target for gene transfer. This constitutes about half the weight of most mammals. The myocardium is a type of striated muscle. Patients with muscular dystrophy also suffer from heart disease. Muscle is supplied with blood by blood vessels with continuous endothelium. Under normal physiological conditions, the endothelial layer of these vessels is a protein having a stalk diameter of about 3 nanometers, which is about 1/13 of the radius of an adenovirus having a stalk diameter of about 70-90 nanometers. It is substantially impermeable to albumin. Therefore, in order to allow an adenoviral gene vector to pass through that layer, the permeability of the endothelial layer of the blood vessels supplying blood to muscle tissue is controlled by the permeability of that layer under normal physiological conditions. It is necessary to increase significantly with respect to sex.
[0058]
Muscle is a highly vascular tissue that far exceeds half the total capillary surface area of a mammal's body. As a result, if the muscle endothelium becomes permeable to albumin-sized molecules, the circulatory system will collapse without the extracorporeal circulation support device and the mammal will be shocked. Thus, an endothelial barrier is essential for homeostasis of circulating blood volume. During normal circulatory homeostasis, the flow of blood through individual cells in the body supplies oxygen at a rate suitable to meet the respective demands of the cells. During the shock, this flow rate drops from that level to an unsustainable level, which causes cellular oxygen deprivation and cell death if the shock lasts for a sufficient amount of time.
[0059]
Endothelial pathophysiology, i.e., dysfunction of the walls of the microcirculatory pathway in the body, occurs in a wide range of physiological conditions including inflammation, hypersensitivity, septic shock, cardiopulmonary bypass, carcinoid syndrome, and carcinoid crisis. Each of these conditions is accompanied by an increase in vascular endothelial permeability that allows not only water, cations, anions, but also large macromolecules to permeate the endothelial barrier.
[0060]
The present invention is based on the observation that permeabilization of vascular endothelium facilitates macromolecular assembly such as adenovirus gene vectors, and transfer from vascular space to extravascular tissues such as muscle tissue via vascular endothelium. It is. As described herein, vascular endothelial permeability can be increased physiologically. Therefore, it is possible to manipulate endothelial permeability without necessarily causing anaphylactic shock by using a vascular permeability promoter such as an inflammation preparation agent or a derivative thereof. Vascular permeability enhancers are regulators that are selected depending on the rapid rate at which they act to change endothelial permeability and the reversibility of their action.
[0061]
The composition of the present invention has a macromolecular assembly such as a gene transfer vector and a vascular permeability promoter. A suitable gene transfer vector is a viral vector, more specifically an adenoviral vector.
[0062]
Preferably, such a gene vector comprises a gene encoding dystrophin, a gene encoding eutrophin, a gene encoding sarcoglycan, a gene encoding minidystrophin, etc. Has a human gene. The gene vector comprises a human skeletal muscle creatine phosphokinase promoter / regulatory region, a murine skeletal muscle creatine phosphokinase promoter / regulatory region, a promoter / regulatory region of a gene normally expressed in human skeletal muscle cells, and a human component. It may have a promoter / regulatory region operatively linked to the human gene, such as a promoter region. Methods for constructing gene vectors are well known in the art.
[0063]
A suitable vascular permeability enhancer is one that alters the permeability of the vascular endothelium to such an extent that the endothelium will accommodate a viral vector of about 150-200 nanometers in diameter. Histamine, acetylcholine, adenosine nucleotide, arachiodonic acid, bradykinin, cyanide, endothelin, endotoxin, interleukin-2, ion-permeable carrier A23187, nitroprusside, leukotriene, oxygen radical, phospholipase, platelet activating factor, protamine, serotonin, tumor necrosis factor, Various such vascular permeability promoters are known including, but not limited to, vascular endothelial growth factor (VEGF), bee venom, and vasoactive amines. Of these listed substances, two are preferred, namely histamine and VEGF.
[0064]
Histamine has been extensively characterized and its pharmacological properties are relatively well understood. As described herein, histamine is an effective agent to promote vascular endothelial permeability to the extent that adenoviral gene vectors can pass from the blood stream to extravascular tissue. Thus, histamine is a preferred vascular permeability promoter of the present invention. There are various known undesirable side effects of administering histamine to mammals. Antihistamines and histamine receptor antagonists are known which are effective in reversing or reducing these side effects in mammals. The use of these compositions in combination with or after the following administration of histamine to mammals is considered as a variant of the invention. While not wishing to be bound by any particular theory, certain antihistamines may be used by histamine H1 or H2 receptors without affecting the interaction of histamine with one or more other histamine receptors. It is believed that they act by blocking, reversing, or antagonizing the binding of histamine to one or more histamine receptors. Thus, certain antihistamines may be particularly effective in preventing or reversing the undesirable side effects of histamine administration comforting mammals without affecting the vascular permeability promoting properties of histamine. . It is contemplated in the present invention that such antihistamines be administered in parallel with or after administration of histamine in mammalian compositions, methods, and methods.
[0065]
VEGF has been shown to be an effective vascular permeability promoter at much lower concentrations than histamine. Furthermore, VEGF does not have all of the undesirable side effects induced by histamine (Roberts et al., 1995, J. Cell Sci. 108: 2369-2379; Roberts et al., 1997, Cancer Res. 57: 765-772; Sanger et al., 1990, Cancer Res. 50: 1774-1778). Accordingly, VEGF is a preferred vascular permeability promoter of the present invention.
[0066]
The present invention is also based on the observation that capillary vasodilation improves the efficiency of gene transfer from vascular space to extravascular tissue via the vascular endothelium. This effect is less important in the liver, depending on the openness of this organ, but is very important in other extravascular tissues such as muscle tissue where most of the capillaries are not perfused at rest. . Vasodilation causes the lumen of the capillary to dilate and is not constrained by any particular operating principle, but may also cause or improve the openness of the vascular endothelium. Thus, vasodilation improves drainage from blood vessels to extravascular tissue. As described herein, a vasodilator composition improves the introduction of a vascular permeability enhancer to narrow a portion of the blood vessel, thereby acting on a larger portion of the endothelial surface of the blood vessel. By improving the effectiveness of the drug. Vasodilation also improves the introduction of a macromolecular assembly to narrow a portion of the blood vessel, thereby making available a larger endothelial surface area for the introduction, thereby allowing percutaneous introduction of the assembly. Improve. Many vasodilators include, but are not limited to, papaverine, nimodipine, hydralazine, nitrogen oxides, epoprostenol, tolazoline, amrinone, milrinone, nitroglycerin, denitrated isosorbide, isosorbide mononitrate, and organic nitrate compounds. Known in the art.
[0067]
Accordingly, the present invention includes a composition having a macromolecular assembly such as a gene transfer vector, a vascular permeability enhancer, and a vasodilator. Preferably, the vasodilator is papavarin.
[0068]
In one embodiment, the composition of the invention has a pharmaceutically acceptable carrier, such as an isotonic buffer. The composition can be administered to a mammal to introduce an amount of the macromolecular assembly ranging from 1 nanogram per kilogram body weight per day to 100 milligrams per kilogram body weight per day. The composition can be administered in one or more donations, with multiple donations occurring over several days, weeks, or months.
[0069]
The vascular permeability promoter and / or vasodilator of the composition of the present invention, or both, can be supplied to mammalian blood vessels as a medicinal composition. The medicinal composition useful in the method of the present invention can be administered to the body as an oral solid preparation, as an eye drop, a suppository, an aerosol, a coating or other preparation. In addition to the vascular permeability enhancer and / or the vasodilator, these medicinal compositions contain a pharmaceutically acceptable carrier and other ingredients known to facilitate and facilitate drug administration. Can be included. Other possible formulations such as nanoparticles, liposomes, resealed erythrocytes, and immune-based systems may also be used to administer the vascular permeability enhancer and / or vasodilator according to the method of the present invention. Can do.
[0070]
In another embodiment, the composition of the present invention further comprises an oxygen transport agent so that oxygen is supplied to the extracorporeal tissue, for example during exposure to a tissue gene transfer vector. All oxygen known in the art, such as blood of mammals to which the composition is administered, blood from different individuals of the same type of mammal, perfluorocompound solutions, hemoglobin-containing compositions, etc. A transport agent can be used.
[0071]
The composition of the present invention can be provided as a kit for introducing a macromolecular assembly into mammalian extravascular tissue, and the kit comprises a vascular permeability promoter and a vasodilator. Preferably, the vascular permeability enhancer is histamine or vascular endothelial growth factor, and the vasodilator is hapavalin. When the kit is used to introduce a gene vector into extravascular tissue, the kit can further include a gene vector such as an adenovirus vector. Preferably, such a gene vector is a human gene such as a gene encoding dystrophin, a gene encoding eutrophin, a gene encoding sarcoglycan, a gene encoding minidystrophin. . The gene vector further comprises a human skeletal muscle creatine phosphokinase promoter / regulatory region, a murine skeletal muscle creatine phosphokinase promoter / regulatory region, a promoter / regulatory region of a gene normally expressed in human skeletal muscle cells, and a human component promoter. A region has a promoter / regulatory region operatively linked to the human gene, such as a promoter / regulatory region operably linked to the human gene. Methods for constructing these gene vectors are well known in the art.
[0072]
Other compositions of the invention can be provided as kits for introducing macromolecular assemblies into the myocardium. Suitable macromolecular assemblies of this kit include, for example, medicinal or other therapeutic compositions useful for treating cardiomyopathy. Such compositions comprise a gene vector having a polynucleotide that encodes a gene product that exerts a therapeutic effect when expressed in the myocardium. Examples of gene products include, but are not limited to, angiotensin 1 receptor, or proteins such as VEGF, angiotensin 1,
[0073]
The present invention is further based on the observation that the pharmacological range of the composition of the present invention is expanded by the mechanical circulatory system support device and the extracorporeal oxygen supply device. In other words, when a mammal is connected to a cardiopulmonary device, it can do all of the following: The heart is functionally protected from the effects of the vascular permeability enhancer and vasodilator contained in the composition. Large vasodilation in the absence of an extracorporeal support device leads to reflex tachycardia and increased contractility to the heart, both of which are already genetically deficient, such as the human heart suffering from muscular dystrophy. Damages the damaged heart. Furthermore, extracorporeal circulation allows independent control of pulmonary perfusion pressure, including that within the pulmonary artery. By placing a large cannula in the right ventricle of the human heart, it is possible to withdraw blood from the right atrium before filling the right ventricle during diastole. This lowers the systolic pulmonary artery and reduces effusion from the blood vessels into the pulmonary parenchyma, thereby preventing fluid accumulation in the human lung. This is important to minimize the acute morbidity of the interventional procedure. The extracorporeal circuit also ensures vascular access to rapid replacement of fluid passing from the blood stream to extravascular tissue during drainage, and maintaining proper tissue oxygenation throughout the body during the procedure. Make it possible. The oxygen supply provided by the cardiopulmonary device is independent of the pulmonary-arterial rate of change, thereby avoiding hypoxemia associated with pulmonary edema. In other words, the blood circulating through the extracorporeal pump is fully oxygenated prior to introduction into the body. Extracorporeal circuits are also set up with minimal invasive access routes.
[0074]
Therefore, the kit of the present invention can further have an oxygen transport agent or at least one disposable member of an extracorporeal circulation system support device and an oxygen supply device. For example, the at least one disposable member separates the gas chamber from a hollow body, a liquid inlet in fluid communication with the interior of the body, a gas inlet for supplying gas to the interior of the gas chamber, and the interior of the body. It has at least one gas permeable membrane and a gas outlet allowing gas outflow from the gas chamber, whereby gas exchange is performed between the inside of the main body and the gas in the gas chamber. The oxygen supply device can be configured similar to that shown in FIGS. 8 and 9, wherein the gas permeable membrane is a PTFE tube extending within at least a portion of the tube, and the gas The chamber is inside the PTFE tube.
[0075]
In addition to the composition of the present invention, it has at least one disposable member of an extracorporeal circulation system support device and an oxygen supply device, and at least one cannula for supplying the composition of the present invention to a blood vessel of a mammal. An effective kit for carrying out the method of the present invention is also proposed. Preferably, the kit includes a macromolecule access, a vascular permeability enhancer, a syringe or a length of peristaltic pump tube, and a cannula such as a hollow bore needle configured to fit the syringe. It has all of the single use components needed to carry out the method. The kit further includes a vasodilator, a pharmaceutically acceptable carrier, a second cannula, an oxygen transport agent, a remover substantially free of the vascular permeability promoter, a clamp, hemostatic forceps or hemostasis. It may have one or more vascular occlusion devices such as a band, a disposable oxygen supply device, etc.
[0076]
The method of the present invention is a method for supplying macromolecular assemblies such as gene vectors to mammalian extravascular tissues. The extravascular tissue can optionally be blocked from the systemic circulatory system (eg, myocardial tissue or limb muscle tissue blocked from the systemic circulatory system). The method comprises providing a vascular permeability enhancer to a blood vessel associated with the tissue to increase the permeability of the endothelial layer of the blood vessel, whereby the vector passes through the endothelial layer of the blood vessel. Supplied to the tissue. The vascular permeability enhancer can be supplied to the blood vessel at the same time as the vector, or can be supplied to the blood vessel before or after the vector is supplied. Preferably, the vascular permeability enhancer is histamine or VEGF. For example, a composition containing 10 millimoles of histamine and adenovirus can be supplied to a mammalian blood vessel, where the histamine improves vascular permeability, whereby the adenovirus is: It can pass through the endothelium of blood vessels to extravascular tissues such as muscles in the vicinity of the blood vessels. The concentration of the vascular permeability enhancer used in the method depends on the type of the drug, but tensioning after exposure to the drug, blood vessels have greater permeability than before exposure to the drug As such, it must be sufficient to increase vascular permeability. Effective concentrations of vascular permeability enhancers are known in the art.
[0077]
In another embodiment, the method of the present invention further preferably applies to the blood vessel before supplying the gene vector to the blood vessel, and preferably before supplying the blood vessel permeability enhancer. And supplying a vasodilator. The vasodilator can be delivered before, during or after delivery of the composition of the present invention. The concentration of the vasodilator is not critical, but it must be large enough to induce vasodilation in the blood vessel. As described herein, various vasodilators are known in the art, as are the concentrations of those agents that are effective in promoting vasodilation. Higher concentrations of vasodilators are used when the mammal to which the vasodilator is administered is applied with a mechanical circulatory support device to compensate for the physiological side effects of the vasodilator. It is considered possible. It is preferred to use papavine in the method of the present invention.
[0078]
The method of the present invention provides a macromolecular assembly for all extravascular tissues, including but not limited to muscle tissue, striated muscle tissue, myocardial tissue, bone tissue, bone marrow tissue, skin tissue, brain tissue, etc. Can be used to do. As described herein, it is not necessary to use the method of the present invention to supply such assemblies to certain extrapancreatic tissues such as the liver and spleen. However, the method of the present invention can be used to deliver macromolecular assemblies to all extravascular tissues, whether or not they are fenestrated.
[0079]
The mammal supplied with the composition of the present invention is preferably a mammal, more preferably a human. It is specifically contemplated to supply the composition of the invention to a human suffering from muscular dystrophy.
[0080]
In one variation of the method of the present invention, after supplying the gene vector to the blood vessel, the perfusion pressure in the blood vessel is increased above the normal physiological perfusion pressure. The increase in perfusion pressure can be 5 to 80 pounds per square inch or more. However, those skilled in the art can use the information disclosed herein to assess the benefits gained by increasing perfusion pressure and the corresponding risk of tissue damage. In situations where the blood vessels are blocked from the mammal's blood circulatory system, particularly the mammalian heart, the risk of damage to the mammal is relative to increased perfusion pressure compared to situations where the blood vessels are not blocked. It is considered that the dependency is low.
[0081]
In the method of the present invention, vascular occlusion is useful for a number of reasons. As described in the preceding paragraph, the pressure in other blood vessels and tissues of the mammal can be minimized by blocking the blood vessels before increasing the pressure in the blood vessels. Occlusion of the blood vessel supplied with the composition of the present invention can further minimize the amount of the composition available to the mammalian circulatory system or other tissues of the mammal. If the composition is a certain amount of a vascular permeability enhancer or vasodilator that would be harmful if supplied to the mammalian circulatory system, questing of the composition against the blood vessels is effective. This can be accomplished by occluding the desired blood vessel prior to delivering the composition to the blood vessel. If the occlusion continues for several minutes or more, it is also useful to supply an oxygen transport agent to the blood vessel. Furthermore, it may be useful to continue to occlude blood vessels until the vascular permeability enhancer, vasodilator, or both are metabolized to harmless levels.
[0082]
Alternatively, after the composition of the present invention is supplied to the blood vessel, a removing agent can be supplied to the blood vessel. This remover is substantially free of the vascular permeability promoter and preferably free of any vasodilators that are desired to be present in the composition of the present invention. By supplying the removal composition to a blood vessel after the supply of the composition of the present invention, the blood vessel permeability enhancer or vasodilator that was supplied to the blood vessel but was not metabolized or absorbed by mammalian tissue Can be diluted or “washed out”. Preferably, the removal composition is continuously supplied to the blood vessel in a plurality of individual aliquots.
[0083]
In particular, the macromolecular assembly of the composition can be sequestered when the composition of the present invention is supplied to a mammalian blood circulatory system or part of that system that includes liver blood flow vessels. It may be effective to close the blood vessels supplying the tissue. For example, as described herein, temporary hepatic flow obstruction minimizes adenoviral quest. The Pringle operation places the surgeon's index finger behind the hepatoduodenal mesentery so that the two main blood vessels that supply blood to the liver with the thumb can be occluded: the hepatic artery and the portal vein Is. This treatment can be performed in humans from the age of 1 and it is known that hepatic inflow occlusion within 1 hour is acceptable.
[0084]
In the method of the present invention, any method for occluding the flow passing through the blood vessel can be used. Various methods of occlusion are known, such as occlusion with a finger by a surgeon applying finger pressure, use of hemostatic forceps, use of a tourniquet, an angiographically or X-ray structured balloon, etc. It has been.
[0085]
If it is desired to supply the composition to the mammalian body blood circulatory system rather than to the mammalian lungs, the method of the present invention further comprises before supplying the vascular permeability promoter. The method includes the step of subjecting the mammal to an extracorporeal circulation support device and an oxygen supply device. Preferably, a cardiopulmonary device is used in a known manner. The extracorporeal system support device and oxygen supply device minimize blood flow to the lungs of the mammal, thereby minimizing drainage from the mammal's pulmonary blood vessels to the lungs.
[0086]
FIG. 5 shows a method for applying a human to the extracorporeal circulation support device and the oxygen supply device. In this method, an ECLS pump oxygenator is connected to a pair of cannulas inserted in a human as shown in FIG. 3, one cannula being inserted into the human right atrium and the other cannula being a human aorta. It extends in. Blood is drawn from the right atrium, oxygenated extracorporeally, and returned to human body tissue (eg, the aortic arch or femoral artery) with controlled pressure and flow. Using this method, blood flow to the lungs is minimized and drainage from the pulmonary blood vessels into the lung parenchyma is minimized. As illustrated in FIG. 4, human hepatic blood flow is also occluded.
[0087]
One devised embodiment of the method of the present invention is a method of supplying a gene vector to mammalian extravascular tissue. This method has the following steps. The blood vessels associated with the tissue are blocked from the mammalian vascular circulatory system. Thereafter, a vasodilator is supplied to the blood vessel. Thereafter, a vascular permeability promoter is supplied to the blood vessel to increase the permeability of the endothelial layer of the blood vessel, and the gene vector is supplied to the blood vessel, whereby the vector is supplied to the tissue via the endothelial layer of the blood vessel. Is done. The perfusion pressure in the blood vessel is increased above the normal physiological perfusion pressure, and an oxygen transport agent is supplied to the blood vessel. Thereafter, a remover is supplied to the blood vessel. This remover is substantially free of the vascular permeability enhancer.
[0088]
Thus, according to this embodiment of the method of the present invention, the supply of a gene vector to extravascular tissue comprises the presence of the vasodilator, the presence of the vascular permeability enhancer, and the cannula in a mammalian vessel. Increased by increasing fluid pressure. Furthermore, the gene vector and both drugs remain blocked by occlusion of the blood vessels before the supply of these vectors and drugs. Since the oxygen transport agent is supplied to the blood vessel, the blood vessel can remain occluded, and the vector and the drug can stay in the blood vessel for a long time. Also, because removal agents are supplied to the blood vessels, excess vectors and drugs are removed from the blood vessels before the mammalian body blood circulation is re-established. Undesirable side effects caused by presence in areas of the mammalian body other than blood vessels are minimized.
[0089]
The method of the present invention can be used to supply a gene vector to substantially all muscle tissue of the present invention. The method includes the following steps. The mammal is subjected to an extracorporeal circulation support device and an oxygen absorber. Thereafter, a vasodilator is supplied to the blood circulation system of the mammal, a vascular permeability promoter is supplied to the blood circulation system in order to increase the permeability of the endothelial layer of the blood circulation system, and the gene vector is blood Supply to the circulatory system. Thereby, the vector is supplied to substantially all muscle tissue through the endothelial layer of the blood circulatory vessels. Then, the perfusion pressure in the blood circulation system is increased beyond the normal physiological perfusion pressure. In order to reduce the sequestration of the gene vector in the mammalian liver, a pringle operation can be performed to occlude the hepatic blood flow to the liver. In order to reduce the sequestration of the gene vector during mammalian incorporation, a complete built-in inflow occlusion can be performed. Complete built-in inflow occlusion is possible, for example, by occluding blood flow through the abdominal axis bone, superior mesenteric artery, and inferior mesenteric artery and can be maintained for at least 15 minutes. . These three vessels can be accessed, for example, by laporoscopic or surgical procedures, or by passing a balloon through the femoral artery.
[0090]
Another important example of a mammal is a method of supplying fluid (eg, having a gene vector) to the mammalian myocardial tissue with little supply to other muscle tissue of the body. This method comprises the step of blocking the mammalian cardiac circulatory system from the systemic circulatory system. The mammalian cardiac circulatory system can be blocked from the systemic circulatory system using any of the methods described herein in Example 6. As described herein, the minimally invasive method using the cardiac interception catheter of the present invention is preferred. These methods can be used, inter alia, for the purpose of supplying gene vectors to myocardial tissue. In order to improve the supply of the gene vector to the blocked myocardial tissue, the inflammation regulator of the present invention is used in the heart to wash away from the cardiovascular system before remixing the cardiovascular and systemic system Can do.
[0091]
The apparatus of the present invention has an oxygen supply device that can be used to supply an oxygen transport agent, such as blood of the present invention, before supplying a drug to the blood vessel of the present invention. The oxygen supply device of the present invention includes at least one of a hollow main body, a liquid inlet in fluid communication with the inside of the main body, a gas inlet for supplying gas to the inside of the gas chamber, and the gas chamber from the inside of the main body. There are two gas permeable membranes and a gas outlet that allows gas to flow out of the gas chamber, whereby gas exchange is performed between the inside of the main body and the gas in the gas chamber. The oxygen supply device can be configured similar to that shown in FIGS. 8 and 9, wherein the gas permeable membrane is a PTFE tube extending within at least a portion of the tube, and the gas The chamber is inside the PTFE tube. Due to the simple structure of the oxygen supply device of the present invention, it can be constructed at low cost and can be handled as a single use disposable member of the extracorporeal oxygen supply device. The simple structure of the oxygen supply device of the present invention further allows it to be manufactured in dimensions adapted to supply a very small amount of liquid oxygen, such as the amount of mammalian vessel contents. Become. By changing the dimensional ratio of the oxygen supply device, in particular the surface area of the gas permeable membrane that allows the liquid phase to contact the body of the oxygen supply device, the oxygen supply device can be used in virtually any liquid phase. The flow rate can be supported. Such proportioning methods are well known in the art.
[0092]
The oxygen supply device of the present invention is used by passing an oxygen supply agent through the main body of the oxygen supply device, whereby the drug contacts the gas permeable membrane. Oxygen, air or other gas supplied to the gas chamber can diffuse into the drug through the gas permeable membrane and can be supplied to the blood vessels of the mammal. As described herein, any oxygen supply can be used. When the amount of drug to be delivered to the occluded blood vessel is small, an oxygen supply device having a relatively small amount in its hollow body is used, and similarly, the oxygen supply device supplies oxygen to a larger amount of drug. When used to do so, an oxygen supply device having a proportionally large amount is used.
[0093]
The hypothesis that the medicinal range of the inflammation regulator / vasodilator mixture is expanded by mechanical circulation support device and extracorporeal oxygen supply can be seen in the following information. In the present invention, the interrupted and diffused heart withstands the same histamine and papabaline doses used for skeletal muscle, which are washed away before the modulator is restored to systemic circulation. As long as it was acceptable. If these compounds enter the cardiac circulatory system without a support device, a cardiac shock occurs.
[0094]
Two methods can be used to support the heart during administration of histamine and papaverine. First, a suitable donor heart can be blocked and spread outside the body prior to transplantation of the treated mammalian heart. Second, the femoral circulatory system is first transplanted, cannulated into the tributary vessels of the upper abdominal system, the heart is diffused in situ, and the cannula is removed from the system before it is removed from the system. Flush using a hindlimb tourniquet that prevents the drug from leaking into the system. Both of these procedures make very transient use of the supersiological diffusion pressure that is possible with a modified pump oxygenator without the need to use any circulating support device for the rest of the mammal. It becomes possible. Thus, the heart and lungs of the mammal being treated are still functioning normally.
[0095]
Devices and methods for delivering compositions to blood vessels are well known in the art, for example via cannulation, syringe-mounted hollow bore needle delivery, fixed length flexible tubing engaged by a peristaltic pump. There are supplies, etc. However, the present invention includes several new and useful devices for performing the methods described herein.
[0096]
For example, the present invention includes a cardiac isolation catheter that can be inserted into the vena cava of a mammal such as a human. This cardiac interception catheter has:
(A) a hollow tubular body comprising a venous blood flow lumen extending longitudinally therein, a near end, a far end, a near end port, and a far end port;
(B) a far end conduit sheet attached to the body; and
(C) A near-end conduit sheet attached to the body.
[0097]
The catheter is located in the mammalian vena cava, with one conduit sheet located in the mammal's superior vena cava between the right atrium and the brachiocephalic junction, and the other conduit sheet Positionable to be located in the inferior vena cava between the right atrium and the hepatic vein. This configuration allows the right atrium to be blocked from the non-cardiac and non-pulmonary venous circulatory system, but in order to completely block the right atrium from the non-cardiac blood circulatory system, it may also be necessary to occlude the odd vein It is recognized that it cannot. The far end port of the cardiac interception catheter is located on the far end side with respect to the far end conduit sheet. The near end port is located on the near end side with respect to the near end conduit sheet. Since both the near-end port and the far-end port of the cardiac isolation catheter are in communication with the venous blood flow lumen of the catheter, the blood at the junction of the brachiocephalic vein and the blood of the hepatic vein are passed through these ports. In fluid communication with the venous blood flow lumen. Accordingly, the cardiac circulatory system is blocked from the non-pulmonary circulatory system by placing the cardiac blocking catheter in the vena cava of the patient.
[0098]
In one embodiment, the cardiac isolation catheter has one or more right atrial fluid access ports in communication with fluid access lumens extending longitudinally within the catheter from both ports of the catheter to the proximal end. . Fluid from the right atrium, right ventricle, and proximal end of the pulmonary artery can be removed from the heart through these ports. Such fluid flow can be driven by intracardiac pressure, extracorporeally generated suction applied to the fluid access lumen, or both. When a suction force is applied to the fluid access lumen, the fluid access lumen can also communicate with the suction port (s) associated with the catheter's conduit sheet (s) (or another aspiration). Lumen can be used). If there are multiple right atrial fluid access ports, they preferably surround around the two bodies of the catheter to minimize the possibility of all ports being blocked by veins or cardiac tissue. Arranged in the direction.
[0099]
If the cardiac occlusion catheter is used to supply fluid (eg, fluid containing a gene vector) to the cardiac circulatory system, it is not necessary to occlude the cardiac circulatory system from the pulmonary veins. Intracardiac valves prevent fluid backflow from the left atrium and left ventricle into the pulmonary veins. However, to prevent fluid from entering the pulmonary circulatory system from the heart, the pulmonary circulatory system can be isolated from the cardiovascular fluid by occluding the pulmonary artery. The pulmonary artery can be occluded by using the cardiac interception catheter of the present invention and a second catheter fitted with an occlusion device.
[0100]
For example, the second catheter may be a catheter having a far end portion and a conduit sheet provided at the far end portion. The second catheter is insertable into at least one lumen (eg, its fluid flow lumen) of the cardiac isolation catheter and extends therefrom through an access port. The second catheter is positionable within the patient's heart such that the conduit sheet of the second catheter penetrates from the access port through the right ventricle to the root of the pulmonary artery. The second catheter can be “operable” using methods well known in the art. Such methods generally involve associating the catheter with a rigid filament (eg, a wire) such that when a longitudinal or torque force is applied to the filament, the tip of the catheter is curved, It is displaced or deformed, or a curvature occurs in the catheter, which allows the catheter to be more easily guided through non-straight passages. Similarly, the catheter can be guided by inserting a hard filament within the lumen of the catheter so that the shape of the catheter becomes the shape of the hard filament, allowing the catheter to pass through a non-straight passage. It is possible to guide more easily.
[0101]
The second catheter may additionally or alternatively be shaped to match the shape of the patient's heart (eg, shape adapted to the interior of a human heart). When the second catheter has such a adapted shape, the catheter can be provided with a removable sheath covering it, so that the sheath is in its adapted shape upon removal of the sheath. Can be formed. Preferably, the conduit sheet is located in the pulmonary artery at a position on the far end side of the pulmonary valve. By seating the pulmonary artery against the conduit sheet of the second catheter, fluid flow through the pulmonary artery is occluded. The conduit sheet may be disposed at the distal end portion of the second catheter, or may be disposed so as to surround the periphery of the distal end portion of the catheter, and the distal end portion of the second catheter is disposed in the conduit sheet. It is also possible to arrange so as to extend beyond the distance to the far end side.
[0102]
Alternatively, the cardiac interception catheter may have a notch or a recess adapted to the shape of the body of the second catheter on the outer surface thereof. As shown in FIG. 17B, the second catheter 40B can be inserted into the vena cava independently of the cardiac interception catheter 10 (and preferably before the cardiac interception catheter). Forty bodies can be arranged to fit within the notches formed in the cardiac interception catheter at the point where the vena cava sits against the conduit sheet of the cardiac interception catheter.
[0103]
When the distal end of the second catheter extends distally beyond the conduit sheet, the distal end extends longitudinally into the second catheter to draw fluid from the lumen of the pulmonary artery. An orifice can be provided in communication with the exiting lumen. Alternatively or additionally, the second catheter may be used to draw fluid from the right atrium, right ventricle, pulmonary artery root (ie, the portion of the pulmonary artery located proximal to the conduit sheet). , One or more ports located proximal to the conduit sheet in communication with a lumen extending longitudinally into the second catheter. By withdrawing fluid from the pulmonary artery, fluid flow that may leak through the conduit sheet is minimized, thus preventing mixing of the cardiovascular and pulmonary systems. By previously extracting fluid from the root of the right atrium, right ventricle, or pulmonary artery, the fluid supplied to the interrupted cardiac circulatory system and the systemic circulatory system may be further mixed when the two circulatory systems are remixed. Is prevented.
[0104]
In order to isolate the patient's cardiac circulatory system from the patient's venous and arterial circulatory system, the cardiac interception catheter of the present invention is used to occlude the body venous blood flow through the vena cava to the heart and a second catheter. Is used to occlude the pulmonary artery blood flow and occlude the arterial blood flow from the aortic root to the systemic circulation. To occlude the aortic blood flow, virtually any method known (eg, clamp, suture, intra-arterial balloon, etc.) or later developed can be used. In order to minimize trauma to the patient, it has an aortic conduit sheet that is positioned above the coronary artery but below the aortic arch (ie, relative to the heart, brachiocephalic artery) Preferably, the arterial blood flow is occluded using an intra-arterial catheter that can be positioned in the patient's aorta. By seating the aorta on the arterial conduit sheet, the intra-arterial catheter is installed and fluid flow through the aorta is occluded.
[0105]
The intra-arterial catheter preferably has a liquid access lumen in its interior that extends longitudinally from its proximal end to a drain port located distal to the arterial conduit sheet. The fluid supplied to the liquid access lumen flows through the intra-arterial catheter and into the heart or aorta (depending on the location of the drain port when the intra-arterial catheter is set up). From there, fluid supplied to the left ventricle or the root of the artery flows into the coronary artery and from there into smaller blood vessels within the heart.
[0106]
The intra-arterial catheter further includes a vent lumen extending longitudinally from its proximal end to a left ventricular vent port located distal to the arterial conduit sheet. it can. The portion of the catheter having the left ventricular vent port therein is optionally configured to be extendable relative to an installed intra-arterial catheter so that the portion extends beyond the left ventricular vent port to the left ventricle. It can be extended into the room. As an option, the drain port and the left ventricular vent port may be arranged such that, when the intra-arterial catheter is installed, both ports are located in the left ventricle, or the drain port is located at the root of the artery, The vent port can be located in a relatively fixed position such that it is located in the left ventricle. By extracting fluid from the left ventricular vent port, fluid backflow through the bicuspid valve can be minimized and fluid backflow into the pulmonary veins can be prevented.
[0107]
The catheter conduit sheet described herein may be of any shape, as is well known in the art. These conduit sheets can be members (eg, balloons) that occlude blood vessels without the need for extravascular members, or they can be extravascular members (eg, extravascular clamps or seats) that seat blood vessels on the conduit sheet. A member configured to occlude a blood vessel in cooperation with a snare (for example, a raised portion of a catheter body) can be used. Specific conduit sheets include, but are not limited to, balloons, raised portions of the catheter body, inflatable portions of the catheter body, recessed portions of the catheter body, rough or irregular portions of the catheter body, and a pair of closely spaced raised portions Surface, etc. When a balloon is used, it is important that the catheter has an inflation lumen that communicates with the interior of the balloon in order to inflate the balloon with a fluid (eg, air or phosphate buffered saline). The catheter can further include one or more suction ports associated with the conduit sheet, such that application of suction to the suction port (ie, suction lumen) positions the catheter therein. The vessel wall is more firmly seated against the conduit sheet. An important property of these conduit sheets is that they provide support, thereby allowing the vessels to be isolated independently of or in cooperation with extravascular members (eg, snares or clamps). Can be occluded.
[0108]
The catheters of the present invention can further comprise one or more detectable indicia, which facilitates positioning and guiding of these catheters within the patient's body. These marks include, but are not limited to, marks detectable using any of the well-known imaging techniques of fluoroscopy, radiography, endotracheal ultrasound heart examination, or holographic holography. can do. The use of such indicia is well known in the art. This indicia is preferably placed in the vicinity of catheter features such as the tip, conduit sheet, port, orifice, etc.
[0109]
The type of material used to make the catheter described herein is not critical. The catheters described herein can be made from virtually any material currently known or developed for the manufacture of endoluminal catheters. Such materials include, for example, biocompatible materials selected from the group consisting of polyethylene, vinyl acetate, copolymers containing vinyl acetate, ethylene vinyl acetate copolymers, copolymers containing polyvinyl chloride, acrylates, acrylates, polymethylenes. Methacrylate, polyethylene methacrylate, polymethacrylate, ethylene glycol dimethacrylate, ethylene dimethacrylate, hydroxymethyl methacrylate, polyurethane, polyvinylpyrrolidone, 2-pyrrolidone, polyacrylonitrile butadiene, polycarbonate, polyamide, fluoropolymer, polyvinyl fluoride, polytetrafluoroethylene , Polytetrafluoroethylene and polyvinyl fluoride copolymer, polystyrene, styrene acrylonitrile, styrene Copolymers with acrylonitrile, acrylonitrile butadiene styrene, copolymers of acrylonitrile butadiene styrene, polymethylpentane, polysulfone, polyester, polyimide, polyisobutylene, polymethylstyrene, silicone rubber, polyvinyl chloride elastomer, polyolefin elastomer, urethane-based elastomer, latex, And synthetic rubber.
[0110]
The use of “wire wound” catheters (ie, catheters with relatively rigid filaments normally embedded in the catheter wall) is contemplated. Any other method known or later developed can be used to prevent catheter twisting or frustration (eg, due to suction).
[0111]
It is known that the site of the junction between the aortic vein and the inferior vena cava varies greatly from individual to individual. Depending on where the azygous vein joins the vena cava, it may be necessary to occlude the atypical vein to shut off the cardiac circulatory system from the systemic circulatory system. A method (for example, angiography) for measuring the position of the junction of the aortic vein and the vena cava is well known. If the aortic vein meets the vena cava at a point located between the superior vena cava and the inferior vena cava seated on the conduit sheet of the cardiac interception catheter, then the heart Prior to supplying the inflammatory regulator (s) to the circulatory system, it is necessary to occlude the azygous vein. The azygous vein can be occluded by virtually any method that occludes blood vessels. For example, it can be surgically ligated, clamped, or hemostatic, or the balloon catheter can be screwed through the access port of the cardiac isolation catheter and into the aortic vein to inflate the balloon.
[0112]
The first embodiment of the catheter described herein allows the cardiac circulatory system to be blocked from the systemic circulatory system for the purpose of supplying the gene vector specifically to the myocardial tissue rather than to the body muscular tissue. Although constructed, it is clear that the apparatus of the present invention can be used for a wide variety of other purposes. Furthermore, with relatively minor modifications, these catheters of the present invention can be used for a variety of purposes.
[0113]
For example, the cardiac interception catheter of the present invention is configured to block venous blood flow from the vena cava of a mammal (particularly human) into the human right atrium, so that the catheter is directed to the right atrium. It can be used in a variety of situations where venous blood flow is undesirable. In addition to the cardiac bypass described herein, such situations include, but are not limited to, thoracotomy and other less invasive thoracic (especially heart) surgical procedures.
[0114]
Since the cardiac occlusion catheter of the present invention is installed in the vena cava of a surgical patient, by using the cardiac occlusion catheter to branch, minimize or occlude venous blood flow through the vena cava, Visibility of sites anatomically located near the vena cava can be improved compared to conventional surgical procedures. Furthermore, the cardiac interrupting catheter of the present invention allows the surgeon to enter the heart venous cavity (i.e., right atrium, right ventricle, pulmonary artery, coronary sinus) without forming an incision in the myocardium. It may have one or more access ports that can supply devices (eg, catheters, small surgical instruments, etc.), compositions (eg, pharmaceutical compositions, imaging agents, gene vectors, etc.). Other surgical procedures in which the cardiac occlusion catheter of the present invention can be advantageously used include, but are not limited to, mitral valve surgery, tricuspid valve repair, as will be apparent to those skilled in the art in view of the present disclosure. , Treatment of atrial septal defects, and other cardiac disorders. For example, the cardiac isolation catheter of the present invention can be used in place of a pair of single stage cannulas inserted into a surgical site, thereby providing the surgeon a cleaner view of the surgical site. Reduce the number of incisions required at that site.
[0115]
The cardiac occlusion catheter of the present invention can be used in conjunction with various known intra-arterial catheters (and optionally various venous occluders) to transform mammalian cardiac circulatory systems into non-cardiac, non-pulmonary circulatory systems. Can be cut off from. In addition, as described herein, an intrapulmonary artery catheter can be used to occlude fluid flow through the pulmonary artery to isolate the cardiac circulatory system from the mammalian pulmonary circulatory system. Such a method allows a medical practitioner to specifically supply medication to a non-cardiac, non-pulmonary circulatory system, a combination of cardiac and pulmonary circulatory systems, or a blocked cardiac circulatory system. One skilled in the art can select the appropriate drugs and the appropriate circumstances to supply them to these compartments.
[0116]
Thus, the term “cardiac blockage catheters” does not imply that the use of these catheters is limited to situations where complete blockage of the cardiac circulatory system from non-cardiac, non-pulmonary circulatory systems is desired. . For example, the cardiac isolation catheter can be used without using an intra-arterial catheter to transfer vena cava blood flow from the right atrium without blocking the cardiac circulatory system.
[0117]
An important embodiment of the cardiac interception catheter of the present invention is illustrated in FIG. In this embodiment, the cardiac isolation catheter has a pair of catheters, here the superior vena
[0118]
This lumen can optionally be connected to an external device such as a pump, oxygen supply, etc. As shown in FIG. 21, one or both of the venous return catheters can be provided with an access lumen extending longitudinally therein from the access port to the proximal end of the catheter. The access port can be provided at the distal end of the catheter, as shown in FIG. 21, or it can be provided elsewhere, but preferably the distal end of the catheter. Is provided. A composition or device (e.g., a second catheter described herein) is passed through the access lumen and access port depending on the location of the access port or the patient's heart or vena cava. Can be inserted into a part.
[0119]
The access port preferably comprises a penetrable seal disposed in the access lumen, optionally in the access port. This
[0120]
For example, FIG. 19B illustrates the use of an established superior vena cava return catheter and an established inferior vena cava catheter in the cardiac occlusion method of the present invention. As shown in this figure, the superior vena cava return catheter is installed through the patient's right jugular vein and the inferior vena cava return catheter is installed through the patient's right femoral vein. These vena cava return catheters are connected to the ten limbs of the extracorporeal blood oxygenator, and the inferior vena cava return catheter collects fluid from the heart and extends longitudinally within the inferior vena cava return catheter An access port located distal to the conduit sheet for transferring it to the venous limb of the extracorporeal fluid circuit via the access lumen.
[0121]
Similarly, the cardiac isolation catheter of the present invention can be used in conjunction with standard femoral or jugular vein catheters to improve absorption of venous blood from the patient's vena cava. This is particularly advantageous if the patient's venous anatomy does not allow the use of a cardiac isolation catheter that is large enough to efficiently remove venous blood from the patient's vena cava . In such a case, the cardiac isolation catheter can be placed through either the patient's femoral or jugular vein as described herein (ie, one conduit sheet is set in the superior vena cava and the other inferior vena cava). Set in a vein and extend the catheter between these two conduit sheets), the standard catheter can be placed in another vein, preferably a vein in which the distal end of the cardiac blockage is installed. It can be installed. Both the venous blood absorption lumen and a lumen in fluid communication with the port at the distal end of the standard catheter are connected to the venous limb of the extracorporeal oxygenator. This increases the rate at which the patient's venous blood can be supplied to the oxygenator.
[0122]
The catheter described herein, in particular, the cardiac isolation catheter of the present invention can be provided as a surgical kit for blocking the heart of the present invention from the systemic circulation of the present invention. Such a kit can comprise, for example:
(A) the cardiac interception catheter of the present invention,
(B) a second catheter insertable into the cardiac isolation catheter to occlude the mammalian pulmonary artery; and
(C) An intra-arterial catheter that occludes the mammalian aorta.
The kit may further comprise additional compositions or compounds useful for blocking the mammalian cardiac circulatory system or for performing the methods described herein. Such additional compositions and compounds include, but are not limited to:
(D) one or more cannulas for connecting the mammalian systemic circulation to the extracorporeal blood oxygenator;
(E) a pump that draws venous blood flow from the cardiac heart catheter and supplies blood to the arterial blood flow lumen of the cannula;
(F) a blood oxygen supply device for supplying oxygen to blood taken from a mammal;
(G) an odd vein occluder (eg, tourniquet, cross clamp, balloon catheter, or hemostatic device),
(H) Inflammatory regulators such as vascular permeability promoters (eg histamine) or vasodilators (eg papabaline).
[0123]
Definition
Certain terms are defined as follows:
[0124]
“Extravascular tissue” refers to a tissue located in the vicinity of a blood vessel in which the effluent from the blood vessel can contact the tissue under high blood vessel permeability conditions. For example, highly conduitd muscle tissue is extravascular tissue because muscle cells are located in the vicinity of the blood vessels and drainage from those blood vessels can be preached to the muscle cells.
[0125]
A “vascular permeability enhancer” is a composition that, when supplied to the blood vessel of a mammal, preferably a mammal, increases the permeability of the blood vessel endothelium to such an extent that the substance in the blood vessel can pass through the endothelial layer. It is a thing.
[0126]
A “vasodilator” is a composition that increases the lumen diameter of a blood vessel when supplied to the blood vessel of a mammal, preferably a mammal. In other words, a vasodilator increases the inner diameter of a blood vessel when administered to a mammalian blood vessel.
[0127]
By “perfusion pressure” within a blood vessel is meant the peak pressure difference between the fluid in the lumen of the blood vessel and the fluid surrounding the blood vessel. It is understood that the peak pressure in the blood vessel corresponds to the force that drives the blood flow through the blood vessel by the heartbeat of the mammal.
[0128]
By “normal physiological” perfusion pressure in a blood vessel is meant the perfusion pressure in the blood vessel of a healthy mammal at rest.
[0129]
“Oxygen transfer agent” means an oxygen molecule (O2 ) And the oxygen molecules can be supplied to a biological oxygen carrier such as hemoglobin or myoglobin. For example, various artificial blood substitutes and perfluoro compound liquids are oxygen transport agents.
[0130]
“Pharmaceutically acceptable carrier” refers to a chemical composition that can be mixed with the composition of the present invention and then used to administer the composition of the present invention to a mammal, particularly a mammal. Means.
[0131]
The “superphysiological level” of a vascular permeability enhancer is the level of a substance present in a mammal that is at rest and in a normal circulatory homeostasis.
[0132]
By describing two nucleic acid sequences as “operationally linked”, a single-stranded or double-stranded nucleic acid moiety has these two nucleic acid sequences, respectively, and the two sequences are contained within the nucleic acid moiety. In this case, it means that at least one of the two sequences can exert a physiological effect that is determined based on the other.
[0133]
A “macromolecular assembly” refers to the passage of a plurality of molecules through the endothelial layer of a mammal, preferably a mammal, more preferably a human blood vessel, in the absence of superior physiological levels of vascular permeability enhancers. It means one or more molecules that are large enough that they cannot. For example, a macromolecular assembly can be a single-stranded protein, a multi-linked protein, a liposome, a linear nucleic acid, a virus such as an adenovirus, picornavirus, or an adeno-associated virus, or a gene vector such as a plasmid or viral vector. , Etc. Also, for example, the macromolecular assembly can be an adenovirus having a human minidystrophin gene as described (Ragot et al., 1993, Nature 361: 647-650). Further, for example, the macromolecular assembly can be the plasmid pAdDeltaRSV modified in that the plasmid has a full-length dystrophin cDNA (Köning et al., 1988, Cell 53: 219-228), where the pAdDeltaRSV The plasmid has a pBSA-2 vector backbone, an RSV promoter operatively linked to the dystrophin cDNA, which is sandwiched between adenovirus 5 'and 3'-ITR sequences.
[0134]
“Gene vector” means a DNA sequence necessary for expression of a gene operatively linked to the promoter / regulatory sequence. In some cases, this sequence can be a core promoter sequence; in other cases, this sequence is an enhancer sequence and other regulatory elements required for expression of the gene in a tissue-specific manner. It can also have elements.
[0135]
By “extracorporeal circulatory support device” is meant a mechanical device that can circulate the mammal's blood through all or part of the mammal's circulatory system without the help of the mammal's heart. For example, cardiopulmonary devices well known in the art are useful devices for providing extracorporeal circulation support.
[0136]
“Venorrhaphy” means a surgical repair of a vein, eg, by suturing a vein incision to maintain vein patency without bleeding.
[0137]
Unless otherwise stated, the “far end” portion of a catheter means the end of the catheter within the patient's body during use of the catheter. The “near end” of the catheter is the end of the catheter that is not inside the patient's body during use of the catheter. The catheter is generally understood to have one distal end and one proximal end, although in particular, the use of a forked or bifurcated catheter at the proximal end as well. Is recognized.
[0138]
A lumen is “longitudinally extended” within the catheter when the longitudinal axis of the lumen (not including when the lumen communicates with the catheter port) is substantially parallel to the longitudinal axis of the catheter. I will put it out. "
[0139]
“Non-intrusive detectable marker” is a method used on a catheter, such as a catheter port or other feature, to position the marker in the patient's body without requiring perforation or incision of the patient's tissue A composition that can be measured by:
[0140]
The first catheter is within the lumen of the vessel lumen or the second catheter if the first catheter is movable within the lumen depending on the shape of the first catheter. It can be inserted. If the first catheter is “insertable” into the lumen of the second catheter, it is not necessary that the two catheters be separable (ie, the first catheter is permanently placed within the lumen of the second catheter). can do).
[0141]
A substance or lumen is another substance or lumen and the other substance or lumen when the fluid can flow from that substance or lumen to the other substance or lumen without breaking or physical failure. In "fluid communication" state.
[0142]
“Rod” means a longitudinal member having a circular or non-circular (eg, elliptical, square, triangular or irregular) cross section. The rod can include one or more lumens extending longitudinally therein.
[0143]
A portion of a catheter, rod or conduit sheet is “expandable” if the perimeter of that portion (including non-circular cross-section catheter, rod and conduit sheet) can be increased or decreased.
[0144]
A fluid “oxygen supply device” is a device that increases the concentration of oxygen dissolved in the fluid.
[0145]
"Pump" refers to all fluid discharge devices.
[0146]
A drug is said to have a “therapeutic effect” if the drug experiences severe or severe symptoms of the disease by supplying the drug to at least one tissue of the diseased mammal. Having ".
[0147]
“Vena cava” is an adjective that describes the superior and inferior vena cava of mammals individually or collectively.
[0148]
A “notch” is “adapted to fit” the body if the internal shape of the notch is movable longitudinally along the longitudinal axis of the notch.
[0149]
An “imaging agent” is a composition that facilitates detection of a cavity, tissue or surface when applied to the cavity, tissue or surface in the body of a mammal. Various image forming agents are known and described in the literature. For example, a composition that can directly detect the presence of a composition that emits gamma radiation or fluorescence, or a composition that can be detected using a known detection device can be used.
[0150]
The present invention will be described with reference to the following examples, which are provided for purposes of illustration only and are not to be construed as limiting the invention. Rather, it should be construed as including all variations that will be apparent from the teachings provided herein.
[0151]
Example 1: Promoting somatic gene transfer by convective transport of adenovirus through a microvascular barrier
Data is provided to support the hypothesis that obstructing transient liver inflow minimizes unnecessary virus sequestration. Experimental pringle manipulation was performed on rats administered recombinant adenovirus to the central circulatory system. This significantly reduced liver staining intensity relative to control mammals that did not undergo pringle manipulation.
[0152]
Next, the method used in the experiment presented in this example is described.
[0153]
The structure and amplification of the E1, E3-deleted recombinant adenovirus designated AdCMVlacZ has already been described (Kozarsky et al., 1993, Som. Cell Molec. Genet. 5: 449-458). Recombinant adenovirus is about 10 per gram rat body weight relative to the rat.9 The total dose of particles was administered. A frozen aliquot of the virus strain with 10% (v / v) glycerol is thawed immediately prior to injection, diluted 1: 5 in PBS, 10 mL per milliliter.12 Got a titer. Mammals were anesthetized by intramuscular injection into the forelimb of 75 milligrams ketamine per kilogram body weight and 5 milligrams xylazine per kilogram body weight. C57B110 mice and Fisher 355 rats were used.
[0154]
The example presented in this example is to examine differences in the convective transport of adenoviral suspensions from the capillary lumen to the muscular tissue stroma, and these differences are Resulting from differences in the age of the animals, the method of supplying the suspension to the mammal, the composition of the suspension, or a combination of these factors. About 5x10 per gram body weightTen Of AdCMVlacZ was administered to all mammals in these experiments. Depending on the outflow resistance of the micropipette and microcannula used to administer AdCMVlacZ in these experiments, the applied infusion pressure is always much higher than the pressure achieved in the vascular bed It is understood that. Consistency was maintained by using a controlled pressure to drive fluid flow through these devices. Tissue specimens obtained from the mammals used in these experiments were autopsied at 0.2% (v / v) glutaraldehyde, 2% (v / v) paraformaldehyde in PBS at necropsy. After perfusion-fixation according to (Sanes et al., 1986, EMBO J. 5: 3133-3142) whole mount staining for β-galactosidase activity as described. The results of these experiments are summarized in Table 1.
[0155]
AdCMVlacZ was administered to each new series A rat in Table 1 by injecting the viral vector into the retro-orbital vein of the rat using the tip of a glass micropipette. Here, the viral vector suspension stream was driven by a foot pedal controlled pico pump.
[0156]
AdCMVlacZ was administered to each of the new series B rats in Table 1 by injecting the viral vector into the rat common femoral artery using the tip of a glass micropipette. Here, the viral vector suspension stream was driven by a foot pedal controlled pico pump.
[0157]
AdCMVlacZ was administered to each of Series C 2-week-old rats in Table 1 immediately after abdominal wall incision and placement of an occlusion clamp in the liver inflowing vessel. The viral vector was injected into the femoral vein and the clamp was left for 30 minutes before removal.
[0158]
[0159]
Series E adult rats in Table 1 underwent femoral artery and venous occlusion and placed a 3-0 proline tourniquet at the level of the proximal flank. 100 units of heparin per kilogram of body weight are injected intramuscularly into the blood circulatory system of each rat, and each femoral artery is attached to the end of a tube whose lumen is not inserted into the artery. A heated taper polyethylene tube (PE10, Becton Dickinson, Sparks, MD) in fluid communication with the needle lumen was cannulated. After tightening the tourniquet, a microvascular clamp was installed to occlude blood flow through the femoral vessel. Controlled supply of the viral vector suspension continuously at 20 pounds per standard square inch gauge pressure with the AdCMVlacZ suspension into the tube and artery and 1 milliliter “chase” volume of PBS. It was driven by a pressure supply device. The clamp and tourniquet were held in place for 45 minutes, after which they were removed and the arteriotomy was repaired using 11-0 sutures (Sharpoint, Reading, PA). The small hip incision was closed using absorbable sutures.
[0160]
Series F rats in Table 1 were treated the same as Series E rats, except that the controlled pressure supply provided a continuous supply of viral vector suspension at 80 pounds per standard square inch gauge pressure.
[0161]
Series G rats in Table 1 were given femoral artery injections as described for Series B rats, except that here the proximal femoral tourniquet and clamp that occludes blood flow through the femoral artery, Used before virus vector supply. 100 microliters of viral vector was supplied using a glass micropipette followed by 1 milliliter aliquot of saline. These aliquots were allowed to stay in the artery for 5 minutes.
[0162]
The series H mice in Table 1 were treated in the same way as the series G mice except that 100 microliters of the solution containing either 10 micromolar histamine or 0.3 milligrams of papabaline was added to the virus. Immediately after vector injection, the artery was fed.
[0163]
Series I mice in Table 1 were treated in the same way as Series H mice, except that both histamine and papabaline were administered to each mouse.
[0164]
Series J mice in Table 1 were treated in the same way as series I mice, except that each mouse was subjected to a venorrhaphy immediately prior to removal of the tourniquet.
[0165]
Series K rats in Table 1 underwent femoral artery and venous occlusion and had a 3-0 proline tourniquet set at the level of their proximal thigh. The hindlimb circulation is by injecting the arteries with a composition containing 500 microliters of 10 millimolar histamine in 150 micrograms of papavaline in 500 microliters of PBS pH 7.4 or 500 microliters of PBS pH 7.4. Primed. 6 × 10 suspended in 500 microliters of the compositionTen AdCMVlacZ particles were injected into the artery followed by an additional 1 milliliter of PBS driven from a tank maintained at 80 pounds per standard square inch gauge. The clamp and tourniquet were maintained in place for a total time of 5 minutes, after which the limb circulatory system was washed with 3 milliliters of PBS.
[0166]
Series L rats in Table 1 were treated in the same manner as Series K rats, except that the composition contained both histamine and papavaline at the concentrations described above.
[0167]
In each of the series M rats in Table 1, limb perfusion was performed as in the series K rats. In this case, however, two overlapping tourniquets were placed through the muscles, and two tourniquets that overlap each other were used in order to allow complete blockage by vascular access via the epigastric upper abdominal blood vessel. This required that the second catheter be advanced through a venous valve at the junction between this side branch and the saphenous vein. In addition, the composition had both histamine and papavaline at the concentrations described above, and a venorrhapny was performed on each rat immediately prior to removal of the tourniquet.
[0168]
In order to provide optical contrast, newborn mouse pups were anesthetized after feeding to ensure that their stomach was full of milk. The skin of each mouse was incised across the abdominal wall and reflected laterally to provide access to the rectus muscle in the distribution in the superior abdominal wall artery. Through a dissecting microscope with a magnification of about 100 times, single red blood cells were easily visualized by lining up through skeletal muscle capillaries. Histamine, papaverine or both dissolved in PBS were applied topically to the capillary. Video recording was performed against the timeline by the attached camera. In adult mice and rats perfused at the distal end of the menopausal muscle, they overlap on the proximal tibial node and a similar observation is made here, again with light on the thin muscles. Contrast was optimized.
[0169]
The results of these experiments presented in Example 1 will now be described.
[0170]
Recombinant human access vector AdCMVlacZ (which has a Stoke diameter of about 70 nanometers; Stewart et al., 1993, EMBO J. 12: 2589-2599) crosses the mammalian blood vessel endothelial barrier in vivo. A novel system for studying microvascular dynamics was used to assess performance. Several interventional procedures that have a synergistic effect on microvascular permeability have emerged, and strategies have been developed for efficient gene transfer to most muscle tissue in the adult rat hindlimb. In view of the similarities between mammalian muscle tissues, it is clear that the present system can be used in all mammals, or perhaps all mammals as well.
[0171]
Among gene transfer vectors considered for therapeutic use, recombinant adenoviruses are noted by extremely efficient local gene transfer after intramuscular injection in newborn mice (Quantin et al., 1992, Proc. Natl. Acad. Sci. 89: 2581-2584; Acsadi et al., 1994, Hum.Molec. Genet.33: 579-584). Adenoviruses have been used to transduce gene expression in several human disease murine models (Kozarsky et al., 1996, Nature Genet. 13: 54-62, Ragot. , Et al., 1993, Nature 361: 647-650). The muscle mass of the hind limb of the newborn mouse has about 30 milligrams of tissue. Diffusion of adenovirus over several millimeters into the immature extracellular matrix of newborn mouse muscle tissue allows the transduction of most of the initial muscle tissue. However, in older mice or rats, the limitations of local supply become apparent, and gene transduction performed by intramuscular injection of adenoviral vectors is gradually becoming less efficient, with several millimeters around the injection site. Will remain limited to.
[0172]
Intravenous adenoviral vector supply mainly provides access to the liver, where discontinuous endothelium is believed to facilitate gene transfer from vascular space to parenchymal cell mass (Kozarsky ), 1996, supra; Kozarsky et al., 1994, J. Biol. Chem. 268: 13695-13702).
[0173]
The disadvantages of adenoviral vector delivery by direct injection or intravascular delivery can be solved where possible by developing adenoviral vector delivery methods useful for transendothelial delivery (eg, raper ( Raper) et al., 1996, Pancreas 12: 401-410).
[0174]
Adenoviral vector delivery through the continuous endothelial barrier of skeletal muscle can be described as a sum of three supply components: convective, diffusive, and vesicle exchange supply (Weinbaum et al., 1995, Symp.Soc.Exp.Biol.49: 323-345). Starling (1896, J. Physiol. 19: 312), Krogh (1919, J. Physiol. 52: 409) and Pappenheimer et al. (1951, Am. J. Physiol. 167: The classical study 13-28) provides relevant data from experiments in skeletal muscle with quantified transport rates for solutes with different molecular dimensions and lipid solubility.
[0175]
The behavior of larger macromolecules has been quantified more recently, with only one of the 30,000 pores being large enough to pass particles less than 1/4 of the diameter of the adenovirus. The pore theory was born (Rippe et al., 1994, Physiol. Rev. 74: 163-219). As expected from the inference of these data, recombinant adenovirus administered transvascularly provided minimal access to skeletal muscle, as confirmed by muscle tissue staining in FIG. 1a. . Intravascular administration of the adenoviral vector is indicated by the staining pattern shown in FIG. 1b, and as shown by the data presented in Table 1, the vector to increase the Starling force for leaching. Supplying superior physiological perfusion pressure at the same time as administration did not significantly improve. These results indicate that the vascular endothelium is remarkably concise, and that the speed of vesicle and convective transport of the viral vector from the stroma to the muscle tissue is not important. Is implied. These results further suggest that transvascular administration of adenoviral vectors is an inefficient body gene transfer strategy.
[0176]
[Table 1]
[0177]
Another approach was investigated based on the pathophysiology of inflammation in skeletal muscle that can be regenerated by topical application of histamine or other vascular permeability enhancers. There is ultrastructural evidence of the transient appearance of a gap between adjacent endothelial cells after application of such agents to endothelial tissue, the gap having a width of about 1 micrometer. In addition, electron micrographs record the ability of colloidal HgS particles of 35 micron in diameter and larger and across these intercellular gaps (Majno et al., 1961 supra).
[0178]
The hypothesis that an induced process of inflammatory exudate may facilitate vector delivery from the circulatory system to adult skeletal muscle in vivo by improving convective delivery of the vector through the vascular endothelium Was established. Body side effects of vasoactive substances were avoided by using a blocked limb perfusion system. As shown by the data presented in Table 1, histamine, papavaline (a potent endothelium-independent vasodilator; Wenmalm, 1994, J. Int. Med. 235: 317-327) and top physiology In general, the synergistic effect of the application of dynamic perfusion pressure effectively transferred genes from vascular space to muscle tissue.
[0179]
The homogeneity of gene transduction in response to these manipulations is illustrated in FIG. 2, where Xgal staining of the majority of muscle tissue in the adult rat hind limb is seen at multiple levels of magnification. Although retention of particles smaller than adenovirus in the capillary basement plate has been recorded by electron microscopy (Majno et al., 1961 supra), the results described here indicate that this barrier is It has been shown.
[0180]
A combination intervention using histamine, papavaline and superior physiological perfusion pressure was lethal if the circulatory system blockade of the limb in which the intervention was performed was incomplete. However, mammals whose limb circulatory system was adequately tolerated the treatment well and returned to normal gait. This method of adenoviral vector administration achieves the efficiency and quantity of gene distribution that is essential for gene therapy of various genetic diseases such as muscular dystrophy.
[0181]
As shown in FIG. 2, panel B, the histological appearance of two adjacent muscles of the quadriceps muscle indicates the absence of artificial staining in the tissue that was not perfused. In FIG. 2 panel B, the blood supply to the rectus femoris was occluded using a hemostat. The results described here further demonstrate the presence of an epimyal tissue barrier against adenovirus spreading, as shown in FIG. 2, panels A and B.
[0182]
In the experiment presented in this example, a dramatic reduction in gene supply to the limb vasculature was also noted, as shown in FIG. 2, panels C and D. This observation suggests that the endothelial cells of the muscular tissue vasculature have lost their ability to absorb virus as a transient side effect of the regulator draw or have been effectively bypassed by fluid convection to the interstitium , Suggests that. This observation is further used by the method of the present invention to specifically supply an adenoviral vector to extravascular tissue without significant absorption of the vector by endothelial cells of the blood vessel (s) supplying the tissue. It also suggests that it is possible.
[0183]
Microvascular perfusion seen in real time through a dissecting microscope was initially used to evaluate multiple drugs. Topical application of 10 mM histamine rapidly induced vasodilation and increased local perfusion, followed by capillary blood stagnation within seconds. Application of 300 micrograms per milliliter of papaverine resulted in a gradual increase in capillaries and increased local perfusion. With topical application of both agents, capillary perfusion was maintained for a long time and formation of local edema was observed. These findings suggest that the synergistic effect of these regulators on gene administration is related to the ability of papabaline to overcome the pre-capillary resistance vessel autoregulation or edema-induced closure. The acute toxicity of the modulators during inadequate hindlimb blockage is associated with its hemodynamic side effects (Thom et al., 1995, J. Clin. Oncol. 13: 264-273).
[0184]
The hemodynamic side effects of these regulators complicate their use in the central circulatory system during attempted body gene delivery (eg, Eyre, 1970, J. Pharm. Pharmacol. 22). 104-109; Silverman et al., 1988, J. Appl. Physiol. 64: 210-217). Furthermore, simultaneous use of an adrenergic agonist to support the circulatory system may reverse the desired effect on gene delivery and / or cause myocardial damage, particularly in the case of cardiomyopathy.
[0185]
The vaso-occlusive techniques described herein, or other techniques known in the art, can be used to minimize or avoid the side effects resulting from the body supply of the modulator. Furthermore, these side effects could theoretically be overcome by installing an extracorporeal circulation support device prior to the body injection of the regulator. In this regard, rapid removal of circulating viral vectors by the liver appears as a second problem. However, the data presented in Table 1 regarding the reduction of liver virus absorption due to liver inflow obstruction suggests that this problem may be able to be significantly overcome by minimally invasive surgical procedures such as laparoscopic procedures. ing.
[0186]
The proposed combination of surgical and pharmaceutical approaches described in this example represents a general method for body gene delivery. The clinical significance of this method depends on how well the procedure can tolerate in larger animals than was used in this example. This problem is described in more detail in Example 3.
[0187]
Example 2: Other compounds effective to improve microvascular permeability
Compounds other than histamine and papabaline that have the effect of improving microvascular permeability include, but are not limited to, platelet activating factor, serotonin, bradykinin, and nitroprusside. Microvascular permeability elicited after administration of these compounds can be assessed by surveying the absorption of 70-100 nanometer diameter dextran particles labeled with fluorescence.
[0188]
Based on the data described herein, the present invention can be extended as follows.
[0189]
Body gene transfer can be achieved in large animals, including humans, by using a combination of inflammatory and vasodilators, provided that an extracorporeal support device is installed.
[0190]
Providing adequate circulatory support and oxygenation equipment relies on relative growth measurements, mathematical relationships that govern the organ function of different sized mammals. Each murine heart and diaphragm muscle cell or fiber operates at a rate approximately 10-15 times that of the human heart and diaphragm. Thus, cardiopulmonary bypass circuits for small rodents must transport oxygen and blood at a rate 10-15 times that required in humans. The fluid dynamic resistance, measured by Poiseuille's law, becomes rate limiting due to the wall thickness of the cannula.
[0191]
A simple solution to this problem is to experiment with animals large enough to model the flow rates achievable in humans and use the paradigm of pediatric and adult myocardial emergency care management. The cannulation site in mammals governs the flow rate. The carotid artery and jugular vein approach is preferentially used due to its minimal invasiveness, and due to the fact that it has been used successfully for many years in pediatric extracorporeal membrane oxygenation (ECMO). If necessary, large arteriovenous cannulation can be used, as used in open heart surgery. The type of cannula insertion and the position of the pump, etc. are illustrated in FIGS.
[0192]
It is important to determine whether an inflammation regulator is one that alters the immune response to new antigen expression. In addition, it is important to determine the relationship between the level of genetic transfer achieved and the magnitude of the physiological impairment resulting from the initial interventional procedure. In the case of muscular dystrophy, it is known that there is a threshold effect of gene dosage, and if this dosage cannot be achieved, the treatment is unlikely to be effective. By using a stronger promoter sequence that drives gene expression, it is possible to compensate for the low efficiency of gene transfer and enhance gene therapy effects. Tissue specific expression is also possible using a tissue specific promoter sequence.
[0193]
A patient in need of the procedure described here undergoes general endotracheal intubation anesthesia, undergoing a neck incision and timely pringing operation, as is currently used for extracorporeal membrane oxygenation Therefore, it is expected to receive a laparoscopic port. The flow through the ECMO circuit begins after the injection of the vasodilator, after which the virus and then the inflammation regulator is injected at the flow rate and the additional amount necessary to achieve hypersystolic circulation. After completion of a short bleed, which can be as short as 5 minutes, the remaining inflammation regulators are removed from the blood to facilitate rapid withdrawal from ECMO. This may be accomplished by using a cell saver, one or more hemofiltration or hemodialysis devices connected in series, or other recovery device. Thereafter, the patient is gradually withdrawn from the extracorporeal oxygenator. In mammalian models that have been studied so far, treated mammals can walk in a short time after surgery.
[0194]
Example 3: Extracorporeal circulation support and blood oxygen supply in sheep
The experiments in this example are to confirm that a mammalian circulatory system larger than a mouse or rat can be supported in vitro under the conditions described herein for the supply of macromolecular assemblies such as adenoviral vectors. It was conducted. Sheep were subjected to cardiopulmonary bypass and then dosed with 3.75 or 7.5 milligrams of papaverine per kilogram body weight and 25 or 125 micrograms histamine per kilogram body weight. The relevant physiological characteristics of these sheep were monitored in real time.
[0195]
The materials and methods used in these experiments shown in this example are now described.
[0196]
Surgical procedure
The extracorporeal circulation support system described herein was configured such that the mammal could withstand a large amount of fluid spillage under the influence of histamine and papabaline.
[0197]
Healthy sheep were orally dosed with Nicol prep consisting of 1 gram erythromycin and 1 gram neomycin base the night before surgery to minimize intestinal dilatation by air. These sheep were fasted overnight (ie, at least 12 hours) with free access to water. After restraint using wildlife protection cages, these mammals are sedated by intramuscular administration of 10 milligrams of ketamine per kilogram body weight and using a 30 milligram dose pentabarbital intravenous bolus per kilogram body weight. Anesthetized. Each vocal cord was sprayed with 2% (v / v) lidocaine, after which these mammals were intubated and connected to a mechanical ventilator. The tidal volume was set at 15 milliliters per kilogram of body weight with a respiration rate of 20 per minute. Anesthesia was initiated using 3% (v / v) isoflurane and maintained using 1-2% (v / v) isoflurane.
[0198]
The depth of anesthesia was measured by lightly plucking the mammal's tail at 15 minute intervals throughout the procedure. If an analgesic response was observed, the animal was given additional anesthesia by doubling the isoflurane percentage for 5 minutes, when the analgesic response to its tail pick disappeared, Returned to percentage.
[0199]
Each mammal was placed on its back and an ECG lead was attached to the distal end. All mammals received the catheter insertion described herein. In addition to access for cardiopulmonary bypass, a cannula was used after anesthesia for the diffusion of saline to replace lymphatics in the vascular space. In all cases, the mammals were euthanized after experimental pumping after barbiturate overdose by blocking the venting device for 10 minutes immediately prior to saline diffusion.
[0200]
The right subcostal incision entered the peritoneal cavity and the liver and duodenum were identified and moved. A Rammel tourniquet was placed to eventually occlude the portal vein and hepatic artery, but the clamp was left in the open position. The towel clip was then loosely applied to the fascia edge of the abdominal incision.
[0201]
A small vertical incision was made over the palpable left carotid pulse, deep enough to place an arterial catheter for pressure monitoring purposes. A longitudinal incision was then made over the pulse of the right common carotid artery. This incision was made deep enough to allow full exposure of the right external jugular vein and the common carotid artery. A 29 inch wire wound venous cannula was placed in the right jugular vein and advanced carefully down until its tip was in a position that was presumed to be in the right atrium, where the estimation was made with surface markings and Was performed based on the distance the catheter was advanced. A 14 inch wire wound cannula was then placed in the right common carotid artery. In both cases, vascular cannulation was premised on achieving proximal and distal control. The arterial cannula was advanced until its tip was in a presumed position at the root of the artery, near the aortic valve.
[0202]
The left external jugular vein was cannulated with a cordis port and then the Swan-Ganz catheter was advanced until its tip was in the pulmonary artery. The appropriate port of the Swan-Ganz catheter was then attached to the pressure transducer to allow simultaneous measurements of pulmonary artery pressure and central venous pressure.
[0203]
The starboard is then incised longitudinally across the palpable right femoral artery pulse and a 14 inch wire wound cannula is inserted between the proximal and distal control points, The tip was advanced against the arterial flow to the point where it came to the right common artery.
[0204]
Once all the cannulas are in place, they are charged with 120 mM sodium chloride, 5 mM potassium chloride, 3 mM magnesium chloride, 24 mM sodium bicarbonate until a pH of 7.4 is achieved. The pump oxygenator circuit was primed with a solution containing and bubbled with a carbogen mixture containing 5% (v / v) carbon dioxide, 95% (v / v) oxygen. Throughout the remainder of the experiment, the carbogen mixture was passed through the bubble oxygenator at a flow rate determined by an experiment high enough to ensure a carbon dioxide partial pressure of 40 torr. This fixed the arterial pH at about 7.4 throughout the pump operation.
[0205]
100 cubic centimeters of blood was taken into a pair of 60 cubic centimeter syringes each containing 6 units of heparin. The heparinized blood was rapidly centrifuged to separate red blood cells from the plasma. The plasma was then mixed with a filtered solution of Evans sprue dye in PBS with approximately 0.5 grams of plasma in 5 milliliters of PBS. Liver inflow occlusion was performed by tightening the Rammel hemostasis previously wrapped around the liver-duodenal ligament. After a 1 minute swirl to slowly mix the Evans Blue dye with the plasma, the plasma is remixed with the isolated red blood cells, and the entire solution is passed through the left external jugular vein through the central venous cordis. ) To return to the mammalian blood stream. The completion of the Evans Blue dye injection was time point t = 1 minute. At t = 0 minutes, bypass was initiated with a pump flow rate of 3 liters per minute. At t = 2 minutes, the mammal was infused with a bolus of 150 milligrams of papabarin in 5 milliliters of medium from the distal port of the arterial line exiting the pump oxygenator. This powerful NO-independent vasodilator was predicted to immediately reduce the blood pressure in mammals. Over the next 2 minutes, the mammal's blood pressure was normalized by increasing the flow rate through the pump and injecting an additional amount of the same solution used to prime the pump. At t = 4 minutes, 25 micrograms of histamine bolus per kilogram body weight was infused intraarterially through the most distal point from the pump in the arterial line of the pump oxygenator.
[0206]
After 30 minutes of pumping, the pump was stopped for 2 minutes to measure the pulmonary artery, central venous, and aortic pressure in the absence of additional extracorporeal circulation, taking into account the contractility of the heart. As soon as these values were obtained, mammals were mercially euthanized by overdose of barbiturate.
[0207]
By means of an arterial cannula, the structure of the pump oxygenator was modified to allow the injection of 140 mmol sodium chloride solution adjusted to pH 7.4 using 10 mmol Tris-HCl. Immediately prior to exsanguination, the Rammel tourniquet that had blocked the liver inflow was removed. A venous cannula was attached to another roller pump to allow complete exsanguination of the euthanized mammal into a suitable container. The mammal was exsanguinated using 10 liters of sodium chloride solution. After exsanguination, an incision was made to allow access to the next organ to obtain a tissue specimen. That is, heart, lung, liver, kidney, large and small intestine, brain, testis, and the following skeletal muscles: diaphragm, left and right biceps and triceps, left quadriceps, biceps Muscle, gastrocnemius soleus, total extensor cervical muscle from the pelvic end, iliopsoas muscle, posterior body wall muscle at maximum compression point by applying the weight of mammal to operating table. The last muscle sample listed above established the variability introduced by the pressure point when placing the mammal on the operating table. Each of these specimens was weighed and a fragment containing about 2 grams of tissue was removed for chopping and formamide extraction. Evans blue dye recruitment rate was measured spectrophotometrically and normalized to tissue wet and dry weight.
[0208]
Next, the results of the experiment presented in this example will be described.
[0209]
The experiments in this example were performed using two sheep and the blood vessels of those experiments are summarized in FIGS. 6a and 6b.
[0210]
A 40 kilogram sheep received 150 milligrams of papavaline and 1 milligram of histamine intravenously, and the physiological data recorded using this sheep is shown in FIG. 6a. As expected, the blood pressure in sheep decreased after administration of the vasodilator papabaline and the vascular permeability promoter histamine. However, as shown in FIG. 6a, the extracorporeal circulatory support system is such that the hemodynamic state of the sheep is approximately equal to the pre-dose blood pressure approximately 10 minutes after the administration of both compounds. Was able to stabilize. As shown in this figure, the extracorporeal circulatory system support system supplies 6 liters of PBS to the sheep, which causes approximately 6 liters of fluid to flow out of the sheep vasculature into the extravascular tissue. It suggests that he was doing.
[0211]
The second 40 kilogram of sheep received 300 milligrams of papavaline and 5 grams of histamine intravenously, and the physiological data recorded using this sheep is shown in FIG. 6b. As expected, the blood pressure in sheep decreased after administration of the vasodilator papabaline and the vascular permeability promoter histamine. However, as shown in FIG. 6b, the extracorporeal circulation support system is such that the hemodynamic state of the sheep is approximately equal to the pre-dose blood pressure at least about 25 minutes after the administration of both compounds. It was possible to stabilize. As shown in this figure, the extracorporeal circulatory system support system supplies 11 liters of PBS to the sheep, which causes approximately 11 liters of fluid to flow out of the sheep vasculature into extravascular tissue. It suggests that he was doing.
[0212]
These results indicate that the extracorporeal circulatory system support system described herein stabilizes the mammal's hemodynamic state under the conditions described herein for the provision of macromolecular assemblies such as the adenovirus vector. It confirms that it is possible.
[0213]
Rat experiments have shown that the distribution of Evans blue dye bound to albumin is predictive of tissue infectivity by recombinant marker adenovirus supplied via blood flow. After intravascular administration of AdCMVlacZ and Xgal staining, blue color could be detected throughout the liver, but not in skeletal muscle. In the case of Evans Blue, the results were similar due to an estimated quantity ratio of a distribution of 1000: 1 or more between the liver and skeletal muscle. It has been found that Pringle manipulation reduces this ratio to about 200: 1 (liver: skeletal muscle) without increasing absorption by skeletal muscle. This ratio is about 6: 1 in sheep given 150 milligrams of papaverine and 1 milligram histamine and about 2: 1 in sheep given 300 milligrams papavarine and 5 grams histamine. there were. These data strongly predict widespread global metastasis of adenoviral vectors to skeletal muscle via mammalian vascular space.
[0214]
Example 4: Transfer of human mini-dystrophin to rat muscle tissue and its internal expression
An adenovirus vector of AdCMVΔ17-48dys was constructed as follows. A plasmid with Sal I binding Δ exon 17-48 mini-dystrophin cDNA cloned into pUC18 was obtained as described (Acsadee et al., 1991, Nature 352: 815-819). The plasmid pAdCMVlacZ described was also obtained (Kozarsky et al., 1994, J. Biol. Chem. 268: 13695-13702). pAdCMVlacZ is E. coli. A shuttle plasmid with
[0215]
AdCMVΔ17-48dys was generated by linearization of plasmid pADCMVMini-1 with specific site cleavage endonuclease Pvu I as described (Graham et al., 1977, J. Gen. Virol. 36: 59-74). 293 cells were co-transfected with Cla I-restricted adenovirus genome d1327. Plaques generated from growing recombinant viruses were isolated and described as described (Graham et al., 1991, In: Methods in Molecular Biology, Murray, ed., Hamana, Clifton, NJ, 109-128). Expanded. Lysates from the plaque extension were used to infect 293 cells, which were collected and immunofluorescent stained with the primary antibody NCL-Dys-2 (Novocasta Laboratories, Newcastle, Tyne, UK). Of 293 cells, recombinant viruses that were positively stained for the presence of dystrophin were analyzed by Western blotting, and viruses expressing the expected size of mini-dystrophin protein were selected for amplification. After three rounds of purification, the virus strain was expanded and an adenovirus preparation was made using standard methods. 293 cells were infected by multiple infections of approximately 100 particles per cell and the transduced cells were analyzed by immunofluorescence and Western blot analysis. These preparations were used in place of AdCMVlacZ for perfusion in the hind limbs of rats as described in Example 1 series M rats.
[0216]
Cold sections of gastrocnemius muscle obtained from rats one week after perfusion with AdCMVΔ17-48 dys were immunofluorescent stained with NCL-Dys-2, which binds to the epitope of human dystrophin but not to rat dystrophin. . As shown in FIG. 11a, the vector was supplied to rat gastrocnemius muscle cells and the mini-dystrophin protein encoded by AdCMVΔ17-48dys was expressed in those cells. Furthermore, the staining pattern is the same as expected for endogenous dystrophin production in rat cells. Rat gastrocnemius muscle that was not supplied with the viral vector and rat gastrocnemius muscle cells that were supplied with the AdCMVlacZ vector (as shown in FIG. 11b) did not show immunofluorescence staining using NCL-Dys-2.
[0217]
The results presented in this example show that the compositions and methods described herein are useful for in vitro delivery of gene vectors to mammalian muscle cells, such muscle cells expressing the gene supplied thereby. Prove that you can.
[0218]
Example 5: Adeno-associated viral vector for gene transfer to muscle tissue
As described herein, experiments on adenovirus-mediated gene transfer to skeletal muscle have demonstrated that the microvascular endothelium restricts access to muscle fibers from the mammalian vascular space. Histamine (and other vascular permeability enhancers) temporarily permeabilizes the microvascular endothelium, thereby leading to a dramatic increase in the efficiency of adenovirus-mediated gene transfer to skeletal muscle, and this effect is due to papaverine It can be greatly increased by using a vasodilator such as Highly efficient gene therapy in blocked perfused myocardial tissue using adenoviral vectors has also been demonstrated.
[0219]
Recent announcements by others regarding sustained transgene expression in muscle tissue following the introduction of tissue using vectors derived from human adeno-associated virus (AAV) include: This suggests that it may be useful in the methods described herein for gene transfer to myocardial tissue. For example, an AAV vector for gene transfer to muscle tissue can include a nucleic acid encoding all or part of a human sarcoglycan such as delta-sarcoglycan.
[0220]
A vector termed here AAV-CMV-delta-sarcoglycan was constructed and is shown in FIG. This vector has a copy of the cDNA for human delta-sarcoglycan (accession number # X95191) operatively linked to the gene, promoter, the pA region intervening between AAV inverted terminal repeats (AAV-ITR), The structure contains sufficient “stuffer” DNA to fill the AAV vector capsid. The "medium" DNA used was 3 'up to 500-1000 base pairs of human immature myosin long cDNA, which is transcriptionally inactive and has no known transcription factor binding properties in mammalian cells. Part of it.
[0221]
The myopathic Syrian hamster strain designated BIO14.6 has a mutated delta-sarcoglycan gene and is therefore a mammalian model of human limb-limb girdle muscular dystrophy (Nigro et al., 1997, Hum. Mol). Genet.6: 601-607). In the BIO 14.6 hamster, expression of the mutant delta-sarcoglycan gene results in the formation of an inoperable sarcoglycan complex. By supplying the AAV-CMV-delta-sarcoglycan to the muscle tissue of BIO 15.6 hamster, the hamster sarcoglycan complex is expressed immunofluorescently by the hamster expressing normal delta-sarcoglycan protein. "Rescued" in the sense that it formed a working sarcoglycan complex with alpha-, gamma-, and delta-sarcoglycans detectable.
[0222]
In a cardiac perfusion experiment in which a rodent heart is transplanted ectopically, the contractility of the heart is maintained when cardiac hypothermia is maintained during myocardial endothelial permeabilization and gene transfer. Ectopic transplantation refers to transplanting a tissue obtained from a site of a donor animal to another site of a recipient animal. In this example, the heart from one rat was implanted into the thigh site of another rat.
[0223]
The results of these experiments indicate that the AAV vector can be used to deliver therapeutic gene constructs to muscle tissue using the methods described in this disclosure. Although there are AAV size limitations on the transgene construct, it is still possible to supply the gene construct within the size of the AAV viral vector (ie, about 1 to 4.5 kilobases). Thus, a genetic construct encoding a relatively small protein or a biologically active portion of a larger protein can be used. For example, vascular endothelial growth factor (VEGF) has been implicated as a central vehicle in the control of endothelial cell proliferation during normal and pathological angiogenesis (Ferrara et al., Nature 380: 439-). 442). A VEGF isoform having 121 amino acid residues can be encoded by the nucleic acid in an AAV vector, which shows VEGF bioactivity in muscle fibers transformed using such a vector. In addition, the 121 amino acid VEGF isoform is a cellular muscle-specific transcription cassette (eg, creatine kinase promoter / enhancer cassette: Jaynes et al., 1988) to increase the specificity of the isoform for only its transfected muscle tissue. Mol. Cell. Biol.8: 62-70).
[0224]
The results of the experiments described in this example further suggest the usefulness of maintaining the hypothermic state of the heart (or the whole body) during gene transfer to the myocardial tissue blocked from the systemic circulation. .
[0225]
Example 6: In vivo delivery of gene vectors to body-blocking myocardial tissue
This example describes a method and apparatus useful for facilitating body metastasis of genetic material to the adult myocardium via the cardiovascular. According to this method, another cardiac circulatory system is formed in vivo, which effectively shuts off the cardiac circulatory system from the body blood circulatory system. By blocking the heart tissue from the systemic circulatory system, the myocardium is supplied to the gene vector, a fresh gene vector-containing vehicle is supplied to the myocardium for a longer period of time, or the gene vector-containing vehicle passing through the myocardium is recycled Circulation (optionally combined with oxygen supply) allows exposure for long periods of time, thus greatly improving the efficiency of gene vector transfer to the myocardium. A particular advantage of this method is that, as described herein, an inflammatory regulator such as a vasodilator (eg, papabaline) or a vascular permeability enhancer (eg, histamine) is included in the vehicle, This is because it is possible to supply these modulators for circulation in the myocardium without supplying large or harmful amounts to the systemic circulation. Furthermore, since the cardiac circulatory system is isolated from the systemic circulatory system using this method, it is possible to change the pressure in the cardiac circulatory system without significantly affecting the pressure in the systemic circulatory system. is there. Therefore, according to this method, it is possible to use inflammation regulators in an amount sufficient to significantly improve the heart-specific absorption of gene vectors while minimizing the body effects of those regulators. It becomes.
[0226]
This method is performed using one of at least two different types of cardiovascular blockade procedures. The “open chest” procedure is performed using known aorta, vein, left and right ventricular vent catheters and surgical instruments. The “minimally invasive” procedure is performed using the cardiac interception catheter described herein. Regardless of the type of cardiac blockage procedure used in this method, perfusion of the subject's non-cardiac tissue is maintained using an extracorporeal oxygenator and a blood circulation pump. Venous blood is collected, for example, by cannulating the femoral vein of the subject and passed through the oxygenator and pump. Oxygenated blood is supplied, for example, by cannulating the femoral artery of the subject, as illustrated in FIGS. 19A and 19B.
[0227]
Open heart cardiovascular blockage procedure
The cardiac circulatory system is blocked in vivo using at least two different thoracotomy procedures. The first of these two procedures is performed as follows.
(I) Through a midline sternotomy, purse strings sutures are inserted into the proximal ascending aorta, the distal ascending aorta, the proximal superior vena cava, and the right atrium near the inferior vena cava.
(Ii) cannulating the distal aorta and pulling the parse string suture tightly around the cannula, the distal aortic cannula having an arterial branch of an extracorporeal cardiopulmonary bypass circuit having a blood oxygenator and a pump Connect to. The distal aortic cannula may be, for example, a 6.5 mm curved metal tip Sarn cannula.
(Iii) a proximal aortic cannula (
(Iv) A right angle venous cannula is passed through the superior vena cava parse string suture and a second right angle venous cannula is passed through the right atrial parse string suture lumen near the inferior vena cava. Both parse string sutures are tightly wrapped around them and these two right angle cannulas are connected to the venous branch of the cardiopulmonary bypass circuit via a Y connector. A tourniquet is wrapped around the upper and lower aorta around the right angle cannula or between the right angle cannula and the right atrium and all venous return flows except those exiting the coronary sinus and the Thebesian vein Can be transferred to the venous branch of the cardiopulmonary bypass circuit. Tighten the tourniquet around the upper and lower aorta. This causes all blood return from the systemic circulation to be carried via the upper and lower aortic cannulas to the extracorporeal cardiopulmonary bypass circuit and from there to the distal aortic cannula. Cardiopulmonary bypass is initiated while maintaining the subject's blood at 37 ° C.
(V) Next, a ventricular vent catheter is inserted into the right and left ventricles. These vent catheters are fixed by a parse string suture and connected to the venous branch of the gene supply circuit via a Y connector.
(Vi) Occlude the aortic vein (eg, by clamping, ensnaring, tying it up, or inflating a balloon within its lumen).
(Vii) The ascending aorta is occluded distal to the left and right coronary arteries using, for example, the
(Viii) A cardioplegia-inducing solution (eg, Plegisol®) is introduced into the myocardium (eg, via the aortic root) via the proximal aortic cannula to cause cardiac anesthesia.
(Ix) The pulmonary artery is occluded distal to the pulmonary valve. After each of these steps, an oxygen supply fluid and / or a fluid containing the gene vector is supplied via the proximal aortic cannula to perfuse the cardiac circulatory system via the left and right coronary arteries. The left ventricular vent catheter collects the cardiac aortic flow that is backflowed through the aortic valve. This part of the circuit is important when high aortic pressure is used to increase the efficiency of gene delivery to avoid ventricular enlargement. All blood or crystalloids returning from the heart via the coronary sinus or the Thebesian vein are delivered to the venous branch of the gene delivery circuit via the right ventricular vent catheter. Blood or crystalloid is oxygenated and returned to the cardiac circulatory system via the proximal aortic cannula.
[0228]
Alternatively, the second of the two thoracotomy procedures to block the cardiac circulatory system is performed. This second procedure is substantially the same as the first procedure except that a coronary sinus outflow catheter is used in place of the right ventricular vent catheter for the introduction of fluid into the gene delivery circuit. It is. The coronary sinus outflow catheter is inserted by surgically incising the right atrium after tightening the tourniquet on the upper and lower aorta to expose the coronary sinus (CS in FIG. 13). A parsstring suture is placed around the ostium of the coronary sinus. The distal end of the coronary sinus outflow catheter is inserted through the ostium, the balloon at the end of the catheter is inflated, and a parse string suture is tightened, thereby securing the coronary sinus outflow catheter to the coronary sinus To do. In this second method, the right ventricular vent catheter need not be used and the pulmonary artery need not be occluded.
[0229]
When the cardiac circulatory system is blocked from the systemic circulatory system, an inflammation regulator is injected into the cardiac circulatory system along with the gene vector, thereby increasing the efficiency of the gene vector efflux from the cardiac circulatory system to the myocardial stroma. Increase the efficiency of absorption and expression of the gene by cardiomyocytes. This system allows the fluid containing the gene vector to be recirculated almost exclusively through the cardiac circulatory system. The fluid contains a high level of dissolved oxygen to allow longer-term blockage of the cardiac circulatory system, thereby improving muscle cell survival and absorption of the gene vector by the muscle cell. Possible oxygen transport materials (e.g. perfluorocompound fluids) or oxygen-containing fluids (e.g. oxygenated blood or crystalloids) may be replenished from time to time or constantly. Since temperature also affects the efficiency of vector-mediated gene delivery to muscle cells (for example, uptake of gene vectors by cardiomyocytes is 4-10 in blocked cells and myocardium treated in vitro). The temperature of the fluid in the gene supply circuit can also be controlled.
[0230]
After blocking the cardiac circulatory system for a predetermined time, the liquid containing the gene vector and the inflammation regulator (single or plural) are substantially free of these vectors and the inflammation regulator (single or plural). Suspend the gene vector supply by replacing it with another liquid. This separate liquid can be used to clean the cardiac circulatory system in a single pass, or it can be recirculated. The tourniquet around the upper and lower aorta, and the clamp attached to the aorta and (if used) the pulmonary artery is a level at which the remaining vector and inflammation regulator (s) are safe for body exposure. Removed when measured or estimated to be At this point, the systemic circulatory system and the cardiac circulatory system merge into a single circulatory system. The subject is then described elsewhere in this specification, and may include a modified ultrafiltration method to remove residual inflammation regulator (s) and vector from the blood stream. Disconnect from cardiopulmonary bypass using appropriate support techniques.
[0231]
The thoracotomy of this procedure was performed on dogs. In preliminary experiments, Evans blue labeled albumin was injected into the dog's blocked cardiac circulatory system. Table 2 shows the concentration of Evans blue labeled albumin in the heart and systemic circulation after 20 minutes of cardiac perfusion using the blockage system described above. These results show that the concentration of Evans blue labeled albumin is about 50 to 100 times higher in the cardiovascular system than in the systemic circulatory system, and in vivo cardiovascular system using this method. It shows an efficiency of 98 to 99 percent of blockage.
[0232]
[Table 2]
[0233]
FIG. 20 illustrates a cross section of the myocardium and diaphragm obtained from a dog that has undergone in vivo cardiovascular blockade. Cocktails with histamine, papaverine, and Evans blue labeled albumin were injected into the blocked cardiac circulatory system and not into their dog's systemic circulatory system. As shown in FIGS. 20C and 20D, the widespread outflow of Evans blue labeled albumin into the interstitium of heart cells is consistent with the specific supply of labeled albumin into the heart stroma. In contrast, as shown in FIGS. 20A and 20B, there is little staining in the stroma between skeletal muscle cells of the diaphragm. These data indicate that the open heart cardiovascular block method described herein can be used to effectively block the cardiac circulatory system in vivo, and further, the cardiovascular system where the inflammatory regulator is blocked When supplied to the system, it is shown that the specific ejection of macromolecular substances into the interstitium of the heart rather than into the interstitium of body tissues such as the diaphragm is achieved. Thus, these results demonstrate the utility of the present method in delivering a gene vector (eg, plasmid, viral vector, etc.) to the myocardium.
[0234]
Minimally invasive treatment
Blockage of the cardiovascular system can also be achieved using various minimally invasive procedures, in which various catheters are connected to the subject's blood vessels (eg, jugular vein, femoral region). Any one or more of veins, femoral artery, superior vena cava and inferior vena cava). Because these catheters can be used in place of certain catheters and clamps described herein in the thoracotomy, these minimally invasive procedures are performed using a minimal incision. be able to. It is understood that a combination of the method described in the thoracotomy procedure and the minimally invasive procedure described herein can also be used.
[0235]
One example of a minimally invasive procedure for blocking the cardiac circulatory system can be performed using known devices such as those of the Heartport Endo CPB System (Heartport Inc., Palo Alto, Calif.). In this embodiment, the subject's systemic circulatory system is maintained by cannulating the subject's vena cava (preferably at or below the right atrium) and the subject's femoral artery. . The femoral cannula is connected to the arterial branch of the extracorporeal pump / oxygenator and the venous cannula is connected to the venous branch of the device. The subject's cardiac circulatory system is blocked using a Heartport Endocoronary Sinus® catheter, a Heartport Endopulmonary Vent® catheter, and a Heartport Endooromic Clamp® catheter.
[0236]
According to this method, the Heartport Endocoronary Sinus® catheter is inserted through the subject's internal jugular vein, superior vena cava into the right atrium and through the coronary sinus. Next, the balloon attached to the Heartport Endocoronary Sinus® catheter is inflated to fix the catheter. The Heartport Endopulmonary Vent® catheter is also inserted into the right atrium of the subject via the internal jugular vein and superior vena cava. The catheter is then guided through the tricuspid valve to the base of the pulmonary artery, preferably extending through the pulmonary valve. The Heartport Endoorotropic Clamp® catheter is inserted into the subject's femoral artery and advanced along the descending aorta to the ascending aorta. This Heartport Endoorotropic Clamp® catheter balloon does not occlude fluid flow from the aortic root into the ascending aorta, but into the aortic arch (ie, as shown in FIG. 18). The fluid flow is expanded at a blocking level. Alternatively, the portion of the Heartport Endoorotic Clamp® catheter distal to the balloon is extended through the aortic valve into the left ventricle.
[0237]
Once these cannulas and catheters are positioned, a cardiac bypass is created in the subject using the veins and femoral cannulas. Cardiac anesthesia inducing solution is supplied to the base of the aorta via a Heartport Endoorotic Clamp® catheter to stop the heart beating. A gene delivery circuit is formed, whereby fluid containing the gene vector is then fed to the aortic base via a Heartport Endooramic Clamp® catheter, and through the coronary artery and coronary vein to the coronary sinus From here, it returns to the gene supply assembly circuit via the Heartport Endocoronally Sinus® catheter. This gene supply apparatus can be operated by gravity (for example, a reservoir storing the liquid suspended on the object) or a pump. When the gene delivery circuit is pumped, it may be a single flow system or configured as a circulatory system so that the liquid collected by the Heartport Endocoronary Sinus® catheter is returned to the aortic base. May be. The liquid can further include one or more inflammatory regulators as described herein.
[0238]
It is understood that this procedure (ie, using a Heartport device) has major drawbacks. Not all blood supplied to the heart artery is returned to the right atrium through the coronary sinus. About 5 percent of this blood flows into the right atrium and right ventricle via passages called “Thebesius” veins. Thus, according to this method, a portion of the fluid supplied to the aortic base by the gene supply circuit mixes with the venous blood of the right atrium and right ventricle, thereby being supplied to the system by the heart bypass circuit. Mixed with blood. Mixing of the gene supply circuit fluid with the venous blood of the cardiac bypass circuit cannot be minimized by drawing fluid from the Heartport Endopulmonary Vent® catheter, thereby mixing with the gene supply circuit fluid. Venous blood is drawn from the pulmonary artery and right ventricle. Of course, the venous blood drawn through this catheter must be replaced by supplying additional blood to the heart bypass circuit. Therefore, this method is not practical given the amount of blood that needs to be replaced. At least one catheter (ie, the Heartportorological Sinus® catheter) and preferably a second (ie, the Heartport Endopulmonary Vent® catheter) includes one arm of the vena cava and the right atrium. It is impractical to occlude the vena cava or right atrium using this Heartport device. Of course, one or both of these Heartport catheters could be inserted through a right atrial parsstring suture, but this would require a sternotomy of the subject, thereby minimizing the method. Intrusion characteristics are lost.
[0239]
Yet another disadvantage of the procedure using the Heartport device is that the intracoronary sinus catheter reduces cardiac blood flow in the heart. A number of cardiac veins open into the coronary sinus at or near the ostium of the coronary sinus. In order to install the catheter in the coronary sinus, it is necessary to inflate the balloon or similar device in the sinus and to block the blood passing therethrough, the balloon is placed against the ostium. Must be seated. However, by seating the balloon at the ostium, the cardiac veins that open into the coronary sinus at or near the ostium are occluded, thereby preventing or reducing blood flow through the veins. When a substance (eg, a gene vector) is supplied to myocardial tissue via these veins, the supply of that substance to the myocardium associated with those veins is suppressed or prevented. Thus, the use of intracoronary sinus catheters can suppress the supply of substances to at least a portion of myocardial tissue, but this is preferably avoided. Said procedure using the Heartport device relies on the use of an intracoronary sinus catheter and is therefore not preferred.
[0240]
Another minimally invasive procedure that does not have the disadvantages of the procedure described above (ie, using the Heartport device) can be used. In this alternative method, the Heartport Endopulmonary Vent (registered trademark) catheter and the Heartport Endocoronary Sinus (registered trademark) catheter are connected by a multi-function venous return cannula (herein referred to as "cardiac blocking catheter"). Replaced. The cardiac interception catheter is inserted into the superior and inferior vena cava, has a conduit sheet (eg, balloon or bulge) that can be used to occlude the superior and inferior vena cava, and is in fluid communication with at least a pair of ports. With a blood flow lumen, at least one port is located above the conduit sheet in the superior vena cava and at least one port is located below the conduit sheet in the inferior vena cava. When both vena cava are occluded by seating them on the conduit sheet, the venous blood flow passing through both vena cava passes through the venous blood reason lumen of the cardiac interception catheter.
[0241]
Another embodiment of the cardiac isolation catheter is illustrated in FIGS. 15 and 16A. In FIG. 15, both the
[0242]
As shown in FIGS. 15 and 16, the cardiac isolation catheter further includes one or
[0243]
The cardiac interception catheter can be inserted into the vena cava in the up-down direction or in the opposite (ie, down-up) direction. If the catheter is inserted vertically, it is preferably inserted into the human subject via the right jugular vein, but through a separate blood vessel communicating with the left jugular vein or superior vena cava. It is also possible to make it. When the catheter is inserted in a downward and upward direction, it is preferably inserted into the human subject via the subject's femoral vein, but through another blood vessel that communicates with the inferior vena cava. It is also possible to insert. Alternatively, the catheter can be inserted completely through the subject (eg, extending from the patient's femoral vein and the patient's jugular vein). The anatomy of the veins of all patients is somewhat different and in some cases it may not be possible to insert a catheter in one direction, so Flexibility is preferred. In such cases, the catheter can be inserted from another location in the same or different directions. This flexibility is an important feature of the catheter.
[0244]
Regardless of the orientation of the cardiac interception catheter, it is used in a substantially similar manner as described below.
[0245]
A cardiac isolation catheter is inserted through the subject's upper and lower vena cava so that the
[0246]
As shown in FIG. 18, the intra-arterial catheter is inserted into the ascending aorta through the artery of the subject. This intra-arterial catheter has a
[0247]
The distal end of the intra-arterial catheter is set in the base of the artery or in the left ventricle, and the aorta is seated on the arterial conduit sheet between the heart artery and the aortic arch. An example of a suitable placement of an intra-arterial catheter is illustrated in FIG. In this figure, the
[0248]
The
[0249]
The non-cardiac tissue of the subject obtains body venous blood from the subject via the venous
[0250]
When the cardiac blocking catheter is fixed to the vena cava of the subject, the second catheter having the distal end is transferred to the right atrium of the subject via the lumen of the cardiac blocking catheter and the
[0251]
All the catheters described herein can be installed by fluoroscopy, X-ray photography, endotracheal ultrasound heart examination, or acoustic holography, etc., well known in the art. To facilitate such installation, one or more ultrasonically opaque, radiographically opaque, or other detectable markers can be provided inside or outside of these catheters. These markers are well known in the art.
[0252]
When the cardiac blocking catheter, the second catheter, and the intra-arterial catheter are installed (eg, as in FIGS. 17 and 18) and if necessary, the occlusion vein is occluded, via the blocked cardiac circulatory system Fluid flow is initiated. Fluid passes through the fluid access lumen 54 and the
[0253]
In order to prevent undesired body exposure to their composition before recombining the cardiovascular and systemic circulatory systems, the genetic vector (s) or inflammation regulator (s) It may be desirable to wash away the plurality). These compositions can be washed away from the circulatory system by supplying the fluid access lumen of the intra-arterial catheter with a fluid that does not contain those compositions. Prior to joining the cardiovascular and systemic circulations, at least a few cardiac circulations should pass through the blocked cardiac circulation. For example, about 0.5 to 1 liter of liquid can be flushed through the cardiac circulatory system of a human subject.
[0254]
If an inflammatory regulator is being supplied to the blocked cardiac circulatory system, it is recommended that an extracorporeal circulatory support device be provided for the subject as described elsewhere herein.
[0255]
The entire disclosure of each and every patent, patent application, and publication cited herein is hereby incorporated by reference.
[0256]
While the invention has been disclosed with reference to specific embodiments, those skilled in the art will devise other embodiments and modifications of the invention without departing from the true spirit and scope of the invention. It is clear that is possible. The appended claims are intended to be construed to include all such embodiments and equivalent variations.
[Brief description of the drawings]
BRIEF DESCRIPTION OF THE FIGURES FIG. 1 illustrates the pattern of gene transfer in rat muscle in the absence of inflammation regulators, indicating the integrity of the vascular endothelial barrier to adenovirus.
FIG. 1a shows marker gene activity in adult rat biceps muscle 4 days after arterial injection of AdCMVlacZ (Table 1, Series C), evaluated by Xgal staining, at a magnification of 500 times. It is an image.
FIG. 1b is an image showing the marker gene activity in adult rat anterior tibialis muscle assessed by Xgal staining at higher pressure injections at a magnification of 350 times (Table 1, Series). e).
FIG. 1c is an image showing 500 × magnification of marker gene activity in adult rat anterior tibial muscle evaluated by Xgal staining of all mount specimens. 3x3 days before getting this imageTen Intramuscular injection of particulate AdCMVlacZ resulted in limited intensive gene transfer to this part of the anterior tibial muscle.
FIG. 2 consists of panels AF, which are a series of images showing high-efficiency gene transfer to adult rat skeletal muscle fibers after introduction of the gene vector in the presence of histamine and papavalin. is there. Panel A is an image showing the entire hind limb from a dissected rat prior to full mount staining to expose multiple cross sections. Panel B is an image showing the marker gene distribution in the quadriceps muscle (uppermost row of panel A), as evaluated by optical microscopy at a magnification of 100. This image shows that the main blood supply to the rectus femoris is blocked by installing a hemostatic device at the level of the common femoral artery. Panel C is an image showing the relative positions of the muscle groups shown in the images summarized in FIG. Panel D is an image showing the meningiform muscle, the short adductor, and the nearby saphenous artery (upper right of the panel) at a magnification of 25 times. Panel E is an image showing a portion of the anterior tibial muscle in a 300x Normarski micrograph, with unstained walls of small arteries (left central portion of the panel) and many uniformly stained myofiber tissues It shows. Panel F is an image showing the gastrocnemius muscle after gene introduction for 25 times magnification.
FIG. 3 is a diagram showing the position of a pump oxygenator for a human patient.
FIG. 4 is a diagram showing a cannulated position and a position effective for liver blood flow occlusion in a human patient.
FIG. 5 is a diagram showing the relative positions of a minimal access vascular clamp, an ECLP pump oxygenator, and a laparoscopic video monitor in a human patient.
FIG. 6a is a graph summarizing physiological data obtained from about 40 kilograms of sheep dosed with 150 milligrams of papavaline and 1 milligram of histamine. HR means heart rate per minute. BP means mean blood pressure in torr unit measurement. CVP means central venous pressure in torr units. PAP means pulmonary artery pressure in torr units. FAP means femoral artery pressure in torr unit measurement. CPBP means cardiopulmonary bypass flow rate in liters per minute.
FIG. 6b is a graph summarizing physiological data obtained from approximately 40 kilograms of sheep dosed with 300 milligrams of papavaline and 5 milligrams of histamine. Abbreviations are the same as in FIG. 6a.
FIG. 7 is a diagram illustrating the use of a pump, an oxygen supply device, and a pressure regulator to introduce a gene vector into an obstructed rodent hind leg. The arteries and veins of the rodent hind leg are blocked from the rodent circulatory system using a hemostatic device or the like. The gene vector is introduced into the artery. A venous catheter connects the vein to the inlet of the pump. This pump passes blood drawn from the vein via the oxygen supply device to the artery via the second catheter. The pressure regulator maintains the perfusion pressure of the rodent artery.
FIG. 8 is a diagram showing an operation of one embodiment of the oxygen supply device shown in FIG. 7;
FIG. 9 is a diagram showing a structure of the oxygen supply device shown in FIG. 7;
10 is a diagram showing a structure of an embodiment of an interface between the pressure regulator shown in FIG. 7 and an introduction mechanism; FIG.
FIG. 11a introduces the adenoviral vector AdCMVΔ17-48dys, NCL-Dys-, a fluorescently labeled antibody that specifically binds to an epitope present in human dystrophin but not in rat dystrophin. 2 is an image showing a cross-section of rat gastrocnemius muscle immunostained using No. 2;
FIG. 11b is an image showing a cross-section of rat gastrocnemius muscle that has been transfected with the adenoviral vector AdCMVΔ17-48dys and immunofluorescently stained with NCL-Dys-2.
FIG. 12 is a diagram of an adeno-associated viral gene vector labeled “AVL-CMV-delta-sarcoglycan” as described herein.
FIG. 13 is a diagram of a human heart, where the descending aorta has been displaced and some surfaces removed for clarity. The label indicates the following anatomical parts: SVC, superior vena cava; IVC, inferior vena cava; RA, right atrium; CS, coronary sinus (only the coronary sinus gate is visible in this figure); TV, Tricuspid valve; RV, right ventricle; PV, pulmonary artery valve; PA, pulmonary artery; LA, left atrium; BV, bicuspid valve; LV, left ventricle; AV, aortic valve;
FIG. 14 shows a human heart having a
FIG. 15 illustrates a human heart having a cardiac interception catheter screwed through its associated vena cava as described herein.
FIG. 16 is a four-part drawing comprising FIGS. 16A, 16B, 16C and 16D and showing the structure of one embodiment of the cardiac blocking catheter of the present invention. FIG. 16A shows the structure of the distal end of the catheter, with the proximal end of the catheter not shown. FIGS. 16B, 16C and 16D show a cross section of the catheter illustrated in FIG. 16A along the plane illustrated in FIG. 16A.
FIG. 17 shows a human heart consisting of FIGS. 17A and 17B and having an associated cardiac blocking catheter screwed through the vena cava and a second catheter placed in the pulmonary artery. In FIG. 17A, the
FIG. 18 illustrates a human heart having an intra-aortic catheter positioned within its aortic base, as described herein.
FIG. 19 is a pair of views of the apparatus configuration in the embodiment of the cardiac circulation blocking method described herein, comprising FIGS. 19A and 19B. In FIG. 19A, an intra-aortic catheter (EC) and a cardiac interception catheter (CIC) are placed in a patient, as described herein, for an extracorporeal blood oxygenator (EBO) and An extracorporeal fluid circuit (EFC) is connected. In FIG. 19B, an intra-aortic catheter (EC), an superior vena cava return catheter (SCRC), and an inferior vena cava return catheter (ICRC) are placed in the patient, as described herein. On the other hand, an extracorporeal blood oxygen supply device (EBO) and an extracorporeal fluid circuit (EFC) are connected.
FIG. 20 consists of FIGS. 20A, 20B, 20C and 20D, and shows Evans blue dye labeling of canine myocardium and diaphragm tissue after introduction of Evans blue label albumin into the dog's blocked cardiac circulatory system. It is four images which show conversion. Diaphragm tissue is illustrated in FIGS. 20A and 20B at different magnifications. Myocardial tissue (left and right ventricular myocardium) is illustrated in FIGS. 20C and 20D.
FIG. 21 is a cross-sectional image showing an embodiment of the cardiac blockade of the present invention, wherein the catheter is connected via the snare S to the superior vena cava SVC and the inferior vena cava IVC, respectively. And a pair of vena
Claims (32)
Translated fromJapanese(a)その内部で長手方向に延出する静脈血液流ルーメン(24)と、近端部と、遠端部と、近端ポート(14)と、遠端ポート(16)とを有する中空筒状本体(10)、
(b)前記本体(10)に取り付けられた遠端導管シート(17)、
(c)前記本体(10)に取り付けられた近端導管シート(15)、を備え、
哺乳動物の大静脈内に於いて、一方の導管シートが右心房(RA)と、腕頭静脈の接合部との間の前記哺乳動物の上大静脈(SVC)内に位置し、他方の導管シートが、右心房(RA)と肝静脈との間の下大静脈(IVC)内に位置するように、位置決め可能に構成され、
前記遠端ポート(16)は、前記遠端導管シート(17)に対して遠端側に位置し、
前記近端ポート(14)は、前記近端導管シート(15)に対して近端側に位置し、
前記遠端導管シート(17)および前記近端導管シート(15)のそれぞれは、前記本体(10)の周囲に延出した一対の互いに近接離間配置された隆起面で構成され、
前記心臓遮断カテーテルの本体(10)に、その内部に於いて長手方向に延出すると共に、前記一対の近接離間隆起面間に位置する吸入ポート(18)と連通する吸引ルーメン(26)を備え、
前記吸引ルーメン(26)に対して吸引力を付与することによって、大静脈を前記遠端導管シート(17)および前記近端導管シート(15)に確実に着座させ、
哺乳動物の大静脈内にすえつけられた時、腕頭静脈の接合部の血液と、肝静脈の血液が、前記両ポート(14,16)を介して前記静脈血液流ルーメン(24)と流体連通するように構成してある心臓遮断カテーテル(CIC,10)。A cardiac isolation catheter (CIC, 10) insertable into the vena cava of a mammal,
(A)A hollow cylinderhaving a venous blood flow lumen (24) extending longitudinally therein, a near end, a far end, a near end port (14), and a far end port (16) Shaped body (10),
(B) a far-end conduit sheet (17) attached to the body (10);
(C) a near-end conduit sheet (15) attached to the body (10),
In the vena cava ofmammals animals, one conduit sheet right atrium (RA), located on vena cava (SVC) in said mammal between the junction of the brachiocephalic vein, the other The conduit sheet is positionablyconfigured to be located in the inferior vena cava (IVC) between the right atrium (RA) and the hepatic vein;
The far end port (16) is locatedon the far end side with respect to the far end conduit sheet (17),
The proximal end port (14) is located proximal to the proximal end conduit sheet (15);
Each of the far-end conduit sheet (17) and the near-end conduit sheet (15) iscomposed of a pair of closely spaced raised surfaces extending around the body(10);
The body (10) of said cardiac blocking catheter, with longitudinally extending at theinside, with a suction port located between the pair of closely spaced raised surfaces (18) and a suction lumen communicating (26) ,
By applying a suction force to the suction lumen (26), the vena cavais securely seatedon the far-end conduit sheet (17)and the near-end conduit sheet (15);
When mounted to the vena cava ofmammals animals, and blood of the junction of the brachiocephalic vein, hepatic vein blood, the said through both ports (14, 16) venous blood flow lumen (24) Acardiac isolation catheter (CIC, 10) configured to be in fluid communication.
心臓遮断カテーテル(CIC,10)を哺乳動物の大静脈内に位置決めした後、前記バルーン(12)を膨張させることによって、大静脈は前記導管シートにしっかりと着座可能である請求項2に記載の心臓遮断カテーテル(CIC,10)。Before SLextensible conduit sheet (15, 17), together with the attached to the body (10), in this body a balloon having an interior in communication with the extension to the inflation lumen longitudinally within (10) (12) Yes,
Aftercardiac blocking catheter (CIC, 10) positioned within the vena cava of a mammal, by inflating the balloon(12), the large veinsof claim 2 can be firmly seated in the conduit sheetCardiac interrupting catheter (CIC, 10).
前記アクセスポート(20)は前記アクセスルーメンと連通している請求項1に記載の心臓遮断カテーテル(CIC,10)。Before SL body (10) includes an access lumen extending longitudinally at its interior, the access port located between said distal end conduit sheet (17)and the proximal conduit sheet(15) (20) And
It said access port (20)isthe heart blocking catheter of claim 1 in communication with thefront Symbol access lumen(CIC, 10).
前記第2カテーテル(40)の前記遠端部を前記肺動脈(PA)に位置決めしたあと、その内部の前記肺動脈バルーン(42)を膨張させることによって前記肺動脈(PA)をブロック可能に構成してある請求項6に記載の心臓遮断カテーテル(CIC,10)。The pulmonary artery balloon (42) provided in the distal end portion of thefront Stories second catheter(40),
After positioning the distal end of the second catheter (40) to the pulmonary artery (PA),it is constructedthe pulmonary artery (PA) blockableby inflating the pulmonary artery balloon (42) of its internalThe cardiac interception catheter (CIC, 10) according to claim 6.
(a)哺乳動物の大静脈に挿入可能であり、
(i)その内部で長手方向に延出する静脈血液流ルーメン(24)と、近端部と、前記近端部からその内部で伸長する少なくとも1つのアクセスルーメンと、遠端部と、近端ポート(14)と、遠端ポート(16)とを備える中空筒状本体(10)、
(ii)前記本体(10)に取り付けられた遠端導管シート(17)、
(iii)前記本体(10)に取り付けられた近端導管シート(15)、を備え、
哺乳動物の大静脈内に於いて、一方の導管シートが右心房(RA)と、腕頭静脈の接合部との間の前記哺乳動物の上大静脈(SVC)内に位置し、他方の導管シートが、右心房(RA)と肝静脈との間の下大静脈(IVC)内に位置するように、位置決め可能に構成され、
前記遠端ポート(16)は、前記遠端導管シート(17)に対して遠端側に位置し、
前記近端ポート(14)は、前記近端導管シート(15)に対して近端側に位置し、
哺乳動物の大静脈内にすえつけられた時、腕頭静脈の接合部の血液と、肝静脈の血液が、前記両ポート(14,16)を介して前記静脈血液流ルーメン(24)と流体連通する心臓遮断カテーテル(CIC,10)、
(b)前記心臓遮断カテーテル(10)の前記アクセスルーメン内に挿入可能であり、遠端部と、その内部で長手方向に延出する膨張ルーメンと、前記遠端部にその内部が前記膨張ルーメンと流体連通しているバルーン(42)と、を有する第2カテーテル(40)、
(c)遠位部および遠端チップとを備えるフレキシブルロッド(50)と、このフレキシブルロッド(50)の前記遠端部に取り付けられた大動脈内導管シート(52)とを有し、
前記大動脈内導管シート(52)は前記フレキシブルロッド(50)の周囲に延出した一対の互いに近接離間配置された隆起面であり、前記フレキシブルロッド(50)は中空であり、その内部に長手方向に延出する吸引ルーメンを有し、
前記吸引ルーメンに吸引力を付与することによって大動脈(A)は前記大動脈内導管シート(52)に於いて確実に着座される大動脈内カテーテル(EC,50)。A kit for blockingthe mammalian heart from the rest of the circulatory system ofthatmammal, the following (a) Cardiac blocking catheter (CIC, 10), (b) a second catheter (40), And (c) having anintra-aortic catheter (EC, 50) ,
(A) can be inserted into the vena cava of mammals,
(I) a venous blood flow lumen (24) extending longitudinally therein, a proximal end, at least one access lumen extending therein from the proximal end, a distal end, and a proximal end A hollow cylindrical body (10) comprising a port (14) and a far end port (16);
(Ii) a far-end conduit sheet (17) attached to the body (10);
(Iii) a near-end conduit sheet (15) attached to the body (10),
In the vena cava ofmammals animals, one conduit sheet right atrium (RA), located on vena cava (SVC) in said mammal between the junction of the brachiocephalic vein, the other The conduit sheet isconfigured to be positionable so as to be located in the inferior vena cava (IVC) between the right atrium (RA) and the hepatic vein;
The far end port (16) is locatedon the far end side with respect to the far end conduit sheet (17),
The proximal end port (14) is located proximal to the proximal end conduit sheet (15);
When mounted to the vena cava ofmammals animals, and blood of the junction of the brachiocephalic vein, hepatic vein blood, the said through both ports (14, 16) venous blood flow lumen (24) Acardiac isolation catheter (CIC, 10) in fluid communication;
(B) Insertable into the access lumen of the cardiac interception catheter (10), a distal end, an inflation lumen extending longitudinallytherein, andan interior of the distal end of the inflation lumen A balloon (42) in fluid communication with the second catheter (40),
A flexible rod (50) and a (c) a distal portion and far-chip,possess a the flexible rod (50) the far aorta attached to the end conduit sheet(52),
The intra-aortic conduit sheet (52) is a pair of closely spaced raised surfaces extending around the flexible rod (50), and the flexible rod (50) is hollow and has a longitudinal direction inside thereof. Has a suction lumen extending to the
Aorticaortic(A) is to be securely seated at the aortic conduit sheet (52) by applying a suction forceprior Symbol aspiration lumen(EC, 50).
前記大動脈内カテーテル(EC,50)の遠端部を哺乳動物の大動脈(A)内に位置決めした後、前記バルーン(52)を膨張させることによって、大動脈(A)を前記大動脈内導管シート(52)に確実に着座させることができる請求項17に記載のキット。Before Symbol flexible rod (50) is hollow, has an inflation lumen extending longitudinally therein, the aortic conduit sheet (52), together with the attached to the flexible rod (50), said inflation A balloon (52) having an interior in communication with the lumen;
After the distal end portion of theintra-aortic catheters (EC, 50) positioned in the aorta (A) of the mammal, by inflating the balloon (52), aorta (A) the aortic conduit sheets (The kit according to claim 17, which can be reliably seated on 52).
前記液体アクセスポートは前記液体アクセスルーメンと流体連通し、前記バルーン(52)よりも前記フレキシブルロッド(50)の遠端チップの近傍に配置される請求項17に記載のキット。Before Symbol balloon (52) are not placed in the distal end tip of the flexible rod (50), said flexible rod (50) includes a liquid access lumen extending longitudinally therein, said flexible rod (50 A liquid access port disposed at the far end of
18.The kit of claim 17, wherein the liquid access port is in fluid communication with theliquid access lumen and is disposed nearer the distal tip of the flexible rod (50) than the balloon (52).
前記流体吸収ポートは前記流体吸収ルーメンと連通している請求項17に記載のキット。Before Stories second catheter(40) includes a fluid absorbing lumen extending longitudinally therein and a fluid absorption port provided on the distal end of the second catheter(40),
The kit of claim 17, wherein the fluid absorption port is in communication with the fluid absorption lumen.
(f)前記哺乳動物から取出された血液に酸素を供給する血液酸素供給器、を備える請求項23に記載のキット。( E) a pump that draws blood from the venous blood flow lumen (24) of the cardiac interception catheter (CIC, 10) and supplies the blood to the arterial blood flow lumen of the cannula (80);
24.The kit according to claim 23, further comprising (f) a blood oxygen supplier for supplying oxygen to blood taken from the mammal.
前記心臓遮断カテーテル(CIC,10)は、カテーテルの近端部へ長手方向に延出する静脈血液流ルーメン(24)と、当該静脈血液流ルーメン(24)と連通する一対の静脈血液吸収ポート(14,16)とを有し、
前記導管シート(15,17)は、カテーテル本体(10)の周囲に延出した一対の互いに近接離間配置された隆起面であり、前記カテーテル本体(10)に、その内部に於いて長手方向に延出すると共に前記一対の近接離間隆起面間に位置する吸入ポート(18)と連通する吸引ルーメン(26)を備え、
前記吸引ルーメン(26)に対して吸引力を付与することによって、大静脈が前記導管シート(15,17)に確実に着座される大静脈血液吸収キット。A vena cava blood absorption kit comprising a cardiac isolation catheter (CIC, 10) insertable into a mammalian vena cava and a pair of conduit sheets (15, 17) attached thereto,
Saidcardiac blocking catheter (CIC, 10)is Ca to the proximal end of the catheters and venous blood flow lumen extending in the longitudinal direction(24), a pair of venous blood absorption port communicatingwith the venous blood flow lumen (24) (14, 16)and has a,
The conduit sheets (15, 17) are a pair of closely spaced raised surfaces extending around the catheter body (10), and are arranged on the catheter body (10) in the longitudinal direction. A suction lumen (26) extending and communicating with a suction port (18) located between the pair of closely spaced raised surfaces;
A vena cava blood absorption kit in whichthe vena cava is securely seated on the conduit sheet (15, 17) by applying a suction force to the aspiration lumen (26).
前記静脈吸収ポート(14,16)のうちの一つと、前記導管シート(15,17)の一つとは前記遠位部に位置され、
前記導管シート上の静脈吸収ポートが、前記遠位部の前記導管シートよりも前記遠端部の近くに位置し、
前記静脈吸収ポート(14,16)の他方と前記導管シート(15,17)の他方とは、前記近位部に位置し、そして
前記遠位部の前記導管シートは、前記遠位部の前記静脈吸収ポートよりも前記遠端部の近くに位置する請求項29に記載の大静脈血液吸収キット。It said cardiac blocking catheter (CIC, 10) has a proximal portion, a distal portion,and a distal end,
One of the venous absorption ports (14, 16) and one of the conduit sheets (15, 17) are located at the distal portion;
A venous absorption port on the conduit sheet is located closer to the distal end than the conduit sheet of the distal portion;
The other of the venous absorption port (14, 16) and the other of the conduit sheet (15, 17) are located at the proximal portion, and the distal portion of the conduit sheet is the distal portion of the distal portion of the distal portion. 30. The venacava blood absorption kit according toclaim 29, wherein the vena cava blood absorption kit is located closer to the far end than the venous absorption port.
前記心臓遮断カテーテル(CIC,10)は、その外面にノッチを有し、該ノッチは、前記第2カテーテル(40)の本体にフィットするように構成されている請求項30に記載の大静脈血液吸収キット。Having at least one access lumen extending therein from the proximal end and a second catheter (40) insertable into the access lumen;
Saidcardiac blocking catheter (CIC, 10) has a notch on its outer surface, said notches,vena cava blood of claim 30 which is configured to fitthe second body of the catheter (40)Absorption kit.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US6831797P | 1997-12-19 | 1997-12-19 | |
| US60/068,317 | 1997-12-19 | ||
| PCT/US1998/027072WO1999031982A1 (en) | 1997-12-19 | 1998-12-18 | Transvascular delivery of a composition to an extravascular tissue of a mammal |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2001526071A JP2001526071A (en) | 2001-12-18 |
| JP4299967B2true JP4299967B2 (en) | 2009-07-22 |
Family
ID=22081785
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000524995AExpired - LifetimeJP4299967B2 (en) | 1997-12-19 | 1998-12-18 | Intratubal administration of the composition to the extravascular tissue of a mammal |
Country Status (5)
| Country | Link |
|---|---|
| EP (1) | EP1041882A4 (en) |
| JP (1) | JP4299967B2 (en) |
| AU (1) | AU774299B2 (en) |
| CA (1) | CA2314905A1 (en) |
| WO (1) | WO1999031982A1 (en) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6627616B2 (en) | 1995-12-13 | 2003-09-30 | Mirus Corporation | Intravascular delivery of non-viral nucleic acid |
| US6379966B2 (en) | 1999-02-26 | 2002-04-30 | Mirus Corporation | Intravascular delivery of non-viral nucleic acid |
| JP2004534719A (en) | 2000-10-13 | 2004-11-18 | ジョンズ・ホプキンス・ユニバーシティ | Methods and compositions for nucleic acid delivery |
| WO2004011060A2 (en) | 2002-07-26 | 2004-02-05 | Mirus Corporation | Delivery of molecules and complexes to mammalian cells in vivo |
| WO2005030292A2 (en) | 2003-09-26 | 2005-04-07 | The Trustees Of The University Of Pennsylvania | Methods, compositions and apparatus for delivering heterologous molecules to cells |
| AR047658A1 (en) | 2004-02-03 | 2006-02-01 | Cargill Inc | CONCENTRATE OF PROTEINS AND WATER CURRENT WITH HYDROSOLUBBLE CARBOHYDRATES |
| BRPI0508073A (en)* | 2004-02-26 | 2007-07-17 | Kardia Pty Ltd V | method and apparatus for substantially isolating cardiac circulation from systemic circulation apparatus for perfusing the heart with a therapeutic agent, obstruction catheter for obstructing flow between a main vessel and one or more branched vessels, method for administering a therapeutic agent to the heart and support structure percutaneously manageable to maintain coronary sinus patency |
| US7722596B2 (en) | 2004-02-26 | 2010-05-25 | Osprey Medical, Inc. | Regional cardiac tissue treatment |
| US7534775B2 (en) | 2004-04-08 | 2009-05-19 | Sangamo Biosciences, Inc. | Methods and compositions for modulating cardiac contractility |
| WO2006039218A2 (en) | 2004-09-30 | 2006-04-13 | The Trustees Of The University Of Pennsylvania | Perfusion circuit and use therein in targeted delivery of macromolecules |
| US8158119B2 (en) | 2005-12-05 | 2012-04-17 | The Trustees Of The University Of Pennsylvania | Cardiac targeted delivery of cells |
| US8152786B2 (en) | 2006-11-07 | 2012-04-10 | Osprey Medical, Inc. | Collection catheter and kit |
| US9050400B2 (en) | 2008-08-12 | 2015-06-09 | Osprey Medical, Inc. | Remote sensing catheter system and methods |
| US9295816B2 (en) | 2009-12-09 | 2016-03-29 | Osprey Medical, Inc. | Catheter with distal and proximal ports |
| WO2013023126A2 (en) | 2011-08-11 | 2013-02-14 | Osprey Medical Inc. | Systems and methods for limb treatment |
| US12064120B2 (en)* | 2019-03-29 | 2024-08-20 | Abiomed, Inc. | Systems and methods for left ventricular unloading in biologic therapy or vectored gene therapy |
| EP4284335A1 (en) | 2021-02-01 | 2023-12-06 | RegenxBio Inc. | Gene therapy for neuronal ceroid lipofuscinoses |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5433700A (en)* | 1992-12-03 | 1995-07-18 | Stanford Surgical Technologies, Inc. | Method for intraluminally inducing cardioplegic arrest and catheter for use therein |
| US5384128A (en)* | 1993-03-02 | 1995-01-24 | University Of Alabama Research Foundation | Method of and compounds for treatment for cystic fibrosis |
| US5478309A (en)* | 1994-05-27 | 1995-12-26 | William P. Sweezer, Jr. | Catheter system and method for providing cardiopulmonary bypass pump support during heart surgery |
- 1998
- 1998-12-18JPJP2000524995Apatent/JP4299967B2/ennot_activeExpired - Lifetime
- 1998-12-18EPEP98966022Apatent/EP1041882A4/ennot_activeWithdrawn
- 1998-12-18CACA002314905Apatent/CA2314905A1/ennot_activeAbandoned
- 1998-12-18AUAU22013/99Apatent/AU774299B2/ennot_activeCeased
- 1998-12-18WOPCT/US1998/027072patent/WO1999031982A1/ennot_activeApplication Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| EP1041882A1 (en) | 2000-10-11 |
| AU774299B2 (en) | 2004-06-24 |
| WO1999031982A1 (en) | 1999-07-01 |
| EP1041882A4 (en) | 2002-04-17 |
| JP2001526071A (en) | 2001-12-18 |
| CA2314905A1 (en) | 1999-07-01 |
| AU2201399A (en) | 1999-07-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6673039B1 (en) | Compositions, kits, methods, and apparatus for transvascular delivery of a composition to an extravascular tissue of a mammal | |
| US6177403B1 (en) | Compositions, methods, and apparatus for delivery of a macromolecular assembly to an extravascular tissue of an animal | |
| JP4299967B2 (en) | Intratubal administration of the composition to the extravascular tissue of a mammal | |
| US8303567B2 (en) | Method for delivering a macromolecular complex to muscle cells | |
| Wang et al. | Wang-Zwische double lumen cannula—toward a percutaneous and ambulatory paracorporeal artificial lung | |
| Tofukuji et al. | Mesenteric dysfunction after cardiopulmonary bypass: role of complement C5a | |
| US20060258980A1 (en) | Global myocardial perfusion catheter | |
| Cave et al. | Thromboxane A2 mediates pulmonary hypertension after cardiopulmonary bypass in the rabbit | |
| Bridges et al. | Global cardiac-specific transgene expression using cardiopulmonary bypass with cardiac isolation | |
| US20210283203A1 (en) | Transluminal Delivery of Viruses for Treatment of Diseased Tissue | |
| Gaines et al. | The Pennsylvania State University paracorporeal ventricular assist pump: optimal methods of use | |
| JPH07500585A (en) | Use of prostacyclin derivatives to prevent or treat side effects of contrast agents | |
| JP2001252354A (en) | Dosing device | |
| US20170143891A1 (en) | Systems and methods for pressure-regulated volume control during cardiopulmonary bypass and perfusion procedures | |
| ZOU et al. | Targeting behavior of hepatic artery injected temperature sensitive liposomal adriamycin on tumor-bearing rats | |
| Berkowitz et al. | Management of pediatric cardiopulmonary bypass | |
| Pagani et al. | Mitral valve reconstruction in sickle cell disease | |
| Cornish et al. | Principles and practice of venovenous extracorporeal membrane oxygenation | |
| JP5779750B2 (en) | Pharmaceutical composition for angiogenesis therapy | |
| Galatoudis et al. | Anesthetic considerations for surgery involving clamping of superior vena cava | |
| TWI221422B (en) | Quasi-T shaped catheter for chemotherapy | |
| TW202430644A (en) | Loco-regional perfusion of a kidney for localized gene therapy | |
| McLoughlin Jr et al. | Case 2—1995 Continuous retrograde cerebral perfusion as an adjunct to brain protection during deep hypothermic systemic circulatory arrest | |
| CA2582143A1 (en) | Gene therapy for treatment of heart failure | |
| Kopcak, Jr et al. | Dual arterial cannulation for aortic surgical procedures in adult sheep |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination | Free format text:JAPANESE INTERMEDIATE CODE: A621 Effective date:20051007 | |
| A131 | Notification of reasons for refusal | Free format text:JAPANESE INTERMEDIATE CODE: A131 Effective date:20070830 | |
| A601 | Written request for extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A601 Effective date:20071128 | |
| A602 | Written permission of extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A602 Effective date:20071205 | |
| A601 | Written request for extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A601 Effective date:20071227 | |
| A602 | Written permission of extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A602 Effective date:20080109 | |
| A601 | Written request for extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A601 Effective date:20080129 | |
| A602 | Written permission of extension of time | Free format text:JAPANESE INTERMEDIATE CODE: A602 Effective date:20080205 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20080229 | |
| RD13 | Notification of appointment of power of sub attorney | Free format text:JAPANESE INTERMEDIATE CODE: A7433 Effective date:20080408 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A821 Effective date:20080408 | |
| A131 | Notification of reasons for refusal | Free format text:JAPANESE INTERMEDIATE CODE: A131 Effective date:20080617 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20080708 | |
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) | Free format text:JAPANESE INTERMEDIATE CODE: A01 Effective date:20090324 | |
| A01 | Written decision to grant a patent or to grant a registration (utility model) | Free format text:JAPANESE INTERMEDIATE CODE: A01 | |
| A61 | First payment of annual fees (during grant procedure) | Free format text:JAPANESE INTERMEDIATE CODE: A61 Effective date:20090420 | |
| R150 | Certificate of patent or registration of utility model | Free format text:JAPANESE INTERMEDIATE CODE: R150 | |
| FPAY | Renewal fee payment (event date is renewal date of database) | Free format text:PAYMENT UNTIL: 20120424 Year of fee payment:3 | |
| FPAY | Renewal fee payment (event date is renewal date of database) | Free format text:PAYMENT UNTIL: 20120424 Year of fee payment:3 | |
| FPAY | Renewal fee payment (event date is renewal date of database) | Free format text:PAYMENT UNTIL: 20130424 Year of fee payment:4 | |
| FPAY | Renewal fee payment (event date is renewal date of database) | Free format text:PAYMENT UNTIL: 20130424 Year of fee payment:4 | |
| FPAY | Renewal fee payment (event date is renewal date of database) | Free format text:PAYMENT UNTIL: 20140424 Year of fee payment:5 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| R250 | Receipt of annual fees | Free format text:JAPANESE INTERMEDIATE CODE: R250 | |
| EXPY | Cancellation because of completion of term |