JP2024506115A - 固体状のポリペプチドを含む組成物および関連する方法 - Google Patents
固体状のポリペプチドを含む組成物および関連する方法Download PDFInfo
- Publication number
- JP2024506115A JP2024506115AJP2023506227AJP2023506227AJP2024506115AJP 2024506115 AJP2024506115 AJP 2024506115AJP 2023506227 AJP2023506227 AJP 2023506227AJP 2023506227 AJP2023506227 AJP 2023506227AJP 2024506115 AJP2024506115 AJP 2024506115A
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- composition
- hydrogel
- equal
- pembrolizumab
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/545—Heterocyclic compounds
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1635—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1658—Proteins, e.g. albumin, gelatin
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Organic Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Description
関連出願
本出願は、「固体状のポリペプチドを含む組成物および関連する方法」という名称の2020年7月31日に出願された米国仮特許出願第63/059,477号の米国特許法119条(e)項の下での利益を主張し、この仮特許出願は、すべての目的のために、その全体が参照により本明細書に組み込まれる。
本出願は、「固体状のポリペプチドを含む組成物および関連する方法」という名称の2020年7月31日に出願された米国仮特許出願第63/059,477号の米国特許法119条(e)項の下での利益を主張し、この仮特許出願は、すべての目的のために、その全体が参照により本明細書に組み込まれる。
技術分野
結晶性抗体などの固体状のポリペプチドを含む組成物を一般に記載する。
結晶性抗体などの固体状のポリペプチドを含む組成物を一般に記載する。
背景
ポリペプチド(例えば、タンパク質)は、各種の予防的および/または治療的理由のいずれかのために、対象に投与され得る。そのような使用に好適であり得るポリペプチドの例としては、抗体、例えば、モノクローナル抗体が挙げられる。有効性およびポリペプチドを含む組成物を投与し得る容易さは、ポリペプチドの濃度および組成物の流動特性に依存し得る。
ポリペプチド(例えば、タンパク質)は、各種の予防的および/または治療的理由のいずれかのために、対象に投与され得る。そのような使用に好適であり得るポリペプチドの例としては、抗体、例えば、モノクローナル抗体が挙げられる。有効性およびポリペプチドを含む組成物を投与し得る容易さは、ポリペプチドの濃度および組成物の流動特性に依存し得る。
したがって、ポリペプチドの投与のための改善された製剤の開発が所望されている。
要旨
結晶性抗体などの固体状のポリペプチドを含む組成物および関連する方法を一般に記載する。組成物は、固体状のポリペプチド(例えば、結晶、無定形固体)を少なくとも部分的に封入するヒドロゲルなどの担体を含み得る。記載されるある特定の材料による封入は、一部の例では、対象へのある特定の種類の投与のため(例えば、予防的または治療的適用のため)に有用なポリペプチドの構造および機能特性を保持しながら、ポリペプチドの相対的に高いローディングを含有する組成物をもたらし得る。一部の例では、相対的に高いポリペプチドローディングを有しながら、相対的に低い動的粘度を有する組成物が提供される。本発明の主題は、一部の場合では、相互に関係する生成物、特定の課題に対する代替の解決手段、および/または1つもしくは複数の系および/もしくは物品の複数の異なる使用を伴う。
結晶性抗体などの固体状のポリペプチドを含む組成物および関連する方法を一般に記載する。組成物は、固体状のポリペプチド(例えば、結晶、無定形固体)を少なくとも部分的に封入するヒドロゲルなどの担体を含み得る。記載されるある特定の材料による封入は、一部の例では、対象へのある特定の種類の投与のため(例えば、予防的または治療的適用のため)に有用なポリペプチドの構造および機能特性を保持しながら、ポリペプチドの相対的に高いローディングを含有する組成物をもたらし得る。一部の例では、相対的に高いポリペプチドローディングを有しながら、相対的に低い動的粘度を有する組成物が提供される。本発明の主題は、一部の場合では、相互に関係する生成物、特定の課題に対する代替の解決手段、および/または1つもしくは複数の系および/もしくは物品の複数の異なる使用を伴う。
一態様では、組成物が提供される。一部の実施形態では、組成物は、ヒドロゲル、およびヒドロゲルによって少なくとも部分的に封入された、固体状のポリペプチドを含む結晶を含む。
一部の実施形態では、組成物は、1mg/mLよりも大きいまたはそれに等しく、かつ500mg/mL未満またはそれに等しい量で存在する固体状のポリペプチドを含む結晶を含み、組成物は、その他の点では本質的に同一の条件下で、同等の濃度の結晶性ポリペプチドを有する水性懸濁液の動的粘度の1.1分の1以下の動的粘度を有する。
一部の実施形態では、組成物は、10wt%未満またはそれに等しい結晶が凝集するように、1種または複数のヒドロゲルと会合した固体状のポリペプチドを含む結晶を含む。
一部の実施形態では、組成物は、ヒドロゲル粒子、およびヒドロゲル粒子によって少なくとも部分的に封入された固体状のポリペプチドを含む。
一部の実施形態では、結晶性ポリペプチドは、担体によって少なくとも部分的に封入されている。
一部の実施形態では、担体は、ヒドロゲルを含む。
一部の実施形態では、固体状のポリペプチドを含む結晶は、50mg/mLよりも大きいまたはそれに等しく、かつ500mg/mL未満またはそれに等しい量で存在し、組成物は、その他の点では本質的に同一の条件下で、同等の濃度の結晶性ポリペプチドを有する水性懸濁液の動的粘度の4分の1以下の動的粘度を有する。
一部の実施形態では、ヒドロゲルは、共有結合により架橋されたポリマー鎖、イオンにより架橋されたポリマー鎖、および/または熱により架橋されたポリマー鎖を含む。
一部の実施形態では、架橋されたポリマー鎖は、75kDa未満またはそれに等しい分子量を有するポリマー鎖から形成されている。
一部の実施形態では、イオンにより架橋されたポリマー鎖は、金属イオンを介して架橋されている。
一部の実施形態では、ヒドロゲルは、架橋されたポリアルキレンオキシドを含む。
一部の実施形態では、ポリアルキレンオキシドは、ポリエチレングリコールを含む。
一部の実施形態では、ヒドロゲルは、架橋された多糖を含む。
一部の実施形態では、多糖は、アルギネートを含む。
一部の実施形態では、多糖は、少なくとも部分的に酸化されたアルギネートを含む。
一部の実施形態では、多糖は、アガロースを含む。
一部の実施形態では、ヒドロゲルは、ポリペプチド鎖を含む。
一部の実施形態では、ヒドロゲルは、ゼラチンを含む。
一部の実施形態では、ヒドロゲルの少なくとも一部は、球、球状または繊維状の形状を有する粒子の形態である。
一部の実施形態では、粒子は、100ミクロンよりも大きいまたはそれに等しく、かつ300ミクロン未満またはそれに等しい平均最大断面寸法を有する。
一部の実施形態では、粒子は、10ミクロンよりも大きいまたはそれに等しく、かつ100ミクロン未満またはそれに等しい平均最大断面寸法を有する。
一部の実施形態では、粒子は、1ミクロンよりも大きいまたはそれに等しく、かつ30ミクロン未満またはそれに等しい平均最大断面寸法を有する。
一部の実施形態では、粒子は、1ミクロンよりも大きいまたはそれに等しく、かつ10ミクロン未満またはそれに等しい平均最大断面寸法を有する。
一部の実施形態では、粒子は、1ミクロン未満またはそれに等しい平均最大断面寸法を有する。
一部の実施形態では、組成物は、結晶性ポリペプチドを5wt%よりも多いまたはそれに等しい量で含む。
一部の実施形態では、リン酸緩衝生理食塩水溶液への曝露の際に、90%未満またはそれに等しいポリペプチドは、曝露5時間後に、液体に放出される。
一部の実施形態では、ポリペプチドは、酵素結合免疫吸着活性アッセイによって測定して、組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間、活性である。
一部の実施形態では、10%以下のポリペプチドは、組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間後に分解または凝集する。
一部の実施形態では、少なくとも90%のポリペプチドは、組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間後にそのネイティブ状態でフォールドされている。
一部の実施形態では、固体状のポリペプチドを含む結晶は、キラル結晶の二次非線形イメージング技法によって測定して、組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間、結晶性である。
一部の実施形態では、組成物は、その他の点では本質的に同一の条件下で、同等の濃度の非封入非結晶性ポリペプチドを有する水性懸濁液の動的粘度の50分の1以下の動的粘度を有する。
一部の実施形態では、組成物は、25℃の温度および100秒-1のずり速度下で、0.3Pa秒未満またはそれに等しい動的粘度を有する。
一部の実施形態では、ポリペプチドは、治療用ポリペプチドとして、予防用ポリペプチドとして、または治療用ポリペプチドおよび予防用ポリペプチドの両方としての機能を果たすことができる。
一部の実施形態では、ポリペプチドは、第1の治療剤および/または予防剤であり、組成物は、第2の治療剤および/または予防剤をさらに含む。
一部の実施形態では、ポリペプチドは、抗体である。
一部の実施形態では、ポリペプチドは、モノクローナル抗体である。
一部の実施形態では、ポリペプチドは、IgGの任意のサブタイプのモノクローナル抗体である。
一部の実施形態では、ポリペプチドは、抗PD-1抗体である。
一部の実施形態では、ポリペプチドは、それぞれ、配列番号1、2および3に記載されるアミノ酸の配列を含む軽鎖(LC)相補性決定領域(CDR)のLC-CDR1、LC-CDR2およびLC-CDR3、ならびにそれぞれ、配列番号6、7および8に記載されるアミノ酸の配列を含む重鎖(HC)CDRのHC-CDR1、HC-CDR2およびHC-CDR3を含む抗PD-1抗体である。
一部の実施形態では、ポリペプチドは、配列番号9に記載されるアミノ酸の配列または配列番号9のバリアントを含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列または配列番号4のバリアントを含む軽鎖可変領域を含む抗PD-1抗体である。
一部の実施形態では、ポリペプチドは、配列番号9に記載されるアミノ酸の配列を含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列を含む軽鎖可変領域を含む抗PD-1抗体である。
一部の実施形態では、抗PD-1抗体は、配列番号10に記載されるアミノ酸の配列または配列番号10のバリアントを含む重鎖、および配列番号5に記載されるアミノ酸の配列または配列番号5のバリアントを含む軽鎖を含むモノクローナル抗体である。
一部の実施形態では、抗PD-1抗体は、配列番号10に記載されるアミノ酸の配列を含む重鎖、および配列番号5に記載されるアミノ酸の配列を含む軽鎖を含むモノクローナル抗体である。
一部の実施形態では、抗PD-1抗体は、ペムブロリズマブまたはペムブロリズマブバリアントである。
一部の実施形態では、抗PD-1抗体は、ペムブロリズマブである。
一部の実施形態では、1つまたは複数の結晶は、カフェインと複合体化した固体状のペムブロリズマブを含む。
一部の実施形態では、1つまたは複数の結晶は、
(a)(i)ペムブロリズマブまたはペムブロリズマブバリアントの水性緩衝溶液、
(ii)ポリエチレングリコール(PEG)、ならびに
(iii)カフェイン、テオフィリン、2’デオキシグアノシン-5’-一リン酸、生理活性ジベレリン、および生理活性ジベレリンの薬学的に許容される塩からなる群から選択される添加物
を混合して、結晶化溶液を形成すること、
(b)結晶形成のために十分な期間、結晶化溶液をインキュベートすること、ならびに
(c)溶液から結晶性ペムブロリズマブまたはペムブロリズマブバリアントを回収すること
を含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含む。
(a)(i)ペムブロリズマブまたはペムブロリズマブバリアントの水性緩衝溶液、
(ii)ポリエチレングリコール(PEG)、ならびに
(iii)カフェイン、テオフィリン、2’デオキシグアノシン-5’-一リン酸、生理活性ジベレリン、および生理活性ジベレリンの薬学的に許容される塩からなる群から選択される添加物
を混合して、結晶化溶液を形成すること、
(b)結晶形成のために十分な期間、結晶化溶液をインキュベートすること、ならびに
(c)溶液から結晶性ペムブロリズマブまたはペムブロリズマブバリアントを回収すること
を含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含む。
一部の実施形態では、添加物は、カフェインである。
一部の実施形態では、1つまたは複数の結晶は、結晶形成に十分な時間、少なくとも25℃であり、かつ50℃以下である温度で、ペムブロリズマブまたはペムブロリズマブバリアントを含む溶液を沈殿溶液に曝露することを含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含み、沈殿溶液は、4.0~5.0のpHを有し、1.0M~2.5Mのリン酸二水素アンモニウムを含む。
一部の実施形態では、沈殿溶液は、(a)1.5M~2.0Mのリン酸二水素アンモニウムおよび100~120mMのトリスHCl、または(b)1.9Mのリン酸二水素アンモニウムおよび0.09Mのリン酸水素アンモニウムを含む。
一部の実施形態では、固体状のポリペプチドの少なくとも一部は、結晶の形態である。
一部の実施形態では、固体状のポリペプチドの少なくとも一部は、無定形固体の形態である。
別の態様では、ポリペプチドを送達する方法が提供される。一部の実施形態では、方法は、ヒドロゲルおよび固体状のポリペプチドを含む組成物を患者に投与することを含み、ポリペプチドは、ヒドロゲルによって少なくとも部分的に封入されている。
一部の実施形態では、組成物を患者に投与することは、組成物を患者に注射することを含む。
一部の実施形態では、患者に注射することは、組成物が4000秒-1よりも大きいまたはそれに等しいずり速度を経験するように、組成物を開口部に通過させることを含む。
一部の実施形態では、ポリペプチドは、治療用ポリペプチドとして、予防用ポリペプチドとして、または治療用ポリペプチドおよび予防用ポリペプチドの両方としての機能を果たすことができる。
一部の実施形態では、固体状のポリペプチドの少なくとも一部は、結晶の形態である。
一部の実施形態では、固体状のポリペプチドの少なくとも一部は、無定形固体の形態である。
一部の実施形態では、ポリペプチドは、抗体である。
一部の実施形態では、ポリペプチドは、モノクローナル抗体である。
一部の実施形態では、ポリペプチドは、IgGの任意のサブタイプのモノクローナル抗体である。
一部の実施形態では、ポリペプチドは、抗PD-1抗体である。
一部の実施形態では、ポリペプチドは、それぞれ、配列番号1、2および3に記載されるアミノ酸の配列を含む軽鎖(LC)相補性決定領域(CDR)のLC-CDR1、LC-CDR2およびLC-CDR3、ならびにそれぞれ、配列番号6、7および8に記載されるアミノ酸の配列を含む重鎖(HC)CDRのHC-CDR1、HC-CDR2およびHC-CDR3を含む抗PD-1抗体である。
一部の実施形態では、ポリペプチドは、配列番号9に記載されるアミノ酸の配列または配列番号9のバリアントを含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列または配列番号4のバリアントを含む軽鎖可変領域を含む抗PD-1抗体である。
一部の実施形態では、ポリペプチドは、配列番号9に記載されるアミノ酸の配列を含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列を含む軽鎖可変領域を含む抗PD-1抗体である。
一部の実施形態では、抗PD-1抗体は、配列番号10に記載されるアミノ酸の配列または配列番号10のバリアントを含む重鎖、および配列番号5に記載されるアミノ酸の配列または配列番号5のバリアントを含む軽鎖を含むモノクローナル抗体である。
一部の実施形態では、抗PD-1抗体は、配列番号10に記載されるアミノ酸の配列を含む重鎖、および配列番号5に記載されるアミノ酸の配列を含む軽鎖を含むモノクローナル抗体である。
一部の実施形態では、抗PD-1抗体は、ペムブロリズマブまたはペムブロリズマブバリアントである。
一部の実施形態では、抗PD-1抗体は、ペムブロリズマブである。
一部の実施形態では、結晶(単数または複数)は、カフェインと複合体化した固体状のペムブロリズマブを含む。
一部の実施形態では、結晶(単数または複数)は、
(a)(i)ペムブロリズマブまたはペムブロリズマブバリアントの水性緩衝溶液、
(ii)ポリエチレングリコール(PEG)、ならびに
(iii)カフェイン、テオフィリン、2’デオキシグアノシン-5’-一リン酸、生理活性ジベレリン、および生理活性ジベレリンの薬学的に許容される塩からなる群から選択される添加物
を混合して、結晶化溶液を形成すること、
(b)結晶形成のために十分な期間、結晶化溶液をインキュベートすること、ならびに
(c)溶液から結晶性ペムブロリズマブまたはペムブロリズマブバリアントを回収すること
を含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含む。
(a)(i)ペムブロリズマブまたはペムブロリズマブバリアントの水性緩衝溶液、
(ii)ポリエチレングリコール(PEG)、ならびに
(iii)カフェイン、テオフィリン、2’デオキシグアノシン-5’-一リン酸、生理活性ジベレリン、および生理活性ジベレリンの薬学的に許容される塩からなる群から選択される添加物
を混合して、結晶化溶液を形成すること、
(b)結晶形成のために十分な期間、結晶化溶液をインキュベートすること、ならびに
(c)溶液から結晶性ペムブロリズマブまたはペムブロリズマブバリアントを回収すること
を含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含む。
一部の実施形態では、添加物は、カフェインである。
一部の実施形態では、1つまたは複数の結晶は、結晶形成に十分な時間、少なくとも25℃であり、かつ50℃以下である温度で、ペムブロリズマブまたはペムブロリズマブバリアントを含む溶液を沈殿溶液に曝露することを含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含み、沈殿溶液は、4.0~5.0のpHを有し、1.0M~2.5Mのリン酸二水素アンモニウムを含む。
一部の実施形態では、沈殿溶液は、(a)1.5M~2.0Mのリン酸二水素アンモニウムおよび100~120mMのトリスHCl、または(b)1.9Mのリン酸二水素アンモニウムおよび0.09Mのリン酸水素アンモニウムを含む。
本発明の他の利益および新規特長は、添付の図面と併せて考慮した場合に、本発明のさまざまな非限定的な実施形態の以下の詳細な説明から明らかになるであろう。本明細書および参考文献によって組み込まれる文書が、相反するおよび/または矛盾する開示を含む場合、本明細書が優先されるものとする。
本発明の非限定的な実施形態を、添付の図を参照して例として記載し、これは、概略図であって、縮尺通りに描くことを意図するものではない。図では、図示されるそれぞれ同一のまたはほぼ同一の構成要素は、典型的には、単一の数字によって例示される。明確さの目的で、すべての構成要素はすべての図において標識せず、当業者が本発明を理解することを可能にするために図示が必要でない場合、本発明のそれぞれの実施形態のすべての構成要素を示さない。
詳細な説明
結晶性抗体などの固体状のポリペプチドを含む組成物および関連する方法を一般に記載する。組成物は、固体状のポリペプチド(例えば、結晶、無定形固体)を少なくとも部分的に封入するヒドロゲルなどの担体を含み得る。記載されるある特定の材料による封入は、一部の例では、患者へのある特定の種類の投与のため(例えば、予防的または治療的適用のため)に有用なポリペプチドの構造および機能特性を保持しながら、ポリペプチドの相対的に高いローディングを含有する組成物をもたらし得る。一部の例では、相対的に高いポリペプチドローディングを有しながら、相対的に低い動的粘度を有する組成物が提供される。
結晶性抗体などの固体状のポリペプチドを含む組成物および関連する方法を一般に記載する。組成物は、固体状のポリペプチド(例えば、結晶、無定形固体)を少なくとも部分的に封入するヒドロゲルなどの担体を含み得る。記載されるある特定の材料による封入は、一部の例では、患者へのある特定の種類の投与のため(例えば、予防的または治療的適用のため)に有用なポリペプチドの構造および機能特性を保持しながら、ポリペプチドの相対的に高いローディングを含有する組成物をもたらし得る。一部の例では、相対的に高いポリペプチドローディングを有しながら、相対的に低い動的粘度を有する組成物が提供される。
タンパク質などのポリペプチドは、患者に投与される一般的な予防用および治療用医薬品である。しかしながら、患者へのポリペプチドの好都合の投与は、多くの課題を提示する。例えば、ポリペプチドの皮下投与は、抗体のための投与の代替経路であり、これは、多くの場合、数週間ごとの静脈内注入を介して投与される。そのような静脈内注入は、医療専門家の助けを必要として、数時間にわたって行われる場合がある。皮下投与(および他の投与の経路)は、注射のための妥当な体積の要件(<1.5mL)を満たすために、高濃度のポリペプチド(例えば、抗体)(>100mg mL-1)を必要とし得る。しかしながら、本開示の文脈では、高濃度のポリペプチドを有する従来の製剤は、高粘度として現れ得るか、ならびに/または免疫原性および生物学的利用率の問題を提示し得る、溶液中でポリペプチドの自己会合およびクラスター形成をもたらしがちであることが理解された。高濃度のポリペプチド溶液はまた、ポリペプチドの活性、薬物動態および安全性に影響を及ぼし得るポリペプチドの凝集に起因して、加速された分解の影響を受けやすくあり得る。投与(例えば、皮下注射)のための望ましい特性の組合せについて好適な製剤(例えば、ポリペプチドを含む)の開発が、より高い患者コンプライアンスおよびより侵襲性が低い投与の選択肢を含む、より高い患者の利便性に向けた意義深い目標である。
組成物の特性を操作する(例えば、粘度を低減する)ある特定の既存のアプローチとしては、緩衝液条件を変更すること、希釈された賦形剤を添加すること、またはポリペプチドそれ自身にマイナーな改変を行うことが挙げられる。しかしながら、これらのアプローチは、異なるポリペプチドについて繰り返されることが必要であり得る困難な最適化を必要とし得る。固体状のポリペプチドの使用は、ある特定の流動特性、より高い溶解度、増強された安定性、および調節可能な放出特性を有する製剤を与え得る。ポリペプチド(例えば、タンパク質)の結晶性形態などの固体状の形態は、精製および構造的な特徴付けのために伝統的に使用されるが、小分子で使用されるアプローチと類似して、抗体などのポリペプチドの高濃度製剤を安定化するためにも利用され得る。しかしながら、ポリペプチドの送達への固体状の形態のアプローチは、相および条件にわたるポリペプチドの機能的および構造的安定性の保持に関連する潜在的な課題に起因して、複雑である。さらに、ポリペプチド結晶の一部の懸濁液は、同等の濃度の水性ポリペプチド溶液と比較した場合に、異なる粘度を呈する。ポリペプチド結晶製剤を開発する(例えば、安全で、好適な結晶化および安定化条件を見出す;結晶化バッチサイズのスケールアップ)難しさに起因して、結晶性インスリンを除いて、商業的成功は限定的であった。
本開示の発明者らは、満足な特性(例えば、ローディング、流動特性、安定性、安全性)を有する固体状のポリペプチドを含む組成物を提供することが可能であり得ることを実現した。本明細書で実現される一アプローチは、固体状のポリペプチド(例えば、抗体)を会合させ(例えば、封入し)、一部の例では、有利な流動特性および/または安定特性を提供するための担体材料(例えば、固体担体)の使用である。例えば、ヒドロゲル材料が、一部の場合では、相対的に高いローディング、相対的に低い粘度、および良好な安定性(例えば、予防的または治療的適用のため)の能力がある組成物をもたらす、固体状のポリペプチドのために好適な担体であり得ることが理解された。
一態様では、ポリペプチドを含む組成物が記載される。組成物は、例えば、下記により詳細に記載されるように、結晶の形態(例えば、結晶性ポリペプチド)または無定形固体の形態の固体状のポリペプチドを含み得る。本明細書に記載される組成物は、一部の例では、患者(例えば、ヒトなどの哺乳動物)への投与のために好適であり得る。
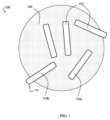
必ずしもすべての実施形態ではないが一部では、組成物は、固体状のポリペプチド(例えば、結晶性または無定形ポリペプチド)と会合する(例えば、少なくとも部分的に封入する)担体を含む。図1は、ある特定の実施形態による、担体105および固体状のポリペプチド(例えば、抗体)をそれぞれ含む結晶110を含む組成物100の概略図を示す。一部の実施形態では、固体状のポリペプチドを含む結晶は、サイズ排除クロマトグラフィー-高速液体クロマトグラフィー(SEC-HPLC)によって決定して、10wt%未満またはそれに等しい(例えば、5wt%未満もしくはそれに等しい、2wt%未満もしくはそれに等しい、1wt%未満もしくはそれに等しい、またはなし)結晶が凝集するように、1種または複数の担体(例えば、ヒドロゲル)と会合する。例えば、組成物は、組成物の形成後、5℃で、1時間よりも長いもしくはそれに等しい、1日よりも長いもしくはそれに等しい、1週間よりも長いもしくはそれに等しい、1か月よりも長いもしくはそれに等しい、2か月よりも長いもしくはそれに等しい、3か月よりも長いもしくはそれに等しい、および/または最大で6か月、最大で12か月、最大で24か月、もしくはそれよりも長い期間後に、10wt%未満またはそれに等しい(例えば、5wt%未満もしくはそれに等しい、2wt%未満もしくはそれに等しい、1wt%未満もしくはそれに等しい、またはなし)結晶が凝集するように、1種または複数のヒドロゲルと会合した固体状のポリペプチドを含み得る。
固体状のポリペプチド(例えば、結晶性ポリペプチド)および担体の間の会合は、特異的または非特異的な相互作用の形態、例えば、物理的相互作用(例えば、機械的な閉じ込め、物理吸着など)または化学的相互作用(例えば、静電相互作用、ファンデルワールス相互作用、疎水性相互作用など)であり得る。
会合の1つの種類は、封入である。図1では、結晶110は、担体105によって少なくとも部分的に封入されている。分子または粒子の少なくとも一部分が担体内(例えば、担体の細孔内)に閉じ込められる場合、分子または粒子は、担体(例えば、下記に記載されるヒドロゲル)によって少なくとも部分的に封入されている。結晶などの分子または粒子が占める体積の一部分(例えば、最大で10体積パーセント(vol%)、最大で25vol%、最大で50vol%、最大で75vol%、または最大で90vol%)が、担体(例えば、ヒドロゲル)によって占められる体積からはみ出していてもよく、依然として、担体によって少なくとも部分的に封入されていてもよいことが理解されるべきである。例えば、図1に戻って参照すると、結晶110aは、担体105内に完全に閉じ込められており、結晶110bは、担体105からはみ出している部分111を含み、結晶110aおよび結晶110bは両方とも、担体105によって少なくとも部分的に封入されていると考えられる。一部の実施形態では、結晶が担体によって少なくとも部分的に(例えば、全体的に)封入されている場合、結晶の体積の少なくとも10%、少なくとも25%、少なくとも50%、少なくとも75%、少なくとも90%、少なくとも95%、少なくとも99%、またはすべてが、担体内に閉じ込められている。算出の実例として、組成物が、0.1cm3の固体状のポリペプチドを含む結晶の総体積を有し、その結晶の体積の合算で0.025cm3が担体内に閉じ込められている場合(例えば、好適なイメージング技法によって決定される通り)、0.025cm3/0.01cm3×100%=25%なので、結晶の体積の少なくとも25%が、担体内に閉じ込められている。一部の実施形態では、結晶の重量の少なくとも10%、少なくとも25%、少なくとも50%、少なくとも75%、少なくとも90%、少なくとも95%、少なくとも99%、またはすべてが、担体内に閉じ込められている。算出の実例として、組成物が、10mgの固体状のポリペプチドを含む結晶の総重量を有し、その結晶の重量の合算で2.5mgが担体内に閉じ込められている場合(例えば、担体内に閉じ込められていない結晶の溶解および定量化によって決定される通り)、2.5mg/10mg×100%=25%なので、結晶の重量の少なくとも25%が、担体内に閉じ込められている。
固体状のポリペプチド(例えば、抗体)の封入は、一部の例では、各種の利益のいずれかを提供し得る。例えば、担体は、固体状のポリペプチドのそうでなければ不十分な流動特性(例えば、高粘度)をマスキングする、ポリペプチドを安定化する、および/またはポリペプチドの放出をモジュレートする(例えば、投与後に)ために有用であり得る。
多くのある特定の種類の担体のいずれかは、本開示に記載される組成物において用いられ得る。担体は、一般に、別の物質を支えるか、または運ぶ物質を指す。好適な担体を、運搬される/会合される/封入される分子/粒子のサイズ、運搬される/会合される/封入される分子/粒子の溶解度(例えば、送達媒体への)、所望の放出速度、所望の安定性、所望の生体適合性、所望の薬理学的特性、所望の流動学的特性、および所望のローディング/密度を含むいくつかの基準のいずれかに基づいて、本開示の利点を伴って、選択することができる。担体は、担体と会合する(例えば、担体によって少なくとも部分的に封入される)分子/粒子のものと別個の化学組成を有していてもよい。一部の実施形態では、担体は、固体材料を含む。固体材料は、固体状のポリペプチドが存在し得るマトリックスを提供し得る。マトリックスは、下記にさらに詳細に記載される、ヒドロゲルなどのポリマー鎖のネットワークを含んでいてもよい。担体は、液体中に懸濁されて、懸濁溶液を形成することができる組成物であり得る。一部の実施形態では、担体は、粒子または小胞組成物である。担体は、例えば、コロイド性担体であり得、これは、一般に、マイクロ粒子またはナノ粒子シェル内に分子または粒子を封入することができる幅広いクラスの物質を指す。担体の例としては、限定されるものではないが、ミセル、リポソーム、ポリマー粒子、ヒドロゲル(下記でより詳細に記載する)、無機粒子(例えば、多孔質粒子)、デンドリマー、ミクロスフェア、ナノスフェア、量子ドット、およびそれらの組合せが挙げられる。一部の実施形態では、ポリペプチドを少なくとも部分的に封入する担体を含む組成物は、液体構成要素をさらに含む。例えば、水性緩衝液などの液体溶媒が、組成物内に存在していてもよい。
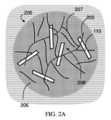
上記で言及されたように、一部の実施形態では、担体組成物は、ヒドロゲルを含む。ヒドロゲルは、上記に記載される組成物の担体であり得る。図2Aは、そのような一実施形態の概略図であり、固体状のポリペプチドを含む結晶110を少なくとも部分的に封入するヒドロゲルを含む組成物200を示す。ヒドロゲルは、一般に、水の吸収力が非常に高い、架橋されたポリマー鎖の三次元ネットワークを指す。一部の実施形態では、ヒドロゲルは、少なくとも50重量パーセント(wt%)、少なくとも60wt%、少なくとも75wt%、少なくとも90wt%、またはそれよりも多くの量の水を含むことができる。再び図2Aを参照すると、組成物200は、架橋207を有するポリマー鎖205および水性溶媒206のネットワークを含むヒドロゲルを含む。結晶110は、例えば、組成物200のヒドロゲルの細孔208中に存在していてもよい。
本開示の文脈では、各種の種類のヒドロゲルが、提供されるポリペプチドに関する組成物および方法に好適であり得ることが発見された。例えば、ある特定のヒドロゲル製剤は、相対的に高い濃度のポリペプチド(例えば、抗体)の投与のための望ましい流動特徴(例えば、ある特定の範囲のずり流動化、チキソ性、粘度などの流動学的特性)または構造特徴(例えば、細孔サイズ)を有し得る。ヒドロゲルは、一般に、ヒドロゲルのポリマー鎖のベースポリマーの性質によって、または架橋の性質によって特徴付けられ得る。
一部の実施形態では、ヒドロゲルは、共有結合により架橋されたポリマー鎖を含む。そのような実施形態では、共有化学結合が、異なるポリマー鎖を接続する。共有結合は、各種の化学的性質を介して形成され得る。例えば、光開始化学反応は、共有結合架橋を引き起こし得る。そのような一例は、ラジカル重合であり、ここで、反応混合物は、架橋反応を開始する(例えば、光開始剤を介して)電磁放射線(例えば、紫外線)が照射される。一部のラジカル重合は、アクリレートまたはメタクリレート基などのラジカルカップリング化学反応に適したある特定の官能基を含む前駆体ポリマー鎖を伴う。光開始剤の例としては、限定されるものではないが、アルキルフェノン、アセトフェノン、ベンゾインエーテル、アシルホスフィンオキシド、およびベンゾフェノンが挙げられる。好適な共有結合架橋化学の別の例は、チオール-エン反応化学であり、ここで、例えば、チオール官能基を含むポリマー鎖は、ビニルスルホン官能基を含むポリマー鎖と共有結合して、チオエーテル共有結合架橋を形成する。図13A~13Dは、チオール-エン化学反応を介したヒドロゲル形成の一例を示す例示的な概略を示す。チオール-エン架橋は、触媒を使用して加速されてもよい。好適な触媒の一例は、アミン(例えば、トリエチルアミン)などの塩基である。好適な共有結合架橋化学の別の例は、マイケル付加化学(例えば、ビニルスルホンまたはマレイミド官能基などを伴う)である。
一部の実施形態では、ヒドロゲルは、イオンにより架橋されたポリマー鎖を含む。そのような実施形態では、静電相互作用(例えば、イオン結合を介した)が、異なるポリマー鎖を接続する。イオンにより架橋されたポリマー鎖は、金属イオン(例えば、異なるポリマー鎖を非共有結合により引き付ける多価金属)を介して架橋されてもよい。好適なイオンの例としては、限定されるものではないが、カルシウムイオン(Ca2+)、マグネシウムイオン(Mg2+)などが挙げられる。しかしながら、一部の実施形態では、ヒドロゲルの異なるポリマー鎖は、金属イオンなどの種の非存在下でさえ、静電気的に引き付けられる場合がある。例えば、ヒドロゲルは、正に帯電した部分(例えば、アンモニウム基)を持つ第1の種類のポリマー鎖、および負に帯電した部分(例えば、カルボキシレート基)を持つ第2の種類のポリマー鎖を含んでいてもよく、逆に帯電した部分が、イオン架橋のためであってもよい。
一部の実施形態では、ヒドロゲルは、熱により架橋されたポリマー鎖を含む。そのような実施形態では、架橋は、温度変化(例えば、冷却または加熱)を介して誘導され得る。熱架橋を受け得る(例えば、温度法を介して)ヒドロゲルの例としては、限定されるものではないが、ゼラチンおよびアガロースなどの熱感受性ポリマーを含むものが挙げられる。
ポリマー鎖のベースポリマーは、各種の好適な構造のいずれかを有し得る。一部の実施形態では、ヒドロゲルのポリマー鎖は、架橋されたポリアルキレンオキシドを含む。ポリアルキレンオキシドの繰り返し単位は、2~18などの各種の炭素数のいずれかを有し得る。一部の実施形態では、ポリアルキレンオキシドの繰り返し単位は、2~10などの各種の炭素数のいずれかを有する骨格を有し得る。一部の実施形態では、ヒドロゲルのポリマー鎖は、架橋されたポリエチレングリコール(PEG)を含む。本明細書に記載される化学実体(例えば、ポリエチレングリコール)が、必要に応じた置換/誘導体化を包含することが理解されるべきである。例えば、ポリアルキレンオキシドを含むポリマー鎖は、末端官能基をさらに含んでいてもよい。具体例として、末端のアクリレート末端基を含むポリマー鎖(例えば、ポリエチレングリコールジアクリレート(PEGDA))が、ポリエチレングリコールを含む架橋されたポリマー鎖を含むヒドロゲルを形成するために使用されてもよい。ポリマー鎖は、分枝状または非分枝状であってもよい。一部の実施形態では、ヒドロゲルは、架橋された多糖を含む。好適な多糖(必要に応じた置換基を含むことが理解される)の例としては、限定されるものではないが、アルギネート、アガロース、キトサン、ヒアルロン酸、およびセルロースが挙げられる。一部の実施形態では、ヒドロゲルは、ポリペプチド鎖を含む。ポリペプチド鎖は、架橋されていてもよい(例えば、共有結合により、イオンにより、熱により)。一部の実施形態では、ヒドロゲルは、ゼラチンを含む。ヒドロゲルの架橋されたポリマー鎖の部分であり得る他の潜在的に好適なポリマーとしては、限定されるものではないが、ポリラクチド、ポリ(グリコール酸)、ポリ(プロピレンフマレート)、ポリカプロラクトン、ポリヒドロキシブチレート、ポリアクリレート、ポリ(ビニルピロリドン)、ポリ(エチレンイミン)、およびポリ(ビニルアルコール)が挙げられる。一部の例示的なヒドロゲルおよびそれらの合成のための条件は、Daly, A. C., Riley, L., Segura, T., & Burdick, J. A. (2019). ”Hydrogel microparticles for biomedical applications.” Nature Reviews Materials, 5(1), 20-43に提供されており、これは、その全体が参照により本明細書に組み込まれる。
必ずしもすべての実施形態ではないが一部では、ヒドロゲルの架橋された鎖は、相対的に低い分子量を有するポリマー鎖から形成される。本開示の文脈では、相対的に低い粘度(例えば、20mPa秒未満またはそれに等しい)を有する相対的に低い分子量のポリマー鎖を使用して、ヒドロゲル粒子が形成され得ることが観察された。そのような低分子量のポリマー鎖は、相対的に低い粘度(例えば、動的粘度)を有するヒドロゲル(例えば、ヒドロゲル粒子)をもたらし得る。ヒドロゲル粒子を形成するための相対的に低い分子量および相対的に低い粘度のポリマー鎖の使用は、少なくとも、そのようなヒドロゲル粒子が、一部の例では、増強された生分解性を有し得るので、少なくとも一部の適用(例えば、針を介して組成物を投与する)において有利であり得る。一部の実施形態では、架橋されたポリマー鎖は、75kDa未満もしくはそれに等しい、50kDa未満もしくはそれに等しい、25kDa未満もしくはそれに等しい、またはそれよりも低い分子量を有するポリマー鎖から形成される。一部の例では、架橋されたポリマー鎖は、20kDa程度、10kDa程度、またはそれよりも低い分子量を有するポリマー鎖から形成される。他に明確に記載されない限り、本開示に記載されるポリマーの分子量は、重量平均分子量を指す。一部の実施形態では、架橋されたポリマー鎖は、20mPa秒未満もしくはそれに等しい、10mPa秒未満もしくはそれに等しい、および/または5mPa秒程度、もしくはそれ未満の動的粘度を有するポリマー鎖から形成される。
必ずしもすべての実施形態ではないが一部では、ヒドロゲルの架橋された鎖は、少なくとも部分的に酸化される多糖ポリマー鎖から形成される。例えば、ポリマー鎖は、部分的に酸化されていてもよい。本開示の文脈では、ポリマー鎖の少なくとも部分的な酸化が、一部の例では、生分解性を増強し得ることが観察された。一部の実施形態では、多糖ポリマー鎖は、少なくとも部分的に酸化されたアルギネートを含む。酸化された多糖は、過ヨウ素酸塩などの各種の好適な酸化剤のいずれかを使用して調製され得る。非限定的な例として、アルギネート多糖は、過ヨウ素酸ナトリウムで処理され得、ポリマー鎖のウロネート残基の少なくとも一部のシスジオール基の炭素間結合の切断を生じる(例えば、アルデヒド基を形成する)。一部の実施形態では、少なくとも部分的に酸化されたポリマー(例えば、酸化されたアルギネート)の多糖鎖の酸化の程度は、5モルパーセント(mol%)未満もしくはそれに等しい、3mol%未満もしくはそれに等しい、1.5mol%未満もしくはそれに等しい、またはそれよりも低い。一部の実施形態では、少なくとも部分的に酸化されたポリマー(例えば、酸化されたアルギネート)の多糖鎖の酸化の程度は、0.1mol%よりも高いもしくはそれに等しい、0.2mol%よりも高いもしくはそれに等しい、0.5mol%よりも高いもしくはそれに等しい、1mol%よりも高いもしくはそれに等しい、またはそれよりも高い。酸化の程度は、ポリマー鎖に曝露される酸化剤(例えば、過ヨウ素酸塩)の量を制御することによって変わり得る。
一部の実施形態では、組成物は、ポリペプチドを含む。ポリペプチドは、一般に、ペプチド(アミド)結合によって連結されたアミノ酸の1つまたは複数の鎖を有する。アミノ酸は、標準の20の天然アミノ酸を含んでいてもよく、またはそれらは、他のアミノ酸(例えば、セレノシステインおよびピロールリシンなどの非天然および/または非タンパク質原性アミノ酸)を含んでいてもよい。一部の実施形態では、ポリペプチドは、相対的に少数のアミノ酸を有する。例えば、ポリペプチドは、そのペプチド鎖中に、わずか50、わずか40、わずか30、わずか25、わずか20、わずか15、わずか10、またはわずか5のアミノ酸を有し得る。しかしながら、一部の実施形態では、ポリペプチドは、相対的に多数のアミノ酸を有する。一部の例では、ポリペプチドは、定義されたコンフォメーションを欠くが、他の例では、ポリペプチドは、安定なコンフォメーションを有する(例えば、生物学的機能のため)。一部の実施形態では、ポリペプチドは、タンパク質(例えば、フォールドされたタンパク質)であり、これは、一般に、そのペプチド鎖中に50よりも多いまたはそれに等しい(例えば、60よりも多いもしくはそれに等しい、75よりも多いもしくはそれに等しい、100よりも多いもしくはそれに等しい、またはそれよりも多い)アミノ酸を有し、分子認識/親和性に基づく結合、化学反応を触媒すること、または細胞に対する構造支持を提供することなどの1つまたは複数の生物学的機能を有する。他の実施形態では、ポリペプチドは、ペプチドホルモン(例えば、グルカゴンまたはグルカゴン様ペプチド-1)などの非タンパク質ペプチドである。一部の実施形態では、ポリペプチドは、そのペプチド鎖中に、5よりも多いもしくはそれに等しい、10よりも多いもしくはそれに等しい、20よりも多いもしくはそれに等しい、50よりも多いもしくはそれに等しい、100よりも多いもしくはそれに等しい、200よりも多いもしくはそれに等しい、500よりも多いもしくはそれに等しい、および/または最大で1,000、最大で2,000、最大で5,000、最大で10,000、最大で20,000、もしくはそれよりも多いアミノ酸を有する。ある特定の実施形態では、ポリペプチドは、複数のペプチド鎖を含む。一部の実施形態では、複数のペプチド鎖は、共有結合により連結されていない。他の実施形態では、複数のペプチド鎖は、共有結合により連結されている。
ポリペプチドがタンパク質を含む一部の実施形態では、ポリペプチドは、抗体である。抗体は、免疫グロブリン分子の可変領域に位置する少なくとも1つの抗原認識部位により抗原に特異的に結合することができる免疫グロブリン(Ig)分子である。一部の実施形態では、ポリペプチドは、モノクローナル抗体(mAb)である。モノクローナル抗体は、一般に、固有の親細胞のクローンである同一の免疫細胞によって作られる抗体を指す。モノクローナル抗体は、治療用および/または予防用であり得、一部は、がんおよび自己免疫障害の処置のためのそれらの高い特異性および多用途性について公知である。
本明細書で使用される場合、「抗体」という用語は、インタクト(すなわち、全長)のポリクローナル抗体またはモノクローナル抗体だけでなく、その抗原結合性断片(Fab、Fab’、F(ab’)2、Fvなど)、一本鎖(scFv)、その突然変異体、抗体部分を含む融合タンパク質、ヒト化抗体、キメラ抗体、ダイアボディ、線状抗体、一本鎖抗体、多重特異性抗体(例えば、二重特異性抗体)、ならびに抗体のグリコシル化バリアント、抗体のアミノ酸配列バリアントおよび共有結合により改変された抗体を含む必要な特異性の抗原認識部位を含む免疫グロブリン分子の任意の他の改変配置も包含する。抗体は、IgD、IgE、IgG、IgA、またはIgM(またはそのサブクラス/サブタイプ)などの任意のクラスの抗体を含む。抗体のその重鎖の定常ドメインのアミノ酸配列に応じて、免疫グロブリンは、異なるクラスに割り当てられ得る。抗体のクラスは、サブクラス/サブタイプ(アイソタイプ)、例えば、IgG1、IgG2、IgG3、IgG4、IgA1およびIgA2にさらに細分化される場合がある。免疫グロブリンの異なるクラスに対応する重鎖定常ドメインは、それぞれ、アルファ、デルタ、イプシロン、ガンマ、およびミューと呼ばれる。免疫グロブリンの異なるクラスのサブユニット構造および三次元配置は周知である。本明細書に記載される抗体は、マウス、ラット、ヒト、または任意の他の起源であり得る(キメラ抗体またはヒト化抗体を含む)。ポリペプチドがモノクローナル抗体である一部の実施形態では、モノクローナル抗体は、上述のクラス(例えば、IgA、IgD、IgE、IgG、IgM)のいずれかのものであり得る。例えば、一部のそのような実施形態では、モノクローナル抗体は、IgGの任意のサブタイプのものである。
一部の実施形態では、ポリペプチドは、治療用ポリペプチドとして、予防用ポリペプチドとして、または治療用ポリペプチドおよび予防用ポリペプチドの両方としての機能を果たすことができ、その詳細を下記にさらに記載する。
一部の実施形態では、ポリペプチドは、治療用ポリペプチドとしての機能を果たすことができる。すなわち、一部の例では、ポリペプチド(例えば、抗体などのタンパク質)は、ポリペプチドが医学的処置のために使用され得る(例えば、診断後)少なくとも1つの効能を有する。この文脈では、「処置する」または「処置」は、一般に、原薬を含有する組成物などの薬剤を、薬剤が治療活性を有する、1つもしくは複数の疾患症状を有するか、または疾患を有すると疑われる対象または患者に、内部にまたは外部から投与することを指す。典型的には、任意の臨床的に測定可能な度合いにより、そのような症状の退縮の誘導によるか、またはその症状の進行を阻害する、遅延させるもしくは遅らせることによるかに関わらず、薬剤は、処置される対象または集団における1つまたは複数の疾患症状を軽減するのに有効な量で投与される。任意の特定の疾患症状を軽減するのに有効である薬剤の量は、疾患状態、患者の年齢および体重、ならびに対象において所望の応答を生じさせる組成物の能力などの因子に従って変わり得る。疾患症状が軽減されたかどうかは、その症状の重症度または進行状況を評価する医師または他の熟練ヘルスケア提供者によって典型的に使用される任意の臨床測定によって評価することができる。この用語は、障害に関連する症状の発生の先送り、および/またはそのような障害の症状の重症度の低減をさらに含む。この用語は、既存の未制御のまたは望まれない症状を軽快させること、追加症状を防止すること、およびそのような症状の基礎原因を軽快させる、または防止することをさらに含む。したがって、この用語は、一般に、有利な結果を、障害、疾患もしくは症状を有する、またはそのような障害、疾患もしくは症状を発生する可能性を有する脊椎動物対象に対して付与することを表す。
一部の例では、治療用ポリペプチドを使用して、ポリペプチドを欠くまたは欠乏している(例えば、インスリン)疾患を処置することができる。一部の例では、治療用ポリペプチドを使用して、生物学的プロセスを阻害することまたは開始することによって疾患を処置することができる。例えば、治療用抗体(例えば、モノクローナル抗体)は、細胞の成長速度(例えば、腫瘍細胞)を阻害することまたは免疫応答を誘発することによって、疾患を処置してもよい。可能性のある治療用ポリペプチドの例としては、限定されるものではないが、公知の結晶化状態を有する任意の治療用ポリペプチドが挙げられる。治療用ポリペプチドの例示的なクラスとしては、抗体(モノクローナル抗体)、融合タンパク質、抗凝固薬、血液因子、骨形成タンパク質、操作されたタンパク質スキャフォールド、酵素、増殖因子、ホルモン、インターフェロン、インターロイキン、および血栓溶解薬が挙げられる。治療用ポリペプチド(例えば、タンパク質)のさらなる例は、Dimitrov, D. (2012). ”Therapeutic Proteins”; Voynov, V., Caravella, JA, Eds. Methods in Molecular Biology, Humana Press, 1-26に見ることができ、これは、その全体が参照により本明細書に組み込まれる。
上記で言及されたように、一部の実施形態では、ポリペプチドは、治療用抗体である。一部の実施形態では、ポリペプチドは、治療用抗体の断片(例えば、治療用抗体の抗原結合性断片)である。一部の実施形態では、ポリペプチドは、治療用モノクローナル抗体またはその抗原結合性断片である。一部の実施形態では、ポリペプチドは、治療用モノクローナル抗体であってもよい。一部の実施形態では、治療用モノクローナル抗体は、抗PD-1モノクローナル抗体である。一部の実施形態では、ポリペプチドは、抗PD-1モノクローナル抗体の抗原結合性断片である。好適な抗PD-1モノクローナル抗体の例としては、限定されるものではないが、ニボルマブ、セミプリマブ、ピディリズマブ(その全体が参照により本明細書に組み込まれる米国特許第7,332,582号に記載される通り)、AMP-514(MedImmune LLC、Gaithersburg、MD)、PDR001(その全体が参照により本明細書に組み込まれる米国特許第9,683,048号に記載される通り)、BGB-A317(その全体が参照により本明細書に組み込まれる米国特許第8,735,553号に記載される通り)、MGA012(MacroGenics、Rockville、MD)、シンチリマブ(Innovent Biologics Co.、San Mateo、CA)、チスレリズマブ(Beigene、Beijing、China)、カムレリズマブ(Jangsu Hengrui Medicine、Lianyungan、Jiangsui、China)、トリパリマブ(Junshi Biosciences、Shanghai、China)、およびプロルゴリマブ(Biocad、St.Petersburg、Russian Federation)が挙げられる。抗PD-1モノクローナル抗体の別の例は、ペムブロリズマブである。一部の実施形態では、治療用モノクローナル抗体は、抗PD-L1抗体である。一部の実施形態では、ポリペプチドは、抗PD-L1モノクローナル抗体の抗原結合性断片である。好適な抗PD-L1モノクローナル抗体の例としては、限定されるものではないが、アテゾリズマブ(tatezolizumab)、デュルバルマブ、アベルマブ、BMS-936559、ならびにその全体が参照により本明細書に組み込まれる国際特許公開第WO2013/019906号のそれぞれ配列番号20および配列番号21の重鎖および軽鎖可変領域を含む抗体が挙げられる。
一部の実施形態では、抗PD-1抗体は、ペムブロリズマブである。代替的に本明細書で「pembro」または「mAb2」と称されるペムブロリズマブ(以前は、MK-3475、SCH 900475およびランブロリズマブとして公知)は、WHO Drug Information, Vol. 27, No. 2, pages 161-162 (2013)に記載される構造を有するヒト化IgG4 mAbであり、下記の表3に記載される重鎖および軽鎖アミノ酸配列ならびにCDRを含む。ペムブロリズマブは、KEYTRUDA(商標)についての添付文書(Merck & Co.,Inc.、Whitehouse Station、NJ USA;2014年に最初に米国で承認され、2021年7月に更新)に記載されるように、米国FDAによって承認されている。
一部の実施形態では、抗PD-1抗体は、ペムブロリズマブバリアントである。本明細書で使用される場合、ペムブロリズマブバリアントは、軽鎖CDR外に位置する位置に3、2または1つの保存的アミノ酸置換、重鎖CDR外に位置する6、5、4、3、2または1つの保存的アミノ酸置換を有する以外は、ペムブロリズマブのものと同一の重鎖および軽鎖配列を含むモノクローナル抗体を意味し、例えば、バリアント位置は、FR領域または定常領域に位置し、必要に応じて、重鎖のC末端リシン残基の欠失を有する。言い換えれば、ペムブロリズマブおよびペムブロリズマブバリアントは、同一のCDR配列を含むが、それぞれ、それらの全長軽鎖および重鎖配列における3つまたは6つ以下の他の位置に保存的アミノ酸置換を有することに起因して、互いと異なる。ペムブロリズマブバリアントは、以下の特性に関してペムブロリズマブと実質的に同じである:PD-1に対する結合親和性、ならびにPD-L1およびPD-L2のそれぞれのPD-1への結合を遮断する能力。
一部の実施形態では、抗PD-1抗体またはその抗原結合性断片は、それぞれ、配列番号1、2および3に記載されるアミノ酸の配列を含む軽鎖CDRのLC-CDR1、LC-CDR2およびLC-CDR3、ならびにそれぞれ、配列番号6、7および8に記載されるアミノ酸の配列を含む重鎖CDRのHC-CDR1、HC-CDR2およびHC-CDR3を含む。一部の実施形態では、抗PD-1抗体またはその抗原結合性断片は、ヒト抗体である。他の実施形態では、抗PD-1抗体またはその抗原結合性断片は、ヒト化抗体である。他の実施形態では、抗PD-1抗体またはその抗原結合性断片は、キメラ抗体である。具体的な実施形態では、抗PD-1抗体またはその抗原結合性断片は、モノクローナル抗体である。
一部の実施形態では、PD-1抗体またはその抗原結合性断片は、ヒトPD-1に特異的に結合し、(a)配列番号9に記載されるアミノ酸配列またはそのバリアントを含む重鎖可変領域、および(b)配列番号4からなる群から選択されるアミノ酸配列またはそのバリアントを含む軽鎖可変領域を含む。
重鎖可変領域配列または全長重鎖配列のバリアントは、フレームワーク領域に(すなわち、CDR外に)最大で17の保存的アミノ酸置換を有することを除いて、参照配列と同一であり、好ましくは、フレームワーク領域に、10、9、8、7、6または5未満の保存的アミノ酸置換を有する。軽鎖可変領域配列または全長軽鎖配列のバリアントは、フレームワーク領域に(すなわち、CDR外に)最大で5の保存的アミノ酸置換を有することを除いて、参照配列と同一であり、好ましくは、フレームワーク領域に、4、3または2未満の保存的アミノ酸置換を有する。
本開示の処置方法、組成物、キットおよび使用の一部の実施形態では、PD-1抗体またはその抗原結合性断片は、ヒトPD-1に特異的に結合し、(a)配列番号10に記載されるアミノ酸の配列もしくはそのバリアントを含むか、またはそれからなる重鎖、および(b)配列番号5に記載されるアミノ酸の配列もしくはそのバリアントを含むか、またはそれからなる軽鎖を含むモノクローナル抗体である。
本開示の処置方法、組成物および使用の一部の実施形態では、PD-1抗体またはその抗原結合性断片は、ヒトPD-1に特異的に結合し、(a)配列番号10に記載されるアミノ酸の配列を含むか、またはそれからなる重鎖、および(b)配列番号5に記載されるアミノ酸の配列を含むか、またはそれからなる軽鎖を含むモノクローナル抗体である。
一部の実施形態では、ポリペプチドは、予防用ポリペプチドである。すなわち、一部の例では、ポリペプチド(例えば、抗体などのタンパク質)は、ポリペプチドが、ポリペプチドの投与から少なくとも1時間、少なくとも1日、少なくとも1週間、少なくとも1か月、少なくとも1年、および/または最大で2年、最大で5年、もしくはそれよりも長い期間内に、疾患が起こるのを予防するためまたは疾患が起こる可能性を低減する(例えば、少なくとも25%、少なくとも50%、少なくとも75%、少なくとも90%、少なくとも95%、少なくとも99%)ために使用され得る少なくとも1つの効能を有する。例えば、抗体は、疾患(例えば、インフルエンザなどのウイルス疾患)に対する受動免疫として患者に投与されてもよい。可能性のある予防用ポリペプチドの例としては、限定されるものではないが、公知の結晶化状態を有する任意の予防用ポリペプチドが挙げられる。予防用ポリペプチドの例示的なクラスとしては、抗体(モノクローナル抗体)、融合タンパク質、抗凝固薬、血液因子、骨形成タンパク質、操作されたタンパク質スキャフォールド、酵素、増殖因子、ホルモン、インターフェロン、インターロイキン、および血栓溶解薬が挙げられる。一部の実施形態では、ポリペプチドは、予防用抗体(例えば、予防用モノクローナル抗体)またはその断片(例えば、その抗原結合性断片)である。
驚くべきことに、封入に関与する広範囲の処理にもかかわらず、本開示に記載される組成物中のポリペプチドは、安定性(例えば、生物活性安定性、化学的安定性、構造的安定性、および/または物理的安定性)を維持することができることが観察された。安定性は、この文脈では、一般に、保管の際のその生物活性、化学的安定性、構造的安定性、および/または物理的安定性を本質的に保持するポリペプチドを指す。安定性を測定するためのさまざまな分析技法が、当技術分野において利用可能であり、例えば、Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991)およびJones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993)に概説されている。安定性は、選択された温度で選択された期間、測定することができる。一部の実施形態では、ポリペプチドは、室温(25℃)もしくは30℃もしくは40℃で少なくとも1か月安定であり、および/または約2~8℃(例えば、5℃)で少なくとも1年、少なくとも2年、またはそれよりも長く(例えば、最大で3年、最大で4年、またはそれよりも長く)安定である。一部の実施形態では、ポリペプチドは、組成物の凍結(例えば、-70℃に)および組成物の解凍(「凍結/解凍サイクル」)後に安定である。
一部の実施形態では、本開示に記載される組成物中のポリペプチドは、生物活性の観点で安定性を維持することができる。そのような活性は、担体(例えば、ヒドロゲル)による封入の際でさえ維持され得る。ポリペプチドの活性は、ポリペプチドの特異的機能を行うことができるレベルに基づいて評価することができる(例えば、治療的または予防的適用などの意図される目的のために)。例えば、ポリペプチドが酵素である場合、反応を触媒するための酵素の活性は、当技術分野における酵素についての任意の公知の活性アッセイを使用して定量的に評価することができる。別の例として、ポリペプチドが抗体である場合、抗体の抗原への親和性は、定量的に評価することができる。そのようなアッセイは、例えば、基質代謝回転が測定される(例えば、着色標識または蛍光標識などの検出可能な標識の生成または消費を介して)酵素結合免疫吸着検定法(ELISA)などの酵素活性アッセイを使用して行うことができる。基質代謝回転は、ポリペプチドが酵素である例では直接的に、または例えばポリペプチドが抗体である場合に酵素への結合を介して間接的に、測定することができる。一部の実施形態では、組成物のポリペプチドは、酵素結合免疫吸着活性アッセイによって測定して、組成物の形成後、5℃で、1か月よりも長いもしくはそれに等しい、2か月よりも長いもしくはそれに等しい、3か月よりも長いもしくはそれに等しい、6か月よりも長いもしくはそれに等しい、12か月よりも長いもしくはそれに等しい、24か月よりも長いもしくはそれに等しい、またはそれよりも長い期間、活性である。アッセイは、その他の点では本質的に同一の条件下(例えば、温度、緩衝液、撹拌などの外部かき混ぜなど)で、組成物の形成前のポリペプチドの活性と比較されるであろう。組成物形成後のポリペプチドの活性は、上記に記載される時点で、組成物の形成前(または形成の時)のポリペプチドの活性の30%以内、20%以内、10%以内、5%以内、2%以内、1%以内、またはそれに等しくあり得る。
一部の実施形態では、本開示に記載される組成物中のポリペプチドは、化学的安定性の観点で安定性を維持することができる。所与の時間での化学的安定性が、抗体が上記に記載されるその生物活性を依然として保持すると考えられるようなものである場合、ポリペプチドは、一般に、組成物中でその化学的安定性を維持する。化学的安定性は、ポリペプチドの化学的に変化した形態を検出することおよび定量化することによって評価することができる。化学的変化は、サイズ改変(例えば、クリッピング)を伴い得、これは、例えば、サイズ排除クロマトグラフィー、SDS-PAGE、および/またはマトリックス支援レーザー脱離イオン化/飛行時間型質量分析(MALDI/TOF MS)を使用して評定することができる。他の種類の化学的変化としては、電荷変化(例えば、脱アミド化の結果として起こる)が挙げられ、これは、例えば、イオン交換クロマトグラフィーによって評定することができる。一部の実施形態では、ポリペプチド(例えば、抗体などのタンパク質)の10%以下、5%以下、2%以下、1%以下、または0.1%以下が、サイズ排除クロマトグラフィー-高速液体クロマトグラフィー(SEC-HPLC)によって測定して、組成物の形成後、5℃で、1か月よりも長いもしくはそれに等しい、2か月よりも長いもしくはそれに等しい、3か月よりも長いもしくはそれに等しい、6か月よりも長いもしくはそれに等しい、12か月よりも長いもしくはそれに等しい、24か月よりも長いもしくはそれに等しい、またはそれよりも長い期間後、分解される。一部の実施形態では、ポリペプチド(例えば、抗体などのタンパク質)の10%以下、5%以下、2%以下、1%以下、または0.1%以下が、SEC-HPLCを使用して低分子量種のパーセンテージによって測定して、組成物の形成後、5℃で、1か月よりも長いもしくはそれに等しい、2か月よりも長いもしくはそれに等しい、3か月よりも長いもしくはそれに等しい、6か月よりも長いもしくはそれに等しい、12か月よりも長いもしくはそれに等しい、24か月よりも長いもしくはそれに等しい、またはそれよりも長い期間後、クリップされる。
一部の実施形態では、本開示に記載される組成物中のポリペプチドは、物理的安定性の観点で安定性を維持することができる。ポリペプチドが、色および/もしくは透明性の外観検査において、またはUV光散乱もしくはサイズ排除クロマトグラフィーによって測定して、凝集、沈殿および/または変性の実質的な兆候を示さない場合、ポリペプチドは、一般に、組成物中でその物理的安定性を維持する。物理的安定性は、ポリペプチド凝集の程度の観点で測定されてもよい。一部の実施形態では、ポリペプチド(例えば、抗体などのタンパク質)の10%以下、5%以下、2%以下、1%以下、または0.1%以下が、SEC-HPLCを使用して高分子量種のパーセンテージによって測定して、組成物の形成後、5℃で、1か月よりも長いもしくはそれに等しい、2か月よりも長いもしくはそれに等しい、3か月よりも長いもしくはそれに等しい、6か月よりも長いもしくはそれに等しい、12か月よりも長いもしくはそれに等しい、24か月よりも長いもしくはそれに等しい、またはそれよりも長い期間後、凝集する。
一部の実施形態では、本開示に記載される組成物中の規定のネイティブ三次元構造を有するポリペプチド(例えば、タンパク質)は、構造的安定性の観点で安定性を維持することができる。in vitro条件でのタンパク質フォールディングの観点で構造的安定性を測定するためのさまざまな分析技法が、当技術分野において公知であり、X線結晶構造解析、蛍光分光法、円偏光二色性、およびタンパク質核磁気共鳴分光法(NMR)を含む。一部の実施形態では、ポリペプチド(例えば、抗体などのタンパク質)の少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、少なくとも99.9%、または100%が、組成物の形成後、5℃で、1か月よりも長いもしくはそれに等しい、2か月よりも長いもしくはそれに等しい、3か月よりも長いもしくはそれに等しい、6か月よりも長いもしくはそれに等しい、12か月よりも長いもしくはそれに等しい、24か月よりも長いもしくはそれに等しい、またはそれよりも長い期間後、それらのネイティブ構造にフォールドされている。
一部の実施形態では、ポリペプチドは、固体状で、組成物中に存在する(例えば、ヒドロゲルによって少なくとも部分的に封入されている)。本開示の文脈では、溶解したポリペプチド(例えば、水性緩衝液中)などの非固体状とは対照的に、固体状のポリペプチドの包含は、一部の例では、組成物中で相対的に高い濃度のポリペプチドを可能にし得ることが理解された。そのような高い濃度は、一部の適用では、望ましくあり得る。ヒドロゲルなどの担体への固体状のポリペプチドの封入は、次いで、濃度(例えば、溶解されるポリペプチドに対して)および流動特性(例えば、流動学的特性)(例えば、遊離固体ポリペプチドに対して)の両方において潜在的な利益を提供することができる。ポリペプチドの固体状の例としては、結晶性形態および無定形形態が挙げられる。
一部の実施形態では、固体状のポリペプチドは、結晶である。例えば、組成物は、固体状のポリペプチドを含む結晶を少なくとも部分的に封入しているヒドロゲルを含んでいてもよい。ポリペプチド結晶は、ポリペプチドの相対的に安定な濃縮形態を提供し得、これは、投与を相対的に容易にしながら、相対的に長い有効期間を可能にし得る。図1および2Aに戻って参照すると、ポリペプチドは、ある特定の実施形態によれば、結晶110(図1または図2Aを参照されたい)の部分として、固体として組成物100(図1)または200(図2)中に存在し得る。固体状のポリペプチドを含む結晶は、一般に、個々のポリペプチド分子を含む規則的な繰り返し単位を有する格子を含む固体を指す。一部の実施形態では、固体状のポリペプチドを含む結晶は、粒界なしで結晶の端まで連続して伸びている結晶格子を有する単結晶である。しかしながら、一部の実施形態では、結晶は、粒界によって分離された複数のサブドメインを含有する多結晶である。結晶を含む組成物は、例えば、結晶のサイズ、組成物またはその中のヒドロゲルの体積、または所望のローディングに応じて、固体状の固体ポリペプチドを含む、少なくとも1、少なくとも2、少なくとも3、少なくとも5、少なくとも10、少なくとも50、および/または最大で100、最大で1,000、もしくはそれよりも多くの結晶を有していてもよい。ポリペプチドは、相対的に高い量(例えば、溶媒を除いて、50wt%よりも高いもしくはそれに等しい、75wt%よりも高いもしくはそれに等しい、90wt%よりも高いもしくはそれに等しい、99wt%よりも高いもしくはそれに等しい、または100wt%)で結晶中に存在し得る。ポリペプチド(例えば、タンパク質)を含むほとんどの結晶は、キラルであり、対称面を欠く。そのため、結晶の形態の組成物中のポリペプチドの存在は、キラル結晶の二次非線形イメージング(SONICC(登録商標))技法を含む各種の好適な技法のいずれかを使用して評価され得る。キラル結晶の二次非線形イメージングは、当技術分野において公知であり、例えば、Kissick, D. J., Wanapun, D., & Simpson, G. J. (2011). ”Second-order nonlinear optical imaging of chiral crystals.” Annual Review of Analytical Chemistry, 4, 419-437に記載されている。
一部の実施形態では、固体状のポリペプチドは、結晶性ペムブロリズマブまたは結晶性ペムブロリズマブバリアントである。結晶性ペムブロリズマブの非限定的な例は、それを作製する方法を含んで、Merck Sharp & Dohme Corpに代わり2020年5月7日に公開されたWO2020/092233号、およびMerck Sharp & Dohme Corpに代わり2016年9月1日に公開されたWO2016/137850号に記載されており、このそれぞれは、その全体が参照により本明細書に組み込まれる。一部の実施形態では、固体状のポリペプチドは、カフェインと複合体化したペムブロリズマブを含む結晶性ペムブロリズマブである。一部の実施形態では、組成物は、固体状のペムブロリズマブを含む結晶を少なくとも部分的に封入するヒドロゲルを含む。一部の実施形態では、組成物は、カフェインと複合体化した固体状のペムブロリズマブを含む結晶を少なくとも部分的に封入しているヒドロゲルを含む。
カフェインと複合体化した結晶性ペムブロリズマブ(カフェインと複合体化した固体状のペムブロリズマブの例)は、本明細書の実施例に記載されるようにして、またはWO2020/092233号に記載されるようにして、調製され得る。結晶性ペムブロリズマブ(固体状のペムブロリズマブの例)はまた、WO2016/137850号に記載されるようにして、調製され得る。一部の実施形態では、組成物は、本明細書の実施例またはWO2020/092233号もしくはWO2016/137850号に記載されるプロセスによって作製される固体状のペムブロリズマブを含む結晶を少なくとも部分的に封入するヒドロゲルを含む。
一部の実施形態では、結晶は、WO2016/137850号に記載されるように、a=63.5~78.9Å、b=110.2~112.2Å、c=262.5~306Å、α=90、β=90、γ=90°の単位格子寸法、およびP212121の空間群によって特徴付けられるペムブロリズマブの結晶である。さらなる実施形態では、結晶は、2.3Å~3.5Å、2.3Å~3.0Å、2.3Å~2.75Å、2.3Å~2.5Åおよび2.3Åからなる群から選択される分解能にX線を回折することができる。一部の実施形態では、ペムブロリズマブまたはペムブロリズマブバリアントの結晶は、結晶形成に十分な時間、少なくとも25℃であり、かつ50℃以下である温度で、ペムブロリズマブまたはペムブロリズマブバリアントを含む溶液を沈殿溶液に曝露することを含む方法によって生成され、ここで、沈殿溶液は、4.0~5.0のpHを有し、1.0M~2.5Mのリン酸二水素アンモニウムを含む。さらなる実施形態では、沈殿溶液は、(a)1.5M~2.0Mのリン酸二水素アンモニウムおよび100~120mMのトリスHCl、または(b)1.9Mのリン酸二水素アンモニウムおよび0.09Mのリン酸水素アンモニウムを含む。
一部の実施形態では、結晶は、カフェインと複合体化したペムブロリズマブを含む。一部の実施形態では、結晶は、カフェインと複合体化したペムブロリズマブを含み、結晶は、空間群P2221、a=43.8Å、b=113.9Å、c=175.0Å、α=β=γ=90°によって特徴付けられる。一部の実施形態では、結晶は、約182.16、181.54、179.99、109.36、108.23、103.58、76.88および76.04ppmにピークを呈する固体状態NMR13Cスペクトルによって特徴付けられるカフェインと複合体化したペムブロリズマブを含む。さらなる実施形態では、結晶性ペムブロリズマブは、約183.07、180.55、110.70、110.15、101.49、99.75、98.56、74.97、74.41、73.52、72.69、13.85、13.27、12.26および11.13ppmにピークをさらに呈する。一部の実施形態では、カフェインと複合体化したペムブロリズマブまたはペムブロリズマブバリアントの結晶は、(a)(i)ペムブロリズマブまたはペムブロリズマブバリアントの水性緩衝溶液、(ii)ポリエチレングリコール(PEG)、ならびに(iii)カフェイン、テオフィリン、2’デオキシグアノシン-5’-一リン酸、生理活性ジベレリン、および前記生理活性ジベレリンの薬学的に許容される塩からなる群から選択される添加物を混合して、結晶化溶液を形成すること、(b)結晶形成のために十分な期間、結晶化溶液をインキュベートすること、ならびに(c)溶液から結晶性ペムブロリズマブまたはペムブロリズマブバリアントを回収することを含む方法によって生成される。さらなる実施形態では、添加物は、カフェインである。
驚くべきことに、本開示の文脈で、ポリペプチドの結晶が、物理的安定性および/または化学的安定性および/または生物学的安定性の観点で、本明細書に記載される組成物中で相対的に安定であり得ることが観察された。一部の実施形態では、ポリペプチド(例えば、モノクローナル抗体)を含む結晶は、キラル結晶の二次非線形イメージング技法によって測定して、組成物の形成後、5℃で、1か月よりも長いもしくはそれに等しい、2か月よりも長いもしくはそれに等しい、3か月よりも長いもしくはそれに等しい、4か月よりも長いもしくはそれに等しい、6か月よりも長いもしくはそれに等しい、12か月よりも長いもしくはそれに等しい、または24か月よりも長いもしくはそれに等しい期間、依然として結晶性であり得る。結晶が結晶性のままであるかどうかは、例えば、上記に記載されるキラル結晶の二次非線形イメージング(SONICC(登録商標))技法を使用して評価することができる。ヒドロゲルなどの担体中への結晶の封入は、例えば、潜在的な破壊力からのポリペプチドの防御によって、ポリペプチドを含む結晶の安定性を増加させ得る。驚くべきことに、本開示に記載されるヒドロゲル形成を含む封入の方法は、ポリペプチドの結晶化度を実質的に破壊することなく行われ得る。
一部の実施形態では、ポリペプチドは、無定形固体の形態である。図1および2Aは、結晶110を表すが、ポリペプチドは、無定形固体として、組成物100または組成物200中に存在してもよい。一部のそのような例では、ポリペプチドを含む無定形固体は、担体(例えば、ヒドロゲル)によって少なくとも部分的に封入され得る。無定形固体は、一般に、明確な格子または幾何学的形状を欠くものである。本開示の文脈では、無定形固体は、乾燥されていてもよく(例えば、吸着水分などの相対的に少量の液体を含まないまたはそれと会合している乾燥粉末)、または無定形固体は、湿潤固体であってもよい(例えば、液体中に懸濁された粉末などの液体と会合したもの)。無定形固体(例えば、湿潤の少なくとも部分的に封入された無定形固体)の形態のポリペプチドは、溶解したポリペプチドとは対照的であり、ポリペプチド間の分子間引力は、均一相混合物が生じるように、溶媒との相互作用によって支配される。
ポリペプチド固体は、各種の好適な方法のいずれかで提供され得る。ポリペプチドの無定形固体は、市販されている場合があり、必要に応じて、1つまたは複数の精製ステップを受けてもよい。固体状のポリペプチドを含む結晶が使用される一部の実施形態では、ポリペプチドは結晶化されてもよい。ポリペプチド(例えば、抗体などのタンパク質)は、好適な技法を使用して結晶化されてもよい。そのような技法としては、限定されるものではないが、バッチ、マイクロバッチ、蒸気拡散、懸滴、マイクロダイアリシス、および自由界面拡散が挙げられる。結晶が成長する好適な溶液条件は、ポリペプチド濃度、緩衝液の選択、pH、構成要素の温度、および沈殿化剤などの因子に依存し得る。ポリペプチドの結晶は、回収され、(例えば、遠心分離によって)さらなる処理(例えば、ヒドロゲルなどの担体への封入)の前に、好適な緩衝液中で保管され得る。
組成物が、固体状のポリペプチドを少なくとも部分的に封入するヒドロゲルを含む一部の実施形態では、ヒドロゲルは、固体状のポリペプチドを含有する溶液から形成されてもよい。例えば、ポリペプチドを含む結晶は、ヒドロゲルのための前駆体構成要素を含む溶液中に存在し得る(例えば、懸濁され得る)。一部のそのような溶液は、前駆体ポリマー鎖、および必要に応じて、架橋剤、開始剤(例えば、光開始剤、塩基などの化学開始剤など)、ポロゲン、および緩衝液分子を含んでいてもよい。そのような溶液は、「プレポリマー」溶液と称される場合がある。一例として、抗体の結晶がポリエチレングリコール系ヒドロゲルによって封入される実施形態では、結晶は、最初に、ポリエチレングリコールおよびポリエチレンジアクリレート(PEGDA)を含むプレポリマー溶液に懸濁され得る。
一部の実施形態では、外部刺激が、固体状のポリペプチド(例えば、結晶性ポリペプチド)を含むプレポリマー溶液に適用されて、架橋およびヒドロゲル形成を引き起こす。そのような外部刺激は、上記に記載される例示的な刺激(例えば、電磁放射線、化学触媒添加)のいずれかであってもよい。ポリエチレングリコール系ヒドロゲルの例を再び参照すると、紫外線を、プレポリマーに照射し、その後のラジカルに基づく架橋およびその後の結晶の周りおよび周囲のヒドロゲル形成を引き起こしてもよい。図2Bは、プレポリマー溶液220が、液体緩衝液206(例えば、PEG緩衝液)中にポリペプチド結晶110、前駆体ポリマー鎖225(例えば、PEGDA)および開始剤228を含む、組成物形成プロセスの例を示す。前駆体ポリマー鎖225の架橋(例えば、紫外線を介した)は、一部の実施形態によれば、組成物200をもたらす。
担体(例えば、ヒドロゲル)のある特定の形態は、組成物のある特定の適用のために有利であり得ることが観察された。ヒドロゲル組成物の形状は、下記にさらに詳細に記載される各種の技法のいずれかを使用して調節されてもよい。一例は、ヒドロゲルミクロスフェアである。好適なヒドロゲルミクロスフェアを形成する一方法は、流体(例えば、マイクロ流体)技法の使用である。例えば、プレポリマー相が第1の方向で接合部を横断して流れ、不混和相(例えば、油相)が第1の方向に直交する第2の方向で接合部を横断して流れる交差接合技法が使用されてもよい。そのような流動パターンは、不混和相に懸濁された固体状のポリペプチドを含むプレポリマーの液滴をもたらし得る。架橋およびヒドロゲル形成のその後の開始は、外部刺激源(例えば、電磁放射線源)を通り過ぎてポリペプチドがロードされたプレポリマー液滴を流すことによって起こり得る。得られた組成物は、液滴サイズ、および固体ポリペプチドを含むプレポリマー溶液の架橋条件、粘度もしくは表面張力、または液滴を発生させるために使用されるデバイスの幾何学的形状(例えば、オリフィスサイズ/直径)などの因子に依存する寸法および形状を有し得る。得られた組成物(例えば、固体ポリペプチドを含むヒドロゲルミクロスフェアを含む)を、不混和相を除去すること、および洗浄すること(例えば、緩衝液で)によって精製することができる。下記の実施例における図3A~3Bは、そのようなプロセスの一例を記載する。
ヒドロゲル形成の間のプレポリマーの溶液条件は、活性の観点、および結晶化度を維持する観点(結晶性ポリペプチドを含む実施形態において)の両方での固体状のポリペプチドの安定性を含むいくつかの因子のいずれかに影響し得る。溶液条件はまた、ヒドロゲルの安定な形成に重要であり得る。例えば、プレポリマー溶液のpHは、ポリペプチドの安定性および/またはポリペプチドの安全性(例えば、治療的および/または予防的適用のための)、ならびにヒドロゲルの安定性に影響を及ぼし得る。本開示の文脈では、ある特定のpH範囲が、安定なポリペプチドの取り扱いおよびヒドロゲル形成に好適であることが発見された。一部の実施形態では、プレポリマー溶液のpHは、4よりも高いもしくはそれに等しい、5よりも高いもしくはそれに等しい、6よりも高いもしくはそれに等しい、7よりも高いもしくはそれに等しい、および/または最高で8、最高で9、もしくは最高で10である。一部の実施形態では、プレポリマー溶液のpHは、5~8である。
本明細書に記載される組成物(例えば、抗体などの固体状のポリペプチドを少なくとも部分的に封入するヒドロゲルなどの担体を含む)は、各種の形態のいずれかで生じ得る。例えば、組成物がヒドロゲルを含む一部の実施形態では、ヒドロゲルは、球、球状または繊維状の形状を有する粒子の形態である。繊維は、2よりも大きいもしくはそれに等しい、5よりも大きいもしくはそれに等しい、10よりも大きいもしくはそれに等しい、および/または最大で50、最大で100、もしくはそれよりも大きいアスペクト比(例えば、長さのその長さと直角を成す最大断面寸法に対する比)を有し得る。一部の場合では、組成物は、ヒドロゲル粒子内に少なくとも部分的に封入された固体状のポリペプチド(例えば、抗体)を有する複数のヒドロゲル粒子を含む。一部の例では、相対的に小さな粒子(例えば、マイクロ粒子またはそれよりも小さい)の形態であることが組成物に有利であることが観察された。例えば、組成物の流動の容易さ(例えば、コンテナ/容器/導管中、それを通して、またはそれから、流体、流体懸濁液または粒子組成物の動きを引き起こすことによる)が望ましい(例えば、皮下投与のために)一部の実施形態では、相対的に小さな粒子の封入されたポリペプチドを含むことが組成物に有利であり得る。一部の実施形態では、ヒドロゲル粒子は、50ナノメートルよりも大きいもしくはそれに等しい、0.1ミクロンよりも大きいもしくはそれに等しい、0.2ミクロンよりも大きいもしくはそれに等しい、0.5ミクロンよりも大きいもしくはそれに等しい、1ミクロンよりも大きいもしくはそれに等しい、10ミクロンよりも大きいもしくはそれに等しい、30ミクロンよりも大きいもしくはそれに等しい、100ミクロンよりも大きいもしくはそれに等しい、またはそれよりも大きい平均最大断面寸法を有する。一部の実施形態では、ヒドロゲル粒子は、300ミクロン未満もしくはそれに等しい、200ミクロン未満もしくはそれに等しい、100ミクロン未満もしくはそれに等しい、50ミクロン未満もしくはそれに等しい、10ミクロン未満もしくはそれに等しい、5ミクロン未満もしくはそれに等しい、1ミクロン未満もしくはそれに等しい、0.5ミクロン未満もしくはそれに等しい、またはそれ未満の平均最大断面寸法を有する。これらの範囲の組合せが可能である。例えば、一部の実施形態では、ヒドロゲル粒子は、100ミクロンよりも大きいもしくはそれに等しく、かつ300ミクロン未満もしくはそれに等しい、30ミクロンよりも大きいもしくはそれに等しく、かつ200ミクロン未満もしくはそれに等しい、10ミクロンよりも大きいもしくはそれに等しく、かつ100ミクロン未満もしくはそれに等しい、1ミクロンよりも大きいもしくはそれに等しく、かつ10ミクロン未満もしくはそれに等しい、または50ナノメートルよりも大きいもしくはそれに等しく、かつ1ミクロン未満もしくはそれに等しい平均最大断面寸法を有する。一部の実施形態では、ヒドロゲル粒子は、1ミクロンよりも大きいまたはそれに等しく、かつ30ミクロン未満またはそれに等しい(例えば、1ミクロンよりも大きいもしくはそれに等しく、かつ5ミクロン未満もしくはそれに等しい、または10ミクロンよりも大きいもしくはそれに等しく、かつ30ミクロン未満もしくはそれに等しい)平均最大断面寸法を有する。一部の実施形態では、ヒドロゲル粒子は、1ミクロン未満またはそれに等しい平均最大断面寸法を有する。粒子の最大断面寸法は、例えば、顕微鏡画像を解析することによって、決定することができる。
本明細書に記載される形状およびサイズを有するヒドロゲルは、限定されるものではないが、エマルション技法(例えば、マイクロ流体エマルション、バッチエマルション)、押出(例えば、注射器/針から)、噴霧、およびリソグラフィーを含む各種の好適な技法のいずれかを使用して形成され得る。押出技法の一例は、遠心押出である。粒子寸法は、例えば、溶液の粘度、流速などに基づいて、実験パラメーターを変更することによって制御することができる。例えば、混合条件が、得られるヒドロゲル粒子の直径の影響を及ぼし得ることが観察された。一部の実施形態では、ヒドロゲル粒子は、少なくとも一部分では、ボルテックス混合を介して形成される。一部の実施形態では、ヒドロゲル粒子は、少なくとも一部分では、超音波処理を介して形成される。超音波処理は、一部の例では、相対的に小さなヒドロゲル粒子(例えば、1ミクロン未満またはそれに等しい最大断面直径を有するヒドロゲル粒子)を提供し得ることが観察された。粒子形状(例えば、アスペクト比)が、収集距離(例えば、押出技法を使用する場合)および/または遠心分離スピード(遠心分離技法がヒドロゲル粒子形成のために使用される場合)によって影響を受け得ることも観察された。粒子形状(例えば、アスペクト比)が、架橋条件(例えば、存在する架橋剤の量)および/またはヒドロゲル前駆体構成要素の分子量(例えば、ポリマー前駆体の分子量)などの化学的考慮事項によって影響を受け得ることも観察された。
一部の実施形態では、固体状のポリペプチド(例えば、結晶性ポリペプチド、無定形固体のポリペプチド)は、相対的に高い量で組成物中に存在する。上記で言及されたように、組成物中にそのようなポリペプチドの高いローディングを有することは、一部の例では、有利であり得る。例えば、組成物中の高濃度のポリペプチドは、より低い濃度のポリペプチドによる例よりも、所与の用量の治療薬または予防薬をより少ない体積で送達することを可能にし得る。より少ない体積は、一部の例では、患者にとってより好都合であり、苦痛がない場合がある(例えば、皮下に投与される場合)。ある特定の組成物(例えば、ヒドロゲルなどの担体を含む)は、凝集および/または不十分な流動特性などの高いローディングに典型的には関連する問題を低減または回避しながら、相対的に高いローディングを可能にし得る。組成物中の固体状のポリペプチドのローディングは、当業者に公知の各種の好適な方法のいずれかで表され得る。例えば、一方法で、固体状のポリペプチドのローディングは、溶媒の重量を除く乾燥基準で決定される重量パーセンテージとして表されてもよい。ローディングを表す別の方法は、体積パーセンテージとしてである。
一部の実施形態では、組成物は、1wt%よりも高いもしくはそれに等しい、2wt%よりも高いもしくはそれに等しい、5wt%よりも高いもしくはそれに等しい、6wt%よりも高いもしくはそれに等しい、10wt%よりも高いもしくはそれに等しい、25wt%よりも高いもしくはそれに等しい、40wt%よりも高いもしくはそれに等しい、および/または最大で50wt%、もしくはそれよりも高い量で固体状のポリペプチド(例えば、結晶性ポリペプチド)を含む。これらの重量パーセンテージは、溶媒の重量を除く乾燥基準で決定され得る。一部の実施形態では、組成物中の固体状のポリペプチド(例えば、結晶性ポリペプチド)の濃度は、1mg/mLより高いもしくはそれに等しい、2mg/mLより高いもしくはそれに等しい、5mg/mLより高いもしくはそれに等しい、10mg/mLより高いもしくはそれに等しい、20mg/mLより高いもしくはそれに等しい、50mg/mLより高いもしくはそれに等しい、100mg/mLより高いもしくはそれに等しい、150mg/mLより高いもしくはそれに等しい、200mg/mLより高いもしくはそれに等しい、またはそれよりも高い。一部の実施形態では、組成物中の固体状のポリペプチド(例えば、結晶性ポリペプチド)の濃度は、500mg/mL未満もしくはそれに等しい、400mg/mL未満もしくはそれに等しい、330mg/mL未満もしくはそれに等しい、300mg/mL未満もしくはそれに等しい、250mg/mL未満もしくはそれに等しい、またはそれ未満である。これらの範囲の組合せが可能である。例えば、一部の実施形態では、組成物中の固体状のポリペプチド(例えば、結晶性ポリペプチド)の濃度は、1mg/mLより高いもしくはそれに等しく、かつ500mg/mL未満もしくはそれに等しい、50mg/mLより高いもしくはそれに等しく、かつ330mg/mL未満もしくはそれに等しい、または100mg/mLより高いもしくはそれに等しく、かつ300mg/mL未満もしくはそれに等しい。組成物中のポリペプチドの量は、例えば、熱重量分析(TGA)技法を使用して決定され得る。
上記で言及されたように、本開示に記載される組成物は、少なくとも一部の適用(例えば、患者への投与)に有益であり得る各種の流動特性(例えば、粘度、ずり流動化などのような流動学的特性)のいずれかを有し得る。驚くべきことに、例えば、相対的に低い動的粘度を有しながら、相対的に高い濃度の固体状のポリペプチドを含む組成物が調製され得ることが観察された。ペプチド濃度および低い動的粘度のそのような予想外の組合せは、一部のそのような組成物を、注射(例えば、皮下注射)を介してなどの治療的および/または予防的適用のための投与に特に好適にし得る。
組成物の動的粘度は、一般に、所与の速度での変形に対する組成物の抵抗性を指す。ニュートン流体は、せん断ひずみ速度に依存しない動的粘度を有するが、非ニュートン流体は、ずり流動化(粘度が、せん断ひずみの速度とともに減少する場合)、ずり粘稠化(粘度が、せん断ひずみの速度とともに増加する場合)、およびチクソトロピー流体などの現象を提示し得る。必ずしもすべての実施形態ではないが一部では、本明細書の組成物は、非ニュートン流体挙動を示す。例えば、一部の実施形態では、本明細書の組成物は、ずり流動する。ずり流動化は、例えば、組成物中のポリペプチドの濃度に依存し得る。ずり流動化は、組成物が相対的に高いせん断応力(例えば、注射)を受ける一部の例で有利であり得る。
一部の実施形態では、本明細書に記載される組成物は、所与のずり速度で相対的に低い動的粘度を実証する。組成物の動的粘度(例えば、ずり速度の関数として)は、レオメーターを使用して組成物についての流れ曲線を実験的に作成することによって決定することができる。当技術分野において公知である平行板レオメーターを使用して、そのような流れ曲線を作成してもよく、これから、動的粘度測定を行うことができる。そのようなレオメーター測定の例は、下記の実施例に提供される。一部の実施形態では、組成物は、25℃の温度で、10秒-1よりも高いもしくはそれに等しい、10秒-1よりも高いもしくはそれに等しい、10秒-1よりも高いもしくはそれに等しい、100秒-1よりも高いもしくはそれに等しい、500秒-1よりも高いもしくはそれに等しい、1,000秒-1よりも高いもしくはそれに等しい、および/または最高で2,000秒-1、最高で4,000秒-1、もしくはそれよりも高いずり速度下、0.3パスカル秒(Pa秒)未満もしくはそれに等しい、0.2Pa秒未満もしくはそれに等しい、0.1Pa秒未満もしくはそれに等しい、0.05Pa秒未満もしくはそれに等しい、0.05Pa秒未満もしくはそれに等しい、および/または0.02Pa秒程度、0.01Pa秒程度、もしくはそれより低い動的粘度を有する。一部の実施形態では、組成物は、25℃の温度で、100秒-1のずり速度下、0.3パスカル秒(Pa秒)未満もしくはそれに等しい、0.2Pa秒未満もしくはそれに等しい、0.1Pa秒未満もしくはそれに等しい、0.05Pa秒未満もしくはそれに等しい、0.05Pa秒未満もしくはそれに等しい、および/または0.02Pa秒程度、0.01Pa秒程度、もしくはそれより低い動的粘度を有する。
一部の実施形態では、固体状のポリペプチドを含む結晶を有する本開示で提供される組成物は、その他の点では本質的に同一の条件下で、同等の濃度の結晶性ポリペプチドを有する水性懸濁液の動的粘度よりも低い動的粘度を有する。本明細書に記載される組成物のある特定の態様、例えば、担体材料(例えば、ヒドロゲル)による封入、担体の組成、および担体の寸法は、水溶液中の遊離結晶性ポリペプチドと比較して、そのような動的粘度の低減に寄与し得る。この文脈では、条件は、温度、ずり速度、遠心分離機器、結晶形態学、および結晶サイズ分布(結晶を比較する場合)などのパラメーターが、本質的に同じ(例えば、5%以内、2%以内、1%以内、またはそれよりも近い)に保たれる場合、本質的にその他の点では同一であり得るが、結晶が存在する(例えば、封入環境またはその欠如)媒体は可変である。例えば、結晶性ポリペプチドのバッチを調製し、2つのサブバッチに分離し得、その第1は、本明細書に記載される組成物に組み込まれ(例えば、ヒドロゲルによって少なくとも部分的に封入され)、その第2は、本発明組成物として結晶性ポリペプチドと等しい濃度をもたらす水溶液の量で懸濁される。本発明組成物および比較水溶液の動的粘度は、次いで、温度およびずり速度の観点で本質的に同一のパラメーター下でレオメーターを使用して決定され得る。次いで、得られた動的粘度を比較し得る。
一部の実施形態では、固体状のポリペプチドを含む結晶を有する組成物は、その他の点では本質的に同一の条件下で、同等の濃度の結晶性ポリペプチドを有する水性懸濁液の動的粘度の1.1分の1以下、1.2分の1以下、1.5分の1以下、2分の1以下、3分の1以下、4分の1以下、および/または4.5分の1以上、5分の1以上、5.2分の1以上、6分の1以上、8分の1以上、10分の1以上の動的粘度を有する。驚くべきことに、そのような動的粘度の比が、少なくとも1mg/mL、少なくとも10mg/mL、少なくとも50mg/mL、少なくとも100mg/mL、少なくとも200mg/mL、および/または最高で300mg/mL、最高で330mg/mL、最高で500mg/mL、もしくはそれよりも高い結晶性ポリペプチドの濃度を有するものなどの相対的に濃縮された組成物に対してでさえ達成可能であることがここに発見された。一部の実施形態では、動的粘度のかなりの低減の上記の範囲は、25℃で、10秒-1~4,000秒-1の少なくとも1つのずり速度下で観察される。一部の実施形態では、動的粘度のかなりの低減の上記の範囲は、25℃で、10秒-1~4,000秒-1のすべてのずり速度下で観察される。
一部の実施形態では、固体状のポリペプチドを含む結晶を有する本開示で提供される組成物は、その他の点では本質的に同一の条件下で、同等の濃度の封入されていない非結晶性ポリペプチドを有する水性懸濁液の動的粘度よりも低い動的粘度を有する。水性懸濁液中の封入されていない非結晶性ポリペプチドは、それらが少なくとも部分的に封入されていない(例えば、ヒドロゲルによって)という条件で、水溶液に、少なくとも部分的に溶解し得るか、完全に溶解し得るか、または懸濁された固体状の形態であり得る。
一部の実施形態では、固体状のポリペプチドを含む結晶を有する組成物は、その他の点では本質的に同一の条件下で、同等の濃度の封入されていない非結晶性ポリペプチドを有する水性懸濁液の動的粘度のも50分の1以下、75分の1以下、100分の1以下、および/または500分の1以上、もしくは1,000分の1以上の動的粘度を有する。
一部の実施形態では、記載される組成物が、ポリペプチドを放出することが観察された。例えば、溶解条件(in vivoまたはin vitro)への組成物の曝露は、組成物内のまたはそれに近接する固体状のポリペプチドの溶解と、続いて起こるバルク溶液へのポリペプチドの分離をもたらし得る(例えば、拡散を介して)。ポリペプチドが組成物から放出される速度が、組成物のある特定の特徴に依存し得ることがさらに観察された。例えば、ヒドロゲル(例えば、ヒドロゲル粒子)による固体状のポリペプチドの少なくとも部分的な封入(例えば、結晶として、無定形固体として)を伴う一部の実施形態では、ヒドロゲルのある特定の特徴は、ポリペプチドが放出される速度に影響を及ぼし得る。任意の特定の理論に縛られることを望まないが、一部のそのようなヒドロゲルの特徴は、ヒドロゲルの細孔サイズ、架橋されたポリマー鎖の化学組成、ポリマー鎖の分子量、ヒドロゲルの架橋密度、ヒドロゲル粒子のサイズ(粒子形態の場合)、ポロゲンの濃度、溶解媒体(例えば、緩衝溶液または生体液)への浸漬の際にヒドロゲルが膨潤する程度、ヒドロゲルが溶解媒体中で分解する程度およびスピード、ならびにヒドロゲル内の局所的な粘度の増加が溶解媒体への浸漬の際に観察される程度を含み得る。放出速度は、少なくとも一部分では、ポリペプチドのサイズおよび/または濃度にも依存し得る。ヒドロゲルの特徴(例えば、ポリマー鎖、細孔サイズなど)の調整は、ポリペプチドの放出動態の調整を可能にし得る。これは、適切な適用のために、ポリペプチドの放出プロファイルを調節することを可能にし得る。ポリペプチド(例えば、抗体)の素早い放出が所望される適用のためには、相対的に大きな細孔を有するヒドロゲルが用いられ得る。ポリペプチドの相対的に遅い放出が所望される適用のためには、小さな細孔、ポリペプチドと相対的に高い分子間相互作用を有するポリマー鎖、および/または局所的な粘度の増加の傾向を有するヒドロゲルが用いられ得る。より遅い放出はまた、組成物中のポリペプチドの相対的に高いローディングを介して達成され得ることが観察された。
一部の実施形態では、組成物は、相対的に高い速度で、ポリペプチドを放出する。放出は、例えば、試料に最初に組み込まれたポリペプチドの量によって正規化された溶解媒体の時系列の濃度測定を使用して、定量的に決定され得る。濃度測定を行う一方法は、ブラッドフォードタンパク質アッセイ法を使用することである。溶解媒体は、例えば、リン酸緩衝生理食塩水(PBS)溶液であり得る。一部の実施形態では、リン酸緩衝生理食塩水溶液への曝露の際に、70%よりも多いもしくはそれに等しい、80%よりも多いもしくはそれに等しい、90%よりも多いもしくはそれに等しい、95%よりも多いもしくはそれに等しい、99%よりも多いもしくはそれに等しい、またはそれよりも多くのポリペプチドが、曝露5時間後に、溶液に放出される。これらのパーセンテージは、ポリペプチドの放出分率に基づいて決定され得る。これらのパーセンテージは、室温(25℃)で決定され得る。
一部の実施形態では、組成物は、相対的に低い速度で、ポリペプチドを放出する。一部の実施形態では、リン酸緩衝生理食塩水溶液への曝露の際に、90%未満もしくはそれに等しい、85%未満もしくはそれに等しい、80%未満もしくはそれに等しい、75%未満もしくはそれに等しい、70%未満もしくはそれに等しい、65%未満もしくはそれに等しい、またはそれ未満のポリペプチドが、曝露5時間後に、溶液に放出される。これらのパーセンテージは、ポリペプチドの放出分率に基づいて決定され得る。これらのパーセンテージは、室温(25℃)で決定され得る。
記載される一部の組成物は、治療剤および/または予防剤として固体状のポリペプチドを含むが、追加の治療剤および/または予防剤が、組成物に含まれていてもよい。例えば、一部の実施形態では、ポリペプチドは、第1の治療剤および/または予防剤であり、組成物は、第2の治療剤および/または予防剤をさらに含む。第2の治療剤および/または予防剤は、異なる種類のポリペプチド(例えば、抗体などのタンパク質、治療用および/または予防用小分子など)であり得る。第1の治療剤および/または予防剤ならびに第2の治療剤および/または予防剤(ならびに必要に応じて、第3の治療剤および/または予防剤など)を有する共製剤化を伴う実施形態は、医薬品カクテルを含み得る。例えば、本明細書の組成物は、HIV感染症などの感染症を処置するための2つ以上の治療剤を含むカクテルであってもよい。別の例として、同じ処置に複数の異なる種類の治療薬を有することに由来する相乗効果が存在する、いくつかのがんの効能が存在することが公知である。一部の実施形態では、本明細書の組成物は、構成要素の1つまたは複数が少なくとも部分的に封入された(例えば、ヒドロゲルによって)固体状のポリペプチドである、複数の構成要素のがん治療薬を含み得る。一部の実施形態では、第2の治療薬および/または予防薬は、ポリペプチドに対して反応性であり得るが(例えば、溶液中で遊離している場合)、固体のポリペプチド(例えば、結晶形態)の封入は、ポリペプチドと第2の治療剤および/または予防剤との間の反応を低減または防止し得る(例えば、隔絶を介して)。第2の治療剤および/または予防剤は、固体状(例えば、結晶性、無定形固体)で組成物中に存在していてもよく、または溶液(例えば、緩衝液)に溶解していてもよい。一部の実施形態では、第2の治療剤および/または予防剤はまた、組成物の担体(例えば、ヒドロゲル)によって少なくとも部分的に封入される。しかしながら、一部の実施形態では、第2の治療剤および/または予防剤は、組成物中に存在するが、担体(例えば、ヒドロゲル)によって封入されていない。
本開示に記載される組成物は、上記に言及されたように、各種の適用のいずれかに好適であり得る。驚くべきことに、記載される一部の組成物が、患者への投与に安全であり得ることがここに観察された。組成物の安全性(例えば、生体適合性)は、少なくとも一部分では、使用される場合に担体(例えば、ヒドロゲル)の組成、粒子のサイズ、およびヒドロゲルを形成するために使用される緩衝液に依存し得る。
一部の実施形態では、本明細書に記載される固体状のポリペプチドを含む組成物は、患者に送達され得る。一部のそのような実施形態は、組成物を患者に投与することを含む。一部のそのような組成物は、上記に記載されるように、ヒドロゲルおよび固体状のポリペプチドを含み得る。ポリペプチド(例えば、抗体などのタンパク質)は、ヒドロゲルによって少なくとも部分的に封入されていてもよい。一部の実施形態では、患者は、ヒト患者である。しかしながら、患者は、一部の例では、動物(例えば、ヒト以外の哺乳動物)であってもよい。投与は、一部の例では、in vivoであり得るか、または他の例では、in vitroであり得る。
組成物は、医学的適用のための当技術分野において公知の各種の技法のいずれかを介して、患者に投与され得る。一部の実施形態では、組成物は、注射を介して患者に投与される。例えば、組成物は、患者に、ボーラスとして注射されてもよい。注射を介した投与は、例えば、皮下注射針および注射器を使用する、皮下、筋肉内、静脈内、腹腔内、骨内、心臓内、関節内、および/または空洞内注射を含み得る。しかしながら、例えば、パッチを介した、吸入を介した、または患者へのインプラントを介した、他の種類の投与が可能である。上記で言及されたように、ある特定の種類の注射、例えば、皮下注射では、相対的に少ない体積(例えば、5mL未満もしくはそれに等しい、3mL未満もしくはそれに等しい、1.5mL未満もしくはそれに等しい、1mL未満もしくはそれに等しい、またはそれ未満)の組成物を送達することが望ましくあり得る。したがって、良好な流動特性(例えば、相対的に低い粘度)を維持しながら相対的に高い濃度のポリペプチドを含む組成物は、一部のそのような例において望ましくあり得る。
ある特定の投与の方法は、相対的に高いずり速度に組成物を暴露することを伴い得る。例えば、針などの開口部を通じた注射を介して組成物を投与することで、組成物は高いずり速度に曝露され得る。一部の実施形態は、組成物が、4000秒-1よりも高いもしくはそれに等しい、5000秒-1よりも高いもしくはそれに等しい、8000秒-1よりも高いもしくはそれに等しい、および/または最高で10,000秒-1、最高で50,000秒-1、最高で100,000秒-1、もしくはそれよりも高いずり速度を経験するように、開口部に組成物を通過させることにより組成物を患者に注射することを含み得る。そのような高いずり速度は、例えば、ある特定のゲージ針の使用の間に観察され得る。例えば、組成物は、20よりも大きいもしくはそれに等しい、23よりも大きいもしくはそれに等しい、25よりも大きいもしくはそれに等しい、26よりも大きいもしくはそれに等しい、および/または最大で28、最大で30、最大で31、もしくはそれよりも大きいゲージを有する針に組成物を通過させることによる注射を介して投与されてもよい。一部の組成物(例えば、ヒドロゲルおよび固体状のポリペプチドを含む)は、そのような高いずり速度で、安定性、完全性、および良好な流動特性を維持し得ることがここに観察された。
「固体状のポリペプチドを含む組成物および関連する方法」という名称の2020年7月31日に出願された米国仮特許出願第63/059,477号は、すべての目的のために、その全体が参照により本明細書に組み込まれる。
以下の実施例は、本発明のある特定の実施形態を説明することを意図するが、本発明な完全な範囲を例示するものではない。
(実施例1)
(実施例1)
この実施例は、ある特定の実施形態によるポリペプチドを含む組成物に関する実験および結果を記載する。
序論
モノクローナル抗体(mAb)は、がんおよび自己免疫障害の処置のためのそれらの高い特異性および多用途性について公知である治療薬である。典型的には、mAbは、クリニックにおいて、静脈内注入を介して数週間ごとに投与され、それぞれの投与は、数時間の時間、およびヘルスケア専門家の助けを必要とする。モノクローナル抗体の皮下注射のための好適な製剤の開発は、より高い患者の利便性および自己投与に向けた重要な治療目標である。皮下経路のために、これらの製剤は、注射のための体積の要件(<1.5mL)を満たすために、高濃度のmAb(>>100mg mL-1)を必要とし得るが、そのような濃度を有する製剤は、典型的には、追加の課題を導入する。高濃度では、mAbは、溶液中で、自己会合し、クラスターを形成し得、これは、高い粘度として現れる。製剤の粘度を操作するための積極的な戦略、例えば、緩衝液の条件の変化、希釈されている賦形剤の添加、またはmAbへのマイナーな改変は、投与のための許容されない高い注射力を回避するために、開発全体にわたって考慮され得る。高濃度の抗体溶液はまた、タンパク質の活性、薬物動態および安全性に潜在的に影響を及ぼす凝集に起因して、加速されたタンパク質分解の影響を受けやすい。
モノクローナル抗体(mAb)は、がんおよび自己免疫障害の処置のためのそれらの高い特異性および多用途性について公知である治療薬である。典型的には、mAbは、クリニックにおいて、静脈内注入を介して数週間ごとに投与され、それぞれの投与は、数時間の時間、およびヘルスケア専門家の助けを必要とする。モノクローナル抗体の皮下注射のための好適な製剤の開発は、より高い患者の利便性および自己投与に向けた重要な治療目標である。皮下経路のために、これらの製剤は、注射のための体積の要件(<1.5mL)を満たすために、高濃度のmAb(>>100mg mL-1)を必要とし得るが、そのような濃度を有する製剤は、典型的には、追加の課題を導入する。高濃度では、mAbは、溶液中で、自己会合し、クラスターを形成し得、これは、高い粘度として現れる。製剤の粘度を操作するための積極的な戦略、例えば、緩衝液の条件の変化、希釈されている賦形剤の添加、またはmAbへのマイナーな改変は、投与のための許容されない高い注射力を回避するために、開発全体にわたって考慮され得る。高濃度の抗体溶液はまた、タンパク質の活性、薬物動態および安全性に潜在的に影響を及ぼす凝集に起因して、加速されたタンパク質分解の影響を受けやすい。
小分子薬物は、通常、固体状(例えば、無定形固体分散物、結晶)で調製されて、ある特定の流動特性、より高い溶解度、増強された安定性、および調節可能な放出特性を有する製剤を与える。タンパク質の結晶性形態は、精製および構造の特徴付けのために従来は使用されたが、mAbまたは他のタンパク質の高濃度製剤を安定化するために同様に利用することができる。結晶それ自身は、非常に高濃度で(潜在的には>500mg/mL-1)、安定なフォールドされたタンパク質で天然で密にパッキングされている。さらに、タンパク質結晶の一部の懸濁液は、同等の濃度のタンパク質溶液と比較した場合に、より低い粘度を呈する。タンパク質結晶製剤を開発する(例えば、安全で、好適な結晶化および安定化条件を見出す;結晶化バッチサイズのスケールアップ)難しさに起因して、結晶が持続性放出を製剤に与える結晶性インスリンを除いて、商業的成功は限定的であった。それ故に、この区域には、開発および革新のためのかなりの余地が存在する。
ヒドロゲル材料は、多くの場合、それらの高い水含有量、柔らかさ、および生体適合性に起因して、薬物送達のための担体として研究されている。ヒドロゲルは、各種の化学的性質およびマイクロ構造を伴って生成され得、これは、多様な表面親和性および調節可能な薬物放出動態(例えば、ヒドロゲルマトリックス分解を介した速い放出、拡散を介した遅い放出)を有するヒドロゲルの設計を可能にし得る。ある特定の既存の研究は、水性形態または結晶性形態のいずれかの小分子薬物、および水性形態のタンパク質の送達のためにヒドロゲルを活用している。これらのヒドロゲルは、ゲル化を誘発することによって(例えば、pH、温度)注射後にin situで形成されるか、または経口製剤もしくは埋め込み可能なデポー剤としての使用のためにあらかじめ形成される。ヒドロゲルはまた、針を通して注射される場合(すなわち、高いせん断)に、より低い粘度を呈し、密にパッキングされた場合に、解膨潤するおよび変形するそれらの能力に起因して高い体積分率に達するミクロスフェア懸濁液として調製することができる。本開示の文脈では、これらの特性が、ミクロスフェア懸濁液を、高濃度の低粘度製剤を探索するための興味深い担体にすることが理解された。
この実施例では、モノクローナル抗体「mAb2」のヒドロゲル/結晶ミクロスフェア製剤を報告する。mAb2は、結晶の濃縮懸濁液(>300mg mL-1)として調製され、これは、次いで、ヒドロゲルミクロスフェア内に封入された。ヒドロゲルミクロスフェアを特徴付けて、mAb2の結晶化度、mAb2ローディング、および封入効率を検証した。さらに、in vitro溶解実験を実行して、ヒドロゲル/結晶製剤からの薬物放出を実証した。最後に、濃縮ヒドロゲル/結晶ミクロスフェア懸濁液の流れ曲線は、他の形態の濃縮mAb2と比較した場合に、この製剤の改善された流動特性を実証する。
結果および考察
ヒドロゲル/結晶ミクロスフェアの生成
ヒドロゲルプレポリマーを、紫外線(UV)照射下で重合し、懸濁されたmAb2結晶を安定化するように、設計した(図3A)。図3Aは、ヒドロゲルプレポリマーが、PEG緩衝液中のmAb2結晶の濃縮懸濁液、PEGDAおよび光開始剤の直接混合によって調製されることを示す。図3Bは、ヒドロゲルプレポリマー液滴が、マイクロ流体交差接合を使用することによって生成され、それぞれの液滴が、UV光への曝露によって架橋されたことを示す。図3Bは、結晶が、架橋前にプレポリマー液滴内に十分に懸濁されたことを示す。UV曝露後、ミクロンスケールの結晶は、架橋されたミクロスフェアのナノ多孔性マトリックス内に捕捉された。概略図は、縮尺通りではない。
ヒドロゲル/結晶ミクロスフェアの生成
ヒドロゲルプレポリマーを、紫外線(UV)照射下で重合し、懸濁されたmAb2結晶を安定化するように、設計した(図3A)。図3Aは、ヒドロゲルプレポリマーが、PEG緩衝液中のmAb2結晶の濃縮懸濁液、PEGDAおよび光開始剤の直接混合によって調製されることを示す。図3Bは、ヒドロゲルプレポリマー液滴が、マイクロ流体交差接合を使用することによって生成され、それぞれの液滴が、UV光への曝露によって架橋されたことを示す。図3Bは、結晶が、架橋前にプレポリマー液滴内に十分に懸濁されたことを示す。UV曝露後、ミクロンスケールの結晶は、架橋されたミクロスフェアのナノ多孔性マトリックス内に捕捉された。概略図は、縮尺通りではない。
10%w/vのポリ(エチレングリコール)(PEG、MW 3350Da)、50mMのHEPES、pH7.0安定化緩衝液中のmAb2結晶の濃縮懸濁液を、最初に調製し(図4A~4C)、次いで、予測されるメッシュサイズおよび分解性を有する生体適合性ヒドロゲルを形成する分子であるポリ(エチレングリコール)ジアクリレート(PEGDA)と混合した。図4A~4Cは、mAb2結晶懸濁液の画像である。図4Aは、それらの結晶化緩衝液から沈殿によって分離された結晶を示し、これは、1700RCFでの遠心分離によって加速することができる。図4Bは、mAb2結晶の顕微鏡写真である。図4Cは、5μmの平均長さを有するmAb2結晶のサイズ分布である。mAb2結晶が、高濃度のPEGを含有する緩衝液中で調製および安定化されたので、PEGDAの存在下の製剤が、処理全体を通して、mAb2結晶化度を著しく破壊しないであろうと予期された。PEGDAが、UVに曝露された場合に迅速に重合され(<60秒)、光開始剤が、ブレンドに完全に溶解するように、PEGDAおよび光開始剤(Darocur 1173)の量を調整した(それぞれ、10%および1.5%v/v)。プレポリマーブレンドのバランス(88.5%v/v)は、それらの安定化緩衝液中のmAb2結晶であった。緩衝液のPEG構成要素は、両方ともmAb2結晶を安定化し、重合したヒドロゲル内の相互接続した細孔の形成を誘導し、これは、ヒドロゲルを通じた拡散速度を増加させた。
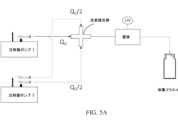
単純なマイクロ流体交差接合およびUV LEDを利用して、30μm程度の直径のヒドロゲル/結晶ミクロスフェアを生成した(図3A~3Bおよび図5A~5E)。図5Aは、フロー系の概略図であり、注射器ポンプ1は、分散相(プレポリマー)を流速QDで送達し、注射器ポンプ2は、連続相(油)を流速QC/2で送達する。交差接合部で、連続相は、分散相に作用し、液滴を形成し、これは、それらがUV曝露筐体を通過するにつれて、下流で光架橋する。図5Bは、UV筐体の写真である。チューブは、レンズキャップと光学ディフューザーとの間に挟まれて、そこに備え付けられたLEDを直接取り付けた。図5C~5Eは、さまざまな流速で、50mMのHEPES pH7.0中に10%v/vのPEGDA(MW 700Da)、10%w/vのPEG(MW 3350Da)を含むプレポリマーを用いて生成された特徴的なミクロスフェアを示す。
ヒドロゲル粒子のサイズおよび分散度は、油およびプレポリマーの流速QCおよびQD(それぞれ)、それらの粘度μCおよびμD、ならびに界面張力に影響された。ミクロスフェアを、不混和性担体流体(鉱物油)中で、0.1~1μL分-1の速度QDで連続して生成した。ミクロスフェアローディングCloadは、ある特定の体積の濃縮mAb2結晶をプレポリマーに混合することによって制御され、下記に定義した。
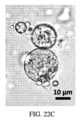
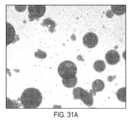
ヒドロゲル/結晶ミクロスフェアの特徴付け
ヒドロゲル/結晶ミクロスフェアは、球状の形状であり、見たところ粗い質感で不透明であった(図6A~6F)。200mg mL-1のmAb2結晶を含有するミクロスフェアの同じ試料を、明視野(図6D)、第二高調波発生(SHG)(図6E)、および紫外二光子励起蛍光(UV-TPEF)(図6F)で撮像した。小さな針状形状のmAb2結晶の特長は、高倍率下で、ミクロスフェア内で識別することができた(図7)。図7において、mAb2結晶の形状は、ヒドロゲル内で識別可能である。高濃度では、個々の結晶は、従来の光学顕微鏡法では、高い試料の不透明性に起因して視覚的に同定することは困難である。第二高調波発生(SHG)顕微鏡法は、キラル結晶の存在を確認し、紫外二光子励起蛍光(UV-TPEF)顕微鏡法は、mAb2の存在を確認し、これらは、ともに、ヒドロゲル粒子が、mAb2結晶でパッキングされていたことを確認した。結晶は、ヒドロゲルメッシュ内に封入および拘束され、それらは、重合および洗浄手順の間を通して、漏出なく、ヒドロゲル内に局在化したままであった。さらに、封入された材料が、時期尚早に結晶化度を失わないか、または溶解しないように、多孔性ヒドロゲルは、mAb2結晶へのPEG緩衝液の十分な溶媒アクセスを可能にした。
ヒドロゲル/結晶ミクロスフェアは、球状の形状であり、見たところ粗い質感で不透明であった(図6A~6F)。200mg mL-1のmAb2結晶を含有するミクロスフェアの同じ試料を、明視野(図6D)、第二高調波発生(SHG)(図6E)、および紫外二光子励起蛍光(UV-TPEF)(図6F)で撮像した。小さな針状形状のmAb2結晶の特長は、高倍率下で、ミクロスフェア内で識別することができた(図7)。図7において、mAb2結晶の形状は、ヒドロゲル内で識別可能である。高濃度では、個々の結晶は、従来の光学顕微鏡法では、高い試料の不透明性に起因して視覚的に同定することは困難である。第二高調波発生(SHG)顕微鏡法は、キラル結晶の存在を確認し、紫外二光子励起蛍光(UV-TPEF)顕微鏡法は、mAb2の存在を確認し、これらは、ともに、ヒドロゲル粒子が、mAb2結晶でパッキングされていたことを確認した。結晶は、ヒドロゲルメッシュ内に封入および拘束され、それらは、重合および洗浄手順の間を通して、漏出なく、ヒドロゲル内に局在化したままであった。さらに、封入された材料が、時期尚早に結晶化度を失わないか、または溶解しないように、多孔性ヒドロゲルは、mAb2結晶へのPEG緩衝液の十分な溶媒アクセスを可能にした。
ヒドロゲルにおけるmAb2抗体のローディングを、熱重量分析により測定した。対照mAb2は、150~350℃の温度範囲にわたって分解し、残留塊が、500℃で存在した。PEGヒドロゲル対照試料は、350~425℃の温度間で急に分解し、500℃で完全に分解した。算出および解析の詳細は、図8A~8Cに含まれる。図8Aは、mAb2なしのヒドロゲル試料のサーモグラムを示す。図8Bは、ヒドロゲルなしのmAb2のサーモグラムを示す。図8Cは、ヒドロゲル-結晶複合試料のサーモグラムを示す。第2の示差サーモグラムでは、ゼロは、データの変曲点に対応する約350℃に位置し、ヒドロゲル分解が、mAb2分解にわたって支配的になったことを指し示す。変曲点は、垂直線でマークする。50mg mL-1、100mg mL-1、200mg mL-1、および300mg mL-1のmAb2を用いて調製されたミクロスフェアは、それぞれ、27.5wt%、38.3wt%、51.6wt%および56.1wt%のローディングを有すると決定された。100%の封入は、<200mg mL-1のミクロスフェアローディングについて達成され、88%の封入は、300mg mL-1のローディングで達成された(図9A~9B、下記の表1)。図9Aは、0~300mg mL-1のミクロスフェアローディングでの試料の分解プロファイルを示す。図9Bは、それぞれのヒドロゲル試料の質量の測定値および理論値の比較を示す。標準偏差を、3つの反復試料について、図9A~9Bにおいてエラーバーとして表す。
観察された高い封入効率は、すべての結晶性材料を液滴に隔離するために使用される水中油法に起因した。さらに、高いローディングは、ヒドロゲルのメッシュが、mAb2で密に充填されたことを指し示した。
ヒドロゲルミクロスフェアからのmAb2のin vitro放出
mAb2結晶がロードされたヒドロゲルミクロスフェアを、リン酸緩衝生理食塩水(PBS)に浸漬した。mAb2が、結晶から溶解し、多孔性ポリマーマトリックスを通した拡散によって放出され、放出速度が、抗体のサイズ、ポリマーの分子量、ポロゲンの濃度、架橋密度、およびヒドロゲル粒子のサイズなどの因子によって影響を受けたことが観察された。数分以内に、ヒドロゲルミクロスフェアの外観は、不透明から透明に変化し、もはや交差偏光下で複屈折ではなく(図10A)、埋め込まれた結晶が溶解したことを指し示した。興味深いことに、溶解プロファイルは、初期バースト放出後に、mAb2が、封入されたmAb2の濃度にわずかに依存して、数時間~数日間にわたってヒドロゲルからゆっくりと放出されたことを指し示した(図10B)。図10Aは、結晶溶解の低速度撮影イメージングを示す。ヒドロゲルの観察された質感は、ミクロスフェアがもはや不透明ではなくなるまで、1.5分にわたって進化した。図10Bは、100、200または300mg mL-1のmAb2がロードされたミクロスフェアからの放出分率プロファイルを示す。標準偏差を、3つの反復試料について、エラーバーとして表す。
mAb2結晶がロードされたヒドロゲルミクロスフェアを、リン酸緩衝生理食塩水(PBS)に浸漬した。mAb2が、結晶から溶解し、多孔性ポリマーマトリックスを通した拡散によって放出され、放出速度が、抗体のサイズ、ポリマーの分子量、ポロゲンの濃度、架橋密度、およびヒドロゲル粒子のサイズなどの因子によって影響を受けたことが観察された。数分以内に、ヒドロゲルミクロスフェアの外観は、不透明から透明に変化し、もはや交差偏光下で複屈折ではなく(図10A)、埋め込まれた結晶が溶解したことを指し示した。興味深いことに、溶解プロファイルは、初期バースト放出後に、mAb2が、封入されたmAb2の濃度にわずかに依存して、数時間~数日間にわたってヒドロゲルからゆっくりと放出されたことを指し示した(図10B)。図10Aは、結晶溶解の低速度撮影イメージングを示す。ヒドロゲルの観察された質感は、ミクロスフェアがもはや不透明ではなくなるまで、1.5分にわたって進化した。図10Bは、100、200または300mg mL-1のmAb2がロードされたミクロスフェアからの放出分率プロファイルを示す。標準偏差を、3つの反復試料について、エラーバーとして表す。
任意の特定の理論に縛られることを望まないが、バースト放出は、フリーラジカル重合の酸素阻害および溶解媒体への移行の際のヒドロゲルの軽度の膨潤に起因する粒子の半径に沿った異種架橋が原因であった。さらに、迅速な結晶溶解および長期の放出の観察は、mAb2の放出についての2ステップ機構を指し示した。最初に、溶解媒体は、ヒドロゲルミクロスフェアに迅速に侵入し、結晶の周囲および結晶内の安定化PEG緩衝液を希釈し、これが、mAb2結晶の溶解をもたらした。大きなmAb2分子(動的光散乱により約11.1nmのDh)は、次いで、数日にわたって、多孔性ヒドロゲルマトリックスを通して拡散した。高いmAb2濃度でのより遅い観察された溶解は、浸漬の際のヒドロゲルミクロスフェア内の粘度の局所的な増加およびmAb2結晶の溶解から生じる可能性があり、これは、効果的な拡散係数の抑制に至ったが、放出動態の完全な調査が、この現象を解明するために必要であろう。
濃縮ヒドロゲルおよび結晶懸濁液の流れ曲線
ヒドロゲル/mAb2結晶ミクロスフェアがどのように注射において振舞うかを評定するために、高ローディングミクロスフェアを、流れ曲線の分析のために、ミクロスフェアの高密度懸濁液として調製した。ヒドロゲルミクロスフェアの名目上の粒子体積分率を、
ヒドロゲル/mAb2結晶ミクロスフェアがどのように注射において振舞うかを評定するために、高ローディングミクロスフェアを、流れ曲線の分析のために、ミクロスフェアの高密度懸濁液として調製した。ヒドロゲルミクロスフェアの名目上の粒子体積分率を、
図11A~11Dは、封入されていない結晶の懸濁液の形態(四角)、封入された結晶を有するヒドロゲルミクロスフェア(三角)、およびmAb2なしのヒドロゲルミクロスフェアの比較可能な体積分率(丸)の懸濁液の形態のmAb2試料についての流れ曲線のプロットである。粘度を、10%w/vのPEGを含有するpH7.0のHEPES緩衝液に懸濁された100mg mL-1(図11A)、200mg mL-1(図11B)、および300mg mL-1(図11C)の製剤化mAb2濃縮物についてのずり速度に対してプロットした。図11Dは、それぞれの製剤化ローディングで、懸濁された結晶に対する封入された結晶についての粘度低減の比を示す。
図12Aは、定角速度、および0.25mmのギャップを伴う平行板配置で動作されたDiscovery Hybridレオメーター3を使用する流動測定についての概略手順を示す。図12Bは、20mMのL-His、pH5.4の濃縮mAb2溶液の流れ曲線を示す。図12Cは、10%w/vのPEG、50mMのHEPESに懸濁されたさまざまな名目上の体積分率の未ロードのヒドロゲル粒子を示す。図12Dは、滑らかなプレート(スチール)および粗いプレート(240グリット、炭化ケイ素)を使用した、Φ=1.0でのヒドロゲル試料の流れ曲線の比較である。ヒドロゲルの懸濁液は、レオメーターにおけるせん断条件下で壁面スリップを経験し得、これは、測定される粘度を低減し、しかしながら、降伏応力を十分に上回ると、スリップは、バルク流と比較して無視でき、測定される粘度は、所与のずり速度で真の粘度に近づくはずである。この挙動は、低いずり速度でPEGDAヒドロゲルミクロスフェアにおいて確認され(図12D)、したがって、粘度の解釈を高いせん断体制(>100秒-1)で収集されたデータに限定した。
100mg mL-1および200mg mL-1のmAb2の溶液は、せん断下で一定の低い粘度を有していた。300mg mL-1で、mAb2溶液は、ずり流動化および高い粘度(>0.6Pa.秒)を呈した(図12B)。この挙動は、せん断下での観察された可逆的自己会合が、高濃度でのmAb間相互作用およびクラスター化に起因した抗体溶液の以前の研究と一致した。この実施例では、mAb2結晶スラリーが、すべての測定された濃度でずり流動化し、200mg mL-1および300mg mL-1で、4000秒-1のずり速度での対応する溶液形態と同等またはそれよりも低い粘度を有していた。未ロードのヒドロゲルミクロスフェア懸濁液も、ずり流動化し、粒子体積分率に依存した粘度でプラトーになった(図12C)。mAb2結晶を含有するヒドロゲルミクロスフェアは、ずり流動化し、興味深いことに、それらの挙動は、すべてのずり速度にわたって、同等の体積分率の未ロードのヒドロゲルミクロスフェア、および同等に濃縮された結晶の懸濁液による境界の間に収まっていた(図11A~11C)。この挙動は、100、200、および300mg mL-1の製剤化ロードについて一貫していた。とりわけ、せん断下の300mg mL-1の製剤の測定された粘度は、注射可能な製剤としての潜在的な適格性の指標である<0.035Pa.秒であった。定性的注射性試験では、300mg mL-1の製剤化ロードを有するヒドロゲルミクロスフェア懸濁液は、手によって、困難なく、26ゲージ針から成功裏に排出された。
任意の特定の理論に縛られることを望まないが、結晶が積載されたミクロスフェアの改善された流動挙動は、3つの効果から生じると合理的に説明された:(1)ヒドロゲルが、埋め込まれた結晶のmAb間の相互作用をクローキングした、(2)露出した(表面)mAb結晶が粘度に対するより小さな寄与を有するように、球状のミクロスフェア形状が、粒子の表面積-体積比を最小化した、および(3)ヒドロゲル製剤が、柔らかく変形可能であり、せん断下で増強された流動挙動をもたらした。低濃度では、クローキング効果は、ミクロスフェアが低体積の結晶を含有したので最も明白であり、ヒドロゲルミクロスフェアの流動特性が支配した。高濃度では、多くの体積のヒドロゲルミクロスフェアが、mAb2結晶によって占められ、したがって、ヒドロゲルは、自由に懸濁されたmAb2結晶の同等の塊よりも低い粘度で「球状結晶」として有効に挙動すると予想された。この報告では、すべてのヒドロゲル製剤は、結晶懸濁液と比べて、粘度の減少をもたらした(図11D)。とりわけ、100秒-1のずり速度で、300mg mL-1のヒドロゲル製剤は、結晶懸濁液と比較して、5.2分の1への粘度の減少を有し、濃縮遊離mAb2溶液と比較して、50分の1未満への粘度の減少を有していた。
結論
要約すると、モノクローナル抗体結晶を含有するヒドロゲルミクロスフェアが、高いローディングおよび低いせん断粘度で生成された。PEGリッチ緩衝液中でこれらの製剤を維持すると、mAb2カーゴの結晶化度が保存され、溶解状態への移行の際に、結晶が溶解し、mAb2がヒドロゲルマトリックスから放出されたことが実証された。ヒドロゲル/結晶ミクロスフェアが、高い製剤化ローディングで高密度懸濁液として製剤化された場合、それらは、ずり流動化し、同等の濃度の結晶懸濁液中のmAb2または遊離mAb2溶液よりも低い粘度を有し、結晶がロードされたヒドロゲルミクロスフェアが、高濃度の治療投薬のための流動性の課題を克服するのを助け得ることを実証した。この研究では、PEGDAを使用して、ヒドロゲルミクロスフェアを合成したが、このアプローチは、多くの他のヒドロゲル系に適用して、放出特性および製剤の性能をさらに調節することができる。
要約すると、モノクローナル抗体結晶を含有するヒドロゲルミクロスフェアが、高いローディングおよび低いせん断粘度で生成された。PEGリッチ緩衝液中でこれらの製剤を維持すると、mAb2カーゴの結晶化度が保存され、溶解状態への移行の際に、結晶が溶解し、mAb2がヒドロゲルマトリックスから放出されたことが実証された。ヒドロゲル/結晶ミクロスフェアが、高い製剤化ローディングで高密度懸濁液として製剤化された場合、それらは、ずり流動化し、同等の濃度の結晶懸濁液中のmAb2または遊離mAb2溶液よりも低い粘度を有し、結晶がロードされたヒドロゲルミクロスフェアが、高濃度の治療投薬のための流動性の課題を克服するのを助け得ることを実証した。この研究では、PEGDAを使用して、ヒドロゲルミクロスフェアを合成したが、このアプローチは、多くの他のヒドロゲル系に適用して、放出特性および製剤の性能をさらに調節することができる。
材料および方法
精製ヒト化モノクローナル抗体(mAb2)は、Merck & Co.、Kenilworth、NJ、USAによって提供された。鉱物油、ポリ(エチレングリコール)ジアクリレート(PEGDA、分子量700)、2-ヒドロキシ-2-メチルプロピオフェノン(Darocur 1173)、ソルビタンモノオレエート(Span 80)、カフェイン、および4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)は、Sigma-Aldrich Corporation製であった。ポリ(エチレングリコール)(PEG、分子量3350)は、Hampton Research製であった。
精製ヒト化モノクローナル抗体(mAb2)は、Merck & Co.、Kenilworth、NJ、USAによって提供された。鉱物油、ポリ(エチレングリコール)ジアクリレート(PEGDA、分子量700)、2-ヒドロキシ-2-メチルプロピオフェノン(Darocur 1173)、ソルビタンモノオレエート(Span 80)、カフェイン、および4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)は、Sigma-Aldrich Corporation製であった。ポリ(エチレングリコール)(PEG、分子量3350)は、Hampton Research製であった。
結晶化のために、「PEG緩衝液」を、50mMのHEPES、pH7.0中の10%w/vのPEG溶液として調製した。「カフェイン緩衝液」を、20mMのL-His、pH5.4中の2.5%w/vのカフェイン溶液として調製した。mAb2を、20mMのL-His、pH5.4中40mg mL-1で調製した。溶液を、蒸留水を用いて調製し、0.22μmのSUPORフィルター(Acrodisc)で滅菌濾過した。
mAb2配列情報
表3は、mAb2についての以下の配列情報を含む:
軽鎖の可変ドメインについての相補性決定領域(VL-CDR1、VL-CDR2、VL-CDR3)、軽鎖(VL)の可変ドメイン、軽鎖、重鎖の可変ドメインについての相補性決定領域(VH-CDR1、VH-CDR2、VH-CDR3)、重鎖(VH)の可変ドメイン、および重鎖。
表3は、mAb2についての以下の配列情報を含む:
軽鎖の可変ドメインについての相補性決定領域(VL-CDR1、VL-CDR2、VL-CDR3)、軽鎖(VL)の可変ドメイン、軽鎖、重鎖の可変ドメインについての相補性決定領域(VH-CDR1、VH-CDR2、VH-CDR3)、重鎖(VH)の可変ドメイン、および重鎖。
mAb2の結晶化
mAb2の結晶を、2.5mLスケールで、バッチで成長させ、それぞれのバッチは、約30mgの結晶性形態のmAb2を与えた。それぞれのバッチについて、mAb2、PEG緩衝液およびカフェイン緩衝液を、3:6:1の体積比で混ぜ合わせた。結晶化混合物を、ロティサリー(Thermo Scientific、モデル88881001)において24rpmで回転させながら、室温で2時間インキュベートした。mAb2結晶を、10分間の1700RCFでの遠心分離(Eppendorf MiniSpin Plus)によってバッチから回収し、新鮮なPEG緩衝液に移し、再懸濁させ、さらなる処理前に最長で1週間、室温で保管した。
mAb2の結晶を、2.5mLスケールで、バッチで成長させ、それぞれのバッチは、約30mgの結晶性形態のmAb2を与えた。それぞれのバッチについて、mAb2、PEG緩衝液およびカフェイン緩衝液を、3:6:1の体積比で混ぜ合わせた。結晶化混合物を、ロティサリー(Thermo Scientific、モデル88881001)において24rpmで回転させながら、室温で2時間インキュベートした。mAb2結晶を、10分間の1700RCFでの遠心分離(Eppendorf MiniSpin Plus)によってバッチから回収し、新鮮なPEG緩衝液に移し、再懸濁させ、さらなる処理前に最長で1週間、室温で保管した。
mAb2結晶を有するプレポリマーの調製
mAb2結晶懸濁液を、1700RCFでの遠心分離により濃縮した。結晶懸濁液を、約333mg mL-1(容量分析で決定)まで濃縮し、次いで、PEG緩衝液の添加によって、所望のmAb2濃度に希釈した。プレポリマーを、mAb2結晶懸濁液へのPEGDAおよびDarocur 1173の直接添加によって調製し、次いで、混合物が十分に分散するまでボルテックスした。
mAb2結晶懸濁液を、1700RCFでの遠心分離により濃縮した。結晶懸濁液を、約333mg mL-1(容量分析で決定)まで濃縮し、次いで、PEG緩衝液の添加によって、所望のmAb2濃度に希釈した。プレポリマーを、mAb2結晶懸濁液へのPEGDAおよびDarocur 1173の直接添加によって調製し、次いで、混合物が十分に分散するまでボルテックスした。
ミクロスフェアのマイクロ流体形成
プレポリマー液滴を、2つの注射器ポンプ(PHD2000、Harvard Apparatus)、交差接合部(P-891、IDEX;150μmのオリフィス)、および透明パーフルオロアルコキシアルカンチューブ(PFA、1902L、IDEX;OD 1/16”、ID 0.001”)からなるマイクロ流体装置を用いて生成した。プレポリマーを、交差接合部の単一の入口に送達し、鉱物油を、プレポリマー入口と垂直の方向の2つの入口を介して導入した。液滴形成を、連続相およびプレポリマーの流速(それぞれ、QCおよびQD)をモジュレートすることによって制御した。液滴を、UV LED(M365LP1、Thor Labs;365nm、1150mW)と密接に接触するように位置させた直径2”の円柱状筐体において、交差接合部の出口の下流のチューブ内で重合させた。より高い流速に対応するために、チューブを、筐体の内部で数回巻いて、曝露の時間を増加させた。重合した液滴を、UV LEDから下流に位置するフラスコに収集した。30~200μmの範囲の直径を有する粒子が生成した。過剰の油を、粒子懸濁液から除去し、次いで、試料を、新鮮なPEG緩衝液中で、30秒間のボルテックスによって洗浄して、少なくとも4回の2000RCFで2分間遠心して、残った油および未反応のヒドロゲル形成剤を除去した。
プレポリマー液滴を、2つの注射器ポンプ(PHD2000、Harvard Apparatus)、交差接合部(P-891、IDEX;150μmのオリフィス)、および透明パーフルオロアルコキシアルカンチューブ(PFA、1902L、IDEX;OD 1/16”、ID 0.001”)からなるマイクロ流体装置を用いて生成した。プレポリマーを、交差接合部の単一の入口に送達し、鉱物油を、プレポリマー入口と垂直の方向の2つの入口を介して導入した。液滴形成を、連続相およびプレポリマーの流速(それぞれ、QCおよびQD)をモジュレートすることによって制御した。液滴を、UV LED(M365LP1、Thor Labs;365nm、1150mW)と密接に接触するように位置させた直径2”の円柱状筐体において、交差接合部の出口の下流のチューブ内で重合させた。より高い流速に対応するために、チューブを、筐体の内部で数回巻いて、曝露の時間を増加させた。重合した液滴を、UV LEDから下流に位置するフラスコに収集した。30~200μmの範囲の直径を有する粒子が生成した。過剰の油を、粒子懸濁液から除去し、次いで、試料を、新鮮なPEG緩衝液中で、30秒間のボルテックスによって洗浄して、少なくとも4回の2000RCFで2分間遠心して、残った油および未反応のヒドロゲル形成剤を除去した。
流れ曲線測定のために、結晶がロードされたヒドロゲルミクロスフェアの懸濁液を、1700RCFで遠心して、標的mAb2ローディングに達するように、名目上の体積分率を増加させた。
mAb2ローディングおよび封入効率
ヒドロゲルのmAb2含有量を、熱重量分析(Q500、TA Instruments)を使用して測定した。およそ5mgのミクロスフェア懸濁液を、試料採取トレイに移した。過剰の溶媒を試料から逃がし、それらを、測定前に10分間、25mL 分-1のN2流下、100℃でさらに脱水した。試料を、100℃から500℃まで加熱し、それに続いて500℃で10分間、等温で保った。試料質量を、実験全体にわたって連続的に記録し、そこから、薬物ローディングおよび封入効率を決定した。実験は、10℃分-1の温度上昇で、三反復で行った。
ヒドロゲルのmAb2含有量を、熱重量分析(Q500、TA Instruments)を使用して測定した。およそ5mgのミクロスフェア懸濁液を、試料採取トレイに移した。過剰の溶媒を試料から逃がし、それらを、測定前に10分間、25mL 分-1のN2流下、100℃でさらに脱水した。試料を、100℃から500℃まで加熱し、それに続いて500℃で10分間、等温で保った。試料質量を、実験全体にわたって連続的に記録し、そこから、薬物ローディングおよび封入効率を決定した。実験は、10℃分-1の温度上昇で、三反復で行った。
ミクロスフェアの顕微鏡的特徴付け
粒子サイズ分布を、Zeiss Axiovert顕微鏡を使用して評定した。最小で30粒子を、それぞれ報告される平均直径および変動係数のために、それぞれの試料について測定した(ImageJ)。
粒子サイズ分布を、Zeiss Axiovert顕微鏡を使用して評定した。最小で30粒子を、それぞれ報告される平均直径および変動係数のために、それぞれの試料について測定した(ImageJ)。
キラル結晶の二次非線形イメージング(SONICC、Formulatrix)を利用して、以下の様式で、ミクロスフェア試料の顕微鏡写真を取得した:明視野、紫外二光子励起蛍光(UV-TPEF)、および第二高調波発生(SHG)。
in vitro溶解
ミクロスフェア試料を、1mLのPBSに浸漬し、ロティサリーミキサーにおいて24rpmでインキュベートした。それぞれの試料採取間隔で、試料を、1700RCFで2分間遠心し、0.5mLの上清を抜き取り、分析まで4℃で保管した。0.5mLの新鮮なPBSを、溶解試料に添加し、これをロティサリーに戻した。濃度を、ブラッドフォード法によって決定した。
ミクロスフェア試料を、1mLのPBSに浸漬し、ロティサリーミキサーにおいて24rpmでインキュベートした。それぞれの試料採取間隔で、試料を、1700RCFで2分間遠心し、0.5mLの上清を抜き取り、分析まで4℃で保管した。0.5mLの新鮮なPBSを、溶解試料に添加し、これをロティサリーに戻した。濃度を、ブラッドフォード法によって決定した。
流動測定
流れ曲線を、スチール平行板配置(40mm)を有するDHR-3レオメーター(TA Instruments)を使用して測定した。平行板を使用して、小さな切断長に起因してコーンプレートの幾何学的形状と不適合であるミクロスフェアに対応した。ギャップサイズを、0.25mmに設定し、>0.35mLの試料を、それぞれの測定のためにロードした。レオメーターを、定角速度で動作させ、それぞれのポイントで20秒間平衡化した。非ニュートン組成物における不均一なせん断応力の効果を説明するために、補正を適用した。試験されたずり速度範囲では(最高で4000秒-1)、すべての報告された値は、装置のトルク分解能を上回り、慣性流および二次流の効果が問題になるずり速度を下回った。
流れ曲線を、スチール平行板配置(40mm)を有するDHR-3レオメーター(TA Instruments)を使用して測定した。平行板を使用して、小さな切断長に起因してコーンプレートの幾何学的形状と不適合であるミクロスフェアに対応した。ギャップサイズを、0.25mmに設定し、>0.35mLの試料を、それぞれの測定のためにロードした。レオメーターを、定角速度で動作させ、それぞれのポイントで20秒間平衡化した。非ニュートン組成物における不均一なせん断応力の効果を説明するために、補正を適用した。試験されたずり速度範囲では(最高で4000秒-1)、すべての報告された値は、装置のトルク分解能を上回り、慣性流および二次流の効果が問題になるずり速度を下回った。
mAb2結晶懸濁液の特徴付け
バッチ結晶化mAb2を、1700RCFでペレットに遠心し、次いで、希釈し、10%w/vのPEG 3350、50mMのHEPES pH7.0緩衝液に再懸濁させた。懸濁液内で、結晶は、5μmの典型的な長さを有するインタクトな針状であった。結晶の長さおよび幅は、1μmであった。
バッチ結晶化mAb2を、1700RCFでペレットに遠心し、次いで、希釈し、10%w/vのPEG 3350、50mMのHEPES pH7.0緩衝液に再懸濁させた。懸濁液内で、結晶は、5μmの典型的な長さを有するインタクトな針状であった。結晶の長さおよび幅は、1μmであった。
マイクロ流体粒子生成についての詳細
ヒドロゲル粒子を、光架橋を開始するUV LEDにカップリングされたマイクロ流体交差接合を使用して合成した。粒子の単分散集団を、50μm程度で生成することができる。
ヒドロゲル粒子を、光架橋を開始するUV LEDにカップリングされたマイクロ流体交差接合を使用して合成した。粒子の単分散集団を、50μm程度で生成することができる。
膨潤を介したヒドロゲルのメッシュサイズ推定
10%v/vのPEGDA(MW 700Da)、8.8%w/vのPEG(MW 3350Da)、50mMのHEPES pH7.0から構成されるバルクヒドロゲルを、1.5%v/vのDarocur 1173の存在下、UV LED(M365LP1、ThorLabs)下での60秒間の曝露で光架橋することによって生成した。ヒドロゲルは、膨潤実験のために、8×8×5mmの切片に切断した。
10%v/vのPEGDA(MW 700Da)、8.8%w/vのPEG(MW 3350Da)、50mMのHEPES pH7.0から構成されるバルクヒドロゲルを、1.5%v/vのDarocur 1173の存在下、UV LED(M365LP1、ThorLabs)下での60秒間の曝露で光架橋することによって生成した。ヒドロゲルは、膨潤実験のために、8×8×5mmの切片に切断した。
それぞれのヒドロゲル切片を、DI水のかき混ぜ浴に24時間浸して、完全に膨潤させ、未反応構成要素を除去した。それぞれのヒドロゲルを、浴から取り出し、たたくようにして水気をとって、過剰の水を除去し、次いで、その膨潤質量Wswellを記録した。次いで、ヒドロゲルを、37℃で48時間乾燥させ、乾燥質量Wdryを記録した。ヒドロゲルのメッシュサイズを、Merrillらによって決定されたCanal-Peppas理論のパラメーターを使用することによって、およびその全体が本明細書に参照により組み込まれるA. Cavallo, M. Madaghiele, U. Masullo, M. G. Lionetto, A. Sannino, J. Appl. Polym. Sci. 2017, 134, 1において光架橋されたPEGDAヒドロゲルについてCavalloらによって適用されるように、膨潤Qから推定した。簡潔には、膨潤したポリマーの体積分率v2,sを、膨潤から算出した:
10%v/vのPEGDAヒドロゲルについての算出されたメッシュサイズは、2nmであった。とりわけ、mAb2分子(Dh 約11.1nm、DLS、Nanobook 90plus PALS)は、ヒドロゲルから迅速に溶解し、未ロードのヒドロゲルについての2nmのメッシュサイズが、ロードされたヒドロゲルについて、少なくとも1桁、有意に低く見積もられたことを指し示した。mAb結晶(約5μm長さ)が、ポロゲンとして働き、ヒドロゲルの多孔性を増加させ、ヒドロゲル内により大きく、より相互接続された多孔性のネットワークをもたらしたと思われた。
mAb2/ヒドロゲル試料の分析
個々のヒドロゲルを、低含有量のmAb2結晶を用いて、高倍率下で撮像し、封入されたmA2結晶が、目に見え、定性的にインタクトであったことを明らかにした。所与のミクロスフェア試料におけるmAb2ローディングを、熱重量分析によって決定した。ヒドロゲルおよびmAb2の分解プロファイルはわずかに重複したが、それらのピークは、複合試料において識別され、ここで、mAb2の大部分が200~300℃で分解し、ヒドロゲル材料が320℃~400℃で分解した。mAb2は、残渣を残したが(wresidual)、ヒドロゲルは、500℃までに完全に分解した。mAb2とヒドロゲル分解との間の遷移を決定するために、第2示差サーモグラム(d2TG)を利用した。ゼロのd2TGで、データは変曲し、このポイントで、ヒドロゲル分解が、分解する主な構成要素であったと見積もられた。このポイントを使用して、分解重量パーセントを、それぞれmAb2およびヒドロゲルに対応するWd1およびWd2に分離した。mAb2の重量パーセンテージを、TGA測定から算出した。
wmAb2=wd1+wresidual
mAb2ローディングの予測重量パーセンテージを、質量平衡から算出した:
個々のヒドロゲルを、低含有量のmAb2結晶を用いて、高倍率下で撮像し、封入されたmA2結晶が、目に見え、定性的にインタクトであったことを明らかにした。所与のミクロスフェア試料におけるmAb2ローディングを、熱重量分析によって決定した。ヒドロゲルおよびmAb2の分解プロファイルはわずかに重複したが、それらのピークは、複合試料において識別され、ここで、mAb2の大部分が200~300℃で分解し、ヒドロゲル材料が320℃~400℃で分解した。mAb2は、残渣を残したが(wresidual)、ヒドロゲルは、500℃までに完全に分解した。mAb2とヒドロゲル分解との間の遷移を決定するために、第2示差サーモグラム(d2TG)を利用した。ゼロのd2TGで、データは変曲し、このポイントで、ヒドロゲル分解が、分解する主な構成要素であったと見積もられた。このポイントを使用して、分解重量パーセントを、それぞれmAb2およびヒドロゲルに対応するWd1およびWd2に分離した。mAb2の重量パーセンテージを、TGA測定から算出した。
wmAb2=wd1+wresidual
mAb2ローディングの予測重量パーセンテージを、質量平衡から算出した:
ローディングも、湿潤基準で推定した(すなわち、懸濁液におけるように湿潤粒子について):
対照試料の流れ曲線
20mLのL-His緩衝液中のmAb2溶液を、50kDaのカットオフ遠心分離フィルターを使用して、100、200、および300mg/mLに濃縮した。100および200mg/mLの溶液は、それぞれ、0.0025および0.0195Pa.秒の粘度でニュートン流体として挙動し、300mg/mLで、溶液は、ずり速度γ=4000秒-1で0.58Pa.秒の粘度でせん断に対して非ニュートン応答を呈した。
20mLのL-His緩衝液中のmAb2溶液を、50kDaのカットオフ遠心分離フィルターを使用して、100、200、および300mg/mLに濃縮した。100および200mg/mLの溶液は、それぞれ、0.0025および0.0195Pa.秒の粘度でニュートン流体として挙動し、300mg/mLで、溶液は、ずり速度γ=4000秒-1で0.58Pa.秒の粘度でせん断に対して非ニュートン応答を呈した。
むき出しの(未ロードの)ヒドロゲルを、いくつかの名目上の体積分率で、10%のPEG 3350、50mMのHEPES pH7.0中の濃縮懸濁液として調製し、軽度のずり流動化を呈した。Φ=0.3、0.4、0.7、0.8、および0.9の名目上の体積分率でγ=4000秒-1での粘度は、それぞれ、0.0030、0.0035、0.0049、0.0080、0.023Pa.秒であった。懸濁している緩衝液の粘度は、0.0026Pa.秒であった。非ニュートン液体の挙動はせん断応力に依存するので、せん断応力は、平行板配置についての半径の関数であり、ワイセンベルク-ラビノヴィッチ補正を、プレートの周縁部でのずり速度およびせん断応力を決定するため、ならびにトルクM、および半径Rおよびギャップサイズhの平行板の角速度Ωから粘度ηを評定するために適用した。
(実施例2)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。チオール末端基で官能化された線状PEG分子(図13C;PEG-DT、MW 3.4kDa)によって互いに共有結合により連結されたビニルスルホン末端基を含む4アームのポリ(エチレン)グリコール(PEG)モノマー(図13A、PEG-VS、MW 10kDa)を含むヒドロゲルを、チオールマイケル付加化学を介して形成した(図13D)。ヒドロゲルは、溶液のpHによって(図14A、B)、またはトリエチルアミンなどの有機触媒の存在下で即時に(図13B、TEA)、制御された速度で架橋した。ヒドロゲル粒子を、バッチエマルション法を介して調製した。「PEG緩衝液」(10%w/vのPEG 3350、50mMのHEPES、pH5~8)中の10%w/vのPEG-VS/PEG-DT(3:2質量比)を含むプレポリマーおよび100mg/mLのmAb2結晶を、ゲル化が終了するまで(または必要に応じて、ゲル化が、油相を介したトリエチルアミンの添加によって誘導されるまで)、撹拌棒により、200~2000rpmでかき混ぜられた油浴に添加した。得られた架橋したマイクロ粒子を、遠心分離によって回収し、「PEG緩衝液」で4回洗浄して、残った油および過剰の反応物を除去した。このプロセスは、中程度の多分散性を有するマイクロ粒子を生成した(図15A)。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。チオール末端基で官能化された線状PEG分子(図13C;PEG-DT、MW 3.4kDa)によって互いに共有結合により連結されたビニルスルホン末端基を含む4アームのポリ(エチレン)グリコール(PEG)モノマー(図13A、PEG-VS、MW 10kDa)を含むヒドロゲルを、チオールマイケル付加化学を介して形成した(図13D)。ヒドロゲルは、溶液のpHによって(図14A、B)、またはトリエチルアミンなどの有機触媒の存在下で即時に(図13B、TEA)、制御された速度で架橋した。ヒドロゲル粒子を、バッチエマルション法を介して調製した。「PEG緩衝液」(10%w/vのPEG 3350、50mMのHEPES、pH5~8)中の10%w/vのPEG-VS/PEG-DT(3:2質量比)を含むプレポリマーおよび100mg/mLのmAb2結晶を、ゲル化が終了するまで(または必要に応じて、ゲル化が、油相を介したトリエチルアミンの添加によって誘導されるまで)、撹拌棒により、200~2000rpmでかき混ぜられた油浴に添加した。得られた架橋したマイクロ粒子を、遠心分離によって回収し、「PEG緩衝液」で4回洗浄して、残った油および過剰の反応物を除去した。このプロセスは、中程度の多分散性を有するマイクロ粒子を生成した(図15A)。
結晶がロードされたヒドロゲルマイクロ粒子を、明視野における顕微鏡法、および交差偏光子を用いる顕微鏡法によって、特徴付けた。マイクロ粒子は、明視野で不透明であり(図15B)、交差偏光子間で明るく(図15C)、封入された材料が結晶性である可能性があることを指し示した。PBS pH7.4緩衝液への浸漬の際に、粒子は澄明化し、封入された結晶が溶解したことを指し示した(図16A~B)。放出も、時系列にわたって測定し、ブラッドフォードタンパク質アッセイ法を使用して定量化し、放出が数時間以内に終了したことを指し示した(図17)。
(実施例3)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。天然多糖のアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲルは、Ca2+などの二価カチオンの存在下で架橋した。ヒドロゲル粒子を、溶解したカルシウム塩を含有する水浴に液滴を堆積させる遠心押出法を介して調製した。「PEG緩衝液」(10%w/vのPEG 3350、50mMのHEPES、pH7)中の2%w/vのアルギン酸ナトリウムを含むプレポリマーおよび200mg/mLのmAb2結晶を、100~3000RCFで遠心した。得られた架橋したマイクロ粒子を、遠心分離によって回収し、「PEG緩衝液」で4回洗浄して、過剰のカルシウムイオンを除去した。このプロセスは、良好な単分散性または二分散性を有するマイクロ粒子を生成した(図18)。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。天然多糖のアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲルは、Ca2+などの二価カチオンの存在下で架橋した。ヒドロゲル粒子を、溶解したカルシウム塩を含有する水浴に液滴を堆積させる遠心押出法を介して調製した。「PEG緩衝液」(10%w/vのPEG 3350、50mMのHEPES、pH7)中の2%w/vのアルギン酸ナトリウムを含むプレポリマーおよび200mg/mLのmAb2結晶を、100~3000RCFで遠心した。得られた架橋したマイクロ粒子を、遠心分離によって回収し、「PEG緩衝液」で4回洗浄して、過剰のカルシウムイオンを除去した。このプロセスは、良好な単分散性または二分散性を有するマイクロ粒子を生成した(図18)。
結晶がロードされたヒドロゲルマイクロ粒子を、明視野における顕微鏡法、および交差偏光子を用いる顕微鏡法によって、特徴付けた。マイクロ粒子は、明視野で不透明であり(図19A)、交差偏光子間で明るく(図19B)、封入された材料が結晶性である可能性があることを指し示した。PBS pH7.4への浸漬の際に、粒子は澄明化し、封入された結晶が溶解したことを指し示した(図20A、B、C)。図20Aは、t=0でのPBSに浸漬されたアルギネートヒドロゲルミクロスフェアを示す。図20Bは、t=30秒でのPBSに浸漬されたアルギネートヒドロゲルミクロスフェアを示す。図20Cは、t=120秒でのPBSに浸漬されたアルギネートヒドロゲルミクロスフェアを示す。図20A、B、Cにおけるスケールバーは、100μmである。
放出も、120分の時系列にわたって測定し、in situ吸光度プローブを用いるUSP-2溶解装置を使用して定量化し、1時間で放出が終了することを指し示した(図21)。
(仮想実施例4)
以下の仮想実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含むポリペプチド組成物の放出のin vivoラット研究を記載する。最高で56wt%(乾燥基準)のモノクローナル抗体を含有するヒドロゲルミクロスフェアが、図10Dに示され、実施例1に記載されるように、in vitro溶解条件下で4日以内の放出を示すことに留意されたい。この放出速度は、封入されていないmAb2の結晶性懸濁液の類似のin vitro溶解状態下で数時間のin vitro放出速度よりも相対的に低い(実施例1の図10Dにも示す)。in vitro放出データに基づいて、ヒドロゲルによって封入されたmAb2結晶は、動物モデルにおいてin vivoで、長期的な放出および薬理学的活性を示すと予想される。
以下の仮想実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含むポリペプチド組成物の放出のin vivoラット研究を記載する。最高で56wt%(乾燥基準)のモノクローナル抗体を含有するヒドロゲルミクロスフェアが、図10Dに示され、実施例1に記載されるように、in vitro溶解条件下で4日以内の放出を示すことに留意されたい。この放出速度は、封入されていないmAb2の結晶性懸濁液の類似のin vitro溶解状態下で数時間のin vitro放出速度よりも相対的に低い(実施例1の図10Dにも示す)。in vitro放出データに基づいて、ヒドロゲルによって封入されたmAb2結晶は、動物モデルにおいてin vivoで、長期的な放出および薬理学的活性を示すと予想される。
ラットモデルを使用して、ヒドロゲルに封入されたmAb2結晶を、50mg/kgで皮下(SC)投薬する。単回注射後、血液試料を、7日にわたって、定期的に採取する。mAb2の対照製剤を、静脈内(IV)投与のために使用する。mAb2の血中レベルをアッセイし、薬物濃度時間曲線下面積(AUC)、最高濃度(Cmax)、最低濃度(Ctrough)、最高濃度の時間(Tmax)、および抗体の半減期(t1/2)をそれぞれ評価する。試料研究設計を下記に提供する(表4)。IVおよびSC試料間のAUCの比較から、絶対生物学的利用率を算出する。
絶対生物学的利用率=AUCIV/AUCSC
絶対生物学的利用率=AUCIV/AUCSC
(実施例5)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物、およびヒドロゲル粒子サイズを調節する方法を記載する。チオール末端基で官能化された線状PEG分子(PEG-DT、MW 3.4kDa)によって互いに共有結合により連結されたビニルスルホン末端基を含む4アームのポリ(エチレン)グリコール(PEG)モノマー(PEG-VS、MW 10kDa)を含むヒドロゲルを、上記の実施例2に記載されるチオールマイケル付加化学および緩衝液を介して形成し、mAb2結晶を、ヒドロゲルに封入した。mAb2結晶を封入するヒドロゲル粒子のサイズを、粒子形成の間に、触媒の存在および混合条件を調節することによって変更した。ボルテックス混合の低いせん断方法を使用して、1ミクロン~30ミクロンの直径を有するヒドロゲル粒子を用いて、mAb2結晶が積載されたPEG-VSヒドロゲル粒子を作出することができることが観察された。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物、およびヒドロゲル粒子サイズを調節する方法を記載する。チオール末端基で官能化された線状PEG分子(PEG-DT、MW 3.4kDa)によって互いに共有結合により連結されたビニルスルホン末端基を含む4アームのポリ(エチレン)グリコール(PEG)モノマー(PEG-VS、MW 10kDa)を含むヒドロゲルを、上記の実施例2に記載されるチオールマイケル付加化学および緩衝液を介して形成し、mAb2結晶を、ヒドロゲルに封入した。mAb2結晶を封入するヒドロゲル粒子のサイズを、粒子形成の間に、触媒の存在および混合条件を調節することによって変更した。ボルテックス混合の低いせん断方法を使用して、1ミクロン~30ミクロンの直径を有するヒドロゲル粒子を用いて、mAb2結晶が積載されたPEG-VSヒドロゲル粒子を作出することができることが観察された。
ボルテックス混合条件および0.05%v/vのTEA下で形成された結晶がロードされたヒドロゲルマイクロ粒子を、生成し、明視野における顕微鏡法、および交差偏光子を用いる顕微鏡法によって、特徴付けた。図22A~22Cは、10~30ミクロンの直径を有する得られたmAb2結晶が積載されたPEG-VSヒドロゲル粒子の明視野顕微鏡画像(図22Aおよび22C)および交差偏光顕微鏡画像(図22B)を示す。図23A~23Bは、1~5ミクロンの直径を有する得られたmAb2結晶が積載されたPEG-VSヒドロゲル粒子の明視野顕微鏡画像(図23A)および交差偏光顕微鏡画像(図23B)を示す。
超音波処理混合条件下および触媒の存在なしで形成された結晶がロードされたヒドロゲルマイクロ粒子も、生成し、明視野における顕微鏡法、および交差偏光子を用いる顕微鏡法によって、特徴付けた。図24A~24Bは、1ミクロン未満の直径を有する得られたmAb2結晶が積載されたPEG-VSヒドロゲル粒子の明視野顕微鏡画像(図24A)および交差偏光顕微鏡画像(図24B)を示す。図24A~24Bにおいて見られ得るように、mAb2結晶は、これらの小粒子に部分的に封入することができ、および/または小粒子を一緒に架橋することができる。交差偏光画像は、これらのヒドロゲル粒子内の結晶の存在を示唆する。
(実施例6)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。天然多糖のアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲルは、二価カチオンのCa2+の存在下で架橋した。ヒドロゲル粒子を、溶解したカルシウム塩を含有する水浴にプレポリマーの液滴を堆積させる遠心押出法を介して調製した。図25は、遠心押出法のための実験設定の概略的プロセス図を示す。粒子を製造したプロセスを調節して、製造上の考慮事項(一部の例では速いプロセスが所望される)を用いて、相対的に高い封入効率(浴中のmAb2のより少ない喪失に起因する)を有する注射可能な粒子(球状の、より小さく、より柔らかい粒子)を作製した。本開示の文脈では、押出によるアルギネート結晶ヒドロゲルの製造が、別個の課題を提示したと決定された。ずり流動化する結晶の存在が、ヒドロゲル粒子形成に影響を及ぼし、非球状粒子の形状が、一部の例では、ヒドロゲルマイクロ粒子懸濁液の流動に関する性能特性に影響を及ぼすと決定された。加えて、結晶性モノクローナル抗体が、処理全体を通して、時期尚早の溶解を低減または防止する特定の条件から有利であり得ると決定された。これらの課題を克服するために、特定の考慮事項が考慮された。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。天然多糖のアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲルは、二価カチオンのCa2+の存在下で架橋した。ヒドロゲル粒子を、溶解したカルシウム塩を含有する水浴にプレポリマーの液滴を堆積させる遠心押出法を介して調製した。図25は、遠心押出法のための実験設定の概略的プロセス図を示す。粒子を製造したプロセスを調節して、製造上の考慮事項(一部の例では速いプロセスが所望される)を用いて、相対的に高い封入効率(浴中のmAb2のより少ない喪失に起因する)を有する注射可能な粒子(球状の、より小さく、より柔らかい粒子)を作製した。本開示の文脈では、押出によるアルギネート結晶ヒドロゲルの製造が、別個の課題を提示したと決定された。ずり流動化する結晶の存在が、ヒドロゲル粒子形成に影響を及ぼし、非球状粒子の形状が、一部の例では、ヒドロゲルマイクロ粒子懸濁液の流動に関する性能特性に影響を及ぼすと決定された。加えて、結晶性モノクローナル抗体が、処理全体を通して、時期尚早の溶解を低減または防止する特定の条件から有利であり得ると決定された。これらの課題を克服するために、特定の考慮事項が考慮された。
図26A~26Bは、粒子の製造プロセスにおける物理的考慮事項を例示するデータを提供する一方で、図27~28Bは、化学的考慮事項を例示する。図26Aが指し示すように、収集距離(図25に示される)は、粒子形状に影響を及ぼし、粒子は、収集距離の増加につれて、平坦になり得る。観察された平坦化は、より大きい収集距離でのより高い液滴速度に起因したと考えられた。また、遠心力および流速も、ヒドロゲル粒子のジェッティングを低減または防止するために制御することができると決定された。図26Bに見られ得るように、遠心分離スピードは、粒子形態学に影響を及ぼす。
図27は、液滴を受ける水溶液中の塩化カルシウム(CaCl2)の濃度に対する抗体結晶溶解についてのデータ(上)、および漸増CaCl2濃度で得られた粒子の関連する画像(下)を示す。図27は、抗体結晶の安定性を妨害し、結晶の溶解をもたらすことに対するCa2+過剰濃度の効果を例示する。さらにまた、ヒドロゲル粒子が、より高いCa2+濃度で涙滴形状に成長したことが観察された。結果に基づいて、少なくとも一部の実施形態について、5~20mMのCa2+濃度が、所望の製剤を達成するために有利であり得ると決定された。
ポリマー鎖の粘度(例えば、アルギネートの粘度)およびヒドロゲル粒子における分子量の効果を決定するために、4つの異なる種類のアルギネート製剤を試験した。第1の種類は、VLVM(非常に低粘度(<20mPa秒;MW<75kDa)の高マンヌロン酸のアルギネート)であり、第2の種類は、VLVG(非常に低粘度(<20mPa秒;MW<75kDa)の高グルロン酸のアルギネート)であり、第3の種類は、MVG(中程度の粘度(>200mPa秒;MW>200kDa)の高マンヌロン酸のアルギネート)であり、第4の種類は、MVM(中程度の粘度(>200mPa秒;MW>200kDa)の高グルロン酸のアルギネート)であった。図28Aは、mAb2結晶非存在下の1%のVLVGおよびVLVMのヒドロゲルの顕微鏡画像(上)、ならびに250mg/mLの封入されたmAb2結晶を有する1%のVLVGのヒドロゲルの顕微鏡画像(下)を示す。図28Bは、mAb2結晶非存在下の1%のMVGおよびMVMのヒドロゲルの顕微鏡画像(上)、ならびに250mg/mLの封入されたmAb2結晶を有する1%のMVGのヒドロゲルの顕微鏡画像(下)を示す。これらの図に実証されるように、本開示に記載される方法を使用して、1%程度の濃度のアルギネート、および20mPa秒またはそれ未満程度の粘度を有し、その粘度が、ヒドロゲル粒子の形状に影響を及ぼし得る、注射可能なヒドロゲルを作製することができる。
(実施例7)
この実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物の注射性能および安定性の試験を記載する。mAb2結晶を含有するアルギネートヒドロゲル粒子を、実施例3に記載される手順に従って調製した。50mg/mLまたは200mg/mLのいずれかのmAb2結晶ローディングを有する、mAb2結晶が積載されたアルギネートヒドロゲル粒子を含む懸濁液を、注射器にロードし、皮下針から排出された場合に、好ましい流動特性を有することが観察された。mAb2ポリペプチドの安定性および効力が、アルギネートヒドロゲルに封入され、そこから放出された場合に乱れなかったことが観察された。
この実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物の注射性能および安定性の試験を記載する。mAb2結晶を含有するアルギネートヒドロゲル粒子を、実施例3に記載される手順に従って調製した。50mg/mLまたは200mg/mLのいずれかのmAb2結晶ローディングを有する、mAb2結晶が積載されたアルギネートヒドロゲル粒子を含む懸濁液を、注射器にロードし、皮下針から排出された場合に、好ましい流動特性を有することが観察された。mAb2ポリペプチドの安定性および効力が、アルギネートヒドロゲルに封入され、そこから放出された場合に乱れなかったことが観察された。
(実施例8)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。具体的には、アルギネートヒドロゲル粒子によって封入された無定形モノクローナル抗体固体を含む組成物を調製した。無定形mAb2を作製するための前駆体組成物を開発し、16~25mg/mlの濃度でPEG 3350を含めて、無定形mAb2を形成した。図29Aは、無定形mAb2を含む前駆体組成物の顕微鏡画像を示す。無定形mAb前駆体組成物を、1%のアルギネートVLVM(非常に低粘度の高マンヌロン酸リッチのアルギネート)溶液と混ぜ合わせること、および7mmの収集距離で、30Gノズルを使用して、400RCFで上記に記載される遠心押出法を使用することによって、アルギン酸ナトリウムヒドロゲル粒子内部にロードした。図29Bは、得られた無定形mAb2が積載されたアルギネートヒドロゲル粒子組成物の顕微鏡画像を示す。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。具体的には、アルギネートヒドロゲル粒子によって封入された無定形モノクローナル抗体固体を含む組成物を調製した。無定形mAb2を作製するための前駆体組成物を開発し、16~25mg/mlの濃度でPEG 3350を含めて、無定形mAb2を形成した。図29Aは、無定形mAb2を含む前駆体組成物の顕微鏡画像を示す。無定形mAb前駆体組成物を、1%のアルギネートVLVM(非常に低粘度の高マンヌロン酸リッチのアルギネート)溶液と混ぜ合わせること、および7mmの収集距離で、30Gノズルを使用して、400RCFで上記に記載される遠心押出法を使用することによって、アルギン酸ナトリウムヒドロゲル粒子内部にロードした。図29Bは、得られた無定形mAb2が積載されたアルギネートヒドロゲル粒子組成物の顕微鏡画像を示す。
(実施例9)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。天然多糖のアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲルは、二価カチオンのCa2+の存在下で架橋した。ヒドロゲル粒子を、600RCF、およびより高いアルギネート流動を提供する先細ディスペンサーを使用したが、上記に記載される遠心押出法を介して調製した。図30A~30Bは、得られたmAb2結晶が積載されたアルギネートヒドロゲル繊維粒子の明視野顕微鏡画像(図30A)および交差偏光顕微鏡画像(図30B)を示す。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。天然多糖のアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲルは、二価カチオンのCa2+の存在下で架橋した。ヒドロゲル粒子を、600RCF、およびより高いアルギネート流動を提供する先細ディスペンサーを使用したが、上記に記載される遠心押出法を介して調製した。図30A~30Bは、得られたmAb2結晶が積載されたアルギネートヒドロゲル繊維粒子の明視野顕微鏡画像(図30A)および交差偏光顕微鏡画像(図30B)を示す。
(実施例10)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。ゼラチンを含むヒドロゲルを、粒子の熱的ゲル化により形成した。7.4のpHを有し、5%のゼラチン、10%w/vのPEG 3350、50mMのHEPES、およびmAb2結晶を含有するプレポリマー溶液を、上昇させた温度(35~40℃)で調製し、ヒドロゲル粒子を、その後に、4~20℃で、熱によって形成した。ヒドロゲル粒子を、エマルション重合を介して調製した。図31A~31Cは、熱ゲル化およびバッチ乳化重合技法を介して形成されたmAb2結晶が積載されたゼラチンヒドロゲル粒子の顕微鏡画像を示す。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。ゼラチンを含むヒドロゲルを、粒子の熱的ゲル化により形成した。7.4のpHを有し、5%のゼラチン、10%w/vのPEG 3350、50mMのHEPES、およびmAb2結晶を含有するプレポリマー溶液を、上昇させた温度(35~40℃)で調製し、ヒドロゲル粒子を、その後に、4~20℃で、熱によって形成した。ヒドロゲル粒子を、エマルション重合を介して調製した。図31A~31Cは、熱ゲル化およびバッチ乳化重合技法を介して形成されたmAb2結晶が積載されたゼラチンヒドロゲル粒子の顕微鏡画像を示す。
(実施例11)
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。化学的に改変された多糖の部分的に酸化されたアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲル粒子を、部分的に酸化されて、一部の例では、それらの生分解特性が増強された多糖ポリマー鎖から形成した。部分的に酸化されたアルギネートポリマー鎖を、アルギン酸ナトリウムを過ヨウ素酸ナトリウムと反応させることによって調製した。過ヨウ素酸ナトリウムのアルギネート中のウロン酸基に対する比を変更して、1.5%および3%の部分的に酸化されたアルギネートを作製した。ヒドロゲル粒子を、実施例3に記載される技法および条件を使用して形成した。図32Aは、部分的に酸化されたアルギネートを用いて形成されたヒドロゲル粒子の顕微鏡画像を示す。図32Bは、部分的に酸化されたアルギネートを用いて形成されたmAb2結晶が積載されたヒドロゲル粒子の顕微鏡画像を示す。
以下の実施例は、ヒドロゲルによって少なくとも部分的に封入された固体状のポリペプチドを含む組成物を記載する。化学的に改変された多糖の部分的に酸化されたアルギネートを含むヒドロゲルを、イオン架橋により形成した。ヒドロゲル粒子を、部分的に酸化されて、一部の例では、それらの生分解特性が増強された多糖ポリマー鎖から形成した。部分的に酸化されたアルギネートポリマー鎖を、アルギン酸ナトリウムを過ヨウ素酸ナトリウムと反応させることによって調製した。過ヨウ素酸ナトリウムのアルギネート中のウロン酸基に対する比を変更して、1.5%および3%の部分的に酸化されたアルギネートを作製した。ヒドロゲル粒子を、実施例3に記載される技法および条件を使用して形成した。図32Aは、部分的に酸化されたアルギネートを用いて形成されたヒドロゲル粒子の顕微鏡画像を示す。図32Bは、部分的に酸化されたアルギネートを用いて形成されたmAb2結晶が積載されたヒドロゲル粒子の顕微鏡画像を示す。
(実施例12)
以下の実施例は、本開示に記載される手順を使用して形成されたヒドロゲル粒子への曝露の際の細胞の挙動の試験を記載する。図33Aは、図に指し示されるさまざまな粘度および酸化度を有するアルギネートを使用した、0.05%、0.5%および2%v/vのアルギネートヒドロゲル粒子の存在下でのNIH Raw 264.7細胞の細胞生存率のプロットを示す。好適な生存率が、試験されたそれぞれのアルギネートヒドロゲルについて観察された。
以下の実施例は、本開示に記載される手順を使用して形成されたヒドロゲル粒子への曝露の際の細胞の挙動の試験を記載する。図33Aは、図に指し示されるさまざまな粘度および酸化度を有するアルギネートを使用した、0.05%、0.5%および2%v/vのアルギネートヒドロゲル粒子の存在下でのNIH Raw 264.7細胞の細胞生存率のプロットを示す。好適な生存率が、試験されたそれぞれのアルギネートヒドロゲルについて観察された。
図33Bは、図に指し示されるさまざまな粘度および酸化度を有するアルギネートを使用した、0.05%、0.5%および2%v/vのアルギネートヒドロゲル粒子の存在下でのNIH Raw 264.7細胞からのサイトカインのTNFα(腫瘍壊死因子アルファ)分泌の量のプロットを示す。より高い濃度のヒドロゲル粒子が、一般に、細胞からのより多くのTNFαの分泌を誘導したことが観察された。
(実施例13)
以下の実施例は、ヒドロゲル粒子から放出されたポリペプチドの品質の試験を記載する。具体的には、結晶性抗体がロードされたヒドロゲル粒子から放出された抗体の機能的安定性および凝集を評価した。
以下の実施例は、ヒドロゲル粒子から放出されたポリペプチドの品質の試験を記載する。具体的には、結晶性抗体がロードされたヒドロゲル粒子から放出された抗体の機能的安定性および凝集を評価した。
ヒドロゲル処理に供したmAb2結晶の機能性を評価するために、mAb2結晶が積載されたヒドロゲル粒子の試料を、PBSに溶解し、酵素結合免疫吸着検定法によって分析した。ヒドロゲル粒子から溶解したmAb2を有する試料は、効力の喪失を指し示さず、プロセス全体(結晶化、封入、溶解、およびその後の取り扱い)が、アッセイの誤差内で、mAb2の競合的結合機能性に負の影響を及ぼさなかったことを実証した。
mAb2試料の超高性能サイズ排除クロマトグラフィー分析も行って、凝集を評価した。未処置対照mAb2試料(すなわち、遊離mAb2)の試料を、ベースライン測定として試験し、試料の1.1%が凝集体として溶出することを指し示した。mAb2結晶がロードされている200mg/mLのPEGDAヒドロゲルマイクロ粒子から溶解したmAb2の試料を試験し、試料の6.6%が凝集体として溶出することを指し示した。
(実施例14)
以下の実施例は、ヒドロゲル粒子内のおよびそこから放出されたポリペプチドの品質の試験を記載する。具体的には、無定形固体が積載されたmAb2アルギネートヒドロゲル粒子の無定形の性質および機能的安定性を、SONICCおよび酵素結合免疫吸着検定法(ELISA)技法を使用して評価した。
以下の実施例は、ヒドロゲル粒子内のおよびそこから放出されたポリペプチドの品質の試験を記載する。具体的には、無定形固体が積載されたmAb2アルギネートヒドロゲル粒子の無定形の性質および機能的安定性を、SONICCおよび酵素結合免疫吸着検定法(ELISA)技法を使用して評価した。
図34は、無定形mAb2の遊離懸濁液(上行、無定形懸濁液について「AS」と標識される)および無定形mAb2固体が積載されたアルギネートヒドロゲル粒子(下行、封入について「Encap」と標識される)の明視野顕微鏡画像(VIS;左欄)、紫外二光子励起蛍光顕微鏡画像(UV-TPEF;中央欄)、および第二高調波発生顕微鏡画像(SGH;右欄)を示す。図34に示される結果は、天然で結晶性ではなかったmAb2の無定形の固体状形態を、ヒドロゲル粒子内に部分的に封入することができたことを指し示した。
ヒドロゲル処理に供したmAb2結晶の機能性を評価するために、無定形固体mAb2が積載されたアルギネートヒドロゲル粒子の試料を、PBSに溶解し、酵素結合免疫吸着検定法によって分析した。ヒドロゲル粒子から溶解したmAb2を有する試料は、効力の喪失を指し示さず、プロセス全体(固体状のポリペプチドの調製、封入、溶解、およびその後の取り扱い)が、アッセイの誤差内で、mAb2の競合的結合機能性に負の影響を及ぼさなかったことを実証した。
本発明のいくつかの実施形態を、本明細書に記載および例示したが、当業者は、本明細書に記載される、機能を行うため、ならびに/あるいはその結果および/またはその1つもしくは複数の利点を得るために、各種の他の手段および/または構造を容易に構想し、そして、そのような変形形態および/または改変のそれぞれは、本発明の範囲内であると見なされる。より一般的に、当業者は、本明細書に記載されるすべてのパラメーター、寸法、材料および配置が、例示的であることを意味すること、ならびに実際のパラメーター、寸法、材料および/または配置が、本発明の教示が使用される具体的な1つまたは複数の適用に依存することを容易に認識するであろう。当業者は、単なるルーチン実験を使用して、本明細書に記載される本発明の具体的な実施形態に対する多くの均等物を、認識するか、またはそれを解明することができるであろう。したがって、前述の実施形態が、例としてのみ提示され、添付の特許請求の範囲およびその均等物の範囲内で、本発明が、具体的に記載されたおよび特許請求の範囲に記載された以外の方法で実施されてもよいことが理解されるべきである。本発明は、本明細書に記載されるそれぞれ個々の特長、系、物品、材料、および/または方法を対象とする。加えて、2つまたはそれよりも多くのそのような特長、系、物品、材料、および/または方法の任意の組合せは、そのような特長、系、物品、材料、および/または方法が互いに矛盾しない場合、本発明の範囲内に含まれる。
本明細書で使用される場合、本明細書および本特許請求の範囲における不定冠詞の「a」および「an」は、明確に反対のことが指し示されない限り、「少なくとも1つ」を意味すると理解されるものとする。
本明細書で使用される場合、本明細書および本特許請求の範囲における「および/または」という語句は、そのように結合される要素、すなわち、一部の場合では結合的に存在し、他の場合では選言的に存在する要素の「いずれかまたは両方」を意味すると理解されるものとする。明確に反対のことが指し示されない限り、具体的に特定された要素に関連するまたは関連しないにかかわらず、他の要素が、必要に応じて、「および/または」節によって具体的に特定される要素以外に存在していてもよい。したがって、非限定的な例として、「Aおよび/またはB」への言及は、「含む」などのオープンエンドの語句と併せて使用される場合、一実施形態では、BなしのA(必要に応じて、B以外の要素を含む)、別の実施形態では、AなしのB(必要に応じて、A以外の要素を含む)、さらに別の実施形態では、AおよびBの両方(必要に応じて、他の要素を含む)などを指し得る。
本明細書で使用される場合、本明細書および本特許請求の範囲において、「または」は、上記に定義された「および/または」と同じ意味を有すると理解されるものとする。例えば、リスト中の項目を分離する場合、「または」または「および/または」は、包括的である、すなわち、いくつかの要素または要素のリスト、および必要に応じて追加のリストされていない項目の少なくとも1つを包含するが、2つ以上を含むとして解釈されるものとする。「~の1つのみ」または「~の正確に1つ」、または特許請求の範囲で使用される場合、「~からなる」などの、明確に反対のことを指し示す用語のみが、いくつかの要素または要素のリストの正確に1つの要素の包含を指す。一般に、本明細書で使用される場合、「または」という用語は、「いずれか」、「~の1つ」、「~の1つのみ」または「~の正確に1つ」などの排他的な用語によって先行される場合、排他的な選択肢(すなわち、「1つ、または両方ではなく一方」)を指し示すとして解釈されるのみとする。「から本質的になる」は、特許請求の範囲で使用される場合、特許法の分野で使用されるその通常の意味を有するものとする。
本明細書で使用される場合、本明細書および本特許請求の範囲において、1つまたは複数の要素のリストへの言及における「少なくとも1つ」という語句は、要素のリスト中の要素のいずれか1つまたは複数から選択される少なくとも1つの要素を意味するが、必ずしも要素のリスト内の具体的にリストされたそれぞれのおよびすべての要素の少なくとも1つを含まず、要素のリスト中の要素の任意の組合せを排除しないと理解されるものとする。この定義はまた、具体的に特定された要素に関連するまたは関連しないにかかわらず、必要に応じて、「少なくとも1つ」という語句が指す要素のリスト内で具体的に特定された要素以外の要素が存在していてもよいことを可能にする。そのため、非限定的な例として、「AおよびBの少なくとも1つ」(または同等に「AまたはBの少なくとも1つ」、または同等に「Aおよび/またはBの少なくとも1つ」)は、一実施形態では、必要に応じて2つ以上を含む、少なくとも1つのAであって、Bは存在しない(および必要に応じて、B以外の要素を含む);別の実施形態では、必要に応じて2つ以上を含む、少なくとも1つのBであって、Aは存在しない(および必要に応じて、A以外の要素を含む);さらに別の実施形態では、必要に応じて2つ以上を含む、少なくとも1つのA、および必要に応じて2つ以上を含む、少なくとも1つのB(および必要に応じて、他の要素を含む)などを指し得る。
特許請求の範囲では、上記の明細書と同様に、「含む(comprising)」、「含む(including)」、「持つ(carrying)」、「有する(having)」、「含有する(containing)」、「伴う(involving)」、「保つ(holding)」などのようなすべての移行句は、オープンエンドである、すなわち、それに限定されないが、含む、を意味すると理解されるべきである。「からなる」および「から本質的になる」という移行句のみが、米国特許庁の米国特許審査便覧セクション2111.03に記載されるように、それぞれ、クローズドまたは半クローズドの移行句であるものとする。
配列表
本出願は、コンピューター可読形態(CRF)の配列表の写しとともに出願される。2021年7月30日に作出され、9,726バイトのサイズのM092570816WO00-SEQ-TJO.txtという名称のCRFは、その全体が参照により本明細書に組み込まれる。
本出願は、コンピューター可読形態(CRF)の配列表の写しとともに出願される。2021年7月30日に作出され、9,726バイトのサイズのM092570816WO00-SEQ-TJO.txtという名称のCRFは、その全体が参照により本明細書に組み込まれる。
Claims (75)
- ヒドロゲル、および
前記ヒドロゲルによって少なくとも部分的に封入された、固体状のポリペプチドを含む結晶
を含む組成物。 - 1mg/mLよりも大きいまたはそれに等しく、かつ500mg/mL未満またはそれに等しい量で存在する固体状のポリペプチドを含む結晶
を含む組成物であって、
前記組成物が、その他の点では本質的に同一の条件下で、同等の濃度の結晶性ポリペプチドを有する水性懸濁液の動的粘度の1.1分の1以下の動的粘度を有する、
組成物。 - 10wt%未満またはそれに等しい結晶が凝集するように、1種または複数のヒドロゲルと会合した固体状のポリペプチドを含む結晶
を含む組成物。 - ヒドロゲル粒子、および
前記ヒドロゲル粒子によって少なくとも部分的に封入された固体状のポリペプチド
を含む組成物。 - 前記結晶性ポリペプチドが、担体によって少なくとも部分的に封入されている、請求項2~3のいずれか一項に記載の組成物。
- 前記担体が、ヒドロゲルを含む、請求項5に記載の組成物。
- 前記固体状のポリペプチドを含む前記結晶が、50mg/mLよりも大きいまたはそれに等しく、かつ500mg/mL未満またはそれに等しい量で存在し、前記組成物が、その他の点では本質的に同一の条件下で、同等の濃度の結晶性ポリペプチドを有する水性懸濁液の動的粘度の4分の1以下の動的粘度を有する、
請求項2~3および6のいずれか一項に記載の組成物。 - 前記ヒドロゲルが、共有結合により架橋されたポリマー鎖、イオンにより架橋されたポリマー鎖、および/または熱により架橋されたポリマー鎖を含む、請求項1、4および6~7のいずれか一項に記載の組成物。
- 前記架橋されたポリマー鎖が、75kDa未満またはそれに等しい分子量を有するポリマー鎖から形成されている、請求項8に記載の組成物。
- 前記イオンにより架橋されたポリマー鎖が、金属イオンを介して架橋されている、請求項8~9のいずれか一項に記載の組成物。
- 前記ヒドロゲルが、架橋されたポリアルキレンオキシドを含む、請求項1、4および6~10のいずれか一項に記載の組成物。
- 前記ポリアルキレンオキシドが、ポリエチレングリコールを含む、請求項11に記載の組成物。
- 前記ヒドロゲルが、架橋された多糖を含む、請求項1、4および6~12のいずれか一項に記載の組成物。
- 前記多糖が、アルギネートを含む、請求項13に記載の組成物。
- 前記多糖が、少なくとも部分的に酸化されたアルギネートを含む、請求項13~14のいずれか一項に記載の組成物。
- 前記多糖が、アガロースを含む、請求項13~15のいずれか一項に記載の組成物。
- 前記ヒドロゲルが、ポリペプチド鎖を含む、請求項1、4および6~16のいずれか一項に記載の組成物。
- 前記ヒドロゲルが、ゼラチンを含む、請求項1、4および6~17のいずれか一項に記載の組成物。
- 前記ヒドロゲルの少なくとも一部が、球、球状または繊維状の形状を有する粒子の形態である、請求項1、4および6~18のいずれか一項に記載の組成物。
- 前記粒子が、100ミクロンよりも大きいまたはそれに等しく、かつ300ミクロン未満またはそれに等しい平均最大断面寸法を有する、請求項19に記載の組成物。
- 前記粒子が、10ミクロンよりも大きいまたはそれに等しく、かつ100ミクロン未満またはそれに等しい平均最大断面寸法を有する、請求項19に記載の組成物。
- 前記粒子が、1ミクロンよりも大きいまたはそれに等しく、かつ30ミクロン未満またはそれに等しい平均最大断面寸法を有する、請求項19に記載の組成物。
- 前記粒子が、1ミクロンよりも大きいまたはそれに等しく、かつ10ミクロン未満またはそれに等しい平均最大断面寸法を有する、請求項19に記載の組成物。
- 前記粒子が、1ミクロン未満またはそれに等しい平均最大断面寸法を有する、請求項19に記載の組成物。
- 前記組成物が、結晶性ポリペプチドを5wt%よりも多いまたはそれに等しい量で含む、請求項1~24のいずれか一項に記載の組成物。
- リン酸緩衝生理食塩水溶液への曝露の際に、90%未満またはそれに等しい前記ポリペプチドが、前記曝露5時間後に、液体に放出される、請求項1~25のいずれか一項に記載の組成物。
- 前記ポリペプチドが、酵素結合免疫吸着活性アッセイによって測定して、前記組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間、活性である、請求項1~26のいずれか一項に記載の組成物。
- 10%以下の前記ポリペプチドが、前記組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間後に分解または凝集する、請求項1~27のいずれか一項に記載の組成物。
- 少なくとも90%の前記ポリペプチドが、前記組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間後にそのネイティブ状態でフォールドされている、請求項1~28のいずれか一項に記載の組成物。
- 前記固体状の前記ポリペプチドを含む前記結晶が、キラル結晶の二次非線形イメージング技法によって測定して、前記組成物の形成後、5℃で24か月よりも長いまたはそれに等しい期間、結晶性である、請求項1~29のいずれか一項に記載の組成物。
- 前記組成物が、その他の点では本質的に同一の条件下で、同等の濃度の非封入非結晶性ポリペプチドを有する水性懸濁液の動的粘度の50分の1以下の動的粘度を有する、請求項1~30のいずれか一項に記載の組成物。
- 前記組成物が、25℃の温度および100秒-1のずり速度下で、0.3Pa秒未満またはそれに等しい動的粘度を有する、請求項1~31のいずれか一項に記載の組成物。
- 前記ポリペプチドが、治療用ポリペプチドとして、予防用ポリペプチドとして、または治療用ポリペプチドおよび予防用ポリペプチドの両方としての機能を果たすことができる、請求項1~32のいずれか一項に記載の組成物。
- 前記ポリペプチドが、第1の治療剤および/または予防剤であり、前記組成物が、第2の治療剤および/または予防剤をさらに含む、請求項1~33のいずれか一項に記載の組成物。
- 前記ポリペプチドが、抗体である、請求項1~34のいずれか一項に記載の組成物。
- 前記ポリペプチドが、モノクローナル抗体である、請求項1~35のいずれか一項に記載の組成物。
- 前記ポリペプチドが、IgGの任意のサブタイプのモノクローナル抗体である、請求項1~36のいずれか一項に記載の組成物。
- 前記ポリペプチドが、抗PD-1抗体である、請求項1~36のいずれか一項に記載の組成物。
- 前記ポリペプチドが、それぞれ、配列番号1、2および3に記載されるアミノ酸の配列を含む軽鎖(LC)相補性決定領域(CDR)のLC-CDR1、LC-CDR2およびLC-CDR3、ならびにそれぞれ、配列番号6、7および8に記載されるアミノ酸の配列を含む重鎖(HC)CDRのHC-CDR1、HC-CDR2およびHC-CDR3を含む抗PD-1抗体である、請求項1~38のいずれか一項に記載の組成物。
- 前記ポリペプチドが、配列番号9に記載されるアミノ酸の配列または配列番号9のバリアントを含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列または配列番号4のバリアントを含む軽鎖可変領域を含む抗PD-1抗体である、請求項1~39のいずれか一項に記載の組成物。
- 前記ポリペプチドが、配列番号9に記載されるアミノ酸の配列を含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列を含む軽鎖可変領域を含む抗PD-1抗体である、請求項1~40のいずれか一項に記載の組成物。
- 前記抗PD-1抗体が、配列番号10に記載されるアミノ酸の配列または配列番号10のバリアントを含む重鎖、および配列番号5に記載されるアミノ酸の配列または配列番号5のバリアントを含む軽鎖を含むモノクローナル抗体である、請求項38~41のいずれか一項に記載の組成物。
- 前記抗PD-1抗体が、配列番号10に記載されるアミノ酸の配列を含む重鎖、および配列番号5に記載されるアミノ酸の配列を含む軽鎖を含むモノクローナル抗体である、請求項38~42のいずれか一項に記載の組成物。
- 前記抗PD-1抗体が、ペムブロリズマブまたはペムブロリズマブバリアントである、請求項38に記載の組成物。
- 前記抗PD-1抗体が、ペムブロリズマブである、請求項38に記載の組成物。
- 1つまたは複数の前記結晶が、カフェインと複合体化した固体状のペムブロリズマブを含む、請求項1~3および5~45のいずれか一項に記載の組成物。
- 1つまたは複数の前記結晶が、
(a)(i)ペムブロリズマブまたはペムブロリズマブバリアントの水性緩衝溶液、
(ii)ポリエチレングリコール(PEG)、ならびに
(iii)カフェイン、テオフィリン、2’デオキシグアノシン-5’-一リン酸、生理活性ジベレリン、および前記生理活性ジベレリンの薬学的に許容される塩からなる群から選択される添加物
を混合して、結晶化溶液を形成すること、
(b)結晶形成のために十分な期間、前記結晶化溶液をインキュベートすること、ならびに
(c)前記溶液から結晶性ペムブロリズマブまたはペムブロリズマブバリアントを回収すること
を含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含む、請求項1~3および5~46のいずれか一項に記載の組成物。 - 前記添加物が、カフェインである、請求項47に記載の組成物。
- 1つまたは複数の前記結晶が、結晶形成に十分な時間、少なくとも25℃であり、かつ50℃以下である温度で、ペムブロリズマブまたはペムブロリズマブバリアントを含む溶液を沈殿溶液に曝露することを含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含み、前記沈殿溶液が、4.0~5.0のpHを有し、1.0M~2.5Mのリン酸二水素アンモニウムを含む、請求項1~3および5~45のいずれか一項に記載の組成物。
- 前記沈殿溶液が、(a)1.5M~2.0Mのリン酸二水素アンモニウムおよび100~120mMのトリスHCl、または(b)1.9Mのリン酸二水素アンモニウムおよび0.09Mのリン酸水素アンモニウムを含む、請求項49に記載の組成物。
- 前記固体状の前記ポリペプチドの少なくとも一部が、結晶の形態である、請求項4および8~50のいずれか一項に記載の組成物。
- 前記固体状の前記ポリペプチドの少なくとも一部が、無定形固体の形態である、請求項4および8~51のいずれか一項に記載の組成物。
- ポリペプチドを送達する方法であって、
ヒドロゲルおよび固体状のポリペプチドを含む組成物を患者に投与することを含み、前記ポリペプチドが、前記ヒドロゲルによって少なくとも部分的に封入されている、
方法。 - 前記組成物を前記患者に投与することが、前記組成物を前記患者に注射することを含む、請求項53に記載の方法。
- 前記患者に注射することが、前記組成物が4000秒-1よりも大きいまたはそれに等しいずり速度を経験するように、前記組成物を開口部に通過させることを含む、請求項53~54のいずれか一項に記載の方法。
- 前記ポリペプチドが、治療用ポリペプチドとして、予防用ポリペプチドとして、または治療用ポリペプチドおよび予防用ポリペプチドの両方としての機能を果たすことができる、請求項53~55のいずれか一項に記載の方法。
- 前記固体状のポリペプチドの少なくとも一部が、結晶の形態である、請求項53~56のいずれか一項に記載の方法。
- 前記固体状の前記ポリペプチドの少なくとも一部が、無定形固体の形態である、請求項53~57のいずれか一項に記載の方法。
- 前記ポリペプチドが、抗体である、請求項53~58のいずれか一項に記載の方法。
- 前記ポリペプチドが、モノクローナル抗体である、請求項53~59のいずれか一項に記載の方法。
- 前記ポリペプチドが、IgGの任意のサブタイプのモノクローナル抗体である、請求項53~60のいずれか一項に記載の方法。
- 前記ポリペプチドが、抗PD-1抗体である、請求項53~61のいずれか一項に記載の方法。
- 前記ポリペプチドが、それぞれ、配列番号1、2および3に記載されるアミノ酸の配列を含む軽鎖(LC)相補性決定領域(CDR)のLC-CDR1、LC-CDR2およびLC-CDR3、ならびにそれぞれ、配列番号6、7および8に記載されるアミノ酸の配列を含む重鎖(HC)CDRのHC-CDR1、HC-CDR2およびHC-CDR3を含む抗PD-1抗体である、請求項53~62のいずれか一項に記載の方法。
- 前記ポリペプチドが、配列番号9に記載されるアミノ酸の配列または配列番号9のバリアントを含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列または配列番号4のバリアントを含む軽鎖可変領域を含む抗PD-1抗体である、請求項53~63のいずれか一項に記載の方法。
- 前記ポリペプチドが、配列番号9に記載されるアミノ酸の配列を含む重鎖可変領域、および配列番号4に記載されるアミノ酸の配列を含む軽鎖可変領域を含む抗PD-1抗体である、請求項53~64のいずれか一項に記載の方法。
- 前記抗PD-1抗体が、配列番号10に記載されるアミノ酸の配列または配列番号10のバリアントを含む重鎖、および配列番号5に記載されるアミノ酸の配列または配列番号5のバリアントを含む軽鎖を含むモノクローナル抗体である、請求項62~65のいずれか一項に記載の方法。
- 前記抗PD-1抗体が、配列番号10に記載されるアミノ酸の配列を含む重鎖、および配列番号5に記載されるアミノ酸の配列を含む軽鎖を含むモノクローナル抗体である、請求項62~66のいずれか一項に記載の方法。
- 前記抗PD-1抗体が、ペムブロリズマブまたはペムブロリズマブバリアントである、請求項62に記載の方法。
- 前記抗PD-1抗体が、ペムブロリズマブである、請求項62に記載の方法。
- 前記結晶が、カフェインと複合体化した固体状のペムブロリズマブを含む、請求項57~69のいずれか一項に記載の方法。
- 前記結晶が、
(a)(i)ペムブロリズマブまたはペムブロリズマブバリアントの水性緩衝溶液、
(ii)ポリエチレングリコール(PEG)、ならびに
(iii)カフェイン、テオフィリン、2’デオキシグアノシン-5’-一リン酸、生理活性ジベレリン、および前記生理活性ジベレリンの薬学的に許容される塩からなる群から選択される添加物
を混合して、結晶化溶液を形成すること、
(b)結晶形成のために十分な期間、前記結晶化溶液をインキュベートすること、ならびに
(c)前記溶液から結晶性ペムブロリズマブまたはペムブロリズマブバリアントを回収すること
を含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含む、請求項57~70のいずれか一項に記載の方法。 - 前記添加物が、カフェインである、請求項71に記載の方法。
- 1つまたは複数の前記結晶が、結晶形成に十分な時間、少なくとも25℃であり、かつ50℃以下である温度で、ペムブロリズマブまたはペムブロリズマブバリアントを含む溶液を沈殿溶液に曝露することを含む方法によって生成された固体状のペムブロリズマブまたはペムブロリズマブバリアントを含み、前記沈殿溶液が、4.0~5.0のpHを有し、1.0M~2.5Mのリン酸二水素アンモニウムを含む、請求項57~69のいずれか一項に記載の方法。
- 前記沈殿溶液が、(a)1.5M~2.0Mのリン酸二水素アンモニウムおよび100~120mMのトリスHCl、または(b)1.9Mのリン酸二水素アンモニウムおよび0.09Mのリン酸水素アンモニウムを含む、請求項73に記載の方法。
- 前記組成物が、請求項1~52に記載の組成物のいずれか1つである、請求項53~74のいずれか一項に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202063059477P | 2020-07-31 | 2020-07-31 | |
| US63/059,477 | 2020-07-31 | ||
| PCT/US2021/043916WO2022026839A2 (en) | 2020-07-31 | 2021-07-30 | Compositions including solid forms of polypeptides and related methods |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2024506115Atrue JP2024506115A (ja) | 2024-02-09 |
| JPWO2022026839A5 JPWO2022026839A5 (ja) | 2024-07-26 |
Family
ID=80038127
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023506227APendingJP2024506115A (ja) | 2020-07-31 | 2021-07-30 | 固体状のポリペプチドを含む組成物および関連する方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20250092138A1 (ja) |
| EP (1) | EP4188470A4 (ja) |
| JP (1) | JP2024506115A (ja) |
| KR (1) | KR20230053614A (ja) |
| CN (1) | CN117615803A (ja) |
| AU (1) | AU2021316104A1 (ja) |
| BR (1) | BR112023001373A2 (ja) |
| CA (1) | CA3185871A1 (ja) |
| MX (1) | MX2023001341A (ja) |
| WO (1) | WO2022026839A2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4284834A1 (en) | 2021-01-29 | 2023-12-06 | Merck Sharp & Dohme LLC | Compositions of programmed death receptor 1 (pd-1) antibodies and methods of obtaining the compositions thereof |
| WO2024030186A1 (en)* | 2022-08-03 | 2024-02-08 | The Regents Of The University Of California | Compositions and methods related to microgels |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010017369A2 (en)* | 2008-08-08 | 2010-02-11 | University Of Delaware | Macromolecular diffusion and release from self-assembled b-hairpin peptide hydrogels |
| US20150147337A1 (en)* | 2012-06-27 | 2015-05-28 | Merck Sharp & Dohme Corp. | Crystalline anti-human il-23 antibodies |
| WO2017191323A1 (en)* | 2016-05-05 | 2017-11-09 | Universidad De Granada | Pharmaceutically active protein crystals grown in-situ within a hydrogel |
| US20180071215A1 (en)* | 2013-12-18 | 2018-03-15 | Massachusetts Institute Of Technology | Core-shell particles for controlled release |
| JP2018510142A (ja)* | 2015-02-27 | 2018-04-12 | メルク・シャープ・アンド・ドーム・コーポレーションMerck Sharp & Dohme Corp. | 抗ヒトpd−1モノクローナル抗体の結晶 |
| WO2019118686A1 (en)* | 2017-12-13 | 2019-06-20 | North Carolina State University | Compositions comprising chemotherapeutic agents and checkpoint inhibitors and methods of use |
| WO2019213522A1 (en)* | 2018-05-03 | 2019-11-07 | University Of Florida Research Foundation | Compositions and methods relating to molecular cerium-oxide nanoclusters |
| WO2020092233A1 (en)* | 2018-10-31 | 2020-05-07 | Merck Sharp & Dohme Corp. | Anti-human pd-1 antibody crystals and methods of use thereof |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH11510837A (ja)* | 1995-07-28 | 1999-09-21 | フォーカル,インコーポレイテッド | 薬物送達のための制御された放出薬剤および組織処置薬剤としての使用のためのマルチブロック生分解性ヒドロゲル |
| US20220016250A1 (en)* | 2018-05-03 | 2022-01-20 | Joel Schneider | Peptide hydrogels for delivery of immunosuppressive drugs and uses thereof |
- 2021
- 2021-07-30JPJP2023506227Apatent/JP2024506115A/jaactivePending
- 2021-07-30CNCN202180065336.4Apatent/CN117615803A/zhactivePending
- 2021-07-30EPEP21851445.3Apatent/EP4188470A4/enactivePending
- 2021-07-30AUAU2021316104Apatent/AU2021316104A1/enactivePending
- 2021-07-30CACA3185871Apatent/CA3185871A1/enactivePending
- 2021-07-30MXMX2023001341Apatent/MX2023001341A/esunknown
- 2021-07-30BRBR112023001373Apatent/BR112023001373A2/ptunknown
- 2021-07-30USUS18/018,660patent/US20250092138A1/enactivePending
- 2021-07-30KRKR1020237006425Apatent/KR20230053614A/koactivePending
- 2021-07-30WOPCT/US2021/043916patent/WO2022026839A2/ennot_activeCeased
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010017369A2 (en)* | 2008-08-08 | 2010-02-11 | University Of Delaware | Macromolecular diffusion and release from self-assembled b-hairpin peptide hydrogels |
| US20150147337A1 (en)* | 2012-06-27 | 2015-05-28 | Merck Sharp & Dohme Corp. | Crystalline anti-human il-23 antibodies |
| US20180071215A1 (en)* | 2013-12-18 | 2018-03-15 | Massachusetts Institute Of Technology | Core-shell particles for controlled release |
| JP2018510142A (ja)* | 2015-02-27 | 2018-04-12 | メルク・シャープ・アンド・ドーム・コーポレーションMerck Sharp & Dohme Corp. | 抗ヒトpd−1モノクローナル抗体の結晶 |
| WO2017191323A1 (en)* | 2016-05-05 | 2017-11-09 | Universidad De Granada | Pharmaceutically active protein crystals grown in-situ within a hydrogel |
| WO2019118686A1 (en)* | 2017-12-13 | 2019-06-20 | North Carolina State University | Compositions comprising chemotherapeutic agents and checkpoint inhibitors and methods of use |
| WO2019213522A1 (en)* | 2018-05-03 | 2019-11-07 | University Of Florida Research Foundation | Compositions and methods relating to molecular cerium-oxide nanoclusters |
| WO2020092233A1 (en)* | 2018-10-31 | 2020-05-07 | Merck Sharp & Dohme Corp. | Anti-human pd-1 antibody crystals and methods of use thereof |
Non-Patent Citations (1)
| Title |
|---|
| ADVANCED THERAPEUTICS, vol. 4, no. 4, JPN6025031628, 20 January 2021 (2021-01-20), ISSN: 0005654170* |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2022026839A2 (en) | 2022-02-03 |
| MX2023001341A (es) | 2023-02-27 |
| KR20230053614A (ko) | 2023-04-21 |
| EP4188470A4 (en) | 2024-11-06 |
| AU2021316104A1 (en) | 2023-02-16 |
| BR112023001373A2 (pt) | 2023-02-14 |
| US20250092138A1 (en) | 2025-03-20 |
| CA3185871A1 (en) | 2022-02-03 |
| WO2022026839A9 (en) | 2022-03-31 |
| CN117615803A (zh) | 2024-02-27 |
| EP4188470A2 (en) | 2023-06-07 |
| WO2022026839A3 (en) | 2022-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Huo et al. | A new class of silica cross-linked micellar core− shell nanoparticles | |
| Wanakule et al. | Nano-inside-micro: Disease-responsive microgels with encapsulated nanoparticles for intracellular drug delivery to the deep lung | |
| Hourdet et al. | Small-angle neutron scattering study of microphase separation in thermoassociative copolymers | |
| Fletcher et al. | Controlled delivery of antibodies from injectable hydrogels | |
| JP2024506115A (ja) | 固体状のポリペプチドを含む組成物および関連する方法 | |
| JP2014514275A (ja) | タンパク質ナノ粒子分散系 | |
| JP2010509243A5 (ja) | ||
| US20070237821A1 (en) | Nanogel-based contrast agents for optical molecular imaging | |
| CN110496104A (zh) | 一种载有ICIs单抗的载药微球及其制备方法 | |
| US20230414716A1 (en) | Sustained release formulations using non-aqueous emulsions | |
| Erfani et al. | Crystalline antibody‐laden alginate particles: a platform for enabling high concentration subcutaneous delivery of antibodies | |
| Zhang et al. | Histone deacetylase inhibitor-loaded calcium alginate microspheres for acute kidney injury treatment | |
| Schieferstein et al. | Hydrogel microsphere encapsulation enhances the flow properties of monoclonal antibody crystal formulations | |
| Lapenna et al. | Poly (glutamic acid)-Based Viscosity Reducers for Concentrated Formulations of a Monoclonal IgG Antibody | |
| Baniahmad et al. | Affinity-controlled capture and release of engineered monoclonal antibodies by macroporous dextran hydrogels using coiled-coil interactions | |
| Mukhopadhyay et al. | Amyloid-like aggregation in native protein and its suppression in the bio-conjugated counterpart | |
| US12239687B2 (en) | Sustained release formulations using non-aqueous membrane emulsification | |
| TWI653058B (zh) | Embedding microsphere and manufacturing method thereof | |
| Hamrin | Aggregation mechanisms of proteins in liquid formulations | |
| Fiaschini et al. | Application of Microsponge Drug Platform to Enhance Methotrexate Administration in Rheumatoid Arthritis Therapy | |
| KR20230079127A (ko) | 하이드로겔 물질 | |
| EA047559B1 (ru) | Составы длительного высвобождения с использованием неводных эмульсий | |
| AU2025234155A1 (en) | Sustained release formulations using non-aqueous membrane emulsification | |
| EA048265B1 (ru) | Составы с замедленным высвобождением с применением неводного мембранного эмульгирования | |
| Blackburn | Microgel bioconjugates for targeted delivery to cancer cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A821 Effective date:20230329 | |
| A711 | Notification of change in applicant | Free format text:JAPANESE INTERMEDIATE CODE: A712 Effective date:20230329 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20231024 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20231221 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20240718 | |
| A621 | Written request for application examination | Free format text:JAPANESE INTERMEDIATE CODE: A621 Effective date:20240718 | |
| A131 | Notification of reasons for refusal | Free format text:JAPANESE INTERMEDIATE CODE: A131 Effective date:20250731 |