JP2024134421A - Thiol compound, crosslinking agent, curable composition and cured product - Google Patents
Thiol compound, crosslinking agent, curable composition and cured productDownload PDFInfo
- Publication number
- JP2024134421A JP2024134421AJP2023044719AJP2023044719AJP2024134421AJP 2024134421 AJP2024134421 AJP 2024134421AJP 2023044719 AJP2023044719 AJP 2023044719AJP 2023044719 AJP2023044719 AJP 2023044719AJP 2024134421 AJP2024134421 AJP 2024134421A
- Authority
- JP
- Japan
- Prior art keywords
- group
- crosslinking agent
- general formula
- linking group
- atoms
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- -1Thiol compoundChemical class0.000titleclaimsabstractdescription59
- 239000003431cross linking reagentSubstances0.000titleclaimsdescription107
- 239000000203mixtureSubstances0.000titleclaimsdescription51
- 125000005647linker groupChemical group0.000claimsabstractdescription49
- 125000004429atomChemical group0.000claimsabstractdescription28
- 125000004430oxygen atomChemical groupO*0.000claimsabstractdescription9
- ZOXJGFHDIHLPTG-UHFFFAOYSA-NBoronChemical group[B]ZOXJGFHDIHLPTG-UHFFFAOYSA-N0.000claimsabstractdescription8
- 229910052796boronInorganic materials0.000claimsabstractdescription8
- 150000001875compoundsChemical class0.000claimsdescription66
- 238000006243chemical reactionMethods0.000claimsdescription55
- 125000001424substituent groupChemical group0.000claimsdescription7
- 239000000463materialSubstances0.000claimsdescription6
- 125000000843phenylene groupChemical groupC1(=C(C=CC=C1)*)*0.000claimsdescription4
- 239000004971Cross linkerSubstances0.000abstractdescription46
- 239000007788liquidSubstances0.000abstractdescription15
- 238000005259measurementMethods0.000description53
- 239000012528membraneSubstances0.000description51
- 125000003396thiol groupChemical group[H]S*0.000description45
- 229920002153Hydroxypropyl cellulosePolymers0.000description43
- 239000001863hydroxypropyl celluloseSubstances0.000description43
- 235000010977hydroxypropyl celluloseNutrition0.000description43
- 239000000243solutionSubstances0.000description42
- 1250000039032-propenyl groupChemical group[H]C([*])([H])C([H])=C([H])[H]0.000description40
- 239000000758substrateSubstances0.000description34
- 125000002947alkylene groupChemical group0.000description31
- 239000005062PolybutadieneSubstances0.000description29
- 229920002857polybutadienePolymers0.000description29
- OZAIFHULBGXAKX-UHFFFAOYSA-N2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrileChemical compoundN#CC(C)(C)N=NC(C)(C)C#NOZAIFHULBGXAKX-UHFFFAOYSA-N0.000description28
- WYURNTSHIVDZCO-UHFFFAOYSA-NTetrahydrofuranChemical compoundC1CCOC1WYURNTSHIVDZCO-UHFFFAOYSA-N0.000description25
- 238000000425proton nuclear magnetic resonance spectrumMethods0.000description25
- 238000001157Fourier transform infrared spectrumMethods0.000description22
- 238000001460carbon-13 nuclear magnetic resonance spectrumMethods0.000description22
- 239000002904solventSubstances0.000description20
- 229910052782aluminiumInorganic materials0.000description19
- XAGFODPZIPBFFR-UHFFFAOYSA-NaluminiumChemical compound[Al]XAGFODPZIPBFFR-UHFFFAOYSA-N0.000description19
- 238000006467substitution reactionMethods0.000description19
- 125000004432carbon atomChemical groupC*0.000description16
- CSNNHWWHGAXBCP-UHFFFAOYSA-LMagnesium sulfateChemical compound[Mg+2].[O-][S+2]([O-])([O-])[O-]CSNNHWWHGAXBCP-UHFFFAOYSA-L0.000description14
- 238000010438heat treatmentMethods0.000description14
- XMLYCEVDHLAQEL-UHFFFAOYSA-N2-hydroxy-2-methyl-1-phenylpropan-1-oneChemical compoundCC(C)(O)C(=O)C1=CC=CC=C1XMLYCEVDHLAQEL-UHFFFAOYSA-N0.000description13
- 230000015572biosynthetic processEffects0.000description13
- 238000004132cross linkingMethods0.000description13
- 125000000740n-pentyl groupChemical group[H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])*0.000description13
- 238000003786synthesis reactionMethods0.000description13
- OXBLVCZKDOZZOJ-UHFFFAOYSA-N2,3-DihydrothiopheneChemical compoundC1CC=CS1OXBLVCZKDOZZOJ-UHFFFAOYSA-N0.000description12
- 238000006596Alder-ene reactionMethods0.000description12
- 239000011324beadSubstances0.000description12
- 238000000034methodMethods0.000description12
- VLKZOEOYAKHREP-UHFFFAOYSA-Nn-HexaneChemical compoundCCCCCCVLKZOEOYAKHREP-UHFFFAOYSA-N0.000description12
- 229920000642polymerPolymers0.000description11
- HEDRZPFGACZZDS-UHFFFAOYSA-NChloroformChemical compoundClC(Cl)ClHEDRZPFGACZZDS-UHFFFAOYSA-N0.000description10
- 239000000178monomerSubstances0.000description10
- 125000005529alkyleneoxy groupChemical group0.000description9
- 125000000732arylene groupChemical group0.000description9
- 230000000052comparative effectEffects0.000description9
- 125000002887hydroxy groupChemical group[H]O*0.000description9
- 239000003999initiatorSubstances0.000description9
- 239000011259mixed solutionSubstances0.000description9
- 125000000391vinyl groupChemical group[H]C([*])=C([H])[H]0.000description9
- BODYVHJTUHHINQ-UHFFFAOYSA-N(4-boronophenyl)boronic acidChemical compoundOB(O)C1=CC=C(B(O)O)C=C1BODYVHJTUHHINQ-UHFFFAOYSA-N0.000description8
- HCZMHWVFVZAHCR-UHFFFAOYSA-N2-[2-(2-sulfanylethoxy)ethoxy]ethanethiolChemical compoundSCCOCCOCCSHCZMHWVFVZAHCR-UHFFFAOYSA-N0.000description8
- IJGRMHOSHXDMSA-UHFFFAOYSA-NAtomic nitrogenChemical compoundN#NIJGRMHOSHXDMSA-UHFFFAOYSA-N0.000description8
- 125000000217alkyl groupChemical group0.000description8
- 125000006850spacer groupChemical group0.000description8
- YLQBMQCUIZJEEH-UHFFFAOYSA-NtetrahydrofuranNatural productsC=1C=COC=1YLQBMQCUIZJEEH-UHFFFAOYSA-N0.000description8
- 238000000411transmission spectrumMethods0.000description8
- 239000011521glassSubstances0.000description7
- 229910052943magnesium sulfateInorganic materials0.000description7
- 235000019341magnesium sulphateNutrition0.000description7
- 238000002156mixingMethods0.000description7
- 238000002360preparation methodMethods0.000description7
- PAKCOSURAUIXFG-UHFFFAOYSA-N3-prop-2-enoxypropane-1,2-diolChemical compoundOCC(O)COCC=CPAKCOSURAUIXFG-UHFFFAOYSA-N0.000description6
- HEMHJVSKTPXQMS-UHFFFAOYSA-MSodium hydroxideChemical compound[OH-].[Na+]HEMHJVSKTPXQMS-UHFFFAOYSA-M0.000description6
- 239000011888foilSubstances0.000description6
- 239000003505polymerization initiatorSubstances0.000description6
- 125000003647acryloyl groupChemical groupO=C([*])C([H])=C([H])[H]0.000description5
- 125000002915carbonyl groupChemical group[*:2]C([*:1])=O0.000description5
- 229920002678cellulosePolymers0.000description5
- 239000001913celluloseSubstances0.000description5
- 238000004128high performance liquid chromatographyMethods0.000description5
- 239000004973liquid crystal related substanceSubstances0.000description5
- 230000008569processEffects0.000description5
- 239000007787solidSubstances0.000description5
- PGTWZHXOSWQKCY-UHFFFAOYSA-N1,8-OctanedithiolChemical compoundSCCCCCCCCSPGTWZHXOSWQKCY-UHFFFAOYSA-N0.000description4
- 239000003795chemical substances by applicationSubstances0.000description4
- 229910052757nitrogenInorganic materials0.000description4
- PSYGHMBJXWRQFD-UHFFFAOYSA-N2-(2-sulfanylacetyl)oxyethyl 2-sulfanylacetateChemical compoundSCC(=O)OCCOC(=O)CSPSYGHMBJXWRQFD-UHFFFAOYSA-N0.000description3
- 239000004593EpoxyChemical class0.000description3
- 230000007613environmental effectEffects0.000description3
- 230000008020evaporationEffects0.000description3
- 238000001704evaporationMethods0.000description3
- 125000004435hydrogen atomChemical group[H]*0.000description3
- 238000004519manufacturing processMethods0.000description3
- 230000004044responseEffects0.000description3
- 229910052717sulfurInorganic materials0.000description3
- 125000004434sulfur atomChemical group0.000description3
- YZWKKMVJZFACSU-UHFFFAOYSA-N1-bromopentaneChemical compoundCCCCCBrYZWKKMVJZFACSU-UHFFFAOYSA-N0.000description2
- 2380000051601H NMR spectroscopyMethods0.000description2
- GJKGAPPUXSSCFI-UHFFFAOYSA-N2-Hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenoneChemical compoundCC(C)(O)C(=O)C1=CC=C(OCCO)C=C1GJKGAPPUXSSCFI-UHFFFAOYSA-N0.000description2
- KWOLFJPFCHCOCG-UHFFFAOYSA-NAcetophenoneChemical compoundCC(=O)C1=CC=CC=C1KWOLFJPFCHCOCG-UHFFFAOYSA-N0.000description2
- SECXISVLQFMRJM-UHFFFAOYSA-NN-MethylpyrrolidoneChemical compoundCN1CCCC1=OSECXISVLQFMRJM-UHFFFAOYSA-N0.000description2
- 239000004642PolyimideSubstances0.000description2
- 235000002597Solanum melongenaNutrition0.000description2
- BHELZAPQIKSEDF-UHFFFAOYSA-Nallyl bromideChemical compoundBrCC=CBHELZAPQIKSEDF-UHFFFAOYSA-N0.000description2
- KKEYFWRCBNTPAC-UHFFFAOYSA-Nbenzene-dicarboxylic acidNatural productsOC(=O)C1=CC=C(C(O)=O)C=C1KKEYFWRCBNTPAC-UHFFFAOYSA-N0.000description2
- 125000004122cyclic groupChemical group0.000description2
- 238000009826distributionMethods0.000description2
- 230000000694effectsEffects0.000description2
- 125000001033ether groupChemical group0.000description2
- 229920013821hydroxy alkyl cellulosePolymers0.000description2
- 238000002347injectionMethods0.000description2
- 239000007924injectionSubstances0.000description2
- 230000008018meltingEffects0.000description2
- 238000002844meltingMethods0.000description2
- 239000003921oilSubstances0.000description2
- 229920003023plasticPolymers0.000description2
- 239000004033plasticSubstances0.000description2
- 229920000139polyethylene terephthalatePolymers0.000description2
- 239000005020polyethylene terephthalateSubstances0.000description2
- 229920001721polyimidePolymers0.000description2
- 230000002441reversible effectEffects0.000description2
- 239000000126substanceSubstances0.000description2
- 238000000967suction filtrationMethods0.000description2
- 238000004809thin layer chromatographyMethods0.000description2
- SRZXCOWFGPICGA-UHFFFAOYSA-N1,6-HexanedithiolChemical compoundSCCCCCCSSRZXCOWFGPICGA-UHFFFAOYSA-N0.000description1
- GJRCLMJHPWCJEI-UHFFFAOYSA-N1,9-NonanedithiolChemical compoundSCCCCCCCCCSGJRCLMJHPWCJEI-UHFFFAOYSA-N0.000description1
- VXNZUUAINFGPBY-UHFFFAOYSA-N1-ButeneChemical groupCCC=CVXNZUUAINFGPBY-UHFFFAOYSA-N0.000description1
- 2390000129561-hydroxycyclohexylphenyl-ketoneSubstances0.000description1
- XYHKMRNYSMEEDT-UHFFFAOYSA-N2-[3-(2-sulfanylethylsulfanyl)propylsulfanyl]ethanethiolChemical compoundSCCSCCCSCCSXYHKMRNYSMEEDT-UHFFFAOYSA-N0.000description1
- UHFFVFAKEGKNAQ-UHFFFAOYSA-N2-benzyl-2-(dimethylamino)-1-(4-morpholin-4-ylphenyl)butan-1-oneChemical compoundC=1C=C(N2CCOCC2)C=CC=1C(=O)C(CC)(N(C)C)CC1=CC=CC=C1UHFFVFAKEGKNAQ-UHFFFAOYSA-N0.000description1
- LWRBVKNFOYUCNP-UHFFFAOYSA-N2-methyl-1-(4-methylsulfanylphenyl)-2-morpholin-4-ylpropan-1-oneChemical compoundC1=CC(SC)=CC=C1C(=O)C(C)(C)N1CCOCC1LWRBVKNFOYUCNP-UHFFFAOYSA-N0.000description1
- LABQKWYHWCYABU-UHFFFAOYSA-N4-(3-sulfanylbutanoyloxy)butyl 3-sulfanylbutanoateChemical compoundCC(S)CC(=O)OCCCCOC(=O)CC(C)SLABQKWYHWCYABU-UHFFFAOYSA-N0.000description1
- 239000004986Cholesteric liquid crystals (ChLC)Substances0.000description1
- 238000005033Fourier transform infrared spectroscopyMethods0.000description1
- VQTUBCCKSQIDNK-UHFFFAOYSA-NIsobuteneChemical groupCC(C)=CVQTUBCCKSQIDNK-UHFFFAOYSA-N0.000description1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-NSiliconChemical compound[Si]XUIMIQQOPSSXEZ-UHFFFAOYSA-N0.000description1
- 235000005811Viola aduncaNutrition0.000description1
- 235000013487Viola odorataNutrition0.000description1
- 240000009038Viola odorataSpecies0.000description1
- 235000002254Viola papilionaceaNutrition0.000description1
- GUCYFKSBFREPBC-UHFFFAOYSA-N[phenyl-(2,4,6-trimethylbenzoyl)phosphoryl]-(2,4,6-trimethylphenyl)methanoneChemical compoundCC1=CC(C)=CC(C)=C1C(=O)P(=O)(C=1C=CC=CC=1)C(=O)C1=C(C)C=C(C)C=C1CGUCYFKSBFREPBC-UHFFFAOYSA-N0.000description1
- IYABWNGZIDDRAK-UHFFFAOYSA-NalleneChemical groupC=C=CIYABWNGZIDDRAK-UHFFFAOYSA-N0.000description1
- RDOXTESZEPMUJZ-UHFFFAOYSA-NanisoleChemical classCOC1=CC=CC=C1RDOXTESZEPMUJZ-UHFFFAOYSA-N0.000description1
- 239000003963antioxidant agentSubstances0.000description1
- 239000002216antistatic agentSubstances0.000description1
- 230000008901benefitEffects0.000description1
- MQDJYUACMFCOFT-UHFFFAOYSA-Nbis[2-(1-hydroxycyclohexyl)phenyl]methanoneChemical compoundC=1C=CC=C(C(=O)C=2C(=CC=CC=2)C2(O)CCCCC2)C=1C1(O)CCCCC1MQDJYUACMFCOFT-UHFFFAOYSA-N0.000description1
- 230000005587bubblingEffects0.000description1
- 230000008859changeEffects0.000description1
- 238000000576coating methodMethods0.000description1
- 238000002425crystallisationMethods0.000description1
- 230000008025crystallizationEffects0.000description1
- 238000005520cutting processMethods0.000description1
- 125000000753cycloalkyl groupChemical group0.000description1
- 125000002993cycloalkylene groupChemical group0.000description1
- 125000004956cyclohexylene groupChemical group0.000description1
- KOMDZQSPRDYARS-UHFFFAOYSA-Ncyclopenta-1,3-diene titaniumChemical compound[Ti].C1C=CC=C1.C1C=CC=C1KOMDZQSPRDYARS-UHFFFAOYSA-N0.000description1
- 125000004979cyclopentylene groupChemical group0.000description1
- 238000000502dialysisMethods0.000description1
- VBXDEEVJTYBRJJ-UHFFFAOYSA-Ndiboronic acidChemical compoundOBOBOVBXDEEVJTYBRJJ-UHFFFAOYSA-N0.000description1
- 238000007598dipping methodMethods0.000description1
- 230000009977dual effectEffects0.000description1
- 150000002148estersChemical group0.000description1
- 125000000816ethylene groupChemical group[H]C([H])([*:1])C([H])([H])[*:2]0.000description1
- 239000003063flame retardantSubstances0.000description1
- 125000005843halogen groupChemical group0.000description1
- SXCBDZAEHILGLM-UHFFFAOYSA-Nheptane-1,7-diolChemical compoundOCCCCCCCOSXCBDZAEHILGLM-UHFFFAOYSA-N0.000description1
- 230000007062hydrolysisEffects0.000description1
- 238000006460hydrolysis reactionMethods0.000description1
- 230000001771impaired effectEffects0.000description1
- 239000004615ingredientSubstances0.000description1
- 239000003112inhibitorSubstances0.000description1
- 230000001678irradiating effectEffects0.000description1
- 229920002521macromoleculePolymers0.000description1
- 229910052751metalInorganic materials0.000description1
- 239000002184metalSubstances0.000description1
- 239000003607modifierSubstances0.000description1
- 239000002808molecular sieveSubstances0.000description1
- PJUIMOJAAPLTRJ-UHFFFAOYSA-NmonothioglycerolChemical compoundOCC(O)CSPJUIMOJAAPLTRJ-UHFFFAOYSA-N0.000description1
- 125000001997phenyl groupChemical group[H]C1=C([H])C([H])=C(*)C([H])=C1[H]0.000description1
- 229920002589poly(vinylethylene) polymerPolymers0.000description1
- 229920001281polyalkylenePolymers0.000description1
- 229920000515polycarbonatePolymers0.000description1
- 239000004417polycarbonateSubstances0.000description1
- 239000011112polyethylene naphthalateSubstances0.000description1
- 125000004805propylene groupChemical group[H]C([H])([H])C([H])([*:1])C([H])([H])[*:2]0.000description1
- 230000008439repair processEffects0.000description1
- 238000001226reprecipitationMethods0.000description1
- 238000007650screen-printingMethods0.000description1
- 239000004065semiconductorSubstances0.000description1
- 229910052710siliconInorganic materials0.000description1
- 239000010703siliconSubstances0.000description1
- URGAHOPLAPQHLN-UHFFFAOYSA-Nsodium aluminosilicateChemical compound[Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=OURGAHOPLAPQHLN-UHFFFAOYSA-N0.000description1
- 238000004528spin coatingMethods0.000description1
- 238000005507sprayingMethods0.000description1
- 229910001220stainless steelInorganic materials0.000description1
- 239000010935stainless steelSubstances0.000description1
- 230000003068static effectEffects0.000description1
- 238000012719thermal polymerizationMethods0.000description1
Images
Landscapes
- Polymers With Sulfur, Phosphorus Or Metals In The Main Chain (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
Translated fromJapanese本開示は、チオール化合物、架橋剤、硬化性組成物及び硬化物に関する。The present disclosure relates to a thiol compound, a crosslinking agent, a curable composition, and a cured product.
メルカプト基を有するチオール化合物(好ましくは多官能チオール化合物)は、不飽和基含有化合物、エポキシ化合物、その他の反応性モノマー等に対する架橋剤として使用される。例えば、チオール化合物のメルカプト基と、不飽和基含有化合物に含まれる不飽和二重結合とがエンチオール反応することにより、架橋膜等の硬化物を作製可能である。A thiol compound having a mercapto group (preferably a polyfunctional thiol compound) is used as a crosslinking agent for unsaturated group-containing compounds, epoxy compounds, other reactive monomers, etc. For example, a cured product such as a crosslinked film can be produced by an enethiol reaction between the mercapto group of a thiol compound and an unsaturated double bond contained in an unsaturated group-containing compound.
ボロン酸エステル骨格及び2つのメルカプト基を有する架橋剤(BDB)及びポリブタジエンを用いて架橋膜を作製する方法が知られている(例えば、非特許文献1を参照)。A method for producing a crosslinked membrane using a crosslinker (BDB) having a boronic ester skeleton and two mercapto groups and polybutadiene is known (see, for example, Non-Patent Document 1).
前述の非特許文献1に記載の架橋剤(BDB)は、室温(25℃)で固体の架橋剤であり、重合性化合物(特に固体の重合性化合物)の架橋剤として使用する際に溶媒を用いる必要がある。架橋剤として使用可能なチオール化合物が室温で液状である場合、架橋剤として使用する際に溶媒が不要となる、あるいは溶媒の使用量を削減することができ、硬化反応の簡略化、環境負荷の低減等に有効である。The crosslinking agent (BDB) described in the
本開示は、上記に鑑みてなされたものであり、架橋剤として使用可能であり、かつ室温で液状であるチオール化合物、これを含む架橋剤及び硬化性組成物並びにこの硬化性組成物を硬化してなる硬化物を提供することを目的とする。The present disclosure has been made in view of the above, and aims to provide a thiol compound that can be used as a crosslinking agent and is liquid at room temperature, a crosslinking agent and a curable composition containing the same, and a cured product obtained by curing the curable composition.
課題を解決するための具体的手段には、以下の態様が含まれる。
<1> 下記一般式(1)で表される構造を含むチオール化合物。 Specific means for solving the problems include the following aspects.
<1> A thiol compound having a structure represented by the following general formula (1):
一般式(1)中、R1は、2価の連結基を表し、R2はそれぞれ独立に、ホウ素原子及び2つの酸素原子とともに4員環~6員環を構成する3価の連結基を表し、R3はそれぞれ独立に、主鎖の原子数が10以上である2価の連結基を表す。
<2> 前記一般式(1)で表される構造は、前記一般式(1A)で表される構造である<1>に記載のチオール化合物。 In general formula (1),R1 represents a divalent linking group, eachR2 independently represents a trivalent linking group forming a 4- to 6-membered ring together with a boron atom and two oxygen atoms, and eachR3 independently represents a divalent linking group having 10 or more atoms in the main chain.
<2> The thiol compound according to <1>, wherein the structure represented by the general formula (1) is a structure represented by the general formula (1A).
一般式(1A)中、R1は、2価の連結基を表し、R2はそれぞれ独立に、ホウ素原子及び2つの酸素原子とともに4員環~6員環を構成する3価の連結基を表し、R4はそれぞれ独立に、2価の連結基を表し、R5はそれぞれ独立に、2価の連結基を表し、R4及びR5を構成する主鎖の原子数の合計が、一端側及び他端側にてそれぞれ独立に9以上である。
<3> 前記一般式(1A)において、R4を構成する主鎖の原子数が5であり、R5を構成する主鎖の原子数が、それぞれ独立に6~14である<2>に記載のチオール化合物。
<4> 下記一般式(2)で表される構造を含むチオール化合物。 In general formula (1A),R1 represents a divalent linking group,R2 each independently represents a trivalent linking group forming a 4- to 6-membered ring together with a boron atom and two oxygen atoms,R4 each independently represents a divalent linking group,R5 each independently represents a divalent linking group, and the total number of atoms in the main chain constitutingR4 andR5 is independently 9 or more at one end and the other end.
<3> The thiol compound according to <2>, wherein, in the general formula (1A), the number of atoms in the main chain constituting R4 is 5, and the number of atoms in the main chain constituting R5 is independently 6 to 14.
<4> A thiol compound having a structure represented by the following general formula (2):
一般式(2)中、R1Aは、2価の連結基を表し、R2Aはそれぞれ独立に2価の連結基を表し、R3Aはそれぞれ独立に2価の連結基を表し、R2A及びR3Aを構成する主鎖の原子数の合計が、一端側及び他端側にてそれぞれ独立に7以上である。
<5> 前記一般式(2)において、R1Aが置換基を有していてもよいフェニレン基であり、R2Aを構成する主鎖の原子数が3であり、R3Aを構成する主鎖の原子数が、それぞれ独立に4~10である<4>に記載のチオール化合物。
<6> <1>~<5>のいずれか1つに記載のチオール化合物を含む架橋剤。
<7> <6>に記載の架橋剤と、
前記架橋剤と反応可能な架橋性基を含む重合性化合物と、
を含む硬化性組成物。
<8> <7>に記載の硬化性組成物を硬化させてなる硬化物。
<9> 結合交換反応が可能な共有結合を有する自己修復性材料である<8>に記載の硬化物。 In general formula (2), R1A represents a divalent linking group, each R2A independently represents a divalent linking group, each R3A independently represents a divalent linking group, and the total number of atoms in the main chain constituting R2A and R3A is independently 7 or more on one end side and the other end side.
<5> The thiol compound according to <4>, wherein, in the general formula (2), R1A is a phenylene group which may have a substituent, R2A has 3 atoms in the main chain, and R3A each independently has 4 to 10 atoms in the main chain.
<6> A crosslinking agent comprising the thiol compound according to any one of <1> to <5>.
<7> The crosslinking agent according to <6>,
a polymerizable compound having a crosslinkable group capable of reacting with the crosslinking agent;
1. A curable composition comprising:
<8> A cured product obtained by curing the curable composition according to <7>.
<9> The cured product according to <8>, which is a self-repairing material having a covalent bond capable of a bond exchange reaction.
本発明の一実施形態によれば、架橋剤として使用可能であり、かつ室温で液状であるチオール化合物、これを含む架橋剤及び硬化性組成物並びにこの硬化性組成物を硬化してなる硬化物が提供される。According to one embodiment of the present invention, there is provided a thiol compound that can be used as a crosslinking agent and is liquid at room temperature, a crosslinking agent and a curable composition containing the thiol compound, and a cured product obtained by curing the curable composition.
以下、本開示のチオール化合物、架橋剤、硬化性組成物及び硬化物について詳細に説明する。The thiol compound, crosslinking agent, curable composition, and cured product disclosed herein are described in detail below.
本開示において、数値範囲を示す「~」とはその前後に記載される数値を下限値及び上限値として含む意味で使用される。
本開示において段階的に記載されている数値範囲において、一つの数値範囲で記載された上限値又は下限値は、他の段階的な記載の数値範囲の上限値又は下限値に置き換えてもよい。また、本開示に記載されている数値範囲において、その数値範囲の上限値又は下限値は、実施例に示されている値に置き換えてもよい。
本開示において、組成物中の各成分の量について言及する場合、組成物中に各成分に該当する物質が複数存在する場合には、特に断らない限り、組成物中に存在する複数の成分の合計量を意味する。
また、本開示では、アクリロイル基及びメタクリロイル基の双方或いはいずれかを「(メタ)アクリロイル基」と表記する場合がある。
本開示において「工程」との語は、独立した工程だけでなく、他の工程と明確に区別できない場合であっても、その工程の所期の目的が達成されれば、本用語に含まれる。
本開示において、置換又は無置換を明記していない化合物については、本開示における効果を損なわない範囲で、任意の置換基を有していてもよい。
なお、本開示において、好ましい態様の組み合わせは、より好ましい態様である。本開示において、任意の組み合わせにおいて、2つ以上の好ましい態様を組み合わせてもよい。 In the present disclosure, the use of "to" indicating a range of numerical values means that the numerical values before and after it are included as the lower limit and upper limit.
In the numerical ranges described in the present disclosure in stages, the upper or lower limit value described in one numerical range may be replaced with the upper or lower limit value of another numerical range described in stages. In addition, in the numerical ranges described in the present disclosure, the upper or lower limit value of the numerical range may be replaced with a value shown in the examples.
In this disclosure, when referring to the amount of each component in a composition, if multiple substances corresponding to each component are present in the composition, the total amount of the multiple components present in the composition is meant, unless otherwise specified.
In the present disclosure, both or either of an acryloyl group and a methacryloyl group may be referred to as a "(meth)acryloyl group."
In the present disclosure, the term "process" includes not only an independent process but also a process that cannot be clearly distinguished from other processes, as long as the intended purpose of the process is achieved.
In the present disclosure, compounds that are not specified as being substituted or unsubstituted may have any substituent as long as the effects of the present disclosure are not impaired.
In the present disclosure, a combination of preferred aspects is a more preferred aspect. In the present disclosure, two or more preferred aspects may be combined in any combination.
<チオール化合物>
[第1実施形態]
本開示の第1実施形態のチオール化合物は、下記一般式(1)で表される構造を含む。<Thiol compounds>
[First embodiment]
The thiol compound of the first embodiment of the present disclosure includes a structure represented by the following general formula (1).
一般式(1)中、R1は、2価の連結基を表し、R2はそれぞれ独立に、ホウ素原子及び2つの酸素原子とともに4員環~6員環を構成する3価の連結基を表し、R3はそれぞれ独立に、主鎖の原子数が10以上である2価の連結基を表す。 In general formula (1),R1 represents a divalent linking group, eachR2 independently represents a trivalent linking group forming a 4- to 6-membered ring together with a boron atom and two oxygen atoms, and eachR3 independently represents a divalent linking group having 10 or more atoms in the main chain.
本実施形態のチオール化合物は、2つのメルカプト基を含み、重合性化合物の架橋剤として使用可能である。さらに、R3はそれぞれ独立に、主鎖の原子数が10以上である2価の連結基であることで、当該チオール化合物は室温にて液状である。以上により、架橋剤として使用する際に溶媒が不要となる、あるいは溶媒の使用量を削減することができ、硬化反応の簡略化、環境負荷の低減等に有効である。 The thiol compound of this embodiment contains two mercapto groups and can be used as a crosslinking agent for polymerizable compounds. Furthermore, each R3 is independently a divalent linking group having 10 or more atoms in the main chain, so that the thiol compound is liquid at room temperature. As a result, when used as a crosslinking agent, a solvent is not required or the amount of solvent used can be reduced, which is effective for simplifying the curing reaction and reducing the environmental load.
さらに、本実施形態のチオール化合物は、架橋剤と反応可能な架橋性基を含む重合性化合物(例えば、エチレン性不飽和二重結合を有する重合性化合物)と反応させることで、結合交換反応が可能な共有結合を有する基を含む分子構造を備える硬化物を作製可能である。このような分子構造を備える硬化物は、光、熱などの外部刺激により自己修復性を有する。これにより、当該硬化物に対して切断等により物理的損傷を与えた場合であっても、物理的損傷が与えられた硬化物同士を接触させた状態で光、熱などの外部刺激を与えることで物理的損傷が与えられた硬化物同士を接合させ、硬化物を修復することが可能となる。このような自己修復性を有する硬化物は、自己修復性材料として用いることができる。Furthermore, the thiol compound of this embodiment can be reacted with a polymerizable compound (e.g., a polymerizable compound having an ethylenically unsaturated double bond) containing a crosslinkable group capable of reacting with a crosslinking agent to produce a cured product having a molecular structure containing a group having a covalent bond capable of a bond exchange reaction. A cured product having such a molecular structure has a self-repairing property in response to an external stimulus such as light or heat. As a result, even if the cured product is physically damaged by cutting or the like, it is possible to repair the cured product by bonding the physically damaged cured products together by applying an external stimulus such as light or heat while the physically damaged cured products are in contact with each other. Such a cured product having a self-repairing property can be used as a self-repairing material.
以下、一般式(1)で表される構造を含むチオール化合物の好ましい形態について説明する。The following describes preferred forms of thiol compounds containing the structure represented by general formula (1).
一般式(1)中、R1における2価の連結基としては、例えば、アルキレン基、アリーレン基、アルキレンオキシ基、ポリアルキレンオキシ基、これらの2つ以上の組み合わせ等が挙げられる。中でも、アルキレン基、アリーレン基が好ましく、フェニレン基がより好ましい。 In the general formula (1), examples of the divalent linking group in R1 include an alkylene group, an arylene group, an alkyleneoxy group, a polyalkyleneoxy group, and a combination of two or more of these. Among these, an alkylene group and an arylene group are preferred, and a phenylene group is more preferred.
一般式(1)中、R2における3価の連結基としては、ホウ素原子及び2つの酸素原子とともに5員環を構成する基であることが好ましい。
2つのR2は、同じであっても異なっていてもよい。 In general formula (1), the trivalent linking group forR2 is preferably a group that forms a five-membered ring together with a boron atom and two oxygen atoms.
The twoR2 's may be the same or different.
一般式(1)中、R3における2価の連結基としては、主鎖の原子数が10以上であればよく、例えば、アルキレン基、アリーレン基、アルキレンオキシ基、ポリアルキレンオキシ基、スルフィド結合、カルボニル基、エステル結合、アミド結合、これらの内の2つ以上を組み合わせた基等が挙げられる。
2つのR3は、同じであっても異なっていてもよい。 In general formula (1), the divalent linking group forR3 may have a main chain with 10 or more atoms, and examples thereof include an alkylene group, an arylene group, an alkyleneoxy group, a polyalkyleneoxy group, a sulfide bond, a carbonyl group, an ester bond, an amide bond, and a group formed by combining two or more of these.
The twoR3 's may be the same or different.
R3における主鎖の原子数は、10~22であってもよく、12~20であってもよく、14~18であってもよい。 The number of atoms in the main chain inR3 may be 10-22, 12-20, or 14-18.
一般式(1)で表される構造は、下記一般式(1A)で表される構造であってもよい。一般式(1)におけるR3が一般式(1A)におけるR5-S-R4であってもよい。 The structure represented by general formula (1) may be a structure represented by the following general formula (1A): R3 in general formula (1) may be R5 -S-R4 in general formula (1A).
一般式(1A)中、R1は、2価の連結基を表し、R2はそれぞれ独立に、ホウ素原子及び2つの酸素原子とともに4員環~6員環を構成する3価の連結基を表し、R4はそれぞれ独立に、2価の連結基を表し、R5はそれぞれ独立に、2価の連結基を表し、R4及びR5を構成する主鎖の原子数の合計が、一端側及び他端側にてそれぞれ独立に9以上である。 In general formula (1A),R1 represents a divalent linking group,R2 each independently represents a trivalent linking group forming a 4- to 6-membered ring together with a boron atom and two oxygen atoms,R4 each independently represents a divalent linking group,R5 each independently represents a divalent linking group, and the total number of atoms in the main chain constitutingR4 andR5 is independently 9 or more at one end and the other end.
一般式(1A)中、R1及びR2の好ましい態様は、一般式(1)中のR1及びR2の好ましい態様と同様である。 In formula (1A), the preferred embodiments of R1 and R2 are the same as the preferred embodiments of R1 and R2 in formula (1).
一般式(1A)中、R4における2価の連結基としては、例えば、アルキレン基、アリーレン基、アルキレンオキシ基、ポリアルキレンオキシ基、スルフィド結合、カルボニル基、エステル結合、アミド結合、これらの内の2つ以上を組み合わせた基等が挙げられる。
2つのR4は、同じであっても異なっていてもよい。 In general formula (1A), examples of the divalent linking group forR4 include an alkylene group, an arylene group, an alkyleneoxy group, a polyalkyleneoxy group, a sulfide bond, a carbonyl group, an ester bond, an amide bond, and a group formed by combining two or more of these.
The twoR4s may be the same or different.
R4を構成する主鎖の原子数は、3~7であってもよく、4~6であってもよく、5であってもよい。
R4における2価の連結基は、アルキレンオキシ基の酸素原子にアルキレン基が結合したアルキレンオキシアルキレン基であってもよく、*1-(CH2)3-O-CH2-*2(*1は、Sとの結合位置を表し、*2は、R2との結合位置を表す)であってもよい。 The number of atoms in the main chain constitutingR4 may be 3 to 7, 4 to 6, or 5.
The divalent linking group inR4 may be an alkyleneoxyalkylene group in which an alkylene group is bonded to the oxygen atom of an alkyleneoxy group, or may be *1-(CH2 )3 -O-CH2- *2 (*1 represents the bonding position to S, and *2 represents the bonding position toR2 ).
一般式(1A)中、R5における2価の連結基としては、R4及びR5を構成する主鎖の原子数の合計が9以上となればよく、例えば、アルキレン基、アリーレン基、アルキレンオキシ基、ポリアルキレンオキシ基、スルフィド結合、カルボニル基、エステル結合、アミド結合、これらの内の2つ以上を組み合わせた基等が挙げられる。
2つのR5は、同じであっても異なっていてもよい。 In general formula (1A), the divalent linking group forR5 may be any group so long as the total number of atoms in the main chain constitutingR4 andR5 is 9 or more. Examples of the divalent linking group include an alkylene group, an arylene group, an alkyleneoxy group, a polyalkyleneoxy group, a sulfide bond, a carbonyl group, an ester bond, an amide bond, and a group consisting of two or more of these groups.
The twoR5 's may be the same or different.
R5を構成する主鎖の原子数は、6~14であってもよく、7~13であってもよく、8~12であってもよい。
R5における2価の連結基は、
(1)炭素数6~14のアルキレン基、
(2)*3-(RO)n-R-*4(Rは、炭素数1~3のアルキレン基を表し、nは1以上の整数を表し、*3は、メルカプト基との結合位置を表し、*4は、R2側の硫黄原子との結合位置を表す)、又は
(3)*3-Rx-C(=O)O-RY-O(O=)C-Rx-*4(RX及びRYは、それぞれ独立にアルキレン基を表し、*3は、メルカプト基との結合位置を表し、*4は、R2側の硫黄原子との結合位置を表す)、
であってもよい。 The number of atoms in the main chain constitutingR5 may be 6-14, 7-13, or 8-12.
The divalent linking group forR5 is
(1) an alkylene group having 6 to 14 carbon atoms,
(2) *3-(RO)n -R-*4 (R represents an alkylene group having 1 to 3 carbon atoms, n represents an integer of 1 or more, *3 represents the bonding position to the mercapto group, and *4 represents the bonding position to the sulfur atom on theR2 side), or (3) *3-Rx -C(=O)O-RY -O(O=)C-Rx -*4 (RX and RY each independently represent an alkylene group, *3 represents the bonding position to the mercapto group, and *4 represents the bonding position to the sulfur atom on theR2 side),
may be also possible.
上記(2)*3-(RO)n-R-*4について、Rは、炭素数2のアルキレン基、すなわち、エチレン基であることが好ましい。
上記(3)*3-Rx-C(=O)O-RY-O(O=)C-Rx-*4について、RXは炭素数1~3のアルキレン基であることが好ましく、RYは炭素数1~5のアルキレン基であることが好ましい。 In the above (2)*3-(RO)n -R-*4, R is preferably an alkylene group having 2 carbon atoms, that is, an ethylene group.
In the above (3)*3-Rx -C(=O)ORY -O(O=)CRx -*4, RX is preferably an alkylene group having 1 to 3 carbon atoms, and RY is preferably an alkylene group having 1 to 5 carbon atoms.
一般式(1A)で表される化合物は、例えば、以下のようにして合成することができる。
(1)両末端にメルカプト基をそれぞれ有するジチオール化合物(例えば、1,8-オクタンジチオール、エチレンビス(チオグリコラート)、3,6-ジオキサ-1,8-オクタンジチオールなど)と、エチレン性不飽和二重結合及びヒドロキシ基を2つ有するジオール化合物(例えば、3-アリルオキシ-1,2-プロパンジオール)とをエンチオール反応させて、末端メルカプト基と、ヒドロキシ基を2つ有する中間化合物を得る。中間化合物の合成は、加熱により行ってもよく、紫外線等の活性エネルギー線の照射により行ってもよい。
(2)前述の中間化合物に対して2当量のジボロン酸(例えば、ベンゼン-1,4-ジボロン酸)を反応させて一般式(1A)で表される化合物を得る。一般式(1A)で表される化合物の合成は、遮光した状態で室温(例えば、10℃~30℃)で行ってもよい。 The compound represented by the general formula (1A) can be synthesized, for example, as follows.
(1) An intermediate compound having a terminal mercapto group and two hydroxy groups is obtained by subjecting a dithiol compound having a mercapto group at each end (e.g., 1,8-octanedithiol, ethylene bis(thioglycolate), 3,6-dioxa-1,8-octanedithiol, etc.) and a diol compound having an ethylenically unsaturated double bond and two hydroxy groups (e.g., 3-allyloxy-1,2-propanediol) to an enethiol reaction. The intermediate compound may be synthesized by heating or by irradiation with active energy rays such as ultraviolet rays.
(2) The intermediate compound is reacted with 2 equivalents of diboronic acid (e.g., benzene-1,4-diboronic acid) to obtain a compound represented by general formula (1A). The synthesis of the compound represented by general formula (1A) may be carried out at room temperature (e.g., 10°C to 30°C) in the dark.
[第2実施形態]
本開示の第2実施形態のチオール化合物は、下記一般式(2)で表される構造を含む。[Second embodiment]
The thiol compound of the second embodiment of the present disclosure includes a structure represented by the following general formula (2).
一般式(2)中、R1Aは、2価の連結基を表し、R2Aはそれぞれ独立に2価の連結基を表し、R3Aはそれぞれ独立に2価の連結基を表し、R2A及びR3Aを構成する主鎖の原子数の合計が、一端側及び他端側にてそれぞれ独立に7以上である。 In general formula (2), R1A represents a divalent linking group, each R2A independently represents a divalent linking group, each R3A independently represents a divalent linking group, and the total number of atoms in the main chain constituting R2A and R3A is independently 7 or more on one end side and the other end side.
本実施形態のチオール化合物は、2つのメルカプト基を含み、重合性化合物の架橋剤として使用可能である。さらに、R3Aはそれぞれ独立に、主鎖の原子数が7以上である2価の連結基であることで、当該チオール化合物は室温にて液状である。以上により、架橋剤として使用する際に溶媒が不要となる、あるいは溶媒の使用量を削減することができ、硬化反応の簡略化、環境負荷の低減等に有効である。 The thiol compound of this embodiment contains two mercapto groups and can be used as a crosslinking agent for polymerizable compounds. Furthermore, each R3A is independently a divalent linking group having 7 or more atoms in the main chain, so that the thiol compound is liquid at room temperature. As a result, a solvent is not required when used as a crosslinking agent, or the amount of solvent used can be reduced, which is effective for simplifying the curing reaction and reducing the environmental load.
以下、一般式(2)で表される構造を含むチオール化合物の好ましい形態について説明する。The following describes preferred forms of thiol compounds containing the structure represented by general formula (2).
一般式(2)中、R1Aにおける2価の連結基としては、例えば、アルキレン基、アリーレン基、アルキレンオキシ基、ポリアルキレンオキシ基、これらの2つ以上の組み合わせ等が挙げられる。中でも、アルキレン基、アリーレン基が好ましく、フェニレン基がより好ましい。 In general formula (2), examples of the divalent linking group for R1A include an alkylene group, an arylene group, an alkyleneoxy group, a polyalkyleneoxy group, and a combination of two or more of these. Among these, an alkylene group and an arylene group are preferred, and a phenylene group is more preferred.
一般式(2)中、R2Aにおける2価の連結基としては、例えば、アルキレン基、アリーレン基、アルキレンオキシ基、ポリアルキレンオキシ基、スルフィド結合、カルボニル基、エステル結合、アミド結合、これらの内の2つ以上を組み合わせた基等が挙げられる。
2つのR2Aは、同じであっても異なっていてもよい。 In general formula (2), examples of the divalent linking group for R2A include an alkylene group, an arylene group, an alkyleneoxy group, a polyalkyleneoxy group, a sulfide bond, a carbonyl group, an ester bond, an amide bond, and a group formed by combining two or more of these.
The two R2A may be the same or different.
R2Aを構成する主鎖の原子数は、1~5であってもよく、2~4であってもよく、3であってもよい。 The number of atoms in the main chain constituting R2A may be 1 to 5, 2 to 4, or 3.
一般式(2)中、R3Aにおける2価の連結基としては、R2A及びR3Aを構成する主鎖の原子数の合計が7以上となればよく、例えば、アルキレン基、アリーレン基、アルキレンオキシ基、ポリアルキレンオキシ基、スルフィド結合、カルボニル基、エステル結合、アミド結合、これらの内の2つ以上を組み合わせた基等が挙げられる。
2つのR3Aは、同じであっても異なっていてもよい。 In general formula (2), the divalent linking group for R3A may be any group as long as the total number of atoms in the main chain constituting R2A and R3A is 7 or more. Examples of the divalent linking group include an alkylene group, an arylene group, an alkyleneoxy group, a polyalkyleneoxy group, a sulfide bond, a carbonyl group, an ester bond, an amide bond, and a group consisting of a combination of two or more of these.
The two R3A may be the same or different.
R3Aを構成する主鎖の原子数は、4~10であってもよく、6~10であってもよく、8であってもよい。
R3Aにおける2価の連結基は、
(1)炭素数4~10のアルキレン基、又は
(2)*3-(RO)n-R-*4(Rは、炭素数1~3のアルキレン基を表し、nは1以上の整数を表し、*3は、メルカプト基との結合位置を表し、*4は、R2A側の硫黄原子との結合位置を表す)
であってもよい。 The number of atoms in the main chain constituting R3A may be 4 to 10, 6 to 10, or 8.
The divalent linking group for R3A is
(1) an alkylene group having 4 to 10 carbon atoms, or (2) *3-(RO)n -R-*4 (R represents an alkylene group having 1 to 3 carbon atoms, n represents an integer of 1 or more, *3 represents the bonding position to the mercapto group, and *4 represents the bonding position to the sulfur atom on the R2A side).
may be also possible.
一般式(2)で表される化合物は、例えば、以下のようにして合成することができる。
両末端にメルカプト基をそれぞれ有するジチオール化合物(例えば、1,8-オクタンジチオール、エチレンビス(チオグリコラート)、3,6-ジオキサ-1,8-オクタンジチオールなど)と、2つのエチレン性不飽和二重結合及び2つのエステル結合を有する不飽和化合物(例えば、ジアリルテレフタル酸)とをエンチオール反応させて、2つの末端メルカプト基及び2つのエステル結合を有する一般式(2)で表される化合物を得る。 The compound represented by the general formula (2) can be synthesized, for example, as follows.
A dithiol compound having mercapto groups at both ends (e.g., 1,8-octanedithiol, ethylene bis(thioglycolate), 3,6-dioxa-1,8-octanedithiol, etc.) is subjected to an enethiol reaction with an unsaturated compound having two ethylenically unsaturated double bonds and two ester bonds (e.g., diallyl terephthalic acid) to obtain a compound represented by general formula (2) having two terminal mercapto groups and two ester bonds.
<架橋剤>
本開示の架橋剤は、前述の第1実施形態のチオール化合物及び前述の第2実施形態のチオール化合物の少なくとも一方(以下、「特定のチオール化合物」とも称する。)を含む。
本開示の架橋剤は、不飽和基含有化合物、エポキシ化合物、その他の反応性モノマー等の重合性化合物の架橋反応に用いられるものであってもよく、不飽和基含有化合物とのエンチオール反応に用いられるものであってもよい。<Crosslinking Agent>
The crosslinking agent of the present disclosure contains at least one of the thiol compound of the first embodiment described above and the thiol compound of the second embodiment described above (hereinafter also referred to as a "specific thiol compound").
The crosslinking agent of the present disclosure may be used in a crosslinking reaction of a polymerizable compound such as an unsaturated group-containing compound, an epoxy compound, or another reactive monomer, or may be used in an enethiol reaction with an unsaturated group-containing compound.
本開示の架橋剤は、特定のチオール化合物のみからなるものであってもよく、特定のチオール化合物以外の成分、例えば、特定のチオール化合物以外の架橋剤(以下、「その他の架橋剤」とも称する。)を含むものであってもよい。The crosslinking agent of the present disclosure may consist of only the specific thiol compound, or may contain components other than the specific thiol compound, for example, a crosslinking agent other than the specific thiol compound (hereinafter also referred to as "other crosslinking agents").
本開示の架橋剤に含まれる特定のチオール化合物の含有率は、架橋剤全量に対し、50質量%~100質量%であってもよく、80質量%~100質量%であってもよく、90質量%~100質量%であってもよい。The content of the specific thiol compound contained in the crosslinking agent of the present disclosure may be 50% by mass to 100% by mass, 80% by mass to 100% by mass, or 90% by mass to 100% by mass, based on the total amount of the crosslinking agent.
その他の架橋剤としては、外部刺激によって可逆的な結合交換反応を生じる架橋構造を重合性化合物と形成する架橋剤(例えば、非特許文献1に記載のBDB)であってもよく、外部刺激によって可逆的な結合交換反応を生じない架橋構造を重合性化合物と形成する架橋剤(その他の架橋剤1)であってもよい。
その他の架橋剤1としては、特に限定されず、1,6-ヘキサンジチオール、1,7-ヘプタンジオール、1,8-オクタンジチオール、1,9-ノナンジチオール、3,6-ジオキサ-1,8-オクタンジチオール、3,7-ジチア-1,9-ノナンジチオール等が挙げられる。 The other crosslinking agent may be a crosslinking agent that forms a crosslinked structure with a polymerizable compound that undergoes a reversible bond exchange reaction in response to an external stimulus (e.g., BDB described in Non-Patent Document 1), or a crosslinking agent that forms a crosslinked structure with a polymerizable compound that does not undergo a reversible bond exchange reaction in response to an external stimulus (other crosslinking agent 1).
<硬化性組成物>
本開示の硬化性組成物は、前述の本開示の架橋剤と、前記架橋剤と反応可能な架橋性基を含む重合性化合物と、を含む。<Curable Composition>
The curable composition of the present disclosure comprises the crosslinking agent of the present disclosure described above and a polymerizable compound that includes a crosslinkable group capable of reacting with the crosslinking agent.
(重合性化合物)
重合性化合物は、架橋剤(特に架橋剤のメルカプト基)と反応可能な架橋性基を含む化合物であれば特に限定されない。例えば、不飽和基含有化合物、エポキシ化合物、その他の反応性モノマー等が挙げられる。(Polymerizable compound)
The polymerizable compound is not particularly limited as long as it contains a crosslinkable group capable of reacting with a crosslinking agent (particularly a mercapto group of the crosslinking agent). Examples of the polymerizable compound include unsaturated group-containing compounds, epoxy compounds, and other reactive monomers.
不飽和基含有化合物としては、例えば、エチレン性不飽和二重結合を有するモノマー、ポリマー等が挙げられ、アリル基、(メタ)アクリロイル基等を有するモノマー、ポリマー等が挙げられる。Examples of unsaturated group-containing compounds include monomers and polymers having an ethylenically unsaturated double bond, and monomers and polymers having an allyl group, (meth)acryloyl group, etc.
エチレン性不飽和二重結合を有するポリマーとしては、ポリマー鎖に対して分岐上のエチレン性不飽和二重結合が直接又は2価の連結基を介して結合したポリマーが挙げられ、例えば、1,2-ポリブタジエン、(メタ)アクリロイル基、アリル基等が導入されたセルロース誘導体などが挙げられる。Examples of polymers having ethylenically unsaturated double bonds include polymers in which ethylenically unsaturated double bonds on branches are bonded to the polymer chain directly or via a divalent linking group, such as 1,2-polybutadiene and cellulose derivatives into which (meth)acryloyl groups, allyl groups, etc. have been introduced.
前述のセルロース誘導体は、例えば、ヒドロキシアルキルセルロース(好ましくはヒドロキシプロピルセルロース)に由来するセルロース誘導体骨格を含んでいてもよい。ヒドロキシアルキルセルロースに由来するセルロース誘導体骨格としては、例えば、下記一般式(3)で表される構造単位を有することが好ましい。The cellulose derivative may contain, for example, a cellulose derivative skeleton derived from hydroxyalkyl cellulose (preferably hydroxypropyl cellulose). The cellulose derivative skeleton derived from hydroxyalkyl cellulose preferably has, for example, a structural unit represented by the following general formula (3).
一般式(3)中、X11、X12及びX13は、それぞれ独立に、単結合、アルキレン基又は-(R14-O)h-(R14はアルキレン基を表し、hは1以上10以下の整数を表す)を表し、R11、R12及びR13は、それぞれ独立に、水素原子、アルキル基又はエチレン性不飽和二重結合を有する基を含む。但し、X11、X12及びX13の少なくとも1つはアルキレン基又は-(R14-O)h-(R14はアルキレン基を表し、hは1以上10以下の整数を表す)であり、R11、R12及びR13の少なくとも1つはエチレン性不飽和二重結合を有する基を含む。 In general formula (3), X11 , X12 and X13 each independently represent a single bond, an alkylene group or -(R14 -O)h - (R14 represents an alkylene group and h represents an integer of 1 or more and 10 or less), and R11 , R12 and R13 each independently include a hydrogen atom, an alkyl group or a group having an ethylenically unsaturated double bond, provided that at least one of X11 , X12 and X13 is an alkylene group or -(R14 -O)h - (R14 represents an alkylene group and h represents an integer of 1 or more and 10 or less), and at least one of R11 , R12 and R13 includes a group having an ethylenically unsaturated double bond.
一般式(3)において、X11、X12及びX13で表されるアルキレン基としては特に制限されず、例えば、直鎖又は分岐の炭素数1~18(好ましくは1~12、より好ましくは1~4)のアルキレン基、環状の炭素数3~18(好ましくは3~12)のシクロアルキレン基が挙げられる。直鎖又は分岐のアルキレン基としては、例えば、メチレン基、エチレン基、n-プロピレン基、イソプロピレン基、n-ブチレン基、イソブチレン基、sec-ブチレン基、tert-ブチレン基、n-ペンチレン基、イソペンチレン基等が挙げられる。環状のアルキレン基としては、例えば、シクロペンチレン基、シクロヘキシレン基等が挙げられる。 In general formula (3), the alkylene group represented by X11 , X12 and X13 is not particularly limited, and examples thereof include linear or branched alkylene groups having 1 to 18 carbon atoms (preferably 1 to 12, more preferably 1 to 4), and cyclic cycloalkylene groups having 3 to 18 carbon atoms (preferably 3 to 12). Examples of linear or branched alkylene groups include methylene, ethylene, n-propylene, isopropylene, n-butylene, isobutylene, sec-butylene, tert-butylene, n-pentylene, and isopentylene. Examples of cyclic alkylene groups include cyclopentylene and cyclohexylene.
一般式(3)において、X11、X12及びX13で表される-(R14-O)h-は、アルキレンオキシ基(アルキレンエーテル基)又はポリアルキレンオキシ基(ポリアルキレンエーテル基)である。-(R14-O)h-で表される基におけるアルキレン基
(-R14-)としては、前述で例示したアルキレン基(X11、X12及びX13で表されるアルキレン基)と同様のものが挙げられる。-(R14-O)h-としては、例えば、エチレンオキシ基、ポリエチレンオキシ基、プロピレンオキシ基、ポリプロピレンオキシ基等が挙げられる。
一般式(3)において、hとしては、架橋によって適度な弾性を有する硬化物を得る観点から、好ましくは1以上6以下、より好ましくは1以上4以下、さらに好ましくは1以上3以下であり、特に好ましくは1である。 In general formula (3), -(R14 -O)h - represented by X11 , X12 and X13 is an alkyleneoxy group (alkylene ether group) or a polyalkyleneoxy group (polyalkylene ether group). Examples of the alkylene group (-R14 -) in the group represented by -(R14 -O)h - include the same as the alkylene groups (alkylene groups represented by X11 , X12 and X13 ) exemplified above. Examples of -(R14 -O)h - include an ethyleneoxy group, a polyethyleneoxy group, a propyleneoxy group and a polypropyleneoxy group.
In general formula (3), from the viewpoint of obtaining a cured product having appropriate elasticity by crosslinking, h is preferably 1 or more and 6 or less, more preferably 1 or more and 4 or less, even more preferably 1 or more and 3 or less, and particularly preferably 1.
なお、上述のアルキレン基及び-(R14-O)h-は、置換基を有していてもよい。置換基としては、例えば、炭素数1~6の直鎖若しくは分岐のアルキル基、炭素数3~6のシクロアルキル基、炭素数6~12のアリル基、ハロゲン原子が挙げられる。なお、置換基が2以上ある場合には、それぞれの置換基は同一であっても異なっていてもよい。 The above-mentioned alkylene group and -(R14 -O)h - may have a substituent. Examples of the substituent include a linear or branched alkyl group having 1 to 6 carbon atoms, a cycloalkyl group having 3 to 6 carbon atoms, an allyl group having 6 to 12 carbon atoms, and a halogen atom. When there are two or more substituents, the respective substituents may be the same or different.
一般式(3)において、R11、R12及びR13で表されるアルキル基としては、炭素数3~10のアルキル基であってもよく、炭素数4~8のアルキル基であってもよく、炭素数4~6のアルキル基であってもよい。アルキル基の炭素数を変更することで、硬化物の緩和時間を調整することができる。R11、R12及びR13で表されるアルキル基としては、直鎖であってもよく、分岐であってもよい。 In the general formula (3), the alkyl group represented by R11 , R12 and R13 may be an alkyl group having 3 to 10 carbon atoms, an alkyl group having 4 to 8 carbon atoms, or an alkyl group having 4 to 6 carbon atoms. By changing the number of carbon atoms in the alkyl group, the relaxation time of the cured product can be adjusted. The alkyl group represented by R11 , R12 and R13 may be linear or branched.
一般式(3)において、エチレン性不飽和二重結合を有する基は、アリル基又は(メタ)アクリロイル基を含む基が好ましい。In general formula (3), the group having an ethylenically unsaturated double bond is preferably a group containing an allyl group or a (meth)acryloyl group.
重合性化合物に含まれる架橋性基のモル数に対する架橋剤に含まれるメルカプト基のモル数の比率(架橋性基/メルカプト基)は、特に限定されず、0.5~2であってもよい。The ratio of the number of moles of mercapto groups contained in the crosslinking agent to the number of moles of crosslinking groups contained in the polymerizable compound (crosslinking groups/mercapto groups) is not particularly limited and may be 0.5 to 2.
(重合開始剤)
例えば、硬化性組成物は、重合開始剤を含んでいてもよい。
重合開始剤としては、公知の重合開始剤を用いることができ、例えば、熱重合開始剤、光重合開始剤が挙げられる。中でも、紫外線照射等の光照射により架橋構造を形成する観点から、光重合開始剤が好ましい。(Polymerization initiator)
For example, the curable composition may include a polymerization initiator.
As the polymerization initiator, a known polymerization initiator can be used, for example, a thermal polymerization initiator or a photopolymerization initiator can be used. Among them, a photopolymerization initiator is preferred from the viewpoint of forming a crosslinked structure by light irradiation such as ultraviolet irradiation.
光重合開始剤としては、例えば、2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン(HMPP)、アセトフェノン、1-ヒドロキシシクロヘキシルフェニルケトン、2-ヒドロキシ-4’-(2-ヒドロキシエトキシ)-2-メチルプロピオフェノン(HHEMPP)、2-メチル-4’-(メチルチオ)-2-モルホリノプロピオフェノン、2-ベンジル-2-(ジメチルアミノ)-4’-モルホリノブチロフェノン、フェニルビス(2,4,6-トリメチルベンゾイル)ホスフィンオキシド、ビス(2,6-ジフルオロ-3
-(1-ヒドロピロール-1-イル)フェニル)チタノセン等が挙げられる。 Examples of the photopolymerization initiator include 2-hydroxy-2-methyl-1-phenylpropan-1-one (HMPP), acetophenone, 1-hydroxycyclohexyl phenyl ketone, 2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone (HHEMPP), 2-methyl-4'-(methylthio)-2-morpholinopropiophenone, 2-benzyl-2-(dimethylamino)-4'-morpholinobutyrophenone, phenylbis(2,4,6-trimethylbenzoyl)phosphine oxide, bis(2,6-difluoro-3
1-(1-hydropyrrol-1-yl)phenyl)titanocene and the like.
重合開始剤の含有量は、硬化性組成物の全質量に対して、0.1質量%~5質量%の範囲が好ましく、0.5質量%~4質量%の範囲がより好ましい。The content of the polymerization initiator is preferably in the range of 0.1% by mass to 5% by mass, and more preferably in the range of 0.5% by mass to 4% by mass, based on the total mass of the curable composition.
(他の成分)
本開示の硬化性組成物は、本開示の効果を著しく損なわない範囲で他の成分を含んでいてもよい。他の成分としては、例えば、重合性モノマー、架橋剤、難燃剤、相溶化剤、酸化防止剤、離型剤(剥離剤)、耐光剤、耐候剤、改質剤、帯電防止剤、加水分解防止剤等が挙げられる。(Other ingredients)
The curable composition of the present disclosure may contain other components within a range that does not significantly impair the effects of the present disclosure. Examples of other components include polymerizable monomers, crosslinking agents, flame retardants, compatibilizers, antioxidants, release agents (peeling agents), light resistance agents, weather resistance agents, modifiers, antistatic agents, and hydrolysis inhibitors.
本開示の硬化性組成物は、自己修復性材料、液晶膜等の形成に用いられるものであってもよい。The curable composition of the present disclosure may be used to form self-repairing materials, liquid crystal films, etc.
<硬化物>
本開示の硬化物は、本開示の硬化性組成物を硬化させてなる。硬化物は、硬化性組成物に含まれる架橋剤と重合性化合物とをエネルギー線照射、加熱等により架橋反応させることで形成される。<Cured Product>
The cured product of the present disclosure is obtained by curing the curable composition of the present disclosure. The cured product is formed by crosslinking the crosslinking agent and the polymerizable compound contained in the curable composition by irradiation with energy rays, heating, or the like.
本開示の硬化物は、結合交換反応が可能な共有結合を有する自己修復性材料であることが好ましい。例えば、本開示の架橋剤が前述の第1実施形態のチオール化合物を含むことで自己修復性を有する硬化物を好適に得ることができる。The cured product of the present disclosure is preferably a self-repairing material having a covalent bond capable of a bond exchange reaction. For example, a cured product having self-repairing properties can be preferably obtained by including the thiol compound of the first embodiment described above in the crosslinking agent of the present disclosure.
本開示の硬化物は、架橋膜等であってもよい。
本開示の硬化性組成物が前述のセルロース誘導体を含む場合、架橋膜は液晶膜であってもよく、コレステリック液晶膜であってもよい。 The cured product of the present disclosure may be a crosslinked film or the like.
When the curable composition of the present disclosure contains the above-mentioned cellulose derivative, the crosslinked film may be a liquid crystal film or a cholesteric liquid crystal film.
本開示の架橋膜の製造方法は特に限定されず、前述の本開示の硬化性組成物を架橋により硬化させたものであればよく、例えば、基板上に本開示の硬化性組成物を付与し、基板上に付与された硬化性組成物を架橋により硬化させたものであってもよい。The method for producing the crosslinked film of the present disclosure is not particularly limited, and may be any method as long as the curable composition of the present disclosure described above is cured by crosslinking. For example, the crosslinked film may be produced by applying the curable composition of the present disclosure onto a substrate, and then curing the curable composition applied onto the substrate by crosslinking.
基板としては特に制限されず、目的に応じて通常用いられるものから適宜選択することができる。基板としては、例えば、ガラス基板、プラスチック基板(例えば、ポリエチレンナフタレート(PEN)基板、ポリエチレンテレフタレート(PET)基板、ポリカーボネート(PC)基板、ポリイミド(PI)基板等)、アルミ基板、ステンレス基板等の金属基板、シリコン基板等の半導体基板等を用いることができる。
基板の厚さ、形状は特に限定されず、目的に応じて適宜選択することが好ましい。
基板上への硬化性組成物の付与方法としては、例えば、スピンコート法、ディップ法、スプレー法等の塗布法;インクジェット法;スクリーン印刷法;減圧注入法等の注入法;等が挙げられる。 The substrate is not particularly limited and can be appropriately selected from those usually used depending on the purpose. For example, a glass substrate, a plastic substrate (e.g., a polyethylene naphthalate (PEN) substrate, a polyethylene terephthalate (PET) substrate, a polycarbonate (PC) substrate, a polyimide (PI) substrate, etc.), a metal substrate such as an aluminum substrate or a stainless steel substrate, a semiconductor substrate such as a silicon substrate, etc. can be used as the substrate.
The thickness and shape of the substrate are not particularly limited, and are preferably selected appropriately depending on the purpose.
Examples of methods for applying the curable composition onto a substrate include coating methods such as spin coating, dipping, and spraying; inkjet methods; screen printing; and injection methods such as reduced pressure injection.
架橋膜が液晶膜である場合、基板の硬化性組成物が付与される面には配向膜が形成されていてもよい。配向膜にラビング処理が施されていてもよい。
例えば、配向膜が形成された第1の基板及び配向膜が形成された第2の基板を準備し、第1の基板及び第2の基板の配向膜同士を対面させた状態で第1の基板及び第2の基板の間に液晶膜を配置してもよい。あるいは、第1の基板及び第2の基板の配向膜同士を対面させた状態で第1の基板及び第2の基板の間に、スペーサーを介して、硬化性組成物を注入し、次いで架橋させて液晶膜を形成してもよい。 When the crosslinked film is a liquid crystal film, an alignment film may be formed on the surface of the substrate to which the curable composition is applied. The alignment film may be subjected to a rubbing treatment.
For example, a first substrate on which an alignment film is formed and a second substrate on which an alignment film is formed may be prepared, and a liquid crystal film may be disposed between the first substrate and the second substrate in a state where the alignment films of the first substrate and the second substrate face each other. Alternatively, a curable composition may be injected between the first substrate and the second substrate via a spacer in a state where the alignment films of the first substrate and the second substrate face each other, and then crosslinked to form a liquid crystal film.
以下、本発明を実施例により更に具体的に説明するが、本発明はその主旨を越えない限り、以下の実施例に限定されるものではない。なお、特に断りのない限り、「部」は質量基準である。The present invention will be explained in more detail below with reference to examples, but the present invention is not limited to the following examples as long as it does not deviate from the gist of the invention. Note that "parts" are by weight unless otherwise specified.
[比較例1]
(架橋剤1の合成)
架橋剤1を以下のようにして合成した。まず、ベンゼン-1,4-ジボロン酸(1.00 g、6.00 mmol)及び1-チオグリセロール(0.994 mL、11.5 mmol)をテトラヒドロフラン12 mLに溶解させた。次に、アルミホイルで遮光した状態で、室温(25℃)条件下でテトラヒドロフラン溶液を3.5時間攪拌した。以下の反応式に示すように、ボロン酸エステル骨格を有する架橋剤1(BDB)を得た。架橋剤1は、白色固体であり、収率は88.6%であった。さらに、架橋剤1(BDB)は、1H-NMRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。[Comparative Example 1]
(Synthesis of Crosslinker 1)
[実施例1]
(架橋剤2の合成)
架橋剤2を以下のようにして合成した。架橋剤2の中間体となる化合物(後述の14OS)を合成し、当該化合物を用いて架橋剤2(B14OS)を合成した。
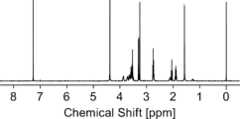
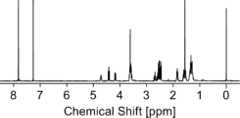
まず、3-アリルオキシ-1,2-プロパンジオール(3-APD、1.02 g、7.71 mmol)、3,6-ジオキサ-1,8-オクタンジチオール(DODT、7.03 g、38.6 mmol)及び光ラジカル発生剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン(11.8 mg)を溶媒であるテトラヒドロフラン(12.0 mL)に溶解させた。次に、室温(25℃)条件下で溶液に365nmの紫外線を10分間照射し、以下の反応式に示すように、メルカプト基及びヒドロキシ基を有する化合物(1-メルカプト-3,6,13-トリオキサ-9-チアヘキサデカン-15,16-ジオール、「14OS」とも称する。)を得た。14OSの収率は、60.8%であった。さらに、化合物(14OS)は、図1~図3に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。[Example 1]
(Synthesis of Crosslinker 2)
First, 3-allyloxy-1,2-propanediol (3-APD, 1.02 g, 7.71 mmol), 3,6-dioxa-1,8-octanedithiol (DODT, 7.03 g, 38.6 mmol), and 2-hydroxy-2-methyl-1-phenylpropan-1-one (11.8 mg) as a photoradical generator were dissolved in tetrahydrofuran (12.0 mL) as a solvent. Next, the solution was irradiated with 365 nm ultraviolet light for 10 minutes under room temperature (25° C.) conditions, and a compound having a mercapto group and a hydroxy group (1-mercapto-3,6,13-trioxa-9-thiahexadecane-15,16-diol, also referred to as "14OS") was obtained as shown in the following reaction formula. The yield of 14OS was 60.8%. Furthermore, it was confirmed that compound (14OS) had the structure shown in the following reaction formula from peak measurements of the1 H-NMR spectrum,13 C-NMR spectrum and FT-IR spectrum shown in FIGS.
次に、合成した化合物(14OS、1.08 g、3.43 mmol)、ベンゼン-1,4-ジボロン酸(0.301 g、1.82 mmol)及び硫酸マグネシウム(1.25 g)を脱水テトラヒドロフラン2.0 mLに溶解させた。次に、アルミホイルで遮光した状態で、室温(25℃)条件下でテトラヒドロフラン溶液を1時間攪拌した。以下の反応式に示すように、ボロン酸エステル骨格を有する架橋剤2(B14OS)を得た。架橋剤2は、室温で無色透明の液体であり、収率は66.6%であった。さらに、架橋剤2(B14OS)は、図4~図6に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。 Next, the synthesized compound (14OS, 1.08 g, 3.43 mmol), benzene-1,4-diboronic acid (0.301 g, 1.82 mmol), and magnesium sulfate (1.25 g) were dissolved in 2.0 mL of dehydrated tetrahydrofuran. Next, the tetrahydrofuran solution was stirred for 1 hour at room temperature (25° C.) while shielded from light with aluminum foil. As shown in the reaction formula below, crosslinker 2 (B14OS) having a boronic acid ester skeleton was obtained.
[実施例2]
(架橋剤3の合成)
架橋剤3を以下のようにして合成した。架橋剤3の中間体となる化合物(後述の14COS)を合成し、当該化合物を用いて架橋剤3(B14COS)を合成した。
まず、3-アリルオキシ-1,2-プロパンジオール(3-APD、1.02 g、7.71 mmol)、エチレンビス(チオグリコラート)(8.10 g、38.5 mmol)及び光ラジカル発生剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン(32.2 mg)を溶媒であるテトラヒドロフラン(12.0 mL)に溶解させた。次に、室温(25℃)条件下で溶液に365nmの紫外線を10分間照射し、以下の反応式に示すように、メルカプト基及びヒドロキシ基を有する化合物(14COS)を得た。14COSの収率は、53.4%であった。さらに、化合物(14COS)は、図7~図9に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。[Example 2]
(Synthesis of Crosslinker 3)
First, 3-allyloxy-1,2-propanediol (3-APD, 1.02 g, 7.71 mmol), ethylene bis(thioglycolate) (8.10 g, 38.5 mmol), and 2-hydroxy-2-methyl-1-phenylpropan-1-one (32.2 mg) as a photoradical generator were dissolved in tetrahydrofuran (12.0 mL) as a solvent. Next, the solution was irradiated with 365 nm ultraviolet light for 10 minutes under room temperature (25° C.) conditions to obtain a compound (14COS) having a mercapto group and a hydroxy group as shown in the following reaction formula. The yield of 14COS was 53.4%. Furthermore, it was confirmed that the compound (14COS) had the structure shown in the following reaction formula from the peak measurements of the1 H-NMR spectrum,13 C-NMR spectrum, and FT-IR spectrum shown in FIGS. 7 to 9.
次に、合成した化合物(14COS、1.22 g、3.55 mmol)、ベンゼン-1,4-ジボロン酸(0.309 g、1.86 mmol)及び硫酸マグネシウム(1.28 g)を脱水テトラヒドロフラン6.0 mLに溶解させた。次に、アルミホイルで遮光した状態で、室温(25℃)条件下でテトラヒドロフラン溶液を1時間攪拌した。以下の反応式に示すように、ボロン酸エステル骨格を有する架橋剤3(B14COS)を得た。架橋剤3は、室温で無色透明の液体であり、収率は42.3%であった。さらに、架橋剤3(B14COS)は、図10~図12に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。 Next, the synthesized compound (14COS, 1.22 g, 3.55 mmol), benzene-1,4-diboronic acid (0.309 g, 1.86 mmol), and magnesium sulfate (1.28 g) were dissolved in 6.0 mL of dehydrated tetrahydrofuran. Next, the tetrahydrofuran solution was stirred for 1 hour at room temperature (25° C.) while shielded from light with aluminum foil. As shown in the reaction formula below, crosslinker 3 (B14COS) having a boronic acid ester skeleton was obtained.
[実施例3]
(架橋剤4の合成)
架橋剤4を以下のようにして合成した。架橋剤4の中間体となる化合物(後述の14S)を合成し、当該化合物を用いて架橋剤4(B14S)を合成した。
まず、3-アリルオキシ-1,2-プロパンジオール(3-APD、1.07 g、8.07 mmol)、1,8-オクタンジチオール(7.21 g、40.4 mmol)及び光ラジカル発生剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン(35.5 mg)を溶媒であるテトラヒドロフラン(12 mL)に溶解させた。次に、室温(25℃)条件下で溶液に365nmの紫外線を10分間照射し、以下の反応式に示すように、メルカプト基及びヒドロキシ基を有する化合物(1-メルカプト-9-チアヘキサデカン-15,16-ジオール、「14S」とも称する。)を得た。14Sの収率は、50.3%であった。さらに、化合物(14S)は、図13~図15に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。[Example 3]
(Synthesis of Crosslinker 4)
First, 3-allyloxy-1,2-propanediol (3-APD, 1.07 g, 8.07 mmol), 1,8-octanedithiol (7.21 g, 40.4 mmol), and 2-hydroxy-2-methyl-1-phenylpropan-1-one (35.5 mg) as a photoradical generator were dissolved in tetrahydrofuran (12 mL) as a solvent. Next, the solution was irradiated with 365 nm ultraviolet light for 10 minutes at room temperature (25° C.), and a compound having a mercapto group and a hydroxy group (1-mercapto-9-thiahexadecane-15,16-diol, also referred to as "14S") was obtained as shown in the following reaction formula. The yield of 14S was 50.3%. Furthermore, it was confirmed that compound (14S) had the structure shown in the following reaction formula from peak measurements of the1 H-NMR spectrum,13 C-NMR spectrum and FT-IR spectrum shown in FIGS.
次に、合成した化合物(14S、1.07 g、3.46 mmol)、ベンゼン-1,4-ジボロン酸(0.301 g、1.82 mmol)及び硫酸マグネシウム(1.25 g)を脱水テトラヒドロフラン6.0 mLに溶解させた。次に、アルミホイルで遮光した状態で、室温(25℃)条件下でテトラヒドロフラン溶液を1時間攪拌した。以下の反応式に示すように、ボロン酸エステル骨格を有する架橋剤4(B14S)を得た。架橋剤4は、室温で無色透明の液体であり、収率は32.4%であった。さらに、架橋剤4(B14S)は、図16~図18に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。 Next, the synthesized compound (14S, 1.07 g, 3.46 mmol), benzene-1,4-diboronic acid (0.301 g, 1.82 mmol), and magnesium sulfate (1.25 g) were dissolved in 6.0 mL of dehydrated tetrahydrofuran. Next, the tetrahydrofuran solution was stirred for 1 hour at room temperature (25° C.) while shielded from light with aluminum foil. As shown in the reaction formula below, crosslinker 4 (B14S) having a boronic acid ester skeleton was obtained.
[実施例4]
(架橋剤5の合成)
架橋剤5を以下のようにして合成した。架橋剤5の中間体となる化合物(後述の18COS)を合成し、当該化合物を用いて架橋剤5(B18COS)を合成した。
まず、3-アリルオキシ-1,2-プロパンジオール(3-APD、1.04 g、7.88 mmol)及び溶媒である脱水テトラヒドロフラン(脱水THF、12 mL)を混合した。次いで、混合液にカレンズMT(登録商標)BD1(1,4-ビス(3-メルカプトブチリルオキシ)ブタン)、11.6 g、39.4 mmol)及び光ラジカル発生剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン(36.5 mg)を加え攪拌した。次に、室温(25℃)条件下で溶液に365nmの紫外線を10分間照射した。紫外線照射後にエバポレーションで溶媒を除去した。溶媒除去後に生成物をクロロホルムに溶解し、高速液体クロマトグラフィー(HPLC)により目的物を精製した。
以上の操作により、以下の反応式に示すように、メルカプト基及びヒドロキシ基を有する化合物(「18COS」も称する。)を得た。18COSの収率は、38.1%であった。さらに、化合物(18COS)は、図19~図21に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。[Example 4]
(Synthesis of Crosslinker 5)
First, 3-allyloxy-1,2-propanediol (3-APD, 1.04 g, 7.88 mmol) and dehydrated tetrahydrofuran (dehydrated THF, 12 mL) as a solvent were mixed. Next, Karenz MT (registered trademark) BD1 (1,4-bis (3-mercaptobutyryloxy) butane), 11.6 g, 39.4 mmol) and 2-hydroxy-2-methyl-1-phenylpropan-1-one (36.5 mg) as a photoradical generator were added to the mixture and stirred. Next, the solution was irradiated with 365 nm ultraviolet light for 10 minutes under room temperature (25°C) conditions. After the ultraviolet light irradiation, the solvent was removed by evaporation. After the solvent removal, the product was dissolved in chloroform, and the target product was purified by high performance liquid chromatography (HPLC).
By the above operations, a compound having a mercapto group and a hydroxy group (also referred to as "18COS") was obtained as shown in the following reaction formula. The yield of 18COS was 38.1%. Furthermore, it was confirmed that the compound (18COS) had the structure shown in the following reaction formula from peak measurements of the1 H-NMR spectrum,13 C-NMR spectrum and FT-IR spectrum shown in Figures 19 to 21.
次に、ベンゼン-1,4-ジボロン酸(0.170 g、1.03 mmol)を脱水THF 4.00mLに溶解させた。合成した化合物(18COS、0.834 g、1.95 mmol)を脱水THF 2.00mLに溶解させた。次いで、ベンゼン-1,4-ジボロン酸溶液及び18COS溶液を混合した。混合溶液に硫酸マグネシウム(0.705 g、5.86 mmol)を添加した。そして、アルミホイルで遮光した状態で、室温(25℃)条件下で混合溶液を2時間攪拌した。このとき、反応の進行は薄層クロマトグラフィーにより追跡した。反応後、吸引ろ過により硫酸マグネシウムを除去し、エバポレーターで濃縮後に、反応溶液にヘキサンを加えた。ヘキサンを除去後、反応溶液をクロロホルムに溶解し、HPLCにより目的物を精製した。
以上の操作により、以下の反応式に示すように、ボロン酸エステル骨格を有する架橋剤5(B18COS)を得た。架橋剤5は、室温で無色透明の液体であり、収率は39.1%であった。さらに、架橋剤5(B18COS)は、図22~図24に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。 Next, benzene-1,4-diboronic acid (0.170 g, 1.03 mmol) was dissolved in 4.00 mL of dehydrated THF. The synthesized compound (18COS, 0.834 g, 1.95 mmol) was dissolved in 2.00 mL of dehydrated THF. Then, the benzene-1,4-diboronic acid solution and the 18COS solution were mixed. Magnesium sulfate (0.705 g, 5.86 mmol) was added to the mixed solution. Then, the mixed solution was stirred for 2 hours at room temperature (25° C.) while shielded from light with aluminum foil. At this time, the progress of the reaction was tracked by thin layer chromatography. After the reaction, magnesium sulfate was removed by suction filtration, and the reaction solution was concentrated with an evaporator, and hexane was added to the reaction solution. After removing the hexane, the reaction solution was dissolved in chloroform, and the target product was purified by HPLC.
By the above operations, crosslinking agent 5 (B18COS) having a boronic acid ester skeleton was obtained as shown in the following reaction formula.
[実施例5]
(架橋剤6の合成)
架橋剤6を以下のようにして合成した。
まず、ジアリルテレフタル酸(0.523 g、2.12 mmol)を脱水THF 6.00 mLに溶解させ、次いで、3,6-ジオキサ-1,8-オクタンジチオール(DODT、1.95 g、10.7 mmol)及び光ラジカル発生剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン(17.0 mg)を順次加えて攪拌した。室温(25℃)条件下で得られた溶液に365nmの紫外線を10分間照射した。紫外線照射後の反応溶液から溶媒をエバポレーションで除去した。次いで、反応溶液をクロロホルムに溶解し、HPLCにより目的物を精製した。
以上の操作により、以下の反応式に示すように、メルカプト基を有する化合物(「T11OS」も称する。)を得た。T11OSの収率は、43.3%であった。さらに、化合物(T11OS)は、図25~図27に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、以下の反応式に示す構造を有することを確認した。[Example 5]
(Synthesis of Crosslinker 6)
First, diallyl terephthalic acid (0.523 g, 2.12 mmol) was dissolved in 6.00 mL of dehydrated THF, and then 3,6-dioxa-1,8-octanedithiol (DODT, 1.95 g, 10.7 mmol) and 2-hydroxy-2-methyl-1-phenylpropan-1-one (17.0 mg), a photoradical generator, were added in that order and stirred. The solution obtained was irradiated with 365 nm ultraviolet light for 10 minutes at room temperature (25°C). The solvent was removed from the reaction solution after ultraviolet irradiation by evaporation. Next, the reaction solution was dissolved in chloroform, and the target product was purified by HPLC.
By the above operations, a compound having a mercapto group (also referred to as "T11OS") was obtained as shown in the following reaction formula. The yield of T11OS was 43.3%. Furthermore, it was confirmed that the compound (T11OS) had the structure shown in the following reaction formula from peak measurements of the1 H-NMR spectrum,13 C-NMR spectrum and FT-IR spectrum shown in Figures 25 to 27.
[実施例6]
(HPC誘導体1の合成)
以下の方法により架橋性基を有するHPC誘導体1を合成した。
減圧下、室温(25℃)で24時間以上乾燥したヒドロキシプロピルセルロース(HPC、重量平均分子量:4.45×104)5.0 gを、窒素充填させたフラスコ内で、N-メチルピロリドン80 mLに溶解させたのち、加熱(65℃)条件下で、水酸化ナトリウム7.6 g、アリルブロミド0.11 mL(1.27 mmol)、1-ブロモペンタン23.2 mL(0.191 mol)を加え48時間攪拌した。これにより、ヒドロキシプロピルセルロース中の水酸基の一部の水素がアリル基及び1-ペンチル基で置換されたHPC誘導体1(HPC-Al/PeEt)を合成した。透析と再沈殿の操作によって、HPC誘導体1 1.73 gを得た。[Example 6]
(Synthesis of HPC derivative 1)
A
5.0 g of hydroxypropyl cellulose (HPC, weight average molecular weight: 4.45 x 104 ) that had been dried under reduced pressure at room temperature (25°C) for at least 24 hours was dissolved in 80 mL of N-methylpyrrolidone in a flask filled with nitrogen, and then 7.6 g of sodium hydroxide, 0.11 mL (1.27 mmol) of allyl bromide, and 23.2 mL (0.191 mol) of 1-bromopentane were added under heating (65°C) conditions and stirred for 48 hours. In this way, HPC derivative 1 (HPC-Al/PeEt) in which some of the hydrogen atoms of the hydroxyl groups in hydroxypropyl cellulose were substituted with allyl groups and 1-pentyl groups was synthesized. Dialysis and reprecipitation gave 1.73 g of
HPC誘導体1において、1H-NMRスペクトルのピーク測定から、アリル基の置換度(モノマー単位当たりに存在する不飽和二重結合を有する基の合計個数/3)及び1-ペンチル基の置換度(モノマー単位当たりに存在する1-ペンチル基の合計個数/3)を求めた。アリル基の置換度は0.12であり、1-ペンチル基の置換度は2.88であった。
HPC誘導体1は、室温で青紫色のブラッグ反射を示した。 The degree of substitution of the allyl group (total number of groups having an unsaturated double bond present per monomer unit/3) and the degree of substitution of the1 -pentyl group (total number of 1-pentyl groups present per monomer unit/3) were determined from peak measurement of the 1 H-NMR spectrum of
(架橋膜の作製)
HPC誘導体1(HPC-Al/PeEt)及び架橋剤2(B14OS)を反応させて架橋膜を作製した。具体的には、HPC誘導体1 0.216 gと、架橋剤2(B14OS)15.2 mgとを混合した溶液と、光重合開始剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン5.9 mgと、を混合させて光硬化性組成物1を調製した。このとき、アリル基のモル数に対する架橋剤2(B14OS)に含まれるメルカプト基(-SH)のモル数の比率(メルカプト基/アリル基)は、100%であった。調製した光硬化性組成物1を基板上に膜状に塗布し、膜状の組成物に対して365nmの紫外線を10分間照射してアリル基とメルカプト基とを反応(チオール-エン反応)させた。これにより、B14OSにおけるメルカプト基と、HPC誘導体1におけるアリル基とがチオール-エン反応により架橋してなる高分子を含む架橋膜(厚さ500 μm)を作製した。
実施例6で作製した架橋膜は、室温で緑色のブラッグ反射を示した。実施例6で作製した架橋膜の透過スペクトルを図28に示す。(Preparation of crosslinked membrane)
A crosslinked film was prepared by reacting HPC derivative 1 (HPC-Al/PeEt) and crosslinker 2 (B14OS). Specifically, a solution containing 0.216 g of
The crosslinked film prepared in Example 6 exhibited green Bragg reflection at room temperature. The transmission spectrum of the crosslinked film prepared in Example 6 is shown in FIG.
(応力緩和測定)
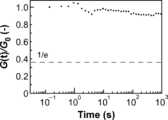
前述のようにして作製した実施例6の架橋膜に対して初期ひずみγ0を与え、そのひずみを一定に維持したまま応力σ(t)の減少速度を測定する応力緩和測定を行った。具体的には、アントンパール社のMCR102装置を用い、直径8mmのパラレルプレートに架橋膜を設置し、25℃にて応力緩和測定を行った。応力をひずみで割った値である緩和弾性率Gについて、初期応力における緩和弾性率(G0)に対する時間tでの応力における緩和弾性率(G(t))の比率であるG(t)/G0をプロットした。また、応力σが、σ0/eとなるまでの時間である緩和時間τを求めた。
また、40℃~100℃の10℃刻みにて上記と同様の条件で応力緩和測定を行った。40℃~100℃におけるG(t)/G0のプロットを図29に示す。図29に示すように、40℃~100℃にて応力の緩和が確認された。図29に示す曲線は、以下に示すKohlrausch-Williams-Watts(KWW)式に基づく曲線である。なお、実施例6の架橋膜について応力緩和測定を行った場合、短時間スケールの緩和が小さく、通常のKWW式に基づく曲線が確認された。式中、G(t)は緩和弾性率であり、τは緩和時間であり、βは緩和時間の分布である(参考文献:Hayashi, M.; Chen, L. Polym. Chem. 2020, 11 (10), 1713-1719.)。(Stress relaxation measurement)
The crosslinked membrane of Example 6 prepared as described above was given an initial strain γ0, and stress relaxation measurement was performed to measure the rate of decrease in stress σ(t) while maintaining the strain constant. Specifically, the crosslinked membrane was placed on a parallel plate with a diameter of 8 mm using an Anton Paar MCR102 device, and stress relaxation measurement was performed at 25°C. For the relaxation modulus G, which is the value obtained by dividing the stress by the strain, G(t)/G0 , which is the ratio of the relaxation modulus (G(t)) at the stress at time t to the relaxation modulus (G0 ) at the initial stress, was plotted. In addition, the relaxation time τ, which is the time until the stress σ becomes σ0/e, was obtained.
Stress relaxation measurements were also performed under the same conditions as above at 10°C intervals from 40°C to 100°C. Figure 29 shows a plot of G(t)/G0 at 40°C to 100°C. As shown in Figure 29, stress relaxation was confirmed at 40°C to 100°C. The curve shown in Figure 29 is a curve based on the Kohlrausch-Williams-Watts (KWW) formula shown below. When stress relaxation measurements were performed on the crosslinked membrane of Example 6, the short-time scale relaxation was small, and a curve based on the normal KWW formula was confirmed. In the formula, G(t) is the relaxation modulus, τ is the relaxation time, and β is the distribution of relaxation times (References: Hayashi, M.; Chen, L. Polym. Chem. 2020, 11 (10), 1713-1719.).
さらに、以下の式に基づいて平均緩和時間<τ>を求めた。式中、βは緩和時間の分布、Γはガンマ関数を表す。Furthermore, the average relaxation time <τ> was calculated based on the following formula, where β represents the distribution of relaxation times and Γ represents the gamma function.
図30に示すように、40℃~100℃の各温度(具体的には、1000/T(K))に対して緩和時間(具体的には、In<τ>)をプロットすることで、アレニウスの式に従う直線が得られた。従って、実施例6にて作製した架橋膜は自己修復性があると推測された。As shown in Figure 30, a straight line according to the Arrhenius equation was obtained by plotting the relaxation time (specifically, In<τ>) against each temperature (specifically, 1000/T(K)) from 40°C to 100°C. Therefore, it was inferred that the crosslinked film produced in Example 6 has self-repairing properties.
[実施例7]
(HPC誘導体2の合成)
以下の方法により架橋性基を有するHPC誘導体2を合成した。
減圧下、室温(25℃)で24時間以上乾燥した実施例1にて用いたヒドロキシプロピルセルロース(HPC)5.0 gを、窒素充填させたフラスコ内で、N-メチルピロリドン80 mLに溶解させたのち、加熱(65℃)条件下で、水酸化ナトリウム7.6 g、アリルブロミド0.33 mL(3.8 mmol)、1-ブロモペンタン23.2 mL(0.191 mol)を加え48時間攪拌した。これにより、ヒドロキシプロピルセルロース中の水酸基の一部の水素がアリル基及び1-ペンチル基で置換されたHPC誘導体2(HPC-Al/PeEt)を合成した。HPC誘導体1の合成と同様の操作によって、HPC誘導体2 2.7 gを得た。[Example 7]
(Synthesis of HPC derivative 2)
5.0 g of hydroxypropyl cellulose (HPC) used in Example 1, which had been dried under reduced pressure at room temperature (25°C) for 24 hours or more, was dissolved in 80 mL of N-methylpyrrolidone in a flask filled with nitrogen, and then 7.6 g of sodium hydroxide, 0.33 mL (3.8 mmol) of allyl bromide, and 23.2 mL (0.191 mol) of 1-bromopentane were added under heating (65°C) conditions and stirred for 48 hours. In this way, HPC derivative 2 (HPC-Al/PeEt) in which some hydrogen atoms of the hydroxyl groups in hydroxypropyl cellulose were replaced with allyl groups and 1-pentyl groups was synthesized. 2.7 g of
HPC誘導体2において、1H-NMRスペクトルのピーク測定から、アリル基の置換度(モノマー単位当たりに存在する不飽和二重結合を有する基の合計個数/3)及び1-ペンチル基の置換度(モノマー単位当たりに存在する1-ペンチル基の合計個数/3)を求めた。アリル基の置換度は0.40であり、1-ペンチル基の置換度は2.60であった。 The degree of substitution of the allyl group (total number of groups having unsaturated double bonds present per monomer unit/3) and the degree of substitution of the 1- pentyl group (total number of 1-pentyl groups present per monomer unit/3) were determined from peak measurement of the 1 H-NMR spectrum of
(架橋膜の作製)
HPC誘導体2(HPC-Al/PeEt、アリル基の置換度は0.40であり、1-ペンチル基の置換度は2.60)及び架橋剤3(B14COS)を反応させて架橋膜を作製した。具体的には、HPC誘導体2 0.114 gと、架橋剤3(B14COS)28.4 mgとを混合した溶液と、光重合開始剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン1.7 mgと、を混合させて光硬化性組成物2を調製した。このとき、アリル基のモル数に対する架橋剤3(B14COS)に含まれるメルカプト基(-SH)のモル数の比率(メルカプト基/アリル基)は、100%であった。調製した光硬化性組成物2を基板上に膜状に塗布し、膜状の組成物に対して365nmの紫外線を10分間照射してアリル基とメルカプト基とを反応(チオール-エン反応)させた。これにより、B14COSにおけるメルカプト基と、HPC誘導体2におけるアリル基とがチオール-エン反応により架橋してなる高分子を含む架橋膜(厚さ500 μm)を作製した。
実施例7で作製した架橋膜は、室温で緑色のブラッグ反射を示した。実施例7で作製した架橋膜の透過スペクトルを図31に示す。(Preparation of crosslinked membrane)
A crosslinked film was prepared by reacting HPC derivative 2 (HPC-Al/PeEt, the degree of substitution of allyl group was 0.40, and the degree of substitution of 1-pentyl group was 2.60) with crosslinker 3 (B14COS). Specifically, a solution obtained by mixing 0.114 g of
The crosslinked film prepared in Example 7 exhibited green Bragg reflection at room temperature. The transmission spectrum of the crosslinked film prepared in Example 7 is shown in FIG.
(応力緩和測定)
前述のようにして作製した実施例7の架橋膜に対して初期ひずみγ0を与え、そのひずみを一定に維持したまま応力σ(t)の減少速度を測定する応力緩和測定を行った。具体的には、アントンパール社のMCR102装置を用い、直径8mmのパラレルプレートに架橋膜を設置し、25℃にて応力緩和測定を行った。応力をひずみで割った値である緩和弾性率Gについて、初期応力における緩和弾性率(G0)に対する時間tでの応力における緩和弾性率(G(t))の比率であるG(t)/G0をプロットした。また、応力σが、σ0/eとなるまでの時間である緩和時間τ(前述のτ2)を求めた。
また、50℃~100℃の10℃刻みにて上記と同様の条件で応力緩和測定を行った。50℃~100℃におけるG(t)/G0のプロットを図32に示す。図32に示すように、50℃~100℃にて応力の緩和が確認された。図32に示す曲線は、2項のKWW式に基づく曲線である。(Stress relaxation measurement)
The crosslinked membrane of Example 7 prepared as described above was given an initial strain γ0, and stress relaxation measurement was performed to measure the rate of decrease in stress σ(t) while maintaining the strain constant. Specifically, the crosslinked membrane was placed on a parallel plate with a diameter of 8 mm using an Anton Paar MCR102 device, and stress relaxation measurement was performed at 25°C. For the relaxation modulus G, which is the value obtained by dividing the stress by the strain, G(t )/G0 , which is the ratio of the relaxation modulus (G(t)) at the stress at time t to the relaxation modulus (G 0 ) at the initial stress, was plotted. In addition, the relaxation time τ (the above-mentioned τ2 ), which is the time until the stress σ becomes σ0/e, was obtained.
Stress relaxation measurements were also performed under the same conditions as above at 10°C intervals from 50°C to 100°C. A plot of G(t)/G0 from 50°C to 100°C is shown in Figure 32. As shown in Figure 32, stress relaxation was confirmed at 50°C to 100°C. The curve shown in Figure 32 is based on the two-term KWW equation.
図33に示すように、50℃~100℃の各温度(具体的には、1000/T(K))に対して緩和時間(具体的には、In<τ2>)をプロットすることで、アレニウスの式に従う直線が得られた。従って、実施例7にて作製した架橋膜は自己修復性があると推測された。 33, a straight line according to the Arrhenius equation was obtained by plotting the relaxation time (specifically, In<τ2 >) against each temperature (specifically, 1000/T(K)) from 50° C. to 100° C. Therefore, it was presumed that the crosslinked film prepared in Example 7 has self-repairing properties.
[実施例8]
(架橋膜の作製)
HPC誘導体2(HPC-Al/PeEt、アリル基の置換度は0.40であり、1-ペンチル基の置換度は2.60)及び架橋剤4(B14S)を反応させて架橋膜を作製した。具体的には、HPC誘導体2 0.158 gと、架橋剤4(B14S)37.2 mgとを混合した溶液と、光重合開始剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン6.7 mgと、を混合させて光硬化性組成物3を調製した。このとき、アリル基のモル数に対する架橋剤4(B14S)に含まれるメルカプト基(-SH)のモル数の比率(メルカプト基/アリル基)は、100%であった。調製した光硬化性組成物3を基板上に膜状に塗布し、膜状の組成物に対して365nmの紫外線を10分間照射してアリル基とメルカプト基とを反応(チオール-エン反応)させた。これにより、B14Sにおけるメルカプト基と、HPC誘導体2におけるアリル基とがチオール-エン反応により架橋してなる高分子を含む架橋膜(厚さ500 μm)を作製した。
実施例8で作製した架橋膜は、室温で赤色のブラッグ反射を示した。実施例8で作製した架橋膜の透過スペクトルを図34に示す。[Example 8]
(Preparation of crosslinked membrane)
A crosslinked film was prepared by reacting HPC derivative 2 (HPC-Al/PeEt, the degree of substitution of the allyl group was 0.40, and the degree of substitution of the 1-pentyl group was 2.60) with crosslinker 4 (B14S). Specifically, a solution obtained by mixing 0.158 g of
The crosslinked film prepared in Example 8 exhibited red Bragg reflection at room temperature. The transmission spectrum of the crosslinked film prepared in Example 8 is shown in FIG.
(応力緩和測定)
前述のようにして作製した実施例8の架橋膜に対して初期ひずみγ0を与え、そのひずみを一定に維持したまま応力σ(t)の減少速度を測定する応力緩和測定を行った。具体的には、アントンパール社のMCR102装置を用い、直径8mmのパラレルプレートに架橋膜を設置し、25℃にて応力緩和測定を行った。応力をひずみで割った値である緩和弾性率Gについて、初期応力における緩和弾性率(G0)に対する時間tでの応力における緩和弾性率(G(t))の比率であるG(t)/G0をプロットした。また、応力σが、σ0/eとなるまでの時間である緩和時間τを求めた。
また、40℃~100℃の10℃刻みにて上記と同様の条件で応力緩和測定を行った。40℃~100℃におけるG(t)/G0のプロットを図35に示す。図35に示すように、40℃~100℃にて応力の緩和が確認された。図35に示す曲線は、実施例6と同様に通常のKWW式に基づく曲線である。(Stress relaxation measurement)
The crosslinked membrane of Example 8 prepared as described above was given an initial strain γ0, and stress relaxation measurement was performed to measure the rate of decrease in stress σ(t) while maintaining the strain constant. Specifically, the crosslinked membrane was placed on a parallel plate with a diameter of 8 mm using an Anton Paar MCR102 device, and stress relaxation measurement was performed at 25°C. For the relaxation modulus G, which is the value obtained by dividing the stress by the strain, G(t)/G0 , which is the ratio of the relaxation modulus (G(t)) at the stress at time t to the relaxation modulus (G0 ) at the initial stress, was plotted. In addition, the relaxation time τ, which is the time until the stress σ becomes σ0/e, was obtained.
Stress relaxation measurements were also performed under the same conditions as above at 10°C intervals from 40°C to 100°C. A plot of G(t)/G0 from 40°C to 100°C is shown in Figure 35. As shown in Figure 35, stress relaxation was confirmed at 40°C to 100°C. The curve shown in Figure 35 is based on the normal KWW equation, as in Example 6.
図36に示すように、40℃~100℃の各温度(具体的には、1000/T(K))に対して緩和時間(具体的には、In<τ>)をプロットすることで、アレニウスの式に従う直線が得られた。従って、実施例8にて作製した架橋膜は自己修復性があると推測された。As shown in Figure 36, a straight line according to the Arrhenius equation was obtained by plotting the relaxation time (specifically, In<τ>) against each temperature (specifically, 1000/T(K)) from 40°C to 100°C. Therefore, it was inferred that the crosslinked film produced in Example 8 has self-repairing properties.
[実施例9]
(架橋膜の作製)
HPC誘導体2(HPC-Al/PeEt、アリル基の置換度は0.40であり、1-ペンチル基の置換度は2.60)及び架橋剤2(B14OS)を反応させて架橋膜を作製した。具体的には、HPC誘導体2 0.221 gと、架橋剤2(B14OS)51.2 mgとを混合した溶液と、光重合開始剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン2.8 mgと、を混合させて光硬化性組成物4を調製した。このとき、アリル基のモル数に対する架橋剤2(B14OS)に含まれるメルカプト基(-SH)のモル数の比率(メルカプト基/アリル基)は、100%であった。調製した光硬化性組成物4を基板上に膜状に塗布し、膜状の組成物に対して365nmの紫外線を10分間照射してアリル基とメルカプト基とを反応(チオール-エン反応)させた。これにより、B14OSにおけるメルカプト基と、HPC誘導体2におけるアリル基とがチオール-エン反応により架橋してなる高分子を含む架橋膜(厚さ500 μm)を作製した。
実施例9で作製した架橋膜は、室温で青色のブラッグ反射を示した。実施例9で作製した架橋膜の透過スペクトルを図37に示す。実施例6と比較すると、アリル基の置換度が増加すると、架橋膜のブラッグ反射が短波長化する傾向が確認された。[Example 9]
(Preparation of crosslinked membrane)
A crosslinked film was prepared by reacting HPC derivative 2 (HPC-Al/PeEt, the degree of substitution of allyl group was 0.40, and the degree of substitution of 1-pentyl group was 2.60) with crosslinking agent 2 (B14OS). Specifically, a solution obtained by mixing 0.221 g of
The crosslinked film prepared in Example 9 exhibited blue Bragg reflection at room temperature. The transmission spectrum of the crosslinked film prepared in Example 9 is shown in Figure 37. Compared with Example 6, it was confirmed that the Bragg reflection of the crosslinked film tends to shift to a shorter wavelength as the degree of substitution of the allyl group increases.
(応力緩和測定)
前述のようにして作製した実施例9の架橋膜に対して初期ひずみγ0を与え、そのひずみを一定に維持したまま応力σ(t)の減少速度を測定する応力緩和測定を行った。具体的には、アントンパール社のMCR102装置を用い、直径8mmのパラレルプレートに架橋膜を設置し、25℃にて応力緩和測定を行った。応力をひずみで割った値である緩和弾性率Gについて、初期応力における緩和弾性率(G0)に対する時間tでの応力における緩和弾性率(G(t))の比率であるG(t)/G0をプロットした。また、応力σが、σ0/eとなるまでの時間である緩和時間τ(前述のτ2)を求めた。
また、50℃~100℃の10℃刻みにて上記と同様の条件で応力緩和測定を行った。50℃~100℃におけるG(t)/G0のプロットを図38に示す。図38に示すように、50℃~100℃にて応力の緩和が確認された。図38に示す曲線は、2項のKWW式に基づく曲線である。(Stress relaxation measurement)
The crosslinked membrane of Example 9 prepared as described above was given an initial strain γ0, and stress relaxation measurements were performed to measure the rate of decrease in stress σ(t) while maintaining the strain constant. Specifically, the crosslinked membrane was placed on a parallel plate with a diameter of 8 mm using an Anton Paar MCR102 device, and stress relaxation measurements were performed at 25°C. For the relaxation modulus G, which is the value obtained by dividing stress by strain, G(t )/G0 , which is the ratio of the relaxation modulus (G(t)) at stress at time t to the relaxation modulus (G 0 ) at the initial stress, was plotted. In addition, the relaxation time τ (the above-mentioned τ2 ), which is the time until the stress σ becomes σ0/e, was obtained.
Stress relaxation measurements were also performed under the same conditions as above at 10°C intervals from 50°C to 100°C. A plot of G(t)/G0 from 50°C to 100°C is shown in Figure 38. As shown in Figure 38, stress relaxation was confirmed at temperatures from 50°C to 100°C. The curve shown in Figure 38 is based on the two-term KWW equation.
図39に示すように、50℃~100℃の各温度(具体的には、1000/T(K))に対して緩和時間(具体的には、In<τ2>)をプロットすることで、アレニウスの式に従う直線が得られた。従って、実施例9にて作製した架橋膜は自己修復性があると推測された。 As shown in Fig. 39, a straight line according to the Arrhenius equation was obtained by plotting the relaxation time (specifically, In<τ2 >) against each temperature (specifically, 1000/T(K)) from 50°C to 100°C. Therefore, it was presumed that the crosslinked film prepared in Example 9 has self-repairing properties.
[実施例10]
(架橋膜の作製)
HPC誘導体2(HPC-Al/PeEt、アリル基の置換度は0.40であり、1-ペンチル基の置換度は2.60)及び架橋剤5(B18COS)を反応させて架橋膜を作製した。具体的には、HPC誘導体2 0.135 gと、架橋剤5(B18COS)41.1 mgとを混合した溶液と、光重合開始剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン7.4 mgと、を混合させて光硬化性組成物5を調製した。このとき、アリル基のモル数に対する架橋剤5(B18COS)に含まれるメルカプト基(-SH)のモル数の比率(メルカプト基/アリル基)は、100%であった。調製した光硬化性組成物5を基板上に膜状に塗布し、膜状の組成物に対して365nmの紫外線を10分間照射してアリル基とメルカプト基とを反応(チオール-エン反応)させた。これにより、B18COSにおけるメルカプト基と、HPC誘導体2におけるアリル基とがチオール-エン反応により架橋してなる高分子を含む架橋膜(厚さ500 μm)を作製した。
実施例10で作製した架橋膜は、室温で緑色のブラッグ反射を示した。[Example 10]
(Preparation of crosslinked membrane)
A crosslinked film was prepared by reacting HPC derivative 2 (HPC-Al/PeEt, the degree of substitution of allyl group was 0.40, and the degree of substitution of 1-pentyl group was 2.60) with crosslinker 5 (B18COS). Specifically, a solution obtained by mixing 0.135 g of
The crosslinked film prepared in Example 10 exhibited green Bragg reflection at room temperature.
[実施例11]
(架橋膜の作製)
HPC誘導体2(HPC-Al/PeEt、アリル基の置換度は0.40であり、1-ペンチル基の置換度は2.60)及び架橋剤6(T11OS)を反応させて架橋膜を作製した。具体的には、HPC誘導体2 0.221 gと、架橋剤6(T11OS)28.2 mgとを混合した溶液と、光重合開始剤である2-ヒドロキシ-2-メチル-1-フェニルプロパン-1-オン5.1 mgと、を混合させて光硬化性組成物6を調製した。このとき、アリル基のモル数に対する架橋剤6(T11OS)に含まれるメルカプト基(-SH)のモル数の比率(メルカプト基/アリル基)は、100%であった。調製した光硬化性組成物6を基板上に膜状に塗布し、膜状の組成物に対して365nmの紫外線を10分間照射してアリル基とメルカプト基とを反応(チオール-エン反応)させた。これにより、T11OSにおけるメルカプト基と、HPC誘導体2におけるアリル基とがチオール-エン反応により架橋してなる高分子を含む架橋膜(厚さ500 μm)を作製した。
実施例11で作製した架橋膜は、室温で緑色のブラッグ反射を示した。[Example 11]
(Preparation of crosslinked membrane)
A crosslinked film was prepared by reacting HPC derivative 2 (HPC-Al/PeEt, the degree of substitution of allyl group was 0.40, and the degree of substitution of 1-pentyl group was 2.60) with crosslinking agent 6 (T11OS). Specifically, a solution obtained by mixing 0.221 g of
The crosslinked film prepared in Example 11 exhibited green Bragg reflection at room temperature.
(応力緩和測定)
前述のようにして作製した実施例11の架橋膜に対して初期ひずみγ0を与え、そのひずみを一定に維持したまま応力σ(t)の減少速度を測定する応力緩和測定を行った。具体的には、アントンパール社のMCR102装置を用い、直径8mmのパラレルプレートに架橋膜を設置し、25℃にて応力緩和測定を行った。応力をひずみで割った値である緩和弾性率Gについて、初期応力における緩和弾性率(G0)に対する時間tでの応力における緩和弾性率(G(t))の比率であるG(t)/G0をプロットした。また、応力σが、σ0/eとなるまでの時間である緩和時間τ(前述のτ2)を求めた。
100℃におけるG(t)/G0のプロットを図40に示す。図40に示すように、応力は緩和しているが、緩和時間が105~106秒オーダーであり、T11OSは化学構造内にボロン酸エステル結合を持たないことから、T11OSは永久架橋剤として機能していることが推測される。(Stress relaxation measurement)
The crosslinked membrane of Example 11 prepared as described above was given an initial strain γ0, and stress relaxation measurement was performed to measure the rate of decrease in stress σ(t) while maintaining the strain constant. Specifically, the crosslinked membrane was placed on a parallel plate with a diameter of 8 mm using an Anton Paar MCR102 device, and stress relaxation measurement was performed at 25°C. For the relaxation modulus G, which is the value obtained by dividing stress by strain, G(t )/G0 , which is the ratio of the relaxation modulus (G(t)) at stress at time t to the relaxation modulus (G 0 ) at the initial stress, was plotted. In addition, the relaxation time τ (the above-mentioned τ2 ), which is the time until the stress σ becomes σ0/e, was obtained.
A plot of G(t)/G0 at 100° C. is shown in Figure 40. As shown in Figure 40, the stress is relaxed, but the relaxation time is on the order of 105 to 106 seconds, and T11OS does not have a boronic ester bond in its chemical structure, so it is presumed that T11OS functions as a permanent cross-linking agent.
合成した架橋剤1(BDB)は室温で固体であった一方、合成した架橋剤2~6(B14OS、B14COS、B14S、B18COS及びT11OS)は、いずれも室温で液体であり、溶媒を使用せずともHPC誘導体と相溶可能であった。The synthesized crosslinker 1 (BDB) was a solid at room temperature, while the synthesized
(ポリブタジエンの準備)
前述の合成した架橋剤1~6と、ポリブタジエン(PB)とを用いて後述のように架橋膜を形成した。ポリブタジエン(PB)については、日本曹達株式会社の液状ポリブタジエン(NISSO PB)のB-3000シリーズを使用した。使用したポリブタジエンについて、1H-NMR測定及びFT-IR測定を行った。1H-NMR測定の結果からポリブタジエン分子鎖中のビニル基含有率が97.3mol%であることを算出した。(Preparation of Polybutadiene)
A crosslinked film was formed as described below using the above-synthesized
[比較例2]
非特許文献1を参考に架橋剤1(BDB)及びポリブタジエンを用いた架橋膜の作製を以下のようにして行った。なお、ポリブタジエン分子鎖中のビニル基含有率を、90mol%と仮定して架橋剤1(BDB)の添加量を決定した。
78.8 mg(ビニル基:1.31mmol)のポリブタジエンに3Åのモレキュラーシーブスで一晩脱水したアニソール(脱水アニソール)316.4 μLを加えた。次に、架橋剤1(BDB)23.4 mg(0.0753 mmol)を脱水アニソール200 μLに溶解させた。架橋剤溶液をポリブタジエン溶液に加えた後、窒素バブリングを行った。次いで、アゾビスイソブチロニトリル(AIBN)を混合溶液に少量(マイクロスパチュラ1/2杯)加え、アルミビーズバスを用いて100℃で加熱した。2時間加熱した後、溶液をスクリュー管に移し、油回転ポンプで30分間減圧した。反応溶液がゲル化した後、500 μmのスペーサーを用いてゲル化物をガラスセルに挟み、アルミビーズバスを用いて150℃で加熱した。30分加熱した後、少し白濁した架橋膜が得られた。[Comparative Example 2]
A crosslinked membrane was prepared using crosslinking agent 1 (BDB) and polybutadiene as follows, with reference to
78.8 mg (vinyl group: 1.31 mmol) of polybutadiene was added with 3 Å molecular sieves overnight dehydrated anisole (dehydrated anisole) at 316.4 μL. Next, 23.4 mg (0.0753 mmol) of crosslinker 1 (BDB) was dissolved in 200 μL of dehydrated anisole. After the crosslinker solution was added to the polybutadiene solution, nitrogen bubbling was performed. Next, a small amount (1/2 microspatula) of azobisisobutyronitrile (AIBN) was added to the mixed solution, and the mixture was heated at 100 ° C. using an aluminum bead bath. After heating for 2 hours, the solution was transferred to a screw tube and decompressed for 30 minutes using an oil rotary pump. After the reaction solution gelled, the gelled product was sandwiched between glass cells using a 500 μm spacer, and heated at 150 ° C. using an aluminum bead bath. After heating for 30 minutes, a slightly cloudy crosslinked film was obtained.
以下の実施例12~16では、架橋剤2~6及びポリブタジエンを用いた架橋膜の作製を以下のようにして行った。なお、ポリブタジエン分子鎖中のビニル基含有率を、前述のように算出した97.3mol%として架橋剤2~6の添加量を決定した。In the following Examples 12 to 16, crosslinked membranes were prepared using
[実施例12]
架橋剤2(B14OS)及びポリブタジエンを用いた架橋膜の作製を以下のようにして行った。
103 mg(ビニル基:1.85 mmol)のポリブタジエンに架橋剤2(B14OS)76.3 mg(0.107 mmol)を加えた。次いで、アゾビスイソブチロニトリル(AIBN)を溶液に少量(マイクロスパチュラ1/2杯)加え、10分間混合した。アルミビーズバスを用いて混合溶液を100℃で1時間程度加熱した。反応溶液がゲル化した後、500 μmのスペーサーを用いてゲル化物をガラスセルに挟み、アルミビーズバスを用いて150℃で加熱した。1時間程度加熱した後、黄色の架橋膜が得られた。[Example 12]
A crosslinked membrane was prepared using crosslinking agent 2 (B14OS) and polybutadiene as follows.
76.3 mg (0.107 mmol) of crosslinking agent 2 (B14OS) was added to 103 mg (vinyl group: 1.85 mmol) of polybutadiene. A small amount (1/2 a microspatula) of azobisisobutyronitrile (AIBN) was then added to the solution and mixed for 10 minutes. The mixed solution was heated at 100°C for about 1 hour using an aluminum bead bath. After the reaction solution gelled, the gel was sandwiched between a glass cell using a 500 μm spacer and heated at 150°C using an aluminum bead bath. After heating for about 1 hour, a yellow crosslinked film was obtained.
[実施例13]
架橋剤3(B14COS)及びポリブタジエンを用いた架橋膜の作製を以下のようにして行った。
104 mg(ビニル基:1.87 mmol)のポリブタジエンに架橋剤3(B14COS)72.2 mg(0.108 mmol)を加えた。次いで、アゾビスイソブチロニトリル(AIBN)を溶液に少量(マイクロスパチュラ1/2杯)加え、10分間混合した。アルミビーズバスを用いて混合溶液を100℃で1時間程度加熱した。反応溶液がゲル化した後、500 μmのスペーサーを用いてゲル化物をガラスセルに挟み、アルミビーズバスを用いて150℃で加熱した。1時間程度加熱した後、無色透明の架橋膜が得られた。[Example 13]
A crosslinked membrane was prepared using crosslinking agent 3 (B14COS) and polybutadiene as follows.
72.2 mg (0.108 mmol) of crosslinking agent 3 (B14COS) was added to 104 mg (vinyl group: 1.87 mmol) of polybutadiene. A small amount (1/2 a microspatula) of azobisisobutyronitrile (AIBN) was then added to the solution and mixed for 10 minutes. The mixed solution was heated at 100°C for about 1 hour using an aluminum bead bath. After the reaction solution gelled, the gel was sandwiched between a glass cell using a 500 μm spacer and heated at 150°C using an aluminum bead bath. After heating for about 1 hour, a colorless and transparent crosslinked film was obtained.
[実施例14]
架橋剤4(B14S)及びポリブタジエンを用いた架橋膜の作製を以下のようにして行った。
97.9 mg(ビニル基:1.76 mmol)のポリブタジエンに架橋剤4(B14S)72.2 mg(0.101 mmol)を加えた。次いで、アゾビスイソブチロニトリル(AIBN)を溶液に少量(マイクロスパチュラ1/2杯)加え、10分間混合した。アルミビーズバスを用いて混合溶液を100℃で1時間程度加熱した。反応溶液がゲル化した後、500 μmのスペーサーを用いてゲル化物をガラスセルに挟み、アルミビーズバスを用いて150℃で加熱した。1時間程度加熱した後、無色透明の架橋膜が得られた。[Example 14]
A crosslinked membrane was prepared using crosslinking agent 4 (B14S) and polybutadiene as follows.
72.2 mg (0.101 mmol) of crosslinking agent 4 (B14S) was added to 97.9 mg (vinyl group: 1.76 mmol) of polybutadiene. A small amount (1/2 a microspatula) of azobisisobutyronitrile (AIBN) was then added to the solution and mixed for 10 minutes. The mixed solution was heated at 100°C for about 1 hour using an aluminum bead bath. After the reaction solution gelled, the gel was sandwiched between a glass cell using a 500 μm spacer and heated at 150°C using an aluminum bead bath. After heating for about 1 hour, a colorless and transparent crosslinked film was obtained.
[実施例15]
架橋剤5(B18COS)及びポリブタジエンを用いた架橋膜の作製を以下のようにして行った。
118 mg(ビニル基:2.13 mmol)のポリブタジエンに架橋剤5(B18COS)95.0 mg(0.100 mmol)を加えた。次いで、アゾビスイソブチロニトリル(AIBN)を溶液に少量(マイクロスパチュラ1/2杯)加え、10分間混合した。アルミビーズバスを用いて混合溶液を100℃で1時間程度加熱した。反応溶液がゲル化した後、500 μmのスペーサーを用いてゲル化物をガラスセルに挟み、アルミビーズバスを用いて150℃で加熱した。1時間程度加熱した後、無色透明の架橋膜が得られた。[Example 15]
A crosslinked membrane was prepared using crosslinking agent 5 (B18COS) and polybutadiene as follows.
95.0 mg (0.100 mmol) of crosslinking agent 5 (B18COS) was added to 118 mg (vinyl group: 2.13 mmol) of polybutadiene. A small amount (1/2 a microspatula) of azobisisobutyronitrile (AIBN) was then added to the solution and mixed for 10 minutes. The mixed solution was heated at 100°C for about 1 hour using an aluminum bead bath. After the reaction solution gelled, the gel was sandwiched between a glass cell using a 500 μm spacer and heated at 150°C using an aluminum bead bath. After heating for about 1 hour, a colorless and transparent crosslinked film was obtained.
[実施例16]
架橋剤6(T11OS)及びポリブタジエンを用いた架橋膜の作製を以下のようにして行った。
102 mg(ビニル基:1.84 mmol)のポリブタジエンに架橋剤6(T11OS)65.1 mg(0.107 mmol)を加えた。次いで、アゾビスイソブチロニトリル(AIBN)を溶液に少量(マイクロスパチュラ1/2杯)加え、10分間混合した。500 μmのスペーサーを用いて混合物をガラスセルに挟み、アルミビーズバスを用いてスペーサーで挟んだ混合物を100℃で1時間程度加熱した。次いで、アルミビーズバスを用いて150℃で1時間程度加熱した後、無色透明の架橋膜が得られた。[Example 16]
A crosslinked membrane was prepared using crosslinking agent 6 (T11OS) and polybutadiene as follows.
65.1 mg (0.107 mmol) of crosslinking agent 6 (T11OS) was added to 102 mg (vinyl group: 1.84 mmol) of polybutadiene. A small amount (1/2 a microspatula) of azobisisobutyronitrile (AIBN) was then added to the solution and mixed for 10 minutes. The mixture was sandwiched between glass cells using a 500 μm spacer, and the mixture sandwiched between the spacers was heated at 100° C. for about 1 hour using an aluminum bead bath. After heating at 150° C. for about 1 hour using an aluminum bead bath, a colorless and transparent crosslinked film was obtained.
比較例2及び実施例12~16の架橋膜について、実施例6の架橋膜と同様にして応力緩和測定を行った。比較例2及び実施例12~16の架橋膜について、応力緩和測定の結果を図41~図46に示す。
比較例2及び実施例12~15の架橋膜では、時間経過に伴う応力の緩和が見られた。また、前述のKWW式により応力緩和曲線をフィッティングすることで緩和時間を算出した。また、比較例2及び実施例12~15の架橋膜では、実施例6と同様にして各温度(具体的には、1000/T(K))に対して緩和時間(具体的には、In<τ>)をプロットすることで、アレニウスの式に従う直線が得られた。従って、比較例2及び実施例12~15の架橋膜は自己修復性があると推測された。 For the crosslinked membranes of Comparative Example 2 and Examples 12 to 16, stress relaxation measurements were performed in the same manner as for the crosslinked membrane of Example 6. The results of the stress relaxation measurements for the crosslinked membranes of Comparative Example 2 and Examples 12 to 16 are shown in Figures 41 to 46.
In the crosslinked membranes of Comparative Example 2 and Examples 12 to 15, stress relaxation over time was observed. In addition, the relaxation time was calculated by fitting the stress relaxation curves using the KWW formula described above. In addition, in the crosslinked membranes of Comparative Example 2 and Examples 12 to 15, a straight line according to the Arrhenius formula was obtained by plotting the relaxation time (specifically, In<τ>) against each temperature (specifically, 1000/T(K)) in the same manner as in Example 6. Therefore, it was presumed that the crosslinked membranes of Comparative Example 2 and Examples 12 to 15 have self-repairing properties.
比較例2で使用した架橋剤1(BDB)は室温で固体であるため、ポリブタジエンとの混合に溶媒が必要であった。
一方、実施例12~16で使用した架橋剤2~6(B14OS、B14COS、B14S、B18COS及びT11OS)は、いずれも室温で液体であるため、ポリブタジエンとの混合に溶媒が不要であり、溶媒の削減が可能であり、かつ架橋膜の作製を簡略化することが可能であった。 The crosslinking agent 1 (BDB) used in Comparative Example 2 was a solid at room temperature, and therefore required a solvent for mixing with the polybutadiene.
On the other hand, the
さらに、実施例12~15の架橋膜(架橋剤2~5を用いて作製した架橋膜)では、HPC誘導体を用いた場合と同様に架橋膜が自己修復性を有する、と推測された。この結果から、HPC誘導体以外の重合性化合物を用いた場合であっても自己修復性材料を作製可能であることが確認できた。
より詳細には、架橋剤2又は5を用いた実施例12及び15の架橋膜は、非常に塑性的であった。緩和曲線の形状に着目すると、HPC誘導体を用いた架橋膜のような数秒オーダーの短時間の緩和は見られなかった。このことから、HPC誘導体を用いた架橋膜の短時間緩和はHPC誘導体由来の緩和であると推測される。
図46に示す実施例16の架橋膜の応力緩和測定の結果では、応力の緩和は観測されなかった。これは、実施例16の架橋膜は、ボロン酸エステル結合を含まないため、結合交換反応を起こさないことが理由と推測される。 Furthermore, it was presumed that the crosslinked films of Examples 12 to 15 (crosslinked films prepared using
More specifically, the crosslinked films of Examples 12 and 15 using
No stress relaxation was observed in the stress relaxation measurement results of the crosslinked membrane of Example 16 shown in Fig. 46. This is presumably because the crosslinked membrane of Example 16 does not contain a boronic acid ester bond and therefore does not undergo a bond exchange reaction.
最後に、架橋剤2(B14OS)の融点を調べる目的で、降温下におけるPOM像の観察を行った。架橋剤2(B14OS)は室温で液体であり、暗視野であった。温度を-45℃まで降温したが、暗視野のままであり、結晶化による明視野への変化は観測されなかった。さらに、架橋剤2(B14OS)をミクロチューブに少量とり、液体窒素で急冷したところ、結晶化した。そのため、架橋剤2(B14OS)の融点は-45℃未満と推測される。Finally, in order to investigate the melting point of crosslinker 2 (B14OS), POM images were observed at lower temperatures. Crosslinker 2 (B14OS) was liquid at room temperature, with a dark field. When the temperature was lowered to -45°C, the dark field remained, and no change to a bright field due to crystallization was observed. Furthermore, when a small amount of crosslinker 2 (B14OS) was placed in a microtube and rapidly cooled with liquid nitrogen, it crystallized. Therefore, it is estimated that the melting point of crosslinker 2 (B14OS) is below -45°C.
[実施例17]
(架橋剤2の合成)
架橋剤2を以下のようにして合成した。架橋剤2の中間体となる化合物(14OS)を合成し、当該化合物を用いて架橋剤2(B14OS)を合成した。14OSの合成にて紫外線照射の替わりに加熱を行った点で実施例1と相違する。
まず、3-アリルオキシ-1,2-プロパンジオール(3-APD、2.00 g、15.1 mmol)を50 mLナスフラスコに加えた。次に、ナスフラスコに脱水THF 5.0 mLを加えて3-APDを溶解させた後、3,6-ジオキサ-1,8-オクタンジチオール(13.8 g、75.7 mmol)とアゾビスイソブチロニトリル(AIBN)10.0 mgを加えて溶液を攪拌した。溶液を60℃のオイルバスに移し、1時間攪拌した。加熱後にエバポレーションで溶媒を除去した。溶媒除去後に生成物をクロロホルムに溶解し、高速液体クロマトグラフィー(HPLC)により目的物を精製した。
以上の操作により、メルカプト基及びヒドロキシ基を有する化合物(14OS)を得た。さらに、実施例17で得られた化合物(14OS)は、図47~図49に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、実施例1の反応式に示す構造を有することを確認した。[Example 17]
(Synthesis of Crosslinker 2)
First, 3-allyloxy-1,2-propanediol (3-APD, 2.00 g, 15.1 mmol) was added to a 50 mL eggplant flask. Next, 5.0 mL of dehydrated THF was added to the eggplant flask to dissolve 3-APD, and then 3,6-dioxa-1,8-octanedithiol (13.8 g, 75.7 mmol) and 10.0 mg of azobisisobutyronitrile (AIBN) were added and the solution was stirred. The solution was transferred to a 60°C oil bath and stirred for 1 hour. After heating, the solvent was removed by evaporation. After removing the solvent, the product was dissolved in chloroform and the target product was purified by high performance liquid chromatography (HPLC).
By the above operations, a compound (14OS) having a mercapto group and a hydroxy group was obtained. Furthermore, it was confirmed that the compound (14OS) obtained in Example 17 has the structure shown in the reaction formula of Example 1 from the peak measurements of the1 H-NMR spectrum,13 C-NMR spectrum, and FT-IR spectrum shown in Figures 47 to 49.
次に、ベンゼン-1,4-ジボロン酸(0.157 g、0.946 mmol)を脱水THF2.0 mLに溶解させた溶液と、合成した化合物(14OS、0.563 g、1.79 mmol)を脱水THF1.0 mLに溶解させた溶液とを混合した。混合溶液に硫酸マグネシウム(0.651 g、5.41 mmol)を加えた。次に、アルミホイルで遮光した状態で、室温(25℃)条件下で混合溶液を1.5時間攪拌した。このとき、反応の進行は薄層クロマトグラフィーにより追跡した。反応後、吸引ろ過により硫酸マグネシウムを除去し、エバポレーターで濃縮後に、反応溶液にヘキサンを加えた。ヘキサンを除去後、反応溶液をクロロホルムに溶解し、HPLCにより目的物を精製した。
以上の操作により、架橋剤2(B14OS)を得た。さらに、実施例17で得られた架橋剤2(B14OS)は、図50~図52に示す1H-NMRスペクトル、13C-NMRスペクトル及びFT-IRスペクトルのピーク測定から、実施例1の反応式に示す構造を有することを確認した。 Next, a solution of benzene-1,4-diboronic acid (0.157 g, 0.946 mmol) dissolved in 2.0 mL of dehydrated THF was mixed with a solution of the synthesized compound (14OS, 0.563 g, 1.79 mmol) dissolved in 1.0 mL of dehydrated THF. Magnesium sulfate (0.651 g, 5.41 mmol) was added to the mixed solution. Next, the mixed solution was stirred for 1.5 hours at room temperature (25° C.) while shielded from light with aluminum foil. At this time, the progress of the reaction was tracked by thin layer chromatography. After the reaction, magnesium sulfate was removed by suction filtration, and the reaction solution was concentrated with an evaporator, and hexane was added to the reaction solution. After removing the hexane, the reaction solution was dissolved in chloroform, and the target product was purified by HPLC.
By the above operations, crosslinking agent 2 (B14OS) was obtained. Furthermore, it was confirmed that crosslinking agent 2 (B14OS) obtained in Example 17 has the structure shown in the reaction formula of Example 1 from peak measurements of the1 H-NMR spectrum,13 C-NMR spectrum and FT-IR spectrum shown in Figures 50 to 52.
実施例1及び実施例17に示すように、紫外線照射又は加熱を行うことで架橋剤2の中間体となる化合物(14OS)が合成可能であることが分かった。また、熱反応の利点としては、合成操作が簡便であり、一度の操作で多量の化合物が合成可能であることが挙げられる。As shown in Examples 1 and 17, it was found that the compound (14OS), which is an intermediate of the
Claims (9)
Translated fromJapanese一般式(1)中、R1は、2価の連結基を表し、R2はそれぞれ独立に、ホウ素原子及び2つの酸素原子とともに4員環~6員環を構成する3価の連結基を表し、R3はそれぞれ独立に、主鎖の原子数が10以上である2価の連結基を表す。 A thiol compound having a structure represented by the following general formula (1):
In general formula (1),R1 represents a divalent linking group, eachR2 independently represents a trivalent linking group forming a 4- to 6-membered ring together with a boron atom and two oxygen atoms, and eachR3 independently represents a divalent linking group having 10 or more atoms in the main chain.
一般式(1A)中、R1は、2価の連結基を表し、R2はそれぞれ独立に、ホウ素原子及び2つの酸素原子とともに4員環~6員環を構成する3価の連結基を表し、R4はそれぞれ独立に、2価の連結基を表し、R5はそれぞれ独立に、2価の連結基を表し、R4及びR5を構成する主鎖の原子数の合計が、一端側及び他端側にてそれぞれ独立に9以上である。 The thiol compound according to claim 1 , wherein the structure represented by the general formula (1) is a structure represented by the general formula (1A).
In general formula (1A),R1 represents a divalent linking group,R2 each independently represents a trivalent linking group forming a 4- to 6-membered ring together with a boron atom and two oxygen atoms,R4 each independently represents a divalent linking group,R5 each independently represents a divalent linking group, and the total number of atoms in the main chain constitutingR4 andR5 is independently 9 or more at one end and the other end.
一般式(2)中、R1Aは、2価の連結基を表し、R2Aはそれぞれ独立に2価の連結基を表し、R3Aはそれぞれ独立に2価の連結基を表し、R2A及びR3Aを構成する主鎖の原子数の合計が、一端側及び他端側にてそれぞれ独立に7以上である。 A thiol compound having a structure represented by the following general formula (2):
In general formula (2), R1A represents a divalent linking group, each R2A independently represents a divalent linking group, each R3A independently represents a divalent linking group, and the total number of atoms in the main chain constituting R2A and R3A is independently 7 or more on one end side and the other end side.
前記架橋剤と反応可能な架橋性基を含む重合性化合物と、
を含む硬化性組成物。 A crosslinking agent according to claim 6 ;
a polymerizable compound having a crosslinkable group capable of reacting with the crosslinking agent;
1. A curable composition comprising:
The cured product according to claim 8, which is a self-repairing material having covalent bonds capable of bond exchange reactions.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023044719AJP2024134421A (en) | 2023-03-20 | 2023-03-20 | Thiol compound, crosslinking agent, curable composition and cured product |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023044719AJP2024134421A (en) | 2023-03-20 | 2023-03-20 | Thiol compound, crosslinking agent, curable composition and cured product |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2024134421Atrue JP2024134421A (en) | 2024-10-03 |
Family
ID=92909964
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023044719APendingJP2024134421A (en) | 2023-03-20 | 2023-03-20 | Thiol compound, crosslinking agent, curable composition and cured product |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2024134421A (en) |
- 2023
- 2023-03-20JPJP2023044719Apatent/JP2024134421A/enactivePending
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Fu et al. | Preparation and properties of UV-curable hyperbranched polyurethane acrylate hard coatings | |
| JP4409397B2 (en) | Silicone resin composition and molded body | |
| US10336938B2 (en) | Liquid crystal composition | |
| JP6911972B2 (en) | Polycondensation resin and optical film made of it | |
| Yamamoto et al. | Synthesis and Thermosensitive Properties of Poly [(N‐vinylamide)‐co‐(vinyl acetate)] s and Their Hydrogels | |
| Suriano et al. | A deep insight into the intrinsic healing mechanism in ureido‐pyrimidinone copolymers | |
| Laysandra et al. | Improving the lifetime of CsPbBr3 perovskite in water using self-healing and transparent elastic polymer matrix | |
| CN102066454A (en) | Light anisotropic film material and light anisotropic film | |
| US9353214B2 (en) | Substituted phenacyl molecules and photoresponsive polymers | |
| JP2024134421A (en) | Thiol compound, crosslinking agent, curable composition and cured product | |
| Wutticharoenwong et al. | Influence of the Thiol Structure on the Kinetics of Thiol‐ene Photopolymerization with Time‐Resolved Infrared Spectroscopy | |
| JP2023079191A (en) | Self-repairable polymer, self-repairable material, and liquid crystal film | |
| CN101231466A (en) | Photosensitive composition, alignment film and method for forming optical compensation film | |
| CN117886838A (en) | Nitrogen-boron coordination cross-linking agent and preparation method thereof, acrylate elastomer adhesive and preparation method thereof | |
| Hwang et al. | Mechanically robust and thermally stable electrochemical devices based on star-shaped random copolymer gel-electrolytes | |
| US9527937B2 (en) | Polymer compound for a conductive polymer and method for producing same | |
| JP2021038354A (en) | Resin composition for optical materials | |
| KR102744394B1 (en) | Method for producing gradient copolymer for optical flim | |
| KR102553747B1 (en) | UV-curable dismantling Pressure sensitive adhesive(PSA) composition and Manufacturing method thereof | |
| JPWO2019189444A1 (en) | Liquid crystal materials, liquid crystal films and their manufacturing methods, sensors, and optical elements | |
| JP2000136220A (en) | Optical material made from synthetic resin and its production | |
| KR20220065649A (en) | Preparation method of Sulfur Containing Cross-linked Polymer using Catalytic Inverse Vulcanization and Sulfur Containing Cross-linked Polymer preparing thereby | |
| Zhang et al. | Photopolymerized and acetylene-functionlized polyacrylates for photoclickable elastomers | |
| Li et al. | Synthesis and characterization of novel biodegradable poly (ester amide) with ether linkage in the backbone chain | |
| CN110452327B (en) | Fluorescent polymer shape memory material and preparation method thereof |