JP2016502448A - Tissue sealant in which collagen and fibrin are mixed and method for producing the same - Google Patents
Tissue sealant in which collagen and fibrin are mixed and method for producing the sameDownload PDFInfo
- Publication number
- JP2016502448A JP2016502448AJP2015546724AJP2015546724AJP2016502448AJP 2016502448 AJP2016502448 AJP 2016502448AJP 2015546724 AJP2015546724 AJP 2015546724AJP 2015546724 AJP2015546724 AJP 2015546724AJP 2016502448 AJP2016502448 AJP 2016502448A
- Authority
- JP
- Japan
- Prior art keywords
- collagen
- fibrin
- substance
- mixed
- present
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/36—Blood coagulation or fibrinolysis factors
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0052—Mixtures of macromolecular compounds
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods
- A61B17/00491—Surgical glue applicators
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/36—Blood coagulation or fibrinolysis factors
- A61K38/363—Fibrinogen
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/39—Connective tissue peptides, e.g. collagen, elastin, laminin, fibronectin, vitronectin, cold insoluble globulin [CIG]
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0028—Polypeptides; Proteins; Degradation products thereof
- A61L26/0033—Collagen
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0028—Polypeptides; Proteins; Degradation products thereof
- A61L26/0042—Fibrin; Fibrinogen
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L33/00—Antithrombogenic treatment of surgical articles, e.g. sutures, catheters, prostheses, or of articles for the manipulation or conditioning of blood; Materials for such treatment
- A61L33/06—Use of macromolecular materials
- A61L33/12—Polypeptides, proteins or derivatives thereof, e.g. degradation products thereof
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/178—Syringes
- A61M5/19—Syringes having more than one chamber, e.g. including a manifold coupling two parallelly aligned syringes through separate channels to a common discharge assembly
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods
- A61B17/00491—Surgical glue applicators
- A61B2017/00495—Surgical glue applicators for two-component glue
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/04—Materials for stopping bleeding
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Chemical & Material Sciences (AREA)
- Materials Engineering (AREA)
- Hematology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Surgery (AREA)
- Heart & Thoracic Surgery (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medical Informatics (AREA)
- Molecular Biology (AREA)
- Vascular Medicine (AREA)
- Anesthesiology (AREA)
- Materials For Medical Uses (AREA)
Abstract
Translated fromJapaneseDescription
Translated fromJapanese本発明は、コラーゲンとフィブリンとが混合された組織シーラント及びその製造方法に関し、より詳しくは、現在市販されているフィブリンシーラントの短所である強度と分解性を補完すると共に、細胞親和的で、かつ血液内に含まれている血小板を活性化させて組織再生を誘導できるようにしたものであり、これによって、製品の品質と信頼性を大幅向上させるので、ユーザである消費者の多様な欲求(ニーズ)を満たして良いイメージを植え付けることができるようにしたものである。 The present invention relates to a tissue sealant in which collagen and fibrin are mixed and a method for producing the same. More specifically, the present invention supplements strength and degradability, which are disadvantages of currently available fibrin sealants, and is cytophilic. It activates platelets contained in the blood to induce tissue regeneration, which greatly improves the quality and reliability of the product. Needs) to be able to plant a good image.
周知のように、医療用シーラントは外科用粘着、接着、及び止血に至るまで多様な分野に適用されており、長い間の歴史を持っている。医療用シーラント材質は人体組織に直接的に適用されるので、生体に適合した物質が使われなければならず、本質的に体液や血液に流入することがあるので、より厳密な生体適合し、生分解物質が使われなければならず、滅菌可能で、かつ毒性や危害が表れてはならない。また、シーラントは組織内に適用された以後にも生体組織との親和度が高くて元の組織で再生を妨害しない材料を選定することが重要である。 As is well known, medical sealants have a long history of application in a variety of fields ranging from surgical adhesion, adhesion, and hemostasis. Since medical sealant material is applied directly to human tissue, a material that is compatible with the living body must be used, and it may essentially flow into body fluids and blood. Biodegradable materials must be used, must be sterilizable, and must not exhibit toxicity or harm. In addition, it is important to select a sealant that has a high affinity with a living tissue even after it is applied to the tissue and does not interfere with regeneration in the original tissue.
現在シーラントの材料には、シアノアクリレート、ポリウレタン、ゼラチン、フィブリンなどを用いて製品に適用している。一般的に、医療用シーラントは皮膚、血管、消化器、脳神経、成形外科、整形外科などの多様な領域で使われている。このようなシーラントに要求される特性は、水分環境での迅速な接着力、滅菌可能で無毒性、創傷面での充分の機械的物性、生分解性、止血効果、及び生体治癒に妨害されてはならない。 Currently, sealant materials such as cyanoacrylate, polyurethane, gelatin, and fibrin are applied to products. In general, medical sealants are used in various fields such as skin, blood vessels, digestive organs, cranial nerves, plastic surgery, and orthopedics. The properties required for such sealants are hampered by rapid adhesion in moisture environments, sterilizable and non-toxic, sufficient mechanical properties at the wound surface, biodegradability, hemostatic effect, and biohealing. Must not.
シアノアクリレートは主に工業用に使われている物質であって、医療用には5%以下に使われるが、縫合糸代替可能性のため、先進国中心の研究が活発に進められている。しかしながら、適用後に衝撃に弱くて、耐熱性、耐水性が落ちる短所と、一部の組織毒性と脆弱性の問題のため、現在制限的に使われている。 Cyanoacrylate is a material mainly used for industrial use, and it is used for medical use at 5% or less. However, due to the possibility of substitution for sutures, research centered on developed countries is actively underway. However, it is currently used in a limited way because of its weakness in impact, low heat resistance and water resistance after application, and some tissue toxicity and fragility issues.
ポリウレタンは接着部の柔軟性が維持される長所を有する物質であって、水との反応性が良くて、速く硬化し、硬化物質が弾性を維持する長所がある。一方、合成原料である芳香族ジイソシアネートが生体毒性があるという短所がある。 Polyurethane is a material having the advantage that the flexibility of the bonded portion is maintained, and has a good reactivity with water, cures quickly, and the cured material maintains elasticity. On the other hand, the aromatic diisocyanate which is a synthetic raw material has a disadvantage that it is biotoxic.
ゼラチンを用いたグルーは生体由来シーラントであって、ゼラチンとレゾルシノールをホルマリンに架橋させた製品と、ゼラチンとポリグルタミン酸とカルボジイミドを用いた製品がある。この製品は、ホルマリンとカルボジイミドの化学的架橋剤を使用して毒性を出すことができる。ホルマリンを架橋剤として使用する製品の場合、一部の国家では使われているが、日本などにはまだ認許が進行中であり、有効性などの検討が進行中である。 Glue using gelatin is a biological sealant, and there are products using gelatin and resorcinol cross-linked to formalin, and products using gelatin, polyglutamic acid and carbodiimide. This product can be toxic using a formalin and carbodiimide chemical crosslinker. In the case of products that use formalin as a cross-linking agent, it is used in some countries, but approval is still in progress in Japan and other countries, and studies on its effectiveness are ongoing.
フィブリングルーは、フィブリノゲン、トロンビン、塩化カルシウムなどを材料にして、フィブリン形成の原理を用いて製品に適用した製品である。接着が速くて熱や圧力が不要であり、接着部位の環境にあまり影響を受けず、生体適合し、生分解特性などの生物学的長所を有する一方、合成物質を用いたシーラントと比較して物理的特性が不足して、生分解速度が相対的に速いという短所がある。このような短所を克服するためにフィブリン重合体の分解速度を遅くし、形態を維持させるためにアプロチニンを添加してフィブリン分解酵素を阻害させる努力をしている。このような短所を補完するために、コラーゲンを添加物質として使用することはフィブリングルー製剤の補完に大きく寄与する。 Fibrin glue is a product applied to products using fibrin formation principle using fibrinogen, thrombin, calcium chloride and the like as materials. Bonding is fast and does not require heat or pressure, is not significantly affected by the environment of the bonding site, is biocompatible and has biological advantages such as biodegradability, while compared to sealants using synthetic materials There are shortcomings in that the physical properties are insufficient and the biodegradation rate is relatively fast. In order to overcome such disadvantages, the degradation rate of the fibrin polymer is slowed down, and aprotinin is added to inhibit the fibrin degrading enzyme in order to maintain the morphology. In order to compensate for these disadvantages, the use of collagen as an additive material greatly contributes to the supplementation of the fibrin glue preparation.
フィブリングルーに使われるフィブリンは、天然材料の接着剤/止血剤として応用されて産業化されており、生体適合性及び生分解性を有する。フィブリンは数週内に一般的に傷の治癒過程で吸収され、炎症反応、免疫反応、組織壊死、または繊維肥大症などの副作用がないことと知られている。また、フィブリンは繊維芽細胞のための天然支持体などの形態で傷の治療に重要な役割を担当する。フィブリン製品は1970年代に概念が定立されて1982年ヨーロッパで最初の製品が商業化されて現在まで使われている。最近、多くの研究でフィブリンを生体組織工学的支持体として立証されており、整形外科、歯科、神経外科など、多様な分野に適用されている。 Fibrin used in fibrin glue is applied and industrialized as an adhesive / hemostatic agent for natural materials and has biocompatibility and biodegradability. Fibrin is generally absorbed in the wound healing process within a few weeks and is known to have no side effects such as inflammatory response, immune response, tissue necrosis, or fiber hypertrophy. Fibrin also plays an important role in wound healing in the form of a natural support for fibroblasts. The concept of fibrin products was established in the 1970s, and the first product was commercialized in Europe in 1982 until now. Recently, many studies have demonstrated fibrin as a tissue engineering support, and it has been applied to various fields such as orthopedics, dentistry, and neurosurgery.
フィブリングルーの短所を補完するために添加物質として使用できるコラーゲンは構造蛋白質成分である。真皮(dermis)、腱/筋(tendon/ligament)、血管などの軟組織、
そして、骨、軟骨のような硬組織から構成され、哺乳類の場合、全体蛋白質の約1/3程度を占めている。コラーゲンの形態は20種類以上が知られており、皮膚や腱/筋、骨などを構成するコラーゲンtype Iがコラーゲンのうちの90%程度を占めている。コラーゲンの構造は3本から構成された分子量(molecular weight)300,000ダルトン(Dalton)(1本100,000Dalton程度)の蛋白質であり、アミノ酸のうち、最も小さな単位(分子量が最も小さな)であるGlycineが反復的に(−GXY−;Glycineは続けて反復的に、X、Yは変わる構成)連結されている。したがって、Glycineがコラーゲンを構
成するアミノ酸で約1/3を占めている。コラーゲンを現在医療用に使用している分野は、止血剤、創傷被覆剤、人工血管、シワ改善用などに使われており、止血剤の場合には1974年子牛の皮(calf skin)から抽出したコラーゲン粉末形態であるアビデン(Aviten)という製品が最初に開発されて現在までも使われている。Collagen that can be used as an additive to supplement the shortcomings of fibrin glue is a structural protein component. Soft tissues such as dermis, tendon / ligament, blood vessels,
It is composed of hard tissues such as bone and cartilage. In the case of mammals, it accounts for about 1/3 of the total protein. More than 20 types of collagen are known, and collagen type I constituting skin, tendons / muscles, bones, etc. occupies about 90% of collagen. The structure of collagen is a protein consisting of three proteins with a molecular weight of 300,000 Dalton (one 100,000 Dalton), and the smallest unit of amino acids (the smallest molecular weight). Glycine is linked repeatedly (-GXY-; Glycine continues repeatedly, X and Y vary). Therefore, Glycine accounts for about 1/3 of the amino acids constituting collagen. Collagen is currently used for medical purposes in hemostatic agents, wound dressings, artificial blood vessels, wrinkle improvement, etc. In the case of hemostatic agents, from 1974 calf skin A product called Aviten, which is in the form of extracted collagen powder, was first developed and used to date.
何よりもコラーゲンを医療再生分野に使用する一番の特徴は、人体組織に生体適合して細胞親和性を示す物質であるので、細胞の付着と増殖、そして生存力維持に重要な物質ということである。また、血液内に含まれている血小板を刺激して血小板内に含まれている増殖因子を誘導して欠損した組織を再生する役割をする。それだけでなく、コラーゲンの構造は、三重螺旋構造は単一構造の蛋白質より相対的に分解性が維持されて人体内でスカフォールドの役割をすることができる。 Above all, the best feature of using collagen in the medical regeneration field is that it is a substance that is biocompatible with human tissues and exhibits cell affinity, so it is an important substance for cell attachment and proliferation, and maintenance of viability. is there. In addition, it stimulates platelets contained in the blood to induce growth factors contained in the platelets to regenerate the deficient tissue. In addition, the collagen structure of the triple helix structure is more degradable than a single structure protein and can act as a scaffold in the human body.
このような物質の結合は、基本的に組織シーラントが有するべき生分解性特性を有し、再生を妨害しない特性を維持するだけでなく、フィブリングルーの足りない物性である物理的特性を補完し、分解程度を遅らせて分解性の再生骨格を提供する。それで、単純シーラントとして役割に加えて組織再生を促進し、再生過程を加速して治療過程を短縮させる。そして、速かに使用するためにプレフィルドタイプで装着して冷凍保管する剤形も可能である。 The binding of such substances basically has the biodegradable properties that the tissue sealant should have, not only maintaining the properties that do not interfere with regeneration, but also complementing the physical properties that are lacking in fibrin glue. , Providing a degradable regenerative skeleton with delayed degradation. Therefore, in addition to its role as a simple sealant, it promotes tissue regeneration, accelerates the regeneration process and shortens the treatment process. In addition, a dosage form that is pre-filled and stored frozen for quick use is also possible.
組織シーラントは、傷の手術部位の縫合、塗布する場合、従来の方法より少ない苦痛と、感染危険が少なく、手術時間が短縮されるなど、患者の施術的負担を減らし、満足度を極大化する製品であって、この分野に大きく脚光を浴びるものであり、市場規模も徐々に拡大されている。また、このような製品の開発は組織の再生を助けるだけでなく、今後、薬物伝達システム及び再生用スカフォールドなどに使用して、再生医学分野にも大きく寄与する。 Tissue sealant minimizes patient's surgical burden and maximizes satisfaction, such as less pain, less risk of infection and shorter operation time when sutured and applied to the surgical site of wounds It is a product, and has attracted a great deal of attention in this field, and the market size is gradually expanding. In addition, the development of such products not only assists in tissue regeneration, but also contributes greatly to the field of regenerative medicine in the future by using it in drug delivery systems and regeneration scaffolds.
本発明は、上記のような従来技術の諸問題点を解消するために案出したものであって、フィブリノゲンとアプロチニンを用いて第1物質を混合するステップと、トロンビンと塩化カルシウム及びコラーゲンを用いて第2物質を混合するステップ、及び第1物質と第2物質とを相互混合して第3物質を製造するステップが含まれることを第1目的としたものであり、上記の技術的構成による本発明の第2目的は、物理的強度を比較した結果、コラーゲンが含まれたシーラントが高い強度を示すことを確認したものであり、第3の目的は、長期/短期分解性試験結果、コラーゲンが含まれたシーラントが分解されることが低いことを示すことを確認したものであり、第4の目的は、電子顕微鏡観察を通じてコラーゲンとフィブリンとが結合されて安定した構造を示すことを確認したものであり、第5の目的は、軟骨細胞、骨細胞、脂肪抽出細胞を用いて増殖及び生存力を比較した結果、コラーゲンが含まれた構造で増殖率が良かったし、高い生存力を示すことを確認したものであり、第6の目的は、コラーゲンが含まれれば高い強度と安定した構造の維持、及び細胞/血液親和的な物質が供給されて、欠損/損傷部位の再生に大きい助けになるということを確認したものであり、第7の目的は、血液内に含まれている血小板を活性化させて組織再生を誘導できるようにしたものであり、第8の目的は、これによって製品の品質と信頼性を格段に向上させるので、ユーザである消費者の多様な欲求(ニーズ)を満たして、良いイメージを植え付けることができるようにしたコラーゲンとフィブリンとが混合された組織シーラント及びその製造方法を提供する。 The present invention has been devised to solve the problems of the prior art as described above, and includes a step of mixing a first substance using fibrinogen and aprotinin, and using thrombin, calcium chloride and collagen. And the step of mixing the second substance and the step of manufacturing the third substance by intermixing the first substance and the second substance. The second object of the present invention is to confirm that the sealant containing collagen shows a high strength as a result of comparing the physical strength, and the third object is the result of long-term / short-term degradability test, collagen The fourth purpose is to confirm that collagen and fibrin are bound through observation under an electron microscope. The fifth objective was to compare the proliferation and viability using chondrocytes, bone cells, and adipose-extracted cells. As a result, the growth rate was increased in a structure containing collagen. It was good and confirmed to show high viability, and the sixth purpose is that if collagen is included, high strength and stable structure maintenance, and a cell / hemophilic substance are supplied, It was confirmed that it helps greatly in the regeneration of the defect / damage site, and the seventh purpose is to activate the platelets contained in the blood to induce tissue regeneration. The eighth objective is to significantly improve the quality and reliability of the product, so that it can meet the various needs (needs) of consumers as users and plant a good image. F Brin and provides a mixed tissue sealant and a manufacturing method thereof.
このような目的の達成のために、本発明はフィブリノゲンとアプロチニンを混合して第1物質を製造するステップ、トロンビンと塩化カルシウム及びコラーゲンを混合して第2物質を製造するステップ、及び第1物質と第2物質とを相互混合して第3物質を製造するステップが含まれることを特徴とする、コラーゲンとフィブリンとが混合された組織シーラントの製造方法を提供する。 In order to achieve such an object, the present invention provides a step of producing a first substance by mixing fibrinogen and aprotinin, a step of producing a second substance by mixing thrombin, calcium chloride and collagen, and a first substance. A method for producing a tissue sealant in which collagen and fibrin are mixed is provided, which includes a step of producing a third substance by intermixing the first substance and the second substance.
また、本発明はフィブリノゲンとアプロチニンを用いて第1物質を混合するステップ、トロンビンと塩化カルシウム及びコラーゲンを用いて第2物質を混合するステップ、及び第1物質と第2物質とを相互混合して第3物質を製造するステップを経てコラーゲンとフィブリンとが混合された組織シーラントを提供する。 The present invention also includes a step of mixing the first substance using fibrinogen and aprotinin, a step of mixing the second substance using thrombin, calcium chloride and collagen, and a mixture of the first substance and the second substance. A tissue sealant in which collagen and fibrin are mixed is provided through a step of manufacturing a third substance.
前述したように、本発明はフィブリノゲンとアプロチニンを用いて第1物質を混合するステップ、トロンビンと塩化カルシウム及びコラーゲンを用いて第2物質を混合するステップ、及び第1物質と第2物質とを相互混合して第3物質を製造するステップが含まれる。 As described above, the present invention includes a step of mixing the first substance using fibrinogen and aprotinin, a step of mixing the second substance using thrombin, calcium chloride and collagen, and the first substance and the second substance. Mixing to produce a third material.
上記の技術的構成による本発明は、物理的強度を比較した結果、コラーゲンが含まれたシーラントが高い強度を示すことを確認した。 As a result of comparing the physical strengths of the present invention with the above technical configuration, it was confirmed that the sealant containing collagen exhibits high strength.
そして、本発明は長期/短期分解性を試験した結果、コラーゲンが含まれたシーラントが分解されることが低いことを確認した。 As a result of testing the long-term / short-term degradability, the present invention confirmed that the sealant containing collagen is less likely to be degraded.
また、本発明は電子顕微鏡観察を通じてコラーゲンとフィブリンとが結合されて安定した構造を示すことを確認した。 In addition, the present invention has confirmed that collagen and fibrin are bonded and show a stable structure through observation with an electron microscope.
そして、本発明は軟骨細胞、骨細胞、脂肪抽出細胞を用いて増殖及び生存力を比較した結果、コラーゲンが含まれた構造で増殖率が良かったし、高い生存力を示すことを確認した。 As a result of comparison of proliferation and viability using chondrocytes, bone cells, and fat-extracted cells, the present invention confirmed that the structure containing collagen had a good proliferation rate and high viability.
併せて、本発明はコラーゲンが含まれれば高い強度と安定した構造の維持、及び細胞/血液親和的な物質が供給されて欠損/損傷部位の再生に大きい助けになるということを確認した。 In addition, the present invention has been confirmed that if collagen is contained, maintenance of a high strength and a stable structure, and a cell / hemophilic substance are supplied to greatly regenerate a defect / damage site.
また、本発明は血液内に含まれている血小板を活性化させて組織再生を誘導できるようにしたものである。 In addition, the present invention activates platelets contained in blood to induce tissue regeneration.
本発明は、上記の効果により製品の品質と信頼性を大幅向上させるので、ユーザである消費者の多様な欲求(ニーズ)を満たして、良いイメージを植え付けることができるようにした非常に有用な発明である。 The present invention greatly improves the quality and reliability of the product due to the above-mentioned effects, so that it is possible to plant a good image by satisfying the various needs (needs) of consumers who are users. It is an invention.
以下、このような効果達成のための本発明の好ましい実施形態を添付の図面によって詳細に説明すると、次の通りである。 Hereinafter, preferred embodiments of the present invention for achieving such effects will be described in detail with reference to the accompanying drawings.
本発明に適用されたコラーゲンとフィブリンとが混合された組織シーラント及びその製造方法は、図1から図10に示すように構成される。 The tissue sealant mixed with collagen and fibrin applied to the present invention and the manufacturing method thereof are configured as shown in FIGS.
以下、本発明を説明するに当たって、関連した公知機能または構成に対する具体的な説明が本発明の要旨を曖昧にすることがあると判断される場合には、その詳細な説明は省略する。 In the following description of the present invention, when it is determined that a specific description of a related known function or configuration may obscure the gist of the present invention, a detailed description thereof will be omitted.
そして、後述する用語は本発明での機能を考慮して設定された用語であって、これは生産者の意図または慣例によって変わることがあるので、その定義は本明細書の全般に亘る内容に基づいて下さなければならない。 The terms to be described later are terms set in consideration of the functions in the present invention, and this may vary depending on the intention or practice of the producer. Must be based on.
まず、本発明はフィブリノゲンとアプロチニンを用いて第1物質を混合するステップが備えられる。 First, the present invention includes a step of mixing a first substance using fibrinogen and aprotinin.
そして、本発明はトロンビンと塩化カルシウム及びコラーゲンを用いて第2物質を混合するステップが備えられる。 The present invention includes a step of mixing the second substance using thrombin, calcium chloride, and collagen.
また、本発明は第1物質と第2物質とを相互混合して第3物質を製造するステップが備えられて、コラーゲンとフィブリンとが混合された組織シーラントを製造するようになる。 In addition, the present invention includes a step of producing a third substance by intermixing the first substance and the second substance to produce a tissue sealant in which collagen and fibrin are mixed.
特に、本発明に適用された上記フィブリノゲンの濃度は65〜130mg/mL、アプロチニンの濃度は1,000〜3,000KIU/mLからなることが好ましい。 In particular, the fibrinogen concentration applied to the present invention is preferably 65 to 130 mg / mL, and the aprotinin concentration is preferably 1,000 to 3,000 KIU / mL.
そして、上記トロンビンの濃度は40〜600U/ml、塩化カルシウムの濃度は4〜140mmol/mL、コラーゲンの濃度は60mg/mL以下からなることが好ましい。 The thrombin concentration is preferably 40 to 600 U / ml, the calcium chloride concentration is 4 to 140 mmol / mL, and the collagen concentration is preferably 60 mg / mL or less.
この際、上記フィブリノゲンの好ましい濃度は65〜130mg/mLであり、これはフィブリノゲンが65mg/mL以下の場合には物理的強度が弱くなり、フィブリノゲンが130mg/mL以上の場合には物理的構造が稠密になって、空隙のサイズが小さくなって、細胞の活性を阻害させることがあるので、上記フィブリノゲンの濃度は65〜130mg/mLが好ましい。 At this time, the preferred concentration of the fibrinogen is 65 to 130 mg / mL. This is because the physical strength is weak when the fibrinogen is 65 mg / mL or less, and the physical structure is when the fibrinogen is 130 mg / mL or more. The density of the fibrinogen is preferably 65 to 130 mg / mL because it may become dense and the size of the voids may be reduced to inhibit cell activity.
また、上記アプロチニンの好ましい濃度は1,000〜3,000KIU/mLであり、これはアプロチニンが1,000KIU/mL以下の場合には組成物の分解が速く進行され、アプロチニンが3,000KIU/mL以上の場合にはアナフィラキシーを誘発する危険性が増加するため、上記アプロチニンの濃度は1,000〜3,000KIU/mLが好ましい。 The preferred concentration of aprotinin is 1,000 to 3,000 KIU / mL. When aprotinin is 1,000 KIU / mL or less, decomposition of the composition proceeds rapidly, and aprotinin is 3,000 KIU / mL. In the above case, since the risk of inducing anaphylaxis increases, the concentration of aprotinin is preferably 1,000 to 3,000 KIU / mL.
また、上記トロンビンの好ましい濃度は40〜600U/mlであり、これはトロンビンが40U/ml以下の場合には組成物の物理的強度が弱くなり、トロンビンが600U/ml以上の場合には組成物の構造が稠密になって細胞親和的でなく、ゲル化速度が急激に速くなって適用部位にシーラントとして役割できない可能性があるため、上記トロンビンの濃度は40〜600U/mlが好ましい。 The preferable concentration of the thrombin is 40 to 600 U / ml. When the thrombin is 40 U / ml or less, the physical strength of the composition becomes weak. When the thrombin is 600 U / ml or more, the composition is reduced. The concentration of the thrombin is preferably 40 to 600 U / ml, because the structure becomes dense and not cytophilic, and the gelation rate rapidly increases and cannot serve as a sealant at the application site.
また、上記塩化カルシウムの好ましい濃度は4〜140mmol/mLであり、これは塩化カルシウムが4mmol/mL以下の場合にはゲル化速度があまりに遅く、塩化カルシウムが140mmol/mL以上の場合には高い浸透圧の影響により細胞によくない影響を及ぼすことがあるので、上記塩化カルシウムの濃度は4〜140mmol/mLが好ましい。 The preferred concentration of calcium chloride is 4 to 140 mmol / mL, which is too slow when calcium chloride is 4 mmol / mL or less, and high penetration when calcium chloride is 140 mmol / mL or more. The concentration of the calcium chloride is preferably 4 to 140 mmol / mL because it may adversely affect the cells due to the effect of pressure.
最後に、上記コラーゲンの濃度は60mg/mL以下からなることが好ましく、特に、上記コラーゲンの好ましい濃度は10〜30mg/mLからなることが好ましい。 Finally, the collagen concentration is preferably 60 mg / mL or less, and particularly preferably the collagen concentration is 10 to 30 mg / mL.
即ち、上記コラーゲンが10mg/mL以下の場合には物理的強度が弱くなり、コラーゲンが30mg/mL以上の場合には分解性と安定した構造維持及び細胞血液内親和的でないので、上記コラーゲンの濃度は10〜30mg/mLからなることが好ましい。 That is, when the collagen is 10 mg / mL or less, the physical strength is weak, and when the collagen is 30 mg / mL or more, the degradability, stable structure maintenance, and affinity for intracellular blood are not high. Is preferably 10 to 30 mg / mL.
一方、本発明に適用された上記コラーゲンとフィブリンとが混合された組織シーラントの製造方法をより具体的に説明すると、次の通りである。 On the other hand, a method for producing a tissue sealant in which the collagen and fibrin applied to the present invention are mixed will be described in more detail as follows.
まず、フィブリノゲンとアプロチニンとが備えられた第1物質を用意するステップを経る。 First, a step of preparing a first substance provided with fibrinogen and aprotinin is performed.
以後、トロンビンと塩化カルシウム及びコラーゲンが備えられた第2物質を用意するステップを経る。 Thereafter, a step of preparing a second substance provided with thrombin, calcium chloride, and collagen is performed.
次に、上記第1物質はデュアルキット(Two-way syringe)の一側に入れて、第2物質
はデュアルキット(Two-way syringe)の他側に入れた後、相互に第1及び第2物質を混
合するステップを経てコラーゲンとフィブリンとが混合された組織シーラントを製造するようになる。Next, the first substance is placed on one side of the dual kit (Two-way syringe), and the second substance is placed on the other side of the dual kit (Two-way syringe). A tissue sealant in which collagen and fibrin are mixed is manufactured through a step of mixing substances.
加えて、本発明は上記フィブリノゲンとトロンビンにアプロチニンとカルシウム溶液を各々注入し、トロンビンにはコラーゲン溶液を混合してデュアルキットに装着してコラーゲンとフィブリンとが混合された組織シーラントを製造するようになる。 In addition, in the present invention, aprotinin and calcium solution are injected into the fibrinogen and thrombin, respectively, and the collagen solution is mixed with thrombin and attached to the dual kit to produce a tissue sealant in which collagen and fibrin are mixed. Become.
本発明は、上記のコラーゲンとフィブリンとが混合された組織シーラントを製造する各ステップを経てコラーゲンとフィブリンとが混合された組織シーラントを製造できるようになる。 According to the present invention, a tissue sealant in which collagen and fibrin are mixed can be manufactured through each step of manufacturing a tissue sealant in which collagen and fibrin are mixed.
上記の本願発明コラーゲンとフィブリンとが混合された組織シーラント及びその製造方法を実施形態を挙げて説明すると、次の通りである。 The tissue sealant in which the above-described collagen of the present invention and fibrin are mixed and the method for producing the tissue sealant will be described as follows.
(実施形態1)
本発明と従来技術との物性比較
本発明の物理的特性を確認するために物性測定機を用いて最大応力、ジェル強度、引張強度などを確認した。(Embodiment 1)
Comparison of physical properties between the present invention and the prior art In order to confirm the physical properties of the present invention, maximum stress, gel strength, tensile strength, etc. were confirmed using a physical property measuring machine.
1.試料用意
1)従来技術はグリーンプラスト製品を使用した。
2)本発明の構成物はグリーンプラストのフィブリノゲンとトロンビン乾燥物にアプロチニン溶液とカルシウム溶液を各々注入して溶解させ、トロンビン溶液には3%コラーゲン溶液を混合してデュアルキットに装着して用意する。
3)物性の測定のために各々試料を円柱形態(Φ12X15mm)の鋳型に入れて形態を製作する。1. Sample preparation 1) The conventional technology used a green plast product.
2) The composition of the present invention is prepared by injecting aprotinin solution and calcium solution into green plast fibrinogen and dried thrombin, respectively, and dissolving the thrombin solution with a 3% collagen solution and mounting it in a dual kit. .
3) For measurement of physical properties, each sample is placed in a cylindrical mold (Φ12 × 15 mm) to produce a form.
2.物性測定
1)物性測定機:レオメータ(Rheometer)(CR-500DX、Sun scientific rheometer)
2)試験項目:最大応力(N)、ジェル強度(g−cm)、引張強度(c/cm2)
3)試験条件:進入距離(7.5mm)、テーブルスピード(50mm/min)、最大応力(10kg)、アダプター(No.1 Φ20mm)2. Physical property measurement 1) Physical property measuring machine: Rheometer (CR-500DX, Sun scientific rheometer)
2) Test items: Maximum stress (N), gel strength (g-cm), tensile strength (c / cm2)
3) Test conditions: entry distance (7.5 mm), table speed (50 mm / min), maximum stress (10 kg), adapter (No. 1 Φ20 mm)
3.試験結果
(実施形態2)
本発明と引用発明製品との分解性比較(短期/長期)
本発明の組成物の分解性を確認するために、フィブリングルー製品と一定期間の間物質の分解程度を確認する。(Embodiment 2)
Degradability comparison between the present invention and the cited invention product (short term / long term)
In order to confirm the degradability of the composition of the present invention, the degree of degradation of the substance is confirmed for a certain period with the fibrin glue product.
1.分解性(短期)
1)試料用意
−従来技術はグリーンプラスト製品を使用した。
−本発明の構成物はグリーンプラストのフィブリノゲンとトロンビン乾燥物にアプロチニン溶液とカルシウム溶液を各々注入して溶解させ、トロンビン溶液には3%コラーゲン溶液を混合してデュアルキットに装着して用意する。
−物性の測定のために各々試料を円柱形態(Φ8X5mm)の鋳型に入れて形態を製作する。1. Degradability (short term)
1) Sample preparation-The prior art used green plast products.
The composition of the present invention is prepared by injecting and dissolving aprotinin solution and calcium solution in green plast fibrinogen and dried thrombin, respectively, and mixing the thrombin solution with a 3% collagen solution and mounting it in a dual kit.
-Each sample is put into a cylindrical mold (Φ8X5mm) for the measurement of physical properties, and the form is manufactured.
2)分解性確認のための処理条件
−溶媒は2つ条件を確認した。DMEM培地のみを使用した条件とリベラーゼ TM(Liberase TM)が含まれたDMEM培地を使用した条件で確認した。(Liberase TMの濃度は10ug/mLとする。)
−試料は12ウエルプレート(well plate)に入れて12時間の間2時間単位で組成物の残存重さにて分解性様相を確認する。2) Treatment conditions for confirming decomposability-Two conditions for solvent were confirmed. Confirmation was made under conditions using only DMEM medium and conditions using DMEM medium containing Liberase ™. (The concentration of Liberase TM is 10 ug / mL.)
-The sample is placed in a 12-well plate and the degradability aspect is confirmed by the remaining weight of the composition in units of 2 hours for 12 hours.
3)試験結果
−酵素処理した分解条件では従来技術の剤形が12時間内に90%以上の分解を確認したものであり、本発明の組成物は12時間の間80%位残留されることを確認することができる。DMEM条件では12時間の間は分解程度を確認できなかった。3) Test results-Under the enzyme-treated degradation conditions, the dosage form of the prior art confirmed 90% or more degradation within 12 hours, and the composition of the present invention remains about 80% during 12 hours. Can be confirmed. Under DMEM conditions, the degree of degradation could not be confirmed for 12 hours.
2.分解性(長期)
1)試料用意
−従来技術はグリーンプラスト製品を使用した。
−本発明の構成物はグリーンプラストのフィブリノゲンとトロンビン乾燥物にアプロチニン溶液とカルシウム溶液を各々注入して溶解させ、トロンビン溶液には3%コラーゲン溶液を混合してデュアルキットに装着して用意する。
−物性測定のために、各々試料を円柱形態(Φ12X15mm)の鋳型に入れて形態を製作する。2. Degradability (long term)
1) Sample preparation-The prior art used green plast products.
The composition of the present invention is prepared by injecting and dissolving aprotinin solution and calcium solution in green plast fibrinogen and dried thrombin, respectively, and mixing the thrombin solution with a 3% collagen solution and mounting it in a dual kit.
-For the measurement of physical properties, each sample is put into a cylindrical mold (Φ12 × 15 mm) to produce a form.
2)分解性確認のための処理条件
−溶媒はDMEMを使用し、37℃条件で1ヶ月間肉眼観察する。2) Treatment conditions for confirming degradability-Use DMEM as a solvent, and visually observe at 37 ° C for 1 month.
3)試験結果
−本発明の組成物は1ヶ月以上観察されるが、従来技術の剤形は3週内に分解された。本発明の組成物が従来技術の剤形より分解期間が長いことが確認された。3) Test results-The composition of the present invention was observed for more than a month, whereas the prior art dosage forms were degraded within 3 weeks. It has been determined that the composition of the present invention has a longer degradation period than prior art dosage forms.
(実施形態3)
本発明の電子顕微鏡分析
本発明組成物の構造を電子顕微鏡で観察する。(Embodiment 3)
Electron Microscopic Analysis of the Present Invention The structure of the composition of the present invention is observed with an electron microscope.
1.試料用意
−組成物の製造はグリーンプラストのフィブリノゲン溶液とコラーゲンとが含まれたトロンビン/カルシウム溶液に各々用意する。コラーゲン溶液の濃度は3%(w/v)適用する。
−用意された各々の溶液はデュアルキットに適用して電子顕微鏡観察のためのトレーに分周してゲル化させる。1. Sample preparation—The compositions are prepared in a thrombin / calcium solution containing green plast fibrinogen solution and collagen. A collagen solution concentration of 3% (w / v) is applied.
-Each prepared solution is applied to a dual kit, and divided into a tray for electron microscope observation to be gelled.
2.実験方法
−本発明の組成物は臨界点乾燥させた後、電子顕微鏡観察する。
−組成物の臨界点乾燥はアルコール処理を通じて進行し、臨界点乾燥器(Hitachi、H
CP−2)で進行する。
−電子顕微鏡で観察するための試料は検体切断してゴールドコーティングを実施した後、SEM(Hitachi、S3500)で観察する。
−電子顕微鏡分析は2万倍拡大して観察した。2. Experimental Method—The composition of the present invention is critical point dried and then observed with an electron microscope.
-Critical point drying of the composition proceeds through alcohol treatment, and critical point dryers (Hitachi, H
Proceed with CP-2).
-Samples to be observed with an electron microscope are cut with a specimen and subjected to gold coating, and then observed with SEM (Hitachi, S3500).
-Electron microscope analysis was observed at a magnification of 20,000 times.
3.試験結果
電子顕微鏡で2万倍拡大して観察した結果、コラーゲンとフィブリン成分が互いに交差して架橋される様相が確認された。コラーゲンの繊維構造も観察された。このような物質の交差を通じて物理的特性が補強されることを予想することができる。3. Test results As a result of magnifying the sample by 20,000 times with an electron microscope, it was confirmed that collagen and fibrin components cross each other and cross-link. Collagen fiber structure was also observed. It can be expected that the physical properties are reinforced through the intersection of such materials.
(実施形態4)
本発明の細胞適合性及び増殖確認試験(軟骨細胞)
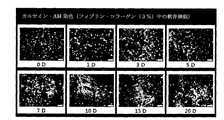
本発明の組成物内で軟骨細胞の増殖(proliferation)と生存率(viability)の様相を確認するために、CCK-8 アッセイ(assay)及びカルセイン-AM及びEthD-1 染色 (Calcein-AM & EthD-1 staining)を用いた。(Embodiment 4)
Cell compatibility and proliferation confirmation test of the present invention (chondrocytes)
In order to confirm the aspect of proliferation and viability of chondrocytes within the composition of the present invention, CCK-8 assay (assay) and calcein-AM and EthD-1 staining (Calcein-AM & EthD) -1 staining) was used.
1.細胞及び組成物
−細胞は人間を除外した動物の軟骨細胞を使用した。細胞数は組成物混合液内の1,200万個を適用した。
−組成物はフィブリングルー製品であるグリーンプラストとコラーゲンを各々3%、6%コラーゲンを混合して構成した。
−組成物の製造はグリーンプラストのフィブリノゲン乾燥物に軟骨細胞が含まれた溶液1mLを適用して溶解させ、トロンビン/カルシウム溶液に各々濃度のコラーゲン溶液1mLを混合した。
−軟骨細胞が含まれたフィブリノゲン溶液とコラーゲンが含まれたトロンビン溶液は総2mLのコラーゲン−フィブリン溶液が用意される。
−用意されたコラーゲン−フィブリン構成物は培養のために24well plateに0.2mLずつ分周し、2−3日毎にDMEM培地を取り替えながら20日間観察する。1. Cells and compositions-Cells used were animal chondrocytes excluding humans. The number of cells applied was 12 million in the composition mixture.
-The composition consisted of 3% and 6% collagen mixed with green plast and collagen, which are fibrin glue products.
-The composition was prepared by applying 1 mL of a solution containing chondrocytes to dried green plastin fibrinogen, and mixing 1 mL of collagen solution of each concentration into the thrombin / calcium solution.
-A total of 2 mL of collagen-fibrin solution is prepared for the fibrinogen solution containing chondrocytes and the thrombin solution containing collagen.
The prepared collagen-fibrin composition is divided by 0.2 mL into a 24-well plate for culturing and observed for 20 days while changing the DMEM medium every 2-3 days.
2.CCK-8 アッセイ(assay)
−培養物が盛られたウエル(well)(24well plate)の培地を除去する。
−新たな培地1mLを入れる。
−CCK−8(Dojindo、CK04−11)試薬を培地容量の10%である100uL
ずつ各々wellに添加した後、5%CO2培養器で37℃条件で3時間の間反応させる。
−反応が完了すれば、反応液をマイクロプレートリーダー(microplate reader)で吸光
度(450nm)を測定する。
−測定されたOD値を用いて培養期間別の細胞増殖(cell proliferation)を確認する。2. CCK-8 assay (assay)
-Remove the culture medium in the wells (24 well plate).
-
-100 uL of CCK-8 (Dojindo, CK04-11) reagent is 10% of medium volume
After each addition to each well, the reaction is performed at 37 ° C. for 3 hours in a 5% CO2 incubator.
-When the reaction is completed, measure the absorbance (450 nm) of the reaction solution with a microplate reader.
-Confirm cell proliferation by culture period using the measured OD value.
3.カルセイン-AM及びEthD-1 染色(Calcein-AM & EthD-1 staining)
−生/死 生存率/細胞毒性アッセイキット(The LIVE/DEAD Viability/Cytotoxicity Assay Kit)(Invitrogen、L3224)のカルセイン-AM (Calcein AM)とEthD-1を各々2μ
M、4μMになるように緩衝溶液に混合して標準溶液(working solution)を作る。
−培養物を新たな24ウエルプレート(well plate)に移して、標準溶液(working solution) 1mLを入れて光が遮断された状態で20分間反応させた後、蛍光顕微鏡で生細胞(live cell)と死細胞(dead cell)を観察する。生きている細胞は黄緑で、死んだ細胞は赤
色で観察される。3. Calcein-AM & EthD-1 staining
-Life / Dead Viability / Cytotoxicity Assay Kit (Invitrogen, L3224) Calcein-AM (Calcein AM) and EthD-1 2 μm each
M. Mix with buffer solution to 4 μM to make a working solution.
-Transfer the culture to a new 24-well plate, add 1 mL of working solution and react for 20 minutes with light blocked, then live cells with fluorescence microscope Observe dead cells. Living cells are observed in yellow-green, and dead cells are observed in red.
4.試験結果
イ.CCK-8 アッセイ(assay)(図5)
ロ.カルセイン-AM及びEthD-1 染色(Calcein-AM & EthD-1 staining)(図6)4). Test results a. CCK-8 assay (assay) (Figure 5)
B. Calcein-AM & EthD-1 staining (Calcein-AM & EthD-1 staining) (Figure 6)
(実施形態5)
本発明の細胞適合性試験(骨細胞)
本発明の組成物内で骨細胞の増殖(proliferation)と生存率(viability)の様相を確認するために、CCK-8 アッセイ(assay)、及びカルセイン-AM及びEthD-1 染色(Calcein-AM
& EthD-1 staining)を用いた。(Embodiment 5)
Cell compatibility test of the present invention (bone cells)
To confirm the appearance of bone cell proliferation and viability within the composition of the present invention, the CCK-8 assay and calcein-AM and EthD-1 staining (Calcein-AM
& EthD-1 staining).
1.細胞及び組成物
−細胞は人間を除外した動物の骨細胞を使用した。細胞数は組成物混合液内の1,200万個を適用した。
−組成物はフィブリングルー製品であるグリーンプラストとコラーゲンを各々3%、6%コラーゲンを混合して構成した。
−組成物の製造はグリーンプラストのフィブリノゲン乾燥物に軟骨細胞が含まれた溶液1mLを適用して溶解させ、トロンビン/カルシウム溶液に各々濃度のコラーゲン溶液1mLを混合した。
−骨細胞が含まれたフィブリノゲン溶液とコラーゲンが含まれたトロンビン溶液は総2mLのコラーゲン−フィブリン溶液が用意される。
−用意されたコラーゲン−フィブリン構成物は培養のために24well plateに0.2mLずつ分周し、2−3日毎にα−MEM培地を取り替えながら20日間観察する。1. Cells and compositions-Cells were derived from animal bone cells excluding humans. The number of cells applied was 12 million in the composition mixture.
-The composition consisted of 3% and 6% collagen mixed with green plast and collagen, which are fibrin glue products.
-The composition was prepared by applying 1 mL of a solution containing chondrocytes to dried green plastin fibrinogen, and mixing 1 mL of collagen solution of each concentration into the thrombin / calcium solution.
-As a fibrinogen solution containing bone cells and a thrombin solution containing collagen, a total of 2 mL of collagen-fibrin solution is prepared.
The prepared collagen-fibrin composition is divided by 0.2 mL into a 24-well plate for culturing and observed for 20 days while changing the α-MEM medium every 2-3 days.
2.CCK-8アッセイ (assay)
−培養物が盛られたwell(24well plate)の培地を除去する。
−新たな培地1mLを入れる。
−CCK−8(Dojindo、CK04−11)試薬を培地容量の10%である100uL
ずつ各々wellに添加した後、5%CO2培養器で37℃条件で3時間の間反応させる。
−反応が完了すれば、反応液をマイクロプレートリーダー(microplate reader)で吸光
度(450nm)を測定する。
−測定されたOD値を用いて培養期間別の細胞増殖(cell proliferation)を確認する。2. CCK-8 assay (assay)
-Remove the medium of the well (24 well plate) on which the culture was deposited.
-
-100 uL of CCK-8 (Dojindo, CK04-11) reagent is 10% of medium volume
After each addition to each well, the reaction is performed at 37 ° C. for 3 hours in a 5% CO2 incubator.
-When the reaction is completed, measure the absorbance (450 nm) of the reaction solution with a microplate reader.
-Confirm cell proliferation by culture period using the measured OD value.
3.カルセイン-AM及びEthD-1 染色(Calcein-AM & EthD-1 staining)
−生/死 生存率/細胞毒性アッセイキット(The LIVE/DEAD Viability / Cytotoxicity Assay Kit)(Invitrogen、L3224)のCalcein AMとEthD-1が各々2μM、4μMにな
るように緩衝溶液に混合して標準溶液(working solution)を作る。
−培養物を新たな24ウエルプレート(well plate)に移して、標準溶液(working solution) 1mLを入れて、光が遮断された状態で20分間反応させた後、蛍光顕微鏡で生細
胞(live cell)と死細胞(dead cell)を観察する。3. Calcein-AM & EthD-1 staining
-Life / Dead Viability / Cytotoxicity Assay Kit (Invitrogen, L3224) Calcein AM and EthD-1 are mixed in a buffer solution so that they are 2 μM and 4 μM, respectively, and standard Make a working solution.
-Transfer the culture to a new 24-well plate, add 1 mL of working solution, react for 20 minutes with light blocked, then live cells with a fluorescence microscope ) And dead cells.
4.試験結果
イ.CCK-8アッセイ (assay) (図7)
ロ.カルセイン-AM及びEthD-1 染色(Calcein-AM & EthD-1 staining)(図8)4). Test results a. CCK-8 assay (assay) (Figure 7)
B. Calcein-AM & EthD-1 staining (Calcein-AM & EthD-1 staining) (Figure 8)
(実施形態6)
本発明の細胞適合性試験(脂肪抽出細胞)
本発明の組成物内で脂肪抽出細胞の増殖(proliferation)と生存率(viability)の様相を確認するために、CCK-8 アッセイ(assay)及びカルセイン-AM及びEthD-1 染色(Calcein-AM & EthD-1 staining)を用いた。(Embodiment 6)
Cell compatibility test of the present invention (fat extracted cells)
In order to confirm the aspect of proliferation and viability of fat-extracted cells within the composition of the present invention, the CCK-8 assay (assay) and calcein-AM and EthD-1 staining (Calcein-AM & EthD-1 staining) was used.
1.細胞及び組成物
−細胞は脂肪から抽出された細胞を使用した。細胞数は組成物混合液内の1,200万個を適用した。
−組成物はフィブリングルー製品であるグリーンプラストとコラーゲンを各々3%コラーゲンを混合して構成した。
−組成物の製造はグリーンプラストのフィブリノゲン乾燥物に軟骨細胞が含まれた溶液1mLを適用して溶解させ、トロンビン/カルシウム溶液に各々濃度のコラーゲン溶液1mLを混合した。
−脂肪抽出細胞が含まれたフィブリノゲン溶液とコラーゲンが含まれたトロンビン溶液は総2mLのコラーゲン−フィブリン溶液が用意される。
−用意されたコラーゲン−フィブリン構成物は培養のために24well plateに0.2mLずつ分周し、2−3日毎にDMEM培地を取り替えながら20日間観察する。1. Cells and compositions-Cells extracted from fat were used. The number of cells applied was 12 million in the composition mixture.
-The composition was composed of 3% collagen mixed with green plast and collagen, which are fibrin glue products.
-The composition was prepared by applying 1 mL of a solution containing chondrocytes to dried green plastin fibrinogen, and mixing 1 mL of collagen solution of each concentration into the thrombin / calcium solution.
-A total of 2 mL of collagen-fibrin solution is prepared for the fibrinogen solution containing fat-extracted cells and the thrombin solution containing collagen.
The prepared collagen-fibrin composition is divided by 0.2 mL into a 24-well plate for culturing and observed for 20 days while changing the DMEM medium every 2-3 days.
2.カルセイン-AM及びEthD-1染色 (Calcein-AM & EthD-1 staining)
−生/死 生存率/細胞毒性アッセイキット(The LIVE/DEAD Viability/Cytotoxicity Assay Kit)(Invitrogen、L3224)のCalcein AMとEthD-1が各々2μM、4μMになる
ようにPBSに混合して標準溶液(working solution)を作る。
−培養物を新たな24ウエルプレート(well plate)に移し、標準溶液(working solution) 1mLを入れて、光が遮断された状態で20分間反応させた後、蛍光顕微鏡で生細胞(live cell)と死細胞(dead cell)を観察する。2. Calcein-AM & EthD-1 staining (Calcein-AM & EthD-1 staining)
-Life / Dead Viability / Cytotoxicity Assay Kit (Invitrogen, L3224) Calcein AM and EthD-1 are mixed in PBS to 2 μM and 4 μM, respectively, and standard solution Make a (working solution).
-Transfer the culture to a new 24-well plate, add 1 mL of working solution, react for 20 minutes with light blocked, then live cells with fluorescence microscope Observe dead cells.
3.試験結果
−カルセイン-AM及びEthD-1染色 (Calcein-AM & EthD-1 staining)(図9)3. Test Results-Calcein-AM and EthD-1 staining (Calcein-AM & EthD-1 staining) (Figure 9)
一方、本発明は上記の構成部を適用するに当たって、多様な変形が可能であり、さまざまな形態を取ることができる。 On the other hand, the present invention can be variously modified and can take various forms when the above-described components are applied.
そして、本発明は上記の詳細な説明で言及される特別な形態に限定されるものでないことが理解されるべきであり、むしろ添付した請求範囲により定義される本発明の精神と範囲内にある全ての変形物と均等物及び取替物を含むことと理解されるべきである。 And it should be understood that the invention is not limited to the specific forms mentioned in the above detailed description, but rather falls within the spirit and scope of the invention as defined by the appended claims. It should be understood to include all variations and equivalents and replacements.
本発明のコラーゲンとフィブリンとが混合された組織シーラント及びその製造方法の技術的思想は、実際に同一結果を反復実施可能なものであって、特にこのような本願発明を実施することによって、技術発展を促進して産業発展に資することができるので保護する価値が十分である。 The technical idea of the tissue sealant in which collagen and fibrin of the present invention are mixed and the method for producing the tissue sealant can actually repeat the same results. In particular, by implementing the present invention, It is worth protecting because it can promote development and contribute to industrial development.
Claims (6)
Translated fromJapaneseトロンビンと塩化カルシウム及びコラーゲンを混合して第2物質を製造するステップと、
前記第1物質と第2物質とを相互に混合して第3物質を製造するステップと、
が含まれることを特徴とする、コラーゲンとフィブリンとが混合された組織シーラントの製造方法。Mixing fibrinogen and aprotinin to produce a first substance;
Mixing thrombin with calcium chloride and collagen to produce a second substance;
Mixing the first material and the second material with each other to produce a third material;
A method for producing a tissue sealant in which collagen and fibrin are mixed.
前記トロンビンの濃度は40〜600U/ml、塩化カルシウムの濃度は4〜140mmol/mL、コラーゲンの濃度は60mg/mL以下であることを特徴とする、請求項1に記載のコラーゲンとフィブリンとが混合された組織シーラントの製造方法。The fibrinogen concentration is 65 to 130 mg / mL, the aprotinin concentration is 1,000 to 3,000 KIU / mL,
The collagen and fibrin according to claim 1, wherein the thrombin concentration is 40 to 600 U / ml, the calcium chloride concentration is 4 to 140 mmol / mL, and the collagen concentration is 60 mg / mL or less. For producing a structured tissue sealant.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020120143519AKR101401944B1 (en) | 2012-12-11 | 2012-12-11 | Tissue sealant of collagen and fibrin mixed and method of manufacturing the same |
| KR10-2012-0143519 | 2012-12-11 | ||
| PCT/KR2013/000143WO2014092239A1 (en) | 2012-12-11 | 2013-01-09 | Tissue sealant in which collagen and fibrin are mixed, and method for preparing same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2016502448Atrue JP2016502448A (en) | 2016-01-28 |
Family
ID=50895882
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015546724APendingJP2016502448A (en) | 2012-12-11 | 2013-01-09 | Tissue sealant in which collagen and fibrin are mixed and method for producing the same |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US20150320904A1 (en) |
| EP (1) | EP2932989B1 (en) |
| JP (1) | JP2016502448A (en) |
| KR (1) | KR101401944B1 (en) |
| CN (1) | CN104902937A (en) |
| AU (1) | AU2013357988B2 (en) |
| BR (1) | BR112015013755B1 (en) |
| CA (1) | CA2894815C (en) |
| CY (1) | CY1121846T1 (en) |
| DK (1) | DK2932989T3 (en) |
| ES (1) | ES2739656T3 (en) |
| HR (1) | HRP20191347T1 (en) |
| HU (1) | HUE045504T2 (en) |
| LT (1) | LT2932989T (en) |
| PL (1) | PL2932989T3 (en) |
| PT (1) | PT2932989T (en) |
| SI (1) | SI2932989T1 (en) |
| SM (1) | SMT201900426T1 (en) |
| TR (1) | TR201911079T4 (en) |
| WO (1) | WO2014092239A1 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021504097A (en)* | 2017-11-28 | 2021-02-15 | ダリム ティッセン カンパニー リミテッド | Hemostatic composition and container containing it |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20170182208A1 (en)* | 2014-03-28 | 2017-06-29 | Vita Threads,Llc | Absorbable fibrin microthread sutures for reduced inflammation and scarring in tissue ligation |
| US10596069B2 (en)* | 2015-12-22 | 2020-03-24 | Ethicon, Inc. | Syringes with mixing chamber in a removable cap |
| CN107432955B (en)* | 2016-09-14 | 2020-09-04 | 四川蓝光英诺生物科技股份有限公司 | Methods and kits for making biological constructs |
| CN106389393A (en)* | 2016-11-23 | 2017-02-15 | 中国人民解放军第三军医大学第附属医院 | Biological protein glue-triamcinolone acetonide slow release agent as well as preparation method and application of slow release agent |
| WO2019106473A1 (en)* | 2017-11-29 | 2019-06-06 | 3M Innovative Properties Company | Collagen-fibrin composition, method and wound articles |
| WO2019211874A2 (en)* | 2018-05-02 | 2019-11-07 | Pandorum Technologies Private Limited | A liquid cornea hydrogel composition |
| BR112021019555A2 (en)* | 2019-03-29 | 2021-11-30 | Innovative Orthopedics Llc | Cartilage replacement compositions and methods |
| KR20220003400A (en) | 2020-07-01 | 2022-01-10 | (주) 코웰메디 | Protective sheet for treating wound |
| US20220241152A1 (en)* | 2021-02-02 | 2022-08-04 | Freedom Corp. | Fibrin biopolymer formation and application device |
| CN116899017A (en)* | 2023-06-20 | 2023-10-20 | 上海利康瑞生物工程有限公司 | Injectable fibrin gel for plastic surgery and preparation method thereof |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05208042A (en)* | 1992-01-30 | 1993-08-20 | Ajinomoto Co Inc | Adhesive agent |
| JP2002514960A (en)* | 1997-06-18 | 2002-05-21 | コヘージョン テクノロジーズ,インコーポレイテッド | Compositions comprising thrombin and microfibril collagen and methods for their preparation and use |
| JP2010063504A (en)* | 2008-09-09 | 2010-03-25 | Chemo Sero Therapeut Res Inst | Carboxylic acid-containing biomedical tissue adhesive and method of preparing the same |
| WO2011049265A1 (en)* | 2009-10-23 | 2011-04-28 | 세원셀론텍(주) | Composition for cartilaginous tissue repair and a production method therefor |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050186283A1 (en)* | 1997-10-10 | 2005-08-25 | Ed. Geistlich Soehne Ag Fuer Chemistrie Industrie | Collagen carrier of therapeutic genetic material, and method |
| UA73028C2 (en) | 2001-01-25 | 2005-05-16 | Нікомед Фарма Ас | A method of preparing a collagen sponge (variants), a device for extracting a part of a collagen foam and an elongated collagen sponge |
| KR20050044725A (en)* | 2001-12-04 | 2005-05-12 | 크리스토퍼 제이 울버튼 | Storage-stable fibrin sealant |
| WO2008078166A2 (en)* | 2006-12-22 | 2008-07-03 | Laboratoire Medidom S.A. | In situ system for intra-articular chondral and osseous tissue repair |
| US9155118B2 (en)* | 2007-01-22 | 2015-10-06 | Qualcomm Incorporated | Multi-link support for network based mobility management systems |
| US8846105B2 (en)* | 2010-01-08 | 2014-09-30 | Profibrix, B.V. | Dry powder fibrin sealant |
- 2012
- 2012-12-11KRKR1020120143519Apatent/KR101401944B1/enactiveActive
- 2013
- 2013-01-09HRHRP20191347TTpatent/HRP20191347T1/enunknown
- 2013-01-09CACA2894815Apatent/CA2894815C/ennot_activeExpired - Fee Related
- 2013-01-09SMSM20190426Tpatent/SMT201900426T1/enunknown
- 2013-01-09PLPL13862143Tpatent/PL2932989T3/enunknown
- 2013-01-09EPEP13862143.8Apatent/EP2932989B1/enactiveActive
- 2013-01-09PTPT13862143Tpatent/PT2932989T/enunknown
- 2013-01-09HUHUE13862143Apatent/HUE045504T2/enunknown
- 2013-01-09SISI201331516Tpatent/SI2932989T1/enunknown
- 2013-01-09TRTR2019/11079Tpatent/TR201911079T4/enunknown
- 2013-01-09ESES13862143Tpatent/ES2739656T3/enactiveActive
- 2013-01-09USUS14/651,427patent/US20150320904A1/ennot_activeAbandoned
- 2013-01-09AUAU2013357988Apatent/AU2013357988B2/ennot_activeCeased
- 2013-01-09WOPCT/KR2013/000143patent/WO2014092239A1/enactiveApplication Filing
- 2013-01-09LTLTEP13862143.8Tpatent/LT2932989T/enunknown
- 2013-01-09BRBR112015013755-5Apatent/BR112015013755B1/ennot_activeIP Right Cessation
- 2013-01-09CNCN201380064818.3Apatent/CN104902937A/enactivePending
- 2013-01-09JPJP2015546724Apatent/JP2016502448A/enactivePending
- 2013-01-09DKDK13862143.8Tpatent/DK2932989T3/enactive
- 2019
- 2019-07-25CYCY20191100790Tpatent/CY1121846T1/enunknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05208042A (en)* | 1992-01-30 | 1993-08-20 | Ajinomoto Co Inc | Adhesive agent |
| JP2002514960A (en)* | 1997-06-18 | 2002-05-21 | コヘージョン テクノロジーズ,インコーポレイテッド | Compositions comprising thrombin and microfibril collagen and methods for their preparation and use |
| JP2010063504A (en)* | 2008-09-09 | 2010-03-25 | Chemo Sero Therapeut Res Inst | Carboxylic acid-containing biomedical tissue adhesive and method of preparing the same |
| WO2011049265A1 (en)* | 2009-10-23 | 2011-04-28 | 세원셀론텍(주) | Composition for cartilaginous tissue repair and a production method therefor |
Non-Patent Citations (3)
| Title |
|---|
| JPN6013042425; Transfusion Medicine Reviews Vol.17,No.4, 2003, p287-298* |
| JPN6016011319; 医薬品インタビューフォームベリプラスト(R)P コンビセット 組織接着用」 改訂第3版, 200911* |
| JPN6016034515; STEM CELLS Vol. 25,p. 1393-1401, 2007* |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021504097A (en)* | 2017-11-28 | 2021-02-15 | ダリム ティッセン カンパニー リミテッド | Hemostatic composition and container containing it |
| JP7223447B2 (en) | 2017-11-28 | 2023-02-16 | ダリム ティッセン カンパニー リミテッド | Hemostatic composition and container containing the same |
| US11628236B2 (en) | 2017-11-28 | 2023-04-18 | Dalim Tissen Co., Ltd. | Composition for hemostasis and container comprising same |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2932989A1 (en) | 2015-10-21 |
| TR201911079T4 (en) | 2019-08-21 |
| SMT201900426T1 (en) | 2019-11-13 |
| DK2932989T3 (en) | 2019-08-05 |
| CY1121846T1 (en) | 2020-07-31 |
| HUE045504T2 (en) | 2019-12-30 |
| PT2932989T (en) | 2019-07-25 |
| SI2932989T1 (en) | 2019-10-30 |
| HRP20191347T1 (en) | 2019-10-18 |
| CN104902937A (en) | 2015-09-09 |
| BR112015013755B1 (en) | 2019-05-14 |
| EP2932989A4 (en) | 2016-05-11 |
| AU2013357988B2 (en) | 2017-08-24 |
| WO2014092239A1 (en) | 2014-06-19 |
| CA2894815C (en) | 2020-03-24 |
| LT2932989T (en) | 2019-10-10 |
| US20150320904A1 (en) | 2015-11-12 |
| KR101401944B1 (en) | 2014-05-30 |
| ES2739656T3 (en) | 2020-02-03 |
| EP2932989B1 (en) | 2019-06-05 |
| AU2013357988A1 (en) | 2015-07-23 |
| CA2894815A1 (en) | 2014-06-19 |
| PL2932989T3 (en) | 2019-12-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2016502448A (en) | Tissue sealant in which collagen and fibrin are mixed and method for producing the same | |
| Okesola et al. | Growth‐factor free multicomponent nanocomposite hydrogels that stimulate bone formation | |
| Chen et al. | Gas-foaming calcium phosphate cement scaffold encapsulating human umbilical cord stem cells | |
| ES2771824T3 (en) | New adhesives for medical applications | |
| KR101114773B1 (en) | A cartilage repair constituent manufacturing method thereof | |
| KR101279812B1 (en) | A manufacturing method of cartilage tissue repair composition | |
| HK1245682A1 (en) | Formulations and kits for forming bioadhesive matrices | |
| WO2014176458A2 (en) | Bioresorbable biopolymer anastomosis devices | |
| KR102661885B1 (en) | Powder composition and method of using the same for producing cross-linked protein foam | |
| KR102665892B1 (en) | Cellulose-based hemostatic mixture of short and long fibers | |
| Yang et al. | Double-cross-linked hydrogel with long-lasting underwater adhesion: enhancement of maxillofacial in situ and onlay bone retention | |
| KR101875264B1 (en) | Bio-ink for fast gelation based on functional hydrogels and manufacturing method thereof | |
| Liu et al. | Hydrophilic competent and enhanced wet-bond strength castor oil-based bioadhesive for bone repair | |
| Lee et al. | Mesh-shaped absorbable hemostatic hydrogel patch fabricated with marine organism-derived protein biomaterials with contact-activated blood coagulation for application in visceral surgery | |
| CN111973797B (en) | Non-invasive implantation high-viscosity adhesive material for orthopedics department and preparation method and application thereof | |
| KR101176793B1 (en) | Bone cement composition containing silk fibroin hydrolysates and polymethylmetacrylate | |
| CN110711264B (en) | Composite material, medical adhesive, and preparation method and application thereof | |
| JP2003265169A (en) | Biotissue-like structure, method for culturing bone marrow stem cell and culture kit | |
| CN113209360B (en) | Medical adhesive for promoting wound healing and preparation method thereof | |
| Karmaker | Development and characterization of autologous fibrin glue augmented with biocompatible polymers | |
| PT104674A (en) | COMPOSITE STRUCTURES BASED ON GELANA GUM FOR USE IN REGENERATIVE MEDICINE AND ITS PREPARATION METHODS | |
| Guan et al. | Distinct tissue responses to porous silk fibroin scaffolds (PSFSs) and polyvinyl alcohol (PVA) sponges in vivo | |
| Mehdizadeh | Syntheses, Characterization, And Applications Of Injectable Citrate-based Mussel-inspired Biodegradable Adhesive (iCMBA) Polymers And Hydrogels |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination | Free format text:JAPANESE INTERMEDIATE CODE: A621 Effective date:20150608 | |
| A131 | Notification of reasons for refusal | Free format text:JAPANESE INTERMEDIATE CODE: A131 Effective date:20160329 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20160629 | |
| A131 | Notification of reasons for refusal | Free format text:JAPANESE INTERMEDIATE CODE: A131 Effective date:20160906 | |
| A521 | Request for written amendment filed | Free format text:JAPANESE INTERMEDIATE CODE: A523 Effective date:20161206 | |
| A02 | Decision of refusal | Free format text:JAPANESE INTERMEDIATE CODE: A02 Effective date:20170110 |