DE102011083595A1 - Inhibition of the effect of interleukin 1 beta for the treatment of endometriosis - Google Patents
Inhibition of the effect of interleukin 1 beta for the treatment of endometriosisDownload PDFInfo
- Publication number
- DE102011083595A1 DE102011083595A1DE201110083595DE102011083595ADE102011083595A1DE 102011083595 A1DE102011083595 A1DE 102011083595A1DE 201110083595DE201110083595DE 201110083595DE 102011083595 ADE102011083595 ADE 102011083595ADE 102011083595 A1DE102011083595 A1DE 102011083595A1
- Authority
- DE
- Germany
- Prior art keywords
- endometriosis
- treatment
- antibody
- interleukin
- inhibition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 201000009273EndometriosisDiseases0.000titleclaimsabstractdescription25
- 238000011282treatmentMethods0.000titleclaimsabstractdescription19
- 230000000694effectsEffects0.000titledescription9
- 230000005764inhibitory processEffects0.000titledescription6
- LOGFVTREOLYCPF-KXNHARMFSA-N(2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acidChemical compoundC[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCNLOGFVTREOLYCPF-KXNHARMFSA-N0.000titledescription4
- 108090000193Interleukin-1 betaProteins0.000titledescription4
- 102000003777Interleukin-1 betaHuman genes0.000titledescription4
- 239000003814drugSubstances0.000claimsabstractdescription7
- 102000008394Immunoglobulin FragmentsHuman genes0.000claimsdescription16
- 108010021625Immunoglobulin FragmentsProteins0.000claimsdescription16
- 108010008281Recombinant Fusion ProteinsProteins0.000claimsdescription16
- 102000007056Recombinant Fusion ProteinsHuman genes0.000claimsdescription16
- 229960001838canakinumabDrugs0.000claimsdescription9
- 102000051628Interleukin-1 receptor antagonistHuman genes0.000claimsdescription6
- 108700021006Interleukin-1 receptor antagonistProteins0.000claimsdescription6
- 230000002265preventionEffects0.000claimsdescription6
- HMLGSIZOMSVISS-ONJSNURVSA-N(7r)-7-[[(2z)-2-(2-amino-1,3-thiazol-4-yl)-2-(2,2-dimethylpropanoyloxymethoxyimino)acetyl]amino]-3-ethenyl-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acidChemical compoundN([C@@H]1C(N2C(=C(C=C)CSC21)C(O)=O)=O)C(=O)\C(=N/OCOC(=O)C(C)(C)C)C1=CSC(N)=N1HMLGSIZOMSVISS-ONJSNURVSA-N0.000claimsdescription5
- 229960004238anakinraDrugs0.000claimsdescription5
- 229950003717gevokizumabDrugs0.000claimsdescription5
- 238000004519manufacturing processMethods0.000claimsdescription3
- 229960001886rilonaceptDrugs0.000claimsdescription3
- 108010046141rilonaceptProteins0.000claimsdescription3
- 102000014909interleukin-1 receptor activity proteinsHuman genes0.000claims2
- 108040006732interleukin-1 receptor activity proteinsProteins0.000claims2
- 239000000126substanceSubstances0.000abstractdescription5
- 230000031018biological processes and functionsEffects0.000abstractdescription2
- 102000019223Interleukin-1 receptorHuman genes0.000description30
- 108050006617Interleukin-1 receptorProteins0.000description30
- 230000003902lesionEffects0.000description29
- 241001465754MetazoaSpecies0.000description15
- 150000001413amino acidsChemical class0.000description10
- 230000014509gene expressionEffects0.000description10
- 210000004291uterusAnatomy0.000description8
- 241000699670Mus sp.Species0.000description7
- 238000000034methodMethods0.000description6
- 230000002357endometrial effectEffects0.000description5
- 210000004696endometriumAnatomy0.000description5
- 238000002474experimental methodMethods0.000description5
- 238000011321prophylaxisMethods0.000description5
- 238000007388punch biopsyMethods0.000description5
- 102000004889Interleukin-6Human genes0.000description4
- 108090001005Interleukin-6Proteins0.000description4
- 230000002401inhibitory effectEffects0.000description4
- 230000003834intracellular effectEffects0.000description4
- 108090000623proteins and genesProteins0.000description4
- 238000002560therapeutic procedureMethods0.000description4
- 206010061218InflammationDiseases0.000description3
- 229940119178Interleukin 1 receptor antagonistDrugs0.000description3
- 230000033115angiogenesisEffects0.000description3
- 239000000427antigenSubstances0.000description3
- 102000036639antigensHuman genes0.000description3
- 108091007433antigensProteins0.000description3
- 239000003418antiprogestinSubstances0.000description3
- 239000003886aromatase inhibitorSubstances0.000description3
- 229940046844aromatase inhibitorsDrugs0.000description3
- 230000004071biological effectEffects0.000description3
- 238000001574biopsyMethods0.000description3
- 208000037265diseases, disorders, signs and symptomsDiseases0.000description3
- 229940079593drugDrugs0.000description3
- 230000004054inflammatory processEffects0.000description3
- 230000003472neutralizing effectEffects0.000description3
- 210000004303peritoneumAnatomy0.000description3
- 102000004169proteins and genesHuman genes0.000description3
- 230000009467reductionEffects0.000description3
- 208000024891symptomDiseases0.000description3
- WWYNJERNGUHSAO-XUDSTZEESA-N(+)-NorgestrelChemical compoundO=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1WWYNJERNGUHSAO-XUDSTZEESA-N0.000description2
- 208000004998Abdominal PainDiseases0.000description2
- BFYIZQONLCFLEV-DAELLWKTSA-NAromasineChemical compoundO=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1BFYIZQONLCFLEV-DAELLWKTSA-N0.000description2
- 102100036150C-X-C motif chemokine 5Human genes0.000description2
- 102000004127CytokinesHuman genes0.000description2
- 108090000695CytokinesProteins0.000description2
- 108090000790EnzymesProteins0.000description2
- 102000004190EnzymesHuman genes0.000description2
- 229940102550Estrogen receptor antagonistDrugs0.000description2
- NMJREATYWWNIKX-UHFFFAOYSA-NGnRHChemical compoundC1CCC(C(=O)NCC(N)=O)N1C(=O)C(CC(C)C)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1NMJREATYWWNIKX-UHFFFAOYSA-N0.000description2
- 102100034221Growth-regulated alpha proteinHuman genes0.000description2
- 101000947186Homo sapiens C-X-C motif chemokine 5Proteins0.000description2
- 101001069921Homo sapiens Growth-regulated alpha proteinProteins0.000description2
- 101001033249Homo sapiens Interleukin-1 betaProteins0.000description2
- 102100026017Interleukin-1 receptor type 2Human genes0.000description2
- 208000002193PainDiseases0.000description2
- -1SPRM)Substances0.000description2
- 101000857870Squalus acanthias GonadoliberinProteins0.000description2
- NKANXQFJJICGDU-QPLCGJKRSA-NTamoxifenChemical compoundC=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1NKANXQFJJICGDU-QPLCGJKRSA-N0.000description2
- 230000009471actionEffects0.000description2
- 230000004913activationEffects0.000description2
- YBBLVLTVTVSKRW-UHFFFAOYSA-NanastrozoleChemical compoundN#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1YBBLVLTVTVSKRW-UHFFFAOYSA-N0.000description2
- 238000013459approachMethods0.000description2
- 230000000903blocking effectEffects0.000description2
- 230000009956central mechanismEffects0.000description2
- 150000001875compoundsChemical class0.000description2
- 208000022993cryopyrin-associated periodic syndromeDiseases0.000description2
- 238000011161developmentMethods0.000description2
- 230000018109developmental processEffects0.000description2
- 201000010099diseaseDiseases0.000description2
- 230000012173estrusEffects0.000description2
- 229960004421formestaneDrugs0.000description2
- OSVMTWJCGUFAOD-KZQROQTASA-NformestaneChemical compoundO=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1OOSVMTWJCGUFAOD-KZQROQTASA-N0.000description2
- 230000012010growthEffects0.000description2
- 239000003102growth factorSubstances0.000description2
- 238000001727in vivoMethods0.000description2
- 208000000509infertilityDiseases0.000description2
- 230000036512infertilityEffects0.000description2
- 231100000535infertilityToxicity0.000description2
- 230000000977initiatory effectEffects0.000description2
- 229940100601interleukin-6Drugs0.000description2
- HPJKCIUCZWXJDR-UHFFFAOYSA-NletrozoleChemical compoundC1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1HPJKCIUCZWXJDR-UHFFFAOYSA-N0.000description2
- 229960004400levonorgestrelDrugs0.000description2
- 230000004060metabolic processEffects0.000description2
- 210000000754myometriumAnatomy0.000description2
- 238000006386neutralization reactionMethods0.000description2
- 239000002243precursorSubstances0.000description2
- 239000000583progesterone congenerSubstances0.000description2
- 210000001519tissueAnatomy0.000description2
- 238000002054transplantationMethods0.000description2
- 229960001771vorozoleDrugs0.000description2
- XLMPPFTZALNBFS-INIZCTEOSA-NvorozoleChemical compoundC1([C@@H](C2=CC=C3N=NN(C3=C2)C)N2N=CN=C2)=CC=C(Cl)C=C1XLMPPFTZALNBFS-INIZCTEOSA-N0.000description2
- XLYOFNOQVPJJNP-UHFFFAOYSA-NwaterSubstancesOXLYOFNOQVPJJNP-UHFFFAOYSA-N0.000description2
- BUHVIAUBTBOHAG-FOYDDCNASA-N(2r,3r,4s,5r)-2-[6-[[2-(3,5-dimethoxyphenyl)-2-(2-methylphenyl)ethyl]amino]purin-9-yl]-5-(hydroxymethyl)oxolane-3,4-diolChemical compoundCOC1=CC(OC)=CC(C(CNC=2C=3N=CN(C=3N=CN=2)[C@H]2[C@@H]([C@H](O)[C@@H](CO)O2)O)C=2C(=CC=CC=2)C)=C1BUHVIAUBTBOHAG-FOYDDCNASA-N0.000description1
- VHZPUDNSVGRVMB-RXDLHWJPSA-N(8s,11r,13s,14s,17s)-11-(4-acetylphenyl)-17-hydroxy-13-methyl-17-(1,1,2,2,2-pentafluoroethyl)-1,2,6,7,8,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-3-oneChemical compoundC1=CC(C(=O)C)=CC=C1[C@@H]1C2=C3CCC(=O)C=C3CC[C@H]2[C@H](CC[C@@]2(O)C(F)(F)C(F)(F)F)[C@]2(C)C1VHZPUDNSVGRVMB-RXDLHWJPSA-N0.000description1
- XAVRSHOUEXATJE-FBQZJRKBSA-N1-[(8s,9s,10r,13s,14s,17s)-3-cyclopentyloxy-10,13-dimethyl-2,7,8,9,11,12,14,15,16,17-decahydro-1h-cyclopenta[a]phenanthren-17-yl]ethanoneChemical compoundC([C@H]1[C@@H]2CC[C@@H]([C@]2(CC[C@@H]1[C@@]1(C)CC2)C)C(=O)C)C=C1C=C2OC1CCCC1XAVRSHOUEXATJE-FBQZJRKBSA-N0.000description1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrileChemical compoundC1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1CLPFFLWZZBQMAO-UHFFFAOYSA-N0.000description1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acidChemical compoundC([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1FWMNVWWHGCHHJJ-SKKKGAJSSA-N0.000description1
- 239000000275Adrenocorticotropic HormoneSubstances0.000description1
- ATXHVCQZZJYMCF-XUDSTZEESA-NAllylestrenolChemical compoundC1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)CC=C)[C@@H]4[C@@H]3CCC2=C1ATXHVCQZZJYMCF-XUDSTZEESA-N0.000description1
- DVUFTQLHHHJEMK-IMJSIDKUSA-NAsp-AlaChemical compoundOC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=ODVUFTQLHHHJEMK-IMJSIDKUSA-N0.000description1
- 102100035904Caspase-1Human genes0.000description1
- 108090000426Caspase-1Proteins0.000description1
- 102000019034ChemokinesHuman genes0.000description1
- 108010012236ChemokinesProteins0.000description1
- QMBJSIBWORFWQT-DFXBJWIESA-NChlormadinone acetateChemical compoundC1=C(Cl)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2QMBJSIBWORFWQT-DFXBJWIESA-N0.000description1
- 101800000414CorticotropinProteins0.000description1
- 108020004414DNAProteins0.000description1
- ZQZFYGIXNQKOAV-OCEACIFDSA-NDroloxifeneChemical compoundC=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1ZQZFYGIXNQKOAV-OCEACIFDSA-N0.000description1
- 208000005171DysmenorrheaDiseases0.000description1
- 206010013935DysmenorrhoeaDiseases0.000description1
- 208000004483DyspareuniaDiseases0.000description1
- UKCVAQGKEOJTSR-UHFFFAOYSA-NFadrozole hydrochlorideChemical compoundCl.C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1UKCVAQGKEOJTSR-UHFFFAOYSA-N0.000description1
- NKZTZAQIKKGTDB-QPLCGJKRSA-NFispemifeneChemical compoundC1=CC(OCCOCCO)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1NKZTZAQIKKGTDB-QPLCGJKRSA-N0.000description1
- VWUXBMIQPBEWFH-WCCTWKNTSA-NFulvestrantChemical compoundOC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1VWUXBMIQPBEWFH-WCCTWKNTSA-N0.000description1
- 201000005569GoutDiseases0.000description1
- 101001076407Homo sapiens Interleukin-1 receptor antagonist proteinProteins0.000description1
- 101001076422Homo sapiens Interleukin-1 receptor type 2Proteins0.000description1
- BCVIOZZGJNOEQS-XKNYDFJKSA-NIle-IleChemical compoundCC[C@H](C)[C@H](N)C(=O)N[C@H](C(O)=O)[C@@H](C)CCBCVIOZZGJNOEQS-XKNYDFJKSA-N0.000description1
- 102000006496Immunoglobulin Heavy ChainsHuman genes0.000description1
- 108010019476Immunoglobulin Heavy ChainsProteins0.000description1
- 102000013463Immunoglobulin Light ChainsHuman genes0.000description1
- 108010065825Immunoglobulin Light ChainsProteins0.000description1
- 102000008070Interferon-gammaHuman genes0.000description1
- 108010074328Interferon-gammaProteins0.000description1
- 101710149731Interleukin-1 receptor type 2Proteins0.000description1
- 102000004890Interleukin-8Human genes0.000description1
- 108090001007Interleukin-8Proteins0.000description1
- YNVGQYHLRCDXFQ-XGXHKTLJSA-NLynestrenolChemical compoundC1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1YNVGQYHLRCDXFQ-XGXHKTLJSA-N0.000description1
- 102000002274Matrix MetalloproteinasesHuman genes0.000description1
- 108010000684Matrix MetalloproteinasesProteins0.000description1
- 208000037093Menstruation DisturbancesDiseases0.000description1
- 108010057466NF-kappa BProteins0.000description1
- 102000003945NF-kappa BHuman genes0.000description1
- 101150000187PTGS2 geneProteins0.000description1
- IUVYJBMTHARMIP-PCBIJLKTSA-NPhe-Asp-IleChemical compound[H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=OIUVYJBMTHARMIP-PCBIJLKTSA-N0.000description1
- 206010065951Retrograde menstruationDiseases0.000description1
- 238000000692Student's t-testMethods0.000description1
- 102000040945Transcription factorHuman genes0.000description1
- 108091023040Transcription factorProteins0.000description1
- DUYNJNWVGIWJRI-LJAQVGFWSA-NacolbifeneChemical compoundC1=CC([C@H]2C(=C(C3=CC=C(O)C=C3O2)C)C=2C=CC(O)=CC=2)=CC=C1OCCN1CCCCC1DUYNJNWVGIWJRI-LJAQVGFWSA-N0.000description1
- 229950002421acolbifeneDrugs0.000description1
- 229950003105afimoxifeneDrugs0.000description1
- TXUZVZSFRXZGTL-QPLCGJKRSA-NafimoxifeneChemical compoundC=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=C(O)C=C1TXUZVZSFRXZGTL-QPLCGJKRSA-N0.000description1
- 239000000556agonistSubstances0.000description1
- 229960002692allylestrenolDrugs0.000description1
- 229960002932anastrozoleDrugs0.000description1
- 239000003098androgenSubstances0.000description1
- 229940030486androgensDrugs0.000description1
- 229940046836anti-estrogenDrugs0.000description1
- 230000001833anti-estrogenic effectEffects0.000description1
- 230000000890antigenic effectEffects0.000description1
- 229940078010arimidexDrugs0.000description1
- 229940087620aromasinDrugs0.000description1
- MCGDSOGUHLTADD-UHFFFAOYSA-NarzoxifeneChemical compoundC1=CC(OC)=CC=C1C1=C(OC=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1MCGDSOGUHLTADD-UHFFFAOYSA-N0.000description1
- 229950005529arzoxifeneDrugs0.000description1
- 210000003567ascitic fluidAnatomy0.000description1
- GJMNAFGEUJBOCE-MEQIQULJSA-NasoprisnilChemical compoundC1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@]([C@]3(C2)C)(COC)OC)=CC=C(\C=N\O)C=C1GJMNAFGEUJBOCE-MEQIQULJSA-N0.000description1
- 229950003620asoprisnilDrugs0.000description1
- 229960000817bazedoxifeneDrugs0.000description1
- UCJGJABZCDBEDK-UHFFFAOYSA-NbazedoxifeneChemical compoundC=1C=C(OCCN2CCCCCC2)C=CC=1CN1C2=CC=C(O)C=C2C(C)=C1C1=CC=C(O)C=C1UCJGJABZCDBEDK-UHFFFAOYSA-N0.000description1
- 210000004027cellAnatomy0.000description1
- 230000020411cell activationEffects0.000description1
- YOQPCWIXYUNEET-UHFFFAOYSA-Nchembl307697Chemical compoundC1=CC(O)=CC=C1C(C=1C=CC(O)=CC=1)=NNC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=OYOQPCWIXYUNEET-UHFFFAOYSA-N0.000description1
- 229960001616chlormadinone acetateDrugs0.000description1
- GKIRPKYJQBWNGO-OCEACIFDSA-NclomifeneChemical compoundC1=CC(OCCN(CC)CC)=CC=C1C(\C=1C=CC=CC=1)=C(\Cl)C1=CC=CC=C1GKIRPKYJQBWNGO-OCEACIFDSA-N0.000description1
- IDLFZVILOHSSID-OVLDLUHVSA-NcorticotropinChemical compoundC([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1IDLFZVILOHSSID-OVLDLUHVSA-N0.000description1
- 229960000258corticotropinDrugs0.000description1
- 229960000978cyproterone acetateDrugs0.000description1
- UWFYSQMTEOIJJG-FDTZYFLXSA-Ncyproterone acetateChemical compoundC1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2UWFYSQMTEOIJJG-FDTZYFLXSA-N0.000description1
- 230000001086cytosolic effectEffects0.000description1
- 230000002950deficientEffects0.000description1
- 229960004976desogestrelDrugs0.000description1
- RPLCPCMSCLEKRS-BPIQYHPVSA-NdesogestrelChemical compoundC1CC[C@@H]2[C@H]3C(=C)C[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1RPLCPCMSCLEKRS-BPIQYHPVSA-N0.000description1
- 229960003309dienogestDrugs0.000description1
- AZFLJNIPTRTECV-FUMNGEBKSA-NdienogestChemical compoundC1CC(=O)C=C2CC[C@@H]([C@H]3[C@@](C)([C@](CC3)(O)CC#N)CC3)C3=C21AZFLJNIPTRTECV-FUMNGEBKSA-N0.000description1
- METQSPRSQINEEU-UHFFFAOYSA-NdihydrospirorenoneNatural productsCC12CCC(C3(CCC(=O)C=C3C3CC33)C)C3C1C1CC1C21CCC(=O)O1METQSPRSQINEEU-UHFFFAOYSA-N0.000description1
- XEYBRNLFEZDVAW-ARSRFYASSA-NdinoprostoneChemical compoundCCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=OXEYBRNLFEZDVAW-ARSRFYASSA-N0.000description1
- 229960002986dinoprostoneDrugs0.000description1
- 208000035475disorderDiseases0.000description1
- 229950004203droloxifeneDrugs0.000description1
- 229960004845drospirenoneDrugs0.000description1
- METQSPRSQINEEU-HXCATZOESA-NdrospirenoneChemical compoundC([C@]12[C@H]3C[C@H]3[C@H]3[C@H]4[C@@H]([C@]5(CCC(=O)C=C5[C@@H]5C[C@@H]54)C)CC[C@@]31C)CC(=O)O2METQSPRSQINEEU-HXCATZOESA-N0.000description1
- 229960004913dydrogesteroneDrugs0.000description1
- JGMOKGBVKVMRFX-HQZYFCCVSA-NdydrogesteroneChemical compoundC1=CC2=CC(=O)CC[C@@]2(C)[C@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2JGMOKGBVKVMRFX-HQZYFCCVSA-N0.000description1
- 206010013990dysuriaDiseases0.000description1
- 239000000328estrogen antagonistSubstances0.000description1
- ONKUMRGIYFNPJW-KIEAKMPYSA-Nethynodiol diacetateChemical compoundC1C[C@]2(C)[C@@](C#C)(OC(C)=O)CC[C@H]2[C@@H]2CCC3=C[C@@H](OC(=O)C)CC[C@@H]3[C@H]21ONKUMRGIYFNPJW-KIEAKMPYSA-N0.000description1
- 229960002941etonogestrelDrugs0.000description1
- GCKFUYQCUCGESZ-BPIQYHPVSA-NetonogestrelChemical compoundO=C1CC[C@@H]2[C@H]3C(=C)C[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1GCKFUYQCUCGESZ-BPIQYHPVSA-N0.000description1
- 229960000218etynodiolDrugs0.000description1
- 238000011156evaluationMethods0.000description1
- 229960000255exemestaneDrugs0.000description1
- 229950011548fadrozoleDrugs0.000description1
- 229940087476femaraDrugs0.000description1
- 229950004684fispemifeneDrugs0.000description1
- 239000012634fragmentSubstances0.000description1
- 229960002258fulvestrantDrugs0.000description1
- 229960005352gestodeneDrugs0.000description1
- SIGSPDASOTUPFS-XUDSTZEESA-NgestodeneChemical compoundO=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](C=C4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1SIGSPDASOTUPFS-XUDSTZEESA-N0.000description1
- 208000031169hemorrhagic diseaseDiseases0.000description1
- 102000046824human IL1RNHuman genes0.000description1
- 229940071829ilarisDrugs0.000description1
- 230000006698inductionEffects0.000description1
- 229960003130interferon gammaDrugs0.000description1
- 102000002467interleukin receptorsHuman genes0.000description1
- 108010093036interleukin receptorsProteins0.000description1
- 229940096397interleukin-8Drugs0.000description1
- XKTZWUACRZHVAN-VADRZIEHSA-Ninterleukin-8Chemical compoundC([C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](NC(C)=O)CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCSC)C(=O)N1[C@H](CCC1)C(=O)N1[C@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC=1C=CC(O)=CC=1)C(=O)N[C@H](CO)C(=O)N1[C@H](CCC1)C(N)=O)C1=CC=CC=C1XKTZWUACRZHVAN-VADRZIEHSA-N0.000description1
- 230000031146intracellular signal transductionEffects0.000description1
- 229940054136kineretDrugs0.000description1
- 238000002350laparotomyMethods0.000description1
- 229960002367lasofoxifeneDrugs0.000description1
- GXESHMAMLJKROZ-IAPPQJPRSA-NlasofoxifeneChemical compoundC1([C@@H]2[C@@H](C3=CC=C(C=C3CC2)O)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1GXESHMAMLJKROZ-IAPPQJPRSA-N0.000description1
- 229960003881letrozoleDrugs0.000description1
- 210000000265leukocyteAnatomy0.000description1
- XZEUAXYWNKYKPL-WDYNHAJCSA-NlevormeloxifeneChemical compoundC1([C@H]2[C@@H](C3=CC=C(C=C3OC2(C)C)OC)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1XZEUAXYWNKYKPL-WDYNHAJCSA-N0.000description1
- 229950002728levormeloxifeneDrugs0.000description1
- 230000004807localizationEffects0.000description1
- 229950001947lonaprisanDrugs0.000description1
- 229960001910lynestrenolDrugs0.000description1
- 229960000606medrogestoneDrugs0.000description1
- HCFSGRMEEXUOSS-JXEXPEPMSA-NmedrogestoneChemical compoundC1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(C)[C@@]1(C)CC2HCFSGRMEEXUOSS-JXEXPEPMSA-N0.000description1
- 229960004616medroxyprogesteroneDrugs0.000description1
- FRQMUZJSZHZSGN-HBNHAYAOSA-NmedroxyprogesteroneChemical compoundC([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](O)(C(C)=O)CC[C@H]21FRQMUZJSZHZSGN-HBNHAYAOSA-N0.000description1
- 229960004296megestrol acetateDrugs0.000description1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-Nmegestrol acetateChemical compoundC1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2RQZAXGRLVPAYTJ-GQFGMJRRSA-N0.000description1
- VKHAHZOOUSRJNA-GCNJZUOMSA-NmifepristoneChemical compoundC1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1VKHAHZOOUSRJNA-GCNJZUOMSA-N0.000description1
- 229960003248mifepristoneDrugs0.000description1
- 238000010172mouse modelMethods0.000description1
- 230000011234negative regulation of signal transductionEffects0.000description1
- 229960004911nomegestrolDrugs0.000description1
- KZUIYQJTUIACIG-YBZCJVABSA-NnomegestrolChemical compoundC1=C(C)C2=CC(=O)CC[C@@H]2[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2KZUIYQJTUIACIG-YBZCJVABSA-N0.000description1
- 229940053934norethindroneDrugs0.000description1
- VIKNJXKGJWUCNN-XGXHKTLJSA-NnorethisteroneChemical compoundO=C1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1VIKNJXKGJWUCNN-XGXHKTLJSA-N0.000description1
- 229960000417norgestimateDrugs0.000description1
- KIQQMECNKUGGKA-NMYWJIRASA-NnorgestimateChemical compoundO/N=C/1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(OC(C)=O)C#C)[C@@H]4[C@@H]3CCC2=C\1KIQQMECNKUGGKA-NMYWJIRASA-N0.000description1
- 229940127234oral contraceptiveDrugs0.000description1
- 239000003539oral contraceptive agentSubstances0.000description1
- 229960003969ospemifeneDrugs0.000description1
- LUMKNAVTFCDUIE-VHXPQNKSSA-NospemifeneChemical compoundC1=CC(OCCO)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1LUMKNAVTFCDUIE-VHXPQNKSSA-N0.000description1
- 210000003101oviductAnatomy0.000description1
- 230000002688persistenceEffects0.000description1
- 239000008194pharmaceutical compositionSubstances0.000description1
- 229940095055progestogen systemic hormonal contraceptivesDrugs0.000description1
- 230000035755proliferationEffects0.000description1
- XEYBRNLFEZDVAW-UHFFFAOYSA-Nprostaglandin E2Natural productsCCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=OXEYBRNLFEZDVAW-UHFFFAOYSA-N0.000description1
- 229950000796quingestroneDrugs0.000description1
- 229960004622raloxifeneDrugs0.000description1
- GZUITABIAKMVPG-UHFFFAOYSA-NraloxifeneChemical compoundC1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1GZUITABIAKMVPG-UHFFFAOYSA-N0.000description1
- 102000005962receptorsHuman genes0.000description1
- 108020003175receptorsProteins0.000description1
- 238000007634remodelingMethods0.000description1
- 230000001850reproductive effectEffects0.000description1
- 206010039073rheumatoid arthritisDiseases0.000description1
- 230000003248secreting effectEffects0.000description1
- 229940125944selective estrogen receptor degraderDrugs0.000description1
- 229940095743selective estrogen receptor modulatorDrugs0.000description1
- 239000000333selective estrogen receptor modulatorSubstances0.000description1
- 229950005786sivifeneDrugs0.000description1
- 150000003431steroidsChemical class0.000description1
- 230000000638stimulationEffects0.000description1
- 210000002536stromal cellAnatomy0.000description1
- 238000007920subcutaneous administrationMethods0.000description1
- 229960001603tamoxifenDrugs0.000description1
- 238000012360testing methodMethods0.000description1
- 230000001225therapeutic effectEffects0.000description1
- XFCLJVABOIYOMF-QPLCGJKRSA-NtoremifeneChemical compoundC1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1XFCLJVABOIYOMF-QPLCGJKRSA-N0.000description1
- 229960005026toremifeneDrugs0.000description1
- 229950008546trimegestoneDrugs0.000description1
- JUNDJWOLDSCTFK-MTZCLOFQSA-NtrimegestoneChemical compoundC1CC2=CC(=O)CCC2=C2[C@@H]1[C@@H]1CC[C@@](C(=O)[C@@H](O)C)(C)[C@@]1(C)CC2JUNDJWOLDSCTFK-MTZCLOFQSA-N0.000description1
Images
Classifications
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2006—IL-1
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Zoology (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Cell Biology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Abstract
Translated fromGermanDescription
Translated fromGermanDie vorliegende Erfindung betrifft die Behandlung und Vorbeugung der Endometriose mit chemischen und biologischen Substanzen und diese enthaltende Arzneimittel die die biologische Wirkung von Interleukin 1 beta (IL-1β) verringern und/oder verhindern.The present invention relates to the treatment and prevention of endometriosis with chemical and biological substances and pharmaceutical compositions containing them which reduce and / or prevent the biological effect of
Endometriose ist eine Krankheit bei der Endometrium außerhalb des Uterus auftritt. Von dieser Krankheit sind hauptsächlich Frauen im gebärfähigen Alter betroffen. Dieses ektopische (außerhalb der ursprünglichen Lokalisation) Endometrium unterliegt ebenso wie das eutopische (normale Lokalisation im Uterus) Endometrium dem Einfluss der Sexualsteroide und damit den zyklusbedingten Umbauvorgängen (Proliferation, sekretorische Aktivität). An Endometriose leiden 10–20 % der Frauen im reproduktiven Alter. Kernsymptome der Endometriose sind chronische Unterleibsschmerzen, Dysmenorrhoe, Dyspareunie, Dysurie, Blutungsstörungen und Unfruchtbarkeit. Die Symptome treten zumeist kombiniert auf. Es wird vermutet, dass die Läsionen durch retrograde Menstruation über den Eileiter in den Peritonealraum gelangen und sich dann dort einnisten. Medikamentöse Ansätze zur Behandlung der Endometriose umfassen zur Zeit die Gabe von GnRH-Agonisten, Androgenen, Aromataseinhibitoren, Antigestagenen oder oraler Kontrazeptiva. Allerdings sind diese Therapien nicht bei allen Patientinnen wirksam und häufig mit Nebenwirkungen assoziiert. Um dieses Problem zu lösen wurden weitere Behandlungsansätze erforscht. Es konnte dabei gezeigt werden, dass die Inhibition der Wirkung von IL-1β eine wirksame Therapie der Endometriose ermöglicht.Endometriosis is a disease in which endometrium occurs outside the uterus. This disease mainly affects women of childbearing age. This ectopic (outside the original localization) endometrium, like the eutopic (normal location in the uterus) endometrium, is subject to the influence of sex steroids and thus to cycle-related remodeling (proliferation, secretory activity). Endometriosis affects 10-20% of women of reproductive age. The core symptoms of endometriosis are chronic abdominal pain, dysmenorrhea, dyspareunia, dysuria, bleeding disorders and infertility. The symptoms are mostly combined. It is thought that the lesions reach the peritoneal space via the fallopian tube through retrograde menstruation and then settle there. Drug approaches to the treatment of endometriosis currently include the administration of GnRH agonists, androgens, aromatase inhibitors, antigestagens or oral contraceptives. However, these therapies are not effective in all patients and are often associated with side effects. In order to solve this problem further treatment approaches were explored. It could be shown that the inhibition of the effect of IL-1β allows an effective therapy of endometriosis.
IL-1β ist ein Zytokin das als Vorläuferprotein mit 266 Aminosäuren und einer Molekülmasse von 30,74 kDa nicht ausschließlich, aber insbesondere von Leukozyten nach deren Stimulation gebildet wird. Das noch biologisch inaktive Vorläuferprotein wird durch verschiedene Enzyme insbesondere durch Caspase 1 gespalten, wodurch das biologisch aktive 153 Aminosäuren lange aktive IL-1β gebildet wird. Das aktive IL-1β bindet an den Interleukin 1 Rezeptor (IL-1R), der aus zwei Untereinheiten besteht. Dem Interleukin Rezeptor Typ 1 (IL1R1) und dem Interleukin 1 Rezeptor Typ 2, wobei der IL1R1 nach Bindung von IL-1β an IL1R1 und IL1R2 eine intrazelluläre Signalkaskade auslöst, die unter anderem zu einer Aktivierung der Transkriptionsfaktoren AP1 und NF-kB führt und damit wesentlich für die inflamatorische Aktivierung von Zellen verantwortlich ist. Auf diesem Weg vermittelt IL-1β eine Vielzahl von biologischen Prozessen, vor allem durch die Induktion von weiteren inflamatorischen Mediatoren, wie z.B. Interleukin 6, Interleukin 8, Corticotrophin und Prostraglandin E2 (PDE2).IL-1β is a cytokine which is formed as a precursor protein with 266 amino acids and a molecular weight of 30.74 kDa not only, but especially of leukocytes after their stimulation. The still biologically inactive precursor protein is cleaved by various enzymes, in
IL-1β ist bei Endometriosepatientinnen in der peritonealen Flüssigkeit vermehrt vorzufinden (
Wenn die Wirkung von IL-1β unterbunden wird, entweder durch Neutralisation von IL-1β mittels neutralisierender Antikörper, oder durch die Inhibition des IL-1R z.B. durch synthetische Interleukin 1 Rezeptor Antagonisten oder funktionsblockierende Antikörper oder durch die Inhibition der Signalweiterleitung am zytoplasmatischen Teil des Interleukin 1 Rezeptors wird die Entstehung und das Wachstum und von endometrialen Läsionen verringert.When the effect of IL-1β is suppressed, either by neutralization of IL-1β by neutralizing antibody, or by inhibition of IL-1R, e.g. synthetic interleukin-1 receptor antagonists or function-blocking antibodies, or inhibition of signal transduction at the cytoplasmic portion of the interleukin-1 receptor, reduce the development and growth of endometrial lesions.
In vivo gelang der Nachweis, dass die Abwesenheit von IL-1β und die Inhibition des IL-1R im Vergleich zur Kontrollgruppe zu einer signifikanten Reduktion der durchschnittlichen Läsionsgrößen führt.In vivo, it was shown that the absence of IL-1β and the inhibition of IL-1R lead to a significant reduction of the average lesion size compared to the control group.
Entsprechend stellt die Neutralisation des IL-1β oder die Inhibition des IL-1R eine Möglichkeit zur Therapie der Endometriose dar.Accordingly, neutralization of IL-1β or inhibition of IL-1R is one way to treat endometriosis.
Gegenstand der vorliegenden Erfindung ist der Einsatz von Antikörpern oder von Antikörperfragmenten gegen IL-1β oder gegen den IL-1R oder von rekombinanten Proteinen die IL-1β oder den IL-1R binden zur Behandlung und/oder Prophylaxe der Endometriose.The present invention is the use of antibodies or antibody fragments against IL-1β or against the IL-1R or recombinant proteins which bind IL-1β or IL-1R for the treatment and / or prophylaxis of endometriosis.
Weiterer Gegenstand der vorliegenden Erfindung sind Antikörper oder Antikörperfragmente gegen IL-1β oder gegen den IL-1R oder von rekombinanten Proteinen die IL-1β oder den IL-1R binden zur Verwendung in einem Verfahren zur Behandlung und/oder Prophylaxe der Endometriose.Another object of the present invention are antibodies or antibody fragments against IL-1β or against the IL-1R or of recombinant proteins which bind IL-1β or IL-1R for use in a method for the treatment and / or prophylaxis of endometriosis.
Gegenstand der vorliegenden Erfindung ist auch die Verwendung von Antikörpern oder eines Antikörperfragments gegen IL-1β oder gegen den IL-1R oder von rekombinanten Proteinen die IL-1β oder den IL-1R binden zur Herstellung eines Arzneimittels zur Behandlung und/oder Prophylaxe der Endometriose. The present invention also provides the use of antibodies or an antibody fragment against IL-1β or against the IL-1R or recombinant proteins which bind IL-1β or IL-1R for the manufacture of a medicament for the treatment and / or prophylaxis of endometriosis.
Ebenfalls Gegenstand der vorliegenden Erfindung ist ein Verfahren zur Behandlung und/oder Prophylaxe der Endometriose unter Verwendung von Antikörpern oder eines Antikörperfragments gegen IL-1β oder gegen den IL-1R oder von rekombinanten Proteinen die IL-1β oder den IL-1R binden.Likewise provided by the present invention is a method for the treatment and / or prophylaxis of endometriosis using antibodies or an antibody fragment against IL-1β or against the IL-1R or recombinant proteins which bind IL-1β or IL-1R.
Gegenstand der vorliegenden Erfindung sind weiterhin Arzneimittel, enthaltend mindestens einen Antikörper oder eine Antikörperfragment gegen IL-1β oder gegen den IL-1R oder enthaltend mindestens ein rekombinantes Protein, das IL-1β oder den IL-1R bindet in Kombination mit einen oder mehreren weiteren Wirkstoffen (z.B. Estrogenrezeptorantagonsisten (einschließlich Antiöstrogenen, SERM und SERD), Gestagene, Antigestagene (einschließlich SPRM), Aromataseinhibitoren oder GnRH-Analoga) zur Behandlung und/oder Prophylaxe der zuvor genannten Erkrankungen.The present invention furthermore relates to medicaments comprising at least one antibody or an antibody fragment against IL-1β or against the IL-1R or containing at least one recombinant protein which binds IL-1β or the IL-1R in combination with one or more further active compounds (eg, estrogen receptor antagonists (including antiestrogens, SERM and SERD), progestins, antigestagens (including SPRM), aromatase inhibitors or GnRH analogs) for the treatment and / or prophylaxis of the aforementioned disorders.
Dabei kommen als Estrogenrezeptorantagonsisten beispielsweise die folgenden Verbindungen in Betracht: Fulvestrant, Raloxifene, Tamoxifene, Toremifene, Arzoxifene, Lasofoxifene, Ospemifene, Sivifene, Bazedoxifene, Afimoxifene, Enclomiphene, Fispemifene, Acolbifene, Droloxifene, Centchromane oder LevormeloxifeneSuitable estrogen receptor antagonists are, for example, the following compounds: fulvestrant, raloxifene, tamoxifen, toremifene, arzoxifene, lasofoxifene, ospemifene, sivifene, bazedoxifene, afimoxifene, enclomiphene, fispemifene, acolbifene, droloxifene, centchromane or levormeloxifene
Als Gestagene geeignet sind insbesondere: Allylestrenol, Chlormadinonacetat, Cyproteronacetat, Desogestrel, Dienogest, Drospirenon, Dydrogesteron, Etonogestrel, Ethynodiol, Gestoden, Levonorgestrel, Lynestrenol, Medrogeston, Medroxyprogesteron, Megestrolazetat, Nomegestrol, Norethindron, Norethisteron, Norethynodrel, Norgestimat, Norgestrel, Quingestron oder Trimegeston.Particularly suitable as progestogens are: allylestrenol, chlormadinone acetate, cyproterone acetate, desogestrel, dienogest, drospirenone, dydrogesterone, etonogestrel, ethynodiol, gestodene, levonorgestrel, lynestrenol, medrogestone, medroxyprogesterone, megestrol acetate, nomegestrol, norethindrone, norethynode, norgestimate, norgestrel, quingestrone or trimegestone.
Geeignete Aromataseinhibitoren sind beispielsweise: Anastrozol (Arimidex®), Exemestan (Aromasin®), Fadrozol (Afema®), Formestan (Lentaron®), Letrozol (Femara®), Pentrozol oder Vorozol (Rivizor®).Suitable aromatase inhibitors include: anastrozole (Arimidex®), exemestane (Aromasin®), fadrozole (AFEMA®), Formestane (Lentaron®), letrozole (Femara®), pentrozole or vorozole (Rivizor®).
Geeignete Antigestagene sind beispielsweise Mifepriston, Lonaprisan oder Asoprisnil.Suitable antigestagens are, for example, mifepristone, lonaprisan or asoprisnil.
Der Antikörper bzw. das Antikörperfragment gegen IL-1β oder den IL-1R und das IL-1β oder den IL-1R bindende rekombinante Protein wirken dabei neutralisierend, funktionsblockierend oder inhibierend auf die Aktivierung des IL-1R.The antibody or the antibody fragment against IL-1β or the IL-1R and the IL-1β or the IL-1R binding recombinant protein act neutralizing, functionally blocking or inhibiting the activation of the IL-1R.
Ein Antikörper, Antikörperfragment oder rekombinantes Protein das den IL-1R bindet wird als funktionsblockierend oder inhibierend bezeichnet, wenn der IL-1R eine mindestens um 20% reduzierte intrazelluläre Aktivität zeigt während IL-1b in unmittelbarer Nähe vorhanden ist, verglichen mit der intrazellulären Aktivität des IL-1R bei Abwesenheit des Antikörpers, Antikörperfragments oder rekombinanten Proteins.An antibody, antibody fragment or recombinant protein that binds the IL-1R is said to function block or inhibit when the IL-1R exhibits at least a 20% reduced intracellular activity while IL-1b is present in close proximity compared to the intracellular activity of the IL-1R in the absence of the antibody, antibody fragment or recombinant protein.
Ein Antikörper, Antikörperfragment oder rekombinantes Protein das IL-1b bindet wird als neutralisierend oder funktionsblockierend oder inhibierend bezeichnet, wenn der IL-1R eine mindestens um 20% reduzierte intrazelluläre Aktivität zeigt während das gebundene IL-1b in unmittelbarer Nähe vorhanden ist, verglichen mit der intrazellulären Aktivität des IL-1R bei Abwesenheit des Antikörpers, Antikörperfragments oder rekombinanten ProteinsAn antibody, antibody fragment or recombinant protein that binds IL-1b is said to be neutralizing or function blocking or inhibiting if the IL-1R shows at least a 20% reduced intracellular activity while the bound IL-1b is present in close proximity compared to the intracellular activity of the IL-1R in the absence of the antibody, antibody fragment or recombinant protein
Die Begriffe "Antikörper", "Antikörperfragment", "Antikörper gegen IL-1β oder IL-1R" und "Antikörperfragment gegen IL-1β oder IL-1R" entsprechen auch den Ausführungen in
Weitere Beispiele für in Frage kommende Antikörper gegen IL-1β sind AAL-160, Canakinumab und LY-2189102.Further examples of candidate antibodies against IL-1β are AAL-160, canakinumab and LY-2189102.
AAL-160 ist in
Canakinumab (Markenname ILARIS, Laborkode: ACZ885) ist beispielsweise Gegenstand folgender Publikationen
Ein Beispiel für einen in Frage kommende Antikörper gegen den IL-1R ist AMG-108.An example of a candidate antibody to IL-1R is AMG-108.
Der Begriff "IL-1β oder IL-1R bindendes rekombinantes Protein" beschreibt eine beliebige Aminosäuresequenz von mindestens 15 Aminosäuren, die auch natürlich vorkommen kann aber mit technischen Verfahren hergestellt wurde und keine strukturelle Ähnlichkeit der Molekülstruktur mit einem Fragment eines Antikörpers besitzt, aber in der Lage ist IL-1b oder den IL-1R zu binden. Die Beispiele für solche rekombinanten Proteine sind Anakinra und Rilonacept. Die Herstellung weiterer derartiger Proteine ist dem Fachmann bekannt.The term "IL-1β or IL-1R binding recombinant protein" describes any amino acid sequence of at least 15 amino acids, which may be naturally occurring but has been prepared by engineering techniques and has no structural similarity to the molecular structure with a fragment of an antibody, but in U.S. Pat Able to bind IL-1b or the IL-1R. The examples of such recombinant proteins are anakinra and rilonacept. The preparation of further such proteins is known to the person skilled in the art.
Zur Behandlung der Endometriose besonders geeignet sind die Antikörper gegen IL-1β: Gevokizumab, AAL-160, Canakinumab, LY-2189102, AMG-108 und die rekombinanten Proteine Anakinra und Rilonacept.Particularly suitable for the treatment of endometriosis are the antibodies against IL-1β: gevokizumab, AAL-160, canakinumab, LY-2189102, AMG-108 and the recombinant proteins anakinra and rilonacept.
Die folgenden Beispiele dienen der Erläuterung der Erfindung ohne diese in irgend einer Weise zu beschränken.The following examples serve to illustrate the invention without limiting it in any way.
Beispiel 1: Die Abwesenheit der Wirkung von Interleukin 1 beta verringert die Läsionsgröße im Endometriose MausmodellExample 1: The absence of the effect of
Die durch IL-1β gesteigerte Angiogenese und Adhäsion von endometrialen Läsionen ist eine zentraler Mechanismus der Entstehung und Persistenz der Endometriose Als Nachweis für die therapeutische Wirkung der Inhibition der Wirkung des IL-1β wird folgender Versuch gesehen, bei dem Endometriose entweder in normalen Mäusen induziert wird, oder in Mäusen, die genetisch so verändert sind, dass sie kein aktives Interleukin 1 beta produzieren.The IL-1β-enhanced angiogenesis and adhesion of endometrial lesions is a central mechanism of endometriosis development and persistence. The evidence for the therapeutic effect of inhibiting the action of IL-1β is the following experiment in which endometriosis is induced either in normal mice , or in mice that are genetically engineered to produce no
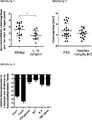
Die Uteri von acht bis zehn Wochen alten C57BL/6J Wildtyp und IL-1β defizienten (IL-1b-KO) Weibchen die sich im Östrus befinden werden entfernt und entlang der Tuben geöffnet. Aus dem geöffneten auf das Myometrium gelegten Uterus wurden 3,14mm2 Stanzbiopsien gewonnen. Diese Stanzbiopsien wurden in jeweils syngene Empfängermäuse transplantiert, wobei jeweils 6 Biopsien von innen an das Peritoneum der Empfängermäuse genäht wurden. Stanzbiopsien von IL1b-KO Uteri werden in IL1b-KO Mäuse und Wildtyputeri in Wildtypmäuse transplantiert. 28 Tage nach der Transplantation werden alle Tiere getötet, laparotomiert und die Läsionsgröße photografisch vermessen. Während des gesamten Versuchs bekommen die Tiere Altromin-Trockenfutter und Wasser ad libitum. Die Auswertung der Versuchsergebnisse erfolgte durch Vergleich der durchschnittlichen Läsionsgröße pro Tier bei Wildtyptieren mit der durchschnittlichen Läsionsgröße pro Tier bei IL1b-KO Tieren.The uteri of eight to ten week old C57BL / 6J wild-type and IL-1β deficient (IL-1b-KO) females that are in the oestrus are removed and opened along the tubes. From the opened uterus placed on the myometrium, 3.14mm2 punch biopsies were obtained. These punch biopsies were transplanted into syngeneic recipient mice, with 6 biopsies each being sutured from the inside to the peritoneum of the recipient mice. Punch biopsies of IL1b-KO uteri are transplanted into IL1b-KO mice and wild-type uteri in wild-type mice. 28 days after the transplantation, all animals are killed, laparotomized and the size of the lesion is measured photographically. Throughout the experiment, the animals get Altromin dry food and water ad libitum. The evaluation of the test results was carried out by comparing the average lesion size per animal in wild-type animals with the average lesion size per animal in IL1b-KO animals.
Die Verhinderung der biologischen Wirkung von IL-1β führt zu einer signifikanten Reduktion des Wachstums der Läsionen verglichen mit Tieren mit biologisch aktivem IL-1β (
Beispiel 2: Die Interleukin 1 Receptor Antagonisierung verringert die Läsionsgröße und die Expression von IL-6 und TNF alpha in endometriotischen Läsionen in vivoExample 2:
Die gesteigerte Expression der von IL-1β induzierten Zytokinen und Chemokinen ist ein zentraler Mechanismus der lokalen Entzündung in endometriotischen Läsionen, die als Konsequenz Schmerzen bei der Endometriose erzeugt. Mit dem folgenden Versuch können wir nachweisen, dass die Inhibition der Wirkung von IL-1β die lokale Entzündung in den endometriotischen Läsionen verringert wird.Increased expression of IL-1β-induced cytokines and chemokines is a central mechanism of local inflammation in endometriotic lesions, which in turn produces pain in endometriosis. In the following experiment, we can demonstrate that inhibition of the action of IL-1β reduces local inflammation in endometriotic lesions.
Die Uteri von acht bis zehn Wochen alte Balb/c Weibchen die sich im Estrus befinden werden entfernt und entlang der Tuben geöffnet. Aus dem geöffneten auf das Myometrium gelegten Uterus werden 3,14mm2 Stanzbiopsien gewonnen. Diese Stanzbiopsien wurden in syngene Empfängermäuse transplantiert, wobei jeweils 6 Biopsien von innen an das Peritoneum genäht werden. Die Tiere werden einen Tag nach der Laparotomie und danach täglich für 7 Tage jeweils morgens und abends mit 10 mg/kg des humanen Interleukine 1 Rezeptor Antagonisten Anakinra oder PBS behandelt. Zehn Tage nach Behandlungsbeginn werden alle Tiere getötet, laparotomiert, die Läsionsgröße gemessen und die Läsionen entfernt. Die Läsionen werden homogenisiert und die RNS der Läsionszellen isoliert. Nach Generierung von DNS aus der RNS wird mittel Taqman PCR die Expression der Zytokine TNF alpha, Interleukin 6, Interferon gamma und der Chemokine CXCL1 und CXCL5 bestimmt. Während des gesamten Versuchs bekamen die Tiere Altromin-Trockenfutter und Wasser ad libitum The uteri of eight to ten-week-old Balb / c females that are in the Estrus are removed and opened along the tubes. 3.14mm2 punch biopsies are obtained from the open uterus placed on the myometrium. These punch biopsies were transplanted into syngeneic recipient mice, with 6 biopsies each being sutured from the inside to the peritoneum. The animals are treated one day after the laparotomy and then daily for 7 days in the morning and evening with 10 mg / kg of the
Die Verhinderung der biologischen Wirkung von IL-1β führt schon an Tag 10 nach Behandlungsbegin zu einer Reduktion der Läsionsgröße (
Verzeichnis der Abbildungen:List of pictures:
ZITATE ENTHALTEN IN DER BESCHREIBUNG QUOTES INCLUDE IN THE DESCRIPTION
Diese Liste der vom Anmelder aufgeführten Dokumente wurde automatisiert erzeugt und ist ausschließlich zur besseren Information des Lesers aufgenommen. Die Liste ist nicht Bestandteil der deutschen Patent- bzw. Gebrauchsmusteranmeldung. Das DPMA übernimmt keinerlei Haftung für etwaige Fehler oder Auslassungen.This list of the documents listed by the applicant has been generated automatically and is included solely for the better information of the reader. The list is not part of the German patent or utility model application. The DPMA assumes no liability for any errors or omissions.
Zitierte PatentliteraturCited patent literature
- WO 2005/023193[0005]WO 2005/023193[0005]
- US 2009/0181019 A1[0021]US 2009/0181019 A1[0021]
- US 2009/0232803 A1[0023]US 2009/0232803 A1[0023]
- DE 60124863 T3[0023]DE 60124863 T3[0023]
- EP 1313769[0024]EP 1313769[0024]
- WO 02/16436[0024]WO 02/16436[0024]
- DE 60134148[0024]DE 60134148[0024]
Zitierte Nicht-PatentliteraturCited non-patent literature
- Oku et al. Human Reproduction 2004[0004]Oku et al. Human Reproduction 2004[0004]
- Akoum et al. Fertil Steril 2008[0004]Akoum et al. Fertil Sterile 2008[0004]
- Wu et al. Journal of Clinical Endocrinology and Metabolism 2004[0004]Wu et al. Journal of Clinical Endocrinology and Metabolism 2004[0004]
- "Canakinumab". mAbs 2 (1): 3–13[0024]"Canakinumab". mAbs 2 (1): 3-13[0024]
- Lachmann, HJ; Kone-Paut I, Kuemmerle-Deschner JB et al. "Use of canakinumab in the cryopyrin-associated periodic syndrome". New Engl J Med 360 (23): 2416–25[0024]Lachman, HJ; Kone-Paut I, Kuemmerle-Deschner JB et al. "Use of canakinumab in the cryopyrin-associated periodic syndrome". New Engl J Med 360 (23): 2416-25[0024]
- Yasothan U, Kar S "Therapies for COPD". Nat Rev Drug Discov 7 (4): 285[0024]Yasothan U, Kar S "Therapies for COPD". Nat Rev Drug Discov 7 (4): 285[0024]
Claims (5)
Translated fromGermanPriority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE201110083595DE102011083595A1 (en) | 2011-09-28 | 2011-09-28 | Inhibition of the effect of interleukin 1 beta for the treatment of endometriosis |
| PCT/EP2012/068795WO2013045404A2 (en) | 2011-09-28 | 2012-09-24 | Inhibition of the effect of interleukin 1 beta in order to treat endometriosis |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE201110083595DE102011083595A1 (en) | 2011-09-28 | 2011-09-28 | Inhibition of the effect of interleukin 1 beta for the treatment of endometriosis |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE102011083595A1true DE102011083595A1 (en) | 2013-03-28 |
Family
ID=46970258
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE201110083595WithdrawnDE102011083595A1 (en) | 2011-09-28 | 2011-09-28 | Inhibition of the effect of interleukin 1 beta for the treatment of endometriosis |
Country Status (2)
| Country | Link |
|---|---|
| DE (1) | DE102011083595A1 (en) |
| WO (1) | WO2013045404A2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115990268A (en)* | 2022-11-03 | 2023-04-21 | 浙江大学医学院附属妇产科医院 | Pharmaceutical composition and pharmaceutical application thereof |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9301920B2 (en) | 2012-06-18 | 2016-04-05 | Therapeuticsmd, Inc. | Natural combination hormone replacement formulations and therapies |
| EP3936133A1 (en) | 2011-11-23 | 2022-01-12 | TherapeuticsMD, Inc. | Natural combination hormone replacement formulations and therapies |
| US10806740B2 (en) | 2012-06-18 | 2020-10-20 | Therapeuticsmd, Inc. | Natural combination hormone replacement formulations and therapies |
| US10806697B2 (en) | 2012-12-21 | 2020-10-20 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US20150196640A1 (en) | 2012-06-18 | 2015-07-16 | Therapeuticsmd, Inc. | Progesterone formulations having a desirable pk profile |
| US20130338122A1 (en) | 2012-06-18 | 2013-12-19 | Therapeuticsmd, Inc. | Transdermal hormone replacement therapies |
| US10568891B2 (en) | 2012-12-21 | 2020-02-25 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US9180091B2 (en) | 2012-12-21 | 2015-11-10 | Therapeuticsmd, Inc. | Soluble estradiol capsule for vaginal insertion |
| US10537581B2 (en) | 2012-12-21 | 2020-01-21 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US10471072B2 (en) | 2012-12-21 | 2019-11-12 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US11266661B2 (en) | 2012-12-21 | 2022-03-08 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US11246875B2 (en) | 2012-12-21 | 2022-02-15 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| KR20170005819A (en) | 2014-05-22 | 2017-01-16 | 쎄러퓨틱스엠디, 인코퍼레이티드 | Natural combination hormone replacement formulations and therapies |
| US10328087B2 (en) | 2015-07-23 | 2019-06-25 | Therapeuticsmd, Inc. | Formulations for solubilizing hormones |
| US20190008804A1 (en)* | 2016-01-12 | 2019-01-10 | Repros Therapeutics Inc. | Trans-Clomiphene and Progesterone Receptor Antagonist Combination Therapy for Treating Hormone-Dependent Conditions |
| CN107029233A (en)* | 2016-02-04 | 2017-08-11 | 复旦大学附属妇产科医院 | Purposes of the interleukins-8 antibody in endometriosis medicine composition is prepared |
| AU2017239645A1 (en) | 2016-04-01 | 2018-10-18 | Therapeuticsmd, Inc. | Steroid hormone pharmaceutical composition |
| US10286077B2 (en) | 2016-04-01 | 2019-05-14 | Therapeuticsmd, Inc. | Steroid hormone compositions in medium chain oils |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002016436A2 (en) | 2000-08-22 | 2002-02-28 | Novartis Ag | ANTIBODIES TO HUMAN IL-1$g(b) |
| WO2005023193A2 (en) | 2003-09-04 | 2005-03-17 | Interleukin Genetics, Inc. | Methods of treating endometriosis |
| DE60124863T2 (en) | 2000-01-21 | 2007-04-26 | Novartis Ag | AGAINST HUMAN INTERLEUKIN-1-BETA RECOMBINANT ANTIBODIES |
| DE60124148T2 (en) | 2000-10-25 | 2007-09-06 | Smithkline Beecham Corp. | CALCILYTIC COMPOUNDS |
| US20090181019A1 (en) | 2007-12-20 | 2009-07-16 | Xoma Technology Ltd. | Methods for the Treatment of Gout |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0314038B8 (en)* | 2002-09-06 | 2021-05-25 | Amgen Inc | isolated human antibody, isolated nucleic acid molecule, vector, use of an antibody, and pharmaceutical composition |
| KR101502920B1 (en)* | 2005-06-21 | 2015-03-17 | 조마 (유에스) 엘엘씨 | IL-1β Binding antibodies and fragments thereof |
- 2011
- 2011-09-28DEDE201110083595patent/DE102011083595A1/ennot_activeWithdrawn
- 2012
- 2012-09-24WOPCT/EP2012/068795patent/WO2013045404A2/enactiveApplication Filing
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE60124863T2 (en) | 2000-01-21 | 2007-04-26 | Novartis Ag | AGAINST HUMAN INTERLEUKIN-1-BETA RECOMBINANT ANTIBODIES |
| US20090232803A1 (en) | 2000-01-21 | 2009-09-17 | Hermann Gram | Antibodies to human il-1beta |
| WO2002016436A2 (en) | 2000-08-22 | 2002-02-28 | Novartis Ag | ANTIBODIES TO HUMAN IL-1$g(b) |
| EP1313769A2 (en) | 2000-08-22 | 2003-05-28 | Novartis AG | Antibodies to human il-1 beta |
| DE60124148T2 (en) | 2000-10-25 | 2007-09-06 | Smithkline Beecham Corp. | CALCILYTIC COMPOUNDS |
| WO2005023193A2 (en) | 2003-09-04 | 2005-03-17 | Interleukin Genetics, Inc. | Methods of treating endometriosis |
| US20090181019A1 (en) | 2007-12-20 | 2009-07-16 | Xoma Technology Ltd. | Methods for the Treatment of Gout |
Non-Patent Citations (6)
| Title |
|---|
| "Canakinumab". mAbs 2 (1): 3-13 |
| Akoum et al. Fertil Steril 2008 |
| Lachmann, HJ; Kone-Paut I, Kuemmerle-Deschner JB et al. "Use of canakinumab in the cryopyrin-associated periodic syndrome". New Engl J Med 360 (23): 2416-25 |
| Oku et al. Human Reproduction 2004 |
| Wu et al. Journal of Clinical Endocrinology and Metabolism 2004 |
| Yasothan U, Kar S "Therapies for COPD". Nat Rev Drug Discov 7 (4): 285 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115990268A (en)* | 2022-11-03 | 2023-04-21 | 浙江大学医学院附属妇产科医院 | Pharmaceutical composition and pharmaceutical application thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013045404A2 (en) | 2013-04-04 |
| WO2013045404A3 (en) | 2013-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE102011083595A1 (en) | Inhibition of the effect of interleukin 1 beta for the treatment of endometriosis | |
| Subramanian et al. | Oral feeding with ethinyl estradiol suppresses and treats experimental autoimmune encephalomyelitis in SJL mice and inhibits the recruitment of inflammatory cells into the central nervous system | |
| DE60129550T2 (en) | USE OF LOW DOSE ESTROGENS IN COMBINATION WITH IMMUNOTHERAPEIC COMPOUNDS FOR THE TREATMENT OF IMMUNE DISEASES | |
| Justice et al. | Ablation of eosinophils leads to a reduction of allergen-induced pulmonary pathology | |
| DE69312077T2 (en) | TREATMENT OF AUTOIMMUNE AND INFLAMMATION DISEASES | |
| Genazzani et al. | Hormonal and natural contraceptives: a review on efficacy and risks of different methods for an informed choice | |
| DE69527847T2 (en) | USE OF ANTI-VEGF AGENTS FOR TREATING ENDOMETRIOSIS | |
| DE60020269T2 (en) | USE OF INTERLEUKIN-6 ANTAGONISTS FOR THE TREATMENT OF OESTROGEN-DEPENDENT CANCER | |
| WO1995020978A1 (en) | Use of anti-tnf antibodies as drugs in treating diseases involving elevated interleukin-6 serum levels | |
| CN112153982A (en) | Method for treating atopic dermatitis by administering an IL-4R inhibitor | |
| DE60003152T2 (en) | TUMOR NECROSE FACTOR ANTAGONISTS AND THEIR USE AGAINST ENDOMETRIOSIS | |
| KR20210095731A (en) | Methods for treating atopic dermatitis by administering an il-4r antagonist | |
| DE69801660T2 (en) | LOCAL TREATMENT OF PSORIASIS USING NEUTRALIZING ANTIBODIES AGAINST IL-8 | |
| Sonoda et al. | Immunoregulatory role of ocular macrophages: the macrophages produce RANTES to suppress experimental autoimmune uveitis | |
| CN118178647A (en) | Antibodies neutralizing GM-CSF for the treatment of rheumatoid arthritis or as analgesics | |
| JP2006516617A (en) | Combination of IL-6 antagonist and steroid to enhance apoptosis | |
| Hirabayashi et al. | Clinical efficacy of tocilizumab in patients with active rheumatoid arthritis in real clinical practice | |
| EP1432379B1 (en) | Methods for inhibiting cognitive deterioration in adults with down's syndrome | |
| DE60312684T2 (en) | PLAZENTA GROWTH FACTOR AS TARGET FOR THE TREATMENT OF OSTEOPOROSE | |
| DE202021004005U1 (en) | Ofatumumab for the treatment of MS while maintaining serum IgG | |
| Tsur et al. | Interdisciplinary exchange of ideas: progestagens for autoimmunity, biologics for pregnancy complications | |
| KR20190090820A (en) | Pharmaceutical composition to prevent opioid poisoning | |
| US20230383001A1 (en) | Method for treating ox40 related disease | |
| WO1999021582A2 (en) | Application of tnf antagonists as medicaments for treating septic diseases | |
| DE69937057T2 (en) | USE OF BASILIXIMAB FOR THE TREATMENT OF RHEUMATOID ARTHRITIS AND SKIN DISEASES |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| R119 | Application deemed withdrawn, or ip right lapsed, due to non-payment of renewal fee | Effective date:20140401 |